Распространенность и клинико-морфологические особенности кариеса корня зуба у взрослого человека
Распространенность и клинико-морфологические особенности кариеса корня зуба у взрослого человека
Сайт издательства «Медиа Сфера»
содержит материалы, предназначенные исключительно для работников здравоохранения. Закрывая это сообщение, Вы подтверждаете, что являетесь дипломированным медицинским работником или студентом медицинского образовательного учреждения.
Иорданишвили А.К.
Кафедра ортопедической стоматологии стоматологического факультета ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России, Санкт-Петербург, Россия;
ФГБВОУ ВО «Военно-медицинская академия им. С.М. Кирова» Министерства обороны РФ, Санкт-Петербург, Россия
Пихур О.Л.
Институт усовершенствования врачей Медико-хирургического центра им. Н.И. Пирогова, Москва, Россия, Санкт-Петербургский институт биорегуляции и геронтологии, Санкт-Петербург, Россия, Северо-Западный государственный медицинский университет им. И.И. Мечникова, Санкт-Петербург, Россия, Военно-медицинская академия им. С.М. Кирова, Санкт-Петербург, Россия, Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова, Санкт-Петербург, Россия
Н.И. Пирогова, Москва, Россия, Санкт-Петербургский институт биорегуляции и геронтологии, Санкт-Петербург, Россия, Северо-Западный государственный медицинский университет им. И.И. Мечникова, Санкт-Петербург, Россия, Военно-медицинская академия им. С.М. Кирова, Санкт-Петербург, Россия, Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова, Санкт-Петербург, Россия
Малина М.С.
Городская поликлиника №56, Санкт-Петербург, Россия
Тытюк С.Ю.
Военно-медицинская академия им. С.М. Кирова, Санкт-Петербург, Россия
Распространенность и клинико-морфологические особенности кариеса корня зуба у взрослого человека
Авторы:
Иорданишвили А.К., Пихур О.Л., Малина М.С., Тытюк С.Ю.
Подробнее об авторах
Журнал: Стоматология. 2019;98(4): 38‑43
DOI: 10.17116/stomat20199804138
Как цитировать:
Иорданишвили А.
Iordanishivili AK, Pihur OL, Malina MS, Tityuk SYu. Prevalence, clinical and morphological features of tooth root caries in the adult human. Stomatologiya. 2019;98(4):38‑43. (In Russ.).
https://doi.org/10.17116/stomat20199804138
?>
Читать метаданные
Изучены заболеваемость кариесом корня зуба, особенности морфологии твердых тканей зуба и клинического течения этой патологии у 4701 (2526 мужчин и 2175 женщин) жителя Санкт-Петербурга и Ленинградской области в возрасте от 18 до 88 лет, которые были разделены на возрастные группы с учетом возрастной периодизации Института возрастной физиологии РАН.
Ключевые слова:
кариес корня зуба
распространенность
клиническое течение
морфология
цемент
дентин
хронический генерализованный пародонтит
возраст
Авторы:
Иорданишвили А. К.
К.
Кафедра ортопедической стоматологии стоматологического факультета ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России, Санкт-Петербург, Россия;
Пихур О.Л.
Институт усовершенствования врачей Медико-хирургического центра им. Н.И. Пирогова, Москва, Россия, Санкт-Петербургский институт биорегуляции и геронтологии, Санкт-Петербург, Россия, Северо-Западный государственный медицинский университет им. И.И. Мечникова, Санкт-Петербург, Россия, Военно-медицинская академия им. С.М. Кирова, Санкт-Петербург, Россия, Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова, Санкт-Петербург, Россия
Малина М.С.
Городская поликлиника №56, Санкт-Петербург, Россия
Тытюк С.Ю.
Военно-медицинская академия им. С.М. Кирова, Санкт-Петербург, Россия
Закрыть метаданные
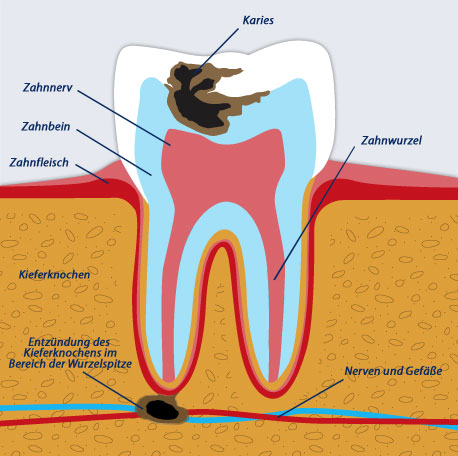
Кариес корня зуба — патологический процесс, проявляющийся после прорезывания зуба и развивающийся в результате взаимодействия комплекса неблагоприятных факторов, ведущих к возникновению и прогрессированию процесса деминерализации твердых тканей в области корня зуба.
Среди факторов риска развития кариеса корня зуба можно выделить биологические (микроорганизмы зубного налета; качественные и количественные характеристики ротовой жидкости, в том числе pH, уровень секреции слюны, ее буферная емкость; минерализация твердых тканей зуба, наследственные факторы [1—3]), поведенческие (социально-культурное поведение, определяемое уровнем стоматологического просвещения населения; гигиена полости рта [4]; вредные привычки — в основном курение; особенности питания — кариесогенная диета, недостаток фтора в питьевой воде и пищевых продуктах), индивидуальные (наличие общесоматических заболеваний и функциональных нарушений, прежде всего заболеваний желудочно-кишечного тракта, сахарного диабета, сердечно-сосудистых заболеваний, а также патологии тканей пародонта [5—7]). Чем разнообразнее и более выражены предрасполагающие факторы возникновения и развития кариеса корня зуба, тем сильнее выражен процесс.
В настоящее время кариес корня зуба считается проблемной локализацией кариозного процесса, а связанные с ним осложнения приводят к потере зуба и утрате ортопедической конструкции, если этот зуб являлся опорой для последней [8].
Цель данного исследования — установить распространенность кариеса корня зуба у взрослых людей разных возрастных групп, изучить морфологию твердых тканей зубов у пациентов с кариесом корня зуба, определить возрастные особенности клинического течения этой патологии у обследованных лиц.
Материал и методы
Проведено стоматологическое обследование 4701 (2526 (53,73%) мужчин и 2175 (46,27%) женщин) пациента в возрасте от 18 до 88 лет, которые были распределены на возрастные группы с учетом пола согласно возрастной периодизации Института возрастной физиологии РАН (рис. 1). Рис. 1. Распределение обследованных лиц с учетом возраста и пола (n).
При осмотре, проводимом общепринятым способом с помощью стоматологических зеркала и зонда, выявляли кариес корня зуба и учитывали частоту встречаемости этой патологии зуба в процентах с учетом возрастной группы и гендерной принадлежности пациентов. При подозрении на кариес корня зуба у обследованных лиц применяли кариес-детектор, а также использовали лучевые методы диагностики. Определяли гигиенический индекс Грин—Вермильона (J.C. Green, J.R. Vermillion, 1964).
При подозрении на кариес корня зуба у обследованных лиц применяли кариес-детектор, а также использовали лучевые методы диагностики. Определяли гигиенический индекс Грин—Вермильона (J.C. Green, J.R. Vermillion, 1964).
У 50 пациентов (26 мужчин и 24 женщины) зрелого, пожилого и старческого возраста оценили гигиену полости рта по индексу Грин—Вермильона исходно и после того, как были даны рекомендации по коррекции индивидуальной гигиены полости рта (ИГПР). Пациенты в течение 4 нед 2 раза в день пользовались зубной пастой Parodontax Комплексная защита (GSK).
Изучение морфологического строения твердых тканей зубов проводили методом растровой (сканирующей) электронной микроскопии (SEM) c помощью растрового электронного микроскопа VEGA 3 («Tescan», Чехия). В качестве материала исследования использованы 56 зубов пациентов обоих полов в возрасте от 18 до 88 лет, удаленных по медицинским показаниям (III степень подвижности зубов, обострение хронического пародонтита и ортодонтические показания).
Полученный в результате эпидемиологического исследования цифровой материал был обработан на персональном компьютере с использованием специализированного пакета для статистического анализа Statistica for Windows v. 6.0. Различия между сравниваемыми группами считались достоверными при р≤0,05.
Результаты и обсуждение
Анализ полученных данных показал, что у взрослых людей, проживающих в Санкт-Петербурге и Ленинградской области, распространенность кариеса корня зуба составила 4,34%.
В результате исследования заболеваемости кариесом корня зуба в разных возрастных группах (рис. 2) Рис. 2. Возрастные и половые особенности распространенности кариеса корня зуба у людей, проживающих в Санкт-Петербурге и Ленинградской области (%). установлено, что наибольшие значения распространенности кариеса корня зуба были у людей старших возрастных групп (р≤0,01). Так, у лиц пожилого и старческого возраста кариес корня зуба встречался в 9,88 и 7,40% случаев, в то время как у людей молодого, первого и второго зрелого (среднего) возраста — в 0,26, 1,35, и 5,02% случаев соответственно.
В молодом возрасте кариес корня был диагностирован у 2 (0,28%) мужчин из 721 обследованного и 1 (0,23%) женщины из 427 обследованных.
У людей первого зрелого возраста кариес корня зуба встречался также относительно редко и диагностирован у 9 (1,46%) из 618 обследованных мужчин и 5 (1,19%) из 421 обследованных женщин. При этом все пациенты страдали хроническим генерализованным пародонтитом (ХГП), а кариозные полости были расположены на оголенных участках корней зубов. Изучение анамнеза жизни этих пациентов позволило выявить, что 6 из них (4 женщины и 2 мужчины) страдали различными формами сахарного диабета, а у остальных 7 пациентов была плохая гигиена полости рта, что и поддерживало течение ХГП.
У лиц второго зрелого возраста кариес корня диагностирован у 22 (5,18%) из 425 мужчин и у 23 (4,87%) из 472 осмотренных женщин. У большинства пациентов данного возраста, страдающих кариесом корня зуба, наблюдалась удовлетворительная и плохая гигиена рта. Это обусловливало у них наличие ХГП и оголение корней зубов. Кроме того, кариес корня зуба был диагностирован на зубах с рецессией десны, являющихся опорами для несъемных зубных протезов.
Это обусловливало у них наличие ХГП и оголение корней зубов. Кроме того, кариес корня зуба был диагностирован на зубах с рецессией десны, являющихся опорами для несъемных зубных протезов.
У лиц старших возрастных групп кариес корня диагностировался чаще (р≤0,05). Так, в пожилом возрасте кариес корня зуба был выявлен у 44 (10,11%) мужчин из 435 обследованных и у 45 (9,66%) из 466 осмотренных женщин; в старческом возрасте — у 27 (8,26%) из 327 мужчин и 26 (6,68%) из 389 осмотренных женщин. В пожилом и старческом возрасте кариес корня зуба протекал на фоне плохой гигиены рта и затрагивал поверхность корней зубов, оголенных вследствие заболеваний тканей пародонта, или являющихся опорами несъемных или кламмеров съемных зубных протезов.
Следует отметить, что у людей старших возрастных групп было наиболее сложно выявлять кариозные полости на корнях зубов из-за наличия мягкого зубного налета и остатков пищи. Кроме того, часто при начальных стадиях развития кариеса корня зуба цвет пораженного цемента корня зуба не отличался от цвета цемента интактных зубов, а при обследовании стоматологическим зондом оказывался размягченным, скрывавшим кариозный дефект корня зуба.
Так как кариес корня зуба у пациентов зрелого возраста развивался на фоне удовлетворительной и плохой, а у пациентов пожилого и старческого возраста — плохой гигиены рта и затрагивал поверхность корней, оголенных вследствие заболеваний пародонта, пациентам рекомендованы не только терапевтические и ортопедические стоматологические мероприятия для лечения кариозного процесса, но и коррекция гигиены рта.
После проведения лечебно-профилактических мероприятий с помощью зубной пасты Parodontax Комплексная защита (GSK) в течение 4 нед 2 раза в день во всех возрастных группах наблюдается положительная динамика гигиены рта (рис. 3), Рис. 3. Распределение пациентов зрелого, пожилого и старческого возраста до и после проведения лечебно-профилактических мероприятий по значению суммарного индекса Грин—Вермильона (%). выражающаяся в увеличении доли пациентов с удовлетворительной гигиеной (с 15,0% до 35,0% у лиц зрелого возраста и с 0,0% до 23,3% у лиц пожилого и старческого возраста).
В ходе исследования проведено изучение морфологии твердых тканей зубов пациентов разных возрастных групп — как интактных, так и с кариесом корня зуба. На рис. 4 показан Рис. 4. Средний кариес корня зуба пациента молодого возраста (SEM, ув. 89). электронно-микроскопический снимок верхнего третьего моляра пациента молодого возраста, на котором вверху интактная эмаль коронковой части зуба, имеющая сглаженный вид, а ниже эмалево-цементной границы наблюдается кариозный дефект размером 500×750 мкм в цементе корня зуба с обнажением дентина.
На электронно-микроскопическом снимке нижнего центрального резца пациента пожилого возраста (рис. 5) Рис. 5. Глубокий кариес корня зуба пациента пожилого возраста (SEM, ув. 73). видны кариозная полость большого размера, заполненная деструктурированным дентином, и две небольшие полости размером порядка 550×1000 мкм. На поверхности полостей наблюдается микробное обсеменение. Распад дентина на дне кариозной полости при развившемся кариесе корня зуба показан на рис. 6. Рис. 6. Деструктурированный дентин на дне кариозной полости (SEM, ув. 106).
6. Рис. 6. Деструктурированный дентин на дне кариозной полости (SEM, ув. 106).
На поверхности цемента корня зуба исследованных зубов часто обнаруживались зубной налет и зубные камни, что подтверждало развитие процесса на фоне хронического пародонтита. На снимке цемента корня первого нижнего моляра пациента пожилого возраста определяется крупный (размером 3,5∙103×6,0∙103 мкм) поддесневой зубной камень (рис. 7). Рис. 7. Зубной камень на поверхности корня зуба пациента пожилого возраста (SEM, ув. 76).
При электронно-микроскопическом исследовании установлено, что вне зависимости от возраста пациентов в 96,4% случаев кариес корня зуба наблюдался при наличии морфологических изменений поверхности цемента зуба в виде его сотообразного растрескивания, а в ряде случаев и скалывания цемента с обнажением дентина корня зуба (рис. 8). Рис. 8. Поверхность цемента корня зуба пациента пожилого возраста (SEM, ув. 245). Таким образом, растрескивание цемента, поверхность которого приобретает сотообразный вид (рис. 9), Рис. 9. Эмалево-цементное соединение, поверхность цемента корня зуба пациента среднего возраста (SEM, ув. 76). в отличие от интактного цемента корня зуба со сглаженным видом (рис. 10) Рис. 10. Поверхность интактного цемента корня зуба пациента среднего возраста (SEM, ув. 63). можно считать предрасполагающим фактором в развитии кариеса корня зуба.
9), Рис. 9. Эмалево-цементное соединение, поверхность цемента корня зуба пациента среднего возраста (SEM, ув. 76). в отличие от интактного цемента корня зуба со сглаженным видом (рис. 10) Рис. 10. Поверхность интактного цемента корня зуба пациента среднего возраста (SEM, ув. 63). можно считать предрасполагающим фактором в развитии кариеса корня зуба.
Заключение
Наибольшая распространенность кариеса корня зуба была у людей старших возрастных групп и составила в пожилом возрасте 9,88%, в старческом возрасте 7,40% случаев. У людей молодого, первого и второго зрелого возраста кариес корня диагностировался относительно редко: в 0,26, 1,35 и 5,02% случаев соответственно. При этом у лиц разного возраста кариес корня зуба чаще встречался у мужчин. В первом зрелом возрасте кариес корня зуба встречался на фоне рецессии десны при ХГП, особенно у лиц, страдающих сахарным диабетом. У людей второго зрелого, а также пожилого и старческого возраста кариес корня зуба обычно протекал на фоне плохой гигиены рта, затрагивал поверхность корней, оголенных вследствие заболеваний пародонта, являющихся опорами несъемного или кламмера съемного зубного протеза. При электронно-микроскопическом исследовании установлено, что вне зависимости от возраста пациентов в 96,4% случаев кариес корня зуба наблюдался при наличии морфологических изменений поверхности цемента зуба в виде его сотообразного растрескивания, а в ряде случаев — и скалывания цемента с обнажением дентина корня зуба.
При электронно-микроскопическом исследовании установлено, что вне зависимости от возраста пациентов в 96,4% случаев кариес корня зуба наблюдался при наличии морфологических изменений поверхности цемента зуба в виде его сотообразного растрескивания, а в ряде случаев — и скалывания цемента с обнажением дентина корня зуба.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Сведения об авторах
Для корреспонденции: Иорданишвили А.К. — e-mail: [email protected]; тел.: +7(812)995-00-03
Причины МКБ 10 кариеса
Кариес в МКБ-10 представлен как поражение твердых тканей полости рта. Речь о зубах. Принято говорить о кариесе как об инфекционной патологии, обусловленной бактериальным обсеменением поверхностей единиц. К кариозным поражениям приводят разные факторы.
Что провоцирует кариес
Распространенные факторы «провокации»:
- привычки питания.
 Сладости, газированные напитки, недостаток в продуктах кальция, фосфора и ряда иных веществ – факторы риска. Углеводы исключительно негативно влияют на эмаль, особенно в сочетании с сахарозой. Но на фоне этого необходимо для развития кариеса, чтобы страдала гигиена полости рта;
Сладости, газированные напитки, недостаток в продуктах кальция, фосфора и ряда иных веществ – факторы риска. Углеводы исключительно негативно влияют на эмаль, особенно в сочетании с сахарозой. Но на фоне этого необходимо для развития кариеса, чтобы страдала гигиена полости рта; - болезни и патологические состояния. Ряд ученых и исследователей придерживается позиции, что туберкулез, диабет и иные хронические патологии провоцируют развитие кариеса. Обусловлено все в конкретной ситуации угнетением иммунитета. Редко болезни и патологические состояния приводят к недостаточному снабжению пульпы кровью, в результате нарушается минерализация. Фактор риска – смена молочных зубов постоянными. В этот период развитие определенной болезни часто оставляет след на здоровье единиц до конца жизни;
- внешние факторы. Это чрезмерное ионизирующее воздействие, неблагоприятная окружающая среда, некачественный воздух, плохая вода. Комплексное воздействие ряда факторов внешнего характера нередко приводит к развитию кариеса;
- микроскопические организмы.
 Ряд болезнетворных патогенов при условии регулярного присутствия в полости рта приводит к образованию кариозных поражений. Активность патологической «флоры» демонстрирует прирост при условии недостаточной выработки слюны и не только.
Ряд болезнетворных патогенов при условии регулярного присутствия в полости рта приводит к образованию кариозных поражений. Активность патологической «флоры» демонстрирует прирост при условии недостаточной выработки слюны и не только.
Виды кариозных поражений
Обыкновенная классификация включает такие виды кариеса:
- начальный, не затрагивающий слои зуба под эмалью. Он касается только последней;
- средний и глубокий, сопровождающиеся поражением дентина.
Также выделяют кариес корня, форму, связанную с «замораживанием» патологического процесса. В МКБ-10 дополнительно выделены «иные варианты» и «кариес неуточненный»
В стоматологии также рассматриваются острые формы кариеса и хронические. Первые отличаются скоростью распространения. Они связаны с поражением твердых тканей, развивающимся за 1-2 недели. Хронические же характеризуются как медленно протекающие варианты. Кариес бывает вторичным, рецидивирующим и т. д.
Диагностика кариозных поражений
Независимо от формы кариеса доктор стоматологической клиники в первую очередь опросит пациента, проведет осмотр.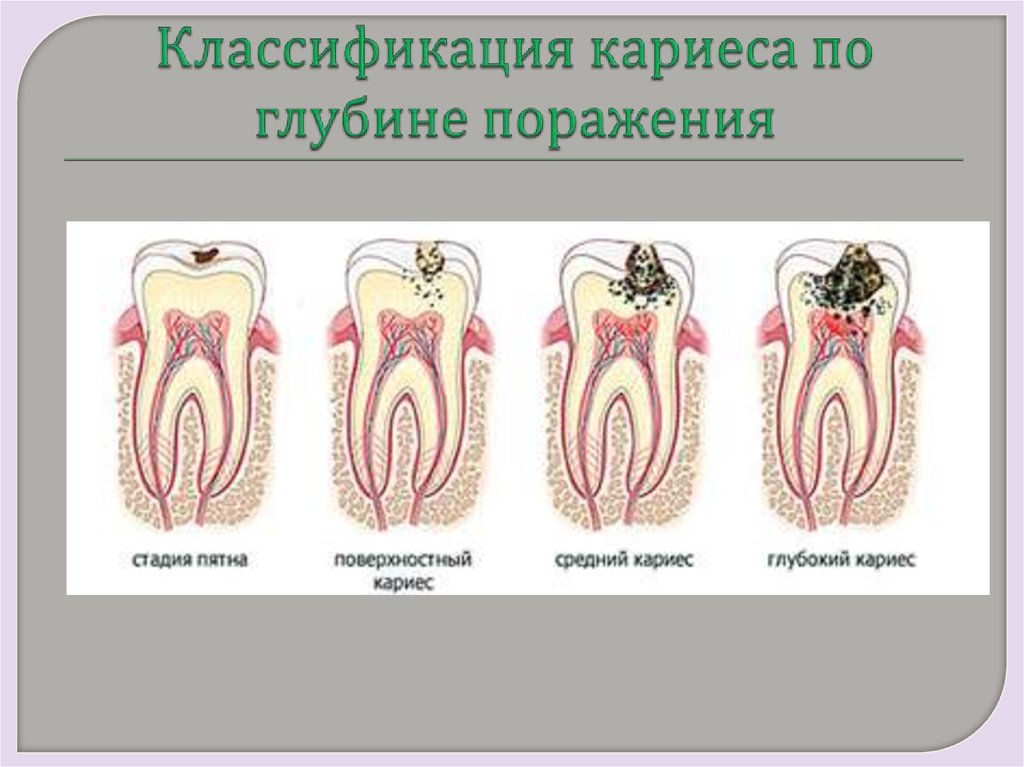 При подозрениях на глубокий кариес или его скрытое расположение (между зубами) назначается рентгенографическое исследование. На снимке врач увидит, есть ли незаметные глазу очаги поражения, примет решение о терапии. Дополнительно посредством рентгена удается выявить сопутствующие скрытые патологии типа пульпита, кист.
При подозрениях на глубокий кариес или его скрытое расположение (между зубами) назначается рентгенографическое исследование. На снимке врач увидит, есть ли незаметные глазу очаги поражения, примет решение о терапии. Дополнительно посредством рентгена удается выявить сопутствующие скрытые патологии типа пульпита, кист.
После реализации диагностических мероприятий стоматолог выбирает тактику и метод лечения. Все зависит от глубины кариозного поражения, от общего состояния полости рта пациента.
Лечение
Терапевтические мероприятия укладываются в ряд этапов:
- Определение тактики с учетом диагностических данных. Поверхностная легкая форма кариеса не требует сверления, достаточно применения лазера. При условии глубокого поражения без инвазивного подхода не обойтись.
- Обезболивание при условии потребности. В ряде клиник пациентам доступна седация. Плюс – абсолютное отсутствие боли и дискомфорта.
- Терапия выбранным способом.
После лечения доктор расскажет пациенту о правилах и рекомендациях на период до одного дня. Также он посоветует специальную профилактику, чтобы исключить повторное возникновение кариеса.
Также он посоветует специальную профилактику, чтобы исключить повторное возникновение кариеса.
Как предупредить поражение
Для исключения вероятности кариозного поражения нужно:
- следить за питанием. Фактор риска – дефицит кальция, фосфора и иных минералов. Негативным в контексте угрозы также является недостаток витаминов. Насыщенная углеводами еда и слишком сладкие продукты, напитки нередко провоцируют кариес;
- регулярно чистить зубы. Помимо щетки и зубной пасты рекомендовано применение ополаскивателя, нити. Состав первого не должен быть чрезмерно агрессивным. В иной ситуации вероятны нежелательные эффекты типа раздражения слизистой рта;
- посещать кабинет стоматолога 1-2 раза в год. Это если и не гарантирует исключение кариеса, то как минимум способствует раннему обнаружению и упрощенной терапии патологических состояний, затрагивающих ткани полости рта.
Так, кариес – распространенная патология инфекционного характера. Она встречается часто. Есть конкретные факторы риска типа дефицита минералов и даже наследственной предрасположенности. При подозрениях на кариозное поражение в виде болей, обостренной чувствительности и потемнений на зубах рекомендован визит к доктору.
Есть конкретные факторы риска типа дефицита минералов и даже наследственной предрасположенности. При подозрениях на кариозное поражение в виде болей, обостренной чувствительности и потемнений на зубах рекомендован визит к доктору.
Что будет при отказе от лечения
Вероятны осложнения. Это как простые воспалительные процессы, так и переход инфекции на мягкие ткани. В тяжелых ситуациях пациенты без терапии сталкиваются с разрушением коронок зубов и их полной утратой. Это требует имплантации и протезирования. По представленным причинам важна своевременная терапия.
Новый антибактериальный пломбировочный материал на основе смолы, содержащий наночастицы, для возможного одноэтапного лечения кариеса
На этой странице пломба, содержащая наноматериалы, для потенциального лечения кариеса. Наночастицы цинка (ZnO@NP, 50 нм) были выбраны из-за их антимикробной способности против аэробных бактерий, и здесь они доказали свою бактерицидность против анаэробных бактериальных штаммов (9). 0007 Streptococcus mutans , Streptococcus mitis и Lactobacillus spp.). Потенциальный механизм действия предложен на основе микробиологических анализов и, по-видимому, не зависит от окислительного стресса, поскольку наночастицы эффективны в микроаэрофильных условиях. Нанесение наночастиц на деминерализованную поверхность зубов и их инфильтрационная способность значительно улучшались, когда ZnO@NP переносился смолой. В целом, этот материал, по-видимому, обладает высоким потенциалом для одноэтапного лечения кариеса.
0007 Streptococcus mutans , Streptococcus mitis и Lactobacillus spp.). Потенциальный механизм действия предложен на основе микробиологических анализов и, по-видимому, не зависит от окислительного стресса, поскольку наночастицы эффективны в микроаэрофильных условиях. Нанесение наночастиц на деминерализованную поверхность зубов и их инфильтрационная способность значительно улучшались, когда ZnO@NP переносился смолой. В целом, этот материал, по-видимому, обладает высоким потенциалом для одноэтапного лечения кариеса.
1. Введение
Кариес представляет собой многофакторное заболевание, характеризующееся разрушением нескольких тканей зуба в результате деминерализации, вызванной кислотами, образованными бактериальным налетом. Бактерии производят эти кислоты как побочный продукт метаболизма углеводов, а затем диффундируют в твердые ткани зубов и растворяют их минеральное содержимое, что приводит к декальцинации. В конечном итоге этот процесс обычно приводит к образованию полости в зубе [1]. При этом инфекционном заболевании эмаль и дентин также в значительной степени подвержены деминерализации под действием кислот [2]. Кариес является одним из наиболее распространенных заболеваний человека и остается проблемой для медицины и стоматологии [3]. Несмотря на общее снижение распространенности кариеса в развитых странах, это заболевание продолжает оставаться актуальной проблемой для взрослого населения как развивающихся, так и промышленно развитых стран [4]. В настоящее время лечение кариеса (или кариеса корня) состоит из нескольких этапов, в связи с чем пациенты склонны прекращать его до достижения полного восстановления. Первым шагом в «лечении корневых каналов» (ЛКИ) является устранение инфекции, за которой следует пломбирование полости и реконструкция пораженной части зуба, чтобы она полностью восстановила свою функциональность. Композиты на основе смолы стали хорошим вариантом для этой последней части из-за их эстетики и возможности прямого заполнения. Однако у них есть одна нерешенная проблема.
При этом инфекционном заболевании эмаль и дентин также в значительной степени подвержены деминерализации под действием кислот [2]. Кариес является одним из наиболее распространенных заболеваний человека и остается проблемой для медицины и стоматологии [3]. Несмотря на общее снижение распространенности кариеса в развитых странах, это заболевание продолжает оставаться актуальной проблемой для взрослого населения как развивающихся, так и промышленно развитых стран [4]. В настоящее время лечение кариеса (или кариеса корня) состоит из нескольких этапов, в связи с чем пациенты склонны прекращать его до достижения полного восстановления. Первым шагом в «лечении корневых каналов» (ЛКИ) является устранение инфекции, за которой следует пломбирование полости и реконструкция пораженной части зуба, чтобы она полностью восстановила свою функциональность. Композиты на основе смолы стали хорошим вариантом для этой последней части из-за их эстетики и возможности прямого заполнения. Однако у них есть одна нерешенная проблема. Пористая смола легко накапливает новый бактериальный налет, что приводит к повторным инфекциям и, что еще хуже, к более инвазивному лечению для его удаления. Поскольку кариес на краях или поверхности реставрации встречается очень часто, было бы крайне желательно, чтобы композит обладал антибактериальной и реминерализирующей способностью [5]. Недавние исследования показывают, что нанотехнологии могут обеспечить новые стратегии профилактики и лечения кариеса [6]. Было предпринято несколько попыток модифицировать смолы для обеспечения антибактериального действия. В большинстве экспериментов антибактериальные агенты вводили в пломбировочные материалы, чтобы препятствовать прикреплению микробов и накоплению зубного налета на их поверхности [7]. Более того, наноматериалы показали большой потенциал для торможения процесса деминерализации, реминерализации зубной структуры и гибели болезнетворных микроорганизмов, участвующих в поражении кариесом. Этот антибактериальный эффект в основном объясняется высоким отношением площади поверхности к объему.
Пористая смола легко накапливает новый бактериальный налет, что приводит к повторным инфекциям и, что еще хуже, к более инвазивному лечению для его удаления. Поскольку кариес на краях или поверхности реставрации встречается очень часто, было бы крайне желательно, чтобы композит обладал антибактериальной и реминерализирующей способностью [5]. Недавние исследования показывают, что нанотехнологии могут обеспечить новые стратегии профилактики и лечения кариеса [6]. Было предпринято несколько попыток модифицировать смолы для обеспечения антибактериального действия. В большинстве экспериментов антибактериальные агенты вводили в пломбировочные материалы, чтобы препятствовать прикреплению микробов и накоплению зубного налета на их поверхности [7]. Более того, наноматериалы показали большой потенциал для торможения процесса деминерализации, реминерализации зубной структуры и гибели болезнетворных микроорганизмов, участвующих в поражении кариесом. Этот антибактериальный эффект в основном объясняется высоким отношением площади поверхности к объему. Кроме того, малый размер этих частиц облегчает проникновение через мембраны бактерий, что приводит к более высокой антимикробной активности [8]. Наночастицы металлов (например, серебра и цинка) за последние годы вызвали значительный интерес из-за их замечательных антимикробных свойств. Наночастицы серебра являются одними из наиболее часто используемых антибактериальных агентов, включаемых в полимерные наполнители; однако обесцвечивание, вызванное восстановлением ионов серебра до металлического серебра, считается серьезной проблемой. Недавно были введены новые наноантибактериальные агенты, такие как наночастицы оксида цинка (ZnO@NP), которые теоретически не вызывают обесцвечивания, нетоксичны и биосовместимы, что делает их пригодными для использования у людей [9]., 10]. Цель данной работы состояла в том, чтобы оценить влияние ZnO@NP, включенного в композит на основе смолы, для потенциального одноэтапного лечения кариеса.
Кроме того, малый размер этих частиц облегчает проникновение через мембраны бактерий, что приводит к более высокой антимикробной активности [8]. Наночастицы металлов (например, серебра и цинка) за последние годы вызвали значительный интерес из-за их замечательных антимикробных свойств. Наночастицы серебра являются одними из наиболее часто используемых антибактериальных агентов, включаемых в полимерные наполнители; однако обесцвечивание, вызванное восстановлением ионов серебра до металлического серебра, считается серьезной проблемой. Недавно были введены новые наноантибактериальные агенты, такие как наночастицы оксида цинка (ZnO@NP), которые теоретически не вызывают обесцвечивания, нетоксичны и биосовместимы, что делает их пригодными для использования у людей [9]., 10]. Цель данной работы состояла в том, чтобы оценить влияние ZnO@NP, включенного в композит на основе смолы, для потенциального одноэтапного лечения кариеса.
2. Экспериментальный
2.1. Бактериальные штаммы
Streptococcus mutans , Streptococcus mitis и Lactobacillus spp.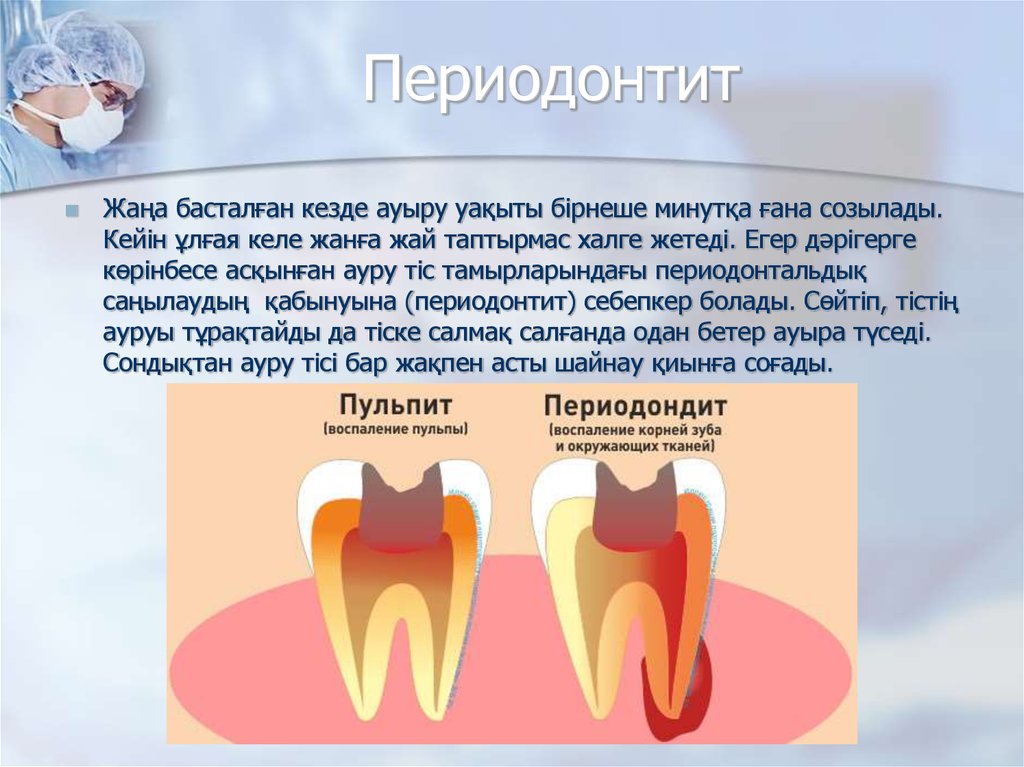 были приобретены из коллекции штаммов Специальной бактериологической службы (CCBE), INEI-ANLIS из Instituto Malbrán (Буэнос-Айрес, Аргентина).
были приобретены из коллекции штаммов Специальной бактериологической службы (CCBE), INEI-ANLIS из Instituto Malbrán (Буэнос-Айрес, Аргентина).
Эти штаммы всегда содержались в микроаэрофильных условиях с использованием анаэробного сосуда и выращивались в тиогликолевом бульоне с колориметрическим индикатором или в агаре с добавлением крови в соответствии с потребностями эксперимента.
2.2. Наночастицы и бактериальные среды
Сферический ZnO@NP (CAS № 1314-13-2) в виде белого порошка был приобретен у Sigma Aldrich и использовался без модификаций, размер <50 нм. DMEM и инфузия мозга и сердца были получены от Britania Lab.
Тиогликолевый бульон также был приобретен в Britania Lab, свежеприготовлен и стерилизован; Кроме того, каждый раз перед использованием его нагревали на мягкой водяной бане до тех пор, пока его цвет не указывал на отсутствие растворенного в жидкости кислорода. Смола Icon® была приобретена у DMG Chemisch-Pharmazeutische Fabrik, Гамбург (композиция на основе матрицы метакрилатной смолы, полностью не раскрыта производителем) и использовалась прямо из шприца-аппликатора. Чашки Петри с агаром с добавлением крови были приобретены в Britania Lab.
Чашки Петри с агаром с добавлением крови были приобретены в Britania Lab.
2.3. Стабильность суспензий ZnO@NP
Равное количество наночастиц (2 мг/мл) добавляли к DMEM, настою сердечно-мозговой жидкости, тиогликолевому бульону и смоле Icon®. Суспензии наночастиц хранили при 37°С в микроаэрофильной банке и визуально проверяли на агрегацию или изменения через t = 0, 2, 4, 6, 12, 24, 48, 72 ч.
2.4. Антибактериальная активность
Большой диапазон от 0,2 до 2,2 мг/мл ZnO@NP (в тиогликолевом бульоне) был проанализирован с помощью метода микроразведений (в 96-луночный планшет) против исходного бактериального инокулята (106 КОЕ/мл), свежеприготовленного (также в тиогликолевом бульоне) из одной колонии. Все образцы и контроли (только бульон, ZnO@NP + бульон, только бактериальная суспензия) были проведены в трех повторностях, и эксперимент был полностью воспроизведен дважды. Инкубацию бактериальной суспензии с разной концентрацией наночастиц проводили в течение 18 ч при 37°С в специально предназначенном для этого анаэробном сосуде. По истечении этого периода аликвоты по 10 мкл л образцов с меньшей мутностью и без нее (и контроли) наносили на чашки Петри с кровяным агаром и инкубировали в тех же условиях в течение 18 ч. Наконец, был проведен подсчет КОЕ. Окрашивание по Граму проводили в начале и в конце эксперимента, чтобы убедиться, что штаммы не были загрязнены в процессе.
По истечении этого периода аликвоты по 10 мкл л образцов с меньшей мутностью и без нее (и контроли) наносили на чашки Петри с кровяным агаром и инкубировали в тех же условиях в течение 18 ч. Наконец, был проведен подсчет КОЕ. Окрашивание по Граму проводили в начале и в конце эксперимента, чтобы убедиться, что штаммы не были загрязнены в процессе.
2.5. ZnO@NP и анализ взаимодействия с поверхностью зубов
Полностью развитые третьи моляры были получены из банка зубов для исследовательских предложений (Факультет одонтологии, Кордова, Аргентина — Факультет стоматологии Национального университета Кордовы, Аргентина — Институциональный комитет по этике, документ N° 3/2016). Они были сохранены в дистиллированной воде при 4°C и дополнительно обработаны для данного исследования. Срезы толщиной 5 мм были вырезаны из области дентина Coronal Medium с помощью низкоскоростной пилы Buehler ISOMET (производство: Alemania). Образцы были отполированы абразивным диском и покрыты фиолетовым лаком для ногтей, за исключением небольшого окна (3 × 3 мм), как показано на рисунке 1. 9.0003
9.0003
2.6. Инфильтрация ZnO@NP в образцы зубов
Вышеупомянутые срезы третьих моляров, обработанные суспензиями ZnO@NP, разрезали пополам (под углом 90° к первому разрезу). Новые срезы наблюдали с помощью СЭМ, чтобы определить способность наноматериала проникать в физиологический раствор и смолу Icon®.
2.7. SEM/EDS Analysis
Обработанные зубные срезы обрабатывали хромом для наблюдения SEM/EDS (Lamarx Lab, Universidad Nacional de Córdoba, Аргентина).
2.8. Статистический анализ
Все эксперименты проводились трижды, числовые данные представлены в виде средних значений с планками погрешностей, представляющими стандартные отклонения.
3. Результаты и обсуждение
Как правило, бактерии ограничены клеточной мембраной и клеточной стенкой. Внешняя граница, клеточная стенка, в основном состоит из пептидогликана и поддерживает осмотическое давление цитоплазмы и характерную морфологию [11]. Основное различие между грамположительными и грамотрицательными бактериями состоит в том, что первые имеют многослойную мембрану из пептидогликана, а последние имеют только одну (из двух) мембран, состоящую из тонкого слоя пептидогликана.
Общий внешний заряд обоих типов бактерий отрицательный; поэтому ожидается лучшее взаимодействие для положительно заряженных лекарств. ZnO@NP, используемые в этом исследовании, были выбраны, потому что они имеют средний размер <50 нм (рис. 2) и глобальный положительный дзета-потенциал>35 мВ. Они являются одними из самых маленьких и более стабильными в кислых значениях рН, что является средой внутри рта [12]. Ожидается хорошее электростатическое взаимодействие между бактериями и выбранными наночастицами из-за их общего внешнего заряда. В частности, в этой работе оценивается влияние ZnO@NP на кариес, вызывающий ранее упомянутые анаэробные штаммы. Все три из них являются грамположительными продуцентами молочной кислоты. Они производят огромное количество этой едкой кислоты из пищевого сахара. По всем этим причинам оценка антибактериальных агентов должна проводиться в культуральной среде с высоким содержанием сахара и кислых бактерий с очень низкой концентрацией кислорода. ZnO@NP были более стабильны в тиогликолевом бульоне, чем в мозгово-сердечном бульоне, поэтому он был выбран для проведения микробиологических экспериментов. Это может быть связано с тем, что последний имеет меньшую концентрацию солей, которые могут способствовать агрегации наночастиц. Высокая стабильность также наблюдалась в DMEM и смоле (для испытаний на взаимодействие и проникновение). Это может быть связано с взаимодействием ZnO@NP с кислотными группами из среды, которые, как известно, действуют как стабилизаторы [13].
Это может быть связано с тем, что последний имеет меньшую концентрацию солей, которые могут способствовать агрегации наночастиц. Высокая стабильность также наблюдалась в DMEM и смоле (для испытаний на взаимодействие и проникновение). Это может быть связано с взаимодействием ZnO@NP с кислотными группами из среды, которые, как известно, действуют как стабилизаторы [13].
Для исследования in vitro антибактериальной активности наночастиц были приняты различные методы, хотя не все из них учитывают особые потребности этих штаммов и свойства наноматериалов [14]. Например, наиболее часто используется метод диффузии в агар, который является косвенной оценкой. На самом деле существует множество факторов, определяющих размер зоны ингибирования в этом анализе, включая растворимость лекарства, концентрацию в диске и скорость его диффузии через агар, а также толщину агаровой среды. Интерпретация дискового диффузионного анализа Кирби-Бауэра дает лишь ограниченную информацию о чувствительности и резистентности к тестируемым препаратам, поскольку все вышеупомянутые факторы не стандартизированы. Что еще более важно, анализ не может различить бактериостатическую и бактерицидную активность. Методика дисковой диффузии Кирби-Бауэра не подходит для оценки антибактериальной активности ZnO@NP, учитывая отсутствие растворимости в воде и низкую диффузию в агаре. В других литературных сообщениях говорится о том, как ZnO@NP значительно снижает рост и размножение бактерий [15, 16], что согласуется с экспериментальными данными настоящего исследования. Однако метод мутности обычно применялся отдельно, что имеет свои недостатки, поскольку он исследует как мертвые, так и живые бактерии. Напротив, в настоящем исследовании измерения оптической плотности бактериальных суспензий (по сравнению с контролями только с суспензией наночастиц) рассматривались как показатель ингибирования роста; выбранные образцы позже были засеяны для дальнейшего подсчета КОЕ. Таким образом, концентрация МПК для каждого штамма была проверена дважды, что позволило преодолеть недостатки отдельных методологий.
Что еще более важно, анализ не может различить бактериостатическую и бактерицидную активность. Методика дисковой диффузии Кирби-Бауэра не подходит для оценки антибактериальной активности ZnO@NP, учитывая отсутствие растворимости в воде и низкую диффузию в агаре. В других литературных сообщениях говорится о том, как ZnO@NP значительно снижает рост и размножение бактерий [15, 16], что согласуется с экспериментальными данными настоящего исследования. Однако метод мутности обычно применялся отдельно, что имеет свои недостатки, поскольку он исследует как мертвые, так и живые бактерии. Напротив, в настоящем исследовании измерения оптической плотности бактериальных суспензий (по сравнению с контролями только с суспензией наночастиц) рассматривались как показатель ингибирования роста; выбранные образцы позже были засеяны для дальнейшего подсчета КОЕ. Таким образом, концентрация МПК для каждого штамма была проверена дважды, что позволило преодолеть недостатки отдельных методологий.
МИК ZnO@NP составляла 1,2 мг/мл для S. mitis и всего 0,6 мг/мл для S. mutans и Lactobacillus , но некоторый эффект можно было наблюдать при концентрации всего 0,2 мг /мл (рис. 3). Эти значения даже ниже, чем те, которые указаны Hojati et al. [17], вероятно, потому, что несколько факторов, влияющих на методологию, которую они использовали, на самом деле не обнаружили никакой зоны ингибирования при диффузии в агар, но доказали эффект прямого контакта через.
mitis и всего 0,6 мг/мл для S. mutans и Lactobacillus , но некоторый эффект можно было наблюдать при концентрации всего 0,2 мг /мл (рис. 3). Эти значения даже ниже, чем те, которые указаны Hojati et al. [17], вероятно, потому, что несколько факторов, влияющих на методологию, которую они использовали, на самом деле не обнаружили никакой зоны ингибирования при диффузии в агар, но доказали эффект прямого контакта через.
Представленные здесь данные также подтверждают антибактериальный эффект и обеспечивают точное значение минимальной ингибирующей концентрации. Кроме того, после проверки жизнеспособности культур, обработанных наночастицами, путем подсчета КОЕ, можно убедиться, что ZnO@NP является бактерицидным для тестируемых штаммов. Важно отметить, что экспериментальная установка позволяет продемонстрировать их бактерицидность даже в микроаэрофильных условиях, которые являются реальными условиями внутри кариозной полости. Один из предполагаемых антибактериальных механизмов ZnO@NP заключается в том, что они продуцируют активные формы кислорода, такие как пероксидный радикал, которые мешают росту микробов. Это может быть верно в аэробной среде, но представленные здесь результаты показывают, что эта антимикробная способность не зависит от наличия кислорода. Кроме того, нет необходимости исследовать фотокаталитическую активность ZnO@NP, поскольку они убивают анаэробные бактерии без какого-либо облучения. Этот эффект в темноте наблюдался и другими исследователями, но никогда не проверялся в условиях микроаэрофильной культуры [18, 19].]. Антибактериальный механизм ZnO@NP в темноте частично объясняется модификацией активности клеточной мембраны после электростатического взаимодействия [20]. В то же время ионы Zn 2+ , вымываемые в ростовые среды, нарушают метаболизм основных сахаров и вытесняют ионы магния, необходимые для ферментативных систем бактерий [8]. Все это в совокупности могло бы объяснить эффективность этого антибактериального средства.
Это может быть верно в аэробной среде, но представленные здесь результаты показывают, что эта антимикробная способность не зависит от наличия кислорода. Кроме того, нет необходимости исследовать фотокаталитическую активность ZnO@NP, поскольку они убивают анаэробные бактерии без какого-либо облучения. Этот эффект в темноте наблюдался и другими исследователями, но никогда не проверялся в условиях микроаэрофильной культуры [18, 19].]. Антибактериальный механизм ZnO@NP в темноте частично объясняется модификацией активности клеточной мембраны после электростатического взаимодействия [20]. В то же время ионы Zn 2+ , вымываемые в ростовые среды, нарушают метаболизм основных сахаров и вытесняют ионы магния, необходимые для ферментативных систем бактерий [8]. Все это в совокупности могло бы объяснить эффективность этого антибактериального средства.
Помимо антибактериального действия ZnO@NP может играть потенциально положительную роль в регенерации тканей, поскольку Ларсен и Олд [21] показали, что цинк помогает стабилизировать белки и оказывает защитное действие при связывании с областями коллагена, чувствительными к протеиназе металлов. расщепление. Они показали, что цинк, образуя моногидроксид цинка, связывает каталитические ионы с боковой цепью в активном центре карбоксипептидазы А и ингибирует ее. По-видимому, цинк действует как конкурентный ингибитор матриксной металлопротеиназы (ММП) и снижает дегенерацию коллагена в гибридном слое с одной связью и не оказывает отрицательного влияния на прочность связи [22]. Наконец, микрофотография SEM вместе с измерениями EDS в обработанных зубных срезах (рис. 4) показали, что загрузка наноматериала была в 22 раза выше (масс.%: 42,9).± 1; Рисунок 4(c)) в дентальных образцах, обработанных ZnO@NP в смоле, чем в образцах, обработанных ZnO@NP при той же концентрации в солевом растворе (масс.%: 1,9 ± 1; рисунок 4(b)). Наночастицы измеряли количественным микроанализом ЭДС в СЭМ, где рассчитывали массовые доли или массовые проценты элементов, присутствующих в образце. Напротив, никакого взаимодействия вообще не наблюдалось, когда наночастицы были взвешены только в воде (рис. 4(а)). Интересно, что в предыдущих исследованиях сообщалось, что включение наночастиц в композитные смолы не влияет на их адгезионные свойства, но действительно оказывает положительное влияние на их механические характеристики.
расщепление. Они показали, что цинк, образуя моногидроксид цинка, связывает каталитические ионы с боковой цепью в активном центре карбоксипептидазы А и ингибирует ее. По-видимому, цинк действует как конкурентный ингибитор матриксной металлопротеиназы (ММП) и снижает дегенерацию коллагена в гибридном слое с одной связью и не оказывает отрицательного влияния на прочность связи [22]. Наконец, микрофотография SEM вместе с измерениями EDS в обработанных зубных срезах (рис. 4) показали, что загрузка наноматериала была в 22 раза выше (масс.%: 42,9).± 1; Рисунок 4(c)) в дентальных образцах, обработанных ZnO@NP в смоле, чем в образцах, обработанных ZnO@NP при той же концентрации в солевом растворе (масс.%: 1,9 ± 1; рисунок 4(b)). Наночастицы измеряли количественным микроанализом ЭДС в СЭМ, где рассчитывали массовые доли или массовые проценты элементов, присутствующих в образце. Напротив, никакого взаимодействия вообще не наблюдалось, когда наночастицы были взвешены только в воде (рис. 4(а)). Интересно, что в предыдущих исследованиях сообщалось, что включение наночастиц в композитные смолы не влияет на их адгезионные свойства, но действительно оказывает положительное влияние на их механические характеристики.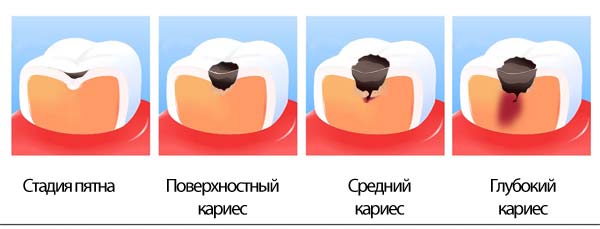 Изменение свойств смолы является общей проблемой при добавлении наночастиц, но ZnO@NP не оказывает никакого отрицательного воздействия на метакрилатный материал. Эти наночастицы придавали смоле антимикробные свойства без изменения прочности связи при сдвиге [2]. Еще одной проблемой до клинического применения является уровень токсичности для клеток человека. К счастью, они не токсичны при очень низких концентрациях [1].
Изменение свойств смолы является общей проблемой при добавлении наночастиц, но ZnO@NP не оказывает никакого отрицательного воздействия на метакрилатный материал. Эти наночастицы придавали смоле антимикробные свойства без изменения прочности связи при сдвиге [2]. Еще одной проблемой до клинического применения является уровень токсичности для клеток человека. К счастью, они не токсичны при очень низких концентрациях [1].
В дополнение к этим преимуществам, ZnO@NP, содержащийся в смоле, показал лучшую фильтрующую способность, чем в солевом растворе (рис. 5). Как можно заметить, Zn, характерный для ZnO@NP, может быть обнаружен на глубине до 1020 мкм м от поверхности зуба, когда в качестве носителя используется метакрилатная смола. Напротив, проникновение цинка отсутствует, когда наночастицы суспендированы в фосфатно-солевом буфере (PBS). Эта способность проникать в дентальный образец имеет основополагающее значение для достижения глубоких бактериальных инфекционных очагов.
4. Выводы
В связи с тем, что эволюция лечения кариеса смещается в сторону «минимально инвазивных» методов, терапевтические эффекты реставрационных материалов возлагаются на все большие надежды. Существующие материалы замещают недостающий объем полости зуба, хотя было бы полезно, чтобы будущие реставрационные материалы не только замещали недостающий объем, но также были биоактивными и обладали полезными терапевтическими свойствами.
Нанотехнология разрабатывает биоактивные терапевтические материалы нового поколения как инновационную концепцию разработки материалов с противокариесным потенциалом, способных оказывать синергетический эффект. Доказано, что включение наночастиц в стоматологические композиты и адгезивы имеет множество преимуществ: антибактериальные свойства и реминерализация поражений зубов. Хотя большинство исследований нового поколения противомикробных, терапевтических и биоактивных смол проводятся in vitro, исследования in vivo по-прежнему необходимы. С другой стороны, необходимо определить, вызывают ли антибактериальные смолы резистентность бактерий к лекарственным средствам. Тем не менее ожидается, что новое поколение противомикробных смол, подобных предложенному в этой работе, принесет огромные преимущества для здоровья полости рта. В то же время эти противомикробные смолы могут стать основой для других противомикробных наноматериалов или наполнителей. Результаты этого исследования обнадеживают и открывают двери для будущих междисциплинарных исследований и клинических исследований, которые позволят установить терапевтическую ценность реставрационных материалов на основе нанотехнологий.
С другой стороны, необходимо определить, вызывают ли антибактериальные смолы резистентность бактерий к лекарственным средствам. Тем не менее ожидается, что новое поколение противомикробных смол, подобных предложенному в этой работе, принесет огромные преимущества для здоровья полости рта. В то же время эти противомикробные смолы могут стать основой для других противомикробных наноматериалов или наполнителей. Результаты этого исследования обнадеживают и открывают двери для будущих междисциплинарных исследований и клинических исследований, которые позволят установить терапевтическую ценность реставрационных материалов на основе нанотехнологий.
Доступность данных
Данные, полученные или проанализированные в ходе этого исследования, включены в эту опубликованную рукопись; однако более подробную информацию можно получить у авторов по обоснованному запросу.
Дополнительные точки
Перспектива будущего . Лечение кариеса должно было бы эволюционировать в более практичную и быструю методику, соответствующую требованиям и стандартам современной стоматологии, в том числе концепции малоинвазивной восстановительной стоматологии. Разработка новых материалов, подобных представленному здесь, имеет важное значение для этого предложения. Для нас очевидно, что менее чем через 10 лет одноэтапное неинвазивное лечение кариеса станет рутинным. В этих рамках особое внимание будет уделяться нанотехнологиям и особенно использованию металлических наночастиц. Резюме . Поражение кариесом и современное лечение: (i) кариес характеризуется разрушением зуба вследствие деминерализации, вызванной бактериальным налетом; (ii) рутинное лечение кариеса состоит из нескольких этапов, которые обычно включают механическое удаление зубной ткани, и поэтому пациенты склонны отказываться от него. Предлагаемый наноматериал: (i) используемые здесь ZnO@NP имеют средний размер <50 нм и глобальный положительный дзета-потенциал>35 мВ; (ii) они являются одними из самых маленьких и более стабильными в кислых значениях pH во рту; (iii) они имеют хорошее электростатическое взаимодействие с бактериями, вызывающими кариес. Антибактериальная активность: (i) МИК ZnO@NP составляла 1,2 мг/мл в течение S.
Разработка новых материалов, подобных представленному здесь, имеет важное значение для этого предложения. Для нас очевидно, что менее чем через 10 лет одноэтапное неинвазивное лечение кариеса станет рутинным. В этих рамках особое внимание будет уделяться нанотехнологиям и особенно использованию металлических наночастиц. Резюме . Поражение кариесом и современное лечение: (i) кариес характеризуется разрушением зуба вследствие деминерализации, вызванной бактериальным налетом; (ii) рутинное лечение кариеса состоит из нескольких этапов, которые обычно включают механическое удаление зубной ткани, и поэтому пациенты склонны отказываться от него. Предлагаемый наноматериал: (i) используемые здесь ZnO@NP имеют средний размер <50 нм и глобальный положительный дзета-потенциал>35 мВ; (ii) они являются одними из самых маленьких и более стабильными в кислых значениях pH во рту; (iii) они имеют хорошее электростатическое взаимодействие с бактериями, вызывающими кариес. Антибактериальная активность: (i) МИК ZnO@NP составляла 1,2 мг/мл в течение S. mitis и всего 0,6 мг/мл для S. mutans и Lactobacillus ; (ii) в этом случае противомикробная активность не зависела от наличия кислорода. Взаимодействие и инфильтрация ZnO@NP дентальными образцами: (i) нагрузка наноматериала на поверхность зубов была в 22 раза выше, когда ZnO@NP несли в смоле вместо PBS; (iv) глубокая инфильтрация ZnO@NP внутрь молярного образца могла быть достигнута только тогда, когда они переносились в метакрилатной смоле.
mitis и всего 0,6 мг/мл для S. mutans и Lactobacillus ; (ii) в этом случае противомикробная активность не зависела от наличия кислорода. Взаимодействие и инфильтрация ZnO@NP дентальными образцами: (i) нагрузка наноматериала на поверхность зубов была в 22 раза выше, когда ZnO@NP несли в смоле вместо PBS; (iv) глубокая инфильтрация ZnO@NP внутрь молярного образца могла быть достигнута только тогда, когда они переносились в метакрилатной смоле.
Раскрытие информации
SDP и MCB являются участниками исследования карьеры CONICET.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
NAV и MJSC внесли равный вклад в подготовку рукописи и проведение экспериментов. Все авторы обсудили результаты и согласились с окончательным вариантом рукописи. Наталья Анхель Вильегас и М. Джазмин Сильверо К. являются соавторами этой работы.
Благодарности
Эта работа была поддержана фондом FONCyT (PICT 2016-016), предоставленным SDP, и фондами CONICET (PIP 2012–2014, грант № 11220110100965), SECyT-UNC и FONCyT (PICT 2014, грант № 821), выданный доктору Бесерре. NAV и MJS особенно благодарны CONICET за их постдокторскую стипендию. DMR благодарит SECyT-UNC за докторскую стипендию. Авторы признательны Себастьяну Эдуардо Гарсии за техническую поддержку в подготовке и анализе образцов СЭМ, а также профессору Рикардо Кабралу за его профессиональную помощь в работе со срезами зубов.
NAV и MJS особенно благодарны CONICET за их постдокторскую стипендию. DMR благодарит SECyT-UNC за докторскую стипендию. Авторы признательны Себастьяну Эдуардо Гарсии за техническую поддержку в подготовке и анализе образцов СЭМ, а также профессору Рикардо Кабралу за его профессиональную помощь в работе со срезами зубов.
Ссылки
-
Р. М. Аль-Мосави и Р. М. Аль-Бадр, «Изучение воздействия стоматологической композитной смолы как антибактериального агента, содержащего наночастицы оксида цинка, на бактерии, связанные с оральной инфекцией», IOSR Journal of Dental and Medical наук , вып. 16, нет. 1, стр. 49–55, 2017 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
-
M. Saffarpour, M. Rahmani, M. Tahriri и A. Peymani, «Антимикробные свойства и прочность сцепления стоматологического клея, содержащего наночастицы оксида цинка», Бразильский журнал устных наук , том.
 15, нет. 1, с. 66, 2016.
15, нет. 1, с. 66, 2016. Посмотреть по адресу:
Сайт издателя | Google Scholar
-
M. Mahfouz и A.A. Esaid, «Распространенность кариеса среди палестинских детей в возрасте 12–15 лет», International Scholarly Research Notices , vol. 2014 г., идентификатор статьи 785404, 4 страницы, 2014 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
-
Б. Камбери, Ф. Кочани, А. Бегзати и др., «Распространенность кариеса среди взрослого населения Косова», стр. Международный стоматологический журнал , том. 2016 г., идентификатор статьи 42, 6 страниц, 2016 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
-
L. Cheng, K. Zhang, N. Zhang et al., «Разработка нового поколения противомикробных и биоактивных стоматологических смол», Journal of Dental Research , vol.
 96, нет. 8, стр. 855–863, 2017.
96, нет. 8, стр. 855–863, 2017. Посмотреть по адресу:
Сайт издателя | Google Scholar
-
С. Нгуен и М. Хиорт, «Усовершенствованные системы доставки лекарств для местного лечения полости рта», Терапевтическая доставка , том. 6, нет. 5, стр. 595–608, 2015.
Посмотреть по адресу:
Сайт издателя | Google Scholar
-
С. Имазато, «Антибактериальные свойства полимерных композитов и систем фиксации дентина», Dental Materials , vol. 19, нет. 6, стр. 449–457, 2003.
Посмотреть по адресу:
Сайт издателя | Google Scholar
-
M. A. S. Melo, S. F. F. Guedes, H. H. K. Xu и L. K. A. Rodrigues, «Реставрационные материалы на основе нанотехнологий для лечения кариеса», Тенденции в биотехнологии , том. 31, нет.
 8, стр. 459–467, 2013.
8, стр. 459–467, 2013. Посмотреть по адресу:
Сайт издателя | Google Scholar
-
Ф. Мартинес-Гутьеррес, П. Л. Олив, А. Бануэлос и др., «Синтез, характеристика и оценка антимикробного и цитотоксического действия наночастиц серебра и титана», Наномедицина: нанотехнология, биология и медицина , том. 6, нет. 5, стр. 681–688, 2010.
Посмотреть по адресу:
Сайт издателя | Академия Google
-
Y. Zhang, T. R. Nayak, H. Hong и W. Cai, «Биомедицинские применения наноматериалов оксида цинка», Current Molecular Medicine , vol. 13, нет. 10, стр. 1633–1645, 2013.
Посмотреть по адресу:
Сайт издателя | Google Scholar
-
Р. Д. Тернер, С. Меснаж, Дж. К. Хоббс и С. Дж. Фостер, «Молекулярная визуализация гликановых цепей связывает архитектуру полисахарида клеточной стенки с морфологией бактериальной клетки», Nature Communications , vol.
 9, нет. 1, с. 1263, 2018.
9, нет. 1, с. 1263, 2018. Посмотреть по адресу:
Сайт издателя | Google Scholar
-
Р. Марсалек, «Размер частиц и дзета-потенциал ZnO», APCBEE Procedia , vol. 9, стр. 13–17, 2014 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
-
C. P. Tso, C. M. Zhung, YH Shih, YM Tseng, S. C. Wu и R. A. Doong, «Стабильность наночастиц оксидов металлов в водных растворах», Water Science and Technology , vol. 61, нет. 1, стр. 127–133, 2010.
Посмотреть по адресу:
Сайт издателя | Google Scholar
-
S. A. Aleaghil, E. Fattahy, B. Baei et al., «Антибактериальная активность наночастиц оксида цинка в отношении Staphylococcus aureus », International Journal of Advanced Biotechnology and Research (IJBR) , vol.
 7, нет. 3, pp. 1569–1575, 2016.
7, нет. 3, pp. 1569–1575, 2016. Просмотр по адресу:
Google Scholar
-
Л. Ниу, М. Фанг, К. Цзяо и др., «Усиление тетраподообразных вискеров оксида цинка в полимерном композите, Журнал стоматологических исследований , том. 89, нет. 7, стр. 746–750, 2010.
Посмотреть по адресу:
Сайт издателя | Google Scholar
-
Б. А. Севинч и Л. Хэнли, «Антибактериальная активность стоматологических композитов, содержащих наночастицы оксида цинка», Journal of Biomedical Materials Research Part B: Applied Biomaterials , vol. 9999B, 2010.
Посмотреть по адресу:
Сайт издателя | Google Scholar
-
S. T. Hojati, H. Alaghemand, F. Hamze et al., «Антибактериальные, физические и механические свойства текучих полимерных композитов, содержащих наночастицы оксида цинка», Стоматологические материалы , том.
 29, нет. 5, стр. 495–505, 2013 г.
29, нет. 5, стр. 495–505, 2013 г. Посмотреть по адресу:
Сайт издателя | Google Scholar
-
R. Mahendra and S. Ranjita, Metal Nanoparticles in Pharma , Springer, Berlin, Germany, 1st edition, 2017.
-
L. Zhang, Y. Jiang, Y. Ding, M. Povey и D. York, «Исследование антибактериального поведения суспензий наночастиц ZnO (наножидкости ZnO)», Journal of Nanoparticle Research , vol. 9, нет. 3, стр. 479–489, 2006 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
-
A. Sirelkhatim, S. Mahmud, A. Seeni et al., «Обзор наночастиц оксида цинка: антибактериальная активность и механизм токсичности», Nano-Micro Letters , vol. 7, нет. 3, pp. 219–242, 2015.
Просмотр по адресу:
Google Scholar
-
Ларсен К.
 С. и Олд Д.С. «Характеристика сайта связывания ингибирующего металла в карбоксипептидазе А», стр. 9.0007 Биохимия , вып. 30, нет. 10, стр. 2613–2618, 1991.
С. и Олд Д.С. «Характеристика сайта связывания ингибирующего металла в карбоксипептидазе А», стр. 9.0007 Биохимия , вып. 30, нет. 10, стр. 2613–2618, 1991. Посмотреть по адресу:
Сайт издателя | Google Scholar
-
K. M. Wang, K. Bitter, and C. Arrais, An Adhesive Dentistry Perspective in Restoration of Tired Canal Teeth , J. Perdigão, Ed., Springer, Berlin, Germany, 2015.
Copyright
Copyright © 2019 Natalia Angel Villegas et al. Это статья с открытым доступом, распространяемая в соответствии с лицензией Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии надлежащего цитирования оригинальной работы.
Диета и здоровье полости рта | Изумрудное понимание
Цитата
(1999), «Диета и здоровье полости рта», Nutrition & Food Science , Vol. 99 № 4. https://doi.org/10.1108/nfs.1999.01799daf.003
99 № 4. https://doi.org/10.1108/nfs.1999.01799daf.003
Издатель
:Изумруд Групп Паблишинг Лимитед
Авторское право © 1999, MCB UP Limited
Диета и здоровье полости рта
Диета и здоровье полости рта
Организован крупный отчет Британским фондом питания по гигиене полости рта: диета и другие факторы. была представлена на однодневной конференции в Лондоне в начале года. взаимосвязь между типами пищевых продуктов и моделями потребления и риском кариес зубов составляет основу отчета. На конференции эксперты-члены Устная целевая группа, составившая отчет, представила документы. К ним относятся отзывы о питании и кариесе, здоровье зубов у детей, пожилых людей и др. группы риска, диетические связи с такими дефектами зубов, как эрозия и с раком полости рта.
Профессор Майк Эдгар рассказал о причине кариеса и указал, что кариес
результат взаимодействия с течением времени трех факторов: восприимчивый зуб
тканях, оральные бактерии в виде зубного налета и поступление с пищей
ферментируемый углевод, на практике в основном сахар, который может быть преобразован
к кислоте бактериями зубного налета. Способ профилактики кариеса — ограничение
частота приема сахаров и других легко ферментируемых углеводных продуктов.
Их следует употреблять во время еды, а не между приемами пищи. Профессор Эдгар
указал, что сыр сводит на нет падение pH слюны после сладкого
десерт. Такой же эффект дает арахис. Жевание жевательной резинки без сахара после
прием пищи стимулирует выделение слюны и нейтрализует кислотность во рту.
Способ профилактики кариеса — ограничение
частота приема сахаров и других легко ферментируемых углеводных продуктов.
Их следует употреблять во время еды, а не между приемами пищи. Профессор Эдгар
указал, что сыр сводит на нет падение pH слюны после сладкого
десерт. Такой же эффект дает арахис. Жевание жевательной резинки без сахара после
прием пищи стимулирует выделение слюны и нейтрализует кислотность во рту.
Профессор Филип Холлоуэй, стоматологическое отделение Манчестерского университета, дал
статья об эпидемиологии кариеса, начиная с того факта, что кариес
был с человечеством с древности. В местах захоронения обнаружены древние черепа
и старые картины и письмена дают нам это свидетельство. Самый ранний человек
черепа показали разрушение зубов, начинающееся с поверхности корня, обращенного
следующий зуб. Зубы древних египтян имели признаки кариеса и римского
центурийцы страдали этой болезнью. В обоих случаях это, вероятно, было связано с
эффект натуральных источников сахара в инжире, финиках, сладком вине и других сладостях
деликатесы. Кариес был в основном болезнью взрослых, и его распространенность была
низок и ограничивается в основном небольшими группами населения, подверженными риску.
Кариес был в основном болезнью взрослых, и его распространенность была
низок и ограничивается в основном небольшими группами населения, подверженными риску.
Распространенность кариеса в этой стране на протяжении веков оставалась низкой, но
стала заметно возрастать в середине прошлого века, когда пошлина на
сахар был удален, а законы о кукурузе отменены. Этот подъем был остановлен лишь ненадолго.
вмешательством двух мировых войн, когда поставки сахара были сокращены. Другой
хороший пример произошел на острове Тристан-да-Куна. До второго
мировой войны островитяне были изолированы от остального мира и имели очень
ограниченный рацион в основном из рыбы и картофеля. С началом войны англичане
на острове была создана военно-морская база, и населению был предоставлен доступ
к блюдам, которыми пользуется обслуживающий персонал. После войны рыбные консервы
была создана промышленность, которая увеличила поставки импортного продовольствия с юга
Африка. Все это привело к увеличению доступности сахара и сахара. продуктов и за короткий промежуток времени кариес изменился с редкого
болезнь, ограниченная несколькими взрослыми, болезнью, которая быстро разрушила
зубной ряд младенцев.
продуктов и за короткий промежуток времени кариес изменился с редкого
болезнь, ограниченная несколькими взрослыми, болезнью, которая быстро разрушила
зубной ряд младенцев.
В Великобритании и других странах Западной Европы произошло резкое падение по распространенности кариеса за последние 25 лет. Распространенность кариеса в в Соединенном Королевстве количество детей дошкольного возраста за этот период сократилось почти наполовину, с 80 процентов пострадали до 45 процентов. Это было одним из самых поощрение улучшения здоровья, достигнутого в этом столетии, и должно оцениваться как важное достижение общественного здравоохранения. Одной из вероятных причин этого изменения было введение фторсодержащих зубных паст. Однако есть еще большие географические различия в распространенности. Отмечается резкий рост заболеваемости. по мере того, как вы путешествуете с юга на север страны и выравниваетесь на севере Ирландия выше, чем где-либо еще в Великобритании.
Существуют также большие различия в распространенности среди различных социально-экономических
группы. В целом среди людей в
социальные классы I и II, чем в IV и V. Сочетание применения фторидов
зубная паста и разумное употребление сахара среди групп высокого риска могут снизить
уровень кариеса без необходимости драматических и, возможно, недостижимых
изменения в образе жизни.
В целом среди людей в
социальные классы I и II, чем в IV и V. Сочетание применения фторидов
зубная паста и разумное употребление сахара среди групп высокого риска могут снизить
уровень кариеса без необходимости драматических и, возможно, недостижимых
изменения в образе жизни.
Профессор Ангус Уоллс из Университета Ньюкасла рассказал о стоматологических
здоровья у пожилых людей. Доля населения Великобритании старше возраста
из 65 растет, и ожидается, что эта тенденция сохранится в течение следующих 20 лет.
Три национальных опроса, проведенных в 1968, 1978 и 1988 гг.
число людей без естественных зубов и сегодня 50 процентов
у людей старше 65 лет есть естественные зубы. Однако проблемы кариеса, износа зубов и
заболевания пародонта встречаются до сих пор. У пожилых людей часто опускаются десны
оставляя зубы открытыми и восприимчивыми к кариесу. Это особое
проблема институционализированных пожилых людей, среди которых до 79 процентов могут
подвержен влиянию. Среди мужчин также выше доля корневого кариеса,
домохозяев и тех, кто редко посещает стоматолога.
Количество зубов влияет на эффективность жевания. В то время как многие современные полуфабрикаты легко пережевываются, мы не можем переваривать то, что не едим. Трудности при пережевывании твердой пищи, такой как яблоки, салаты и хрустящая корочка хлеб из непросеянной муки может привести к недостаточному потреблению клетчатки, железа, витамина С и других микроэлементы. Эффективность жевания зависит от количества естественных зубов. сохраняется и уменьшается частичными или полными съемными протезами. Было обнаружено, что потребление некрахмальных полисахаридов было снижено до 10 грамм в группе институционализированные пожилые люди с зубными протезами.
Салли Крейг, Child Dental Health, Шеффилд рассказала о дефектах зубов и
эрозия. Дефекты зубов могут быть дородовыми или постнатальными, наследственными или приобретенными.
Дефекты формирования дентина обычно имеют генетическое происхождение. Дефекты эмали
может возникать при нарушении процесса минерализации или формирования матрикса
и потенциальная возможная причина — дефекты питания или излишества в постнатальном периоде. Кислые напитки и продукты могут вызвать эрозию. Это вызывает особую тревогу, когда
детям дают их в последнюю очередь на ночь после чистки зубов.
Подсчитано, что потребление безалкогольных напитков увеличилось на 700 процентов с тех пор, как
1950-е годы. Подростки с привычкой глотать напиток через рот
увеличивает риск эрозии, в то время как тонкая соломинка, которая принимает напиток непосредственно
к задней части рта, не касаясь зубов, может уменьшить эрозию.
Кислые напитки и продукты могут вызвать эрозию. Это вызывает особую тревогу, когда
детям дают их в последнюю очередь на ночь после чистки зубов.
Подсчитано, что потребление безалкогольных напитков увеличилось на 700 процентов с тех пор, как
1950-е годы. Подростки с привычкой глотать напиток через рот
увеличивает риск эрозии, в то время как тонкая соломинка, которая принимает напиток непосредственно
к задней части рта, не касаясь зубов, может уменьшить эрозию.
Эрозия – это форма потери тканей зуба, вызванная химическим процессом, который не
не включают бактерии, как кариес. В недавнем опросе от половины пяти до
у шестилетних детей были обнаружены признаки потери зубной ткани на одном или нескольких молочных зубах.
резцов, а среди детей 11 лет и старше на четверть и более встречались
иметь некоторые на небной поверхности верхних постоянных резцов. Повторяющийся
рвота, такая как при анорексии и булимии, является еще одной причиной
эрозия. Рекомендации пациентам должны быть сосредоточены на изменении пищевых привычек, оптимизации
режимы ухода за полостью рта, такие как использование фторсодержащей зубной пасты и получение
лечение любых сопутствующих заболеваний.
Профессор Мартин Даунер, Стоматологический институт Истмана, Лондон, выступил с докладом о рак полости рта. Это состояние встречается сравнительно редко, но имеет высокую степень заболеваемость и смертность. Его заболеваемость варьируется в разных частях мира. Например, это более распространено в Индии, где жевательный табак считается сопутствующей причиной и во Франции, где потребление спиртов грубой перегонки встречается чаще. Рак ротовой полости является восьмой по частоте причиной рака в западных странах. в Европе и примерно по 2000 новых случаев в Англии и Уэльсе каждый. год.
Комбинированные эффекты курения табака и употребления алкоголя, которые не
смягчается защитой, обеспечиваемой обильным диетическим потреблением свежих
фрукты и овощи, по-видимому, объясняют большинство случаев рака ротовой полости в
Западные страны. Дефицит железа вызывает повышенный риск, в то время как витамины А,
B, C, E и бета-каротин обладают защитным действием. Наблюдаемое увеличение, вероятно,
быть из-за повышенного потребления алкоголя в течение последних 40 лет.