Лечение флюса, абсцесса, флегмоны | Вита-Дент
Наша стоматология «Вита-Дент» в Гатчине готова оказать услугу по лечению флюса, абсцесса и флегмоны. Клиника находится в центре города, что чрезвычайно удобно для пациентов. На рынке стоматологических услуг мы работаем с 1995 года и за это время заслужили признательность жителей Гатчины и прилегающих к ней районов.
У населения до сих пор сохраняется предубеждение к обращению к стоматологу. Многие помнят боль, сопровождавшую лечение зубов из-за некачественных обезболивающих препаратов и несовершенства бормашин того времени. Сегодня ситуация изменилась кардинально, но память заставляет тянуть с обращением к стоматологу. А ведь если бы люди своевременно, дважды в год, проходили профилактическое обследование у зубного врача, они забыли бы о зубной боли.
Если все же у Вас появилась пульсирующая боль в районе какого-то зуба, если опухла щека и десна в районе больного зуба и поднялась температура тела до 38 — 38,5 градусов, не занимайтесь самолечением и немедленно обращайтесь в стоматологическую клинику. Такое состояние, в быту называемое флюсом, чрезвычайно опасно и может привести к заражению крови и даже к летальному исходу. Потеря больного зуба — самое легкое последствие промедления с посещением специалиста.
Такое состояние, в быту называемое флюсом, чрезвычайно опасно и может привести к заражению крови и даже к летальному исходу. Потеря больного зуба — самое легкое последствие промедления с посещением специалиста.
Профессионалы выделяют три стадии развития процесса: начальный этап формирования флюса, абсцесс и флегмону. Первопричиной заболевания является проникновение болезнетворных микроорганизмов к надкостнице у основания зуба. Поскольку надкостница в медицине называется периостом, воспаление надкостницы (флюс) стали называть одонтогенным периоститом. Путь микробам к надкостнице через защитные барьеры человеческого организма прокладывают кариес, заболевания десны и травматические трещины в зубе. Иногда микробы проникают к надкостнице по зубным каналам при их некачественном пломбировании.
Со временем простое воспаление надкостницы перетекает в абсцесс, когда в тканях ротовой полости начинает скапливаться гной. Если вовремя не обратиться к хирургу-стоматологу за вскрытием гнойного скопления и последующего длительного дренажа воспаленной зоны, гной может проникнуть под мышечную ткань лица.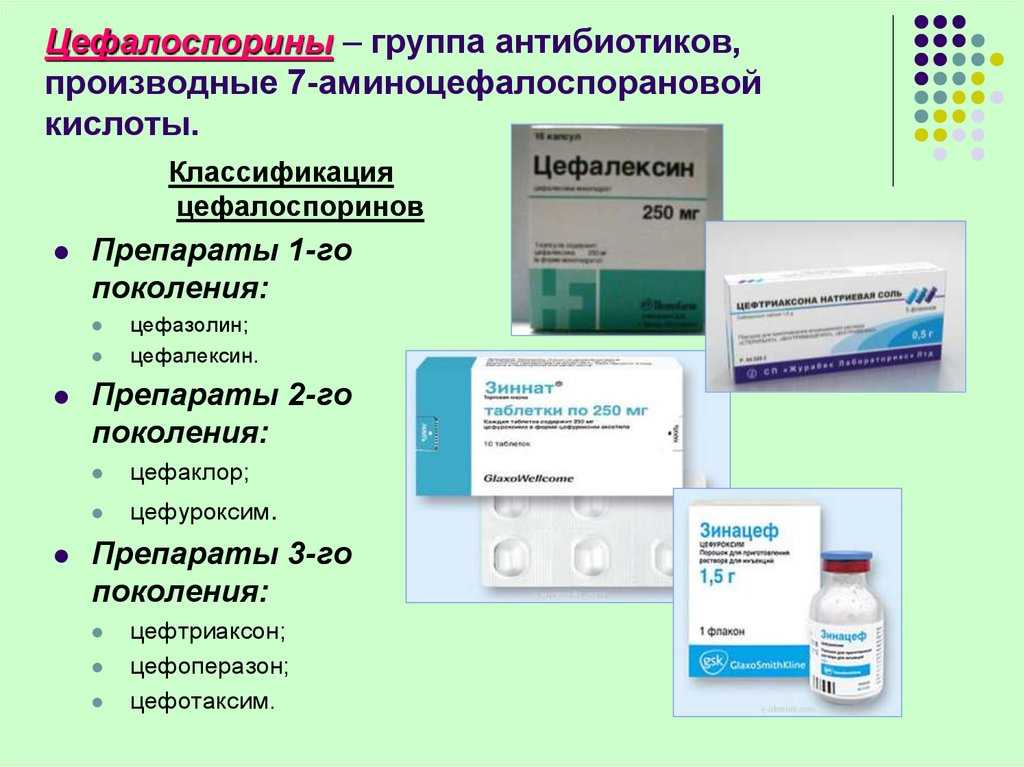 Это очень опасная ситуация, при которой ни в коем случае не допустимо греть воспаленную зону. Самостоятельное лечение проблемы антибиотиками без вскрытия нарыва и удаления гноя бессмысленно.
Это очень опасная ситуация, при которой ни в коем случае не допустимо греть воспаленную зону. Самостоятельное лечение проблемы антибиотиками без вскрытия нарыва и удаления гноя бессмысленно.
Лечение гнойного периостита начинается с осмотра пациента и сбора анамнеза, дополняемых рентгенодиагностикой и анализом крови. Собственно лечение гнойного воспаления состоит во вскрытии гнойника, удалении гноя и дренировании раны. Хирургическая операция происходит в условиях местной анестезии в амбулатории. На этапе восстановления широко используются специально подобранные антибиотики и противовоспалительные препараты, полоскания и физиотерапия.
Записаться в стоматологию в Гатчине можно по телефонам
Ингибиторы эффлюксной помпы для бактериальных патогенов: от скамьи до постели больного
1. Льюис К. Антибиотики: восстановить утраченное искусство открытия лекарств.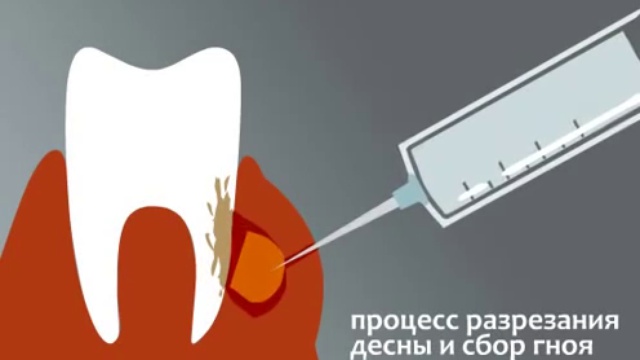 Природа. 2012; 485:439–40. [PubMed] [Google Scholar]
Природа. 2012; 485:439–40. [PubMed] [Google Scholar]
2. Ory EM, Yow EM. Применение и злоупотребление антибиотиками широкого спектра действия. ДЖАМА. 1963; 185: 273–9. [PubMed] [Google Scholar]
3. Флеминг-Дутра К.Е., Херш А.Л., Шапиро Д.Дж., Бартосес М., Эннс Э.А., Файл Т.М., мл. Распространенность ненадлежащих назначений антибиотиков среди амбулаторных посещений в США, 2010–2011 гг. ДЖАМА. 2016; 315:1864–73. [PubMed] [Академия Google]
4. Хак М., Сартелли М., МакКимм Дж., Абу Бакар М. Инфекции, связанные с оказанием медицинской помощи – обзор. Заразить устойчивостью к наркотикам. 2018;11:2321–33. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Ventola CL. Кризис устойчивости к антибиотикам: Часть 1: Причины и угрозы. П Т. 2015; 40: 277–83. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Falagas ME, Karageorgopoulos DE. Панрезистентность к лекарственным препаратам (PDR), широкая лекарственная устойчивость (XDR) и множественная лекарственная устойчивость (MDR) среди грамотрицательных бактерий: необходимость международной гармонизации терминологии. Клин Инфекция Дис. 2008;46:1121–2. [PubMed] [Академия Google]
Клин Инфекция Дис. 2008;46:1121–2. [PubMed] [Академия Google]
7. Хоффман С.Дж., Ауттерсон К. Введение. Что необходимо для устранения глобальной угрозы устойчивости к антибиотикам? J Law Med Ethics. 2015; 43 (Приложение 3): 6–11. [PubMed] [Google Scholar]
8. Blair JM, Webber MA, Baylay AJ, Ogbolu DO, Piddock LJ. Молекулярные механизмы устойчивости к антибиотикам. Nat Rev Microbiol. 2015;13:42–51. [PubMed] [Google Scholar]
9. Piddock LJ. Клинически значимые хромосомно-кодируемые оттоки множественной лекарственной устойчивости у бактерий. Clin Microbiol Rev. 2006;19: 382–402. [Бесплатная статья PMC] [PubMed] [Google Scholar]
10. Schindler BD, Kaatz GW. Мультилекарственные эффлюксные насосы грамположительных бактерий. Обновление устойчивости к наркотикам. 2016; 27:1–3. [PubMed] [Google Scholar]
11. Li XZ, Plésiat P, Nikaido H. Проблема опосредованной оттоком устойчивости к антибиотикам у грамотрицательных бактерий. Clin Microbiol Rev. 2015; 28:337–418. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Blair JM, Richmond GE, Piddock LJ. Насосы множественного оттока лекарств у грамотрицательных бактерий и их роль в устойчивости к антибиотикам. Будущая микробиология. 2014;9: 1165–77. [PubMed] [Google Scholar]
13. Webber MA, Piddock LJ. Важность эффлюксных насосов в устойчивости бактерий к антибиотикам. J Антимикробная химиотерапия. 2003; 51:9–11. [PubMed] [Google Scholar]
14. Sharma A, Sharma R, Bhattacharyya T, Bhando T, Pathania R. Устойчивость к фосфомицину у Acinetobacter baumannii опосредуется оттоком через переносчик главного облегчающего суперсемейства (MFS) — AbaF. J Антимикробная химиотерапия. 2017;72:68–74. [PubMed] [Академия Google]
15. Коста С.С., Нтоку Э., Мартинс А., Вивейрос М., Пурнарас С., Коуто И. и соавт. Идентификация кодируемого плазмидой гена эффлюксной помпы QacA в метициллин-резистентном штамме Staphylococcus aureus (MRSA) HPV107, представителе иберийского клона MRSA. Противомикробные агенты Int J. 2010; 36: 557–61. [PubMed] [Google Scholar]
Противомикробные агенты Int J. 2010; 36: 557–61. [PubMed] [Google Scholar]
16. Santagati M, Iannelli F, Cascone C, Campanile F, Oggioni MR, Stefani S, et al. Новый конъюгативный транспозон TN1207.3 несет ген оттока макролидов mef(A) в Пиогенный стрептококк . Устойчивость к микробам. 2003; 9: 243–7. [PubMed] [Google Scholar]
17. Piddock LJ. Эффлюксные помпы для множественной лекарственной устойчивости — не только для резистентности. Nat Rev Microbiol. 2006; 4: 629–36. [PubMed] [Google Scholar]
18. Бхардвадж А.К., Моханти П. Насосы бактериального оттока, участвующие в развитии множественной лекарственной устойчивости, и их ингибиторы: омоложение противомикробной химиотерапии. Недавний Пэт Antiinfect Drug Discov. 2012;7:73–89. [PubMed] [Google Scholar]
19. Ломовская О., Уоррен М.С., Ли А., Галаццо Дж., Фронко Р., Ли М. и соавт. Идентификация и характеристика ингибиторов эффлюксных насосов множественной лекарственной устойчивости у Pseudomonas aeruginosa : Новые препараты для комбинированной терапии. Противомикробные агенты Chemother. 2001;45:105–16. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Противомикробные агенты Chemother. 2001;45:105–16. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Bhattacharyya T, Sharma A, Akhter J, Pathania R. Низкая молекула IITR08027 восстанавливает антибактериальную активность фторхинолонов против полирезистентного
21. Anoushiravani M, Falsafi T, Niknam V. Зависимый от протонной движущей силы отток тетрациклина в клинических изолятах Хеликобактер пилори . J Med Microbiol. 2009; 58: 1309–13. [PubMed] [Google Scholar]
22. Fenosa A, Fusté E, Ruiz L, Veiga-Crespo P, Vinuesa T, Guallar V, et al. Роль tolC в устойчивости Klebsiella oxytoca к антибиотикам. J Антимикробная химиотерапия. 2009; 63: 668–74. [PubMed] [Google Scholar]
23. Осей Секьере Дж., Амоако Д.Г. Карбонилцианид м-хлорфенилгидразин (CCCP) меняет устойчивость к колистину, но не к карбапенемам и тигециклину при множественной лекарственной устойчивости Энтеробактерии .
24. Варгиу А.В., Никайдо Х. Свойства связывания нескольких лекарств откачивающего насоса AcrB, охарактеризованные молекулярно-динамическим моделированием. Proc Natl Acad Sci. 2012;109:20637–42. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Гупта С., Коэн К.А., Уингли К., Майга М., Диарра Б., Бишай В.Р. Ингибирование оттока верапамилом усиливает действие бедаквилина на Mycobacterium tuberculosis . Противомикробные агенты Chemother. 2014;58:574–576. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. Singh M, Jadaun GP, Ramdas, Srivastava K, Chauhan V, Mishra R, et al. Влияние ингибиторов эффлюксной помпы на лекарственную чувствительность устойчивых к офлоксацину изолятов Mycobacterium tuberculosis . Индийская J Med Res. 2011;133:535–40. [Бесплатная статья PMC] [PubMed] [Google Scholar]
27. Радченко М., Симерский Дж., Ни Р., Лу М. Структурная основа блокады помп MATE для оттока многих лекарств. Нац коммун. 2015;6:7995. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Нац коммун. 2015;6:7995. [Бесплатная статья PMC] [PubMed] [Google Scholar]
28. Bohnert JA, Kern WV. Отдельные арилпиперазины способны обратить вспять множественную лекарственную устойчивость у Escherichia coli , сверхэкспрессирующих насосы оттока RND. Противомикробные агенты Chemother. 2005; 49: 849–52. [PMC free article] [PubMed] [Google Scholar]
29. Vargiu AV, Ruggerone P, Opperman TJ, Nguyen ST, Nikaido H. Молекулярный механизм ингибирования MBX2319 мультилекарственного эффлюксного насоса Escherichia coli AcrB и сравнение с другими ингибиторами . Противомикробные агенты Chemother. 2014;58:6224–34. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Ставри М., Пиддок Л.Дж., Гиббонс С. Ингибиторы насоса оттока бактерий из природных источников. J Антимикробная химиотерапия. 2007; 59: 1247–60. [PubMed] [Google Scholar]
31. Гиббонс С., Олуватуи М., Каатц Г.В. Новый ингибитор мультилекарственных насосов оттока в Staphylococcus aureus . J Антимикробная химиотерапия. 2003; 51:13–7. [PubMed] [Google Scholar]
J Антимикробная химиотерапия. 2003; 51:13–7. [PubMed] [Google Scholar]
32. Pfeifer HJ, Greenblatt DK, Koch-Wester J. Клиническая токсичность резерпина у госпитализированных пациентов: отчет Бостонской совместной программы наблюдения за наркотиками. Am J Med Sci. 1976; 271: 269–76. [PubMed] [Google Scholar]
33. Kumar A, Khan IA, Koul S, Koul JL, Taneja SC, Ali I, et al. Новые структурные аналоги пиперина в качестве ингибиторов откачивающей помпы NorA Staphylococcus aureus . J Антимикробная химиотерапия. 2008;61:1270–6. [PubMed] [Google Scholar]
34. Шарма С., Кумар М., Шарма С., Нарготра А., Коул С., Хан И.А. Пиперин в качестве ингибитора Rv1258c, предполагаемого мультилекарственного эффлюксного насоса
35. Chan BC, Ip M, Lau CB, Lui SL, Jolivalt C, Ganem-Elbaz C, et al. Синергические эффекты байкалеина с ципрофлоксацином против сверхэкспрессированного метициллин-резистентного Staphylococcus aureus (MRSA) NorA и ингибирование пируваткиназы MRSA. J Этнофармакол. 2011; 137:767–73. [PubMed] [Google Scholar]
J Этнофармакол. 2011; 137:767–73. [PubMed] [Google Scholar]
36. Fujita M, Shiota S, Kuroda T, Hatano T, Yoshida T, Mizushima T, et al. Выдающийся синергизм между байкалеином и тетрациклином, а также байкалеином и бета-лактамами против резистентных к метициллину Золотистый стафилококк . Микробиол Иммунол. 2005; 49: 391–6. [PubMed] [Google Scholar]
37. Стермитц Ф.Р., Лоренц П., Тавара Дж.Н., Зеневич Л.А., Льюис К. Синергизм в лекарственном растении: антимикробное действие берберина, усиленное 5’-метоксигидрокарпином, мультилекарственным ингибитором помпы. Proc Natl Acad Sci. 2000;97:1433–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Морель С., Стермитц Ф.Р., Тегос Г., Льюис К. Изофлавоны как усилители антибактериальной активности. J Agric Food Chem. 2003; 51: 5677–9.. [PubMed] [Google Scholar]
39. Гиббонс С., Мозер Э., Каатц Г.В. Галлаты катехина ингибируют множественную лекарственную устойчивость (МЛУ) у Staphylococcus aureus . Планта Мед. 2004; 70:1240–2. [PubMed] [Google Scholar]
Планта Мед. 2004; 70:1240–2. [PubMed] [Google Scholar]
40. Судано Роккаро А., Бланко А.Р., Джулиано Ф., Русиано Д., Энеа В. Галлат эпигаллокатехина усиливает активность тетрациклина в стафилококках, подавляя его отток из бактериальных клеток. Противомикробные агенты Chemother. 2004; 48:1968–73. [Бесплатная статья PMC] [PubMed] [Google Scholar]
41. Oluwatuyi M, Kaatz GW, Gibbons S. Антибактериальная и модифицирующая резистентность активность Rosmarinus officinalis . Фитохимия. 2004;65:3249–54. [PubMed] [Google Scholar]
42. Lorenzi V, Muselli A, Bernardini AF, Berti L, Pagès JM, Amaral L, et al. Гераниол восстанавливает антибиотическую активность против полирезистентных изолятов грамотрицательных видов. Противомикробные агенты Chemother. 2009;53:2209–11. [Бесплатная статья PMC] [PubMed] [Google Scholar]
43. Opperman TJ, Nguyen ST. Недавние успехи в изучении молекулярного механизма ингибирования откачивающей помпы. Фронт микробиол. 2015;6:421. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Шевалье Дж., Атифи С., Эйро А., Махамуд А., Барб Дж., Паже Дж.М. Новые производные пиридохинолина как потенциальные ингибиторы эффлюксной помпы фторхинолонов у резистентных штаммов Enterobacter aerogenes . J Med Chem. 2001;44:4023–6. [PubMed] [Google Scholar]
45. Pradel E, Pages JM. Эффлюксная помпа AcrAB-tolC способствует множественной лекарственной устойчивости внутрибольничного патогена Enterobacter aerogenes . Противомикробные агенты Chemother. 2002;46:2640–3. [Бесплатная статья PMC] [PubMed] [Google Scholar]
46. Sabatini S, Gosetto F, Manfroni G, Tabarrini O, Kaatz GW, Patel D, et al. Эволюция ядра природных флавонов с получением производных 2-(4-пропоксифенил)хинолина в качестве сильнодействующих ингибиторов эффлюксной помпы S. aureus NorA. J Med Chem. 2011;54:5722–36. [PubMed] [Google Scholar]
47. Thorarensen A, Presley-Bodnar AL, Marotti KR, Boyle TP, Heckaman CL, Bohanon MJ, et al. 3-арилпиперидины как потенциаторы существующих антибактериальных средств. Bioorg Med Chem Lett. 2001;11:1903–6. [PubMed] [Google Scholar]
3-арилпиперидины как потенциаторы существующих антибактериальных средств. Bioorg Med Chem Lett. 2001;11:1903–6. [PubMed] [Google Scholar]
48. Kaatz GW, Moudgal VV, Seo SM, Hansen JB, Kristiansen JE. Ингибиторы обратного захвата серотонина, селективные к фенилпиперидину, препятствуют активности помпы множественного оттока лекарств у Staphylococcus aureus . Противомикробные агенты Int J. 2003; 22: 254–61. [PubMed] [Google Scholar]
49. Махмуд Х.И., Джамшиди С., Саттон Дж.М., Рахман К.М. Текущие достижения в разработке ингибиторов бактериальных насосов оттока многих лекарств. Курр Мед Хим. 2016; 23:1062–81. [Бесплатная статья PMC] [PubMed] [Google Scholar]
50. Zechini B, Versace I. Ингибиторы полирезистентных систем оттока у бактерий. Недавний Пэт Antiinfect Drug Discov. 2009; 4:37–50. [PubMed] [Google Scholar]
51. Piddock LJ, Garvey MI, Rahman MM, Gibbons S. Природные и синтетические соединения, такие как триметоприм, действуют как ингибиторы оттока грамотрицательных бактерий. J Антимикробная химиотерапия. 2010;65:1215–23. [PubMed] [Google Scholar]
J Антимикробная химиотерапия. 2010;65:1215–23. [PubMed] [Google Scholar]
52. Нейфах А.А., Бидненко В.Е., Чен Л.Б. Множественная лекарственная устойчивость, опосредованная оттоком, у Bacillus subtilis: сходства и различия с системой млекопитающих. Proc Natl Acad Sci U S A. 1991; 88:4781–5. [Бесплатная статья PMC] [PubMed] [Google Scholar]
53. Song L, Wu X. Разработка ингибиторов эффлюксной помпы в противотуберкулезной терапии. Противомикробные агенты Int J. 2016;47:421–9. [PubMed] [Google Scholar]
54. Fiamegos YC, Kastritis PL, Exarchou V, Han H, Bonvin AM, Vervoort J, et al. Антимикробная и ингибирующая помпа оттока активность кофеилхининовых кислот из Artemisia absinthium против грамположительных патогенных бактерий. ПЛОС Один. 2011;6:e18127. [Бесплатная статья PMC] [PubMed] [Google Scholar]
55. Joshi P, Singh S, Wani A, Sharma S, Jain SK, Singh B, et al. Остол и куркумин как ингибиторы человеческого Pgp и помпы оттока нескольких лекарств Staphylococcus aureus : изменение устойчивости к передовым антибактериальным препаратам. Мед. хим. коммун. 2014;5:1540–7. [Google Scholar]
Мед. хим. коммун. 2014;5:1540–7. [Google Scholar]
56. Holler JG, Christensen SB, Slotved HC, Rasmussen HB, Gúzman A, Olsen CE, et al. Новая ингибирующая активность Staphylococcus aureus NorA Эффлюксная помпа с помощью кемпферола рамнозида, выделенного из Persea lingue nees. J Антимикробная химиотерапия. 2012;67:1138–44. [PubMed] [Google Scholar]
57. Michalet S, Cartier G, David B, Mariotte AM, Dijoux-franca MG, Kaatz GW, et al. Производные N-кофеоилфеналкиламида как ингибиторы бактериального эффлюксного насоса. Bioorg Med Chem Lett. 2007; 17:1755–8. [PubMed] [Google Scholar]
58. Li B, Yao Q, Pan XC, Wang N, Zhang R, Li J и др. Артесунат усиливает антибактериальный эффект {бета|-лактамных антибиотиков в отношении Escherichia coli за счет увеличения накопления антибиотика за счет ингибирования насосной системы множественного оттока лекарств AcrAB-TolC. J Антимикробная химиотерапия. 2011;66:769–77. [PubMed] [Google Scholar]
59. Чериго Л., Переда-Миранда Р., Фрагозо-Серрано М., Якобо-Эррера Н., Каатц Г.В., Гиббонс С. Ингибиторы бактериальных множественных лекарственных насосов оттока из гликозидов смолы Ipomoea murucoides . J Nat Prod. 2008;71:1037–45. [PubMed] [Google Scholar]
Чериго Л., Переда-Миранда Р., Фрагозо-Серрано М., Якобо-Эррера Н., Каатц Г.В., Гиббонс С. Ингибиторы бактериальных множественных лекарственных насосов оттока из гликозидов смолы Ipomoea murucoides . J Nat Prod. 2008;71:1037–45. [PubMed] [Google Scholar]
60. Рана Т., Сингх С., Каур Н., Патания К., Фарук У. Обзор ингибиторов оттока важных с медицинской точки зрения бактерий из растительных источников. Int J Pharm Sci Rev Res. 2014;26:101–11. [Академия Google]
61. Рой С.К., Кумари Н., Пахва С., Аграхари У.К., Бутани К.К., Ячак С.М. и др. Ингибирующая активность кумаринов Mesua ferrea в отношении насосов оттока NorA. Фитотерапия. 2013;90:140–50. [PubMed] [Google Scholar]
62. Stermitz FR, Scriven LN, Tegos G, Lewis K. Два флавонола из Artemisa annua , которые усиливают активность берберина и норфлоксацина против резистентного штамма Staphylococcus aureus . Планта Мед. 2002;68:1140–1. [PubMed] [Академия Google]
63. Chan BC, Ip M, Gong H, Lui SL, See RH, Jolivalt C, et al. Синергические эффекты диосметина с эритромицином против переносчика ABC со сверхэкспрессией метициллин-резистентного Staphylococcus aureus (MRSA) RN4220/pUL5054 и ингибирование пируваткиназы MRSA. Фитомедицина. 2013;20:611–4. [PubMed] [Google Scholar]
Синергические эффекты диосметина с эритромицином против переносчика ABC со сверхэкспрессией метициллин-резистентного Staphylococcus aureus (MRSA) RN4220/pUL5054 и ингибирование пируваткиназы MRSA. Фитомедицина. 2013;20:611–4. [PubMed] [Google Scholar]
64. Рой С.К., Пахва С., Нанданвар Х., Ячак С.М. Фенилпропаноиды Alpinia galangal в качестве ингибиторов эффлюксного насоса у Mycobacterium smegmatis mc2 155. Фитотерапия. 2012;83:1248–55. [PubMed] [Google Scholar]
65. Shiu WK, Malkinson JP, Rahman MM, Curry J, Stapleton P, Gunaratnam M, et al. Новый антибактериальный препарат растительного происхождения является ингибитором эффлюксных насосов в Staphylococcus aureus . Противомикробные агенты Int J. 2013;42:513–518. [PubMed] [Google Scholar]
66. Chovanová R, Mezovská J, Vaverková Š, Mikulášová M. Ингибирование помпы оттока Tet(K) устойчивого к тетрациклину Staphylococcus epidermidis эфирными маслами трех видов Salvia . Lett Appl Microbiol. 2015;61:58–62. [PubMed] [Google Scholar]
Lett Appl Microbiol. 2015;61:58–62. [PubMed] [Google Scholar]
67. Bruhn DF, Scherman MS, Liu J, Scherbakov D, Meibohm B, Böttger EC, et al. In vitro и in vivo оценка синергизма между противотуберкулезными спектинамидами и неклассическими противотуберкулезными антибиотиками. Научный доклад 2015; 5:13985. [Бесплатная статья PMC] [PubMed] [Google Scholar]
68. Smith EC, Williamson EM, Wareham N, Kaatz GW, Gibbons S. Антибактериальные препараты и модуляторы бактериальной резистентности из незрелых шишек Chamaecyparis lawsoniana . Фитохимия. 2007;68:210–7. [PubMed] [Google Scholar]
69. Smith EC, Kaatz GW, Seo SM, Wareham N, Williamson EM, Gibbons S. Фенольный дитерпен тотарол ингибирует активность помпы оттока нескольких лекарств в Staphylococcus aureus . Противомикробные агенты Chemother. 2007;51:4480–3. [Бесплатная статья PMC] [PubMed] [Google Scholar]
70. Singh S, Kalia NP, Joshi P, Kumar A, Sharma PR, Kumar A, et al. Boeravinone B, новый двойной ингибитор бактериального эффлюксного насоса NorA Staphylococcus aureus и P-гликопротеин человека уменьшают образование биопленок и внутриклеточную инвазию бактерий. Фронт микробиол. 2017; 8:1868. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Boeravinone B, новый двойной ингибитор бактериального эффлюксного насоса NorA Staphylococcus aureus и P-гликопротеин человека уменьшают образование биопленок и внутриклеточную инвазию бактерий. Фронт микробиол. 2017; 8:1868. [Бесплатная статья PMC] [PubMed] [Google Scholar]
71. Limaverde PW, Campina FF, da Cunha FAB, Crispim FD, Figueredo FG, Lima LF, et al. Ингибирование откачивающей помпы TetK эфирным маслом Chenopodium ambrosioides L. и α-терпиненом против Staphylococcus aureus IS-58. Пищевая химическая токсикол. 2017;109:957–61. [PubMed] [Google Scholar]
72. Kakarla P, Floyd J, Mukherjee M, Devireddy AR, Inupakutika MA, Ranweera I, et al. Ингибирование мультилекарственного оттока насоса LmrS от Staphylococcus aureus специей тмина Cuminum cyminum . Арка микробиол. 2017; 199: 465–74. [PubMed] [Google Scholar]
73. Fazly Bazzaz BS, Iranshahi M, Naderinasab M, Hajian S, Sabeti Z, Masumi E. Оценка эффектов гальбановой кислоты из Ferula szowitsiana и конферола из F. badrakema , в качестве модуляторов множественной лекарственной устойчивости в клинических изолятах Escherichia coli и Staphylococcus aureus . Рез Фарм Наук. 2010;5:21–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
badrakema , в качестве модуляторов множественной лекарственной устойчивости в клинических изолятах Escherichia coli и Staphylococcus aureus . Рез Фарм Наук. 2010;5:21–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
74. Tintino SR, Morais-Tintino CD, Campina FF, Costa MDS, Menezes IRA, de Matos YMLS и др. Дубильная кислота влияет на фенотип Staphylococcus aureus , устойчивых к тетрациклину и эритромицину, путем ингибирования эффлюксных насосов. Биоорг хим. 2017;74:197–200. [PubMed] [Google Scholar]
75. Siriyong T, Srimanote P, Chusri S, Yingyongnarongkul BE, Suaisom C, Tipmanee V, et al. Конессин как новый ингибитор насосных систем множественного оттока лекарств в Pseudomonas aeruginosa . BMC Комплемент Altern Med. 2017;17:405. [Бесплатная статья PMC] [PubMed] [Google Scholar]
76. Siriyong T, Chusri S, Srimanote P, Tipmanee V, Voravuthikunchai SP. Экстракт Holarrhena antidysenterica и его стероидный алкалоид конессин в качестве модифицирующих резистентность агентов против широкой лекарственной устойчивости Acinetobacter baumannii . Устойчивость к микробам. 2016;22:273–82. [PubMed] [Google Scholar]
Устойчивость к микробам. 2016;22:273–82. [PubMed] [Google Scholar]
77. Chan BC, Han XQ, Lui SL, Wong CW, Wang TB, Cheung DW, et al. Борьба с устойчивым к метициллину Staphylococcus aureus – Две жирные кислоты из портулака ( Portulaca oleracea L.) проявляют синергетическое действие с эритромицином. Дж Фарм Фармакол. 2015;67:107–16. [PubMed] [Google Scholar]
78. Falcão-Silva VS, Silva DA, Souza Mde F, Siqueira-Junior JP. Модуляция лекарственной устойчивости в Staphylococcus aureus гликозидом кемпферола из Herissantia tiubae ( Malvaceae ) Phytother Res. 2009; 23:1367–70. [PubMed] [Google Scholar]
79. Kalia NP, Mahajan P, Mehra R, Nargotra A, Sharma JP, Koul S, et al. Капсаицин, новый ингибитор насоса оттока NorA, снижает внутриклеточную инвазию Staphylococcus aureus . J Антимикробная химиотерапия. 2012;67:2401–8. [PubMed] [Google Scholar]
80. Гупта В.К., Тивари Н., Гупта П., Верма С., Пал А. , Шривастава С.К. и соавт. Клеродан дитерпен из Polyalthia longifolia в качестве модификатора резистентности метициллинрезистентного Staphylococcus aureus . Фитомедицина. 2016;23:654–61. [PubMed] [Google Scholar]
, Шривастава С.К. и соавт. Клеродан дитерпен из Polyalthia longifolia в качестве модификатора резистентности метициллинрезистентного Staphylococcus aureus . Фитомедицина. 2016;23:654–61. [PubMed] [Google Scholar]
81. Martins A, Vasas A, Viveiros M, Molnár J, Hohmann J, Amaral L, et al. Антибактериальные свойства соединений, выделенных из Carpobrotus edulis . Противомикробные агенты Int J. 2011; 37: 438–44. [PubMed] [Google Scholar]
82. Бхарате Дж. Б., Сингх С., Вани А., Шарма С., Джоши П., Хан И. А. и др. Открытие 4-ацетил-3-(4-фторфенил)-1-(п-толил)-5-метилпиррола в качестве двойного ингибитора человеческого Р-гликопротеина и Staphylococcus aureus nor A Эффлюксная помпа. Орг Биомол Хим. 2015;13:5424–31. [PubMed] [Google Scholar]
83. Schindler BD, Jacinto P, Kaatz GW. Ингибирование помпы оттока лекарственного средства в Staphylococcus aureus : Текущее состояние потенцирования существующих антибиотиков. Будущая микробиология. 2013; 8: 491–507. [PubMed] [Google Scholar]
2013; 8: 491–507. [PubMed] [Google Scholar]
84. Holler JG, Slotved HC, Mølgaard P, Olsen CE, Christensen SB. Халконовые ингибиторы эффлюксной помпы NorA у Staphylococcus aureus целые клетки и обогащенные вывернутыми мембранными везикулами. Биоорг Мед Хим. 2012;20:4514–21. [PubMed] [Google Scholar]
85. Haynes KM, Abdali N, Jhawar V, Zgurskaya HI, Parks JM, Green AT, et al. Идентификация и взаимосвязь между структурой и активностью новых соединений, которые усиливают действие антибиотиков в Escherichia coli . J Med Chem. 2017;60:6205–19. [Бесплатная статья PMC] [PubMed] [Google Scholar]
86. Cortez-Cordova J, Kumar A. Активность ингибитора оттока насоса фенилаланин-аргинин β-нафтиламида против насоса AdeFGH Acinetobacter baumannii . Противомикробные агенты Int J. 2011;37:420–4. [PubMed] [Google Scholar]
87. Bohnert JA, Schuster S, Kern WV, Karcz T, Olejarz A, Kaczor A, et al. Новые пиперазинарилиденимидазолоны ингибируют насос AcrAB-tolC в Escherichia coli и одновременно действуют как флуоресцентные мембранные зонды в комбинированном анализе притока и оттока в реальном времени. Противомикробные агенты Chemother. 2016; 60: 1974–83. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Противомикробные агенты Chemother. 2016; 60: 1974–83. [Бесплатная статья PMC] [PubMed] [Google Scholar]
88. Machado D, Fernandes L, Costa SS, Cannalire R, Manfroni G, Tabarrini O, et al. Механизм действия ингибитора оттока 2-фенилхинолина PQQ4R против Кишечная палочка . Пир Дж. 2017; 5:e3168. [Бесплатная статья PMC] [PubMed] [Google Scholar]
89. Handzlik J, Szymanska E, Alibert S, Chevalier J, Otrębska E, Pękala E, et al. Поиск новых средств борьбы с грамотрицательными резистентными бактериями среди аминопроизводных 5-арилиденгидантоина. Биоорг Мед Хим. 2013;21:135–45. [PubMed] [Google Scholar]
90. Нельсон М.Л., Леви С.Б. Реверсирование устойчивости к тетрациклину, опосредованное различными бактериальными детерминантами устойчивости к тетрациклину, с помощью ингибитора антипорт-белка Tet(B). Противомикробные агенты Chemother. 1999;43:1719–24. [Бесплатная статья PMC] [PubMed] [Google Scholar]
91. Tintino SR, Morais-Tintino CD, Campina FF, Pereira RL, Costa Mdo S, Braga MF, et al. Действие холекальциферола и альфа-токоферола на эффлюксные помпы Staphylococcus aureus . EXCLI J. 2016; 15:315–22. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Действие холекальциферола и альфа-токоферола на эффлюксные помпы Staphylococcus aureus . EXCLI J. 2016; 15:315–22. [Бесплатная статья PMC] [PubMed] [Google Scholar]
92. Simons SO, Kristiansen JE, Hajos G, van der Laan T, Molnár J, Boeree MJ, et al. Активность ингибитора оттока SILA 421 против лекарственно-устойчивого туберкулеза. Противомикробные агенты Int J. 2013; 41: 488–9.. [PubMed] [Google Scholar]
93. Sabatini S, Kaatz GW, Rossolini GM, Brandini D, Fravolini A. От фенотиазина до производных 3-фенил-1,4-бензотиазина в качестве ингибиторов оттока нескольких лекарств Staphylococcus aureus NorA насос. J Med Chem. 2008;51:4321–30. [PubMed] [Google Scholar]
94. Song Y, Qin R, Pan X, Ouyang Q, Liu T, Zhai Z и др. Разработка новых антибактериальных усилителей на основе структуры AcrB и оценка их антибактериальной усиливающей активности. Int J Mol Sci. 2016; 17 пий: E1934. [Бесплатная статья PMC] [PubMed] [Google Scholar]
95. Costa LM, de Macedo EV, Oliveira FA, Ferreira JH, Gutierrez SJ, Peláez WJ, et al. Ингибирование откачивающей помпы NorA Staphylococcus aureus синтетическими рипаринами. J Appl Microbiol. 2016; 121:1312–22. [PubMed] [Google Scholar]
Ингибирование откачивающей помпы NorA Staphylococcus aureus синтетическими рипаринами. J Appl Microbiol. 2016; 121:1312–22. [PubMed] [Google Scholar]
96. Coêlho ML, Ferreira JH, de Siqueira Júnior JP, Kaatz GW, Barreto HM, de Carvalho Melo Cavalcante AA, et al. Ингибирование транспортера нескольких лекарств NorA оксигенированными монотерпенами. Микроб Патог. 2016;99: 173–7. [PubMed] [Google Scholar]
97. Вани Н.А., Сингх С., Фарук С., Шанкар С., Кул С., Хан И.А. и соавт. Аминокислоты амидов пиперовой кислоты (PA) и 4-этилпипериновой кислоты (EPA) в качестве ингибиторов откачивающей помпы NorA Staphylococcus aureus . Bioorg Med Chem Lett. 2016;26:4174–8. [PubMed] [Google Scholar]
98. Fontaine F, Héquet A, Voisin-Chiret AS, Bouillon A, Lesnard A, Cresteil T, et al. Бороновые соединения как перспективные ингибиторы эффлюксного насоса Staphylococcus aureus NorA: исследование производных 6-замещенных пиридин-3-бороновой кислоты. Eur J Med Chem. 2015;95:185–98. [PubMed] [Google Scholar]
2015;95:185–98. [PubMed] [Google Scholar]
99. Zhang J, Sun Y, Wang Y, Lu M, He J, Liu J и др. Неантибиотический агент гинзенозид 20(S)-rh3 усиливал антибактериальные эффекты ципрофлоксацина in vitro и in vivo как потенциального ингибитора NorA. Евр Дж Фармакол. 2014; 740: 277–84. [PubMed] [Google Scholar]
100. Бонерт Дж. А., Шустер С., Керн В. В. Пимозид ингибирует насос оттока AcrAB-tolC в Escherichia coli . Open Microbiol J. 2013;7:83–6. [Бесплатная статья PMC] [PubMed] [Google Scholar]
101. Lee MD, Galazzo JL, Staley AL, Lee JC, Warren MS, Fuernkranz H, et al. Ингибиторы резистентности к лекарствам, опосредованной насосом оттока, полученные в результате микробной ферментации. Фармако. 2001; 56:81–5. [PubMed] [Google Scholar]
102. Ломовская О., Бостиан К.А. Практическое применение и осуществимость ингибиторов оттока в клинике – видение прикладного использования. Биохим Фармакол. 2006;71:910–8. [PubMed] [Google Scholar]
103. Gandhi S, Fleet JL, Bailey DG, McArthur E, Wald R, Rehman F, et al. Лекарственное взаимодействие блокаторов кальциевых каналов и кларитромицина и острая почечная недостаточность. ДЖАМА. 2013; 310:2544–53. [PubMed] [Академия Google]
Gandhi S, Fleet JL, Bailey DG, McArthur E, Wald R, Rehman F, et al. Лекарственное взаимодействие блокаторов кальциевых каналов и кларитромицина и острая почечная недостаточность. ДЖАМА. 2013; 310:2544–53. [PubMed] [Академия Google]
104. Nakajima A, Sugimoto Y, Yoneyama H, Nakae T. Высокий уровень устойчивости к фторхинолонам у Pseudomonas aeruginosa из-за взаимодействия эффлюксного насоса MexAB-oprM и мутации ДНК-гиразы. Микробиол Иммунол. 2002;46:391–5. [PubMed] [Google Scholar]
Ужасы эндемического кровавого флюса: дизентерия в 1800-х | by Glenn Fay, Jr.
В 15, 16 и 17 веках пресноводные моряки использовали нос корабля (туалет) или сбрасывали ночные горшки с человеческими экскрементами с носа корабля и одновременно вытаскивали питьевую воду и воду для купания. корма. Как мы знаем сегодня, это, так сказать, рецепт желудочно-кишечной катастрофы. В те дни юмор на горшке не был взрывоопасным, особенно если диарея усиливалась и приводила к медленной смерти, что было слишком часто.
Дизентерия, также известная как «лагерная лихорадка» или «кровавый флюс», была эндемичной на протяжении всего колониального периода. Симптомы заболевания включают кровавый или слизистый понос, желудочные спазмы, боль, тошноту, рвоту и лихорадку . Мало того, что дизентерия является бактериальной инфекцией, токсины также могут выделяться другим типом бактерий шигеллы, которые повреждают кровеносные сосуды в кишечнике, почках и легких. Это может вызвать кровотечение, кровавый понос, почечную недостаточность или даже отек легких.
Поскольку кровавый понос был настолько распространенным явлением, человек понятия не имели о его причинах, и он бушевал вплоть до Гражданской войны . Нет, мы знаем, что это вызвано бактериями Shigella и быстро распространяется в антисанитарных условиях, когда пища и вода загрязнены человеческими отходами. Переполненные корабли и солдатские лагеря, плохая личная гигиена и отсутствие мытья рук создали идеальные условия для размножения шигелл. Это сделало дизентерию рецидивирующей, изнурительной и часто смертельной болезнью.
Это сделало дизентерию рецидивирующей, изнурительной и часто смертельной болезнью.
Лечение было несовершенным. Не было антибиотиков или стерильных внутривенных жидкостей, как сегодня. Лечение дизентерии следовало стандартному лечению лихорадки кровопусканием, образованием волдырей, приемом внутрь солей свинца и рвотных средств (чтобы вызвать рвоту) при необходимости. Но это был не полный список вариантов, как мы увидим в следующем душераздирающем отрывке.
Вот рассказ пациента, записанный доктором Хантом в сентябре 1814 года, через несколько месяцев после начала болезни. Пациент, майор Биби, сообщил о своем лечении дизентерии во время пребывания в больнице общего профиля в Берлингтоне, штат Вермонт.
«Примерно в середине ноября прошлого года у нас с полковником Джонсоном случился понос, и мы обратились в Мэлоун к хирургу (тогда служившему в армии), который дал нам коробку вяжущих пилюль размером с крупную горошину (впоследствии оказалось, что это ацетит свинца) с указаниями принимать их часто, пока наша болезнь не будет остановлена. В среднем мы брали от пяти до сис в день. Они принесли много облегчения, и к концу месяца мы вернулись на службу на Френч-Миллс, по-видимому, излечившись. Мы были так довольны этими пилюлями, что каждый из нас взял с собой большую коробку при отъезде и часто после этого прибегал к ним, когда наша болезнь проявляла склонность к возвращению».
В среднем мы брали от пяти до сис в день. Они принесли много облегчения, и к концу месяца мы вернулись на службу на Френч-Миллс, по-видимому, излечившись. Мы были так довольны этими пилюлями, что каждый из нас взял с собой большую коробку при отъезде и часто после этого прибегал к ним, когда наша болезнь проявляла склонность к возвращению».
5 декабря на полковника Джонсона напали сильные боли в желудке и кишечнике, сопровождавшиеся частыми рвотными позывами и сильными тенезмами. Медицинская помощь была немедленно обеспечена, и самые быстрые и действенные средства были применены без облегчения. Симптомы усиливались с каждым днем, и он пролежал семь дней, мучимый мучительной болью, и сохранял сознание, пока не умер». (Манн)
Майор Биби продолжает описывать возникшую у него непрекращающуюся невыносимую боль в желудке, кишечнике, суставах и сфинктере. Ему вводили волдыри, кровопускание, ртутные каломельные таблетки, порошок Доверса (ипекакуана и опиум), вино, кора и большое количество опиума, эфира и лауданума (смесь опиума), но безрезультатно. У него пропал аппетит, и на ногах появились язвы.
У него пропал аппетит, и на ногах появились язвы.
Доктор Хант писал, что майор Биби месяцами страдал и терял чувствительность из-за волн мучительной боли не только в грудной клетке и животе, но и во всех руках, ногах и во всем теле. Наконец, через год после его первоначального показания доктору Ханту, майор Биби скончался.
К сожалению, с лечением или без него, дизентерия часто оставляла выживших достаточно ослабленными, чтобы быть восприимчивыми к другим заболеваниям. Симптомы майора Биби могли быть отчасти связаны с употреблением свинца, поскольку теперь мы знаем, что свинец является опасным тяжелым металлом.
В конце концов, многие врачи пришли к выводу, что некоторые лекарства несовершенны, и пациенты просто должны позволить болезни идти своим чередом. Многие умерли от сильного обезвоживания до того, как инфекция была вылечена из их систем. Те, кто выжил, остались слабыми и восприимчивыми к инфекции в будущем.
Некоторые люди страдали в течение длительного времени перед смертью, в то время как другие страдали в течение короткого промежутка времени; не было графика заражения и выздоровления при дизентерии, как при оспе.
