Артикаин ДФ инструкция по применению: показания, противопоказания, побочное действие – описание Articaine DF Раствор для инъекций (31818)
При неосложненном удалении зубов верхней челюсти в невоспалительной стадии вводят в подслизистую в области переходной складки с вестибулярной стороны 1.8 мл Артикаина ДФ (на каждый зуб). В редких случаях требуется дополнительное введение от 1 мл до 1.8 мл для достижения полной анестезии.
Для анестезии при небных разрезах и наложении швов с целью создания небного депо необходимо около 0.1 мл анестетика на инъекцию. От болезненной небной инъекции в большинстве случаев можно отказаться. При удалении нескольких рядом расположенных зубов количество инъекций обычно удается ограничить.
При удалении премоляров нижней челюсти при отсутствии воспаления можно обойтись без мандибулярной анестезии, так как инфильтрационная анестезия, обеспечиваемая инъекцией 1.8 мл на зуб, как правило, достаточна.
Если же таким путем не удалось достичь желаемого эффекта, следует выполнить дополнительную инъекцию 1-1.
При хирургических вмешательствах Артикаин ДФ в зависимости от тяжести и длительности вмешательства дозируется индивидуально. Нижеприведенная таблица демонстрирует рекомендуемые объемы и дозы препарата для нескольких типов анестезии. Предложенные дозы предназначены для здоровых пациентов.
| Типа анестезии | Объем препарата | Количество картриджей с препаратом | Доза артикаина гидрохлорида |
| Инфильтрационная анестезия | 0.5-2.5 мл | 0.3-1.4 | 20-100 мг |
| Блокада нерва | 0.5-3.4 мл | 0. 3-1.9 3-1.9 | 20-136 мг |
| При хирургических вмешательствах | 1-5.1 мл | 0.5-2.8 | 40-204 мг |
Меры предосторожности при применении
Противопоказано в/в применение!
Во избежание внутрисосудистой инъекции необходимо проводить тест на аспирацию.
Инъекционное давление должно соответствовать чувствительности ткани.
Нельзя производить инъекцию в воспаленную область!
Прием пищи возможен только после восстановления чувствительности.
Открытые картриджи нельзя использовать снова для других пациентов. Нельзя использовать поврежденный картридж.
Септанест с адреналином — Стоматологическое и медицинское оборудование
Состав
100 мл раствора содержат
активные вещества: артикаина гидрохлорида 4 г, адреналина тартрата 1,820мг (эквивалентно адреналину 1 мг) и 0,910мг (эквивалентно адреналину 0,5 мг) для концентраций 1:100000 и 1:200000соответственно,
вспомогательные вещества: натрия хлорид, натрия метабисульфит, натрия эдетат, раствор натрия гидроксида, вода для инъекций.
Описание
Прозрачный, бесцветный раствор
Фармакотерапевтическая группа
Анестетики местные. Амиды.
Артикаин в комбинации с другими препаратами
Код АТС N01BB58
Фармакологические свойства
Фармакокинетика
Септанест с адреналином 1/100 000, 1/200 000 при подслизистом введении в полости рта обладает высокой диффузной способностью. Связывается с белками плазмы на 95%. Биотрансформируетсяв печени. Период полувыведения – около 25 мин. Выводится в основном почками(около 60%).
Артикаин быстро гидролизуется холинэстеразами плазмы крови впервичный метаболит – артикаиновую каслоту, которая далее метаболизируется вглюкуронид артикаиновой кислоты. Артикаин проникает через плацентарный барьер ввесьма незначительном количестве; практически не определяется в грудном молоке.Артикаин и его метаболиты выводятся из организма с мочой.
Артикаин проникает через плацентарный барьер ввесьма незначительном количестве; практически не определяется в грудном молоке.Артикаин и его метаболиты выводятся из организма с мочой.
Адреналин при парентеральном введении быстро разрушаетсямоноаминоксидазой и катехол-О-метилтрансферазой клеток. Период полувыведения –1-2 мин. Экскреция метаболитов осуществляется почками.
Фармакодинамика
Септанест с адреналином 1/100 000, 1/200 000 – комбинированный препарат, содержащий артикаин и адреналин, предназначен для местной анестезии в стоматологии.
Артикаин — местный анестетик амидной группы ряда тиофенов. Втканях подвергается гидролизу и освобождает основание, обладающее высокойдиффузионной способностью и проникающее через мембрану внутрь нервного волокна. Ионизируется и трансформируется в катион. Взаимодействуя с рецепторами, ингибирует вход ионов натрия в клетку нейрона в фазе деполяризации, предотвращает возникновение и проведение нервного импульса. Вследствие высокой способности связываться с белками крови артикаин характеризуется низкой системной токсичностью.
Вследствие высокой способности связываться с белками крови артикаин характеризуется низкой системной токсичностью.
Адреналин оказывает сосудосуживающее действие, вследствие чего усиливает и пролонгирует действие артикаина. Адреналин препятствует системной абсорбции артикаина и развитию его побочных эффектов.
При инфильтрационной и проводниковой анестезии в стоматологии Септанест с адреналином 1/100 000, 1/200 000 оказывает быстрое (через 1 – 3 мин) и относительно длительное (не менее 45 мин) местноанестезирующеедействие, характеризуется надежным обезболивающим эффектом. Препарат не нарушает заживление ран, что обусловлено хорошей тканевой переносимостью. Вызывает слабую поверхностную анестезию.
Показания к применению
Инфильтрационная и проводниковая анестезия пристоматологических вмешательствах (особенно у больных с сопутствующими тяжелыми соматическими заболеваниями), в том числе при проведении следующих манипуляций:
— неосложненное удаление одного или нескольких зубов
— препарирование кариозных полостей и зубов перед протезированием
Способ применения и дозы
При неосложненном удалении зубов верхней челюсти и приотсутствии воспаления вводят в подслизистую в области переходной складки свестибулярной стороны 1,7 мл препарата (на каждый зуб).![]() В отдельных случаях может потребоваться дополнительное введение от 1 до 1,7 мл препарата для достижения полной анестезии. В большинстве случаев нет необходимости выполнять болезненные инъекции с небной стороны.
В отдельных случаях может потребоваться дополнительное введение от 1 до 1,7 мл препарата для достижения полной анестезии. В большинстве случаев нет необходимости выполнять болезненные инъекции с небной стороны.
Для анестезии при небных разрезах и наложении швов с целью создания небного депо необходимо около 0,1 мл препарата на укол.
При удалении нескольких рядом расположенных зубов количество инъекций обычно удается ограничить.
В случае удаления премоляров нижней челюсти при отсутствии воспаления можно обойтись без мандибулярной анестезии, так как инфильтрационная анестезия, обеспечиваемая инъекцией 1,7 мл на зуб, как правило, достаточна. Если же эти путем не удалось достичь желаемого эффекта, следует выполнить дополнительную инъекцию 1 — 1,7 мл препарата в подслизистую в области переходной складки нижней челюсти с вестибулярной стороны.
В случае если не удалось достичь полной анестезии, необходимо провести блокаду нижнечелюстного нерва.![]()
Для подготовки кариозной полости или препарирования под коронку любого зуба, за исключением нижних моляров, показано введение препарата в дозе от 0,5 до 1,7мл на каждый зуб, по типу инфильтрационной анестезии с вестибулярной стороны. Точное количество зависит от желаемой глубины и продолжительности процедуры. Максимальная разовая доза составляет 7мг артикаина гидрохлорида на 1 кг массы тела. Продолжительность анестезии, в течение которой можно провести вмешательство, составляет 30-45 минут.
Максимальная разовая доза для детей старше 4 лет составляет5мг артикаина гидрохлорида на 1 кг массы тела ребенка (0,125мл раствора).
Побочные действия
Препарат обычно хорошо переносится пациентами, однако, возможно развитие следующих побочных явлений:
— нарушения сознания вплоть до его потери, нарушения дыхания вплоть до его остановки в зависимости от примененной дозы, мышечный тремор, непроизвольные подергивания мышц, иногда прогрессирующие вплоть до генерализованных судорог, тошнота, рвота
Редко
— помутнение в глазах, преходящая слепота, диплопия
— умеренно выраженные нарушения гемодинамики, проявляющиеся в снижении АД, тахикардии или брадикардии, угнетении сердечно–сосудистой деятельности, что в крайнем проявлении может привести к коллапсу и остановке сердца
— аллергические реакции: отек или воспаление в месте инъекции, в других областях возможно покраснение кожи, крапивница, зуд, конъюнктивит, ринит, ангионевротический отек различной степени выраженности(включая отек верхней и/или нижней губы, щек, голосовой щели с затруднением глотания, затруднение дыхания). Все эти явления могут прогрессировать до развития анафилактического шока.
Все эти явления могут прогрессировать до развития анафилактического шока.
Очень редко
— побочные явления, обусловленные действием адреналина (тахикардия, аритмия, повышение АД, головная боль)
Противопоказания
— повышенная чувствительность к артикаину, адреналину, сульфитам, а также
любому из вспомогательных компонентов препарата
— пароксизмальная тахикардия и другие тахиаритмии
— бронхиальная астма при повышенной чувствительности к сульфитам
— закрытоугольная глаукома, одновременный приемнеселективных бета-
адреноблокаторов
— тяжелая форма печеночной недостаточности (порфирия)
— внутрисосудистая инъекция
— гипертиреоз
— сопутствующее лечение с применением ингибиторов МАО или трициклических антидепрессантов
— детский возраст до 4 лет
Лекарственные взаимодействия
Гипертензивный эффект симпатомиметических аминов типа адреналина может быть усилен трициклическими антидепрессантами и ингибиторами моноаминооксидазы. Взаимодействие подобного типа описано для адреналина и норадреналина в концентрациях 1:25000 и 1:80000 соответственно. Не следует назначать препарат на фоне лечения неселективными бета-адреноблокаторами, поскольку в этом случае высок риск развития гипертонического криза и выраженной брадикардии. Некотровые ингаляционные средства для наркоза, такие как, галотан, могут повышать чувствительность миокарда к катехоламинам, приводя к аритмии во время применения Септонеста с адреналином 1/100000, 1/200 000.
Взаимодействие подобного типа описано для адреналина и норадреналина в концентрациях 1:25000 и 1:80000 соответственно. Не следует назначать препарат на фоне лечения неселективными бета-адреноблокаторами, поскольку в этом случае высок риск развития гипертонического криза и выраженной брадикардии. Некотровые ингаляционные средства для наркоза, такие как, галотан, могут повышать чувствительность миокарда к катехоламинам, приводя к аритмии во время применения Септонеста с адреналином 1/100000, 1/200 000.
Адреналин может снижать эффект антидиабетических препаратов.
Особые указания
Септанест с адреналином 1/100 000 и 1/200 000 содержит сульфиты, которые могут усиливать анафилактические реакции. Повышенная чувствительность к сульфитам чаще наблюдается у больных с бронхиальной астмой.
В случае если препарат применяется впервые для этогопациента необходимо проведение кожной пробы: внутри кожно вводят 0,02 мл препарата и в течение 15 мин наблюдают местную реакцию. При наличии выраженной гиперемии, зуда и других явлений не переносимости препарат не применяют.
При наличии выраженной гиперемии, зуда и других явлений не переносимости препарат не применяют.
При назначении Септанест с адреналином 1/100 000 и 1/200 000 необходимо быть крайне осторожным с больными с дефицитом холинэстеразы(вследствие вероятности пролонгирования, а иногда и усиления действия препарата).
У больных с заболеваниями сердечно-сосудистой системы(хроническая сердечная недостаточность, стенокардия, нарушения ритма, инфарктмиокарда в анамнезе, артериальная гипертензия, цереброваскулярные расстройства с наличием паралича в анамнезе), хроническим бронхитом, эмфиземой, сахарным диабетом, гипертиреозом, феохромоцитомой, а также при наличии выраженного беспокойства, препарат следует назначать с осторожностью, при необходимости целесообразно использование препарата, содержащего меньшее количество адреналина. Препарат должен применяться с осторожностью у пациентов, имеющих в анамнезе эпилепсию. Поскольку местные анестетики амидного типа метаболизируются печенью, препарат должен с осторожностью использоваться при лечении пациентов с заболеваниями печени, так как повышается риск развития токсической концентрации препарата в плазме крови.
Поскольку местные анестетики амидного типа метаболизируются печенью, препарат должен с осторожностью использоваться при лечении пациентов с заболеваниями печени, так как повышается риск развития токсической концентрации препарата в плазме крови.
Во время лечения с использованием ингибиторов свертывания крови и агрегации случайное внутрисосудистое введение Септанест с адреналином может привести к серьезному кровотечению.
Случайное внутрисосудистое введение препарата может сопровождаться судорогами с последующим торможением деятельности центральной нервной системы или остановкой сердечно-сосудистой деятельности. При возникновении данных симптомов необходимо незамедлительное проведение реанимационных мероприятий.
Не следует применять для инъекции поврежденные картриджи. Частично использованные картриджи нельзя применять для лечения других пациентов(для исключения риска инфицирования вирусным гепатитом и другим).
Прием пищи допустим только после восстановления чувствительности. Имеется вероятность положительных результатов при проведении допинг-тестов у спортсменов.
Применение в педиатрии Препарат не рекомендуется детям младше 4 лет, из-за техники введения
Беременность и период лактации
Применение препарата возможно в период беременности. При необходимости применения препарата у кормящей матери нет необходимости прерывать грудное вскармливание, так как активные вещества не выделяются с грудным молоком в клинически значимых количествах.
Особенности влияния на способность управлять транспортными средствами и потенциально опасными механизмами В специальных тестах не было выявлено отчетливого влияния препарата на операторскую деятельность. Однако, в связи с тем, что предоперационное беспокойство больного и стресс, обусловленный оперативным вмешательством, могут влиять на способность управлять транспортными средствами, врач — стоматолог должен индивидуально, в каждом конкретном случае, решать вопрос о допуске пациента к управлению транспортом или работе с механизмами.
Препарат нельзя вводить внутривенно!
Нельзя проводить инъекцию в область воспаления!
Передозировка
Симптомы: головокружение, двигательное беспокойство, нарушение сознания, непроизвольные мышечные подергивания, генерализованные судороги, тахикардия, брадикардия, выраженное снижение артериального давления, шок, тяжелые нарушения кровообращения, коллапс.
Лечение: необходимо срочно прекратить инъекцию и придать пациенту горизонтальное положение. Необходим тщательный контроль показателей гемодинамики (пульс, артериальное давление) и проходимости дыхательных путей. Даже если симптомы кажутся не тяжелыми, следует подготовить все необходимое для внутривенной инфузии, и, по крайней мере, провести венепункцию. В зависимости от нарушения дыхания, следует дать кислород, провести искусственное дыхание («рот в нос») и, при необходимости, эндотрахеальную интубацию с контролируемой вентиляцией легких. Применение аналептических препаратов противопоказано.
Применение аналептических препаратов противопоказано.
При непроизвольных мышечных подергиваниях или генерализованных судорогах показано внутривенное введения барбитуратов короткого или ультракороткого действия. Введение следует проводить медленно, под постоянным контролем показателей гемодинамики и дыхания. Одновременно следует проводить внутривенную инфузию кристаллоидных растворов через заранее установленную канюлю. Также следует дать больному кислород.
При тахикардии, брадикардии или выраженном снижении АД пациенту следует придать горизонтальное положение с приподнятыми ногами.
При тяжелых нарушениях кровообращения и шоке инъекцию препарата следует прекратить. Обеспечить больному горизонтальное положение с приподнятыми ногами, провести ингаляцию кислорода и внутривенную инфузию сбалансированных электролитных и плазмозамещающих растворов, внутривенно ввести глюкокортикоиды (250-1000 мг метилпреднизолона).
В случае угрожающего сосудистого коллапса и нарастающей брадикардии ввести внутривенно 25-100 мкг адреналина (0,25-1,0 мл с концентрацией 100 мкг/мл). Введение проводят медленно, под контролем пульса и артериального давления.
Не следует вводить более 100 мкг адреналина (1мл раствора 1раз). При введении дополнительных количеств адреналина его следует добавить кинфузионному раствору. Скорость инфузии должна коррелировать с частотой пульса и уровнем АД.
Тяжелые формы тахикардии и тахиаритмии могут быть устранены применением антиаритмических препаратов, однако, не следует использовать неселективные бета-адреноблокаторы. В некоторых случаях необходимо применение кислорода и контроль показателей гемодинамики.
При повышении артериального давления у больных с артериальной гипертонией следует применять периферические вазодилятаторы.
Форма выпуска и упаковка
По 10 картриджей упаковывают в контурную ячейковую упаковку из пленки поливинилхлоридной и фольги алюминиевой.
По 5 контурных ячейковых упаковок вместе с инструкцией по применению на государственном и русском языках помещают в пачку из картона.
Условия хранения
Хранить в защищенном от света месте при температуре не выше +25°С.
Хранить в недоступном для детей месте!
Срок хранения
2 года
Не использовать после истечения срока годности, указанного на упаковке.
Условия отпуска из аптек
По рецепту
Производитель
Фирма «Септодонт» Франция, 94107, Сен-Мор-де-Фоссе, ул. Понде Кретей, 58
Обезболивание артикаином в сочетании с адреналином и клонидином в детской стоматологической практике
На правах рукописи
Мельникова Анастасия Васильевна
ОБЕЗБОЛИВАНИЕ АРТИКАИНОМ В СОЧЕТАНИИ С АДРЕНАЛИНОМ И КЛОНИДИНОМ В ДЕТСКОЙ СТОМАТОЛОГИЧЕСКОЙ ПРАКТИКЕ
14. 01.14 — Стоматология. Медицинские науки.
01.14 — Стоматология. Медицинские науки.
г 7 МАЯ 2015
Автореферат диссертации на соискание ученой степени кандидата медицинских наук
Москва-2015
005569328
Работа выполнена в Государственном бюджетном образовательном учреждении дополнительного профессионального образования «Российская медицинская академия последипломного образования» Министерства здравоохранения Российской Федерации на кафедре стоматологии.
Научный руководитель:
Шугайлов Игорь Александрович — доктор медицинских наук, профессор.
Официальные оппоненты:
Кисельникова Лариса Петровна — доктор медицинских наук, профессор, ГБОУ ВПО «Московский государственный медико-стоматологический университет имени А.И. Евдокимова» Минздрава России, кафедра детской стоматологии, заведующая кафедрой.
Адмакин Олег Иванович — доктор медицинских наук, профессор, ГБОУ ВПО «Первый Московский государственный медицинский университет имени И. М. Сеченова» Минздрава России, кафедра профилактики и коммунальной стоматологии, заведующий кафедрой.
М. Сеченова» Минздрава России, кафедра профилактики и коммунальной стоматологии, заведующий кафедрой.
Ведущая организация:
ФГБОУ ДПО «Институт повышения квалификации Федерального медико-биологического агентства России».
Защита диссертации состоится «25» июня 2015 г. в 10:00 часов на заседании Диссертационного совета (Д 208.111.01) на базе ФГБУ «ЦНИИС и 4JIX» Минздрава России по адресу: г. Москва, ул. Тимура Фрунзе, д. 16.
С диссертацией можно ознакомиться в библиотеке ФГБУ «ЦНИИС и 4JIX» Минздрава России по адресу: г. Москва, ул. Тимура Фрунзе, д. 16 и на сайте: www.cniis.ru
Автореферат разослан « » 2015 г.
Ученый секретарь
Диссертационного совета, к.м.н.
Гусева И.Е.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность
Проблема боли и обезболивания остаются одними из важнейших и сложных аспектов в современной стоматологии. Негативный опыт, связанный с отсутствием адекватного обезболивания влечет за собой невозможность полноценного стоматологического лечения в дальнейшем из-за несвоевременного обращения пациента к стоматологу [Сохов С. Т., 1997; Грицук С.Ф., 2004; Рабинович С.А., 2002; Шугайлов И.А., 2003; Московец О.Н., 2009].
Т., 1997; Грицук С.Ф., 2004; Рабинович С.А., 2002; Шугайлов И.А., 2003; Московец О.Н., 2009].
Ведущее место в амбулаторной стоматологии отводится препаратам местного действия, особенностью действия которых состоит в том, что они тормозят возбудимость преимущественно немиелинизированных волокон группы С, обусловливающих протопатическую боль, тогда как пульпа зубов, в основном, иннервируется миелинизированными волокнами группы АД, участвующими в формировании сенсорного компонента болевой реакции [Шугайлов И.А., 2003; Ikeda Н., 2003; Henry М. А., 2007; Hucho Т., 2007; Krishnan V., 2007; Abd-Elmeguid А., 2009].
Более равномерное угнетение возбудимости обеих групп нервных волокон, чем использование только местного анестетика, достигается комбинацией его с вазоконстриктором, снижающим периферический кровоток и приводящим к локальной гипоксии тканей, к которой наиболее чувствительны тонкие миелинизированные волокна группы АД [Шугайлов И.А., 2003; Caviedes-Bucheli J., 2009].
Помимо афферентной ноцицептивной импульсации, в формировании боли имеют значение и образовавшиеся в результате воспаления алгогенные вещества, воздействующие не только на периферические нервные волокна, но и на опиатные рецепторы (ц, а, к) [Fristad I., 2003; Fried К., 2007; Caviedes-Bucheli J„ 2007; 2011; Bianchi M„ 2008; Park С. К., 2010; Sacerdote Р., 2012].
В педиатрической практике большое значение имеют и анатомо-физиологические особенности организма ребенка, в том числе индивидуальной стресс-реактивности, что обусловливает различия в характере патологических процессов у детей и взрослых [Рабинович С. А., 2000; Сунцов В.Г., 2001; Malamed S. F., 2000]. Наиболее частыми нарушениями у детей, связанными со страхом перед стоматологическим вмешательством, являются расстройства
нервно-психической сферы, сердечно-сосудистой системы, а также желудочно-кишечного тракта [Рабинович С.А., 2000].
Необходимость применения вазоконстрикторов в составе местноанестезирующего раствора усугубляет стресс-реакцию, поскольку они вызывают положительные хроно- и инотропный эффекты, а также спазм периферических сосудов [Ивасенко П.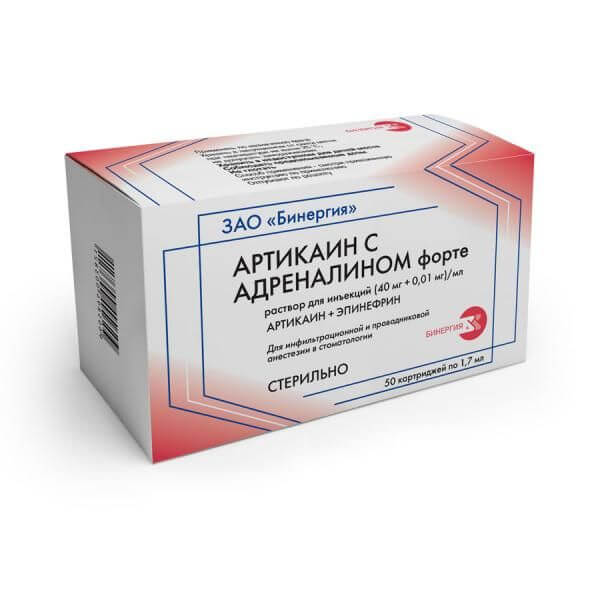 И., 2000; Назаров И.П., 2003].
И., 2000; Назаров И.П., 2003].
Перечисленные положения привели к продолжению попыток оптимизации современных методов местного обезболивания в стоматологии. В частности в ряде исследований [Мишунин Ю.В., 2005; Гуленко О.В., 2006; Вгкоую В., 2005] продемонстрирован опыт включения в состав местно-анестезирующего раствора клонидина, являющегося селективным частичным агонистом а2-адренорецепторов. Гуленко О.В. применила клонидин при интралигаментарной анестезии у детей 10-12 лет, получив в своем исследовании потенцирование и углубление местного обезболивания с использованием клонидина (1:200 000) в составе 2% раствора лидокаина. Ранее препарат использовался в составе премедикации, позволяя значимо потенцировать как местную, так и общую анестезию у детей и взрослых, снижая, таким образом, частоту побочных реакций [Ерохов С.А. 2003; Клемешева Ю.Н., 2009]. Ерохов С.А. в своих работах использовал клонидин в дозе 0,5 мкг/кг в составе премедикации при аденотомии у детей в возрасте от 5 до 12 лет и показал потенцирование местного обезболивания на фоне стабилизации показателей вегетативной нервной системы. При общей анестезии введение клонидина способствовало снижению потребности в анестетике, большей стабильности в гемодинамике, более быстром пробуждении и меньшей потребности в обезболивании в послеоперационном периоде [Назаров И.П., 2005]. Во многих исследованиях доказано, что стабильность гемодинамики при использовании клонидина, превышает таковую по сравнению с использованием только лидокаина или лидокаина и адреналина в рамках региональной анестезии [ВагЙкЯотее Б., 1991; Масаке Р., 1995]. Перидуральная анестезия с применением клонидина широко применяется в акушерстве, ее особенностями является большая длительность и уменьшение потребности в анестетике [Милютин А.Д., 2005]. У детей регионарно клонидин используют в основном при
При общей анестезии введение клонидина способствовало снижению потребности в анестетике, большей стабильности в гемодинамике, более быстром пробуждении и меньшей потребности в обезболивании в послеоперационном периоде [Назаров И.П., 2005]. Во многих исследованиях доказано, что стабильность гемодинамики при использовании клонидина, превышает таковую по сравнению с использованием только лидокаина или лидокаина и адреналина в рамках региональной анестезии [ВагЙкЯотее Б., 1991; Масаке Р., 1995]. Перидуральная анестезия с применением клонидина широко применяется в акушерстве, ее особенностями является большая длительность и уменьшение потребности в анестетике [Милютин А.Д., 2005]. У детей регионарно клонидин используют в основном при
каудальной анестезии в дозе 1-3 мкг/кг. [Геодакян О.С, Цыпин JI.E., 2000].
Фармакологической основой указанных свойств препарата является его центральное стимулирующее действие на пресинаптические а2-адренорецепторы тормозных структур головного мозга и периферических нервных окончаний артериального и венозного русла, что способствует пролонгированию действия анестетика подобно адреналину и одновременно оказывает центральный антиноцицептивный эффект. В отличие от адреналина клонидин оказывает минимальное агонистическое действие на al-адренорецепторы и не влияет на ß-адренорецепторы, что значительно в меньшей степени отражается на системной гемодинамике по сравнению с катехоламином, предотвращая гипертензионные и тахикардиальные реакции [Лоуренс Д., 2002; Никифоров A.B. 2004].
В отличие от адреналина клонидин оказывает минимальное агонистическое действие на al-адренорецепторы и не влияет на ß-адренорецепторы, что значительно в меньшей степени отражается на системной гемодинамике по сравнению с катехоламином, предотвращая гипертензионные и тахикардиальные реакции [Лоуренс Д., 2002; Никифоров A.B. 2004].
Перечисленные преимущества теоретически способны нивелировать весь комплекс патофизиологических эффектов (от сердечно-сосудистых до адаптационных), отмечаемых у пациента на приеме у стоматолога. Однако целесообразность использования данной тактики, особенно в детской практике, до конца не известна.
Вышеперечисленные положения и обусловили выбор цели настоящего исследования.
Цель исследования:
Повышение эффективности местного обезболивания твердых тканей зуба и снижение риска соматических осложнений на основе применения клонидина в сочетании с артикаином и адреналином в детской стоматологической практике.
Задачи исследования:
1. Определить степень влияния местного обезболивания твердых тканей зуба у детей 13-16 лет на основе применения артикаина в сочетании с адреналином и клонидином на сердечно-сосудистую систему.
Определить степень влияния местного обезболивания твердых тканей зуба у детей 13-16 лет на основе применения артикаина в сочетании с адреналином и клонидином на сердечно-сосудистую систему.
2. Определить степень выраженности индивидуальной стресс-реактивности при использовании в качестве раствора для местного обезболивания твердых тканей зуба у детей 13-16 лет артикаина с адреналином и клонидином.
3. Провести сравнительную оценку адекватности местного обезболивания твердых тканей зуба 4% раствором артикаина с различными сочетаниями адреналина и клонидина и обосновать выбор метода местного обезболивания при лечении зубов у детей 13-16 лет.
4. Оценить адекватность обезболивания твердых тканей зуба местно-анестезирующим раствором 4% артикаина в сочетании с адреналином( 1:200 ООО или 1:400 ООО) и клонидином (1:100 000) при лечении кариеса дентина и пульпита у детей 13-16 лет.
5. Разработать практические рекомендации по применению местного обезболивания твердых тканей зубов у детей 13-16 лет на основе применения клонидина в сочетании с артикаином и адреналином.
Научная новизна работы
1. Впервые установлено наличие снижения риска развития соматических осложнений и повышения эффективности местного обезболивания за счет применения клонидина (1:100000) в местноанестезирующем растворе 4% артикаина в сочетаниях с адреналином (1:200 000 и 1:400 000).
2. Впервые установлена эффективность местного обезболивания у детей 13-16 лет артикаином (4%) с адреналином (1:200 000) и клонидином (1:100 000) при лечении кариеса дентина и пульпита, а сочетания артикаина (4%), адреналина (1:400 000) и клонидина (1:100 000) — при лечении кариеса дентина. При этом обезболивание артикаином в сочетании с клонидином в указанных концентрациях было низкоэффективным.
3. Впервые установлено, что местное обезболивание артикаином (4%) с адреналином (1:200 000) и клонидином (1:100 000) , а также артикаином (4%) с адреналином (1:400 000) и клонидином (1:100 000), в отличие от обычного применения артикаина (4%) с адреналином (1:200 000), нивелирует негативное влияние адреналина на центральную гемодинамику и показатели адаптации у детей 13-16 лет при лечении кариеса дентина и пульпита.
4. Впервые установлено, что добавление клонидина (1:100 000) в местноанестезирующий раствор 4% артикаина с адреналином (1:200000 пролонгирует в 1,3 раза и усиливает в 1,2 раза обезболивающий эффект твердых тканей зуба у детей 13-16 лет при лечении кариеса дентина и пульпита.
Практическая значимость работы
На основании исследований, отражающих эффективность анестезии, состояние гемодинамики и показателей адаптации в условиях местного обезболивания у детей 13-16 лет, показано преимущество использования комбинации артикаина (4%), адреналина (1:200 000) и клонидина (1:100 000) при лечении кариеса дентина и пульпита, а сочетание артикаина (4%), адреналина (1:400 000) и клонидина (1:100 000) — при кариесе дентина по сравнению с обычным применением артикаина (4%) с адреналином (1:200 000).
Установленный уровень адекватности предложенных методов обезболивания с включением клонидина позволяет рекомендовать их для местного обезболивания при лечении стоматологических заболеваний у детей 13-16 лет, обеспечивая снижение риска соматических осложнений.
Основные положения, выносимые на защиту:
1. Метод местного обезболивания с включением клонидина (1:100000) в раствор артикаина (4%) с адреналином (1:200 000 и 1:400000) при местной анестезии твердых тканей 1.1-2.7 зубов обеспечивает стабилизацию показателей гемодинамики детей 13-16 лет.
2. Метод местного обезболивания с включением клонидина (1:100 000) в раствор артикаина (4%) с адреналином (1:200 000 и 1:400 000) и при местной анестезии твердых тканей 1.7-2.7 зубов не оказывает существенного влияния на показатели адаптации детей 13-16 лет.
3. Сочетание артикаин (4%) +адреналин (1:200 000) + клонидин (1:100 000) обеспечивает эффективное обезболивание при лечении детей как с кариесом дентина, так и пульпитом, в то время как уменьшение концентрации адреналина в 2 раза в местноанестезирующем растворе (артикаин (4%) + адреналин (1:400 000) + клонидин (1:100 000)) является эффективным при лечении кариеса дентина. Метод с использованием сочетания артикаин (4%) + клонидин (1:100 000) является низкоэффективным при выполнении стоматологических вмешательств на твердых тканях зуба у детей 13-16 лет.
4. Адекватное обезболивание при выполнении
стоматологических вмешательств у детей 13-16 лет возраста по поводу кариеса дентина и пульпита может быть достигнуто применением местноанестезирующего раствора на основе артикаина (4%), адреналина(1:200 ООО) и клонидина (1:100 000), поскольку он характеризуется достаточной продолжительностью и глубиной обезболивания при отсутствии негативного влияния на гемодинамику и показатели адаптации. Метод обезболивания с уменьшенной дозой (1:400 000) адреналина обеспечивает адекватное обезболивание только при кариесе дентина на фоне стабильных показателей гемодинамики.
Апробация работы
Основные положения диссертационной работы доложены на XI Всероссийском стоматологическом форуме «Образование, наука и практика в стоматологии» «Дентал-Ревю 2014» по объединенной тематике «Кариес зубов и его осложнения у детей и взрослых, современные методы диагностики, профилактики и лечения» 10-12 февраля 2014 года в г. Москве, в МВЦ «Крокус-Экспо».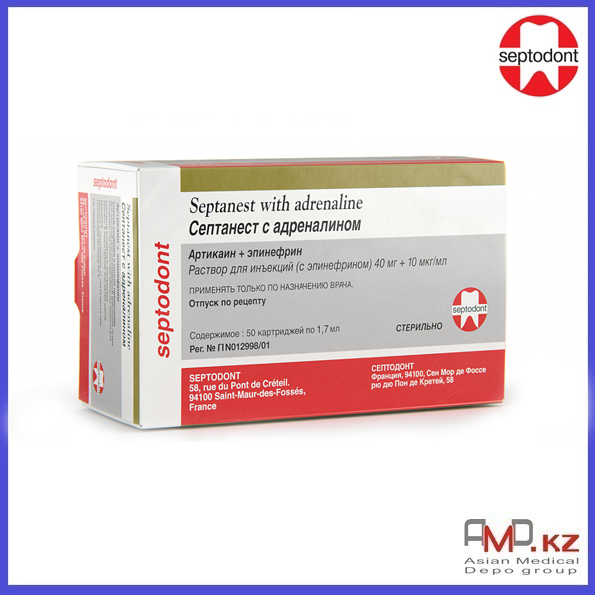
Апробация диссертации состоялась на расширенном заседании кафедры стоматологии ГБОУ ДПО РМАПО Минздрава России «17» ноября 2014 г.
Публикации
По теме диссертации опубликовано 5 научных работ в научных рецензируемых журналах, рекомендованных ВАК Минобрнауки России.
Внедрение в практику
Результаты исследования адекватности сочетания артикаина с клонидином (1:100 000) и адреналином (1:200 000 и 1:400 000) при местной анестезии у детей 13-16 лет внедрены в клиническую практику детской стоматологической поликлиники №41 ДЗМ г.Москвы.
Полученные результаты включены в программы обучения врачей-стоматологов, интернов, ординаторов и аспирантов на кафедрах стоматологического факультета ГБОУ ДПО РМАПО Минздрава России.
Личное участие автора
Автором самостоятельно осуществлен запланированный в рамках диссертационной работы объем обследования и лечения 125 детей с формированием базы данных, статистической обработкой и обобщением полученных результатов исследования, работа с отечественной и зарубежной англоязычной литературой, оформление и иллюстрация диссертационной работы.
Объем и структура диссертации
Диссертация изложена на 143 страницах машинописного текста, состоит из введения, четырех глав, заключения, выводов, практических рекомендаций и списка литературы, включающего 122 источника, из них 73 отечественных и 49 зарубежных авторов. Работа иллюстрирована 25 таблицами и 49 рисунками.
Соответствие диссертации области исследования
Область диссертационного исследования Мельниковой A.B. включает совершенствование методов местного обезболивания при амбулаторных стоматологических вмешательствах у детей с целью повышения качества и эффективности их лечения и соответствует п. № «6» (разработка и совершенствование методов организации и оказания стоматологической помощи населению и развития специальности в новых условиях хозяйствования) паспорта специальности 14.01.14 — Стоматология. Медицинские науки.
Проведение диссертационного исследования Мельниковой A.B. одобрено Комитетом по этике научных исследований ГБОУ ДПО РМАПО Минздрава России протокол № 2 от «03» марта 2014 г.
СОДЕРЖАНИЕ ДИССЕРТАЦИОННОГО ИССЛЕДОВАНИЯ
Материалы и методы исследования
Исследование выполнено на кафедре стоматологии ГБОУ ДПО «Российская медицинская академия последипломного образования» Минздрава России.
В исследование включено 125 пациентов (65 девочек и 60 мальчиков) в возрасте 13-16 лет, которым проводилось лечение 1.7-
2.7 зубов по поводу кариеса дентина, а также хронического пульпита и его обострения.
Выбор анестезируемых зубов был обусловлен завершением развития их корней, что позволяло получать более воспроизводимые и точные показатели при электроодонто-диагностики. Ограничение выбора зубов было продиктовано необходимостью уменьшения вероятности влияния их различного анатомического расположения на результаты исследования и на достоверность полученных результатов в целом.
Для обезболивания применялся метод инфильтрационной анестезии с помощью карпульного шприца ИС-02 «МИД» и использовались препараты — ультракаин Д (артикаин), ультракаин Д-С (артикаин + эпинефрин 1:200000) («Sanofi-aventis», Германия), клофелин (клонидин, раствор для внутривенного введения 0,1 мг/мл («Органика», Россия), сочетания во 2,3,4 группах готовились ех tempore. В соответствии с утвержденной МЗ РФ инструкции, детский возраст 13-16 лет не является противопоказанием к применению данного препарата.
В соответствии с утвержденной МЗ РФ инструкции, детский возраст 13-16 лет не является противопоказанием к применению данного препарата.
Доза клонидина была подобрана нами на основе данных литературы, согласно которым в исследовании В. Brkovic (2005) клонидин для обезболивания зубов использовался у взрослых пациентов в концентрации 15 мкг/мл в 2 мл 2% лидокаина, что составляет 1:67 000. В педиатрической практике у детей в возрасте 10-12 лет О.В. Гуленко (2006) применяла клонидин в 2% растворе лидокаина в концентрации 1:200 000 и отметила достаточную эффективность данного метода обезболивания.
Учитывая тот факт, что 4% артикаин обладает более выраженным сосудорасширяющим действием, чем 2% лидокаин в настоящем исследовании было решено использовать концентрацию клонидина 12 мкг/мл или 1:100 000, что составляет 20 мкг и является лишь 20% от максимально допустимой разовой дозы у детей (100 мг).
Более того, известна стимуляционная проба, используемая для диагностики дефицита СТГ у детей: 150 мкг/кв. м или 4 мкг/кг однократно [Еламанова С., 2006]. При этом экстраполируя эти данные на средний вес пациентов настоящего исследования, составивший 55,2 ± 4,1 кг, разовая доза стимуляционной пробы составила бы 220,8 мкг или 0,22 мг, что на порядок больше, чем в наших исследованиях, которая составила лишь 20 мкг.
м или 4 мкг/кг однократно [Еламанова С., 2006]. При этом экстраполируя эти данные на средний вес пациентов настоящего исследования, составивший 55,2 ± 4,1 кг, разовая доза стимуляционной пробы составила бы 220,8 мкг или 0,22 мг, что на порядок больше, чем в наших исследованиях, которая составила лишь 20 мкг.
Критериями включения в исследование явились: нормальный уровень ситуативной тревожности. (А.Ф. Бизяев 1992), а также отсутствие острых и хронических соматических заболеваний, влияющих на степень напряжения вегетативной нервной системы, например вегето-сосудистая дистония.
Помимо этого критерием включения пациентов в группы, где в составе местноанестезирующего раствора присутствовал клонидин, являлась недостаточная эффективность обезболивания с помощью традиционных методов анестезии в анамнезе.
Критериями исключения пациентов из исследования были все заболевания и состояния, являющиеся противопоказанием к применению артикаина, адреналина и клонидина по утвержденной МЗ РФ инструкции: повышенная чувствительность к артикаину, адреналину или к любому другому компоненту препарата, пароксизмальная тахикардия и другие нарушения сердечного ритма, закрытоугольная форма глаукомы, анемия (В12-дефицитная анемия, метгемоглобинемия, гипоксии), бронхиальная астма при повышенной чувствительности к сульфитам, дефицит холинэстеразы крови, заболевания центральной нервной системы, миастении, тяжелые формы печеночной недостаточности (порфирий), тяжелые формы гипертиреоза, возраст до 4 лет, атриовентрикулярная блокада 2 и 3 степени, выраженная синусовая брадикардия, выраженные атеросклеротические изменения сосудов головного мозга, кардиогенный шок, депрессия, облитерирующие заболевания периферических артерий, синдром слабости синусового узла, индивидуальная непереносимость компонентов препарата, одновременное применение трициклических антидепрессантов, беременность, период лактации, одновременный прием этанола [Клофелин, ультракаин Д-С, инструкция к применению].
Все пациенты были распределены на 4 группы в зависимости от применяемого местноанестезирующего раствора для обезболивания (рисунок 1):
125 пациентов.
которым проводилось лечение постоянных зубов В/Ч по поводу кариеса дентина (94 чел (75,2%)) и пульпита (31 чел (24,8%)) (мальчиков — 60, девочек — 65; средний возраст 15 ± 3,8 лет), без нарушений психосоматического статуса
4- 4- Ф +
Группа 1 Г руппа 2 Группа 3 Группа 4
(32 чел) (28 чел) (34 чел) (31 чел)
1 1 4-
Метод Метод Метод Метод
обезболивания обезболивания обезболивания обезболивания
зубов: зубов: зубов: зубов:
артикаин (4%) артикаин (4%) артикаин (4%) артикаин (4%)
+ адреналин + клонидин + адреналин + адреналин
(1 : 200 000) (1 : 100 000) (1 : 200 000) (1 : 400 000)
+ клонидин клонидин
(1 : 100 000) (1 : 100 000)
Рисунок 1. Материал клинического исследования и распределение на группы
При проведении статистического анализа установлено, что исследуемые группы достоверно не различались по возрасту, полу, среднему росту, весу, а также нозологической форме заболевания и количеству посещений стоматолога в год, что позволяло считать исследуемые выборки однородными и ожидать качественного статистического результата их дальнейшего сравнительного анализа. ввоп Е.С.,1974)
ввоп Е.С.,1974)
Указанные параметры были оценены на следующих этапах исследования: до начала обезболивания, через 5 минут после обезболивания (выполнения анестезии), во время стоматологического вмешательства (наиболее травматичный момент — во время удаления пульпы или препарирования кариозной полости), по его окончании и после окончания обезболивания (действия анестетика) (рисунок 2).
Этапы измерения показателей
2 3 4
До начала исследования
Через 5 минут
после выполнения анестезии
Во время стоматологического вмешательства
По окончании стоматологического вмешательства
После окончания действия анестетика
• Исследование функционального состояния ССС: систолическое/диастолическое/среднее АД; ЧСС, Бр02
• Определение степени адаптации пациента к стрессовой ситуации: индекс напряжения (ИН), соотношение различных типов волн — и/ИР, отражающих влияние симпатического и парасимпатического отделов ВНС •Оценка глубины и продолжительности обезболивания методом ЭОД
• Оценка степени болезненности проводимого вмешательства методом ВАШ
Рисунок 2. Дизайн и методы исследования
Дизайн и методы исследования
Результаты исследования
Исходные гемодинамические параметры пациентов 4-х групп до начала исследования статистически не различались.
В группе 1 ожидаемыми были гемодинамические системные эффекты в связи с присутствием в растворе для обезболивания адреналина. Это выражалось в быстрой смене состояний симпатико- и парасимпатикотонии, то есть фазностью действия адреналина и отражалось на изменении САД, сАД, ЧСС и ДАД. При этом через 5 минут после анестезии повышение показателей
САД, сАД, ДАД и ЧСС в данной группе было статистически достоверно (р<0,05) по сравнению с группой 3 и 4, где в растворе для обезболивания также присутствовал адреналин. В то же время в группе 2, где применяли только клонидин в комбинации с анестетиком, через 5 минут после обезболивания САД, сАД и ДАД в сравнении с другими группами существенно снижалось (р<0,05) (рисунок 3).
При анализе течения обезболивания в группе 2, где применялось обезболивание артикаином (4%) и клонидином (1:100 000), отмечена более благоприятная гемодинамическая ситуация. Отсутствие адреналина в анестезирующем растворе привело к тому, что значимого подъема АД (как САД, ДАД, сАД), а также увеличения ЧСС по сравнению с показателями до анестезии, у этих детей не отмечалось, при этом системное действие клонидина приводило к нормализации АД и ЧСС, то есть проявлению парасимпатических (симпатолитических) влияний (рисунок 3).
Отсутствие адреналина в анестезирующем растворе привело к тому, что значимого подъема АД (как САД, ДАД, сАД), а также увеличения ЧСС по сравнению с показателями до анестезии, у этих детей не отмечалось, при этом системное действие клонидина приводило к нормализации АД и ЧСС, то есть проявлению парасимпатических (симпатолитических) влияний (рисунок 3).
Обезболивание с использованием артикаина (4%), адреналина (1:200 000) и клонидина (1:100 000) (группа 3) сопровождалось менее выраженной симпатической реакцией по сравнению с группой 1, где был применен артикаин и адреналин. При этом отмечена нормализация изучаемых показателей во время стоматологического вмешательства, после его окончания и обезболивания, причем различия среднего значения САД, ДАД, сАД и ЧСС во время и после вмешательства, а также после окончания обезболивания по сравнению с показателем через 5 минут после анестезии были статистически достоверными (р<0,05) (рисунок 3).
С целью минимизации системных гемодинамических эффектов адреналина в 4 группе был использован метод обезболивания артикаином (4%), адреналином (1:400 000) и клонидином (1:100 000).![]() При этом динамика гемодинамических параметров характеризовалась отсутствием каких-либо колебаний (рисунок 3).
При этом динамика гемодинамических параметров характеризовалась отсутствием каких-либо колебаний (рисунок 3).
систолическое АД среднее АД
ЧСС
диастолическое ад
Рисунок 3. Сравнительная оценка показателей сердечнососудистой системы по группам на этапах исследования
Полученные результаты в трех описанных группах мы объяснили с позиций наличия у клонидина альфа-2 адреномиметического действия. Вначале, при внутритканевом введении, клонидин проявлял местное вазоконстрикторное действие, приводя к замедленному попаданию адреналина в системный кровоток, уменьшая, таким образом, выраженность его влияния на гемодинамику. В дальнейшем, попадая в системный кровоток, препарат оказывал центральное альфа-2 адреномиметическое действие, усиливая парасимпатикотонию. В результате уменьшалась фазная стимуляция адреналином ВНС, а также проявлялся центральный антиноцицептивный эффект клонидина. Этим можно объяснить постепенную нормализацию АД и ЧСС к концу исследования в группах 2, 3 и 4, что свидетельствовало об адекватности выбранной дозы препарата и отличалось от результатов, полученных ранее В. Вгкоую (2005), согласно которым добавление клонидина (15 мкг/мл) в местноанестезирующий раствор 2% лидокаина при удалении зубов у взрослых вызывало достоверное снижение ДАД после окончания стоматологического вмешательства по сравнению с показателем до анестезии.
Вгкоую (2005), согласно которым добавление клонидина (15 мкг/мл) в местноанестезирующий раствор 2% лидокаина при удалении зубов у взрослых вызывало достоверное снижение ДАД после окончания стоматологического вмешательства по сравнению с показателем до анестезии.
Изменения показателей гемодинамики, в свою очередь, влияли на снижение сатурации кислорода в тканях (8р02), которое было наиболее выраженным в группе 1. Это соответствовало ухудшению психосоматического состояния пациента, которое выражалось в побледнении кожных покровов, ощущении слабости у 3-х пациентов 1 группы приблизительно на 20-ой минуте стоматологического вмешательства (рисунок 4).
перед через 5 мин. после во время после после окончания
обезболиванием обезболивания вмешательства вмешательства обезболивания
и Группа 1 В Группа 2 ■ Группа 3 Группа 4
Рисунок 4. Сравнительная оценка влияния методов обезболивания на параметры сатурации кислорода (Бр02) крови у исследуемых
групп
Анализ степени вовлеченности организма в стресс показал, что в группе 1 (артикаин (4%) + адреналин (1:200 000) динамика показателя выходила за рамки адаптивных возможностей, достигая уровня компенсированного дистресса уже через 5 минут после обезболивания (р<0,05) по сравнению с другими группами. Сходная динамика отмечалась и в отношении показателя ЬБ/НР (рисунок 5). Эта ситуация могла быть объяснена с позиций системных гемодинамических эффектов адреналина, которые попеременно стимулировали симпатическую и парасимпатическую системы организма, приводя к снижению адаптивных возможностей и росту ИН. В какой-то мере это последствие можно назвать ятрогенным.
Сходная динамика отмечалась и в отношении показателя ЬБ/НР (рисунок 5). Эта ситуация могла быть объяснена с позиций системных гемодинамических эффектов адреналина, которые попеременно стимулировали симпатическую и парасимпатическую системы организма, приводя к снижению адаптивных возможностей и росту ИН. В какой-то мере это последствие можно назвать ятрогенным.
В группе 2 в связи с присутствием в местноанестезирующем растворе клонидина, который способствует парасимпатикотонии, через 5 мин после проведения обезболивания показатели адаптации снижались (р<0,05). Во время стоматологического вмешательства они вновь возрастали достигая значений аналогичных параметров в группах 3 и 4, но оставались ниже, чем в группе 1 (р<0,05) (рисунок 5).
В то же время, комбинированное обезболивание в группах 3 и 4 с включением как адреналина, так и клонидина влияло на показатели адаптации незначительно (рисунок 5).
Группа 1 Группа 2 Группа 3 Группа 4
перед через 5 мин. вовремя после после
вовремя после после
обезболиванием после вмешательства вмешательства окончания обезболивания обезболивания
Рисунок 5. Сравнительная оценка показателей адаптации у пациентов исследуемых групп
На основании полученных результатов было предположено, что решающее значение на стабильность адаптивных возможностей организма и, связного с их истощением, психологического напряжения во время стоматологического вмешательства имеет комбинированное антагонистическое и синергическое действие при одновременном применении клонидина и адреналина. При этом опасность быстрого подъема артериального давления за счет
усиления периферического спазма сосудов в тканях зуба не была подтверждена по результатам изучения показателей гемодинамики, однако замедление высвобождения адреналина в системный кровоток приводило к уменьшению попеременной стимуляции симпатической и парасимпатической систем и, таким образом, по-видимому, не вызывало срыва адаптивных возможностей организма. Этому способствовало и центральное а2-адреномиметическое действие клонидина, усиливавшее парасимпатикотонию.
Этому способствовало и центральное а2-адреномиметическое действие клонидина, усиливавшее парасимпатикотонию.
Оценка эффективности изучаемых методов обезболивания по данным электроодонтодиагностики показала отсутствие различий по времени начала обезболивания (НО) во всех группах. Однако дальнейшие измерения продемонстрировали ряд существенных различий между группами. В группе 3 настоящего исследования, где применяли местное обезболивание артикаином (4%) в сочетании с адреналином (1:200 ООО) и клонидином (1:100 ООО), начало и продолжительность пульпарной анальгезии (НПА и ППА) значительно превышали аналогичные параметры других групп (р < 0,05). Последний показатель в группе 3 (артикаин (4%) + адреналин (1:200 000) + клонидин (1:100 000) был в 3,98 раз выше, чем в группе 2 (артикаин (4%) + клонидин (1:100 000), в 1,48 раз -чем в группе 1 (артикаин (4%) + адреналин (1:200 000), и в 2,3 раза, чем в группе 4 (артикаин (4%) + адреналин (1:400 000) + клонидин (1:100 000) (таблица 1).
Сравнивая все группы в настоящем исследовании по показателю продолжительности обезболивания (ПО) было отмечено, что в группе 3 (артикаин (4%) + адреналин (1:200 000) + клонидин (1:100 000) он был в 3 раза выше, чем в группе 2 (артикаин (4%) + клонидин (1:100 000), в 1,3 раза выше, чем в группе 1 (артикаин (4%) + адреналин (1:200 000), и в 1,7 раза выше, чем в группе 4 (артикаин (4%) + адреналин (1:400 000) + клонидин (1:100 000) (таблица 1).
Таблица 1
Сравнительная оценка длительности обезболивания у пациентов исследуемых групп
Показатель Группа 1 Группа 2 Группа 3 Группа 4 р<0,05
Начало обезболивания (мин.) 0,5 ±0,06 0,5 ± 0,08 0,5 ± 0,04 0,5 ± 0,06
Начало пульпарнои анальгезии (мин.) 3,2 ± 0,1В 4,2+0,16 2,4 + 0,15 3,6+ 0,17 между 1 и 2, 1 и 3, 1 и 4, 2 и 3, 2 и 4, 3 и4
Продолжительность пульпарнои анальгезии (мин.) 65,4 ± 7,8 24,3 ± 6,4 96,7 + 8,3 41,3 ±7,5 между 1 и 2, 1 и 3, 1 и 4, 2 и 3, 2 и 4, 3 и 4
Продолжительность обезболивания (мин. ) 138,6 + 9,7 63,2 ± 11,4 183,4+10,6 106,2 ± 12,3 между 1 и 2, 1 и 3, 1 и 4, 2 и 3, 2 и 4, 3 и 4
) 138,6 + 9,7 63,2 ± 11,4 183,4+10,6 106,2 ± 12,3 между 1 и 2, 1 и 3, 1 и 4, 2 и 3, 2 и 4, 3 и 4
Сравнивая динамику глубины обезболивания по данным ЭОД в исследуемых группах, было отмечено, что наиболее выраженное обезболивание было достигнуто в группе 3 (197,2 ± 15,3 мкА) (р < 0,05), наименьшее — в группе 2 (105,4 ± 11,5 мкА) (р < 0,05), средняя — в группах 1 и 4 (164,3±14,1мкА и 132,6 ± 12,7 мкА
продолжительности обезболивания у исследуемых групп (данные
ЭОД)
Полученные результаты подтверждались также данными ВАШ, на основании анализа которых установлено, что более эффективное обезболивание по субъективной оценке пациентов степени болезненности стоматологического вмешательства было достигнуто в группах 1 и 3, а менее эффективное — в группах 2 и 4 (р < 0,05) (рисунок 7).
3,5±0,4
Группа 1 Группа 2 Группа 3 Группа 4
Рисунок 7. Сравнительная оценка степени болезненности стоматологических вмешательств по ВАШ между группами
Анализ полученных результатов в отношении выбора наиболее адекватного метода обезболивания показал, что у пациентов 1-ой группы несмотря на наличие высокого показателя ЭОД, что свидетельствовало о достаточной эффективности обезболивания, гемодинамические параметры (САД, сАД, ДАД,) были подвержены нежелательным изменениям фазного характера с попеременной стимуляцией симпатического и парасимпатического отделов ВНС, а показатели адаптации (ИН и ЬР/НГ) свидетельствовали о наличии высокого напряжения во время стоматологического вмешательства. Во 2-ой, 3-ей и 4-ой группах подобные изменения были незначительными или отсутствовали, что происходило на фоне достаточной глубины обезболивания в группах 3, умеренной — в группе 4 и низкой — в группе 2.
Во 2-ой, 3-ей и 4-ой группах подобные изменения были незначительными или отсутствовали, что происходило на фоне достаточной глубины обезболивания в группах 3, умеренной — в группе 4 и низкой — в группе 2.
При этом на показатели адаптации влияли как гемодинамические изменения, так и глубина проводимого обезболивания.
С практической точки зрения в группе 2 на фоне низкой эффективности обезболивания отмечена выраженная болезненность при депульпировании зубов, а также более выраженная кровоточивость сосудов пульпы, чем при использовании местноанестезирующих растворов с адреналином. Таким образом, метод обезболивания 4% артикаином в сочетании с клонидином является недостаточно эффективным для проведения безболезненных вмешательств на твердых тканях зуба и при депульпировании. По нашему мнению, это связано с меньшим сосудосуживающим действием клонидина по сравнению с адреналином, и, как следствие, невозможностью нивелировать сосудорасширяющее действие 4% артикаина, что, в свою очередь, приводит к быстрой резорбции местноанестезирующего раствора из тканей на месте инъекции и снижению длительности и глубины обезболивания твердых тканей зуба.
Метод обезболивания 4% артикаином с уменьшенной в 2 раза концентрацией адреналина (1:400 ООО) в сочетании с клонидином (1:100 ООО), наряду с нормальными показателями гемодинамики, также характеризовался недостаточной эффективностью обезболивания для проведения депульпирования зубов, что подтверждалось данными ЭОД и ВАШ, которые занимали промежуточное положение между результатами групп 1 и 3 с одной стороны и группы 2-е другой. В то же время процесс лечения кариеса дентина у большинства пациентов группы 4 не вызывал какого-либо дискомфорта.
Следует отметить, что в случае неэффективного обезболивания у 2-х пациентов из группы 2 и у 2-х пациентов из группы 4 при лечении хронического пульпита либо его обострения была проведена дополнительная инъекция 1,7 мл стандартной карпулы 4% артикаина с адреналином (1:200 000), так как недостаточная эффективность обезболивания нами была расценена как результат слабовыраженного вазоконстрикторного эффекта применяемых растворов. Это позволило нам провести безболезненные манипуляции и завершить лечение этих пациентов. При этом выявлено, что наряду с существенным углублением обезболивающего эффекта (ВАШ 1,9 в 1-ой группе и 1,5 в 4-ой) ни у одного пациента нами не было зарегистрировано изменений вегетативных показателей, аналогичных данным у пациентов 1 группы. При этом необходимо учитывать, что пациентам 4-ой
При этом выявлено, что наряду с существенным углублением обезболивающего эффекта (ВАШ 1,9 в 1-ой группе и 1,5 в 4-ой) ни у одного пациента нами не было зарегистрировано изменений вегетативных показателей, аналогичных данным у пациентов 1 группы. При этом необходимо учитывать, что пациентам 4-ой
группы ранее был введен адреналин, таким образом, пациенты получали суммарную дозу адреналина в 1,5 раза большую, чем пациенты 1 группы. Это объясняется тем, что введенный при первой инъекции клонидин обеспечил даже в минимальной дозе (20 мкг) мощное вегетопротекторное действие на ВНС пациента, что доказывает центральное а2-адреномиметическое действие клонидина.
И, наконец, в третьей группе отмечена высокая эффективность обезболивания на фоне стабильных показателей гемодинамики. При этом лечение хронических форм пульпита даже в стадии обострения сопровождалось безболезненностью и отсутствием изменений параметров адаптации.
Полученные данные свидетельствуют в пользу наличия комбинированного антагонистического и синергического действия при одновременном применении клонидина и адреналина, с одной стороны замедляющего поступление адреналина в системный кровоток, а с другой — способствующего более длительному присутствию в тканях и анестетика, пролонгируя, таким образом, его эффекты. Это обеспечивает адекватное обезболивание у детей 13-16 лет при стоматологических вмешательствах по поводу лечения пульпита и кариеса зубов, что, в свою очередь, обеспечивает повышение эффективности и качества лечебно-диагностического процесса в целом.
Это обеспечивает адекватное обезболивание у детей 13-16 лет при стоматологических вмешательствах по поводу лечения пульпита и кариеса зубов, что, в свою очередь, обеспечивает повышение эффективности и качества лечебно-диагностического процесса в целом.
Таким образом, в результате проведенного исследования можно сделать следующие выводы.
ВЫВОДЫ
1. Местное обезболивание 4% артикаином с адреналином (1:200 000) повышает среднее значение ЭОД до 164,3±14,1 мкА во время вмешательства, что, в свою очередь, обеспечивает безболезненное его проведение на твердых тканях зуба, однако это сопровождается статистически достоверными волнообразными изменениями показателей гемодинамики (повышение САД, ДАД и сАД и ЧСС), что объясняется системным действием адреналина, что может привести к развитию соматических осложнений, особенно у пациентов детского возраста.
2. Замена адреналина на клонидин в местноанестезирующем растворе 4% артикаина приводит к нормализации гемодинамических показателей, однако эффективность обезболивания была недостаточной, что подтверждалось данными ЭОД и ВАШ.
3. Добавление клонидина в местноанестезирующий раствор 4% артикаина с адреналином 1:200 ООО обеспечивает эффективное обезболивание по данным ЭОД и ВАШ на фоне стабилизации показателей гемодинамики и стресс-реактивности.
4. Снижение концентрации адреналина до 1:400 ООО в 4% растворе артикаина с клонидином 1:100 ООО обеспечивает стабилизацию гемодинамических показателей, однако не сопровождается достаточной глубиной обезболивания по данным ЭОД и ВАШ и клиническим проявлениям, что позволяет использовать этот метод при лечении кариеса дентина, но не пульпита.
5. Местное обезболивание 4% артикаином с адреналином (1:200 000) и клонидином (1:100 000) у детей 13-16 лет характеризуется статистически достоверной стабильностью изучаемых вегетативных показателей, по сравнению с данными пациентов, которым был применен 4% артикаин с адреналином (1: 200 000), что подтверждается уменьшением в 1,2 раза фазного изменения гемодинамических параметров. При снижении дозы адреналина в растворе до 1:400 000, фазных изменений гемодинамических параметров в присутствии клонидина (1:100 000) также не зарегистрировано.
6. Комбинированное обезболивание, включающее 4% артикаин, адреналин (1:200 000) и клонидин (1:100 000) при проведении местной анестезии у детей 13-16 лет характеризуется достоверно в 1,14 раз лучшими показателями адаптации по сравнению данными измерений, проведенными у пациентов без включения в анестезирующий раствор клонидина.
7. Добавление клонидина (1:100 000) к местноанестезирующему раствору 4% артикаина с адреналином 1:200 000 обеспечивает пролонгирование обезболивающего эффекта, а также снижение степени болезненности вмешательства в 1,3 раза и увеличение глубины обезболивания по данным ЭОД в 1,2 раза.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. В случае принятия решения о применении комбинированного обезболивания, включающего 4% артикаин и клонидин1:100000, при лечении кариеса дентина у детей 13-16 лет, доза адреналина может быть уменьшена (до 1:400 000).
2. При недостаточной эффективности предшествующего обезболивания с помощью общепринятых методов анестезии, следует рассмотреть вопрос о возможном применении комбинированного обезболивания, включающего 4% артикаин, адреналин (1:200 000) и клонидин (1:100 000) у детей 13-16 лет независимо от степени выраженности воспалительного процесса (кариес дентина или пульпит).
3. При необходимости дополнительных инъекций, после ранее проведенной анестезии 4% артикаином с адреналином (1:200 000) и клонидином (1:100 000), отсутствует необходимость добавления к обычному местнообезболивающему препарату раствора клонидина.
Список работ, опубликованных по теме диссертации:
1. Мельникова A.B., Шугайлов И.А. Влияние местного обезболивания артикаином в сочетании с адреналином и клонидином на состояние сердечно-сосудистой системы детей старшего возраста в стоматологической практике // Стоматология для всех / International Dental Review.- 2014. -№ 1. — С. 16-20.
2. Мельникова A.B., Миленин В.В, Шугайлов H.A. Определение степени адаптации пациента к стрессовой ситуации в детской стоматологической практике // Стоматология для всех / International Dental Review.- 2014. — № 1. — С. 22-24.
3. Мельникова A.B., Шугайлов И.А., Гарус Я.Н. Оценка эффективности местного обезболивания твердых тканей зуба артикаинсодержащим препаратом в сочетании с адреналином и клонидином в детской стоматологической практике // Стоматология,- 2014. — № 2. — С. 43-46.
— № 2. — С. 43-46.
4. Мельникова A.B., Шугайлов И.А. Применение клонидина в сочетании с артикаином и адреналином для обезболивания твердых тканей зуба в детской стоматологической практике //
Стоматология для всех / International Dental Review.- 2014. -№ 2. — С. 26-30.
5. Мельникова A.B., Шугайлов И.А Клинико-физиологическое обоснование применения клонидина в сочетании с артикаином и адреналином для местного обезболивания в детской стоматологической практике // Стоматология.- 2014. -№ 3.- С. 48-52.
Список сокращений:
АД — артериальное давление
ВАШ — визуальная аналоговая шкала
вне — вегетативная нервная система
ДАД — диастолическое артериальное давление
ИН — индекс напряжения по P.M. Баевскому
НПА — начало пульпарной анальгезии
ППА — период пульпарной анальгезии
ПО — продолжительность обезболивания
САД — систолическое артериальное давление
сАД — среднее артериальное давление
ССС — сердечно-сосудистая система
ЦНС — центральная нервная система
чсс — частота сердечных сокращений
шке — шкала клиническая стоматологическая
ЭКГ — электрокардиограмма
эод -электроодонтодиагностика
эо — эффективное обезболивание
HF — (High Frequency) высокочастотные короткие волны
LF — (Low Frequency) низкочастотные волны, средней длины
Sp02 — степень насыщения гемоглобина кислородом
в артериальной крови
Отпечатано в типографии АОЗТ — фирма «Русские», 143500, г. Истра, Московская обл., ул. Адасько, 2, тел.: 8 (495) 989-66-49, 8 (49831) 5-00-76, e-mail: [email protected], зак. 123-15, тир. 100 экз.
Истра, Московская обл., ул. Адасько, 2, тел.: 8 (495) 989-66-49, 8 (49831) 5-00-76, e-mail: [email protected], зак. 123-15, тир. 100 экз.
Хирургическая стоматология и ЧЛХ
Применение костного блока BIO-OST при хирургическом лечении заболеваний пародонта
Л.А. Ананьева
ГБОУ ВПО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России, Москва, Россия
На хирургическом этапе лечения заболеваний пародонта для устранения вертикальных костных дефектов применяются остеопластические материалы, применение которых основывается на их остеоиндуктивных и остеокондуктивных свойствах.
Остеоиндуктивные материалы способны стимулировать костные недифференцированные мезенхимальные клетки к делению, дифференцированию и секреции (синтезу новой костной ткани).
Остеокондуктивные материалы биоинертны и биоактивны, структура и размер их пор способствуют врастанию ткани и аппозиционному росту. Такие материалы должны полностью резорбироваться и замещаться новообразованной костной тканью.
Такие материалы должны полностью резорбироваться и замещаться новообразованной костной тканью.
Как наиболее доступные и простые в применении при хирургическом восстановлении вертикальных костных дефектов используются ксеногенные остеопластические материалы.
Новым представителем ксеногенных остеопластических биокомпозитных материалов является матрикс остеоплатический Bio-Ost с фоновой остеоиндукцией (Регистрационное удостоверение №РЗН201/3086. Декларация соответствия № 044532).
Фоновая остеоиндукция обеспечивается введением в его состав рекомбинантного костного морфогенетического белка rhBmp-2.
Деминерализованный костный матрикс, изготовленный на основе губчатого слоя ксеногенной кости и содержащий рекомбинантный белковый остеоинд фуктор (rhВМР-2), стимулирует интенсивное образование кровяного сгустка и служит трехмерной матричной структурой для роста соединительной ткани, перестраивающейся в процессе регенерации во вновь образованную костную ткань.
Bio-Ost выпускается в следующих формах: гранулы из губчатого или кортикального слоя, губчатые и кортикальные блоки.
Рассмотрим клинический пример использования костного блока Bio-Ost 10×10×10 мм при хирургическом лечении пародонтальной кисты в области зубов 4.1—4.2.
Объективно в области 3.1—4.1 определяется пародонтальный карман глубиной более 10 мм. На внутриротовой контактной рентгенограмме: резорбция костной ткани более чем на 1/3 длины корней зубов в области 3.1—4.1, кортикальная пластинка отсутствует.
Диагноз: К 04.8 (корневая киста).
Ход операции. Под аппликационной Lidoxor и инфильтрационной анестезией Sol. Articaini 4% — 1,7 мл в области зубов 3.2—4.2 произведен внутрибороздковый и сосочкосохраняющий разрез в области 3.1—4.1 и два вертикальных разреза до переходной складки. Отслоен полнослойный слизисто-надкостничный лоскут. Удалена пародонтальная киста в области 3.1, 4.1. Рутпленинг в области 4.2, 4.1, 3.1, 3.2. Аппликация на поверхность корней зубов 4. 2, 4.1, 3.1, 3.2 17% раствора ЭДТА на 1 мин, обильная ирригация физиологическим раствором. Костный блок Bio-Ost подготовлен. Лоскут иммобилизирован. Bio-Ost введен на подготовленную раневую поверхность, уплотнен без чрезмерного давления. Лоскут уложен на место и зафиксирован обвивными и узловыми швами Prolene 6−0. Холод местно. Даны рекомендации.
2, 4.1, 3.1, 3.2 17% раствора ЭДТА на 1 мин, обильная ирригация физиологическим раствором. Костный блок Bio-Ost подготовлен. Лоскут иммобилизирован. Bio-Ost введен на подготовленную раневую поверхность, уплотнен без чрезмерного давления. Лоскут уложен на место и зафиксирован обвивными и узловыми швами Prolene 6−0. Холод местно. Даны рекомендации.
Изменения гемомикроциркуляции пульпы интактных зубов при проведении местного обезболивания 4% раствором артикаина с различным содержанием эпинефрина
Е.Н. Анисимова, С.Н. Ермольев, Л.В. Першина
ГБОУ ВПО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России, Москва, Россия
Успешное освоение и внедрение новых технологий в стоматологии возможно только в условиях комфорта для пациента [1]. Этого можно достичь при использовании местного обезболивания, эффективность и безопасность которого зависит от применения современных местнообезболивающих средств — препарата на основе 4% артикаина, который расширяет сосуды и используется с вазоконстриктором эпинефрином в различных концентрациях (1:100 000; 1:200 000 и 1:400 000) [2]. Однако использование высокой концентрации эпинефрина (1:100 000) при любом способе введения создает эффект ишемизации тканей в зоне инъекции, что может приводить к местным осложнениям [3, 4]. Регистрация изменений гемомикроциркуляции проводится с помощью лазерной допплеровской флоуметрии [5].
Цель — изучение динамики микроциркуляции пульпы интактных зубов при проведении местного обезболивания 4% раствором артикаина с различным содержанием эпинефрина, введенного различными способами.
Материал и методы. Клинические исследования проводились на базе кафедры обезболивания в стоматологии ГБУ ВПО МГМСУ. Обследованы 105 человек, из них 80 женщин и 25 мужчин в возрасте от 20 до 60 лет без выраженной сопутствующей патологии, которым проводилось обезболивание 108 интактных зубов без патологии пародонта 4% раствором артикаина без вазоконстриктора и с различным его содержанием (1:100 000; 1:200 000; 1:400 000) инфильтрационным, интралигаментарным и модифицированным пародонтальным [5] способами введения. Для проведения флоуметрии использовали компьютеризированный лазерный анализатор капиллярного кровотока ЛАКК-02 (Москва). Критериями оценки микроциркуляции являлись: М — показатель микроциркуляции, δ —среднее квадратическое отклонение и Kv — коэффициент вариации. Регистрацию показателей ЛДФ-грамм проводили до введения анестетика и через 5, 10, 15, 30 и 60 мин.
Результаты. Регистрация динамики микроциркуляции пульпы интактных зубов без патологии пародонта при инфильтрации 4% раствором артикаина без эпинефрина показала снижение ее уровня через 5 мин на 5,3%, через 10 мин на 18,7%, через 15 мин на 29,7%, через 30 мин на 26,1%. К 60-й минуте уровень кровотока превысил начальные значения на 6,6%. Вазомоторная активность повышалась через 5 мин на 35,6%, через 10 мин на 52,2%, через 15 мин на 71,2%, через 30 мин на 87,7%, через 60 мин на 71%. Интенсивность кровотока превысила исходные показатели: до 10 мин на 58,3%, к 15-й минуте на 76,7%, к 30-й минуте на 88,8%, к 60-й минуте на 72,2%. При введении вазоконстриктора в состав местного анестетика в концентрации 1:400 000 показатель микроциркуляции был снижен на 7,5% к 5-й минуте, на 30,2% к 10-й минуте, на 14,2% к 15-й минуте, на 8,1% к 30-й минуте, к 60-й минуте на 0,1%. Вазомоторная активность увеличивалась сразу: к 5-й минуте на 69,6%, на 30,5% к 10-й минуте, 48,4% к 15-й минуте, 61,2% к 30-й минуте, 27,5% к 60-й минуте. Интенсивность кровотока увеличивалась к 5-й минуте на 66,7%, возвращаясь к начальному значению к 10-й минуте, затем происходило повышение на 38,1% к 15-й минуте, на 56,7% к 30-й минуте и на 23,5% к 60-й минуте. При содержании эпинефрина 1:200 000 в анестетике уровень микроциркуляции снижался на 26,9% к 5-й минуте, к 10-й минуте на 35,8%, к 15-й минуте на 20,5%. К 30-й минуте показатель достигал начального уровня, превышая его на 6,3% к 60-й минуте исследования. Колеблемость потока эритроцитов и вазомоторная активность возрастали на 22,7 и 43,7% к 5-й минуте соответственно, к 10-й минуте — на 5,9 и 32,6%, к 15-й минуте — на 37,0 и 64,8%, на 41,4 и 38,6% к 30-й минуте, на 50 и 50,4% показатели были увеличены к 60-й минуте. На 15-й минуте восстанавливалась интенсивность кровотока, снижаясь на 1%, вазомоторная активность оставалась повышенной на 29%. При введении 4% артикаина с вазоконстриктором 1:100 000 уровень капиллярного кровотока снижался: на 1,7% к 5-й минуте, на 27,2% к 10-й минуте, на 65,7% к 15-й минуте, к 30-й на 39,4%, к 60-й минуте на 6%. Вазомоторная активность к 5-й минуте повышалась на 56,9%, к 10-й минуте на 36,3%, к 15-й минуте на 28,8%, к 30-й минуте на 49%, к 60-й минуте на 79,2%. Интенсивность кровотока возрастала на 41,4% к 5-й минуте, к 10-й минуте на 34,6%, к 15-й минуте на 5,9%, на 30-й минуте на 34,6%, к 60-й минуте на 39,3%.
При введении 4% раствора артикаина без эпинефрина модифицированным пародонтальным способом в области интактных нижнечелюстных моляров без патологии пародонта показатель микроциркуляции к 5-й минуте снижается на 11,4%, к 10-й минуте на 34%, к 15-й минуте на 31,1%, к 30-й минуте на 20,3%, к 60-й минуте превышает исходный уровень на 0,8%. Колеблемость потока эритроцитов в первые 5 мин была снижена на 4,2%, к 10-й минуте оставалась прежней, повышалась на 15-й минуте на 44,2%, к 30-й минуте на 73%, к 60-й минуте на 27,2%. Вазомоторная активность увеличивалась на 6,4% через 5 мин, на 23,8% через 10 мин, на 55,4% через 15 мин, через 30 мин на 80,5%, и на 24,7% через 60 мин. При добавлении эпинефрина в концентрации 1:400 000 в раствор 4% артикаина к 5-й минуте уровень микроциркуляции снижался на 25,1%, к 10-й минуте на 27,2%, к 15-й минуте на 32,7%, к 30-й минуте на 36,4%, к 60-й минуте был выше исходного на 1,2%. Вазомоторная активность возрастала к 5-й минуте на 39,2%, к 10-й минуте на 55,9%, к 15-й минуте на 49,6%, к 30-й минуте на 33,5%, к 60-й минуте на 17%, колеблемость потока эритроцитов повышалась на 20% к 5-й минуте, на 40% к 15-й минуте, на 25% восстанавливаясь к 30-й минуте, превышая исходные на 7,7% к 60-й минуте исследования. При содержании эпинефрина 1:200 000 в анестетике уровень микроциркуляции снижается к 5-й минуте на 59,1%, к 10-й минуте на 49%, к 15-й минуте на 48,8%, к 30-й минуте на 12,8%, к 60-й минуте превосходит начальный уровень на 4,0%. Вазомоторная активность снижается на 56,5% через 5 мин, на 57,6% через 10 мин, на 23,4% через 15 мин, на 72,2% через 30 мин, выше начальных данных на 51,9% к 60-й минуте. Интенсивность кровотока к 5-й минуте снижается на 82,3%, к 10-й минуте на 79,0%, к 15-й минуте на 46,8%, к 30-й минуте на 75,8%, увеличиваясь на 52% к 60-й минуте. При использовании 4% артикаина с вазоконстриктором 1:100 000 снижение уровня микроциркуляции к 5-й минуте составляет 71,5%, к 10-й минуте на 42,4%, к 15-й минуте на 34,3%, к 30-й минуте на 18,6% и превышает начальные значения на 2,5% к 60-й минуте. Вазомоторная активность увеличивается к 5-й минуте на 40,5%, к 10-й минуте на 10,3%, к 15-й минуте на 37,5%, к 30-й минуте на 35,4% и на 45,3% к 60-й минуте. При этом колеблемость потока эритроцитов увеличивалась к 5-й минуте на 23,8%, к 10-й минуте на 5,9%, к 15-й минуте на 27,2%, к 30-й минуте на 37,5% и к 60-й минуте на 38,5%.
При проведении интралигаментарной анестезии 4% раствором артикаина без эпинефрина в области интактных зубов без патологии пародонта уровень капиллярного кровотока в пульпе через 5 мин снижается на 18,0%, через 10 мин на 11,4%, через 15 мин на 16,5%, через 30 мин на 18%, через 60 мин превышает исходные значения на 1,5%. При этом вазомоторная активность повышалась на 46% к 5-й минуте, к 10-й минуте на 15,1%, к 15-й минуте на 23,8%, к 30-й минуте на 3,2% и увеличивалась на 37,8% к 60-й минуте. Интенсивность кровотока повышалась на 35,7% в первые 5 мин, была повышенной на 10,0% до 15-й минуты, на 25,0% к 30-й минуте, на 40% к 60-й минуте.
При добавлении вазоконстриктора 1:400 000 уровень капиллярного кровотока снижался на 30,3% к 5-й минуте, на 19,6% к 10-й минуте, на 3,8% к 15-й минуте, на 1,6% к 30-й минуте, превосходил начальные данные на 16,4% к 60-й минуте. Вазомоторная активность снижалась на 16,5% к 5-й минуте, повышаясь на 0,8% к 10-й минуте, ниже исходных значений на 6,5% к 15-й минуте, увеличиваясь на 4,8 и 25,4% к 30-й и 60-й минуте соответственно. Интенсивность микроциркуляции снижалась на 10% к 5-й минуте, оставаясь сниженной к 10-й минуте, на 20% к 15-й минуте, возвращаясь к исходным значениям к 60-й минуте. При введении 4% раствора артикаина с эпинефрином 1:200 000 уровень микроциркуляции снижается к 5-й минуте на 51,3%, к 10-й минуте на 47,7%, к 15-й минуте на 45,1%, к 30-й минуте на 16,1%, превосходя исходный показатель на 17,6% к 60-й минуте. Вазомоторная активность снижалась на 27,3% к 5-й минуте, на 25,7% к 10-й минуте, на 23,3% к 15-й минуте, на 16,1%, превышая начальный показатель на 0,7% к 60-й минуте. Интенсивность микроциркуляции снижалась на 64,9% к 5-й минуте, на 62,2% к 10-й минуте, на 59,5% к 15-й минуте, на 32,4% к 30-й минуте и превосходила начальный показатель на 17,8% к 60-й минуте. При проведении интралигаментарной анестезии 4% раствором артикаина с содержанием вазоконстриктора 1:100 000 к 5-й минуте уровень капиллярного кровотока снизился на 83,7%, к 10-й минуте на 68%, к 15-й минуте на 89%, к 30-й минуте на 63,4%, к 60-й минуте на 5,5%. Вазомоторная активность снижалась к 5-й минуте на 66,4%, к 10-й минуте на 62,9%, к 15-й минуте на 88,1%, к 30-й минуте на 77,5%, превышая свои показатели на 6,4% к 60-й минуте. Интенсивность капиллярного кровотока увеличилась на 13,6%, далее происходило снижение показателей на 15,8% к 10-й минуте, на 10,5% к 15-й минуте, на 36,7% к 30-й минуте, превышая начальные показатели на 9,5% к 60-й минуте.
Вывод. Максимальное снижение показателей микроциркуляции при использовании инфильтрационного способа введения 4% артикаина составляет 29,7% от начальных данных, при введении вазоконстриктора в состав местного анестетика в концентрации 1:400 000 этот показатель уменьшается на 1,7%, при использовании концентрации эпинефрина 1:200 000 — на 36%, при разведении 1:100 000 — на 66%, по сравнению с препаратом без вазоконстриктора. К окончанию исследования при использовании 4% раствора артикаина без эпинефрина и в концентрации 1:400 000, 1:200 000 показатели микроциркуляции восстанавливаются, что является проявлением отсутствия ишемии пульпы. При использовании препарата с вазоконстриктором в разведении 1:100 000 не происходило полного восстановления уровня капиллярного кровотока, оставаясь сниженным на 6% к 60-й минуте исследования, что означает снижение скорости движения эритроцитов в микрососудах и содержании в них раствора анестетика.
Исследование модифицированной пародонтальной анестезии интактных зубов без патологии пародонта с применением 4% артикаина без эпинефрина выявляет максимальное снижение уровня микроциркуляции на 34%, при введении раствора 4% артикаина с концентрацией эпинефрина 1:400 000 — на 5,6%, при концентрации 1:20 000 — на 42,5%, концентрация эпинефрина 1:100 000 — на 54,7%, относительно 4% раствора артикаина без эпинефрина. К 60-й минуте исследования уровень микроциркуляции всех используемых препаратов превышает исходный уровень, что свидетельствует о компенсаторных механизмах в пульпе зуба.
При введении 4% раствора артикаина с концентрацией эпинефрина 1:400 000, интралигаментарным способом, уровень микроциркуляции снижается на 40,6%, при разведении вазоконстриктора 1:200 000 — на 64,7%, при концентрации 1:100 000 — на 79,8%, относительно препарата без вазоконстриктора, максимальный уровень снижения микроциркуляции которого составляет 18% от исходных данных. Показатели микроциркуляции возвращаются к исходному уровню, что является признаком восстановления капиллярного кровотока в пульпе зубов.
1. Анисимова Е.Н., Логинова Н.К., Ермольев С.Н., Букенгольц А.А., Олейникова Е.В. Функционально-диагностическая оценка эффективности местного обезболивания. Dental Forum. 2013;1.
2. Анисимова Е.Н., Рабинович С.А., Анисимова Н.Ю. Артикаин — все «За». Безопасность и эффективность использования 4% раствора артикаина с различной концентрацией эпинефрина. Новое в стоматологии. 2014;202 (6):62−65.
3. Ka¨mmerer PW, Kra¨mer N, Esch J, Pfau H, Uhlemann U, Piehlmeier L, Daubla¨nder M. Epinephrine-reduced articaine solution (1:400,000) in paediatric dentistry: a multicentre non-interventional clinical trial. Eur Arch Paediatr Dent. 2013;89−95.
4. Malamed SF. Local anesthesia: Pediatric Emergency Medicine. 13 International Dental Congress on Anesthesia, Sedation, And Pain Control Fairmont Orchid Resort- Kona, Hawaii February. 2012;1−40.
5. Логинова Н.К., Ермольев С.Н. Лазерная допплерография пульпы зуба. Методич. рек. ФГУ «ЦНИИС И ЧЛХ Росмедтехнологий». 2008;6−12.
Повышение эффективности обезболивания при оказании неотложной стоматологической помощи пациентам с артериальной гипертензией
Е.Н. Анисимова, И.В. Орехова, С.Т. Сохов
ГБОУ ВПО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России, Москва, Россия
Стоматологическая помощь является одной из наиболее востребованных медицинских услуг. Число лиц, обращающихся к стоматологу, непрерывно увеличивается, меняется возрастной состав пациентов. Так, в городских поликлиниках большинство пациентов, нуждающихся в стоматологическом вмешательстве, старше 65 лет, а распространенность артериальной гипертензии (АГ) в этой возрастной группе достигает 50—65% [1]. Больные с сопутствующей сердечно-сосудистой патологией имеют повышенный риск сосудистых осложнений при проведении местного обезболивания [2]. Вазоконстриктор, входящий в состав местнообезболивающего раствора, может вызвать обострение сопутствующего заболевания, однако эффективное обезболивание болезненных стоматологических вмешательств предусматривает его наличие в составе местнообезболивающего раствора [3]. Учитывая это, управление болью является серьезной проблемой для стоматологов при проведении местного обезболивания 3% раствором мепивакаина для оказании неотложной стоматологической помощи у пациентов с сопутствующей патологией. Для повышения эффективности местного обезболивания европейские коллеги регулярно назначают НПВС в качестве превентивной аналгезии [4]. Превентивная аналгезия — это антиноцицептивная терапия, которую назначают до вмешательства для предотвращения периферической и центральной сенсибилизации [5]. В отличие от наркотических анальгетиков и производных пиразолона, НПВС оказывают минимальное влияние на состояние системы кровообращения и дыхания, моторику желудочно-кишечного тракта, тонус сфинктеров и не имеют наркогенного потенциала. Механизм действия НПВП заключается в угнетении циклооксигеназы (ЦОГ), который отвечает за выработку различных биологически активных веществ: простагландинов, простациклинов, тромбоксана и др. Учитывая способность НПВС снижать уровень медиаторов воспаления, была выдвинута гипотеза, что превентивная аналгезия НПВС увеличивает эффективность местного обезболивания.
Цель исследования — повышение эффективности местного обезболивания 3% раствором мепивакаина с помощью превентивной аналгезии препаратами НПВС у пациентов с артериальной гипертензией на амбулаторном приеме при оказании неотложной стоматологической помощи.
Материал и методы. Нами обследованы 248 (149 женщин и 99 мужчин) пациентов в возрасте от 35 до 70 лет, обратившихся за неотложной стоматологической помощью (К04.0 Пульпит, К04.4 Острый апикальный периодонтит пульпарного происхождения, К04.7 периапикальный абсцесс без полости, К10.22 Острый периостит челюсти), с показателями артериального давления выше 140/90 мм рт.ст. Оценка эффективности местного обезболивания, проведенного 3% раствором мепивакаина различными способами и 3% раствором мепивакаина в сочетании с превентивной аналгезией препаратами НПВС проводилась с помощью визуально-аналоговой шкалы (ВАШ). Для превентивной аналгезии назначались препараты, максимальная концентрация в плазме крови которых достигается через 20—30 мин после применения. Стоматологическое вмешательство осуществлялось под непрерывным контролем АД и ЧСС с помощью прикроватного монитора Armed PC-9000B.
Результаты. Повышение эффективности местной анестезии отмечалось при использовании инфильтрационной анестезии на верхней челюсти при К04.0 Пульпит с 85,3 до 94,1%, при К04.4 Острый апикальный периодонтит пульпарного происхождения с 90,2 до 96,3%, при К04.7 Периапикальный абсцесс без полости с 87,4 до 95,5%, проводникового способа обезболивания у нижнечелюстного отверстия при К04.0 Пульпит с 80,3 до 91,1%, при К04.4 Острый апикальный периодонтит пульпарного происхождения с 84,2 до 93,3%, при К04.7 Периапикальный абсцесс без полости с 85,4 до 95,5%. При мониторировании гемодинамических показателей отклонений не выявлено. НПВП-гастеропатии, сердечной недостаточности от однократного приема НПВС не отмечалось.
Вывод. Результаты проведенного исследования подтверждают эффективность превентивной аналгезии НПВС для повышения эффективности местного обезболивания 3% раствором мепивакаина. Быстрый и длительный обезболивающий эффект, простота и удобство перорального приема в таблетированной форме, минимальный риск побочных реакций, альтернатива наркотическим анальгетикам и анальгину позволили рекомендовать нам НПВП в стоматологическую практику.
1. Douglass CW, Shanmugham JR. Primary care, the dental profession, and the prevalence of chronic diseases in the United States. Dent Clin North Am. 2012;56:699−730.
2. Skaar D, O’Connor H, Lunos S, Luepker R, Michalowicz BS. Dental pro- cedures and risk of experiencing a second vascular event in a Medicare population. J Am Dent Assoc. 2012;143 (11):1190−1198.
3. Анисимова Е.Н., Анисимова Н.Ю., Рабинович С.А. Артикаин — все «За». Безопасность и эффективность использования 4% раствора артикаина с различной концентрацией эпинефрина. Новое в стоматологии. 2014;202 (6):62−66.
4. Mickel AK, Wright AP, Chogle S, Jones JJ, Kantorovich I, Curd F. An analysis of current analgesic preferences for endodontic pain management. J Endod. 2006;32:1146−1154.
5. Березенко М.Н., Губайдуллин Р.Р., Онегин М.А. Применение превентивной аналгезии при тотальном эндопротезировании тазобедренного сустава снижает интенсивность боли в послеоперационном периоде. Справочник врача по общей практики. 2015;11−12:69−72.
Лечение детей с хроническим неспецифическим паренхиматозным паротитом
С.М. Базаева, О.З. Топольницкий, М.В. Смысленова, А.С. Клиновская
ГБОУ ВПО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России, Москва, Россия
Среди заболеваний больших слюнных желез у детей наиболее часто встречается воспалительное поражение околоушных слюнных желез — паротит, на долю которого приходится более 85% всех воспалительных заболеваний слюнных желез. Клиническое течение неспецифического паренхиматозного паротита может быть острым, хроническим и хроническим в стадии обострения.
Особенностью хронического паренхиматозного паротита является длительность и цикличность заболевания, проявляющаяся периодами обострения и ремиссии, при которых необходимо учитывать активное или неактивное течение воспаления (Г.Н. Москаленко, 2000).
Учитывая вышесказанное, целью нашего исследования явилась модификация схемы лечения детей с хроническим паренхиматозным паротитом в системе диспансерного наблюдения.
Цель исследования — разработать и внедрить в практическое здравоохранение модифицированную схему обследования и лечения детей с хроническим паренхиматозным паротитом в диспансерном режиме.
Данное исследование условно разделили на два этапа. На I этапе проводился ретроспективный анализ количества детей с хроническим неспецифическим паренхиматозным паротитом среди всех нозологических форм заболеваний у детей, находившихся на лечении с Центре стоматологии и ЧЛХ за 6 лет.
Нами был произведен анализ архивных данных за период с 1999 по 2006 г. для выявления количества пациентов с хроническим неспецифическим паренхиматозным паротитом. Общее количество посещений пациентов со всеми нозологическими формами стоматологических заболеваний составило 48 345 детей в возрасте от 1 нед до 16 лет. С хроническим неспецифическим паренхиматозным паротитом были обследованы и проводилось лечение у 2540 детей в возрасте от 1 года 2 мес до 16 лет, что составило 5,25% от общего количества обследованных в клинике детей.
Из общего количества находившихся на обследовании, лечении и диспансерном наблюдении детей с хроническим паренхиматозным паротитом большую часть по числу обращений составили мальчики — 1597 (63%), из них наибольшее количество обращений пришлось на возраст 12 лет (191 мальчиков) и 7 лет (156). Необходимо отметить группу детей в возрасте от 1 года до 2 лет — первично диагноз был установлен у 3 мальчиков (1 год 8 мес, 1 год 10 мес, 1 год 11 мес).
По архивным данным было проведено обследование и лечение 943 (37%) девочек в возрасте от 1 года до 16 лет с хроническим паренхиматозным паротитом. Наибольшее количество в данной группе составили девочки в возрасте 6 (147) и 7 (122) лет.
Таким образом, статистическая обработка архивных данных за 1999—2006 гг. выявила 5,25% детей с хроническим паренхиматозным паротитом от общего числа обратившихся пациентов. Количество обратившихся мальчиков составило 63% с наибольшей обращаемостью в возрасте 12 и 7 лет.
Результаты. В целях совершенствования современных методов диагностики и лечения детей с хроническим паренхиматозным паротитом мы провели обследование и лечение 105 детей, с данной патологией, в возрасте от 3 до 12 лет.
У 40% детей, направленных в клинику диагноз был поставлен относительно правильно, т. е. было установлено хроническое воспаление в околоушной слюнной железе. В 60% диагноз был установлен неточно, что говорит о недостаточности у врачей сведений о данном заболевании.
Все 105 детей были обследованы по следующей схеме: общеклиническое; ультразвуковое; рентгенологическое.
Ультразвуковое исследование околоушных слюнных желез проводилось в динамике воспалительного процесса для получения визуальной информации о состоянии стромы, васкуляризации, размеров околоушных слюнных желез. В процессе исследования выявляли увеличенные внутри- и внежелезистые лимфатические узлы.
Рентгенологическое исследование околоушных слюнных желез проводилось методикой контрастной сиалографии и ортопантомосиалографии с предварительным введением рентгеноконтрастного, водорастворимого вещества омнипак или йодолипол.
При этом контрастную рентгеносиалографию проводили в исключительно диагностических случаях с целью уточнения диагноза и как лечебно-профилактическую инстилляцию йодолиполом.
В период ремиссии, а также в процессе лечения и в период обострения всем пациентам проводилось эхографическое исследование, что позволило следить за динамикой развития заболевания.
Алгоритм диспансерного наблюдения, лечения и профилактики детей с хроническим паренхиматозным паротитом.
Нами предложена модифицированная систематизация заболевания, где в период обострения хронического паренхиматозного паротита выделяем активное или неактивное течение; период ремиссии — активное или неактивное течение.
При активном течении воспалительного процесса клинически четко проявлялось обострение хронического паренхиматозного паротита. Заболевание отличалось выраженной воспалительной реакцией околоушной слюнной железы. Продолжительность обострения в железе при активном течении составляла от 2—3 нед до 2 мес, количество обострений от 4 до 8 раз в год.
При неактивном течении обострение хронического паренхиматозного паротита протекало без выраженных местных и общих симптомов, с меньшим количеством обострений — от 1 до 3 раз в год, что не противоречит данным Г.Н. Москаленко (2010 г.).
Предлагаемая нами систематизация заболевания удобна для применения в практическом здравоохранении.
У 44 детей из исследуемой группы, с клинически активным течением процесса предъявляли жалобы на появление болезненной припухлости в околоушной области от 4 до 8 раз в год. С клинически неактивным протекающим процессом наблюдался 61 ребенок.
С целью исключения патологического процесса в области ветви, угла и тела нижней челюсти 19 больным, предъявляющим жалобы на резкую болезненность в околоушно-жевательной области, распространение инфильтрата на всю околоушную область, затрудненное и ограниченное открывание рта, проводили рентгенологическое исследование нижней челюсти. В двух случаях для исключения патологии (новообразования и патологии выводных протоков) проводилась спиральная КТ с контрастированием железы, однако данный метод имеет ограничение у детей. Нами установлено, что период ремиссии хронического паренхиматозного паротита составил: от 1 до 6 мес — 36 детей; от 6 мес до 1 года — 69 детей.
В период ремиссии проводилось эхографическое исследование, где было установлено: понижение эхогенности паренхимы железы; уплотнение капсулы околоушной слюнной железы; наличие единичных кистозных полостей размером до 0,3 см в диаметре; наличие увеличенных лимфатических узлов до 0,4 см, с ровными контурами, обычной эхогенности и эхоструктуры.
Эхографическое исследование околоушных слюнных желез, проводимое в период ремиссии заболевания, является объективным тестом для контроля качества лечения, позволяет отказаться от сиалографии и ортопантомосиалографии.
Наличие и характер следующих рентгенологических признаков: неравномерность изображения паренхимы железы, определение или прерывистость протоков I, II, III, IV, V порядков, наличие кистозных полостей размером от 0,3 до 5 мм зависит от деструктивных изменений в околоушной слюнной железе.
Лечение детей с хроническим паренхиматозным паротитом носило патогенетический и симптоматический характер и зависело от периода воспалительного процесса.
В период обострения хронического паренхиматозного паротита назначали необходимый комплекс процедур, способствующий стиханию острого воспалительного процесса. С этой целью нами был применен антигомотоксический препарат «Траумель С» наряду с антибиотиками (при t выше 38 °С).
При назначении гомеопатического препарата «Эхинацея компотизум СН», мы использовали его противовоспалительное, антибактериальное, аналгезирующее, дезинтоксикационное, иммуностимулирующее действия. Кроме того, для стихания воспалительного процесса в период обострения, 44 детям с активным течением воспалительного процесса назначали антибактериальную терапию.
Проводили противовоспалительную терапию медикаментами, а также физическими факторами.
Проводили инстилляцию протоков околоушной слюнной железы лекарственными веществами (ферменты).
Особое значение уделяли общеукрепляющему лечению и средствам, повышающим неспецифическую защиту организма.
В период ремиссии, при хроническом воспалении околоушных слюнных желез мы считали необходимым воздействовать на бактериальную флору, снижение продолжительности хронического воспаления: улучшение секреции слюны, способствующей выведению некротических масс, слущивающегося эпителия из протока; усиление регенеративной способности железы. Для этого в период ремиссии с целью предупреждения развития обострения назначали препараты «Траумель С», «Эхинацея композитум СН», поливитамины, витамин, А (в виде введения в проток околоушной железы), закаливание, санацию очагов хронической инфекции.
В результате после проведенного лечения перечисленные симптомы были менее выражены, чем при первичном обращении пациентов. Длительность периода обострения составляла 3—4 нед, после проведенного лечения сократилась от 1 до 2 нед. Уменьшилось также количество обострений. У 32 детей из 44 отмечен переход воспалительного процесса из активного течения в неактивное.
Учитывая продолжительность заболевания, сохранение патологических изменений в железе и необходимость в профилактической терапии в период ремиссии мы предлагаем алгоритм диспансерного наблюдения, лечения и профилактики детей с хроническим паренхиматозным паротитом.
Данная схема лечения позволяет получить стойкую ремиссию с максимальным исключением антибактериальных препаратов.
Анализ отдаленных клинических результатов дентальной имплантации по частоте воспалительных осложнений
Д.А. Бронштейн, Ю.А. Повстянко, Н.А. Узунян, Ф.Г. Шумаков, К.В. Шматов
ФГБОУ ДПО «Институт повышения квалификации ФМБА России», Москва, Россия
Публикации об отдаленных результатах дентальной имплантации в статистически достоверных масштабах наблюдений встречаются редко. Чаще всего оценка эффективности имплантации ограничивается сроком три—пять лет, хотя в профессиональной среде используется термин «пожизненная установка имплантатов», а в классических критериях дентальной имплантации (Smith, 1987) предусматривается неосложненное функционирование не менее 80,0% установленных имплантатов в течение 10 лет.
В то же время длительный опыт использования метода имплантации в крупных стоматологических клиниках и институтах дает возможность провести многосторонний анализ эффективности имплантации при сроке эксплуатации протезов на имплантатах не менее 10 лет. При этом возможно детальное выявление влияния разных условий функционирования имплантатов на результативность имплантации [1—6].
Цель исследования — провести анализ эффективности внутрикостной дентальной имплантации в отдаленные сроки 10 лет в зависимости от условий функционирования имплантатов.
Материал и методы. Проведен анализ результатов установки 4875 внутрикостных дентальных имплантатов у 1207 пациентов с частичной или полной потерей зубов (K08.1) по статистическим данным ряда клиник в Москве. Период анализа с момента установки имплантатов — 10 лет. Большинство пациентов не соблюдали периодичность диспансерных посещений.
Основными критериями неэффективности имплантации были: мукозит и периимплантит (дифференцированно с резорбцией на 1/3 и ½ длины имплантатов), а также удаление имплантата.
Результаты. Характеристика видов применяемой имплантации в разных клинических условиях при анализе за 10-летний период отражает частоту их использования в зависимости от общеизвестных знаний и эмпирического опыта врача, что в значительной степени отражает эффективность разных подходов к имплантации.
На верхней челюсти устанавливались 2894 имплантата, на нижней — 1981 (соответственно 59,4 и 40,6%). Клинические условия обусловливали более частую установку имплантатов в боковом отделе: 3251 (66,7%) имплантат против 1624 (33,3%) во фронтальном отделе. При полном отсутствии зубов установлены 2923 имплантата, при частичном — 1952 (соответственно 60 и 40%).
Среди установленных имплантатов 926 (19,0%) устанавливались непосредственно в лунку удаленного зуба, 533 (10,9%) имплантатов — в ранние сроки (спустя 1—3 мес) после удаления зуба, 1866 (38,3%) имплантатов — примерно через год после удаления зуба (после перестройки альвеолярной лунки), 1550 (31,8%) имплантатов устанавливались в разные сроки в перестроившуюся костную ткань не ранее, чем через год после удаления зуба. 903 (18,5%) имплантата устанавливались в тип костной ткани D1, 1087 (22,3%) — в костную ткань D2, 1926 (39,5%) — в D3, 959 (19,7%) — в D4.
Недостаточный объем костной ткани обусловливал необходимость использования остеопластических операций (1936 имплантатов, 39,7% от всех установленных имплантатов). В структуре остеопластических операций синус-лифтинг, направленная тканевая регенерация с мембранной техникой, пересадка костных блоков составляли соответственно 22,7, 52,4 и 24,9%.
В структуре размеров установленных имплантатов превалировали величины 10—13 мм: 8 мм — 5,7% (279 имплантатов), 10 мм — 33,5%, 11,5 мм — 36,5%, 13 мм — 22,5%, 15 мм — 1,8%. Среди установленных имплантатов с полированной шейкой было 3014 (61,8%), без полированной — 1861 (38,2%).
Мягкотканная пластика проводилась у 555 имплантатов, что составило 11,4% от всех установленных.
Среди конструкций протезов на имплантатах преимущественно использовались одиночные или объединенные искусственные коронки, а также мостовидные протезы (в основном с винтовой фиксацией).
При обобщении результатов дентальной имплантации спустя десять лет после установки 4875 внутрикостных имплантатов выявлено: наличие мукозита у 2173 (44,6%) имплантатов, периимплантит с резорбцией костной ткани не более 1/3 длины имплантата у 1016 (20,8%) имплантатов (с резорбцией до ½ длины у 489; 10,0%), удалены 248 (5,1%) имплантатов, состояние периимплантатных тканей без явлений воспаления и резорбции костной ткани у 949 (19,5%) имплантатов.
На нижней челюсти результаты имплантации были лучше в сравнении с верхней челюстью в связи с более благоприятной структурой костной ткани и несмотря на более лучшую гигиену вокруг верхних имплантатов. Так, на верхней челюсти удалены 5,7% имплантатов, на нижней — 4,2%; резорбция костной ткани на ½ и 1/3 длины имплантата на верхней челюсти наблюдалась соответственно у 11,5 и 24,2% имплантатов, на нижней соответственно у 7,8 и 15,9%; мукозит примерно с одинаковой частотой выявлялся на верхней и нижней челюстях — у 45,4% и 43,4%; нормальное состояние периимплантатных тканей у верхних имплантатов регистрировалось в 13,2% случаев, у нижних — в 28,7%.
Имплантация в боковом отделе челюстей давала большее количество осложнений в сравнении с фронтальным отделом, поскольку:
Articaine — обзор | ScienceDirect Topics
2.16.7 Местные анестетики
Наиболее часто используемые местные анестетики — это хлоропрокаин , лидокаин , бупивакаин и его левовращающий энантиомер , левовращающий энантиомер 0005000500050005, арбаинсаин 000500050006acaine 0005 мепивакаин , прилокаин , а также бензокаин и цинхокаин , которые используются только местно.Местные анестетики характеризуются различной продолжительностью действия, что, в свою очередь, приводит к различным показаниям к применению. Местные анестетики не остаются в месте введения, но абсорбируются в зависимости от места введения и кровоснабжения, а также достигают плода через кровь матери. Местные анестетики подавляют нервную проводимость за счет блокады натриевых каналов. Это может привести к характерным побочным эффектам при передозировке или случайной внутрисосудистой инъекции. Системная токсичность местных анестетиков хорошо коррелирует с их анестезирующим действием.Ранними признаками являются возбуждение центральной нервной системы или даже судороги, сердечно-сосудистая токсичность включает задержку проводимости и расширение сосудов. У беременных, получающих эпидуральную анестезию во время родов, частота системных токсических реакций на местные анестетики составляет 1% по сравнению с 0,2–0,3% у небеременных женщин. Добавление сосудосуживающих веществ, таких как адреналин / адреналин или норадреналин / норэпинефрин, может продлить действие местного анестетика и снизить уровень в крови за счет ограничения скорости системного всасывания.С другой стороны, увеличивается риск местных осложнений, таких как некроз тканей или гангрена. Метабисульфит , который добавляется к содержащим адреналин растворам местных анестетиков в качестве антиоксиданта, является нейротоксичным и подозревается как причина синдрома конского хвоста.
Однако местные анестетики обычно хорошо переносятся на всех сроках беременности. Похоже, что они не оказывают длительного воздействия на нейрофизиологию новорожденного. Никаких тератогенных повреждений после использования в первом триместре не наблюдалось.Следует соблюдать осторожность при анестезии половых органов, поскольку существует несколько сообщений о токсическом воздействии на новорожденных (см. Прилокаин, лидокаин).
Далее будут кратко представлены наиболее часто используемые местные анестетики.
Артикаин
Артикаин часто используется, в первую очередь в стоматологической медицине — также в сочетании с адреналином. Нет данных об эмбрио- или фетотоксических эффектах.
Бупивакаин
Бупивакаин часто используется в акушерстве.Он имеет сильный эффект и выраженные побочные эффекты со стороны центральной нервной системы и кардиотоксические эффекты, которые усиливаются во время беременности из-за прогестерона. Бупивакаин может вызвать феномен повторного входа, вызывающий желудочковую тахикардию и фибрилляцию. Уровень токсических эффектов был значительно снижен после того, как 0,75% бупивакаина было запрещено использовать в акушерских отделениях. Основное преимущество этого местного анестетика — длительный эффект (от 3 до 10 часов). Из-за высокого связывания с белками переход в плаценту ограничен по сравнению с лидокаином, сообщалось о переносе через плаценту 32% для R- и S-энантиомеров (de Barros Duarte 2011).
Лидокаин
Лидокаин является наиболее часто используемым местным анестетиком. Благодаря низкому значению pH (7,7–7,8) он быстро действует и легко проникает через плаценту. Сообщалось о переносе 60% лидокаина и его метаболитов через плаценту (de Barros Duarte 2011). О негативном влиянии на беременность не известно. В исследовании с участием более 1200 беременных женщин не было обнаружено увеличения частоты врожденных пороков развития (Heinonen 1977). Лидокаин также используется в акушерстве для перидуральной анестезии.Он облегчает родовые боли, не влияя существенно на силу схваток или сотрудничество роженицы. Сообщалось об одном случае системной токсичности лидокаина у новорожденного после анестезии половых органов матери (Bozynski 1987). Изменения вызванного потенциала ствола мозга (Bozynski, 1989) и нарушения регуляции температуры с гипертермией наблюдались после нескольких часов эпидуральной анальгезии (Macaulay 1992). В некоторых исследованиях эпидуральная анестезия была связана с изменениями в поведении новорожденных, которые, однако, были редкими и временными (Decocq 1997, Fernando 1997).
Прилокаин
Прилокаин используется для инфильтрационной и индукционной анестезии, а также в сочетании с лидокаином для поверхностной анестезии. Обладая сравнительно ограниченной системной токсичностью, один из его метаболитов, o -толуидин, является токсичным генератором метгемоглобина. В частности, после анестезии половых органов в акушерстве было несколько сообщений о случаях метгемоглобинемии у новорожденных (Uslu 2013, Heber 1995, Hrgovic 1990). Другое исследование не обнаружило повышенных значений метгемоглобина у матерей и лишь минимально повышенных уровней у новорожденных.Из 17 женщин, которым была проведена анестезия половых органов с дозой прилокаина, ограниченной 200 мг, ни у одной из них не развилась симптоматическая метгемоглобинемия (Kirschbaum 1991). Обзор литературы по метгемоглобинемии, вызванной местными анестетиками, показал более высокий риск при использовании прилокаина и бензокаина, чем при использовании других местных анестетиков (Guay 2009).
Ропивакаин
Ропивакаин — местный анестетик амидного типа. Его фармакокинетические и фармакодинамические свойства сравнимы с бупивакаином, но с меньшей сердечно-сосудистой токсичностью и анестезирующим потенциалом, который примерно на 30% ниже.Предпочтительная сенсорная блокада более выражена, чем при применении бупивакаина. Тем не менее, не было продемонстрировано никаких преимуществ ропивакаина по сравнению с бупивакаином в отношении моторных блокад (которые могут потребовать инструментального родоразрешения) с таким же обезболивающим качеством (Eddleston 1996). Токсические побочные эффекты и побочные эффекты со стороны центральной нервной системы возникают при приеме ропивакаина по сравнению с бупивакаином только при более высоком общем количестве вводимого местного анестетика (Santos 1995).
Комбинация местных анестетиков с другими активными веществами
Добавление опиатов к местным анестетикам, вводимым эпидурально, дает преимущества более быстрого начала действия, улучшенного обезболивания и снижения дозы местных анестетиков.Тем самым снижается частота моторных блокад и инструментальных родов. При эпидуральной или спинальной анестезии предпочтительны липофильные опиаты, такие как суфентанил, и фентанил, поскольку они быстро поглощаются в месте введения и имеют лишь ограниченные побочные эффекты. Риск угнетения дыхания снижается за счет более короткого периода удержания ликвора. Другие побочные эффекты, связанные с опиатами, такие как тошнота, рвота и зуд, возникают реже (Gogarten 1997). Липофильные опиаты, такие как суфентанил, легче всасываются в сосудистую систему и могут быть обнаружены в значительных концентрациях в плазме.По сравнению с фентанилом, суфентанил обеспечивает более эффективное обезболивание и меньше накапливается у новорожденных, несмотря на доказанный прохождение через плаценту (Loftus 1995). Суфентанил 30 мкг, введенный в эпидуральное пространство, не привел к клинически значимым неонатальным нарушениям (глава 2.1). Недавнее исследование «случай-контроль» с участием 206 новорожденных с респираторным дистресс-синдромом и 206 детей из контрольной группы выявило положительную связь между воздействием эпидуральной анальгезии у матери и респираторным дистресс-синдромом в ближайшем неонатальном периоде у новорожденных ≥34 недель гестации (Kumar 2014).Неясно, является ли это эффектом фентанила, вводимого эпидурально, эпидуральной анестезии как таковой или остаточным вмешательством. Дозы лекарств в статье не приводятся. Вопрос о том, оказывает ли эпидуральное введение фентанила эпидурально во время родов или сама эпидуральная анестезия отрицательно на начало грудного вскармливания или продолжительность грудного вскармливания, является спорным (Reynolds 2010) (сравните также главу 4.1). Как отмечает Сабо (2013) в своем всеобъемлющем обзоре, обсуждение ограничивается недостатками исследования, такими как отсутствие рандомизации или контроля для потенциальных смешивающих переменных.
Добавление клонидина к местным анестетикам, вводимым эпидурально, снижает потребность в местных анестетиках с лучшим обезболиванием и меньшим количеством побочных эффектов, связанных с опиатами, таких как, например, зуд (Wallet 2010). В группе, получавшей клонидин, показатели артериального давления были ниже во время лечения, но никаких терапевтических мер не потребовалось. Девандре (2008) обнаружил сопоставимое снижение минимальной концентрации местного анестетика при добавлении 5 мкг суфентанила, а также 75 мкг клонидина до 0.2% ропивакаин в виде болюса. Однако клонидин не рекомендовался для рутинного использования из-за учащения случаев гипотонии (Dewandre 2010). В рандомизированном двойном слепом исследовании, сравнивающем исследуемый раствор низкоконцентрированного левобупивакаина и суфентанила с добавлением клонидина или без него для контролируемой пациентом эпидуральной анестезии, Базин (2011) обнаружил лучший контроль боли в родах при добавлении клонидина. В группе клонидина артериальное давление было ниже, а частота инструментальных родов выше без разницы в исходе для плода.
Рекомендация
Местные анестетики могут использоваться во время беременности для инфильтрационной и проводниковой анестезии. Это касается и препаратов с добавкой адреналина. Вещества выбора — это, например, бупивакаин в акушерстве и артикаин в стоматологии. Следует избегать приема прилокаина из-за сравнительно высокого риска метгемоглобинемии, особенно когда он используется для анестезии половых органов непосредственно перед родами. Мепивакаин следует использовать только тогда, когда нельзя использовать другие местные анестетики.При добавлении клонидина к эпидуральной инфузии кровяное давление необходимо контролировать еще более тщательно.
Увеличивает ли артикаин, а не лидокаин, риск повреждения нервов при блокаде нижних альвеолярных нервов у пациентов, подвергающихся местной анестезии при стоматологическом лечении? Мини-систематический обзор литературы
Renton T. Хирургия полости рта: часть 4. Сведение к минимуму и лечение нервных травм и других осложнений. Br Dent J 2013; 215 : 393–399.
Артикул Google Scholar
Брандт Р.Г., Андерсон П.Ф., Макдональд Н.Дж., Сон В., Питерс М.К. Эффективность анестезии пульпы артикаина по сравнению с лидокаином в стоматологии: метаанализ. J Am Dent Assoc 2011; 142 : 493–504.
Артикул Google Scholar
Су Н, Ли Ц, Ван Х, Шен Дж, Лю В., Коу Л. Эффективность и безопасность артикаина по сравнению с лидокаином при лечении необратимого пульпита: систематический обзор и метаанализ рандомизированных контролируемых исследований. Aust Endod J 2016; 42 : 4–15.
Артикул Google Scholar
Маламед С. Ф., Ганьон С., Леблан Д. Эффективность артикаина: новый амидный местный анестетик. J Am Dent Assoc 2000; 131 : 635–642.
Артикул Google Scholar
Пауэлл В. Артикаин превосходит лидокаин в обеспечении пульпарной анестезии. J Am Dent Assoc 2012; 143 : 897–898.
Артикул Google Scholar
Пакстон К., Том Д. Э. Эффективность составов артикаина: количественные обзоры. Dent Clin North Am 2010; 54 : 643–653.
Артикул Google Scholar
Haase A, Reader A, Nusstein J, Beck M, Барабан M. Сравнение анестезирующей эффективности артикаина и лидокаина в качестве дополнительной буккальной инфильтрации первого моляра нижней челюсти после блокады нижнего альвеолярного нерва. J Am Dent Assoc 2008: 139 : 1228–1235.
Артикул Google Scholar
Канаа М. Д., Уитворт Дж. М., Мичан Дж. Сравнение эффективности 4% артикаина с адреналином 1: 100 000 и 2% лидокаина с адреналином 1: 80 000 в достижении анестезии пульпы на зубах верхней челюсти с необратимым пульпитом. J Endod 2012; 38 : 279–282.
Артикул Google Scholar
Бартлетт Дж., Мансур Дж.Артикаиновая буккальная инфильтрация и лидокаиновая нижняя зубная блокада — обзор литературы. Br Dent J 2016; 220 : 117–120.
Артикул Google Scholar
Япп К. Э., Хопкрафт М. С., Парашос П. Артикаин: обзор литературы. Br Dent J 2011; 210 : 323–329.
Артикул PubMed PubMed Central Google Scholar
Costa C G, Tortamano I P, Rocha R G, Francischone C. E, Tortamano N.Периоды начала и продолжительности приема артикаина и лидокаина при инфильтрации верхней челюсти. Quintessence Int 2005; 36 : 197–201.
PubMed PubMed Central Google Scholar
Катяль В. Эффективность и безопасность артикаина по сравнению с лигнокаином в стоматологическом лечении: метаанализ. J Dent 2010; 38 : 307–317.
Артикул PubMed PubMed Central Google Scholar
Srinivasan N, Kavitha M, Loganathan C S, Padmini G.Сравнение анестезирующей эффективности 4% артикаина и 2% лидокаина при челюстно-буккальной инфильтрации у пациентов с необратимым пульпитом. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2009; 107 : 133–136.
Артикул PubMed PubMed Central Google Scholar
Робертсон Д., Нуссштейн Дж., Ридер А, Бек М., Маккартни М. Анестезирующая эффективность артикаина при буккальной инфильтрации задних зубов нижней челюсти. J Am Dent Assoc 2007; 138 : 1104–1112.
Артикул PubMed PubMed Central Google Scholar
Дараваде Д. А., Кумар С., Будхираджа С., Миттал М., Мехта Т. Н.. Клиническое исследование эффективности 4% гидрохлорида артикаина по сравнению с 2% гидрохлоридом лигнокаина в стоматологии. J Int Oral Health 2014; 6 : 81–83.
PubMed PubMed Central Google Scholar
Балто К.Введение артикаиновой анестезии может привести к более сильной пульпарной анестезии по сравнению с лидокаином у взрослых пациентов. J Evid Based Dent Pract 2011; 11 : 183–184.
Артикул PubMed PubMed Central Google Scholar
Хаас Д. А., Леннон Д. 21-летнее ретроспективное исследование сообщений о парестезии после местного анестетика. J Can Dent Assoc 1995; 61 : 319–320, 323–326, 329–330.
PubMed PubMed Central Google Scholar
Hillerup S, Jensen R. Повреждение нерва, вызванное блокадой нижней челюсти. Int J Oral Maxillofac Surg 2006; 35 : 437–443.
Артикул PubMed PubMed Central Google Scholar
Маламед С. Ф., Ганьон С., Леблан Д. Артикаина гидрохлорид: исследование безопасности нового местного анестетика амида. J Am Dent Assoc 2001; 132 : 177–185.
Артикул PubMed PubMed Central Google Scholar
Погрель М. А. Постоянное повреждение нервов из-за блокады нижних альвеолярных нервов: актуальное обновление. J Calif Dent Assoc 2012; 40 : 795–797.
PubMed PubMed Central Google Scholar
Гриффитс П.Практика информирования о доказательствах: представляем мини-обзор. Br J Общественные медсестры 2002; 7 : 38–39.
Артикул PubMed PubMed Central Google Scholar
Петрисор Б. А, Китинг Дж., Шемич Э. Оценка доказательств: уровни доказательности и степени рекомендации. Травма 2006; 37 : 321–327.
Артикул PubMed PubMed Central Google Scholar
Макела М., Витт К.Как читать статью: критическая оценка исследований для применения в здравоохранении. Singapore Med J 2005: 46 : 108–114.
Хиггинс Дж. П. Т., Альтман Д. Г., Гётше П. К. и др. Инструмент Кокрановского сотрудничества для оценки риска систематической ошибки в рандомизированных исследованиях. BMJ 2011; 343 : d5928.
Артикул PubMed PubMed Central Google Scholar
Slim K, Nini E, Forestier D, Kwiatkowski F, Panis Y, Chipponi J.Методологический указатель для нерандомизированных исследований (несовершеннолетние): разработка и валидация нового инструмента. ANZ J Surg 2003; 73 : 712–716.
Артикул PubMed PubMed Central Google Scholar
Погрель М. А. Необратимое повреждение нервов в результате блокады нижних альвеолярных нервов — обновленная информация, включающая артикаин. J Calif Dent Assoc 2007; 35 : 271–273.
PubMed PubMed Central Google Scholar
Гаристо Г. А., Гаффен А. С., Лоуренс Х. П., Тененбаум Х. С., Хаас Д. А..Возникновение парестезии после введения местного анестетика в стоматологию в США. J Am Dent Assoc 2010; 141 : 836–844.
Артикул PubMed PubMed Central Google Scholar
Gaffen A S, Haas D A. Ретроспективный обзор добровольных сообщений о нехирургических парестезиях в стоматологии. J Can Dent Assoc 2009; 75 : 579.
PubMed PubMed Central Google Scholar
Saxon E.Определение нулевой гипотезы. BMC Biol 2015; 13 : 68.
Артикул PubMed PubMed Central Google Scholar
Погрель М. А, Тамби С. Постоянное поражение нервов в результате блокады нижних альвеолярных нервов. J Am Dent Assoc 2000; 131 : 901–907.
Артикул Google Scholar
Робинсон П. П.Наблюдения за восстановлением чувствительности после травм нижнего альвеолярного нерва. Br J Oral Maxillofac Surg 1988; 26 : 177–189.
Артикул Google Scholar
Робинсон П.П., Смит К.Г., Джонсон Ф.П., Коппинс Д.А. Оборудование и методы для простого сенсорного тестирования. Br J Oral Maxillofac Surg 1992; 30 : 387–389.
Артикул PubMed PubMed Central Google Scholar
Корбетт И. П., Канаа М. Д., Уитворт Дж. М., Мичан Дж.Артикаиновая инфильтрация для анестезии первых моляров нижней челюсти. J Endod 2008; 34 : 514–518.
Артикул Google Scholar
Канаа М. Д., Уитворт Дж. М., Корбетт И. П., Мичан Дж. Г.. Буккальная инфильтрация артикаином повышает эффективность блокады нижнего альвеолярного нерва лидокаином. Int Endod J 2009; 42 : 238–246.
Артикул PubMed PubMed Central Google Scholar
Poorni S, Veniashok B, Senthilkumar A D, Indira R, Ramachandran S.Анестезирующая эффективность четырехпроцентного артикаина для пульпарной анестезии с использованием техники блокады нижнего альвеолярного нерва и буккальной инфильтрации у пациентов с необратимым пульпитом: проспективное рандомизированное двойное слепое клиническое исследование. J Endod 2011; 37 : 1603–1607.
Артикул Google Scholar
Лейт Р., Линч К., О’Коннелл А. Применение артикаина у детей: обзор. Eur Arch Paediatr Dent 2012; 13 : 293–296.
Артикул PubMed PubMed Central Google Scholar
Маламед С Ф. Не прошла ли блокада нижнечелюстного нерва? J Am Dent Assoc 2011; 142 (выпуск спецификации): 3S – 7S.
Артикул Google Scholar
Хиллеруп С., Бакке М., Ларсен Дж. О., Томсен С. Э., Гердс Т. Е.. Зависимая от концентрации нейротоксичность артикаина: электрофизиологическое и стереологическое исследование седалищного нерва крысы. Anesth Analg 2011; 112 : 1330–1338.
Артикул PubMed PubMed Central Google Scholar
Malet A, Faure M, Deletage N, Pereira B, Haas J, Lambert G. Сравнительные цитотоксические эффекты различных местных анестетиков на линии клеток нейробластомы человека. Anesth Analg 2015; 120 : 589–596.
Артикул Google Scholar
Маламед С Ф.Местные анестетики: самые важные лекарства для стоматологии, клинические данные за 2006 г. J Calif Dent Assoc 2006; 34 : 971–976.
PubMed PubMed Central Google Scholar
Маламед С Ф. Артикаин против лидокаина: отвечает автор. J Calif Dent Assoc 2007; 35 : 383–385.
PubMed PubMed Central Google Scholar
Хинтце А, Песслер Л.Сравнительные исследования эффективности 4% артикаина (адреналин 1: 200 000) и 2% артикаина (адреналин 1: 200 000) при местной инфильтрационной анестезии в стоматологии — рандомизированное двойное слепое исследование. Clin Oral Investigation 2006; 10 : 145–150.
Артикул PubMed PubMed Central Google Scholar
Aguiar J, Chebroux A, Martinez-Taboada F, Leece E A. Обезболивающие эффекты блокады верхнечелюстных и нижних альвеолярных нервов у кошек, перенесших удаление зубов. J Feline Med Surg 2015; 17 : 110–116.
Артикул PubMed PubMed Central Google Scholar
Хунг П, Чанг Х, Ян П, Куо И, Лань В, Линь С. Сравнение блокады нижней челюсти по Гоу-Гейтсу и блокады нижнего альвеолярного нерва с использованием стандартизованного протокола. J Formos Med Assoc 2006; 105 : 139–146.
Артикул Google Scholar
Potocnik I, Tomsic M, Sketelj J, Bajroviä F F.Артикаин более эффективен, чем лидокаин или мепивакаин, при блокаде сенсорной нервной проводимости у крыс in vitro. J Dent Res 2006; 85 : 162–166.
Артикул Google Scholar
Sisk A L. Оценка техники блокады нижней челюсти Акиноси в челюстно-лицевой хирургии. J Oral Maxillofac Surg 1986; 44 : 113–115.
Артикул Google Scholar
Барони Д. Б., Франц-Монтан М., Кого К. и др.Влияние артикаина на переднюю часть подбородочного нерва: гистологический анализ на крысах. Acta Odontol Scand 2013; 71 : 82–87.
Артикул Google Scholar
Батиста Д. С., Берто Л. А., Вольпато М. С. и др. Анестезирующая эффективность артикаина и лидокаина при блокаде резкого / подбородочного нерва. J Endod 2010; 36 : 438–441.
Артикул Google Scholar
Чопра Р., Джиндал Г., Сачдев В., Сандху М.Двойное слепое перекрестное исследование для сравнения ощущения боли при введении блокады нижнего альвеолярного нерва с использованием забуференного двухпроцентного лидокаина у детей. Педиатр Дент 2016; 38 : 25–29.
PubMed Google Scholar
Danielsson K, Evers H, Holmlund A, Kjellman O, Nordenram A, Persson N.E. Местные анестетики длительного действия в челюстно-лицевой хирургии. Клиническая оценка бупивакаина и этидокаина при блокаде нижнечелюстного нерва. Int J Oral Maxillofac Surg 1986; 15 : 119–126.
Артикул PubMed PubMed Central Google Scholar
Руд Дж. П. Блокада нижнего альвеолярного нерва. Использование 5-процентного лигнокаина. Br Dent J 1976; 140 : 413–414.
Артикул PubMed PubMed Central Google Scholar
Ахмад З. Х., Равикумар Х., Карале Р., Приэтанатх Р. С., Сукумаран А.Изучение анестезирующей эффективности блокады нижнего альвеолярного нерва с использованием артикаина при необратимом пульпите. J Contemp Dent Pract 2014; 15 : 71–74.
Артикул PubMed PubMed Central Google Scholar
Камбалиматх Д. Х., Долас Р. С., Камбалиматх В. В., Агравал С. М.. Эффективность 4% артикаина и 2% лидокаина: клиническое исследование. J Maxillofac Oral Surg 2013; 12 : 3–10.
Артикул PubMed PubMed Central Google Scholar
Мурти А, Стассен Л. Ф. Возникновение парестезии верхнечелюстного отдела тройничного нерва после стоматологического местного анестетика: история болезни. J Ir Dent Assoc 2015; 61 : 34–35.
PubMed PubMed Central Google Scholar
Чой Э, Со Дж., Чон Б., Пак В.Диплопия после анестезии блокады нижнего альвеолярного нерва: отчет о 2 случаях и обзор литературы. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2009; 107 : e21 – e24.
Артикул PubMed PubMed Central Google Scholar
Аль-Сандук Т., Аль-Сарадж А. Глазные осложнения после блокады нижнего альвеолярного нерва: клинический случай. J Calif Dent Assoc 2010; 38 : 57–59.
PubMed PubMed Central Google Scholar
Вайман Р. Дж.Травма нерва после блокады нижней челюсти: история болезни. Вмятина сегодня 2010; 29 : 14.
PubMed PubMed Central Google Scholar
Торговец Дж. Длительная парестезия. Br Dent J 2010; 195 : 119.
Артикул Google Scholar
Фаулер С., Ридер А. Является ли объем 3,6 мл лучше 1,8 мл для блокады нижнего альвеолярного нерва у пациентов с симптоматическим необратимым пульпитом? J Endod 2013; 39 : 970–972.
Артикул PubMed PubMed Central Google Scholar
Steinkruger G, Nusstein J, Reader A, Beck M, Weaver J. Значение ориентации скоса иглы в достижении успешной блокады нижнего альвеолярного нерва. J Am Dent Assoc 2013; 137 : 1685–1691.
Артикул Google Scholar
Комфортно оцепенел: журнал Scottish Dental
Комфортное онемение
Д-р Лаура Фи исследует противоречия, связанные с местными анестетиками и пациентом со сложными соматическими заболеваниями.
02 августа, 2016
/ клинический
Доктор Лаура Фи
Местные анестетики прерывают нервную проводимость, подавляя приток ионов натрия через каналы в мембранах нейронов.Когда нейрон стимулируется, канал активируется, и ионы натрия могут диффундировать в клетку, вызывая деполяризацию. После этого внезапного изменения напряжения на мембране натриевой канал переходит в инактивированное состояние, и дальнейший приток запрещается, в то время как активные транспортные механизмы возвращают ионы натрия наружу.
После этой реполяризации канал переходит в нормальное состояние покоя. Местные анестетики обладают наибольшим сродством к рецепторам натриевых каналов во время их активированного и инактивированного состояний, а не в состоянии покоя 1, 2 .
Фармакология
Местные анестетики состоят из трех компонентов, которые придают необходимые клинические свойства:
- Липофильное ароматическое кольцо — улучшает растворимость соединения в липидах
- Промежуточная эфирно-амидная связь
- Третичный амин.
Артикаин состоит из амидной группы и сложноэфирной связи. Он имеет тиофеновое кольцо вместо бензольного кольца, как видно из химической структуры лигнокаина. Тиофеновое кольцо улучшает его растворимость в липидах.Поэтому в некоторых исследованиях артикаин показывает лучший потенциал проникновения через нейрональную оболочку и мембрану по сравнению с другими местными анестетиками 3 .
Константа диссоциации анестетика влияет на начало его действия. Чем ниже значения pKa, тем большая часть незаряженных основных молекул может диффундировать через нервную оболочку. Артикаин имеет pKa 7,8, тогда как pKa лигнокаина составляет 7,9. Это оказывается важным, когда местный анестетик вводится для обезболивания воспаленных тканей, когда pH тканей снижается 4 .Период полувыведения артикаина составляет 20 минут, а у лигнокаина — 90 минут. Следовательно, артикаин представляет меньший риск системной токсичности во время длительного стоматологического лечения при введении дополнительных доз анестетика 5 .
Сравнение артикаина и лигнокаина
Некоторые исследования утверждают, что нет значительной разницы в облегчении боли, обеспечиваемой 2-процентным лигнокаином и 4-процентным артикаином, когда оба препарата содержат адреналин. 6 .Однако недавний систематический обзор продемонстрировал другой вывод 7 . Этот обзор показал, что при рассмотрении успешной инфильтрационной анестезии 4-процентный раствор артикаина, содержащий адреналин, был почти в четыре раза больше, чем аналогичный объем 2-процентного лигнокаина, также содержащего адреналин. Другие исследования показали, что 4% артикаина обеспечивают более высокий уровень анестезии в передней части верхней челюсти по сравнению с 2% лигнокаином, однако этот уровень превосходства менее значим в области моляров верхней челюсти 8 .
Имеются данные, подтверждающие, что артикаин более эффективен в задней области верхней челюсти по сравнению с лигнокаином при воспалении тканей 9 . Однако недостаточно доказательств, чтобы предложить аналогичный уровень превосходства для зубов нижней челюсти, когда раствор вводился с помощью техники блокады нижнего альвеолярного нерва 10 .
Аддитивное введение лигнокаина с использованием техники IANB и буккальная инфильтрация артикаином потенциально могут повысить уровень пульпарной анестезии, достигаемой в области моляров нижней челюсти и премоляров 11 .Включение адреналина в 4-процентный артикаин считается критически важным для достижения его глубокой анестезии 12 .
Brandt и др. Продемонстрировали, что артикаин эффективнее при введении с использованием техники блокады нижнего альвеолярного нерва (IANB) 7 . Однако следует подчеркнуть, что эффективность агента, вводимого через нижнюю альвеолярную блокаду, была значительно ниже, чем эффективность, вводимая методом инфильтрации. Было показано, что ни артикаин, ни лигнокаин не продемонстрировали превосходства над другими при введении на зубы с симптомами.Важно осознавать ограничения в этом исследовании по сравнению 4-процентного раствора артикаина с 2-процентным раствором лигнокаина 7 . В других исследованиях также сообщалось об отсутствии разницы между артикаином и лигнокаином при использовании техники IANB при лечении симптоматических зубов 11,13 .
Интересно, что было продемонстрировано, что 4% артикаина с 1: 100 000 адреналина, вводимые с использованием техники буккальной инфильтрации, давали значительно более быстрое начало пульпарной анестезии по сравнению с блокадой нижнего альвеолярного нерва.Таким образом, стоматологи могут рассмотреть возможность введения артикаина при буккальной инфильтрации в качестве альтернативы блокаде нижнего альвеолярного нерва при анестезии первого моляра нижней челюсти 14 . Другое исследование также пришло к выводу, что артикаин, вводимый только посредством буккальной инфильтрации, был более эффективным, чем лигнокаин, вводимый методом нижнеальвеолярного отростка, при анестезии первых коренных зубов нижней челюсти 15 .
Парестезия
В 2010 году Гаристо и др. Сообщили о 248 случаях парестезии после стоматологического лечения 16 .В большинстве случаев возникала блокада нижнечелюстного нерва, а в 89% случаев был поврежден язычный нерв. Было показано, что парестезия была в 7,3 раза более вероятна при использовании 4% артикаина по сравнению с лигнокаином. Аналогичные результаты были получены Hillerup et al, которые продемонстрировали большую нервную токсичность на 4% по сравнению с 2% артикаином. Поэтому было бы целесообразно ограничить использование 4% артикаина инфильтратами и избегать блокады нервов 17 .
Также было показано, что артикаин превосходит инфильтрацию нижней челюсти и не вызывает нервной токсичности, если не вводится рядом с подбородочным нервом. 18 .
Парестезия связана с использованием местных анестетиков, особенно при использовании техники блокады нижнего альвеолярного нерва 19 . Обсервационное исследование, проведенное в Дании, показало, что риск повреждения нервов в 20 раз выше при использовании артикаина по сравнению с другими местными анестетиками и введением по методике IANB 17. Учитывая, что артикаин менее нейротоксичен, чем другие анестетики, результаты этого исследования были неожиданными 20 .Важно учитывать, что этиология парестезии может быть результатом повреждения иглой язычного и нижнего альвеолярного нерва. Факторы, включая внутриневральную гематому, экстра-нейральную гематому, отек и химическую нейротоксичность артикаина, также могут играть роль 21 .
Стоматологи также должны учитывать «эффект Вебера» 22 . Это происходит, когда новый продукт выводится на рынок и подвергается более тщательной проверке. Сразу после введения 4% артикаина, содержащего 1: 100 000 адреналина, значительно увеличилась частота парестезии.Но два года спустя было зафиксировано снижение, несмотря на увеличение количества проданных картриджей 21 .
В литературе сообщается, что язычный нерв повреждается чаще, чем нижнеальвеолярный нерв. Примерно 70 процентов необратимых повреждений нервов вызвано язычным нервом, тогда как 30 процентов случаев были зарегистрированы с поражением нижнего альвеолярного нерва 23. Текущие данные показывают, что 85-94 процентов нехирургической парестезии, вызванной местными анестетиками, излечивается в два месяца.После двухмесячного периода две трети пациентов, у которых не исчезла парестезия, никогда полностью не выздоровеют. 23 .
Артикаин также используется в таких областях медицины, как пластическая и реконструктивная хирургия, офтальмология и ортопедическая хирургия. Интересно, что нет сообщений о парестезии от артикаина после его использования в медицине. Возможно ли, что артикаин воздействует только на нервы, питающие полость рта, и особенно на язычный нерв? Считается, что парестезия поражает язычный нерв в два раза больше, чем нижний альвеолярный нерв, из-за фасцикулярного рисунка места инъекции.Кроме того, когда пациент открывает рот для лечения, язычный нерв растягивается и располагается ближе кпереди; это снижает уровень гибкости, необходимой для отклонения иглы. Во время введения игла с зазубринами может повредить нижний альвеолярный или язычный нерв при отведении 24 .
Интересно, что в 2006 году, когда Хиллеруп выразил обеспокоенность тем, что артикаин вызывает нейросенсорные расстройства, было обнаружено, что 80% всех этих сообщений поступили из Дании.Стоит отметить, что в то время население Дании составляло приблизительно 5,6 миллиона человек по сравнению с 501 миллионом в более широком сообществе ЕС. Это исследование привело к тому, что Рабочая группа Европейского Союза по фармаконадзору провела расследование с участием 57 стран и более 100 миллионов пациентов, получавших артикаин. Вывод был категоричным: все местные анестетики могут вызывать повреждение нервов. По их оценкам, частота сенсорных нарушений после приема артикаина составляла 1 из 4.6 миллионов пролеченных пациентов. Таким образом, не существовало никаких медицинских доказательств, запрещающих использование артикаина, и профиль безопасности препарата остался неизменным.
Стоит учитывать, что до того, как артикаин был введен в США, частота необратимых повреждений нервов в результате блокады нижних альвеолярных нервов составляла 1: 26 762. В 2007 году Погрель также пришел к выводу, что блокада нервов может вызвать необратимые повреждения независимо от того, какой анестетик используется. И артикаин, и лигнокаин были связаны с этим явлением пропорционально их употреблению.
Отрицательные побочные эффекты
Артикаин может вызывать беспокойство, беспокойство, головокружение, судороги, головокружение, тремор, сонливость и депрессию 13 . Сообщалось о глазных осложнениях из-за вмешательства в сенсорные и моторные пути 25 . Другие побочные эффекты включают головные боли, отек лица и гингивит 13. В литературе также упоминаются кожные высыпания с зудом после введения артикаина 26. Также сообщалось о некрозе кожи на подбородке после введения 4% артикаина с использованием техники IANB 27 .
Что касается сердечно-сосудистой системы, 4% артикаина может снизить сердечную проводимость и возбудимость. В литературе описаны такие осложнения, как снижение сократимости миокарда, периферическая вазодилатация, желудочковая аритмия, остановка сердца и, в редких случаях, смерть. Важно соблюдать осторожность у пациентов с тяжелой печеночной недостаточностью. Однако быстрое расщепление артикаина на неактивные метаболиты приводит к низкой системной токсичности 29 .
Заключение по артикаину
С 1973 года по артикаину опубликовано более 200 статей. Практически все эти исследования пришли к выводу, что артикаин так же эффективен и безопасен, как и другие сопоставимые местные анестетики, такие как лигнокаин, мепивацин или прилокаин. Было показано, что артикаин является наименее вероятным анестетиком, вызывающим передозировку, вызванную введением слишком большого количества картриджей. Не наблюдалось значительной разницы в обезболивании между составами, содержащими 4% артикаина и 2% лигнокаина, содержащими адреналин.
Время начала и продолжительность анестезии 4% артикаина сопоставимы с другими коммерчески доступными местными анестетиками. Кроме того, большинство исследований показали, что частота осложнений, включая парестезию, одинакова для лигнокаина и артикаина. FDA одобрило применение 4% артикаина с адреналином 1: 100 000 для детей в возрасте четырех лет.
Популярность артикаина не может быть оспорена стоматологами.В США в 2009 году 41 процент всех используемых стоматологических местных анестетиков составлял артикаин. В 2012 году доля рынка артикаина в Германии составляла 97 процентов, и в том же году было показано, что 70 процентов стоматологов используют артикаин в Австралии.
Адреналинсодержащие анестетики
Адреналин вызывает сужение кровеносных сосудов, активируя альфа-1-адренорецепторы. Это способствует гемостазу в операционном поле и задерживает всасывание анестетика. Это замедленное всасывание снижает риск системной токсичности и увеличивает продолжительность его действия.Адреналин может вызывать значительную сердечную стимуляцию из-за своего действия в качестве агониста бета-1-адренорецепторов 30 .
Сердечно-сосудистые влияния
Адреналин является агонистом рецепторов альфа, бета-1 и бета-2. Это сосудосуживающее средство, поскольку крошечные сосуды в подслизистых тканях содержат только альфа-рецепторы 31 . Существует много споров о влиянии адреналина на пациентов с сердечно-сосудистыми заболеваниями. Дионн и др. Изучили влияние трех картриджей американского препарата Лидокаин с адреналином 1: 100 000.Подслизистая инъекция этой дозы увеличивала сердечный выброс, частоту сердечных сокращений и ударный объем. Системное артериальное сопротивление снизилось, а среднее артериальное давление осталось неизменным 32 .
Аналогичным образом, Hersh et al наблюдали аналогичные результаты после введения артикаина, содержащего 1: 100 000 и 1: 200 000 адреналина. Хотя влияние адреналина, о котором сообщают Hersh et al, было незначительным, примечательно, что все 14 участников были здоровы и не принимали лекарств, но у двоих из этих пациентов наблюдалось учащенное сердцебиение 33 .
Доза примерно двух картриджей лигнокаина, содержащего адреналин 1: 80 000, является наиболее консервативным и часто упоминаемым ограничением дозы для пациентов с серьезными сердечно-сосудистыми заболеваниями. В конечном итоге для принятия решения стоматолог должен практиковать здравое клиническое суждение и при необходимости обсуждать любые проблемы с врачом пациента. Пиковое влияние адреналина происходит в течение 5-10 минут после инъекции и быстро снижается. 33 .
Еще одно практическое предложение — определить дозировку на основе оценки пациента.Если медицинский статус пациента вызывает сомнения, разумный протокол состоит в том, чтобы записать исходную частоту сердечных сокращений и артериальное давление до операции и снова после введения двух картриджей лигнокаина, содержащих 1: 80 000 адреналина. Если состояние пациента остается стабильным, могут быть введены дополнительные дозы с последующей повторной оценкой жизненно важных функций 30 .
Гипертония
После введения одного-двух картриджей местного анестетика, содержащего адреналин, осторожной аспирации и медленной инъекции и отсутствия у пациента признаков или симптомов сердечной недостаточности, можно использовать дополнительный адреналин, содержащий местный анестетик.Некоторые стоматологи предпочитают безопасный вариант: сначала использовать минимальное количество адреналинсодержащего местного анестетика, а затем при необходимости добавлять анестетик без адреналина 34 .
Риск того, что анестезия закончится слишком быстро, что приведет к выработке пациентом повышенного уровня эндогенного адреналина из-за боли, будет гораздо более опасным, чем небольшое количество адреналина в стоматологическом анестетике 35 .
Лекарственные взаимодействия
Препараты, блокирующие бета-адренорецепторы, повышают токсичность адреналинсодержащих местных анестетиков.Он подавляет ферменты в печени и снижает кровоток в печени. Поэтому не рекомендуется назначать большие дозы местного анестетика пациентам, принимающим бета-адреноблокаторы. В литературе имеется множество сообщений об инсульте и остановке сердца 36 . Медленное введение и аспирация также могут помочь предотвратить нежелательные реакции 37 .
Разумное использование адреналина рекомендуется пациентам, принимающим неселективные бета-адреноблокаторы. В отличие от селективных агентов, которые блокируют только рецепторы бета-1 в сердце, неселективные агенты также блокируют сосудистые рецепторы бета-2.В этом случае альфа-агонистическое действие адреналина становится более выраженным, и как диастолическое, так и среднее артериальное давление могут стать опасно повышенными. Часто это сопровождается резким снижением частоты сердечных сокращений. Существенные последствия этого взаимодействия хорошо задокументированы 38 .
Взаимодействие с бета-блокаторами происходит во времени, аналогичном наблюдаемому для нормальных сердечно-сосудистых реакций на адреналин. Он начинается после всасывания из места инъекции, достигает пика в течение пяти минут и снижается в течение следующих 10-15 минут.Адреналин не противопоказан пациентам, принимающим неселективные бета-блокаторы, но дозы должны быть минимальными и рекомендуется мониторинг артериального давления 39 .
Верапамил, популярный блокатор кальциевых каналов, увеличивает токсичность 2-процентного лигнокаина. Что касается пациентов, принимающих бета-адреноблокаторы, два картриджа должны быть пределом 40. Что касается бупивакаина, то блокаторы кальциевых каналов усиливают кардиотоксичность этого анестетика длительного действия 41 .
Антигипертензивные средства — это основные сердечно-сосудистые препараты, которые взаимодействуют с анестетиками, содержащими адреналин. Теоретически бета-адреноблокаторы, диуретики и блокаторы кальциевых каналов могут вызывать побочные реакции при использовании с адреналинсодержащими местными анестетиками 42 .
Адреналин вызывает агонизм альфа- и бета-адренорецепторов. Стимуляция альфа-адренорецепторов приводит к сужению периферических кровеносных сосудов, тогда как стимуляция бета-адренорецепторов снижает сопротивление сосудов из-за расширения сосудов в печени и мышцах, что снижает диастолическое артериальное давление.Если бета-эффекты блокируются, альфа-адренергическая стимуляция приводит к беспрепятственному повышению систолического артериального давления, вызывая нарушение мозгового кровообращения.
Следовательно, если таким пациентам требуется более одного-двух картриджей, следует вводить растворы, не содержащие адреналина. Однако преимущество блокаторов бета-адренорецепторов у стоматологических пациентов состоит в том, что сердце защищено от повышения частоты, вызываемого бета-адренергической стимуляцией экзогенным адреналином 43 .
Диуретики могут влиять на метаболическое действие адреналина. Повышенный уровень адреналина снижает концентрацию калия в плазме 44 . Это снижение было зарегистрировано у пациентов, получавших стоматологические местные анестетики, содержащие адреналин 45 .
У пациентов, перенесших хирургические вмешательства в полости рта и принимающих не калийсберегающие диуретики, наблюдалась гипокалиемия, вызванная адреналином. 44 . Следует помнить, что препараты, блокирующие кальциевые каналы, также могут усиливать гипокалиемию, вызванную адреналином 46 .
| АГЕНТ | CONC W / V | CONC MG / ML | MAX DOSE MG / KG | MG DOSE 9088 ML / KG| КАРТРИЖИ | | |
|---|---|---|---|---|---|---|
| БУПИВАКАИН 0,5% | 0,5 | 5 | 1,3 | 0,26 | 90 | 8 |
| ЛИДОКАИН 2% | 2 | 20 | 4.4 | 0,22 | 300 | 6 |
| МЕПИВАКАИН 2% | 2 | 2 | 4,4 | 0,33 | 300 | 6 |
| ARTICAINE 4% | 4 | 40 | 7 | 0,18 | 500 | 5 |
| PRILOCAINE 3% | 3 | 30 | 5 | 4,4 | 400 | 6 |
| МЕПИВАКАИН 3% | 3 | 30 | 4.4 | 0,15 | 300 | 4 |
| PRILOCAINE 4% | 4 | 40 | 5 | 0,13 | 400 | 4 |
| АГЕНТ | КОНЦЕНТРАЦИЯ | ТОРГОВОЕ НАИМЕНОВАНИЕ |
|---|---|---|
| BUPIVACAINE | 0,5% | MERCAINE |
| МЕПИВАКАИН | 2% | ЛИГНОСПАН |
| ЛИДОКАИН | 2% | СКАНДОНЕСТ |
| ПРИЛОКАИН | 3% | СЕПТАНЕСТ |
| ARTICAINE | 4% | CITANEST |
| МЕПИВАКАИН | 3% | СКОНДОНЕСТ |
| PRILOCAINE | 4% | CITANEST |
Стенокардия и постинфаркт миокарда
Использование адреналина, содержащего местные анестетики, рекомендуется как часть протокола снижения стресса.Дозировка адреналина должна быть ограничена тем, что содержится в двух картриджах лигнокаина 2 процента 1: 80 000 адреналина. Для пациентов с нестабильной стенокардией недавний инфаркт миокарда менее шести месяцев назад или недавняя операция по аортокоронарному шунтированию в течение трех месяцев требуют отсрочки планового стоматологического лечения 47 . Если неотложная помощь необходима, рекомендуется использовать протоколы снижения стресса с помощью успокаивающих средств с ограничением двумя картриджами с адреналином, содержащими анестетик 48.
В рамках протокола снижения стресса Wand позволяет стоматологу вводить местный анестетик с помощью безопасного наконечника. Шприц для анестезии часто является основной причиной стресса для пациентов, поскольку многие считают его самой неудобной частью стоматологического лечения. Wand помогает доставлять регулируемый компьютером поток анестетика, что обеспечивает безболезненную стоматологическую анестезию при различных типах инъекций. Это может помочь уменьшить беспокойство пациента.
Сердечная аритмия
Плановую стоматологию следует отложить у пациентов с тяжелыми или рефрактерными аритмиями до их стабилизации.
Безопасно ограничить дозу местного анестетика двумя картриджами лигнокаина 2%, содержащими 1: 80 000 адреналина 49 . Противопоказано использование пародонтальной связки или внутрикостных инъекций с использованием местного анестетика, содержащего адреналин. 50 .
Застойная сердечная недостаточность
Пациенты, принимающие гликозиды наперстянки, такие как дигоксин, должны находиться под тщательным наблюдением, если вводятся адреналинсодержащие анестетики, поскольку взаимодействие между этими двумя препаратами может вызвать аритмию.Пациенты, принимающие нитратные препараты длительного действия или сосудорасширяющие препараты, могут демонстрировать снижение эффективности адреналина и, следовательно, могут испытывать более короткую продолжительность местной стоматологической анестезии 48 .
Цереброваскулярное нарушение
После инсульта рекомендуется отложить стоматологическое лечение из-за значительно повышенного риска рецидива. После шестимесячного перерыва стоматологические процедуры можно перенести с помощью адреналинсодержащих местных анестетиков.Если у пациента, перенесшего инсульт, есть проблемы с сердечно-сосудистой системой, дозировка местного анестетика с вазоконстриктором должна быть минимальной 48 .
Астма
Стресс может спровоцировать приступ астмы, поэтому необходимы протоколы снижения стресса. Рекомендуется консервативное использование местных анестетиков, содержащих адреналин. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов предупреждает, что препараты, содержащие сульфиты, могут вызывать аллергические реакции у восприимчивых людей 51 .
Некоторые исследования показывают, что метабисульфит натрия, который является антиоксидантным средством, используемым в стоматологических местных анестетиках, может вызывать приступы астмы 52 .Данные о частоте этой реакции ограничены, и даже у пациентов, чувствительных к сульфиту, риск ее возникновения крайне мал. Имеются данные о том, что более 96 процентов астматиков нечувствительны к сульфитам, а те, кто чувствительны, обычно являются тяжелыми стероидозависимыми астматиками. 53 .
Perusse и его коллеги пришли к выводу, что местный анестетик с адреналином можно безопасно использовать у пациентов с нестероидно-зависимой астмой. Однако до тех пор, пока мы не узнаем больше о пороге чувствительности к сульфиту, рекомендуется консервативное использование местного анестетика с адреналином у пациентов с кортикостероидной астмой.Это связано с более высоким риском аллергии на сульфит и возможностью непреднамеренной внутрисосудистой инъекции, вызывающей тяжелую астматическую реакцию у чувствительного пациента 54 . Однако в последнее время многие специалисты считают результаты этих более ранних исследований сомнительными.
Заболевание печени
У пациентов с хроническим активным гепатитом или со статусом носителя антигена гепатита дозы местного анестетика должны быть минимальными.У пациентов с циррозом печени на более поздних стадиях метаболизм местных анестетиков может быть значительно замедлен, что приводит к повышению уровня в плазме крови и осложнениям, связанным с реакциями токсичности. Может потребоваться уменьшение дозы местного анестетика и увеличение промежутка времени между инъекциями 55 .
Диабет
У некоторых пациентов наблюдается резкое колебание между гипергликемией и гипогликемией, поэтому следует сократить использование адреналинсодержащих анестетиков из-за риска гипогликемии с повышенным содержанием адреналина 48 .
Кокаин
Основное беспокойство у пациентов, злоупотребляющих кокаином, представляет собой значительную опасность ишемии миокарда, сердечных нарушений ритма и гипертонии. Некоторые исследователи рекомендуют отложить стоматологическое лечение на 24–72 часа 56 .
Трициклические антидепрессанты
Пациентам, принимающим эти препараты, можно безопасно вводить от одного до двух картриджей местного анестетика, содержащего адреналин. Однако необходимо постоянное тщательное наблюдение за признаками
гипертонии из-за усиления симпатомиметических эффектов 57 .
ВИЧ
Было показано, что препараты-ингибиторы протеаз повышают уровни лигнокаина в плазме, потенциально увеличивая кардиотоксичность 58 .
Болезнь Паркинсона
Несмотря на отсутствие данных о влиянии препарата энтакапон против Паркинсона, рекомендуется соблюдать осторожность при использовании адреналинсодержащих анестетиков. Рекомендуемый верхний предел для взрослых — три картриджа с 2-процентным лигнокаином и 1: 80 000 адреналина. 59 .
Местное анестезиологическое обращение
Был представлен местный анестетик, реверсирующий действие, которое эффективно нейтрализует влияние адреналина на подслизистые сосуды. Фентоламин (Ora Verse) — блокатор альфа-рецепторов, содержащийся в стоматологических картриджах 60 .
В будущем это может оказаться полезным для некоторых пациентов с ограниченными возможностями здоровья, таких как диабетики или пожилые пациенты, для которых адекватное питание может быть затруднено длительным онемением. Однако в настоящее время этот агент отмены недоступен в Великобритании или Ирландии.
Об авторе
Доктор Лаура Фи окончила Тринити-колледж в Дублине с отличием по специальности стоматология. Во время учебы она была награждена медалью Костелло за исследования в области борьбы с перекрестными инфекциями в бакалавриате. Она является членом стоматологического факультета Королевского колледжа хирургов, а в 2013 году получила сертификат по имплантологии в Нортумберлендском институте оральной медицины и с тех пор получила диплом по имплантологии в Королевском колледже хирургов. , Эдинбург.Лаура в настоящее время завершает получение сертификата по малой оральной хирургии Королевского колледжа хирургов, Англия. Она также участвовала в обучении на бакалавриате в стоматологической школе в Белфасте, где у нее есть почетный контракт на оральную хирургию.
Список литературы
Berde CB, Strichartz GR. Местные анестетики. В: Miller RD, Eriksson LI, Fleisher LA et al. Анестезия Миллера. 7 -е изд. Филадельфия, Пенсильвания: Elsevier, Chuchill Livingstone, 2009.
Кацунг BG, белый PF. Местные анестетики. В: Katzung BG, Masters SB, Trevor AJ, редакторы. Базовая и клиническая фамакология. 11 -е изд. Нью-Йорк, штат Нью-Йорк: Mc Graw-Hill Companies Inc; 2009
Маламед С.Ф., Гагон С., Леблан Д. Эффективность артикаина: новый амидный местный анестетик. J Am Dent Assoc 2000; 131: 635-642
Какроуду ША, Мехта С., Миллар Б.Дж. Артикаина гидрохлорид: это решение? Dent Update 2015; 42: 88-93
Becker DE, Reed KL.Основы местной анестезиологической фармакологии. Anesth Prog 2006; 53 (3): 98-108
Маламед СФ. Инъекция пародонтальной связки: альтернатива блокаде нижнего альвеолярного нерва. Oral Surg 1982; 53: 117
Брандт Р., Андерсон П., Макдональд Н., Сон В., Питерс М. Анестезия пульпы эффективность артикаина по сравнению с лидокаином в стоматологии. J Am Dent Assoc 2011; 142 (5): 493-504
Япп К., Хопкрафт М, Парашос П.Артикаин: обзор литературы. Br Dent J 2011; 210: 323-329
Srinivasan N, Kavitha M, Longanathan C, Padmini G. Сравнение эффективности 4% артикаина и 2% лидокаина при инфильтрации ротовой полости верхней челюсти у пациентов с необратимым пульпитом. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2009; 107: 133-136
Claffey E, Reader A, Nusstien J, Beck M, Weaver J. Анестезирующая эффективность артикаина при блокаде нижних альвеол у пациентов с необратимым пульпитом.Дж. Эндод 2004; 30: 568-571
Канаа, доктор медицины, Уитворт Дж. М., Корбетт И. П., Мичан Дж. Дж. Буккальная инфильтрация артикаином повышает эффективность блокады нижнего альвеолярного нерва лидокаином. Int Endod J 2009; 42: 238-246
Moore PA, Boynes SG, Hersh EV, De Rossi SS, Sollecito TP, Goodson JM, Leonel JS, Flores C, Peterson C, Hutcheson M. Обезболивающая эффективность 4% артикаина 1: 200 000 эпинефрина: два контролируемых клинических испытания.J Am Dent Assoc 2006; 137: 1,572–1581
Септодонт Инк. Септокаин (4% гидрохлорид артикаина с адреналином 1,100,000), рецепт для инъекций. Брошюра с информацией о лекарствах от производителя.
Юнг И.Ю., Ким Дж. Х., Ким Э. С., Ли Си Ю., Ли С. Дж. Оценка буккальных инфильтратов и блокады нижних альвеолярных нервов при пульпарной анестезии первых моляров нижней челюсти. J Endod 2008; 34: 11-13
Корбетт И.П., Канаа, Мэриленд, Уитворт Дж. М., Мичан Дж.Артикаиновая инфильтрация для анестезии первых моляров нижней челюсти. J Endod 2008; 34: 514-518
Garisto GA, Gaffen AS, Lawrence HP, Tenenbaum HC, Haas DA. Возникновение парестезии после введения местного анестетика в стоматологию в США. J Am Dent Assoc. 2010; 141: 836-844
Hillerup S, Jensen RH, Ersboll BK. Повреждение тройничного нерва, связанное с инъекцией местных анестетиков: поражение иглой нейротоксичности.J Am Dent Assoc. 2011; 142: 531-539
Робертсон Д., Нуссштейн Дж., Читатель А., Бек М., Мак Картни М. Обезболивающая эффективность артикаина при буккальной инфильтрации задних зубов нижней челюсти. J Am Dent Assoc. 2007; 138: 1104-1112
Хаас Д.А., Леннон Д. 21-летнее ретроспективное исследование сообщений о парестезии после местного анестетика. J Can Dent Assoc 1995; 61: 319-330
.Werdehausen WR, Fazeli S, Braun S, Hermanns H, Essman F, Hollman MW, Bauer I, Stevens MF.Индукция апоптоза различными местными анестетиками в клеточной линии нейробластомы. Br J Anaesth 2009; 103: 711-718
Haas DA. Локальные осложнения от местной анестезии. J Calif Dent Assoc 1998; 26: 677-682
Hartnell NR, Wilson JP. Воспроизведение эффекта Вебера с использованием постмаркетинговых отчетов о побочных эффектах, добровольно представленных в Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Фармакотерапия 2004; 24: 743-749
Pogrel MA, Schmidt BL, Sambajon V, Jordan RC.Повреждение язычного нерва из-за блокады нижнего альвеолярного нерва: возможное объяснение. J Am Dent Assoc 2003; 134: 195-199
Стейси Г.К., Хаджар Г. Колючая игла и необъяснимые парестезии и тризм после стоматологической регионарной анестезии. Oral Surg Oral Med Oral Pathol 1994; 77: 585-588
Penarrocha-Diago M, Sanchis- Bielsa JM. Офтальмологические осложнения после внутриротовой местной анестезии артикаином. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2000; 90: 21-24
Маланин К., Калимо К.Повышенная чувствительность к местному анестетику гидрохлориду артикаина. Anesth Prog 1995; 42: 144-145
Торренте-Кастельс Э., Гаргалло-Альбиол Дж., Родригес-Баеза А., Берини-Айтес Л., Гай-Эскода С. Некроз кожи подбородка: возможное осложнение инъекции блокады нижнего альвеолярного нерва. J Am Dent Assoc 2008; 139: 1,625–1630
Elad S, Admon D, Kedmi M, Naveh E, Benzki E, Ayalon S, Tuchband A, Lutan H, Kaufman E.Сердечно-сосудистый эффект местной анестезии артикаином плюс 1: 200 000 адреналина по сравнению с лидокаином плюс 1: 100 000 адреналина у кардиологических пациентов с ограниченными медицинскими показателями: проспективное рандомизированное двойное слепое исследование. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2008; 105: 725-730
Oertel R, Rahn R, Kirch W. Клиническая фармакокинетика артикаина. Clin Pharmacokinet 1997; 33; 417-425
Becker DE, Reed KL. Местные анестетики: обзор фармакологических соображений.Anesth Prog. 2012 Лето; 59 (2): 90-102
Западный край, ТЦ, Западный край DP. Адренергические агонисты и антагонисты. В: Брантон Л.Л., Чабнер Б.А., Кноллманн BC, редакторы. Гудман и Гилман «Фармакологические основы терапии». 12 -е изд. Нью-Йорк, штат Нью-Йорк: Mc Graw-Hill Companies Inc; 2011
Дионне Р.А., Гольдштейн Д.С., Вирдзек ПР. Влияние премедикации диазепамом и местного анестетика, содержащего адреналин, на сердечно-сосудистую систему и реакцию катехоламинов на оральную хирургию.Anesth Analg. 1984; 63: 640-646
Hersh EV, Giannakopoulos H, Levin LM et al. Фармакокинетика и сердечно-сосудистые эффекты высоких доз артикаина с 1: 100 000 и 1: 200 000 адреналина. J Am Dent Assoc. 2006; 137: 1562-1571
Schecter E, Wilson MF и Kong, YS, Физиологические реакции на инфузию адреналина: основа для нового стресс-теста при ишемической болезни сердца. Am Heart J 105: 554-60, 1983
Димсдейл Дж., Мосс Дж.Катехоламины плазмы при стрессе и физических нагрузках. J Am Med Assoc 1980; 243: 340-2
Gandy W. Тяжелое взаимодействие адреналина и пропранолола. Ann Emer Med. 1989; 18: 98-99
Маламед С.Ф., Справочник по стоматологической анестезии, Elsevier Mosby, St Louis Mo, USA, 5 th edition, 2004
Доман С. Аудит использования местной анестезии внутри перегородки в стоматологической практике на юге Англии.Prim Dent Care 2011; 18: 143-147
Годзиеба А., Смектала, Енджеевски М., Спорняк-Тутак К. Клиническая оценка безопасного использования местной анестезии с сосудосуживающими средствами у пациентов с сердечно-сосудистыми нарушениями: систематический обзор. Med Sci Monit. 2014; 20: 393-398
Таллман Р.Д., Розенблатт Р.М., Уивер Дж.М., Ван Ю.Л. Верапамил увеличивает токсичность местных анестетиков. J. Clin Pharmacol 1988 Apr; 28 (4): 317-21
Адсан Х, Тулунай М, Онаран О.Влияние верапамила и нимодипина на кардиотоксичность, вызванную бупивакаином, у крыс: исследования in vivo и in vitro. Anesth Anal 1998 апрель; 86 (4): 818-24
Becker DE. Неблагоприятные лекарственные взаимодействия. Anesth Prog. 2011; 58: 31-41
Фостер, Калифорния, Астон С.Дж. Взаимодействие пропранолола и адреналина: потенциальная катастрофа. Plast Reconstr Surg. 1983; 72: 74-78
Struthers AD, Reid JL, Whitesmith R, Rodger JC.Влияние внутривенного адреналина на электрокардиограмму, артериальное давление и уровень калия в сыворотке. Br Heart J 1982; 49: 90-93
Мичан Дж. Дж., Роулинз Мэриленд. Влияние адреналина в растворах анестетика лигнокаина на калий плазмы у здоровых добровольцев. Eur J Clin Pharmacol 1987; 32: 81-83
Мимрам А., Рибштейн Дж., Сиссман Дж. Влияние блокаторов кальциевых каналов на гипокалиемию, вызванную адреналином. Наркотики 1993; 46 (Дополнение 2): 103-107
Peruse R, Goulet JP, Turcotte JY.Противопоказания к применению сосудосуживающих средств в стоматологии: Часть 1, сердечно-сосудистые заболевания. Oral Surg Oral Med Oral Pathol 1992, 74: 679-86
.Little JW, Falace DA et al. Стоматологическое лечение пациентов с ограниченными возможностями здоровья, 5 th ed. Мосби — Ежегодник, Сент-Луис, 1997
Беккер Д.К., Взаимодействие с лекарствами в стоматологической практике: обзор фактов и разногласий. Compend Cont Educ Dent 1994, 15: 1228-44
Музыка BC.Фибрилляция предсердий и ее связь с лечением зубов. J Am Dent Assoc 1999, 130: 1080-5
Министерство здравоохранения и социальных служб США: Предупреждение о рецептурных лекарствах, содержащих сульфиты, FDA Drug Bull, 17: 2-3, 1987
Seng GF, Gay BJ. Опасности сульфитов в стоматологических растворах местных анестетиков: предупреждение и рекомендации. J Am Dent Assoc 1986, 113: 769-70
Буш Р.К., Тейлор С.Л. и др.Распространенность агентов чувствительности у больных астмой. Am J Med 1986, 81: 816-20
Perusse R, Goulet JP, Turcotte JY. Противопоказания к применению вазоконстрикторов в стоматологии: Часть II, гипертиреоз, сахарный диабет, сульфитная чувствительность, кортикозависимая астма и феохромоцитома. О Сург О Мед О Путь 1992, 74: 687-91
Демас PN, JR Mc Clain. Гепатит: значение для стоматологической помощи. Oral Surg Oral Med Oral Pathol 88 (1): 2-4, 1999
Yagiela JA.Неблагоприятные лекарственные взаимодействия в стоматологической практике: взаимодействия, связанные с вазоконстрикторами. J Am Dent Assoc 1999, 130: 701-9
Гуле, JP, Perusse R, Turcotte JY. Противопоказания к вазоконстрикторам в стоматологии: Часть III, фармакологические взаимодействия. Oral Surg Oral Med Oral Pathol 1992 74: 692-7
Greenwood I, Heylen R, Zakrzewska JM. Антиретровирусные препараты — значение для назначения стоматолога. Br Dent J 1998; 184: 478-482
Фридлендер А.Х., Малер М., Норман К.М., Эттингер Р.Л.Болезнь Паркинсона: системные и орофациальные проявления, лечение и лечение зубов. J Am Dent Assoc 2009 июнь; 140 (6): 658-69
Мур П.А., Херш Э.В., Папас А.С. и др. Фармакокинетика лидокаина с адреналином после отмены местной анестезии мезилатом фентоламина. Anesth Prog. 2008; 55: 40-48
списков
Теги: артикаин / Местные анестетики
Категории: CPD / Журнал
Артикаина гидрохлорид с адреналином — Australian Prescriber
Септанест, Дельтазин, Буканест (Specialites Septodont) | |
|
Артикаин — местный анестетик, который был одобрен за рубежом в течение нескольких лет.Как и другие амидные анестетики, артикаин блокирует нервную проводимость, когда проникает вокруг нерва. Это действие продлевается при сочетании препарата с сосудосуживающим средством, например адреналином.
Комбинация артикаина и адреналина может использоваться для местной или региональной анестезии при стоматологических процедурах. Анестезия начинается в течение шести минут и длится час. Период полувыведения артикаина составляет примерно 1,8 часа. Он метаболизируется, а затем выводится в основном с мочой.
Артикаин 4% с адреналином сравнивался с лигнокаином 2% с адреналином в трех двойных слепых испытаниях.Лекарства вводились в виде инфильтрации подслизистой оболочки или блокады нервов перед стоматологическими процедурами. По визуальной аналоговой шкале боли не было значительных различий между анестезией, достигнутой у 882 пациентов, получавших артикаин, и у 443 пациентов, получавших лигнокаин . 1
Примерно один из пяти пациентов сообщил о нежелательных явлениях после стоматологической анестезии. Наиболее частыми жалобами в обеих группах были послеоперационные боли, за которыми следовали головные боли и отек лица.Хотя частота встречаемости была менее 1%, парестезия и гипестезия затронули больше пациентов, получавших артикаин. Хотя у некоторых пациентов наблюдались изменения пульса и артериального давления, это могло быть связано с беспокойством по поводу инъекции и процедуры. 2 Как и в случае с другими местными анестетиками, важно, чтобы препарат не вводился в кровеносный сосуд. В стоматологической хирургии должно быть реанимационное оборудование на случай сердечно-сосудистого коллапса или судорог. Хотя иммуногенный потенциал артикаина, вероятно, невелик, он противопоказан пациентам с аллергией на метабисульфит натрия, поскольку в состав препарата входит этот антиоксидант.
Широкое использование артикаина привело к возникновению редких побочных эффектов. Например, может возникнуть паралич глазных мышц после введения артикаина в задние, верхние альвеолярные отростки. 3 Хотя эффективность артикаина, по-видимому, равна эффективности лигнокаина, у австралийских стоматологов нет убедительных клинических причин менять свой выбор местного анестетика.
Использование артикаина и адреналина, побочные эффекты и предупреждения
Общее название: артикаин и адреналин (AR ti kane и EP i NEF rin)
Фирменное наименование: Септокаин
Лекарственные формы: раствор для инъекций (4% -1: 100000; 4% -1: 200 000 )
Медицинское заключение компании Drugs.com, 7 сентября 2020 г. Автор: Cerner Multum.
Что такое артикаин и адреналин?
Артикаин и адреналин — обезболивающие (обезболивающие). Они работают, блокируя нервные сигналы в вашем теле.
Артикаин и адреналин — это комбинированное лекарство, используемое для обезболивания рта во время стоматологической процедуры.
Артикаин и адреналин также могут использоваться для целей, не указанных в данном руководстве.
Предупреждения
Вы не должны получать артикаин и адреналин, если у вас когда-либо была аллергическая реакция на какие-либо лекарства, вызывающие онемение.
Перед приемом этого лекарства
Не принимайте артикаин и адреналин, если у вас аллергия на какие-либо лекарства, вызывающие онемение.
Чтобы убедиться, что артикаин и адреналин безопасны для вас, сообщите своему врачу, если у вас есть:
FDA категория беременности C. Неизвестно, вредит ли артикаин и адреналин нерожденному ребенку. Сообщите своему врачу, если вы беременны или планируете забеременеть при использовании этого лекарства.
Неизвестно, проникают ли артикаин и адреналин в грудное молоко или могут нанести вред кормящемуся ребенку.Сообщите своему врачу, если вы кормите ребенка грудью.
Как вводится артикаин и адреналин?
Артикаин и адреналин вводятся в виде инъекций, которые обычно вводятся в область десен во рту. Вы получите эту инъекцию в кабинете стоматолога или в хирургическом отделении полости рта.
Что произойдет, если я пропущу дозу?
Поскольку артикаин и адреналин вводятся по мере необходимости перед стоматологической процедурой, вы вряд ли соблюдаете график дозирования.
Что произойдет, если я передозирую?
Обратитесь за неотложной медицинской помощью или позвоните в справочную службу Poison по телефону 1-800-222-1222.
Симптомы передозировки могут включать сильную сонливость, обморок, судороги (судороги), поверхностное дыхание или медленное сердцебиение.
Чего следует избегать после приема артикаина и адреналина?
Это лекарство может вызывать онемение в течение длительного периода времени. Избегайте еды, жевательной резинки и горячих жидкостей, пока ощущение во рту полностью не вернется. Жевание во время онемения рта может привести к укусу языка, губ или внутренней части щеки.
Побочные эффекты артикаина и адреналина
Получите неотложную медицинскую помощь, если у вас есть какие-либо из этих признаков аллергической реакции: крапивница; затрудненное дыхание; отек или отечность лица, губ, языка или горла.
Немедленно сообщите опекунам, если у вас есть:
слабое или поверхностное дыхание;
медленный пульс;
ощущение головокружения, будто вы можете потерять сознание;
затуманенное зрение, звон в ушах; или
беспокойство, замешательство, беспокойство или тремор.
Немедленно позвоните своему врачу или стоматологу, если после процедуры у вас возникнет отек, боль или сильное кровотечение.
Общие побочные эффекты могут включать:
язык боль или опухание, красные или опухшие десны;
легкая припухлость на лице;
головная боль; или
онемение и покалывание.
Это не полный список побочных эффектов, могут возникнуть и другие.Спросите у своего доктора о побочных эффектах. Вы можете сообщить о побочных эффектах в FDA по телефону 1-800-FDA-1088.
Какие другие препараты повлияют на артикаин и адреналин?
Расскажите своему врачу обо всех лекарствах, которые вы используете, и о тех, которые вы начинаете или прекращаете использовать во время лечения артикаином и адреналином, особенно:
антидепрессант — амитриптиллин, кломипрамин, дезипрамин, доксепин, имипрамин, нортриптилин, протриптилин, тримипрамин;
антипсихотических средств — хлорпромазин, дроперидол, флуфеназин, галоперидол, перфеназин; или
ингибитор МАО — изокарбоксазид, линезолид, метиленовый синий для инъекций, фенелзин, разагилин, селегилин, транилципромин и другие.
Этот список не полный. Другие препараты могут взаимодействовать с артикаином и адреналином, включая лекарства, отпускаемые по рецепту и без рецепта, витамины и растительные продукты. В этом руководстве по лекарствам перечислены не все возможные взаимодействия.
Дополнительная информация
- Ваш стоматолог или фармацевт может предоставить дополнительную информацию об артикаине и адреналине.
Помните, храните это и все другие лекарства в недоступном для детей месте, никогда не делитесь своими лекарствами с другими и используйте это лекарство только по назначению.
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, отображаемая на этой странице, применима к вашим личным обстоятельствам.
Заявление об отказе от ответственности
Copyright 1996-2021 Cerner Multum, Inc. Версия: 2.01.
Спросите стоматолога: ваше сердце сильно трепещет, когда вам делают укол анестетика?
ЕСЛИ ВАШЕ сердце начало колотиться после инъекции у стоматолога, тогда вы поймете, насколько неприятным это может быть. Это часть «реакции адреналина», и, наряду с учащенным сердцебиением, вы также можете почувствовать беспокойство и начать потеть.
Это не опасно, но может сбить с толку, особенно когда вы этого не ожидали. Так что же происходит на самом деле? Ну, это связано с адреналином, добавленным с местным анестетиком. Он включен, потому что временно сужает кровеносные сосуды, что позволяет дольше удерживать анестетик в этой области. Таким образом, у стоматолога будет больше времени работать с зубом, а вы его не почувствуете.
Стоматологическая тревога также может вызвать учащенное сердцебиение и пот с дополнительными симптомами неконтролируемой дрожи, учащенного дыхания, головокружения и покалывания в пальцах ног, губ и пальцев.Так что бывает трудно разделить причину, часто это комбинация того и другого.
Важно помнить, что ощущение адреналиновой реакции обычно проходит через несколько минут, и это не опасно для вас. Адреналин — это естественное вещество в нашем организме, которое выделяется, когда нам нужно быстро двигаться. Это называется «реакцией борьбы или бегства», поэтому, когда мы находимся в опасной ситуации, наши тела высвобождают ее, чтобы мы могли быстро уйти от вреда.
Этого не происходит из-за того, что дантист сделал «плохой укол» — это нормальное явление, предотвратить которое практически невозможно.Лучше иметь в виду, что ваше сердце предназначено для ускорения и замедления в разных ситуациях. Итак, как и в тренажерном зале, сердце вернется к нормальной частоте пульса в состоянии покоя.
Люди с сердечными заболеваниями могут быть более обеспокоены. Американская кардиологическая ассоциация рекомендует всем пациентам с сердечными заболеваниями получить максимум два картриджа со стоматологическим анестетиком. Для сравнения: нормальный человек без сердечных заболеваний может получить до 11 картриджей с анестетиком.
Более того, понятно, что пациенты, у которых была эта реакция, могут полагать, что они могут переносить только анестетик, не содержащий адреналина. Этот анестетик (простой местный) просто непредсказуемо вызывает онемение зубов и может привести к тому, что пациент почувствует лечение.
Итак, как и все остальное, это баланс, и любые проблемы, связанные с инъекциями, лучше всего обсуждать со своим стоматологом.
артикаина и адреналина | Michigan Medicine
Какую самую важную информацию я должен знать об артикаине и адреналине?
Вы не должны получать артикаин и адреналин, если у вас когда-либо была аллергическая реакция на какие-либо лекарства, вызывающие онемение.
Что такое артикаин и адреналин?
Артикаин и адреналин — обезболивающие (обезболивающие). Они работают, блокируя нервные сигналы в вашем теле.
Артикаин и адреналин — это комбинированное лекарство, используемое для обезболивания рта во время стоматологической процедуры.
Артикаин и адреналин также могут использоваться для целей, не указанных в данном руководстве.
Что мне следует обсудить с врачом перед получением артикаина и адреналина?
Вы не должны принимать это лекарство, если у вас аллергия на какие-либо лекарства, вызывающие онемение.
Чтобы убедиться, что артикаин и адреналин безопасны для вас, сообщите своему врачу, если у вас есть:
- нарушение сердечного ритма;
- пониженное или повышенное артериальное давление;
- астма или сульфитная аллергия; или
- история изъятий.
FDA категория беременности C. Неизвестно, вредит ли артикаин и адреналин нерожденному ребенку. Сообщите своему врачу, если вы беременны или планируете забеременеть при использовании этого лекарства.
Неизвестно, проникают ли артикаин и адреналин в грудное молоко или могут нанести вред кормящемуся ребенку. Сообщите своему врачу, если вы кормите ребенка грудью.
Как вводится артикаин и адреналин?
Артикаин и адреналин вводятся в виде инъекций, которые обычно вводятся в область десен во рту. Вы получите эту инъекцию в кабинете стоматолога или в хирургическом отделении полости рта.
Что произойдет, если я пропущу дозу?
Поскольку артикаин и адреналин вводятся по мере необходимости перед стоматологической процедурой, вы вряд ли соблюдаете график дозирования.
Что произойдет, если я передозирую?
Обратитесь за неотложной медицинской помощью или позвоните в справочную службу Poison по телефону 1-800-222-1222.
Симптомы передозировки могут включать сильную сонливость, обморок, судороги (судороги), поверхностное дыхание или медленное сердцебиение.
Чего следует избегать после приема артикаина и адреналина?
Это лекарство может вызывать онемение в течение длительного периода времени. Избегайте еды, жевательной резинки и горячих жидкостей, пока ощущение во рту полностью не вернется.Жевание во время онемения рта может привести к укусу языка, губ или внутренней части щеки.
Каковы возможные побочные эффекты артикаина и адреналина?
Получите неотложную медицинскую помощь, если у вас есть какие-либо из этих признаков аллергической реакции: крапивница; затрудненное дыхание; отек или отечность лица, губ, языка или горла.
Немедленно сообщите опекунам, если у вас есть:
- слабое или поверхностное дыхание;
- медленный пульс;
- ощущение головокружения, будто вы можете потерять сознание;
- затуманенное зрение, звон в ушах; или
- беспокойство, замешательство, беспокойство или тремор.
Немедленно позвоните своему врачу или стоматологу, если после процедуры у вас возникнет отек, боль или сильное кровотечение.
Общие побочные эффекты могут включать:
- язык боль или опухание, красные или опухшие десны;
- легкая припухлость на лице;
- головная боль; или
- онемение и покалывание.
Это не полный список побочных эффектов, могут возникнуть и другие.Спросите у своего доктора о побочных эффектах. Вы можете сообщить о побочных эффектах в FDA по телефону 1-800-FDA-1088.
Какие другие препараты повлияют на артикаин и адреналин?
Расскажите своему врачу обо всех лекарствах, которые вы используете, и о тех, которые вы начинаете или прекращаете использовать во время лечения артикаином и адреналином, особенно:
- антидепрессант — амитриптиллин, кломипрамин, дезипрамин, доксепин, имипрамин, нортриптилин, протриптилин, тримипрамин;
- антипсихотический препарат — хлорпромазин, дроперидол, флуфеназин, галоперидол, перфеназин; или
- ингибитор МАО — изокарбоксазид, линезолид, метиленовый синий для инъекций, фенелзин, разагилин, селегилин, транилципромин и другие.
Этот список не полный. Другие препараты могут взаимодействовать с артикаином и адреналином, включая лекарства, отпускаемые по рецепту и без рецепта, витамины и растительные продукты. В этом руководстве по лекарствам перечислены не все возможные взаимодействия.
Где я могу получить дополнительную информацию?
Ваш стоматолог или фармацевт может предоставить дополнительную информацию об артикаине и адреналине.
.Помните, храните это и все другие лекарства в недоступном для детей месте, никогда не передавайте свои лекарства другим и используйте это лекарство только по назначению.
Были предприняты все усилия для обеспечения точности, актуальности и полноты информации, предоставленной Cerner Multum, Inc. («Multum»), но никаких гарантий на этот счет не дается. Содержащаяся здесь информация о препарате может меняться с течением времени. Информация Multum была собрана для использования практикующими врачами и потребителями в Соединенных Штатах, и поэтому Multum не гарантирует, что использование за пределами Соединенных Штатов является целесообразным, если специально не указано иное.Информация о лекарствах Multum не содержит рекомендаций по лекарствам, диагностике пациентов и не рекомендует терапию. Информация о лекарственных препаратах Multum — это информационный ресурс, предназначенный для оказания помощи лицензированным практикующим врачам в уходе за своими пациентами и / или обслуживании потребителей, рассматривающих эту услугу как дополнение к опыту, навыкам, знаниям и суждениям практикующих врачей, а не их замену. Отсутствие предупреждения для данного лекарственного средства или комбинации лекарств никоим образом не должно толковаться как указание на то, что лекарство или комбинация лекарств безопасны, эффективны или подходят для любого данного пациента.Multum не несет никакой ответственности за какие-либо аспекты здравоохранения, управляемые с помощью информации, которую предоставляет Multum. Информация, содержащаяся в данном документе, не предназначена для охвата всех возможных способов использования, указаний, мер предосторожности, предупреждений, лекарственных взаимодействий, аллергических реакций или побочных эффектов. Если у вас есть вопросы о лекарствах, которые вы принимаете, проконсультируйтесь с врачом, медсестрой или фармацевтом.
Copyright 1996-2021 Cerner Multum, Inc. Версия: 2.01. Дата редакции: 17.09.2014.
