причины, симптомы, диагностика и лечение
Ксеростомия – это ощущение постоянной сухости во рту, вызванное недостаточно интенсивным слюноотделением. Сопровождается также ощущением жжения и сухости языка и горла, проблемами с разжевыванием и глотанием пищи, ощущением привкуса металла во рту и затруднениями с речью.
Ксеростомия может быть либо симптомом основной тяжелой болезни (ВИЧ, сахарный диабет, болезнь Паркинсона, онкологические заболевания), либо последствием пережитых хирургических манипуляций (например, удаления слюнных желез), медикаментозной терапии, лучевой терапии или химиотерапии.
Слюна является смазывающим веществом, облегчающим измельчение и переработку пищи, а также оказывает противовоспалительное воздействие, она реминерализует зубную эмаль и нейтрализует негативное воздействие кислот, содержащихся в пище, на поверхность зубов. Именно поэтому ксеростомия – серьезная проблема, требующая комплексного и незамедлительного лечения.
Причины возникновения ксеростомии
Наиболее частая причина возникновения этого симптома – последствия лекарственной терапии. Именно поэтому в группе риска прежде всего находятся люди пенсионного возраста: большое количество препаратов разных фармакологических групп, принимаемых одновременно, может приводить к обезвоживанию, сухости во рту и как следствие — ко ксеростомии.
Нередки также случаи, когда ксеростомия является симптомом других заболеваний – например, железодефицитной анемии, сахарного диабета, гипертонической болезни. Повышен риск возникновения ксеростомии у больных кистозным фиброзом, носителей ВИЧ-инфекции, пациентов, страдающих ревматоидным артритом.
Отдельную группу риска можно выделить для больных синдромом Штейна. В таких случаях ксеростомия возникает на фоне аутоиммунных нарушений, вызывающих дисфорию слюнных желез. В результате отмечается их гипофункция и как следствие – сухость слизистой оболочки рта.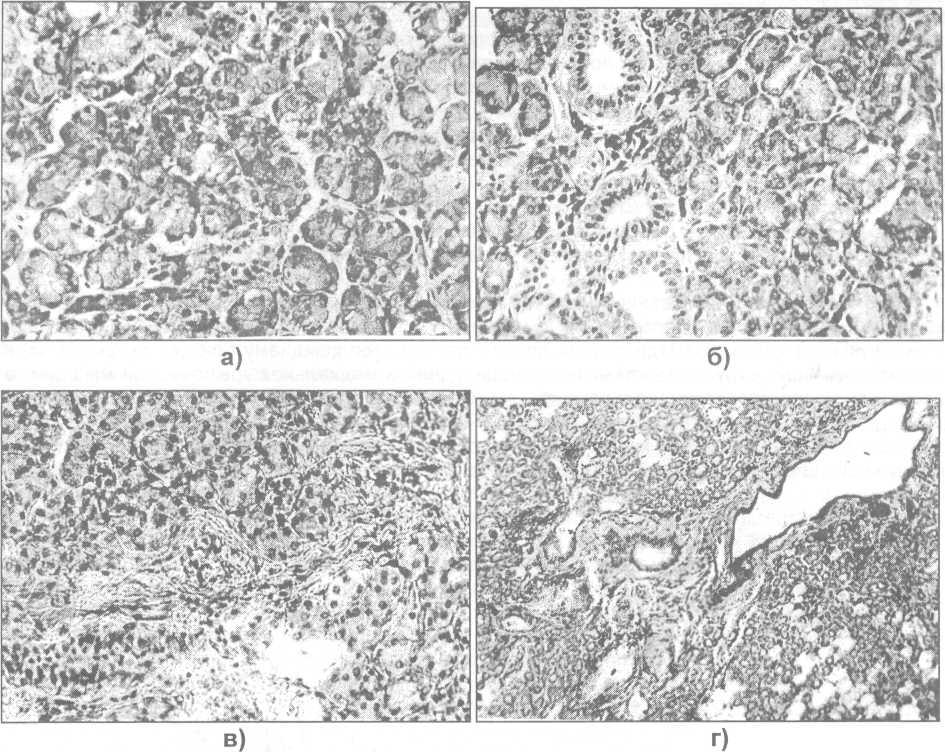
В числе заболеваний, провоцирующих появление ксеростомии, следует отметить и паротит, наряду с другими вирусными инфекциями, затрагивающими слюнные железы, их систему кровоснабжения и иннервации.
Ксеростомию на короткий срок может вызывать и обычное обезвоживание. В том числе – обезвоживание на фоне диареи, лихорадки, пищевых отравлений, ожоговой болезни, существенной кровопотери. Ксеростомия также отмечается после прохождения лучевой терапии.
В случае, когда слюнные железы были удалены хирургическим путем, возникновение ксеростомии неизбежно. В таком случае единственным выходом для пациента остается применение специальных увлажняющих средств для полости рта.
Временная ксеростомия может развиваться и не на фоне патологических процессов, протекающих в организме. Например, в числе причин может быть нарушение носового дыхания, вызванное искривлением носовой перегородки или полипами в носу.
Риск развития ксеростомии повышается также у больных, страдающих сиалоаденитом, болезнью Микулича, а также у склонных чрезмерно полоскать ротовую полость агрессивными концентрированными растворами с дезинфицирующим действием.
Ксеростомия: клинические проявления
Так как ксеростомия характеризуется прежде всего снижением выработки слюны, к числу клинических проявлений данного заболевания относятся различные негативные последствия сухости во рту для организма.
Выделяют несколько стадий данного заболевания:
- На начальных стадиях ксеростомию достаточно непросто обнаружить: подчелюстная и околоушная слюнные железы все еще выделяют достаточно слюны, и некоторый дискомфорт наблюдается только после продолжительного разговора.

- В дальнейшем слюна начинает вырабатываться меньше, и наступает т.н. стадия частичной декомпенсации. На этой стадии прием пищи затрудняется настолько, что без воды становится практически невозможным.
- Третья стадия – стадия практически полного угнетения функции слюнных желез. Болезненными становятся приемы пищи, разговоры, часто появляется стоматит, глоссит и другие поражения слизистой оболочки полости рта: эрозии, язвы, шелушение и растрескивание губ, язвочки в уголках рта.
Лечение ксеростомии
Первым и одним из наиболее важных этапов лечения ксеростомии является диагностика. Доктор проводит опрос пациента с целью выяснения, какие именно препараты он принимает на постоянной основе, какого рода стоматологические манипуляции с ним производились и так далее.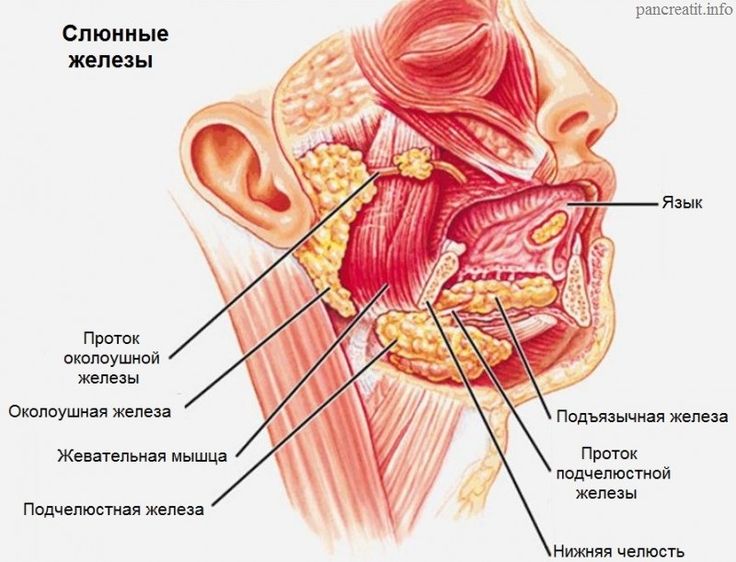 Для диагностики ксеростомии проводят сиалографию и ультразвуковое исследование слюнных желез.
Для диагностики ксеростомии проводят сиалографию и ультразвуковое исследование слюнных желез.
Симптоматическое лечение ксеростомии – это легкий путь к облегчению состояния пациента, однако эта мера является временной. Именно поэтому так важно установить происхождение болезни. Если в случае возникновения ксеростомии после приема лекарственных препаратов помочь пациенту довольно легко, то у перенесших лучевую терапию шансы на выздоровление немного ниже. (Лучевая терапия может влиять на работоспособность слюнных желез).
В ходе лечения особую роль играет патогенетическая терапия, направленная на борьбу с причинами возникновения ксеростомии. Для лечения применяется новокаиновое воздействие на околоушную и подчелюстную слюнные железы. А также следующие процедуры: электрофорез, гальванотерапия и вибромассаж.
Для облегчения состояния рекомендуют увеличить потребление чистой негазированной воды. Также подойдут леденцы (желательно натуральные и с заменителем сахара), жевательная резинка.
Избегайте сухой и солёной пищи, алкоголя – в том числе спиртосодержащих растворов для полоскания рта. Показан отказ от курения и выбор зубной щетки с более мягкой щетиной.
Процесс исцеления зависит от целого ряда факторов, однако в большинстве случаев (исключая случаи атрофии слюнных желез) при выполнении всех рекомендаций врача прогноз благоприятный.
Заболевания слюнных желез
Слюна имеет важное значение для речи и глотания и играет важную роль в поддержании здоровья полости рта путем поддержания целостности слизистой оболочки полости рта. Она содержит множество белков с антибактериальной активностью, солей и минералов, в том числе фтор, и действует как буфер и, следовательно, принимает участие в контроле развития кариеса зубов и заболеваний пародонта.
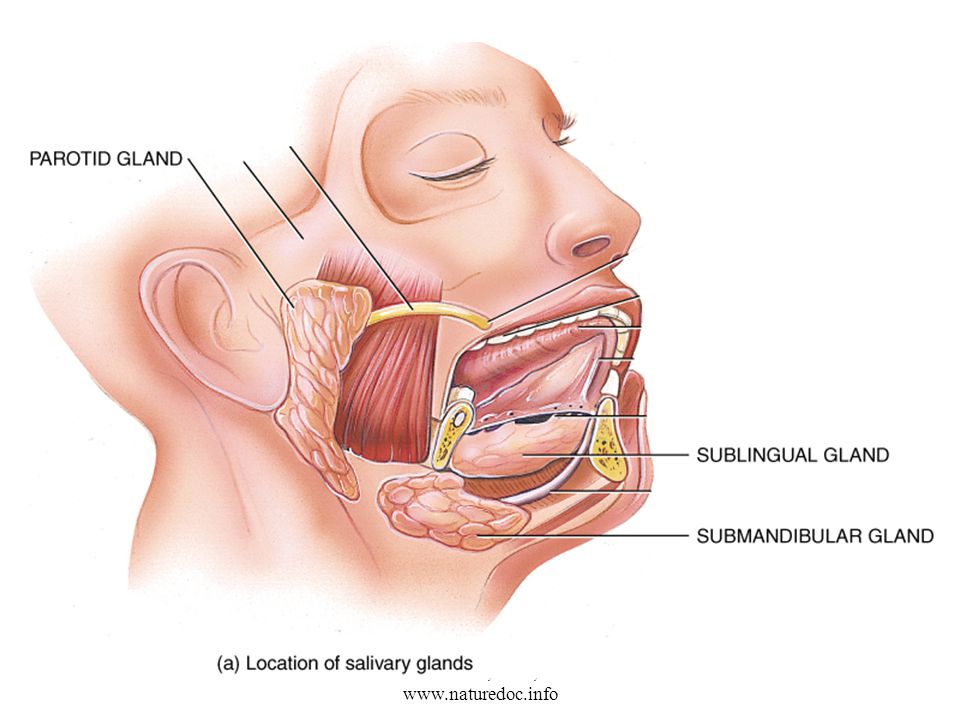
Слюна производится тремя парами крупных слюнных желез: околоушные железы, подчелюстные и подъязычные железы, располагающиеся в области дна полости рта.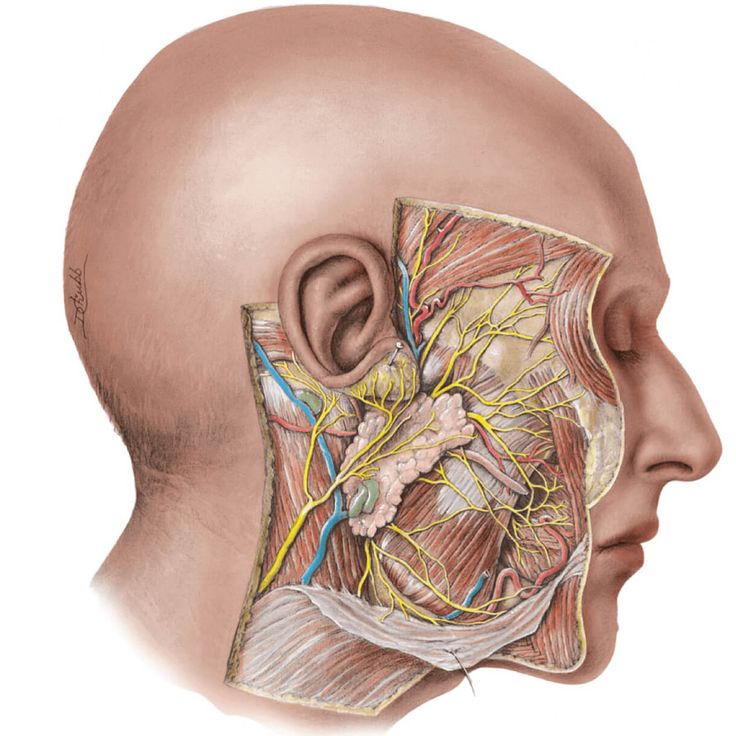 Кроме того, насчитывается около 200 малых слюнных желез, раположенных по всей слизистой оболочке полости рта: по слизистой твердого и мягкого неба, щек и губ.
Кроме того, насчитывается около 200 малых слюнных желез, раположенных по всей слизистой оболочке полости рта: по слизистой твердого и мягкого неба, щек и губ.
Слюнные железы могут быть вовлечены во многие патологические процессы, в том числе врожденные аномалии, инфекциооно-воспалительные заболевания, непроходимости, неоплазии и дегенеративные заболевания. В клинической практике наиболее часто встречающимися патологиями являются инфекции, обструкции камнями, доброкачественные опухоли и аутоиммунные заболевания.
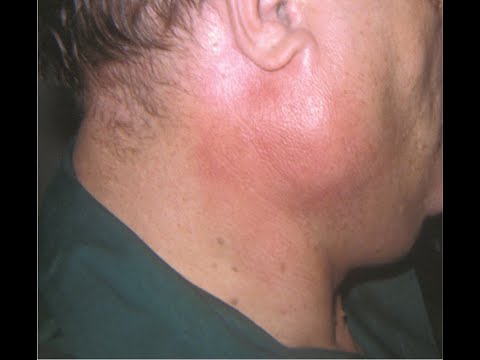
Инфекции (сиаладенит). Вирус эпидемического паротита является наиболее частой причиной инфекции слюнных желез. Бактериальная инфекция крупных слюнных желез, как правило, развивается из полости рта, а в железах, поврежденных наличием камней или облучением или у ослабленных больных, это является часто рецидивирующим явлением.
Обструкция (калькулезный сиаладенит). Камни могут образовываться в крупных слюнных желез и их протоках. Они могут вызвать нарушение оттока слюны, что, как правило, сопровождается болью и появлением припухлости во время еды.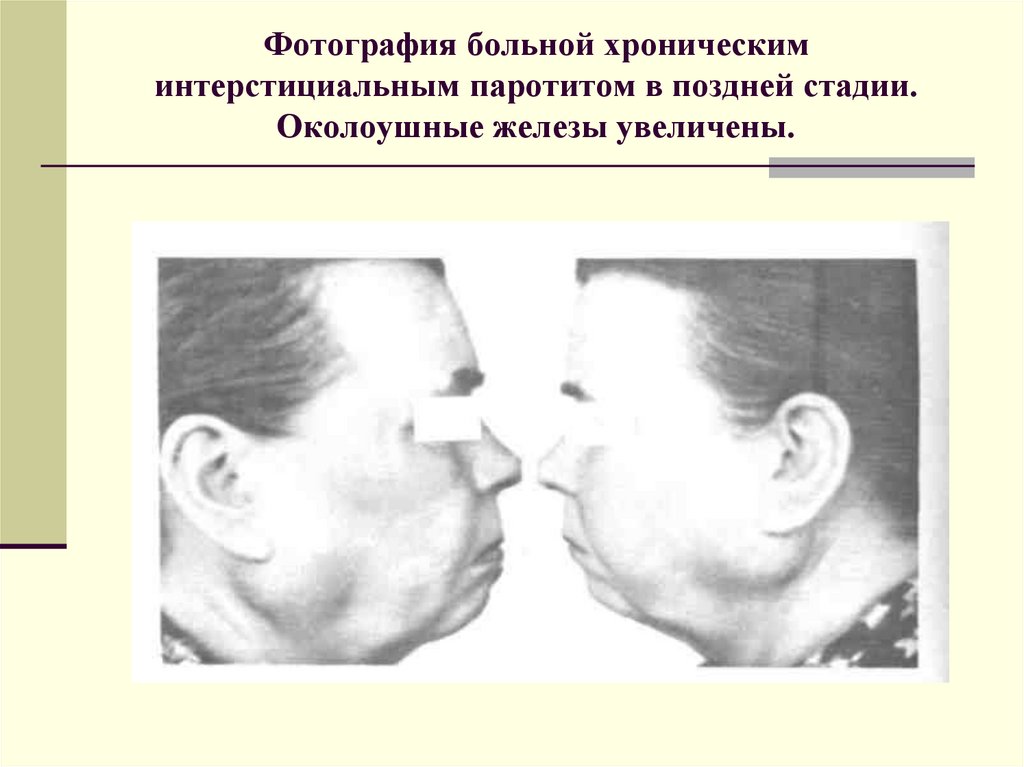 Если обструкция не разрешается, железа повреждается, что часто требует проведение операции по ее удалению. Обструкция малых желез проявляется в виде кисты, которое выпячивается на слизистой оболочке губ и щек.
Если обструкция не разрешается, железа повреждается, что часто требует проведение операции по ее удалению. Обструкция малых желез проявляется в виде кисты, которое выпячивается на слизистой оболочке губ и щек.
Опухоли. Существует большое количество видов как доброкачественных, так и злокачественных опухолей, которые могут встретиться в любой из крупных и малых слюнных желез. Чаще встречаются доброкачественные новообразования (плеоморфная аденома), которые растут постоянно и могут достигать различных размеров и пропорций. Злокачественные опухоли слюнных желез составляют около 5% всех случаев рака. Лечение опухолей слюнных желез требует наличие хирургических навыков из-за близости важных черепных нервов, необходимости выделения и сохранения ствола и ветвей лицевого нерва, и часто агрессивного характера заболевания. В таких случаях пациенты нуждаются в комбинации хирургического лечения и лучевой терапии для контроля над болезнью.
Дегенеративное заболевание.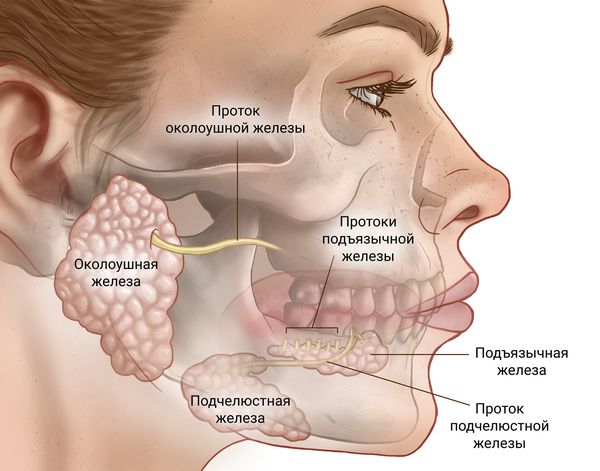 Слюнные и слезные железы могут быть вовлечены в аутоимунный синдром – синдром Шегрена, который приводит к сухости глаз и сухости во рту. Синдром Шегрена часто сопровождается другими системными заболеваниями, такими как ревматоидный артрит, системная красная волчанка или первичный билиарный склероз. Упациентов развиваются тяжелые повреждения в полости рта, связанные с недостаточностью продукции слюны, примерно у 10% пациентов с синдромом Шегрена развивается неходжкинская лимфома. Поэтому важно тщательное обследование пациентов для раннего выявления и лечения лимфомы.
Слюнные и слезные железы могут быть вовлечены в аутоимунный синдром – синдром Шегрена, который приводит к сухости глаз и сухости во рту. Синдром Шегрена часто сопровождается другими системными заболеваниями, такими как ревматоидный артрит, системная красная волчанка или первичный билиарный склероз. Упациентов развиваются тяжелые повреждения в полости рта, связанные с недостаточностью продукции слюны, примерно у 10% пациентов с синдромом Шегрена развивается неходжкинская лимфома. Поэтому важно тщательное обследование пациентов для раннего выявления и лечения лимфомы.
Методы лечения
Атрофия поднижнечелюстной железы путем перевязки протока и блокады SP-рецептора у крыс
1) Тамарин А. Восстановление подчелюстной железы после обструкции I. Общие изменения и электронно-микроскопические изменения клеток зернистого протока. J Ultrastr Res , 1971; 34: 276–287. [PubMed]
2) Harrison JD, Fouad HM, Garrett JR. Различия в реакции на обструкцию протоков поднижнечелюстных и подъязычных слюнных желез кошек и значение иннервации. J Oral Pathol Med , 2001; 30: 29–34. [PubMed]
J Oral Pathol Med , 2001; 30: 29–34. [PubMed]
3) Osailan SM, Proctor GB, McGurk M, Paterson K. Лигирование внутриротовых протоков без включения парасимпатического нерва вызывает атрофию поднижнечелюстной железы у крыс. Int J Exp Pathol , 2006; 87: 41–48. [Бесплатная статья PMC] [PubMed]
4) Bhaskar SN, Bolden TE, Weinmann JP. Экспериментальный обструктивный аденит у мышей. J Dent R , 1956; 35: 852–862. [PubMed]
5) Shiba R, Hamada T, Kawakatsu K. Гистохимические и электронно-микроскопические исследования влияния перевязки протоков слюнных желез крыс. Arch Oral Biol , 1972; 17: 290–309. [PubMed]
6) Harrison JD, Garrett JR. Эффекты перевязки протоков паренхимы слюнных желез кошки изучены ферментативно-гистохимическими методами. Histochem J , 1976; 8: 35–44. [PubMed]
7) Nilsson BO, Ekström J, Rosengren E. Метаболизм полиаминов в околоушной железе крысы после перевязки протока. Acta Physiol Scand , 1987; 131: 177–181. [PubMed]
[PubMed]
8) Norkerg LE, Abok K, Lundquist PG. Влияние лигирования и облучения на подчелюстные железы у крыс. Акта Отоларингол , 1988; 105: 181–192. [PubMed]
9) Snell RS, Garrett JR. Влияние постганглионарной симпатэктомии на структуру поднижнечелюстной и большой подъязычной слюнных желез крысы. Z Zellforsch , 1958; 48: 639–652. [PubMed]
10) Kyriacou K, Garrett JR. Морфологические изменения поднижнечелюстной железы кролика после парасимпатической или симпатической денервации. Arch Oral Biol , 1988; 33: 4: 281–290. [PubMed]
11) Лихтман Дж.В. Реорганизация синаптических связей в поднижнечелюстном узле крысы в постнатальном развитии. J Physiol , 1977; 273: 155–177. [Бесплатная статья PMC] [PubMed]
12) Кава К., Ропер С. О двух подразделениях и внутренних синаптических связях в поднижнечелюстном ганглии крысы. J Physiol , 1984; 346: 301–320. [PMC бесплатная статья] [PubMed]
13) Цубои Т., Хонда Т. , Хишида С., Шигетоми Т., Уэда М., Сугиура Ю. Количественное исследование плотности нервных волокон в поднижнечелюстной железе крыс. Nagoya J Med Sci , 2004; 67: 25–34. [ПубМед]
, Хишида С., Шигетоми Т., Уэда М., Сугиура Ю. Количественное исследование плотности нервных волокон в поднижнечелюстной железе крыс. Nagoya J Med Sci , 2004; 67: 25–34. [ПубМед]
14) Плотник Г.Х. Измененная пластичность парасимпатической иннервации в выздоравливающей поднижнечелюстной железе крысы после обширной атрофии. Exp Physiol , 2009; 94: 213–219. [PMC free article] [PubMed]
15) Honda T, Ozaki T, Tonosaki Y, Nishiyama K, Shigemoto R, Sugiura Y. Синаптическая организация и ультраструктурные особенности субстанции P-рецептор-подобных иммунореактивных нейронов в промежуточном латеральном ядре крысы. Neurosci Lett , 1995; 197: 117–120. [ПубМед]
16) Шигемото Р., Накая Ю., Номура С., Огава-Мегуро Р., Охиси Х., Канеко Т., и др. Иммуноцитохимическая локализация рецептора вещества Р крысы в стриатуме. Ncurosci Lett , 1993; 153: 157–160. [PubMed]
17) Тандлер Б. Ультраструктура хронически воспаленных поднижнечелюстных желез человека. Arch Pathol Lab Med , 1977; 101: 425–431. [PubMed]
Arch Pathol Lab Med , 1977; 101: 425–431. [PubMed]
18) Гризиус М.М. Дисфункция слюнных желез: обзор системной терапии. Oral Surg Oral Med Oral Pathol Oral Radiol Endod , 2001; 92: 156–162. [PubMed]
19) Daniels TE, Wu AJ, Calif J. Ксеростомия – клиническая оценка и лечение в общей практике. Дент Ассо , 2001; 28: 933–941. [PubMed]
20) Taylor SE, Miller EG. Превентивное фармакологическое вмешательство при радиационно-индуцированной дисфункции слюны. Proc Soc Exper Biol Med , 1999; 221: 14–26. [PubMed]
21) Takai Y, Asano K, Clemente RP, Mori M. Гистохимия лектина поднижнечелюстных желез после перевязки протоков у мышей и крыс. J Oral Pathol , 1985; 14: 740–749. [PubMed]
22) Тамарин А. Восстановление подчелюстной железы после непроходимости. Электронно-микроскопические изменения ацинарных клеток. J Ultrastructure Research , 1971; 34: 288–302. [PubMed]
23) Hanks CT, Chaudhry A. Регенерация поднижнечелюстной железы крыс после частичной экстирпации; Световое и электронно-микроскопическое исследование. Am J Anat , 1971; 130: 195–207. [PubMed]
Am J Anat , 1971; 130: 195–207. [PubMed]
24) Hecht R, Connelly M, Marchetti L, Ball WD, Hand AR. Гибель клеток при развитии вставочных протоков в поднижнечелюстной железе крысы. Анат Рек. , 2000; 258: 349–358. [PubMed]
25) Такахаши С., Накамура С., Судзуки Р., Ислам Н., Домон Т., Ямамото Т., и др. Апоптоз и митоз паренхиматозных клеток в перевязанных протоках поднижнечелюстной железы крысы. Ткани и клетки , 2000; 32: 457–463. [PubMed]
26) Карпентер Г.Х., Проктор Г.Б., Гарретт М.Р. Преганглионарная парасимпатэктомия снижает уровень слюнной секреции SIgA из поднижнечелюстной железы крысы. J Нейроиммунология , 2005; 160: 4–11. [ПубМед]
27) Кобаяши М., Итикава Х., Кобаши М., Фунахаши М., Митох Ю., Мацуо Р. Происхождение чувствительных нервных волокон, иннервирующих поднижнечелюстную слюнную железу у крыс. Brain Res , 2005; 1060: 184–187. [PubMed]
28) Проктор Г.Б., Карпентер Г.Х. Регуляция функции слюнных желез вегетативными нервами.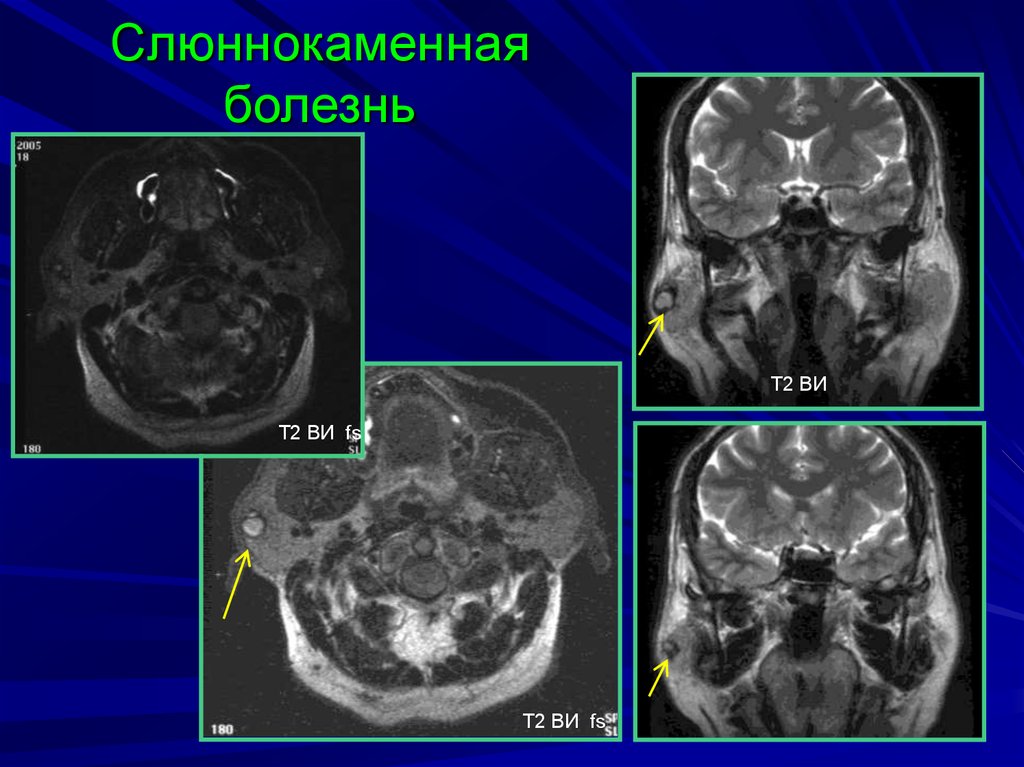 Auton Neurosci , 2007; 133: 3–18. [PubMed]
Auton Neurosci , 2007; 133: 3–18. [PubMed]
29) Goedert M, Nagy JI, Emson.PC. Происхождение вещества Р в поднижнечелюстной железе крысы и ее большом протоке. Brain Res , 1982; 252: 327–333. [PubMed]
30) Pernow B. Substance P. Pharmacol Rev , 1983; 35: 85–141. [PubMed]
31) Hökfelt T, Kellerth JO, Nilsson G, Pernow B. Экспериментальные иммуногистохимические исследования локализации и распределения вещества P в первичных сенсорных нейронах кошек. Brain Res , 1975; 100: 235–252. [PubMed]
32) Takahashi T, Otsuka M. Региональное распределение субстанции P в спинном мозге и нервных корешках кошки и влияние дорзального сечения. Brain Res , 1975; 87: 1–11. [PubMed]
33) Ekström J, Brodin E, Ekman R, Hakanson R, Sundler F. Вазоактивный кишечный пептид и субстанция P в слюнных железах крыс после денервации или перевязки протоков. Регуляторный пептид , 1984; 10: 1–10. [PubMed]
Синдром Шегрена — время для нового подхода | Ревматология
Журнальная статья
Л. Дж. Доусон,
Дж. Доусон,
Л. Дж. Доусон
Ищите другие работы этого автора на:
Оксфордский академический
пабмед
Google ученый
П. М. Смит,П. М. Смит
Ищите другие работы этого автора на:
Оксфордский академический
пабмед
Google ученый
Р. Дж. Мутс,
Р. Дж. Мутс
Ищите другие работы этого автора на:
Оксфордский академический
пабмед
Google ученый
Э. А. Филд
Э. А. Филд
Ищите другие работы этого автора на:
Оксфордский академический
пабмед
Google ученый
Rheumatology , Volume 39, Issue 3, March 2000, Pages 234–237, https://doi. org/10.1093/rheumatology/39.3.234
org/10.1093/rheumatology/39.3.234
- Содержание статьи
- Рисунки и таблицы
- видео
- Аудио
- Дополнительные данные
Цитировать
Cite
Л. Дж. Доусон, П. М. Смит, Р. Дж. Мутс, Э. А. Филд, Синдром Шегрена — время для нового подхода, Ревматология , том 39, выпуск 3, март 2000 г., страницы 234–237, https://doi. org/10.1093/ревматология/39.3.234
Дж. Доусон, П. М. Смит, Р. Дж. Мутс, Э. А. Филд, Синдром Шегрена — время для нового подхода, Ревматология , том 39, выпуск 3, март 2000 г., страницы 234–237, https://doi. org/10.1093/ревматология/39.3.234
Выберите формат Выберите format.ris (Mendeley, Papers, Zotero).enw (EndNote).bibtex (BibTex).txt (Medlars, RefWorks)
Закрыть
Разрешения
- Электронная почта
- Твиттер
- Фейсбук
- Подробнее
Фильтр поиска панели навигации РевматологияЭтот выпускЖурналы Британского общества ревматологииРевматологияКнигиЖурналыOxford Academic Термин поиска мобильного микросайта
Закрыть
Фильтр поиска панели навигации РевматологияЭтот выпускЖурналы Британского общества ревматологииРевматологияКнигиЖурналыOxford Academic Термин поиска на микросайте
Расширенный поиск
Синдром Шегрена является одним из ряда органоспецифических аутоиммунных заболеваний, включая ревматоидный артрит. В настоящее время общепринята классификация синдрома Шегрена на первичную и вторичную формы, но изнурительные эффекты ксеростомии и ксерофтальмии могут долгое время оставаться незамеченными, несмотря на постепенное усиление симптомов. Клинические последствия синдрома Шегрена варьируют от затруднений при разговоре и приеме пищи, кандидоза полости рта и распространенного кариеса до хронического сиалоаденита, слепоты и В-клеточной лимфомы [1, 2]. Лечение заболевания в настоящее время носит паллиативный характер и в основном ограничивается устранением последствий сухости во рту и глаз [3]. Данные эпидемиологических исследований показывают, что распространенность синдрома Шегрена может приближаться или даже превышать [4] распространенность ревматоидного артрита, которым страдает от 1 до 3% населения в целом [5].
В настоящее время общепринята классификация синдрома Шегрена на первичную и вторичную формы, но изнурительные эффекты ксеростомии и ксерофтальмии могут долгое время оставаться незамеченными, несмотря на постепенное усиление симптомов. Клинические последствия синдрома Шегрена варьируют от затруднений при разговоре и приеме пищи, кандидоза полости рта и распространенного кариеса до хронического сиалоаденита, слепоты и В-клеточной лимфомы [1, 2]. Лечение заболевания в настоящее время носит паллиативный характер и в основном ограничивается устранением последствий сухости во рту и глаз [3]. Данные эпидемиологических исследований показывают, что распространенность синдрома Шегрена может приближаться или даже превышать [4] распространенность ревматоидного артрита, которым страдает от 1 до 3% населения в целом [5].
Исследования синдрома Шегрена были ограничены и в основном ограничивались картированием иммунологического прогресса заболевания [1]. Это контрастирует с экстенсивным, многогранным подходом к патогенезу ревматоидного артрита, который уже привел к ряду терапевтических вмешательств [6]. Изучение синдрома Шегрена оставалось малоизученным направлением исследований, в основном из-за традиционного взгляда на заболевание, согласно которому симптомы возникают в результате разрушения железистой ткани [1, 7]. Еще одним препятствием для расследования является отсутствие согласия между исследователями в отношении критериев диагностики заболевания. Трудно оценить данные лабораторных или клинических исследований, когда всего лишь 15% пациентов, характеризуемых как страдающие синдромом Шегрена по одному набору критериев, соответствуют критериям, изложенным в другом месте [8-10].
Изучение синдрома Шегрена оставалось малоизученным направлением исследований, в основном из-за традиционного взгляда на заболевание, согласно которому симптомы возникают в результате разрушения железистой ткани [1, 7]. Еще одним препятствием для расследования является отсутствие согласия между исследователями в отношении критериев диагностики заболевания. Трудно оценить данные лабораторных или клинических исследований, когда всего лишь 15% пациентов, характеризуемых как страдающие синдромом Шегрена по одному набору критериев, соответствуют критериям, изложенным в другом месте [8-10].
До недавнего времени считалось, что потеря функции слюны, наблюдаемая при синдроме Шегрена, возникает как прямое следствие атрофии слюнных желез. Казалось бы, это простой механизм, объясняющий симптомы болезни. Однако два наблюдения указывают на то, что этот механизм, возможно, слишком упрощен. Во-первых, недавние клинические наблюдения показали, что ксеростомия может предшествовать любому значительному разрушению железистой ацинарной ткани, ответственной за нормальную функцию железы [10-13] (Speight, личное сообщение). Во-вторых, атрофия слюнных желез является нормальным следствием старения [14], которое само по себе не приводит к снижению скорости потока [15–17]. Исследования возрастных изменений слюнных желез свидетельствуют о том, что эти ткани обладают значительным функциональным резервом, позволяющим сохранять нормальную скорость потока в пожилом возрасте. Таким образом, пациенты с синдромом Шегрена могут иметь обильную ацинарную ткань слюнных желез, но все же иметь пониженную скорость слюноотделения.
Во-вторых, атрофия слюнных желез является нормальным следствием старения [14], которое само по себе не приводит к снижению скорости потока [15–17]. Исследования возрастных изменений слюнных желез свидетельствуют о том, что эти ткани обладают значительным функциональным резервом, позволяющим сохранять нормальную скорость потока в пожилом возрасте. Таким образом, пациенты с синдромом Шегрена могут иметь обильную ацинарную ткань слюнных желез, но все же иметь пониженную скорость слюноотделения.
Эти результаты опровергают мнение о том, что потеря функции при синдроме Шегрена, по крайней мере, на ранних стадиях заболевания, является следствием атрофии железы. Наиболее разумной гипотезой, основанной на имеющихся на сегодняшний день данных, является то, что какой-то компонент иммунного ответа специфически ингибирует секрецию жидкости ацинарными клетками слюнных желез. Железистая атрофия является хорошо известным последствием потери функции, и возможно, что атрофия слюнных желез при синдроме Шегрена является результатом иммунно-опосредованного торможения, а не его причиной.
Следовательно, дальнейшие исследования синдрома Шегрена должны быть направлены на выявление продукта иммунного ответа, способного подавлять секреторную функцию ацинарных клеток. Первоначальные эксперименты могут быть проведены с использованием животных моделей in vitro для заболевания. Большая часть предыдущих исследований синдрома Шегрена с использованием животных моделей была сосредоточена вокруг иммунологических аспектов заболевания с целью воспроизвести как можно больше симптомов синдрома Шегрена [18]. Этот подход может помочь выяснить, какие аспекты иммунной системы вовлечены в заболевание, но он не обязательно помогает в определении механизмов, которые связывают иммунный ответ с гипофункцией слюны. Создание «идеальной» животной модели синдрома Шегрена само по себе не объясняет нам, почему иммунный ответ препятствует работе желез.
Мы предлагаем альтернативный подход. Вместо того, чтобы пытаться воспроизвести синдром Шегрена in vivo , мы полагаем, что возможно воспроизвести симптомы in vitro . Короче говоря, возьмите нормальные, здоровые, секретирующие жидкость ацинарные клетки, подвергните их воздействию продуктов иммунной системы и определите, способны ли они затем к секреции жидкости. Таким образом, поскольку мы имеем гораздо более точный контроль над средой in vitro по сравнению с in vivo , должно быть относительно просто определить, какой фактор или факторы ответственны за симптомы заболевания.
Короче говоря, возьмите нормальные, здоровые, секретирующие жидкость ацинарные клетки, подвергните их воздействию продуктов иммунной системы и определите, способны ли они затем к секреции жидкости. Таким образом, поскольку мы имеем гораздо более точный контроль над средой in vitro по сравнению с in vivo , должно быть относительно просто определить, какой фактор или факторы ответственны за симптомы заболевания.
Для создания такой модели in vitro должна быть возможность:
изолировать и поддерживать ацинарные клетки в течение достаточно долгого времени, чтобы обеспечить воздействие продуктов иммунной системы;
получать продукты иммунной системы;
оценить секреторную способность ацинарных клеток до и после лечения.
Все эти требования теперь достижимы.
Определяющим признаком ксеростомии является отсутствие секреции слюнной жидкости. Механизмы секреции слюны хорошо изучены [19, 20].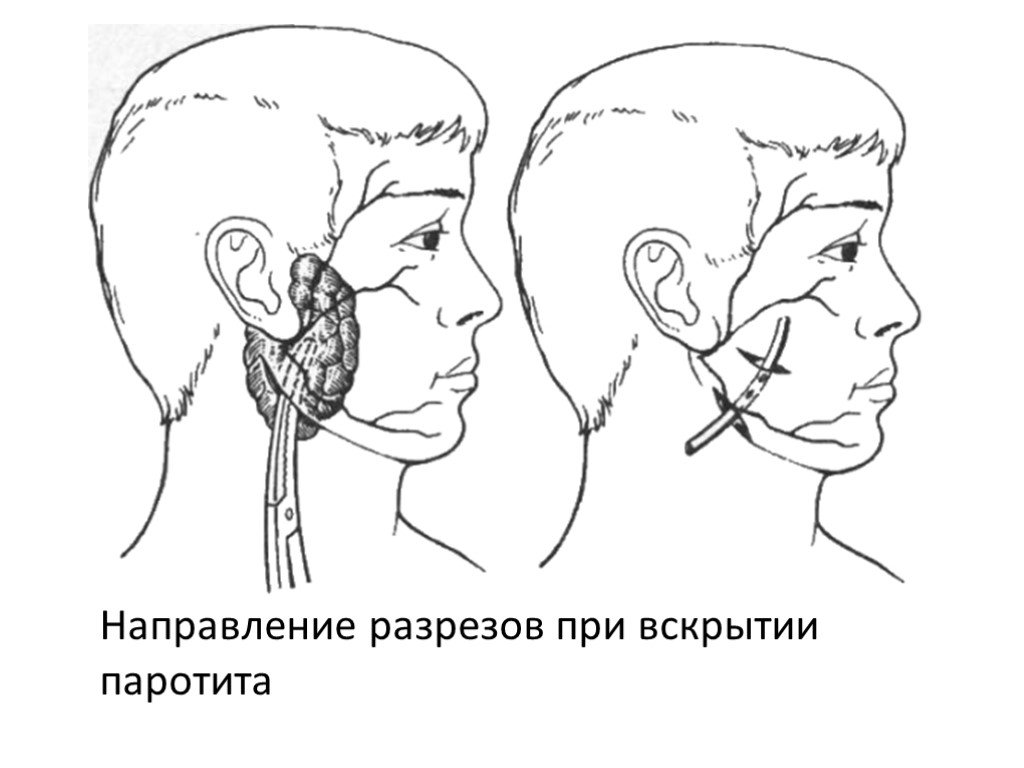 Два ключевых элемента секреторного процесса в ацинарных клетках, повышенная внутриклеточная активность Ca 2 + и повышенная проводимость апикальной мембраны Cl — поддаются исследованию in vitro с использованием микрофлуориметрии [20] и электрофизиологии пэтч-клэмп [21]. соответственно.
Два ключевых элемента секреторного процесса в ацинарных клетках, повышенная внутриклеточная активность Ca 2 + и повышенная проводимость апикальной мембраны Cl — поддаются исследованию in vitro с использованием микрофлуориметрии [20] и электрофизиологии пэтч-клэмп [21]. соответственно.
Одним из возможных посредников взаимодействия между иммунной системой и секрецией жидкости являются цитокины. Цитокины продуцируются лимфоцитами на начальных стадиях иммунного ответа и их функция заключается в межклеточной коммуникации. Одной из функций цитокинов может быть прекращение секреции жидкости. Цитокины могут быть получены в массовом порядке в клеточной культуре путем выделения и активации лимфоцитов селезенки [22]. Преимущество этого подхода в том, что он позволяет получить профиль цитокинов, аналогичный тому, который получен в in vivo , поэтому вероятность получения положительного результата должна быть максимальной. Тем не менее, задача точного определения того, какие цитокины или комбинации цитокинов были наиболее эффективными, все еще должна быть выполнена. К счастью, многие цитокины коммерчески доступны, а профили цитокинов для «синдромоподобных» животных моделей Шегрена доступны в литературе [23–26].
К счастью, многие цитокины коммерчески доступны, а профили цитокинов для «синдромоподобных» животных моделей Шегрена доступны в литературе [23–26].
Недавно мы продемонстрировали, что ацинарные клетки слюнных желез мышей можно поддерживать в первичной культуре в течение периодов до 1 недели без изменения способности клеток реагировать с повышенным внутриклеточным Ca 2+ активность и активация ионных каналов, к секреторным стимулам [27]. Эти данные указывают на то, что эксперименты с хроническим воздействием цитокинов, по крайней мере, осуществимы и что мы сможем обнаружить любые зависимые от цитокинов изменения в связи между стимулом и секрецией.
Несмотря на то, что было бы разумно разработать этот подход модели in vitro с использованием животной модели, однажды установленный, он может быть легко применен к человеческим тканям. Основным преимуществом как патч-кламп, так и микрофлуориметрии является то, что они применяются к отдельным клеткам, и поэтому для этих экспериментов требуется лишь небольшое количество ткани.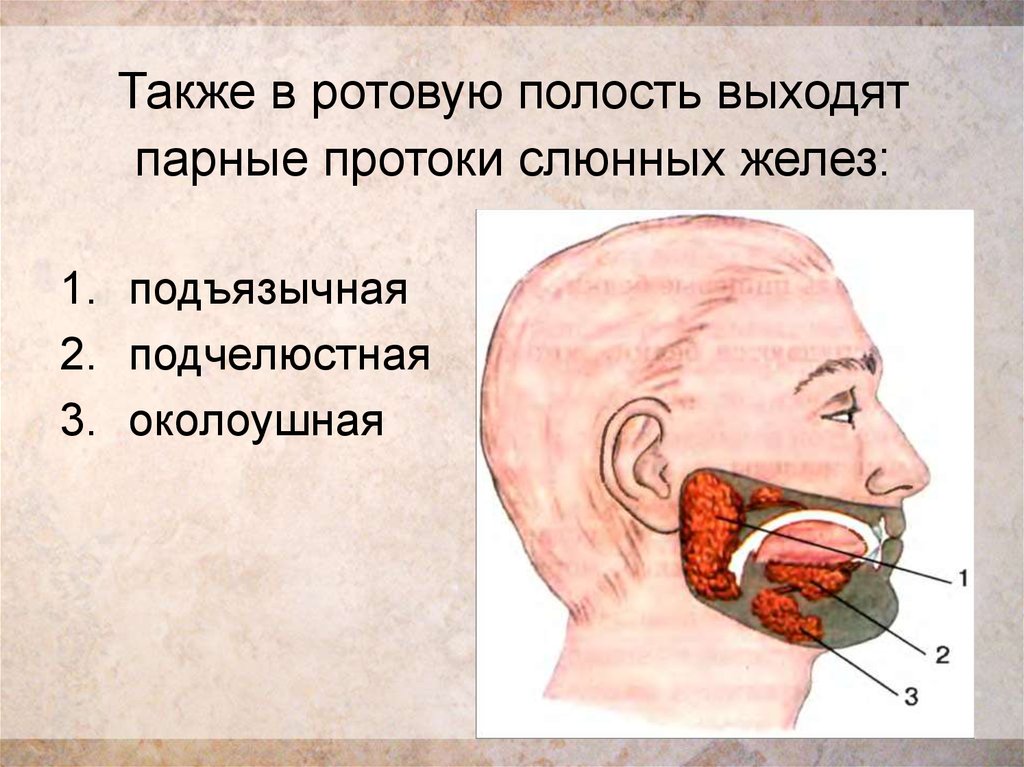 Ацинарные клетки могут быть получены от здоровых людей и от пациентов с синдромом Шегрена после обычных хирургических процедур. Ткани, полученные для диагностических целей, могут быть оценены и позже классифицированы как ткани Шегрена или не Шегрена в зависимости от окончательного диагноза. Таким образом, можно исследовать первопричину заболевания, никоим образом не мешая диагностике или лечению. После выделения с этими тканями можно обращаться так же, как и с животными моделями.
Ацинарные клетки могут быть получены от здоровых людей и от пациентов с синдромом Шегрена после обычных хирургических процедур. Ткани, полученные для диагностических целей, могут быть оценены и позже классифицированы как ткани Шегрена или не Шегрена в зависимости от окончательного диагноза. Таким образом, можно исследовать первопричину заболевания, никоим образом не мешая диагностике или лечению. После выделения с этими тканями можно обращаться так же, как и с животными моделями.
Дальнейшим расширением этого подхода является то, что секреторные свойства этих клеток до и после воздействия иммунных продуктов, таких как цитокины, могут быть непосредственно сопоставлены с секреторными свойствами ацинарных клеток, полученных из диагностической биопсии губной железы пациентов, впоследствии показанных страдать от синдрома Шегрена. Кроме того, корреляция между степенью секреторной компетентности и положительным диагнозом синдрома Шегрена может помочь обосновать критерии, используемые для диагностики, и, таким образом, помочь устранить различия в диагностике.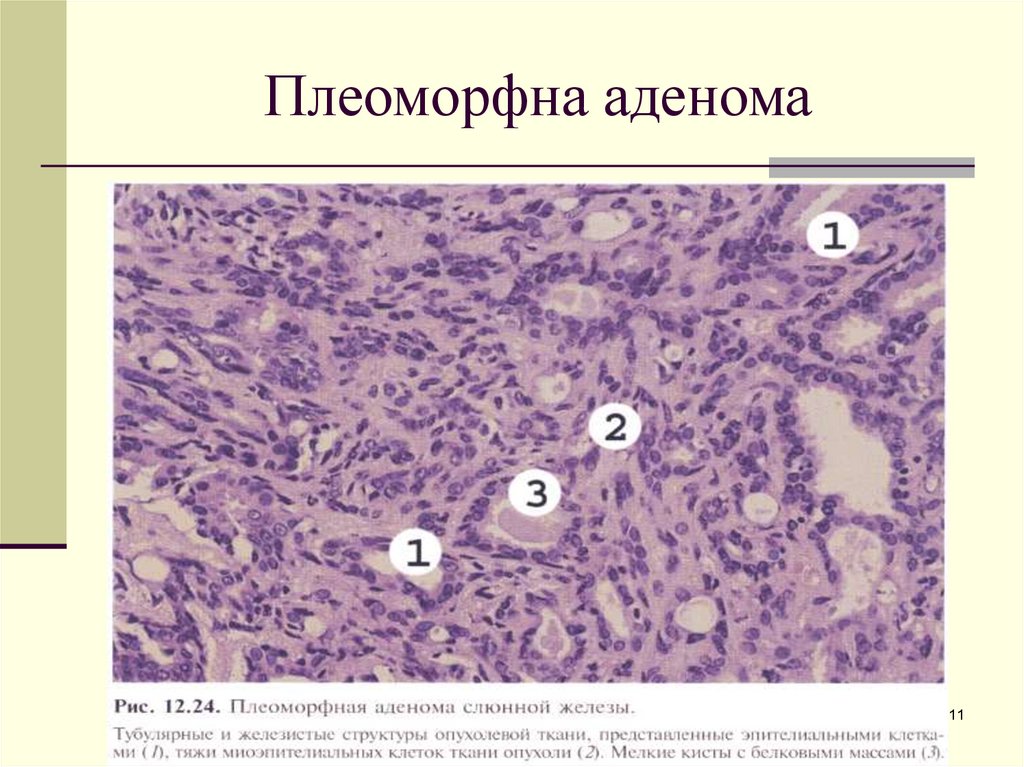
Цитокины являются лишь первыми и наиболее очевидными кандидатами на роль посредников между иммунной системой и секрецией жидкости. У пациентов с синдромом Шегрена вырабатывается широкий спектр антител, включая ревматоидный фактор и антитела против антигенов SS-A и SS-B. Методы in vitro , описанные выше, также могут применяться для исследования любой роли, которую эти антитела играют в ингибировании секреции жидкости. Учитывая, что антитела против мускариновых рецепторов M 3 были идентифицированы у пациентов с синдромом Шегрена [28] и что активация мускариновых M 3 рецептор стимулирует увеличение внутриклеточного Ca 2+ и секрецию жидкости, это потенциально плодотворная область для изучения.
Программа исследований, изложенная выше, требует междисциплинарного подхода с привлечением ученых из лабораторий, включая иммунологов и физиологов, а также группы клиницистов, включая стоматологов, офтальмологов и ревматологов. Фундаментальные исследования патогенеза синдрома Шегрена зависят от клиницистов, предоставляющих образцы тканей, а также от правильной диагностики и лечения пациентов с этим заболеванием. Пациенты с подозрением на синдром Шегрена должны быть полностью обследованы и иметь доказательства как клинических, так и лабораторных признаков заболевания, которых достаточно для постановки диагноза синдрома Шегрена в соответствии с приемлемыми критериями [8, 9].]. База данных клинических и лабораторных исследований является обязательным условием любой исследовательской программы, и в настоящее время в Ливерпуле у нас есть когорта примерно из 60 пациентов с первичным синдромом Шегрена с признаками системного аутоиммунного заболевания, проявляющегося аутоантителами и/или незначительной гистопатологией слюнных желез, характерной для синдрома Шегрена. синдром.
Пациенты с подозрением на синдром Шегрена должны быть полностью обследованы и иметь доказательства как клинических, так и лабораторных признаков заболевания, которых достаточно для постановки диагноза синдрома Шегрена в соответствии с приемлемыми критериями [8, 9].]. База данных клинических и лабораторных исследований является обязательным условием любой исследовательской программы, и в настоящее время в Ливерпуле у нас есть когорта примерно из 60 пациентов с первичным синдромом Шегрена с признаками системного аутоиммунного заболевания, проявляющегося аутоантителами и/или незначительной гистопатологией слюнных желез, характерной для синдрома Шегрена. синдром.
Понимание взаимосвязи между иммунным ответом и секрецией слюнной жидкости, особенно на ранних стадиях синдрома Шегрена, могло бы привести к разработке эффективных терапевтических вмешательств для этого изнурительного и малоизученного заболевания.
Авторы хотели бы отметить постоянный вклад и сотрудничество Ливерпульской исследовательской группы синдрома Шегрена: Роджера Бакнелла, Люка Дж. Доусона, Э. Энн Филд, Сьюзан Хайэм, С. Кэй, Лесли Лонгман, Роберта Дж. Мутса и Питер М. Смит.
Доусона, Э. Энн Филд, Сьюзан Хайэм, С. Кэй, Лесли Лонгман, Роберта Дж. Мутса и Питер М. Смит.
1
Venables PJW. Синдром Шегрена. В: Лахманн П.Дж., Петерс К., Розен Ф.С., Уолпорт М.Дж., ред.
Клинические аспекты иммунологии
. Бостон: Blackwell Scientific,
1993
.
2
Сатклифф Н., Инанк М., Спейт П., Изенберг Д. Предикторы развития лимфомы при первичном синдроме Шегрена.
Семен Ревматоидный артрит
1998
;
28
:
80
–7.
3
Fox RI. Что вызывает синдром Шегрена. В: Карсонс С., Харрис Э.К., ред.
Новый справочник по синдрому Шегрена
. Нью-Йорк: Издательство Оксфордского университета,
1998
.
4
Цена EJ, Venables PJ. Этиопатогенез синдрома Шегрена.
Семен Ревматоидный артрит
1995
;
25
:
117
–33.
5
Хейз Дж. М., Силман А. Дж. Обзор данных Великобритании по ревматическим заболеваниям — 2. Ревматоидный артрит.
Br J Ревматол
1990
;
29
:
310
–2.
6
Elliott MJ, Maini RN, Feldmann M et al. Повторная терапия моноклональными антителами к фактору некроза опухоли альфа (cA2) у пациентов с ревматоидным артритом.
Ланцет
1994
;
344
:
1125
–7.
7
Фокс Р.И., Сайто И. Синдром Шегрена: иммунологические и нейроэндокринные механизмы.
Adv Exp Med Biol
1994
;
350
:
609
–21.
8
Фокс Р.И., Робинсон К.А., Курд Дж.Г., Козин Ф., Хауэлл Ф.В. Синдром Шегрена. Предлагаемые критерии классификации.
Ревматоидный артрит
1986
;
29
:
577
–85.
9
Виталий С., Мутсопулос Х.М., Бомбардьери С. Исследовательская группа Европейского сообщества по диагностическим критериям синдрома Шегрена. Чувствительность и специфичность тестов на поражение глаз и полости рта при синдроме Шегрена.
Энн Реум Дис
1994
;
53
:
637
–47.
10
Фокс Р.И., Маруяма Т. Патогенез и лечение синдрома Шегрена.
Curr Opin Rheumatol
1997
;
9
:
393
–9.
11
Хамфрис-Бехер М., Брайер Дж., Ямачика С., Пек А.Б., Йонссон Р. Альтернативный взгляд на иммунный ответ при аутоиммунной экзокринопатии: индукция функционального покоя, а не деструктивная аутоагрессия.
Scand J Immunol
1999
;
49
:
7
–10.
12
Андо Ю., Шимура С., Савай Т., Саски Х., Такишима Т., Ширато К. Морфометрический анализ дыхательных путей при синдроме Шегрена.
Am Resp Resp Dis
1993
;
148
:
545
–50.
13
Джонсон Р., Кронельд У., Бэкман К., Магнуссон Б., Тарковски А. Прогрессирование сиалоаденита у пациентов с синдромом Шегрена.
Br J Ревматол
1993
;
32
:
578
–81.
14
Скотт Дж. Качественные и количественные наблюдения за гистологией губных слюнных желез человека, полученные посмертно.
J Biol Buccale
1980
;
8
:
187
–200.
15
Heft MW, Baum BJ. Нестимулированный и стимулированный околоушный слюноотделение у лиц разного возраста.
J Dent Res
1984
;
63
:
1182
–5.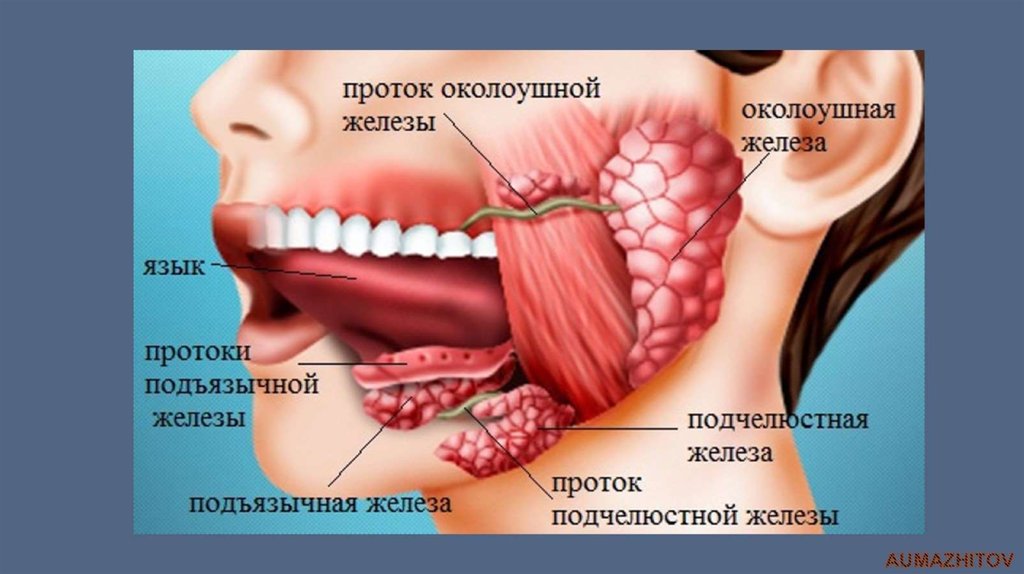
16
Судно JA, Baum BJ. Нормально ли снижение слюноотделения у пожилых людей?
Ланцет
1990
;
336
:
1507
.
17
Среебный Л.М. Ксеростомия: диагностика, лечение и клинические осложнения. В: Эдгар В.М., О’муллейн Д.М., ред.
Слюна и здоровье полости рта
. Лондон: Британская стоматологическая ассоциация,
1996
.
18
Hu Y, Nakagawa Y, Purushotham KR, Humphreys-Beher MG. Функциональные изменения в слюнных железах мышей NOD, склонных к аутоиммунным заболеваниям.
Am J Physiol
1992
;
263
:
E607
–14.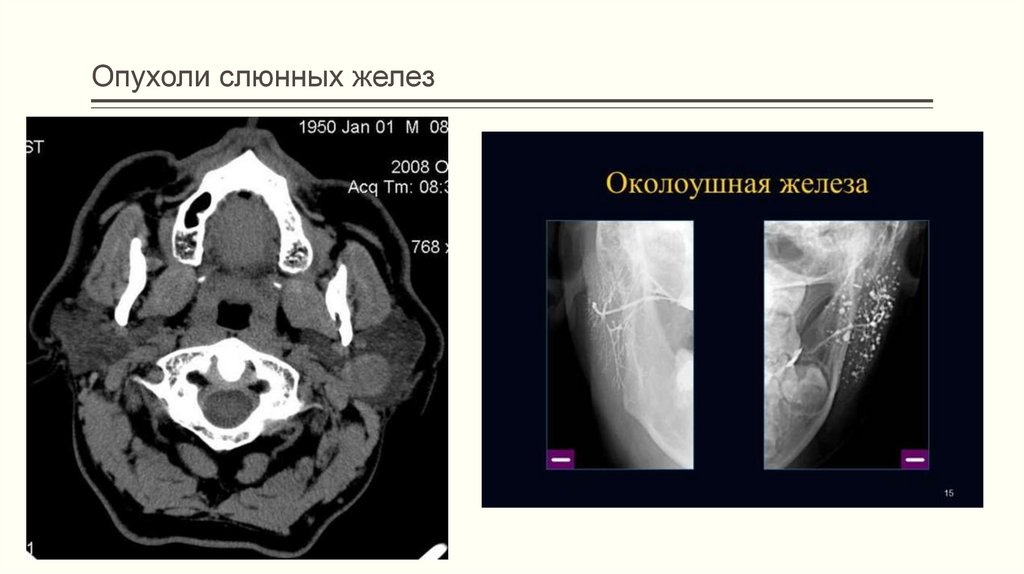
19
Петерсен Огайо. Связь между стимулом и секрецией: цитоплазматические сигналы кальция и контроль ионных каналов в экзокринных ацинарных клетках.
J Physiol
(Лонд)
1992
;
448
:
1
–51.
20
Смит PM. Механизмы секреции слюнными железами. В: Эдгар В.М., О’муллан Д.М., ред.
Слюна и здоровье полости рта
. Лондон: Британская стоматологическая ассоциация,
1996
.
21
Смит П.М., Галлахер Д.В. Электрофизиологические корреляты секреции жидкости слюнными ацинусами. В: Гаррет Дж. Р., Экстром Дж., Андерсон Л. С., ред.
Железистые механизмы секреции слюны
. Базель: Karger,
Базель: Karger,
1998
.
22
Бирн Дж.А., Батлер Дж.Л., Купер М.Д. Дифференциальные требования к активации для первичных Т-клеток и клеток памяти.
Дж Иммунол
1988
;
141
:
3249
–57.
23
Hayashi Y, Hanji N, Hamano H. Экспрессия генов цитокинов и продукция аутоантител при синдроме Шегрена у мышей MRL/lpr.
Аутоиммунитет
1996
;
23
:
269
–77.
24
Yanagi K, Ishimaru N, Haneji N, Saegusa K, Saito I, Hayashi Y. Анти-120-кДа альфа-фодриновый иммунный ответ с Th2-цитокиновым профилем в мышиной модели NOD синдрома Шегрена.
Eur J Immunol
1998
;
28
:
3336
–45.
25
Мустафа В., Чжу Дж., Дэн Г. и др. Повышенные уровни мРНК цитокинов, связанных с макрофагами и клетками Th2, в поднижнечелюстных железах мышей MRL/lpr с аутоиммунным сиалоаденитом.
Clin Exp Immunol
1998
;
112
:
389
–96.
26
Hayashi Y, Haneji N, Hamano H. Патогенез синдромоподобных аутоиммунных поражений Шегрена у мышей MRL/lpr.
Патол Инт
1994
;
44
:
559
–68.
27
Доусон Л.

