безопасность и эффективность применения в широкой клинической практике
АСК — ацетилсалициловая кислота
ЖКТ — желудочно-кишечный тракт
ИБС — ишемическая болезнь сердца
ЛС — лекарственные средства
НПВС — нестероидные противовоспалительные лекарственные средства
ЦОГ — циклооксигеназа
PG — простагландин
TxA2 — тромбоксан
Современную клиническую практику трудно представить без применения различных нестероидных противовоспалительных лекарственных средств (НПВС). В Древней Греции более 3,5 тыс. лет назад Гиппократ использовал как жаропонижающее и обезболивающее средство экстракт коры ивы. Значительно позже, в XVII веке из нее было выделено вещество, которое получило название салициловой кислоты (от лат. salix — ива). В конце XIX века в Германии было начато производство салициловой кислоты и ацетилсалициловой кислоты (АСК). В настоящее время в клинической практике известно более 20 различных представителей этой группы, имеющих различия по химической структуре, особенностям механизма действия, показаниям к применению и переносимости.
Механизм действия НПВС. НПВС ингибируют синтез простагландинов (PG), которые являются важными физиологическими и патологическими медиаторами. PG принимают участие в таких процессах, как боль, воспаление, онкогенез, остеопороз, регуляция температуры тела (гипертермия) и работы почек и т.д. Из арахидоновой кислоты с участием фермента циклооксигеназы (ЦОГ) образуется PGh3, который является предшественником таких PG, как тромбоксан (TxA2), простациклин, или PGI2, D2, E2 и F2(см. рисунок).Рисунок 1. Механизм действия НПВС [2, 3]. Известны две основные изоформы ЦОГ: ЦОГ-1 и ЦОГ-2. Вопрос о выделении в экспериментальных условиях третьей изоформы — ЦОГ-3 как варианта ЦОГ-1 остается нерешенным [1]. Первая изоформа (ЦОГ-1) синтезируется постоянно и работает по универсальному механизму, т.е. независимо от того, в каком органе или ткани идет синтез. Синтез второй изоформы (ЦОГ-2) стимулируется различными факторами воспаления (липополисахариды, интерлейкины, α-фактор некроза опухоли) в различных клетках организма человека, таких как эндотелий, остеокласты, синовиоциты, моноциты и макрофаги [2].
Основные фармакодинамические свойства НПВС — противовоспалительный, жаропонижающий и обезболивающие эффекты — обеспечиваются посредством ингибирования ЦОГ-1 и ЦОГ-2. Именно ингибированием ЦОГ-1 и ЦОГ-2 обусловлены основные нежелательные реакции на фоне применения НПВС. Простагландины PGE2 и PGI2, которые синтезируются с участием ЦОГ-1 в желудочно-кишечном тракте (ЖКТ), являются цитопротекторами слизистой оболочки за счет снижения секреции париетальными клетками желудка соляной кислоты, улучшения кровотока и стимуляции выработки слизи. Кроме того, с участием ЦОГ-1 происходит синтез TxA Риск развития таких осложнений выше у людей пожилого возраста и не зависит от длительности применения лекарственных средств (ЛС) [4].
Риск развития таких осложнений выше у людей пожилого возраста и не зависит от длительности применения лекарственных средств (ЛС) [4].
Классификация НПВС представлена в табл. 1. Среди представителей НПВС существуют различия в химической структуре, особенностях действия и в степени ингибирования ЦОГ-1 и ЦОГ-2. Селективность НПВС в отношении изоформ ЦОГ принято оценивать по отношению степени ингибирования ЦОГ-1 к ЦОГ-2 (коэффициент селективности). Селективными ингибиторами ЦОГ-2 являются те НПВС, у которых данный коэффициент более 5, высокоселективными ингибиторами — если данный коэффициент более 50 (см. табл. 1). НПВС с высокой селективностью в отношении ЦОГ-2 получили название коксибов (от англ. — сyclo-oxygenase, сокращенный вариант COX).
Клиническая фармакология ибупрофена. Одним из НПВС, широко применяющимся в клинической практике, является ибупрофен, который был синтезирован С. Адамсом и Д. Николсоном в Великобритании 1962 г. На территории Российской Федерации он зарегистрирован под торговым названием Нурофен (оригинальный препарат). Оказывает выраженные противовоспалительный, анальгетический и жаропонижающий эффекты, что в сочетании с хорошей переносимостью, предсказуемостью побочных эффектов и низким риском развития осложнений послужило причиной его широкого распространения в клинической практике.
Оказывает выраженные противовоспалительный, анальгетический и жаропонижающий эффекты, что в сочетании с хорошей переносимостью, предсказуемостью побочных эффектов и низким риском развития осложнений послужило причиной его широкого распространения в клинической практике.
По химической структуре ибупрофен является производным пропионовой кислоты, по механизму действия — неселективным ингибитором ЦОГ-1 и ЦОГ-2, липоксигеназы, участвующей в синтезе провоспалительных лейкотриенов [6].
Ибупрофен представляет собой рацемическую смесь двух оптических лево- и правовращающих изомеров — энантиомеров S (+) и R (–). Клиническая эффективность ибупрофена обусловлена в основном действием формы S (+), однако наличием изомера R (–) объясняют некоторые противовоспалительные свойства ибупрофена [7].
Многообразие лекарственных форм ибупрофена. Современные возможности применения ибупрофена связаны с достижениями в области патофизиологии заболеваний и разработкой новых лекарственных форм этого ЛС.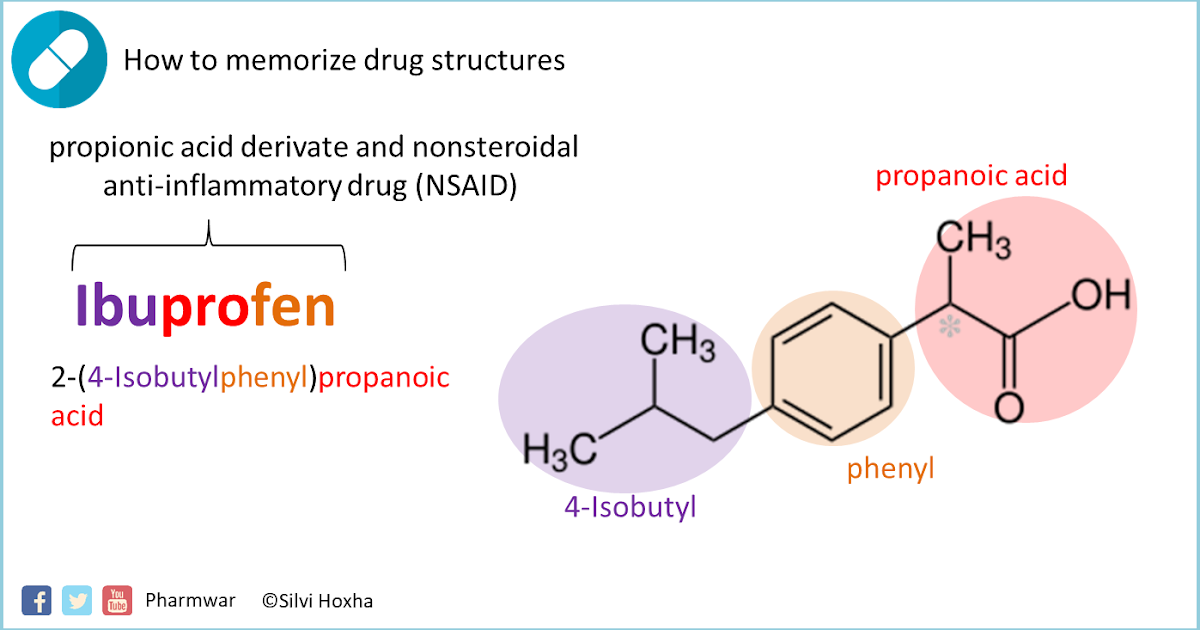 В настоящее время на рынке ЛС ибупрофен представлен разнообразными лекарственными формами.
В настоящее время на рынке ЛС ибупрофен представлен разнообразными лекарственными формами.
В клинической практике представлены также новые лекарственные формы с модифицированным высвобождением, т.е. с измененным по отношению к обычной форме механизмом и характером высвобождения лекарственного вещества. Известны такие формы ибупрофена, как форма быстрого высвобождения (immediate release — IR) и форма медленного высвобождения (sustained release — SR).
Фармакокинетика ибупрофена. Основные фармакокинетические параметры ибупрофена, в частности концентрация энантиомеров в плазме или площадь под фармакокинетической кривой, зависят от лекарственной формы и дозы ибупрофена (см. табл. 2).
При приеме внутрь ибупрофен быстро абсорбируется из верхних отделов тонкой кишки. Биодоступность ибупрофена как слабой кислоты при приеме внутрь составляет в среднем 80%. Прием пищи, как правило, снижает скорость всасывания ибупрофена, однако показано, что некоторые продукты и напитки (например, кока-кола) могут вызывать увеличение степени абсорбции. Время достижения максимальной концентрации изомеров ибупрофена в плазме или сыворотке в среднем составляет 1—2 ч и зависит от лекарственной формы ибупрофена (см. табл. 2). По скорости всасывания лекарственные формы ибупрофена можно распределить в возрастающем порядке: ибупрофен таблетки → ибупрофен суспензия → ибупрофен раствор. Быстрая абсорбция ибупрофена из жидких форм (суспензия, раствор) обеспечивает более быстрый обезболивающий и жаропонижающий эффект.
После приема внутрь 40—60% формы R (–) ибупрофен метаболизируется в кишечнике и печени в форму S (+). Дальнейшая биотрансформация ибупрофена проходит в 2 фазы. I — фаза окислительных реакций связана с системой микросомальных ферментов цитохрома P-450 (2C9, 2C8 и 2C19), обеспечивающих образование неактивных карбоксильных и фенольных соединений. Различия в генотипах системы P-450 2C9 приводят к различиям в метаболизме ибупрофена, увеличению площади под фармакокинетической кривой и изменению печеночного клиренса [7]. II фаза метаболизма ибупрофена включает процессы образования неактивных глюкуроновых и тауриновых соединений, которые в последующем экскретируются преимущественно через почки. Нарушение функции печени вследствие цирроза печени приводит к замедлению инверсии формы R (–) ибупрофена в S форму (+), а также к увеличению времени полувыведения до 3,4 ч. Нарушение функции почек также снижает скорость выведения метаболитов ибупрофена.
Ибупрофен имеет высокую степень связи с альбуминами плазмы (90—99%). У взрослых ибупрофен при приеме внутрь и внутривенном введении имеет короткий период полувыведения около 2 ч. Ибупрофен хорошо проникает в синовиальную жидкость воспаленных суставов, что обеспечивает обезболивающий и противовоспалительный эффекты. Жаропонижающий эффект ибупрофена обусловлен ингибированием синтеза PGЕ2 в центральной нервной системе. Ибупрофен является липофильным веществом, однако через гематоэнцефалический барьер проникает только его свободная (несвязанная с альбумином) фракция.
У взрослых ибупрофен при приеме внутрь и внутривенном введении имеет короткий период полувыведения около 2 ч. Ибупрофен хорошо проникает в синовиальную жидкость воспаленных суставов, что обеспечивает обезболивающий и противовоспалительный эффекты. Жаропонижающий эффект ибупрофена обусловлен ингибированием синтеза PGЕ2 в центральной нервной системе. Ибупрофен является липофильным веществом, однако через гематоэнцефалический барьер проникает только его свободная (несвязанная с альбумином) фракция.
При местном применении ибупрофена отмечается некоторое снижение системной биодоступности препарата до 14—30% от таковой при приеме внутрь [12], в то же время после местного применения более высокие концентрации отмечаются в подкожных и мягких тканях, в том числе мышечной [13]. В ряде работ у больных разных категорий показано, что эффективность местного применения ибупрофена (5% гель) и ибупрофена (1200 мг/сут) приема внутрь как при острых травматических повреждениях мягких тканей, так и при хроническом болевом синдроме одинаковая, а переносимость топических форм лучше [12, 14, 15].
Показатели фармакокинетической кривой при ректальном применении сопоставимы с данными фармакокинетики при применении препарата внутрь. Абсорбция при ректальном введении ибупрофена характеризуется высокой степенью биодоступности и быстротой наступления максимальной концентрации в плазме. Кроме того, особенности кровоснабжения ректальной области приводят к тому, что только часть препарата подвергается метаболизму в печени, что приводит к увеличению периода полувыведения.
Показатели фармакокинетики существенно не различаются как у мужчин и женщин, так и в разных возрастных группах. Фармакокинетические показатели у детей старше 2 лет и подростков не отличаются от таковых у взрослых. Исключение составляют лишь дети младше 2 лет, у которых метаболизм ибупрофена значительно ниже, чем у взрослых, что требует правильного режима дозирования препарата в зависимости от массы тела ребенка. С увеличением возраста отмечается некоторое увеличение периодов полувыведения, что отражает возрастные изменения процессов метаболизма и клиренса, однако у пожилых людей выведение ибупрофена не претерпевает значительных изменений.
Безопасность ибупрофена. Разработка селективных ингибиторов ЦОГ-2 была направлена на преодоление ограничений применения НПВС из-за риска развития нежелательных реакций ЖКТ. Однако в ходе внедрения в клиническую практику коксибов возникла другая проблема безопасности при длительном применении — увеличение риска развития сердечно-сосудистых тромботических осложнений, инфаркта миокарда и инсульта [16]. В основе повышения риска развития тромботических осложнений на фоне селективных ингибиторов ЦОГ-2 лежит нарушение баланса между тромбоксаном и простациклином, регулирующими функцию эндотелия и агрегацию тромбоцитов. Селективные коксибы за счет избирательной блокады ЦОГ-2 нарушают баланс между уровнем тромбоксана и простациклина, что является основой для развития тромботических осложнений [2]. Однако результаты последующих клинических наблюдений показали, что на фоне применения неселективных НПВС также повышается риск развития сердечно-сосудистых осложнений [17, 18]. Современные международные рекомендации, основанные на результатах длительных клинических исследований, ограничивают применение и коксибов, и неселективных НПВС у больных ишемической болезнью сердца (ИБС), инсультом или с наличием высокого риска развития ИБС [3, 5].
Другой нежелательной реакцией на фоне длительного применения НПВС является нарушение функции почек, поскольку обе изоформы ЦОГ играют значимую роль в регуляции работы почек. PG регулируют тонус сосудов, поддерживают нормальный кровоток, что необходимо для поддержания нормальной функции почек. В настоящее время известно, что ингибирование ЦОГ-1 приводит к снижению клубочковой фильтрации, а ингибирование ЦОГ-2 замедляет реабсорбцию натрия у здоровых добровольцев и людей пожилого возраста. По данным метаанализа селективные ингибиторы ЦОГ-2 увеличивают риск развития почечной недостаточности и аритмии [2, 19].
Ибупрофен обладает обширной доказательной базой по безопасности, благодаря чему во многих странах мира находится в безрецептурном отпуске (в дозировках менее 1200 мг).
Безопасность ибупрофена продемонстрирована во многих крупных клинических исследованиях. Наибольший интерес представляет многоцентровое рандомизированное исследование, проведенное в 1999 г.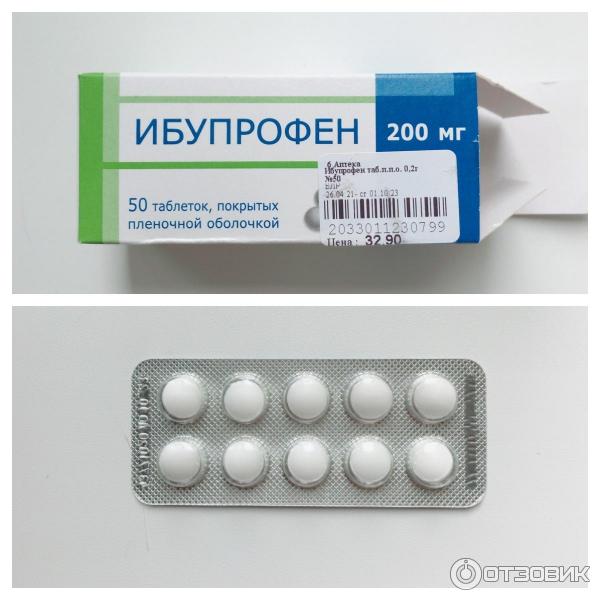 во Франции с участием 8677 пациентов (PAIN study), целью которого являлось сравнение эффективности и переносимости безрецептурных анальгетиков: АСК, парацетамола и ибупрофена. Было показано, что ибупрофен (в дозе менее 1200 мг) переносится так же хорошо, как считавшийся ранее эталоном безопасности парацетамол, а по сравнению с АСК вызывает значительно меньшую частоту побочных реакций [20].
во Франции с участием 8677 пациентов (PAIN study), целью которого являлось сравнение эффективности и переносимости безрецептурных анальгетиков: АСК, парацетамола и ибупрофена. Было показано, что ибупрофен (в дозе менее 1200 мг) переносится так же хорошо, как считавшийся ранее эталоном безопасности парацетамол, а по сравнению с АСК вызывает значительно меньшую частоту побочных реакций [20].
При сравнении частоты нежелательных реакций ЖКТ отмечено, что для ибупрофена характерна высокая безопасность, обусловленная наличием малоактивного энантиомера R, который является конкурентом для активной формы S за активный центр ЦОГ-1, отвечающий за синтез PG, которые обеспечивают защиту слизистой оболочки ЖКТ. Кроме того, короткий период полувыведения ибупрофена также, возможно, дает преимущества по безопасности применения этого ЛС.
Ибупрофен не образует токсичных метаболитов, его токсичность после случайной или преднамеренной передозировки ниже и он имеет относительно больший терапевтический индекс (примерно в 4 раза выше, чем у парацетамола). Для ибупрофена также нехарактерно развитие синдрома Рея (острая печеночная энцефалопатия у детей на фоне приема АСК) [14, 21].
Для ибупрофена также нехарактерно развитие синдрома Рея (острая печеночная энцефалопатия у детей на фоне приема АСК) [14, 21].
Клиническая эффективность ибупрофена. Ибупрофен является эффективным анальгетиком при остром болевом синдроме различного генеза. В дозе 400 мг неоднократно доказал свое преимущество по сравнению с плацебо при послеоперационной, зубной боли, боли в горле, дисменореи, головной боли напряжения и мигрени, травме мягких тканей, невралгиях и миалгиях, а также ряде других состояний, сопровождающихся выраженным болевым синдромом.
При головной боли ибупрофен как препарат первого ряда входит в перечень анальгетиков, рекомендованных ВОЗ, а также Европейской федерацией неврологических обществ (EFNS) для терапии приступа мигрени легкой и средней тяжести (класс А) [22, 23]. Эффективность ибупрофена в терапии цефалгий доказана во многих плацебо-контролируемых клинических исследованиях, а также нескольких метаанализах, в том числе у детей и подростков [24—28].
В дозе 200—400 мг ибупрофен является «золотым стандартом» при лечении умеренного болевого синдрома у лиц с послеоперационной зубной болью [29]. В метаанализе продемонстрирована высокая эффективность ибупрофена по сравнению с плацебо по результатам 72 исследований. Ибупрофен значительно снижал боль у всех пациентов — не менее чем на 50% в среднем на 4,7 ч. Повторная анальгезия требовалась всего у 48% пациентов, принявших ибупрофен в дозе 200 мг, и у 42% — в дозе 400 мг [30]. В другом метаанализе на основании 33 исследований выявлено преимущество ибупрофена (400 мг) в купировании болевого синдрома после экстракции зуба по сравнению с парацетамолом (1000 мг), а также комбинацией парацетамола (600—650 мг) и кодеина (60 мг) [31].
Особенно остро стоит вопрос выбора эффективного и безопасного НПВП в детской практике, ввиду того что лихорадочный и болевой синдром являются ведущими в ряде заболеваний, в том числе при респираторных инфекциях, наиболее часто встречающихся у маленьких детей. В крупных многоцентровых рандомизированных исследованиях показано, что среди всех анальгетиков-антипиретиков ибупрофен и парацетамол являются наиболее безопасными препаратами. Так, метаанализ, объединяющий 24 рандомизированных и 12 обсервационных исследования в период с 1950 по 2008 г., не показал статистически значимых различий по частоте развития нежелательных побочных реакций ЖКТ и почек, а также по влиянию на течение бронхиальной астмы при приеме ибупрофена, парацетамола и плацебо [32]. Наиболее крупный систематический обзор данных по эффективности и безопасности ибупрофена по сравнению с парацетамолом в лечении лихорадки и боли у детей и взрослых был проведен в 2010 г. В него вошли 85, в том числе крупных рандомизированных исследований в период 2008—2009 г. Авторами был сделан вывод о большей эффективности ибупрофена по сравнению с парацетамолом при лечении лихорадки и боли во всех возрастных группах при равной безопасности [33].
В крупных многоцентровых рандомизированных исследованиях показано, что среди всех анальгетиков-антипиретиков ибупрофен и парацетамол являются наиболее безопасными препаратами. Так, метаанализ, объединяющий 24 рандомизированных и 12 обсервационных исследования в период с 1950 по 2008 г., не показал статистически значимых различий по частоте развития нежелательных побочных реакций ЖКТ и почек, а также по влиянию на течение бронхиальной астмы при приеме ибупрофена, парацетамола и плацебо [32]. Наиболее крупный систематический обзор данных по эффективности и безопасности ибупрофена по сравнению с парацетамолом в лечении лихорадки и боли у детей и взрослых был проведен в 2010 г. В него вошли 85, в том числе крупных рандомизированных исследований в период 2008—2009 г. Авторами был сделан вывод о большей эффективности ибупрофена по сравнению с парацетамолом при лечении лихорадки и боли во всех возрастных группах при равной безопасности [33].
По рекомендации ВОЗ ибупрофен в дозе 5—10 мг/кг наравне с парацетамолом является препаратом выбора в качестве жаропонижающего и болеутоляющего средства (при слабом и умеренном болевом синдроме) у детей с 3 мес. Никакие другие НПВС не могут быть рекомендованы для использования в детской практике в силу отсутствия необходимой доказательной базы их эффективности и безопасности [34, 35].
Никакие другие НПВС не могут быть рекомендованы для использования в детской практике в силу отсутствия необходимой доказательной базы их эффективности и безопасности [34, 35].
В настоящее время ибупрофен является также единственным препаратом, внесенным в формуляр ВОЗ, для лечения открытого артериального протока у новорожденных [36]. Изучаются новые, потенциально возможные, показания к применению ибупрофена.
Муковисцидоз. В нескольких клинических исследованиях продемонстрировано влияние ибупрофена на замедление прогрессирования легочного процесса (замедление снижения объема форсированного выдоха за 1-ю секунду) у больных муковисцидозом при длительном применении в различных возрастных группах [37—39]. Полученные результаты, вероятно, связаны с уменьшением притока полиморфно-ядерных клеток в легкие и, следовательно, воспалительного процесса [40]. Несмотря на то что применялись большие дозы ибупрофена, риск развития побочных реакций ЖКТ оставался низким [37, 38].
Болезнь Паркинсона. Считается, что одним из ключевых звеньев патогенеза болезни Паркинсона является нейровоспаление. На основании данного предположения проведено несколько исследований, целью которых было определение роли НПВП в развитии заболевания. Проведенный в 2010 г. метаанализ 7 крупных эпидемиологических исследований продемонстрировал снижение риска развития болезни Паркинсона на 15% в общей группе пациентов, принимавших НПВП, а также на 29 и 21% соответственно при регулярном и длительном применении НПВП. Наиболее сильный нейропротективный эффект отмечен у ибупрофена, что подтверждено и рядом других исследований [41—43].
Рак молочной железы. В настоящее время большой интерес вызывает положительное влияния НПВС, в первую очередь АСК и ибупрофена, на риск развития различных видов рака [44—46]. По результатам метаанализа (38 исследований, n=2 788715) сделаны выводы о возможном онкопротективном действие НПВП, прежде всего ибупрофена (относительный риск 0,79 при 95% доверительном интервале от 0,64 до 0,97) в отношение развития рака молочной железы [47]. Другой метаанализ (26 исследований, n=528 705) продемонстрировал аналогичные результаты [48]. Возможно, после проведения крупных плацебо-контролируемых исследований применение ибупрофена будет рекомендовано в качестве профилактики онкологических заболеваний.
Другой метаанализ (26 исследований, n=528 705) продемонстрировал аналогичные результаты [48]. Возможно, после проведения крупных плацебо-контролируемых исследований применение ибупрофена будет рекомендовано в качестве профилактики онкологических заболеваний.
Таким образом, при назначении терапии важно сделать выбор в пользу проверенного временем средства. Более чем 40-летний опыт применения ибупрофена в широкой клинической практике почти в 80 странах мира в качестве безрецептурного препарата является наглядным примером его эффективности и безопасности [49].
клиническая фармакология и терапевтическая эффективность при головной боли
Головна > Статьи > Ибупрофен: клиническая фармакология и терапевтическая эффективность при головной боли
Актуальна тема «Ібупрофен: вибір оптимальної лікарської форми» Головна сторінка теми
Авторы:
И. И. Князькова
И. Князькова
21.06.2018
Нестероидные противовоспалительные препараты (НПВП) представляют собой одну из наиболее широко распространенных и востребованных групп лекарственных средств, доступных на фармацевтическом рынке. Отмечено, что в мире около 300 млн человек принимают НПВП кратковременно, причем до 200 млн – без назначения врача и более 30 млн – постоянно [1]. В то же время анализ исследований в области рационального применения НПВП показал, что основными причинами их нерационального применения являются: недостаточный уровень информированности врачей и фармацевтических работников, недостаточный уровень осведомленности пациентов, отсутствие взаимодействия между участниками процесса назначения, отпуска и приема препарата [2]. В представленной статье обобщены данные о клинической фармакологии ибупрофена и его эффективности при головной боли.
Ибупрофен – первый представитель производных пропионовой кислоты, запатентованный в 1961 г. фармацевтом и фармакологом Стюартом Адамсом и химиком Джоном Николсоном и представленный в 1969 г. в качестве лучшей альтернативы ацетилсалициловой кислоте (АСК). Сегодня, по оценкам экспертов, ибупрофен является наиболее часто назначаемым НПВП в клинической практике [3]. Производные ацетилсалициловой и пропионовой кислот разрешены к применению в качестве безрецептурных лекарственных препаратов.
Механизм действия НПВП связан с ингибированием ферментов циклооксигеназы 1 и 2 типа (ЦОГ‑1 и ЦОГ‑2), ответственных за превращение арахидоновой кислоты в простаноиды. Ибупрофен относится к неселективным ингибиторам ЦОГ, которые ингибируют обе изоформы фермента [4].
Продемонстрировано, что экспрессия изоформы ЦОГ‑1 осуществляется постоянно почти во всех типах клеток организма; она участвует в физиологических процессах, протекающих в тканях и органах. В то же время экспрессия ЦОГ‑2 происходит не постоянно, а индуцируется повреждением тканей или воспалением. Именно поэтому считается, что экспрессия ЦОГ‑2 является ответственной за развитие воспаления, боли и лихорадки [5].
Именно поэтому считается, что экспрессия ЦОГ‑2 является ответственной за развитие воспаления, боли и лихорадки [5].
Ингибируя синтез простагландинов через систему ЦОГ, НПВП обладают уникальным сочетанием противовоспалительной, аналгетической, жаропонижающей активности, а также антиагрегантным действием [6]. Отличительной особенностью ибупрофена является выраженное обезболивающее и жаропонижающее действие, а также противовоспалительный эффект [7].
Клиническая фармакология ибупрофена
Ибупрофен представляет собой рацемическую смесь R- и S-энантиомеров. После приема внутрь ибупрофен быстро всасывается в желудочно-кишечном тракте. Максимальная концентрация в плазме крови действующего вещества достигается через 45 мин после приема натощак и через 1-2 ч при приеме после еды [8]. Препарат быстро распределяется во всем организме. Время начала действия ибупрофена может изменяться в зависимости от того, какая лекарственная форма применяется. Продемонстрирована сильная корреляционная связь между концентрацией ибупрофена в сыворотке крови и уровнем обезболивания [9].
Ибупрофен на 90-99% связывается с белками плазмы крови и проникает в синовиальную жидкость [10]. После абсорбции в желудочно-кишечном тракте около 40-60% R-формы ибупрофена медленно трансформируется в активную S-форму. Биологическая активность ассоциирована с S-энантиомером, который является фармакологически активным в качестве ингибитора синтеза простагландинов [11].
Следует отметить, что R-форма менее активна в качестве ингибитора синтеза простагландинов, но ее фармакологические свойства ассоциируются с противовоспалительным действиям ибупрофена [12]. Препарат подвергается биотрансформации и метаболизируется через систему цитохромов (CYP) P450 при участии следующих изоферментов CYP Р450: CYP2C9 и CYP2C8 и, возможно, CYP‑2C19 [13].
Известны три основных метаболита ибупрофена, которые почти полностью выводятся почками. Некоторое количество (10%) выводится в неизмененном виде.
Ибупрофен обладает относительно коротким периодом полувыведения – от 1,6 до 2 ч [14]. Короткий период полувыведения препарата был предложен как фактор, обеспечивающий относительно низкую частоту серьезных побочных эффектов со стороны желудочно-кишечного тракта (кровотечение, пептические язвы) по сравнению с традиционными НПВП [15]. Отмечено увеличение периода полувыведения при заболеваниях печени и почечной недостаточности. Причем при тяжелой почечной недостаточности (клиренс креатинина <30 мл/мин) препарат противопоказан.
Короткий период полувыведения препарата был предложен как фактор, обеспечивающий относительно низкую частоту серьезных побочных эффектов со стороны желудочно-кишечного тракта (кровотечение, пептические язвы) по сравнению с традиционными НПВП [15]. Отмечено увеличение периода полувыведения при заболеваниях печени и почечной недостаточности. Причем при тяжелой почечной недостаточности (клиренс креатинина <30 мл/мин) препарат противопоказан.
Ибупрофен, как и большинство НПВП, относится к производным органических кислот и является слабой кислотой с рН 4,0.
Предполагается, что указанные значения рН обусловливают способность препарата накапливаться в значительных количествах в очаге воспаления (K.D. Rainsford, 2009).
Ибупрофен медленно проникает в полость сустава, задерживаясь в синовиальной ткани и создавая в ней большие концентрации, чем в плазме. У пожилых людей элиминация ибупрофена существенно не изменяется, в связи с чем коррекция дозировки обычно не требуется (E. L. Compreton, R.C. Glass, I.D. Hird, 1984).
L. Compreton, R.C. Glass, I.D. Hird, 1984).
Основные эффекты ибупрофена и его энантиомеров:
- Ингибирование синтеза простагландинов.
- Неселективный ингибитор ЦОГ‑1 и ЦОГ‑2:
– S-форма – более мощный ингибитор ЦОГ‑1 и ЦОГ‑2, чем R-энантиомер;
– R-форма конкурирует с S-энантиомером на активном сайте ЦОГ‑1;
– S-энантиомер – более мощный ингибитор ЦОГ‑1, чем ЦОГ‑2;
– рацемическая смесь изомеров ибупрофена – более сильный ингибитор пероксидазной активности ЦОГ‑2, чем ЦОГ‑1.
- Ингибирование продукции лейкотриенов:
– ингибирование функции лейкоцитов;
– снижение миграции полиморфноядерных лейкоцитов, экспрессии ICAM‑1, E-селектина и сосудистых молекул адгезии;
– уменьшение оксирадикальной продукции, индуцированной N-формил-метионил-лейцил-фенилаланином (fMLP), полиморфноядерных лейкоцитов и ксантиноксидазы.
- Образование оксида азота (NO) и эффекты:
– снижение содержания NO в конденсате выдыхаемого воздуха и нитритов/нитратов в моче у здоровых добровольцев и NO в легких крыс после эндотоксин-индуцированного повреждения легких;
– транзиторное увеличение с последующим стойким снижением образования NO после перорального приема ибупрофена в дозе 400 мг;
– уменьшение NO-опосредованной вазодилатации;
– снижение выработки NO, пероксинитрита и продуктов перекисного окисления липидов человеческими полиморфноядерными лейкоцитами.
- Ингибирование продукции ряда транскрипционных факторов, MAP-киназы, ядерных рецепторов, белков теплового шока.
- Ингибирование продукции цитокинов:
– S- и R-формы ибупрофена одинаково активны в качестве ингибиторов продукции интерлейкина‑1 и фактора некроза опухолей-α (ФНО-α) моноцитами.
- Ингибирование синтеза антител (IgG, IgM).
- Влияние на апоптоз клеток:
– снижение апоптоза и ФНО-α-зависимого апоптозного сигнала in vivo;
– уменьшение влияния донаторов NO на жизнеспособность и апоптоз клеток.
- Продукция анандамида:
– ингибирование анандамидгидролазы в нервной системе с увеличением выработки эндогенного каннабиноида (анандамида).
Аналгетическая эффективность ибупрофена подтверждена на различных моделях болевого синдрома: при головной боли [16-26], зубной боли [27-32], боли в горле [33], мышечно-скелетной боли [34] и др. Остановимся на роли ибупрофена в лечении головной боли.
Остановимся на роли ибупрофена в лечении головной боли.
Следует отметить, что при выраженных эпизодах головной боли напряжения важно максимально быстро купировать болевой синдром для скорейшего восстановления активности пациента. Требования к эффективному средству для купирования головной боли напряжения следующие [35]:
- влияние на разные звенья патогенеза головной боли;
- быстрое действие, полное отсутствие головной боли через 2 ч;
- пролонгированный эффект, отсутствие рецидива боли;
- безопасность, хорошая переносимость.
В соответствии с современными рекомендациями при эпизодической головной боли напряжения препаратами первой линии симптоматической терапии являются простые аналгетики и НПВП (G. Haag, H.-C. Diener et al. J. Headache Pain, 2011). При этом большинство экспертов по головной боли в качестве препаратов выбора рекомендуют НПВП (табл. 1).
В многочисленных клинических исследованиях (R.A. Moore, S. Derry et al. , 2014; G. Haag, H.- C. Diener et al., 2011; E. Packman, R. Leyva et al., 2015; B. Packman, E. Packman, G. Doyle et al., 2000; T.J. Steiner, K. Paemeleire et al., 2007) с участием пациентов с головной болью напряжения – наиболее распространенной формой первичной головной боли – продемонстрировано, что ибупрофен обеспечивает быстрый и выраженный терапевтический эффект наряду с хорошей переносимостью.
, 2014; G. Haag, H.- C. Diener et al., 2011; E. Packman, R. Leyva et al., 2015; B. Packman, E. Packman, G. Doyle et al., 2000; T.J. Steiner, K. Paemeleire et al., 2007) с участием пациентов с головной болью напряжения – наиболее распространенной формой первичной головной боли – продемонстрировано, что ибупрофен обеспечивает быстрый и выраженный терапевтический эффект наряду с хорошей переносимостью.
Причем значительное облегчение головной боли наблюдается уже через 30 мин после приема ибупрофена, полное купирование боли через 3 ч наблюдалось у 75% больных [38].
Продемонстрировано, что парацетамол в дозе 1000 мг достоверно менее эффективен [39]. Отмечено, что ибупрофен в дозе 400 мг может быть рекомендован как средство первого выбора среди НПВП в связи с благоприятным гастроинтестинальным профилем [40].
Данные систематического обзора и метаанализа рандомизированных плацебо-контролируемых исследований (J. Xiong, H. Lu, R. Wang, Z. Jia, 2017) по применению ибупрофена для профилактики высотной головной боли продемонстрировали высокую эффективность ибупрофена в указанной когорте обследованных лиц и позволили заключить, что данный препарат может быть альтернативой для профилактики высотной головной боли в сочетании с ацетазоламидом или дексаметазоном.
Учитывая роль простагландинов в механизмах формирования мигренозной боли, применение НПВП патогенетически обусловлено при мигрени – как для купирования приступов, так и для профилактики их возникновения. НПВП оказывают следующие эффекты:
– ингибирование синтеза простагландинов и сенситизации периферических ноцицепторов;
– ингибирование синтеза простагландинов в центральной нервной системе, в том числе на уровне нейронов заднего рога спинного мозга;
– модуляция метаболизма серотонинергической и норадренергической систем;
– подавление агрегации тромбоцитов;
– обе изоформы ЦОГ присутствуют в твердой мозговой оболочке, блокада ЦОГ подавляет синтез простагландинов;
– ингибирование ЦОГ подавляет феномен распространяющейся корковой депрессии.
При трудностях идентификации характера головной боли (при сочетанных формах цефалгий) применяется недифференцированный подход в назначении НПВП. Следует отметить, что прием НПВП сопряжен с минимальным риском формирования лекарственно индуцированной головной боли. Кроме того, в лечении менструальной мигрени (купирование и профилактика) НПВП являются средствами выбора.
Кроме того, в лечении менструальной мигрени (купирование и профилактика) НПВП являются средствами выбора.
В целом ибупрофен выдержал «соревнование» и вызовы времени почти за пять десятилетий от начала применения в клинической практике и три десятилетия от начала безрецептурных продаж. Накоплен большой клинический опыт, подтверждающий высокую эффективность ибупрофена при головной боли, и его применение является современным стандартным подходом в лечении таких пациентов. Залогом успеха терапии ибупрофеном, как и в целом препаратами класса НПВП, является мониторинг побочных эффектов, обеспечивающий безопасность лечения.
Накопленные на сегодня данные позволяют сделать вывод о том, что нерациональное использование НПВП обусловлено недостаточным уровнем осведомленности о номенклатуре и ассортименте НПВП, неудовлетворительным уровнем информированности об их фармакологических свойствах, а также недостаточным уровнем информирования пациентов о правильном применении этих препаратов.
Список литературы находится в редакции.
Статья в формате PDF
- Актуальна тема:
- Актуальна тема «Ібупрофен: вибір оптимальної лікарської форми»
- Номер:
- Тематичний номер «Неврологія, Психіатрія, Психотерапія» № 2 (45) червень 2018 р.
Публикации в СМИ
- Главная
- Пресс-центр
- Публикации в СМИ
(Ibuprofenum) INN
Синонимы. Бруфен, Долгих Мотрин.
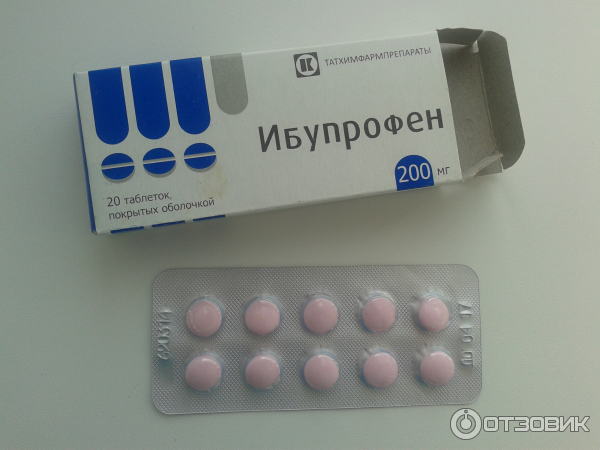
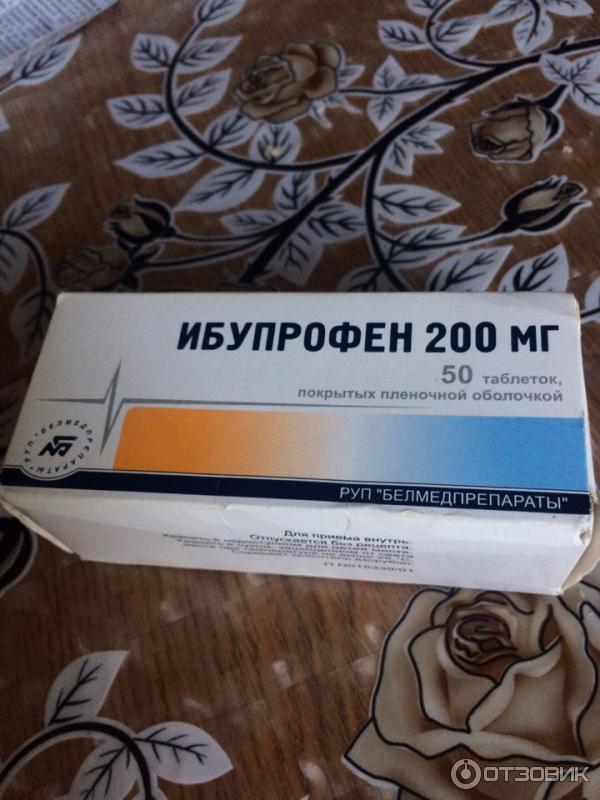
Состав и форма выпуска. Таблетки ибупрофена по 0,2 г, покрытые оболочкой; 20% крем «Долгит».
Показания. Ревматоидный артрит (ибупрофен оказывает при ревматоидном артрите более выраженное действие в начальных стадиях воспалительного процесса без резких изменений суставов), лихорадочные состояния, деформирующий остеоартроз, анкилозирующий спондилит, различные формы суставных и внесуставных ревматоидных заболеваний, болевой синдром; некоторые воспалительные поражения периферической нервной системы; дисменорея.
Фармакологическое действие. Препарат является одним из современных НПВС. Обладает выраженной анальгезирующей активностью, противовоспалительным и жаропонижающим действием. Механизм противовоспалительного действия — см. кислота ацетилсалициловая. Имеются данные о стимулирующем влиянии ибупрофена на образование эндогенного интерферона и его способности оказывать иммуномодулирующее действие и улучшать показатели неспецифической резистентности организма. По силе противовоспалительного действия он уступает диклофенаку натрия и индометацину, но лучше переносится. При болевом синдроме начало действия препарата отмечается через 0,5 часа, максимальный эффект — через 2-4 часа, длительность действия — 4-6 часов.
Фармакокинетика. Препарат хорошо и быстро всасывается при приеме
внутрь из ЖКТ в кровь. Пик плазменной концентрации достигается через 45 минут после приема однократной дозы. Степень связывания с белками плазмы крови высокая — 90-98%. Препарат хорошо проникает в синовиальную жидкость, где его концентрация достигает более высоких значений, чем в плазме крови.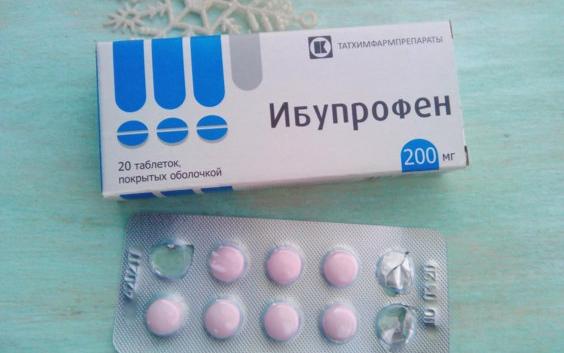 Т 1/2 составляет 2 часа.
Т 1/2 составляет 2 часа.
Побочные эффекты. Изжога, тошнота, рвота, кровотечение из ЖКТ; анемия, тромбоцитопения, агранулоцитоз; аллергические реакции; сонливость, нарушения зрения.
Противопоказания. Повышенная чувствительности к препарату; язвенная болезнь желудка и двенадцатиперстной кишки, язвенный колит; приступы бронхоспазма, связанные с приемом НПВС в анамнезе; геморрагический диатез; беременность и лактация; детский возраст до 12 лет.
Нежелательные реакции при взаимодействии с другими лекарственными средствами. При одновременном применении ибупрофена с непрямыми антикоагулянтами или ГКС повышается риск развития кровотечений. Пробенецид и сульфинпиразон удлиняют действие ибупрофена при их совместном применении. Ибупрофен повышает токсичность метотрексата. Уменьшение диуретического эффекта отмечается при совместном применении диуретиков с ибупрофеном.
Информация для пациента. Препарат обычно хорошо переносится, не вызывая раздражения слизистой оболочки желудка, что рассматривается как основное его преимущество по сравнению с салицилатами. Таблетки и капсулы принимают внутрь за 30-40 минут до еды, запивая стаканом воды. Не следует ложиться в течение 15-30 минут после приема препарата. Капсулы пролонгированного действия, покрытые оболочкой, проглатывают, не разжевывая и не разламывая.
Таблетки и капсулы принимают внутрь за 30-40 минут до еды, запивая стаканом воды. Не следует ложиться в течение 15-30 минут после приема препарата. Капсулы пролонгированного действия, покрытые оболочкой, проглатывают, не разжевывая и не разламывая.
Код вставки на сайт
<a href=»http://www.sechenov.ru/pressroom/publications/ibuprofen1/»><h2>Ибупрофен</h2></a>
<p>(Ibuprofenum) INN </p>
<p><strong>Синонимы.</strong> Бруфен, Долгих Мотрин. </p>
<p><strong>Состав и форма выпуска.</strong> Таблетки ибупрофена по 0,2 г, покрытые оболочкой; 20% крем «Долгит».</p>
<p><strong>Показания.</strong> Ревматоидный артрит (ибупрофен оказывает при ревматоидном артрите более выраженное действие в начальных стадиях воспалительного процесса без резких изменений суставов), лихорадочные состояния, деформирующий остеоартроз, анкилозирующий спондилит, различные формы суставных и внесуставных ревматоидных заболеваний, болевой синдром; некоторые воспалительные поражения периферической нервной системы; дисменорея. </p>
<p><strong>Фармакологическое действие.</strong> Препарат является одним из современных НПВС. Обладает выраженной анальгезирующей активностью, противовоспалительным и жаропонижающим действием. Механизм противовоспалительного действия — см. кислота ацетилсалициловая. Имеются данные о стимулирующем влиянии ибупрофена на образование эндогенного интерферона и его способности оказывать иммуномодулирующее действие и улучшать показатели неспецифической резистентности организма. По силе противовоспалительного действия он уступает диклофенаку натрия и индометацину, но лучше переносится. При болевом синдроме начало действия препарата отмечается через 0,5 часа, максимальный эффект — через 2-4 часа, длительность действия — 4-6 часов.</p>
<p><strong>Фармакокинетика.</strong> Препарат хорошо и быстро всасывается при приеме <br />внутрь из ЖКТ в кровь. Пик плазменной концентрации достигается через 45 минут после приема однократной дозы. Степень связывания с белками плазмы крови высокая — 90-98%.
</p>
<p><strong>Фармакологическое действие.</strong> Препарат является одним из современных НПВС. Обладает выраженной анальгезирующей активностью, противовоспалительным и жаропонижающим действием. Механизм противовоспалительного действия — см. кислота ацетилсалициловая. Имеются данные о стимулирующем влиянии ибупрофена на образование эндогенного интерферона и его способности оказывать иммуномодулирующее действие и улучшать показатели неспецифической резистентности организма. По силе противовоспалительного действия он уступает диклофенаку натрия и индометацину, но лучше переносится. При болевом синдроме начало действия препарата отмечается через 0,5 часа, максимальный эффект — через 2-4 часа, длительность действия — 4-6 часов.</p>
<p><strong>Фармакокинетика.</strong> Препарат хорошо и быстро всасывается при приеме <br />внутрь из ЖКТ в кровь. Пик плазменной концентрации достигается через 45 минут после приема однократной дозы. Степень связывания с белками плазмы крови высокая — 90-98%. Препарат хорошо проникает в синовиальную жидкость, где его концентрация достигает более высоких значений, чем в плазме крови. Т 1/2 составляет 2 часа. <br /><br /><strong>Побочные эффекты.</strong> Изжога, тошнота, рвота, кровотечение из ЖКТ; анемия, тромбоцитопения, агранулоцитоз; аллергические реакции; сонливость, нарушения зрения. </p>
<p><strong>Противопоказания.</strong> Повышенная чувствительности к препарату; язвенная болезнь желудка и двенадцатиперстной кишки, язвенный колит; приступы бронхоспазма, связанные с приемом НПВС в анамнезе; геморрагический диатез; беременность и лактация; детский возраст до 12 лет. </p>
<p><strong>Нежелательные реакции при взаимодействии с другими лекарственными средствами.</strong> При одновременном применении ибупрофена с непрямыми антикоагулянтами или ГКС повышается риск развития кровотечений. Пробенецид и сульфинпиразон удлиняют действие ибупрофена при их совместном применении.
Препарат хорошо проникает в синовиальную жидкость, где его концентрация достигает более высоких значений, чем в плазме крови. Т 1/2 составляет 2 часа. <br /><br /><strong>Побочные эффекты.</strong> Изжога, тошнота, рвота, кровотечение из ЖКТ; анемия, тромбоцитопения, агранулоцитоз; аллергические реакции; сонливость, нарушения зрения. </p>
<p><strong>Противопоказания.</strong> Повышенная чувствительности к препарату; язвенная болезнь желудка и двенадцатиперстной кишки, язвенный колит; приступы бронхоспазма, связанные с приемом НПВС в анамнезе; геморрагический диатез; беременность и лактация; детский возраст до 12 лет. </p>
<p><strong>Нежелательные реакции при взаимодействии с другими лекарственными средствами.</strong> При одновременном применении ибупрофена с непрямыми антикоагулянтами или ГКС повышается риск развития кровотечений. Пробенецид и сульфинпиразон удлиняют действие ибупрофена при их совместном применении. Ибупрофен повышает токсичность метотрексата. Уменьшение диуретического эффекта отмечается при совместном применении диуретиков с ибупрофеном. </p>
<p><strong>Информация для пациента.</strong> Препарат обычно хорошо переносится, не вызывая раздражения слизистой оболочки желудка, что рассматривается как основное его преимущество по сравнению с салицилатами. Таблетки и капсулы принимают внутрь за 30-40 минут до еды, запивая стаканом воды. Не следует ложиться в течение 15-30 минут после приема препарата. Капсулы пролонгированного действия, покрытые оболочкой, проглатывают, не разжевывая и не разламывая. <br /></p>
Ибупрофен повышает токсичность метотрексата. Уменьшение диуретического эффекта отмечается при совместном применении диуретиков с ибупрофеном. </p>
<p><strong>Информация для пациента.</strong> Препарат обычно хорошо переносится, не вызывая раздражения слизистой оболочки желудка, что рассматривается как основное его преимущество по сравнению с салицилатами. Таблетки и капсулы принимают внутрь за 30-40 минут до еды, запивая стаканом воды. Не следует ложиться в течение 15-30 минут после приема препарата. Капсулы пролонгированного действия, покрытые оболочкой, проглатывают, не разжевывая и не разламывая. <br /></p>
(Ibuprofenum) INN
Синонимы. Бруфен, Долгих Мотрин.
Состав и форма выпуска. Таблетки ибупрофена по 0,2 г, покрытые оболочкой; 20% крем «Долгит».
Показания. Ревматоидный артрит (ибупрофен оказывает при ревматоидном артрите более выраженное действие в начальных стадиях воспалительного процесса без резких изменений суставов), лихорадочные состояния, деформирующий остеоартроз, анкилозирующий спондилит, различные формы суставных и внесуставных ревматоидных заболеваний, болевой синдром; некоторые воспалительные поражения периферической нервной системы; дисменорея.
Фармакологическое действие. Препарат является одним из современных НПВС. Обладает выраженной анальгезирующей активностью, противовоспалительным и жаропонижающим действием. Механизм противовоспалительного действия — см. кислота ацетилсалициловая. Имеются данные о стимулирующем влиянии ибупрофена на образование эндогенного интерферона и его способности оказывать иммуномодулирующее действие и улучшать показатели неспецифической резистентности организма. По силе противовоспалительного действия он уступает диклофенаку натрия и индометацину, но лучше переносится. При болевом синдроме начало действия препарата отмечается через 0,5 часа, максимальный эффект — через 2-4 часа, длительность действия — 4-6 часов.
Фармакокинетика. Препарат хорошо и быстро всасывается при приеме
внутрь из ЖКТ в кровь. Пик плазменной концентрации достигается через 45 минут после приема однократной дозы. Степень связывания с белками плазмы крови высокая — 90-98%. Препарат хорошо проникает в синовиальную жидкость, где его концентрация достигает более высоких значений, чем в плазме крови. Т 1/2 составляет 2 часа.
Т 1/2 составляет 2 часа.
Побочные эффекты. Изжога, тошнота, рвота, кровотечение из ЖКТ; анемия, тромбоцитопения, агранулоцитоз; аллергические реакции; сонливость, нарушения зрения.
Противопоказания. Повышенная чувствительности к препарату; язвенная болезнь желудка и двенадцатиперстной кишки, язвенный колит; приступы бронхоспазма, связанные с приемом НПВС в анамнезе; геморрагический диатез; беременность и лактация; детский возраст до 12 лет.
Нежелательные реакции при взаимодействии с другими лекарственными средствами. При одновременном применении ибупрофена с непрямыми антикоагулянтами или ГКС повышается риск развития кровотечений. Пробенецид и сульфинпиразон удлиняют действие ибупрофена при их совместном применении. Ибупрофен повышает токсичность метотрексата. Уменьшение диуретического эффекта отмечается при совместном применении диуретиков с ибупрофеном.
Информация для пациента. Препарат обычно хорошо переносится, не вызывая раздражения слизистой оболочки желудка, что рассматривается как основное его преимущество по сравнению с салицилатами. Таблетки и капсулы принимают внутрь за 30-40 минут до еды, запивая стаканом воды. Не следует ложиться в течение 15-30 минут после приема препарата. Капсулы пролонгированного действия, покрытые оболочкой, проглатывают, не разжевывая и не разламывая.
Таблетки и капсулы принимают внутрь за 30-40 минут до еды, запивая стаканом воды. Не следует ложиться в течение 15-30 минут после приема препарата. Капсулы пролонгированного действия, покрытые оболочкой, проглатывают, не разжевывая и не разламывая.
Перейти в раздел:
- Новости
- События
- Видео
- Фотогалерея
- Библиотека
- Газета «Сеченовские вести»
- Журнал «Национальное здравоохранение»
- Условия использования сайта
Ученые нашли новую связь между ибупрофеном и болезнями сердца
https://ria.ru/20180321/1516935427.html
Ученые нашли новую связь между ибупрофеном и болезнями сердца
Ученые нашли новую связь между ибупрофеном и болезнями сердца — РИА Новости, 21.03.2018
Ученые нашли новую связь между ибупрофеном и болезнями сердца
Регулярное употребление даже небольших доз ибупрофена и других обезболивающих лекарств повышает риск развития мерцательной аритмии и других болезней сердца. .. РИА Новости, 21.03.2018
.. РИА Новости, 21.03.2018
2018-03-21T15:24
2018-03-21T15:24
2018-03-21T17:55
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/151695/63/1516956328_0:0:5616:3159_1920x0_80_0_0_b1af9bc5489b345dd2bf1ff95875f6b9.jpg
тайвань
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2018
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.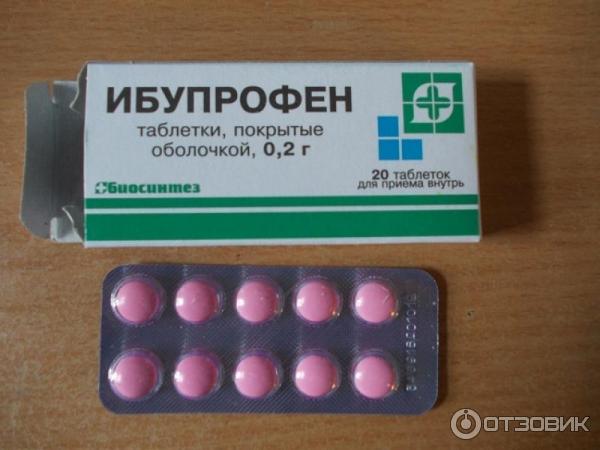 xn--p1ai/awards/
xn--p1ai/awards/
1920
1080
true
1920
1440
true
https://cdnn21.img.ria.ru/images/151695/63/1516956328_703:0:4915:3159_1920x0_80_0_0_241e90a0c01a0a5d5ef4a490415ee468.jpg
1920
1920
true
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
открытия — риа наука, тайвань
Открытия — РИА Наука, Наука, Тайвань
МОСКВА, 21 мар — РИА Новости. Регулярное употребление даже небольших доз ибупрофена и других обезболивающих лекарств повышает риск развития мерцательной аритмии и других болезней сердца примерно на 20-30 процентов, заявляют ученые в статье, опубликованной в журнале BJCP.
7 декабря 2017, 16:41
Ученые рассказали, чем опасны популярные обезболивающие
Так называемые нестероидные обезболивающие, в том числе ибупрофен, диклофенак и ряд других лекарств, работают, подавляя действие циклооксигеназ–ферментов, отвечающих за развитие воспалительной реакции. Эти вещества не вызывают привыкания и достаточно хорошо подавляют боль, благодаря чему их сегодня можно купить без рецепта и фактически в неограниченных количествах.
Хуэй Цзюй Цай, биолог из Национального института здоровья Тайваня, и его коллеги наблюдали за здоровьем примерно 57 тысяч пациентов местных клиник и выяснили, что подобные обезболивающие могут негативно влиять на работу сердца и сосудов.
Половина этих людей страдала от мерцательной аритмии, нарушения сердечных ритмов. Ее развитие часто приводит к появлению тромбов в сердце, его остановке и прочим потенциально фатальным проблемам. Остальные участники опытов не страдали от подобных проблем и обладали относительно здоровой сердечно-сосудистой системой.
В прошлом, как отмечает Цай, ученые уже замечали, что ибупрофен и прочие универсальные обезболивающие могут вызывать остановку сердца и другие нарушения его работы в тех случаях, если пациенты принимают их в очень больших количествах. Руководствуясь этой идеей, медики сравнили, как много подобных препаратов употребляли носители аритмии и здоровые участники опытов.
2 февраля 2018, 12:11
Названа еще одна опасность ибупрофена
Выяснилось, что люди с болезнями сердца и сосудов принимали гораздо больше обезболивающих, чем остальные пациенты клиник. Когда ученые очистили статистику от всех побочных факторов, их расчеты показали, что постоянное употребление ибупрофена и его «кузенов» повышает вероятность развития мерцательной аритмии и связанных с ней болезней примерно на 20 процентов.
При этом прием комбинаций из узкоспециализированных и «общих» типов обезболивающих еще больше повышал вероятность развития проблем с сердцем — у таких пациентов аритмия появлялась примерно на 30 процентов чаще, чем у здоровых людей.
Все это, как считает Цай, говорит о том, что ибупрофен и прочие нестероидные обезболивающие не стоит принимать в больших количествах. Медикам, по его мнению, «стоит заново оценить все плюсы и минусы использования нестероидных обезболивающих в клинической практике».
Обнаружены новые побочные эффекты ибупрофена | Новости
Ключевые слова / keywords: Гепатотоксичность, Ибупрофен, НПВС, Побочные эффекты, Ibuprofen, Side effects
Распространенный НПВС-препарат ибупрофен может иметь больше гепатотоксичных побочных эффектов, чем предполагалось ранее. Данные результаты получены из in vivo исследования от Калифорнийского университета. Также в нем подчеркиваются различия в побочных эффектах, определенных на мужских и женских особях лабораторных животных. Работа опубликована в Scientific Reports.
Ибупрофен является одним из самых распространенных НПВС, отпускаемых без рецепта. «Хорошо изучены побочные эффекты, связанные с воздействием на сердце и увеличением риска инсульта, но воздействие на печень исследовано в меньшей мере», – сообщает один из авторов работы, профессор Aldrin Gomes из Отдела нейробиологии, физиологии и поведения Колледжа биологических наук Дейвиса, Калифорния.
«Хорошо изучены побочные эффекты, связанные с воздействием на сердце и увеличением риска инсульта, но воздействие на печень исследовано в меньшей мере», – сообщает один из авторов работы, профессор Aldrin Gomes из Отдела нейробиологии, физиологии и поведения Колледжа биологических наук Дейвиса, Калифорния.
В эксперименте мыши получали среднюю дозу ибупрофена в течение недели – эквивалент ежедневного приема 400 мг для человека. Затем исследователи применили массовую спектрометрию для изучения метаболических изменений в гепатоцитах. Было обнаружено, что ибупрофен взывает множественные изменения в экспрессии синтеза различных протеинов. Ибупрофен вызывал изменения по меньшей мере в 34 различных метаболических путях у мышей, в том числе изменения метаболизма аминокислот, гормонов, витаминов, а также активных форм кислорода. При этом перекись водорода вызывает стрессорные изменения в клетках.
Также исследователи обнаружили различие в побочных эффектах на мужские и женские особи мышей – в некоторых случаях наблюдались даже противоположные эффекты.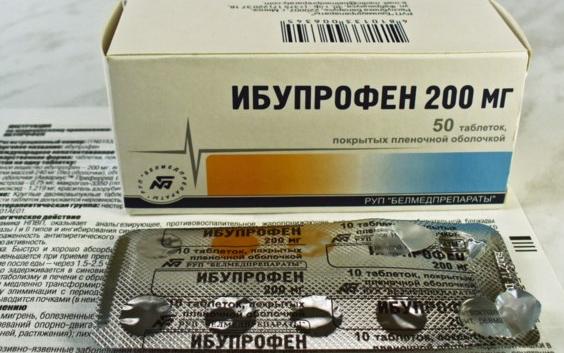 Например, у протеасом – систем метаболизма продуктов клеточной жизнедеятельности,в которых он усиливал активность цитохрома P450, участвующего в нейтрализации лекарственных средств, у женских особей, но уменьшал эту активность у мужских. Это означает, что препараты, принимаемые совместно с ибупрофеном, могут циркулировать в кровотоке мужских особей животных дольше, чем у женских.
Например, у протеасом – систем метаболизма продуктов клеточной жизнедеятельности,в которых он усиливал активность цитохрома P450, участвующего в нейтрализации лекарственных средств, у женских особей, но уменьшал эту активность у мужских. Это означает, что препараты, принимаемые совместно с ибупрофеном, могут циркулировать в кровотоке мужских особей животных дольше, чем у женских.
Чрезмерное использование НПВС, в частности ибупрофена, является распространенным среди пациентов явлением, поэтому результаты данного исследования являются актуальной информацией для врачей терапевтического профиля.
Источник: http://dx.doi.org/10.1038/s41598-020-60053-y
поле обязательно для заполнения
поле обязательно для заполнения
поле обязательно для заполнения
СпециализацияАкушер-гинекологАллергологГастроэнтерологГематологГепатологДермато-венерологКардиологНеврологНейрохирургИнфекционистОнкологОтоларингологОфтальмологПедиатрПсихиатрПульмонологПроктологРевматологРентгенолог и радиологТерапевт и врач общей практикиУрологФтизиатрХирургЭндокринологДругое
поле обязательно для заполнения
Нажимая на кнопку Подписаться, вы даете согласие на обработку персональных данных
- schema.org/SiteNavigationElement»>
- Premium
- Аллергология
- Бронхопульмонология
- Вакцинопрофилактика
- Гастроэнтерология
- Гепатология
- Гинекология
- Дерматовенерология
- Иммунология
- Инфекции
- Кардиология
- ЛОР-патология
- Медтехника
- Неотложная помощь
- Нутрициология
- Онкология
- Педиатрия
- Психоневрология
- Ревматология
- Сезонная аллергия
- Терапия
- Уронефрология
- Фармакология
- Эндокринология
- ИТ в здравоохранении
Купить Подписаться Архив номеров
-
19
СенV Юбилейный Международный Форум онкологии и радиотерапии ForLife дата окончания: 23 Сентября 2022 Место проведения: Москва, Краснопресненская наб.
 , д.12, Центр Международной Торговли и онлайн
, д.12, Центр Международной Торговли и онлайн -
20
СенПремия им. академика А.И. Савицкого дата окончания: 20 Сентября 2022 Место проведения: Москва, Краснопресненская набережная 12, Центр международной торговли
-
20
СенОткрыта регистрация на бесплатную юбилейную конференцию «Амбулаторный прием» в Москве дата окончания: 20 Сентября 2022 Место проведения: Москва, Новый Арбат, д.
 36, здание Правительства Москвы и онлайн
36, здание Правительства Москвы и онлайн -
20
Сен«Дни гиперурикемии» на портале Lvrach.ru! дата окончания: 22 Сентября 2022 Место проведения: Онлайн
-
21
СенXXI Российский Конгресс «Инновационные технологии в педиатрии и детской хирургии» с международным участием и XXI Международная выставка «Современные диагностические, лекарственные и нутрициологические технологии в педиатрии и детской хирургии» дата окончания: 23 Сентября 2022 Место проведения: 129366, г.
 Москва, проспект Мира, д. 150, гостиничый комплекс «Космос»
Москва, проспект Мира, д. 150, гостиничый комплекс «Космос»
Проблемы ибупрофена: как обезболивающие влияют на организм
Общество
15 февраля 2021, 14:17
Поделиться
Читать 360tv в
Британские врачи сообщили о серьезных побочных эффектах от популярного обезболивающего ибупрофена. Специалисты отметили, что он может вызывать головокружение, головные боли, тошноту, несварение желудка и даже создает риск возникновения желудочно-кишечного кровотечения и ухудшения зрения. Но осторожными нужно быть с любыми обезболивающими.
О побочных эффектах ибупрофена рассказали в Национальной службе здравоохранения Великобритании. Врачи выяснили, что «более чем у одного человека» из 100 наблюдались негативные симптомы после приема ибупрофена. У одних сильнее болела голова, у других она кружилась, появлялись тошнота и несварение желудка.
Но самые большие проблемы — риск возникновения желудочно-кишечного кровотечения и нарушение зрения. В некоторых случаях также возможна аллергическая реакция.
В некоторых случаях также возможна аллергическая реакция.
О негативных чертах ибупрофена писали и раньше. Например, в декабре 2020 года доктор Александр Мясников заявил, что препараты, в основе которых ибупрофен или анальгин, могут вызвать инсульт, инфаркт или гипертонию. Особенно эти вещества противопоказаны людям старше 60 лет.
В марте 2020-го Всемирная организация здравоохранения заявила об опасности самостоятельного приема ибупрофена при лечении коронавируса, отметив риски внутреннего кровотечения.
Впрочем, специалисты в области медицины предупредили, что к любому веществу нужно относиться с опаской. Лучше же всего не заниматься самолечением, а обратиться к профессионалам.
Залог успеха в правильной дозировке
Фармацевт, бывший руководитель аптечной сети «Дальхимфарм» Ирина Булыгина в беседе с «360» сказала, что все нестероидные противовоспалительные препараты, которые рекламируют по телевизору, имеют такие побочные эффекты.
Людям, у которых есть проблемы с желудочно-кишечным трактом, не назначают подобные вещества. Причем неважно, в таблетках они, в виде свечей или инъекций.
Причем неважно, в таблетках они, в виде свечей или инъекций.
У нас нет безопасных лекарственных средств. Любое лекарство — это яд, вопрос дозировки и правильного применения. Если дозировка превышена и человек не знает о своих проблемах, для него это может плохо закончиться
Ирина Булыгина.
Чтобы обезопасить себя, нужно искать своего врача, а не заниматься самолечением.
Конечно, если у человека ужасно болит голова, можно выпить обезболивающее. Но после этого следует пойти к врачу и разобраться, является ли эта головная боль каким-то заболеванием. Делать это необходимо, если головные боли происходят регулярно.
Своевременное лечение
Эксперт в медицинской сфере, врач-стоматолог Алексей Антипенко объяснил, что если длительное время принимать обезболивающие, в первую очередь страдает желудок — развиваются эрозивные изменения или гастрит.
У каждого препарата есть определенное количество времени, когда его можно принимать без наблюдения специалиста. Если пациент принимает препарат дольше, нужно идти к врачу и сдавать анализы крови, чтобы проверить организм.
Долгое употребление обезболивающих препаратов может иметь основным побочным эффектом то, что патологический процесс за счет того, что пациент сидел дома и терпел, перейдет в худшую стадию по сравнению с той, с которой все началось. Последствия могут быть гораздо плачевнее, чем когда нужно было лечить
Алексей Антипенко.
По словам Антипенко, желудочно-кишечное кровотечение, о котором говорили британские врачи, может развиваться уже при наличии сопутствующего заболевания. При этом гастрит есть у всех в той или иной степени, отметил Антипенко, потому что мы периодически пьем кофе и едим не совсем правильную еду, даже если пытаемся придерживаться здорового образа жизни.
Если с умом принимать обезболивающие, никаких проблем не будет. Но когда у человека боль, он уже не думает об объемах приема того или иного препарата. И здесь может вылезти все что угодно. По словам Антипенко, анальгином тоже можно «до смерти закидаться».
Сказать категорически, что «не пейте ибупрофен, от него голова болит или еще что-то», — нет.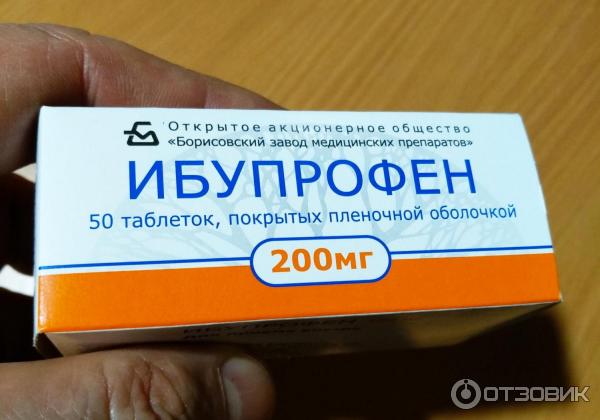 У него есть хорошее свойство, он работает. <…> Он очень здорово сбивает температуру часа на три
У него есть хорошее свойство, он работает. <…> Он очень здорово сбивает температуру часа на три
Алексей Антипенко.
Без наблюдения врача принимать обезболивающие препараты можно три-пять дней. Особое внимание следует уделить людям, у кого есть, например, проблемы с желудком. Им не следует злоупотреблять обезболивающими. И необходимо потом обратиться к лечащему врачу.
Аллергикам тоже нужно аккуратно принимать подобные препараты.
Можно пользоваться дедовскими методами снятия боли. Например, есть точка между большим и указательным пальцами на руке. Нужно нажать на эту точку и держать секунд 20, потом отпускать и повторять. Также можно ногтями сдавливать мочку уха, чтобы стало больно. Эти способы не снимут боль полностью, но временно ее перекроют.
Авторы:
Ольга Нижельская
Борис Ломакин
Лекарства
Врачи
Резюме PharmGKB: пути ибупрофена — PMC
1. Davies NM. Клиническая фармакокинетика ибупрофена. Первые 30 лет. Клин Фармакокинет. 1998; 34: 101–154. [PubMed] [Google Scholar]
1998; 34: 101–154. [PubMed] [Google Scholar]
2. Рейнсфорд К.Д. Ибупрофен: фармакология, эффективность и безопасность. Инфламмофармакология. 2009; 17: 275–342. [PubMed] [Google Scholar]
3. Durrmeyer X, Hovhannisyan S, Médard Y, Jacqz-Agrain E, Decobert F, Barre J, et al. Связаны ли полиморфизмы цитохрома P450 CYP2C8 и CYP2C9 с реакцией на ибупрофен у глубоко недоношенных детей? ПЛОС Один. 2010;5:e12329. [Бесплатная статья PMC] [PubMed] [Google Scholar]
4. Pierce CA, Voss B. Эффективность и безопасность ибупрофена и ацетаминофена у детей и взрослых: метаанализ и качественный обзор. Энн Фармакотер. 2010; 44: 489–506. [PubMed] [Google Scholar]
5. Evans AM, Nation RL, Sansom LN, Bochner F, Somogyi AA. Связь между фармакокинетикой энантиомеров ибупрофена и дозой рацемического ибупрофена у человека. Biopharm Drug Dispos. 1990; 11: 507–518. [PubMed] [Академия Google]
6. Херш Э.В., Пинто А., Мур П.А. Побочные лекарственные взаимодействия, включающие общие рецептурные и безрецептурные анальгетики. Клин Тер. 2007; 29 (прил.): 2477–2497. [PubMed] [Google Scholar]
Клин Тер. 2007; 29 (прил.): 2477–2497. [PubMed] [Google Scholar]
7. Дасгупта А., Тиммерман Т.Г. In vitro вытеснение фенитоина из связи с белками нестероидными противовоспалительными препаратами толметином, ибупрофеном и напроксеном в нормальной и уремической сыворотках. Мониторинг наркотиков. 1996; 18:97–99. [PubMed] [Google Scholar]
8. Ллойд М.Д., Евглевскис М., Ли Г.Л., Вуд П.Дж., Тредгилл М.Д., Вудман Т.Дж. α-Метилацил-КоА-рацемаза (AMACR): метаболический фермент, метаболизатор лекарств и маркер рака P504S. Прог Липид Рез. 2013;52:220–230. [PubMed] [Академия Google]
9. Руди А.С., Найт П.М., Братер Д.К., Холл С.Д. Стереоселективный метаболизм ибупрофена у человека: введение R -, S — и рацемического ибупрофена. J Pharmacol Exp Ther. 1991; 259:1133–1139. [PubMed] [Google Scholar]
10. Hall SD, Rudy AC, Knight PM, Brater DC. Отсутствие пресистемной инверсии (R)- в (S)-ибупрофен у человека. Клин Фармакол Тер. 1993; 53: 393–400. [PubMed] [Google Scholar]
11. Джамали Ф., Мехвар Р., Рассел А.С., Саттари С., Якимец В.В., Ку Дж. Фармакокинетика энантиомеров ибупрофена у человека при различных дозах и составах: кишечная хиральная инверсия. Дж. Фарм. 1992;81:221–225. [PubMed] [Google Scholar]
Джамали Ф., Мехвар Р., Рассел А.С., Саттари С., Якимец В.В., Ку Дж. Фармакокинетика энантиомеров ибупрофена у человека при различных дозах и составах: кишечная хиральная инверсия. Дж. Фарм. 1992;81:221–225. [PubMed] [Google Scholar]
12. Kepp DR, Sidelmann UG, Hansen SH. Выделение и характеристика основных метаболитов фазы I и II ибупрофена. Фарм Рез. 1997; 14: 676–680. [PubMed] [Google Scholar]
13. Хамман М.А., Томпсон Г.А., Холл С.Д. Региоселективный и стереоселективный метаболизм ибупрофена цитохромом Р450 2С человека. Биохим Фармакол. 1997; 54:33–41. [PubMed] [Google Scholar]
14. Chang SY, Li W, Traeger SC, Wang B, Cui D, Zhang H, et al. Подтверждение того, что цитохром P450 2C8 (CYP2C8) играет незначительную роль в гидроксилировании (S)-(+)- и (R)-(-)-ибупрофена in vitro. Препарат Метаб Распоряжение. 2008; 36: 2513–2522. [PubMed] [Академия Google]
15. Андраде С., Сандарш С., Четан К.Б., Нагеш К.С. Антидепрессанты-ингибиторы обратного захвата серотонина и аномальные кровотечения: обзор для клиницистов и пересмотр механизмов. Дж. Клин Психиатрия. 2010;71:1565–1575. [PubMed] [Google Scholar]
Дж. Клин Психиатрия. 2010;71:1565–1575. [PubMed] [Google Scholar]
16. Schmider J, Greenblatt DJ, von Moltke LL, Karsov D, Shader RI. Ингибирование CYP2C9 селективными ингибиторами обратного захвата серотонина in vitro: исследования п-гидроксилирования фенитоина. Бр Дж Клин Фармакол. 1997; 44: 495–498. [Бесплатная статья PMC] [PubMed] [Google Scholar]
17. Торнио А., Ниеми М., Неувонен П.Дж., Бэкман Дж.Т. Стереоселективное взаимодействие между ингибитором CYP2C8 гемфиброзилом и рацемическим ибупрофеном. Eur J Clin Pharmacol. 2007; 63: 463–469. [PubMed] [Google Scholar]
18. Kuehl GE, Lampe JW, Potter JD, Bigler J. Глюкуронирование нестероидных противовоспалительных препаратов: определение ферментов, ответственных за микросомы печени человека. Препарат Метаб Распоряжение. 2005;33:1027–1035. [PubMed] [Google Scholar]
19. Сакагучи К., Грин М., Сток Н., Регер Т.С., Зуник Дж., Кинг С. Глюкуронирование соединений, содержащих карбоновые кислоты, изоформами УДФ-глюкуронозилтрансферазы. Арх Биохим Биофиз. 2004;424:219–225. [PubMed] [Google Scholar]
Арх Биохим Биофиз. 2004;424:219–225. [PubMed] [Google Scholar]
20. Turgeon D, Carrier JS, Chouinard S, Bélanger A. Глюкуронидирующая активность фермента UGT2B17 в отношении ксенобиотиков. Препарат Метаб Распоряжение. 2003; 31: 670–676. [PubMed] [Google Scholar]
21. Basu NK, Kubota S, Meselhy MR, Ciotti M, Chowdhury B, Hartori M, Owens IS. Распределяемая в желудочно-кишечном тракте УДФ-глюкуронозилтрансфераза 1А10, которая метаболизирует эстрогены и нестероидные противовоспалительные препараты, зависит от фосфорилирования. Дж. Биол. Хим. 2004;279: 28320–28329. [PubMed] [Google Scholar]
22. Sallustio BC, Sabordo L, Evans AM, Nation RL. Расположение в печени электрофильных конъюгатов ацилглюкуронида. Curr Drug Metab. 2000; 1:163–180. [PubMed] [Google Scholar]
23. Castillo M, Lam YW, Dooley MA, Stahl E, Smith PC. Распределение и ковалентное связывание ибупрофена и его ацилглюкуронида у пожилых людей. Клин Фармакол Тер. 1995; 57: 636–644. [PubMed] [Google Scholar]
24. Grillo MP, Lohr MT, Khera S. Взаимодействие γ-глутамилтранспептидазы с ибупрофен- S -ацилглутатион in vitro и in vivo у человека. Препарат Метаб Распоряжение. 2013;41:111–121. [PubMed] [Google Scholar]
Grillo MP, Lohr MT, Khera S. Взаимодействие γ-глутамилтранспептидазы с ибупрофен- S -ацилглутатион in vitro и in vivo у человека. Препарат Метаб Распоряжение. 2013;41:111–121. [PubMed] [Google Scholar]
25. Grillo MP. Лекарственно- S -ацил-глутатионтиоэфиры: синтез, биоаналитические свойства, химическая активность, биологическое образование и разложение. Curr Drug Metab. 2011;12:229–244. [PubMed] [Google Scholar]
26. Khamdang S, Takeda M, Noshiro R, Narikawa S, Enomoto A, Anzai N, et al. Взаимодействие переносчиков органических анионов и переносчиков органических катионов человека с нестероидными противовоспалительными препаратами. J Pharmacol Exp Ther. 2002; 303: 534–539.. [PubMed] [Google Scholar]
27. Chu XY, Bleasby K, Yabut J, Cai X, Chan GH, Hafey MJ, et al. Транспорт ингибитора дипептидилпептидазы-4 ситаглиптина человеческим переносчиком органических анионов 3, полипептидом 4C1, транспортирующим органические анионы, и P-гликопротеином множественной лекарственной устойчивости. J Pharmacol Exp Ther. 2007; 321: 673–683. [PubMed] [Google Scholar]
J Pharmacol Exp Ther. 2007; 321: 673–683. [PubMed] [Google Scholar]
28. Itagaki S, Gopal E, Zhuang L, Fei YJ, Miyauchi S, Prasad PD, Ganapathy V. Взаимодействие ибупрофена и других структурно родственных НПВП с монокарбоксилатным транспортером, связанным с натрием SMCT1 (SLC5A8). ) Фарм Рез. 2006;23:1209–1216. [PubMed] [Google Scholar]
29. Омквист Д.Х., Бродин Б., Нильсен CU. Ибупрофен является неконкурентным ингибитором переносчика пептидов hPEPT1 (SLC15A1): возможные взаимодействия между субстратами hPEPT1 и ибупрофеном. Бр Дж. Фармакол. 2010; 161:1793–1805. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Tamai I, Takanaga H, Maeda H, Sai Y, Ogihara T, Higashida H, Tsuji A. Участие протон-котранспортера, MCT1, в кишечном транспорте монокарбоновых кислот. Biochem Biophys Res Commun. 1995;214:482–489. [PubMed] [Google Scholar]
31. Wang J, Hughes TP, Kok CH, Saunders VA, Frede A, Groot-Obbink K, et al. Контрастные эффекты диклофенака и ибупрофена на активное поглощение иматиниба лейкозными клетками.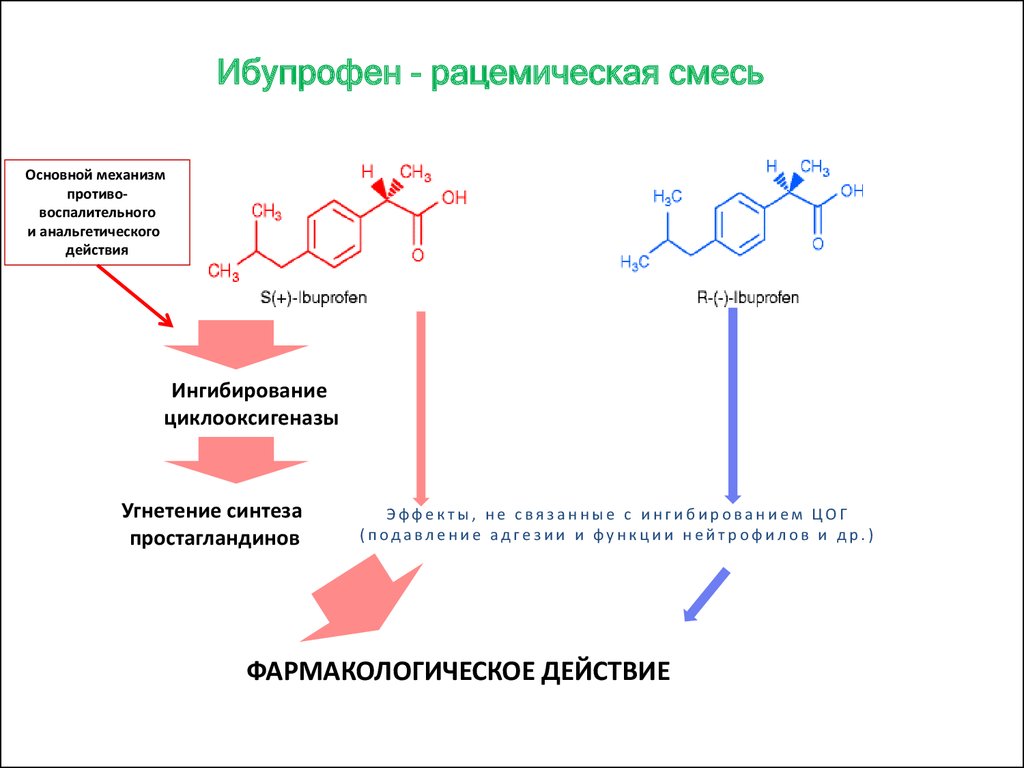 Бр Дж Рак. 2012;106:1772–1778. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Бр Дж Рак. 2012;106:1772–1778. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Honjo H, Uwai Y, Aoki Y, Iwamoto K. Стереоселективный ингибирующий эффект флурбипрофена, ибупрофена и напроксена на транспортеры органических анионов человека hOAT1 и hOAT3. Biopharm Drug Dispos. 2011; 32: 518–524. [PubMed] [Академия Google]
33. Киндла Дж., Мюллер Ф., Мит М., Фромм М.Ф., Кениг Дж. Влияние нестероидных противовоспалительных препаратов на полипептид, транспортирующий органические анионы (ОАТР), 1B1- и ОАТР1В3-опосредованный транспорт лекарственных средств. Препарат Метаб Распоряжение. 2011;39:1047–1053. [PubMed] [Google Scholar]
34. Maeda A, Tsuruoka S, Kanai Y, Endou H, Saito K, Miyamoto E, Fujimura A. Оценка взаимодействия между нестероидными противовоспалительными препаратами и метотрексатом с использованием переносчика органических анионов человека 3 -трансфицированные клетки. Евр Дж Фармакол. 2008;596: 166–172. [PubMed] [Google Scholar]
35. Takeda M, Khamdang S, Narikawa S, Kimura H, Hosoyamada M, Cha SH, et al. Характеристика транспорта метотрексата и его лекарственных взаимодействий с переносчиками органических анионов человека. J Pharmacol Exp Ther. 2002; 302: 666–671. [PubMed] [Google Scholar]
Характеристика транспорта метотрексата и его лекарственных взаимодействий с переносчиками органических анионов человека. J Pharmacol Exp Ther. 2002; 302: 666–671. [PubMed] [Google Scholar]
36. Эль-Шейх А.А., ван ден Хеувел Дж.Дж., Коендеринк Дж.Б., Рассел Ф.Г. Взаимодействие нестероидных противовоспалительных препаратов с белком множественной лекарственной устойчивости (MRP) 2/ABCC2- и MRP4/ABCC4-опосредованным транспортом метотрексата. J Pharmacol Exp Ther. 2007;320:229–235. [PubMed] [Google Scholar]
37. Анджелини А., Иецци М., Ди Феббо С., Ди Илио С., Куккурулло Ф., Поррека Э. Реверсия опосредованной Р-гликопротеином множественной лекарственной устойчивости при саркоме человека MES-SA/Dx-5 клеток нестероидными противовоспалительными препаратами. Oncol Rep. 2008; 20:731–735. [PubMed] [Google Scholar]
38. Clemente MI, Alvarez S, Serramía MJ, Turriziani O, Genebat M, Leal M, et al. Нестероидные противовоспалительные препараты повышают антиретровирусную активность нуклеозидных ингибиторов обратной транскриптазы в Т-лимфоцитах, инфицированных ВИЧ 1 типа: роль белка множественной лекарственной устойчивости 4. Antivir Ther. 2009 г.;14:1101–1111. [PubMed] [Google Scholar]
Antivir Ther. 2009 г.;14:1101–1111. [PubMed] [Google Scholar]
39. Mulato AS, Ho ES, Cihlar T. Нестероидные противовоспалительные препараты эффективно снижают транспорт и цитотоксичность адефовира, опосредованного переносчиком органических анионов в почках человека 1. J Pharmacol Exp Ther. 2000; 295:10–15. [PubMed] [Google Scholar]
40. Boneberg EM, Zou MH, Ullrich V. Ингибирование циклооксигеназы-1 и -2 с помощью R (-)- и S (+)-ибупрофена. Дж. Клин Фармакол. 1996; 36 (12 дополнений): 16S–19S. [PubMed] [Академия Google]
41. Gierse JK, Koboldt CM, Walker MC, Seibert K, Isakson PC. Кинетические основы селективного ингибирования циклооксигеназ. Biochem J. 1999; 339 (Pt 3): 607–614. [Бесплатная статья PMC] [PubMed] [Google Scholar]
42. Neupert W, Brugger R, Euchenhofer C, Brune K, Geisslinger G. Влияние энантиомеров ибупрофена и его тиоэфиров кофермента A на синтазы эндопероксида простагландина человека. Бр Дж. Фармакол. 1997; 122: 487–492.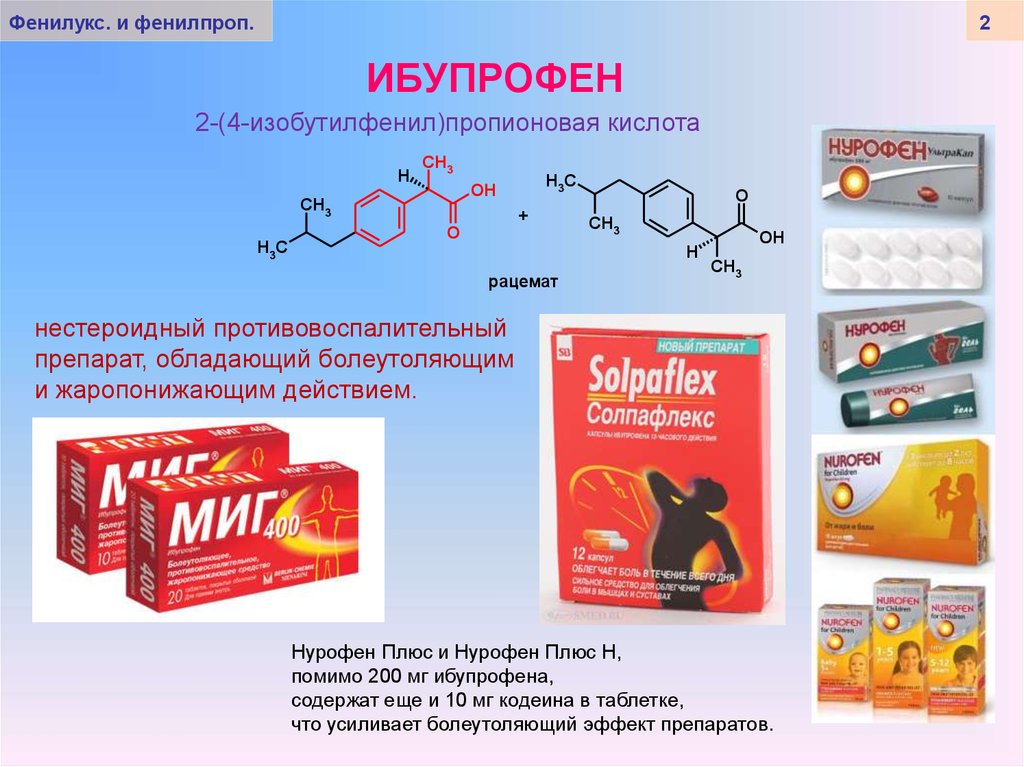 [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
43. Smyth EM, Grosser T, Wang M, Yu Y, FitzGerald GA. Простаноиды в норме и при болезни. J липидный рез. 2009 г.;50 (Прил.):S423–S428. [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Blain H, Boileau C, Lapicque F, Nédélec E, Loeuille D, Guillaume C, et al. Ограничение анализа цельной крови in vitro для прогнозирования ЦОГ-селективности НПВП при клиническом применении. Бр Дж Клин Фармакол. 2002; 53: 255–265. [Бесплатная статья PMC] [PubMed] [Google Scholar]
45. Rainsford KD. Открытие, механизмы действия и безопасность ибупрофена. Int J Clin Pract Suppl. 2003; 135:3–8. [PubMed] [Академия Google]
46. Давуд М.Ю., Хан-Давуд Ф.С. Клиническая эффективность и дифференцированное ингибирование простагландина F2альфа менструальной жидкости в рандомизированном двойном слепом перекрестном лечении с плацебо, ацетаминофеном и ибупрофеном при первичной дисменорее. Am J Obstet Gynecol. 2007;196:35e1–5. [PubMed] [Google Scholar]
47. Ricciotti E, FitzGerald GA. Простагландины и воспаление. Артериосклеры Тромб Васк Биол. 2011;31:986–1000. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Ricciotti E, FitzGerald GA. Простагландины и воспаление. Артериосклеры Тромб Васк Биол. 2011;31:986–1000. [Бесплатная статья PMC] [PubMed] [Google Scholar]
48. Де ла Круз Дж. П., Рейес Дж. Дж., Руис-Морено М. И., Лопес-Виллодрес Дж. А., Джебруни Н., Гонсалес-Корреа Дж. А. Различия в антитромбоцитарном действии дексибупрофена, ибупрофена и флурбипрофена in vitro в крови человека. Анест Анальг. 2010; 111:1341–1346. [PubMed] [Академия Google]
49. Kaplan HB, Edelson HS, Korchak HM, Given WP, Abramson S, Weissmann G. Влияние нестероидных противовоспалительных средств на функции нейтрофилов человека in vitro и in vivo. Биохим Фармакол. 1984; 33: 371–378. [PubMed] [Google Scholar]
50. Smith RJ, Iden SS. Фармакологическая модуляция вызванного хемотаксическим фактором высвобождения связанных с гранулами ферментов из нейтрофилов человека. Эффекты простагландинов, нестероидных противовоспалительных средств и кортикостероидов. Биохим Фармакол. 1980;29:2389–2395. [PubMed] [Google Scholar]
51. Ангст М.С., Кларк Д.Д., Карвалью Б., Тингл М., Шмельц М., Йоманс Д.К. Профиль цитокинов в коже человека в ответ на экспериментальное воспаление, вредную стимуляцию и введение ингибитора ЦОГ: исследование микродиализа. Боль. 2008; 139:15–27. [PubMed] [Google Scholar]
Ангст М.С., Кларк Д.Д., Карвалью Б., Тингл М., Шмельц М., Йоманс Д.К. Профиль цитокинов в коже человека в ответ на экспериментальное воспаление, вредную стимуляцию и введение ингибитора ЦОГ: исследование микродиализа. Боль. 2008; 139:15–27. [PubMed] [Google Scholar]
52. Menzel EJ, Burtscher H, Kolarz G. Ингибирование продукции цитокинов и экспрессии молекул адгезии ибупрофеном не влияет на трансэндотелиальную миграцию моноцитов. Воспаление. 1999;23:275–286. [PubMed] [Google Scholar]
53. Villanueva M, Heckenberger R, Strobach H, Palmér M, Schrör K. Эквипотентное ингибирование R (-)-, S (+)- и рацемическим ибупрофеном полиморфноядерных клеток человека. функция клеток in vitro. Бр Дж Клин Фармакол. 1993; 35: 235–242. [Бесплатная статья PMC] [PubMed] [Google Scholar]
54. Валко М., Лейбфриц Д., Монкол Дж., Кронин М.Т., Мазур М., Телсер Дж. Свободные радикалы и антиоксиданты в нормальных физиологических функциях и заболеваниях человека. Int J Biochem Cell Biol. 2007;39: 44–84. [PubMed] [Google Scholar]
2007;39: 44–84. [PubMed] [Google Scholar]
55. Costa D, Moutinho L, Lima JL, Fernandes E. Антиоксидантная активность и ингибирование окислительного взрыва нейтрофилов человека, опосредованного нестероидными противовоспалительными препаратами арилпропионовой кислоты. Биол Фарм Бык. 2006; 29: 1659–1670. [PubMed] [Google Scholar]
56. Menzel JE, Kolarz G. Модуляция активности синтазы оксида азота ибупрофеном. Воспаление. 1997; 21: 451–461. [PubMed] [Google Scholar]
57. Vandivier RW, Eidsath A, Banks SM, Preas HL, 2nd, Leighton SB, Godin PJ, et al. Снижение выработки оксида азота ибупрофеном у добровольцев. J Pharmacol Exp Ther. 1999;289:1398–1403. [PubMed] [Google Scholar]
58. Fowler CJ, Björklund E, Lichtman AH, Naidu PS, Congiu C, Onnis V. Ингибирующие свойства ибупрофена и его амидных аналогов в отношении гидролиза и циклооксигенации эндоканнабиноидного анандамида. J Enzyme Inhib Med Chem. 2013; 28: 172–182. [Статья бесплатно PMC] [PubMed] [Google Scholar]
59. Fowler CJ, Tiger G, Stenström A. Ибупрофен ингибирует дезамидирование анандамида в головном мозге крыс в фармакологически значимых концентрациях. Режим торможения и взаимосвязь структура-активность. J Pharmacol Exp Ther. 1997;283:729–734. [PubMed] [Google Scholar]
Fowler CJ, Tiger G, Stenström A. Ибупрофен ингибирует дезамидирование анандамида в головном мозге крыс в фармакологически значимых концентрациях. Режим торможения и взаимосвязь структура-активность. J Pharmacol Exp Ther. 1997;283:729–734. [PubMed] [Google Scholar]
60. Guindon J, De Léan A, Beaulieu P. Местные взаимодействия между анандамидом, эндоканнабиноидом, и ибупрофеном, нестероидным противовоспалительным препаратом, при острой и воспалительной боли. Боль. 2006; 121:85–93. [PubMed] [Google Scholar]
61. Holt S, Paylor B, Boldrup L, Alajakku K, Vandevoorde S, Sundström A, et al. Ингибирование амидгидролазы жирных кислот, ключевого фермента, метаболизирующего эндоканнабиноиды, аналогами ибупрофена и индометацина. Евр Дж Фармакол. 2007; 565: 26–36. [PubMed] [Академия Google]
62. Уорд К.Е., Аршамбо Р., Мерсфельдер Т.Л. Тяжелые побочные кожные реакции на нестероидные противовоспалительные препараты: обзор литературы. Am J Health Syst Pharm. 2010;67:206–213. [PubMed] [Google Scholar]
63.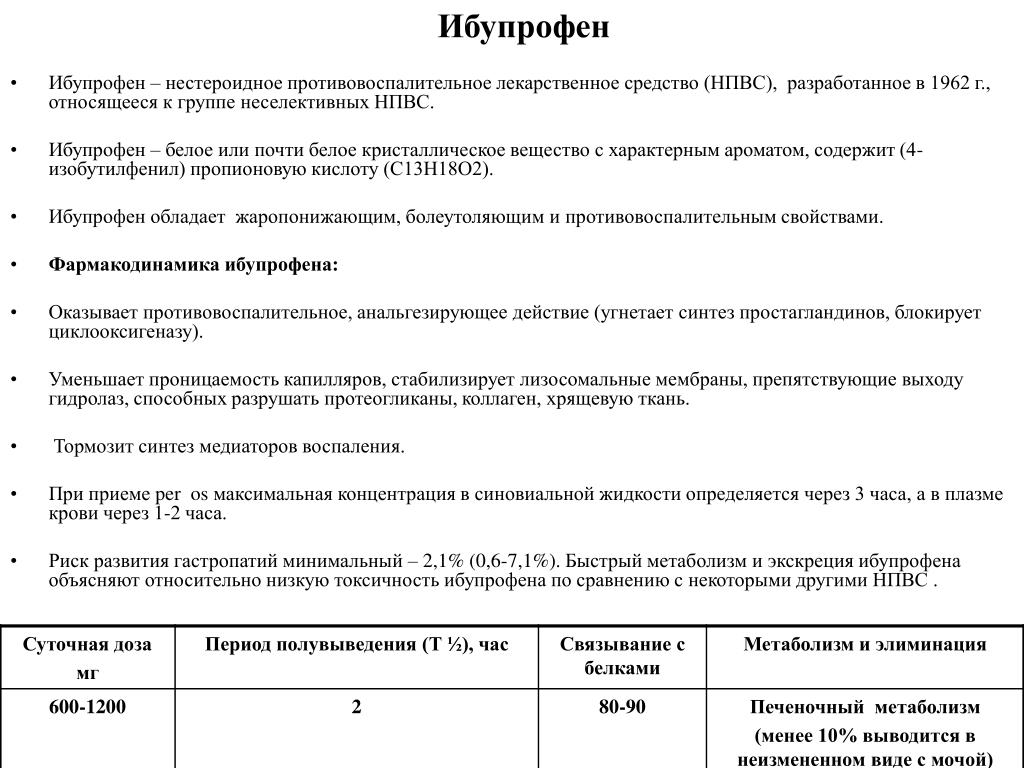 Bhala N, Emberson J, Merhi A, Abramson S, Arber N, Baron JA, et al. Сотрудничество Coxib и традиционных исследователей НПВП (CNT). Сосудистые и верхние желудочно-кишечные эффекты нестероидных противовоспалительных препаратов: метаанализ данных отдельных участников из рандомизированных исследований. Ланцет. 2013;382:769–779. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Bhala N, Emberson J, Merhi A, Abramson S, Arber N, Baron JA, et al. Сотрудничество Coxib и традиционных исследователей НПВП (CNT). Сосудистые и верхние желудочно-кишечные эффекты нестероидных противовоспалительных препаратов: метаанализ данных отдельных участников из рандомизированных исследований. Ланцет. 2013;382:769–779. [Бесплатная статья PMC] [PubMed] [Google Scholar]
64. Schnitzer TJ, Burmester GR, Mysler E, Hochberg MC, Doherty M, Ehrsam E, et al. Целевая исследовательская группа. Сравнение лумиракоксиба с напроксеном и ибупрофеном в исследовании Therapeutic Arthritis Research and Gastrointestinal Event Trial (TARGET), снижение частоты язвенных осложнений: рандомизированное контролируемое исследование. Ланцет. 2004; 364: 665–674. [PubMed] [Google Scholar]
65. Farkouh ME, Kirshner H, Harrington RA, Ruland S, Verheugt FW, Schnitzer TJ, et al. Целевая исследовательская группа. Сравнение лумиракоксиба с напроксеном и ибупрофеном в исследовании Therapeutic Arthritis Research and Gastrointestinal Event Trial (TARGET), сердечно-сосудистые исходы: рандомизированное контролируемое исследование. Ланцет. 2004; 364: 675–684. [PubMed] [Академия Google]
Ланцет. 2004; 364: 675–684. [PubMed] [Академия Google]
66. Гроссер Т., Фрайс С., Фитцджеральд Г.А. Биологическая основа сердечно-сосудистых последствий ингибирования ЦОГ-2: терапевтические проблемы и возможности. Джей Клин Инвест. 2006; 116:4–15. [Бесплатная статья PMC] [PubMed] [Google Scholar]
67. Hippisley-Cox J, Coupland C. Риск инфаркта миокарда у пациентов, принимающих ингибиторы циклооксигеназы-2 или обычные нестероидные противовоспалительные препараты: популяционные вложенные анализ случай-контроль. БМЖ. 2005; 330:1366. [Бесплатная статья PMC] [PubMed] [Google Scholar]
68. Graham DJ, Campen D, Hui R, Spence M, Cheetham C, Levy G, et al. Риск острого инфаркта миокарда и внезапной сердечной смерти у пациентов, получавших селективные и неселективные нестероидные противовоспалительные препараты в отношении циклооксигеназы 2: вложенное исследование случай-контроль. Ланцет. 2005; 365: 475–481. [PubMed] [Google Scholar]
69. Гарсия Родригес Л.А., Варас-Лоренцо С. , Магуайр А., Гонсалес-Перес А. Нестероидные противовоспалительные препараты и риск инфаркта миокарда у населения в целом. Тираж. 2004;109: 3000–3006. [PubMed] [Google Scholar]
, Магуайр А., Гонсалес-Перес А. Нестероидные противовоспалительные препараты и риск инфаркта миокарда у населения в целом. Тираж. 2004;109: 3000–3006. [PubMed] [Google Scholar]
70. Гарсия Родригес Л.А., Гонсалес-Перес А. Длительное применение нестероидных противовоспалительных препаратов и риск инфаркта миокарда у населения в целом. БМС Мед. 2005;3:17. [Бесплатная статья PMC] [PubMed] [Google Scholar]
71. Catella-Lawson F, Reilly MP, Kapoor SC, Cucchiara AJ, DeMarco S, Tournier B, et al. Ингибиторы циклооксигеназы и антитромбоцитарные эффекты аспирина. N Engl J Med. 2001; 345:1809–1817. [PubMed] [Академия Google]
72. Эллисон Дж., Дагер В. Недавнее предупреждение FDA о одновременном применении аспирина и ибупрофена и влиянии на агрегацию тромбоцитов. Пред. Кардиол. 2007; 10:61–63. [PubMed] [Google Scholar]
73. Сотрудничество исследователей антитромботических препаратов. Совместный метаанализ рандомизированных исследований антитромбоцитарной терапии для предотвращения смерти, инфаркта миокарда и инсульта у пациентов с высоким риском. БМЖ. 2002; 324:71–86. [Бесплатная статья PMC] [PubMed] [Google Scholar]
БМЖ. 2002; 324:71–86. [Бесплатная статья PMC] [PubMed] [Google Scholar]
74. MacDonald TM, Wei L. Влияние ибупрофена на кардиопротекторный эффект аспирина. Ланцет. 2003; 361: 573–574. [PubMed] [Академия Google]
75. Hudson M, Baron M, Rahme E, Pilote L. Ибупрофен может аннулировать преимущества аспирина при использовании для вторичной профилактики инфаркта миокарда. J Ревматол. 2005; 32: 1589–1593. [PubMed] [Google Scholar]
76. Curtis JP, Wang Y, Portnay EL, Masoudi FA, Havranek EP, Krumholz HM. Аспирин, ибупрофен и смертность после инфаркта миокарда: ретроспективное когортное исследование. БМЖ. 2003; 327:1322–1323. [Бесплатная статья PMC] [PubMed] [Google Scholar]
77. Schulman S, Henriksson K. Взаимодействие ибупрофена и варфарина с первичным гемостазом. Br J Ревматол. 1989;28:46–49. [PubMed] [Google Scholar]
78. Juel J, Pedersen TB, Langfrits CS, Jensen SE. Введение трамадола или ибупрофена повышает уровень МНО у пациентов, принимающих варфарин. Eur J Clin Pharmacol. 2013;69:291–292. [PubMed] [Google Scholar]
Eur J Clin Pharmacol. 2013;69:291–292. [PubMed] [Google Scholar]
79. Фелан К.М., Мосхолдер А.Д., Лу С. Взаимодействие лития с ингибиторами циклооксигеназы 2 рофекоксибом и целекоксибом и другими нестероидными противовоспалительными препаратами. Дж. Клин Психиатрия. 2003; 64: 1328–1334. [PubMed] [Академия Google]
80. Рагеб М., Бан Т.А., Бьюкенен Д., Фролич Дж.К. Взаимодействие индометацина и ибупрофена с литием у больных манией при стабильном уровне лития. Дж. Клин Психиатрия. 1980; 41: 397–398. [PubMed] [Google Scholar]
81. Bailey CE, Stewart JT, McElroy RA. Токсичность лития, вызванная ибупрофеном. South Med J. 1989; 82:1197. [PubMed] [Google Scholar]
82. Ragheb M. Ибупрофен может повышать уровень лития в сыворотке у пациентов, получающих литий. Дж. Клин Психиатрия. 1987; 48: 161–163. [PubMed] [Академия Google]
83. Хан И.Х. Литий и нестероидные противовоспалительные препараты. БМЖ. 1991; 302: 1537–1538. [Бесплатная статья PMC] [PubMed] [Google Scholar]
84. Radack KL, Deck CC, Bloomfield SS. Ибупрофен снижает эффективность антигипертензивных препаратов. Рандомизированное двойное слепое плацебо-контролируемое исследование ибупрофена по сравнению с ацетаминофеном. Энн Интерн Мед. 1987; 107: 628–635. [PubMed] [Google Scholar]
Radack KL, Deck CC, Bloomfield SS. Ибупрофен снижает эффективность антигипертензивных препаратов. Рандомизированное двойное слепое плацебо-контролируемое исследование ибупрофена по сравнению с ацетаминофеном. Энн Интерн Мед. 1987; 107: 628–635. [PubMed] [Google Scholar]
85. Gurwitz JH, Everitt DE, Monane M, Glynn RJ, Choodnovskiy I, Beaudet MP, Avorn J. Влияние ибупрофена на эффективность антигипертензивного лечения гидрохлоротиазидом у пожилых людей. J Gerontol A Biol Sci Med Sci. 1996;51:М74–М79. [PubMed] [Google Scholar]
86. Fournier JP, Sommet A, Bourrel R, Oustric S, Pathak A, Lapeyre-Mestre M, Montastruc JL. Нестероидные противовоспалительные препараты (НПВП) и интенсификация лечения гипертонии: популяционное когортное исследование. Eur J Clin Pharmacol. 2012;68:1533–1540. [PubMed] [Google Scholar]
87. MacDonald TM, Richard D, Lheritier K, Krammer G. Влияние лумиракоксиба 100 мг один раз в день по сравнению с ибупрофеном 600 мг три раза в день на профили артериального давления у пациентов с гипертоническим остеоартритом, принимающих различные классы антигипертензивных средств. Int J Clin Pract. 2010;64:746–755. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Int J Clin Pract. 2010;64:746–755. [Бесплатная статья PMC] [PubMed] [Google Scholar]
88. López-Rodríguez R, Novalbos J, Gallego-Sandín S, Roman-Martínez M, Torrado J, Gisbert JP, Abad-Santos F. Влияние полиморфизмов CYP2C8 и CYP2C9 на фармакокинетические и фармакодинамические параметры рацемических и энантиомерных форм ибупрофена у здоровых добровольцев. Фармакол рез. 2008; 58: 77–84. [PubMed] [Google Scholar]
89. Гарсия-Мартин Э., Мартинес С., Табарес Б., Фриас Х., Агундес Х.А. Индивидуальная вариабельность фармакокинетики ибупрофена связана с взаимодействием цитохрома Р450 2С8 и 2С9.аминокислотные полиморфизмы. Клин Фармакол Тер. 2004; 76: 119–127. [PubMed] [Google Scholar]
90. Kirchheiner J, Meineke I, Freytag G, Meisel C, Roots I, Brockmöller J. Энантиоспецифические эффекты вариантов аминокислот цитохрома P450 2C9 на фармакокинетику ибупрофена и на ингибирование циклооксигеназ 1 и 2. , Клин Фармакол Ther. 2002; 72: 62–75. [PubMed] [Google Scholar]
91. Караньевич-Лада М., Лучак М., Гловка Ф. Фармакокинетические исследования энантиомеров ибупрофена и его хиральных метаболитов у людей с различными вариантами генов, кодирующих CYP2C8 и CYP2C9.изоферменты. Ксенобиотика. 2009; 39: 476–485. [PubMed] [Google Scholar]
Караньевич-Лада М., Лучак М., Гловка Ф. Фармакокинетические исследования энантиомеров ибупрофена и его хиральных метаболитов у людей с различными вариантами генов, кодирующих CYP2C8 и CYP2C9.изоферменты. Ксенобиотика. 2009; 39: 476–485. [PubMed] [Google Scholar]
92. Мартинес С., Гарсия-Мартин Э., Бланко Г., Гамито Ф.Дж., Ладеро Х.М., Агундес Х.А. Влияние полиморфизма цитохрома P450 CYP2C8 на распределение энантиомера (R)-ибупрофена у здоровых людей. Бр Дж Клин Фармакол. 2005; 59: 62–69. [Бесплатная статья PMC] [PubMed] [Google Scholar]
93. Blanco G, Martínez C, Ladero JM, Garcia-Martin E, Taxonera C, Gamito FG, et al. Взаимодействие генотипов CYP2C8 и CYP2C9 модифицирует риск острого желудочно-кишечного кровотечения, связанного с приемом нестероидных противовоспалительных препаратов. Фармакогенетическая геномика. 2008; 18:37–43. [PubMed] [Академия Google]
94. Пилотто А., Серипа Д., Франчески М., Скарчелли С., Колайццо Д., Грандоне Э. и другие. Генетическая предрасположенность к гастродуоденальным кровотечениям, связанным с нестероидными противовоспалительными препаратами: роль полиморфизмов цитохрома Р450 2С9. Гастроэнтерология. 2007; 133: 465–471. [PubMed] [Google Scholar]
Гастроэнтерология. 2007; 133: 465–471. [PubMed] [Google Scholar]
95. Carbonell N, Verstuyft C, Massard J, Letierce A, Cellier C, Deforges L, et al. Аллель потери функции CYP2C9*3 связан с острыми кровотечениями из верхних отделов желудочно-кишечного тракта, связанными с применением НПВП, отличных от аспирина. Клин Фармакол Тер. 2010;87:693–698. [PubMed] [Google Scholar]
96. Martinez C, Blanco G, Ladero JM, García-Martín E, Taxonera C, Gamito FG и соавт. Генетическая предрасположенность к острым желудочно-кишечным кровотечениям после применения НПВП. Бр Дж. Фармакол. 2004; 141: 205–208. [Бесплатная статья PMC] [PubMed] [Google Scholar]
97. Martin JH, Begg EJ, Kennedy MA, Roberts R, Barclay ML. Связан ли генотип цитохрома P450 2C9 с язвой желудка, вызванной НПВП? Бр Дж Клин Фармакол. 2001; 51: 627–630. [Бесплатная статья PMC] [PubMed] [Google Scholar]
98. Lee YS, Kim H, Wu TX, Wang XM, Dionne RA. Генетически опосредованные межиндивидуальные вариации анальгетического ответа на препараты, ингибирующие циклооксигеназу. Клин Фармакол Тер. 2006; 79: 407–418. [PubMed] [Google Scholar]
Клин Фармакол Тер. 2006; 79: 407–418. [PubMed] [Google Scholar]
99. Ali IU, Luke BT, Dean M, Greenwald P. Аллельные варианты в регуляторных областях циклооксигеназы-2: ассоциация с развитой колоректальной аденомой. Бр Дж Рак. 2005; 93: 953–959. [Бесплатная статья PMC] [PubMed] [Google Scholar]
100. Brasky TM, Bonner MR, Moysich KB, Ochs-Balcom HM, Marian C, Ambrosone CB, et al. Генетические варианты ЦОГ-2, нестероидные противовоспалительные препараты и риск рака молочной железы: исследование западного Нью-Йорка и рака молочной железы (WEB). Лечение рака молочной железы. 2011; 126:157–165. [Бесплатная статья PMC] [PubMed] [Google Scholar]
101. Ченг И., Лю С., Пламмер С.Дж., Крамрой Л.М., Кейси Г., Витте Д.С. Генетическая вариация ЦОГ-2, НПВП и риск прогрессирующего рака предстательной железы. Бр Дж Рак. 2007; 97: 557–561. [Бесплатная статья PMC] [PubMed] [Google Scholar]
102. Liu X, Plummer SJ, Nock NL, Casey G, Witte JS. Нестероидные противовоспалительные препараты и снижение риска прогрессирующего рака предстательной железы: модификация лимфотоксином альфа. Am J Эпидемиол. 2006; 164: 984–989. [PubMed] [Google Scholar]
Am J Эпидемиол. 2006; 164: 984–989. [PubMed] [Google Scholar]
103. McGreavey LE, Turner F, Smith G, Boylan K, Timothy Bishop D, Forman D, et al. Нет доказательств того, что полиморфизмы CYP2C8, CYP2C9, UGT1A6, PPARdelta и PPARgamma действуют как модификаторы защитного эффекта регулярного применения НПВП в отношении риска колоректальной карциномы. Фармакогенетическая геномика. 2005; 15: 713–721. [PubMed] [Google Scholar]
104. Passarelli MN, Coghill AE, Hutter CM, Zheng Y, Makar KW, Potter JD, Newcomb PA. Общие варианты риска колоректального рака в SMAD7 связаны с выживаемостью среди потребителей нестероидных противовоспалительных препаратов до диагностики: популяционное исследование женщин в постменопаузе. Гены Хромосомы Рак. 2011;50:875–886. [Бесплатная статья PMC] [PubMed] [Google Scholar]
105. Samowitz WS, Wolff RK, Curtin K, Sweeney C, Ma KN, Andersen K, et al. Взаимодействие между полиморфизмами CYP2C9 и UGT1A6 и нестероидными противовоспалительными препаратами в профилактике колоректального рака. Клин Гастроэнтерол Гепатол. 2006; 4: 894–901. [PubMed] [Google Scholar]
Клин Гастроэнтерол Гепатол. 2006; 4: 894–901. [PubMed] [Google Scholar]
106. Scherer D, Koepl LM, Poole EM, Balavarca Y, Xiao L, Baron JA, et al. Генетическая вариация в генах UGT модифицирует ассоциации НПВП с риском колоректального рака: семейный реестр рака толстой кишки. Гены Хромосомы Рак. 2014; 53: 568–578. [Бесплатная статья PMC] [PubMed] [Google Scholar]
107. Slattery ML, Curtin K, Wolff R, Ma KN, Sweeney C, Murtaugh M, et al. PPARgamma и рак толстой и прямой кишки: ассоциации со специфическими опухолевыми мутациями, генами, связанными с аспирином, ибупрофеном и инсулином (Соединенные Штаты) Cancer Causes Control. 2006; 17: 239–249. [PubMed] [Google Scholar]
Ибупрофен — Фонд алкоголя и наркотиков
Последняя публикация: 10 ноября 2021 г.
Что такое ибупрофен?
Ибупрофен — это фармацевтический препарат, который классифицируется как нестероидный противовоспалительный препарат (НПВП).
Ибупрофен используется для лечения ряда состояний, включая:
- боль от легкой до умеренной
- сильную боль (в сочетании с кодеином)
- лихорадку
- отек, покраснение и болезненность тканей (воспаление)
- , ревматоидный артрит боль и подагра (в сочетании с физиотерапией).
 1
1
Некоторые люди принимают ибупрофен, чтобы получить кайф, или как акт членовредительства, намеренно принимая дозу, превышающую рекомендуемую.
Ибупрофен обычно проглатывают и выпускается в различных формах, включая:
- таблетки
- капсулы
- суппозитории
- растворимые порошки
- жидкости. 1
Другие наименования
Ибупрофен также может быть известен под торговой маркой или торговой маркой. Некоторые распространенные примеры:
| Общее название | Торговые марки |
|---|---|
| Ибупрофен | Бруфен®, Нурофен® |
| Ибупрофен и кодеин | Нурофен Плюс® |
Эффекты ибупрофена
Не существует безопасного уровня употребления наркотиков. Использование любого лекарства всегда сопряжено с определенным риском — даже лекарства могут вызывать нежелательные побочные эффекты. Важно соблюдать осторожность при приеме любого вида наркотиков.
Использование любого лекарства всегда сопряжено с определенным риском — даже лекарства могут вызывать нежелательные побочные эффекты. Важно соблюдать осторожность при приеме любого вида наркотиков.
Ибупрофен действует на всех по-разному в зависимости от:
- размера, веса и состояния здоровья
- привык ли человек к его приему
- принимает ли другие наркотики примерно в то же время
- принимаемое количество.
Побочные эффекты
Наиболее распространенными побочными эффектами ибупрофена:
- головная боль
- Глоловечество . уши
- нечеткость зрения и раздражение глаз
- задержка жидкости и отек лодыжек
- легкая аллергическая реакция
- боль в животе, тошнота, рвота, изжога, диарея и запор
- раздражение и боль мочевого пузыря, частое мочеиспускание. 1,2
НПВП, такие как ибупрофен, могут увеличить риск сердечного приступа или инсульта у людей с сердечными заболеваниями или без них или факторы риска сердечных заболеваний. 2
2
Дополнительная информация о НПВП и проблемах с сердцем
Передозировка
Если вы примете дозу, превышающую рекомендуемую, может возникнуть передозировка. Немедленно вызовите скорую помощь, набрав тройной ноль (000), если у вас или кого-то еще есть какие-либо из следующих симптомов (сотрудникам скорой помощи не нужно привлекать полицию):
- спутанность сознания и дезориентация
- сонливость
- боль в животе
- нечеткость зрения
- шум в ушах (звон в ушах)
- диарея
- тревога и паранойя
- анемия (низкий уровень эритроцитов), тошнота и рвота
- рвота кровью, которая может выглядеть как кофейная гуща, и испражнения, похожие на черную смолу
- тяжелая аллергическая реакция, включая отек лица
- проблемы с почками и печенью
- припадки/судороги
- кома и смерть. 1, 14, 5
Долгосрочные эффекты
Побочные эффекты длительного применения лучше обсудить с лечащим врачом. Регулярное употребление ибупрофена может со временем вызвать:
Регулярное употребление ибупрофена может со временем вызвать:
- анемию из-за желудочного кровотечения
- нарушения слуха
- поражение почек и печени
- кровотечения в желудке и кишечнике
- повышенный риск сердечного приступа. 1
Использование ибупрофена с другими препаратами
Последствия приема ибупрофена с другими препаратами, включая алкоголь, лекарства, отпускаемые по рецепту, и другие лекарства, отпускаемые без рецепта, часто непредсказуемы.
Прием ибупрофена с алкоголем может увеличить риск раздражения желудка и дискомфорта. 1
Ибупрофен может изменить действие некоторых лекарств от кровяного давления и может увеличить риск кровотечения при приеме с такими лекарствами, как варфарин. 1
Получение помощи
Если прием ибупрофена влияет на ваше здоровье, семью, отношения, работу, учебу, финансовые или другие жизненные ситуации, вы можете найти помощь и поддержку.
Позвоните по телефону 1300 85 85 84 , чтобы поговорить с реальным человеком и получить ответы на свои вопросы, а также советы по практическим «следующим шагам».
Path3Помощь
Не уверены, что ищете? Попробуйте наш интуитивно понятный инструмент Path3Help и получите информацию о поддержке и услугах, специально предназначенных для вас.
Узнать больше
Подробнее о передозировке
- Upfal J. Австралийский справочник по наркотикам. 8-е изд. Виктория: Гриффин Пресс; 2016.
- Кэрнс Р., Каранжес Э.А., Вонг А., Браун Дж.А., Робинсон Дж., Пирсон С.А. и др. Тенденции самоотравление и употребление психотропных препаратов среди людей в возрасте 5-19 лет: популяционное ретроспективное когортное исследование в Австралии. БМЖ открыт. 2019;9(2):e026001.

- Plus M. Ибупрофен: Американское общество фармацевтов системы здравоохранения; 2016 [цитировано 12 марта 2020 г.].
- Хантер Л.Дж., Вуд Д.М., Дарган П.И. Паттерны токсичности и лечение острой передозировки нестероидных противовоспалительных препаратов (НПВП). Неотложная медицина открытого доступа: OAEM. 2011;3:39-48.
- Клиника Мэйо. Ибупрофен (пероральный путь) Меры предосторожности: клиника Майо; 2020
Подробнее о библиотеке ADF
Эффекты
боль в животе, отек лодыжек, раздражение мочевого пузыря, запор, диарея, головокружение, сонливость, раздражение глаз, усталость, задержка жидкости, Головная боль, тошнота, беспокойный сон, звон в ушах, потливость, покалывание в руках и ногах, лечит артрит, лечит лихорадку, лечит подагру, лечит воспаления, лечит легкую боль, лечит умеренную боль, рвота
АКА
бруфен, нурофен
Ибупрофен: насколько хорошо вы знаете свой любимый наркотик?
Карла Ю. Фалькон, доктор медицинских наук, доктор медицинских наук.
Фалькон, доктор медицинских наук, доктор медицинских наук.
Ибупрофен был первоначально разработан как противоревматическое средство в 1961 году и впервые был представлен по рецепту в 1969 году в Великобритании под названием Буфрен. Он стал доступен по рецепту в Соединенных Штатах в 1974 г., без рецепта в Великобритании в 19 г.83, и безрецептурный в США в 1984 г.
В качестве НПВП ибупрофен является неселективным ингибитором циклооксигеназы-1 (ЦОГ-1) и циклооксигеназы-2 (ЦОГ-2). . Хотя точный механизм остается неизвестным, известно, что ибупрофен является мощным ингибитором синтеза простагландинов, который контролирует боль, воспаление и лихорадку. Существует две стереоформы препарата, однако на S-(+)-энантиомер приходится большая часть фармакологической активности, и в исследованиях in vitro было обнаружено, что он в 160 раз более эффективен, чем его рацемат, R- (-)-ибупрофен ингибирует синтез простагландинов и в два раза более эффективен в ингибировании агрегации тромбоцитов и образовании тромбоксана. Его противовоспалительный эффект почти полностью объясняется S-(+)-энантиомером.
Его противовоспалительный эффект почти полностью объясняется S-(+)-энантиомером.
Ибупрофен быстро всасывается, достигая максимальной концентрации в сыворотке крови через один-два часа после приема, период полувыведения составляет от 1,8 до двух часов. Его первичное распределение происходит в плазменном альбумине с объемом распределения 0,12 л/кг у взрослых, а значительные уровни достигаются в синовиальной жидкости, которая является предполагаемым местом действия НПВП. При дозах более 600 мг происходит увеличение несвязанной фракции препарата, что приводит к увеличению клиренса. Ибупрофен выводится после биотрансформации в метаболиты глюкуронидного конъюгата с мочой и калом через 45–79 ч.% в виде метаболитов и <1% остаются неизменными. Максимальная рекомендуемая суточная доза составляет 3200 мг, а терапевтическое окно ибупрофена широкое: 10-50 мг/л и высокая токсическая концентрация (>100 мг/л).
Основной мерой предосторожности при назначении НПВП является риск повреждения желудочно-кишечного тракта (ЖКТ), которое в основном возникает из-за блокады синтеза гастропротекторных простагландинов. Приблизительно 10-20% пациентов, принимающих НПВП, могут жаловаться на диспепсию, боль в животе и желудочно-кишечный дискомфорт, но эти симптомы не коррелируют с клинически значимыми изъязвлениями. Рекомендуется принимать ибупрофен во время еды или со стаканом молока, если возникают желудочно-кишечные расстройства, и, хотя было показано, что прием ибупрофена во время еды сокращает время всасывания, он не влияет на конечную концентрацию в сыворотке крови. В то время как ибупрофен имеет самый низкий риск желудочно-кишечного кровотечения из всех НПВП, предположительно из-за его короткого периода полувыведения, риск серьезного желудочно-кишечного изъязвления и кровотечения является серьезным и может быть опасным для жизни; поэтому следует избегать приема НПВП, если у пациента в анамнезе были желудочно-кишечные кровотечения.
Приблизительно 10-20% пациентов, принимающих НПВП, могут жаловаться на диспепсию, боль в животе и желудочно-кишечный дискомфорт, но эти симптомы не коррелируют с клинически значимыми изъязвлениями. Рекомендуется принимать ибупрофен во время еды или со стаканом молока, если возникают желудочно-кишечные расстройства, и, хотя было показано, что прием ибупрофена во время еды сокращает время всасывания, он не влияет на конечную концентрацию в сыворотке крови. В то время как ибупрофен имеет самый низкий риск желудочно-кишечного кровотечения из всех НПВП, предположительно из-за его короткого периода полувыведения, риск серьезного желудочно-кишечного изъязвления и кровотечения является серьезным и может быть опасным для жизни; поэтому следует избегать приема НПВП, если у пациента в анамнезе были желудочно-кишечные кровотечения.
Сердечно-сосудистые осложнения, такие как ухудшение артериального давления и повышенный риск инфаркта миокарда, также являются рисками, связанными с использованием НПВП. Таким образом, следует избегать использования ибупрофена у пациентов с застойной сердечной недостаточностью и с осторожностью применять его у пациентов с артериальной гипертензией, поскольку при применении НПВП было отмечено среднее повышение артериального давления на 5 мм рт.ст.
Таким образом, следует избегать использования ибупрофена у пациентов с застойной сердечной недостаточностью и с осторожностью применять его у пациентов с артериальной гипертензией, поскольку при применении НПВП было отмечено среднее повышение артериального давления на 5 мм рт.ст.
Первичные осложнения со стороны печени встречаются редко и обычно обратимы. Однако следует избегать применения ибупрофена у пациентов с циррозом из-за снижения функциональной способности печени и его потенциального влияния на фармакокинетику ибупрофена, а также возможных гематологических и почечных осложнений. Интересно, что хотя ибупрофен выводится в результате окислительного метаболизма, алкогольное поражение печени оказывает минимальное влияние на фармакокинетику ибупрофена.
Поскольку НПВП выводятся почками, следует избегать применения ибупрофена у пациентов с почечной недостаточностью. Одновременное применение антикоагулянтов увеличивает риск желудочно-кишечного кровотечения в шесть раз, поэтому его следует избегать.
НПВП следует применять с осторожностью у пациентов с астмой в анамнезе, однако реакции гиперчувствительности чаще всего связаны с пациентами с тяжелой астмой, требующей больших доз препаратов, например, при зависимости от кортикостероидов.
Неизвестно, что ибупрофен оказывает тератогенное действие на человека. Американская академия педиатрии обычно считает безопасным прерывистый прием низких доз ибупрофена при беременности, если его прием прекращается за шесть-восемь недель до срока. Однако некоторые предостерегают от использования в третьем триместре беременности, и поскольку НПВП используются ближе к сроку, риск для матери и ребенка возрастает. Ингибирование ибупрофеном синтеза простагландинов может вызвать удлинение беременности и родов, повышенную перинатальную кровопотерю и усиление анемии. Ибупрофен является предпочтительным НПВП для кормящих матерей, поскольку он плохо проникает в молоко. У детей НПВП считаются столь же безопасными, как и ацетаминофен, при этом основной риск заключается в ошибках дозирования.
Несмотря на то, что ибупрофен показал высокую эффективность в качестве анальгетика, некоторые исследователи отмечают предельную дозу. В результате рекомендуется принимать дополнительные анальгетики в сочетании с ибупрофеном как способ усилить анальгезию, например, одновременное введение ацетаминофена, что приводит к статистически значимому снижению дискомфорта по сравнению с 600 мг ибупрофена отдельно (Menhinick, 2004, ИЭЖ). Количественный системный обзор показал, что комбинация ибупрофена и ацетаминофена обеспечивает большую анальгетическую эффективность, чем опиоиды, а также меньше побочных эффектов (Moore, 2013, JADA). С его испытанной и доказанной эффективностью легко понять, почему ибупрофен является одним из предпочтительных анальгетиков эндодонтистов.
Доктор Фалькон является доцентом кафедры эндодонтии в Университете Рутгерса, где она также получила степень в области стоматологии и прошла обучение по эндодонтии. С ней можно связаться по телефону falconcy@sdm. rutgers.edu.
rutgers.edu.
Побочные эффекты ибупрофена — NHS
Общие побочные эффекты таблеток, капсул, гранул и жидкости
Эти распространенные побочные эффекты при пероральном приеме ибупрофена возникают более чем у 1 из 100 человек. Есть вещи, которые вы можете сделать, чтобы справиться с ними:
Головные болиОбязательно отдыхайте и пейте много жидкости. Старайтесь не пить слишком много алкоголя. Важно не принимать какие-либо другие лекарства от боли, чтобы помочь при головной боли. Поговорите со своим врачом, если головные боли длятся дольше недели или сильные.
Чувство головокружения Если ибупрофен вызывает у вас головокружение, прекратите то, что вы делаете, и сядьте или лягте, пока не почувствуете себя лучше. Избегайте кофе, сигарет и алкоголя. Если головокружение не проходит в течение нескольких дней, обратитесь к своему фармацевту или врачу. Не садитесь за руль и не катайтесь на велосипеде, пока у вас кружится голова.
Не садитесь за руль и не катайтесь на велосипеде, пока у вас кружится голова.
Придерживайтесь простых приемов пищи. Не ешьте богатую или острую пищу. Всегда принимайте ибупрофен в таблетках, капсулах, гранулах или жидкости с едой, закусками или запивая молоком.
Болезнь (рвота)Во избежание обезвоживания пейте воду часто и небольшими глотками. Поговорите с фармацевтом, если у вас есть признаки обезвоживания, такие как мочеиспускание реже, чем обычно, или моча темного цвета с сильным запахом. Не принимайте никаких других лекарств от рвоты, не посоветовавшись с фармацевтом или врачом.
Если вы принимаете противозачаточные таблетки и болеете, ваши противозачаточные средства могут не защитить вас от беременности. Проверьте упаковку с таблетками, чтобы получить совет.
Ветер Старайтесь не есть продукты, вызывающие метеоризм (например, чечевицу, фасоль и лук). Ешьте небольшими порциями, ешьте и пейте медленно и регулярно занимайтесь спортом. Также могут помочь аптечные препараты, такие как таблетки активированного угля или симетикон.
Ешьте небольшими порциями, ешьте и пейте медленно и регулярно занимайтесь спортом. Также могут помочь аптечные препараты, такие как таблетки активированного угля или симетикон.
Если у вас повторяется расстройство желудка, прекратите прием ибупрофена и как можно скорее обратитесь к врачу. Если вам нужно что-то, чтобы облегчить дискомфорт, попробуйте принять антацид, но не откладывайте поход к врачу.
Обратитесь к врачу или фармацевту, если совет о том, как справиться с ситуацией, не помогает, а побочный эффект все еще беспокоит или не проходит.
Распространенные побочные эффекты геля, мусса и спрея
Вероятность появления побочных эффектов при нанесении ибупрофена на кожу ниже, чем при применении таблеток, капсул, гранул или жидкости, поскольку меньшее количество препарата попадает в организм. Но вы все равно можете получить те же побочные эффекты, особенно если вы используете много на большой площади кожи.
Нанесение ибупрофена на кожу иногда может привести к тому, что ваша кожа станет более чувствительной, чем обычно, к солнечному свету. Поговорите со своим врачом, если это проблема.
Серьезные побочные эффекты
Немедленно обратитесь к врачу или позвоните по номеру 111 и прекратите прием ибупрофена, если у вас:
- черный кал или кровь в рвотных массах – это может быть признаком желудочного кровотечения
- опухшие лодыжки, кровь в вы мочитесь или вообще не мочитесь — это может быть признаком проблемы с почками
Посетите сайт 111.nhs.uk или позвоните по номеру 111.
Требуются немедленные действия: Звоните 999 или обратитесь в неотложную помощь сейчас, если:
- у вас сильная боль в груди или животе – это может быть признаком пробоины в желудке или кишечнике
- у вас затрудненное дыхание или симптомы астмы ухудшаются шею и неприязнь к яркому свету – это могут быть признаки или воспаление защитных оболочек, окружающих головной и спинной мозг (мозговые оболочки)
- у вас нечеткое зрение или вы видите или слышите нереальные вещи (галлюцинации)
Найдите ближайшее отделение скорой помощи
Серьезная аллергическая реакция
В редких случаях возможна серьезная аллергическая реакция (анафилаксия) на ибупрофен.
Требуются немедленные действия: позвоните по номеру 999 или обратитесь в службу неотложной помощи сейчас, если:
- у вас кожная сыпь, которая может включать зуд, покраснение, отек, образование волдырей или шелушение кожи
- у вас свистящее дыхание
- у вас стеснение в груди или горле
- у вас проблемы с дыханием или речью
- у вас начинает отекать рот, лицо, губы, язык или горло
У вас может быть серьезная аллергическая реакция и может потребоваться немедленное лечение в больнице.
Долгосрочные побочные эффекты
Ибупрофен может вызвать язву желудка или кишечника, особенно если принимать его внутрь в течение длительного времени или в больших дозах. Если вам нужно принимать его в течение длительного времени, ваш врач может также назначить лекарство для защиты вашего желудка.
Если вам нужно принимать его в течение длительного времени, ваш врач может также назначить лекарство для защиты вашего желудка.
Другие побочные эффекты
Это не все побочные эффекты таблеток, капсул и сиропа ибупрофена. Полный список см. в листовке внутри упаковки с лекарствами.
Информация:
Вы можете сообщить о любом предполагаемом побочном эффекте, используя схему безопасности «Желтая карточка».
Посетите Желтую карточку для получения дополнительной информации.
Последняя проверка страницы: 18 ноября 2021 г.
Дата следующего рассмотрения: 18 ноября 2024 г.
Advil Dual Action: ацетаминофен и ибупрофен
Перейти к основному содержанию-
Использует
Временно облегчает легкие боли, вызванные:
- Головной болью
- Зубная боль
- Боль в спине
- Менструальные спазмы
- Мышечные боли
- Небольшая боль при артрите
-
Дозировка
12 лет и старше:
- по 2 капсулы каждые 8 часов, пока симптомы сохраняются.

- Не принимайте более 6 капсул в течение 24 часов, если это не предписано врачом.
Дети младше 12 лет:
- Спросите врача.
- по 2 капсулы каждые 8 часов, пока симптомы сохраняются.
-
Ингредиенты
Активный ингредиент:
- Ацетаминофен 250 мг… Обезболивающее
- Ибупрофен 125 мг (НПВП*)…..Обезболивающее
- *Нестероидный противовоспалительный препарат
Неактивные ингредиенты:
- Карнаубский воск, коллоидный диоксид кремния, кроскармеллоза натрия, оксиды железа, глицерилдибегенат, гипромеллоза, фармацевтические чернила, полидекстроза, полиэтиленгликоль, прежелатинизированный крахмал, диоксид титана.
Использовать по назначению. Прочтите полные предупреждения и информацию.
Посмотреть полную маркировку продукта
-
Возможные последствия для здоровья
Этот продукт показан для взрослых и детей в возрасте 12 лет и старше.
 Попросите врача, прежде чем давать детям в возрасте до 12 лет. Не принимайте более 6 капсул в течение 24 часов, если это не предписано врачом. Этот продукт содержит ацетаминофен, который может вызвать серьезное повреждение печени, если вы принимаете его с другими препаратами, содержащими ацетаминофен, с 3 или более алкогольными напитками или если вы превысите максимальную суточную дозу. Этот продукт также содержит ибупрофен, который может вызвать аллергическую реакцию, особенно у людей с аллергией на аспирин. См. этикетку продукта для получения полной информации о продукте и предупреждений.
Попросите врача, прежде чем давать детям в возрасте до 12 лет. Не принимайте более 6 капсул в течение 24 часов, если это не предписано врачом. Этот продукт содержит ацетаминофен, который может вызвать серьезное повреждение печени, если вы принимаете его с другими препаратами, содержащими ацетаминофен, с 3 или более алкогольными напитками или если вы превысите максимальную суточную дозу. Этот продукт также содержит ибупрофен, который может вызвать аллергическую реакцию, особенно у людей с аллергией на аспирин. См. этикетку продукта для получения полной информации о продукте и предупреждений. Ацетаминофен, также известный как парацетамол, не следует принимать вместе с другими лекарствами, которые также содержат ацетаминофен. Ацетаминофен содержится во многих лекарствах от боли, лихорадки, симптомов простуды и гриппа, а также в снотворных средствах. Не принимайте больше рекомендуемой дозы, так как это может нанести вред, в том числе нанести серьезный вред вашей печени. Если у вас есть заболевания печени или почек, поговорите со своим врачом, прежде чем принимать ацетаминофен.

Полную информацию о продукте и предупреждения см. на этикетке.
Самые популярные вопросы о Advil Dual Action
-
Содержит ли Advil ацетаминофен?
Симптомы и советы
Менструальные боли
Что такое «менструальные спазмы» и что их вызывает?
Прочитать статью
Головные боли
Средства от головной боли
Прочитать статью
Сравнить продукты Advil
Advil Tablets
СЧЕТ 300
ФОРМА ТАБЛЕТЫ
Ключевая функция легко проглотить
Ингредиент Ibuprofen
Легко глотать ✓
Фат -действия ✓
Продолжительность до 6H
DOSAGE 1 Таблетка. . Если симптомы сохраняются, можно использовать 2. Не принимайте более 6 таблеток в течение 24 часов, если это не предписано врачом. До 12 лет: обратитесь к врачу.
АДВИЛ ТАБЛЕТКА
Advil Liqui-Gels Minis
Кол-во 200
Форма Капсулы
Основная характеристика Маленькие и легко глотаемые
Ингредиент Жидкость Ибупрофен
Легко глотать ✓
Быстродействующий ✓
Продолжительность действия До 6 часов
Дозировка – 16 часов каждые 1 капсулу. Если симптомы сохраняются, можно использовать 2. Не принимайте более 6 капсул в течение 24 часов, если это не предписано врачом. До 12 лет: обратитесь к врачу.
Если симптомы сохраняются, можно использовать 2. Не принимайте более 6 капсул в течение 24 часов, если это не предписано врачом. До 12 лет: обратитесь к врачу.
Advil Liqui-Gels Mini
Advil Liqui-Gels
Кол-во 160
Форма Капсулы
Основное свойство Быстродействующий
Ингредиент Жидкость Ибупрофен
Легко проглатывается ✓
Быстродействующий ✓
Продолжительность действия До 6 часов
Дозировка 1 капсула каждые 4-6 часов. Если симптомы сохраняются, можно использовать 2. Не принимайте более 6 капсул в течение 24 часов, если это не предписано врачом. До 12 лет: обратитесь к врачу.
Advil Liqui-Gels
Advil Easy Open Arthritis Cap
Кол-во 200
Форма Таблетки
Основное свойство Легко открывающаяся крышка
Ингредиент Ибупрофен
Быстродействующий ✓
Продолжительность действия До 6 часов
Дозировка 1 таблетка каждые 4-6 часов. Если симптомы сохраняются, можно использовать 2. Не принимайте более 6 таблеток в течение 24 часов, если это не предписано врачом. До 12 лет: обратитесь к врачу.
Не принимайте более 6 таблеток в течение 24 часов, если это не предписано врачом. До 12 лет: обратитесь к врачу.
Advil Easy Open Open Artritis Cap
Advil Dual Action
Счет 144
Форма Caplets
Ключевая функция давно протянутая
Ингредиент Ibuprofen / Acetaminophen
Fast-Acting ✓
Duration До 80003
Dogle. каждые 8 часов. Не принимайте более 6 капсул в течение 24 часов, если это не предписано врачом. До 12 лет: обратитесь к врачу.
Advil Dual Action
Advil PM Liqui-Gels
Count 80
Form Capsules
Key feature Fast-acting
Ingredient Sulobilized Ibuprofen / Diphenhydramine
Easy to swallow ✓
Fast-acting ✓
Duration Up до 6 часов
Дозировка Принимать по 2 капсулы перед сном. Не принимайте более 2 капсул в течение 24 часов.
Advil PM Liqui-Gels
Advil Liqui-Gels
Кол-во 160
Форма Капсулы
Основная характеристика Быстродействующий
Ингредиент Жидкость Ибупрофен
Легко проглатывается ✓
Быстродействующий ✓
Продолжительность действия До 6 часов
Дозировка 1 капсула каждые 4–6 часов. Если симптомы сохраняются, можно использовать 2. Не принимайте более 6 капсул в течение 24 часов, если это не предписано врачом. До 12 лет: обратитесь к врачу.
Если симптомы сохраняются, можно использовать 2. Не принимайте более 6 капсул в течение 24 часов, если это не предписано врачом. До 12 лет: обратитесь к врачу.
Advil Liqui-Gels
Advil Liqui-Gels Minis
Кол-во 200
Форма Капсулы
Основные характеристики Маленькие и удобные для проглатывания
Ингредиент Жидкость Ибупрофен
Легко проглатывается ✓
Быстродействующий ✓
Продолжительность действия До 6 часов
Дозировка 1 капсула каждые 4-6 часов. Если симптомы сохраняются, можно использовать 2. Не принимайте более 6 капсул в течение 24 часов, если это не предписано врачом. До 12 лет: обратитесь к врачу.
Advil Liqui-Gels Mini
Advil Easy Open Arthritis Cap
Кол-во 200
Форма Таблетки
Основная характеристика Легко открываемая крышка
Ингредиент Ибупрофен
Быстродействующий ✓
Продолжительность действия До 6 часов
Дозировка 1 таблетка каждые 4-6 часов. Если симптомы сохраняются, можно использовать 2. Не принимайте более 6 таблеток в течение 24 часов, если это не предписано врачом. До 12 лет: обратитесь к врачу.
Если симптомы сохраняются, можно использовать 2. Не принимайте более 6 таблеток в течение 24 часов, если это не предписано врачом. До 12 лет: обратитесь к врачу.
Advil Easy Open Open Arthritis Cap
Advil Dual Action
Счет 144
Форма Caplets
Ключевая функция давно протянутая
Ингредиент ибупрофен / ацетаминофен
Быстрое действие ✓
Duration До 8 0003
0002 Дозировка 2 капсулы каждые 8 часов. Не принимайте более 6 капсул в течение 24 часов, если это не предписано врачом. До 12 лет: обратитесь к врачу.
Advil Dual Action
Advil PM Liqui-Gels
Счет 80
Форма Капсулы
Ключевая особенность быстрорастущей
Ингредиент сулобилизованный ибупрофен / дифенгидрамин
Easy TOLUSTIV до 6 часов
Дозировка Принимать по 2 капсулы перед сном. Не принимайте более 2 капсул в течение 24 часов.
Advil PM Liqui-Gels
Advil Liqui-Gels
Счет 160
Форма капсулы
Ключевая функция быстро эффективного действия
Ингредиент жидкость IBUPROFEN
Легко в глотании ✓
Фат-факт ✓
9000 2 Доделия до до конца. 6ч
6ч
Дозировка 1 капсула каждые 4-6 часов. Если симптомы сохраняются, можно использовать 2. Не принимайте более 6 капсул в течение 24 часов, если это не предписано врачом. До 12 лет: обратитесь к врачу.
Advil Liqui-Gels
Таблетки Advil
СЧЕТ 300
ФОРМА ТАБЛИЦЫ
КЛЮЧЕВАЯ Особенность Легко для проглощения
Ингредиент IBUPROFEN
Легко проглотить ✓
Быстрое действие ✓
Продолжительность до 6 часов
DOSage 1 Таблетка. Каждый 4 — 6 часов. Если симптомы сохраняются, можно использовать 2. Не принимайте более 6 таблеток в течение 24 часов, если это не предписано врачом. До 12 лет: обратитесь к врачу.
АДВИЛ ТАБЛЕТКА
Пожалуйста, убедитесь, что Javascript включен для обеспечения доступности веб-сайтаРазличия, сходства и что лучше
Основные отличия | Лечение | Эффективность | Стоимость и сравнение | Побочные эффекты | Лекарственные взаимодействия | Предупреждения | Для детей | Часто задаваемые вопросы
Ацетаминофен и ибупрофен — это лекарства, отпускаемые без рецепта (OTC), которые снимают боль и лихорадку. Хотя ацетаминофен и ибупрофен лечат схожие симптомы травм и болезней, это разные препараты. Ибупрофен входит в группу препаратов, называемых нестероидными противовоспалительными препаратами (НПВП), тогда как ацетаминофен классифицируется как неопиоидный анальгетик и жаропонижающий. Хотя он может лечить боль и лихорадку так же, как ибупрофен и другие НПВП, ацетаминофен не является НПВП.
Хотя ацетаминофен и ибупрофен лечат схожие симптомы травм и болезней, это разные препараты. Ибупрофен входит в группу препаратов, называемых нестероидными противовоспалительными препаратами (НПВП), тогда как ацетаминофен классифицируется как неопиоидный анальгетик и жаропонижающий. Хотя он может лечить боль и лихорадку так же, как ибупрофен и другие НПВП, ацетаминофен не является НПВП.
В качестве безрецептурных болеутоляющих средств ацетаминофен и НПВП могут снимать головную боль и другие незначительные боли. Ацетаминофен и ибупрофен, как правило, являются препаратами короткого действия, которые необходимо принимать несколько раз в течение дня. Хотя оба препарата являются широко используемыми лекарствами, они имеют некоторые различия в побочных эффектах и способах их использования. Ацетаминофен и ибупрофен также содержат разные активные ингредиенты и действуют по-разному.
Каковы основные различия между ацетаминофеном и ибупрофеном?
Ацетаминофен, известный под торговой маркой Тайленол, является обезболивающим (обезболивающим) и жаропонижающим (лихорадочным) средством. Точный механизм действия ацетаминофена неизвестен, но считается, что он воздействует на определенные рецепторы в головном мозге, связанные с ощущением боли. Он также воздействует на терморегулирующую область мозга, снижая лихорадку. В отличие от НПВП, ацетаминофен не обладает противовоспалительным действием и может не так хорошо работать при воспалительных состояниях, таких как ревматоидный артрит.
Точный механизм действия ацетаминофена неизвестен, но считается, что он воздействует на определенные рецепторы в головном мозге, связанные с ощущением боли. Он также воздействует на терморегулирующую область мозга, снижая лихорадку. В отличие от НПВП, ацетаминофен не обладает противовоспалительным действием и может не так хорошо работать при воспалительных состояниях, таких как ревматоидный артрит.
Ибупрофен — это НПВП, который можно использовать при боли, воспалении и лихорадке. Общие торговые марки ибупрофена включают Motrin и Advil. Ибупрофен является неселективным ингибитором фермента ЦОГ, который блокирует выработку простагландинов, химических веществ, вызывающих воспаление. Из-за его воздействия на ферменты ЦОГ применение ибупрофена сопряжено с риском побочных эффектов со стороны желудочно-кишечного тракта (ЖКТ) и сердечно-сосудистой системы.
Ацетаминофен или ибупрофен действуют дольше?
Одной дозы обычного ацетаминофена или ибупрофена хватает примерно на четыре-шесть часов. Обычная доза ацетаминофена составляет от 325 до 650 мг каждые четыре-шесть часов, тогда как обычная доза ибупрофена составляет от 200 до 400 мг каждые четыре-шесть часов. Продолжительность эффектов ацетаминофена и ибупрофена может варьироваться в зависимости от лекарственной формы. Таблетки Tylenol и Advil с пролонгированным высвобождением могут обеспечить более продолжительное облегчение, чем обычные таблетки.
Обычная доза ацетаминофена составляет от 325 до 650 мг каждые четыре-шесть часов, тогда как обычная доза ибупрофена составляет от 200 до 400 мг каждые четыре-шесть часов. Продолжительность эффектов ацетаминофена и ибупрофена может варьироваться в зависимости от лекарственной формы. Таблетки Tylenol и Advil с пролонгированным высвобождением могут обеспечить более продолжительное облегчение, чем обычные таблетки.
Важно следовать инструкциям по дозировке на этикетке препарата. Прием слишком большого количества ацетаминофена может вызвать серьезные побочные эффекты, в том числе заболевания печени. В редких случаях прием слишком большого количества ибупрофена также может вызвать заболевание печени. Ибупрофен, как и другие НПВП, может вызывать повреждение почек при интенсивном или длительном применении.
Максимальная доза ацетаминофена и ибупрофена может варьироваться, поэтому всегда рекомендуется проконсультироваться с врачом. Для большинства взрослых максимальная доза ацетаминофена составляет 3250 мг в день, а максимальная доза ибупрофена — 1200 мг в день.
СВЯЗАННЫЕ: Что такое ацетаминофен? | Что такое ибупрофен?
Состояния, которые лечатся ацетаминофеном по сравнению с ибупрофеном
Ацетаминофен и ибупрофен являются эффективными болеутоляющими средствами, используемыми для лечения легкой и умеренной боли и лихорадки. Примеры боли от легкой до умеренной включают головную боль, боль в спине, зубную боль, мышечную боль, растяжение связок и менструальные спазмы.
Ацетаминофен одобрен FDA для лечения легкой боли и лихорадки. Тем не менее, он также широко используется для лечения болей при артрите, мигрени и дисменореи (болезненных менструациях). Ацетаминофен не обладает противовоспалительным действием и может быть не так эффективен, как НПВП при этих состояниях.
Ибупрофен можно использовать для лечения общей острой боли и лихорадки. Он также предназначен для лечения боли и воспаления при артрите, мигрени и дисменорее (болезненных менструациях).
Исследования также показали, что ацетаминофен и ибупрофен можно использовать для лечения открытого артериального протока у недоношенных детей. Артериальный проток — это крупный кровеносный сосуд в сердце младенца, который обычно закрывается после рождения. Однако у некоторых малышей этот кровеносный сосуд остается открытым, что может вызвать сердечные осложнения.
Артериальный проток — это крупный кровеносный сосуд в сердце младенца, который обычно закрывается после рождения. Однако у некоторых малышей этот кровеносный сосуд остается открытым, что может вызвать сердечные осложнения.
Что более эффективно: ацетаминофен или ибупрофен?
Ацетаминофен и ибупрофен могут иметь разную эффективность при лечении лихорадки и разных видов боли. Из-за его противовоспалительного действия ибупрофен может быть более эффективным, чем ацетаминофен, для лечения воспалительных болей. Однако ацетаминофен имеет меньший риск серьезных побочных эффектов, чем ибупрофен.
В одном мета-анализе было обнаружено, что ибупрофен аналогичен ацетаминофену или превосходит его в лечении боли и лихорадки у взрослых и детей. Оба препарата оказались одинаково безопасными. Одно исследование в ходе анализа показало, что ацетаминофен безопаснее и имеет меньше побочных эффектов, чем ибупрофен. Этот анализ включал 85 различных исследований взрослых и детей.
Было показано, что ибупрофен более эффективен при острой и хронической боли, чем ацетаминофен. В одном исследовании было обнаружено, что ибупрофен более эффективен, чем парацетамол (другое название ацетаминофена) для лечения различных болевых состояний, таких как мигрень и остеоартрит. Другое исследование пришло к аналогичным результатам и показало, что ибупрофен обеспечивает лучшее обезболивание и переносимость при остеоартрите, чем ацетаминофен.
В одном исследовании было обнаружено, что ибупрофен более эффективен, чем парацетамол (другое название ацетаминофена) для лечения различных болевых состояний, таких как мигрень и остеоартрит. Другое исследование пришло к аналогичным результатам и показало, что ибупрофен обеспечивает лучшее обезболивание и переносимость при остеоартрите, чем ацетаминофен.
В зависимости от состояния, подлежащего лечению, один вариант лечения может быть предпочтительнее другого. Степень облегчения боли от препарата также будет различаться в зависимости от реакции человека на лекарство и общей переносимости боли. Лучше обратиться за медицинской помощью к специалисту в области здравоохранения, если вы или ваш ребенок испытываете боль или лихорадку.
Сравнение охвата и стоимости ацетаминофена и ибупрофена
Ацетаминофен можно приобрести без рецепта, он доступен в форме дженерика и торговой марки. Medicare и большинство страховых планов могут не покрывать ацетаминофен, поскольку он широко доступен как недорогой непатентованный препарат. Средняя цена наличными для универсального ацетаминофена может достигать 11,99 долларов США. Используя дисконтную карту SingleCare, вы можете сэкономить больше и снизить стоимость примерно до 2 долларов за бутылку непатентованного ацетаминофена.
Средняя цена наличными для универсального ацетаминофена может достигать 11,99 долларов США. Используя дисконтную карту SingleCare, вы можете сэкономить больше и снизить стоимость примерно до 2 долларов за бутылку непатентованного ацетаминофена.
Как правило, Medicare и большинство страховых планов покрывают расходы на ибупрофен, если он прописан врачом. Ибупрофен доступен как общий или фирменный препарат. Обычная цена ибупрофена наличными составляет около 15 долларов США, и ее можно снизить, используя дисконтную карту SingleCare. В зависимости от аптеки, которую вы используете, стоимость может быть снижена примерно до 4 долларов за бутылку с таблетками ибупрофена по 200 мг.
Общие побочные эффекты ацетаминофена и ибупрофена
Побочные эффекты ацетаминофена могут включать тошноту, рвоту, запор, зуд и дискомфорт в желудке. Другие возможные побочные эффекты включают кожную сыпь и повреждение печени.
Ибупрофен также может вызывать побочные эффекты со стороны желудочно-кишечного тракта, включая запор, диарею, газы, вздутие живота, тошноту, изжогу и расстройство желудка. Кроме того, ибупрофен может вызвать кожную сыпь и проблемы с почками.
Кроме того, ибупрофен может вызвать кожную сыпь и проблемы с почками.
Возможны аллергические реакции на ацетаминофен и ибупрофен. Признаки и симптомы аллергических реакций включают сыпь, одышку и стеснение в груди. Обратитесь за медицинской помощью, если вы испытываете эти побочные эффекты.
Возможно, это неполный список. Проконсультируйтесь с врачом или фармацевтом о возможных побочных эффектах.
Источник: Micromedex (ацетаминофен), DailyMed (ибупрофен)
Лекарственные взаимодействия ацетаминофена и ибупрофена
И ацетаминофен, и ибупрофен могут взаимодействовать с варфарином (кумадином), распространенным разжижителем крови. Прием ацетаминофена или ибупрофена с варфарином может увеличить риск кровотечения. Употребление алкоголя с ацетаминофеном или ибупрофеном также может разжижать кровь и повышать риск кровотечения.
Ацетаминофен может взаимодействовать с изониазидом, антибиотиком, используемым для лечения туберкулеза. Прием изониазида может повлиять на то, как печень перерабатывает ацетаминофен, и может вызвать повреждение печени. Фенитоин и карбамазепин являются противосудорожными препаратами, которые также могут увеличить риск повреждения печени при приеме с ацетаминофеном.
Прием изониазида может повлиять на то, как печень перерабатывает ацетаминофен, и может вызвать повреждение печени. Фенитоин и карбамазепин являются противосудорожными препаратами, которые также могут увеличить риск повреждения печени при приеме с ацетаминофеном.
Ибупрофен может взаимодействовать с большим количеством препаратов, чем ацетаминофен. Ибупрофен, как и другие НПВП, может повышать артериальное давление, что может мешать действию лекарств от артериального давления. Некоторые антидепрессанты, такие как селективные ингибиторы обратного захвата серотонина (СИОЗС), могут увеличить риск кровотечения при приеме с ибупрофеном.
Возможны другие лекарственные взаимодействия. Поговорите с поставщиком медицинских услуг для получения дополнительной информации о возможных лекарственных взаимодействиях с ацетаминофеном или ибупрофеном.
Возможно, это не полный список всех возможных лекарственных взаимодействий. Проконсультируйтесь с врачом обо всех лекарствах, которые вы принимаете.
Предупреждения относительно ацетаминофена и ибупрофена
Обычно ацетаминофен хорошо переносится. Однако прием ацетаминофена в дозе, превышающей рекомендуемую, может увеличить риск серьезных побочных эффектов, таких как повреждение печени. Известно, что в высоких дозах ацетаминофен гепатотоксичен или повреждает печень. Ибупрофен с меньшей вероятностью, чем ацетаминофен, вызывает повреждение печени.
С другой стороны, ибупрофен чаще вызывает желудочно-кишечные и сердечно-сосудистые побочные эффекты, чем ацетаминофен. Как и все НПВП, ибупрофен может увеличить риск развития язвы кишечника и желудка, особенно у людей с язвенной болезнью в анамнезе. Некоторые препараты, снижающие кислотность, могут помочь снизить риск язвы желудка при приеме НПВП.
Прием ибупрофена также может увеличить риск сердечного приступа и инсульта, особенно у людей с проблемами сердца или высоким кровяным давлением в анамнезе. Следует избегать применения ибупрофена для лечения боли до, во время или после операции аортокоронарного шунтирования (АКШ).
Ацетаминофен может считаться более безопасным, чем ибупрофен, при беременности. Однако эти препараты следует принимать во время беременности только в том случае, если польза превышает риск. Прием ацетаминофена или ибупрофена может вызвать преждевременное закрытие артериального протока у детей.
Ацетаминофен и ибупрофен для детей
Многие исследования показывают, что ацетаминофен и ибупрофен одинаково снижают температуру у детей, хотя некоторые исследования предполагают, что ибупрофен может быть более эффективным, чем ацетаминофен. В дополнение к лихорадке ацетаминофен или ибупрофен можно использовать при незначительной боли и дискомфорте у детей. Лучший вариант будет зависеть от общего состояния вашего ребенка.
Ацетаминофен и ибупрофен выпускаются в жидкой форме, что облегчает их введение маленьким детям. Дозировка ацетаминофена и ибупрофена у детей может варьироваться в зависимости от их возраста или веса. Рекомендуется проконсультироваться с врачом, чтобы определить наиболее подходящую дозировку для вашего ребенка.
В некоторых случаях ацетаминофен и ибупрофен можно комбинировать или чередовать при стойкой лихорадке. Сочетание ацетаминофена и ибупрофена может принести больше облегчения, чем одно лекарство. Использование альтернативного подхода может позволить ребенку получать облегчение чаще. Например, вы можете лечить их симптомы каждые три часа, а не каждые шесть часов, чередуя ацетаминофен и ибупрофен. Прежде чем комбинировать или чередовать эти препараты, поговорите с врачом.
Распространенные торговые марки ацетаминофена
- Тайленол, Парацетамол, Ацета, Панадол (ацетаминофен)
- Экседрин (парацетамол/аспирин/кофеин)
- Левацет (ацетаминофен/аспирин/кофеин/салициламид)
- Staflex (ацетаминофен/бромфенирамин)
- Bupap, Tencon, Bucet (ацетаминофен/буталбитал)
- Fioricet, Esgic, Isocet, триада (ацетаминофен/буталбитал/кофеин)
- Panlor, Trezix (системный ацетаминофен/кофеин/дигидрокодеин)
Распространенные торговые марки ибупрофена
- Advil, Motrin (ибупрофен)
- Advil Dual Action (ибупрофен/ацетаминофен)
- Advil Allergy Sinus (ибупрофен/хлорфенирамин/псевдоэфедрин)
- Advil PM, Motrin PM (ибупрофен/дифенгидрамин)
- Дуексис (ибупрофен/фамотидин)
Часто задаваемые вопросы об ацетаминофене и ибупрофене
Что такое ацетаминофен?
Ацетаминофен является безрецептурным анальгетиком и жаропонижающим средством. Он используется для лечения легкой и умеренной боли и лихорадки у взрослых и детей. Ацетаминофен выпускается в формах обычной и повышенной концентрации.
Он используется для лечения легкой и умеренной боли и лихорадки у взрослых и детей. Ацетаминофен выпускается в формах обычной и повышенной концентрации.
Что такое ибупрофен?
Ибупрофен — это нестероидный противовоспалительный препарат (НПВП), который может лечить боль и лихорадку. Он бывает безрецептурным и отпускаемым по рецепту. Более сильные дозы ибупрофена часто используются для лечения хронических болей, таких как остеоартрит.
Являются ли ацетаминофен и ибупрофен одинаковыми?
Нет. Ацетаминофен известен под торговой маркой Tylenol и одобрен для лечения боли и лихорадки. Ибупрофен известен под торговой маркой Advil или Motrin и одобрен для лечения боли, лихорадки и воспаления. Ибупрофен также выпускается безрецептурно и по рецепту.
Что лучше: ацетаминофен или ибупрофен?
Ибупрофен более эффективен, чем ацетаминофен, для лечения воспалительных болей. Ибупрофен одобрен FDA для лечения остеоартрита и ревматоидного артрита, тогда как ацетаминофен может использоваться не по прямому назначению для этих состояний. Однако ацетаминофен может вызывать менее серьезные побочные эффекты, чем ибупрофен.
Однако ацетаминофен может вызывать менее серьезные побочные эффекты, чем ибупрофен.
Могу ли я использовать ацетаминофен или ибупрофен во время беременности?
Ацетаминофен считается более безопасным для беременных, чем ибупрофен. Беременным женщинам следует избегать применения ибупрофена из-за риска побочных эффектов. FDA не рекомендует использовать НПВП при беременности в сроке 20 недель или позже. Проконсультируйтесь с врачом, если вы беременны или кормите грудью, прежде чем принимать обезболивающее.
Могу ли я использовать ацетаминофен или ибупрофен с алкоголем?
Нет. Употребление алкоголя с ацетаминофеном или ибупрофеном может увеличить риск побочных эффектов. Алкоголь может повредить слизистую оболочку желудка и кишечника, увеличивая риск язвы желудка. Употребление алкоголя может увеличить риск язвы желудка от ацетаминофена или ибупрофена. Кроме того, чрезмерное хроническое употребление алкоголя может увеличить риск повреждения печени. Следует избегать сочетания алкоголя с ацетаминофеном или ибупрофеном.
