МОРФОЛОГИЧЕСКАЯ ТРАНСФОРМАЦИЯ КИШЕЧНОГО ТРАНСПЛАНТАТА ПОСЛЕ ЦИСТЭКТОМИИ С ОРТОТОПИЧЕСКОЙ ПЛАСТИКОЙ МОЧЕВОГО ПУЗЫРЯ | Ситдыкова
Аннотация
Введение. Неизученным является гистоморфологическое состояние и механизмы трансформации кишечного эпителия ортотопического мочевого пузыря.
Цель исследования. Изучение морфологических адаптативно-компенсаторные изменений в стенке кишечного трансплантата (КТ) и их связь с гомеостазом на различных этапах после оперативного лечения.
Материал и методы. Исследовано морфологическое состояние стенки кишечного трансплантата (КТ) у 42 больных, подвергшихся цистэктомии с формированием ортотопического кишечного мочевого пузыря (15-подвздошная кишка, 27 – сигмовидная) на сроках от 1,0 до 6,5 мес. и 1 года и более после оперативного лечения.
Результаты. Морфологические изменения, происходящие в стенке КТ начинаются с момента попадания в его просвет мочи, что происходит в сочетании с изменением стереотипной динамики органа. Выраженные изменения наблюдаются во всех отделах стенки тонкой и толстой кишки. Происходит регенерация и перестройка эпителия, выражающаяся в атрофии и уменьшении числа всасывающих цилиндрических клеток и увеличении количества слизеобразующих бокаловидных элементов, завершающаяся к 12 мес. и более после операции. Это в сочетании с уменьшением числа и размеров ворсин и крипт, редукцией лимфатического русла и склерозом кровеносных сосудов и стромы блокирует всасывание. Увеличение количества слизеобразующих бокаловидных клеток, обеспечивает создание барьера, защищающего слизистую КТ от воздействия мочи.
Выраженные изменения наблюдаются во всех отделах стенки тонкой и толстой кишки. Происходит регенерация и перестройка эпителия, выражающаяся в атрофии и уменьшении числа всасывающих цилиндрических клеток и увеличении количества слизеобразующих бокаловидных элементов, завершающаяся к 12 мес. и более после операции. Это в сочетании с уменьшением числа и размеров ворсин и крипт, редукцией лимфатического русла и склерозом кровеносных сосудов и стромы блокирует всасывание. Увеличение количества слизеобразующих бокаловидных клеток, обеспечивает создание барьера, защищающего слизистую КТ от воздействия мочи.
Заключение. Морфологические изменения, происходящие в стенке КТ под воздействием мочи, способствуют сохранению гомеостаза и являются идентичными при толсто- и тонкокишечном варианте пластики мочевого пузыря.
Раскрытие информации: Исследование не имело спонсорской поддержки. Авторы заявляют об отсутствии конфликта интересов.
Введение
Радикальная цистэктомия с лимфодис- секцией и различными видами кишечной деривации мочи является золотым стандартом лечения пациентов с мышечно-инвазивным раком мочевого пузыря [1]. Несмотря на достаточно большое количество клинических наблюдений больных после цистэктомии с формированием изолированного кишечного трансплантата, остается недостаточно неизученным гистоморфологическое состояние и механизмы трансформации кишечного эпителия ортотопического мочевого пузыря [2-5].
Несмотря на достаточно большое количество клинических наблюдений больных после цистэктомии с формированием изолированного кишечного трансплантата, остается недостаточно неизученным гистоморфологическое состояние и механизмы трансформации кишечного эпителия ортотопического мочевого пузыря [2-5].
Цель исследования — изучение морфологических адаптативно-компенсаторные изменений в стенке кишечного трансплантата (КТ) и их связь с гомеостазом на различных этапах после оперативного лечения.
Материалы и методы
Исследовано морфологическое состояние стенки КТ у 42 больных, подвергшихся операции цистэктомии с формированием ортотопического кишечного мочевого пузыря (15-подвздошная кишка, 27 — сигмовидная) на сроках от 1 до 6,5 мес. и 1 года и более после операции. У всех пациентов использована оригинальная методика «создания «У»-образного, анти- или изоперистальтического артифициального кишечного мочевого пузыря из изолированного отрезка тонкого или толстого кишечника по методике Э. Н. Ситдыкова. Гистологический материал забирался путем эндоскопической «холодной» щипковой биопсии и исследовался с помощью окраски гематоксилином, эозином по Ван-Гизону и муцикармином.
Н. Ситдыкова. Гистологический материал забирался путем эндоскопической «холодной» щипковой биопсии и исследовался с помощью окраски гематоксилином, эозином по Ван-Гизону и муцикармином.
Результаты
Изменения, происходящие в стенке КТ начинаются с момента попадания в его просвет необычного для кишки содержимого, т.е. мочи, что происходит в сочетании с изменением стереотипной динамики органа. Выраженные изменения наблюдаются во всех отделах стенки тонкой кишки. Эпителий практически отсутствует во всех полях зрения, а единичные клетки эпителиального покрова обнаруживаются лишь в глубине крипт (рис. 1).
Рисунок 1. Тонкокишечный трансплантат (3 месяца после операции). Некроз поверхностных отделов ворсин, десквамация эпителия, небольшие группы эпителиальных клеток в глубине крипт.
Figure 1. Small intestine graft (3 months after surgery). Necrosis of villi’s surface areas, desquamation of epithelium, small groups of epithelial cells in the depth of crypts.
В оставшихся клетках местами наблюдается пикноз ядер с их гиперхромией, набухание или уменьшение размеров цитоплазмы, в которой отмечаются явления вакуольной дистрофии. Значительная часть оставшихся клеток теряет связь с базальной мембраной, десквамируются и находятся вблизи неё. Количество кишечных ворсин неравномерно уменьшается, высота ворсин снижается, что сопровождается расширением основания. Они представляют собой небольшие холмообразные возвышения, причём крипты не определяются за счёт выравнивания собственной пластинки кишки. Подслизистый слой и строма ворсин несколько отёчны, что сопровождается спадением лимфатических сосудов. Кровеносные сосуды, напротив, полнокровны с выраженным периваскулярным отёком. По мере приближения к просвету кишки наблюдаются тромбозы сосудов, выраженные в зонах фибриноидных некрозов поверхностных отделов слизистой, местами достигая тотального поражения (рис. 2).
Рисунок 2. Тонкокишечный трансплантат (3 месяца после операции). Тромбоз кровеносного русла поверхностных отделов слизистой кишки.
Тромбоз кровеносного русла поверхностных отделов слизистой кишки.
Figure 2. Small intestinal graft (3 months after surgery). Thrombosis of the bloodstream in the superficial parts of the intestinal mucosa.
Строма ворсинок диффузно инфильтрирована с преобладанием плазмоцитов, лимфоцитов и макрофагов, с незначительным количеством эозинофилов и сегментоядерных лейкоцитов. Небольшая часть клеточного инфильтрата, диффузно располагается и в подслизистом слое, но число клеток вблизи базальной мембраны низкая, в мышечном слое встречаются лишь единичные лимфоидные элементы. С другой стороны, в подслизистом слое оказываются наиболее выраженные локальные лимфоидные скопления, местами формирующие очаги типа фолликулов без центров размножения.
Изменения, происходящие в стенке толстой кишки в период от 1 до 6,5 месяцев, имеют аналогичные по характеру и выраженности проявления, описанные в КТ, сформированном из тонкой кишки. Наблюдается выраженная десквамация эпителия слизистой оболочки в основном в апикальных отделах кишечных ворсин, сопровождающаяся некрозом стромы. У основания кишечных ворсин и криптах сохраняются небольшие пласты эпителия, а часть клеток здесь находится в состоянии некробиоза или некроза. Сами клетки меняют свои типичные продолговатые очертания и оказываются деформированными или округлыми. Эпителиальные клетки располагаются в виде монослоя цилиндрических клеточных элементов, среди которых нередки дистрофия и некрозы с полным разрушением слизистой (рис. 3).
У основания кишечных ворсин и криптах сохраняются небольшие пласты эпителия, а часть клеток здесь находится в состоянии некробиоза или некроза. Сами клетки меняют свои типичные продолговатые очертания и оказываются деформированными или округлыми. Эпителиальные клетки располагаются в виде монослоя цилиндрических клеточных элементов, среди которых нередки дистрофия и некрозы с полным разрушением слизистой (рис. 3).
Рисунок 3. Толстокишечный трансплантат (6 месяцев после операции). Десквамация эпителия поверхностных отделов слизистой уплощенной поверхности кишки.
Figure 3. Colon graft (6 months after surgery). Epithelium desquamation in the superficial parts of the gut’s mucosa flattened surface.
Высота ворсин снижается, а верхние отделы их уплощаются. В некоторых участках ворсины принимают горизонтальное положение, тесно прилегая одна к другой, образуя ровную внутреннюю поверхность. На отдельных участках наблюдаются фибриноидные некрозы, которые распространяются на большую глубину и захватывают расположенные поверхностно кровеносные сосуды, часть из которых тромбирована. Большое количество кровеносных сосудов в подслизистом слое гиперемировано, в то время как лимфатические капилляры, как правило, находятся в спавшемся состоянии. В участках разрушения поверхностных отделов слизистой в зонах некрозов наблюдается интенсивная лимфоидная инфильтрация. В других участках клеточная инфильтрация носит преимущественно диффузный характер и представлена лимфоцитами и макрофагами. В строме ворсин и подслизистом слое наблюдается выраженный отёк, менее заметный в мышечном слое.
Большое количество кровеносных сосудов в подслизистом слое гиперемировано, в то время как лимфатические капилляры, как правило, находятся в спавшемся состоянии. В участках разрушения поверхностных отделов слизистой в зонах некрозов наблюдается интенсивная лимфоидная инфильтрация. В других участках клеточная инфильтрация носит преимущественно диффузный характер и представлена лимфоцитами и макрофагами. В строме ворсин и подслизистом слое наблюдается выраженный отёк, менее заметный в мышечном слое.
На сроках более 12 месяцев после операции наблюдается постепенное восстановление слизистой тонкокишечного КТ. Целостная эпителиальная выстилка покрывает практически всю внутреннюю поверхность резервуара, и лишь апикальные отделы единичных ворсин оказываются лишенными эпителиального покрова в виде площадок. Слизистая представлена преимущественно бокаловидными клетками. Эти клетки имеют гиперхромные ядра, расположенные в базальном отделе и цитоплазму, расширенную в виде большой капли в апикальном отделе.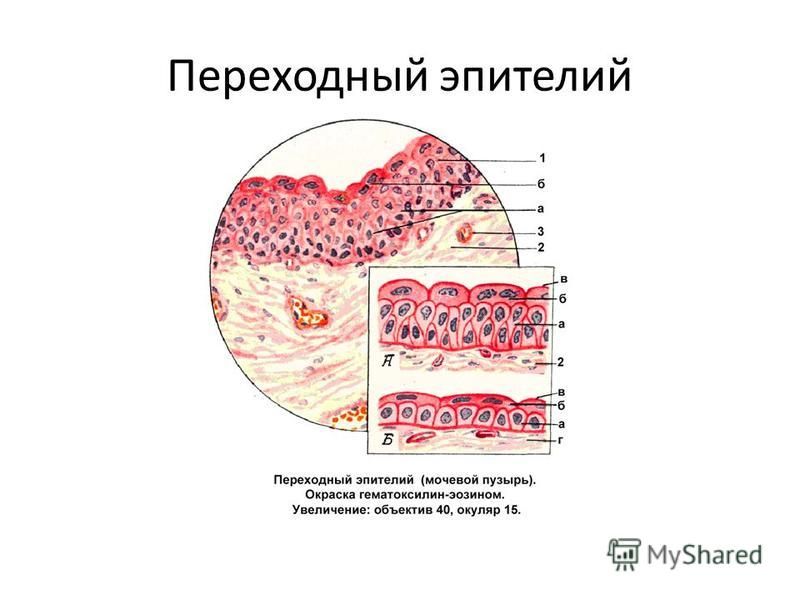 Между слизистыми клетками располагаются цилиндрические всасывающие клетки, имеющие признаки атрофии. В апикальной части отдельных ворсин число таких атрофичных клеток значительно возрастает, и они образуют своеобразное клеточное покрытие в виде плотного слоя («частокол») веретеновидных клеточных элементов (рис. 4).
Между слизистыми клетками располагаются цилиндрические всасывающие клетки, имеющие признаки атрофии. В апикальной части отдельных ворсин число таких атрофичных клеток значительно возрастает, и они образуют своеобразное клеточное покрытие в виде плотного слоя («частокол») веретеновидных клеточных элементов (рис. 4).
Рисунок 4. Тонкокишечный трансплантат (12 месяцев после операции). Слой («частокол») веретеновидных цилиндрических клеток на утолщенной верхушке ворсины.
Figure 4. Small intestine graft (12 months after surgery). Layer («palisade») of fusiform cylindrical cells on a thickened apex of the villus.
В тоже время уплощенные апикальные отделы части ворсин оказываются лишенными эпителиального покрова. В этих участках нередко наблюдаются фибриноидные некрозы и тромбозы сосудов поверхностной зоны. Размеры ворсин, особенно их высота, заметно снижаются, что сопровождается уменьшением их поперечного размера. Соответственно снижается и число ворсин на единицу площади КТ.
Соответственно снижается и число ворсин на единицу площади КТ.
Слизистая толстокишечного ортотопического мочевого пузыря через 12 месяцев восстанавливалась в большей части, лишь ламинарные отделы ворсин иногда оказывались лишенными эпителиальной выстилки. Клетки, выстилающие как поверхностные отделы, так и большую часть в глубине крипт, по своему морфологическому строению идентичны слизистым (бокаловидным) (рис. 5).
Рисунок 5. Толстокишечный трансплантат (12 месяцев после операции). Слизистые клетки, образующие выстилку кишечного резервуара.
Figure 5. Colon graft (12 months after surgery). Mucous cells that form the lining of the intestinal reservoir.
В строме ворсин и подслизистом слое с небольшим количеством рыхловолокнистой соединительной ткани диффузно располагаются единичные лимфоциты, макрофаги и лимфоидные фолликулы. Лимфатические сосуды не определяются, а количество кровеносных снижено и часть из них склерозирована и тромбирована в поверхностных отделах стенки КТ.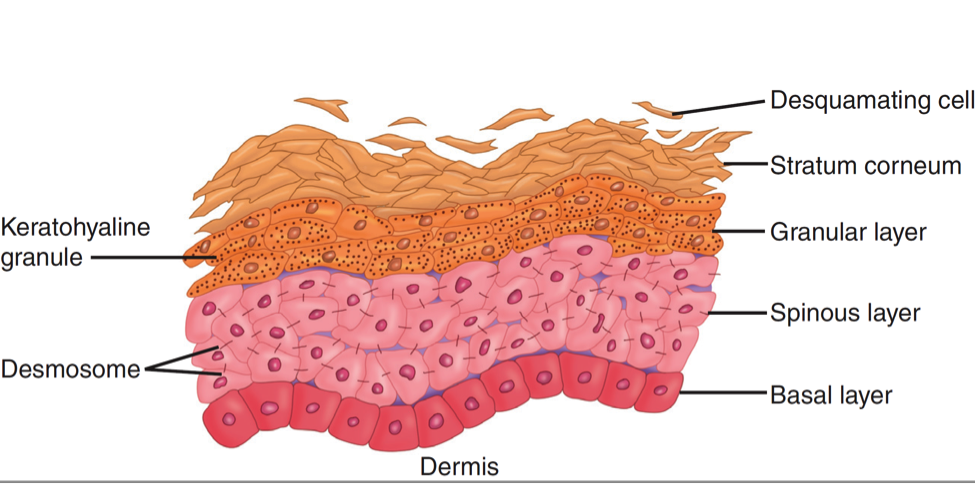 Мышечный слой не претерпевает значительных морфологических изменений, кроме небольшой атрофии мышечных элементов. В отдельных участках поверх уплощенных ворсин и кишечных ямок нарастает монослой из кишечного эпителия с большим количеством цилиндрических клеток (рис. 6).
Мышечный слой не претерпевает значительных морфологических изменений, кроме небольшой атрофии мышечных элементов. В отдельных участках поверх уплощенных ворсин и кишечных ямок нарастает монослой из кишечного эпителия с большим количеством цилиндрических клеток (рис. 6).
Рисунок 6. Толстокишечный трансплантат (12 месяцев после операции). Монослой цилиндрических клеток нарастающий на поверхность слизистой.
Figure 6. Colon graft (12 months after surgery). Monolayer of cylindrical cells are accrescenting on the mucosa surface.
Обнаруженные изменения идентичны острому альтеративно-десквамативному энтериту и колиту, что предполагает нарушение всасывания преимущественно за счет потери эпителиального покрова кишки. С другой стороны, резкое венозное полнокровие способствует не только нарушению всасывания, но и, напротив, может приводить к выделению определенного количества жидкости из стенки поврежденной кишки. Следовательно, уже на ранних этапах повреждение слизистой КТ сопровождается блокированием всасывания, что делает физиологичным выполнение им своих функций при определенных вторичных изменениях стенок.
Через год происходит регенерация и перестройка эпителия, выражающаяся в атрофии и уменьшении числа всасывающих цилиндрических клеток и увеличении количества слизеобразующих бокаловидных элементов. Это в сочетании с уменьшением числа и размеров ворсин и крипт, редукцией лимфатического русла и склерозом кровеносных сосудов и стромы блокирует всасывание. Увеличение количества слизеобразующих бокаловидных клеток, обеспечивает создание барьера, защищающего слизистую КТ от воздействия мочи.
Заключение
Морфологические изменения, происходящие в стенке КТ под воздействием мочи, способствуют сохранению гомеостаза и являются идентичными при толсто- и тонкокишечном варианте пластики мочевого пузыря.
1. Рак мочевого пузыря (классика и новации). Под ред. Когана М.И. М.:Медфорум; 2017.
2. Цветов Е.П. Морфологические изменения трансплантата при кишечной пластике мочевого пузыря. Новый хирург. Архив. 1961;1:48-54.
3. Шахов Е.В. Гистологическая характеристика тонкокишечного трансплантата используемого для пластики мочевого пузыря в эксперименте. Материалы 2-го Всесоюз.симпозиума. Горький; 1973.
Материалы 2-го Всесоюз.симпозиума. Горький; 1973.
4. Комяков Б.К., Аничков Н.М., Бодарева Н.В. Морфологическая адаптация артифициального мочевого пузыря. Материалы Пленума РОУ. Краснодар, 2010.
5. Перепечай В.А. Оптимизация хирургического лечения мышечно-инвазивного и местнораспространенного рака мочевого пузыря. Дисc. …докт.мед.наук. Ростов-на-Дону. 2016:420.
6. Yuan J, Lin H, Li P, Zhang R, Luo A, Berardinelli F, Dai Y, Wang R. Molecular mechanisms of vacuum therapy in penile rehabilitaTIon: a novel animal study. EurUrol. 2010;58:773-80. DOI:10.1016/j.eururo.2010.07.005
7. Lin H, Yang W, Zhang J, Dai Y, Wang R. Penile rehabilitaTIon with a vacuum erecTIle device in an animal model is related to an anTIhypoxic mechanism: blood gas evidence. Asian J Androl. 2013;15:387. DOI:10.1038/aja.2013.18
8. Yuan J, Hoang A, Romero C, Lin H, Dai Y, Wang R. Vacuum therapy in erecTIle dysfuncTIon-science and clinical evidence. Int J Impot Res. 2010;22:211-9. DOI:10.1038/ijir. 2010.4
2010.4
Что нужно знать о коже?
Функции кожи
Будучи самым крупным человеческим органом, кожа покрывает площадь, эквивалентную почти 2 квадратным метрам, и может весить до 10 кг. Она служит защитным барьером против внешней среды при сохранении внутреннего гомеостаза.
Общественное значение: внешний вид человека
Защита: защитный барьер против внешней среды, такой как химические или механические повреждения, ультрафиолетовое излучение, а также поддержание гомеостаза в организме
Ощущения: чувствительна к боли, прикосновениям, давлению и температуре
Терморегуляция: терморегуляция путем дилатации, сужения сосудов и потоотделения
Метаболизм: синтез витамина D (метаболизм кальция и фосфата) под влиянием солнечного света
Анатомия кожи
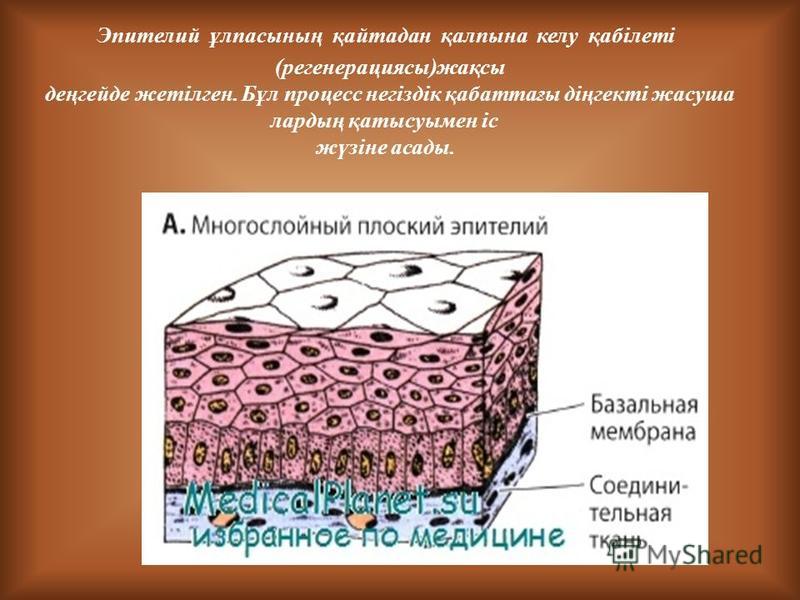
Кожа состоит из двух основных слоев: эпидермиса и дермы, которые находятся на жировом слое, называемым гиподерма (подкожной жировой клетчаткой).
Эпидермис
Эпидермис представляет собой многослойный роговой слой плоских эпителий, размер которого обычно составляет от 0,03 до 0,05 миллиметра. Он в основном состоит из кератиноцитов в прогрессирующих стадиях дифференциации от более глубоких до более поверхностных слоев. Когда кератиноциты делятся, они переходят от более глубоких слоев к более поверхностным слоям. Как только они достигают рогового слоя (самого внешнего слоя), они просачиваются в процессе эпидермального оборота, например: после принятия ванны или возникновения царапин. Этот процесс называется «десквамацией». Полный оборот эпидермиса («обновление кожи») занимает приблизительно 2 месяца.
Дерма
По сравнению с более тонким эпидермисом дерма представляет собой сложную сеть, содержащую клеточные и бесклеточные компоненты. Она содержит кровеносные сосуды, нервы, корни волос и потовые железы. Структурно дерма состоит из двух подслоев, поверхностной папиллярной дермы и более глубокой ретикулярной дермы. Сосудистые петли папиллярного дермы обеспечивают эпидермис питательными веществами и кислородом. Коллаген — главным образом, обнаруженный в ретикулярной дерме — является основным структурным белком в дерме, обеспечивающим его долговечность. Эластин, еще один важный структурный белок в дерме, он придает коже эластичность.
Она содержит кровеносные сосуды, нервы, корни волос и потовые железы. Структурно дерма состоит из двух подслоев, поверхностной папиллярной дермы и более глубокой ретикулярной дермы. Сосудистые петли папиллярного дермы обеспечивают эпидермис питательными веществами и кислородом. Коллаген — главным образом, обнаруженный в ретикулярной дерме — является основным структурным белком в дерме, обеспечивающим его долговечность. Эластин, еще один важный структурный белок в дерме, он придает коже эластичность.
Фибробласты являются основными клетками дермы и отвечают за синтез и деградацию дермальных белков (коллаген и эластин). Другими клетками, находящимися в дерме, являются макрофаги и лимфоциты. Эти клетки являются частью иммунной системы кожи.
Гиподерма (подкожная жировая клетчатка)
Гиподерма образует основу эпидермиса и дермы и состоит прежде всего из рыхлой соединительной ткани и жира. Он содержит большие кровеносные сосуды и нервы, чем те, которые содержатся в дерме. Гиподерма служит в основном как изолятор и обеспечивает хранение энергии.
Гиподерма служит в основном как изолятор и обеспечивает хранение энергии.
Ремоделирование эпителия дыхательных путей при астме
Сохранить цитату в файл
Формат: Резюме (текст)PubMedPMIDAbstract (текст)CSV
Добавить в коллекции
- Создать новую коллекцию
- Добавить в существующую коллекцию
Назовите свою коллекцию:
Имя должно содержать менее 100 символов
Выберите коллекцию:
Не удалось загрузить вашу коллекцию из-за ошибки
Повторите попытку
Добавить в мою библиографию
- Моя библиография
Не удалось загрузить делегатов из-за ошибки
Повторите попытку
Ваш сохраненный поиск
Название сохраненного поиска:
Условия поиска:
Тестовые условия поиска
Эл.
Который день? Первое воскресеньеПервый понедельникПервый вторникПервая средаПервый четвергПервая пятницаПервая субботаПервый деньПервый рабочий день
Который день? ВоскресеньеПонедельникВторникСредаЧетвергПятницаСуббота
Формат отчета: РезюмеРезюме (текст)АбстрактАбстракт (текст)PubMed
Отправить максимум: 1 шт. 5 шт. 10 шт. 20 шт. 50 шт. 100 шт. 200 шт.
Отправить, даже если нет новых результатов
Необязательный текст в электронном письме:
Создайте файл для внешнего программного обеспечения для управления цитированием
Полнотекстовые ссылки
Атыпон
Полнотекстовые ссылки
Обзор
. 2001 г., 15 ноября; 164 (10, часть 2): S46-51.
2001 г., 15 ноября; 164 (10, часть 2): S46-51.
doi: 10.1164/ajrccm.164.supplement_2.2106066.
Дж. В. Фахи 1
принадлежность
- 1 Отделение пульмонологии и интенсивной терапии, Медицинский факультет и Научно-исследовательский институт сердечно-сосудистых заболеваний, Калифорнийский университет в Сан-Франциско, Сан-Франциско, Калифорния 94143, США. [email protected]
- PMID:
- DOI: 10.1164/ajrccm.164.supplement_2.2106066
Обзор
JV Fahy.
Am J Respir Crit Care Med. .
.
. 2001 г., 15 ноября; 164 (10, часть 2): S46-51.
doi: 10.1164/ajrccm.164.supplement_2.2106066.
Автор
Дж. В. Фахи 1
принадлежность
- 1 Отделение пульмонологии и интенсивной терапии, Медицинский факультет и Научно-исследовательский институт сердечно-сосудистых заболеваний, Калифорнийский университет в Сан-Франциско, Сан-Франциско, Калифорния 94143, США. [email protected]
- PMID: 11734466
- DOI:
10.
 1164/ajrccm.164.supplement_2.2106066
1164/ajrccm.164.supplement_2.2106066
Абстрактный
При астме в эпителии дыхательных путей происходят некоторые патологические изменения, но связь между этими изменениями и возникновением и прогрессированием астмы остается малоизученной. Одна возможность состоит в том, что изменения в структуре и функции эпителия, вызванные воздействием окружающей среды у генетически восприимчивых субъектов, представляют собой первичные поворотные события, которые происходят на ранней стадии патогенеза астмы. В качестве альтернативы, эти эпителиальные изменения могут возникать просто как следствие основных ранних событий в других системах, таких как иммунное отклонение в детстве в сторону хелперных Т-клеток типа 2 (Th3) подтипа клеток CD4 (+). Эпителиальная десквамация при астме представляет собой патологическое изменение, которое часто называют важным для механизмов ремоделирования дыхательных путей и гиперреактивности дыхательных путей.
Похожие статьи
Легкая и умеренная астма связана с гиперплазией бокаловидных клеток дыхательных путей и аномалиями экспрессии гена муцина.

Ордоньес С.Л., Хашаяр Р., Вонг Х.Х., Феррандо Р., Ву Р., Хайд Д.М., Хотчкисс Дж.А., Чжан Ю., Новиков А., Долганов Г., Фахи Дж.В. Ордоньес С.Л. и соавт. Am J Respir Crit Care Med. 2001 г., февраль; 163(2):517-23. doi: 10.1164/ajrccm.163.2.2004039. Am J Respir Crit Care Med. 2001. PMID: 11179133
Аномалии бокаловидных клеток и гена муцина при астме.
Фахи СП. Фахи СП. Грудь. 2002 г., декабрь; 122 (6 дополнений): 320S-326S. doi: 10.1378/сундук.122.6_suppl.320s. Грудь. 2002. PMID: 12475809 Обзор.
Влияние терапии антагонистами лейкотриеновых рецепторов в низких дозах на ремоделирование дыхательных путей и экспрессию цистеиниллейкотриена в модели астмы у мышей.
Муз М. Х., Девечи Ф., Булут Ю., Ильхан Н., Екелер Х., Тургут Т.
Муз М.Х. и др.
Эксп Мол Мед. 2006 г., 30 апреля; 38 (2): 109–18. doi: 10.1038/emm.2006.14.
Эксп Мол Мед. 2006.
PMID: 16672764
Х., Девечи Ф., Булут Ю., Ильхан Н., Екелер Х., Тургут Т.
Муз М.Х. и др.
Эксп Мол Мед. 2006 г., 30 апреля; 38 (2): 109–18. doi: 10.1038/emm.2006.14.
Эксп Мол Мед. 2006.
PMID: 16672764Опосредованная FcepsilonRI продукция амфирегулина тучными клетками человека увеличивает экспрессию гена муцина в эпителиальных клетках.
Окумура С., Сагара Х., Фукуда Т., Сайто Х., Окаяма Ю. Окумура С. и др. J Аллергия Клин Иммунол. 2005 г., февраль; 115 (2): 272-9. doi: 10.1016/j.jaci.2004.10.004. J Аллергия Клин Иммунол. 2005. PMID: 15696081
Ремоделирование дыхательных путей при астме.
Суми Й, Хамид К. Суми Ю и др. Аллергол Интерн. 2007 декабрь; 56 (4): 341-8. doi: 10.2332/аллерголинт.Р-07-153. Epub 2007 1 ноября.

Посмотреть все похожие статьи
Цитируется
Роль пироптоза в респираторных заболеваниях и его терапевтический потенциал.
Лю Дж., Фань Г., Тао Н., Сунь Т. Лю Дж. и др. Дж. Инфламм Рез. 2022 28 марта; 15:2033-2050. doi: 10.2147/JIR.S352563. Электронная коллекция 2022. Дж. Инфламм Рез. 2022. PMID: 35370413 Бесплатная статья ЧВК. Обзор.
Candida albicans вызывает защитные аллергические реакции посредством опосредованной тромбоцитами поляризации Т-хелперов 2 и Т-хелперов 17.
Wu Y, Zeng Z, Guo Y, Song L, Weatherhead JE, Huang X, Zeng Y, Bimler L, Chang CY, Knight JM, Valladolid C, Sun H, Cruz MA, Hube B, Naglik JR, Luong AU, Херадманд Ф.
 , Корри Д.Б.
У Ю и др.
Иммунитет. 2021 9 ноября; 54(11):2595-2610.e7. doi: 10.1016/j.immuni.2021.08.009. Epub 2021 9 сентября.
Иммунитет. 2021.
PMID: 34506733
Бесплатная статья ЧВК.
, Корри Д.Б.
У Ю и др.
Иммунитет. 2021 9 ноября; 54(11):2595-2610.e7. doi: 10.1016/j.immuni.2021.08.009. Epub 2021 9 сентября.
Иммунитет. 2021.
PMID: 34506733
Бесплатная статья ЧВК.Новые мишени для разрешения ремоделирования дыхательных путей при обструктивных заболеваниях легких.
Наяк А.П., Дешпанде Д.А., Пенн Р.Б. Наяк А.П. и соавт. F1000рез. 2018 30 мая; 7: F1000 Факультет Rev-680. doi: 10.12688/f1000research.14581.1. Электронная коллекция 2018. F1000рез. 2018. PMID: 29904584 Бесплатная статья ЧВК. Обзор.
Der f1 индуцирует пироптоз в бронхиальном эпителии человека через инфламмасому NLRP3.
Цай Ю.М., Чанг К.Х., Хунг Дж.И., Чанг В.А., Лин Х.П., Ши Дж.М., Чонг И.В., Хсу Ю.Л. Цай Ю.
 М. и соавт.
Int J Mol Med. 2018 фев; 41 (2): 757-764. дои: 10.3892/ijmm.2017.3310. Epub 2017 5 декабря.
Int J Mol Med. 2018.
PMID: 29207030
Бесплатная статья ЧВК.
М. и соавт.
Int J Mol Med. 2018 фев; 41 (2): 757-764. дои: 10.3892/ijmm.2017.3310. Epub 2017 5 декабря.
Int J Mol Med. 2018.
PMID: 29207030
Бесплатная статья ЧВК.Трахеобронхопатия от ингаляционных кортикостероидов.
Husta BC, Raoof S, Erzurum S, Mehta AC. Husta BC и др. Грудь. 2017 декабрь; 152(6):1296-1305. doi: 10.1016/j.chest.2017.08.013. Epub 2017 31 августа. Грудь. 2017. PMID: 28864055 Бесплатная статья ЧВК. Обзор.
Просмотреть все статьи «Цитируется по»
Типы публикаций
термины MeSH
вещества
Грантовая поддержка
- P50 HL 56385/HL/NHLBI NIH HHS/США
- R01 HL61662/HL/NHLBI NIH HHS/США
Полнотекстовые ссылки
Атыпон
Укажите
Формат: ААД АПА МДА НЛМ
Добавить в коллекции
- Создать новую коллекцию
- Добавить в существующую коллекцию
Назовите свою коллекцию:
Имя должно содержать менее 100 символов
Выберите коллекцию:
Не удалось загрузить вашу коллекцию из-за ошибки
Повторите попытку
Отправить по номеру
Тяжелая астма — эпителиальное заболевание
P. Chanez
Chanez
European Respiratory Journal 2005 25: 945-946; DOI: 10.1183/0
- 36.05.00038605
- Артикул
- Информация и показатели
- ↵
Godard P, Chanez P, Siraudin L, Nicoloyannis N, Duru G. Затраты на астму коррелируют с тяжестью: 1-летнее проспективное исследование. Евро Респир J 2002;19: 61–67.
- ↵
Эллис АГ. Патологическая анатомия бронхиальной астмы. Am J Med Sci 1908; 136: 407–429.
- ↵
Кэмпбелл А.М., Чанез П., Виньола А.М., и др. Функциональные характеристики бронхиального эпителия, полученные при чистке зубов у больных астмой и у здоровых людей. Am Rev Respir Dis 1993; 147: 529–534.
- ↵
Риккардоло, Флорида, Ди Стефано А.
 , ван Крикен Дж. Х., и др. Пролиферация и воспаление в бронхиальном эпителии после воздействия аллергена у атопических астматиков. Clin Exp Allergy 2003;33:905–911.
, ван Крикен Дж. Х., и др. Пролиферация и воспаление в бронхиальном эпителии после воздействия аллергена у атопических астматиков. Clin Exp Allergy 2003;33:905–911. - ↵
Уолтер М.Дж., Мортон Д.Д., Кадживара Н., Агапов Э., Хольцман М.Дж. Вирусная индукция фенотипа хронической астмы и генетическая сегрегация от острой реакции. J Clin Invest 2002; 110: 165–175.
- ↵
Holgate ST, Lackie PM, Howarth PH. Активация эпителиально-мезенхимальной трофической единицы в патогенезе бронхиальной астмы. Int Arch Allergy Immunol 2001; 124: 253–258.
- ↵
Буске Дж., Джеффри П.К., Буссе В.В., Джонсон М., Виньола А.М. Астма. От бронхоконстрикции до воспаления и ремоделирования дыхательных путей. Am J Respir Crit Care Med 2000; 161: 1720–1745.
- ↵
Лундгрен Р., Содерберг М., Хорстедт П.
 , Стенлинг Р. Морфологические исследования биоптатов слизистой оболочки бронхов у астматиков до и после десяти лет лечения ингаляционными стероидами. Евро Респир J 1988;1:883–889.
, Стенлинг Р. Морфологические исследования биоптатов слизистой оболочки бронхов у астматиков до и после десяти лет лечения ингаляционными стероидами. Евро Респир J 1988;1:883–889. - ↵
Гамильтон Л.М., Паддикомб С.М., Дирман Р.Дж., и др. Измененное фосфорилирование белка тирозина в астматическом бронхиальном эпителии. Eur Respir J 2005; 25: 978–985.
- ↵
Vignola AM, Chiappara G, Siena L, и др. Пролиферация и активация клеток бронхиального эпителия при кортикостероидозависимой астме. J Allergy Clin Immunol 2001;108:738–746.
- ↵
Паддикомб С.М., Торрес-Лозано С., Рихтер А., и др. Повышенная экспрессия ингибитора циклин-зависимой киназы p21waf в астматическом бронхиальном эпителии. Am J Respir Cell Mol Biol 2003; 28: 61–68.
- ↵
Чакир Дж.

Астма является важным клинически распространенным заболеванием во всем мире. Несмотря на лучшее знание патогенеза, механизмы, лежащие в основе индукции и персистенции заболевания, в значительной степени неизвестны. В настоящее время принято считать, что воспаление дыхательных путей и структурные изменения бронхов являются важными признаками. Отношения между этими структурными изменениями и клиническими и функциональными нарушениями явно заслуживают дальнейшего изучения. Эти результаты привели к усилению использования ингаляционных кортикостероидов в качестве основного лечения астмы. Тем не менее, несмотря на длительное наблюдение специалистов и постоянное оптимальное лечение, все еще есть пациенты с постоянными симптомами, измененной функцией легких и высокой частотой обострений. Эти тяжелые пациенты имеют серьезные недостатки в повседневной жизни и несут ответственность за большую часть расходов, связанных с астмой 1.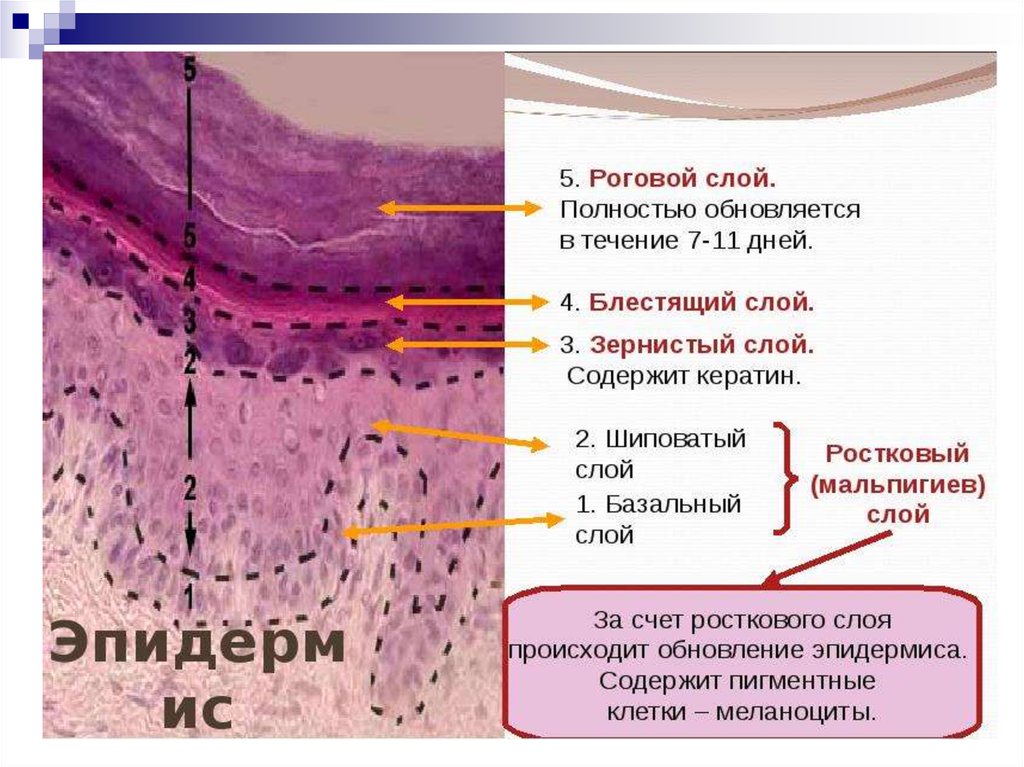 Поэтому очень важно лучше понять механизмы, ведущие к этому тяжелому фенотипу.
Поэтому очень важно лучше понять механизмы, ведущие к этому тяжелому фенотипу.
Почти столетие назад Эллис 2 подчеркнул, что патологию астмы можно исследовать, исследуя мокроту живых пациентов или легкие пациентов, умерших во время приступа. Из этих источников роль бронхиального эпителия была уточнена путем описания удлиненных эпителиальных клеток в мокроте и наличия аномалий псевдомногослойного и реснитчатого эпителия в большинстве случаев с летальным исходом, хотя она значительно различалась по локализации и протяженности 2. Роль роль эпителиальных клеток была пересмотрена более подробно всего 15 лет назад, и было ясно установлено, что их реакция на воспаление и повреждение ненормальна при астме 3.
Аллергены являются потенциальными вредными факторами, которые могут взаимодействовать и повреждать бронхиальный эпителий, приводя к развитию долговременных заболеваний, таких как астма. В исследовании с использованием провокационного теста in vivo было показано, что они влияют на гомеостаз бронхиального эпителия, индуцируя пролиферацию 4. Вирусные инфекции являются хорошо известными индукторами большинства обострений астмы у детей и взрослых. Они взаимодействуют с бронхиальным эпителием и участвуют в структурных изменениях дыхательных путей, что приводит к бронхиальной гиперсекреции и гиперреактивности, длящимся ≥1 года на некоторых животных моделях, имитируя персистенцию заболевания у человека. 5. Несколько различных механизмов, связанных с воспалением, вызывают повреждение эпителия при бронхиальной астме. Потенциальными виновниками являются медиаторы, выделяемые воспалительными клетками, такие как катионные белки, различные протеолитические ферменты, металлопротеиназы и соединения, реагирующие с кислородом. Бронхиальный отек и просачивание сосудов способствуют ломкости слоя эпителия в астматических бронхах. Процессы ранней репарации пытаются восстановить целостность ткани. Динамика этих событий сложна, включая активацию и гибель клеток, а также пролиферацию, миграцию и дифференцировку. Восстанавливающийся эпителий продуцирует различные факторы роста, способные активировать структурные клетки подслизистой основы, в том числе фибробласты и гладкомышечные клетки.
Вирусные инфекции являются хорошо известными индукторами большинства обострений астмы у детей и взрослых. Они взаимодействуют с бронхиальным эпителием и участвуют в структурных изменениях дыхательных путей, что приводит к бронхиальной гиперсекреции и гиперреактивности, длящимся ≥1 года на некоторых животных моделях, имитируя персистенцию заболевания у человека. 5. Несколько различных механизмов, связанных с воспалением, вызывают повреждение эпителия при бронхиальной астме. Потенциальными виновниками являются медиаторы, выделяемые воспалительными клетками, такие как катионные белки, различные протеолитические ферменты, металлопротеиназы и соединения, реагирующие с кислородом. Бронхиальный отек и просачивание сосудов способствуют ломкости слоя эпителия в астматических бронхах. Процессы ранней репарации пытаются восстановить целостность ткани. Динамика этих событий сложна, включая активацию и гибель клеток, а также пролиферацию, миграцию и дифференцировку. Восстанавливающийся эпителий продуцирует различные факторы роста, способные активировать структурные клетки подслизистой основы, в том числе фибробласты и гладкомышечные клетки. Эта межклеточная кооперация привела некоторых авторов к предположению, что структурные изменения дыхательных путей, наблюдаемые при астме, обусловлены реактивацией эпителиально-мезенхимальной трофической единицы, которая контролирует морфогенез дыхательных путей в антенатальной жизни 6.
Эта межклеточная кооперация привела некоторых авторов к предположению, что структурные изменения дыхательных путей, наблюдаемые при астме, обусловлены реактивацией эпителиально-мезенхимальной трофической единицы, которая контролирует морфогенез дыхательных путей в антенатальной жизни 6.
При астме бронхиальный эпителий видоизменяется, становится хрупким и активируется. Аномалии включают потерю самого поверхностного слоя эпителия, разрушение реснитчатых клеток, усиление высвобождения фактора роста и сверхэкспрессию рецепторов, таких как рецепторы эпидермального фактора роста (EGFR). Макроскопическая морфология эпителия, наблюдаемая при эндобронхиальной биопсии, была противоречивой. Отслоение эпителия, о котором ранее сообщали исследователи, изучавшие эндобронхиальные биоптаты, теперь считается, по крайней мере, частично, связано с процедурой отбора проб. Несмотря на этот потенциальный смешанный фактор, хрупкость эпителия остается реальностью 7. Ни одно исследование не продемонстрировало способность ингаляционных кортикостероидов восстанавливать полностью нормальный эпителиальный слой 8.
В этом выпуске European Respiratory Journal , Hamilton et al . 9 сообщают об изменении тирозинового фосфорилирования эпителиальных клеток бронхов, полученном при фиброоптической бронхоскопии у живых астматиков с тяжелой формой заболевания. Эндобронхиальные биопсии или эксплантированные очищенные клетки использовались для анализа различных сигнальных путей. Интересно, что эти изменения были довольно уникальными для клеток тяжелых пациентов по сравнению с нормальными субъектами и пациентами с более легкой формой заболевания. На уровни фосфотирозина не повлияло 6-недельное лечение ингаляционными кортикостероидами. Было обнаружено, что эпидермальный фактор роста, тирозинкиназа, активируется в эпителии тяжелых астматиков.0295 Эксперименты in vitro продемонстрировали неспособность кортикостероидов подавлять фосфорилирование EGFR и некоторых нижестоящих или ассоциированных белков, таких как митоген-активируемая протеинкиназа.
При тяжелой астме экспрессия рецепторов, таких как EGFR, повышается, и на нее не влияют современные методы лечения, включая кортикостероиды 10. Маркеры выживания и пролиферации клеток экспрессируются совместно с маркерами активации, такими как ядерный фактор-кВ, эпителий эндобронхиальных биоптатов, полученных от кортикозависимых пациентов. У пациентов с тяжелой астмой эпителиальный слой был толще, чем у пациентов с легкой формой заболевания, и было идентифицировано небольшое количество апоптотических клеток. Это исследование было важно, чтобы предположить, что при тяжелой астме эпителиальные клетки связаны с аномальным процессом репарации, несмотря на отсутствие десквамации эпителия. к этой длительной активации, несмотря на отсутствие потери контроля над этой пролиферацией 11. Этот фермент регулирует скорость пролиферации клеток и не зависит от кортикостероидов. Он может быть вызван различными медиаторами и факторами роста, в том числе трансформирующим фактором роста-β, избыточная продукция которого обнаружена в астматических дыхательных путях 12. Сочетание анализа эндобронхиальных биопсий с полученными результатами ex vivo с использованием первичных культур очищенных эпителиальных клеток способствует установлению эпителиальных аномалий как потенциального внутреннего фактора в патофизиологии тяжелой астмы.
Маркеры выживания и пролиферации клеток экспрессируются совместно с маркерами активации, такими как ядерный фактор-кВ, эпителий эндобронхиальных биоптатов, полученных от кортикозависимых пациентов. У пациентов с тяжелой астмой эпителиальный слой был толще, чем у пациентов с легкой формой заболевания, и было идентифицировано небольшое количество апоптотических клеток. Это исследование было важно, чтобы предположить, что при тяжелой астме эпителиальные клетки связаны с аномальным процессом репарации, несмотря на отсутствие десквамации эпителия. к этой длительной активации, несмотря на отсутствие потери контроля над этой пролиферацией 11. Этот фермент регулирует скорость пролиферации клеток и не зависит от кортикостероидов. Он может быть вызван различными медиаторами и факторами роста, в том числе трансформирующим фактором роста-β, избыточная продукция которого обнаружена в астматических дыхательных путях 12. Сочетание анализа эндобронхиальных биопсий с полученными результатами ex vivo с использованием первичных культур очищенных эпителиальных клеток способствует установлению эпителиальных аномалий как потенциального внутреннего фактора в патофизиологии тяжелой астмы.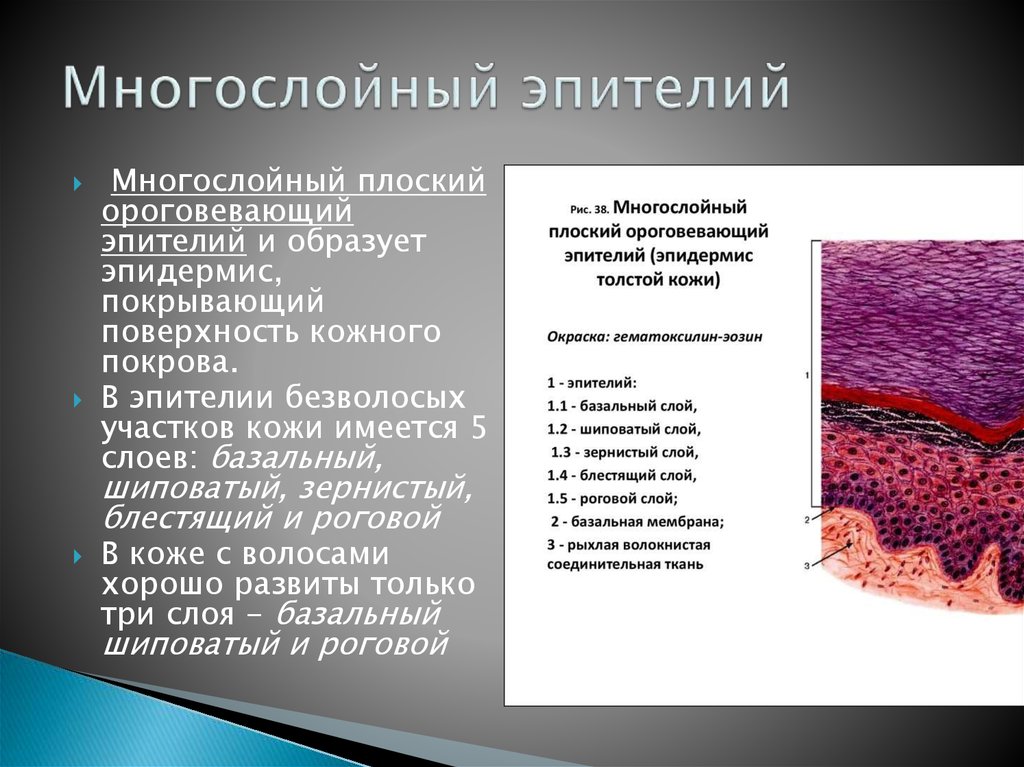
Разрешение воспаления представляет собой хорошо скоординированный активный процесс, который контролируется эндогенными противовоспалительными медиаторами. Эти медиаторы могут отключать хемоаттракцию и активацию лейкоцитов и обращать вспять сосудистые аномалии. Трансцеллюлярный метаболизм арахидоновой кислоты за счет взаимодействия с липоксигеназой дает начало липоксиновому семейству метаболитов эйкозаноидов. Бронхиальный эпителий богат 15 продуктами, производными липоксигеназы, что указывает на его потенциал в качестве источника этих природных противовоспалительных продуктов. Недавно было обнаружено, что тяжелая астма связана с потерей продукции lipoxin-A4 по сравнению с легкой, контролируемой астмой 13. Таким образом, липидные медиаторы являются потенциально важными компонентами разрешения воспаления, избегая дальнейшей амплификации, ведущей к ремоделированию ткани. Эти данные дают некоторое обоснование для разработки стабильных миметиков, которые могут влиять на ключевые аспекты хронического воспаления при астме.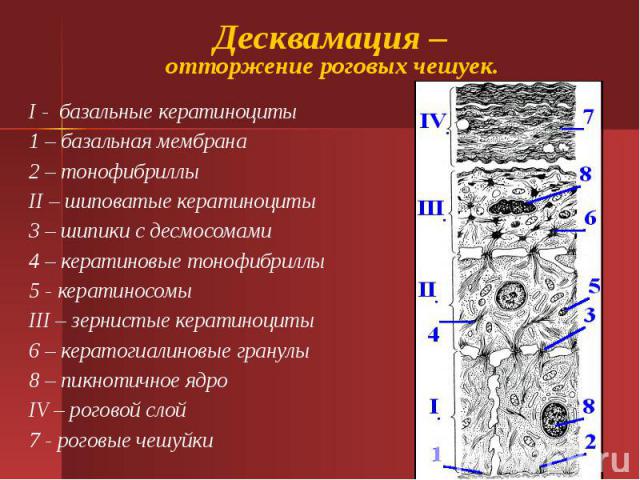
Эти данные помогают выделить эпителий как важнейший партнер при тяжелой астме и могут указывать на бронхиальные эпителиальные внутриклеточные сигнальные пути как потенциальные мишени для новых терапевтических вмешательств, когда глюкокортикоиды и длительно действующие β 2 -агонисты имеют ограниченную эффективность.

 1164/ajrccm.164.supplement_2.2106066
1164/ajrccm.164.supplement_2.2106066
 Х., Девечи Ф., Булут Ю., Ильхан Н., Екелер Х., Тургут Т.
Муз М.Х. и др.
Эксп Мол Мед. 2006 г., 30 апреля; 38 (2): 109–18. doi: 10.1038/emm.2006.14.
Эксп Мол Мед. 2006.
PMID: 16672764
Х., Девечи Ф., Булут Ю., Ильхан Н., Екелер Х., Тургут Т.
Муз М.Х. и др.
Эксп Мол Мед. 2006 г., 30 апреля; 38 (2): 109–18. doi: 10.1038/emm.2006.14.
Эксп Мол Мед. 2006.
PMID: 16672764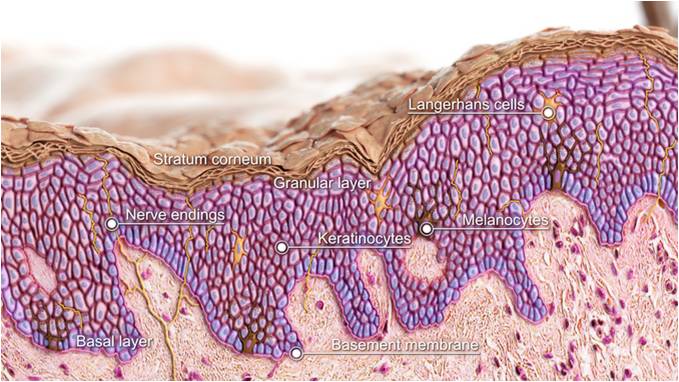
 , Корри Д.Б.
У Ю и др.
Иммунитет. 2021 9 ноября; 54(11):2595-2610.e7. doi: 10.1016/j.immuni.2021.08.009. Epub 2021 9 сентября.
Иммунитет. 2021.
PMID: 34506733
Бесплатная статья ЧВК.
, Корри Д.Б.
У Ю и др.
Иммунитет. 2021 9 ноября; 54(11):2595-2610.e7. doi: 10.1016/j.immuni.2021.08.009. Epub 2021 9 сентября.
Иммунитет. 2021.
PMID: 34506733
Бесплатная статья ЧВК.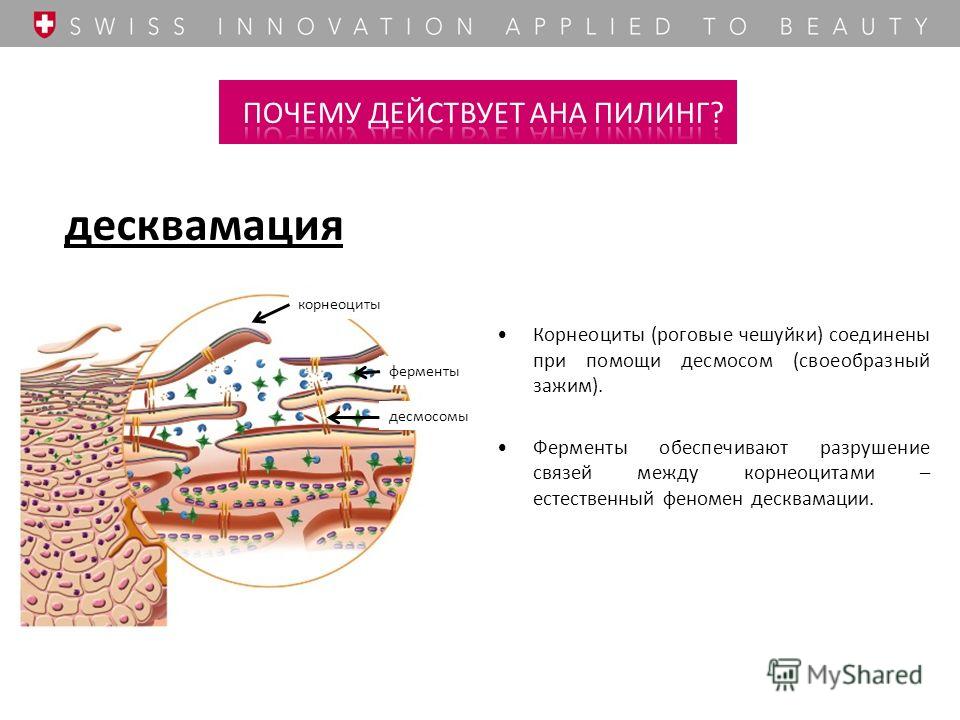 М. и соавт.
Int J Mol Med. 2018 фев; 41 (2): 757-764. дои: 10.3892/ijmm.2017.3310. Epub 2017 5 декабря.
Int J Mol Med. 2018.
PMID: 29207030
Бесплатная статья ЧВК.
М. и соавт.
Int J Mol Med. 2018 фев; 41 (2): 757-764. дои: 10.3892/ijmm.2017.3310. Epub 2017 5 декабря.
Int J Mol Med. 2018.
PMID: 29207030
Бесплатная статья ЧВК. , ван Крикен Дж. Х., и др. Пролиферация и воспаление в бронхиальном эпителии после воздействия аллергена у атопических астматиков. Clin Exp Allergy 2003;33:905–911.
, ван Крикен Дж. Х., и др. Пролиферация и воспаление в бронхиальном эпителии после воздействия аллергена у атопических астматиков. Clin Exp Allergy 2003;33:905–911.  , Стенлинг Р. Морфологические исследования биоптатов слизистой оболочки бронхов у астматиков до и после десяти лет лечения ингаляционными стероидами. Евро Респир J 1988;1:883–889.
, Стенлинг Р. Морфологические исследования биоптатов слизистой оболочки бронхов у астматиков до и после десяти лет лечения ингаляционными стероидами. Евро Респир J 1988;1:883–889.