Натрий тетраборат декагидрат
Артикул: 1303-96-4
по запросу
Производитель: Не указано
8-985-231-84-76, mail@himreakt.
 ru
ruОсновное описание
Идентификация
Химические и физические свойства
Риски, безопасность и условия использования
Классификация химических реактивов
Смотрите также
Форма запроса
Чтобы купить натрий тетраборат декагидрат, отправьте запрос
Контактные данные
Контактное лицо:
Телефон:
Email:
ИНН организации:
Название организации:
Информация о заказе
Упаковка:
Количество:
Фасовка:
Производство:
— — — Выберите значение — — -ОтечественныйИмпортный
Дополнительные требования:
Включите в запрос ваши требования к продукции. Обращаем внимание, что мы не продаем химические реактивы частным лицам.
Нажимая кнопку «Отправить» Вы соглашаетесь с Условиями использования и Политикой конфиденциальности
×
| Мужская | |||||||||
| 43-50 | 50-59 | 59-72 | 72-83 | 83-95 | 95-104 | 104-113 | |||
| 147-157 | 152-170 | 165-188 | 170-193 | 170-193 | 170-193 | 170-193 | |||
| 81-86 | 86-91 | 97-102 | 102-107 | 112-117 | 117-122 | 122-127 | |||
| Женская | |||||||||
| 79-84 | 84-89 | 89-94 | 94-99 | 99-104 | |||||
| 58-64 | 64-69 | 69-74 | 76-81 | 84-89 | |||||
| 84-89 | 89-94 | 94-99 | 102-107 | 109-114 | |||||
Бура (натрия тетраборат 10-водный), 50гр
INCI Name: Sodium tetraborate
Химическая формула: Na2B4O7*10h3O
Синонимы: натрий тетраборат декагидрат, бура, натрия тетраборат
Внешний вид: бесцветный кристаллический порошок, в массе белого цвета
Химические характеристики:
Температура плавления 742°C
Плотность 2,37 г/см3 (20°C)
Для рук:
При сильной потливости рук рекомендуют подержать их в такой ванночке: в 3-х стаканах воды растворить 1 ч. л. буры, положить в полученный раствор туалетное мыло, чуть подождать, чтобы оно размокло, слегка помешать воду. В полученной ванночке держат руки 5 минут, вытаскивают, стряхивают капли (при этом руки не вытирают) и сразу же смазывают глицерином. Спустя несколько минут избыток глицерина можно вытереть полотенцем.
л. буры, положить в полученный раствор туалетное мыло, чуть подождать, чтобы оно размокло, слегка помешать воду. В полученной ванночке держат руки 5 минут, вытаскивают, стряхивают капли (при этом руки не вытирают) и сразу же смазывают глицерином. Спустя несколько минут избыток глицерина можно вытереть полотенцем.
Стоит отметить, что после прямого контакта с бурой необходимо тщательно мыть руки и не допускать ее попадания внутрь, поскольку препарат признан токсическим и запрещен в качестве пищевой добавки, потому что губительно воздействует на клетки почек и печени.
Для лица:
Использование буры в косметологии для лица помогает хорошо очищать поры от загрязнений и устранять пигментные пятна.
Для чистки кожи можно смешать перемолотую в «пудру» буру и каолин в соотношении 2:1 и добавить воды до получения пастообразной консистенции. Лицо сначала протирают спиртом, кожу под глазами обильно смазывают маслом или же кремом, а затем наносят пасту на лицо ровным слоем (можно использовать шпатель) и выдерживают около 25 мин. По прошествии времени массу снимают шпателем и тщательно умываются водой. Досуха вытираются и наносят питательный крем.
По прошествии времени массу снимают шпателем и тщательно умываются водой. Досуха вытираются и наносят питательный крем.
В качестве отбеливающей маски можно использовать следующий рецепт: 0,25 кг. творога, 1 ст.л. камфорного спирта, 1 ст.л. борной кислоты и буры, по 1 ч.л. перекиси и нашатыря. Все хорошо смешать и нанести на лицо на 15-20 мин, а затем удалить теплой водой.
Рецепты для волос:
Бура в косметологии прекрасно справляется с грязными волосами. К тому же она сводит на нет шелушение, зуд кожного покрова головы, а также уменьшает активность имеющихся бактерий на нем.
В качестве шампуня для волос можно использовать косметическую буру, которую необходимо добавить в воду в соотношении 1/8 стакана буры на 4 л. воды. Брать большую концентрацию не рекомендуется, поскольку это негативно скажется на состоянии волос. Полученный шампунь хорошо взболтать и разлить по емкостям. Вымытые бурой волосы нужно будет сполоснуть лимонной кислотой.
Также можно приготовить еще вот такой шампунь: в емкость вливают 0,25 л.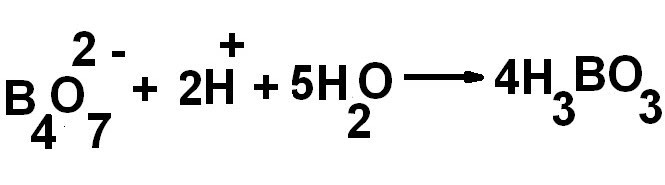 горячей воды, всыпают 1 ч.л. буры, и 1 ст.л. мыльного порошка. Все хорошо смешивается и наносится на волосы. Вместо воды можно воспользоваться ромашковым раствором, предварительно профильтровав его.
горячей воды, всыпают 1 ч.л. буры, и 1 ст.л. мыльного порошка. Все хорошо смешивается и наносится на волосы. Вместо воды можно воспользоваться ромашковым раствором, предварительно профильтровав его.
Применение в косметике: бура – натуральный минерал, широко применяемый в косметической промышленности. Используется в кремах, лосьонах, шампунях, гелях, соли и бомбочках для ванны.
В сочетании с лимонной кислотой в бомбочках для ванн даёт эффект бурления, в смеси с водой и гуаровой камедью может применятся в качестве геля для душа.
Лечебное применение: наружно, как антисептическое средство у взрослых для полосканий, смазывания кожи (при опрелостях, пролежнях).
Концентрация и способы применения:
- В косметических средствах – не более 5%. Развести в горячей (75 С) воде, после чего добавить в крем.
Бура используется в приготовлении крема, как эмульгатор, для получения густой консистенции, то есть делает из жидких фаз собственно крем. Плюс как легкий консервант, т.к. является антисептиком.
Плюс как легкий консервант, т.к. является антисептиком.
Бура сушит кожу, поэтому ее лучше добавлять в крем для жирной и пористой кожи.
Производитель: Турция
Годен до 01.2026 года
Формула буры с примерами решения
Формула буры
Бура, которая также может обозначаться как борат натрия, тетраборат натрия или борат натрия, является наиболее часто используемым моющим средством.
Что такое боракс?
Бура представляет собой порошок или гранулы белого цвета. Впервые он был замечен и обнаружен в 8 веке нашей эры в высохших озерах Тибета. Большее количество месторождений буры находится в Турции, Калифорнии, Чили, Боливии, Тибете и Румынии. Он бывает двух типов в зависимости от содержания кристаллов и воды. Их:
- Sodium tetraborate pentahydrate which is represented by Na2B4O7·5h3O
- Anhydrous sodium tetraborate is denoted by Na2B4O7
- Sodium tetraborate decahydrate can be labelled as Na2B4O7·10h3O
Formula for Borax
Borax is frequently formed in dry или пересохшие дна озер, в которых вода высыхала и оставляла после себя залежи полезных ископаемых. Он создается путем объединения бора, натрия и кислорода.
Он создается путем объединения бора, натрия и кислорода.
Бура может быть получена различными способами, и их химическая реакция может быть представлена ниже:
Химическая формула или реакция буры из колеманита:
Карбонат натрия реагирует с колеманитом в присутствии тепла, что способствует образованию буры и метабората натрия.
2NA2CO3 + CA2B6O11 + HEAT → 2NABO2 + NA2B4O7 + 2CACO3
ЗДЕСЬ,
- NA2CO3 относится к карбонату натрия
- CA2B6O11.0016
- CACO3 символизирует карбонат кальция
Химическая формула или реакция буры из метаборирования натрия:
4NABO2 + CO2 → NA2B4O7 + NA2CO3
- CO2 -Refers TO CARBON DIO DIO DIO. Химическая формула или реакция буры из борной кислоты:
Na2CO3 + 4h4BO3 → 6h3O + CO2 + Na2B4O7
- h4BO3 представляет борную кислоту
- h3O подразумевает воду
Применение буры:Бура используется в различных местах для различных целей, некоторые из них:
- Она используется в качестве коммерческого моющего средства
- Применяется для различных бытовых целей
- Используется16 в производстве мыла 900
- Используется в качестве буферного агента
- Используется в качестве пищевой добавки
- Помогает в процессе добычи полезных ископаемых
- Поддерживает некоторые медицинские процедуры
- Способствует сохранению и консервированию
- Используется в производстве стекла, керамики и гончарных изделий
Решенные примеры буры:Вот несколько решенных примеров буры:
Задача 1: Напишите реакцию превращения буры в борную кислоту?
Решение: Бура может быть преобразована в борную кислоту путем обработки соляной кислотой.
 Бура может быть немедленно преобразована в борную кислоту.
Бура может быть немедленно преобразована в борную кислоту. 2 HCl + Na2B4O7·10h3O → 4 h4BO3 + 5h3O + 2 NaCl
Здесь
- HCl представляет соляную кислоту.
- h4BO3 обозначает борную кислоту.
- NaCl подразумевает хлорид натрия.
Задача 2: Напишите реакцию гидролиза буры?
Решение: Добавление воды к буре приведет к образованию гидроксида натрия и борной кислоты.
Na2B4O7 + 7h3O → 2NaOH + 4h4BO3
Формула буры – структура, свойства, применение, примеры вопросов
Бор — это химический элемент, который существует как в кристаллической, так и в аморфной формах. Он имеет символ B и атомный номер 5 с атомным весом 10,81 а.е.м. Аморфная форма бора имеет мощную форму коричневого цвета, а в кристаллическом состоянии она блестящая и темная. Турция является крупнейшим производителем бора в мире.
Формула буры
Борат натрия или декагидрат бората натрия или декагидрат тетрабората натрия, который широко известен как бура, широко известен своим противогрибковым или профилактическим действием.
 Бура в основном представляет собой гидрат соли борной кислоты. Бура обычно относится к нескольким кристаллам и имеет разные химические формулы в зависимости от кристаллизационной воды. Бура имеет широкий спектр применения, она используется в качестве ко-комплексообразователя, фунгицида и средства для смягчения воды.
Бура в основном представляет собой гидрат соли борной кислоты. Бура обычно относится к нескольким кристаллам и имеет разные химические формулы в зависимости от кристаллизационной воды. Бура имеет широкий спектр применения, она используется в качестве ко-комплексообразователя, фунгицида и средства для смягчения воды. Структура буры
Наличие буры
Повторяющееся испарение в сезонных озерах приводит к естественному появлению буры. Впервые он был обнаружен в руслах высохших озер Тибета и завезен в арабские поместья.
Получение буры
Буру получают из колеманита (Ca 2 B 6 O 11 ). Реакция выглядит следующим образом:
CA 2 B 6 O 11 + 2NA 2 CO 3 → (в присутствии HEAT) → NA 2 B 4 O 2 B 4 O 2 2 2 2 2 B 4 + 2 2 B 4 9.
 2 B 4 7 2 2 . 3 ↓(осадок)
2 B 4 7 2 2 . 3 ↓(осадок) Далее нам необходимо обработать NaBO 2 (метаборат натрия) диоксидом углерода, чтобы преобразовать его в буру, и реакция будет следующей: + CO 2 → Na 2 B 4 O 7 + Na 2 CO 3
Физические свойства буры
- Бура представляет собой белое кристаллическое соединение.
- Молярная масса буры составляет 202,2 г/моль (безводная форма) и 381,38 г/моль (декагидрат).
- Плотность буры 1,7 г/см 3 (декагидрат).
- Показатель преломления буры составляет 1,472 (декагидрат).
- Температура кипения буры 1575°C (безводная).
- Температура плавления буры 743°C (безводная).
Химические свойства буры
- Бура легко воспламеняется и дает желтовато-зеленое пламя.
- Бура представляет собой растворимое соединение с растворимостью в воде 31,7 г/л.
- Бура обладает высокой растворимостью в этиленгликоле и низкой растворимостью в ацетоне.
- Бура реагирует с соляной кислотой с образованием борной кислоты. Участвующая реакция задается как
NA 2 B 4 O 7 · 10H 2 O + 2 HCL → 4 B (OH) 3 + 2 NACL + 5 H 2 3 + 2 NACL + 5 H 2 . хорошо растворим в этиленгликоле и мало растворим в ацетоне.
Использование буры
- Бура используется как средство от вредителей.
- Бура — очень хорошее дезинфицирующее средство.
- Бура используется в качестве пищевого консерванта.
- Бура используется для приготовления буферных растворов.
- Бура используется в качестве подщелачивателя в фармацевтических целях.
Примеры вопросов
Вопрос 1: Перечислите несколько вредных эффектов буры?
Ответ:
- Раздражение дыхательных путей является обычным явлением из-за постоянного воздействия боракса.
- Потребление буры в небольшом количестве может также вызвать тошноту, рвоту, головную боль и сыпь на ладонях.
Вопрос 2: Объясните ко-комплексообразование буры?
Ответ:
Боракс является источником ионов бората, которые очень хорошо образуют комплексные ионы в воде. Борат вместе с подходящим слоем полимера помогает хроматографировать негликированный гемоглобин в отличие от гликированного гемоглобина.
Вопрос 3: Как отличить буру от борной кислоты?
Ответ:
Борная кислота0152
Бура представляет собой гидрат соли борной кислоты. Борная кислота является слабой одноосновной кислотой Льюиса бора. Он также известен как борат натрия, декагидрат бората натрия или декагидрат тетрабората натрия. Он также известен как гидроборат, борная кислота или ортоборная кислота. 
Вопрос 4: Какой продукт образуется при реакции буры с гидроксидом натрия?
Ответ:
Тетрагидроксиборат натрия образуется при взаимодействии буры с NaOH (гидроксидом натрия). Реакция протекает следующим образом:
Na 2 B 4 O 7 + 7H 2 O + 2NaOH ⇢ 4Na[B(OH) 4 ].
Вопрос 5: Перечислите различные химические формулы буры на основе кристаллизационной воды?
Ответ:
Compound
Formula
Anhydrous Sodium tetraborate Na 2 B 4 O 7 Sodium tetraborate octahydrate Na 2 [B 4 O 5 (OH) 4 ]. 8H 2 O
Sodium tetraborate pentahydrate Na 2 B 4 O 7 . 5ч 2 O
Вопрос 6: Объясните свойства буры для смягчения воды?
Ответ:
Жесткость воды в основном обусловлена катионами Ca +2
, Mg +2 катионов. Бура вступает в реакцию с этими катионами и образует легко отделяемый осадок, в результате чего вода становится мягкой. Реакция, участвующая в процессе умягчения, выглядит следующим образом:Ca +2 (водн.) + Na 2 B 4 O 7 (AQ) ⇢ CA B 4 O 7 (S) ⇣ + 2 NA + (AQ)
9 51541244 (AQ)
51515134 40234 (AQ)
5151541344 (AQ)
515134 (AQ)
9 0006 5134 (AQ)5134.

