Кандидоз слизистой оболочки полости рта
Кандидоз слизистой оболочки полости рта – это следствие болезни, а не причина. Известно 18 патогенетических факторов, способствующих его развитию. Различают местные и общие. К первым относятся травматические повреждения (в т. ч. хронические), ношение съемных протезов, курение, афтозный стоматит, заболевания пародонта, слизистой оболочки полости рта (например, красный плоский лишай, лейкоплакия). Благоприятная среда для грибов рода Candida – кариозные зубы, содержимое зубных каналов.
Общие факторы – гиповитаминоз, сахарный диабет и другие эндокринные недуги, бесконтрольный прием антибиотиков, кортикостероидов, цитостатиков, а также злокачественные новообразования, болезни кроветворных органов, лучевые поражения.
Наиболее уязвимы перед кандидозом пожилые люди (из-за снижения иммунной резистентности) и дети, у которых еще не в полной мере сформировались защитные механизмы организма. Среди взрослых чаще наблюдается у лиц старше 50 лет.
Поскольку эти грибы любят углеводы, то последние надо ограничить. Одноклеточные микроорганизмы обнаруживаются даже в сладких творожных десертах. В гнилых фруктах и ягодах вырабатывается опасный для человека штамм Candida guilliermondii, способный стать возбудителем заболевания.
Клиническая картина кандидоза выражена не ярко. Беспокоят сухость, незначительное жжение, дискомфорт во рту. После лечения заболевания эти симптомы исчезают; но могут оставаться, если имеется еще какой-либо недуг (например, парестезия, гальваноз полости рта).
Грибы рода Candida – условно патогенная флора. Человек может быть лишь их носителем долгое время. По данным исследования профессора Р. Ребровой (1979 г.), у 30% практически здоровых лиц обнаруживают грибы в объеме до 1х103 КОЕ/мл. При наличии клинической картины это обозначает либо кандидоносительство, либо кандидоз легкой степени. При средней степени заболевания культуральное исследование обнаруживает до 1х104 КОЕ/мл грибов, тяжелой – выше 1х105 КОЕ/мл (при наличии клинической картины).
Выделяют 4 формы кандидоза. Часто встречаемая – хронический эритематозный. Он характеризуется стертыми симптомами (покраснением, умеренной гиперемией). Основные жалобы больных хроническим гиперпластическим кандидозом (кандидозной лейкоплакией) – утолщение слизистой оболочки полости рта, ноющие боли от приема горячей или соленой пищи, трещины в углах губ (ангулярный хейлит), а также участки гиперкератоза.
Острая эритематозная форма дает отек слизистой, пенистую слюну и более яркую гиперемию.
При лучевых поражениях или злокачественных заболеваниях встречается острый псевдомембранозный кандидоз (молочница). Его симптомы – наличие во рту творожистого налета, пленок, при удалении которых выявляются эрозированные поверхности, пенистая слюна, гиперплазия нитевидных сосочков языка. Молочница чаще бывает у детей и после лечения обычно проходит. Но иногда развиваются висцеральные формы, поражающие ЖКТ и органы дыхания.
Взрослые заболевают острым псевдомембранозным кандидозом редко. В ротовой полости присутствует большое количество грибов, и сильно снижается иммунологическая активность организма.
В ротовой полости присутствует большое количество грибов, и сильно снижается иммунологическая активность организма.
Чтобы уточнить диагноз, надо выявить патогенетический фактор, провести культуральное исследование, подсчитать колониеобразующие единицы в динамике. Лечение – комплексное. Если обнаружен местный фактор, его устраняют (заменяют съемные протезы, отказываются от курения и т. д.). Пища – преимущественно белковая; рекомендуется белково-овощная диета.
Спектр противогрибковых препаратов весьма широк. Но имеющего 100% противогрибковое действие – нет. Ведь грибы – эукариоты (их клетки сходны с клетками хозяина – эритроцитами, гепатоцитами). Антибиотик разрушает те и другие. Принимая средства общего действия, надо следить за гематокритом крови, билирубином и т. д.
Лечением основного заболевания, способствующего появлению грибов рода Candida, занимаются врачи-терапевты. Местное назначает врач-стоматолог, наблюдающий больного.
При кандидозе эффективны имидазольные препараты, спрей или раствор клотримазола, кетоконазол, миконазол. Мази хуже всасываются, их лучше применять при ангулярном хейлите (трещины в углах рта могут быть проявлением грибкового поражения). Препараты общего действия – пимафуцин, флюконазол. Последний широко применяют и для профилактики, но он токсичен для печени и почек.
Мази хуже всасываются, их лучше применять при ангулярном хейлите (трещины в углах рта могут быть проявлением грибкового поражения). Препараты общего действия – пимафуцин, флюконазол. Последний широко применяют и для профилактики, но он токсичен для печени и почек.
В межрецидивный период для поддержки нормальной микрофлоры полости рта назначаются бактерийные препараты (биофлор, диалакт, бактисубтил и др.). Многим больным рекомендуем кефир или биокефир, летом – голубику. Доза медикамента подбирается в зависимости от формы заболевания. Если она недостаточна, например, при тяжелом течении, то наступит рецидив. Человек не долечился, грибы попадают вглубь слизистой, болезнь принимает хроническое течение. Осложнения возникают при непереносимости противогрибкового препарата, из-за пониженной чувствительности к лечению при развитии устойчивых форм грибов рода Candida к данной группе медикаментов.
Доказано, что при комплексном приеме противогрибковых лекарств и препаратов, имеющих другой механизм действия (рифампицин, тетрациклин), они совместно атакуют грибы.
Первые обладают мембранотропным эффектом (дезактивируют клетку), вторые – действуют внутриклеточно.
Но надо помнить, что кандидоз в целом поддается лечению тяжело. Поэтому рекомендуется принимать профилактические препараты при употреблении кортикостероидов, цитостатиков и др. Перенесший данное заболевание должен соблюдать меры личной гигиены (например, пользоваться отдельной посудой) и поменьше контактировать с детьми.
Анализ на грибы рода Candida можно сделать в любом ЦГЭ по месту жительства, кожно-венерологическом диспансере и в бактериологической лаборатории 9-й ГКБ Минска.
‡агрузка…
«Гинеколог обнаружил у меня кандидоз. Что это за заболевание и как надо лечиться? Яна, Речица».
— Это инфекционное поражение слизистой наружных половых органов и влагалища дрожжеподобными грибками рода кандида. В последние годы распространенность заболевания растет. А ведь у беременных с кандидозом может инфицироваться и внутриутробно плод, и новорожденный в родах. За последние 20 лет частота кандидоза среди доношенных младенцев увеличилась с 1,9 до 15,6%.
За последние 20 лет частота кандидоза среди доношенных младенцев увеличилась с 1,9 до 15,6%.
Известно около 190 видов грибков рода кандида, они относятся к условно–патогенным микроорганизмам. Дрожжеподобные грибки являются аэробами. Наиболее благоприятная температура для их роста — 21 — 370С. При температуре 400С он задерживается, выше 500С — происходит полное отмирание клеток, а кипячение в течение нескольких минут приводит к гибели микроорганизмов. Около 75 — 80% женщин переносят в течение жизни хотя бы один эпизод кандидозной инфекции, и у 40 — 45% из них развивается, по крайней мере, один рецидив. Но если у девочек заболевание встречается редко, то в возрасте 20 — 40 лет — все чаще и чаще. Кандидозом болеют ежегодно около 13 млн. американок, то есть 10% женского населения страны.
Способствуют развитию инфекции длительный и/или бессистемный прием антибиотиков, воспалительные заболевания половых органов, снижение иммунореактивности организма, использование оральных контрацептивов, способность грибков рода кандида изменять биохимические свойства в зависимости от условий существования, беременность, эндокринные заболевания, анемия, недостаток витаминов С, В2, В6, РР, общие тяжелые заболевания, ослабляющие защитные функции организма, болезни желудочно–кишечного тракта (дисбактериоз, недуги печени и желчного пузыря).
Чаще всего при кандидозе возникают зуд и жжение, постоянные или усиливающиеся во второй половине дня, вечером, ночью, после длительной ходьбы. В области наружных половых органов — вплоть до расчесов. Сильный, постоянный зуд нередко ведет к бессоннице, неврозам, а также в сочетании с болью может нарушить мочеиспускание, создать болезненность и чувство жжения во влагалище, что приводит к дискомфорту в половой жизни. Еще один тревожный сигнал — выделения белого цвета.
У кандидоза 3 основные клинические формы.
Вы можете быть носителем инфекции. Как правило, это состояние бессимптомно и определяется лабораторными исследованиями мазков.
Кандидоз может быть и острым, тогда картина воспаления ярко выражена: покраснение, отек, высыпания в виде пузырьков на коже и слизистых оболочках наружных половых органов и влагалища, обильные характерные творожистоподобные выделения. Такое состояние длится не более 2 месяцев.
Третья форма — хронический (рецидивирующий) кандидоз, когда на коже и слизистых оболочках наружных половых органах и влагалища преобладают вторичные проявления в виде утолщения тканей. Возникновение хронического кандидоза врачи склонны объяснять состоянием организма больной, в частности, особенностями защитной системы влагалища. Нередко острый кандидоз переходит в хроническую форму, если тактика лечения или терапия были выбраны неверно, если пациентка просто положилась на широкую рекламу системных либо местных противогрибковых препаратов.
Возникновение хронического кандидоза врачи склонны объяснять состоянием организма больной, в частности, особенностями защитной системы влагалища. Нередко острый кандидоз переходит в хроническую форму, если тактика лечения или терапия были выбраны неверно, если пациентка просто положилась на широкую рекламу системных либо местных противогрибковых препаратов.
Между тем краткосрочные курсы самолечения без устранения возбудителя приводят к быстрому росту устойчивых форм.
Диагноз ставится при микроскопическом исследовании мазков, этот метод можно использовать в условиях обычных поликлиник, где нет специальных лабораторий. Культуральная диагностика («посев») играет важнейшую роль в постановке диагноза. Она позволяет установить вид грибка (что практически невозможно при микроскопии), а также определить количество дрожжевых клеток в единице объема. Но здесь уже необходимы наличие специализированной бактериологической лаборатории, соблюдение определенных правил взятия и доставки материала и время, несколько дней, в ожидании результатов роста грибка на питательных средах.
Следует подчеркнуть, что обнаружение грибков рода кандида в количестве менее 102 КОЕ/мл — не основание для назначения лечения при отсутствии клинических симптомов.
Лечение проводит гинеколог или дерматовенеролог.
Сейчас множество разнообразных противогрибковых препаратов, представленных в лекарственных формах как для интравагинального использования (свечи, таблетки, кремы и т.д.), так и для системного применения (таблетки, капсулы). При отсутствии эффекта от краткосрочных схем лечения стоит пересмотреть тактику и увеличить продолжительность противогрибковой терапии.
И пациентка с вагинальным кандидозом должна быть проинформирована: ее половому партнеру тоже рекомендуется обследование и при необходимости помощь врача.
Ольга ПЕРЕСАДА,
профессор кафедры акушерства и гинекологии БелМАПО, доктор медицинских наук.
Советская Белоруссия №142 (24525). Среда 30 июля 2014 года
- Show More
Кандидоз полости рта — словарь терминов и определений.

Наш QR код
Кандидоз слизистой оболочки полости рта – это поверхностное поражение дрожжеподобными грибами рода Candida. Слизистые оболочки и кожа человека считаются основным местом обитания этих грибов, но они относятся к условно-патогенной флоре. Это означает, что они могут «мирно» существовать с человеком, но при возникновении каких-то провоцирующих факторов развивается настоящее заболевание. Такими факторами являются сниженный иммунитет, длительный прием антибиотиков, хронические заболевания, наличие большого количества кариозных зубов, плохой уход за полостью рта, профессиональные вредности и пр.
Симптомы кандидоза полости рта
Течение заболевания может быть острым и хроническим, а клиническая картина может быть выраженной или стертой. Острая форма чаще всего продолжается 7-14 дней. На поверхности слизистой оболочки полости рта появляется белый налет. Он может иметь разный характер, но обычно напоминает мелкие крошки или капли свернувшегося молока. Именно поэтому это заболевание иногда называют молочницей. Слизистая оболочка становится легко ранимой, болезненной, может ощущаться чувство жжения. Сначала налет легко снимается шпателем, но через некоторое время появляется опять. При прогрессировании кандидоза налет снимается сложнее. Некоторые формы заболевания протекают практически без налета, но больные жалуются на дискомфорт в полости рта.
Именно поэтому это заболевание иногда называют молочницей. Слизистая оболочка становится легко ранимой, болезненной, может ощущаться чувство жжения. Сначала налет легко снимается шпателем, но через некоторое время появляется опять. При прогрессировании кандидоза налет снимается сложнее. Некоторые формы заболевания протекают практически без налета, но больные жалуются на дискомфорт в полости рта.
Лечение кандидоза полости рта
Лечение должно быть комплексным с назначением противогрибковой терапии. Дополнительно назначается местное лечение, витаминотерапия, препараты повышающие иммунитет и пр.
Профилактика кандидоза полости рта
Профилактика заключается в лечении хронических заболеваний, в рациональном питании, адекватном назначении антибактериальной терапии. Стоматологи тоже играют свою роль в профилактике кандидоза. Очень важно тщательно следить за гигиеной полости рта. В зубном налете скапливаются бактерии, которые будут неблагоприятным фактором для «соседей» грибов Candida. Убрать твердые зубные отложения и провести тщательную гигиену помогает профессиональная чистка зубов. Не следует запускать кариес. Большое количество «больных» зубов является дополнительным очагом инфекции. Проводите профилактические осмотры и своевременно лечите стоматологические заболевания. Обращайтесь к врачу при появлении любых жалоб.
Убрать твердые зубные отложения и провести тщательную гигиену помогает профессиональная чистка зубов. Не следует запускать кариес. Большое количество «больных» зубов является дополнительным очагом инфекции. Проводите профилактические осмотры и своевременно лечите стоматологические заболевания. Обращайтесь к врачу при появлении любых жалоб.
Вернуться назад
- 02-07-2022 У ребёнка началась смена зубов ?
- 25-06-2022 Удалили зуб, а потом поднялась температура — это осложнение? И что делать?
- 16-06-2022 Есть ли уневерсальный имплантат, который подойдёт всем ?
- 04-06-2022 — Лечите, а не терпите!
- 30-05-2022 Имплантация — самый лучший способ восстановления утраченных зубов.
- 19-05-2022 Давно не были у стоматолога?
- 06-05-2022 Почему зубы могут стать подвижными при лечении c помощью брекет-систем?
- 29-04-2022 EsCom Доступная цена, отличное качество!
- 17-04-2022 А вы знали, что можно вернуть себе часть потраченных на лечение денег?
- 20-03-2022 Выравнивание зубов элайнерами: это дольше чем ношение брекетов?
- 02-07-2022 У ребёнка началась смена зубов ?
- 25-06-2022 Удалили зуб, а потом поднялась температура — это осложнение? И что делать?
- 16-06-2022 Есть ли уневерсальный имплантат, который подойдёт всем ?
Посмотреть все новости
Наш QR-код
Кандидоз слизистой оболочки полости рта – это поверхностное поражение дрожжеподобными грибами рода Candida. Слизистые оболочки и кожа человека считаются основным местом обитания этих грибов, но они относятся к условно-патогенной флоре. Это означает, что они могут «мирно» существовать с человеком, но при возникновении каких-то провоцирующих факторов развивается настоящее заболевание. Такими факторами являются сниженный иммунитет, длительный прием антибиотиков, хронические заболевания, наличие большого количества кариозных зубов, плохой уход за полостью рта, профессиональные вредности и пр.
Слизистые оболочки и кожа человека считаются основным местом обитания этих грибов, но они относятся к условно-патогенной флоре. Это означает, что они могут «мирно» существовать с человеком, но при возникновении каких-то провоцирующих факторов развивается настоящее заболевание. Такими факторами являются сниженный иммунитет, длительный прием антибиотиков, хронические заболевания, наличие большого количества кариозных зубов, плохой уход за полостью рта, профессиональные вредности и пр.
Симптомы кандидоза полости рта
Течение заболевания может быть острым и хроническим, а клиническая картина может быть выраженной или стертой. Острая форма чаще всего продолжается 7-14 дней. На поверхности слизистой оболочки полости рта появляется белый налет. Он может иметь разный характер, но обычно напоминает мелкие крошки или капли свернувшегося молока. Именно поэтому это заболевание иногда называют молочницей. Слизистая оболочка становится легко ранимой, болезненной, может ощущаться чувство жжения. Сначала налет легко снимается шпателем, но через некоторое время появляется опять. При прогрессировании кандидоза налет снимается сложнее. Некоторые формы заболевания протекают практически без налета, но больные жалуются на дискомфорт в полости рта.
Сначала налет легко снимается шпателем, но через некоторое время появляется опять. При прогрессировании кандидоза налет снимается сложнее. Некоторые формы заболевания протекают практически без налета, но больные жалуются на дискомфорт в полости рта.
Лечение кандидоза полости рта
Лечение должно быть комплексным с назначением противогрибковой терапии. Дополнительно назначается местное лечение, витаминотерапия, препараты повышающие иммунитет и пр.
Профилактика кандидоза полости рта
Профилактика заключается в лечении хронических заболеваний, в рациональном питании, адекватном назначении антибактериальной терапии. Стоматологи тоже играют свою роль в профилактике кандидоза. Очень важно тщательно следить за гигиеной полости рта. В зубном налете скапливаются бактерии, которые будут неблагоприятным фактором для «соседей» грибов Candida. Убрать твердые зубные отложения и провести тщательную гигиену помогает профессиональная чистка зубов. Не следует запускать кариес. Большое количество «больных» зубов является дополнительным очагом инфекции. Проводите профилактические осмотры и своевременно лечите стоматологические заболевания. Обращайтесь к врачу при появлении любых жалоб.
Не следует запускать кариес. Большое количество «больных» зубов является дополнительным очагом инфекции. Проводите профилактические осмотры и своевременно лечите стоматологические заболевания. Обращайтесь к врачу при появлении любых жалоб.
Вернуться назад
Альмеда ! Клиника стоматологии и косметологии.
г. Санкт-Петербург, ул. Димитрова, д. 8, кор. 2
366-07-92, 366-07-93, 936-07-93
| Правовая информация | Пользовательское соглашение | Политика конфиденциальности |
цена в Amel Dental Clinic
Заболевание, которое называется кандидоз – это инфекционная болезнь, которую провоцирует грибок определенного рода. Этот вид грибков является обычным обитателем ротовой полости человека и не вызывает проблем до тех пор, пока в организме не происходят процессы, провоцирующие возникновение кандидоза. В первую очередь, это снижение иммунитета. Чаще всего кандидоз (молочница во рту) диагностируется у определенных групп людей – младенцев, кормящихся грудью и пожилых людей.
В первую очередь, это снижение иммунитета. Чаще всего кандидоз (молочница во рту) диагностируется у определенных групп людей – младенцев, кормящихся грудью и пожилых людей.
К факторам, которые провоцируют развитие кандидоза, специалисты клиники Amel Dental Clinic относят:
1
Отсутствие постоянного ухода за зубами и не соблюдение гигиены в ротовой полости.
2
Индивидуальные особенности строения языка человека, например, складки.
3
Различные хронические заболевания, ослабляющие иммунитет.
4
Беременность.
5
Употребление табака.
6
Нехватка витаминов в организме.
7
Последствия облучения.
Факторов, которые провоцируют кандидоз во рту, множество, и врач обязан установить причину для назначения эффективного лечения и купирования повторного возникновения заболевания.
Оральный кандидоз у разных пациентов может проявляться разной симптоматикой, характером течения заболевания.
Грибковое поражение слизистой полости рта может иметь разные формы:
1
Острый кандидоз.
2
Хронический.
При этом острый кандидоз бывает псевдомембранозный и атрофический, а хроническая молочница также имеет две формы: атрофический кандидоз и гиперпластический.
Псевдомембранозный – поражение слизистой оболочки, которое может протекать без выраженных симптомов. При неосложненном течении заболевания возможно появление на слизистой рта единичной или нескольких бляшек с белым налетом, которые легко удаляются путем соскабливания, открывая покрасневший, воспаленный участок слизистой. В редких случаях возможно слияние единичных бляшек и образование больших областей поражения с утолщением тканей. Подобное осложнение встречается у грудничков и людей, прошедших длительный курс антибактериальной, гормональной, иммуноподавляющей терапии.
Атрофический кандидоз в острой форме протекает с выраженной соматической симптоматикой – сильное жжение, сухость, покраснение слизистой. Пациенты жалуются на появление кислого, соленого, горького или металлического привкуса во рту. Чаще всего причиной заболевания является прохождение до этого медикаментозной терапии. Хронический атрофический кандидоз, в отличие от острого, чаще развивается после установки и в процессе ношения ортопедических конструкций (зубных протезов).
Хронический гиперпластический кандидоз – заболевание, которое поражает разные участки полости рта. Бляшки с белой пленкой образуются на спинке языка, на губах, на слизистой щек, в уголках губ, на мягком участке неба. Со временем происходит огрубение поверхности кандид, патологически измененные ткани врастают в слизистую и их удаление становится невозможным.
Симптомы кандидозаВ острой форме кандидоз горла и полости рта чаще всего развивается у новорожденных детей. На начальном этапе в ротовой полости возникает сыпь в виде маленьких точек белого цвета. Впоследствии заболевание распространяется на большую площадь, поражает небо, миндалины. Слизистая покрывается сплошной белой пленкой. Белый налет во рту легко снимается. Под пленкой находится воспаленный участок красного цвета, который в некоторых случаях кровоточит.
Впоследствии заболевание распространяется на большую площадь, поражает небо, миндалины. Слизистая покрывается сплошной белой пленкой. Белый налет во рту легко снимается. Под пленкой находится воспаленный участок красного цвета, который в некоторых случаях кровоточит.
Возникают кандиды во рту безболезненно, однако, при их травмировании либо проникновении в открытые ранки инфекции, может появиться болезненное ощущение. В таких случаях на месте раздражения могут возникнуть язвы, места поражения покрываются налетом коричневого либо бурого цвета.
Врачи Amel Dental Clinic отмечают, что хроническая форма заболевания нередко возникает у пациентов, страдающих ВИЧ-инфекцией. В этом случае лечение кандидоза полости рта затруднено общим состоянием здоровья пациента, раздражение является болезненным и вызывает сильную сухость во рту, жжение и другие неприятные ощущения.
Кандидоз, который возникает в уголках рта, в быту называют «заедами». Это неприятное явление, которое сопровождается трещинами и болезненными ощущениями. Оно может быть вызвано частым облизыванием уголков рта, частым употреблением жевательной резинки, привычкой держать во рту пальцы (у детей).
Оно может быть вызвано частым облизыванием уголков рта, частым употреблением жевательной резинки, привычкой держать во рту пальцы (у детей).
При обнаружении симптомов кандидоза, необходимо обратиться к врачу. В клинике Amel Dental Clinic специалисты занимаются лечением кандидоза по современным методикам с использованием эффективных медикаментов и оборудования.
В первую очередь врач устанавливает причину возникновения заболевания и предрасположенность пациента к аллергическим реакциям на назначенные препараты. Далее назначаются антимикотические препараты, то есть те, которые борются с причиной возникновения заболевания – грибковой инфекцией. Кроме того, после определения, как лечить кандидоз полости рта, врач может выписать антисептические медикаменты, призванные устранить высыпание во рту и защитить рану от проникновения дополнительных вирусов.
Маленьким пациентам клиники Amel Dental Clinic, специалисты рекомендуют дополнительную обработку посуды и сосок слабым раствором соды для обеззараживания. Назначается строгая диета при кандидозе у детей – исключаются сладости, например, мед, печенье и другие продукты, содержащие углеводы.
Назначается строгая диета при кандидозе у детей – исключаются сладости, например, мед, печенье и другие продукты, содержащие углеводы.
Продолжительность периода лечения составляет 2-3 недели в зависимости от степени заболевания и особенностей пациента. После завершения лечения врачи клиники Amel Dental рекомендуют следить за гигиеной ротовой полости, регулярно проводить профессиональную чистку зубов, отказаться от курения и укреплять общий иммунитет. Эти простые действия помогут предотвратить повторное возникновение заболевания.
Профилактика кандидоза во ртуМолочница на языке – заболевание, которого можно избежать, если соблюдать следующие правила:
1
Обеспечить тщательную и регулярную гигиену полости рта (чистка зубов утром и вечером, использование зубной нити, межзубных ершиков, ирригатора для максимально качественного ухода во всех уголках рта).
2
Не реже 2 раз в год проходить осмотр у стоматолога.
 Профилактический осмотр позволяет диагностировать любые воспалительные процессы на ранней стадии без осложнений. Людям, которые проходят ортодонтическое лечение,у которых есть протезы в полости рта, нужно посещать стоматологию как минимум 4 раза в год.
Профилактический осмотр позволяет диагностировать любые воспалительные процессы на ранней стадии без осложнений. Людям, которые проходят ортодонтическое лечение,у которых есть протезы в полости рта, нужно посещать стоматологию как минимум 4 раза в год.3
После каждого приема пищи, после использования ингалятора нужно прополоскать рот.
4
Отказаться от курения.
5
Следить за своим здоровьем, держать под контролем хронические заболевания. Если проходите лечение, необходимо выполнять рекомендации врачей – это поможет избежать осложнений, в том числе таких, как развитие кандидоза слизистой в полости рта.
Выбор антимикотических препаратов при комплексном лечении пациентов с кандидозом полости рта
М. О. Нагаева
к. м. н., доцент кафедры терапевтической стоматологии ГОУ ВПО ОмГМА Минздрава РФ
М. Г. Чеснокова
д. м. н., профессор, кафедра микробиологии, вирусологии и иммунологии ГОУ ВПО ОмГМА Минздрава РФ
И.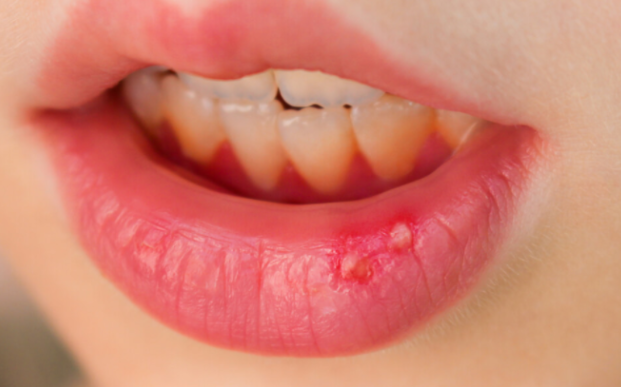 В. Анисимова
В. Анисимова
к. м. н., ассистент кафедры терапевтической стоматологии ГОУ ВПО ОмГМА Минздрава РФ
Истинная заболеваемость кандидозом полости рта в России неизвестна, поскольку он официально не регистрируется, поэтому публикации по этой проблеме в отечественной литературе немногочисленны [5]. Колонизация слизистых оболочек грибами Сandida у практически здоровых людей колеблется от 15 до 40 % и может возрасти до 80 % на фоне какой-либо патологии.
Актуальность исследования
Усиленный рост гриба, приводящий к развитию кандидоза, наблюдается при нарушении местного и системного иммунитета.
Возможно и экзогенное заражение. Поверхностный кандидоз слизистых возникает и у практически здоровых лиц. Глубокий кандидоз развивается при тяжелом иммунодефиците на фоне кандидозного стоматита, глоссита или фарингита. Через поврежденную слизистую грибы проникают в кровь, вызывая фунгемию и сепсис.
Лечение кандидоза должно быть индивидуальным для каждого больного с учетом локализации и остроты процесса и возможности наличия хронической стадии заболевания, с учетом иммунного статуса, наличия других заболеваний. Этиотропное лечение является наиболее важной составляющей комплексного лечения больных с кандидозом полости рта. Эрадикация возбудителя — первое мероприятие, после которого можно переходить к профилактике рецидивов и коррекции местных и общих предрасполагающих факторов. Этиотропная терапия может быть местной (в случае изолированного кандидозного поражения полости рта) и системной (при распространении инфекционного процесса на нижерасположенные отделы пищеварительного тракта, кожу, другие слизистые оболочки). Системная терапия кандидоза слизистой оболочки полости рта назначается, как правило, только при определенных показаниях: хронический гиперпластический кандидоз, эрозивно-язвенная форма кандидоза; кандидоз полости рта на фоне сахарного диабета, иммунодефицитного состояния; при неэффективной местной терапии.
Этиотропное лечение является наиболее важной составляющей комплексного лечения больных с кандидозом полости рта. Эрадикация возбудителя — первое мероприятие, после которого можно переходить к профилактике рецидивов и коррекции местных и общих предрасполагающих факторов. Этиотропная терапия может быть местной (в случае изолированного кандидозного поражения полости рта) и системной (при распространении инфекционного процесса на нижерасположенные отделы пищеварительного тракта, кожу, другие слизистые оболочки). Системная терапия кандидоза слизистой оболочки полости рта назначается, как правило, только при определенных показаниях: хронический гиперпластический кандидоз, эрозивно-язвенная форма кандидоза; кандидоз полости рта на фоне сахарного диабета, иммунодефицитного состояния; при неэффективной местной терапии.
Перечень антигрибковых препаратов огромен, и с каждым годом появляются новые препараты в виде ополаскивателей, растворов, таблетированных форм. Основную группу специфических препаратов составляют антимикотические средства, однако на сегодняшний день чувствительность к ним грибов Candida неодинаковая, а зачастую недостаточная. Тем не менее тесты на чувствительность не считаются рутинной процедурой, не всегда доступны и обычно не рассматриваются как стандартная методика в ведении больного. Тесты на чувствительность считаются полезными в тех случаях, когда мы имеем дело с глубокими инфекциями, обусловленными non-albicans видами Candida. В этих случаях, особенно если больного предварительно уже лечили антифунгальными азолами, должна быть рассмотрена возможность микробиологической резистентности.
Тем не менее тесты на чувствительность не считаются рутинной процедурой, не всегда доступны и обычно не рассматриваются как стандартная методика в ведении больного. Тесты на чувствительность считаются полезными в тех случаях, когда мы имеем дело с глубокими инфекциями, обусловленными non-albicans видами Candida. В этих случаях, особенно если больного предварительно уже лечили антифунгальными азолами, должна быть рассмотрена возможность микробиологической резистентности.
Целью нашего исследования явилось определение чувствительности к антимикотикам штаммов грибов рода Сandida, выделенных у больных оральным кандидозом.
Материалы и методы
На базе кафедры терапевтической стоматологии ОмГМА и ГКСП № 1 г. Омска нами проведено клиническое обследование 48 пациентов с жалобами на боль и жжение в слизистой оболочке полости рта. Обследование проводилось согласно алгоритму, предложенному Недосеко В. Б., Анисимовой И. В. (2003) [3].
В комплексном обследовании пациентов проводилось микробиологическое исследование материала, полученного путем соскоба со слизистой оболочки спинки языка.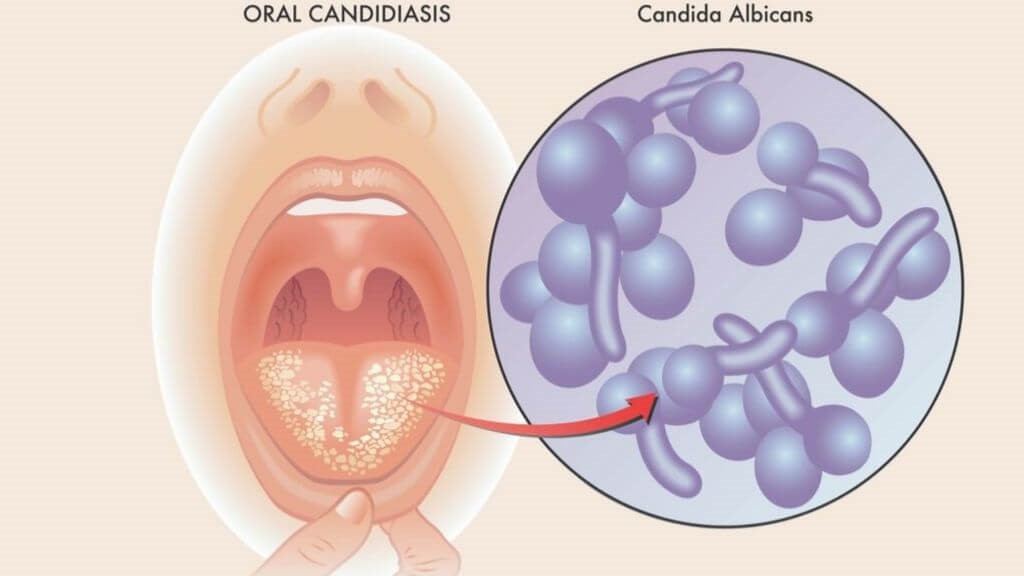 Забор биоматериала осуществлялся до назначения лечебных мероприятий сухим стерильным тампоном без использования транспортной среды. Перед взятием микробиологического материала пациентам рекомендовали воздержаться от приема пищи и гигиенических процедур. Микробиологический материал помещался в стерильную транспортную пробирку и в течение двух часов доставлялся в баклабораторию. С целью выделения факультативно-анаэробных микроорганизмов, дрожжеподобных грибов рода Candida биоматериал засевали на питательные среды. Готовили серию последовательных двукратных разведений материала с 102 по 1012. Для выделения стафилококков осуществляли посев соответствующих разведений на желточно-солевой агар, для выявления стрептококков проводили посев на кровяной агар с азидом натрия. Для выделения бактерий рода Haemophilus и Neisseria материал засевали на шоколадный агар с линкомицином, энтеробактерий — на среду Эндо, для обнаружения энтерококков использовали энтерококковый агар.
Забор биоматериала осуществлялся до назначения лечебных мероприятий сухим стерильным тампоном без использования транспортной среды. Перед взятием микробиологического материала пациентам рекомендовали воздержаться от приема пищи и гигиенических процедур. Микробиологический материал помещался в стерильную транспортную пробирку и в течение двух часов доставлялся в баклабораторию. С целью выделения факультативно-анаэробных микроорганизмов, дрожжеподобных грибов рода Candida биоматериал засевали на питательные среды. Готовили серию последовательных двукратных разведений материала с 102 по 1012. Для выделения стафилококков осуществляли посев соответствующих разведений на желточно-солевой агар, для выявления стрептококков проводили посев на кровяной агар с азидом натрия. Для выделения бактерий рода Haemophilus и Neisseria материал засевали на шоколадный агар с линкомицином, энтеробактерий — на среду Эндо, для обнаружения энтерококков использовали энтерококковый агар.
Для выделения грибов рода Candida биоматериал засевали на среду Сабуро, Кандиселект.
Для идентификации грибов оценивали культуральные свойства на среде Кандисилект, биохимическую идентификацию проводили с помощью тест-системы «Ауксоколор».
Для определения чувствительности дрожжеподобных грибов рода Candida к антимикотическим препаратам (нистатин, амфотерицин В, клотримазол, флуконазол, итраконазол) использовали классический дискодиффузионный метод и Фунгитест.
Для постановки дискодиффузионного метода готовили взвесь культуры в изотоническом растворе хлорида натрия, 1 мл взвеси выливали на поверхность среды Мюллера — Хинтона. Учет результатов проводили путем измерения диаметра зоны подавления роста культуры к антимикотику.
Для проведения Фунгитеста готовили суспензию грибов из чистой культуры, выросшей на среде Сабуро, — первый калиброванный инокулят с мутностью, соответствующей стандарту 3 х 106 грибов/мл.
Разведение первичного раствора 1:20 добавляли в суспензионную среду для получения стандартного инокулята (103 КОЕ/мл). Стандартный инокулят вносили в лунки микропланшета. Инкубировали в течение 48 часов.
Инкубировали в течение 48 часов.
Результаты исследования и их обсуждение
При обследовании 48 пациентов нами было выявлено 23 пациента с признаками орального кандидоза. Все пациенты предъявляли жалобы на боль, жжение, сухость во рту. У 60,8 % (14 пациентов) выявлялись клинические признаки хронического атрофического кандидоза (рис. 1), у 39,2 % (9 пациентов) был обнаружен хронический гиперпластический кандидоз (рис. 2).
Рис. 1. Пациентка К., 65 лет. Хронический атрофический кандидоз полости рта
Рис. 2. Пациентка И., 69 лет. Хронический гиперпластический кандидоз полости рта. Кандидозная заеда
В результате микробиологического исследования материала из полости рта 23 пациентов выделено и идентифицировано 75 штаммов условно патогенных микроорганизмов (48 штаммов Candida albicans, 27 штаммов условно патогенных бактерий). Большинство выделенных микроорганизмов высевалось в значимых концентрациях (104 КОЕ — 29,3 %, 106 КОЕ 40,0 %, 108 КОЕ — 22,7 %). При этом Candida albicans наиболее часто встречалась в ассоциации с S. epidermidis (104 КОЕ, 106 КОЕ), с E. faecalis (104 КОЕ, 106 КОЕ), S. salivarius (106 КОЕ). В ходе определения чувствительности грибов Candida аlbicans к антимикотическим препаратам выявлено 18 (37,5 %) штаммов с признаками резистентности. Наибольшая устойчивость выделенных штаммов грибов определялась к нистатину (33 % чувствительных штаммов) (рис. 3).
epidermidis (104 КОЕ, 106 КОЕ), с E. faecalis (104 КОЕ, 106 КОЕ), S. salivarius (106 КОЕ). В ходе определения чувствительности грибов Candida аlbicans к антимикотическим препаратам выявлено 18 (37,5 %) штаммов с признаками резистентности. Наибольшая устойчивость выделенных штаммов грибов определялась к нистатину (33 % чувствительных штаммов) (рис. 3).
Рис. 3. Чувствительность к антимикотикам в дискодиффузионном методе
Чувствительность Candida аlbicans к итраконазолу, кетоконазолу, 5 флюороцитазину и миконазолу составила 100 % (рис. 3, 4).
Рис. 4. Чувствительность к антимикотикам в методе «Фунгитест»
При определении чувствительности к флуконазолу дискодиффузионным методом выявлено 94,4 % чувствительных к флуконазолу штаммов. При использовании метода «Фунгитест» чувствительность к флуконазолу в концентрации 8 составила 88,8 %, к флуконазолу в концентрации 64 — 100 %. К клотримазолу проявляли чувствительность 94,4 % штаммов C. аlbicans. Все выделенные штаммы были чувствительны к амфотерицину В(64), к амфотерицину В(8) — лишь 66,6 % штаммов. При определении чувствительности дискодиффузионным методом к амфотерицину В проявляли чувствительность 77,4 % исследуемых штаммов.
При определении чувствительности дискодиффузионным методом к амфотерицину В проявляли чувствительность 77,4 % исследуемых штаммов.
Заключение
При назначении этиотропного лечения пациентам с оральным кандидозом необходимо учитывать результаты микологического исследования с определением чувствительности к антимикотическим препаратам, так как у выделенных штаммов Candida аlbicans в 37 % случаев выявлена резистентность к антимикотикам. При выборе метода определения чувствительности к противогрибковым препаратам необходимо учитывать, что дискодиффузионный метод является ориентировочным, Фунгитест обладает выраженной специфичностью и высокой чувствительностью. Кроме того, методы отличаются спектром антимикотиков. Таким образом, для обеспечения оптимального выбора противогрибковых препаратов в практике можно рекомендовать использование двух методов — как дискодиффузионного, так и метода «Фунгитест».
ФАРМАТЕКА » Применение препарата Стоматофит в комплексном лечении кандидоза слизистой оболочки рта
Кандидоз является одним из наиболее распространенных заболеваний слизистой оболочки рта. Наряду с применением химиотерапевтических противогрибковых препаратов повышению эффективности его лечения способствует включение в комплекс растительного препарата Стоматофит.
Наряду с применением химиотерапевтических противогрибковых препаратов повышению эффективности его лечения способствует включение в комплекс растительного препарата Стоматофит.
Кандидоз слизистой оболочки рта является актуальной проблемой современной стоматологии, т.к. распространенность этого заболевания постоянно растает. По данным А.В. Шумского (1998), кандидоз занимает третье место среди всех заболеваний, проявляющихся на слизистой оболочке рта. Кандидоз полости рта (код Международной классификации болезней 10-го пересмотра – В37.0) считается проявлением снижения иммунитета, и вызывают его сапрофитные микроорганизмы Candida, наиболее часто встречаются C. albicans, C. tropicalis, C. parapsilosia, C. glabrata. C. albicans обнаруживается в полости рта примерно у 60 % здоровых взрослых, чаще у женщин и курящих мужчин. Другие виды составляют от 10 до 20 % всех случаев орального кандидоносительства. При кандидозе полости рта у ВИЧ-инфицированных, больных сахарным диабетом и онкологических больных чаще встречаются более редкие виды [1]. Основное отличие кандидоза от остальных оппортунистических микозов заключается в том, что он является преимущественно эндогенной инфекцией: С. albicans и другие виды Candida обитают в кишечнике, на коже и слизистых оболочках. Известно, что к колонизации грибами рода Candida склонны пациенты с хроническим пародонтитом, множественным кариесом, ксеростомией, связанной с гипофункцией слюнных желез. Процент колонизации повышается у пациентов пожилого и старческого возраста, особенно это актуально для тех, кто носит протезы и не обеспечивает должного гигиенического ухода за полостью рта [2]. Особенности сосущестовования грибов с макроорганизмом зависят от его состояния, количества патогенных грибов и степени их патогенности. Факторами, предрасполагающими к развитию кандидоза слизистой оболочки рта, сегодня считают механические микротравмы слизистой оболочки, явления гальваноза полости рта, нарушения обмена веществ, соматические заболевания, вторичные иммунодефицитные состояния. Важную роль играют и нерациональная антибиотикотерапия, длительное лечение кортикостероидами, цитостатиками.
Основное отличие кандидоза от остальных оппортунистических микозов заключается в том, что он является преимущественно эндогенной инфекцией: С. albicans и другие виды Candida обитают в кишечнике, на коже и слизистых оболочках. Известно, что к колонизации грибами рода Candida склонны пациенты с хроническим пародонтитом, множественным кариесом, ксеростомией, связанной с гипофункцией слюнных желез. Процент колонизации повышается у пациентов пожилого и старческого возраста, особенно это актуально для тех, кто носит протезы и не обеспечивает должного гигиенического ухода за полостью рта [2]. Особенности сосущестовования грибов с макроорганизмом зависят от его состояния, количества патогенных грибов и степени их патогенности. Факторами, предрасполагающими к развитию кандидоза слизистой оболочки рта, сегодня считают механические микротравмы слизистой оболочки, явления гальваноза полости рта, нарушения обмена веществ, соматические заболевания, вторичные иммунодефицитные состояния. Важную роль играют и нерациональная антибиотикотерапия, длительное лечение кортикостероидами, цитостатиками. Кандидоз слизистой оболочки рта можно рассматривать как проявление дисбактериоза, причем именно нерациональная антибиотикотерапия, которая приводит к подавлению многих микроорганизмов, устраняет их антагонистическое влияние на грибы рода Candida. Особенно это актуально по отношению к антибиотикам широкого спектра, которые подавляют лактобациллы, являющиеся физиологическими антагонистами дрожжеподобных грибов. Антибиотики могут вызвать развитие кандидоза при любом способе введения, но наиболее негативные последствия возникают от их местного применения. Наименьшее количество осложнений наблюдается при пероральном и парентеральном путях введении антибиотиков курсами не более недели.
Кандидоз слизистой оболочки рта можно рассматривать как проявление дисбактериоза, причем именно нерациональная антибиотикотерапия, которая приводит к подавлению многих микроорганизмов, устраняет их антагонистическое влияние на грибы рода Candida. Особенно это актуально по отношению к антибиотикам широкого спектра, которые подавляют лактобациллы, являющиеся физиологическими антагонистами дрожжеподобных грибов. Антибиотики могут вызвать развитие кандидоза при любом способе введения, но наиболее негативные последствия возникают от их местного применения. Наименьшее количество осложнений наблюдается при пероральном и парентеральном путях введении антибиотиков курсами не более недели.
Так как кандидоз служит проявлением снижения иммунитета и сопровождается дисбиотическими изменениями, его лечение остается сложной задачей. Именно поэтому лечение кандидоза должно не только быть индивидуальным и комплексным, но и включать общее и местное воздействия. Этиотропную терапию следует проводить с применением противогрибковых препаратов классов макролидов и азолов, а для местного применения желательно использовать принципы фитотерапии. Такая тенденция связана с тем, что самостоятельное или неправильное применение противогрибковых средств стимулирует возникновение штаммов грибов, резистентных к антимикотикам. Именно поэтому актуально использование растительных препаратов с высокой эффективностью и низкой токсичностью. Фитопрепараты рекомендовано применять и для устранения явлений дисбиоза, запаха изо рта и воспаления слизистой оболочки рта и пародонта.
Такая тенденция связана с тем, что самостоятельное или неправильное применение противогрибковых средств стимулирует возникновение штаммов грибов, резистентных к антимикотикам. Именно поэтому актуально использование растительных препаратов с высокой эффективностью и низкой токсичностью. Фитопрепараты рекомендовано применять и для устранения явлений дисбиоза, запаха изо рта и воспаления слизистой оболочки рта и пародонта.
В комплексном лечении кандидоза полости рта эффективно применение препарата Стоматофит®. Данный препарат получают экстракцией растительного сырья (цветков ромашки, коры дуба, листьев шалфея, травы арники, корневищ аира, травы мяты перечной, травы тимьяна обыкновенного) спиртом этиловым 70 %.
Препарат Стоматофит® мы применили к 6 пациентам, стоящим на учете в гастроэнтерологическом отделении с многократно рецидивирующим кандидозом слизистой оболочки рта с установленным диагнозом «кандидоз слизистой оболочки рта». Пациентки (средний возраст – 61 год) предъявляли жалобы на жжение в полости рта, особенно по утрам. В анамнезе неоднократное лечение пероральными противогрибковыми препаратами. При осмотре у всех пациенток выявлена гипосаливация, свободной слюны в полости рта нет или она присутствует в виде пенистых скудных фрагментов, слизистая оболочка истончена, атрофична (рис. 1). Язык, как правило, сильно обложен, иногда окрашен пищевыми пигментами (рис. 2). Всех пациенток, имеющих в полости рта разнородные металлы, направляли на изучение разности потенциалов. Обнаружено, что разность потенциалов наших пациенток составляла от 181 до 246 мВ при норме до 100 мВ. Кандидоз полости рта подтвержден на основании микроскопического исследования соскобов слизистой оболочки щек и спинки языка. Определена чувствительность всех пациенток к противогрибковым препаратам, после чего выбрано основное средство лечения кандидоза.
В анамнезе неоднократное лечение пероральными противогрибковыми препаратами. При осмотре у всех пациенток выявлена гипосаливация, свободной слюны в полости рта нет или она присутствует в виде пенистых скудных фрагментов, слизистая оболочка истончена, атрофична (рис. 1). Язык, как правило, сильно обложен, иногда окрашен пищевыми пигментами (рис. 2). Всех пациенток, имеющих в полости рта разнородные металлы, направляли на изучение разности потенциалов. Обнаружено, что разность потенциалов наших пациенток составляла от 181 до 246 мВ при норме до 100 мВ. Кандидоз полости рта подтвержден на основании микроскопического исследования соскобов слизистой оболочки щек и спинки языка. Определена чувствительность всех пациенток к противогрибковым препаратам, после чего выбрано основное средство лечения кандидоза.
Всем пациенткам рекомендовали соблюдать гигиену полости рта с чисткой межзубных промежутков и обязательной чисткой языка. Для ротовых ванночек применен растительный препарат Стоматофит®, 7,5 мл которого предварительно разведены в 50 мл воды. Противопоказанием к назначению препарата Стоматофит® была повышенная чувствительность к компонентам препарата. Для коррекции местного иммунного статуса пациенткам назначено курсовое применение таблеток Имудон.
Противопоказанием к назначению препарата Стоматофит® была повышенная чувствительность к компонентам препарата. Для коррекции местного иммунного статуса пациенткам назначено курсовое применение таблеток Имудон.
Облегчение состояния и ослабление жжения наступили уже на второй день активного лечения препаратом Стоматофит®. Пациентки отмечали приятное пенообразование препарата, его растительный вкус.
На основании нашего опыта применения препарата Стоматофит® можно заключить, что это эффективный природный препарат и может быть включен в комплексное лечение пациентов с кандидозом слизистой оболочки рта.
И.М. Макеева – д.м.н., декан стоматологического факультета ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова» Минздрава России; e-mail: [email protected]
А. В. Арзуканян – врач-ординатор кафедры терапевтической стоматологии ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова» Минздрава России
В. Арзуканян – врач-ординатор кафедры терапевтической стоматологии ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова» Минздрава России
Совершенствование методов лабораторной диагностики и обоснование терапии кандидоза слизистой оболочки полости рта
На правах рукописи
УДК 616.311-002.72-07-085 СУРКОВА Светлана Александровна
СОВЕРШЕНСТВОВАНИЕ МЕТОДОВ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ И ОБОСНОВАНИЕ ТЕРАПИИ КАНДИДОЗА СЛИЗИСТОЙ ОБОЛОЧКИ ПОЛОСТИ РТА
14.01.14-Стоматология (мед. науки) 03.02.03 — Микробиология (мед. науки)
АВТОРЕФЕРАТ
диссертации на соискание учёной степени кандидата медицинских наук
О МАЯ 2013
00506057т
Москва -2013
005060571
Работа выполнена в Государственном бюджетном образовательном учреждении высшего профессионального образования «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Министерства здравоохранения Российской Федерации (ГБОУ ВПО МГМСУ им. А.И. Евдокимова Минздрава России)
А.И. Евдокимова Минздрава России)
Научные руководители:
Доктор медицинских наук, профессор Ушаков Рафаэль Васильевич Доктор медицинских наук, профессор Царёв Виктор Николаевич Официальные оппоненты:
Максимовская Людмила Николаевна, заслуженный врач России, доктор медицинских наук, профессор (ГБОУ ВПО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России, заведующая кафедрой стоматологии общей практики ФПДО)
Червинец Вячеслав Михайлович, доктор медицинских наук, профессор (ГБОУ ВПО «Тверская государственная медицинская академия» Минздрава России, заведующий кафедрой микробиологии, вирусологии, иммунологии).
Ведущая организация: ГБОУ ДПО «Институт повышения квалификации Федерального медико-биологического агентства России»
Защита состоится «_» 2013 г. в_часов на заседании диссертационного
совета Д 208.041.07, созданного на базе ГБОУ ВПО МГМСУ имени А.И. Евдокимова Минздрава России по адресу: Москва, ул. »’ 2013 г.
»’ 2013 г.
Ученый секретарь диссертационного совета кандидат медицинских наук, доцент
О.П. Дашкова
ОБАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы.
В настоящее время проблема воспалительных заболеваний слизистой оболочки полости рта и тканей пародонта занимает одно из ведущих мест в современной стоматологии. (Максимовский Ю.М., 1997; Иванов B.C., 2001; Барер Г.М., 2006). Однако, эффективность методов лечения (терапевтического, пародонтологического, хирургического), существенно снижается при развитии воспалительных процессов, ассоцированных с дрожжевыми грибами рода кандида (Олейник И.И., 1991, 2000; Тимирбаев М.А., 1999, 2009; Плахтий Л.Я., 2004; Царёв В.Н., 2006,2009).
Торпидные (устойчивые) к лечению формы заболеваний СОПР и пародонта в последние годы встречаются всё чаще, что по данным современной литературы, может быть связано с активизацией грибковой микрофлоры (Дмитриева JI.A., Чернышова C.B., 2000; Царёв В.Н., 2006, 2009). В зарубежной литературе, а в последние годы, также и у отечественных авторов появился термин — кандида-ассоциированный пародонтит (J.Vinkelhoff, 1996; Waltimo Т.М. е.а., 2000). Как отмечает в своих исследованиях Носик A.C. (2004), микотическое воспаление тканей пародонта отличается от хронического пародонтита бактериальной этиологии проникновением псевдомицелия в десневой эпителий и более глубокие ткани пародонта.
В зарубежной литературе, а в последние годы, также и у отечественных авторов появился термин — кандида-ассоциированный пародонтит (J.Vinkelhoff, 1996; Waltimo Т.М. е.а., 2000). Как отмечает в своих исследованиях Носик A.C. (2004), микотическое воспаление тканей пародонта отличается от хронического пародонтита бактериальной этиологии проникновением псевдомицелия в десневой эпителий и более глубокие ткани пародонта.
Слизистая оболочка полости рта и ткани пародонта подвергаются специфической грибковой патологией в связи с неправильным выбором антибактериальной терапии, что ведет в свою очередь к развитию дисбиоза и иммуноспецифическим ситуациям различного генеза. Как оказалось, многие химиопрепараты и антибиотики, эффективные в отношении пародонтопатогенных видов бактерий, действуют негативно механизмы иммунной защиты и, тем самым, приводить к прогрессированию микотического процесса в организме (Бажанов H.H., Тер-Асатуров Г.П.,
2000; Хмельницкий O.K., 2002; Ахмедов Г. Д. с соавт., 2010; Караулов A.B. с соавт., 2012).
Д. с соавт., 2010; Караулов A.B. с соавт., 2012).
Углубленное изучение основных причин возникновения и механизмов развития кандидо-ассоциированных процессов в современной отечественной медицинской литературе мы не обнаружили. Новые дальнейшие исследования в области современных микологических и молекулярных методов открывают перспективы совершенствования не только диагностики, но и лечения, в частности, разработки алгоритмов применения новых химиопрепаратов фунгицидного (противогрибкового) действия.
К сожалению, местное применение антимикотиков в виде инстилляций, наложения повязок или применения гелевых форм, не даёт стойкого лечебного эффекта, поэтому, приоритетными являются сегодня работы по внедрению новых антимикотиков — из группы триазоловых производных (итраконазол, флюконазол, вориконазол) и производных тербинафина (ламизил). Как свидетельствуют данные литературы, последние при кандидозе менее эффективны.
Комплексного исследования по обоснованию применения или по оценке сравнительной эффективности перечисленных фунгицидных химиопрепаратов при кандидозе СОПР с применением современных микологических, иммунологических и молекулярно-биологических методов не проводилось. Исследования именного такого рода могут существенно продвинуть вперёд решение проблемы борьбы с микотическими процессами, которые крайне актуальны для современной стоматологии, особенно, в современных условиях высокой частоты иммунодефицитных ситуаций.
Исследования именного такого рода могут существенно продвинуть вперёд решение проблемы борьбы с микотическими процессами, которые крайне актуальны для современной стоматологии, особенно, в современных условиях высокой частоты иммунодефицитных ситуаций.
Учитывая это, цель нашей работы — совершенствование комплексной диагностики кандидозных процессов полости рта и персонификация выбора фунгицидных и иммуномодулирующих химиопрепаратов для лечения пациентов на основании анализа результатов клинико-лабораторного, микологического (культурального), иммунологического и молекулярно-биологического методов исследования.
4
Задачи исследования
1. Дать комплексную характеристику клинико-лабораторных данных и уточнить дифференциально-диагностические признаки кандидоза у пациентов стоматологического профиля.
2. Испытать новые хромогенные питательные среды для ускоренной диагностики кандидоза, дифференциации и видовой идентификации дрожжевых грибов, встречающихся при воспалительных процессах рта.
3. Провести анализ чувствительности и резистентности возбудителей кандидоза in vitro к антимикотикам и обосновать их применение для лечения кандидоза.
4. Провести сравнительную оценку чувствительности и специфичности отечественного набора реактивов для мультиплексной молекулярной диагностики кандидоза по сравнению с культуральным микологическим методом.
5. Провести выбор методов оценки иммунитета у больных кандида-ассоциированными воспалительными процессами полости рта и сопоставить их с данными молекулярного и культурального микологического исследования.
6. Изучить клиническую эффективность современных фунгицидных препаратов активных в отношении потенциальных возбудителей кандидоза, разработать параметры оценки эффективности их применения и алгоритм проведения этиотропной терапии.
Научная новизна
Уточнёна видовая принадлежность дрожжевых грибов рода кандида, встречающихся при кандидозе СОПР — впервые при данной патологии у стоматологических пациентов выделены и идентифицированы представители видов С. а, Индия).
а, Индия).
Обосновано применение иммуноферментного анализа для выявления различных форм кандидоза слизистой оболочки полости рта (кандидозного стоматита и пародонтита).
Разработан алгоритм применения фунгицидных и иммуномодулирующих препаратов в комплексном лечении кандида-ассоциированных воспалительных процессов полости рта.
Проведена клиническая и микробиологическая (микологическая) оценка эффективности химиотерапии кандида-ассоциированного стоматита с использованием сочетания флюконазола и иммуномодулирующего препарата ликопида. .
Практическая значимость
Уточнены клинико-лабораторные патогмоничные признаки кандида-ассоциированных воспалительных процессов полости рта.
Апробированы новые дифференциально-диагностические хромогенны среды для ускоренной видовой идентификации возбудителей кандидоза.
Обоснована эффективность новой диагностической тест-системь (набора реактивов) для быстрой и эффективной индикации возбудителе? кандидоза с помощью ПЦР.
Изучена возможность применения ИФА для диагностики кандида ассоциированных воспалительных процессов полости рта.
Внедрён алгоритм диагностики и показания для комбинированног лечения кандидоза, включающей использование фунгицидных иммуномодулирующих препаратов.
б
Положения, выносимые на защиту
1. Комплексная диагностика кандидоза базируется на результатах клинических исследований с учётом данных анамнеза, лабораторного обследования, включая иммуно-ферментное определение АТ к кандида (скрининговый экспресс-метод) и выявлении возбудителя количественными методами — культуральным микологическим или молекулярным (ПЦР-диагностика) при постановке окончательного диагноза.
2. Различные штаммы грибов рода кандида различаются по своей чувствительности к фунгицидным препаратам, что нередко связано с видовой принадлежностью грибов. Наибольшая частота штаммов устойчивых к воздействию фунгицидных препаратов выявляется среди штаммов, относящихся к видам С. кгше1 и С. glabraía.
кгше1 и С. glabraía.
3. Прединвазивный и инвазивный кандидоз СОПР у стоматологических пациентов в зависимости от комплекса сочетания причинных и патогенетических факторов может иметь различные проявления, которые соответствуют клинической картине атрофического или гипертрофического кандидоза, включая возможность инвазивного поражения тканей пародонта, с острым или хроническим течением.
4. Фунгицидные препараты группы производных триазола в сочетании с иммуномодулирующим препаратом ликопидом являются эффективным средством комплексного лечения кандидидоза СОПР и пародонта.
Личный вклад автора
Личный вклад автора заключается в самостоятельном обследовании 211 пациентов и лечении, организации специальных исследований и дополнительных консультаций. Автор принимала участие в инструментально-лабораторной диагностике, лично проводила взятие материала и подготовку препаратов для микробиологических,
молекулярно-биологических и иммунологических исследований. Автор самостоятельно анализировала материал и проводила статистическую обработку полученных данных.
Автор самостоятельно анализировала материал и проводила статистическую обработку полученных данных.
Апробация работы
Результаты исследований апробированы на XXXIII конференции молодых учёных МГМСУ (март, 2011), XI конференции НИМСИ «От науки — к практике» (декабрь, 2011), XII национальном конгрессе с международным участием «Человек и лекарство» (Москва, 2012), межкафедральной конференции отдела фундаментальных основ стоматологии Научно-исследовательского медико-стоматологического института и кафедры микробиологии, вирусологии, иммунологии ГБОУ МГМСУ им. А.И. Евдокимова от 6 ноября 2012 года (протокол № 11).
Публикации
5 печатных работ по теме диссертации, в том числе, 2 статьи — в журналах рецензируемых РИНЦ в соответствии с рекомендациями ВАК Минобрнауки Российской Федерации.
Внедрение результатов исследования
Авторские результаты внедрены в программу педагогического процесса на кафедре микробиологии, вирусологии, иммунологии МГМСУ в соответствии с Федеральным государственным образовательным стандартом по теме учебного модуля «Инфекционные и оппортунистические стоматиты», практическую работу Клинико-диагностического центра и Центра стоматологии и ЧЛХ МГМСУ. Подготовлено к печати учебное пособие по совершенствованию лабораторной диагностики заболеваний пародонта.
Подготовлено к печати учебное пособие по совершенствованию лабораторной диагностики заболеваний пародонта.
Объём и структура диссертации
Диссертационная работа включает: обзор литературы, глав «Материалы и методы исследования», три главы собственных результате
8
исследований, раздела обсуждения результатов, а также заключение, выводы и практические рекомендации. Список литературы: 279 источников, в том числе-162 отечественных и 117 — иностранных изданий.
Диссертация изложена на 142 страницах компьютерного машинописного текста, иллюстрации -17 таблиц, 30 рисунок.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
Контингент обследованных включал пациентов, обратившихся к врачу-стоматологу КДЦ или стоматологической клиники ФПДО МГМСУ за период с 2009 по 2012 гг. Всего было обследовано 211 пациентов с заболеваниями СОПР и пародонта, из которых 81 пациенту по данным проведённой клинико-лабораторной диагностики был поставлен диагноз: кандидоз слизистой оболочки полости рта (СОПР). Возраст пациентов был от 23 до 69 лет, в том числе, 45 женщин и 36 мужчин.
Возраст пациентов был от 23 до 69 лет, в том числе, 45 женщин и 36 мужчин.
В соответствии с задачами исследования сформированы 2 группы сравнения:
1 группа включала 60 пациентов с типичными клиническими проявлениями (в том числе, 31 женщина и 29 мужчин), которым был поставлен диагноз кандидоз СОПР. Данная группа характеризовалась отсутствием связи с протезированием.
2 группа включала всего 151 пациентов (в том числе 86 женщин, 65 мужчин), из числа которых у 21 диагноз кандидоза был поставлен в течение 3-х лет после протезирования и первоначально квалифицировался как протезный стоматит, а затем диагноз был сформулирован согласно Международной классификации МКБ-10 (ВОЗ, Женева, 1997): В 37.0 «Кандидозный стоматит».
Таким образом, всего было обследован и пролечен 81 пациент в возрасте от 32 до 87 лет с разными формами кандидоза СОПР и пародонта (табл. 1).
Для подтверждения диагноза кандидоза использовали клинические и лабораторные методы — микроскопический, культуральный (микологический), иммуноферментный и молекулярно-биологический (Мороз, 2009; Царёв, 2009). еН; определяли степень потери прикрепления десны и резорбцию альвеолярной кости рентгенологически на ортопантомографе (рис. 1).
еН; определяли степень потери прикрепления десны и резорбцию альвеолярной кости рентгенологически на ортопантомографе (рис. 1).
Рис.1 Ортопантомограмма пациентки К…, 56 лет.
Диагноз: кандида-ассоциированный пародонтит тяжелой степени
Проводили обследование слизистой оболочки полости рта; проводили микробиологические (культивирование и идентификация бактерий и грибов), молекулярно-биологические (полимеразная цепная реакция и иммуноферментное определение антител к кандида) и иммунологические исследования (фенотипирование лейкоцитов с набором моноклональных CD антител методом проточной цитофлюориметрии). Молекулярно-биологическое исследование включало постановку полимеразной цепной реакции с применением отечественных диагностических систем (НПФ «ГенЛаб», РФ) на отечественной аппаратуре для амплификации ДНК «Терцик». Оценку уровня AT к грибам Candida осуществляли с помощью твёрдофазного иммуноферментного анализа (ИФА) на спектрофотометре «Мультискан» (Швеция).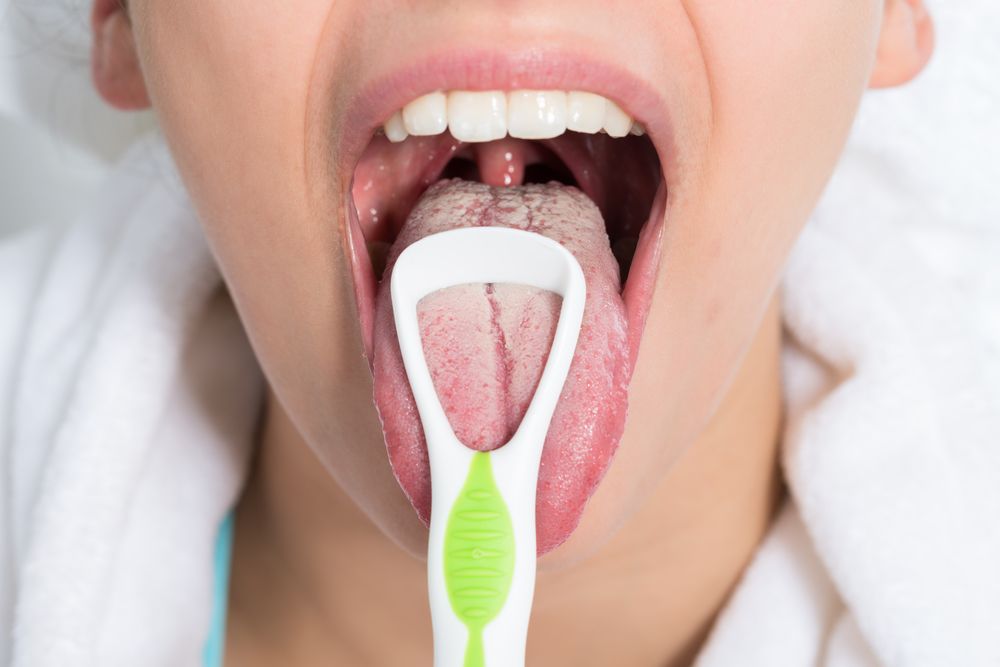
п
Для количественного определения дрожжевых грибов выполняли посев на агаризованную среду Сабуро и дифференциально-диагностические среды ХайХром Кандида-агар М1297А иМ1297АЛ.
Микологическое исследование выполняли по традиционному алгоритму медицинской микологии (А.И.Сергеев, 2000). Результаты количественной оценки выделения грибов регистрировали в lg КОЕ на 1 мл.
Культуральная оценка образования псевдомицелия грибов или тип филаментации, а также формирование ростовых трубок и хламидоспор ОCandida, Mycocandida, Mycotorula и др.) проводили на специальных средах (рисовый агар, сыворотка крови). Для идентификации по биохимическим свойствам использовали, тест систему API С, среды с углеводами и индикатором бромтимоловый синий. Полученные данные идентификации сравнивали с результатами идентификации в первичном посеве на хромогенные селективные и дифференциально-диагностические среды ХайХром Кандида-агар М1297А и M1297AR.
Всего выделено, идентифицировано и проанализировано 105 штаммов грибов рода Candida.
Оценку чувствительности выделенных штаммов к фунгицидным препаратам проводили традиционным диско-диффузионным методом и кассетным микрометодом разведения в агаризованной среде Сабуро (для оценки минимальной подавляющей концентрации — МПК). Изучали чувствительность производных азола (флюконазол, итраконазол, кетоконазол, вориконазол) и полиенового антибиотика (нистатин) в диапазоне концентраций от 0,5 до 256 мкг/мл.
Методы статистической обработки результатов. Использовали методики параметрической (средняя величина, ошибка средней величины М+ш, коэффициент Стьюдента, вероятность различий Р) и непараметрической обработки результатов. Для относительных величин (частота случаев, отношение числа выделенных штаммов к общему числу и т.п.) определяли частоту (%). В подгруппах с малой выборкой использовали критерий х2. При статистической
ПЦР-диагностика:
1 .Положительный результат 96 79,3
2.Отрицательный результат 25 20,7
Всего: 121 100,0
Совпадение результатов 76 из 81 93,8
Таким образом, по критерию специфичности данной тест-системы для ПЦР по сравнению с культуральным методом получена цифра 93,8 %. Кроме того, дрожжевые грибы рода Candida выделялись из пародонтального кармана культуральным микологическим методом. Примерно у 1/3 пациентов обнаружены фрагменты псевдомицелия, прорастающего в десневой эпителий больных.
Кроме того, дрожжевые грибы рода Candida выделялись из пародонтального кармана культуральным микологическим методом. Примерно у 1/3 пациентов обнаружены фрагменты псевдомицелия, прорастающего в десневой эпителий больных.
По результатам исследований (табл. 3), установлено, что при высокой и умеренной обсеменённости пародонтального кармана грибами другой метод исследования — ИФА практически всегда даёт положительный результат и процент совпадения результатов приближается к 100%. При низком количестве грибов, напротив, антитела с помощью ИФА выявляются в 1/3-1/4 случаев.
Таблица 3
Взаимосвязь степени обсеменённости содержимого пародонтального кармана грибами кандида по данным культурального микологического исследования и частоты обнаружения АТ к грибам с помощью ИФА
Количественная обсеменённость грибами: Число больных, абс. Положительный результат определения антител в ИФА
абс. % совпадения
1. Высокая степень: 25 25 100,0
количество >6,0
2. Умеренная степень: 17 16 94,1
Умеренная степень: 17 16 94,1
Кандида-агар М1297А и ХайХром Кандида-агар M1297AR, позволяющие выделить в первичном посеве и одновременно идентифицировать 4 и 5 видов Candida соответственно. Несоответствие результатов традиционной идентификации с идентификацией на новых хромогенных средах выявлено в единичных случаях.
По результатам исследования и идентификации выделенных штаммов у 67 пациентов с кандидозом СОПР или пародонта, установлено преобладание вида С. albicans (свыше 82 % пациентов), причём у некоторых пациентов (около 10 %) он выделялся в ассоциациях: С. Krusei — у 4-х, С. tropicalis — у 3-х и С. glabrata — у 2-х пациентов.
Таким образом, вид С. albicans доминировал по частоте выделения у больных кандидозом СОПР и хроническим пародонтитом в стадии обострения (кандида — ассоциированным пародонтитом).
Второе место занимал вид С. Krusei (11 пациентов, что составило около 13 %), причём, у 4-х больных — только вместе с С. albicans (в ассоциации).
Единичные находки отмечены для представителей видов, некоторые из них ранее не были идентифицированы при заболеваниях СОПР и пародонта: С. tropicalis, С. glabrata и С. brimiptii, а также С. guilliermondii и С.parapsilosis, выявленные только в ассоциациях с С.albicans (рис. 2).
Рисунок 2
Частота выделения штаммов Candida разных видов у пациентов с кандидозом СОПР и пародонта (%)
j «Candida albicans Candida Krusei
1 t Candida spp.
Всего выделено 105 штаммов дрожжевых грибов данного рода, в том числе: 80 штаммов С. albicans, 11 * С. Krusei, 6 — С. glabrata, 2 — С. tropicalis, по одному штамму — С. brumptii, C.parapsilosis и С. guilliermondii, что составило 76,2 %, 10,5 %, 5,7 %,. 1.9 % и по 0,95 % соответственно.
Для повышения точности диагностики мы впервые провели выявление молекулярных маркеров дрожжевых грибов (образцы экстрагированной ДНК из материала) при заболеваниях СОПР и пародонта, используя отечественный набор реактивов для ПЦР-исследования (фирмы «ГенЛаб»).
Из 121 пациента (включая 81 — с подтверждённым диагнозом кандидоза СОПР и пародонта), которым проводили ПЦР-диагностику, у 96 в исследуемом материале (соскобе со СОПР или содержимом пародонтального кармана) выявлена искомая ДНК, что составило 93,8 % от общего числа пациентов с подтверждённым диагнозом (81 чел.), обследованных данным методом. ПЦР была положительна у 76 человек из группы с подтверждённым диагнозом (81 чел.), но также ещё у 20 человек с отрицательным (по данным культурапьного исследования).
Совпадение положительных результатов детектируемых обоими методами из расчёта на 81 пациент, наблюдалось в 93,8% случаев (табл. 2).
Таблица 2
Частота совпадения результатов культурального микологического и молекулярного исследования (121 пациент)
Группа выборки Число больных, абс. Число больных, %
Культуральное исследованию: 1 .Положительный результат ‘•.V. …. 2.Отрицательный результат 81 40 66,9 33,1
Всего: 121 100,0
обработке результатов использовали компьютерную программу Excel для Microsoft.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Полученные данные комплексного клинико-лабораторного обследования пациентов позволили разделить всех пациентов на несколько группы сравнения с учётом выявления грибов в исследуемом материале и их количества, выраженного в колоннеобразующих единицах (КОЕ).
Клинические проявления кандидозного поражения слизистой оболочки полости рта отличаются многообразием, но при соблюдении правильных методических подходов, не вызывают затруднения при диагностике. При более глубоком поражении тканей полости рта — кандида-ассоциированном пародонтите, помимо описанных ранее (A.C. Носик, 2004), нами выявлены дополнительные клинические симптомы. В частности: формирование биопленки с характерной «творожистой» или «сметаноподобной» консистенции, которая определяется в десневых карманах при пародонтите средней и тяжелой степени тяжести, не плотное прилегания краевой десны к зубам («зияющие карманы»), быстрое формирование зубных отложений. При выявлении данных признаков рекомендуется проводить у пациентов расширенное микологическое обследование.
Для выявления этиологического фактора следует проводить специальные исследования. Для подтверждения диагноза кандидоза проводили микроскопическое исследование (с окраской по Граму), при котором в материале пародонтального кармана, взятого при кюретаже обнаружены фрагменты псевдомицелия. Аналогичная картина отмечена нами при исследовании мазка-соскоба со слизистой у пациентов с перечисленными клиническими формами кандидозного стоматита.
Для определения видового состава дрожжеподобных грибов, выделенных со СОПР и из пародонтального кармана пациентов использовали новые питательные среды из класса хромогенных — ХайХром
количество 3,0-5,0
3. Низкая степень: 15 5 33,3
количество <2,0
4. Грибы не выделены, 24 5 20,8
при положительной ПЦР
Всего пациентов: 81 51 63,0
Кандидоз слизистой оболочки полости рта является нередким осложнением протезирования, развивающимся на протяжении 1-3 лет после протезирования или перебазировки, однако при прочих равных условиях наиболее частой причиной развития кандидоза является применение полиакриловых конструкций, изготовленных из «Фторакса» или «Протакрила». Сплавы металлов, полиуретан и современные композитные материалы существенно снижали частоту осложнений кандидозной природы.
Сплавы металлов, полиуретан и современные композитные материалы существенно снижали частоту осложнений кандидозной природы.
Клинико-лабораторное обоснование и мониторинг эффективности лечения.
Для обоснования выбора препарата изучена чувствительность штаммов дрожжевых грибов Candida albicans, С .tropicalis, С. krusei, С. parapsilosis, С. glabrala. В качестве контроля использовали референтные штаммы из коллекции НИИ медицинской микологии им. П. Н. Кашкина: C.albicans NCTC 885-653 и др. Исследованные штаммы грибов кандида оказались высокочувствительны к флюконазолу, итраконазолу и их дженерикам — орунгалу, хайконазолу, но при этом была выявлена высокая резистентность к кетоконазолу и наличие мутантов устойчивых к нистатину.
Наиболее чувствительными грибы кандида были к флюко- и итраконазолу (0,5-1,0 до 50 мкг/мл), а к кетоконазолу, нистатину — 50-100 мкг/мл и выше для устойчивых мутантов. Более устойчивыми к действию флюконазола и итраконазола были представители С. krusei и С. glabrata (50
krusei и С. glabrata (50
мкг/мл и выше), причём МИК нистатина не превышала 50-100 мкг/мл, что позволило рекомендовать этот препарат при устойчивости к производным триазола. Достоверных различий противогрибковой активности флюконазола с дженериком хайконазолом не выявлено.
Результаты исследования чувствительности штаммов грибов к фунгицидным препаратам с помощью диско-диффузионного метода представлены в табл. 4.
Таблица 4
Результаты определения чувствительности штаммов грибов рода Candida к
фунгицидным препаратам
Вид N Различия: Кетоконазол Флюконазол Интраконазол Нистатин
С. albicans 80 Чувств ИТ. 72 90% 76 95% 76 95% 62 77,5
‘езистент. 28 10% 4 5% 4 5% 18 22,5
С. krusei 11 Чувствит. 0 0% 0 0% 0 0% 9 81,8
‘езистент. 11 100 % 11 00% 11 100% 3 27,2
С. glabrata 6 Чувствит. 1 16,7% 4 ¡6,6% 2 33,3% 3 50%
‘езистент. 5 83,3% 2 13,3% 4 66,6% 3 50%
Candida spp. 5 Чувствит. 5 100% 5 00% 5 100% 5 100
5 Чувствит. 5 100% 5 00% 5 100% 5 100
Полученные данные позволили рекомендовать дифференцированное назначение противогрибковых препаратов.
Общее лечение.
Назначали внутрь противогрибковые препараты флюконазола или итраконазола в капсулах по 100 и 200 мг соответственно (в зависимости от результатов определения чувствительности) 1 раз в сутки в течение 7 суток. Производные кетоконазола имеют длительный период полувыведения. При выделении С. Кгихех, устойчивой к азоловым производным применяли нистатин по 500 000 ЕД 2 раза в сутки в течение 7 суток.
В комплекс лечения также был включён препарат с иммуномодулирующим действием — ликопид в дозе 10 мг натощак ежедневно, курсами по 10 суток (при необходимости — повтор курса через 20
дней). Больным кандидозом необходимо полноценное высококачественное питание с уменьшением количества легкоусвояемых углеводов. Внутрь назначали витамины группы В (В1, В2, В6), РР, С (аскорутин и поливитаминный комплекс «Мультивит»),
Местное лечение.
Хороший противогрибковый эффект наблюдался при сосании декамина в форме карамели: по 1-2 карамели 6 раз в день (каждые 3 часа). В одной карамели содержится 0,00015 г декамина. Одну-две карамели помещали под язык или за щеку и держат до полного рассасывания, не производя по возможности глотательных движений, чтобы препарат как можно дольше находился в контакте со слизистой оболочкой рта.
Для аппликаций и смазывания использовали 20 % раствор буры в глицерине, люголевский раствор в глицерине, 1 % спиртовой раствор сангвиритрина, красителей. При дрожжевой заеде и хейлите была эффективна нистатиновая мазь (по 100 000 ЕД на 1 г основы) или крем клотримазола.
Контрольное исследование
Проведённое после завершения курса лечения (через 1 месяц) продемонстрировало высокую эффективность по результатам клинического и лабораторного исследования. У 94% исчезали клинические проявления кандидозного стоматита, наблюдалась ремиссия кандида-ассоциированного пародонтита, исчезали кандидозные заеды. У 82% грибы не выявляли культуральным методом, у 75% — с помощью ПЦР. Однако у 64% оставались положительными результаты ИФА, что может быть объяснено формированием выраженной иммунной реакции организма.
У 82% грибы не выявляли культуральным методом, у 75% — с помощью ПЦР. Однако у 64% оставались положительными результаты ИФА, что может быть объяснено формированием выраженной иммунной реакции организма.
Заключение
В нашей работе мы проводили комплексное лабораторное исследование разными методами. ИФА в твёрдой фазе использовали как скриннинговый метод для определения высокого уровня антител сыворотки крови к грибам Candida albicans для последующего сопоставления данных
культурального и молекулярно-биологического обнаружения грибов с уровнем антител к ним. Полученные нами данные свидетельствую о высоком уровне ложноположительных реакций ИФА, и позволяют обосновать целесообразность применения для подтверждения диагноза кандидоза СОПР культурального метода с применением современных хромогенных сред и ПЦР-диагностики. Оба метода позволяют быстро и эффективно (с высоким уровнем чувствительности и специфичности) выявить представителей основных видов дрожжеподобных грибов, которые, по нашим данным, встречаются при кандидозе СОПР (С. albicans, С. krusei, С. tropicalis, С. parapsilosis, С. glabrata).
albicans, С. krusei, С. tropicalis, С. parapsilosis, С. glabrata).
Исходя из результатов мониторинга присутствия кандида в ассоциации условно-патогенных бактерий при пародонтите А.Ю. Миронов с соавт. (2012) пришли к заключению, что присутствие грибов кандида в пародонтальном кармане сопряжено с изменением чувствительности бактерий к антибиотикам и приводит к повышению количества резистентных штаммов бактерий, что, соответственно, снижает эффективность проводимой антибактериальной терапии.
По данным известного морфолога-исследователя проблемы кандидоза О.К Хмельницкого (2002) при дифференциальной диагностике различных форм кандидозного процесса, основанной на комплексном подходе к применению разных клинико-лабораторных методов, необходимо учитывать возможные формы взаимодействия кандида с макроорганизмом, что позволит обосновать адекватное этиологическое и патогенетическое лечение. Результаты комплексного клинико-лабораторного подхода, использованного в нашем исследовании, подтвердил данное положение.
ВЫВОДЫ
1. В современной структуре кандидоза СОПР (по обращаемости к стоматологу) ведущее место занимают хронические формы (гипертрофический кандидоз — у 28,4 %; атрофический кандидоз — у 30,9 %). В 25,9 % случаев мы диагностировали атипичное течение кандидозного процесса полости рта,
охарактеризованное нами как кандида-ассоциированный пародонтит. Клинические проявления такого поражения пародонта имеют свои особенности, позволяющие проводить дифференциальную диагностику от бактериальных поражений. Данные комплексного клинико-лабораторного обследования позволяют провести разделение пациентов на группы с учётом обнаружения грибов в исследуемом материале и степени количественной обсеменённости, начиная от критического числа 103 КОЕ/мл и выше.
2. Для точной этиологической диагностики кандидоза СОПР и пародонта необходимо сочетание, культурального, микроскопического, молекулярно-биологического методов диагностики и иммуноферментного анализа, как скриннингового метода. Апробированные в нашей работе новые хромогенные питательные среды для ускоренной диагностики позволяют одновременно провести идентификацию основных видов возбудителей кандидоза (С. albicans, С. Krusei, С.tropicalis, С. glabrata, С. parapsilosis).
Апробированные в нашей работе новые хромогенные питательные среды для ускоренной диагностики позволяют одновременно провести идентификацию основных видов возбудителей кандидоза (С. albicans, С. Krusei, С.tropicalis, С. glabrata, С. parapsilosis).
3. Определение чувствительности грибов в эксперименте на питательной среде in vitro (и, соответственно, устойчивости отдельных штаммов) к используемым противогрибковым химиопрепаратам позволяет вьивить круг наиболее эффективных препаратов (флюконазол, итраконазол) и обосновать выбор схемы антимикотической терапии. Обоснован выбор вориконазола и дженерика итраконазола — хайконазола, как возможной лекарственной формы для клинического применения (доклинические исследования).
4. Апробирован отечественный диагностический набор реагентов для детекции генетических маркеров дрожжевых грибов молекулярными методами (чувствительность 93,8 %), проведено сравнение результатов ПЦР-диагностики и культурального микологического исследования при диагностике кандидоза, что позволило рекомендовать методику для комплексной диагностики кандидоза СОПР и контроля эрадикации штаммов возбудителей (через 3-4 недели после завершения фунгицидной химиотерапии).
5. Выявлены особенности иммунного статуса пациентов, свидетельствующие о развитии . иммунодефицита Т-системы и недостаточности макрофагально-
гранулоцитарного звена, которые позволили обосновать клиническое применение ликопида и установить его эффективность.
6. Разработаны показания для назначения и параметры оценки эффективности применения фунгицидных препаратов в комплексном лечении кандидоза, которые базируются на совпадении результатов нескольких методов исследования.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
В настоящей работе определены характерные местные, общие и анамнестические признаки поражений СОПР, вызванные дрожжевыми грибами кандида. В связи с этим для повышения эффективности диагностики кандидоза рекомендуется:
1. Рекомендации по диагностике
В диагностике пародонтита ассоциированного с грибами кандида следует использовать клинические признаки:
• вялотекущий характер процесса — практически непрерывное течение или короткие промежутки между обострениями заболеваниями;
• наличие длительно-протекающих и рецидивирующих инфекций в анамнезе,
• длительные курсы лечения антибиотиками широкого спектра, глюкокортикоидами или иммунодепрессантами,
• отсутствие клинического эффекта от антибактериального лечения,
• выделение кандида из респираторного, желудочно-кишечного или урогенитального тракта, свидетельствующее о поражения других органов и систем.
Особенно важное значение при дифференциальной диагностике с другими заболеваниями СОПР на наш взгляд имеют:
• наличие налёта (биопленки) «творожистой» или «сметаноподобной» консистенции,
• гиперемия, цианоз слизистой оболочке десны,
• при пародонтите средней и тяжелой степени тяжести не плотное прилегания краевой десны к зубам («зияющие карманы»),
• быстрое формирование рыхлых и обильных зубных отложений.
Во всех случаях стоматита, развившегося после протезирования стоматологических пациентов проведение микроскопического и культурального исследования на грибы рода Candida с применением новых хромогенных сред, позволяющих проводить видовую идентификацию грибов кандида. Для быстрой и эффективной индикации возбудителей кандидоза рекомендуется применять отечественную диагностическую систему для проведения диагностики с помощью полимеразной цепной реакции.
Применение ИФА для диагностики кандида-ассоциированного стоматита следует расценивать как скриннинговую методику при обследовании значительных контингенов лиц. Всем больным кандидозом показано исследование иммунного статуса и проведение ИФА исследования на антитела к ВИЧ и гепатитам В и С.
Всем больным кандидозом показано исследование иммунного статуса и проведение ИФА исследования на антитела к ВИЧ и гепатитам В и С.
2. Рекомендации по лечению
Для выбора препарата с целью комбинированной химиотерапии кандидоза, включающей использование фунгицидных и
иммуномодулирующих препаратов, рекомендуется проводить определение чувствительности грибов к фунгицидным средствам. При выявлении чувствительности к флуконазолу (дифлюкан, флюкостат) препарат используется в дозе 100-150 мг (в зависимости от формы) 1 раз в сутки перорально в течение 1 недели. При выявлении чувствительности к итраконазолу (орунгал) препарат используется в дозе 200 мг 1 раз в сутки ежедневно в течение 1 недели. При выделении С. Krusei, устойчивой к азоловым производным рекомендуется применять нистатин по 500 000 ЕД 2 раза в сутки в течение 1 недели.
В качестве иммуномодулирующего препарата в составе комплексного лечения кандидоза следует применять ликопид по 10 мг утром натощак в
течение 10 дней 2-3 курсами с интервалом в 1 месяц (независимо от назначения фунгицидных средств).
После проведённого лечения кандидоза (через 3-4 недели) необходимо контрольное культуральное или ПЦР-исследование для подтверждения эрадикации возбудителя.
Печатные работы автора, опубликованные по теме диссертации:
1. Царев В.Н., Носик A.C., Сударикова С.А. (Суркова), Мезенцева H.A. Принципы современной клинико-лабораторной диагностики инвазивной кандидозной инфекции // Журнал «Стоматолог» — 2010. — №3. — С.46-52.
2. Сударикова С. А. (Суркова), Царёв В.Н. Особенности клинико-лабораторной диагностики инвазивной кандидозной инфекции слизистой оболочки полости рта и пародонта // Журнал «Dental Forum» — 2011. — №3. — С.126-127.
3. Царев В.Н., Носик A.C., Сударикова С.А. (Суркова), Ушаков Р.В. Новые диагностические подходы к выявлению инвазивной кандидозной инфекции слизистой оболочки полости рта и пародонта // Журнал «Стоматолог» — 2011. — №4 — С. 14-20.
4. Царёв В.Н., Суркова С.А. (Сударикова), Давыдова М.М. Особенности диагностики инвазивной кандидозной инфекции слизистой оболочки полости рта и тканей пародонта // Журнал «Медицинский алфавит. Стоматология». — 2012. — №6. — С.24-33.
Стоматология». — 2012. — №6. — С.24-33.
5. Суркова С.А. (Сударикова). Особенности клинико-лабораторной диагностики инвазивной кандидозной инфекции слизистой оболочки полости рта // Журнал «Dental Forum» — 2012. — №3. — С.94-95.
Подписано в печать: 14.05.2013 Тираж: 100 экз. Заказ № 967 Отпечатано в типографии «Реглет» г. Москва, Ленинградский проспект, д. 74 +7 (495)790-47-77 www.reglet.ru
Хронический гиперпластический кандидоз слизистой оболочки полости рта: история болезни
Хронический гиперпластический кандидоз слизистой оболочки полости рта: история болезни- María Teresa Pérez-Gracia 1* , Celia M Haya-Fernández 2 , Beatriz Medina-Cebrian 2 и Beatriz Suay-García 3 2020202020202
- 1 Факультет фармации, Институт биомедицинских наук, Университет CEU Cardenal Herrera, Валенсия, Испания
- 2 Департамент стоматологии, Universidad Ceu Cardenal Herrera, Valencia, Испания
- 3 Департамент фармации, Universidad Ceu Cardenal Herrera, Valencia, Испания
* CORCESTING AUTUR Перес-Грация
Факультет фармации, Институт биомедицинских наук, Университет CEU Cardenal Herrera, Валенсия, Испания
Тел.
 : +34 009613,
: +34 009613, Факс: +34 00961369000
Электронная почта: [email protected]
Дата получения : 9 июня 2014 г.
Дата принятия : 05 июля 2015 г.
Дата публикации : 21 июля 2014 г.
DOI: 10.24966/CSMC-8801/100001
Abstract
Кандидоз полости рта, в основном вызываемый Candida albicans , имеет большое значение в стоматологии из-за его частоты и клинического разнообразия. Эта инфекция часто наблюдается у людей с различными типами предрасполагающих факторов. Клинические формы кандидоза полости рта разнообразны, и используются разные классификации. Следующий случай представляет собой случай пациента мужского пола с четко очерченными беловатыми бляшками, которые не отделяются при расчесывании, расположенными на слизистой оболочке щек с двух сторон, на обеих губных ретрокомиссурах. Образцы, взятые из очагов поражения, были культивированы и обнаружены 9Было идентифицировано 0004 C. albicans , что подтвердило клинический диагноз хронического гиперпластического кандидоза. Проведена противогрибковая терапия (миконазол). Контроль, проведенный через два месяца, показал улучшение состояния поражений, а через шесть месяцев наблюдалась полная ремиссия. Важность этого случая заключается в том, что этот тип кандидоза имеет очень низкую распространенность по сравнению с другими клиническими типами, такими как псевдомембранозный или эритематозный кандидоз. Кроме того, его важность заключается еще и в том, что необходимо проводить исчерпывающий клинический мониторинг, так как существует риск малигнизации.
albicans , что подтвердило клинический диагноз хронического гиперпластического кандидоза. Проведена противогрибковая терапия (миконазол). Контроль, проведенный через два месяца, показал улучшение состояния поражений, а через шесть месяцев наблюдалась полная ремиссия. Важность этого случая заключается в том, что этот тип кандидоза имеет очень низкую распространенность по сравнению с другими клиническими типами, такими как псевдомембранозный или эритематозный кандидоз. Кроме того, его важность заключается еще и в том, что необходимо проводить исчерпывающий клинический мониторинг, так как существует риск малигнизации.
Ключевые слова
Candida albicans; Гиперпластический кандидоз; Кандидоз полости рта
ВВЕДЕНИЕ
Кандидоз полости рта вызывается Candida, которая присутствует в полости рта примерно у 50% здоровых людей в виде комменсального организма [1,2]. Трансформация комменсального организма в патоген зависит от воздействия различных предрасполагающих факторов, которые модифицируют микросреду полости рта и способствуют возникновению условно-патогенной инфекции [3,4]. Среди этих факторов хронические местные раздражители, неправильный уход за приборами, кортикостероиды, ксеростомия, диетические факторы, иммунологические и эндокринные нарушения, злокачественные и хронические заболевания, тяжелые дискразии крови, облучение головы и шеи, неправильное питание, возраст, госпитализация, эпителий полости рта. дисплазии и заядлом курении [5].
Среди этих факторов хронические местные раздражители, неправильный уход за приборами, кортикостероиды, ксеростомия, диетические факторы, иммунологические и эндокринные нарушения, злокачественные и хронические заболевания, тяжелые дискразии крови, облучение головы и шеи, неправильное питание, возраст, госпитализация, эпителий полости рта. дисплазии и заядлом курении [5].
Candida albicans является наиболее вирулентным и распространенным видом, за которым следуют C. tropicalis, C. glabrata, C. parapsilosis, C. guillermondii, C. krusei, C. kyfer и совсем недавно C. dubliniensis [6-9].
C. albicans колонизирует поверхность полости рта и может вызывать повреждения за счет экспрессии факторов вирулентности, включая адгезию к клеткам-хозяевам, морфологический переход, гидрофобность и секрецию гидролитических ферментов [10-12]. Основным фактором вирулентности C. albicans является его способность адаптироваться к множеству различных мест обитания и последующее образование прикрепленных к поверхности микробных сообществ, известных как биопленки [13].
Кандидозные инфекции слизистой оболочки полости рта могут вызывать различные клинические и гистопатологические проявления. В настоящее время наиболее часто используется классификация, разработанная Holmtup и Axel [14], в которой рассматриваются следующие проявления: псевдомембранозный кандидоз (острый-хронический), эритематозный кандидоз (острый-хронический), гиперпластический кандидоз и ассоциированные поражения (протезный кандидоз). стоматит, угловой хейлит, ромбовидный глоссит) [15-19].
Эритематозный кандидоз характеризуется локализованной эритемой слизистой оболочки полости рта с сопутствующими симптомами или без них, которая обычно возникает на языке и небе и связана с приемом антибиотиков широкого спектра действия, кортикостероидов и ВИЧ-инфекцией. На спинке языка эритематозный кандидоз представляет собой депапиллярные участки, вызванные утратой нитевидных сосочков. Гистологически это поражение похоже на псевдомембранозный кандидоз. Это наиболее часто распознаваемый тип кандидоза, составляющий 60% случаев [20].
Псевдомембранозный кандидоз или молочница, характеризующаяся белыми пятнами на поверхности слизистой оболочки щек, языка и мягкого неба, возникает у пациентов, применяющих кортикостероиды местно или в виде аэрозоля, у ВИЧ-позитивных пациентов и при других типах пациентов с ослабленным иммунитетом. Это составляет около 35% случаев [20].
Гиперпластический кандидоз является наименее распространенным из триады основных клинических вариантов, с 5% случаев. ХГС может проявляться в узловатой форме или в виде беловатых бляшек, которые не могут быть отнесены к какому-либо другому заболеванию, не отделяются при грубом натирании и обычно располагаются на слизистой оболочке щеки и языке, особенно билатерально, в ретрокомиссурах обеих губ [21,22]. . При этой форме инфекции гифы Candida обнаруживаются не только на уровне поверхности эпителия, но также проникают в более глубокие слои, где может наблюдаться дисплазия эпителия с сопутствующим риском малигнизации [20].
Диагноз часто ставится на основании клинического осмотра и тщательного сбора анамнеза. Дополнительные дополнительные диагностические методы, такие как биопсия и микробиологическая культура (декстрозный агар Сабуро и хромогенная среда), важны для подтверждения диагноза [3].
Дополнительные дополнительные диагностические методы, такие как биопсия и микробиологическая культура (декстрозный агар Сабуро и хромогенная среда), важны для подтверждения диагноза [3].
Лечение кандидоза полости рта должно быть направлено на выявление основных факторов, которые могут вызвать заболевание, посредством клинического обследования и сбора анамнеза. Если изменение или коррекция основного предрасполагающего фактора невозможна или не требуется, начинают медикаментозную терапию [5]. Лечение основано на применении местных полиеновых (нистатин или амфотерицин) или азольных противогрибковых средств (клотримазол, миконазол, кетоконазол, флуконазол или итраконазол) [23,24]. Выбор препарата зависит от истории болезни пациента, оральных симптомов и соблюдения режима лечения.
Клинический случай
50-летний мужчина впервые посетил стоматологическую клинику CEU-Cardenal Herrera. Причиной визита было проведение осмотра и чистки полости рта, так как с момента его последнего визита к стоматологу прошло 3 года. Курил по 10 сигарет в день, других системных заболеваний не имел. Мы наблюдали безболезненные, четко очерченные беловатые бляшки, которые не отделялись при расчесывании, располагались на слизистой оболочке щеки и обеих губах ретрокомиссуры (рис. 1), пациент не знал, как давно у него были эти поражения. Клинические признаки белых поражений могут быть диагностированы как хронический гиперпластический кандидоз (ХГС). Поэтому дифференциальную диагностику всех белых образований, которые не удалось удалить, следует проводить как лейкоплакию. Мы консультировали пациента по поводу отказа от курения. Для установления окончательного диагноза мы сделали биопсию под местной анестезией (рис. 2) и дополнительную микробиологическую культуру.
Курил по 10 сигарет в день, других системных заболеваний не имел. Мы наблюдали безболезненные, четко очерченные беловатые бляшки, которые не отделялись при расчесывании, располагались на слизистой оболочке щеки и обеих губах ретрокомиссуры (рис. 1), пациент не знал, как давно у него были эти поражения. Клинические признаки белых поражений могут быть диагностированы как хронический гиперпластический кандидоз (ХГС). Поэтому дифференциальную диагностику всех белых образований, которые не удалось удалить, следует проводить как лейкоплакию. Мы консультировали пациента по поводу отказа от курения. Для установления окончательного диагноза мы сделали биопсию под местной анестезией (рис. 2) и дополнительную микробиологическую культуру.
Рисунок 1: Внутриротовое изображение, показывающее разграниченные беловатые бляшки, которые не отделяются при очистке, расположенные на слизистой оболочке щеки с двух сторон у ретрокомиссур обеих губ.
Рисунок 2: Изображение, показывающее момент биопсии.
Биоптат очагов обычно брали и окрашивали гематоксилин-эозином, результаты показали псевдоэпителиоматозную слизистую оболочку полости рта с очень выраженным гиперкератозом без дисплазии и поверхностным кандидозом, связанным с псевдоликвидным воспалением стромы.
Результатом микробиологического посева был рост колоний Candida albicans (рис. 3). Мы обрабатывали очаги поражения миконазоловым гелем 3 раза в день в течение 2 месяцев. Контроль, проведенный через два месяца, показал улучшение состояния поражений (рис. 4), а через 6 месяцев наблюдалась полная ремиссия.
Рисунок 3. Колонии Candida albicans в средах с декстрозным агаром Сабуро (слева) и CHROMagar Candida® (справа).
Рисунок 4: . Внутриротовое изображение через два месяца после противогрибкового лечения. Никаких поражений не наблюдается на обеих губах ретрокомиссуры с обеих сторон.
МАТЕРИАЛЫ И МЕТОДЫ
Образцы мазков брали со слизистой оболочки полости рта. Образцы распределяли в среде Сабуро с декстрозным агаром и среде CHROMagar Candida® (Becton Dickinson, Германия) и инкубировали при 37°С в течение 48 часов. Результаты наблюдали через 24 и 48 часов.
Образцы распределяли в среде Сабуро с декстрозным агаром и среде CHROMagar Candida® (Becton Dickinson, Германия) и инкубировали при 37°С в течение 48 часов. Результаты наблюдали через 24 и 48 часов.
Агар Сабуро с декстрозой (Becton Dickinson, Германия) является средой, наиболее часто используемой для выделения Candida spp. и другие дрожжи клинического происхождения [24]. CHROMagar Candida® (Becton Dickinson, Германия) представляет собой селективную и дифференциальную культуральную среду, которая облегчает выделение и предполагаемую идентификацию некоторых клинически значимых видов, таких как C. albicans, C. krusei, C. tropicalis и C. glabrata. Эта среда позволяет специфически идентифицировать колонии C. albicans благодаря их зеленому цвету; Колонии C. tropicalis кажутся голубыми с розовым ореолом вокруг них; Колонии C. krusei розовые и мягкие на вид, а C. glabrata имеют коричневый цвет [25,26].
После первичного выделения дрожжей для обнаружения C. albicans были применены быстрые методы, такие как тест на филаментацию в сыворотке. Кроме того, для подтверждения идентификации использовались методы усвоения питательных веществ (API 20 C AUX, bioMérieux, Франция).
Кроме того, для подтверждения идентификации использовались методы усвоения питательных веществ (API 20 C AUX, bioMérieux, Франция).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Клинический диагноз гиперпластического кандидоза был установлен на основании биопсии очага поражения и обнаружения Candida в микробиологической культуре.
Хронический гиперпластический кандидоз (ХГС) представляет собой вариант кандидоза полости рта, который обычно проявляется в виде четко очерченных пальпируемых приподнятых поражений, которые могут варьироваться от небольших полупрозрачных беловатых участков до больших непрозрачных бляшек, которые невозможно стереть. Наиболее частым местом этих поражений является слизистая оболочка щек, особенно области спаек [20]. Небо и язык также могут быть вовлечены, хотя и реже. Основным этиологическим агентом заболевания является грибковый возбудитель ротовой полости Candida, преимущественно относящийся к Candida albicans, хотя другие системные сопутствующие факторы, такие как дефицит витаминов и общее подавление иммунитета, могут играть определенную роль.
В этом случае пациент не принимал антибиотики или стероиды в течение длительного периода времени. Однако эти факторы чаще связаны с другими типами кандидоза полости рта, такими как острый эритематозный кандидоз. В нашем случае в качестве факторов риска пациент представил табак и недостаточную гигиену полости рта. Эти факторы риска связаны с хроническим гиперпластическим кандидозом.
Привычка к курению напрямую связана с ХГС из-за: индукции повышенного ороговения эпителия; снижение уровня иммуноглобулина А в слюне; возможное угнетение функции полиморфноядерных лейкоцитов [20].
Клинически поражения бессимптомны и регрессируют после соответствующей противогрибковой терапии и коррекции основных пищевых или других дефицитов. Регресс значительной части поражений ХГС в результате противогрибковой терапии свидетельствует о том, что гиперплазия является защитным ответом слизистой оболочки хозяина против диссеминированной инфекции Candida [20]. Если поражения не лечить, у незначительной части может наблюдаться дисплазия и развиваться в карциному. При этом клиническое улучшение поражений наблюдалось через два месяца лечения миконазолом, а полная ремиссия – через 6 месяцев.
При этом клиническое улучшение поражений наблюдалось через два месяца лечения миконазолом, а полная ремиссия – через 6 месяцев.
Гистопатологическое исследование подозреваемого поражения необходимо для диагностики ХГС [20]. Поскольку эта форма может имитировать другие поражения, особенно плоскоклеточный рак, настоятельно рекомендуется биопсия. Гистопатологическое исследование выявит эпителиальный паракератоз с полиморфно-ядерными лейкоцитами в поверхностных слоях. В нашем случае диагностика проводилась с помощью биопсии и микробиологического посева.
Этот случай был интересен для нас тем, что этот тип кандидоза имеет низкую распространенность по сравнению с другими клиническими типами, такими как псевдомембранозный или эритематозный кандидоз. Кроме того, его важность заключается еще и в том, что необходимо проводить исчерпывающий клинический мониторинг, так как существует риск малигнизации. Кроме того, этот случай важен тем, что для проведения дифференциальной диагностики гиперпластического кандидоза необходимо провести биопсию для исключения других лейкоплакий.
ЗАКЛЮЧЕНИЕ
Диагноз ХГС сложен, так как его характеристики сходны с таковыми при лейкоплакии, инфицированной Candida. По этой причине важно провести дифференциальную диагностику с использованием биопсии и микробиологического посева.
Полная ремиссия поражения после противогрибкового лечения подтверждает диагноз ХГС.
ССЫЛКИ
- Barlow AJ, Chattaway FW (1969) Наблюдения за носительством Candida albicans у человека. Бр Дж Дерматол 81:103-106.
- Самаранаяке Л.П. (1990) Кандидоз полости рта: старая болезнь в новых обличьях. Дент Обновление 17: 36-38.
- Coronado-Castellote L, Jimenez-Soriano Y (2013)Клиническая и микробиологическая диагностика кандидоза полости рта. J Clin Exp Dent 5: e279-e286.
- Aguirre-Urízar JM (2002) Оральный кандидоз. Преподобный Ибероам Микол 19: 17-21.
- Скалли С., Эль-Кабир М., Самаранаяке Л.П. (1994)Кандидоз и кандидоз полости рта: обзор. Crit Rev Oral Biol Med 5: 125-157.
- Дельгадо А.
 Д., де Хесус Педро Р., Аоки Ф.Х., Резенде М.Р., Трабассо П. и др. (2009)Клиническая и микробиологическая оценка пациентов с длительным диагнозом инфекции вируса иммунодефицита человека и оральной колонизации Candida. Clin Microbiol Infect 15: 364-371.
Д., де Хесус Педро Р., Аоки Ф.Х., Резенде М.Р., Трабассо П. и др. (2009)Клиническая и микробиологическая оценка пациентов с длительным диагнозом инфекции вируса иммунодефицита человека и оральной колонизации Candida. Clin Microbiol Infect 15: 364-371. - Luque AG, Biasoli MS, Tosello ME, Binolfi A, Lupo S, et al. (2009)Оральный дрожжевой носитель среди ВИЧ-инфицированных и неинфицированных групп населения в Росарио, Аргентина. Микозы 52: 53-59.
- Ribeiro PM, Bacal F, Koga-Ito CY, Junqueira JC, Jorge AOC (2011) Наличие Candida spp. в полости рта пациентов с трансплантацией сердца. J Appl Oral Sci 19: 6-10.
- Junqueira JC, Vilela SFG, Rossoni RD, Barbosa JO, Costa ACBP и др. (2012) Оральная колонизация дрожжами у ВИЧ-позитивных пациентов в Бразилии. Rev Inst Med Trop Sao Paulo 54: 17-24.
- Schaller M, Borelli C, Korting HC, Hube B (2005) Гидролитические ферменты как факторы вирулентности Candida albicans. Микозы 48: 365-377.
- Мишра Н.
 Н., Прасад Т., Шарма Н., Паяси А., Прасад Р. и др. (2007) Патогенность и лекарственная устойчивость Candida albicans и других видов дрожжей. Обзор. Acta Microbiol Immunol Hung 54: 201-235.
Н., Прасад Т., Шарма Н., Паяси А., Прасад Р. и др. (2007) Патогенность и лекарственная устойчивость Candida albicans и других видов дрожжей. Обзор. Acta Microbiol Immunol Hung 54: 201-235. - Junqueira JC, Fuchs BB, Muhammed M, Coleman JJ, Suleiman JM, et al. (2011) Пероральные изоляты Candida albicans от ВИЧ-позитивных людей обладают такой же in vitro биопленкообразующей способностью и патогенностью, что и инвазивные изоляты Candida. ВМС Микробиол 11: 247.
- Сильва С., Энрикес М., Оливейра Р., Уильямс Д., Азередо Дж. (2010) Активность биопленки in vitro видов Candida, не относящихся к Candida albicans. Curr Microbiol 61: 534-540.
- Holmstrup P, Axell T (1990) Классификация и клинические проявления оральных дрожжевых инфекций. Acta Odontol Scand 48: 57-59.
- Samaranayake LP, Кеунг-Леунг В., Джин Л. (2009). Грибковые инфекции слизистой оболочки полости рта. Пародонтол 2000 49: 39-59.
- Farah CS, Lynch N, McCullough MJ (2010) Грибковые инфекции полости рта: обновленная информация для врачей общей практики.
 Ост Дент Дж. 55: 48-54.
Ост Дент Дж. 55: 48-54. - Williams DW, Kuriyama T, Silva S, Malic S, Lewis MA (2011)Биопленки Candida и кандидоз полости рта: лечение и профилактика. Пародонтол 2000 55: 250-265.
- Martin R, Wächtler B, Schaller M, Wilson D, Hube B (2011)Взаимодействия хозяин-патоген и гены, связанные с вирулентностью, во время инфекций полости рта Candida albicans. Int J Med Microbiol 301: 417-422.
- Gow NA, Hube B (2012) Важность клеточной стенки Candida albicans во время комменсализма и инфекции. Curr Opin Microbiol 15: 406-412.
- Sitheeque MAM Samaranayake LP (2003) Хронический гиперпластический кандидоз/кандидоз (кандидозная лейкоплакия). Clin Rev Oral Biol Med 14: 253-267.
- Гонсалес-Гарсия Р.Х., Састре-Перес М.Ф., Муньос-Гуэрра Л., Наваль-Гиас Ф.Дж., Родригес-Кампо К. и др. (2006)Кандидоз гиперплазии хронической слизистой оболочки полости рта. Rev Esp Cir Oral и Maxilofac 28.
- Liu X, Hua H (2007) Оральные проявления хронического кожно-слизистого кандидоза: семь сообщений о случаях заболевания.
 J Oral Pathol Med 36: 528-532.
J Oral Pathol Med 36: 528-532. - Rhodus NL (2012) Лечение кандидоза полости рта. Северо-западная стоматология 91: 32-33.
- Odds FC (1991) Количественная система микрокультуры со стандартизированным инокулятом для типирования штаммов, тестирования чувствительности и других физиологических измерений Candida albicans и других дрожжей. J Clin Microbiol 29: 2735-2740.
- Баумгартнер К., Фрейдьер А.М., Гилле Ю. (1996) Прямая идентификация и распознавание видов дрожжей из клинического материала с использованием чашек Albicans ID и CHROMagar Candida. J Clin Microbiol 34: 454-456.
- Pfaller MA, Houston A, Coffmann S (1996) Применение CHROMagar Candida для быстрого скрининга клинических образцов на Candida albicans, Candida tropicalis, Candida krusei и Candida (Torulopsis) glabrata. J Clin Microbiol 34: 58-61.
© 2022, Copyrights Herald Scholarly Open Access. Все права защищены!
Джоан | Бесплатный полнотекстовый | Кандидоз полости рта: патофизиология и передовая практика диагностики, классификации и успешного лечения
1.
 Введение
Введение Виды Candida могут быть как комменсалами, так и условно-патогенными микроорганизмами полости рта [1]. Род Candida включает более 150 видов аспорогенных дрожжей, широко распространенных в окружающей среде [2]. Большинство видов не могут жить при температуре человеческого тела [2,3], поэтому лишь ограниченное число видов Candida безвредно живет во рту, глазах, желудочно-кишечном тракте, влагалище и коже [2,3,4,5, 6,7,8,9]. Сообщается, что распространенность Candida albicans (C. albicans), выделенных из полости рта, составляет от 30 до 50 % здорового населения в целом, 50–65 % людей, носящих зубные протезы, 65–88 % людей, проживающих в учреждения длительного ухода и 90-95% лиц с инфекцией вируса иммунодефицита человека (ВИЧ), а также у пациентов, получающих кортикостероиды, химиотерапию, иммунодепрессанты или лучевую терапию по поводу рака головы и шеи [1,2,4,10,11, 12,13]. При дисбалансе нормальной оральной флоры или неадекватной иммунной защите Candida может разрастаться, вызывая грибковую инфекцию, называемую оральным кандидозом или молочницей. Термины кандидоз полости рта и кандидоз являются синонимами. В этом исследовании термин кандидоз используется вместо кандидоза, потому что суффикс «-osis» соответствует окончанию, используемому для подавляющего большинства грибковых инфекций, тогда как окончание «-iasis» используется для паразитарных заболеваний [5].
Термины кандидоз полости рта и кандидоз являются синонимами. В этом исследовании термин кандидоз используется вместо кандидоза, потому что суффикс «-osis» соответствует окончанию, используемому для подавляющего большинства грибковых инфекций, тогда как окончание «-iasis» используется для паразитарных заболеваний [5].
Более 17 видов Candida могут вызывать инфекцию слизистой оболочки полости рта и глубоких тканей. Хотя C. albicans остается наиболее частым возбудителем кандидоза, впоследствии увеличилась частота выделения не-albicans видов Candida (NAC) из поражений полости рта и кровотока [4, 5, 6, 7, 14, 15, 16, 17]. ]. Наиболее известными были C. glabrata и C. parapsilosis, за которыми следуют C. tropicalis и C. Krusei. На четыре вида Candida плюс C. albicans приходится более 90% случаев орального или диссеминированного кандидоза и кандидемии [5,6,7,8,9].,10]. Этот сдвиг видов с более высокой частотой кандидоза, вызванного видами NAC, стал основным фактором, влияющим на заболеваемость и ведение пациентов, которые находятся в отделениях интенсивной терапии (ОИТ) или имеют важные факторы риска, такие как гематологические злокачественные новообразования, трансплантаты. , большие абдоминальные операции и/или длительное лечение кортикостероидами, поскольку существует растущая противогрибковая резистентность наряду с широким диапазоном минимальных ингибирующих концентраций (МИК) к флуконазолу между видами Candida [16,17,18,19].,20,21]. Все C. krusei по своей природе устойчивы к флуконазолу, и инфекции, вызванные этим видом, тесно связаны с предшествующей профилактикой флуконазолом и нейтропенией [15, 16, 17, 18, 19, 20, 21]. Растущая доля C. glabrata устойчива к флуконазолу. C. tropicalis и C. parapsilosis обычно чувствительны к азолам; однако C. tropicalis менее чувствителен к флуконазолу, чем C. albicans. Кроме того, видовое распространение и устойчивость к эхинокандину демонстрируют значительные различия между медицинскими центрами и странами [16,17,21]. Характеристики пациентов и предшествующая противогрибковая терапия также оказывают значительное влияние на распространение и частоту возникновения видов Candida независимо от географического региона.
, большие абдоминальные операции и/или длительное лечение кортикостероидами, поскольку существует растущая противогрибковая резистентность наряду с широким диапазоном минимальных ингибирующих концентраций (МИК) к флуконазолу между видами Candida [16,17,18,19].,20,21]. Все C. krusei по своей природе устойчивы к флуконазолу, и инфекции, вызванные этим видом, тесно связаны с предшествующей профилактикой флуконазолом и нейтропенией [15, 16, 17, 18, 19, 20, 21]. Растущая доля C. glabrata устойчива к флуконазолу. C. tropicalis и C. parapsilosis обычно чувствительны к азолам; однако C. tropicalis менее чувствителен к флуконазолу, чем C. albicans. Кроме того, видовое распространение и устойчивость к эхинокандину демонстрируют значительные различия между медицинскими центрами и странами [16,17,21]. Характеристики пациентов и предшествующая противогрибковая терапия также оказывают значительное влияние на распространение и частоту возникновения видов Candida независимо от географического региона.
Кандидоз полости рта привлек значительное внимание с момента появления ВИЧ-инфекции и увеличения распространенности скомпрометированных лиц благодаря современным терапевтическим достижениям. Оральный кандидоз на самом деле является смешанной инфекцией видов Candida. На три основных вида C. albicans (наиболее распространенные; более 50%), C. tropicalis и C. glabrata приходится более 80% случаев кандидоза полости рта, поскольку они могут уклоняться от антимикробной активности лизоцима слюны и легко прилипать к пластмассе зубных протезов. поверхностей [5,6,7,22]. Tobgi и Samaranayake и MacFarlane сообщили о значимой зависимости доза-реакция между концентрацией лизоцима и фунгицидной активностью. При тестировании различных видов Candida C. krusei и C. parapsilosis оказались наиболее чувствительными к лизоциму по сравнению с C. albicans и C. glabrata, которые были наименее чувствительными [22]. Относительно высокая резистентность C. albicans и C. glabrata к лизоциму может частично объяснить их высокую пероральную распространенность как среди носителей, так и у пациентов с оральным кандидозом [22,23,24]. Смешанная колонизация C. albicans и C. glabrata может усиливать грибковую инвазию и повреждение эпителиальных тканей полости рта [25]. Помимо колонизации необходимы и другие факторы риска. У пациентов с ослабленным иммунитетом отсутствие надлежащего лечения кандидоза полости рта может привести к хронической персистирующей инфекции или инвазивному кандидозу, что может привести к некротизирующему язвенному мукозиту, гнойному кандидозу, воспалительной папиллярной гиперплазии твердого неба, кандидозу ротоглотки и пищевода или потенциально летальному системному кандидозу, например как кандидозный эндокардит [2,7,26,27]. У пациентов с кандидемией или инвазивным кандидозом могут наблюдаться лихорадка, дисфагия, плохое питание, медленное выздоровление или длительное пребывание в больнице с высокой смертностью до 79% [2,4,17]. Хотя у большинства пациентов не развивается кандидемия, более половины всех случаев диссеминированного кандидоза или кандидемии остаются недиагностированными на момент смерти [2, 5, 7, 16, 17].
Смешанная колонизация C. albicans и C. glabrata может усиливать грибковую инвазию и повреждение эпителиальных тканей полости рта [25]. Помимо колонизации необходимы и другие факторы риска. У пациентов с ослабленным иммунитетом отсутствие надлежащего лечения кандидоза полости рта может привести к хронической персистирующей инфекции или инвазивному кандидозу, что может привести к некротизирующему язвенному мукозиту, гнойному кандидозу, воспалительной папиллярной гиперплазии твердого неба, кандидозу ротоглотки и пищевода или потенциально летальному системному кандидозу, например как кандидозный эндокардит [2,7,26,27]. У пациентов с кандидемией или инвазивным кандидозом могут наблюдаться лихорадка, дисфагия, плохое питание, медленное выздоровление или длительное пребывание в больнице с высокой смертностью до 79% [2,4,17]. Хотя у большинства пациентов не развивается кандидемия, более половины всех случаев диссеминированного кандидоза или кандидемии остаются недиагностированными на момент смерти [2, 5, 7, 16, 17]. Таким образом, Candida в культуре крови никогда не следует рассматривать как контаминант и всегда следует искать источник фунгемии. Заболеваемость кандидемией явно превышает заболеваемость инвазивным аспергиллезом и мукормикозом и стала важной внутрибольничной инфекцией в больницах [15,16,17].
Таким образом, Candida в культуре крови никогда не следует рассматривать как контаминант и всегда следует искать источник фунгемии. Заболеваемость кандидемией явно превышает заболеваемость инвазивным аспергиллезом и мукормикозом и стала важной внутрибольничной инфекцией в больницах [15,16,17].
Кандидоз полости рта обычно легко поддается лечению с хорошим прогнозом, но эрадикация грибка для достижения микологического излечения затруднена [2,4,5]. В связи с этим возникает вопрос, является ли рецидив вторичной инфекцией или результатом персистирующих клеток Candida. Клинически безуспешное лечение или рецидив кандидоза полости рта не редкость из-за неправильного диагноза, отсутствия другой патологии, неспособности исправить основные предрасполагающие факторы или неправильного назначения противогрибковых средств, таких как повторяющееся использование пероральной суспензии нистатина, неадекватная продолжительность лечения, и снижение чувствительности к лекарственным препаратам или увеличение количества азол-резистентных штаммов со временем [2,7,16,20]. Среди этих ловушек устранение идентифицируемых предрасполагающих факторов считается главным приоритетом в предотвращении рецидива или неэффективности лечения кандидоза полости рта.
Среди этих ловушек устранение идентифицируемых предрасполагающих факторов считается главным приоритетом в предотвращении рецидива или неэффективности лечения кандидоза полости рта.
Исторически сложилось так, что оральный кандидоз называют афоризмом «болезнь больных», поэтому у пациентов с оральным кандидозом следует вызывать подозрение [1,2,5]. Это может быть отражением основного системного заболевания, такого как ВИЧ/СПИД, недостаточность питания, анемия, сахарный диабет, синдром Кушинга, лейкопения, гипотиреоз, терминальная стадия заболеваний почек или печени, а также гематологические злокачественные новообразования лейкемии, множественной миеломы или лимфомы. (Фигура 1). Другие белые поражения ротовой полости, в том числе красный плоский лишай, лихеноидная реакция, хроническая реакция «трансплантат против хозяина», лейкоплакия и плоскоклеточный рак, могут влиять на эффективность слизистого барьера и затем стать суперинфекцией с кандидозом полости рта [4,5,6,7]. ]. Эти основные факторы риска обычно более важны, чем сам кандидоз полости рта.
На основе наших предыдущих исследований и более чем 30-летней практики оральной медицины в медицинском центре [28, 29, 30, 31, 32], этот обзор описывает патофизиологию кандидоза полости рта и предлагает передовой опыт диагностики, практическую классификацию и успешное ведение пациентов с этим заболеванием.
2. Взаимодействие защитных сил хозяина и факторов вирулентности Candida при оральном кандидозе
Системные факторы хозяина обычно считаются важнейшей этиологией в развитии кандидозной инфекции полости рта, а виды Candida являются чисто условно-патогенными микроорганизмами, которые вызывают болезненное состояние, когда защитные силы хозяина неадекватны [1,2,26,27]. Однако эта концепция была изменена, поскольку местные факторы хозяина, такие как аномалии эпителия полости рта, изменение барьера слизистой оболочки, нарушение функции слюнных желез, вдыхание стероидов, ношение зубных протезов, частое курение и диета, богатая углеводами, также предрасполагают к оральному кандидозу (табл. 1) [1,2,4,26,33,34]. Эпителиальные клетки ротовой полости являются первой линией защиты от инфекции Candida, функционируя как физический барьер. У здорового человека поверхностная слизистая оболочка защищает хозяина от Candida, потому что постоянное шелушение слизистой оболочки полости рта происходит со скоростью, превышающей кандидозный рост. Скорость потока слюны, ее количество и качество влияют на микробный клиренс в полости рта. Слюна обеспечивает многие компоненты адаптивного и врожденного иммунного ответа, имеющие решающее значение для местной защиты хозяина. Слюна содержит противогрибковые факторы, такие как лизоцим, лактопероксидаза, лактоферрин и полипептиды, богатые гистидином, которые помогают контролировать популяции Candida в ротовой полости [2,5,7]. Повышенные уровни IgA, секреторного IgA (sIgA) и лизоцима, наблюдаемые у пациентов с кандидозным стоматологическим стоматитом, могут играть защитную роль [5,26]. IgA слюны также может усиливать неспецифический антимикробный эффект лактопероксидазной системы [26].
1) [1,2,4,26,33,34]. Эпителиальные клетки ротовой полости являются первой линией защиты от инфекции Candida, функционируя как физический барьер. У здорового человека поверхностная слизистая оболочка защищает хозяина от Candida, потому что постоянное шелушение слизистой оболочки полости рта происходит со скоростью, превышающей кандидозный рост. Скорость потока слюны, ее количество и качество влияют на микробный клиренс в полости рта. Слюна обеспечивает многие компоненты адаптивного и врожденного иммунного ответа, имеющие решающее значение для местной защиты хозяина. Слюна содержит противогрибковые факторы, такие как лизоцим, лактопероксидаза, лактоферрин и полипептиды, богатые гистидином, которые помогают контролировать популяции Candida в ротовой полости [2,5,7]. Повышенные уровни IgA, секреторного IgA (sIgA) и лизоцима, наблюдаемые у пациентов с кандидозным стоматологическим стоматитом, могут играть защитную роль [5,26]. IgA слюны также может усиливать неспецифический антимикробный эффект лактопероксидазной системы [26].
Кандидоз полости рта обычно возникает у новорожденных и пожилых людей. Незрелый иммунный механизм новорожденных и сниженная иммунная защита у пожилых людей являются основными этиологическими факторами в патогенезе кандидоза ротовой полости [4,5]. Однако важны и другие сопутствующие факторы, такие как плохая гигиена полости рта, курение и зубные протезы. Курение сигарет может вызвать повышенную кератинизацию эпителия, снижение уровня IgA в слюне и возможное угнетение функции полиморфноядерных лейкоцитов, что может привести к избыточному росту и колонизации Candida [7,26,27]. Оральное носительство видов Candida минимально у лиц с полной адентией до установки протезов, но частота носительства имеет тенденцию к увеличению вскоре после ношения протеза [5]. Длительное ношение зубных протезов, плохая гигиена зубных протезов и травмы слизистой оболочки являются важными местными факторами, способствующими развитию кандидозного зубного стоматита. Микросреда слизистой оболочки неба с протезом имеет низкое содержание кислорода, в значительной степени лишена слюны и имеет низкий кислый рН, что может способствовать активности гидролитических ферментов вирулентности Candida, обеспечивая инвазию в ткани хозяина и избегание защитных механизмов хозяина. 1,5,35,36]. Кроме того, кандидозная колонизация полости рта и кандидоз, очевидно, усиливают ятрогенные факторы, такие как широкое применение антибиотиков широкого спектра действия, иммунодепрессантов, цитостатиков, нейролептиков и антидепрессантов, кортикостероидов, ингаляционных стероидов или воздействие облучения [1,2,7,26]. ].
1,5,35,36]. Кроме того, кандидозная колонизация полости рта и кандидоз, очевидно, усиливают ятрогенные факторы, такие как широкое применение антибиотиков широкого спектра действия, иммунодепрессантов, цитостатиков, нейролептиков и антидепрессантов, кортикостероидов, ингаляционных стероидов или воздействие облучения [1,2,7,26]. ].
Превращение видов Candida из безвредных комменсалов в болезнетворные условно-патогенные микроорганизмы связано со сложным набором взаимодействий между атрибутами вирулентности организма и защитой хозяина [1,5,26,33,34,35,36 ,37,38,39,40,41,42,43,44,45,46,47,48,49,50,51,52,53]. Кандидозная адгезия к слизистой оболочке полости рта является важным этапом в процессе колонизации и инфицирования [7, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46]. Процесс адгезии сложен и многофакторен. Это связано с взаимодействием дрожжевых клеток, клеток-хозяев и различных факторов окружающей среды, таких как слюна, сахара и рН [1, 5, 7, 33, 34, 35, 36, 37, 38, 39]. ,40,41,42,43,44,45,46]. Candida является так называемым совершенным патогеном, обладающим замечательной способностью обнаруживать изменения в окружающей среде и соответствующим образом реагировать путем фенотипического переключения клеточной физиологии и морфологии с дрожжей на гифы или псевдогифы, которые облегчают проникновение в эпителий [39]. Клетки гиф обладают одним принципиальным свойством направленного роста (тигмотропизм), позволяющим грибу активно проникать в межклеточные соединения. В дополнение к активному проникновению C. albicans может проникать в клетки-хозяева, используя эндоцитоз, пассивный, индуцированный грибами, но управляемый клеткой-хозяином процесс, при котором литические ферменты и инвазины, экспрессируемые на гифах, связываются с E-кадгерином и другими межэпителиальными соединениями и разрушают их. белки клеточного соединения, позволяющие организмам проникать в эпителиальные клетки [1,34,35,36,38,39,40,41]. Клетки C. albicans также обладают фибриллярным слоем, расположенным на самой внешней поверхности клеточной стенки.
,40,41,42,43,44,45,46]. Candida является так называемым совершенным патогеном, обладающим замечательной способностью обнаруживать изменения в окружающей среде и соответствующим образом реагировать путем фенотипического переключения клеточной физиологии и морфологии с дрожжей на гифы или псевдогифы, которые облегчают проникновение в эпителий [39]. Клетки гиф обладают одним принципиальным свойством направленного роста (тигмотропизм), позволяющим грибу активно проникать в межклеточные соединения. В дополнение к активному проникновению C. albicans может проникать в клетки-хозяева, используя эндоцитоз, пассивный, индуцированный грибами, но управляемый клеткой-хозяином процесс, при котором литические ферменты и инвазины, экспрессируемые на гифах, связываются с E-кадгерином и другими межэпителиальными соединениями и разрушают их. белки клеточного соединения, позволяющие организмам проникать в эпителиальные клетки [1,34,35,36,38,39,40,41]. Клетки C. albicans также обладают фибриллярным слоем, расположенным на самой внешней поверхности клеточной стенки. Эти структуры могут улучшить прилипание, обеспечить устойчивость к соскабливанию, а также сопротивляться приливу слюны и фагоцитозу [5,7]. C. albicans при оральном кандидозе также демонстрирует высокую частоту изменений морфологии колоний между белыми и непрозрачными формами [5,7,42,43]. Режимы высокочастотного переключения потенцируют патогенные механизмы, включая способность (1) внедряться и размножаться в самых различных средах организма, (2) ускользать от иммунной системы за счет изменения поверхностной антигенности, (3) способствовать проникновению в ткани за счет продукции гидролитических ферментов, (4) образуют биопленку и (5) избегают противогрибкового лечения [1,5,7,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49,50]. Важной особенностью клеточной поверхности дрожжей C. albicans является наличие рецепторов к фрагментам комплемента С3. Патогенность C. albicans повышается за счет связывания C3, поскольку фагоцитарное поглощение дрожжей нейтрофилами человека нарушается [1,5,7,26].
Эти структуры могут улучшить прилипание, обеспечить устойчивость к соскабливанию, а также сопротивляться приливу слюны и фагоцитозу [5,7]. C. albicans при оральном кандидозе также демонстрирует высокую частоту изменений морфологии колоний между белыми и непрозрачными формами [5,7,42,43]. Режимы высокочастотного переключения потенцируют патогенные механизмы, включая способность (1) внедряться и размножаться в самых различных средах организма, (2) ускользать от иммунной системы за счет изменения поверхностной антигенности, (3) способствовать проникновению в ткани за счет продукции гидролитических ферментов, (4) образуют биопленку и (5) избегают противогрибкового лечения [1,5,7,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49,50]. Важной особенностью клеточной поверхности дрожжей C. albicans является наличие рецепторов к фрагментам комплемента С3. Патогенность C. albicans повышается за счет связывания C3, поскольку фагоцитарное поглощение дрожжей нейтрофилами человека нарушается [1,5,7,26]. Кроме того, совместная адгезия C. albicans с бактериями имеет решающее значение для ее устойчивости, и наблюдался широкий спектр синергетических взаимодействий с различными пероральными видами для усиления колонизации хозяина [37,46,47]. Поэтому для устранения кандидоза ротовой полости необходимы как противогрибковая терапия, так и адекватная гигиена полости рта.
Кроме того, совместная адгезия C. albicans с бактериями имеет решающее значение для ее устойчивости, и наблюдался широкий спектр синергетических взаимодействий с различными пероральными видами для усиления колонизации хозяина [37,46,47]. Поэтому для устранения кандидоза ротовой полости необходимы как противогрибковая терапия, так и адекватная гигиена полости рта.
Рост Candida в слюне или богатой углеводами питательной среде часто сопровождается образованием кислоты и сопутствующим снижением pH до очень низкого уровня. Диапазон pH, способствующий росту кандидоза, составляет около 3,0–8,0, при этом оптимальными условиями для роста являются значения pH в диапазоне 5,1–6,9 [54]. Однако C. albicans и некоторые другие виды могут хорошо расти при рН менее 2,0 [54]. Низкокислотные условия подавляют бактериальную флору, но способствуют росту кандидоза и прикреплению к эпителиальным поверхностям [5,35,45,54,55]. Эти кислые метаболиты, такие как пируваты и ацетаты, обладают мощным цитопатическим потенциалом, который может способствовать интенсивному воспалению слизистой оболочки [5,7,35,41,42,43,44,45,46,47,48]. Диетические углеводы могут модулировать развитие биопленки C. albicans, влияя на ее факторы вирулентности и структурные особенности [51].
Диетические углеводы могут модулировать развитие биопленки C. albicans, влияя на ее факторы вирулентности и структурные особенности [51].
Основным компонентом клеточной стенки Candida являются углеводы, составляющие 80~90% сухого веса клетки [5]. Высокоуглеводная диета или плохой гликемический контроль у пациентов с диабетом могут способствовать пролиферации Candida и увеличению выработки гидролитических ферментов, таких как секретируемые аспартилпротеиназы (SAP) и фосфолипазы (LP), способные разрушать базальную мембрану, внеклеточный матрикс и эпителиальный слой. клеточные соединения, которые не только усиливают инвазию дрожжей в измененный эпителий полости рта, но также обладают прямой цитотоксичностью и вызывают воспаление слизистой оболочки, наблюдаемое при атрофическом или эритематозном кандидозе [1,5,7,35,48,51]. SAP и LP могут переваривать и разрушать клеточные мембраны, состоящие из фосфолипидов со встроенным белком. SAP также позволяют Candida уклоняться от защиты хозяина, разрушая молекулы иммунной системы хозяина, включая антитела и антимикробные пептиды [5,35,48]. Кроме того, исследование на мышиной модели показало, что индуцированное гифами повреждение эпителия в основном опосредовано секрецией цитолитического пептидного токсина, называемого кандидализином, который необходим для развития кандидоза полости рта [1,40,49].,50]. Исследования in vitro, проведенные Samaranayake et al. показали, что использование обогащенной глюкозой слюны, смешанной с добавленными антибиотиками, для подавления роста бактерий приводит к быстрому снижению рН с 7,5 до 3,2 в течение 48 часов, что сопровождается ростом дрожжей [5, 55, 56]. Эти результаты показывают, что сахар может способствовать росту дрожжей [5, 51, 52, 55, 56, 57]. Например, некоторые молодые люди в настоящее время могут не любить пить чистую воду, но пить газированные напитки и напитки, содержащие большое количество сахара и способствующие росту грибка полости рта. Клинически у многих молодых людей развился ангулярный хейлит, атрофический глоссит, диффузный эритематозный кандидоз, а также необузданный пришеечный кариес («содовые зубы»), что насторожило настоящего исследователя в восприятии сахарного диабета и дефицита железа (ЖД) у этих лиц (рис.
Кроме того, исследование на мышиной модели показало, что индуцированное гифами повреждение эпителия в основном опосредовано секрецией цитолитического пептидного токсина, называемого кандидализином, который необходим для развития кандидоза полости рта [1,40,49].,50]. Исследования in vitro, проведенные Samaranayake et al. показали, что использование обогащенной глюкозой слюны, смешанной с добавленными антибиотиками, для подавления роста бактерий приводит к быстрому снижению рН с 7,5 до 3,2 в течение 48 часов, что сопровождается ростом дрожжей [5, 55, 56]. Эти результаты показывают, что сахар может способствовать росту дрожжей [5, 51, 52, 55, 56, 57]. Например, некоторые молодые люди в настоящее время могут не любить пить чистую воду, но пить газированные напитки и напитки, содержащие большое количество сахара и способствующие росту грибка полости рта. Клинически у многих молодых людей развился ангулярный хейлит, атрофический глоссит, диффузный эритематозный кандидоз, а также необузданный пришеечный кариес («содовые зубы»), что насторожило настоящего исследователя в восприятии сахарного диабета и дефицита железа (ЖД) у этих лиц (рис. 1). ). Исследования показывают, что слюна пациентов с ДЖ или диабетом может способствовать росту Candida in vitro [7,8,51,52,53]. Анализ чувствительности in vivo к противогрибковым средствам в сочетании с глюкозой у инфицированных мышей с диабетом показал, что увеличение концентрации глюкозы также снижает активность противогрибковых средств [52]. Таким образом, кандидоз полости рта может поразить любого человека, если определенные заболевания, стресс, зубные протезы, диета или лекарства нарушают местный или системный иммунный баланс. Candida может не только пассивно, но и активно участвовать в процессе патогенеза развития кандидоза полости рта. Патогенности Candida может способствовать ряд факторов вирулентности (табл. 2).
1). ). Исследования показывают, что слюна пациентов с ДЖ или диабетом может способствовать росту Candida in vitro [7,8,51,52,53]. Анализ чувствительности in vivo к противогрибковым средствам в сочетании с глюкозой у инфицированных мышей с диабетом показал, что увеличение концентрации глюкозы также снижает активность противогрибковых средств [52]. Таким образом, кандидоз полости рта может поразить любого человека, если определенные заболевания, стресс, зубные протезы, диета или лекарства нарушают местный или системный иммунный баланс. Candida может не только пассивно, но и активно участвовать в процессе патогенеза развития кандидоза полости рта. Патогенности Candida может способствовать ряд факторов вирулентности (табл. 2).
3. Дефицит железа и иммуносупрессия при оральном кандидозе
У пациентов была диагностирована железодефицитная анемия (ЖДА), когда у мужчин гемоглобин (Hb) < 13 г/дл, у женщин Hb < 12 г/дл, и все они уровень железа в сыворотке < 60 мг/дл в соответствии с критериями Всемирной организации здравоохранения [58]. ЖЖ дополнительно характеризуется низким уровнем ферритина в сыворотке и низкой насыщенностью трансферрина (Fe/ОЖСС < 16%) или высокой общей железосвязывающей способностью (ОЖСС) [28, 58]. ЖДА классически описывается как микроцитарная, гипохромная анемия и повышение ширины распределения эритроцитов (RDW) [28,30,58]. Диагностика ДЖ с анемией или без нее не всегда проста. ДЗ имеет тенденцию развиваться медленно, происходит адаптация, и пациенты часто терпят свои симптомы и считают их нормальными. Они узнают об улучшении только тогда, когда симптомы исчезнут [28]. Несколько исследователей заметили связь между ДЖ и кандидозом полости рта [14, 57, 58, 59].,60,61,62,63,64,65,66,67,68,69,70,71,72,73,74,75,76,77,78]. Выявлена высокая распространенность ДЖ у пациентов с диффузным хроническим кожно-слизистым кандидозом (КМС), также может возникать дефицит витаминов [5,59]. CMC представляет собой группу заболеваний, которые обычно проявляются в детстве и характеризуются рецидивирующими и персистирующими кандидозными инфекциями, поражающими кожу, ногти, слизистую оболочку полости рта и половых органов.
ЖЖ дополнительно характеризуется низким уровнем ферритина в сыворотке и низкой насыщенностью трансферрина (Fe/ОЖСС < 16%) или высокой общей железосвязывающей способностью (ОЖСС) [28, 58]. ЖДА классически описывается как микроцитарная, гипохромная анемия и повышение ширины распределения эритроцитов (RDW) [28,30,58]. Диагностика ДЖ с анемией или без нее не всегда проста. ДЗ имеет тенденцию развиваться медленно, происходит адаптация, и пациенты часто терпят свои симптомы и считают их нормальными. Они узнают об улучшении только тогда, когда симптомы исчезнут [28]. Несколько исследователей заметили связь между ДЖ и кандидозом полости рта [14, 57, 58, 59].,60,61,62,63,64,65,66,67,68,69,70,71,72,73,74,75,76,77,78]. Выявлена высокая распространенность ДЖ у пациентов с диффузным хроническим кожно-слизистым кандидозом (КМС), также может возникать дефицит витаминов [5,59]. CMC представляет собой группу заболеваний, которые обычно проявляются в детстве и характеризуются рецидивирующими и персистирующими кандидозными инфекциями, поражающими кожу, ногти, слизистую оболочку полости рта и половых органов. CMC, вероятно, является наиболее трудноизлечимым кандидозным заболеванием; однако коррекция дефицита железа или витаминов иногда может быть полезной [5, 57, 59].]. Хиггс и Уэллс сообщили, что у 23 из 31 пациента с КМЦ был дефицит железа, а терапия препаратами железа привела к значительному улучшению у 9 из 11 этих пациентов [59]. Клинически маловероятно, что дефицит одного питательного вещества является единственным фактором, ответственным за хронический кандидоз полости рта, но ИД может вызывать стойкую грибковую инфекцию, которую трудно искоренить, пока сохраняется дефицит [14, 28, 60, 61, 62, 63].
CMC, вероятно, является наиболее трудноизлечимым кандидозным заболеванием; однако коррекция дефицита железа или витаминов иногда может быть полезной [5, 57, 59].]. Хиггс и Уэллс сообщили, что у 23 из 31 пациента с КМЦ был дефицит железа, а терапия препаратами железа привела к значительному улучшению у 9 из 11 этих пациентов [59]. Клинически маловероятно, что дефицит одного питательного вещества является единственным фактором, ответственным за хронический кандидоз полости рта, но ИД может вызывать стойкую грибковую инфекцию, которую трудно искоренить, пока сохраняется дефицит [14, 28, 60, 61, 62, 63].
В моем предыдущем исследовании сообщалось о первом восприятии ДЖ или ДЗ анемии (ЖДА) из-за изменений слизистой оболочки полости рта у 64 пациентов, у которых была высокая частота кандидоза полости рта (85%). Это привело к разнообразным клиническим формам, включая ангулярный хейлит (63%), атрофический глоссит (59%).%), псевдомембранозный кандидоз (44%), эритематозный кандидоз (41%), срединный ромбовидный глоссит (5%), хронический кожно-слизистый кандидоз (5%), папиллярно-гиперпластический кандидоз (3%) и хейлокандидоз (3%). ИД глоссит с разной степенью папиллярной атрофии часто сопровождался псевдомембранозным или эритематозным кандидозом [28]. У всех пациентов (50 ДДА и 14 ДД без анемии) было относительно мало симптомов, кроме усталости. Тем не менее, изменения слизистой оболочки полости рта появились. ID было достаточно, чтобы стимулировать оральные проявления даже при отсутствии анемии. Кроме того, колоректальный рак был обнаружен у 12,5% больных ЖДА старше 65 лет [28]. Поэтому важно выяснить происхождение ЖДА, поскольку она может быть первым признаком злокачественного заболевания [28, 62, 63, 64].
ИД глоссит с разной степенью папиллярной атрофии часто сопровождался псевдомембранозным или эритематозным кандидозом [28]. У всех пациентов (50 ДДА и 14 ДД без анемии) было относительно мало симптомов, кроме усталости. Тем не менее, изменения слизистой оболочки полости рта появились. ID было достаточно, чтобы стимулировать оральные проявления даже при отсутствии анемии. Кроме того, колоректальный рак был обнаружен у 12,5% больных ЖДА старше 65 лет [28]. Поэтому важно выяснить происхождение ЖДА, поскольку она может быть первым признаком злокачественного заболевания [28, 62, 63, 64].
Возможность персистирующей кандидозной инфекции при ДЖ может быть обусловлена нарушением клеточного иммунитета [59,60,61,62,63,64,65,66,67,68,69,70,71,72,73,74, 75,76,77,78]. Тем не менее, нарушение функции лимфоцитов не может полностью объяснить поражение полости рта и рост Candida в слюне, поскольку он в равной степени подавлен у пациентов с поражением полости рта и без него. Таким образом, местные факторы, такие как влияние недостатка железа на изменение микрофлоры полости рта и аномалии эпителия, могут иметь важное значение [14, 28, 74, 75, 76, 77, 78]. Железо необходимо для роста всех клеток. Широкий спектр неэритроидных изменений ДЖ, включая аномалии эпителия полости рта, атрофический гастрит и тонкие и ломкие ногти, такие как койлонихии, может возникать раньше, чем отмечаются значительные изменения морфологии эритроцитов или уровня гемоглобина (Hb) [14, 72,73,74,75,76,77,78]. Оральные эпителиальные аномалии являются одними из наиболее частых и важных изменений, которые обеспечивают подходящую среду для кандидозного роста, ответственного за оральный кандидоз [14,28,65]. Во многих исследованиях сообщалось о очень значительном уменьшении общей толщины эпителия, особенно толщины зоны созревания, и низких уровнях железосодержащих ферментов в буккальном эпителии у пациентов с дефицитом железа [14,68]. Продолжающаяся ИД приводит к снижению уровня гемоглобина, который переносит недостаточное количество кислорода к слизистой оболочке полости рта и, в конечном итоге, приводит к атрофии слизистой оболочки [28,68]. В последующем ИД может вызывать снижение иммунитета к инфекции из-за нарушения клеточного иммунитета, недостаточной бактерицидной активности полиморфноядерных лейкоцитов, неадекватного гуморального ответа и аномалии эпителия [14, 28, 70, 71, 72, 73, 74, 75, 76, 77, 78].
Железо необходимо для роста всех клеток. Широкий спектр неэритроидных изменений ДЖ, включая аномалии эпителия полости рта, атрофический гастрит и тонкие и ломкие ногти, такие как койлонихии, может возникать раньше, чем отмечаются значительные изменения морфологии эритроцитов или уровня гемоглобина (Hb) [14, 72,73,74,75,76,77,78]. Оральные эпителиальные аномалии являются одними из наиболее частых и важных изменений, которые обеспечивают подходящую среду для кандидозного роста, ответственного за оральный кандидоз [14,28,65]. Во многих исследованиях сообщалось о очень значительном уменьшении общей толщины эпителия, особенно толщины зоны созревания, и низких уровнях железосодержащих ферментов в буккальном эпителии у пациентов с дефицитом железа [14,68]. Продолжающаяся ИД приводит к снижению уровня гемоглобина, который переносит недостаточное количество кислорода к слизистой оболочке полости рта и, в конечном итоге, приводит к атрофии слизистой оболочки [28,68]. В последующем ИД может вызывать снижение иммунитета к инфекции из-за нарушения клеточного иммунитета, недостаточной бактерицидной активности полиморфноядерных лейкоцитов, неадекватного гуморального ответа и аномалии эпителия [14, 28, 70, 71, 72, 73, 74, 75, 76, 77, 78]. Это указывает на то, что ID, действующий либо локально, либо через системные механизмы, может быть вовлечен в патогенез кандидоза полости рта. Это также дает новое представление о том, что терапия железом может принести пользу в лечении кандидоза полости рта.
Это указывает на то, что ID, действующий либо локально, либо через системные механизмы, может быть вовлечен в патогенез кандидоза полости рта. Это также дает новое представление о том, что терапия железом может принести пользу в лечении кандидоза полости рта.
В моем предыдущем исследовании большинство пациентов с ИД субъективно почувствовали улучшение самочувствия в течение нескольких недель терапии препаратами железа [28]. Оральный стоматит полностью разрешился в течение 1–2 мес. Однако для возвращения запасов железа к норме требовалось постоянное пополнение запасов железа в течение 3–6 месяцев. Противогрибковая терапия нистатином в таблетках проводилась пациентам в течение 2–4 недель, что приводило к значительному улучшению при наличии кандидоза полости рта. Некоторые пациенты жаловались на рецидивирующий стоматит из-за неадекватного всасывания железа через несколько лет и снова нуждались в пополнении запасов железа. Это означает, что окончательное разрешение кандидоза ротовой полости зависит от системы защиты хозяина, и длительная диетотерапия важна для пациентов с ЖДА [28].
Другое исследование Lai et al. сообщили о двух пациентах с тимомой, ассоциированной с миастенией, которые страдали рецидивирующим кандидозом полости рта в течение многих лет после тимэктомии и химиолучевой терапии [29]. Сначала наблюдался хороший ответ на обычную противогрибковую терапию, который впоследствии стал рефрактерным. Количественное определение субпопуляции лимфоцитов показало дефицит Т-клеток и снижение отношения CD4/CD8. Вилочковая железа является главной железой иммунитета и краеугольным камнем модуляции созревания Т-лимфоцитов. Левамизол, иммуномодулятор или иммуностимулирующий препарат были добавлены в качестве дополнительной терапии в сочетании с пероральным лечением нистатином. Оральный кандидоз реагировал благоприятно, и было получено значительное облегчение с одновременным увеличением Т-клеток и отношения CD4/CD8 [29].]. Эти результаты ясно демонстрируют значительную роль клеточного иммунитета в оральном кандидозе и то, что окончательная эрадикация инфекции зависит от защиты хозяина.
Использование подсчета клеток CD4 в качестве маркера клинического прогрессирования заболевания хорошо зарекомендовало себя при ВИЧ-инфекции [17,79,80,81,82]. Поставщики помощи при ВИЧ-инфекции часто контролируют количество CD4 у пациента, чтобы оценить эффективность схемы лечения ВИЧ и определить, упало ли количество клеток до уровня, при котором человек может подвергаться риску определенных оппортунистических инфекций. Расположение и интенсивность кандидоза у пациентов с ВИЧ тесно связаны с тенденцией к снижению количества CD4. По мере прогрессивного снижения количества CD4 увеличивается риск оппортунистических кандидозных инфекций. Когда количество CD4 меньше 400 клеток/мм 3 , существует повышенный риск кандидоза полости рта и влагалища; ниже 200 клеток/мм 3 , существует риск кандидоза ротоглотки; и когда количество CD4 составляет менее 30 клеток/мм 3 , существует повышенный риск кандидоза пищевода или системной кандидемии [80]. В этой клинической ситуации непрерывный прием азольных противогрибковых препаратов, особенно флуконазола, часто приводил к неэффективности лечения и повышению резистентности к противогрибковым препаратам. Однако высокоактивная антиретровирусная терапия (ВААРТ) может контролировать орофарингеальный кандидоз с косвенным влиянием на количество CD4. В рекомендациях по лечению ВИЧ от Американского общества инфекционистов (IDSA) предполагается, что ВААРТ может снизить частоту рецидивов ротоглоточного кандидоза, а постоянная профилактическая противогрибковая терапия обычно не требуется [79].,80,81,82]. Однако некоторые предрасполагающие факторы эрадикировать довольно сложно, если не невозможно, что требует профилактической противогрибковой терапии. Профилактика с прерывистым назначением флуконазола три раза в неделю рекомендуется, когда количество CD4 менее 200 клеток/мм 3 развивается, потому что нистатин часто вызывает плохой ответ и быстрый рецидив орального кандидоза у пациентов с ВИЧ [17,79,80,81, 82]. Однако оптимальная продолжительность профилактики остается известной. Высокая частота орального носительства Candida и кандидоза среди больных ВИЧ/СПИДом подчеркивает, что для предотвращения кандидоза необходима полнофункциональная иммунная система.
Однако высокоактивная антиретровирусная терапия (ВААРТ) может контролировать орофарингеальный кандидоз с косвенным влиянием на количество CD4. В рекомендациях по лечению ВИЧ от Американского общества инфекционистов (IDSA) предполагается, что ВААРТ может снизить частоту рецидивов ротоглоточного кандидоза, а постоянная профилактическая противогрибковая терапия обычно не требуется [79].,80,81,82]. Однако некоторые предрасполагающие факторы эрадикировать довольно сложно, если не невозможно, что требует профилактической противогрибковой терапии. Профилактика с прерывистым назначением флуконазола три раза в неделю рекомендуется, когда количество CD4 менее 200 клеток/мм 3 развивается, потому что нистатин часто вызывает плохой ответ и быстрый рецидив орального кандидоза у пациентов с ВИЧ [17,79,80,81, 82]. Однако оптимальная продолжительность профилактики остается известной. Высокая частота орального носительства Candida и кандидоза среди больных ВИЧ/СПИДом подчеркивает, что для предотвращения кандидоза необходима полнофункциональная иммунная система.
Клинические исследования свидетельствуют о том, что кандидозная инфекция почти всегда обнаруживается у пациентов с тяжелым иммунодефицитом Т-клеточного типа. Однако это редко наблюдается у пациентов с дефектами В-клеток при отсутствии сопутствующих дефектов Т-клеток [83,84,85,86]. Это подразумевает критическую роль клеточно-опосредованных факторов даже на поверхностях слизистых оболочек. Это наблюдение было подтверждено на большинстве моделей хронической кандидозной инфекции полости рта у мышей с иммунодефицитом, у которых отсутствовали Т-лимфоциты; более того, полное исчезновение инфекции у мышей было обнаружено, когда они были восстановлены с помощью функциональных CD4+ Т-клеток [1,83,84,85,86]. Все это, по-видимому, является убедительным доказательством роли клеток CD4 в защите от системного кандидоза, а также важной иммунорегуляторной роли нейтрофилов. Ключевой компонент защиты от Candida, нейтрофилы обычно обнаруживаются в эпителии вокруг гиф. Клетки, продуцирующие интерлейкин (IL)-17, по-видимому, играют ключевую роль в их рекрутировании. Источником IL-17 могут быть CD4+ Т-хелперные клетки 17 (Th27), что подтверждается наблюдениями о том, что пациенты с дефицитом CD4, страдающие ВИЧ/СПИДом, и пациенты с дефицитом Th27 очень восприимчивы к оральному кандидозу [84,86]. Высвобождаемые цитокины (ИЛ-17 и ИЛ-22) в очаге инфекции рекрутируют нейтрофилы, усиливая секрецию провоспалительных цитокинов и хемокинов [1]. Адаптивный иммунный ответ Th27-типа в основном участвует в защите слизистой оболочки хозяина, контролируя начальный рост Candida и ингибируя последующую инвазию в ткани [1,83]. IL-17 и IL-22 напрямую влияют на эпидермальный иммунитет и продемонстрировали свою связь с защитой от многих экспериментальных и человеческих инфекций C. albicans [1,84,85,86].
Источником IL-17 могут быть CD4+ Т-хелперные клетки 17 (Th27), что подтверждается наблюдениями о том, что пациенты с дефицитом CD4, страдающие ВИЧ/СПИДом, и пациенты с дефицитом Th27 очень восприимчивы к оральному кандидозу [84,86]. Высвобождаемые цитокины (ИЛ-17 и ИЛ-22) в очаге инфекции рекрутируют нейтрофилы, усиливая секрецию провоспалительных цитокинов и хемокинов [1]. Адаптивный иммунный ответ Th27-типа в основном участвует в защите слизистой оболочки хозяина, контролируя начальный рост Candida и ингибируя последующую инвазию в ткани [1,83]. IL-17 и IL-22 напрямую влияют на эпидермальный иммунитет и продемонстрировали свою связь с защитой от многих экспериментальных и человеческих инфекций C. albicans [1,84,85,86].
CMC представляет собой инфекционный фенотип у пациентов с наследственным или приобретенным дефицитом Т-клеток. Наследственная форма CMC характеризуется первичным иммунодефицитом, связанным с нарушением ответов IL-17 и IL-22 [84,85,86]. Было идентифицировано несколько моногенетических дефектов, вызывающих CMC, но наиболее частая форма CMC является результатом гетерозиготных аутосомно-доминантных мутаций с усилением функции в сигнальном преобразователе и активаторе транскрипции (STAT) 1 [86]. Существуют также синдромальные формы CMC, такие как синдром аутосомно-доминантного гипер-IgE (HIES), вызванный нарушением STAT3. Несмотря на различия в клинической картине STAT1-CMC и STAT3-HIES, оба заболевания демонстрируют сопоставимое снижение иммунитета Th27 и Th32 и недостаточную секрецию IL-17, что приводит к недостаточному набору нейтрофилов из кровотока и неспособности сдерживать рост грибков на слизистой оболочке. 1,85,86]. Индукция дифференцировки Th27- и Th32-клеток была возможна у пациентов STAT1-CMC в различной степени in vitro, о чем свидетельствовало увеличение частоты клеток, но было невозможно преодолеть дефекты Th27 и Th32 у пациентов STAT3-HIES. Важное различие в двух группах пациентов предполагает активное участие Т-клеточных рецепторов в качестве терапевтической стратегии для улучшения противогрибкового ответа при STAT1-CMC [86]. Диффузная КМК с ранним началом является наиболее тяжелой формой и обычно не поддается лечению; даже инфекция остается относительно поверхностной [5,84,85,86].
Существуют также синдромальные формы CMC, такие как синдром аутосомно-доминантного гипер-IgE (HIES), вызванный нарушением STAT3. Несмотря на различия в клинической картине STAT1-CMC и STAT3-HIES, оба заболевания демонстрируют сопоставимое снижение иммунитета Th27 и Th32 и недостаточную секрецию IL-17, что приводит к недостаточному набору нейтрофилов из кровотока и неспособности сдерживать рост грибков на слизистой оболочке. 1,85,86]. Индукция дифференцировки Th27- и Th32-клеток была возможна у пациентов STAT1-CMC в различной степени in vitro, о чем свидетельствовало увеличение частоты клеток, но было невозможно преодолеть дефекты Th27 и Th32 у пациентов STAT3-HIES. Важное различие в двух группах пациентов предполагает активное участие Т-клеточных рецепторов в качестве терапевтической стратегии для улучшения противогрибкового ответа при STAT1-CMC [86]. Диффузная КМК с ранним началом является наиболее тяжелой формой и обычно не поддается лечению; даже инфекция остается относительно поверхностной [5,84,85,86]. Многие попытки коррекции наследственных иммунных дефектов у больных КМЦ с помощью иммунорегуляторов левамизола, тимозина и ткани тимуса плода или инфузии лейкоцитов дают лишь преходящие эффекты [2,66,85]. Были предприняты попытки хирургического вмешательства или криотерапии для удаления стойких поражений полости рта, но долгосрочные преимущества этих процедур ненадежны [5,59].,85]. Эти данные ясно демонстрируют значительную роль дефектов клеточного иммунитета в патогенезе кандидоза полости рта.
Многие попытки коррекции наследственных иммунных дефектов у больных КМЦ с помощью иммунорегуляторов левамизола, тимозина и ткани тимуса плода или инфузии лейкоцитов дают лишь преходящие эффекты [2,66,85]. Были предприняты попытки хирургического вмешательства или криотерапии для удаления стойких поражений полости рта, но долгосрочные преимущества этих процедур ненадежны [5,59].,85]. Эти данные ясно демонстрируют значительную роль дефектов клеточного иммунитета в патогенезе кандидоза полости рта.
4. Диагностика кандидоза полости рта
Клинически различные формы кандидоза полости рта, а именно псевдомембранозный кандидоз, эритематозный кандидоз, ангулярный хейлит, атрофический глоссит, срединный ромбовидный глоссит (МРГ), зубной стоматит, хейлокандидоз, кожно-слизистый кандидоз, гиперпластический кандидоз может быть идентифицирован орофарингеальный кандидоз или редкий гнойный кандидоз [5,28]. Кандидоз полости рта часто представляет собой многоочаговые и смешанные формы, которые обычно протекают бессимптомно или проявляются болезненностью, неприятным вкусом и ощущением жжения. Он может длиться недели, месяцы и даже годы, особенно у пациентов с диффузным КМЦ.
Он может длиться недели, месяцы и даже годы, особенно у пациентов с диффузным КМЦ.
Диагноз любой формы кандидоза полости рта в основном клинический и основан на прямом распознавании поражения. Обычно нет необходимости выполнять биопсию, за исключением случаев кандидозной лейкоплакии [28,87,88]. Реакция на противогрибковые препараты указывает на то, что этиологией является кандидоз полости рта. Микробиологические исследования необходимы при диагностических сомнениях, резистентности к противогрибковым препаратам или необходимости корректировки дозы противогрибкового препарата, как у пациентов с иммунодефицитом [5,87,88]. Диагноз может быть подтвержден микробиологическим исследованием либо путем окрашивания мазка из пораженного участка периодической кислотой-Шиффом (PAS) или окрашиванием метенамин-серебром Гомори (GMS), либо путем посева мазка из полоскания рта с использованием агара Сабуро. Образец должен быть взят из активного свежего поражения; старые поражения часто не содержат жизнеспособных организмов [5,7,88]. Однако обнаружение Candida в полости рта не всегда свидетельствует об инфекции, поскольку это распространенный комменсальный организм во рту. Корреляция между лабораторными данными и клиническими проявлениями остается краеугольным камнем в диагностике кандидоза полости рта. Эффективность противогрибковых препаратов помогает в диагностике. Серологические тесты, фенотипирование или генетические молекулярные методы могут быть полезны при системных грибковых инфекциях и имеют как диагностическое, так и прогностическое значение. Также доступен ряд упрощенных, быстрых и чувствительных коммерческих наборов для идентификации видов Candida, основанных либо на обнаружении роста дрожжей в различных субстратах, либо на наблюдении за реакцией антиген-антитело [5,7,89].]. Наиболее широко используются системы быстрой идентификации дрожжей, такие как API 20C и ID 32C [5,89]. Однако они в основном основаны на биохимических тестах и/или интерпретации цвета, часто охватывают лишь узкий круг видов и требуют последующего культивирования в течение 24–72 часов для получения идентификации.
Однако обнаружение Candida в полости рта не всегда свидетельствует об инфекции, поскольку это распространенный комменсальный организм во рту. Корреляция между лабораторными данными и клиническими проявлениями остается краеугольным камнем в диагностике кандидоза полости рта. Эффективность противогрибковых препаратов помогает в диагностике. Серологические тесты, фенотипирование или генетические молекулярные методы могут быть полезны при системных грибковых инфекциях и имеют как диагностическое, так и прогностическое значение. Также доступен ряд упрощенных, быстрых и чувствительных коммерческих наборов для идентификации видов Candida, основанных либо на обнаружении роста дрожжей в различных субстратах, либо на наблюдении за реакцией антиген-антитело [5,7,89].]. Наиболее широко используются системы быстрой идентификации дрожжей, такие как API 20C и ID 32C [5,89]. Однако они в основном основаны на биохимических тестах и/или интерпретации цвета, часто охватывают лишь узкий круг видов и требуют последующего культивирования в течение 24–72 часов для получения идентификации. Более новый метод масс-спектрометрии с лазерной десорбцией и ионизацией с использованием матрицы (MALDI-TOF) имеет преимущество, заключающееся в сокращении времени культивирования до 24 часов и идентификации видов Candida в течение нескольких минут [9].0,91]. Масс-спектрометрия MALDI-TOF зарекомендовала себя как быстрый и надежный метод идентификации штаммов Candida в клинической лаборатории.
Более новый метод масс-спектрометрии с лазерной десорбцией и ионизацией с использованием матрицы (MALDI-TOF) имеет преимущество, заключающееся в сокращении времени культивирования до 24 часов и идентификации видов Candida в течение нескольких минут [9].0,91]. Масс-спектрометрия MALDI-TOF зарекомендовала себя как быстрый и надежный метод идентификации штаммов Candida в клинической лаборатории.
Системные факторы, влияющие на патогенез кандидоза полости рта, часто включают иммунный статус и факторы питания хозяина. Измененные иммунные функции, такие как тяжелая лейкопения или лимфопения, часто являются наиболее важными факторами, предрасполагающими к грибковой инфекции [4]. Измененный статус питания, в том числе дефицит гематина или диета, богатая углеводами, действует совместно с рядом кофакторов [5,7,28,57]. Мои предыдущие исследования показали, что ценность гематологических исследований при обследовании пациентов с необъяснимой болью во рту важна, особенно у тех, у кого нет других очевидных причин [28,30]. Гематологические исследования состоят из общего анализа крови (CBC), включая гемоглобин (Hb), гематокрит (Hct), средний корпускулярный объем (MCV) и ширину распределения эритроцитов (RDW), измеряемую как стандартное отклонение (SD). Можно использовать предложенную классификацию анемии по MCV и RDW исследования Бессмана [9].2]. Оценку сывороточного уровня ферритина, железа, общей железосвязывающей способности (ЖССЖ), сывороточного B12 и фолиевой кислоты следует проводить при подозрении на дефицит железа и витаминов [28, 30, 92, 93, 94, 95, 96, 97]. ]. Дальнейший скрининг на ВИЧ-инфекцию, диабет, заболевания печени или почек и злокачественные новообразования необходимо проводить, когда история болезни пациента и данные медицинского осмотра указывают на возможную патологию. Каждый пациент должен быть проконсультирован гематологом или врачом для дальнейшего обследования и лечения.
Гематологические исследования состоят из общего анализа крови (CBC), включая гемоглобин (Hb), гематокрит (Hct), средний корпускулярный объем (MCV) и ширину распределения эритроцитов (RDW), измеряемую как стандартное отклонение (SD). Можно использовать предложенную классификацию анемии по MCV и RDW исследования Бессмана [9].2]. Оценку сывороточного уровня ферритина, железа, общей железосвязывающей способности (ЖССЖ), сывороточного B12 и фолиевой кислоты следует проводить при подозрении на дефицит железа и витаминов [28, 30, 92, 93, 94, 95, 96, 97]. ]. Дальнейший скрининг на ВИЧ-инфекцию, диабет, заболевания печени или почек и злокачественные новообразования необходимо проводить, когда история болезни пациента и данные медицинского осмотра указывают на возможную патологию. Каждый пациент должен быть проконсультирован гематологом или врачом для дальнейшего обследования и лечения.
5. Классификация кандидоза полости рта
Традиционно наиболее часто используемая классификация кандидоза полости рта, предложенная Lehner в 1966 г. , разделяла кандидоз полости рта на острые и хронические типы псевдомембранозного кандидоза и атрофический кандидоз. Lehner признал, что хронический гиперпластический кандидоз полости рта был частым проявлением CMC [5,98]. Он предложил дальнейшее подразделение хронического гиперпластического кандидоза на четыре группы в зависимости от характера локализации и вовлечения эндокринной системы: (1) хронический кандидоз полости рта, (2) синдром эндокринного кандидоза, (3) хронический локализованный кожно-слизистый кандидоз и (4) хронический диффузный кандидоз. кандидоз [5,98,99,100,101]. Однако последнее подразделение гиперпластического кандидоза ротовой полости вызвало некоторую путаницу, особенно между CMC и гиперплазией. Более того, атрофический кандидоз был истолкован как эритематозный кандидоз, поскольку более чем в 60% случаев наблюдается увеличение толщины эпителия, а не атрофия [5,28]. Несколько исследователей заметили, что красный цвет кандидоза полости рта кажется более распространенным, чем белые поражения.
, разделяла кандидоз полости рта на острые и хронические типы псевдомембранозного кандидоза и атрофический кандидоз. Lehner признал, что хронический гиперпластический кандидоз полости рта был частым проявлением CMC [5,98]. Он предложил дальнейшее подразделение хронического гиперпластического кандидоза на четыре группы в зависимости от характера локализации и вовлечения эндокринной системы: (1) хронический кандидоз полости рта, (2) синдром эндокринного кандидоза, (3) хронический локализованный кожно-слизистый кандидоз и (4) хронический диффузный кандидоз. кандидоз [5,98,99,100,101]. Однако последнее подразделение гиперпластического кандидоза ротовой полости вызвало некоторую путаницу, особенно между CMC и гиперплазией. Более того, атрофический кандидоз был истолкован как эритематозный кандидоз, поскольку более чем в 60% случаев наблюдается увеличение толщины эпителия, а не атрофия [5,28]. Несколько исследователей заметили, что красный цвет кандидоза полости рта кажется более распространенным, чем белые поражения. Профессор Йенс Йорген Пиндборг, всемирно известный оральный патолог, заявил, что, когда наши предшественники окрестили гриб Candida, что означает белый, они не осознавали, что кандидоз чаще всего характеризуется красным цветом [5].
Профессор Йенс Йорген Пиндборг, всемирно известный оральный патолог, заявил, что, когда наши предшественники окрестили гриб Candida, что означает белый, они не осознавали, что кандидоз чаще всего характеризуется красным цветом [5].
Holmstrup и Bessermann в 1983 г. предложили дихотомическую классификацию кандидоза полости рта, которая выделила и разделила кандидоз, ограниченный тканями полости рта и периоральной области, на одну группу как первичный кандидоз полости рта, а другие заболевания, при которых кандидоз полости рта с сопутствующей генерализованной системной кожно-слизистой кандидозной инфекцией, классифицировали как вторичный кандидоз полости рта [5,99]. Первичный кандидоз полости рта четко описал все известные формы заболевания, включая острые и хронические типы псевдомембранозного кандидоза и эритематозного кандидоза, кандид-ассоциированный ангулярный хейлит и хронический бляшковидный или узелковый кандидоз [5,9].8,99].
Для кандидоза полости рта с сопутствующими системными поражениями слизистых оболочек (вторичный кандидоз полости рта) общая классификация ККМ, предложенная Odds в 1988 г. , включала шесть категорий: (1) ККМ с эндокринопатией, (2) семейная ККМ с эндокринопатией, (3) семейная ККМ с эндокринопатией. CMC без эндокринопатии, (4) идиопатическая CMC с началом в юношеском возрасте, (5) идиопатическая CMC с началом в зрелом возрасте старше 20 лет и (6) CMC, связанная с тимомой [5, 98, 99, 100, 101]. Однако этиология КМЦ многогранна и включает взаимодействие генетических, гормональных и иммунологических факторов. Всегда есть пациенты с CMC, которых нельзя легко ограничить одним подразделением; более того, подавляющее большинство случаев КМК в настоящее время чаще встречается у взрослых пациентов с приобретенными заболеваниями, связанными с иммуносупрессией, такими как ЖДА, сахарный диабет, нейтропения, эндокринопатия или ВИЧ/СПИД. Разнообразная природа КМЦ и связанных с ней заболеваний делает практически невозможным разделение многочисленных и разнообразных проявлений заболевания в жесткой системе классификации без затруднений и путаницы [5, 101]. Хронический кандидозный стоматит при диффузном КМЦ первоначально является псевдомембранозным, а затем вскоре приводит к хроническим гиперпластическим поражениям, которые представляют собой плоские или приподнятые белые прилипшие бляшки, поражающие любую поверхность слизистой оболочки полости рта.
, включала шесть категорий: (1) ККМ с эндокринопатией, (2) семейная ККМ с эндокринопатией, (3) семейная ККМ с эндокринопатией. CMC без эндокринопатии, (4) идиопатическая CMC с началом в юношеском возрасте, (5) идиопатическая CMC с началом в зрелом возрасте старше 20 лет и (6) CMC, связанная с тимомой [5, 98, 99, 100, 101]. Однако этиология КМЦ многогранна и включает взаимодействие генетических, гормональных и иммунологических факторов. Всегда есть пациенты с CMC, которых нельзя легко ограничить одним подразделением; более того, подавляющее большинство случаев КМК в настоящее время чаще встречается у взрослых пациентов с приобретенными заболеваниями, связанными с иммуносупрессией, такими как ЖДА, сахарный диабет, нейтропения, эндокринопатия или ВИЧ/СПИД. Разнообразная природа КМЦ и связанных с ней заболеваний делает практически невозможным разделение многочисленных и разнообразных проявлений заболевания в жесткой системе классификации без затруднений и путаницы [5, 101]. Хронический кандидозный стоматит при диффузном КМЦ первоначально является псевдомембранозным, а затем вскоре приводит к хроническим гиперпластическим поражениям, которые представляют собой плоские или приподнятые белые прилипшие бляшки, поражающие любую поверхность слизистой оболочки полости рта. Эти толстые белые бляшки не стираются; даже инфекция остается относительно поверхностной (рис. 2).
Эти толстые белые бляшки не стираются; даже инфекция остается относительно поверхностной (рис. 2).
Ангулярный хейлит и атрофический глоссит остаются наиболее распространенными проявлениями дефицита гематина в полости рта, требующими дальнейшего изучения с помощью анализов крови [28,30,61]. Ангулярный хейлит считается компонентом хронического многоочагового кандидоза. Предлежание может быть односторонним, но чаще двусторонним. Однако ангулярный хейлит может быть как инфекционной, так и неинфекционной этиологии. Значительная часть поражений обусловлена кандидозной инфекцией или синергической инфекцией видами Candida и Staphylococcus aureus, что было показано микробиологическими исследованиями [5,28,9].8]. Атрофический глоссит известен как острый атрофический кандидоз или кандидозный глоссит. Кандидозный глоссит может проявляться псевдомембранозным или эритематозным кандидозом [28, 102].
Срединный ромбовидный глоссит (MRG), который часто возникает у пациентов с анемией или диабетом, связан с кандидозной инфекцией и не является аномалией развития, так как редко встречается у детей [28, 103, 104]. MRG характеризуется центральной папиллярной атрофией, которая проявляется в виде центральной эллиптической или ромбовидной области атрофии и эритемы по средней линии задней части спинки языка, впереди желобовидных сосочков. Из этих поражений можно выделить высокие уровни Candida, и биопсия из этого поражения обычно дает Candida более чем в 85% случаев [104]. МРГ как вариант эритематозного кандидоза может быть подтвержден полным ответом на противогрибковую терапию (рис. 3) [28, 103, 104]. Однако полная регенерация сосочка при MRG может не происходить при длительно существующем поражении. Однако иссечение поражения обычно не требуется.
MRG характеризуется центральной папиллярной атрофией, которая проявляется в виде центральной эллиптической или ромбовидной области атрофии и эритемы по средней линии задней части спинки языка, впереди желобовидных сосочков. Из этих поражений можно выделить высокие уровни Candida, и биопсия из этого поражения обычно дает Candida более чем в 85% случаев [104]. МРГ как вариант эритематозного кандидоза может быть подтвержден полным ответом на противогрибковую терапию (рис. 3) [28, 103, 104]. Однако полная регенерация сосочка при MRG может не происходить при длительно существующем поражении. Однако иссечение поражения обычно не требуется.
Кандидозный стоматит зубных протезов часто характеризуется хронической эритемой и отеком части или всей слизистой оболочки неба и альвеолярных отростков, контактирующих с зубными протезами. Однако зубной стоматит может проявляться смешанным эритематозным и псевдомембранозным кандидозом, сопровождающимся ангулярным хейлитом (рис. 4). Зубной стоматит наблюдается у 75% носителей зубных протезов, и часто клинические симптомы отсутствуют [1,33,105]. Раздражение от трения неподходящими зубными протезами может повредить слизистый барьер, что приведет к проникновению Candida в ткани, вызывая инфекцию [5,33]. Акриловая основа протеза и материалы для перебазировки протеза действуют как хронический резервуар, позволяющий постоянно засевать Candida на небную ткань; это, в свою очередь, вызывает сильную местную воспалительную реакцию в виде тканевой эритемы и гиперплазии [5,33,105,106]. Это состояние считается классической инфекцией, связанной с биопленкой Candida [5,33]. Три типа протезного стоматита, предложенные Ньютоном в 1962 можно отличить как (1) локализованное простое воспаление или точечную гиперемию; (2) диффузный эритематозный или генерализованный простой тип, поражающий всю слизистую оболочку, покрытую протезом; и (3) зернистый тип (воспалительная папиллярная гиперплазия) с вовлечением центральной части твердого неба и альвеолярных гребней [5,90,91,92]. Гранулярный тип часто встречается в сочетании с генерализованным простым типом.
Раздражение от трения неподходящими зубными протезами может повредить слизистый барьер, что приведет к проникновению Candida в ткани, вызывая инфекцию [5,33]. Акриловая основа протеза и материалы для перебазировки протеза действуют как хронический резервуар, позволяющий постоянно засевать Candida на небную ткань; это, в свою очередь, вызывает сильную местную воспалительную реакцию в виде тканевой эритемы и гиперплазии [5,33,105,106]. Это состояние считается классической инфекцией, связанной с биопленкой Candida [5,33]. Три типа протезного стоматита, предложенные Ньютоном в 1962 можно отличить как (1) локализованное простое воспаление или точечную гиперемию; (2) диффузный эритематозный или генерализованный простой тип, поражающий всю слизистую оболочку, покрытую протезом; и (3) зернистый тип (воспалительная папиллярная гиперплазия) с вовлечением центральной части твердого неба и альвеолярных гребней [5,90,91,92]. Гранулярный тип часто встречается в сочетании с генерализованным простым типом. Однако зернистый тип или воспалительный папиллярный гиперпластический кандидоз может существовать у пациентов с иммунодефицитом, таких как случаи ИД или системной красной волчанки, без зубных протезов (рис. 5) [5,29].,105,106,107].
Однако зернистый тип или воспалительный папиллярный гиперпластический кандидоз может существовать у пациентов с иммунодефицитом, таких как случаи ИД или системной красной волчанки, без зубных протезов (рис. 5) [5,29].,105,106,107].
Кандидозная лейкоплакия или хронический гиперпластический кандидоз бывает гомогенной или узловатой (пятнистой) и, как правило, протекает бессимптомно. Однако нет единого мнения, следует ли называть это поражение кандидозной лейкоплакией или гиперпластическим кандидозом и является ли кандидозная инфекция причиной лейкоплакии или является инфекцией, наложенной на ранее существовавшее поражение. Это может быть подтверждено только наличием гиф Candida в поражении и полным разрешением после эмпирической противогрибковой терапии [5,100]. Биопсия необходима, потому что более высокая частота злокачественной трансформации 9При крапчатой лейкоплакии, инфицированной Candida, сообщалось о -40% по сравнению с 2–6% риском злокачественной трансформации, указанным для гомогенной лейкоплакии в целом [5,7,100]. Дефицит фолиевой кислоты или ДЖ выявлен у 33% больных кандидозной лейкоплакией [5,7]. Однако лишь небольшая часть пациентов с кандидозной лейкоплакией имеют сопутствующие заболевания. Сообщалось о синдроме мальабсорбции, сахарном диабете и астме, которые лечили стероидными ингаляторами [5,7,100].
Дефицит фолиевой кислоты или ДЖ выявлен у 33% больных кандидозной лейкоплакией [5,7]. Однако лишь небольшая часть пациентов с кандидозной лейкоплакией имеют сопутствующие заболевания. Сообщалось о синдроме мальабсорбции, сахарном диабете и астме, которые лечили стероидными ингаляторами [5,7,100].
Орофарингеальный кандидоз может проявляться поражением задней трети языка, мягкого неба, боковой и задней стенок глотки и миндалин. Считается надежным маркером иммуносупрессии или ВИЧ-инфекции, связанной с числом CD4+ Т-лимфоцитов менее 200 клеток/мм 9 .0006 3 [18,19,80,81,108,109,110]. Новый коронавирус (SARS-CoV-2) обладает особыми способностями к распространению и нарушению регуляции иммунных механизмов. Наблюдалось возникновение орофарингеального кандидоза у пациентов с COVID-19 в критическом состоянии [108]. Орофарингеальный кандидоз может быть фактором риска системного кандидоза, особенно у пациентов в критическом состоянии, у которых наблюдается лихорадка, несмотря на антибактериальную терапию и множественные взаимосвязанные факторы риска, такие как тяжелая нейтропения, лимфопения, уремия, трансплантация органов на иммунодепрессантах или наличие инвазивных медицинских устройств и полная парентеральная терапия. питание (рис. 6) [80,83,108,109,110]. Однако агрессивный характер системного кандидоза может быть обусловлен предшествующей неправильной диагностикой и ошибочной терапией. Около трети пациентов с лихорадкой и нейтропенией, не реагирующих на однонедельный курс антибиотикотерапии, страдают системными грибковыми инфекциями. Ранняя эмпирическая противогрибковая терапия имеет решающее значение, поскольку она, очевидно, может снизить смертность. Кроме того, может потребоваться посев крови или раны на грибок для идентификации вида [108, 109, 110].
питание (рис. 6) [80,83,108,109,110]. Однако агрессивный характер системного кандидоза может быть обусловлен предшествующей неправильной диагностикой и ошибочной терапией. Около трети пациентов с лихорадкой и нейтропенией, не реагирующих на однонедельный курс антибиотикотерапии, страдают системными грибковыми инфекциями. Ранняя эмпирическая противогрибковая терапия имеет решающее значение, поскольку она, очевидно, может снизить смертность. Кроме того, может потребоваться посев крови или раны на грибок для идентификации вида [108, 109, 110].
Гнойный кандидоз является редкой клинической формой, которая может проявляться язвенно-некротическим мукозитом, подслизистым абсцессом, целлюлитоподобными инфекциями дермы или остеомиелитом челюстных костей [111,112]. Диагноз часто откладывается до тех пор, пока он не перестанет реагировать на стандартное лечение антибиотиками, а результаты повторных посевов показывают, что возбудителем является Candida. Лечение состоит из хирургического дренирования, санации и применения азольных противогрибковых препаратов (рис. 7).
7).
Юкставермилионный кандидоз представляет собой хроническую самокупирующуюся кандидозную инфекцию красной губы и юкставермилионной кожи у детей раннего возраста или взрослых, которая, по-видимому, провоцируется привычкой облизывать губы или незначительной травмой [113,114]. Эти инфекции обычно проявлялись в виде эритематозных, зудящих, желтых коркообразных бляшек на коже juxtavermilion с шелушением красных поверхностей или без них (рис. 8). Признаки внутриротового кандидоза, особенно потеря нитевидных сосочков языка, могут присутствовать в нескольких случаях. Расстройство имитирует раннюю стадию CMC, но остается в пределах нескольких миллиметров от слизисто-кожного соединения, и пораженные лица, по-видимому, обладают иммунодефицитом [5, 113, 114].
Клинически кандидозная инфекция часто является ведущей причиной хронических язв в полости рта после исключения других возможных причин, таких как травма, кожно-слизистые заболевания, сифилис, новообразования, недостаточность питания или реакция на лекарственные препараты у пациентов в критическом состоянии. Это было основано на клиническом опыте настоящего исследователя в медицинском центре в течение трех десятилетий. Когда прилипшие белые пятна или бляшки отшелушиваются, хронические язвы во рту могут иметь различные аспекты, такие как диффузная эрозия слизистой оболочки с кровотечением, сплошные маленькие круглые язвы или большая язва, покрытая толстым блестящим налетом сероватого или желтоватого цвета. изменения в виде организованного биопленочного материала на инфицированной слизистой оболочке (рис. 9).). Биопленка Candida представляет собой структурированное микробное сообщество, прикрепленное к поверхности и окруженное внеклеточным матриксом собственного производства. Биопленка обычно устойчива к большинству противогрибковых препаратов и ее трудно контролировать с помощью обычной пероральной суспензии нистатина [36,48,51,52,53].
Это было основано на клиническом опыте настоящего исследователя в медицинском центре в течение трех десятилетий. Когда прилипшие белые пятна или бляшки отшелушиваются, хронические язвы во рту могут иметь различные аспекты, такие как диффузная эрозия слизистой оболочки с кровотечением, сплошные маленькие круглые язвы или большая язва, покрытая толстым блестящим налетом сероватого или желтоватого цвета. изменения в виде организованного биопленочного материала на инфицированной слизистой оболочке (рис. 9).). Биопленка Candida представляет собой структурированное микробное сообщество, прикрепленное к поверхности и окруженное внеклеточным матриксом собственного производства. Биопленка обычно устойчива к большинству противогрибковых препаратов и ее трудно контролировать с помощью обычной пероральной суспензии нистатина [36,48,51,52,53].
В этом отчете настоящий исследователь предлагает практическую классификацию кандидоза полости рта на основе клинико-патологических особенностей и локализации (таблица 3). Четыре новых состояния, такие как хейлокандидоз, кандидоз юкставермиллиона, кандидоз ротоглотки и редкий гнойный кандидоз полости рта, включены впервые и могут быть достойны упоминания в этой классификации. Орофарингеальный кандидоз и редкий гнойный кандидоз полости рта являются зловещим признаком инвазивного кандидоза и системной кандидемии [5,108,109].,110,111,112]. Хейлокандидоз, описанный Reade et al. в 1982 г. и ювенильный кандидоз juxtavermillion Bouquot и Fenton в 1988 г. часто игнорируются, которые проявляются вокруг губ пораженных молодых людей и хорошо реагируют на противогрибковую терапию [5,113,114].
Четыре новых состояния, такие как хейлокандидоз, кандидоз юкставермиллиона, кандидоз ротоглотки и редкий гнойный кандидоз полости рта, включены впервые и могут быть достойны упоминания в этой классификации. Орофарингеальный кандидоз и редкий гнойный кандидоз полости рта являются зловещим признаком инвазивного кандидоза и системной кандидемии [5,108,109].,110,111,112]. Хейлокандидоз, описанный Reade et al. в 1982 г. и ювенильный кандидоз juxtavermillion Bouquot и Fenton в 1988 г. часто игнорируются, которые проявляются вокруг губ пораженных молодых людей и хорошо реагируют на противогрибковую терапию [5,113,114].
Наше предыдущее исследование показало, что CMC, связанный с ID или приобретенной иммуносупрессией, может быть первичной кандидозной инфекцией, ограниченной только оральными и периоральными участками [28]. Таким образом, не все случаи CMC были вторичными инфекциями видов Candida с сопутствующим системным кожно-слизистым кандидозом. Предварительная классификация кандидоза полости рта на первичную или вторичную кандидозную инфекцию может быть неуместной, поскольку вторичная инфекция определяется как инфекция, возникающая во время или сразу после лечения другой инфекции или заболевания. Это может быть вызвано первым лечением или изменениями в иммунной системе. Теоретически кандидоз полости рта обычно возникает как вторичная инфекция у пациентов с ослабленным иммунитетом или длительно принимающих стероиды и антибиотики широкого спектра действия. Дихотомическая классификация кандидоза полости рта на первичный кандидоз полости рта, ограниченный оральными и периоральными участками, и вторичный кандидоз полости рта как кандидозное поражение полости рта, сопровождающееся системным ККМ, может привести к значительной путанице [2,9].9]. В исследовании CMC просто подразделяется на врожденный или унаследованный тип с детства и приобретенный тип в более позднем возрасте. Приобретенный тип КМЦ может быть очаговым или диффузным. Новая классификация кандидоза ротовой полости Lu включает все известные формы заболевания, которые могут быть более практичными в использовании (таблица 3). Однако ограничением этой переклассификации является то, что она основана на наблюдениях и опыте одного клинициста за несколько десятилетий практики.
Это может быть вызвано первым лечением или изменениями в иммунной системе. Теоретически кандидоз полости рта обычно возникает как вторичная инфекция у пациентов с ослабленным иммунитетом или длительно принимающих стероиды и антибиотики широкого спектра действия. Дихотомическая классификация кандидоза полости рта на первичный кандидоз полости рта, ограниченный оральными и периоральными участками, и вторичный кандидоз полости рта как кандидозное поражение полости рта, сопровождающееся системным ККМ, может привести к значительной путанице [2,9].9]. В исследовании CMC просто подразделяется на врожденный или унаследованный тип с детства и приобретенный тип в более позднем возрасте. Приобретенный тип КМЦ может быть очаговым или диффузным. Новая классификация кандидоза ротовой полости Lu включает все известные формы заболевания, которые могут быть более практичными в использовании (таблица 3). Однако ограничением этой переклассификации является то, что она основана на наблюдениях и опыте одного клинициста за несколько десятилетий практики. Будущие исследования в этой области выиграют от мнений большего числа клиницистов, чтобы обновлять эту реклассификацию.
Будущие исследования в этой области выиграют от мнений большего числа клиницистов, чтобы обновлять эту реклассификацию.
6. Ведение пациентов с кандидозом полости рта
Кандидоз полости рта является излечимым заболеванием, и прогноз у большинства пациентов обычно положительный [1,2]. Тщательный сбор анамнеза и соответствующее обследование имеют решающее значение для успешного лечения пациентов с кандидозом полости рта. Вероятность развития кандидоза полости рта можно снизить за счет устранения факторов риска и соблюдения эффективной гигиены полости рта. Механические средства для удаления тяжелых кандидозных бляшек из поражений полости рта важны и могут способствовать противогрибковому действию и ускорению заживления (рис. 10) [5,7,112,115].
От первых противогрибковых препаратов, нистатина и амфотерицина в конце 1950-х до начала 21-го века, за 60 лет стало доступно лишь небольшое количество противогрибковых препаратов, и большинство из них являются фунгистатическими. Нистатин остается препаратом первого выбора при оральном кандидозе. Нистатин плохо всасывается в желудочно-кишечном тракте и не оказывает системного действия. Он действует локально, и ключом к хорошей работе является прямой контакт с пораженными тканями при достаточном времени и дозировке. Глотание таблеток или капсул нистатина вместо рассасывания или растворения их во рту неэффективно при лечении кандидоза полости рта [2, 82, 115, 116]. В исследованиях сообщалось, что нистатиновые пастилки отдельно или пастилки и суспензия в комбинации были более эффективны, чем суспензия отдельно [28, 116]. Смывающий эффект слюны или очищающее действие мускулатуры рта имеет тенденцию к снижению концентрации лекарственного средства в суспензии до субтерапевтического уровня. Пациенты должны быть четко проинформированы о необходимости держать капсулу нистатина во рту и медленно сосать в течение более длительного времени (3–5 мин) перед проглатыванием [28]. Клинически многие пациенты с хроническим кандидозом полости рта были невосприимчивы к суспензии нистатина в течение нескольких недель, но быстро реагировали на леденцы с нистатином в течение одной недели.
Нистатин остается препаратом первого выбора при оральном кандидозе. Нистатин плохо всасывается в желудочно-кишечном тракте и не оказывает системного действия. Он действует локально, и ключом к хорошей работе является прямой контакт с пораженными тканями при достаточном времени и дозировке. Глотание таблеток или капсул нистатина вместо рассасывания или растворения их во рту неэффективно при лечении кандидоза полости рта [2, 82, 115, 116]. В исследованиях сообщалось, что нистатиновые пастилки отдельно или пастилки и суспензия в комбинации были более эффективны, чем суспензия отдельно [28, 116]. Смывающий эффект слюны или очищающее действие мускулатуры рта имеет тенденцию к снижению концентрации лекарственного средства в суспензии до субтерапевтического уровня. Пациенты должны быть четко проинформированы о необходимости держать капсулу нистатина во рту и медленно сосать в течение более длительного времени (3–5 мин) перед проглатыванием [28]. Клинически многие пациенты с хроническим кандидозом полости рта были невосприимчивы к суспензии нистатина в течение нескольких недель, но быстро реагировали на леденцы с нистатином в течение одной недели. Продолжительность антимикотического лечения должна быть достаточной. Рекомендуется удвоить время, необходимое для исчезновения клинических признаков инфекции, или продлить противогрибковое лечение не менее чем на четыре недели, чтобы получить более стойкое микологическое излечение после терапии, но соблюдение пациентом местных противогрибковых средств может быть нарушено из-за непереносимости вкуса к нистатина и пролонгированной продолжительности лечения [5,28].
Продолжительность антимикотического лечения должна быть достаточной. Рекомендуется удвоить время, необходимое для исчезновения клинических признаков инфекции, или продлить противогрибковое лечение не менее чем на четыре недели, чтобы получить более стойкое микологическое излечение после терапии, но соблюдение пациентом местных противогрибковых средств может быть нарушено из-за непереносимости вкуса к нистатина и пролонгированной продолжительности лечения [5,28].
Исследования in vitro показали, что хлоргексидин может подавлять противогрибковую активность нистатина. Хлоргексидин может взаимодействовать с нистатином с образованием комплекса, который может сделать оба агента неэффективными против Candida. Это свидетельствует о том, что комбинированную пероральную терапию нистатином и хлоргексидином проводить не следует [28,117]. При кандидозном стоматите зубных протезов неровности акрилового базиса зубного протеза и материалов для перебазировки зубного протеза являются резервуаром гиф Candida и дрожжевых клеток. Удаление дрожжевых клеток с воспаленной слизистой неба без дезинфекции зубных протезов приведет к рецидиву инфекции [1,5,7,28,100]. Крайне важно уничтожить дрожжевые грибки как на слизистой оболочке полости рта, так и в зубных протезах. Пациенты должны быть проинструктированы о следующих мерах предосторожности: (1) снятие зубных протезов во время рассасывания леденцов с нистатином, (2) ношение зубных протезов как можно реже, (3) эффективная гигиена полости рта и зубных протезов, (4) хранение зубных протезов в дезинфицирующим раствором 0,2% хлоргексидина в течение ночи и (5) достаточной продолжительностью противогрибкового лечения.
Удаление дрожжевых клеток с воспаленной слизистой неба без дезинфекции зубных протезов приведет к рецидиву инфекции [1,5,7,28,100]. Крайне важно уничтожить дрожжевые грибки как на слизистой оболочке полости рта, так и в зубных протезах. Пациенты должны быть проинструктированы о следующих мерах предосторожности: (1) снятие зубных протезов во время рассасывания леденцов с нистатином, (2) ношение зубных протезов как можно реже, (3) эффективная гигиена полости рта и зубных протезов, (4) хранение зубных протезов в дезинфицирующим раствором 0,2% хлоргексидина в течение ночи и (5) достаточной продолжительностью противогрибкового лечения.
Во второй линии терапии кандидоза полости рта преобладают азольные противогрибковые препараты. Ранние азолы включают клотримазол, миконазол и кетоконазол, но некоторые недостатки и побочные эффекты ограничивают их использование. Клотримазол и миконазол действуют местно и обладают двойным действием в отношении грамположительных бактерий и Candida. Оба могут быть использованы для лечения ангулярного хейлита. С другой стороны, эрадикация грибка из клинического поражения только с помощью местных противогрибковых средств неадекватна; источником возбудителей кандидозного ангулярного хейлита обычно является полость рта [7]. Кетоконазол в качестве первого противогрибкового средства перорального введения сильно связывается с белками плазмы и плохо проникает в слюну или мочу. Клиницистам больше не следует назначать кетоконазол в качестве терапии первой линии при любых грибковых инфекциях, включая кандидоз полости рта, из-за плохой концентрации в пораженных тканях полости рта и риска тяжелой гепатотоксичности, нефротоксичности, тератогенного действия и побочных лекарственных взаимодействий [118, 119].]. Его использование полезно только тогда, когда другие эффективные противогрибковые средства недоступны или потенциальные преимущества перорального кетоконазола перевешивают потенциальные риски.
С другой стороны, эрадикация грибка из клинического поражения только с помощью местных противогрибковых средств неадекватна; источником возбудителей кандидозного ангулярного хейлита обычно является полость рта [7]. Кетоконазол в качестве первого противогрибкового средства перорального введения сильно связывается с белками плазмы и плохо проникает в слюну или мочу. Клиницистам больше не следует назначать кетоконазол в качестве терапии первой линии при любых грибковых инфекциях, включая кандидоз полости рта, из-за плохой концентрации в пораженных тканях полости рта и риска тяжелой гепатотоксичности, нефротоксичности, тератогенного действия и побочных лекарственных взаимодействий [118, 119].]. Его использование полезно только тогда, когда другие эффективные противогрибковые средства недоступны или потенциальные преимущества перорального кетоконазола перевешивают потенциальные риски.
Триазолы, включая флуконазол, итраконазол, вориконазол и позаконазол, могут использоваться для лечения системных грибковых инфекций, кандидоза ротоглотки и пищевода или кандидоза кожи и слизистых оболочек и для периодической поддерживающей терапии у пациентов со слабой иммунной системой, вызванной лечением рака, трансплантация костного мозга или такие заболевания, как СПИД [79,80,81,82,109,120]. Флуконазол включен в Список основных лекарственных средств Всемирной организации здравоохранения и обладает многими отличительными свойствами, такими как отличная абсорбция в желудочно-кишечном тракте с очень длительным периодом полувыведения из сыворотки и удобная доза один раз в день для всех показаний. Фармакокинетические свойства флуконазола сходны после внутривенного или перорального введения. Он может обеспечить сильную корреляцию между концентрациями в сыворотке, слюне, моче и пораженных тканях. Концентрация в месте инфекции, а не концентрация в сыворотке, является важной противогрибковой активностью [118,119].,120,121,122,123,124]. Введение двукратной обычной суточной дозы флуконазола в качестве нагрузочной дозы является фармакологически рациональным способом более быстрого достижения более высоких равновесных концентраций в крови. Флуконазол выпускается в виде порошка для пероральной суспензии. Показатели клинического излечения и приверженность пациентов к использованию флуконазола выше, чем нистатиновая суспензия для лечения кандидоза полости рта [123].
Флуконазол включен в Список основных лекарственных средств Всемирной организации здравоохранения и обладает многими отличительными свойствами, такими как отличная абсорбция в желудочно-кишечном тракте с очень длительным периодом полувыведения из сыворотки и удобная доза один раз в день для всех показаний. Фармакокинетические свойства флуконазола сходны после внутривенного или перорального введения. Он может обеспечить сильную корреляцию между концентрациями в сыворотке, слюне, моче и пораженных тканях. Концентрация в месте инфекции, а не концентрация в сыворотке, является важной противогрибковой активностью [118,119].,120,121,122,123,124]. Введение двукратной обычной суточной дозы флуконазола в качестве нагрузочной дозы является фармакологически рациональным способом более быстрого достижения более высоких равновесных концентраций в крови. Флуконазол выпускается в виде порошка для пероральной суспензии. Показатели клинического излечения и приверженность пациентов к использованию флуконазола выше, чем нистатиновая суспензия для лечения кандидоза полости рта [123].
Кандидоз часто возникает у пациентов с ослабленным иммунитетом, которые принимают много лекарств, но многие лекарства могут взаимодействовать с азолами. Взаимодействие азолов и схемы лечения пациента необходимо тщательно оценить перед добавлением или отменой азольного препарата. Серьезное взаимодействие с некоторыми препаратами (цизаприд, дофетилид, пимозид, хинидин) может привести к удлинению интервала QT, опасным для жизни желудочковым тахиаритмиям, таким как torsades de pointes или токсический эпидермальный некролиз (ТЭН), и лекарственной реакции с эозинофилией и системными симптомами. ПЛАТЬЕ). У пациентов с плохой функцией почек задержка почечного клиренса азольных противогрибковых препаратов будет повышать концентрацию препарата в сыворотке крови, а также вызывать побочные эффекты, такие как головная боль, тошнота и гепатотоксичность [115, 118, 119].,120,121,122,123,124,125].
Существует большая разница в тестах на чувствительность к противогрибковым препаратам и дозировке флуконазола между видами Candida. Терапевтических концентраций препарата в бляшке может быть недостаточно для уничтожения дрожжей; более того, высокий риск селекции и обогащения азолрезистентных штаммов возрастает после длительного применения [82, 120, 121, 122, 123, 124, 125]. Орофарингеальный кандидоз и кандидоз пищевода остаются важными причинами заболеваемости у пациентов с ВИЧ, несмотря на поразительную способность антиретровирусной терапии восстанавливать иммунитет. Факторы риска азол-резистентного орофарингеального кандидоза у больных СПИДом, такие как низкий уровень CD4, продолжительные или многократные курсы терапии, прерывистая терапия, низкая суточная доза азола (<100 мг/день) и высокая общая кумулятивная доза азола, были идентифицированы [79,80,81,82]. По этим причинам идентификация видов Candida и тестирование на чувствительность к азолам все чаще используются для определения правильного лечения рецидивирующего ротоглоточного кандидоза у пациентов с ВИЧ. Традиционный системный противогрибковый препарат амфотерицина В и более новый противогрибковый препарат эхинокандин (так называемый противогрибковый пенициллин; каспофунгин, микафунгин и анидулафунгин) могут обладать широким спектром активности в отношении видов Candida и терапевтическим выбором второй линии при инвазивном кандидозе [124].
Терапевтических концентраций препарата в бляшке может быть недостаточно для уничтожения дрожжей; более того, высокий риск селекции и обогащения азолрезистентных штаммов возрастает после длительного применения [82, 120, 121, 122, 123, 124, 125]. Орофарингеальный кандидоз и кандидоз пищевода остаются важными причинами заболеваемости у пациентов с ВИЧ, несмотря на поразительную способность антиретровирусной терапии восстанавливать иммунитет. Факторы риска азол-резистентного орофарингеального кандидоза у больных СПИДом, такие как низкий уровень CD4, продолжительные или многократные курсы терапии, прерывистая терапия, низкая суточная доза азола (<100 мг/день) и высокая общая кумулятивная доза азола, были идентифицированы [79,80,81,82]. По этим причинам идентификация видов Candida и тестирование на чувствительность к азолам все чаще используются для определения правильного лечения рецидивирующего ротоглоточного кандидоза у пациентов с ВИЧ. Традиционный системный противогрибковый препарат амфотерицина В и более новый противогрибковый препарат эхинокандин (так называемый противогрибковый пенициллин; каспофунгин, микафунгин и анидулафунгин) могут обладать широким спектром активности в отношении видов Candida и терапевтическим выбором второй линии при инвазивном кандидозе [124].
Стоматологи и врачи должны знать об этих ключевых моментах, обсуждавшихся выше, и должным образом назначать противогрибковые препараты для успешного лечения кандидоза полости рта или ротоглотки, чтобы предотвратить рецидив и системное распространение. Обучение пациентов использованию противогрибковых препаратов также имеет важное значение.
7. Выводы и важные предложения по лечению кандидоза полости рта
- (1)
-
Поддержание хорошей гигиены полости рта и зубных протезов имеет решающее значение. Важно снять зубные протезы на ночь, использовать чистящее средство для зубных протезов или изготовить новый зубной протез, если существует неподходящий протез со стоматитом.
- (2)
-
Полоскание рта после применения ингаляционного стероида помогает предотвратить кандидоз полости рта.
- (3)
-
Глюкоза способствует росту дрожжей, а диета с высоким содержанием углеводов способствует их прикреплению к эпителиальным клеткам ротовой полости.
 Ограничение их потребления полезно для контроля колонизации Candida и инфекции полости рта.
Ограничение их потребления полезно для контроля колонизации Candida и инфекции полости рта. - (4)
-
Удаление тяжелых кандидозных бляшек или биопленки с поражений полости рта механическими средствами может улучшить противогрибковое действие и ускорить заживление.
- (5)
-
Таблетки нистатина значительно превосходят пероральную суспензию нистатина при лечении кандидоза полости рта. Глотание таблеток нистатина, а не рассасывание или растворение их во рту, неэффективно для лечения кандидоза полости рта.
- (6)
-
Продолжительность противогрибкового лечения должна быть достаточной или продлена как минимум на четыре недели для достижения более стойкого микологического излечения.
- (7)
-
Ранняя монотерапия флуконазолом или флуконазол в сочетании с нистатином помогает при лечении ротоглоточного кандидоза, гнойного кандидоза или хронических язв полости рта, связанных с Candida.
- (8)
-
Попытки увеличить количество CD4 у пациентов с ВИЧ/СПИДом или тимомой полезны для лечения кандидоза полости рта.
 ВААРТ может уменьшить рецидивирующий орофарингеальный кандидоз.
ВААРТ может уменьшить рецидивирующий орофарингеальный кандидоз. - (9)
-
Основные предрасполагающие факторы следует выявлять и лечить одновременно, а также регулярно контролировать.
- (10)
-
Окончательная ликвидация кандидоза полости рта осуществляется защитной системой хозяина.
Финансирование
Это исследование финансировалось нашим учреждением и не получало внешнего финансирования.
Заявление Институционального наблюдательного совета
Исследование проводилось в соответствии с рекомендациями Хельсинкской декларации и одобрено Институциональным наблюдательным советом (CGMF IRB 104-2741B). Этот обзор расширил предыдущее исследование, в котором оценивалась диагностика железодефицитной анемии и железодефицитной анемии по воспалению рта и их ответ на лечение.
Заявление об информированном согласии
Информированное согласие было получено от всех участников исследования.
Заявление о доступности данных
В этом обзоре не сообщалось о каких-либо неопубликованных исследованиях.
Конфликт интересов
У автора нет конфликта интересов, относящегося к данной статье.
Ссылки
- Вила, Т.; Султан, А.С.; Монтелонго-Хореги, Д.; Джабра-Ризк, М.А. Кандидоз полости рта: болезнь возможности. J. Fungi 2020 , 6, 15. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Дарвазех, A.M.G.; Дарвазе, Т.А. Что делает оральный кандидоз рецидивирующей инфекцией? Клинический взгляд. Дж. Микол. 2014 , 2014, 1–5. [Google Scholar] [CrossRef]
- Schsuer, F.; Ханшке, Р. Таксономия и экология рода Candida. Микозы 1999 , 42, 12–21. [Google Scholar] [CrossRef]
- Акпан, А.; Морган Р. Кандидоз полости рта. аспирантура. Мед. J. 2002 , 78, 455–459. [Google Scholar] [CrossRef]
- Самаранаяке, Л.П.; Макфарлейн, Т.В. (Ред.) Оральный кандидоз; Баттерворт: Лондон, Великобритания, 19 лет.90; стр. 1–259. [Google Scholar] «> Рунке, М. Эпидемиология инфекций Candida albicans и роль дрожжевых грибков, отличных от Candida albicans. Курс. Цели по наркотикам 2006 , 7, 495–504. [Google Scholar] [CrossRef] [PubMed]
- Supriya, H.; Харишчандра, Р .; Сухасини, PD; Раджалекшми, В. Патогенный механизм Candida albicans в слизистой оболочке полости рта — обзор. Междунар. Дж. Науки о здоровье. Рез. 2016 , 1, 489–497. [Google Scholar]
- Рао, П. Н.; Рао, К.Н. Изучение нормальной флоры конъюнктивы (бактериальной и грибковой) и ее связи с наружными глазными инфекциями. Индийский I. Офтальмол. 1972 , 20, 164–170. [Google Scholar]
- Стапит, П.Р.; Туладхар, Н.Р. Конъюнктивальная флора нормального человеческого глаза. JSM Офтальмол. 2014 , 2, 1021. [Google Scholar]
- Alrayyes, S.F.; Алрувайли, HM; Тахер, И.А.; Элрахави, К.М.; Алмаин, А.Х.; Ашехи, А.О.; Алам, М.К. Оральное кандидозное носительство и связанные с ним показатели риска среди взрослых в Сакаке, Саудовская Аравия.
 BMC Oral Health 2019 , 22, 86. [Google Scholar] [CrossRef][Green Version]
BMC Oral Health 2019 , 22, 86. [Google Scholar] [CrossRef][Green Version] - Зомородян К.; Кавуси, Ф.; Пишдад, Г.Р.; Мехриар, П.; Эбрахими, А .; Бандегани, А .; Пакшир, К. Распространенность оральной колонизации Candida у пациентов с сахарным диабетом. Дж. Микол. Мед. 2016 , 26, 103–110. [Google Scholar] [CrossRef]
- Видья, К.М.; Рао, Великобритания; Ниттайананта, В .; Лю, Х .; Овотаде, Ф. Дж. Микозы полости рта и другие оппонтунистические инфекции при ВИЧ: терапия и возникающие проблемы — отчет о семинаре. Оральный Дис. 2016 , 22, 158–165. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Schelenz, S.; Абдалла, С .; Грей, Г.; Стаббингс, Х .; Гоу, И.; Бейкер, П. Эпидемиология колонизации оральных дрожжей и инфекции у пациентов с гематологическими злокачественными новообразованиями, опухолями головы и шеи и солидными опухолями. Дж. Орал Патол. Мед. 2011 , 40, 83–89.
 [Google Scholar] [CrossRef] [PubMed]
[Google Scholar] [CrossRef] [PubMed] - Ренни, Дж. С.; Макдональд, Д.Г.; Дагг, Дж.Х. Железо и эпителий полости рта: обзор. Дж. Р. Соц. Мед. 1984 , 77, 602–607. [Google Scholar] [CrossRef][Green Version]
- Гвинея, Дж. Глобальные тенденции распространения видов Candida, вызывающих кандидемию. клин. микробиол. Заразить. 2014 , 20, 5–10. [Google Scholar] [CrossRef][Зеленая версия]
- Каур, Р.; Дхакад, MS; Гоял Р.; Кумар, Р. Появление не-albicans видов Candida и противогрибковая резистентность у пациентов отделения интенсивной терапии. Азиатский пакет. Дж. Троп. Биомед. 2016 , 6, 455–460. [Google Scholar] [CrossRef][Green Version]
- Киндос, Г. Эпидемиология кандидемии и инвазивного кандидоза. Меняющееся лицо. Преподобный Ибероам Микол. 2014 , 31, 42–48. [Google Scholar] [CrossRef] [PubMed]
- Патил, С.; Маджумдар, Б.; Сароде, Южная Каролина; Сароде, Г.
 С.; Аван, К.Х. Орофарингеальный кандидоз у ВИЧ-инфицированных пациентов — обновление. Фронт. микробиол. 2018 , 9, 980. [Google Scholar] [CrossRef][Green Version]
С.; Аван, К.Х. Орофарингеальный кандидоз у ВИЧ-инфицированных пациентов — обновление. Фронт. микробиол. 2018 , 9, 980. [Google Scholar] [CrossRef][Green Version] - Томпсон Г.Р., III; Патель, П.К.; Киркпатрик, WR; Вестбрук, Южная Дакота; Берг, Д.; Эрландсен, Дж.; Реддинг, SW; Паттерсон, Т.Ф. Орофарингеальный кандидоз в эпоху антиретровирусной терапии. Оральный сург. Оральный мед. Орал Патол. Оральный радиол. Эндод. 2010 , 109, 488–495. [Google Scholar] [CrossRef][Green Version]
- Yang, YL; Lo, HJ Механизмы устойчивости к противогрибковым средствам. Дж. Микробиол. Иммунол. Заразить. 2001 , 34, 79–86. [Google Scholar]
- Мишра Н.Н.; Прасад, Т .; Шарма, Н.; Паяси, А .; Прасад, Р.; Гупта, Д.К.; Сингх, Р. Патогенность и лекарственная устойчивость Candida albicans и других видов дрожжей. Акта микробиол. Иммунол. Повесили. 2007 , 54, 201–235. [Академия Google] [CrossRef] «> Тобги, Р.С.; Самаранаяке, Л.П.; Макфариэн, Т.В. Чувствительность видов Candida к лизоциму in vitro. Оральный микробиол. Иммунол. 1988 , 3, 36–39. [Google Scholar] [CrossRef]
- Савасдипукса, Н.; Лей, З .; Самнер, LW; Ниёмплой П.; Сангванич, П. Лизоцим с противогрибковой активностью из семян Pithecellobium dulce. Пищевая Технол. Биотехнолог. 2011 , 49, 489–494. [Google Scholar]
- Galvez-Iriqui, AC; Plascencia-Jatomea, M. Lysozymes: Характеристики, механизм действия и технологические применения в борьбе с патогенными микроорганизмами. мекс. Дж. Фитопат. 2020 , 38, 360–383. [Google Scholar] [CrossRef]
- Реддинг, С.В.; Дахия, К.; Киркпатрик, WR; Коко, Би Джей; Паттерсон, Т.Ф.; Фотергилл, А.В.; Ринальди, М.Г.; Thomas, C.R., Jr. Candida glabrata является новой причиной кандидоза ротоглотки у пациентов, получающих лучевую терапию по поводу рака головы и шеи. Оральный сург. Оральный мед.
 Орал Патол. Устное радио. Эндод. 2004 , 97, 47–52. [Google Scholar] [CrossRef] [PubMed]
Орал Патол. Устное радио. Эндод. 2004 , 97, 47–52. [Google Scholar] [CrossRef] [PubMed] - Van Wyk, C.; Стенкамп, К. Факторы хозяина, влияющие на кандидоз полости рта. Юг. фр. Дж. Эпидемиол. Заразить. 2011 , 26, 18–21. [Google Scholar] [CrossRef][Green Version]
- Mayer, FL; Уилсон, Д.; Хубе, Б. Механизм патогенности Candida albicans. Вирулентность 2013 , 4, 119–128. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Lu, S.Y. Восприятие дефицита железа по изменениям слизистой оболочки полости рта, которые свидетельствуют о высокой распространенности кандидозной инфекции. Дж. Формос. Мед. доц. 2016 , 115, 619–627. [Google Scholar] [CrossRef] [PubMed][Зеленая версия]
- Лай, WH; Лу, С.Ю.; Eng, H.L. Левамизол помогает в лечении рефрактерного кандидоза полости рта в двух случаях миастении. Чанг. Гунг Мед. J. 2002 , 25, 606–612. [Google Scholar] [PubMed] «> Lu, S.Y.; Ву, Х.К. Первоначальная диагностика анемии на основании боли во рту и улучшенная классификация анемий по MCV и RDW у 30 пациентов. Оральный сург. Оральный мед. Орал Патол. Оральный радиол. Эндод. 2004 , 98, 679–685. [Google Scholar] [CrossRef]
- Lu, S.Y.; Eng, HL Диагностика вторичных язв во рту, связанных с сифилисом. Чанг. Гунг Мед. Дж. 2002 , 25, 683–688. [Google Scholar]
- Чан, CP; Чанг, JYF; Ван, Ю.П.; Ву, Ю.Х.; Лу, С.Ю.; Sun, A. Красный плоский лишай полости рта — дифференциальный диагноз, сывороточные аутоантитела, гематиновая недостаточность и лечение. Дж. Формос. Мед. доц. 2018 , 117, 756–765. [Google Scholar] [CrossRef]
- Джабра-Ризк, Массачусетс; Конг, Э .; Цуй, К.; Нгуен, М .; Клэнси, К.; Фидель, П.; Новерр, M. Патогенез Candida albicans: соответствие структуре реакции на повреждение микробов-хозяев. Заразить. Иммун. 2016 , 84, 2724–2739. [Google Scholar] [CrossRef][Green Version] «> Höfs, S.; Могаверо, С .; Хубе, Б. Взаимодействие Candida albicans с клетками-хозяевами: факторы вирулентности, защита хозяина, стратегии побега и микробиота. Дж. Микробиол. 2016 , 53, 149–169. [Google Scholar] [CrossRef] [PubMed]
- Schaller, M.; Борелли, К.; Кортинг, ХК; Хубе, Б. Гидролитические ферменты как факторы вирулентности Candida Albicans. Микозы 2005 , 48, 365–377. [Академия Google] [CrossRef] [PubMed]
- Верстрепен, К.Дж.; Клис, Ф.М. Флокуляция, адгезия и образование биопленок у дрожжей. Мол. микробиол. 2006 , 60, 5–15. [Google Scholar] [CrossRef] [PubMed]
- Tenovuo, J.; Молдовяну З.; Местецки, Дж.; Прюитт, К.М.; Рахемтулла, Б.М. Взаимодействие специфических и врожденных факторов иммунитета: IgA усиливает антимикробный эффект лактопероксидазной системы в отношении Streptococcus mutans. Дж. Иммунол. 1982 , 128, 726–731. [Google Scholar] «> De Groot, P.W.; Бадер, О .; де Бур, AD; Вейг, М.; Чаухан, Н. Адгезины в грибковых патогенах человека: клей с большим количеством палочки. Эукариот. Клетка. 2013 , 12, 470–481. [Google Scholar] [CrossRef][Green Version]
- Desai, JV Candida albicans hyphae: от начала роста до инвазии. J. Fungi 2018 , 4, 10. [Google Scholar] [CrossRef][Green Version]
- Phan, QT; Майерс, CL; Фу, Ф .; Шеппард, округ Колумбия; Йемен, М. Р.; Уэлч, WH; Ибрагим, А.С.; Эдвардс, Дж. Э., младший; Filler, SG Als3 представляет собой инвазин Candida albicans, который связывается с кадгеринами и индуцирует эндоцитоз клетками-хозяевами. PLoS биол. 2007 , 5, е64. [Google Scholar] [CrossRef][Зеленая версия]
- Суидергалл, М.; Filler, SG Кандидоз ротоглотки: грибковая инвазия и реакция эпителиальных клеток. PLoS Патог. 2017 , 13, е1006056. [Google Scholar] [CrossRef]
- Soll, D.
 R. Высокочастотное переключение у Candida albicans. клин. микробиол. Ред. 1992 , 5, 183–203. [Google Scholar] [CrossRef] [PubMed]
R. Высокочастотное переключение у Candida albicans. клин. микробиол. Ред. 1992 , 5, 183–203. [Google Scholar] [CrossRef] [PubMed] - Cannon, RD; Чаффин, В.Л. Колонизация является решающим фактором в развитии кандидоза полости рта. Дж. Дент. Образовательный 2001 , 65, 785–787. [Академия Google] [CrossRef]
- Молеро, Г.; Диес-Орехас, Р.; Наварро Гарсия, Ф.; Монтеолива, Л.; Пла, Дж.; Gil, C. Candida albicans: генетика, диморфизм и патогенность. Междунар. микробиол. 1998 , 1, 95–106. [Google Scholar]
- Zhu, W.; Филлер, С.Г. Взаимодействие Candida albicans с эпителиальными клетками. Клеточная микробиология. 2010 , 12, 273–282. [Google Scholar] [CrossRef][Green Version]
- Williams, D.W.; Иордания, RPC; Вэй, XQ; Алвес, К.; Мудрый, член парламента; Уилсон, MJ; Льюис, М. Взаимодействие Candida albicans с эпителиальными поверхностями хозяина. J. Оральная микробиол.
 2013 , 5, 3402. [Google Scholar] [CrossRef]
2013 , 5, 3402. [Google Scholar] [CrossRef] - Silverman, RJ; Ноббс, AH; Викерман, М.М.; Барбур, Мэн; Дженкинсон, Х. Ф. Взаимодействие белка Als3 клеточной стенки Candida albicans с адгезином AspB Streptococcus gordonii способствует развитию смешанных сообществ. Заразить. Иммун. 2010 , 78, 4644–4652. [Google Scholar] [CrossRef][Зеленая версия]
- Уолл, Г.; Монтелонго-Хореги, Д.; Видаль Бонифачо, Б.; Лопес-Рибо, JL; Uppuluri, рост и распространение биопленки P. Candida albicans: вклад в патогенез. Курс. мнение микробиол. 2019 , 11, 1–6. [Google Scholar] [CrossRef] [PubMed]
- Swidergall, M.; Халаджи, М .; Солис, Н.В.; Мойес, Д.Л.; Драммонд, Р.А.; Хубе, Б.; Лионакис, MS; Мердок, К.; Филлер, С.Г.; Naglik, J.R. Кандидализин необходим для рекрутирования нейтрофилов и вирулентности во время системной инфекции Candida albicans. Дж. Заразить. Дис. 2019 , 220, 1477–1488. [Google Scholar] [CrossRef] «> Verma, AH; Ричардсон, Дж. П.; Чжоу, К.; Коулман, Б.М.; Мойес, Д.Л.; Хо, Дж.; Хапплер, А.Р.; Рамани, К .; МакГичи, MJ; Муфазалов, И.А.; и другие. Эпителиальные клетки полости рта организуют врожденный ответ типа 17 на Candida albicans через фактор вирулентности кандидализин. науч. Иммунол. 2017 , 2, eaam8834. [Google Scholar] [CrossRef][Зеленая версия]
- Сантана, Иллинойс; Гонсалвес, Л.М.; Васконселлос, А.А.; да Силва, WJ; Кьюри, Дж. А.; Кьюри, A.A.D.B. Пищевые углеводы модулируют развитие биопленки Candida albicans на поверхности протеза. PLoS ONE 2013 , 8, e64645. [Google Scholar] [CrossRef][Green Version]
- Mandal, S.M.; Махата, Д.; Мильоло, Л.; Парех, А .; Адди, PS; Мандал, М .; Басак, А. Глюкоза напрямую способствует противогрибковой устойчивости грибкового патогена Candida spp. Дж. Биол. хим. 2014 , 289, 25469–25473. [Google Scholar] [CrossRef][Green Version]
- Taff, HT; Митчелл, К.
 Ф.; Эдвард, Дж. А.; Анды, Д.Р. Механизмы лекарственной устойчивости биопленки Candida. Будущая микробиология. 2013 , 8, 1325–1337. [Google Scholar] [CrossRef][Green Version]
Ф.; Эдвард, Дж. А.; Анды, Д.Р. Механизмы лекарственной устойчивости биопленки Candida. Будущая микробиология. 2013 , 8, 1325–1337. [Google Scholar] [CrossRef][Green Version] - Odds, FC; Эббот, А.Б. Простая система для предположительной идентификации Candida albicans и дифференциации штаммов по видам. Сабураудиа 1980 , 18, 301–318. [Академия Google] [CrossRef]
- Самаранаяке, Л.П.; Макфарлейн, Т.В. Факторы, влияющие на адгезию in vitro грибкового орального возбудителя Candida albicans к эпителиальным клеткам человеческого происхождения. Арк. Оральный биол. 1982 , 27, 869–873. [Google Scholar] [CrossRef]
- Абу-Элтин, К.Х. Влияние пищевых углеводов на прилипание in vitro четырех видов Candida к клеткам буккального эпителия человека. Микро. Экол. Здоровье Дис. 2005 , 17, 156–162. [Google Scholar]
- Самаранаяке Л. П. Факторы питания и кандидоз полости рта.
 Дж. Орал Патол. 1986 , 15, 61–65. [Google Scholar] [CrossRef]
Дж. Орал Патол. 1986 , 15, 61–65. [Google Scholar] [CrossRef] - ВОЗ/ЮНИСЕФ/УООН. Оценка, профилактика и контроль железодефицитной анемии: руководство для руководителей программ; Всемирная организация здравоохранения: Женева, Швейцария, 2001 г. [Google Scholar]
- Higgs, J.M.; Уэллс, Р.С. Хронический слизисто-кожный кандидоз: новые подходы к лечению. бр. Дж. Дерматол. 1973 , 89, 179–190. [Google Scholar] [CrossRef]
- Феллер, Л.; Хамисса, Р.А.; Чандран, Р .; Алтини, М .; Леммер, Дж. Оральный кандидоз в связи с оральным иммунитетом. Дж. Орал Патол. Мед. 2014 , 43, 563–569. [Google Scholar] [CrossRef][Green Version]
- Sun, A.; Лин, HP; Ван, Ю.П.; Чан, К.П. Значительная связь дефицита гемоглобина, железа и витамина B12, высокого уровня гомоцистеина и положительных антител к париетальным клеткам желудка с атрофическим глосситом. Дж. Орал Патол. Мед. 2012 , 41, 500–504.
 [Google Scholar] [CrossRef] [PubMed]
[Google Scholar] [CrossRef] [PubMed] - Short, M.W.; Домагальский, Дж. Э. Железодефицитная анемия: оценка и лечение. Являюсь. фам. Врач 2013 , 87, 98–104. [Google Scholar] [PubMed]
- Bermejo, F.; Гарсия-Лопес, С. Руководство по диагностике дефицита железа и железодефицитной анемии при заболеваниях пищеварения. Мировой Ж. Гастроэнтерол. 2009 , 15, 4638–4643. [Google Scholar] [CrossRef] [PubMed]
- Ho, CH; Чау, В.К.; Хсу, ХК; Гау, Дж. П.; Вы, JY; Чен, К.С. Прогностические факторы риска и распространенность злокачественных новообразований у пациентов с железодефицитной анемией на Тайване. Являюсь. Дж. Гематол. 2005 , 78, 108–112. [Академия Google] [CrossRef] [PubMed]
- Ренни, Дж. С.; Хатчеон, А.В.; Макфарлейн, Т.В.; Макдональд, Д.Г. Роль дефицита железа в экспериментально индуцированном оральном кандидозе у крыс. Дж. Мед. микробиол. 1983 , 16, 363–369.
 [Google Scholar] [CrossRef] [PubMed][Green Version]
[Google Scholar] [CrossRef] [PubMed][Green Version] - Флетчер, Дж.; Мазер, Дж.; Льюис, MJ; Уайтинг, Г. Поражения полости рта при железодефицитной анемии: связь с Candida albicans в слюне и с нарушением трансформации лимфоцитов. Дж. Инфек. Дис. 1975 , 131, 44–45. [Академия Google] [CrossRef]
- Мерфи, Северная Каролина; Биссада, Н.Ф. Дефицит железа: недооцененный предрасполагающий фактор ангулярного хейлита. Варенье. Вмятина. доц. 1979 , 99, 640–641. [Google Scholar] [CrossRef]
- Ренни, Дж. С.; Макдональд, Д.Г.; Дауглас, Т.А. Значения гемоглобина, сывороточного железа и трансферрина у взрослых самцов сирийских хомяков (Mesocricetus auratus). лаборатория Аним. 1981 , 15, 35–36. [Google Scholar] [CrossRef]
- Миллер Дж. Л. Железодефицитная анемия: распространенное и излечимое заболевание. Харб Колд Спринг. Перспектива. Мед. 2013 , 3, 1–13. [Google Scholar] [CrossRef] [PubMed][Green Version] «> Кумар, В.; Чоудри, В.П. Дефицит железа и инфекции. Индийский Дж. Педиатр. 2010 , 77, 789–793. [Google Scholar] [CrossRef]
- Надери, Н.; Этаати, З .; Джойбари, М.Р.; Собхани, С.А.; Ташнизи, С.Х. Иммунное отклонение при рецидивирующем вульвовагинальном кандидозе: корреляция с железодефицитной анемией. Иран. Дж. Иммунол. 2013 , 10, 118–126. [Google Scholar]
- Бирд, Дж. Л. Биология железа в иммунной функции, мышечном метаболизме и функционировании нейронов. Дж. Нутр. 2001 , 131, 568С–569С. [Google Scholar] [CrossRef]
- Wharton, B.A. Дефицит железа у детей: диагностика и профилактика. бр. Дж. Гематол. 1999 , 106, 270–280. [Google Scholar] [CrossRef] [PubMed]
- Joynson, DHM; Уокер, Д.М.; Джейкобс, А .; Долби А.Е. Дефекты клеточного иммунитета у больных железодефицитной анемией. Ланцет 1972 , 2, 1058–1059. [Google Scholar] [CrossRef] «> Farthing, M.J.G. Железо и иммунитет. Акта. Педиатр. Сканд. Доп. 1989 , 361, 44–52. [Google Scholar] [CrossRef]
- Киллип, С.; Беннетт, Дж. М.; Чемберс, доктор медицины, железодефицитная анемия. Являюсь. фам. Врач 2007 , 75, 671–678. [Google Scholar]
- Гарри, П.Дж.; Гудвин, Дж. С.; Хант, В.К. Статус железа и анемия у пожилых людей: новые данные и обзор предыдущих исследований. Варенье. Гериатр. соц. 1983 , 31, 389–399. [Google Scholar] [CrossRef] [PubMed]
- Rennie, JS; Макдональд, Г.; Даггс, Дж.Х. Количественный анализ буккального эпителия человека при железодефицитной анемии. Дж. Орал Патол. 1982 , 11, 39–46. [Google Scholar] [CrossRef]
- Паппас, П.Г.; Рекс, Дж. Х.; Собель, JD; Филлер, С.Г.; Dismukes, WE; Уолш, Т.Дж.; Эдвардс, Дж. Э. Американское общество инфекционистов: рекомендации по лечению кандидоза. клин. Заразить. Дис. 2004 , 38, 161–189.
 [Google Scholar] [CrossRef][Green Version]
[Google Scholar] [CrossRef][Green Version] - Bandar, I.N.; Видодо, Д.; Джаузи, С .; Муталиб, А .; Соегондо, С .; Wahyuningsih, R. Корреляция между количеством CD4 и интенсивностью колонизации Candida в ротоглотке ВИЧ-инфицированного/больного СПИДом. Акта Мед. Индоны. 2006 , 38, 119–125. [Google Scholar]
- Романелли Ф.; Matheny, S.C. ВИЧ-инфекция: роль первичной медико-санитарной помощи. Являюсь. фам. Врач 2009 , 80, 946–952. [Google Scholar]
- Паппас П.Г.; Кауфман, Калифорния; Анды, Д.; Бенджамин, Д.К., младший; Каландра, Т.Ф.; Эдвардс, Дж. Э., младший; Филлер, С.Г.; Фишер, Дж. Ф.; Кульберг, Б.Дж.; Остроски-Цейхнер, Л.; и другие. Клинические практические рекомендации по лечению кандидоза: обновление 2009 г., подготовленное Американским обществом инфекционистов. клин. Заразить. Дис. 2009 , 48, 503–535. [Google Scholar] [CrossRef] [PubMed][Green Version] «> Dongari-Bagtzoglou, A.; Фидель, П.Л. Цитокиновые ответы хозяина и защитный иммунитет при орофарингеальном кандидозе. Дж. Дент. Рез. 2005 , 84, 966–977. [Google Scholar] [CrossRef] [PubMed]
- Conti, HR; Гаффен, С.Л. Реакции хозяина на Candida albicans: клетки Th27 и кандидоз слизистых оболочек. микроб. Заразить. 2010 , 12, 518–527. [Google Scholar] [CrossRef][Зеленая версия]
- Ленер Т.; Уилтон, JMA; Иваний Л. Иммунодефицитные состояния при хроническом слизисто-кожном кандидозе. Иммунология 1972 , 22, 755–787. [Google Scholar]
- Хиллер, Дж.; Хагл, Б.; Эффнер, Р.; Пуэль, А .; Шаллер, М.; Машер, Б.; Айрич, С .; Айрич, К.; Янссон, А.Ф.; Ринг, Дж.; и другие. Приобретение функции STAT1 и доминантно-негативные мутации STAT3 нарушают иммунитет к IL-17 и IL-22, связанный с CMC. Дж. Расследование. Дерматол. 2018 , 138, 711–714. [Google Scholar] [CrossRef][Зеленая версия] «> Тераи, Х.; Симахара, М. Полезность культурального теста и прямого обследования для диагностики орального атрофического кандидоза. Междунар. Дж. Дерматол. 2009 , 48, 371–373. [Google Scholar] [CrossRef]
- Коронадо-Кастельоте, Л.; Хименес-Сориано, Ю. Клиническая и микробиологическая диагностика кандидоза полости рта. Дж. Клин. Эксп. Вмятина. 2013 , 5, е279–е286. [Google Scholar] [CrossRef][Зеленая версия]
- Рамани Р.; Громадский, С .; Пинкус, Д.Х.; Салкин, И.Ф.; Чатурведи, В. Эффективность систем API 20C и ID 32C для идентификации распространенных и редких клинических изолятов дрожжей. Дж. Клин. микробиол. 1998 , 36, 3396–3398. [Google Scholar] [CrossRef][Зеленая версия]
- Сингхал, Н.; Кумар, М.; Канауджиа, П.К.; Вирди, Дж.С. Масс-спектрометрия MALDI-TOF: новая технология идентификации и диагностики микробов. Фронт. микробиол. 2015 , 6, 791. [Google Scholar] [CrossRef][Green Version] «> Bal, AM; Макгилл, М. Быстрая идентификация видов Candida непосредственно из культуральных бульонов крови с помощью масс-спектрометрии Sepsityper-MALDI-TOF: влияние на противогрибковую терапию. JR Coll Physicians Ediinb. 2018 , 48, 114–119. [Google Scholar] [CrossRef] [PubMed]
- Bessman, JD; Гилмер, П.Р., младший; Гарднер, Ф. Х. Усовершенствованная классификация анемий по MCV и RDW. Являюсь. Дж. Клин. Патол. 1983 , 80, 322–326. [Google Scholar] [CrossRef]
- Bertero, MT; Caligaris-Cappio, F. Анемия хронических нарушений при системных аутоиммунных заболеваниях. Гематология 1997 , 82, 375–381. [Google Scholar]
- Ву, Ю. К.; Ван, Ю.П.; Чанг, JYF; Ченг, SJ; Чен, HM; Сан, А. Оральные проявления и профиль крови у больных железодефицитной анемией. Дж. Формос. Мед. доц. 2014 , 113, 83–87. [Google Scholar] [CrossRef] [PubMed][Green Version]
- Tyldesley, W.
 R. Стоматит и рецидивирующие язвы во рту: необходим ли полный анализ крови? бр. Дж. Оральный хирург. 1983 , 21, 27–30. [Google Scholar] [CrossRef]
R. Стоматит и рецидивирующие язвы во рту: необходим ли полный анализ крови? бр. Дж. Оральный хирург. 1983 , 21, 27–30. [Google Scholar] [CrossRef] - Marti, HR; Фишер, С.; Киллер, Д.; Burgi, W. Могут ли автоматические гематологические анализаторы отличить талассемию от дефицита железа? Акта. гемат. 1987 , 78, 180–183. [Академия Google] [CrossRef] [PubMed]
- Ван, Ю.П.; Чанг, JYF; Ву, Ю. К.; Ченг, SJ; Чен, HM; Сан, А. Оральные проявления и профиль крови у пациентов с чертой талассемии. Дж. Формос. Мед. доц. 2013 , 112, 761–765. [Google Scholar] [CrossRef][Green Version]
- Lynch, D.P. Кандидоз полости рта: История, классификация и клиническая картина. Оральный сург. Оральный мед. Орал Патол. 1994 , 78, 189–193. [Google Scholar] [CrossRef]
- Holmstrup, P.; Аксель, Т. Классификация и клинические проявления оральных дрожжевых инфекций. Акта. Одонтол.
 Сканд. 1990 , 48, 57–59. [Google Scholar] [CrossRef]
Сканд. 1990 , 48, 57–59. [Google Scholar] [CrossRef] - Sitheeque, M.A.M.; Самранаяке Л.П. Хронический гиперпластический кандидоз/кандидоз (кандидозная лейкоплакия). крит. Преподобный Орал Биол. Мед. 2003 , 14, 253–267. [Google Scholar] [CrossRef]
- Odds, F.C. Хронический кожно-слизистый кандидоз. При кандидозе и кандидозе; Bailliere Tindall: Лондон, Великобритания, 1988 г .; стр. 143–152. [Google Scholar]
- Тераи, Х.; Шимахара, М. Атрофический язык, связанный с Candida. Дж. Орал Патол. Мед. 2005 , 34, 397–400. [Google Scholar] [CrossRef]
- Cooke, B.E.D. Срединный ромбовидный глоссит: кандидоз, а не аномалия развития. бр. Дж. Дермато. 1975 , 93, 399–405. [Google Scholar] [CrossRef]
- Ван дер Ваал, И.; Бимстер, Г.; ван дер Кваст, В.А.М. Срединный ромбовидный глоссит, вызванный Candida? Оральный сург. Оральный мед.
 Оральный патол. 1979 , 47, 31–35. [Google Scholar] [CrossRef]
Оральный патол. 1979 , 47, 31–35. [Google Scholar] [CrossRef] - Жендро, Л.; Лоуи, З.Г. Эпидемиология и этиология зубных стоматитов. Дж. Просто. 2011 , 20, 251–260. [Google Scholar] [CrossRef] [PubMed]
- Cawson, R.A. Индукция эпителиальной гиперплазии Candida albicans. Бри. Дж. Дерма. 1973 , 89, 497–503. [Google Scholar] [CrossRef] [PubMed]
- Ettinger, RL Этиология воспалительной папиллярной гиперплазии. Дж. Прост. Вмятина. 1975 , 34, 254–261. [Google Scholar] [CrossRef]
- Салехи, М.; Ахмадикия, К.; Махмуди, С.; Калантари, С.; Джамалимогадамсиахкали, С.; Изади, А .; Корд, М .; Маншади, ЮАР; Сейфи, А .; Гиасванд, Ф .; и другие. Орофарингеальный кандидоз у госпитализированных с COVID-19пациенты из Ирана: идентификация видов и картина чувствительности к противогрибковым препаратам. Микозы 2020 , 63, 771–778. [Google Scholar] [CrossRef] «> Shay, K.; Трухлар, М. Р.; Реннер, Р.П. Кандидоз ротоглотки у пожилых пациентов. Варенье. Гериатр. соц. 1997 , 45, 863–870. [Google Scholar] [CrossRef][Зеленая версия]
- Пинель, Б.; Кассу-Мунат, Т .; Бенсадун, Р.Дж. Орофарингеальный кандидоз и лучевая терапия. Рак Радиотер. 2012 , 16, 222–229. [Академия Google] [CrossRef]
- Галло, В.Дж.; Шапиро, Д.Н.; Мосс, М. Гнойный кандидоз: обзор литературы и отчет о случае. Варенье. Вмятина. доц. 1976 , 92, 936–939. [Google Scholar] [CrossRef]
- McManners, J.; Самаранаяке, Л.П. Гнойный кандидоз полости рта — обзор литературы и отчет о случае. Междунар. J. Оральный Maxillofac. Surg. 1990 , 19, 257–259. [Google Scholar] [CrossRef]
- Букет, Дж. Э.; Фентон, С.Дж. Ювенильный кандидоз juxtavermilion: еще одна форма старой болезни? Варенье. Вмятина. доц. 1988 , 116, 187–192. [Google Scholar] [CrossRef] «> Lee, S.Y.; Чой, JY; Ким, JW; Ю, Д.С.; Ли, Ю.Б. Случай хейлокандидоза. Анна. Дерматол. 2019 , 31, 22–23. [Google Scholar] [CrossRef]
- Уильямс, Д.; Льюис М. Патогенез и лечение кандидоза полости рта. J. Оральная микробиол. 2011 , 3, 1–11. [Google Scholar] [CrossRef][Green Version]
- Xin, L.; Чен, З .; Жи-мин, Ю .; Hong, H. Эффективность нистатина для лечения кандидоза полости рта: системный обзор и метаанализ. Препарат Дез. Дев. тер. 2016 , 10, 1161–1171. [Google Scholar]
- Баркволл, П.; Аттрамадал, А. Влияние нистатина и диглюконата хлоргексидина на Candida albicans. Оральный сург. Оральный мед. Орал Патол. 1989 , 67, 279–281. [Google Scholar] [CrossRef]
- Teva Pharmaceuticals USA Inc. Таблетки кетоконазола по рецепту; Teva Pharmaceuticals USA Inc.: Северный Уэльс, Пенсильвания, США, 2015 г.; п. 387. [Google Scholar] «> Janssen Pharmaceuticals, Inc. Таблетки низорала (кетоконазола) по рецепту; Janssen Pharmaceuticals, Inc.: Титусвилль, Нью-Джерси, США, 2013 г. [Google Scholar]
- Браммер, К.В.; Фэрроу, PR; Фолкнер, Дж.К. Клиническая фармакология. Фармакокинетика и проникновение флуконазола в ткани/жидкости у человека. Преподобный Заразить. Дис. 1990 , 12, 318–326. [Google Scholar] [CrossRef] [PubMed]
- Шиба, К.; Сайто, А .; Мияхара Т. Безопасность и фармакокинетика однократных пероральных и внутривенных доз флуконазола у здоровых людей. клин. Фармакол. тер. 1990 , 12, 206–215. [Google Scholar]
- Troke, PF; Эндрюс, Р.Дж.; Пай, GW; Ричардсон, К. Флуконазол и другие азолы: перенос активности in vitro на in vivo и клиническую эффективность. Преподобный Заразить. Дис. 1990 , 12, 276–280. [Google Scholar] [CrossRef]
- Голин Р.А.; Ашер, Д.; Веккер, Н.; Арнольд, Дж.; Мурфилд, Э.
 Сравнение пероральных суспензий флуконазола и нистатина для лечения кандидоза полости рта у младенцев. Педиатрическая инфекция. Дис. J. 2002 , 21, 1165–1167. [Google Scholar]
Сравнение пероральных суспензий флуконазола и нистатина для лечения кандидоза полости рта у младенцев. Педиатрическая инфекция. Дис. J. 2002 , 21, 1165–1167. [Google Scholar] - Allen, U. Противогрибковые средства для лечения системных грибковых инфекций у детей. Можно. Дж. Инфек. Дис. Мед. микробиол. 2010 , 21, е116–е121. [Академия Google] [CrossRef]
- Бенитес, Л.Л.; Карвер, П.Л. Побочные эффекты, связанные с длительным приемом азольных противогрибковых средств. Наркотики 2019 , 79, 833–853. [Google Scholar] [CrossRef] [PubMed]
Рисунок 1.
Оральный кандидоз может быть признаком системного заболевания. ( A , B ) Эритематозный кандидоз, ангулярный хейлит и распространенный цервикальный кариес привели к диагнозу сахарного диабета и железодефицитной анемии у 30-летнего мужчины, который ежедневно пил газировку вместо воды. ( C , D ) Псевдомембранозный кандидоз и диффузная гиперплазия десен с цианотичным изменением привели к диагнозу острого миелоидного лейкоза у мужчины 32 лет. ( E , F ) Хейлокандидоз и псевдомембранозный кандидоз вокруг некротической язвы на небе привели к диагнозу ВИЧ-инфекции у 28-летнего мужчины. ( G , H ) Псевдомембранозный и эритематозный кандидоз с некротической язвой языка привели к диагнозу тяжелой лейкопении у 33-летней женщины.
( E , F ) Хейлокандидоз и псевдомембранозный кандидоз вокруг некротической язвы на небе привели к диагнозу ВИЧ-инфекции у 28-летнего мужчины. ( G , H ) Псевдомембранозный и эритематозный кандидоз с некротической язвой языка привели к диагнозу тяжелой лейкопении у 33-летней женщины.
Рисунок 1.
Оральный кандидоз может быть признаком системного заболевания. ( A , B ) Эритематозный кандидоз, ангулярный хейлит и распространенный цервикальный кариес привели к диагнозу сахарного диабета и железодефицитной анемии у 30-летнего мужчины, который ежедневно пил газировку вместо воды. ( C , D ) Псевдомембранозный кандидоз и диффузная гиперплазия десен с цианотическими изменениями привели к диагнозу острого миелоидного лейкоза у 32-летнего мужчины. ( E , F ) Хейлокандидоз и псевдомембранозный кандидоз вокруг некротической язвы на небе привели к диагнозу ВИЧ-инфекция у мужчины 28 лет. ( G , H ) Псевдомембранозный и эритематозный кандидоз с некротической язвой языка привели к диагнозу тяжелой лейкопении у 33-летней женщины.
Рисунок 2. Хронический кожно-слизистый кандидоз (ХМК). ( A , B ) Врожденный тип CMC у 14-летней девочки проявлялся изуродованными и утолщенными ногтями, кожной сыпью с корками и персистирующей оральной молочницей, которая первоначально была псевдомембранозной, а затем сменилась гиперпластическими поражениями в виде плоских или приподнятых белые прилипшие бляшки, которые трудно стереть; даже инфекция оставалась относительно поверхностной. ( C , D ) Приобретенный тип ККМ, ограниченный оральной и периоральной локализацией, у 56-летней женщины с железодефицитной анемией.
Рис. 2.
Хронический кожно-слизистый кандидоз (ХМК). ( A , B ) Врожденный тип CMC у 14-летней девочки проявлялся изуродованными и утолщенными ногтями, кожной сыпью с корками и персистирующей оральной молочницей, которая первоначально была псевдомембранозной, а затем сменилась гиперпластическими поражениями в виде плоских или приподнятых белые прилипшие бляшки, которые трудно стереть; даже инфекция оставалась относительно поверхностной. ( C , D ) Приобретенный тип ККМ, ограниченный оральной и периоральной локализацией, у 56-летней женщины с железодефицитной анемией.
( C , D ) Приобретенный тип ККМ, ограниченный оральной и периоральной локализацией, у 56-летней женщины с железодефицитной анемией.
Рисунок 3. Срединный ромбовидный глоссит (МРГ) как вариант эритематозного кандидоза ( А , С , Е ) у трех женщин с железодефицитной анемией и у одной из них также с сахарным диабетом. Они показали полный ответ с регенерацией сосочка языка после приема железа в сочетании с терапией нистатином через 2 недели (9).0416 B , D , F ).
Рисунок 3. Срединный ромбовидный глоссит (МРГ) как вариант эритематозного кандидоза ( А , С , Е ) у трех женщин с железодефицитной анемией и у одной из них также с сахарным диабетом. Они показали полный ответ с регенерацией сосочка языка после приема препаратов железа в сочетании с терапией нистатином через 2 недели ( B , D , F ).
Рисунок 4.
Кандидозный стоматит зубных протезов ( A – D ), показывающая более диффузную эритему, поражающую часть или всю слизистую оболочку, покрытую протезом, в сочетании с псевдомембранозным кандидозом и ангулярным хейлитом у четырех человек, которые носили зубные протезы в течение многих лет. Неправильно подобранный протез ( E ) продемонстрировал плохую гигиену протеза, а материалы для перебазировки протеза действовали как хронический резервуар, допуская постоянное посев Candida на небные ткани пациента ( D ). Полное разрешение зубного стоматита после противогрибковой терапии таблетками нистатина, эффективной гигиены полости рта и зубных протезов, снятия зубного протеза (9).0416 Ф ).
Неправильно подобранный протез ( E ) продемонстрировал плохую гигиену протеза, а материалы для перебазировки протеза действовали как хронический резервуар, допуская постоянное посев Candida на небные ткани пациента ( D ). Полное разрешение зубного стоматита после противогрибковой терапии таблетками нистатина, эффективной гигиены полости рта и зубных протезов, снятия зубного протеза (9).0416 Ф ).
Рис. 4.
Кандидозный стоматит зубных протезов ( A – D ), проявляющийся более диффузной эритемой, поражающей часть или всю слизистую оболочку, покрытую зубными протезами, в сочетании с псевдомембранозным кандидозом и ангулярным хейлитом у четырех человек, носивших зубные протезы в течение многих лет. Неправильно подобранный протез ( E ) продемонстрировал плохую гигиену протеза, а материалы для перебазировки протеза действовали как хронический резервуар, допуская постоянное посев Candida на небные ткани пациента ( Д ). Полное разрешение зубного стоматита после противогрибковой терапии таблетками нистатина, эффективной гигиены полости рта и зубных протезов и снятия протеза ( F ).
Рисунок 5. ( A , B ) Псевдомембранозный кандидоз и зернистый тип или воспалительный папиллярный гиперпластический кандидоз неба и рецидивирующий хейлокандидоз с сильным окрашиванием губ у 35-летнего мужчины с системной красной волчанкой. ( С , Д ) Ангулярный хейлит и воспалительный папиллярный гиперпластический кандидоз неба у 25-летней женщины с дефицитом железа и умеренной анемией. ( E ) Псевдомембранозный кандидоз и воспалительный папиллярный гиперпластический кандидоз слизистой оболочки щеки у 50-летнего мужчины с сахарным диабетом, который показал резкий ответ на терапию нистатином через 5 дней ( F ) и полный ответ на терапию через 10 дней ( Г ).
Рис. 5.
( А , B ) Псевдомембранозный кандидоз и зернистый тип или воспалительный папиллярный гиперпластический кандидоз неба и рецидивирующий хейлокандидоз с сильным окрашиванием губ у 35-летнего мужчины с системной красной волчанкой. ( C , D ) Ангулярный хейлит и воспалительный папиллярный гиперпластический кандидоз неба у 25-летней женщины с дефицитом железа и умеренной анемией. ( E ) Псевдомембранозный кандидоз и воспалительный папиллярный гиперпластический кандидоз слизистой оболочки щеки у 50-летнего мужчины с сахарным диабетом, который через 5 дней продемонстрировал резкий ответ на терапию нистатином ( F ) и полный ответ на терапию через 10 дней ( G ).
( C , D ) Ангулярный хейлит и воспалительный папиллярный гиперпластический кандидоз неба у 25-летней женщины с дефицитом железа и умеренной анемией. ( E ) Псевдомембранозный кандидоз и воспалительный папиллярный гиперпластический кандидоз слизистой оболочки щеки у 50-летнего мужчины с сахарным диабетом, который через 5 дней продемонстрировал резкий ответ на терапию нистатином ( F ) и полный ответ на терапию через 10 дней ( G ).
Рисунок 6. ( A , C , E , G ) Орофарингеальный кандидоз с высокой температурой и потенциальной кандидемией у 24-летней женщины с системной красной волчанкой и уремией, рефрактерной к терапии нистатиновой суспензией, кетоконазолом и ванкомицин в течение одной недели в местной больнице. ( Б , Д , Ф , Н ) После назначения флуконазола в сочетании с таблетками нистатина у нее не было лихорадки через 2 дня и полный ответ в течение одного месяца.
Рис. 6.
( A , C , E , G ) Орофарингеальный кандидоз с высокой температурой и потенциальной кандидемией у 24-летней женщины с системной красной волчанкой и уремией, рефрактерной к терапии нистатиновой суспензией, кетоконазолом и ванкомицин в течение одной недели в местной больнице. ( B , D , F , H ) После назначения флуконазола в сочетании с таблетками нистатина у нее не было лихорадки через 2 дня и полный ответ в течение одного месяца.
6.
( A , C , E , G ) Орофарингеальный кандидоз с высокой температурой и потенциальной кандидемией у 24-летней женщины с системной красной волчанкой и уремией, рефрактерной к терапии нистатиновой суспензией, кетоконазолом и ванкомицин в течение одной недели в местной больнице. ( B , D , F , H ) После назначения флуконазола в сочетании с таблетками нистатина у нее не было лихорадки через 2 дня и полный ответ в течение одного месяца.
Рис. 7.
( A ) Гнойный кандидоз, приводящий к глубокой некротической язве полости рта с лицевой целлюлитоподобной инфекцией дермы и лихорадкой у 64-летней женщины с нефротическим синдромом, которая была невосприимчива к терапии антибиотиками широкого спектра действия в течение 5 дней. ( Б – D ) Успешное лечение было достигнуто за счет местной хирургической обработки и назначения флуконазола через 1 неделю ( B ), через 3 недели ( C ) и полного ответа в течение 4 недель ( D ).
Рис. 7. ( A ) Гнойный кандидоз, приводящий к глубокой некротической язве полости рта с лицевой целлюлитоподобной инфекцией дермы и лихорадкой у 64-летней женщины с нефротическим синдромом, которая была невосприимчива к терапии антибиотиками широкого спектра действия в течение 5 дней. ( B – D ) Успешное лечение было достигнуто за счет местной хирургической обработки и назначения флуконазола через 1 неделю ( B ), через 3 недели ( C ) и полного ответа в течение 4 недель ( D ).
Рисунок 8.
( A ) Ювенильный кандидоз juxtavermillion у здоровой 4-летней девочки. ( B – D ) Cheilocandidos с внутриротовым кандидозом у трех пациентов с ослабленным иммунитетом. ( Э , Ф ) Связанный с кандидозом ангулярный хейлит и язвы в полости рта до терапии у 60-летней женщины с диабетом и уремией. ( G , H ) Полный ответ на таблетки нистатина и крем клотримазол через 10 дней.
Рис. 8. ( A ) Ювенильный кандидоз juxtavermillion у здоровой 4-летней девочки. ( B – D ) Cheilocandidos с внутриротовым кандидозом у трех пациентов с ослабленным иммунитетом. ( E , F ) Связанный с кандидозом ангулярный хейлит и язвы во рту до терапии у 60-летней женщины с диабетом и уремией. ( G , H ) Полный ответ на таблетки нистатина и крем клотримазол через 10 дней.
Рис. 9.
( A ) Изменение хронических язв во рту, связанных с кандидозом полости рта, покрытых толстой блестящей организованной биопленкой сероватого цвета на слизистой оболочке нижних губ, передней десны и кончике языка в течение 1 года у 68-летней женщины в критическом состоянии с остеоартрит и синдром Рейтера на многих лекарствах, включая преднизолон. ( B ) Постепенное разрешение поражения было достигнуто первоначальным назначением флуконазола через 2 недели ( B ), через 4 недели ( C ), а затем переход на таблетки нистатина и полный ответ в течение 6 недель ( D ).
Рис. 9. ( A ) Изменение хронических язв во рту, связанных с кандидозом полости рта, покрытых толстой блестящей организованной биопленкой сероватого цвета на слизистой оболочке нижних губ, передней десны и кончике языка в течение 1 года у 68-летней женщины в критическом состоянии с остеоартрит и синдром Рейтера на многих лекарствах, включая преднизолон. ( B ) Прогрессирующее разрешение поражения было достигнуто при первоначальном назначении флуконазола через 2 недели ( B ), через 4 недели ( C ) с последующим переходом на таблетки нистатина и полным ответом в течение 6 недель ( D ). ).
Рисунок 10.
( A , D ) Псевдомембранозный кандидоз у 60-летнего мужчины с карциномой носоглотки после лучевой терапии головы и шеи. ( B , E ) Использование надкостничного элеватора для удаления тяжелых кандидозных бляшек с языка и небных поражений. ( C , F ) Механические средства усиливают противогрибковое действие таблеток нистатина и ускоряют заживление в течение одной недели. ( G – I ) Тяжелый орофарингеальный псевдомембранозный кандидоз с диффузными поражениями в виде множественных слипшихся белых пятен или более крупных бляшек, похожих на простоквашу или творог, у 59-летнего мужчины с циррозом печени был устойчив к пероральной суспензии нистатина, назначенной врачом. врача на несколько дней. ( J – L ) Быстрое разрешение кандидоза ротоглотки путем механического удаления тяжелых белых бляшек и назначения таблеток нистатина через неделю.
( G – I ) Тяжелый орофарингеальный псевдомембранозный кандидоз с диффузными поражениями в виде множественных слипшихся белых пятен или более крупных бляшек, похожих на простоквашу или творог, у 59-летнего мужчины с циррозом печени был устойчив к пероральной суспензии нистатина, назначенной врачом. врача на несколько дней. ( J – L ) Быстрое разрешение кандидоза ротоглотки путем механического удаления тяжелых белых бляшек и назначения таблеток нистатина через неделю.
Рис. 10.
( A , D ) Псевдомембранозный кандидоз у 60-летнего мужчины с карциномой носоглотки после лучевой терапии головы и шеи. ( B , E ) Использование надкостничного элеватора для удаления тяжелых кандидозных бляшек с языка и небных поражений. ( C , F ) Механические средства усиливают противогрибковое действие таблеток нистатина и ускоряют заживление в течение одной недели. ( G – I ) Тяжелый псевдомембранозный кандидоз ротоглотки с диффузными поражениями в виде множественных слипшихся белых пятен или более крупных бляшек, похожих на простоквашу или творог в 59-летний мужчина с циррозом печени был невосприимчив к пероральной суспензии нистатина, назначенной врачом в течение нескольких дней. ( J – L ) Быстрое разрешение кандидоза ротоглотки путем механического удаления тяжелых белых бляшек и назначения таблеток нистатина через неделю.
( J – L ) Быстрое разрешение кандидоза ротоглотки путем механического удаления тяжелых белых бляшек и назначения таблеток нистатина через неделю.
Таблица 1. Системные или местные факторы хозяина, предрасполагающие к оральному кандидозу.
Таблица 1. Системные или местные факторы хозяина, предрасполагающие к оральному кандидозу.
| Systemic Host Factors | Local Host Factors |
|---|---|
| Altered physiological status | Mucosal barrier alterations |
| Infancy/old age | Exogenous epithelial change |
| Altered гормональный статус | Травма |
| Диабет | Потеря окклюзии |
| Гипопаратиреоз/гипотиреоз/гипотиреоз1272 | Maceration |
| Cushing’s syndrome | Endogenous epithelial changes |
| Altered hematinic or nutritional status | Atrophy |
| Iron deficiency | Hyperplasia |
| Hypovitaminosis, Vit B12, folic acid | Дисплазия/рак ротовой полости |
| Недоедание | Количественные изменения слюны |
| Altered immune status | Xerostomia |
| Defects in cell-mediated immunity | Sjogren’s syndrome |
| Reduced numbers of phagocytes | Radiotherapy/Cytotoxic therapy |
| Lymphopenia or leukopenia | Saliva качественные изменения |
| снижение количества CD4 | pH/концентрация глюкозы |
| Due to infective states/ HIV | Poor oral or denture hygiene |
| Blood dyscrasias/ malignancies | High carbohydrate diet |
| Immunosuppressant/ chemotherapy | Heavy smoking/ Betel nut жевание |
| Антибиотики широкого спектра действия | Ингаляционные стероиды |
Таблица 2. Потенциальные факторы вирулентности видов Candida.
Потенциальные факторы вирулентности видов Candida.
Таблица 2. Потенциальные факторы вирулентности видов Candida.
| Virulence Factors | Effects |
|---|---|
| Adherence | Promote retention in the mouth |
| Expression of cell surface adhesins | Specific adhesion |
| Cell surface hydrophobicity | Nonspecific adhesion |
| Invasion and destruction of host tissue | Enhance pathogenicity |
| Hyphae development/thigmotropism | Promote invasion/active penetration |
| Secret hydrolytic enzymes | Cytotoxicity to oral epithelium |
| Секретные кислые метаболиты | Разложение базальной мембраны/матрикса |
| Эндоцитоз | Passive penetration of epithelium |
| Evasion of host defense | Reduce phagocytosis/help retention |
| Phenotypic switching | Antigenic modification |
| Proteolytic degrading immune factors | Destroy sIgA/ antimicrobial peptides |
| Связывание комплемента | Антигенная маскировка |
| Синергизм с бактериями | Содействие сохранению смешанных видов |
Таблица 3. Новая классификация кандидоза полости рта по клинико-патологическим признакам и локализации.
Новая классификация кандидоза полости рта по клинико-патологическим признакам и локализации.
Таблица 3. Новая классификация кандидоза полости рта по клинико-патологическим признакам и локализации.
| Острый/хронический кандидоз | Гиперпластический кандидоз |
| Псевдомембранозный кандидоз | Plaque-like |
| Erythematous candidosis | Nodular-like |
| Candida-associated lesions | Granular or papillary-like * |
| Denture stomatitis | Keratinized primary lesions superinfected with Candida |
| Локализованное простое воспаление | Лейкоплакия |
| Диффузный эритематозный тип | Красный плоский лишай |
| Granular type (inflammatory papillary hyperplasia) * | Lupus erythematosus |
| Median rhomboid glossitis (MRG) | Chronic mucocutaneous candidosis (CMC) |
| Angular cheilitis | Congenital/ Familial CMC, diffuse тип |
| Хейлокандидоз | Приобретенный ККМ, фокальный или диффузный тип |
| Кандидоз Юкставермиллион | Endocrinopathy associated |
| Oropharyngeal candidosis | Hypothyroidism, hypoparathyroidism, |
| Dangerous sign of immunosuppression | MG-thymoma, Addison’s disease, etc. |
| Suppurative oral candidosis | Immunosuppression associated |
| Очаговый некротизирующий язвенный мукозит или остеомиелит | Диабет, железодефицитная анемия, ВИЧ/СПИД, нейтропения и т. д. |
МГ, тяжелая миастения. * Кандидоз зернистого типа (воспалительная папиллярная гиперплазия) поражает не только носителей зубных протезов, но и пациентов с иммунодефицитом без зубных протезов.
| Примечание издателя: MDPI остается нейтральным в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности. |
© 2021 автор. Лицензиат MDPI, Базель, Швейцария. Эта статья находится в открытом доступе и распространяется на условиях лицензии Creative Commons Attribution (CC BY) (https://creativecommons.
 org/licenses/by/4.0/).
org/licenses/by/4.0/). Концентрации Candida, определенные после посева концентрированной жидкости для полоскания рта, отражают клинические признаки | BMC Oral Health
- Исследовательская статья
- Открытый доступ
- Опубликовано:
- Хироаки Тояма 1 ,
- Такехиса Мацумото 2 ,
- Киёнори Хаяси 3 ,
- Kenji Kurashina 3 ,
- Hiroshi Kurita 1 ,
- Mitsuo Uchida 4 ,
- Eriko Kasuga 2 &
- …
- Takayuki Honda 2
BMC Здоровье полости рта том 15 , номер статьи: 150 (2015) Процитировать эту статью
-
2929 Доступ
-
23 Цитаты
-
1 Альтметрический
-
Сведения о показателях
Абстрактный
Фон
Кандидоз полости рта — это инфекция, вызываемая дрожжеподобным грибком под названием Candida . Для выделения Candida из ротовой полости можно использовать различные методы. Однако правильно и удовлетворительно диагностировать кандидоз полости рта сложно, поскольку в настоящее время отсутствуют микробиологические или лабораторные стандарты, основанные на образцах из полости рта. Целью данного исследования является создание надежного лабораторного теста для диагностики кандидоза полости рта.
Для выделения Candida из ротовой полости можно использовать различные методы. Однако правильно и удовлетворительно диагностировать кандидоз полости рта сложно, поскольку в настоящее время отсутствуют микробиологические или лабораторные стандарты, основанные на образцах из полости рта. Целью данного исследования является создание надежного лабораторного теста для диагностики кандидоза полости рта.
Методы
Образцы оральных мазков, полосканий и концентрированных полосканий были получены у 200 последовательных амбулаторных пациентов (103 пациента мужского пола и 97 пациентов женского пола; средний возраст 47,2 года; возрастной диапазон 9–89 лет). Было подсчитано колоний Candida из культивируемых образцов для сравнения чувствительности и специфичности вышеуказанных методов отбора проб, а также была изучена взаимосвязь между обнаружением или концентрацией Candida и клиническими признаками полости рта.
Результаты
Среднее количество колоний составило 263 ± 590 КОЕ/мазок для метода тампона, 2894±6705 КОЕ/100 мкл для метода полоскания и 9245±19 030 КОЕ/100 мкл для метода концентрированного полоскания. Средние числа составляли 23 КОЕ/мазок для метода мазка, 56 КОЕ/100 мкл для метода полоскания и 485 КОЕ/100 мкл для метода концентрированного полоскания. Candida выявлен в полости рта у 33,5 % и 52,0 % амбулаторных больных методом мазка и концентрированного полоскания соответственно. Концентрации Candida , определенные с помощью концентрированного ополаскивателя, были тесно связаны с тяжестью клинических симптомов в ротовой полости. Положительные прогностические значения остаточного корня, покраснения слизистой оболочки полости рта, зубных протезов, глоссалгии, сухости во рту и нарушения вкуса были полезными предикторами кандидоза полости рта.
Средние числа составляли 23 КОЕ/мазок для метода мазка, 56 КОЕ/100 мкл для метода полоскания и 485 КОЕ/100 мкл для метода концентрированного полоскания. Candida выявлен в полости рта у 33,5 % и 52,0 % амбулаторных больных методом мазка и концентрированного полоскания соответственно. Концентрации Candida , определенные с помощью концентрированного ополаскивателя, были тесно связаны с тяжестью клинических симптомов в ротовой полости. Положительные прогностические значения остаточного корня, покраснения слизистой оболочки полости рта, зубных протезов, глоссалгии, сухости во рту и нарушения вкуса были полезными предикторами кандидоза полости рта.
Выводы
Образцы концентрированных полосканий подходят для оценки кандидоза полости рта, а концентрации Candida , исследованные с использованием этого метода, тесно связаны с признаками инфекции полости рта, ассоциированными с инфекцией Candida .
Отчеты экспертной оценки
История вопроса
Кандидоз полости рта является распространенной оппортунистической инфекцией полости рта и вызывается дрожжевым грибком Candida 9Род 1712, прежде всего Candida albicans . Клинически он проявляется во многих формах, включая псевдомембранозную (острую/хроническую), эритематозную (острую/хроническую), бляшковидную (хроническую) и узловую (хроническую) формы [1]. Однако видов Candida часто выделяют из ротовой полости здоровых людей всех возрастов с зарегистрированной распространенностью 15–75 % [2–4], и поэтому трудно отличить кандидоз полости рта от комменсального состояния с помощью микробиологических обнаружение Candida видов в полости рта. Кроме того, кандидоз полости рта часто диагностируют на основании клинических данных, независимо от того, были ли обнаружены видов Candida . Следовательно, для правильной диагностики пероральной инфекции Candida требуются дополнительные микробиологические критерии.
Клинически он проявляется во многих формах, включая псевдомембранозную (острую/хроническую), эритематозную (острую/хроническую), бляшковидную (хроническую) и узловую (хроническую) формы [1]. Однако видов Candida часто выделяют из ротовой полости здоровых людей всех возрастов с зарегистрированной распространенностью 15–75 % [2–4], и поэтому трудно отличить кандидоз полости рта от комменсального состояния с помощью микробиологических обнаружение Candida видов в полости рта. Кроме того, кандидоз полости рта часто диагностируют на основании клинических данных, независимо от того, были ли обнаружены видов Candida . Следовательно, для правильной диагностики пероральной инфекции Candida требуются дополнительные микробиологические критерии.
Для выделения Candida из полости рта можно использовать различные методы, в том числе мазки, простые мазки, культуральные отпечатки, сбор цельной слюны, концентрированные ополаскиватели полости рта и биопсии слизистой оболочки [5, 6]. Из них метод концентрированного полоскания рта является одним из наиболее подходящих методов для определения концентраций Candida в полости рта [7]; однако этот метод не подходит для обнаружения очага инфекции Candida . Концентрация Candida ниже 600 КОЕ/мл в образцах концентрированных полосканий сообщается о здоровом комменсальном носительстве [8], тогда как лица с концентрацией Candida выше 2–3 × 10 3 КОЕ/мл предрасположены к пероральному Candida инфекции [7]. Однако Уайт и соавт. сообщили, что Candida уровней до 9 × 10 3 КОЕ/мл наблюдались у здоровых людей, и эти уровни иногда были выше, чем у пациентов с кандидозом полости рта [9].
Из них метод концентрированного полоскания рта является одним из наиболее подходящих методов для определения концентраций Candida в полости рта [7]; однако этот метод не подходит для обнаружения очага инфекции Candida . Концентрация Candida ниже 600 КОЕ/мл в образцах концентрированных полосканий сообщается о здоровом комменсальном носительстве [8], тогда как лица с концентрацией Candida выше 2–3 × 10 3 КОЕ/мл предрасположены к пероральному Candida инфекции [7]. Однако Уайт и соавт. сообщили, что Candida уровней до 9 × 10 3 КОЕ/мл наблюдались у здоровых людей, и эти уровни иногда были выше, чем у пациентов с кандидозом полости рта [9].
Кандидоз полости рта часто возникает у лиц с ослабленным иммунитетом, включая ВИЧ-инфицированных и больных СПИДом, реципиентов трансплантированных органов и пациентов, получающих химиотерапию [10]. Фактически, заболевание часто является начальным признаком нескольких иммунодефицитных заболеваний, и его клиническое значение в качестве биомаркера было признано в последние годы [11]. Однако правильно и удовлетворительно диагностировать кандидоз полости рта сложно, поскольку в настоящее время отсутствуют микробиологические или лабораторные стандарты, основанные на образцах из полости рта. В этом исследовании мы изучили взаимосвязь между клиническими находками в полости рта и различными методами получения образцов из полости рта, чтобы определить, какие критерии могут помочь дифференцировать кандидоз полости рта от присутствия Candida в комменсальном состоянии.
Однако правильно и удовлетворительно диагностировать кандидоз полости рта сложно, поскольку в настоящее время отсутствуют микробиологические или лабораторные стандарты, основанные на образцах из полости рта. В этом исследовании мы изучили взаимосвязь между клиническими находками в полости рта и различными методами получения образцов из полости рта, чтобы определить, какие критерии могут помочь дифференцировать кандидоз полости рта от присутствия Candida в комменсальном состоянии.
Методы
Образцы, полученные от 200 последовательных амбулаторных пациентов (103 пациента мужского пола и 97 пациентов женского пола; средний возраст 47,2 года; возрастной диапазон 9–89 лет), обратившихся к стоматологу в больнице Айзава с марта 2011 г. по июнь 2011 г. эта учеба. Также использовались образцы от 30 добровольцев (17 мужчин и 13 женщин; средний возраст 30,1 года; возрастной диапазон 23–43 года) без клинических симптомов со стороны полости рта и признаков кандидоза. У всех из них один зуб не был сломан, а кариозные зубы полностью вылечены. От всех пациентов, родителей несовершеннолетних и добровольцев было получено информированное согласие. Комитет по этике больницы Айзава одобрил этот протокол исследования под номером утверждения h32-14.
От всех пациентов, родителей несовершеннолетних и добровольцев было получено информированное согласие. Комитет по этике больницы Айзава одобрил этот протокол исследования под номером утверждения h32-14.
Подготовка проб и определение КОЕ
В исследовании использовались следующие 3 метода проб.
1. Метод взятия мазка : Материалы были получены путем взятия дорсальной поверхности языка 5 движениями (длиной около 2 см) ватного тампона (Hakujuji Co Ltd. Токио, Япония), а затем тампон был непосредственно инокулировали на среду CHROMagar Candida (Kanto Chemical Co. Ltd., Токио, Япония).
2. Метод полоскания : после того, как образец был получен методом мазка, образец раствора для полоскания рта был собран путем полоскания рта 10 мл стерильного физиологического раствора, который удерживали во рту в течение 5 с перед сбором. в стерильной таре. Сто микролитров промывочного раствора инокулировали на среду CHROMagar Candida.
3. Метод концентрированного полоскания : полость рта промывают 10 мл стерильного физиологического раствора и собирают от 7 до 10 мл раствора для полоскания. Концентрированный промывочный раствор готовили путем его центрифугирования при 2300 × г в течение 20 мин. После удаления супернатанта осадок клеток ресуспендировали в 500 мкл, который инокулировали на среду CHROMagar Candida аликвотами по 100 мкл. колоний Candida подсчитывали после инкубации при 37 °C в течение 48 часов. Если бы было слишком много 9Подсчитано 1739 колоний Candida , растворы Candida были разбавлены в десять раз.
Концентрированный промывочный раствор готовили путем его центрифугирования при 2300 × г в течение 20 мин. После удаления супернатанта осадок клеток ресуспендировали в 500 мкл, который инокулировали на среду CHROMagar Candida аликвотами по 100 мкл. колоний Candida подсчитывали после инкубации при 37 °C в течение 48 часов. Если бы было слишком много 9Подсчитано 1739 колоний Candida , растворы Candida были разбавлены в десять раз.
Связь между присутствием
видов Candida и клиническими симптомами в полости рта Затем мы исследовали связь между присутствием видов Candida и клиническими признаками в полости рта с использованием образцов, полученных методом мазка и методом концентрированного полоскания. Затем определяли связь между количеством колоний Candida (концентрацией Candida ) и клиническими признаками полости рта с использованием образцов, полученных методом концентрированного полоскания. В таблице 1 показаны клинические симптомы полости рта, использованные в этом исследовании, и их классификация.
Полноразмерная таблица
Оценка состояния полости рта
Клинические симптомы со стороны полости рта классифицировались следующим образом. Глоссалгию оценивали с использованием визуальной аналоговой шкалы (отрицательная: 0 мм; легкая: 1 мм; умеренная: 30 мм; тяжелая: более 54 мм) [12, 13]. Нарушение вкуса оценивали с использованием Общих терминологических критериев нежелательных явлений версии 3.0, опубликованных Национальным институтом рака (отрицательное: отсутствие изменений вкуса; легкое: изменение вкуса, но без изменения диеты; умеренное: изменение вкуса при изменении диеты или вредное или вредное воздействие). неприятный вкус; тяжелые: потеря вкуса) [14]. Сухость во рту оценивалась с использованием классификации Kakinoki et al. (отрицательный: не сухой; легкий: слюна показывает вязкость; умеренный: слюна с крошечными пузырьками на языке; тяжелая: сухой язык без вязкости, небольшое количество слюны или ее отсутствие) [15]. Покраснение слизистой оболочки полости рта оценивали с использованием Eilers Oral Assessment Guide (отрицательный результат: отсутствие покраснения на слизистой оболочке рта; легкий: локальные области покраснения без изъязвлений; умеренный: покраснение всей слизистой оболочки рта без изъязвлений; тяжелый: изъязвления с кровотечением или без него). 16].
Покраснение слизистой оболочки полости рта оценивали с использованием Eilers Oral Assessment Guide (отрицательный результат: отсутствие покраснения на слизистой оболочке рта; легкий: локальные области покраснения без изъязвлений; умеренный: покраснение всей слизистой оболочки рта без изъязвлений; тяжелый: изъязвления с кровотечением или без него). 16].
Налет на языке оценивали с использованием визуальной шкалы, разработанной Kojima et al. (отрицательный результат: менее 1/3 языка слегка обложен; легкая степень: около 2/3 языка слегка покрыта налетом или около 1/3 языка покрыта толстым слоем; средняя степень: около 2/3 языка покрыта толстым слоем; тяжелая: более 2/3 языка покрыты толстым налетом [17]. Покраснение языка оценивалось аналогичным образом (отрицательный результат: менее 1/3 языка с легким покраснением; незначительный: около 2/3 языка с легким покраснением или около 1/3 языка с сильным покраснением; умеренная: около 2/3 языка с сильным покраснением; сильная: более 2/3 языка с сильным покраснением)
Определение нормального диапазона здорового комменсального носительства
Обследовали 30 добровольцев без клинических признаков кандидоза полости рта на наличие видов Candida . Мы использовали наибольшее количество колоний, полученное из их мазков и образцов концентрированных полосканий, в качестве порога для отличия кандидоза полости рта от комменсального состояния полости рта видов Candida . Коэффициент обнаружения Candida , взаимосвязь между клиническими признаками полости рта и 9Затем определяли обнаружение 1739 Candida и взаимосвязь между клиническими признаками и количеством колоний Candida , полученных методом мазка и методом концентрированного полоскания. Чувствительность и специфичность каждого клинического признака исследовали при обнаружении видов Candida из .
Мы использовали наибольшее количество колоний, полученное из их мазков и образцов концентрированных полосканий, в качестве порога для отличия кандидоза полости рта от комменсального состояния полости рта видов Candida . Коэффициент обнаружения Candida , взаимосвязь между клиническими признаками полости рта и 9Затем определяли обнаружение 1739 Candida и взаимосвязь между клиническими признаками и количеством колоний Candida , полученных методом мазка и методом концентрированного полоскания. Чувствительность и специфичность каждого клинического признака исследовали при обнаружении видов Candida из .
Статистический анализ
Тест х 2 использовали для определения значимости разницы между показателями положительных результатов Candida 9.1712 с использованием метода мазка из полости рта и метода концентрированного полоскания рта. Медианные значения количества обнаруженных Candida , которые были получены от идентичных лиц, сравнивали с использованием непараметрического критерия знакового ранга Уилкоксона. Значимость отношений между медианой концентраций Candida и степенью каждого клинического орального признака анализировали с использованием непараметрического критерия Крускала-Уоллиса.
Значимость отношений между медианой концентраций Candida и степенью каждого клинического орального признака анализировали с использованием непараметрического критерия Крускала-Уоллиса.
Статистическая значимость была установлена на уровне p < 0,05 для всех методов анализа. Кроме того, тест Бонферрони использовался для принятия множественных сравнений. Все статистические анализы проводились с использованием программного обеспечения SPSS версии 22 (SPSS, Чикаго, Иллинойс, США).
Результаты
Для того, чтобы установить необходимые методы перед проведением всего анализа, были проведены пробные испытания первых 10 образцов. Количество колоний, полученное у первых 10 амбулаторных пациентов с использованием методов мазка, полоскания и концентрированного полоскания, показано на рис. 1. Медиана и межквартильный диапазон составляли 23 КОЕ (межквартильный диапазон от 3 до 9).6 КОЕ)/тампон для метода мазка, 56 КОЕ (межквартильный диапазон, от 11 до 900 КОЕ)/100 мкл для метода полоскания и 485 КОЕ (межквартильный диапазон, от 210 до 6981 КОЕ)/100 мкл для метода концентрированного полоскания в первые 10 амбулаторных больных. Первые 10 амбулаторных пациентов были протестированы всеми тремя методами; тем не менее, мы использовали метод концентрированной промывки для последующих исследований, потому что он дал больше колоний Candida . Среднее количество колоний Candida , полученных с использованием метода концентрированного ополаскивания, было значительно выше, чем количество, полученное с использованием двух других методов, соответственно (9).1739 p < 0,01, критерий знакового ранга Вилкоксона с критерием Бонферрони). Метод концентрированного ополаскивания оказался наиболее чувствительным, поскольку с его помощью можно было обнаружить видов Candida , в то время как метод мазка или метод ополаскивания этого не сделали. Таким образом, мы поняли, что метод концентрированного полоскания подходит для последующих исследований.
Первые 10 амбулаторных пациентов были протестированы всеми тремя методами; тем не менее, мы использовали метод концентрированной промывки для последующих исследований, потому что он дал больше колоний Candida . Среднее количество колоний Candida , полученных с использованием метода концентрированного ополаскивания, было значительно выше, чем количество, полученное с использованием двух других методов, соответственно (9).1739 p < 0,01, критерий знакового ранга Вилкоксона с критерием Бонферрони). Метод концентрированного ополаскивания оказался наиболее чувствительным, поскольку с его помощью можно было обнаружить видов Candida , в то время как метод мазка или метод ополаскивания этого не сделали. Таким образом, мы поняли, что метод концентрированного полоскания подходит для последующих исследований.
Сравнение чувствительности метода мазка, метода полоскания и метода концентрированного полоскания ( n = 10). Точки, представляющие данные одного и того же пациента, соединены линиями 9.0049
Точки, представляющие данные одного и того же пациента, соединены линиями 9.0049
Изображение полного размера
Предположительно идентифицировано видов Candida по цвету колоний, выращенных на среде CHROMagar Candida. Используя этот метод, следующие профилей Candida наблюдались у 68 пациентов, 12 пациентов, одного пациента, девяти пациентов, семи пациентов, пяти пациентов, одного пациента и одного пациента соответственно: C. albicans , C. tropicalis. , C. glabrata , C. albicans + C. glabrata , C. albicans + C. tropicalis , C. albicans + C. glabrata + C. tropicalis , C. albicans + C. krusei + unidentified Candida species, and C. glabrata + C. tropicalis + неидентифицированные Candida видов. Не было никаких существенных различий в клинических признаках полости рта между 68 пациентами с C. albicans и 12 пациентами с C. tropicalis .
tropicalis .
Показатели обнаружения и количество колоний, полученные методом мазка и методом концентрированного полоскания рта, показаны в таблице 2. видов Candida были обнаружены в полости рта у 67 из 200 пациентов (33,5%) методом мазка и у 104 200 (52 %) методом концентрированного ополаскивания. Среднее количество колоний составляло 7 КОЕ (межквартильный диапазон, от 2 до 37 КОЕ)/мазок для метода тампона и 141 КОЕ (межквартильный диапазон, от 14 до 1001 КОЕ)/100 мкл для метода концентрированного полоскания. Коэффициенты обнаружения ( p < 0,01, χ 2 ) и количество колоний ( p < 0,01, знаковый ранговый критерий Уилкоксона), полученные с использованием метода концентрированного полоскания, были значительно выше, чем полученные с помощью метода мазка.
Таблица 2 Частота обнаружения и количество колоний в образцах мазков и концентрированных смывов пациентов ( n = 200)Полноразмерная таблица
Связи между клиническими симптомами полости рта и обнаружением Candida методом мазков приведены в таблицах 3 и 4. Когда Candida была обнаружена методом мазка, чувствительность обложенного языка, сухости во рту, протеза, покраснения языка и остаточного корня составила 41,8, 46,3, 40,3, 34,3 и 29,9 % соответственно, а специфичность покраснения слизистая оболочка полости рта, ангулярный хейлит, остаточный корень, глоссалгия, нарушение вкуса, зубной протез и изъязвление составили 97,7, 99,2, 92,5, 94,0, 93,2, 88,0 и 92,5 % соответственно. Положительные прогностические значения остаточного корня, покраснения слизистой оболочки полости рта, зубного протеза, глоссалгии, сухости во рту и нарушения вкуса составили 66,7, 66,7, 62,8, 52,9., 54,4 и 35,7 % соответственно.
Когда Candida была обнаружена методом мазка, чувствительность обложенного языка, сухости во рту, протеза, покраснения языка и остаточного корня составила 41,8, 46,3, 40,3, 34,3 и 29,9 % соответственно, а специфичность покраснения слизистая оболочка полости рта, ангулярный хейлит, остаточный корень, глоссалгия, нарушение вкуса, зубной протез и изъязвление составили 97,7, 99,2, 92,5, 94,0, 93,2, 88,0 и 92,5 % соответственно. Положительные прогностические значения остаточного корня, покраснения слизистой оболочки полости рта, зубного протеза, глоссалгии, сухости во рту и нарушения вкуса составили 66,7, 66,7, 62,8, 52,9., 54,4 и 35,7 % соответственно.
Полноразмерная таблица
Таблица 4 Показатели клинических признаков из полости рта и обнаружение Candida методом мазка 9 Полноразмерная таблица 9004 Связи между клиническими признаками полости рта и обнаружением Candida с использованием метода концентрированного полоскания обобщены в таблицах 5 и 6. При обнаружении Candida с использованием метода концентрированного полоскания чувствительность наложенного языка, сухость во рту, зубной протез, покраснение языка , а остаточный корень – 45,2, 42,3, 34,6, 290,8 и 26,0 % соответственно, а особенности покраснения слизистой оболочки полости рта, ангулярного хейлита, остаточного корня, глоссалгии, нарушения вкуса, зубного протеза и изъязвления составили 99,0, 99,0, 96,9, 96,9, 95,8, 92,7 и 91,7 % , соответственно. Положительные прогностические значения остаточного корня, покраснения слизистой оболочки полости рта, зубного протеза, глоссалгии, сухости во рту и нарушения вкуса составили 90,0, 88,9, 83,7, 82,4, 77,2 и 71,4 % соответственно.
При обнаружении Candida с использованием метода концентрированного полоскания чувствительность наложенного языка, сухость во рту, зубной протез, покраснение языка , а остаточный корень – 45,2, 42,3, 34,6, 290,8 и 26,0 % соответственно, а особенности покраснения слизистой оболочки полости рта, ангулярного хейлита, остаточного корня, глоссалгии, нарушения вкуса, зубного протеза и изъязвления составили 99,0, 99,0, 96,9, 96,9, 95,8, 92,7 и 91,7 % , соответственно. Положительные прогностические значения остаточного корня, покраснения слизистой оболочки полости рта, зубного протеза, глоссалгии, сухости во рту и нарушения вкуса составили 90,0, 88,9, 83,7, 82,4, 77,2 и 71,4 % соответственно.
Полноразмерная таблица
Таблица 6 Показатели клинических признаков полости рта и обнаружение Candida методом концентрированного полосканияПолноразмерная таблица
Различия между степенями каждого клинического признака полости рта и количеством колоний полученные с использованием метода мазка, показаны в Таблице 7. Высокое количество Candida было в значительной степени связано с сухостью во рту. Различия между степенями каждого клинического признака полости рта и концентрациями колоний, полученными с использованием метода концентрированного полоскания, показаны в Таблице 8. Высокая подсчетов Candida были в значительной степени связаны с сухостью во рту, покраснением языка, налетом на языке и зубными протезами.
Высокое количество Candida было в значительной степени связано с сухостью во рту. Различия между степенями каждого клинического признака полости рта и концентрациями колоний, полученными с использованием метода концентрированного полоскания, показаны в Таблице 8. Высокая подсчетов Candida были в значительной степени связаны с сухостью во рту, покраснением языка, налетом на языке и зубными протезами.
Полноразмерная таблица
Полноразмерный стол
Когда Candida 9У здоровых добровольцев было определено 1712 подсчетов, метод мазка дал колонии у 3/30 добровольцев (1, 4 и 5 колоний соответственно), тогда как метод концентрированного полоскания дал колонии у 8/30 добровольцев (1, 1, 2). , 22, 25, 36, 38 и 67 колоний соответственно). На основании этих результатов мы определили 0–5 КОЕ/мазок и 0–67 КОЕ/100 мкл в качестве референтных диапазонов для здоровых комменсальных носителей, обнаруженных методом мазка и методом концентрированного полоскания соответственно. Напротив, среди амбулаторных пациентов без клинических симптомов со стороны полости рта самые высокие показатели, полученные с использованием метода мазка и метода концентрированного полоскания, составляли 23 КОЕ/мазок и 90 КОЕ/100 мкл соответственно.
Напротив, среди амбулаторных пациентов без клинических симптомов со стороны полости рта самые высокие показатели, полученные с использованием метода мазка и метода концентрированного полоскания, составляли 23 КОЕ/мазок и 90 КОЕ/100 мкл соответственно.
Обсуждение
В данном исследовании видов Candida были обнаружены в полости рта у амбулаторных пациентов стоматологической клиники с частотой 52,0 и 33,5 % при использовании метода концентрированного полоскания и метода мазка соответственно. Следовательно, метод концентрированного полоскания оказался более чувствительным, чем метод мазка, для обнаружения видов Candida в полости рта. Некоторые оральные клинические признаки (например, обложенный язык, сухость во рту, зубной протез, покраснение языка и остаточный корень) были относительно надежными предикторами кандидоза полости рта. Однако положительные прогностические значения остаточного корня, покраснения слизистой оболочки полости рта, зубного протеза, глоссалгии, сухости во рту и нарушения вкуса были высокими, и только эти клинические признаки полости рта часто ассоциировались с наличием Candida видов.
Метод концентрированного полоскания больше подходит для обнаружения видов Candida в полости рта, чем метод мазка. Однако количество колоний в образцах концентрированных полосканий было меньше, чем теоретически предсказанное значение 20-кратного увеличения образцов полосканий. Это может быть связано с низкой центробежной силой 2300 × г . Кроме того, метод концентрированного полоскания показал ту же чувствительность, что и метод полоскания, при наличии большого количества колоний; однако метод концентрированного ополаскивания был более чувствительным, когда из образца можно было получить только несколько колоний. Для первых 10 амбулаторных пациентов, обследованных в этом исследовании, метод концентрированного полоскания дал более колоний Candida , чем стандартный метод подъема, и метод концентрированного полоскания обычно может показывать более высокую чувствительность для обнаружения Candida в ротовой полости, чем стандартный метод полоскания; поэтому мы использовали результаты, полученные с помощью метода концентрированного полоскания, а не стандартного метода полоскания для сравнения в текущем исследовании. Доступны несколько методов отбора проб, включая отпечатки, полоскания рта, мазки, сбор всей слюны [18], биопсию и мазки, и каждый метод имеет как преимущества, так и недостатки [5]. Хотя метод концентрированного полоскания не позволяет обнаружить локальный очаг инфекции, он позволяет количественно определить другие микробы в дополнение к Candida видов [5]. Метод концентрированной промывки также прост в применении и более чувствителен, чем метод культуры отпечатков. Следовательно, предполагается, что в будущих исследованиях предпочтительно использовать метод концентрированного полоскания для получения сопоставимых данных из разных центров [8].
Доступны несколько методов отбора проб, включая отпечатки, полоскания рта, мазки, сбор всей слюны [18], биопсию и мазки, и каждый метод имеет как преимущества, так и недостатки [5]. Хотя метод концентрированного полоскания не позволяет обнаружить локальный очаг инфекции, он позволяет количественно определить другие микробы в дополнение к Candida видов [5]. Метод концентрированной промывки также прост в применении и более чувствителен, чем метод культуры отпечатков. Следовательно, предполагается, что в будущих исследованиях предпочтительно использовать метод концентрированного полоскания для получения сопоставимых данных из разных центров [8].
Количество Candida может соответствовать тяжести нескольких клинических признаков. Сухость во рту наблюдалась у 44 из 104 пациентов, у которых методом концентрированного полоскания был обнаружен Candida , а чувствительность, специфичность и положительные прогностические значения этой характеристики составили 42,3, 86,5 и 77,2 % соответственно. 9Концентрации 1739 Candida , полученные с использованием метода концентрированного полоскания, показали некоторые существенные различия в выраженности сухости во рту, покраснения языка, остаточного корня, обложенного языка и зубных протезов.
9Концентрации 1739 Candida , полученные с использованием метода концентрированного полоскания, показали некоторые существенные различия в выраженности сухости во рту, покраснения языка, остаточного корня, обложенного языка и зубных протезов.
Точно так же отсутствие ряда клинических признаков (покраснение слизистой оболочки полости рта, ангулярный хейлит, остаточный корень, глоссалгия, нарушение вкуса, зубной протез и изъязвление) было надежным индикатором отсутствия Candida. Аналогичным образом, низкая плотность Candida может не вызывать обложенный язык, сухость во рту, зубные протезы, покраснение языка и остаточный корень, которые часто наблюдаются у амбулаторных пациентов с Candida в полости рта; действительно, плотность Candida показала значительную разницу между степенью тяжести каждого из этих признаков.
Нарушение вкуса, покраснение слизистой оболочки полости рта, ангулярный хейлит, изъязвление наблюдались менее чем у 10 % амбулаторных больных с диагнозом кандидоз методом концентрированного полоскания, а глоссалгия отмечена у 13,5 % амбулаторных больных с диагнозом кандидоз с помощью концентрированного полоскания. концентрированный метод полоскания. В любом случае, все вышеперечисленные клинические симптомы полости рта, вероятно, были связаны с другими заболеваниями полости рта, а не с 9Инфекция 1739 Candida . Концентрации менее 90 КОЕ/100 мкл, полученные методом концентрированного полоскания, не были связаны с какими-либо признаками кандидоза полости рта у амбулаторных пациентов и добровольцев. Пациенты с количеством колоний Candida менее 90 КОЕ/100 мкл в методе концентрированного полоскания могли находиться на стадии до явного кандидоза.
концентрированный метод полоскания. В любом случае, все вышеперечисленные клинические симптомы полости рта, вероятно, были связаны с другими заболеваниями полости рта, а не с 9Инфекция 1739 Candida . Концентрации менее 90 КОЕ/100 мкл, полученные методом концентрированного полоскания, не были связаны с какими-либо признаками кандидоза полости рта у амбулаторных пациентов и добровольцев. Пациенты с количеством колоний Candida менее 90 КОЕ/100 мкл в методе концентрированного полоскания могли находиться на стадии до явного кандидоза.
Виды Candida часто обнаруживаются в ротовой полости у здоровых людей, и их наличие не обязательно свидетельствует о 9Инфекция 1739 Candida . Пороговая концентрация Candida требуется для того, чтобы отделить людей с комменсальным Candida от лиц с инфекционно-ассоциированным Candida . Большинство здоровых тайских подростков являются носителями Candida на низком уровне, то есть ниже 50 КОЕ/100 мкл [19], а уровни Candida 60 КОЕ/100 мкл в образцах концентрированных промывных культур связаны со здоровым комменсальным носительством [8]. ]. С другой стороны, люди с состояниями, которые предрасполагают их к инфекции, имеют более высокие показатели (2 × 10 2 до 3 × 10 2 КОЕ/100 мкл). Уровни Candida до 9 × 10 2 КОЕ/100 мкл наблюдались у здоровых людей без клинических признаков со стороны полости рта в других исследованиях [7, 9].
]. С другой стороны, люди с состояниями, которые предрасполагают их к инфекции, имеют более высокие показатели (2 × 10 2 до 3 × 10 2 КОЕ/100 мкл). Уровни Candida до 9 × 10 2 КОЕ/100 мкл наблюдались у здоровых людей без клинических признаков со стороны полости рта в других исследованиях [7, 9].
Количественный анализ может иметь важное значение для оценки кандидоза полости рта, включая дифференциацию от комменсального носительства Candida . Оральный кандидоз представляет собой особо серьезную проблему в отношении заболеваемости лиц с ослабленным иммунитетом, в том числе ВИЧ-позитивных и больных СПИДом, реципиентов органов и пациентов, получающих химиотерапию [10, 20, 21]. Кроме того, было несколько сообщений о взаимоотношениях между оральными Candida и сахарный диабет [22], пероральный Candida и синдром Шегрена [23] и пероральный Candida и сочетание хронической почечной недостаточности и гемодиализа [24].
Выводы
В этом исследовании концентрация Candida связана с несколькими клиническими симптомами в ротовой полости у инфицированных пациентов и может быть тесно связана с текущим клиническим состоянием и прогнозом пациента. Мы показали, что количественный анализ Candida требуется для того, чтобы правильно дифференцировать комменсальные формы инфекции от тех, которые требуют лечения из-за инфекции Candida . Такой анализ также может быть пригоден для наблюдения за изменениями во времени и количественного анализа концентрации Candida . Внедрение метода концентрированного ополаскивания в независимых местах по всему миру относительно просто, поскольку метод прост. Это значительно облегчит прямое сравнение исследований по Candida , происходящих из различных географических регионов и затрагивающих различные популяции субъектов.
Сокращения
- КОЕ:
-
колониеобразующая установка
- SD:
-
стандартное отклонение
Ссылки
- «>
-
Ганнум М.А., Юревич Р.Дж., Мукерджи П.К., Цуй Ф., Сикаруди М., Накви А. и др. Характеристика грибкового микробиома полости рта (микобиома) у здоровых людей. PLoS Патог. 2010;8(6):e1000713. doi:10.1371/journal.ppat.1000713.
Артикул Google ученый
-
Zegarelli DJ. Грибковые инфекции полости рта. Отоларингол Clin North Am. 1993;26:1069–89.
ПабМед Google ученый
-
Седжли К.М., Самаранаяке Л.П. Преобладание аэробных и факультативно анаэробных грамотрицательных палочек и дрожжей в ротовой полости у гонконгских китайцев. Arch Oral Biol.
 1994; 39: 459–66.
1994; 39: 459–66. Артикул пабмед Google ученый
-
Уильямс Д.В., Льюис М.А. Выделение и идентификация Candida из полости рта. Оральный Дис. 2000; 6: 3–11.
Артикул пабмед Google ученый
-
Byadarahally Raju S, Rajappa S. Выделение и идентификация Candida из полости рта. ISRN Дент. 2011;2011:487921. дои: 10.5402/2011/487921.
ПабМед ПабМед Центральный Google ученый
-
Самаранаяке Л.П., Макфарлейн Т.В., Лэми П.Дж., Фергюсон М.М. Сравнение методов полоскания полости рта и взятия отпечатков для обнаружения дрожжей, кишечной палочки и Staphylococcus aureus носительство в полости рта. Дж Орал Патол. 1986; 15: 386–8.
Артикул пабмед Google ученый
«> -
Уайт PL, Уильямс Д.В., Курияма Т., Самад С.А., Льюис М.А., Барнс Р.А. Обнаружение Candida в концентрированных культурах для полоскания рта методом ПЦР в реальном времени. Дж. Клин Микробиол. 2004;42:2101–7.
Артикул пабмед ПабМед Центральный Google ученый
-
Саунус Дж.М., Казуллис А., Фарах С.С. Клеточные и молекулярные механизмы устойчивости к оральным инфекциям Candida albicans . Фронт биосай. 2008; 13: 5345–58.
Артикул пабмед Google ученый
-
Герман П., Берек З., Надь Г., Камоцай К., Розгони Ф. Патогенез, микробиологические и клинические аспекты кандидоза полости рта (кандидоза).
 Acta Microbiol Immunol Hung. 2001; 48: 479–95.
Acta Microbiol Immunol Hung. 2001; 48: 479–95. Артикул пабмед Google ученый
-
Хаскиссон ЕС. Визуальные аналоговые весы. В: Мерзак Р., редактор. Измерение и оценка боли. Нью-Йорк: Рэйвен; 1983. с. 33–7.
Google ученый
-
Коллинз С.Л., Мур Р.А., Маккуэй Х.Дж. Визуальная аналоговая шкала интенсивности боли: что такое умеренная боль в миллиметрах? Боль. 1997; 72: 95–97.
Артикул пабмед Google ученый
-
Программа оценки терапии рака, Общие терминологические критерии нежелательных явлений, версия 3.0, DCTD, NCI, NIH, DHHS, 31 марта 2003 г., 9 августа 2006 г. http://ctep.cancer.gov.
-
Какиноки Ю., Нишихара Т., Арита М., Сибуя К., Исикава М. Полезность нового тестера влажности для диагностики сухости во рту у пациентов с ограниченными возможностями.
 Геродонтология. 2004;21(4):229–31.
Геродонтология. 2004;21(4):229–31. Артикул пабмед Google ученый
-
Эйлерс Дж., Бергер А., Петерсен М. Разработка, тестирование и применение руководства по устной оценке. Форум Oncol Nurs. 1988;15(3):325–30.
ПабМед Google ученый
-
Кодзима К. Клинические исследования на языке с налетом. Jpn J Oral Maxillofac Surg. 1985; 31: 45–64.
Артикул Google ученый
-
Sugimoto J, Kanehira T, Mizugai H, Chiba I, Morita M. Взаимосвязь между уровнями гистатина 5 в слюне и количеством Candida КОЕ у здоровых пожилых людей. Геродонтология. 2006; 23:164–9.
Артикул пабмед Google ученый
-
Santiwongkarn P, Kachonboon S, Thanyasrisung P, Matangkasombut O.
 Распространенность орального носительства Candida у тайских подростков. Джей Инвестиг Клин Дент. 2012;3:51–5.
Распространенность орального носительства Candida у тайских подростков. Джей Инвестиг Клин Дент. 2012;3:51–5. Артикул пабмед Google ученый
-
Чаллакомб С.Дж., Наглик Дж.Р. Влияние ВИЧ-инфекции на иммунитет слизистой оболочки полости рта. Ад Дент Рез. 2006; 19:29–35.
Артикул пабмед Google ученый
-
Jain PA, Veerabhadrudu K, Kulkarni RD, Ajantha GS, Shubhada C, Amruthkishan U. Сравнительное исследование адгезии пероральных изолятов Candida albicans от ВИЧ-серопозитивных и ВИЧ-сероотрицательных индивидуумов к клеткам буккального эпителия человека . Индиан Дж. Патол Микробиол. 2010;53:513–7.
ПабМед Google ученый
-
Сойса Н.С., Самаранаяке Л.П., Эллепола А.Н. Сахарный диабет как фактор, способствующий оральному кандидозу.
 Диабет Мед. 2006; 23: 455–9.
Диабет Мед. 2006; 23: 455–9. Артикул пабмед Google ученый
-
Yan Z, Young AL, Hua H, Xu Y. Множественные пероральные инфекции Candida у пациентов с синдромом Шегрена — распространенность, клинические профили и профили лекарственной чувствительности. J Ревматол. 2011; 38: 2428–31.
Артикул пабмед Google ученый
-
Годой Х.С., де Соуза Бонфим-Мендонса П., Накамура С.С., Ямада С.С., Синобу-Мескита С., Пьералиси Н. и др. Колонизация полости рта дрожжевыми грибками у больных с хронической почечной недостаточностью, находящихся на гемодиализе. Дж Орал Патол Мед. 2013;42:229–34.
Артикул пабмед Google ученый
Акселл Т., Самаранаяке Л.П., Рейхарт П.А., Олсен И. Предложение по переклассификации кандидоза полости рта. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1997;84:111–2.
Артикул пабмед Google ученый
McKendrick AJ, Wilson MI, Main DM. Пероральный Candida и длительная терапия тетрациклином. Arch Oral Biol. 1967; 12: 281–90.
Артикул пабмед Google ученый
Скачать ссылки
Благодарности
Авторы выражают благодарность участвовавшим в исследовании пациентам и персоналу отделения стоматологии и челюстно-лицевой хирургии медицинского факультета Университета Синсю, университетской больницы Синсю и отделения стоматологии и челюстно-лицевой хирургии больницы Айзава за их поддержку в этом исследовании. .
.
Информация об авторе
Авторы и организации
-
Кафедра стоматологии и челюстно-лицевой хирургии, Медицинский факультет Университета Синсю, Больница Университета Синсю, 3-1-1 Асахи, Мацумото, 390-8621, Япония
Хироаки Тояма и Хироси Курита
-
Кафедра лабораторной медицины, Медицинский факультет Университета Синсю, Больница Университета Синсю, 3-1-1 Асахи, Мацумото, 390-8621, Япония
Такехиса Мацумото, Эрико Касуга и Такаюки Хонда
-
Отделение стоматологии и челюстно-лицевой хирургии, больница Айзава, 2-5-1 Хондзё, Мацумото, 390-8510, Япония
Киёнори Хаяси и Кенджи Курашина
-
Center for Health, Safety and Environmental Management, Shinshu University, 3-1-1 Asahi, Matsumoto, 390-8621, Japan
Mitsuo Uchida
Авторы
- Hiroaki Tooyama 0 Посмотреть 5 публикаций автора
поищите этого автора в PubMed Google Scholar
- Takehisa Matsumoto
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Академия
- Kiyonori Hayashi
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Kenji Kurashina
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Hiroshi Kurita
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Mitsuo Uchida
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Eriko Kasuga
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Takayuki Honda
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
Автор, ответственный за переписку
Такехиса Мацумото.
Дополнительная информация
Конкурирующие интересы
Авторы заявляют об отсутствии конкурирующих интересов.
Вклад авторов
HT провела эксперименты и написала рукопись; ТМ участвовала в планировании и разработке исследования; KH, KK и EK помогали в сборе данных; MU выполнил все статистические анализы; HK и TH исправили статью и руководили исследованием. Все авторы прочитали и одобрили окончательный вариант рукописи.
Права и разрешения
Открытый доступ Эта статья распространяется в соответствии с условиями международной лицензии Creative Commons Attribution 4.0 (http://creativecommons.org/licenses/by/4.0/), которая разрешает неограниченное использование, распространение, и воспроизведение на любом носителе, при условии, что вы укажете автора(ов) оригинала и источник, предоставите ссылку на лицензию Creative Commons и укажете, были ли внесены изменения. Отказ от права Creative Commons на общественное достояние (http://creativecommons. org/publicdomain/zero/1.0/) применяется к данным, представленным в этой статье, если не указано иное.
org/publicdomain/zero/1.0/) применяется к данным, представленным в этой статье, если не указано иное.
Перепечатки и разрешения
Об этой статье
Кандидоз слизистой оболочки полости рта — Энциклопедия Альтмейерса
Автор: Проф., д.м.н. Peter Altmeyer
Все авторы этой статьи
Синоним(ы)
Хронический локализованный кандидоз; e) кандидоз полости рта; д) орофарингеальный кандидоз; кандидоз полости рта; Кандидоз полости рта, кандидоз полости рта; оральная молочница; орофарингеальный кандидоз; кандидоз ротоглотки; кандидамицетный стоматит
Определение
Этот раздел был переведен автоматически.
Инвазия в основном языка, а также слизистых оболочек щек, мягкого и твердого неба с отдельно стоящими или сливающимися белыми до серо-белых, обычно хорошо отделяемыми бляшками, иногда жжением языка.
Классификация
Этот раздел был переведен автоматически.
По Mayser (2018) можно выделить несколько клинических проявлений:
- Острый псевдомембранозный кандидоз (оральный кандидоз)
- Острый эритематозный кандидоз
- Острый атрофический кандидоз (стоматологоносительский стоматит)
- Хронический гиперпластический кандидоз (Candida leukoplacia)
- Перлеш (Angulus infectiosus)
Вас также может заинтересовать
Возникновение/эпидемиология
Этот раздел был переведен автоматически.
Повышенная заболеваемость, особенно у детей раннего возраста, у пациентов с хронической бронхиальной астмой, которые постоянно лечатся ингаляционными глюкокортикоидами, при иммуносупрессии, сахарном диабете или у пожилых людей с плохо подогнанными и ухоженными зубными протезами. Кандидоз полости рта является наиболее частым оппортунистическим заболеванием у ВИЧ-инфицированных. Предрасполагающими являются также эрозивные заболевания слизистой оболочки полости рта, такие как красный плоский лишай, вульгарная пузырчатка и другие.
Клинические признаки
Этот раздел был переведен автоматически.
Острый псевдомембранозный кандидоз (молочница полости рта)
Острый псевдомембранозный кандидоз является клиническим проявлением кандидоза полости рта, который обычно называют классической молочницей полости рта. Встречается в основном у новорожденных и при иммунодефиците.
В этом случае беловатые отложения обнаруживаются на плоской энантеме, малосимптомные, вначале в виде зернистости, позже на небольших участках или больших участках слияния. Покрытия легко снимаются деревянной лопаточкой. После снятия покрытий остается подстилающая, темно-красная, слегка кровоточащая слизистая оболочка. Субъективно выражается дискомфорт в виде нарушения вкуса и/или ощущения пушистости. Эта форма кандидоза полости рта часто сочетается с кандидозом глотки, пищевода или языка.
Покрытия легко снимаются деревянной лопаточкой. После снятия покрытий остается подстилающая, темно-красная, слегка кровоточащая слизистая оболочка. Субъективно выражается дискомфорт в виде нарушения вкуса и/или ощущения пушистости. Эта форма кандидоза полости рта часто сочетается с кандидозом глотки, пищевода или языка.
Острый эритематозный кандидоз
Клинически определяется отек, блестящая, ярко-красная слизистая оболочка полости рта с выпавшими сосочками. Обычно поражается поверхность языка. Острый эритематозный кандидоз обычно развивается из существовавшего ранее острого псевдомембранозного кандидоза. Возникает в основном при иммунодефицитах или после длительной антибактериальной терапии.
Хронический атрофический кандидоз
Эта форма кандидоза полости рта обычно возникает у носителей протезов (зубоносный стоматит) под контактными точками протеза. Слизистая оболочка очага ярко-красная, атрофически блестящая. Изменения твердого неба, а также слизистой оболочки десен верхней и нижней челюсти соответствуют точкам контакта протеза. Субъективное ощущение нарушено незначительно.
Субъективное ощущение нарушено незначительно.
Кандидозная лейкоплакия
До сих пор остается неясным, можно ли описать эту клиническую симптоматику как кандидозную лейкоплакию или как гиперпластический кандидоз. Также неясно, является ли кандидозная инфекция причиной лейкоплакии или это суперинфекция ранее существовавшего изменения слизистой оболочки.
Клинически данная клиническая картина характеризуется лейкоплакией (подобной булыжнику) (в отличие от классического орального кандидоза отсутствуют легко отделяемые отложения). Лейкоплакические изменения окружены эритемной каймой. Разграничение (или исключение) предраковой лейкоплакии имеет важное значение.
Диагностика
Этот раздел был переведен автоматически.
Микологическая культура. Примечание: проверьте стул на наличие дрожжей!
Общая терапия
Этот раздел был переведен автоматически.
Тщательная гигиена полости рта, при необходимости лечение основного заболевания. При необходимости реставрация зубов или протез.
При необходимости реставрация зубов или протез.
Наружная терапия
Этот раздел был переведен автоматически.
Неабсорбируемые антимикотики, такие как амфотерицин В или нистатин в жидкой форме (например, амфо-моронал суспензия или леденцы, кандио-гермал суспензия, нистатин Ледерле Трп.) в течение не менее 10 дней Полоскание горла раствором амфотерицина В, разбавленным 1:50 дважды в день доказал свою эффективность.
Внутренняя терапия
Этот раздел был переведен автоматически.
При тяжелом поражении или поражении пищевода (молочнице-эзофагите) системная терапия флуконазолом (например, дифлюканом) по 200 мг/сут в течение 10–14 дней. Резистентность известна после контроля лечения водой для полоскания глотки или комбинированной терапии амфотерицином B или липосомальным амфотерицином B (AmBisome) и флуцитозином (например, Ancotil). с.у. Кандидозный сепсис.
Альтернатива: позаконазол 1:1×200 мг перорально в день; после этого 100 мг перорально. на 13 дней.
на 13 дней.
Альтернатива: В случаях резистентности к терапии Амфотерицин В 0,3 мг/кг массы тела/день в/в. на 5-10 дней.
Вторичная профилактика рецидивирующего орального кандидоза (возможно, с оральным эзофагитом): флуконазол 50 мг/день перорально. или 3 раза в неделю по 100 мг/день п.о. В качестве альтернативы: позаконазол: 3 раза по 200 мг/день.
У пациентов с ослабленным иммунитетом: флуконазол первоначально 200 мг перорально, затем 100 мг/сут в течение 5–10 дней. В случае отсутствия ответа удвойте дозу.
Послепродажное обслуживание
Этот раздел был переведен автоматически.
Регулярные клинические осмотры и мазки.
Литература
Этот раздел был переведен автоматически.
- Fukushima C et al (2003) Кандидоз полости рта, связанный с применением ингаляционных кортикостероидов: сравнение флуказона и бекломатазона. Энн Аллергия Астма Иммунол 90: 646-651
-
Mayer P (2018) Микозы. В: Дерматология Брауна-Фалько, венерология, аллергология G.
 Plewig et al. (Hrsg) Springer Verlag S 280-281
Plewig et al. (Hrsg) Springer Verlag S 280-281
Входящие ссылки (18)
Острый эритематозный кандидоз; Острый эритематозный кандидоз слизистой оболочки полости рта; Острый псевдомембранозный кандидоз; Острый псевдомембранозный кандидоз; амфотерицин б; кандидозный фолликулит; кандидозная лейкоплакия; кандидозная лейкоплакия; Хронический атрофический кандидоз; Хронический кожно-слизистый кандидоз; … Показать все
Исходящие ссылки (8)
Амфотерицин b; Антимикотики; кандидозный сепсис; флуконазол; флуцитозин; нистатин; Перлеш (обзор); Позаконазол;Заявление об отказе от ответственности
Пожалуйста, обратитесь к врачу для достоверного диагноза. Этот веб-сайт предназначен только для справки.
Авторы
Последнее обновление: 29.10.2020
Автор: Проф., д.м.н. Peter Altmeyer
Пожалуйста, завершите регистрацию, чтобы получить доступ ко всем статьям и изображениям.
Чтобы получить доступ, вы должны пройти регистрацию. Вы либо не подтвердили свой адрес электронной почты, либо нам все еще нужны доказательства того, что вы являетесь представителем медицинской профессии.
Вы либо не подтвердили свой адрес электронной почты, либо нам все еще нужны доказательства того, что вы являетесь представителем медицинской профессии.
Изображения (4)
Обзор изображений
Средство поиска изображений
Содержание статьи
Защита слизистой оболочки полости рта слюнным гистатином-5 против Candida albicans в мышиной модели инфекции полости рта ex vivo | FEMS Yeast Research
albicans . Однако исследований, демонстрирующих его эффективность на тканях полости рта, не проводилось. С этой целью в этом исследовании была разработана мышиная модель инфекции ротовой полости ex vivo . Жизнеспособность 9Подсчет 0004 C. albicans и гистопатологический анализ продемонстрировали значительный защитный эффект Hst-5 на ткани полости рта мыши против C. albicans . Что еще более важно, слюна хозяина оказывала сопоставимый антикандидозный эффект. Однако этот эффект был нейтрализован при обработке слюны протеазами и C. albicans , которые, как было показано ранее, разрушают Hst-5, что указывает на то, что Hst-5, вероятно, является компонентом слюны, ответственным за наблюдаемую защиту. В совокупности результаты этого исследования впервые демонстрируют эффективность слюнного Hst-5 в защите ткани полости рта хозяина от инфекции C. albicans , тем самым подтверждая терапевтический потенциал этого природного пептида-хозяина.Candida albicans , слюнный гистатин-5, противомикробный пептид, врожденный иммунитет, модель на мышах
Однако в условиях иммунной дисфункции колонизация C. albicans может стать оппортунистическим патогеном, вызывающим рецидивирующие инфекции слизистых оболочек, особенно при ВИЧ-9.0006 + особей (Klein., 1984; de Repentigny., 2004; Fidel, 2006). Растущее появление штаммов C. albicans , устойчивых к обычно используемым противогрибковым препаратам, сделало клиническое лечение кандидоза все более трудным и сделало необходимость в улучшенной лекарственной терапии решающей (Fidel, 2006; Perlroth., 2007). Таким образом, выявление механизмов и кофакторов, лежащих в основе повышенной восприимчивости к оральному кандидозу в уязвимых группах населения, таких как ВИЧ-инфицированные + , послужит крупным прорывом в нашем понимании патогенеза орального кандидоза. Полость рта является уникальной средой и основной мишенью для оппортунистических инфекций (Klein., 1984; de Repentigny., 2004; Fidel, 2006). Однако слюна, сложная смесь жидкостей слюнных желез, играет важную роль в защите слизистой оболочки полости рта от микробных инфекций (Edgar, 1992; Humphrey & Williamson, 2001; Kamagata-Kiyoura. , 2004). В частности, слюна содержит набор пептидов с широким спектром противомикробных свойств, вырабатываемых хозяином (Oppenheim., 19).88; Эдгертон., 1998). Эти пептиды считаются важной частью врожденной иммунной системы хозяина, способствуя поддержанию баланса между здоровьем и болезнью в этой сложной среде (Edgerton., 1998). Удивительно, однако, что важная роль этих природных противомикробных препаратов в защите полости рта от кандидоза и особенно их потенциал в качестве терапевтических агентов только начинают осознаваться.
, 2004). В частности, слюна содержит набор пептидов с широким спектром противомикробных свойств, вырабатываемых хозяином (Oppenheim., 19).88; Эдгертон., 1998). Эти пептиды считаются важной частью врожденной иммунной системы хозяина, способствуя поддержанию баланса между здоровьем и болезнью в этой сложной среде (Edgerton., 1998). Удивительно, однако, что важная роль этих природных противомикробных препаратов в защите полости рта от кандидоза и особенно их потенциал в качестве терапевтических агентов только начинают осознаваться.
Наиболее заметным среди противомикробных пептидов является гистатин-5 (Hst-5), богатый гистидином катионный белок из 24 аминокислот, продуцируемый и секретируемый околоушными и поднижнечелюстно-подъязычными железами человека (Oppenheim., 19).88; Эдгертон., 1998; Никава., 2002). Hst-5, о котором сообщается, что он присутствует в слюне здоровых взрослых в диапазоне концентраций от 50 до 300 мкг/мл -1 , проявляет мощную активность против C. albicans , включая штаммы, устойчивые к обычно используемым противогрибковым агентам (Tsai & Бобек, 1997; Helmerhorst., 1999а, б). Кроме того, было также показано, что Hst-5 оказывает синергетическое действие с противогрибковыми препаратами, что указывает на потенциальное использование этого пептида в качестве подходящего кандидата для комбинированной терапии (Koshlukova., 2000; Situ & Bobek, 2000; van’t Hof., 2000).
albicans , включая штаммы, устойчивые к обычно используемым противогрибковым агентам (Tsai & Бобек, 1997; Helmerhorst., 1999а, б). Кроме того, было также показано, что Hst-5 оказывает синергетическое действие с противогрибковыми препаратами, что указывает на потенциальное использование этого пептида в качестве подходящего кандидата для комбинированной терапии (Koshlukova., 2000; Situ & Bobek, 2000; van’t Hof., 2000).
Хотя это не было подтверждено, предполагается, что Hst-5 играет важную роль в защите слизистой оболочки полости рта от C. albicans из-за его мощных противогрибковых свойств (Oppenheim., 1988; Helmerhorst., 1997; Edgerton. , 1998; Гюрко., 2001). Эти предположения были подтверждены клиническим исследованием, проведенным в нашем учреждении, где у ВИЧ-инфицированных + индивидуумов, сильно колонизированных C. albicans , было показано значительное снижение уровня Hst-5 в слюне по сравнению со здоровыми индивидуумами (Torres., 2008). Эти результаты предполагают участие врожденного иммунитета хозяина и, в частности, Hst-5 в защите от Колонизация C. albicans .
Эти результаты предполагают участие врожденного иммунитета хозяина и, в частности, Hst-5 в защите от Колонизация C. albicans .
Совсем недавно мы продемонстрировали, что C. albicans способен эффективно расщеплять Hst-5 с помощью секретируемых им аспарагиновых протеаз (Saps), протеолитических ферментов, которые считаются важными детерминантами вирулентности и, как было показано, расщепляют различные белки-хозяева (Naglik. , 1999; Villar., 2007; Meiller., 2009). В частности, Sap9 был идентифицирован как член семейства, ответственный за деградацию, таким образом идентифицируя Hst-5 как первый специфичный для хозяина субстрат для этого изофермента (Meiller., 2009).).
Примечательно, что степень деградации пептида пропорциональна плотности клеток C. albicans и обратно пропорциональна концентрации Hst-5. Эти параметры важны, так как указывают на то, что переход C. albicans от комменсала к патогену точно сбалансирован, при этом Hst-5, вероятно, играет ключевую роль в процессе, ведущем к развитию инфекционного процесса. Однако вопрос о том, происходят ли эти взаимодействия между хозяином и патогеном также в ротовой полости хозяина, остается спекулятивным. На самом деле, несмотря на обширные доступные исследования противогрибковых свойств Hst-5 in vitro , исследований его эффективности на тканях ротовой полости хозяина не проводилось. Таким образом, настоящее исследование было направлено на оценку антикандидозной активности Hst-5 в среде, более точно имитирующей условия in vivo . С этой целью была принята мышиная модель кандидоза полости рта ex vivo , чтобы продемонстрировать способность Hst-5 и слюны хозяина защищать ткани полости рта от инфекции C. albicans . Что еще более важно, на основе доступной информации из наших предыдущих исследований были разработаны эксперименты для идентификации Hst-5 как компонента слюны, ответственного за наблюдаемый защитный эффект слюны.
Однако вопрос о том, происходят ли эти взаимодействия между хозяином и патогеном также в ротовой полости хозяина, остается спекулятивным. На самом деле, несмотря на обширные доступные исследования противогрибковых свойств Hst-5 in vitro , исследований его эффективности на тканях ротовой полости хозяина не проводилось. Таким образом, настоящее исследование было направлено на оценку антикандидозной активности Hst-5 в среде, более точно имитирующей условия in vivo . С этой целью была принята мышиная модель кандидоза полости рта ex vivo , чтобы продемонстрировать способность Hst-5 и слюны хозяина защищать ткани полости рта от инфекции C. albicans . Что еще более важно, на основе доступной информации из наших предыдущих исследований были разработаны эксперименты для идентификации Hst-5 как компонента слюны, ответственного за наблюдаемый защитный эффект слюны.
Общая цель этого исследования — внести свой вклад в наше понимание факторов и условий хозяин-патоген, которые играют роль в кандидозной инфекции. Кроме того, полученные результаты будут иметь важное клиническое значение, поскольку они помогут в определении новых терапевтических стратегий, направленных на профилактику и/или лечение кандидоза полости рта.
Кроме того, полученные результаты будут иметь важное клиническое значение, поскольку они помогут в определении новых терапевтических стратегий, направленных на профилактику и/или лечение кандидоза полости рта.
0″ data-legacy-id=»ss2″> Материалы и методы
1″ data-legacy-id=»ss3″> Штаммы и условия выращивания
Во всех экспериментах использовали штамм Candida albicans SC5314 (Gillum., 19).84). Candida albicans выращивали в бульоне YPD (Difco Laboratories, Detroit, MI) в течение ночи при 30 °C при встряхивании, и клетки уравновешивали в свежей среде до OD 600 нм , равной 1,0. Если не указано иное, для большинства экспериментов использовали Hst-5 в концентрации 150 мкг мл -1 (в пределах физиологической концентрации слюны) и C. albicans при плотности клеток 1 × 10 7 клеток мл -1 (произвольная концентрация выбрана на основе предыдущих исследований).
3″ data-legacy-id=»ss4″> Реагенты
Пептид Hst-5 был синтезирован в основной лаборатории биополимеров Университета Мэриленда. Пептид был проверен с помощью МС, а его чистота была проверена с помощью ВЭЖХ. Hst-5 восстанавливали в 1 мМ фосфатно-солевом буфере (PBS). Рекомбинантные протеазы C. albicans (Sap9 и Sap2) были получены в Pichia pastoris и очищены, как описано ранее (Albrecht., 2006). Все эксперименты проводились не менее чем в трех отдельных случаях.
5″ data-legacy-id=»ss5″> Образцы слюны
Приблизительно 5 мл цельной нестимулированной слюны было собрано у четырех здоровых взрослых людей. Идентификаторы пациентов не использовались, было получено одобрение IRB и информированное согласие. После сбора образцы немедленно подвергали культивированию грибов путем посева 20 мкл каждого образца на чашки с агаром YPD для определения грибкового носительства. Кроме того, у всех субъектов были взяты оральные мазки для посева грибков путем двустороннего протирания стерильным ватным тампоном языка и слизистой оболочки щек, чтобы подтвердить отсутствие кандидозной колонизации. Только C. albicans неколонизированных и неинфицированных субъектов были включены, чтобы исключить влияние комменсальных штаммов. Образцы слюны очищали от клеток и другого дебриса путем центрифугирования в течение 10 мин при 16 000 g при 4 °C, а извлеченный супернатант стерилизовали фильтрованием.
Кроме того, у всех субъектов были взяты оральные мазки для посева грибков путем двустороннего протирания стерильным ватным тампоном языка и слизистой оболочки щек, чтобы подтвердить отсутствие кандидозной колонизации. Только C. albicans неколонизированных и неинфицированных субъектов были включены, чтобы исключить влияние комменсальных штаммов. Образцы слюны очищали от клеток и другого дебриса путем центрифугирования в течение 10 мин при 16 000 g при 4 °C, а извлеченный супернатант стерилизовали фильтрованием.
7″ data-legacy-id=»ss6″> Ex vivo модель инфекции
Мышиная модель инфекции ротовой полости ex vivo была разработана для демонстрации антикандидозного действия Hst-5 и слюны на ткани ротовой полости хозяина. Для этих экспериментов языки были вырезаны у умерщвленных 8-недельных самок мышей CD-1 (Charles River Laboratories) (выполнено с одобрения Университета Мэриленда — Балтиморского комитета по уходу за животными и их использованию). Языки помещали в лунки 24-луночных планшетов для тканевых культур, содержащих 1 × 10 7 клеток мл -1 из C. albicans в 1 мл PBS.
Языки помещали в лунки 24-луночных планшетов для тканевых культур, содержащих 1 × 10 7 клеток мл -1 из C. albicans в 1 мл PBS.
9″ data-legacy-id=»ss7″> Влияние Hst-5 и слюны на C. albicans
Для определения дозозависимого эффекта Hst-5 на C. albicans языки инфицировали в присутствии возрастающих концентраций Hst-5 (50–500 мкг мл -1 ), как описано ниже. Аналогичным образом, для оценки чувствительности C. albicans к Hst-5 (150 мкг/мл -1 ) при различной плотности клеток подсчитывали КОЕ с языка, инфицированного C. albicans в 1 × 10 6 , 1 × 10 7 , 2 × 10 8 или 2 × 10 9 клеток мл -1 определяли и оценивали как процент уничтожения с помощью Hst-5. .
В дополнение к Hst-5 были также проведены эксперименты, чтобы определить, оказывает ли слюна хозяина защитный эффект на ткани против C. albicans . В этих экспериментах языки заражали очищенной слюной без добавления Hst-5. Были включены контроли языков, инфицированных PBS (без слюны или Hst-5). Планшеты инкубировали при 35°С в течение 30 мин в присутствии Hst-5 или слюны при осторожном вращении. После трехкратного промывания PBS языки дополнительно инкубировали в течение 3 часов в свежем RPMI 1640 (с добавлением глутамина и HEPES) (Invitrogen, Гранд-Айленд, Нью-Йорк), чтобы обеспечить прорастание и продукцию гиф путем прикрепления дрожжевых клеток. Чтобы определить эффект более длительного воздействия Hst-5, были также проведены эксперименты, в которых дополнительно Hst-5 (150 мкг мл -1 ) добавляли в среду RPMI перед 3-часовой инкубацией, при этом общее время воздействия Hst-5 составляло 3,5 часа.
albicans . В этих экспериментах языки заражали очищенной слюной без добавления Hst-5. Были включены контроли языков, инфицированных PBS (без слюны или Hst-5). Планшеты инкубировали при 35°С в течение 30 мин в присутствии Hst-5 или слюны при осторожном вращении. После трехкратного промывания PBS языки дополнительно инкубировали в течение 3 часов в свежем RPMI 1640 (с добавлением глутамина и HEPES) (Invitrogen, Гранд-Айленд, Нью-Йорк), чтобы обеспечить прорастание и продукцию гиф путем прикрепления дрожжевых клеток. Чтобы определить эффект более длительного воздействия Hst-5, были также проведены эксперименты, в которых дополнительно Hst-5 (150 мкг мл -1 ) добавляли в среду RPMI перед 3-часовой инкубацией, при этом общее время воздействия Hst-5 составляло 3,5 часа.
0″ data-legacy-id=»ss12″> Статистический анализ
Все эксперименты проводились не менее чем в трех отдельных случаях.
Критерий Стьюдента t использовали для оценки статистической значимости результатов наряду с SE. Считалось, что статистически значимое различие присутствует при P <0,05.
4″ data-legacy-id=»ss14″> Оценка защиты тканей с помощью Hst-5 и слюны хозяина
В отличие от пропорционального эффекта, зависящего от концентрации Hst-5, восприимчивость C. albicans до Hst-5 была обратно пропорциональна плотности его клеток, где, исходя из процента уничтожения, более высокая плотность клеток C. albicans продемонстрировала снижение восприимчивости к Hst-5 (рис. 1b).1
Открыть в новой вкладкеСкачать слайд
Защитный эффект Hst-5 на жизнеспособность Candida albicans (КОЕ г -1 ткани) с использованием ex vivo модели инфекции полости рта . (a) Значительное снижение C. albicans жизнеспособных клеток, извлеченных из языка, инфицированного в присутствии возрастающих концентраций Hst-5, демонстрирует дозозависимый ингибирующий эффект для Hst-5 на C. albicans . ( б ) Напротив, антикандидозный эффект Hst-5 был обратно пропорционален плотности клеток C. albicans , где, исходя из процента уничтожения Hst-5, восприимчивость C. albicans к Hst-5 снижалась. с увеличением плотности клеток. Столбики погрешностей указывают SE средних значений. Значимой разницы между 0 и 50 мкг мл 9 не наблюдается.0006 -1 Концентрация Hst-5 ( P >0,05). Для всех остальных значений P <0,05.
с увеличением плотности клеток. Столбики погрешностей указывают SE средних значений. Значимой разницы между 0 и 50 мкг мл 9 не наблюдается.0006 -1 Концентрация Hst-5 ( P >0,05). Для всех остальных значений P <0,05.
2
Открыть в новой вкладкеСкачать слайд
Слюннозащита тканей полости рта и нейтрализация защиты. а) значительное снижение Candida albicans КОЕ, полученные с языка, зараженного слюной (слюна), по сравнению с контрольным языком (контроль) с PBS. Однако при предварительной обработке слюны очищенными протеазами (Saliva+Saps) значительного влияния на количество КОЕ не наблюдалось. (b) Аналогичным образом, антикандидозный эффект слюны был нарушен после ее предварительной инкубации с клетками C. albicans (Слюна + СА), что свидетельствует о протеолизе и деактивации защитного компонента слюны путем обработки слюны соками и C. albicans клеток. Результаты представляют собой средние данные четырех испытуемых, протестированных несколько раз. Столбики погрешностей указывают SE средних значений. Существенной разницы между контрольной и обработанной слюной не наблюдается ( P >0,05). Для всех остальных значений P <0,05.
Для всех остальных значений P <0,05.
2″ data-legacy-id=»ss18″> Обработка слюны очищенными протеазами
Для идентификации Hst-5 как слюнного компонента, ответственного за наблюдаемый антикандидозный эффект слюны, одновременно были проведены эксперименты, в которых слюну предварительно обрабатывали очищенными протеазами. 9Ранее было показано, что очищенные соки 0004 C. albicans разлагают и деактивируют Hst-5 in vitro (Meiller., 2009). Поэтому это свойство было использовано для нейтрализации активности слюны, которая может быть связана с Hst-5. Результаты экспериментов по нейтрализации Saps показали, что предварительная обработка образцов слюны протеазами (Saliva+Saps) приводила к почти полной потере защиты, обеспечиваемой слюной до обработки Saps (Saliva) (рис. 2а). Потеря защитного эффекта была более резкой при комбинации Sap2 и Sap9. использовались протеазы. По отдельности в той же концентрации Sap2 был более эффективен в нейтрализации слюны (данные не показаны).
использовались протеазы. По отдельности в той же концентрации Sap2 был более эффективен в нейтрализации слюны (данные не показаны).
6″ data-legacy-id=»ss20″> Гистопатологический анализ обработанной и необработанной инфицированной ткани
В дополнение к анализу жизнеспособности для оценки защитных возможностей Hst-5 и слюны инфицированная ткань также была подвергнута гистопатологическому анализу для визуализации взаимодействия C. albicans с ротовой эпителий. После окрашивания PAS или PNA-FISH срезы тканей анализировали с помощью световой или конфокальной микроскопии соответственно. В соответствии с результатами подсчета КОЕ, изображения ткани, обработанной Hst-5, показали значительно сниженное присутствие прилипших дрожжевых клеток и проникновение гиф в эпителий на языках, обработанных Hst-5 (Hst+), по сравнению с необработанными (Hst+). −) языки (рис. 3а).
albicans с ротовой эпителий. После окрашивания PAS или PNA-FISH срезы тканей анализировали с помощью световой или конфокальной микроскопии соответственно. В соответствии с результатами подсчета КОЕ, изображения ткани, обработанной Hst-5, показали значительно сниженное присутствие прилипших дрожжевых клеток и проникновение гиф в эпителий на языках, обработанных Hst-5 (Hst+), по сравнению с необработанными (Hst+). −) языки (рис. 3а).
3
Открыть в новой вкладкеСкачать слайд
Гистопатологический анализ языка мышей, инфицированных Candida albicans , в отсутствие и в присутствии Hst-5 и слюны. Репрезентативные микроскопические изображения (× 20) окрашенной PAS ткани, демонстрирующие значительно сниженные уровни прилипания и инвазии C. albicans в ткань языка, обработанную (а) Hst-5 (Hst+), по сравнению с необработанной (Hst-) тканью. (b) Аналогичное защитное действие на ткани полости рта против 9Инфекция 0004 C. albicans наблюдалась в ткани, обработанной слюной (Sal+), по сравнению с необработанной (Sal-) тканью. Шкала баров = 20 мкм.
Шкала баров = 20 мкм.
Аналогичным образом, результаты анализа срезов тканей языка, обработанного слюной, были сравнимы с результатами лечения Hst-5, где было замечено значительно уменьшенное количество C. albicans , прилипших к обработанным слюной (Sal+) языкам и внедрявшихся в них. по сравнению с контрольными языками, инфицированными PBS (Sal-) (рис. 3b).
Результаты изображений PNA-FISH соответствовали результатам для окрашенных PAS срезов во всех проведенных экспериментах. Образец репрезентативного изображения PNA-FISH показан на рис. 4, демонстрируя типичную картину, наблюдаемую с Hst-5 или обработанной слюной (T) тканью по сравнению с необработанной (U) тканью. Аналогичным образом, на рис. 5 показано репрезентативное увеличенное изображение языка, инфицированного C. albicans , демонстрирующий типичную обширную адгезию и инвазию гиф в эпителий, происходящую в отсутствие Hst-5 или слюны.
4
Открыть в новой вкладке Загрузить слайд
Увеличенные (× 100) изображения срезов ткани языка с помощью PNA–FISH, гибридизированных с Cy3-конъюгированным Candida albicans -специфическим зондом. Репрезентативные изображения, демонстрирующие присутствие C. albicans на ткани необработанных (U) языков по сравнению с присутствием на языках, обработанных (T) Hst-5 или слюной. Шкала баров = 20 мкм.
Репрезентативные изображения, демонстрирующие присутствие C. albicans на ткани необработанных (U) языков по сравнению с присутствием на языках, обработанных (T) Hst-5 или слюной. Шкала баров = 20 мкм.
5
Открыть в новой вкладке Загрузить слайд
Увеличенное типичное изображение окрашенного PAS среза необработанной ткани языка, инфицированного Candida albicans . Репрезентативное изображение, демонстрирующее обширное прилегание и инвазию гиф (стрелки) паракератинового и шиповатого слоев эпителия. Масштабная линейка = 20 мкм.
Считается, что в полости рта решающую роль в этом процессе играют врожденные иммунные факторы хозяина, такие как антимикробные пептиды. В случае кандидоза полости рта Hst-5 привлек значительное внимание благодаря своим сильным противогрибковым свойствам. Однако, хотя антикандидозная активность Hst-5 была четко установлена in vitro , исследований, изучающих его эффективность в защите ткани хозяина от кандидозной инфекции, не проводилось. Модели кандидоза слизистых оболочек, которые близко соответствуют динамике in vivo , крайне желательны, поскольку они играют центральную роль в оценке грибковой патогенности и защиты хозяина. Что еще более важно, такие модели полезны для оценки эффективности различных средств для лечения кандидоза полости рта. Мышиная модель была предпочтительной животной моделью для изучения кандидоза слизистых оболочек из-за продемонстрированного сходства конкретных процессов хозяина. Поэтому мы приняли мышиную ex vivo модель оральной инфекции, чтобы реально оценить антикандидозную активность Hst-5 на тканях полости рта хозяина. Кроме того, хотя было показано, что человеческая слюна оказывает защитное антикандидозное действие на ткани полости рта, этот эффект не был приписан какому-либо конкретному компоненту слюны (Kamagata-Kiyoura., 2004). С этой целью были также разработаны эксперименты для оценки защитного действия слюны на ткани полости рта и определения роли Hst-5 в этом процессе.
Кроме того, хотя было показано, что человеческая слюна оказывает защитное антикандидозное действие на ткани полости рта, этот эффект не был приписан какому-либо конкретному компоненту слюны (Kamagata-Kiyoura., 2004). С этой целью были также разработаны эксперименты для оценки защитного действия слюны на ткани полости рта и определения роли Hst-5 в этом процессе.
На основе жизнеспособных C. albicans единиц, извлеченных из необработанных и обработанных инфицированных языков, результаты продемонстрировали уменьшение количества КОЕ пропорционально используемой концентрации Hst-5 (рис. 1а). Эти результаты были аналогичны результатам, полученным из анализов уничтожения in vitro в предыдущих исследованиях (Meiller., 2009). Удивительно, но при воздействии на язык Hst-5 в течение 30 минут или 3,5 часов существенной разницы в уровне антикандидозной защиты не наблюдалось, что указывает на то, что Hst-5 проявляет свой антикандидозный эффект очень быстро.
В соответствии с предыдущими выводами эффективность Hst-5 на ткани была обратно пропорциональна плотности клеток C. albicans (рис. 1b). Эти результаты важны с точки зрения способности C. albicans разлагать Hst-5; на основе денситометрического анализа интактного Hst-5 по сравнению с продуктами деградации после электрофоретического разделения фрагментированного Hst-5 было показано, что уровень деградации пропорционален плотности клеток C. albicans (Meiller., 2009).). В текущем исследовании при плотности C. albicans , неспособной значительно разлагать Hst-5 (1 × 10 6 клеток мл -1 ), 85% клеток погибло (рис. 1b). Наоборот, плотность клеток 1 × 10 9 клеток/мл -1 , вызывающая 45% потерю целостности Hst-5, приблизительно 58% из клеток C. albicans были убиты ( P <0,05). В совокупности эти результаты убедительно свидетельствуют о том, что снижение активности Hst-5, вызванное C. albicans 9Увеличение числа 0005, вероятно, связано с протеолизом пептида путем пролиферации C. albicans .
albicans (рис. 1b). Эти результаты важны с точки зрения способности C. albicans разлагать Hst-5; на основе денситометрического анализа интактного Hst-5 по сравнению с продуктами деградации после электрофоретического разделения фрагментированного Hst-5 было показано, что уровень деградации пропорционален плотности клеток C. albicans (Meiller., 2009).). В текущем исследовании при плотности C. albicans , неспособной значительно разлагать Hst-5 (1 × 10 6 клеток мл -1 ), 85% клеток погибло (рис. 1b). Наоборот, плотность клеток 1 × 10 9 клеток/мл -1 , вызывающая 45% потерю целостности Hst-5, приблизительно 58% из клеток C. albicans были убиты ( P <0,05). В совокупности эти результаты убедительно свидетельствуют о том, что снижение активности Hst-5, вызванное C. albicans 9Увеличение числа 0005, вероятно, связано с протеолизом пептида путем пролиферации C. albicans .
Более важным, однако, была демонстрация защитного эффекта для слюны, сравнимого с эффектом, проявляемым только Hst-5 (рис. 2). Интересно, что уровень защиты слюны (на основе подсчета C. albicans КОЕ) был эквивалентен таковому для концентраций Hst-5 в пределах физиологического диапазона слюны (150–300 мкг/мл -1 ), как определено по Hst- 5 кривая гибели в зависимости от концентрации (рис. 1а). Хотя этот наблюдаемый эффект слюны не обязательно может быть связан с Hst-5, результаты последующих анализов нейтрализации убедительно свидетельствовали о том, что Hst-5 является ключевым компонентом слюны. На основании имеющейся информации, демонстрирующей фрагментацию и дезактивацию Hst-5 с помощью SAPS, слюну предварительно обрабатывали протеазами перед нанесением на ткани полости рта (Meiller., 2009).). Как и ожидалось, результаты показали почти полную потерю первоначально наблюдаемого защитного действия слюны (рис. 2а). По отдельности обработка Sap2 оказалась более эффективной в нейтрализации Hst-5, чем Sap9, при тех же концентрациях. Эти наблюдения были интересны, поскольку они согласуются с предыдущими результатами, согласно которым на основе анализа продуктов деградации Hst-5 методом ОФ-ВЭЖХ и MALDI-TOF/TOF MS было показано, что Sap2 приводит к усилению деградации Hst-5 (Meiller.
2). Интересно, что уровень защиты слюны (на основе подсчета C. albicans КОЕ) был эквивалентен таковому для концентраций Hst-5 в пределах физиологического диапазона слюны (150–300 мкг/мл -1 ), как определено по Hst- 5 кривая гибели в зависимости от концентрации (рис. 1а). Хотя этот наблюдаемый эффект слюны не обязательно может быть связан с Hst-5, результаты последующих анализов нейтрализации убедительно свидетельствовали о том, что Hst-5 является ключевым компонентом слюны. На основании имеющейся информации, демонстрирующей фрагментацию и дезактивацию Hst-5 с помощью SAPS, слюну предварительно обрабатывали протеазами перед нанесением на ткани полости рта (Meiller., 2009).). Как и ожидалось, результаты показали почти полную потерю первоначально наблюдаемого защитного действия слюны (рис. 2а). По отдельности обработка Sap2 оказалась более эффективной в нейтрализации Hst-5, чем Sap9, при тех же концентрациях. Эти наблюдения были интересны, поскольку они согласуются с предыдущими результатами, согласно которым на основе анализа продуктов деградации Hst-5 методом ОФ-ВЭЖХ и MALDI-TOF/TOF MS было показано, что Sap2 приводит к усилению деградации Hst-5 (Meiller. , 2009). ).
, 2009). ).
Больше подходит для клинического применения in vivo , инкубация слюны с C. albicans при заранее определенной плотности клеток, существенно нарушающей целостность Hst-5, приводила к потере первоначальной защитной способности слюны на 35–40% ( P <0,05) (рис. 2b). ). Тем не менее, чтобы окончательно идентифицировать Hst-5 как ключевой элемент слюны, потребуется нейтрализация защиты слюны с помощью Hst-5-специфического антитела. Хотя в настоящее время в наших лабораториях производится моноклональное антитело, специфичное к Hst-5, в настоящее время оно недоступно. Однако важно отметить, что Hst-5 является единственной идентифицированной специфичной для хоста мишенью для Sap9.. Таким образом, нейтрализация слюны при обработке Sap9 указывает на то, что, скорее всего, Hst-5 является компонентом, ответственным за защиту слюны.
Кроме того, при предварительном тестировании массива из нуль-мутантных штаммов SAP C. albicans на их способность разлагать Hst-5 не было обнаружено ингибирования деградации Hst-5 с мутантным штаммом C. albicans sap2 , тогда как с мутантом sap9 наблюдалось 100% ингибирование деградации (Meiller., 2009).). В совокупности эти данные показывают, что хотя Sap2-очищенная протеаза эффективно расщепляет Hst-5, эта протеаза не является фактором, ассоциированным с клетками C. albicans , ответственным за нейтрализацию Hst-5 и слюны после инкубации с дрожжевыми клетками C. albicans . .
albicans sap2 , тогда как с мутантом sap9 наблюдалось 100% ингибирование деградации (Meiller., 2009).). В совокупности эти данные показывают, что хотя Sap2-очищенная протеаза эффективно расщепляет Hst-5, эта протеаза не является фактором, ассоциированным с клетками C. albicans , ответственным за нейтрализацию Hst-5 и слюны после инкубации с дрожжевыми клетками C. albicans . .
Таким образом, это исследование идентифицирует Hst-5 как медиатор слюны, участвующий в защите ротовой полости от C. albicans , тем самым подтверждая терапевтический потенциал этого пептида. Основываясь на объединенных результатах, разумно предположить, что Hst-5 играет ключевую роль в предотвращении перехода C. albicans от комменсала к патогену. Именно нарушение тонкого баланса между факторами хозяина и возбудителя определяет динамику инфекционного процесса в полости рта. Тем не менее, клинические исследования необходимы для полного выяснения роли врожденного иммунитета хозяина в повышенной предрасположенности к оральному кандидозу в контексте ВИЧ, уровня Hst-5 в слюне и распространенности кандидоза.
При ограниченном арсенале доступных противогрибковых препаратов в сочетании с растущим появлением резистентных C. albicans , перспектива предотвращения кандидоза с использованием врожденных противомикробных пептидов в качестве альтернативной лекарственной терапии становится все более привлекательной (Helmerhorst., 1999a, b; Situ & Bobek, 2000; van’t Hof., 2001). В частности, его мощные антикандидозные свойства в сочетании с отсутствием токсичности для клеток человека делают Hst-5 многообещающим терапевтическим средством для профилактики и/или лечения кандидоза полости рта, особенно у ВИЧ-инфицированных. Однако, чтобы полностью изучить терапевтический потенциал Hst-5 у хозяина, in vivo модель гарантируется. Эти эксперименты в настоящее время готовятся в наших лабораториях.
и другие. (
2006
)
Гликозилфосфатидилинозитол-заякоренные протеазы Candida albicans белки-мишени, необходимые как для клеточных процессов, так и для взаимодействия хозяин-патоген
.
J Biol Chem
281
:
688
–
694
.
Кальдероне
РА
(
2002
)
Кандида и кандидоз
.
ASM Press
,
Вашингтон
.
Де Репентиньи
L
Левандовски
D
Жоликер
P
(
2004
)
Иммунопатогенез орофарингеального кандидоза при инфекции вирусом иммунодефицита человека
.
Clin Microbiol Rev
17
:
729
–
759
.
Эдгар
ВМ
(
1992
)
Слюна: секреция, состав и функции
.
Brit Dent J
172
:
305
–
312
.
Edgerton
M
Кошлукова
SE
Chrzan
BG
Straubinger
RM
1998
)
Кандидоцидная активность гистатинов слюны
.
J Biol Chem
272
:
20438
–
20447
.
Фидель
PL
младший
.
Adv Dent Res
19
:
80
–
84
.
Гиллум
АМ
Цай
ЭЙ
Кирш
ДР
(
1984
)
Выделение Candida albicans гена оротидин-5′-фосфатдекарбоксилазы путем комплементации мутаций S. cerevisiae ura3 и F. coli 3009s 480 pyr 5
Мол Ген Генет
198
:
179
–
182
.
Гюрко
С
Ленденманн
U
Helmerhorst
EJ
Troxler
RF
Oppenheim
FG
(
2001
)
Уничтожение Candida albicans с помощью гистатина 5: клеточное поглощение и потребность в энергии
.
Антони ван Левенгук
79
:
297
–
309
.
Хельмерхорст
EJ
Вант Хоф
W
Veerman
ECI
Simoons-Smit
I
Нью-Амеронген
AV
(
1997
)
Синтетические аналоги гистатина с противомикробным действием широкого спектра действия
.
Biochem J
326
:
39
–
45
.
Хельмерхорст
EJ
Ходжсон
R
Van’t Hof
W
Veerman
EC
Allison
C
Нью-Амеронген
AV
(
1999a
)
Влияние основных антимикробных пептидов, полученных из гистатина, на биопленки ротовой полости
.
J Dent Res
78
:
1245
–
1250
.
Хельмерхорст
EJ
Рейндерс
IM
Van’t Hof
W
Simoons-Smit
I
Veerman
ECI
80050 Nieuw Amerongen 9 3
1999b
)
Устойчивые к амфотерицину В и флуконазолу Candida spp., Aspergillus fumigatus и другие новые патогенные грибы чувствительны к основным противогрибковым пептидам
9 9.
Антимикробные агенты Ch
43
:
702
–
704
.
Хамфри
SP
Уильямсон
RT
(
2001
)
Обзор слюны: нормальный состав, поток и функция
.
J Протез Дент
85
:
162
–
169
.
Камагата-Киёра
Y
Ямагути
H
Нитта
T
(
2004
)
Защитное действие человеческой слюны на экспериментальный кандидоз ротовой полости мышей
.
J Заразить Chemother
10
:
253
–
255
.
Klein
RS
Harris
CA
Small
CB
Lesser
M
Friedland
ГХ
(
1984
)
Кандидоз полости рта у пациентов с высоким риском как начальное проявление синдрома приобретенного иммунодефицита
.
New Engl J Med
311
:
354
–
358
.
Кошлукова
SE
Араужо
MWB
Эдгертон
М
(
2000
)
Высвобожденный АТФ является внеклеточным цитотоксическим медиатором при индуцированном гистатином 5 в слюне уничтожении Candida albicans
.
Infect Immun
68
:
6848
–
6856
.
Мейллер
TF
Шильд
L
и другие. (
2009
)
Новая стратегия уклонения от иммунитета Candida albicans : протеолитическое расщепление антимикробного пептида слюны
.
PLoS ONE
4
:
e5039
.
Наглик
JR
Чаллакомб
SJ
(
1999
)
Candida albicans секретирует аспартилпротеиназы в вирулентности и патогенезе
.
Infect Immun
67
:
2740
–
2745
.
Никава
H
Макихира
S
Хамада
T
Самаранаяке
LP
(
2002
)
Чувствительность изолятов Candida albicans из ротовой полости ВИЧ-позитивных пациентов к гистатину-5
.
J Протез Dent
88
:
263
–
267
.
Oppenheim
FG
McMillian
FM
Levitz
SM
Diamond
RD
Offner
GD
Troxler
RF
(
1988
)
Гистатины, новое семейство богатых гистидином белков в секреции околоушной железы человека
.
J Biol Chem
263
:
7472
–
7477
.
Перлрот
Дж
Спеллберг
Б
(
2007
)
Внутрибольничные грибковые инфекции: эпидемиология, диагностика и лечение
.
Мед Микол
45
:
321
–
346
.
Бобек
ЛА
(
2000
)
In vitro оценка противогрибкового терапевтического потенциала гистатина-5 слюны, двух вариантов гистатина-5 и домена муцина слюны (MUC7) 1
.
Противомикробные агенты Ch
44
:
1485
–
1493
.
Torres
SR
Garzino-Demo
A
MEEKS
V
Мейллер
TF
JABRA-RIZK
MA
TF
JABRA-RIZK
MA
TF
JABRA-RIZK
MA
TF
JABRA-RIZK
MA
TF
0049(
2008
)
Гистатин-5 слюны и грибковая колонизация полости рта у ВИЧ-инфицированных
.
Микозы
52
:
11
–
15
.
Бобек
ЛА
(
1997
)
Исследования механизма кандидацидной активности гистатина-5 слюны человека с вариантами гистатина-5 и азол-чувствительными и -резистентными Candida видов
.
Противомикробные агенты Ch
41
:
2224
–
2228
.
Van’t Hof
W
Reijnders
IM
Helmerhorst
EJ
Walgreen-Weterings
E
Simoons-Smit
IM
Veerman
EC
Amerongen
AV
(
2000
)
Синергетический эффект низких доз гистатина 5 и его аналогов на противогрибковую активность амфотерицина В
.
Антони ван Левенгук
78
:
163
–
169
.
Van’t Hof
W
Veerman
ECI
Helmerhorst
EJ
Нью-Амеронген
8 AV (
2001
)
Антимикробные пептиды: свойства и применение
.
Биол Хим
382
:
597
–
619
.
Villar
CC
Kashleva
H
Nobile
CJ
Mitchell
AP
Dongari-Bagtzoglou
A
(
2007
)
Инвазия слизистой оболочки Candida albicans связан с деградацией Е-кадгерина, опосредованной фактором транскрипции rim 101p и протеазой Sap5p
.
Infect Immun
75
:
2126
–
2135
.
Примечания автора
Редактор: Ричард Кальдероне
© Федерация европейских микробиологических обществ, 2010 г. Опубликовано Blackwell Publishing Ltd. Все права защищены.
© Федерация европейских микробиологических обществ, 2010 г. Опубликовано Blackwell Publishing Ltd. Все права защищены
IL-17-опосредованная противогрибковая защита слизистой оболочки полости рта не зависит от нейтрофилов
Введение
Опосредованный интерлейкином-17 (IL-17) иммунитет стал ключевым механизмом защиты от грибковых инфекций слизистой оболочки. Генетические дефекты пути IL-17 связаны с хроническим кожно-слизистым кандидозом (CMC), состоянием, характеризующимся рецидивирующими или персистирующими инфекциями кожи, ногтей, половых органов и слизистой оболочки полости рта видами Candida . 1 Первым прямым доказательством того, что IL-17 важен для защиты CMC, было выявление пациентов с полным аутосомно-рецессивным дефицитом рецептора IL-17 A (IL-17RA) или частичным аутосомно-доминантным дефицитом IL-17F. 2 Совсем недавно были идентифицированы пациенты с миссенс-мутациями в адапторной молекуле Act1 3 . Кроме того, пациенты с мутациями с потерей функции в STAT3 или с мутациями с усилением функции в STAT1 , которые демонстрируют дефицит циркулирующих Т-клеток, продуцирующих IL-17, и пациенты с мутациями в AIRE с высокими титрами нейтрализующих аутоантител к IL-17A, IL-17F и IL-22 проявляют CMC. 4, 5, 6, 7, 8 В совокупности эти данные указывают на то, что цитокины IL-17 играют неповторяющуюся роль в противогрибковой защите барьерных тканей. Эксперименты на мышах воспроизвели строгую зависимость кожно-слизистой защиты от C. albicans от передачи сигналов IL-17. 9, 10 Семейство цитокинов IL-17 состоит из шести членов (IL-17A–IL-17F).
1 Первым прямым доказательством того, что IL-17 важен для защиты CMC, было выявление пациентов с полным аутосомно-рецессивным дефицитом рецептора IL-17 A (IL-17RA) или частичным аутосомно-доминантным дефицитом IL-17F. 2 Совсем недавно были идентифицированы пациенты с миссенс-мутациями в адапторной молекуле Act1 3 . Кроме того, пациенты с мутациями с потерей функции в STAT3 или с мутациями с усилением функции в STAT1 , которые демонстрируют дефицит циркулирующих Т-клеток, продуцирующих IL-17, и пациенты с мутациями в AIRE с высокими титрами нейтрализующих аутоантител к IL-17A, IL-17F и IL-22 проявляют CMC. 4, 5, 6, 7, 8 В совокупности эти данные указывают на то, что цитокины IL-17 играют неповторяющуюся роль в противогрибковой защите барьерных тканей. Эксперименты на мышах воспроизвели строгую зависимость кожно-слизистой защиты от C. albicans от передачи сигналов IL-17. 9, 10 Семейство цитокинов IL-17 состоит из шести членов (IL-17A–IL-17F). Наиболее хорошо изученные цитокины IL-17A и IL-17F, которые могут образовывать гомодимеры и гетеродимеры, передают сигнал через гетеродимерный рецепторный комплекс IL-17RA-IL-17RC, в то время как родственный цитокин IL-17C использует димерный рецептор, состоящий из IL-17RC. 17РА и Ил-17РЭ для сигнализации. 11 Т-хелперные клетки считаются основными продуцентами IL-17A и IL-17F. 12 Считается, что они способствуют долговременной защите от грибков, в частности от C. albicans , который является частью нормальной комменсальной флоры человека. 13 В соответствии с этим представлением, C. albians -специфические Т-клетки памяти у человека принадлежат преимущественно к подмножеству, секретирующему IL-17, 14 и антиген-специфические Т-хелперы-17 способствуют защите от грибковой инфекции при индукции в условиях экспериментальной вакцинации. 15, 16, 17 Помимо CD4 + Т-клеток, IL-17 может секретироваться широким спектром клеток врожденной иммунной системы, 18 , что особенно важно при острой инфекции.
Наиболее хорошо изученные цитокины IL-17A и IL-17F, которые могут образовывать гомодимеры и гетеродимеры, передают сигнал через гетеродимерный рецепторный комплекс IL-17RA-IL-17RC, в то время как родственный цитокин IL-17C использует димерный рецептор, состоящий из IL-17RC. 17РА и Ил-17РЭ для сигнализации. 11 Т-хелперные клетки считаются основными продуцентами IL-17A и IL-17F. 12 Считается, что они способствуют долговременной защите от грибков, в частности от C. albicans , который является частью нормальной комменсальной флоры человека. 13 В соответствии с этим представлением, C. albians -специфические Т-клетки памяти у человека принадлежат преимущественно к подмножеству, секретирующему IL-17, 14 и антиген-специфические Т-хелперы-17 способствуют защите от грибковой инфекции при индукции в условиях экспериментальной вакцинации. 15, 16, 17 Помимо CD4 + Т-клеток, IL-17 может секретироваться широким спектром клеток врожденной иммунной системы, 18 , что особенно важно при острой инфекции. Соответственно, IL-17A- и IL-17F-продуцирующие врожденные лимфоидные клетки (ILC) играют ключевую роль в опосредовании IL-17-зависимой защиты против C. albicans в мышиной модели орофарингеальной инфекции. 19
Соответственно, IL-17A- и IL-17F-продуцирующие врожденные лимфоидные клетки (ILC) играют ключевую роль в опосредовании IL-17-зависимой защиты против C. albicans в мышиной модели орофарингеальной инфекции. 19
Хотя цитокины IL-17 широко изучались в последние годы, механизм их действия остается недостаточно изученным. В то время как IL-17RA широко экспрессируется на гемопоэтических и негематопоэтических клетках, корецептор IL-17RC имеет более ограниченный характер экспрессии. 20 Некроветворные клетки, включая эпителиальные клетки, эндотелиальные клетки и фибробласты, считаются наиболее важными клетками-мишенями для IL-17A и IL-17F. Связывание лиганда с гетеродимером IL-17RA-IL-17RC активирует ядерный фактор каппа-В через адапторный белок Act1 и фактор 6, ассоциированный с рецептором фактора некроза опухоли, а также белки CCAAT/энхансер-связывающие белки C/EBP-β и C/. EBP-δ для стимуляции транскрипции и повышения стабильности мРНК генов-мишеней. Ранние исследования биологической функции IL-17A связывали его с биологией нейтрофилов. Они продемонстрировали, что IL-17 индуцирует продукцию гранулоцитарного колониестимулирующего фактора (G-CSF), IL-6 и нейтрофильного хемотаксического фактора IL-8 в клетках человека, 21, 22 и что форсированная экспрессия IL-17 с помощью различных механизмов (т. е. индукция эндогенного IL-17 эндотоксином, сверхэкспрессия кодируемого аденовирусом IL-17A или введение рекомбинантного IL-17A) приводит к массивной нейтрофилии. 22, 23, 24 Сообщалось, что нарушение метаболического пути IL-17 вызывает нарушение ответа нейтрофилов в нескольких экспериментальных условиях. Например, легочная инфекция Klebsiella pneumonia и Staphylococcus aureus у мышей с дефицитом IL-17RA вызывает сниженную индукцию G-CSF, гранулоцитарно-макрофагального колониестимулирующего фактора и хемокинов, привлекающих нейтрофилы 25, 26 , и связан со снижением рекрутирования нейтрофилов в очаг инфекции и нарушением бактериального контроля . 26, 27 Аналогично, IL-17 также участвует в опосредованном нейтрофилами контроле инфекции S.
Они продемонстрировали, что IL-17 индуцирует продукцию гранулоцитарного колониестимулирующего фактора (G-CSF), IL-6 и нейтрофильного хемотаксического фактора IL-8 в клетках человека, 21, 22 и что форсированная экспрессия IL-17 с помощью различных механизмов (т. е. индукция эндогенного IL-17 эндотоксином, сверхэкспрессия кодируемого аденовирусом IL-17A или введение рекомбинантного IL-17A) приводит к массивной нейтрофилии. 22, 23, 24 Сообщалось, что нарушение метаболического пути IL-17 вызывает нарушение ответа нейтрофилов в нескольких экспериментальных условиях. Например, легочная инфекция Klebsiella pneumonia и Staphylococcus aureus у мышей с дефицитом IL-17RA вызывает сниженную индукцию G-CSF, гранулоцитарно-макрофагального колониестимулирующего фактора и хемокинов, привлекающих нейтрофилы 25, 26 , и связан со снижением рекрутирования нейтрофилов в очаг инфекции и нарушением бактериального контроля . 26, 27 Аналогично, IL-17 также участвует в опосредованном нейтрофилами контроле инфекции S. aureus в коже. 28 Индукция хемокинов и цитокинов и рекрутирование нейтрофилов также затрагиваются у мышей с дефицитом IL-17 в ответ на Mycobacterium bovis бацилла Кальметта-Герена, связанная с уменьшением образования гранулемы. 29 Более того, дефицит IL-17RA аннулирует защиту от паразита Trypansoma cruzi из-за снижения уничтожения паразита нейтрофилами и улучшения нейтрофильной иммунопатологии. 30 Наконец, IL-17-зависимый вакцинный иммунитет к Blastomyces dermatitidis коррелирует с увеличением количества нейтрофилов и противогрибковой активностью в месте заражения. 17 В дополнение к этим ситуациям, в которых IL-17-опосредованный ответ нейтрофилов способствует элиминации патогенов и, таким образом, полезен для хозяина, IL-17 может также оказывать патогенное действие при нарушении регуляции, опосредуя хроническое воспаление, связанное с явной нейтрофилией. Об этом, например, сообщают при кистозном фиброзе, псориазе, легочном аспергиллезе или респираторно-синцитиальном вирусе, а также при инфекции, вызванной вирусом гриппа.
aureus в коже. 28 Индукция хемокинов и цитокинов и рекрутирование нейтрофилов также затрагиваются у мышей с дефицитом IL-17 в ответ на Mycobacterium bovis бацилла Кальметта-Герена, связанная с уменьшением образования гранулемы. 29 Более того, дефицит IL-17RA аннулирует защиту от паразита Trypansoma cruzi из-за снижения уничтожения паразита нейтрофилами и улучшения нейтрофильной иммунопатологии. 30 Наконец, IL-17-зависимый вакцинный иммунитет к Blastomyces dermatitidis коррелирует с увеличением количества нейтрофилов и противогрибковой активностью в месте заражения. 17 В дополнение к этим ситуациям, в которых IL-17-опосредованный ответ нейтрофилов способствует элиминации патогенов и, таким образом, полезен для хозяина, IL-17 может также оказывать патогенное действие при нарушении регуляции, опосредуя хроническое воспаление, связанное с явной нейтрофилией. Об этом, например, сообщают при кистозном фиброзе, псориазе, легочном аспергиллезе или респираторно-синцитиальном вирусе, а также при инфекции, вызванной вирусом гриппа. 31, 32, 33, 34, 35 В совокупности это указывает на ключевую роль нейтрофилов в реакциях, опосредованных IL-17. Удивительно, но регуляция ответа нейтрофилов на C. albicans подробно не анализировался, несмотря на выдающуюся роль IL-17 в защите от этого грибка. 1
31, 32, 33, 34, 35 В совокупности это указывает на ключевую роль нейтрофилов в реакциях, опосредованных IL-17. Удивительно, но регуляция ответа нейтрофилов на C. albicans подробно не анализировался, несмотря на выдающуюся роль IL-17 в защите от этого грибка. 1
Здесь мы показываем, что защитные эффекты IL-17 против ротоглоточного кандидоза (OPC) не зависят от эффекторных функций нейтрофилов. Хотя нейтрофилы участвуют в ограничении проникновения грибка в очаг инфекции, рекрутирование и активность нейтрофилов не нарушается у мышей с дефицитом IL-17RA и IL-17RC или у мышей с дефицитом цитокинов IL-17A и IL-17F. Вместо этого передача сигналов IL-17, по-видимому, опосредует иммунитет слизистых оболочек против C. albicans , регулируя экспрессию антимикробных пептидов (AMP) в эпителии ротовой полости, которые устраняют грибок со слизистой оболочки полости рта и предотвращают персистентную инфекцию.
Результаты
Нейтрофилы необходимы для борьбы с грибками в OPC
Чтобы оценить ответ нейтрофилов во время орофарингеальной инфекции C. albicans , мы оценили динамику рекрутирования нейтрофилов в очаг инфекции. Мы наблюдали клеточные инфильтраты на языке, начиная уже через 16 часов после заражения (рис. 1а, б и данные не показаны). Нейтрофилы накапливались в эпителиальном слое, преимущественно в местах, где гиф C. albicans вторглись в кератиноцитарный барьер на дорсальной и вентральной сторонах языка. Грибковое окрашивание было обнаружено в клеточных инфильтратах, хотя гифы выглядели деградировавшими по сравнению с более периферическими длинными гифами в роговом слое. Мы не наблюдали проникновения C. albicans в базальную мембрану и нижележащие ткани. Популяция инфильтрирующих лейкоцитов, которая состояла в основном из нейтрофилов с меньшим вкладом моноцитов, достигала максимальных уровней через 24–48 ч после заражения и впоследствии снижалась одновременно с исчезновением инфекции и выздоровлением мышей (рис. 1а и данные не показаны). . Истощение нейтрофилов у мышей дикого типа с использованием антитела NimpR14 привело к сильному нарушению контроля над грибком, и мышей пришлось убить по гуманным причинам на 3-й день после заражения (рис.
albicans , мы оценили динамику рекрутирования нейтрофилов в очаг инфекции. Мы наблюдали клеточные инфильтраты на языке, начиная уже через 16 часов после заражения (рис. 1а, б и данные не показаны). Нейтрофилы накапливались в эпителиальном слое, преимущественно в местах, где гиф C. albicans вторглись в кератиноцитарный барьер на дорсальной и вентральной сторонах языка. Грибковое окрашивание было обнаружено в клеточных инфильтратах, хотя гифы выглядели деградировавшими по сравнению с более периферическими длинными гифами в роговом слое. Мы не наблюдали проникновения C. albicans в базальную мембрану и нижележащие ткани. Популяция инфильтрирующих лейкоцитов, которая состояла в основном из нейтрофилов с меньшим вкладом моноцитов, достигала максимальных уровней через 24–48 ч после заражения и впоследствии снижалась одновременно с исчезновением инфекции и выздоровлением мышей (рис. 1а и данные не показаны). . Истощение нейтрофилов у мышей дикого типа с использованием антитела NimpR14 привело к сильному нарушению контроля над грибком, и мышей пришлось убить по гуманным причинам на 3-й день после заражения (рис. 1с, данные не показаны). Затем мы стремились показать незаменимую роль нейтрофилов в модели, используя альтернативные стратегии истощения нейтрофилов. Сначала мы использовали анти-Ly6G-антитело 1A8, но, несмотря на полное удаление нейтрофилов из крови, большое количество нейтрофилов все еще можно было обнаружить на языке инфицированных мышей, даже если ежедневно вводили высокие дозы антитела (дополнительный рисунок S1A онлайн). ). Хотя популяция Ly6G 9Клетки 0006 hi оказались сильно уменьшены в языке мышей, получавших 1A8, тщательный анализ показал, что большая популяция клеток CD11b + Ly6C + на самом деле представляла собой нейтрофилы, покрытые 1A8, которые были неспособны связывать какие-либо дополнительные флуоресцентно меченное антитело 1A8, используемое для анализа (дополнительная фигура S1A и данные не показаны). Таким образом, мы использовали комбинированную стратегию, истощая циркулирующие нейтрофилы с помощью антитела против Ly6G и блокируя мобилизацию вновь образованных нейтрофилов из костного мозга с помощью антитела против G-CSF, соответственно, как описано ранее.
1с, данные не показаны). Затем мы стремились показать незаменимую роль нейтрофилов в модели, используя альтернативные стратегии истощения нейтрофилов. Сначала мы использовали анти-Ly6G-антитело 1A8, но, несмотря на полное удаление нейтрофилов из крови, большое количество нейтрофилов все еще можно было обнаружить на языке инфицированных мышей, даже если ежедневно вводили высокие дозы антитела (дополнительный рисунок S1A онлайн). ). Хотя популяция Ly6G 9Клетки 0006 hi оказались сильно уменьшены в языке мышей, получавших 1A8, тщательный анализ показал, что большая популяция клеток CD11b + Ly6C + на самом деле представляла собой нейтрофилы, покрытые 1A8, которые были неспособны связывать какие-либо дополнительные флуоресцентно меченное антитело 1A8, используемое для анализа (дополнительная фигура S1A и данные не показаны). Таким образом, мы использовали комбинированную стратегию, истощая циркулирующие нейтрофилы с помощью антитела против Ly6G и блокируя мобилизацию вновь образованных нейтрофилов из костного мозга с помощью антитела против G-CSF, соответственно, как описано ранее. 36 Действительно, это привело к снижению числа нейтрофилов >95%, но не к дефекту накопления воспалительных моноцитов в инфицированном языке (дополнительные рисунки S1B и C). Подобно лечению NimpR14, этот режим приводил к высокой грибковой нагрузке через 3 дня после заражения, момент времени, когда грибок исчез у животных дикого типа, которым не вводили разрушающие нейтрофилы антитела (рис. 1d). В отсутствие нейтрофилов гиф C. albicans росли неконтролируемо и проникали в собственную пластинку языка уже через 1 день после заражения и гораздо более заметно на 2-й день после заражения (рис. 1д, е). Вместе эти данные подчеркивают важную роль нейтрофилов в защите хозяина от OPC, как недавно предположил Huppler 9.1739 и др. 37 В ответ на инфекцию нейтрофилы образуют кажущуюся непроницаемой иммунологическую перегородку, примыкающую к эпителиальному барьеру, ограничивающему грибок в очаге инфекции.
36 Действительно, это привело к снижению числа нейтрофилов >95%, но не к дефекту накопления воспалительных моноцитов в инфицированном языке (дополнительные рисунки S1B и C). Подобно лечению NimpR14, этот режим приводил к высокой грибковой нагрузке через 3 дня после заражения, момент времени, когда грибок исчез у животных дикого типа, которым не вводили разрушающие нейтрофилы антитела (рис. 1d). В отсутствие нейтрофилов гиф C. albicans росли неконтролируемо и проникали в собственную пластинку языка уже через 1 день после заражения и гораздо более заметно на 2-й день после заражения (рис. 1д, е). Вместе эти данные подчеркивают важную роль нейтрофилов в защите хозяина от OPC, как недавно предположил Huppler 9.1739 и др. 37 В ответ на инфекцию нейтрофилы образуют кажущуюся непроницаемой иммунологическую перегородку, примыкающую к эпителиальному барьеру, ограничивающему грибок в очаге инфекции.
Нейтрофилы необходимы для борьбы с грибками при орофарингеальном кандидозе (OPC). ( a ) CD11b + Ly6G + Ly6C + нейтрофилов на языке инфицированных мышей дикого типа (WT) подсчитывали с помощью проточной цитометрии в указанные моменты времени. Данные представляют собой среднее значение + s.d. из 2–7 мышей, объединенных в результате трех независимых экспериментов. ( b ) Сагиттальные срезы языка инфицированных мышей WT окрашивали периодической кислотой Шиффа (PAS) и докрашивали гематоксилином. Показан репрезентативный раздел для каждой временной точки. Бар=100 мкм. ( c ) Грибковая нагрузка на язык необработанных или получавших NimpR14 мышей WT была проанализирована на 2-й и 3-й день после заражения. ( d ) Грибковое поражение языка у необработанных или обработанных анти-Ly6G и анти-гранулоцитарным колониестимулирующим фактором (G-CSF) мышей WT на 3-й день после заражения. Данные в c и d объединены из двух экспериментов каждый. Каждый символ представляет одну мышь; среднее значение + с.
( a ) CD11b + Ly6G + Ly6C + нейтрофилов на языке инфицированных мышей дикого типа (WT) подсчитывали с помощью проточной цитометрии в указанные моменты времени. Данные представляют собой среднее значение + s.d. из 2–7 мышей, объединенных в результате трех независимых экспериментов. ( b ) Сагиттальные срезы языка инфицированных мышей WT окрашивали периодической кислотой Шиффа (PAS) и докрашивали гематоксилином. Показан репрезентативный раздел для каждой временной точки. Бар=100 мкм. ( c ) Грибковая нагрузка на язык необработанных или получавших NimpR14 мышей WT была проанализирована на 2-й и 3-й день после заражения. ( d ) Грибковое поражение языка у необработанных или обработанных анти-Ly6G и анти-гранулоцитарным колониестимулирующим фактором (G-CSF) мышей WT на 3-й день после заражения. Данные в c и d объединены из двух экспериментов каждый. Каждый символ представляет одну мышь; среднее значение + с. д. указывается. Пунктирная линия представляет собой предел обнаружения. ** Р <0,01. ( e – f ) Репрезентативные сагиттальные срезы языка от необработанных или обработанных анти-Ly6G и анти-G-CSF ( e ) или обработанных NimpR14 ( f ) мышей WT в день 1 ( e ) ) или на 2-й день ( f ) после заражения и окрашивание PAS и гематоксилином. Показаны репрезентативные разделы. Бар=100 мкм. См. также дополнительный рисунок S1.
д. указывается. Пунктирная линия представляет собой предел обнаружения. ** Р <0,01. ( e – f ) Репрезентативные сагиттальные срезы языка от необработанных или обработанных анти-Ly6G и анти-G-CSF ( e ) или обработанных NimpR14 ( f ) мышей WT в день 1 ( e ) ) или на 2-й день ( f ) после заражения и окрашивание PAS и гематоксилином. Показаны репрезентативные разделы. Бар=100 мкм. См. также дополнительный рисунок S1.
Слайд PowerPoint
Изображение полного размера
IL-17A и IL-17F незаменимы для рекрутирования нейтрофилов на слизистой оболочке полости рта фаза инфекции,
19 , мы хотели подтвердить, что повышенная восприимчивость животных с дефицитом IL-17 была результатом нарушенного ответа нейтрофилов. Для этого мы подсчитали количество нейтрофилов в языке с помощью проточной цитометрии на 1-й день после заражения, когда грибковая нагрузка была сопоставима у мышей дикого типа и мышей с дефицитом IL-17. Удивительно, но мы не обнаружили снижения количества нейтрофилов, привлеченных к инфицированному языку, у мышей, у которых были истощены IL-17A и IL-17F, по сравнению с контрольными мышами, которые не получали антитела, разрушающие цитокины IL-17 (рис. 2а). и данные не показаны). Точно так же рекрутирование нейтрофилов было нормальным у инфицированных мышей, лишенных IL-17A и IL-17F, из-за опосредованного антителами истощения ILC или генетического дефицита связанного с ретиноидами орфанного рецептора γt (дополнительные рисунки S2A и B). Более того, мыши с генетическим дефектом в IL-17A- и IL-17F-специфической субъединице рецептора IL-17RC также не имели дефектного переноса нейтрофилов во время OPC (рис. 2b). Кроме того, мы не наблюдали каких-либо изменений в динамике инфильтрации или в распределении нейтрофилов на языке у мышей, у которых отсутствовал функциональный путь IL-17 (рис. 2с, данные не показаны). После этих неожиданных результатов мы задались вопросом, могут ли другие провоспалительные цитокины IL-17 компенсировать отсутствие IL-17A и IL-17F или IL-17RC.
Удивительно, но мы не обнаружили снижения количества нейтрофилов, привлеченных к инфицированному языку, у мышей, у которых были истощены IL-17A и IL-17F, по сравнению с контрольными мышами, которые не получали антитела, разрушающие цитокины IL-17 (рис. 2а). и данные не показаны). Точно так же рекрутирование нейтрофилов было нормальным у инфицированных мышей, лишенных IL-17A и IL-17F, из-за опосредованного антителами истощения ILC или генетического дефицита связанного с ретиноидами орфанного рецептора γt (дополнительные рисунки S2A и B). Более того, мыши с генетическим дефектом в IL-17A- и IL-17F-специфической субъединице рецептора IL-17RC также не имели дефектного переноса нейтрофилов во время OPC (рис. 2b). Кроме того, мы не наблюдали каких-либо изменений в динамике инфильтрации или в распределении нейтрофилов на языке у мышей, у которых отсутствовал функциональный путь IL-17 (рис. 2с, данные не показаны). После этих неожиданных результатов мы задались вопросом, могут ли другие провоспалительные цитокины IL-17 компенсировать отсутствие IL-17A и IL-17F или IL-17RC. Мы обнаружили, что IL-17C сильно индуцируется C. albicans (рис. 2d). В соответствии с опубликованными данными, 38, 39 IL-17C продуцировался CD45-негативными клетками слизистой оболочки полости рта и независимо от транскрипционного фактора, связанного с ретиноидом, орфанного рецептора γt (рис. 2d, данные не показаны). Однако у мышей IL17re -/-, у которых отсутствовала субъединица рецептора, специфичного к IL-17C, наблюдалось нормальное количество нейтрофилов, инфильтрирующих язык на 1-й день после заражения, и они были столь же устойчивы к OPC, как и животные дикого типа. Они избавились от грибка, восстановили свой нормальный вес и не проявляли признаков патологии на 7-й день после заражения (рис. 2e-g). В совокупности эти данные свидетельствуют о том, что (провоспалительные) цитокины IL-17 незаменимы для стимулирования ответа нейтрофилов во время OPC. Избыточность между IL-17A, IL-17F и IL-17C может быть исключена путем истощения IL-17A и IL-17F в мышей Il17re -/- (данные не показаны).
Мы обнаружили, что IL-17C сильно индуцируется C. albicans (рис. 2d). В соответствии с опубликованными данными, 38, 39 IL-17C продуцировался CD45-негативными клетками слизистой оболочки полости рта и независимо от транскрипционного фактора, связанного с ретиноидом, орфанного рецептора γt (рис. 2d, данные не показаны). Однако у мышей IL17re -/-, у которых отсутствовала субъединица рецептора, специфичного к IL-17C, наблюдалось нормальное количество нейтрофилов, инфильтрирующих язык на 1-й день после заражения, и они были столь же устойчивы к OPC, как и животные дикого типа. Они избавились от грибка, восстановили свой нормальный вес и не проявляли признаков патологии на 7-й день после заражения (рис. 2e-g). В совокупности эти данные свидетельствуют о том, что (провоспалительные) цитокины IL-17 незаменимы для стимулирования ответа нейтрофилов во время OPC. Избыточность между IL-17A, IL-17F и IL-17C может быть исключена путем истощения IL-17A и IL-17F в мышей Il17re -/- (данные не показаны). Соответственно, в языке инфицированных мышей IL17ra -/-, лишенных общей субъединицы рецептора IL-17, также было подсчитано неуменьшенное количество нейтрофилов (фиг. 2g). Чтобы дать объяснение этим неожиданным результатам, мы исследовали зависимость IL-17 от G-CSF, общей мишени пути IL-17, регулирующего мобилизацию нейтрофилов из костного мозга. Мы обнаружили, что экспрессия мРНК G-CSF сильно индуцировалась в ответ на OPC (данные не показаны), и в сыворотке инфицированных мышей присутствовали высокие уровни белка G-CSF (рис. 2h). Однако индукция Г-КСФ в ответ на C. albicans не зависел от IL-17 (рис. 2h). Точно так же индукция хемотаксического фактора нейтрофилов CXCL1 не изменилась у мышей с отсутствием функциональной передачи сигналов IL-17 (дополнительная фигура S2C). В заключение, эти данные ясно показывают, что IL-17 не является существенным для мобилизации нейтрофилов из костного мозга и доставки в инфицированную ткань во время OPC. Рисунок 2
Соответственно, в языке инфицированных мышей IL17ra -/-, лишенных общей субъединицы рецептора IL-17, также было подсчитано неуменьшенное количество нейтрофилов (фиг. 2g). Чтобы дать объяснение этим неожиданным результатам, мы исследовали зависимость IL-17 от G-CSF, общей мишени пути IL-17, регулирующего мобилизацию нейтрофилов из костного мозга. Мы обнаружили, что экспрессия мРНК G-CSF сильно индуцировалась в ответ на OPC (данные не показаны), и в сыворотке инфицированных мышей присутствовали высокие уровни белка G-CSF (рис. 2h). Однако индукция Г-КСФ в ответ на C. albicans не зависел от IL-17 (рис. 2h). Точно так же индукция хемотаксического фактора нейтрофилов CXCL1 не изменилась у мышей с отсутствием функциональной передачи сигналов IL-17 (дополнительная фигура S2C). В заключение, эти данные ясно показывают, что IL-17 не является существенным для мобилизации нейтрофилов из костного мозга и доставки в инфицированную ткань во время OPC. Рисунок 2 Путь интерлейкина-17 (IL-17) необязателен для рекрутирования нейтрофилов на слизистой оболочке полости рта. ( a ) CD11b + Ly6G + Ly6C + нейтрофилы в языке наивных и инфицированных мышей дикого типа (WT), которые получали анти-IL-17A и анти-IL-17F или не получали лечения, как указано, подсчитывали с помощью проточной цитометрии на 1-й день после инфицирования. ( b ) CD11b + Ly6G + Ly6C + нейтрофилов в языке наивных и инфицированных мышей дикого типа и IL17rc -/- подсчитывали с помощью проточной цитометрии на 1-й день после заражения. ( c ) Сагиттальные срезы языка мышей WT и Il17rc -/- окрашивали периодической кислотой Шиффа (PAS) и докрашивали гематоксилином на 1-й день после заражения. Показаны репрезентативные разделы. Бар=100 мкм. ( d ) Индукция мРНК Il17c в языке мышей WT и Rorc -/- на 1-й день после заражения. ( e ) Грибковое поражение языка мышей WT и Il17re -/- на 7-й день после заражения. Пунктирная линия представляет собой предел обнаружения.
( a ) CD11b + Ly6G + Ly6C + нейтрофилы в языке наивных и инфицированных мышей дикого типа (WT), которые получали анти-IL-17A и анти-IL-17F или не получали лечения, как указано, подсчитывали с помощью проточной цитометрии на 1-й день после инфицирования. ( b ) CD11b + Ly6G + Ly6C + нейтрофилов в языке наивных и инфицированных мышей дикого типа и IL17rc -/- подсчитывали с помощью проточной цитометрии на 1-й день после заражения. ( c ) Сагиттальные срезы языка мышей WT и Il17rc -/- окрашивали периодической кислотой Шиффа (PAS) и докрашивали гематоксилином на 1-й день после заражения. Показаны репрезентативные разделы. Бар=100 мкм. ( d ) Индукция мРНК Il17c в языке мышей WT и Rorc -/- на 1-й день после заражения. ( e ) Грибковое поражение языка мышей WT и Il17re -/- на 7-й день после заражения. Пунктирная линия представляет собой предел обнаружения. ( f ) Масса тела мышей WT и Il17re -/- в ответ на инфекцию. ( g ) CD11b + Ly6G + Ly6C + нейтрофилов на языке наивных и инфицированных мышей дикого типа, Il17ra -/- и Il17re -/- подсчитывали в день с помощью проточной цитометрии. после заражения. ( h ) Уровни гранулоцитарного колониестимулирующего фактора (G-CSF) количественно определяли на 1-й день после заражения в сыворотке наивных и инфицированных мышей дикого типа, получавших анти-IL-17A и анти-IL-17F или не получавших лечения. (слева), а также у наивных и инфицированных 9Мыши 1739 IL-17ra -/- и IL-17rc -/- (в центре и справа). В a , b , d , e , g и h каждый символ представляет одну мышь; среднее значение + с.д. указывается. В f показанные данные представляют собой среднее значение + стандартное отклонение. из шести мышей. Данные объединены по крайней мере из двух независимых экспериментов в a , b , f , g и h .
( f ) Масса тела мышей WT и Il17re -/- в ответ на инфекцию. ( g ) CD11b + Ly6G + Ly6C + нейтрофилов на языке наивных и инфицированных мышей дикого типа, Il17ra -/- и Il17re -/- подсчитывали в день с помощью проточной цитометрии. после заражения. ( h ) Уровни гранулоцитарного колониестимулирующего фактора (G-CSF) количественно определяли на 1-й день после заражения в сыворотке наивных и инфицированных мышей дикого типа, получавших анти-IL-17A и анти-IL-17F или не получавших лечения. (слева), а также у наивных и инфицированных 9Мыши 1739 IL-17ra -/- и IL-17rc -/- (в центре и справа). В a , b , d , e , g и h каждый символ представляет одну мышь; среднее значение + с.д. указывается. В f показанные данные представляют собой среднее значение + стандартное отклонение. из шести мышей. Данные объединены по крайней мере из двух независимых экспериментов в a , b , f , g и h . * Р <0,05; ** Р <0,01; *** Р <0,001. Различия между зараженными группами не являются статистически значимыми ни в одной из панелей. См. также дополнительный рисунок S2.
* Р <0,05; ** Р <0,01; *** Р <0,001. Различия между зараженными группами не являются статистически значимыми ни в одной из панелей. См. также дополнительный рисунок S2.
Слайд PowerPoint
Изображение с полным размером
Функция нейтрофилов в норме у мышей с дефицитом IL-17 нейтрофилы. Как мы показали ранее, дефицит пути IL-17 не связан с внутренним дефектом кандидацидной активности нейтрофилов.
40 Поэтому мы исследовали роль гранулоцитарно-макрофагального колониестимулирующего фактора, который играет ключевую роль в стимулировании кандидацидной активности нейтрофилов при системном кандидозе и, таким образом, предотвращает быструю гибель мышей от внутривенной инфекции C. albicans . 40 В соответствии с Csf2 , ген, кодирующий гранулоцитарно-макрофагальный колониестимулирующий фактор, являющийся известной мишенью пути IL-17, 21, 25, 26, 41 его экспрессия индуцировалась во время OPC у WT, но не Животные с дефицитом IL-17RC (рис. 3а). Однако дефицит гранулоцитарно-макрофагального колониестимулирующего фактора не вызывал нарушения грибкового контроля во время OPC (рис. 3b, c), что подчеркивает важные различия в механизме противогрибкового контроля при разных формах кандидоза. При непосредственной оценке статуса активации нейтрофилов в Il17ra -/- мышей и контрольной группы мы не наблюдали различий в экспрессии маркеров активации CD11b и CD18 (фиг. 3d). Кроме того, на высвобождение активных форм кислорода нейтрофилами, выделенными из инфицированных языков, не влияло отсутствие функционального пути IL-17 (рис. 3e,f), несмотря на то, что у мышей с дефицитом gp91phox (кодируется Cybb ), важная субъединица НАДФН-оксидазы, необходимая для образования активных форм кислорода, не смогла очистить грибок (рис. 3g). Наконец, мы наблюдали диспергированное окрашивание дигидрохлорида 4′,6-диамидино-2-фенилиндола и внеядерного гистона h2 в богатых нейтрофилами областях инфицированного языка, что свидетельствует о наличии нейтрофильных внеклеточных ловушек, но мы не смогли обнаружить различий между IL-17A- и IL-17F-истощенные и неистощенные мыши (данные не показаны).
3а). Однако дефицит гранулоцитарно-макрофагального колониестимулирующего фактора не вызывал нарушения грибкового контроля во время OPC (рис. 3b, c), что подчеркивает важные различия в механизме противогрибкового контроля при разных формах кандидоза. При непосредственной оценке статуса активации нейтрофилов в Il17ra -/- мышей и контрольной группы мы не наблюдали различий в экспрессии маркеров активации CD11b и CD18 (фиг. 3d). Кроме того, на высвобождение активных форм кислорода нейтрофилами, выделенными из инфицированных языков, не влияло отсутствие функционального пути IL-17 (рис. 3e,f), несмотря на то, что у мышей с дефицитом gp91phox (кодируется Cybb ), важная субъединица НАДФН-оксидазы, необходимая для образования активных форм кислорода, не смогла очистить грибок (рис. 3g). Наконец, мы наблюдали диспергированное окрашивание дигидрохлорида 4′,6-диамидино-2-фенилиндола и внеядерного гистона h2 в богатых нейтрофилами областях инфицированного языка, что свидетельствует о наличии нейтрофильных внеклеточных ловушек, но мы не смогли обнаружить различий между IL-17A- и IL-17F-истощенные и неистощенные мыши (данные не показаны). На основании этих данных мы пришли к выводу, что, хотя нейтрофилы, по-видимому, сильно активируются во время острого OPC, их вклад в защиту, по-видимому, полностью не зависит от пути IL-17. Рисунок 3
На основании этих данных мы пришли к выводу, что, хотя нейтрофилы, по-видимому, сильно активируются во время острого OPC, их вклад в защиту, по-видимому, полностью не зависит от пути IL-17. Рисунок 3 Активность нейтрофилов нормальная при отсутствии функционального пути интерлейкина-17 (IL-17). ( a ) Индукция мРНК Csf2 на языке мышей дикого типа (WT) и Il17rc -/- на 1-й день после заражения. Каждый символ представляет одну мышь, среднее значение + s.d. указывается. Данные объединены из двух независимых экспериментов. * Р <0,05. ( b ) Грибковое поражение языка мышей WT и Csf2 -/- на 7-й день после заражения. Каждый символ представляет одну мышь; пунктирная линия представляет собой предел обнаружения. ( c ) Масса тела мышей WT и Csf2 -/- в ответ на инфекцию. Данные представляют собой среднее значение + s.d. из шести животных и объединены из двух независимых экспериментов. ( d ) Экспрессия CD11b и CD18 на поверхности CD11b + Ly6G + Ly6C + нейтрофилов на языке и в периферической крови IL17ra -/- и гетерозиготных контрольных мышей на 1-й день после заражения. Такие же результаты наблюдались и у контролей дикого типа (не показано). Каждый символ представляет одну мышь, среднее значение + s.d. указывается. ( e , f ) Нейтрофилы крови и языка инфицированных Il17ra -/- и гетерозиготных контрольных мышей инкубировали с диацетатом дихлорфлуоресцеина (DCF-DA), и уровни дихлорфлуоресцеина (DCF) анализировали с помощью проточной цитометрии. Репрезентативное окрашивание нейтрофилов CD11b + Ly6G + Ly6C + инфицированных мышей показано на и . Данные по инфицированным Cybb -/- нейтрофилам включены в качестве отрицательного контроля. Количественная оценка DCF hi нейтрофилов показано в f . Каждый символ представляет одну мышь, среднее значение + s.
( d ) Экспрессия CD11b и CD18 на поверхности CD11b + Ly6G + Ly6C + нейтрофилов на языке и в периферической крови IL17ra -/- и гетерозиготных контрольных мышей на 1-й день после заражения. Такие же результаты наблюдались и у контролей дикого типа (не показано). Каждый символ представляет одну мышь, среднее значение + s.d. указывается. ( e , f ) Нейтрофилы крови и языка инфицированных Il17ra -/- и гетерозиготных контрольных мышей инкубировали с диацетатом дихлорфлуоресцеина (DCF-DA), и уровни дихлорфлуоресцеина (DCF) анализировали с помощью проточной цитометрии. Репрезентативное окрашивание нейтрофилов CD11b + Ly6G + Ly6C + инфицированных мышей показано на и . Данные по инфицированным Cybb -/- нейтрофилам включены в качестве отрицательного контроля. Количественная оценка DCF hi нейтрофилов показано в f . Каждый символ представляет одну мышь, среднее значение + s. d. указывается. Данные являются репрезентативными для двух независимых экспериментов. ( г ) Грибковую нагрузку на языке Cybb -/- и контрольных мышей дикого типа анализировали на 2-й и 3-й день после инфицирования, как указано. Каждый символ представляет одну мышь; среднее значение + с.д. указывается. Данные объединены из двух независимых экспериментов.
d. указывается. Данные являются репрезентативными для двух независимых экспериментов. ( г ) Грибковую нагрузку на языке Cybb -/- и контрольных мышей дикого типа анализировали на 2-й и 3-й день после инфицирования, как указано. Каждый символ представляет одну мышь; среднее значение + с.д. указывается. Данные объединены из двух независимых экспериментов.
Слайд PowerPoint
Изображение в натуральную величину
IL-17A и IL-17F необходимы для уничтожения грибков независимым от нейтрофилов образом
Хотя дефекты передачи сигнала IL-17 не влияют на ответ нейтрофилов на OPC, как показывают наши результаты, IL-17F Путь -17 строго необходим для защиты хозяина и уничтожения грибков на слизистой оболочке полости рта. В соответствии с опубликованными отчетами, мыши 9, 19, 42 IL17ra -/- и IL17rc -/- не смогли избавиться от грибка (рис. 4а). Вместо этого они стабилизировали массу тела на сниженном уровне и приспособились к постоянной колонизации C. albicans (рис. 4b,c и данные не показаны). гиф C. albicans сохранялись в локализованных очагах в роговом слое (рис. 4d). В ответ на длительное присутствие грибка эпителиальная архитектура оказалась сильно нарушенной вблизи грибковых очагов, но местная реакция больше не характеризовалась большими воспалительными инфильтратами через 1 неделю после заражения. Количество нейтрофилов было максимальным на 1-й день после инфицирования и впоследствии постоянно снижалось как у Il17rc -/- и мыши дикого типа (фиг. 4e). Немного более высокое количество нейтрофилов у мышей Il17rc -/-, наблюдавшееся на 3-й день после заражения и далее, скорее всего, было следствием повышенной грибковой нагрузки у этих мышей в эти более поздние моменты времени (см. рис. 4a, c, данные не показаны). . Затем мы исследовали временное окно, в котором для борьбы с грибком требовались IL-17A и IL-17F. Для этого мы вводили нейтрализующие антитела мышам дикого типа, чтобы истощить IL-17A и IL-17F, начиная со 2-го дня после заражения, когда массовый ответ нейтрофилов уже снижался (см.
albicans (рис. 4b,c и данные не показаны). гиф C. albicans сохранялись в локализованных очагах в роговом слое (рис. 4d). В ответ на длительное присутствие грибка эпителиальная архитектура оказалась сильно нарушенной вблизи грибковых очагов, но местная реакция больше не характеризовалась большими воспалительными инфильтратами через 1 неделю после заражения. Количество нейтрофилов было максимальным на 1-й день после инфицирования и впоследствии постоянно снижалось как у Il17rc -/- и мыши дикого типа (фиг. 4e). Немного более высокое количество нейтрофилов у мышей Il17rc -/-, наблюдавшееся на 3-й день после заражения и далее, скорее всего, было следствием повышенной грибковой нагрузки у этих мышей в эти более поздние моменты времени (см. рис. 4a, c, данные не показаны). . Затем мы исследовали временное окно, в котором для борьбы с грибком требовались IL-17A и IL-17F. Для этого мы вводили нейтрализующие антитела мышам дикого типа, чтобы истощить IL-17A и IL-17F, начиная со 2-го дня после заражения, когда массовый ответ нейтрофилов уже снижался (см. рис. 1а и 4е), тогда как 17 производство все еще зависело от врожденных клеточных источников. 19 Это предотвратило уничтожение грибка и не позволило мышам восстановить свой первоначальный вес (рис. 4f,g). Фактически, грибковая нагрузка у этих мышей была лишь незначительно снижена на 7-й день после заражения по сравнению с мышами, лишенными IL-17A и IL-17F, в течение всего курса инфекции, начиная с дня -1 (рис. 4g), что позволяет предположить, что IL- 17 остается критически важным для защиты хозяина за пределами немедленного ответа, опосредованного нейтрофилами, в 1-й день после заражения. Вместе эти данные подтвердили и расширили наши предыдущие выводы и показали, что нейтрофилов недостаточно для разрешения инфекции и что клиренс C. albicans из ткани зависели от IL-17 и опосредовались клетками, отличными от нейтрофилов. Эксперименты с мышами-химерами костного мозга подтвердили роль радиорезистентных клеток, скорее всего эпителиальных клеток (данные не представлены).
рис. 1а и 4е), тогда как 17 производство все еще зависело от врожденных клеточных источников. 19 Это предотвратило уничтожение грибка и не позволило мышам восстановить свой первоначальный вес (рис. 4f,g). Фактически, грибковая нагрузка у этих мышей была лишь незначительно снижена на 7-й день после заражения по сравнению с мышами, лишенными IL-17A и IL-17F, в течение всего курса инфекции, начиная с дня -1 (рис. 4g), что позволяет предположить, что IL- 17 остается критически важным для защиты хозяина за пределами немедленного ответа, опосредованного нейтрофилами, в 1-й день после заражения. Вместе эти данные подтвердили и расширили наши предыдущие выводы и показали, что нейтрофилов недостаточно для разрешения инфекции и что клиренс C. albicans из ткани зависели от IL-17 и опосредовались клетками, отличными от нейтрофилов. Эксперименты с мышами-химерами костного мозга подтвердили роль радиорезистентных клеток, скорее всего эпителиальных клеток (данные не представлены).
Дефицит интерлейкина-17 (IL-17) способствует стойкой грибковой колонизации без явного воспаления. ( a ) Грибковое поражение языка мышей дикого типа (WT), Il-17ra -/- и Il-17rc -/- на 7-й день после заражения. ( b ) Масса тела мышей WT, Il17ra -/- и Il-17rc -/- в ответ на инфекцию. ( c ) Грибковое поражение языка мышей WT и Il17rc -/- на 14-й день после заражения. ( d ) Окрашивание периодической кислотой Шиффа (PAS)/гематоксилином сагиттальных срезов языка мышей WT и Il17rc -/- на 7-й день после заражения. Показаны репрезентативные разделы. Бар=100 мкм. ( и ) CD11b + Ly6G + Ly6C + нейтрофилов подсчитывали в интактных и инфицированных языках мышей WT и Il17rc -/- в указанные моменты времени. ( f , г ) Масса тела ( f ) и грибковая нагрузка на языке ( г ) инфицированных мышей WT на 7-й день после заражения, которым вводили анти-IL-17A и анти-IL-17A. 17F, начиная с дня-1 или со дня +2 после заражения и далее. Пунктирная линия в a , c и g представляет собой предел обнаружения. В a , c , e и g , каждый символ представляет одну мышь, а среднее значение + s.d. указывается. В f данные представляют собой среднее значение + стандартное отклонение. из 9–10 животных. Различия между группами, получавшими лечение, и группой, не получавшей лечения, являются статистически значимыми, начиная с 4-го дня после инфицирования, с * P <0,05. Различия между двумя обработанными группами не являются статистически значимыми. Данные показаны в a , b , c , e , f и g объединены по крайней мере из двух независимых экспериментов.
17F, начиная с дня-1 или со дня +2 после заражения и далее. Пунктирная линия в a , c и g представляет собой предел обнаружения. В a , c , e и g , каждый символ представляет одну мышь, а среднее значение + s.d. указывается. В f данные представляют собой среднее значение + стандартное отклонение. из 9–10 животных. Различия между группами, получавшими лечение, и группой, не получавшей лечения, являются статистически значимыми, начиная с 4-го дня после инфицирования, с * P <0,05. Различия между двумя обработанными группами не являются статистически значимыми. Данные показаны в a , b , c , e , f и g объединены по крайней мере из двух независимых экспериментов.
Слайд PowerPoint
Изображение полного размера
Для дальнейшего изучения роли IL-17A и IL-17F в защите хозяина от OPC мы обратились к генам-мишеням IL-17, которые мы до сих пор не рассматривали, а именно к AMP. AMP, включая S100A8, S100A9 и дефенсин бета 3, сильно индуцируются во время OPC. 9 Однако молекулярная и клеточная регуляция АМП изучена недостаточно. Здесь мы сосредоточились на S100A9, субъединица белкового комплекса кальпротектин, который хелатирует ионы двухвалентных металлов, необходимых для микробного роста 43 , и который вносит решающий вклад в защиту от C. albicans в нескольких моделях инфекций. 44 Мы обнаружили, что белок S100A9 накапливается в слизистой оболочке полости рта в непосредственной близости от инвазии C. albicans (рис. 5а). В то время как индукция мРНК S100A9 в препаратах тотального языка была сильно снижена в отсутствие функционального пути IL-17, 9, мы обнаружили, что уровни белка S100A9 были лишь частично снижены в общих гомогенатах языка у животных с дефицитом IL-17A и IL-17F, а также у животных с дефицитом IL-17RA и IL-17RC по сравнению с соответствующими контролями (рис. 5b и данные не показаны).
AMP, включая S100A8, S100A9 и дефенсин бета 3, сильно индуцируются во время OPC. 9 Однако молекулярная и клеточная регуляция АМП изучена недостаточно. Здесь мы сосредоточились на S100A9, субъединица белкового комплекса кальпротектин, который хелатирует ионы двухвалентных металлов, необходимых для микробного роста 43 , и который вносит решающий вклад в защиту от C. albicans в нескольких моделях инфекций. 44 Мы обнаружили, что белок S100A9 накапливается в слизистой оболочке полости рта в непосредственной близости от инвазии C. albicans (рис. 5а). В то время как индукция мРНК S100A9 в препаратах тотального языка была сильно снижена в отсутствие функционального пути IL-17, 9, мы обнаружили, что уровни белка S100A9 были лишь частично снижены в общих гомогенатах языка у животных с дефицитом IL-17A и IL-17F, а также у животных с дефицитом IL-17RA и IL-17RC по сравнению с соответствующими контролями (рис. 5b и данные не показаны). Мы предположили, что это несоответствие между измерениями мРНК и белков может быть объяснено различными способами регуляции в разных клеточных компартментах. S100A9 в изобилии продуцируется нейтрофилами, которые хранят предварительно сформированный белок S100A9 в своей цитоплазме и высвобождают его во время образования нейтрофильной внеклеточной ловушки для декорирования выброшенных хроматиновых волокон. 44 Кроме того, S100A9 также может экспрессироваться в некроветворных клетках, таких как эпителиальные клетки, при воспалительных состояниях. 45 Мы предположили, что S100A9 в языке мышей, инфицированных OPC, может происходить как минимум из двух разных клеточных источников и что экспрессия S100A9, происходящая из эпителиальных клеток, но не из нейтрофилов, может находиться под контролем пути IL-17. Такой сценарий согласовывался бы с нашим наблюдением, что общая экспрессия белка S100A9 языка лишь частично зависела от IL-17, тогда как 9Индукция мРНК 1739 de novo S100A9 в ответ на C.
Мы предположили, что это несоответствие между измерениями мРНК и белков может быть объяснено различными способами регуляции в разных клеточных компартментах. S100A9 в изобилии продуцируется нейтрофилами, которые хранят предварительно сформированный белок S100A9 в своей цитоплазме и высвобождают его во время образования нейтрофильной внеклеточной ловушки для декорирования выброшенных хроматиновых волокон. 44 Кроме того, S100A9 также может экспрессироваться в некроветворных клетках, таких как эпителиальные клетки, при воспалительных состояниях. 45 Мы предположили, что S100A9 в языке мышей, инфицированных OPC, может происходить как минимум из двух разных клеточных источников и что экспрессия S100A9, происходящая из эпителиальных клеток, но не из нейтрофилов, может находиться под контролем пути IL-17. Такой сценарий согласовывался бы с нашим наблюдением, что общая экспрессия белка S100A9 языка лишь частично зависела от IL-17, тогда как 9Индукция мРНК 1739 de novo S100A9 в ответ на C. albicans зависела от функционального пути IL-17. Чтобы проверить эту гипотезу, мы лишили мышей Il17ra -/- нейтрофилов до инфицирования. Это привело к полной потере белка S100A9 по сравнению с частичным снижением количества нейтрофилов у мышей IL17ra -/- на 1-й день после заражения. Напротив, синтез мРНК S100A9 de novo был нарушен в отсутствие передачи сигналов IL-17 независимо от присутствия или отсутствия нейтрофилов (рис. 5c, d). То же самое наблюдалось и для других AMP, таких как дефензин бета 3 (дополнительная фигура S3). Селективная зависимость индукции АМФ от IL-17 в эпителиальных клетках, но не в нейтрофилах, была дополнительно подтверждена экспериментами по сортировке клеток. Пока S100A9мРНК не была обнаружена в эпителиальных клетках мышей Il17ra -/- на 1-й день после заражения (рис. 5e), транскрипты S100A9 присутствовали в нейтрофилах как дикого типа, так и мышей Il17ra-/- на сопоставимых уровнях (рис. 5f). В совокупности эти данные выявили специфичную для типа клеток регуляцию AMP, включая S100A9 и дефенсин бета 3, в нейтрофилах и некроветворных клетках.
albicans зависела от функционального пути IL-17. Чтобы проверить эту гипотезу, мы лишили мышей Il17ra -/- нейтрофилов до инфицирования. Это привело к полной потере белка S100A9 по сравнению с частичным снижением количества нейтрофилов у мышей IL17ra -/- на 1-й день после заражения. Напротив, синтез мРНК S100A9 de novo был нарушен в отсутствие передачи сигналов IL-17 независимо от присутствия или отсутствия нейтрофилов (рис. 5c, d). То же самое наблюдалось и для других AMP, таких как дефензин бета 3 (дополнительная фигура S3). Селективная зависимость индукции АМФ от IL-17 в эпителиальных клетках, но не в нейтрофилах, была дополнительно подтверждена экспериментами по сортировке клеток. Пока S100A9мРНК не была обнаружена в эпителиальных клетках мышей Il17ra -/- на 1-й день после заражения (рис. 5e), транскрипты S100A9 присутствовали в нейтрофилах как дикого типа, так и мышей Il17ra-/- на сопоставимых уровнях (рис. 5f). В совокупности эти данные выявили специфичную для типа клеток регуляцию AMP, включая S100A9 и дефенсин бета 3, в нейтрофилах и некроветворных клетках. Эпителиальные клетки, но не нейтрофилы, действуют как эффекторные клетки IL-17-опосредованной защиты от OPC. Это согласуется и убедительно подтверждает наши выводы о том, что IL-17 действует независимым от нейтрофилов образом, опосредуя противогрибковый иммунитет в слизистой оболочке полости рта.
Эпителиальные клетки, но не нейтрофилы, действуют как эффекторные клетки IL-17-опосредованной защиты от OPC. Это согласуется и убедительно подтверждает наши выводы о том, что IL-17 действует независимым от нейтрофилов образом, опосредуя противогрибковый иммунитет в слизистой оболочке полости рта.
Экспрессия S100A9 в эпителии, но не в нейтрофилах, избирательно регулируется путем интерлейкина-17 (IL-17). ( a ) Сагиттальные срезы языка инфицированных мышей дикого типа (WT) окрашивали через 1 день после заражения анти-S100A9 (зеленый) и дигидрохлоридом 4′,6-диамидино-2-фенилиндола (DAPI) (синий). Показаны репрезентативные изображения. Бар = 53 мкм. ( b ) Уровни белка S100A9 на 1-й день после заражения в гомогенатах языка WT (белые столбцы) и Il17rc -/- мыши (серые столбцы). ( c ) Уровни белка S100A9 на 1-й день после инфицирования в гомогенатах языка мышей дикого типа (белые столбцы) и мышей Il17ra -/- (серые столбцы), которые получали анти-Ly6G и анти-G-CSF или не получали лечения как указано. ( d ) S100A9 мРНК на 1-й день после инфицирования языка мышей WT и Il17ra -/- , которых лечили так же, как в c . Каждый символ представляет одну мышь; среднее значение + с.д. указывается. Данные показаны в b и c представляют два независимых эксперимента, а данные, показанные в d , объединены из двух независимых экспериментов. ( E , F ) Live CD45 — EPCAM + CD31 — Эпителиальные клетки языка ( E ) и CD45 + LY6G + NeureRophils (6 + LY6G + (6 + LY6G + (). У мышей Il17ra -/- на 1-й день после заражения и определяли уровни мРНК S100A9. Данные представляют собой среднее значение + s.d. повторных измерений из пула из пяти животных на группу. н.д., не обнаружено. См. также дополнительный рисунок S3.
( d ) S100A9 мРНК на 1-й день после инфицирования языка мышей WT и Il17ra -/- , которых лечили так же, как в c . Каждый символ представляет одну мышь; среднее значение + с.д. указывается. Данные показаны в b и c представляют два независимых эксперимента, а данные, показанные в d , объединены из двух независимых экспериментов. ( E , F ) Live CD45 — EPCAM + CD31 — Эпителиальные клетки языка ( E ) и CD45 + LY6G + NeureRophils (6 + LY6G + (6 + LY6G + (). У мышей Il17ra -/- на 1-й день после заражения и определяли уровни мРНК S100A9. Данные представляют собой среднее значение + s.d. повторных измерений из пула из пяти животных на группу. н.д., не обнаружено. См. также дополнительный рисунок S3.
Слайд PowerPoint
Изображение полного размера
Обсуждение
Биология IL-17 привлекла большое внимание с момента первого сообщения о клетках Т-хелперов-17 почти десять лет назад, 41, 46 и даже больше с момента открытия IL-17- секретирующие ILC. 47, 48 Учитывая его способность вызывать патологические состояния, IL-17 наиболее широко изучался в контексте аутоиммунных и аутовоспалительных заболеваний. 12 Однако IL-17 играет решающую роль в защите хозяина от определенных типов инфекций, в первую очередь от тех, которые вызываются C. albicans , что было выявлено в результате идентификации генетических дефектов в IL-17-родственных генах в CMC пациенты. 1 В то время как основное внимание в исследованиях было сосредоточено на выявлении клеточных источников IL-17 в различных условиях, меньше усилий было направлено на определение механизма, с помощью которого IL-17 оказывает свое биологическое действие. Поскольку общие гены-мишени IL-17 регулируют мобилизацию нейтрофилов из костного мозга и рекрутирование в очаг инфекции, обычно считается, что активность IL-17 связана с нейтрофилами. Однако в контексте OPC, как мы показываем здесь, функции IL-17 и нейтрофилов различны, и они не связаны друг с другом.
47, 48 Учитывая его способность вызывать патологические состояния, IL-17 наиболее широко изучался в контексте аутоиммунных и аутовоспалительных заболеваний. 12 Однако IL-17 играет решающую роль в защите хозяина от определенных типов инфекций, в первую очередь от тех, которые вызываются C. albicans , что было выявлено в результате идентификации генетических дефектов в IL-17-родственных генах в CMC пациенты. 1 В то время как основное внимание в исследованиях было сосредоточено на выявлении клеточных источников IL-17 в различных условиях, меньше усилий было направлено на определение механизма, с помощью которого IL-17 оказывает свое биологическое действие. Поскольку общие гены-мишени IL-17 регулируют мобилизацию нейтрофилов из костного мозга и рекрутирование в очаг инфекции, обычно считается, что активность IL-17 связана с нейтрофилами. Однако в контексте OPC, как мы показываем здесь, функции IL-17 и нейтрофилов различны, и они не связаны друг с другом. В то время как нейтрофилы удерживают грибок в эпителии ротовой полости и, подобно валу, предотвращают распространение грибка в подлежащие ткани, IL-17 необходим для элиминации C. albicans от хозяина и для предотвращения персистенции грибков в эпителии независимым от нейтрофилов образом. Это исследование дает важные новые сведения об опосредованном IL-17 противогрибковом защитном механизме, действующем в тканях слизистого барьера.
В то время как нейтрофилы удерживают грибок в эпителии ротовой полости и, подобно валу, предотвращают распространение грибка в подлежащие ткани, IL-17 необходим для элиминации C. albicans от хозяина и для предотвращения персистенции грибков в эпителии независимым от нейтрофилов образом. Это исследование дает важные новые сведения об опосредованном IL-17 противогрибковом защитном механизме, действующем в тканях слизистого барьера.
Большинство доказательств зависимости рекрутирования нейтрофилов от IL-17 было получено на моделях легочной инфекции. 49 Однако в коже и в соответствии с тем, что мы наблюдали во время OPC, эффекты, опосредованные IL-17, оказались независимыми от нейтрофилов. 50 Потребуются дальнейшие исследования, чтобы прояснить тканеспецифическую регуляцию различной активности, опосредованной IL-17. Наши данные основаны на анализе пяти различных условий с дефектным путем IL-17, включая Il17ra -/-, Il17rc -/-, IL-17A- и IL-17F-истощенных мышей WT, RORc. -/- и ILC-истощенные мыши Rag1 -/-, все из которых дали сопоставимые результаты. В отличие от опубликованных отчетов, в которых описывалось снижение количества нейтрофилов у мышей с дефицитом рецептора IL-17 на 5-й день после инфицирования OPC, 9, 37, 42 мы не обнаружили каких-либо изменений в количестве или распределении нейтрофилов при подсчете клеток всего языка методом проточной цитометрии и оценке распределения нейтрофилов на гистологических срезах. Мы сосредоточили наш анализ на ранней временной точке, когда влияние нейтрофилов на контроль инфекции было наиболее значимым и когда грибковая нагрузка была сопоставима между животными с дефицитом пути IL-17 и контрольными животными. Начиная с 3-го дня после заражения, мы наблюдали даже более высокие числа нейтрофилов у мышей с дефицитом рецептора IL-17 по сравнению с контрольной группой, что, скорее всего, было результатом персистирующей инфекции при отсутствии функционального пути IL-17. Подробный механизм, который инструктирует G-CSF-зависимую мобилизацию и рекрутирование нейтрофилов во время OPC, ожидает дальнейших исследований.
-/- и ILC-истощенные мыши Rag1 -/-, все из которых дали сопоставимые результаты. В отличие от опубликованных отчетов, в которых описывалось снижение количества нейтрофилов у мышей с дефицитом рецептора IL-17 на 5-й день после инфицирования OPC, 9, 37, 42 мы не обнаружили каких-либо изменений в количестве или распределении нейтрофилов при подсчете клеток всего языка методом проточной цитометрии и оценке распределения нейтрофилов на гистологических срезах. Мы сосредоточили наш анализ на ранней временной точке, когда влияние нейтрофилов на контроль инфекции было наиболее значимым и когда грибковая нагрузка была сопоставима между животными с дефицитом пути IL-17 и контрольными животными. Начиная с 3-го дня после заражения, мы наблюдали даже более высокие числа нейтрофилов у мышей с дефицитом рецептора IL-17 по сравнению с контрольной группой, что, скорее всего, было результатом персистирующей инфекции при отсутствии функционального пути IL-17. Подробный механизм, который инструктирует G-CSF-зависимую мобилизацию и рекрутирование нейтрофилов во время OPC, ожидает дальнейших исследований. Прямое распознавание грибов эпителием индуцирует продукцию G-CSF 51 и, таким образом, может быть достаточным для управления ответом нейтрофилов во время OPC.
Прямое распознавание грибов эпителием индуцирует продукцию G-CSF 51 и, таким образом, может быть достаточным для управления ответом нейтрофилов во время OPC.
Член семейства IL-17 IL-17C активирует гены-мишени, сходные с IL-17A и IL-17F, 38, 39 , и, способствуя псориаформному воспалению кожи у мышей и людей, проявляет перекрывающиеся эффекты с IL-17A и IL -17F. 52 Сильная индукция IL-17C во время OPC предполагает, что этот новый член семейства IL-17 может также участвовать в противогрибковой защите. Однако наши данные показывают, что это не так и что IL-17RE-зависимая передача сигналов не способствует защите от OPC. IL-17E, который мы также исследовали, не индуцировался во время OPC, что подчеркивает важность IL-17A и IL-17F как основных членов семейства IL-17 в противогрибковой защите.
Нейтропения — в отличие от дефицита IL-17 — обычно не является специфическим фактором риска кожно-слизистого кандидоза у людей. Ситуация у мышей, где C. albicans не является частью нормальной микрофлоры, иная, и нейтрофилы строго необходимы для сдерживания большой грибковой нагрузки, которой хозяин подвергается в экспериментальных условиях. Соответственно, тяжесть заболевания несопоставима между мышами с истощением нейтрофилов и мышами с дефицитом IL-17. В то время как C. albicans гиф проникали глубоко в ткани в условиях истощения нейтрофилов, гриб был ограничен роговым слоем и образовывал изолированные очаги во время персистирующей колонизации у животных с дефицитом передачи сигналов IL-17. Аналогичное распределение наблюдалось при псевдомембранозном кандидозе у лиц, инфицированных вирусом иммунодефицита человека, 53 , у которых наблюдалось низкое количество Т-клеток и, в частности, количество Th27. 40 Несмотря на поверхностное расположение C. albicans в эпителии, хозяину не удается избавиться от грибка при отсутствии функционального пути IL-17. Потребность в IL-17 постоянна и критична с самого начала, о чем свидетельствует зависимость от продукции IL-17 из врожденных клеточных источников.
albicans не является частью нормальной микрофлоры, иная, и нейтрофилы строго необходимы для сдерживания большой грибковой нагрузки, которой хозяин подвергается в экспериментальных условиях. Соответственно, тяжесть заболевания несопоставима между мышами с истощением нейтрофилов и мышами с дефицитом IL-17. В то время как C. albicans гиф проникали глубоко в ткани в условиях истощения нейтрофилов, гриб был ограничен роговым слоем и образовывал изолированные очаги во время персистирующей колонизации у животных с дефицитом передачи сигналов IL-17. Аналогичное распределение наблюдалось при псевдомембранозном кандидозе у лиц, инфицированных вирусом иммунодефицита человека, 53 , у которых наблюдалось низкое количество Т-клеток и, в частности, количество Th27. 40 Несмотря на поверхностное расположение C. albicans в эпителии, хозяину не удается избавиться от грибка при отсутствии функционального пути IL-17. Потребность в IL-17 постоянна и критична с самого начала, о чем свидетельствует зависимость от продукции IL-17 из врожденных клеточных источников. 19 Отсроченное истощение IL-17A и IL-17F, начиная со 2-го дня после заражения, приводило лишь к ограниченному снижению грибковой нагрузки по сравнению с мышами, истощенными в течение всего периода заражения, и предотвращало полное выздоровление. Стойкая колонизация эпителия полости рта C. albicans не связана с усиленным воспалением или нейтрофилией. Это резко контрастирует с ситуацией, наблюдаемой при системном кандидозе, когда неконтролируемый грибок в инфицированных почках вызывает повышенное рекрутирование нейтрофилов, 54, 55 и накопление нейтрофилов (позднее после заражения) связано с иммунопатологией и смертностью. 56, 57
19 Отсроченное истощение IL-17A и IL-17F, начиная со 2-го дня после заражения, приводило лишь к ограниченному снижению грибковой нагрузки по сравнению с мышами, истощенными в течение всего периода заражения, и предотвращало полное выздоровление. Стойкая колонизация эпителия полости рта C. albicans не связана с усиленным воспалением или нейтрофилией. Это резко контрастирует с ситуацией, наблюдаемой при системном кандидозе, когда неконтролируемый грибок в инфицированных почках вызывает повышенное рекрутирование нейтрофилов, 54, 55 и накопление нейтрофилов (позднее после заражения) связано с иммунопатологией и смертностью. 56, 57
Предполагается, что IL-17A напрямую связывается с C. albicans . 58 Однако такое взаимодействие, которое потенциально может иметь негативные последствия для грибка, вряд ли будет связано с противогрибковым иммунитетом на слизистой оболочке полости рта, поскольку дефект контроля грибка, наблюдаемый у мышей, лишенных IL-17A (и IL- 17F) цитокинов сравнима с таковой в Il17ra -/- и Il17rc -/- мышей, экспрессирующих нормальный или даже более высокий уровень IL-17. Ранее сообщалось об IL-17-зависимой индукции AMP во время OPC, 9 , но их клеточный источник оставался неясным, поскольку анализировалась только объемная ткань языка. АМП, такие как кальпротектин и дефенсины, продуцируются различными типами клеток, включая нейтрофилы и эпителиальные клетки. Здесь мы проанализировали ответ AMP и продемонстрировали, что управляемая IL-17 экспрессия AMP не связана с ответом нейтрофилов. S100A9продукция эпителиальными клетками, которая регулируется на уровне транскрипции, избирательно зависит от передачи сигналов IL-17 в слизистой оболочке полости рта. Напротив, секреция S100A9 нейтрофилами, которая регулируется посттрансляционно, не зависит от IL-17. Этот результат подчеркивает критическую роль эпителия полости рта в защитном иммунитете против OPC. Вклад отдельных АМП в уничтожение грибков по-прежнему трудно окончательно проанализировать из-за отсутствия подходящих инструментов. Кроме того, AMP демонстрируют высокую степень избыточности, что делает врожденную иммунную систему очень надежной.
Ранее сообщалось об IL-17-зависимой индукции AMP во время OPC, 9 , но их клеточный источник оставался неясным, поскольку анализировалась только объемная ткань языка. АМП, такие как кальпротектин и дефенсины, продуцируются различными типами клеток, включая нейтрофилы и эпителиальные клетки. Здесь мы проанализировали ответ AMP и продемонстрировали, что управляемая IL-17 экспрессия AMP не связана с ответом нейтрофилов. S100A9продукция эпителиальными клетками, которая регулируется на уровне транскрипции, избирательно зависит от передачи сигналов IL-17 в слизистой оболочке полости рта. Напротив, секреция S100A9 нейтрофилами, которая регулируется посттрансляционно, не зависит от IL-17. Этот результат подчеркивает критическую роль эпителия полости рта в защитном иммунитете против OPC. Вклад отдельных АМП в уничтожение грибков по-прежнему трудно окончательно проанализировать из-за отсутствия подходящих инструментов. Кроме того, AMP демонстрируют высокую степень избыточности, что делает врожденную иммунную систему очень надежной. Соответственно, селективный дефицит липокалина 2 не устраняет резистентность мышей к OPC. 59 Критическая роль кальпротектина в противогрибковой защите, с другой стороны, была продемонстрирована снижением клиренса грибков и повышенной смертностью S100A9-дефицитных мышей в ответ на инфекции C. albicans , включая кожные. 44 В соответствии с исследованиями на мышах, у лиц с положительной реакцией на вирус иммунодефицита человека, которые склонны к развитию CMC и, в частности, OPC, наблюдается снижение уровня кальпротектина в слюне. 60 В совокупности это убедительно свидетельствует о том, что решающая роль метаболического пути IL-17 в защитном иммунитете против C. albicans предназначен для инструктирования противогрибкового ответа эпителия и того, что IL-17-управляемая активность полностью не связана с ответом нейтрофилов в слизистой оболочке полости рта.
Соответственно, селективный дефицит липокалина 2 не устраняет резистентность мышей к OPC. 59 Критическая роль кальпротектина в противогрибковой защите, с другой стороны, была продемонстрирована снижением клиренса грибков и повышенной смертностью S100A9-дефицитных мышей в ответ на инфекции C. albicans , включая кожные. 44 В соответствии с исследованиями на мышах, у лиц с положительной реакцией на вирус иммунодефицита человека, которые склонны к развитию CMC и, в частности, OPC, наблюдается снижение уровня кальпротектина в слюне. 60 В совокупности это убедительно свидетельствует о том, что решающая роль метаболического пути IL-17 в защитном иммунитете против C. albicans предназначен для инструктирования противогрибкового ответа эпителия и того, что IL-17-управляемая активность полностью не связана с ответом нейтрофилов в слизистой оболочке полости рта.
Методы
Мыши и стратегии истощения. мышей C57Bl/6 были приобретены у Janvier Elevage (Saint Berthevin, Франция). Мыши Il17ra-/- , il17rc-/- и il17re -/- были получены от Amgen (Таузенд-Оукс, Калифорния) и выведены в нашем животноводческом центре Rodent Center HCI. 9Мыши 1739 Rorc -/-, Csf2 -/- и Cybb -/- были подарком от Буркхарда Бехера (Цюрихский университет, Швейцария), Манфреда Копфа и Вольфа-Дитриха Хардта (оба ETH Zürich, Швейцария) , соответственно. Все мыши находились на фоне C57Bl/6, содержались в специфических свободных от патогенов условиях и использовались в возрасте 6–15 недель. В некоторых экспериментах анти-IL-17A (клон 17F3, BioXCell (Западный Ливан, Нью-Гемпшир), 200 мкг на мышь в день) и анти-IL-17F 61 (любезно предоставлено Pfizer (Нью-Йорк, Нью-Йорк), 200 мкг на мышь в сутки) вводили ежедневно, начиная с 1 дня до заражения. Для истощения нейтрофилов NimpR14 (полученный из гибридомы, любезно предоставленной Нэнси Хогг, Cancer Research UK, Лондон) вводили ежедневно, начиная с одного дня до заражения. Альтернативно, анти-GSF (клон 67604, R&D Systems (Abingdon, UK), 10 мкг на мышь в день) вводили ежедневно, начиная с одного дня до заражения, вместе с одной дозой анти-Ly6G (клон 1A8, BioXCell, 150 мкг на мышь).
Мыши Il17ra-/- , il17rc-/- и il17re -/- были получены от Amgen (Таузенд-Оукс, Калифорния) и выведены в нашем животноводческом центре Rodent Center HCI. 9Мыши 1739 Rorc -/-, Csf2 -/- и Cybb -/- были подарком от Буркхарда Бехера (Цюрихский университет, Швейцария), Манфреда Копфа и Вольфа-Дитриха Хардта (оба ETH Zürich, Швейцария) , соответственно. Все мыши находились на фоне C57Bl/6, содержались в специфических свободных от патогенов условиях и использовались в возрасте 6–15 недель. В некоторых экспериментах анти-IL-17A (клон 17F3, BioXCell (Западный Ливан, Нью-Гемпшир), 200 мкг на мышь в день) и анти-IL-17F 61 (любезно предоставлено Pfizer (Нью-Йорк, Нью-Йорк), 200 мкг на мышь в сутки) вводили ежедневно, начиная с 1 дня до заражения. Для истощения нейтрофилов NimpR14 (полученный из гибридомы, любезно предоставленной Нэнси Хогг, Cancer Research UK, Лондон) вводили ежедневно, начиная с одного дня до заражения. Альтернативно, анти-GSF (клон 67604, R&D Systems (Abingdon, UK), 10 мкг на мышь в день) вводили ежедневно, начиная с одного дня до заражения, вместе с одной дозой анти-Ly6G (клон 1A8, BioXCell, 150 мкг на мышь). мышь) в день -1. Все антитела вводили внутрибрюшинно. Все эксперименты на мышах, описанные в этом исследовании, проводились в строгом соответствии с рекомендациями швейцарского Закона о защите животных и в соответствии с протоколами, утвержденными Ветеринарным управлением кантона Цюрих, Швейцария (номер лицензии 184/2009).и 201/2012). Были предприняты все усилия, чтобы свести к минимуму страдания и обеспечить самые высокие этические и гуманные стандарты.
мышь) в день -1. Все антитела вводили внутрибрюшинно. Все эксперименты на мышах, описанные в этом исследовании, проводились в строгом соответствии с рекомендациями швейцарского Закона о защите животных и в соответствии с протоколами, утвержденными Ветеринарным управлением кантона Цюрих, Швейцария (номер лицензии 184/2009).и 201/2012). Были предприняты все усилия, чтобы свести к минимуму страдания и обеспечить самые высокие этические и гуманные стандарты.
Штамм гриба и инфекция. Лабораторный штамм C. albicans SC5314 выращивали в среде с дрожжевым пептоном и декстрозой при 30 °C в течение 15–18 часов. Мышей заражали 2,5 × 10 6 КОЕ. C. albicans сублингвально, как описано 62 без иммуносупрессии. Мышей контролировали на предмет заболеваемости и убивали, когда у них проявлялись серьезные признаки боли или стресса. Потеря и восстановление массы тела отслеживались на протяжении всех экспериментов и отображались в % от исходной массы. Для определения грибковой нагрузки язык удаляли, гомогенизировали в стерильном 0,05% растворе NP40 в среде H 9.2667 2 O в течение 3 мин при 25 Гц с использованием Tissue Lyzer (Qiagen, Hombrechtikon, Швейцария), и серийные разведения высевали на дрожжевой пептонно-декстрозный агар, содержащий 100 мкг мл -1 ампициллина.
Для определения грибковой нагрузки язык удаляли, гомогенизировали в стерильном 0,05% растворе NP40 в среде H 9.2667 2 O в течение 3 мин при 25 Гц с использованием Tissue Lyzer (Qiagen, Hombrechtikon, Швейцария), и серийные разведения высевали на дрожжевой пептонно-декстрозный агар, содержащий 100 мкг мл -1 ампициллина.
Выделение клеток языка и анализ методом проточной цитометрии. Мышей анестезировали сублетальной дозой кетамина, ксилазина и ацепромазина и перфузировали путем инъекции фосфатно-солевого буфера в правый желудочек сердца. Языки нарезали на мелкие кусочки и расщепляли ДНКазой I (2,4 мг мл -1 , Roche, Роткройц, Швейцария) и колагеназы IV (4,8 мг мл -1 , Life Technologies, Цуг, Швейцария) в фосфатно-солевом буфере в течение 45 мин при 37 °C. Суспензии одиночных клеток окрашивали в ледяном фосфатно-солевом буфере с добавлением 2 мМ ЭДТА, 10% фетальной телячьей сыворотки и 0,02% азида натрия с помощью CD45 (клон 104, Biolegend, Сан-Диего, Калифорния), CD11b (клон M1/ 70, Biolegend), Ly6C (клон AL-21, BD Biosciences, Allschwil, Швейцария), Ly6G (клон 1A8, BD Biolegend), CD18 (M18/2, Biolegend), EpCAM (G8. 8, Biolegend) и CD31 ( клон MEC13.3, Biolegend). Данные были получены на LSRII (BD Biosciences) и проанализированы с помощью программного обеспечения FlowJo (TreeStar, Ashland, OR). Для сортировки клеток использовали Aria III (BD Biosciences).
8, Biolegend) и CD31 ( клон MEC13.3, Biolegend). Данные были получены на LSRII (BD Biosciences) и проанализированы с помощью программного обеспечения FlowJo (TreeStar, Ashland, OR). Для сортировки клеток использовали Aria III (BD Biosciences).
Выделение РНК и количественная ПЦР с обратной транскриптазой. Выделение тотальной РНК из языков и получение кДНК проводили по стандартным протоколам. Количественную ПЦР проводили с использованием SYBR Green (Roche) и Rotor-Gene 3000 (Corbett Research/Qiagen). Праймерами были Cxcl1 fwd 5′-ccgctcgcttctctgtg-3′, Cxcl1 rev 5′-gcagctcattggcgatag-3′; S100a9 fwd 5′-gtccaggtcctccatgatgt-3′ и S100a9 rev 5′-tcagacaaatggtggaagca-3′; defb3 fwd 5′-gtctccacctgcagcttttag-3′ и defb3 rev 5′-actgccaatctgacgagtgtt-3′; Il17c fwd 5′-ctggaagctgacactcacg-3′ и Il17c rev 5′-ggtagcggttctcatctgtg-3′. Данные были нормализованы к β-актину и отображены как относительные значения.
Гомогенизация тканей и иммуноферментный анализ. Для измерения белка языки гомогенизировали в фосфатно-солевом буфере с 0,1% Triton-X100 и таблеткой Roche Protein Inhibitor с использованием Tissue Lyzer (Qiagen) в течение 3 минут при частоте 25 Гц. Белок G-CSF определяли сэндвич-иммуноферментным анализом с использованием очищенного анти-G-CSF (клон 67604, R&D Systems) для покрытия и биотинилированного поликлонального кроличьего анти-G-CSF (Peprotech, Лондон, Великобритания) для обнаружения в соответствии со стандартом. протоколы. S100A9уровни белка определяли с помощью набора для твердофазного иммуноферментного анализа S100A9 DuoSet (R&D Systems).
Для измерения белка языки гомогенизировали в фосфатно-солевом буфере с 0,1% Triton-X100 и таблеткой Roche Protein Inhibitor с использованием Tissue Lyzer (Qiagen) в течение 3 минут при частоте 25 Гц. Белок G-CSF определяли сэндвич-иммуноферментным анализом с использованием очищенного анти-G-CSF (клон 67604, R&D Systems) для покрытия и биотинилированного поликлонального кроличьего анти-G-CSF (Peprotech, Лондон, Великобритания) для обнаружения в соответствии со стандартом. протоколы. S100A9уровни белка определяли с помощью набора для твердофазного иммуноферментного анализа S100A9 DuoSet (R&D Systems).
Гистохимия и иммунофлуоресценция. Ткани были помещены в OCT (Sakura, Alphen aan den Rijn, Нидерланды), быстро заморожены в жидком азоте и хранились при температуре -20 °C. Сагиттальные криосрезы (10 мкм) высушивали на воздухе при комнатной температуре, окрашивали периодической кислотой по Шиффу (Roth, Arlesheim, Швейцария) и контрастно окрашивали гематоксилином (Roth). Срезы монтировали с помощью Pertex (Biosystems, Nunningen, Швейцария) и анализировали на Axiovert 25 (Zeiss, Feldbach, Швейцария) при увеличении × 10–40. Все линейки масштаба указывают 100 мкм. Для иммунофлуоресцентного окрашивания криосрезы фиксировали ледяным 4% параформальдегидом и окрашивали анти-S100A9.(любезно предоставлено C. Urban, Умеа, Швеция, 0,5 мкг мл -1 ), анти-мышиный IgG-Alexa647 (5 мкг мл -1 , Abcam, Кембридж, Великобритания), анти-крысиный IgG( H+L)-Alexa488 (7,5 мкг мл -1 , Jackson Immunoresearch, Ньюмаркет, Великобритания) и дигидрохлорид 4′,6-диамидино-2-фенилиндола (Sigma-Aldrich, Buchs, Швейцария). Предметные стекла монтировали с помощью Mowiol (VWR International AG, Dietikon, Швейцария). Изображения были получены с помощью 200-метрового микроскопа Zeiss Axiovert, конфокального устройства с вращающимся диском CSU-X1 (Visitron Systems, Puchheim, Germany) и камеры Evolve 512 EMCCD (Photometrics, Tucson, AZ). Использовались объективы × 10 и × 20.
Срезы монтировали с помощью Pertex (Biosystems, Nunningen, Швейцария) и анализировали на Axiovert 25 (Zeiss, Feldbach, Швейцария) при увеличении × 10–40. Все линейки масштаба указывают 100 мкм. Для иммунофлуоресцентного окрашивания криосрезы фиксировали ледяным 4% параформальдегидом и окрашивали анти-S100A9.(любезно предоставлено C. Urban, Умеа, Швеция, 0,5 мкг мл -1 ), анти-мышиный IgG-Alexa647 (5 мкг мл -1 , Abcam, Кембридж, Великобритания), анти-крысиный IgG( H+L)-Alexa488 (7,5 мкг мл -1 , Jackson Immunoresearch, Ньюмаркет, Великобритания) и дигидрохлорид 4′,6-диамидино-2-фенилиндола (Sigma-Aldrich, Buchs, Швейцария). Предметные стекла монтировали с помощью Mowiol (VWR International AG, Dietikon, Швейцария). Изображения были получены с помощью 200-метрового микроскопа Zeiss Axiovert, конфокального устройства с вращающимся диском CSU-X1 (Visitron Systems, Puchheim, Germany) и камеры Evolve 512 EMCCD (Photometrics, Tucson, AZ). Использовались объективы × 10 и × 20. Анализ изображений выполняли с помощью программного обеспечения Volocity (Perkin Elmer, Шверценбах, Швейцария).
Анализ изображений выполняли с помощью программного обеспечения Volocity (Perkin Elmer, Шверценбах, Швейцария).
Анализ окислительного взрыва. Нейтрофилы инкубировали с 20 мкМ дихлорфлуоресцеиндиацетата (Sigma-Aldrich) в среде без Ca 2+ — и Mg 2+ при 37 °C в течение 15 мин, промывали RPMI и стимулировали 5 × 10 4 умерщвляли нагреванием Candida перед тем, как клетки окрашивали поверхностными антителами клеток и анализировали с помощью проточной цитометрии.
Статистика. Статистическая значимость определялась непараметрическим методом Манна–Уитни U — тест с использованием GraphPad Prism (GraphPad Software, La Jolla, CA) с * P <0,05; ** Р <0,01; *** Р <0,001. Для данных, представленных в логарифмическом масштабе, указывается среднее геометрическое.
Ссылки
-
Puel, A., Cypowyj, S., Marodi, L.
 , Abel, L., Picard, C. & Casanova, J.L. Врожденные нарушения человеческого иммунитета к IL-17 лежат в основе хронического кожно-слизистого кандидоза. Курс. мнение Аллергия клин. Иммунол. 12 , 616–622 (2012).
, Abel, L., Picard, C. & Casanova, J.L. Врожденные нарушения человеческого иммунитета к IL-17 лежат в основе хронического кожно-слизистого кандидоза. Курс. мнение Аллергия клин. Иммунол. 12 , 616–622 (2012). КАС Статья Google ученый
-
Пуэль, А. и др. . Хронический кожно-слизистый кандидоз у людей с врожденными нарушениями иммунитета к интерлейкину-17. Наука 332 , 65–68 (2011).
КАС Статья Google ученый
-
Буассон, Б. и др. . Мутация ACT1 избирательно устраняет реакции интерлейкина-17 у людей с хроническим кожно-слизистым кандидозом. Иммунитет 39 , 676–686 (2013).
КАС Статья Google ученый
-
де Бокудри, Л. и др. . Мутации в STAT3 и IL12RB1 нарушают развитие человеческих Т-клеток, продуцирующих IL-17.
 Дж. Экспл. Мед. 205 , 1543–1550 (2008 г.).
Дж. Экспл. Мед. 205 , 1543–1550 (2008 г.). КАС Статья Google ученый
-
Кисанд К. и др. . Хронический кожно-слизистый кандидоз у пациентов с APECED или тимомой коррелирует с аутоиммунитетом к Th27-ассоциированным цитокинам. Дж. Экспл. Мед. 207 , 299–308 (2010).
КАС Статья Google ученый
-
Лю Л. и др. . Мутации STAT1 человека с приобретением функции нарушают иммунитет к IL-17 и лежат в основе хронического кожно-слизистого кандидоза. Дж. Экспл. Мед. 208 , 1635–1648 (2011).
КАС Статья Google ученый
-
Пуэль, А. и др. . Аутоантитела к IL-17A, IL-17F и IL-22 у больных хроническим кожно-слизистым кандидозом и аутоиммунным полиэндокринным синдромом I типа.
 J. Exp. Мед. 207 , 291–297 (2010).
J. Exp. Мед. 207 , 291–297 (2010). КАС Статья Google ученый
-
ван де Вердонк, Ф.Л. и др. . Мутации STAT1 при аутосомно-доминантном хроническом кожно-слизистом кандидозе. Н. англ. Дж. Мед. 365 , 54–61 (2011).
КАС Статья Google ученый
-
Conti, H.R. и др. . Клетки Th27 и передача сигналов рецептора IL-17 необходимы для защиты слизистой оболочки хозяина от кандидоза полости рта. Дж. Экспл. Мед. 206 , 299–311 (2009).
КАС Статья Google ученый
-
Кагами С., Риццо Х.Л., Курц С.Е., Миллер Л.С. & Blauvelt, A. IL-23 и IL-17A, но не IL-12 и IL-22, необходимы для оптимальной защиты кожи хозяина от Candida albicans . Дж. Иммунол. 185 , 5453–5462 (2010).

КАС Статья Google ученый
-
Гаффен, С.Л. Структура и передача сигналов в семействе рецепторов IL-17. Нац. Преподобный Иммунол. 9 , 556–567 (2009).
КАС Статья Google ученый
-
Корн Т., Беттелли Э., Оукка М. и Кучру В.К. Клетки IL-17 и Th27. Энн. Преподобный Иммунол. 27 , 485–517 (2009).
КАС Статья Google ученый
-
Ганнум, Массачусетс и др. . Характеристика грибкового микробиома полости рта (микобиома) у здоровых людей. г. ПлоС Патог. 6 , e1000713 (2010 г.).
Артикул Google ученый
-
Акоста-Родригес, Э.В. и др. . Поверхностный фенотип и антигенная специфичность человеческих Т-хелперных клеток памяти, продуцирующих интерлейкин 17.
 Нац. Иммунол 8 , 639–646 (2007).
Нац. Иммунол 8 , 639–646 (2007). КАС Статья Google ученый
-
Бер, Э. и др. . Новый Th-клеточный эпитоп Candida albicans опосредует защиту от грибковой инфекции. Дж. Иммунол. 188 , 5636–5643 (2012).
Артикул Google ученый
-
Лин Л. и др. . Клетки Th2-Th27 опосредуют защитный адаптивный иммунитет против инфекции Staphylococcus aureus и Candida albicans у мышей. PLoS Патог. 5 , e1000703 (2009).
Артикул Google ученый
-
Вютрих, М. и др. . Индуцированная вакциной защита от 3 системных микозов, эндемичных для Северной Америки, требует клеток Th27 у мышей. Дж. Клин. расследование 121 , 554–568 (2011).
Артикул Google ученый
-
Куа, Д.
 Дж. и Тато, К.М. Врожденные клетки, продуцирующие IL-17: стражи иммунной системы. Нац. Преподобный Иммунол. 10 , 479–489 (2010).
Дж. и Тато, К.М. Врожденные клетки, продуцирующие IL-17: стражи иммунной системы. Нац. Преподобный Иммунол. 10 , 479–489 (2010). КАС Статья Google ученый
-
Gladiator, A., Wangler, N., Trautwein-Weidner, K. & Leibundgut-Landmann, S. Передовой опыт: врожденные лимфоидные клетки, секретирующие IL-17, необходимы для защиты хозяина от грибковой инфекции. Дж. Иммунол. 190 , 521–525 (2013).
КАС Статья Google ученый
-
Ge, D. & You, Z. Экспрессия белка интерлейкина-17RC в нормальных тканях человека. Междунар. Арк. Мед. 1 , 19 (2008).
Артикул Google ученый
-
Фоссьез, Ф. и др. . Т-клеточный интерлейкин-17 побуждает стромальные клетки продуцировать провоспалительные и гемопоэтические цитокины.
 Дж. Экспл. Мед. 183 , 2593–2603 (1996).
Дж. Экспл. Мед. 183 , 2593–2603 (1996). КАС Статья Google ученый
-
Лаан, М. и др. . Рекрутирование нейтрофилов человеческим IL-17 посредством высвобождения хемокинов CXC в дыхательных путях. Дж. Иммунол. 162 , 2347–2352 (1999).
КАС пабмед Google ученый
-
Шварценбергер, П. и др. . IL-17 стимулирует гранулопоэз у мышей: использование альтернативного нового метода генной терапии для оценки цитокинов in vivo. г. Дж. Иммунол. 161 , 6383–6389 (1998).
КАС пабмед Google ученый
-
Miyamoto, M., Prause, O., Sjostrand, M., Laan, M., Lotvall, J. & Linden, A. Эндогенный IL-17 как медиатор рекрутирования нейтрофилов, вызванный воздействием эндотоксина на дыхательные пути мыши .
 Дж. Иммунол. 170 , 4665–4672 (2003).
Дж. Иммунол. 170 , 4665–4672 (2003). КАС Статья Google ученый
-
Ченг, П. и др. . Роль гамма-дельта Т-клеток в ответе хозяина на пневмонию, вызванную Staphylococcus aureus . ВМС Иммунол. 13 , 38 (2012).
КАС Статья Google ученый
-
Е., П. и др. . Необходимость передачи сигналов рецептора интерлейкина 17 для экспрессии хемокинов CXC легких и гранулоцитарного колониестимулирующего фактора, рекрутирования нейтрофилов и защиты хозяина. Дж. Эксп. Мед. 194 , 519–527 (2001).
КАС Статья Google ученый
-
Кудва А. и др. . Грипп A ингибирует Th27-опосредованную защиту хозяина от бактериальной пневмонии у мышей. Дж. Иммунол. 186 , 1666–1674 (2011).

КАС Статья Google ученый
-
Чо, Дж.С. и др. . IL-17 необходим для защиты хозяина от кожных Инфекция Staphylococcus aureus у мышей. Дж. Клин. расследование 120 , 1762–1773 (2010).
Артикул Google ученый
-
Умемура М. и др. . IL-17-опосредованная регуляция врожденного и приобретенного иммунного ответа против легочной инфекции Mycobacterium bovis бациллы Кальметта-Герена. Дж. Иммунол. 178 , 3786–3796 (2007).
КАС Статья Google ученый
-
Тоселло Боари, Дж. и др. . Передача сигналов IL-17RA снижает воспаление и смертность при инфекции Trypanosoma cruzi за счет рекрутирования нейтрофилов, продуцирующих супрессивный IL-10. PLoS Патог. 8 , e1002658 (2012 г.
 ).
). Артикул Google ученый
-
Лукач Н.В., Смит Дж.Дж., Мукерджи С., Моррис С.Б., Нуньес Г. и Линделл Д.М. Индуцированная респираторным вирусом активация TLR7 контролирует связанное с IL-17 увеличение количества слизи посредством регуляции IL-23. г. Дж. Иммунол. 185 , 2231–2239 (2010).
КАС Статья Google ученый
-
Романи, Л. и др. . Дефектный катаболизм триптофана лежит в основе воспаления при хронической гранулематозной болезни мышей. Природа 451 , 211–215 (2008).
КАС Статья Google ученый
-
Тан, Х.Л., Регейм, Н., Браун, С., Буш, А., Ллойд, К.М. и Дэвис, Дж. К. Путь Th27 при муковисцидозе легких. г. утра. Дж. Дыхание. крит. Уход Мед. 184 , 252–258 (2011).
КАС Статья Google ученый
-
Crowe, CR и др.
 . Критическая роль IL-17RA в иммунопатологии гриппозной инфекции. Дж. Иммунол. 183 , 5301–5310 (2009 г.).
. Критическая роль IL-17RA в иммунопатологии гриппозной инфекции. Дж. Иммунол. 183 , 5301–5310 (2009 г.). КАС Статья Google ученый
-
Ван дер Фитс, Л. и др. . Индуцированное имиквимодом псориазоподобное воспаление кожи у мышей опосредуется через ось IL-23/IL-17. Дж. Иммунол. 182 , 5836–5845 (2009).
КАС Статья Google ученый
-
Wengner, A.M., Pitchford, S.C., Furze, R.C. и Рэнкин, С.М. Согласованное действие хемокинов G-CSF и ELR+CXC на мобилизацию нейтрофилов при остром воспалении. Кровь 111 , 42–49 (2008).
КАС Статья Google ученый
-
Хапплер, А.Р., Конти, Х.Р., Эрнандес-Сантос, Н., Дарвилл, Т., Бисвас, П.С. и Гаффен, С.Л. Роль нейтрофилов в ИЛ-17-зависимом иммунитете к кандидозу слизистых оболочек.
 Дж. Иммунол. 192 , 1745–1752 (2014).
Дж. Иммунол. 192 , 1745–1752 (2014). КАС Статья Google ученый
-
Рамирес-Карроцци, В. и др. . IL-17C аутокринно регулирует врожденную иммунную функцию эпителиальных клеток. Нац. Иммунол. 12 , 1159–1166 (2011).
КАС Статья Google ученый
-
Песня, X. и др. . IL-17RE является функциональным рецептором для IL-17C и опосредует иммунитет слизистой оболочки к инфекции кишечными патогенами. Нац. Иммунол. 12 , 1151–1158 (2011).
КАС Статья Google ученый
-
Бер, Э., Уитни, П.Г., Мур, К., Рейс, Э.С.К. & Leibundgut-Landmann, S. IL-17 регулирует системный грибковый иммунитет, контролируя функциональную компетентность NK-клеток. Иммунитет 40 , 117–127 (2014).

Артикул Google ученый
-
Парк, Х. и др. . Отдельная линия Т-клеток CD4 регулирует воспаление тканей, продуцируя интерлейкин 17. Nat. Иммунол. 6 , 1133–1141 (2005).
КАС Статья Google ученый
-
Хо, А.В. и др. . IL-17RC необходим для передачи иммунного сигнала через расширенный сигнальный домен SEF/IL-17R в цитоплазматическом хвосте. г. Дж. Иммунол. 185 , 1063–1070 (2010).
КАС Статья Google ученый
-
Корбин Б.Д. и др. . Хелирование металлов и ингибирование роста бактерий в тканевых абсцессах. Наука 319 , 962–965 (2008).
КАС Статья Google ученый
-
Урбан, С.Ф. и др.
 . Внеклеточные ловушки нейтрофилов содержат кальпротектин, цитозольный белковый комплекс, участвующий в защите хозяина от Candida albicans . PLoS Патог. 5 , e1000639 (2009 г.).
. Внеклеточные ловушки нейтрофилов содержат кальпротектин, цитозольный белковый комплекс, участвующий в защите хозяина от Candida albicans . PLoS Патог. 5 , e1000639 (2009 г.). Артикул Google ученый
-
Хсу, К. и др. . Противоинфекционные защитные свойства кальгранулинов S100. Противовоспалительное средство. Антиаллергенный. Агенты Мед. хим. 8 , 290–305 (2009).
КАС Статья Google ученый
-
Харрингтон, Л.Э. и др. . Эффекторные Т-клетки CD4+, продуцирующие интерлейкин 17, развиваются по линии, отличной от линий Т-хелперов 1 и 2 типов. Нац. Иммунол. 6 , 1123–1132 (2005).
КАС Статья Google ученый
-
Buonocore, S. и др. . Врожденные лимфоидные клетки вызывают интерлейкин-23-зависимую врожденную патологию кишечника.
 Природа 464 , 1371–1375 (2010).
Природа 464 , 1371–1375 (2010). КАС Статья Google ученый
-
Такатори, Х. и др. . Клетки, подобные индукторам лимфоидной ткани, являются врожденным источником IL-17 и IL-22. Дж. Экспл. Мед. 206 , 35–41 (2009).
КАС Статья Google ученый
-
Уэй, Э.Э., Чен, К. и Коллс, Дж.К. Нарушение регуляции иммунитета легких — защитный и патологический ответ Th27 при инфекции. евро. Дж. Иммунол. 43 , 3116–3124 (2013).
КАС Статья Google ученый
-
Эль Малки, К. и др. . Альтернативный путь имиквимод-индуцированного псориазоподобного воспаления кожи при отсутствии передачи сигналов рецептора интерлейкина-17. Дж. Расследование. Дерматол. 133 , 441–451 (2013).

КАС Статья Google ученый
-
Мойес Д.Л. и др. . Двухфазный врожденный иммунный ответ MAPK различает дрожжевые и гифальные формы Candida albicans в эпителиальных клетках. Клеточный микроб-хозяин 8 , 225–235 (2010).
КАС Статья Google ученый
-
Джонстон А. и др. . Кератиноцитарная сверхэкспрессия IL-17C способствует псориазоподобному воспалению кожи. Дж. Иммунол. 190 , 2252–2262 (2013).
КАС Статья Google ученый
-
Eversole, L.R., Reichart, P.A., Ficarra, G., Schmidt-Westhausen, A., Romagnoli, P. & Pimpinelli, N. Иммунный ответ оральных кератиноцитов при ВИЧ-ассоциированном кандидозе. Оральный хирург. Оральный мед. Орал Патол. Оральный радиол. Эндод. 84 , 372–380 (1997).

КАС Статья Google ученый
-
Бер, Э., Уитни, П., Мур, К., Рейс и Соуза, К. и ЛейбундГут-Ландманн, С. IL-17 регулирует грибковый иммунитет, контролируя функциональную компетентность NK-клеток. Иммунитет 40 , 1–11 (2014).
Артикул Google ученый
-
Лионакис, М.С., Лим, Дж.К., Ли, К.К. и Мерфи, П.М. Органоспецифические врожденные иммунные ответы в мышиной модели инвазивного кандидоза. J. Врожденный иммунитет. 3 , 180–199 (2011).
КАС Статья Google ученый
-
Лионакис М.С. и др. . Хемокиновый рецептор Ccr1 управляет нейтрофильной иммунопатологией почек и смертностью при инвазивном кандидозе. PLoS Патог. 8 , e1002865 (2012).
КАС Статья Google ученый
-
Майер, О.
 и др. . Интерфероны типа I способствуют фатальной иммунопатологии, регулируя воспалительные моноциты и нейтрофилы во время инфекции Candida. PLoS Патог. 8 , e1002811 (2012).
и др. . Интерфероны типа I способствуют фатальной иммунопатологии, регулируя воспалительные моноциты и нейтрофилы во время инфекции Candida. PLoS Патог. 8 , e1002811 (2012). КАС Статья Google ученый
-
Зеланте, Т. и др. . Обнаружение IL-17A млекопитающих регулирует адаптацию и вирулентность грибов. Нац. коммун. 3 , 683 (2012).
Артикул Google ученый
-
Феррейра, М.К., Уибли, Н., Мамо, А.Дж., Зибенлист, У., Чан, Ю.Р. и Гаффен, С.Л. Липокалин 2, индуцированный ИЛ-17, незаменим для иммунитета к оральному кандидозу. Заражение. Иммун. 82 , 1030–1035 (2013).
Артикул Google ученый
-
Свит, С.П., Денбери, А.Н. и Чаллакомб, С.Дж. Уровни кальпротектина в слюне повышены у пациентов с кандидозом полости рта или синдромом Шегрена, но снижаются при ВИЧ-инфекции.


