Классификация анестетиков в стоматологии
Большинство терапевтических и хирургических манипуляций в ротовой полости проводятся под местной анестезией. Местные анестетики в стоматологии должны отвечать следующим требованиям:
- иметь невысокую токсичность составных веществ;
- полностью растворяться в физиологических растворах;
- сохранять обезболивающий эффект в течение всего времени хранения;
- не раздражать и не разрушать мягкие ткани ротовой полости;
- должен максимально быстро обезболивать зубы и десна;
- провоцировать минимальное количество побочных действий;
- обезболивание местным анестетиком должно носить обратный характер.
Анестетики в стоматологии, классификация основных фармацевтических форм
Обезболивающие средства в современной стоматологической практике разделяются на следующие группы:
- Новокаины. Основным преимуществом этого анестетика считается его низкая токсичность. К недостаткам новокаиновых анестезий следует отнести невысокий обезболивающий эффект. Данный препарат также способен тормозить физиологические процессы регенерации мягких тканей.
- Тримекаины. Такие препараты амидной группы имеют более выраженное анестезирующее действие. Они также малотоксичны для организма человека, их дезактивация происходит в печеночных клетках. Но при этом обезболивающий эффект желает быть сильнее.
- Лидокаины. Это обезболивание в два раза сильнее, чем новокаиновая анестезия. Токсичность препарата возрастает прямо пропорционально количеству введённого в ткани раствора. Препарат расширяет просвет кровеносных сосудов, что иногда заканчивается резким снижением артериального давления. К недостаткам данного медикамента еще можно отнести его проникновение через гематоплацентарный барьер.
- Мепивакины, которые считаются одними из самых безопасных обезболивающих средств.
 Фармакологические свойства мепивакаина сходны с лидокаином, но менее выражена токсичность.
Фармакологические свойства мепивакаина сходны с лидокаином, но менее выражена токсичность. - Артикаины. Современные методы анестезии, как правило, используют обезболивающие средства артикаинового ряда, которые обладают высокой эффективностью и низкой токсичностью.
Какой анестетик в стоматологии менее безвредный? Выбор препарата.
Врач-стоматолог подбирает обезболивающее средство ориентируясь на индивидуальную переносимость. Использовать какие-либо медикаменты можно только после проведения аллергологической пробы. Для этого пациенту на внутреннюю поверхность предплечья капают несколько капель анестетика. Затем стерильной иглой врач царапает кожный покров. Через 12-15 минут специалист считывает результат. Если у пациента наблюдается покраснение, отек и зуд кожных покровов, то применять данный препарат противопоказано.
По мнению большинства стоматологов, наиболее целесообразным способом анестезии считается инъекция препаратов артикаина. Если у человека обнаружена гиперчувствительность к обезболивающему медикаменту, то больному назначают курс антигистаминных препаратов. Через несколько дней таким пациентам проводят пробы на переносимость других групп анестетиков.
Способы обезболивания в стоматологии
Анестетики в стоматологии используются в таких основных фармакологических видах:
- Аэрозоли 10% лидокаина. Внешняя обработка слизистой оболочки ротовой полости применяется в качестве подготовительного этапа к основной анестезии. Зуб при этом не обезболивается.
- Мази, которые предназначены для аппликационной анестезии. Такой способ обезболивания имеет место в детской стоматологии при лечении поверхностных поражений молочных зубов.
- Ампулы для проводниковой и инфильтрационной анестезии. Ампульные лекарства также применяются для выполнения общего наркоза.
- Карпулы. В современной стоматологии очень мало выпускается ампульных препаратов.
 Большинство инъекций осуществляются посредством специального карпульного шприца.
Большинство инъекций осуществляются посредством специального карпульного шприца.
Анестетики, применяемые в клинике «Окодент»
В медицинском центре «Окодент» имеется широчайший ассортимент обезболивающих средств. Выбор анестетика проводится в индивидуальном порядке, учитывая методику анестезии, химический состав анестетика, диагноз пациента и его аллергологический статус.
В клинике врачи-стоматологи широко практикуют поэтапность инъекции, что способствует минимальной болезненности укола и высоким обезболивающим эффектам.
Классификация способов местной анестезии
Для медицины анестезия означает временную потерю болевой чувствительности. Главный русский ее синоним — обезболивание. Это состояние, позволяющее оператору свободно обращаться с тканями. Анестезия может быть общей и местной. В стоматологии основным, почти единственным способом пока остается местная инъекционная анестезия специфическими лекарствами —
Эффект анестезии обеспечивается следующим механизмом. С помощью инъектора, снабженного иглой, раствор местного анестетика подводится к наружной мишени на слизистой оболочке полости рта, игла ее перфорирует и продвигается к внутренней мишени, где инъектор под давлением создает региональное депо анестетика. Депо в области внутренней мишени обеспечивает эффективную концентрацию лекарства и необходимый его объем. Объемная доза анестетика очень важна для смачивания необходимого числа нервных рецепторов и перехватов Ранвье. Депо анестетика и его положение — главный элемент успеха.
Для создания успешного регионального депо необходима точная доставка раствора к внутренней мишени, как правило, в избыточном объеме. Положение внутренней мишени виртуально при блокаде нижнеальвеолярного нерва (НАН) и зависит от многих факторов, как анатомических, так и психологических.
Создание депо возможно двумя способами: диффузионным и сосудистым. Диффузионный способ — основа классических инъекционных анестезий. Сосудистый способ топографического распределения анестетика представил A. Bier [21] в 1908 г. как внутривенную региональную анестезию. Она в историческом аспекте упоминается в общемедицинской литературе. Ее вариант, внутрикостная анестезия конечностей, возникла в Советском Союзе в Отечественную войну и была популярна, так как военный хирург совмещал в одном лице и оператора, и анестезиолога. С.Б. Фрайман (1947) [15], И.Л. Крупко и соавт. (1969) [4], Н.И. Атясов (1970) [1] доказали ее венозный механизм. В ее появлении определенную роль сыграли и стоматологи [12]. После войны внутрикостная анестезия расцвела и через более чем 20 лет исчезла. В зарубежной литературе сообщения о внутрикостной анестезии конечностей относятся к 1995 г. со ссылкой на еще советских авторов [37].
Диффузионный способ — основа классических инъекционных анестезий. Сосудистый способ топографического распределения анестетика представил A. Bier [21] в 1908 г. как внутривенную региональную анестезию. Она в историческом аспекте упоминается в общемедицинской литературе. Ее вариант, внутрикостная анестезия конечностей, возникла в Советском Союзе в Отечественную войну и была популярна, так как военный хирург совмещал в одном лице и оператора, и анестезиолога. С.Б. Фрайман (1947) [15], И.Л. Крупко и соавт. (1969) [4], Н.И. Атясов (1970) [1] доказали ее венозный механизм. В ее появлении определенную роль сыграли и стоматологи [12]. После войны внутрикостная анестезия расцвела и через более чем 20 лет исчезла. В зарубежной литературе сообщения о внутрикостной анестезии конечностей относятся к 1995 г. со ссылкой на еще советских авторов [37].
В стоматологической литературе, как в отечественной, так и зарубежной, считается, что для зубов сосудистой дентальной анестезии не существует, имеются лишь варианты диффузионной.
Во многих стоматологических учебниках и руководствах простейшая классификация инъекционной анестезии сводится к ее разделению на инфильтрационную и проводниковую. В таблице представлена реально используемая в дентальной практике терминология современных дентальных методов.
Классификация и терминология методов местной дентальной анестезии Примечание. * — в качестве модели проводниковых инъекций в таблице представлены методы блокады нижнеальвеолярного нерва у мандибулярного отверстия.
Проводниковые методы при этом сводятся, как правило, к блокаде НАН, который оказался наиболее сложной анестезиологической проблемой практического стоматолога. K. Wong (2001) [40] в системном обзоре определил полный успех блокады НАН на основании электротестирования в молярах с нормальной пульпой в 69%, а с необратимо воспаленной — 30%.
Недостаточность мандибулярных анестезий по сравнению с инфильтрационными произошла в результате широкого внедрения амидных анестетиков, которые в России появились в 80-90-е годы [8]. Неудачи проводниковых анестезий разрешались с помощью внутрикостной, интралигаментарной, интрасептальной и внутрипульпарной инъекций. Отсюда и возник объединяющий их термин — «дополнительные», «вспомогательные» [29]. Этот термин не отражает сущностную сторону их отличия от классических. Разница между ними очень глубокая. С нашей точки зрения более точен термин «спонгиозные».
Неудачи проводниковых анестезий разрешались с помощью внутрикостной, интралигаментарной, интрасептальной и внутрипульпарной инъекций. Отсюда и возник объединяющий их термин — «дополнительные», «вспомогательные» [29]. Этот термин не отражает сущностную сторону их отличия от классических. Разница между ними очень глубокая. С нашей точки зрения более точен термин «спонгиозные».
Спонгиозные анестезии 4% артикаином с адреналином были высокоэффективны при обезболивании пульпы, особенно нижних зубов. Это показали и наши исследования спонгиозных инъекций с высокой частотой успеха только на нижних зубах: Д.В. Медведев (2011) [6] — 100%, О.Е. Ефимова (2011) [2] — 98,2%. Высока эффективность спонгиозного обезболивания как нижних, так и верхних зубов артикаином с адреналином 1:100 000 — 93% [17], 2% лидокаином с адреналином 1:80 000 — 87,1% [8]. При сопоставлении их с проводниковыми разница составляет 15-25%. Таким образом, спонгиозные анестезии становятся эффективной альтернативой проводниковым мандибулярным инъекциям [18, 29].
Интралигаментарная анестезия получила особую популярность благодаря своей простоте. Например, в Болгарии 75,9% стоматологов используют ее почти при всех видах вмешательств в своей практике [27]. Анкетированием 800 из 2500 американских эндодонтистов установлено, что почти 95% из них используют дополнительные методы, чаще всего ИЛА — 50%, а также внутрикостную двухэтапную инъекцию [20]. В рабочих классификациях немецких авторов к основным инфильтрационным и проводниковым инъекциям присоединяется еще третий вид — интралигаментарная анестезия [19, 23, 32].
В 80-е годы вопрос о сосудистом характере спонгиозных анестезий изредка возникал в литературе [31, 36]. В XXI веке этот вопрос почти не ставился. Он представлен единичным исследованием [39] и решен в пользу диффузионного механизма. В то же время практики единодушно отмечают высокую частоту пульса после внутрикостных анестезий и связь с адреналином и дозой [6, 35].
В настоящей работе представлен анализ литературы, указывающий на сосудистое распределение анестетического раствора при спонгиозном введении, объясняющее их многочисленные особенности. Представляем следующие доказательства сосудистого характера спонгиозных инъекций. Многие из них уже упоминались в наших ранних работах [7, 9, 10, 30].
Представляем следующие доказательства сосудистого характера спонгиозных инъекций. Многие из них уже упоминались в наших ранних работах [7, 9, 10, 30].
1. Спонгиозная инъекция комбинации анестетика обязательно с эпинефрином содержит в себе как диффузный, так и сосудистый механизм распределения анестетического раствора в тканях. Диффузный элемент работает в первой фазе инъекции, переходя при дальнейшем введении в сосудистый. В сосудистой сети спонгиозного вещества кости создается депо анестетика. Депо «организует» эпинефрин, который при ретроградном распределении раствора по венам, капиллярам на уровне артериол прерывает их проходимость в артериальное русло через активацию α-адренорецепторов (рис. 1).
Рис 1. Создание депо анестетического раствора при спонгиозной анестезии.
2. Присутствие эпинефрина в анестетическом растворе — обязательное условие для спонгиозных (сосудистых) инъекций [26].
3. При классической инъекции депо местного анестетика формируется диффузионно вокруг кончика иглы. При этом наблюдается потеря эффективности к периферии по радиусу в геометрической прогрессии. При спонгиозных анестезиях сосудистое депо также связано с иглой. Но границы депо неопределенны, так как оно образовано сетью венозных сосудов и капилляров. Возможны зоны выпадения анестезии соседних с инъекцией зубов и, наоборот, обезболивание очень отдаленных. Этот феномен мы назвали эффектом мозаичности спонгиозной анестезии [5].
4. Депо спонгиозного распределения охватывает пародонт и пульпу — пульпо-пародонтальный комплекс, как правило, нескольких зубов (многозубность). В среднем внутрикостная анестезия блокирует 3,2 [17], интралигаментарная — 3,6 [6]; интрасептальная — 2,6 [2] зуба. Число блокированных зубов зависит от дозы анестетика.
5. Кривая эффект/время при спонгиозных анестезиях принципиально другая, чем при классических, например инфильтрационной (рис. 2). Суть различий в том, что все виды спонгиозной анестезии начинаются практически 1) сразу под иглой, 2) с максимальной глубиной и 3) резко заканчиваются. Закон «все или ничего».
Закон «все или ничего».
Рис. 2. Спонгиозная (внутрикостная) анестезия (непрерывная линия): быстрое наступление (40 с), максимальный эффект в первую минуту (суперэффект) и резкое окончание. Инфильтрация (прерывистая): плавное наступление и плавное окончание анестезии. Максимальный эффект через 10-15 мин [16].
Кривая эффект/время инфильтрационной анестезии начинается плавно и плавно заканчивается, не обязательно достигая максимальной величины болевого порога. Клиницисты высоко оценивают быстрое (почти под иглой) наступление анестезии и ее глубину при спонгиозной инъекции.
6. Доза всех спонгиозных анестезий (внутрикостной, интралигаментарной и интрасептальной) приблизительно в 2 раза меньше, чем инфильтрационной. Высокая эффективность их была представлена выше. Иначе говоря, коэффициент полезного действия спонгиозных анестезий значительно превышает традиционные инъекции.
7. Аспирация «+» при всех спонгиозных анестезиях отмечается приблизительно в 90% случаев [11]. При интралигаментарной и интрасептальной инъекции положительная аспирация наблюдалась в виде тонкой струйки с частотой 34/36/94,4% и 68/76/89,4% соответственно. При внутрикостной аспирации частота положительных аспираций наблюдалась в 68/76/89,4%.
8. Рентгеновское распределение контрастного вещества после внутрикостного и интрасептального введения на трупах демонстрирует его наличие как в сосудах, окружающих зуб, так и в самой пульпе (рис. 3).
Рис. 3. Распределение ртути на трупе (мужчина 55 лет) после интрасептальной инъекции между 3,4 и 3,3. Ртуть наблюдается в тонких сосудах спонгиозного вещества кости. В пульпе 3,4 также определяется тонкий сосудик [8].
9. Гистологическая картина после интрасептальной инъекции красителя (туши) на трупе более четко демонстрирует его венозное распределение в пульпе зуба, из-за хорошей сосудистой проходимости туши по сравнению со ртутью (рис. 3, 4). При спонгиозных инъекциях ртути и красителей они почти всегда находят путь к сосудам кости и пульпы.
Рис. 4. Распределение красителя (туши) в пульпе премоляра после интрасептальной анестезии на трупе женщины 36 лет [8].
Попадание анестетика в сосуд еще не означает развитие там эффекта. Для активации анестетика необходимо, чтобы он задержался там определенное время — не менее 40 с (для создания депо) [34].
10. Доказана с помощью фотоплетизмографии остановка кровотока в пульпе зуба после интралигаментарной инъекции лидокаина с эпинефрином на 15 мин [26].
11. Качественной особенностью спонгиозных анестезий в отличие от классических, например мандибулярной, является отсутствие выраженных парестезий тканей лица: губ, щек, языка, кожи лица.
12. У спонгиозных анестезий бактериемия наблюдалась в 50-97%, при инфильтрационной щечной анестезии — в 16% [33]. R. Walton, B. Abbott [38] уточняют, что бактериемия встречается при интралигаментарных инъекциях не чаще, чем при других стоматологических вмешательствах. Бактериемия при интралигаментарной анестезии сопоставима с частотой, наблюдаемой при удалении зубного камня и кюретаже десневых карманов. Она носит временный характер. Антисептическая обработка десневой борозды снижает бактериемию с 61 до 30% [23].
R. Heizmann, J. Gabka [25] не наблюдали бактериемии за более чем 10-летнее применение интралигаментарной анестезии в клинике. О том же за пятилетний период пишет W. Zugal [41]. Септичность инъекций является важной этической проблемой спонгиозных анестезий при учете их сосудистого механизма.
13. Сосудистое распределение эпинефрина при спонгиозных инъекциях — еще одна угроза развития системных осложнений. Анализ наших диссертационных работ по осложнениям: гипотензивным (обморок, коллапс) или гипертензивным (криз) при спонгиозных и классических анестезиях показывает, что реакции чуть чаще наблюдались при спонгиозных, чем классических инъекциях.
В литературе по дополнительным инъекционным технологиям отсутствуют данные о серьезных системных осложнениях, кроме очень ранней работы A. Boakes и соавт. [22], где проанализировано 12 докладов Комитета по Безопасности Лекарств (Англия) о тяжелых побочных реакциях применения дентальных анестетиков, содержащих норэпинефрин в концентрации 1:25 000. Интересно, что в 2 случаях из 12 реакции развились после проведения очень редкой в то время внутрикостной анестезии. У пациенток возникли мучительные головные боли сразу после внутрикостной инъекции в течение 4-5 мин. У одной из них имело место затемнение сознания, памяти, нарушение речи в течение нескольких дней.
Boakes и соавт. [22], где проанализировано 12 докладов Комитета по Безопасности Лекарств (Англия) о тяжелых побочных реакциях применения дентальных анестетиков, содержащих норэпинефрин в концентрации 1:25 000. Интересно, что в 2 случаях из 12 реакции развились после проведения очень редкой в то время внутрикостной анестезии. У пациенток возникли мучительные головные боли сразу после внутрикостной инъекции в течение 4-5 мин. У одной из них имело место затемнение сознания, памяти, нарушение речи в течение нескольких дней.
Мы также наблюдали 3 случая возникновения сильной и продолжительной головной боли после 205 проведенных интралигаментарных анестезий артикаином с эпинефрином.
Учитывая ведущий сосудистый компонент механизма спонгиозных анестезий;
— принимая во внимание эффективность и относительную их безопасность;
— учитывая универсальность применения, простоту выполнения и нарастающую распространенность в мире;
— традиционная классификация местной анестезии должна быть модифицирована. Суть модификации заключается в разделении всех методов на диффузионные и сосудисто-диффузионные:
Местная анестезия
Внутрикостная, интралигаментарная и интрасептальная анестезии могут быть объединены уже сложившимся термином «спонгиозная анестезия». Не теряет значения уже старый с нашей точки зрения термин «дополнительные методы». Общепризнано, что все эти методы являются внутрикостными. Но использование этого термина не этично: «Я сейчас Вам сделаю внутрикостную инъекцию». Кроме того, в списке спонгиозных анестезий будет дважды встречаться термин «внутрикостная». Классификация не исключает применения дополнительных терминов: Malamed (1997) [29] — supplemental, Noque (1907) — diploique, Villette и соавт. (2008) — diploique, osteocentral, trascortical, Malamed (1997) [29] — intraosseous, Marthaler (1968) — intraseptale, Рабинович (2000) [13] — пародонтальная, Петрикас (1987) [8] — спонгиозная, Поллак (1936) [12] — спонгиозная.
Кафедра обезболивания в стоматологии МГМСУ им. А. И. Евдокимова
01. Местные анестетики. Механизм действия. Показания к применению. Побочные эффекты. Симптомы передозировки. Влияние фармакокинетики на эффективность и безопасность местных анестетиков.
02. Классификация местных анестетиков по химической структуре.
03. Клинико-фармакологическая характеристика местных анестетиков группы сложных эфиров. Показания к применению. Побочные эффекты.
04. Клинико-фармакологическая характеристика местных анестетиков группы амидов. Показания и противопоказания к применению. Побочные эффекты.
05. Сравнительная характеристика местных анестетиков группы сложных эфиров и амидов.
06. Прокаин (новокаин). Показания к применению и побочные эффекты. Формы выпуска. Максимально допустимая доза для взрослых и детей.
07. Лидокаин. Показания к применению и побочные эффекты. Формы выпуска. Максимально допустимая доза для взрослых и детей.
08. Артикаин. Показания к применению и побочные эффекты. Формы выпуска. Максимально допустимая доза для взрослых и детей.
09. Мепивакаин. Показания к применению и побочные эффекты. Формы выпуска. Максимально допустимая доза для взрослых и детей.
10. Бупивакаин. Показания к применению и побочные эффекты. Форма выпуска. Максимально допустимая доза.
11. Ропивакаин. Показания к применению и побочные эффекты. Форма выпуска. Максимально допустимая доза.
12. Сравнительная характеристика артикаина, лидокаина, мепивакаина, бупивакаина, ропивакаина и прокаина (новокаина). Показания и противопоказания к применению. Побочные эффекты. Форма выпуска.
13. Вазоконстрикторы. Показания и противопоказания к применению местноанестезирующих препаратов, содержащих вазоконстрикторы.
14. Обоснование выбора концентрации вазоконстриктора в составе местнообезболивающего раствора в зависимости от степени болезненности предстоящего стоматологического вмешательства и наличия сопутствующей патологии у пациента.
15. Состав карпулы с местноанестезирующими препаратами. Роль консервантов и стабилизаторов, возможные побочные эффекты.
16. Классификация способов местного обезболивания.
17. Аппликационная анестезия. Показания к применению. Местноанестезирующие препараты, используемые для аппликационной анестезии. Формы выпуска.
18. Инфильтрационная анестезия. Показания и применению. Сравнительный анализ эффективности местнообезболивающих препаратов, используемых для инфильтрационной анестезии.
19. Анатомо-топографические особенности верхней челюсти, определяющие выбор способов местной анестезии.
20. Инфильтрационная анестезия на верхней челюсти. Показания и противопоказания к применению. Обоснование выбора местноанестезирующих препаратов.
21. Проводниковые способы анестезии на верхней челюсти. Показания к применению. Зоны обезболивания. Возможные осложнения и их профилактика.
22. Туберальная анестезия (внутриротовой способ и внеротовой способ по П.М. Егорову). Показания к применению, техника проведения, зона обезболивания. Возможные осложнения и их профилактика, диагностика, лечение.
23. Инфраорбитальная анестезия (внутриротовой и внеротовой способ). Показания, техника проведения, зона обезболивания. Возможные осложнения и их профилактика, диагностика, лечение.
24. Резцовая анестезия. Внутри и внеротовой доступ. Показания к применению, зона обезболивания, возможные осложнения и их профилактика.
25. Палатинальная анестезия. Показания к применению, техника проведения, зона обезболивания, возможные осложнения и их профилактика.
26. Анатомо-топографические особенности нижней челюсти, определяющие выбор способов местной анестезии.
27. Анестезия нижнего луночного нерва по П.М. Егорову. Внутри и внеротовые ориентиры. Показания к применению, техника проведения, зона обезболивания. Преимущества и недостатки.
28. Техника анестезии нижнечелюстного нерва по Гоу-Гейтсу. Техника проведения, зона обезболивания. Преимущества и недостатки.
Преимущества и недостатки.
29. Анестезия нижнего луночкового нерва при ограниченном открывании рта (по Вазирани-Акинози). Техника проведения, зона обезболивания. Преимущества и недостатки.
30. Торусальная анестезия. Внутриротовые и внеротовые ориентиры. Показания к применению. Осложнения.
31. Сравнительная характеристика различных методов анестезии нижнечелюстного нерва, преимущества и недостатки.
32. Анестезия подбородочного нерва (внутриротовой и внеротовой способ)). Показания, техника проведения, зона обезболивания. Возможные осложнения и их профилактика, диагностика, лечение.
33. Пародонтальные способы обезболивания. Классификация. Преимущества и недостатки. Показания и противопоказания к применению.
34. Интралигаментарная анестезия. Техника проведения, инструментальное обеспечение, зона обезболивания. Обоснование выбора местноанестезирующих препаратов. Показания и противопоказания к применению.
35. Интрасептальная анестезия. Техника проведения. Показания и противопоказания к проведению. Обоснование выбора местноанестезирующих препаратов.
36. Современные карпульные шприцы. Классификация. Методы стерилизации шприцов.
37. Аспирационная проба при проведении местной анестезии. Показания к проведению.
38. Основные характеристики инъекционных игл для местной анестезии. Утилизация игл.
39. Строение карпулы. Состав местноанестезирующего раствора.
40. Автоматизированные инъекторы. Преимущества их использования при проведении пародонтальных способов обезболивания.
Клинические особенности местного обезболивания в стоматологии детского возраста
А. В. Кузин
ассистент кафедры факультетской хирургической стоматологии ПМГМУ им. И. М. Сеченова, стоматолог-хирург детского отделения МАУ БСП
Врач, выбравший своим делом стоматологию детского возраста, способен повлиять на здоровье не только детей, но и нации в целом. Если с первых визитов к стоматологу у ребенка формируются положительные впечатления от лечения и доверительное отношение к врачу, отсутствует страх, он будет следить за здоровьем полости рта и своевременно обращаться за помощью в течение жизни.
Обезболивание при оказании стоматологической помощи пациентам детского возраста, безусловно, играет одну из важнейших ролей, однако представляет большую сложность для врача.
С одной стороны, устранение болевого синдрома необходимо для проведения лечения. С другой, местное обезболивание затруднительно у большинства детей в силу страха ребенка перед иглой, шприцем, чувством «онемения», «раздувания» тканей, болью во время инъекции. Правильно выбранная тактика местного обезболивания на основании рационального выбора фармакологического препарата, техники анестезии с применением новейших инструментов может быть верным шагом к достижению успеха в лечении.
Выбор местного анестетика строится на основе соматического статуса ребенка, возраста и веса. Местная анестезия показана детям старше 4 лет. У детей до 4 лет безопасность применения всех местных анестетиков остается неизученной (Зорян Е. В., Рабинович С. А., Матвеева Е. Г., 2009). Это не означает, что проводить местную анестезию у детей до 4 лет нельзя. Использовать местную анестезию можно, но только в оправданных случаях, когда возможный риск развития осложнений от непроведенного лечения превышает риск возникновения осложнений от применения местной анестезии (Кисельникова Л. П., Токарева А. В., 2008).
При использовании местной анестезии у детей до 4 лет следует информировать родителей о неизученном влиянии анестетика на здоровье ребенка, добросовестно вести медицинскую документацию. Предельно строго следует проводить расчет дозировки вводимого анестетика, в пересчете на массу тела ребенка. Данная проблема является широко обсуждаемой в медицинских научных кругах и, к сожалению, остается далекой от решения.
Выбор местного анестетика строится на основе соматического статуса ребенка, возраста и веса. Местная анестезия показана детям старше 4 лет.
С точки зрения безопасности применения на амбулаторном стоматологическом приеме детей рекомендованы и получили широкое распространение анестетики артикаинового ряда (Зорян Е. В., Рабинович С. А., Матвеева Е. Г., 2007; Рабинович С. А., Васильев Ю. Л., 2011). Это обусловлено рядом фармакологических свойств. Артикаин 4%-ный обладает относительно низкой жирорастворимостью по сравнению с лидокаином и мепивакаином и меньше проходит через гистогематические барьеры.
В., Рабинович С. А., Матвеева Е. Г., 2007; Рабинович С. А., Васильев Ю. Л., 2011). Это обусловлено рядом фармакологических свойств. Артикаин 4%-ный обладает относительно низкой жирорастворимостью по сравнению с лидокаином и мепивакаином и меньше проходит через гистогематические барьеры.
Метаболизм артикаина протекает значительно быстрее в сравнении с другими анестетиками. Так, период полувыведения (t1/2) артикаина — 20 минут, t1/2 лидокаина — 90 мин., t1/2 мепивакаина — 114 мин.
Другие анестетики амидного ряда: мепивакаин, лидокаин — являются анестетиками выбора в детской стоматологии по ряду причин. На территории РФ 2%-ный лидокаин не выпускается в карпулированной форме и использование его в детской практике ограничено возможностями устаревшей технологии: ампулы, пластиковый шприц, иглы большого размера и диаметра.
Мепивакаин 3%-ный не содержит консервантов и вазоконстикторов. Данный анестетик рекомендован к использованию при наличии у ребенка сопутствующей патологии и предназначен для проведения коротких по длительности вмешательств. У детей, больных бронхиальной астмой, для местной анестезии показано использование 3%-ного мепивакаина (без эпинефрина) (Зорян Е. В., Рабинович С. А., Матвеева Е. Г., 2008). Это обусловлено тем, что данный препарат не содержит сульфитов (стабилизатор эпинефрина), которые могут быть причиной возникновения приступа бронхоспазма.
Если врач собирается провести обезболивание у ребенка с избыточным весом, расчет дозировки вводимого анестетика проводится без учета жировой ткани.
Дети с патологиями сердечно-сосудистой системы, в том числе и с врожденными в стадии компенсации, относятся к группе риска развития осложнений. Применение вазоконстрикторов у этой категории больных относительно противопоказано. По возможности следует использовать анестетики без вазоконстриктора, к которым относится 3%-ный мепивакаин.
Выбор разведения вазоконстриктора зависит от предполагаемой длительности вмешательства и наличия у ребенка сопутствующей патологии. Как правило, длительность лечения ребенка не превышает 20—30 минут. Более длительное вмешательство негативно сказывается на психологии ребенка и его отношении к лечению зубов. В частности, нарастает усталость, снижается внимание, возникает потребность в двигательной активности. Все это нарушает сотрудничество между врачом и ребенком, которое порой достигается с большой сложностью.
Как правило, длительность лечения ребенка не превышает 20—30 минут. Более длительное вмешательство негативно сказывается на психологии ребенка и его отношении к лечению зубов. В частности, нарастает усталость, снижается внимание, возникает потребность в двигательной активности. Все это нарушает сотрудничество между врачом и ребенком, которое порой достигается с большой сложностью.
В большинстве случаев при лечении кариеса и его осложнений, удалении временных зубов нет необходимости в обеспечении длительного по времени обезболивания анестетиками с высоким содержанием эпинефрина (1:100000) (Рабинович С. А., Зорян Е. В., 2006).
Для проведения коротких по длительности вмешательств у детей с сопутствующей патологией показано использование анестетиков без вазоконстриктора.
После стоматологического лечения немаловажно предупредить родителей о том, что ребенок может травмировать ткани губ и щек, не чувствуя их после местной анестезии. Длительность периода «онемения» составляет в среднем 2 часа для анестетиков 1:200000 и 5—6 часов для анестетиков 1:100000. Естественно, длительный период «онемения» мягких тканей неблагоприятен и может привести к травме (ребенок, не чувствуя боли, кусает «онемевшие» ткани), которая в некоторых случаях может привести к обширным раневым дефектам и последующей деформации красной каймы губ.
Врач должен осознавать всю меру ответственности при использовании анестетиков 1:100000, которые обеспечивают неоправданно длительную анестезию. Обязательно при проведении анестезии у детей, особенно впервые, необходимо предупреждать родителей и беседовать с ребенком о возможности самотравмирования мягких тканей, «онемевших» от анестезии.
Анестетики с высоким разведением вазоконстриктора 1:100000
В детской практике используются только для проведения ряда хирургических вмешательств с целью гемостаза. Длительность обезболивания составляет 75 минут для пульпы зуба и 360 минут для мягких тканей.
К таким амбулаторным вмешательствам следует отнести операцию удаления ретинированного, сверхкомплектного зуба, апперкулэктомию, цистэктомию, пластику уздечек и преддверия полости рта, удаление новообразования. Применение анестетиков с высоким разведением эпинефрина при других видах стоматологических вмешательств неоправданно и несоизмеримо с объемом вмешательства.
Применение анестетиков с высоким разведением эпинефрина при других видах стоматологических вмешательств неоправданно и несоизмеримо с объемом вмешательства.
Анестетики с низким разведением вазоконстриктора 1:200000
Показаны для большинства амбулаторных вмешательств в стоматологии детского возраста. 4%-ный артикаин 1:200000 обеспечивает анестезию мягких тканей на протяжении180 минут и пульпы зуба 45 минут, что удовлетворяет протоколу большинства амбулаторных вмешательств.
В настоящее время в странах Европы появились анестетики на основе 4%-ного артикаина с эпинефрином 1:400000. Они обеспечивают анестезию пульпы зуба тканей на протяжении 20 минут и мягких тканей на протяжении 1 часа. Этот анестетик обеспечивает необходимую для врача длительность анестезии и короткий период «онемевших» тканей, что так важно для пациентов детского возраста. В настоящее время в РФ данные анестетики не сертифицированы, однако ведется работа по их внедрению в отечественную стоматологию.
Стоит также отметить, что между анестетиками с вазоконстрикторами 1:100000, 1:200000 и 1:400000 нет разницы в глубине анестезии и эффективности. Существует разница только в длительности местной анестезии пульпы зуба: 25, 45 и 75 минут соотв. Многие стоматологи ошибочно подразделяют анестетики на «сильные» (1:100000) и «слабые» (1:200000). Данное утверждение является заблуждением.
Для проведения коротких по длительности вмешательств у детей с сопутствующей патологией показано использование анестетиков без вазоконстриктора. Однако их использование не гарантирует полной безопасности и не снижает риска развития осложнений. Стоит отметить их некоторые фармакологические особенности. Вазоконстрикторы добавляются к раствору местного анестетика не только с целью увеличения длительности обезболивания, но и для снижения их токсичности. Дело в том, что все анестетики обладают сосудорасширяющим действием и подвергаются достаточно быстрой абсорбции в кровяное русло. Добавление вазоконстриктора замедляет абсорбцию анестетика и пролонгирует его действие. При использовании анестетика без вазоконстрикторов указанного эффекта не возникает. Анестетик форсировано поступает в кровь, что может привести к токсической реакции. Данное осложнение возможно при превышении допустимой дозировки, которая различна для анестетиков с вазоконстриктором и без него. Резюмируя, следует отметить, что анестетики без вазоконстриктора не оказывают влияние на деятельность сердечно-сосудистой системы, менее аллергенны, так как не содержат консервантов, однако в силу ускоренной абсорбции токсичны и безопасны в использовании только при соблюдении дозировки.
При использовании анестетика без вазоконстрикторов указанного эффекта не возникает. Анестетик форсировано поступает в кровь, что может привести к токсической реакции. Данное осложнение возможно при превышении допустимой дозировки, которая различна для анестетиков с вазоконстриктором и без него. Резюмируя, следует отметить, что анестетики без вазоконстриктора не оказывают влияние на деятельность сердечно-сосудистой системы, менее аллергенны, так как не содержат консервантов, однако в силу ускоренной абсорбции токсичны и безопасны в использовании только при соблюдении дозировки.
Анестетики без вазоконстриктора
Обеспечивают различную длительность обезболивания тканей зуба. В частности, 2%-ный лидокаин обеспечивает анестезию пульпы зуба в течение 5 минут, при этом скорость наступления анестезии составляет также 5 минут, что является неудовлетворительным для врача. Поэтому использование 2%-ного лидокаина без вазоконстриктора нецелесообразно для обезболивания зубов.
3%-ный мепивакаин в сравнении с другими анестетиками обладает менее выраженным сосудорасширяющим действием, что обусловливает возможность его применения без добавления вазоконстриктора. Анестетик обеспечивает обезболивание на протяжении 10—20 минут, при этом лечение необходимо проводить с 5-й по 20-ю минуту при проведении терапевтических вмешательств и с 10-й по 20-ю при операции удаления зуба.
Артикаин 4%-ный в настоящее время доступен на территории РФ. Данный анестетик является короткодействующим: обезболивание пульпы зуба на протяжении 6 минут, мягких тканей 45 минут. Его широкое использование в стоматологии детского возраста ограниченно из-за слишком короткого действия, которое не подходит для большинства вмешательств.
Дозировка
Во всех случаях местного обезболивания необходимо проводить расчет дозировки вводимого анестетика в пересчете на массу тела ребенка. Для препаратов артикаина с вазоконстриктором рекомендуемая дозировка составляет 5 мг на 1 кг веса. Перед проведением местного обезболивания вес ребенка уточняется у родителей.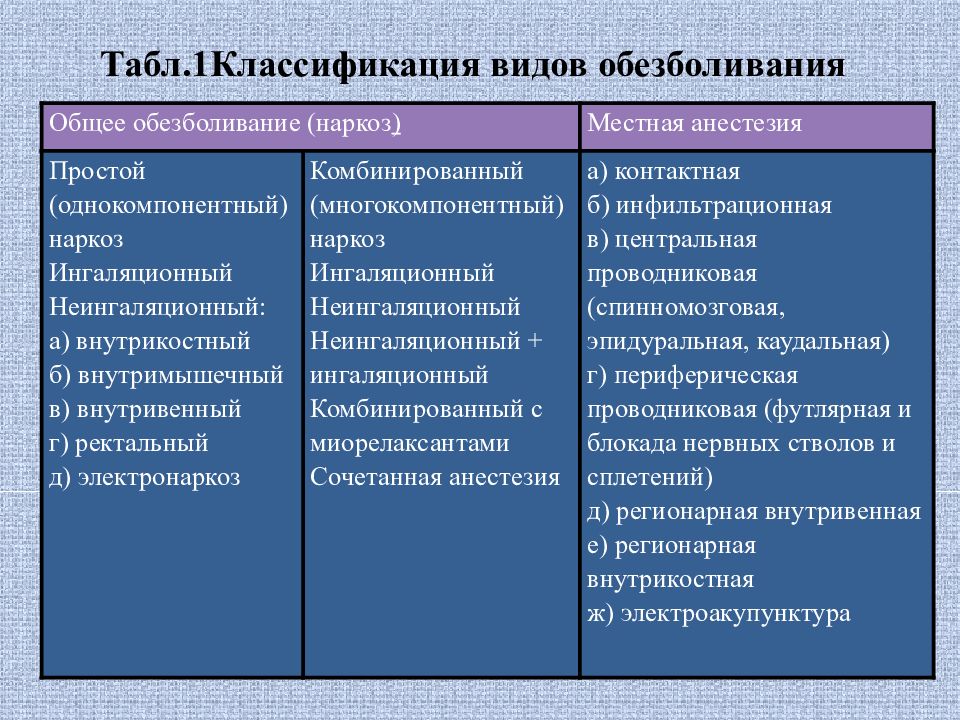 В клинической практике удобно использовать таблицу с весом и максимально допустимой дозой вводимого анестетика (табл. № 1, 2).
В клинической практике удобно использовать таблицу с весом и максимально допустимой дозой вводимого анестетика (табл. № 1, 2).
Таблица № 1
| ВЕС | МГ | МЛ | КАРПУЛЫ |
| 10 | 44 | 1.5 | 0.8 |
| 15 | 66 | 2.2 | 1.2 |
| 20 | 88 | 2.8 | 1.4 |
| 25 | 110 | 3.6 | 1.7 |
| 30 | 132 | 4.4 | 2.4 |
| 35 | 154 | 5.1 | 2.9 |
| 40 | 176 | 5.9 | 3.2 |
| 45 | 198 | 6.6 | 3.6 |
| 50 | 220 | 7.3 | 4.0 |
| Мепивакаин 3%-ный без вазоконстриктора. Максимальная доза 4.4 мг/кг. 3%-ный раствор в 1 карпуле 1.8 мл (54 мг). | |||
Таблица № 2
| ВЕС | МГ | МЛ | КАРПУЛЫ |
| 10 | 50 | 1.2 | 0.69 |
| 15 | 75 | 1.9 | 1.0 |
| 20 | 100 | 2.5 | 1.4 |
| 25 | 125 | 3.1 | 1.7 |
| 30 | 150 | 3.7 | 2.1 |
| 35 | 175 | 4.4 | 2.4 |
| 40 | 200 | 5.0 | 2.8 |
| 45 | 225 | 5.6 | 3.1 |
| 50 | 250 | 6.2 | 3.4 |
| Артикаин 4%-ный с вазоконстриктором.Максимальная доза 5 мг/кг. 3%-ный раствор в 1 карпуле 1.8 мл (72 мг). | |||
Довольно часто на амбулаторном стоматологическом приеме встречаются дети, страдающие ожирением, метаболическим синдромом, что во многом обусловлено изменением культуры питания населения. Дозировка вводимого анестетика в этих случаях имеет некоторые особенности. В частности, если врач собирается провести обезболивание у ребенка с избыточным весом, расчет дозировки вводимого анестетика проводится без учета жировой ткани.
Инъекционный инструментарий
Для проведения местного обезболивания у детей применяются карпульные шприцы различной конструкции. Отдать предпочтение следует инъекторам, предназначенным для проведения аспирационной пробы (Рабинович С. А., Васильев Ю. Л., Сохов С. Т., 2013; Тарасенко С. В., Кузин А. В., Беляева Е. А., Куртышов А. А., 2013). Местное инъекционное обезболивание у детей сопряжено с риском внутрисосудистого введения местного анестетика. Этот факт объясняется высокой степенью васкуляризации тканей челюстно-лицевой области детей. Так, частота внутрисосудистого введения анестетика при проведении мандибулярной анестезии у взрослых составляет 10—15 %, а у детей — 20—25 %. Наилучшими техническими характеристиками обладают шприцы с плунжером в виде якоря и штопора. Выбор инъекционной иглы зависит от метода обезболивания. Для проводниковых методов следует использовать иглы диаметром не менее 0.4 мм (27G). При проведении проводниковой анестезии иглы 0.3 мм (30G) излишне изгибаются в тканях (дефлекция), что приводит к депонированию анестетика в стороне от предполагаемой конечной точки обезболивания (Рабинович С. А., Васильев Ю. Л., 2011).
Иглы 0.3 мм (30G) целесообразно использовать для инфильтрационной анестезии и пародонтальных методов обезболивания.
Не стоит забывать, что при проведении местного обезболивания возможен отлом иглы. Данное осложнение, как правило, возникает при резком движении ребенка: отдергивании головы, резком закрывании рта. В большинстве случаев данные тяжелые осложнения возникают при использовании игл 30G при проведении мандибулярной анестезии у детей.
Бытует мнение, что чем тоньше игла, тем менее болезненно пациент воспринимает этап прокола слизистой и продвижения иглы в тканях. Это мнение можно отнести к разряду заблуждений. Существуют исследования, подтверждающие, что диаметр иглы не влияет на снижение степени болезненности проводимого обезболивания (Malamed S. F., 2002).
Особенности обезболивания временных зубов
Безусловно, выбор метода обезболивания зависит от планируемого вмешательства.
При лечении кариеса и пульпита временных зубов предпочтение отдается инфильтрационным методам, проводимым с вестибулярной (щечной/губной) стороны, при этом нет надобности в проведении язычной или небной анестезии. Это объясняется преобладанием в структуре челюстных костей губчатого вещества и большого количества питательных отверстий, облегчающих диффузию местного анестетика.
С целью снижения степени болезненности инъекции и повышения уровня комфорта для ребенка следует придерживаться следующих рекомендаций по проведению местного обезболивания:
- Необходима предварительная отвлекающая подготовительная беседа с ребенком, при которой врач использует термины, понятные для ребенка. При этом не произносятся слова «укол», «шприц», «анестезия», «удаление», «игла».
- Ребенок не должен видеть (сопровождать взглядом) инъекционный инструментарий. Все инструменты подаются ассистентом вне видимости ребенка.
- Следует проводить аппликационную анестезию, чтобы ребенок не чувствовал этапа прокола слизистой.
- Должно соблюдаться правило: «одна игла — один вкол». При случайном контакте иглы с костной тканью челюсти ее острие деформируется, как правило, происходит загиб в противоположную от скоса сторону. Повторная инъекция этой же «тупой» иглой в другом сегменте будет проходить с приложением давления, неприятного для ребенка.
- Вводить анестетик нужно медленно, 1 мл/мин. Форсированное введение анестетика приводит к гидродинамической травме тканей, что причиняет боль.
- Двухэтапное введение порции анестетика. При проведении инфильтрационной анестезии врач первоначально вводит небольшое количество анестетика ? 0.1 подслизисто, при этом визуально определяется зона инфильтрации тканей размером с просяное зерно. Далее врач беседует с ребенком на протяжении 2—3 минут.
- Последующее введение основной порции анестетика проходит безболезненно.
- Температура раствора анестетика должна быть близка к температуре тела ребенка. Для этого не следует хранить карпулы анестетика в холодильнике. Перед инъекцией врач может «согреть» карпулу в руке или в проточной горячей воде.
Объем вводимого анестетика для инфильтрационного обезболивания временных резцов и клыков составляет в среднем 0.3 мл, для обезболивания временных моляров используется 0.5—0.6 мл. Не следует проводить поднадкостничную анестезию, это причинит ребенку боль и не приведет к увеличению эффективности. Игла должна продвигаться подслизисто по направлению к верхушкам корней зубов. Не верхней челюсти при проведении инфильтрационной анестезии не следует проводить вколов иглы в область уздечки верхней губы, слизистых тяжей в области временных клыков. Эти зоны имеют разветвленную сеть нервов, обеспечивая гиперчувствительность в этих областях.
При проведении операции удаления временных зубов верхней челюсти с диагнозом «периодонтит» используют различные комбинации инфильтрационных методов. На верхней челюсти при удалении резцов и клыков используется инфильтрационная вестибулярная (0.5 мл) и резцовая анестезия (менее 0.2 мл). При этом классическую проводниковую анестезию с продвижением иглы в резцовый канал не проводят, а вводят некоторое количество анестетика сбоку от резцового сосочка, до появления признаков ишемии. По возможности следует избегать проведения болезненной резцовой анестезии, заменить которую можно аппликационной анестезией либо проводя вкол иглы в вестибулярный межзубной сосочек и затем продвигая ее к небной его стороне при непрерывной подаче анестетика.
Выбор разведения вазоконстриктора зависит от предполагаемой длительности вмешательства и наличия у ребенка сопутствующей патологии. Как правило, длительность лечения ребенка не превышает 20—30 минут
При обезболивании первых и вторых временных моляров используется инфильтрационная вестибулярная (0.5—0.6 мл) и небная (0.2 мл) анестезия. Небная анестезия может быть заменена вышеописанным доступом через межзубной сосочек. Для снижения степени болезненности инъекции местного анестетика в область твердого неба следует использовать предварительную аппликационную анестезию.
При удалении временных зубов нижней челюсти с диагнозом «периодонтит» используют комбинации проводниковых и инфильтрационных методов. При удалении резцов и клыков используется инфильтрационная вестибулярная (0.3 мл) и язычная (менее 0.2 мл) анестезия. Язычная инфильтрационная анестезия проводится в области перехода прикрепленной десны в подвижную слизистую дна полости рта. Анестетик вводят в подслизистый слой, продвижение иглы не проводится для профилактики внутрисосудистого введения. Можно провести обезболивание язычной слизистой путем проведения вкола иглы в межзубный сосочек с вестибулярной стороны и последующего ее продвижения к язычной слизистой.При удалении временных первых моляров нижней челюсти используют вышеописанную методику с той лишь разницей, что с вестибулярной стороны удаляемого зуба вводится 0.5 мл анестетика. При наличии локального воспаления необходимо провести проводниковую ментальную анестезию. При удалении вторых временных моляров нижней челюсти с диагнозом «периодонтит» проводят либо мандибулярную анестезию (1 мл), либо комбинацию ментальной анестезии (0.6 мл) и язычной инфильтрационной (0.2 мл).
В период физиологической смены прикуса удаление временных зубов по ортодонтическим показаниям имеет некоторые особенности. Самой распространенной ошибкой является удаление «подвижного» зуба под аппликационной анестезией. Глубина аппликационного обезболивания составляет 2—3 мм слизистой, а корни зуба могут быть резорбированы не полностью, и их удаление будет болезненным. Использовать аппликационную анестезию как самостоятельный метод можно только в том случае, если зуб фиксирован слизистой с одного края. В остальных случаях следует проводить инфильтрационную анестезию. Анестетик вводится до появления признаков ишемии десны, его объем минимален.
Особенности обезболивания постоянных зубов
Лечение постоянных зубов у детей, безусловно, требует обезболивания. Выбор метода обезболивания зависит в первую очередь от возраста ребенка и степени его развития. Сложности обезболивания, как правило, возникают при лечении моляров нижней челюсти, что обусловлено различной степенью развития кортикального слоя костей лицевого скелета. В большинстве случаев при лечении неосложненного кариеса постоянных зубов нижней челюсти у детей до 12 лет достаточно проведения инфильтрационного обезболивания. У детей старше 12 лет инфильтрационное обезболивание эффективно только в области резцов и премоляров.
Для лечения клыков нижней челюсти у детей старше 12 лет следует проводить мандибулярную анестезию либо ментальную анестезию, объем вводимого анестетика 0.6—1 мл. Для лечения первых моляров при коротких по длительности вмешательствах (15—20 минут) эффективно проведение инфильтрационной щечной анестезии, при этом объем вводимого анестетика составляет 0.6—1 мл. Инфильтрационное обезболивание вторых моляров нижней челюсти не так эффективно, в большинстве случаев полноценное обезболивание тканей пульпы возможно только с применением проводниковой мандибулярной анестезии.
Существуют некоторые особенности в проведении проводниковых методов обезболивания нижней челюсти. В первую очередь их проведение должно быть обосновано с точки зрения нозологии и выбранного врачом метода лечения. По возможности следует избегать проводниковых методов обезболивания и отдавать предпочтение более безопасным инфильтрационным методикам.
Существуют исследования, подтверждающие, что диаметр иглы не влияет на снижение степени болезненности проводимого обезболивания
Мандибулярная анестезия у детей разного возраста проводится по разным внутриротовым ориентирам. Это связано с различным положением нижнечелюстного отверстия по отношению к окклюзионной плоскости зубов.
У детей младше 6 лет нижнечелюстное отверстие находится ниже окклюзионной поверхности, поэтому вкол иглы проводится на уровне окклюзионной поверхности. Соответственно, у детей 6—10 лет вкол иглы проводится выше окклюзионной поверхности на 5 мм, и только у детей старше 10 лет мандибулярная анестезия проводится по аналогии с взрослыми. При проведении мандибулярной анестезии для снижения риска внутрисосудистого введения анестетика во всех случаях следует проводить аспирационную пробу. Вводить анестетик следует медленно.
Ментальная анестезия проводится с учетом периода развития зубочелюстной системы. По сравнению с взрослыми подбородочное отверстие у детей расположено значительно кпереди: у детей до 4 лет — в области временных клыков, у детей 4—6 лет — в области первого временного моляра.
Другие способы обезболивания. Помимо проводниковых и инфильтрационных способов обезболивания, ставших уже традиционными, пародонтальные и внутрикостные методики получают в настоящее время все большее распространение в стоматологии. Однако вопрос безопасности их применения остается открытым. В частности, при проведении интралигаментарной анестезии распространение анестетика проходит через губчатое вещество челюстных костей, достигая периапикальной области. Вазоконстриктор оказывает длительный сосудосуживающий эффект (Brannstrom M., Lindskog S., Nordenvall K. J., 1984; Tagger E., Tagger M., Sarnat H. 1994), безопасность которого не изучена для зубов в период их формирования.
Внутрикостная анестезия не показана к применению в стоматологии детского возраста. Существует опасность травмы зачатков зубов, негативного влияния вазоконстриктора на зоны роста периапикальных тканей. Также вибрация и шум внутрикостного инъектора могут напугать ребенка или, еще хуже, спровоцировать резкие движения, способные привести к травме вращающимися элементами. Автор не рекомендует проведение внутрикостной анестезии в детской практике, хотя в литературе встречаются исследования об их «высочайшей» эффективности у детей (Sixou J. L., Rogier M. E., 2006).
По возможности следует избегать проводниковых методов обезболивания и отдавать предпочтение более безопасным инфильтрационным методикам
Однако нельзя полностью отрицать вышеуказанные методы при лечении постоянных зубов со сформированными верхушками. В частности, высока эффективность интрасептальной, внутрикостной и интралигаментарной анестезии при лечении моляров нижней челюсти (Медведев Д. В., Петрикас А. Ж., Тазова О. Е., 2010; Петрикас А. Ж., Якупова Л. А., Медведев Д. В., 2010).
Данные методики можно использовать как самостоятельный метод обезболивания при коротких вмешательствах длительностью 15—20 минут. Также их можно использовать дополнительно при недостаточности первично проведенной анестезии: лечение острого пульпита моляров нижней челюсти (Анисимова Е. Н., Рабинович С. А., Бутаева Н. Т., 2013; Макеева И. М., Ерохин А. И., Кузин А. В., 2012), неправильный выбор анестетика, действие которого закончилось.
Заключение
Эффективность обезболивания в стоматологии детского возраста зависит не только от мануальных навыков врача, но и от его теоретической подготовки по фармакологии лекарственных средств, психологии работы с детьми. Если ранее в стоматологии детского возраста нередко использовался подход «лечить ребенка любой ценой в отведенное для него время», то сегодня современные тенденции к оказанию помощи детскому населению диктуют: «лечить безболезненно с повышенной степенью комфорта для ребенка и его родителей». Появление новых средств и способов обезболивания позволяет врачу достичь высокого профессионализма в работе с детьми.
Сведения об авторе/литератураКузин Андрей Викторович , к.м.н., ассистент кафедры факультетской хирургической стоматологии Первого МГМУ им. И. М. Сеченова, стоматолог-хирург детского отделения МАУ БСП
Kuzin A. V., Candidate of Medical Sciences, Assistant of the Department of Faculty Surgical Dentistry, First Moscow State Medical University. I.M.Sechenova, dentist-surgeon of the children’s department of MAU BSP
Clinical features of local anesthesia in pediatric dentistry
Аннотация. Эффективность обезболивания в стоматологии детского возраста зависит не только от мануальных навыков врача, но и от его теоретической подготовки по фармакологии лекарственных средств, психологии работы с детьми. Если ранее в стоматологии детского возраста нередко использовался подход «лечить ребенка любой ценой в отведенное для него время», то сегодня современные тенденции к оказанию помощи детскому населению диктуют: «лечить безболезненно с повышенной степенью комфорта для ребенка и его родителей». Появление новых средств и способов обезболивания позволяет врачу достичь высокого профессионализма в работе с детьми.
Annotation. The effectiveness of pain relief in pediatric dentistry depends not only on the doctor’s manual skills, but also on his theoretical training in the pharmacology of medicines, the psychology of working with children. If earlier in pediatric dentistry the approach “to treat a child at any cost in the allotted time” was often used, today modern trends in rendering assistance to the child population dictate: “to treat painlessly with an increased degree of comfort for the child and his parents”. The emergence of new means and methods of pain relief allows the doctor to achieve high professionalism in working with children.
Ключевые слова: анестетики; обезболивание; детская стоматология.
Key words: anesthetics; anesthesia; children’s dentistry.
Литература
- Анисимова Е. Н., Рабинович С. А., Бутаева Н. Т., Букенгольц А. А., Олейникова Е. В., Айрапетян С. М. Повышение эффективности и безопасности обезболивания при лечении моляров нижней челюсти. Институт стоматологии. — 2013. — № 58. — С. 62—64.
- Зорян Е. В., Рабинович С. А., Матвеева Е. Г. Алгоритм выбора местноанестезирующих препаратов, проблемы и решения. Клиническая стоматология. 2008. — № 1. – С. 18—22.
- Зорян Е. В., Рабинович С. А., Матвеева Е. Г. Значение учета клинико-фармакологических особенностей местных анестетиков в стоматологии детского возраста. 2009/1: 70—71.
- Зорян Е. В., Рабинович С. А., Матвеева Е. Г. Ошибки и осложнения при проведении местной анестезии в стоматологии. (Проблемы и решения). Часть I. — Практическое руководство для врачей-стоматологов. — М. : МГМСУ, 2007. — 90 с.
- Кисельникова Л. П., Токарева А. В. Стоматологическая помощь детям раннего возраста в условиях общего обезболивания. Стоматология детского возраста. — 2008, № 1. — С. 33—30.
- Макеева И. М., Ерохин А. И., Кузин А. В., Воронкова В. В. Сравнительная оценка дополнительных местных методов обезболивания при остром пульпите. Маэстро стоматологии. — 2012, № 2. — С. 63—67.
- Медведев Д. В., Петрикас А. Ж., Тазова О. Е. Влияние различных обезболивающих препаратов на эффективность интралигаментарной анестезии. Клиническая стоматология. — 2010, № 4.
- Петрикас А. Ж., Якупова Л. А., Медведев Д. В., Бородина О. Е.,Егорова В. А., Дюбайло М. В. Сосудистые дентальные анестезии и их механизм. Стоматология. — 2010, № 1.
- Рабинович С. А., Васильев Ю. Л. Анатомо-топографические и инструментальные аспекты местного обезболивания в стоматологии. — М., 2011.
- Рабинович С. А., Васильев Ю. Л., Сохов С. Т. Эволюция медицинского шприца: от волынки до цифровых технологий. — М., 2013.
- Рабинович С. А., Зорян Е. В. Вазоконстрикторы в составе местноанестезирующих препаратов — значение и проблемы. Клиническая стоматология. — 2006, № 3. — С. 24—26.
- Тарасенко С. В., Кузин А. В., Беляева Е. А., Куртышов А. А. Профилактика внутрисосудистого введения анестетика с использованием аспирационной пробы при проведении анестезии нижнего луночкового нерва. Институт стоматологии. — 2013, № 1.
- American Academy of Pediatric Dentistry/ Guideline on Use of Local Anesthesia for Pediatric Dental Patients. REFERENCE MANUAL V 33 / NO 6 11 / 12: 174—180.
- Brannstrom M, Lindskog S, Nordenvall KJ. Enamel hypoplasia in permanent teeth induced by periodontal ligament anesthesia of primary teeth. JADA 1984;109:735—6
- Malamed S. F. Handbook of local anesthesia. 5th ed. St. Louis: Mosby; 2002.
- Movahhed T., Makerem A., Imanimoghaddam M., Anbiaee N., Sarrafshirazi A. R., Shakeri M. T. Locating the mandibular foramen relative to the occlusal plane using panoramic radiography Journal of Applied Scinces, 2011.
- Sixou J. L., Rogier M. E. Benefits of transcortical anesthesia in children and adolescents Le Chirurgien—Dentiste de France N° 1252 — 6 APRIL 2006.
- Tagger E, Tagger M, Sarnat H, Mass E. Periodontal ligament injection in the dog primary dentition: spread of local anesthetic solution. Int J Paediatr Dent 1994;4(3):159—66.
Меняем алгоритм: аллергические реакции на местные анестетики у детей
Д. Перони (Diego Peroni)
Педиатрическое подразделение отделения клинической и экспериментальной медицины, Университет Пизы, Пиза, Италия
М. Пасини (Marko Pasini)
Стоматологическая клиника отделения хирургии, интенсивной терапии, медицинской и молекулярной патологии, Университет Пизы, Пиза, Италия
К. Юрато (Chiara Iurato)
Педиатрическое подразделение отделения клинической и экспериментальной медицины, Университет Пизы, Пиза, Италия
С. Каппелли (Stefano Cappelli)
Педиатрическое подразделение отделения клинической и экспериментальной медицины, Университет Пизы, Пиза, Италия
Д. Джиюка (Giacomo Giuca)
Стоматологическая клиника отделения хирургии, интенсивной терапии, медицинской и молекулярной патологии, Университет Пизы, Пиза, Италия
М. Р. Джиюка (Maria Rita Giuca)
Стоматологическая клиника отделения хирургии, интенсивной терапии, медицинской и молекулярной патологии, Университет Пизы, Пиза, Италия
Местные анестетики (МА) блокируют нервную проводимость и обычно используются для местной или региональной анестезии во время стоматологических, хирургических, акушерских и офтальмологических процедур [12, 27, 31]. Частота аллергических реакций на МА у детей, как правило, завышена [17]. Действительно, в литературе нежелательные реакции регистрируются при 0,1-1% процедур, в которых используется МА, и менее 1% всех побочных реакций обусловлены аллергическими механизмами [4, 15].
Классификация местных анестетиков
Молекулы МA содержат липофильное ароматическое кольцо, связанное с гидрофильной аминной группой цепью, которая используется для классификации агентов как сложных эфиров или амидов. Они обеспечивают полное, но временное обезболивание в результате их взаимодействия с Na-каналами. Сложные эфиры подвергаются метаболизму плазменной псевдохолинэстеразой, а амиды — микросомальными ферментами печени [9, 24].
Повышенная чувствительность к местным анестетикам
Реакции гиперчувствительности являются дозозависимыми, непредсказуемыми побочными явлениями при введении дозы, хорошо переносимой большинством детей [13]. Лекарственная аллергия может быть диагностирована только в ситуациях, когда может быть выявлен основной иммунный механизм в развитии реакций гиперчувствительности. Во всех остальных случаях следует учитывать неаллергические реакции гиперчувствительности [16]. Из-за их низкой молекулярной массы МA являются слабыми антигенами, по этой причине аллергические реакции следует считать необычными. Однако могут возникать два типа аллергических реакций: IgE-опосредованные реакции I типа или Т-клеточные опосредованные реакции IV типа.
Ближайшие события
Немедленные аллергические реакции (реакции типа I) редки и обычно возникают в течение 6 часов (редко 6-12 часов, но не более 24 часов) после введения. Клинические проявления немедленных аллергических реакций включают: крапивницу, ангионевротический отек, бронхоспазм, ринит, конъюнктивит, желудочно-кишечные симптомы и анафилаксию, включая анафилактический шок. Среди аллергических реакций на местную анестезию наиболее частыми являются замедленные кожные реакции IV типа, такие как экзема. Замедленные реакции обычно возникают в течение 24-72 часов после ввведения (редко через 6 часов) [7].
Оба типа аллергических реакций наиболее часто встречаются при воздействии сложных эфирных соединений. Парааминобензойная кислота (ПАБК) — метаболит сложных эфиров, отвечает за их аллергенный потенциал. Метилпарабен и пропилпарабен являются консервантами, используемыми как в сложных эфирах, так и в амидах, их метаболиты химически сходны по структуре с ПАБК [14]. Как следствие, аллергия на метилпарабен составляет значительную долю побочных реакций на МА. Амиды обладают более низким аллергенным потенциалом, чем сложные эфиры, поэтому они предпочтительны в клинической практике.
Перекрестные реактивы являются общими между молекулами сложноэфирной и амидной групп, в то время как перекрестная реактивность между ними не должна происходить, потому что их метаболиты различны. Тем не менее, были описаны некоторые случаи аллергических реакций, как на сложные эфиры, так и на амиды [10].
Дифференциальная диагностика аллергии
Большинство побочных реакций, которые могут наблюдаться во время процедур местной анестезии, не являются аллергическими. Однако, используя МA, детские стоматологи должны предвидеть возможные последствия, для того чтобы предопределить аллергические реакции. Наиболее серьезным побочным действием МА является их системная токсичность, которая в первую очередь затрагивает центральную нервную и сердечно-сосудистую системы [19]. Системная токсичность может проявиться после массивной резорбции большой дозы МА или после непреднамеренного внутрисосудистого введения. Первыми признаками являются субъективные неврологические симптомы (парестезии, головокружение, нарушения слуха и зрения), за которыми следуют тяжелые симптомы со стороны центральной нервной системы, такие как судороги и кома. Эти проявления являются предшественниками сердечно-сосудистых симптомов, которые включают гипотензию, брадикардию и, в крайних случаях, желудочковую аритмию и асистолию [29]. МA могут также оказать местное токсическое действие, которое обычно обусловлено неправильной техникой введения. Симптомы включают боль, синяки, инфекции и гематому [6]. Во время небольших хирургических вмешательств у детей и подростков также могут наблюдаться вегетативные реакции, характеризующиеся такими симптомами, как вазовагальный синкопе (бледность, брадикардия), паническая атака или спазмофилический криз с гипервентиляцией. Также могут возникать тахикардия и сердечные аритмии, обусловленные добавлением адреналина для снижения скорости резорбции МА [19]. Гиперчувствительность или аллергические реакции могут быть вызваны латексными перчатками или антибиотиками, назначенными для профилактики послеоперационных инфекций; как уже было сказано, консерванты, такие как парабен или метилпарабен, и добавки, присутствующие в растворе анестетика, тоже могут вызывать аллергические реакции [14].
Распространенность аллергий на местные анестетики среди детей
Отмеченная частота аллергических реакций на МА в педиатрической популяции является низкой, и составляет менее 1% от всех побочных реакций, связанных с МА [20].
Что касается IgE-опосредованной аллергии, то в 2012 году Bhole с соавт. пересмотрели литературу с 1975 по 2011 год и обнаружили 23 серии случаев, в которых участвовали 2978 пациентов с подозрением на аллергию на МA. Только у 29 из 2978 пациентов была доказана IgE-опосредованная аллергия, что означает распространенность 0,97% среди пациентов, проверенных на аллергию. Для определения реакции как IgE-опосредованной использовались пробы уколом (prick-тест), внутрикожные пробы (ВП) и подкожное введение. 2487 из 2978 пациентов (83,5%) были протестированы с помощью пробы уколом — 30 были положительными (1,2%). 2648 (89%) тестировались с помощью ВП — 37 были положительными (1,4%). Подкожное введение было выполнено у 2560 пациентов (86%) и была положительной у 19 (0,74%). В этих 23 сериях случаев были испытаны 2858 амидных и 129 сложноэфирных соединений. 22 из 2858 (0,77%) испытанных амидов и 7 из 120 (5,8%) эфиров были определены как аллергические агенты.
Побочные реакции после введения МА часто описываются как «аллергия». Однако, по оценкам, менее чем в 1% случаев подтверждаются аллергии на МА у детей [1]. Sulcuk с соавт. [1996] заявил, что безопасность агентов МA высока, но побочные реакции встречаются.
Ранее сообщалось, что частота побочных реакции может быть снижена, если инъекции вводятся осторожно [26]. Большинство побочных реакций являются психогенными или вазовагальными. Стоматологи должны быть осведомлены об этих фактах, чтобы свести к минимуму частые страхи и мифы, касающиеся использования МA стоматологической практике [2].
Управление гиперчувствительностью к местным анестетиками
Диагностика побочных реакций во время местной анестезии может быть осложнена. При наличии сходных симптомов с аллергией на МА рекомендуется использовать термин «гиперчувствительность к МА» до полного понимания этиологии [16].
Сотрудничество между аллергологами и стоматологами или другими специалистами, которые используют эти препараты в повседневной практике (дерматологи), имеет решающее значение. Точный алгоритм был предложен, и ему необходимо следовать для правильной диагностики. История болезни должна быть полной [8]. Возможная неправильная классификация, основанная только на клиническом анамнезе, может иметь негативные последствия для будущего терапевтического выбора. Если анамнез предполагает гиперчувствительность к МА, то больного следует направить к аллергологу [13].
Ретроспективная оценка симптомов, основанная только на анамнезе пациента, может быть отягощена субъективной ошибкой, обусловленной чувством страха у пациента или его родителей, и временем, прошедшим с момента конкретного события. Чтобы свести к минимуму эту возможную предвзятость Европейским сообществом по лекарственной аллергии (ENDA) была предложена анкета [5].
Элементы анамнеза, которые свидетельствуют о необходимости направить пациента к аллергологу:
- симптомы схожие с аллергической реакцией;
- сроки появления симптомов (связь между контактом с препаратом и появлением симптомов).
Не требуется аллергологическая оценка в следующих случаях:
- при отсутствии связи между введением препарата и реакцией;
- у атопических пациентов без истории болезни с указанием аллергии на МA, потому что атопия сама по себе не является предрасполагающим состоянием.
Альтернативный диагноз должен всегда приниматься во внимание. Например, инфекции (особенно вирусные) у детей могут вызывать симптомы, которые ошибочно можно отнести к аллергическим реакциям (сыпь, крапивница, ангионевротический отек и др).
Оценка состояния пациента должна также включать толерантность к контактным агентам, используемым во время инвазивной процедуры. Фактически, аллергические реакции могут быть вызваны другими агентами: латексом (перчатки), никелем, лекарственными наполнителями (парабены, сульфиты, адреналин) [16].
Клинические инструменты для постановки определенного диагноза аллергии на МA: стандартизированные кожные тесты (in vivo) и тесты на лекарственные препараты. Для достоверности результата специфическое аллергологическое исследование должно проводиться через 4-6 недель после полного исчезновения всех клинических симптомов и признаков. С другой стороны, через 6-12 месяцев некоторые тесты могут оказаться отрицательными.
Несмотря на то, что эти тесты легко и быстро провести, важно, чтобы стандартизированные кожные тесты выполнялись в соответствии со стандартизированной методологией обученным персоналом. Их отрицательные результаты имеют значительную прогностическую ценность до 97%. Для выполнения тестов используются коммерчески доступные препараты, они не содержат адреналина или других добавок, таких как сульфиты или парабены [18]. Может быть использован либо конкретный препарат, который предположительно является причиной реакции, либо другой, чтобы проверить его переносимость.
При диагностике аллергической гиперчувствительности к МA рекомендуются пробы уколом и внутрикожные пробы (ВП). Пробы уколом имеют более высокую специфичность, но более низкую чувствительность, чем ВП. Однако, они связаны с самым низким риском анафилаксии во время процедуры. Для гарантии достоверности теста необходимо минимизировать возможные сопутствующие факторы, такие как недавние инфекции или введенные вещества (препараты).
Пациенты с отрицательными пробами уколом проходят ВП. ВП проводят на предплечье, вдали от места проведения пробы уколом. ВП более чувствительны и воспроизводимы, однако, имеют более низкую специфичность и связаны с более высоким риском побочных реакций. Рекомендуется проводить тест с постепенно возрастающей концентрацией (1:1000, 1:100, 1:10, неразбавленный). Пациенты с отрицательным ВП должны пройти провокационный тест. Патч-тесты проводятся с неразбавленными препаратами. Они позволяют диагностировать клеточно-опосредованную гиперчувствительность, и полезны при диагностике контактной аллергии на МА.
Золотым стандартом для установления диагноза аллергии МA является провокационный тест [3]. Провокационных тестов следует избегать:
- если внутрикожные пробы положительны;
- в случае риска развития опасных для жизни реакций;
- в случае сопутствующих тяжелых заболеваний и при беременности.
Провокационный тест должен проводиться в условиях больницы, оборудованной для вмешательства в случае серьезных реакций. Родители должны быть подробно проинформированы о цели теста и связанного с ним риска, а также о самой процедуре.
Существуют различные протоколы введения лекарственных средств, начиная с очень низких доз, которые постепенно увеличиваются при отсутствии реакций. В случае реакции, испытание необходимо прервать. Тест может быть выполнен слепым: начинают с подкожного введения Салина. Затем подкожно вводят 0,1, 0,2, 0,5, 1 и 2 мл неразбавленного МА (без адреналина). Инъекции проводят в область предплечья с интервалом времени 30 минут [25].
Основываясь на другом протоколе, тест может быть выполнен путем первоначального введения 0,1 мл неразбавленного раствора МA подкожно в верхнюю часть руки. Место инъекции исследуют через 15 минут путем сравнения его с местом инъекции контрольного раствора. Если реакция на 0,1 мл отрицательна, тест продолжается с инъекциями более высоких концентраций препарата в верхнюю часть руки в другом месте (0,5 мл и через 15 минут 1 мл) [21].
Другой тест может быть выполнен путем инъекции 0,1 мл 1:10 разбавленного раствора MA подкожно в верхнюю часть руки. Тест продолжается подкожными инъекциями неразбавленного анестетика в возрастающих дозах с интервалом 15 минут при отсутствии реакций (0,1 мл, 1 мл и 2 мл) [Chiriac and Demoly, 2013].
По всем правилам, провокационный тест считается последним этапом диагностической процедуры после отрицательных внутрикожных проб. Однако, согласно клиническому анамнезу, следует также рассмотреть провокационный тест с альтернативным препаратом без внутрикожных тестов; в этом случае необходим протокол, который включает подкожное введение неразбавленного МA в дозах от 0,5 мл до 1 мл. Отсутствие реакций в течение 30 минут после инъекции считается отрицательным результатом [22]. Если в конце диагностической процедуры не наблюдалось ни немедленных, ни поздних реакций, у пациента отсутствует более высокий риск немедленных аллергических реакций на МА, чем у общей популяции.
Вывод
Риск развития аллергии на МА у детей завышен. Для подтверждения или исключения диагноза аллергии необходима диагностическая процедура, включающая полный анамнез, объективные медицинские записи, внутрикожные пробы и провокационный тест. Перед отрицательными внутрикожными тестами следует выполнить подкожную пробу с определенным МA. И наоборот, пациенты с положительными внутрикожными тестами должны пройти новый тест с другим МА, чтобы найти альтернативный препарат, который можно использовать. Такой подход позволит свести к минимуму количество детей, которым ошибочно отказано в использовании местных анестетиков в стоматологии.
Источник: www.ejpd.eu
Сведения об авторах/Литература- Allen G, Chan D, Gue S. Investigation and diagnosis of an immediate allergy to amide local anaesthetic in a paediatric dental patient. Aust Dent J 2017 Jun;62(2):241-45.
- Baluga JC, Casamayou R, Carozzi E, López N, Anale R, Borges R, et al. Allergy to local anaesthetics in dentistry. Myth or reality? Allergol Immunopathol (Madr) 2002 Jan-Feb;30(1):14-9.
- Bernstein IL, Li JT, Bernstein DI, Hamilton R, Spector SL, Tan R, et al. American Academy of Allergy, Asthma and Immunology; American College of Allergy, Asthma and Immunology. Allergy diagnostic testing: an updated practice parameter. Ann Allergy Asthma Immunol 2008 Mar;100(3 Suppl 3):S1-148.
- Bhole MV, Manson AL, Seneviratne SL, Misbah SA. IgE-mediated allergy to local anaesthetics: separating fact from perception: a UK perspective. Br J Anaesth 2012;108:903-11.
- Bousquet PJ, Demoly P, Romano A, Aberer W, Bircher A, Blanca M, et al. Global Allergy, Asthma European Network (GALEN) and Drug Allergy and Hypersensitivity Database (DAHD) and the European Network for Drug Allergy (ENDA)– Pharmacovigilance of drug allergy and hypersensitivity using the ENDA-DAHD database and the GALEN platform. The Galenda project. Allergy 2009; 64(2):194-203.
- Boyce RA, Kirpalani T, Mohan N. Updates of Topical and Local Anesthesia Agents. Dent Clin North Am 2016 Apr;60(2):445-71.
- Brockow K, Przybilla B, Aberer W, Bircher AJ, Brehler R, Dickel H. Guideline for the diagnosis of drug hypersensitivity reactions. Allergo J Int 2015;24:94-105.
- Bücher K, Rothmaier K, Hickel R, Heinrich-Weltzien R, Kühnisch J. The need for repeated dental care under general anaesthesia in children. Eur J Paediatric Dent 2016;17(2):129-35.
- Campanella V, Libonati A, Nardi R, Angotti V, Gallusi G, Montemurro E, et al. Single tooth anesthesia versus conventional anesthesia: a cross-over study. Clin Oral Investig 2018 Mar 10. [Epub ahead of print]
- Caron AB.Allergy to multiple local anesthetics. Allergy Asthma Proc 2007:28:600-01.
- Chiriac AM, Demoly P. Drug provocation tests: up-date and novel approaches. Allergy Asthma Clin Immunol 2013 Apr 3;9(1):12.
- Cianetti S, Lombardo G, Lupatelli E, Pagano S, Abraha I, Montedori A, et al. Dental fear/anxiety among children and adolescents. A systematic review. Eur J Paediatric Dent 2017;18(2):121-30.
- Demoly P, Adkinson NF, Brockow K, Castells M, Chiriac AM, Greenberger PA. International consensus on drug allergy. Allergy 2014 Apr;69(4):420-37.
- Enggleston ST, Lush LW. Understanding allergic reactions to local anesthetics. Ann Pharmacother 1996:30:851-57.
- Gall H, Kaufmann R, Kalveram CM. Adverse reactions to local anesthetics: analysis of 197 cases. J Allergy Clin Immunol 1996;9:933-7.
- Grzanka A, Wasilewska I, Śliwczyńska M, Misiołek H. Hypersensitivity lo local anesthetics. Anaesthesiol Intensive Ther 2016;48(2):128-34.
- Lee SH, Lee NY. An alternative local anaesthesia technique to reduce pain in paediatric patients during needle insertion. Eur J Paediatr Dent 2013;14(2):109-12.
- Macy E, Schatz M, Zeiger RS Immediate hypersensitivity to methylparaben causing false-positive results of local anesthetic skin testing or provocative dose testing. Permanente J 2002;6:17–21.
- Malinovsky JM, Chiriac AM, Tacquard C, Mertes PM, Demoly P. Allergy to local anesthetics: Reality or myth? Presse Med 2016;45:753-7.
- Matsumura T, Miyamoto T, Fukayama H. Suspected Local Anesthetic Allergy of a Child: A Case Report. Pediatr Dent Care 2017;2:139.
- McClimon B, Rank M, Li J. The predictive value of skin testing in the diagnosis of local anaesthetic allergy. Allergy Asthma Proc 2011;32:95−8.
- Mertes PM, Malinovsky JM, Jouffroy L. Working Group of the SFAR and SFA, Aberer W, Terreehorst I et al. Reducing the risk of anaphylaxis during anesthesia: 2011 updated guidelines for clinical practice. J Investig Allergol Clin Immunol 2011;21(6):442-53.
- Morais-Almeida M, Gaspar A, Marinho S, Rosado-Pinto J. Allergy to local anesthetics of the amide group with tolerance to procaine. Allergy 2003:58:827-8.
- Nastasio S, Sciveres M, Maggiore G. The best choice for second-line agent in standard treatment-refractory children with autoimmune hepatitis. J Pediatr Gastroenterol Nutr 2018 Mar;66(3):e86-7.
- Ring J, Franz R, Brockow K. Anaphylactic reactions to local anesthetics. Chem Immunol Allergy 2010;95:190-200.
- Rood JP. Adverse reaction to dental local anaesthetic injection—‘allergy’ is not the cause. Br Dent J 2000 Oct 14;189(7):380-4.
- Salomon E, Mazzoleni S, Sivolella S, Cocilovo F, Gregori D, Giuca MR et al. Age limit for infiltration anaesthesia for the conservative treatment of mandibular first molars. A clinical study on a paediatric population. Eur J Paediatric Dent 2012;13(3)Suppl:259-62.
- Selcuk E, Ertürk S, Afrashi A. An adverse reaction to local anaesthesia: report of a case. Dent Update 1996 Oct;23(8):345-6.
- Shapira J, Rubinow A. Evaluation and management of hypersensitivity to local anesthetics in pediatric dentistry. Anesth Prog 1987 Sep-Oct;34(5):191-4.
- Thyssen JP, Menné T, Elberling J, Plaschke P, Johansen JD. Hypersensitivity to local anaesthetics-update and proposal of evaluation algorithm. Contact Dermatitis 2008;59:69-78.
- Yilmaz Y, Eyuboglu O, Keles S. Comparison of the efficacy of articaine and prilocaine local anaesthesia for pulpotomy of maxillary and mandibular primary molars Eur J Paediatric Dent 2011;12(2):117-
Диего Перони, Детское подразделение отделения клинической и экспериментальной медицины, Университет Пизы, Пиза, Италия
D. Peroni, University of Pisa, Department of Clinical and Experimental Medicine, Paediatric Unit, Pisa, Italy
Марко Пасини, Стоматологическая клиника отделения хирургии, интенсивной терапии, медицинской и молекулярной патологии, Университет Пизы, Пиза, Италия
M. Pasini, University of Pisa, Department of Surgical, Medical and Molecular Pathology and Critical Care, Dental Clinic, Pisa, Italy
Кьяра Юрато, Детское подразделение отделения клинической и экспериментальной медицины, Университет Пизы, Пиза, Италия
C. Iurato, University of Pisa, Department of Clinical and Experimental Medicine, Paediatric Unit, Pisa, Italy
Стефано Каппелли, Детское подразделение отделения клинической и экспериментальной медицины, Университет Пизы, Пиза, Италия
S. Cappelli, University of Pisa, Department of Clinical and Experimental Medicine, Paediatric Unit, Pisa, Italy
Аннотация. Целью настоящего обзора явилась оценка аллергических проявлений на стоматологические местные анестетики (МА) у детей и предложение алгоритма диагностики аллергии на МА с целью минимизации числа детей, ошибочно отнесенных к категории аллергиков. Проведено комплексное обследование литературы по аллергии на МА у детей перед стоматологическим лечением. При разработке диагностического алгоритма данные из литературы были интегрированы с личным опытом.
Данные литературы показали, что в целом менее 1% молодых пациентов с подозрением на МА имеют положительные пробу и диагноз. Полная диагностическая процедура должна включать: клинический анамнез, объективные медицинские записи, результаты кожных тестов и провокационный тест с подозрением на препарат. Пациенты с отрицательными внутрикожными тестами должны выполнять подкожную пробу, в то время как пациенты с положительным внутрикожным тестом должны быть протестированы на другой неродственный МA. Аллергия на МА является редким заболеванием. Полный диагностический алгоритм позволит правильно идентифицировать проблему.
Annotation. The purpose of this review was to evaluate allergic manifestations to dental local anaesthetic (LA) in children and to propose an algorithm for the diagnosis of LA allergy, in order to minimise the number of children who are wrongly categorised as allergic. A comprehensive literature survey was performed on LA allergy in children before a dental treatment. In proposing a diagnostic algorithm, evidences from literature have been integrated with personal experience.
Data from literature showed that overall less than 1% of young patients tested for suspected LA have a positive subcutaneous test and have a positive diagnosis. A complete diagnostic procedure should include: clinical history reported by patients, objective medical records, results of skin tests and provocation test with the suspected drug. Patients with negative skin tests should perform a subcutaneous challenge, while patients with a positive skin test should be tested for a different unrelated LA. Allergy to LA is a rare condition. A complete diagnostic algorithm will allow to identify paediatric patients correctly.
Ключевые слова: Аллергия, диагностика, местная анестезия.
Кeyword: Allergy; Diagnosis; Local Anesthetic.
Список литературы
Алгоритм выбора местноанестезирующего препарата для пациентов различных групп риска
Научные руководители: асс., к.м.н. Петрова А.П., асс. Венатовская Н.В.
Актуальность. Актуальность данной работы обусловлена тем, что при отсутствии сбора анамнеза перед введением местной анестезии возможны побочные реакции у пациента, что может привести к осложнениям вплоть до летального исхода.
Цель: определить методику подбора местноанестезирующего препарата у пациентов, относящихся к различным группам риска.
Задачи:
1. Изучить классификацию местных анестетиков и их фармакологические свойства
2. Правильно подобрать местный анестетик на основе анамнеза и аллерготеста у пациентов, относящихся к различным группам риска
Материалы и методы. Был проведен анализ научных статей на русском и английском языках, библиотечных источников, кандидатских диссертаций по теме алгоритм выбора местноанестезирующего препарата для пациентов с группой риска.
Результаты и обсуждение. Верно подобранное анестезиологическое руководство уменьшает риск возникновения угрожающих жизни неотложных состояний на амбулаторном стоматологическом приеме. Повышение качества, эффективности и безопасности стоматологической помощи неразрывно связано не только с дальнейшим совершенствованием мануальных навыков, но и с формированием у врачей-стоматологов профессиональной компетентности [1].
Классификация местных анестетиков и механизм действия.
В зависимости от промежуточной цепи МА делятся на эфиры и амиды. Первая группа местных анестетиков (группа эфиров) включает сложные эфиры бензойной кислоты (кокаин, Бенкаин), сложные эфиры парааминобензойной кислоты (прокаин, бутамбен), сложные эфиры аминобензойной и бензойнойкислот (тетракаин). Эфирные МА абсолютно нестабильны в растворах и в организме стремительно гидролизуются псевдохолинэстеразой и некоторыми другими эстеразами. Один из продуктов гидролиза – парааминобензойная кислота, способна порождать аллергические реакции. Период полувыведения в плазме у этих веществ весьма небольшой, по этой причине их разделение в тканях недостаточно исследовано.
Ко второй группе МА (группа амидов) относят амиды гетероциклической и ароматической кислот, амиды ароматических аминов – анилиды (лидокаин, бупивакаин, мепивакаин, ропивакаин и др.). Амидные МА сравнительно стабильны в растворе и медленно гидролизуются микросомальными ферментами печени. Скорость метаболизма различных препаратов крайне вариабельна: прилокаин – самый быстрый метаболизируемый препарат, бупивакаин – самый медленный. Незначительное число веществ выводится в не модифицированном виде почками. Существенная часть МА уже после введения действует в системный кровоток. Количество всосавшегося препарата и его пиковая концентрация в плазме зависят от дозы и присутствия в растворе вазоконстриктора (особенно при проводниковой и инфильтрационной анестезии). Одна и та же доза МА связана с различным риском токсического воздействия и зависит от методики анестезии, уровня васкуляризации тканей и взаимодействия с липидами тканей. Анестетики стремительно всасываются через слизистые оболочки. Связывание МА с белками плазмы оказывает большое влияние на фармакокинетику и фармакодинамику. Анестетики группы эфиров соединяются с белками плазмы несущественно (< 5–10%). Наоборот, анестетики группы амидов активно соединяются с белками, уровень связывания колеблется от 55 вплоть до 95%. Связывание с белками оказывает большое влияние на проникновение МА через плацентарный барьер. Уже после всасывания анестетика с области внедрения его концентрация в плазме находится в зависимости от скорости распределения в тканях и элиминации. Период полувыведения МА группы эфиров сравнительно короток (около 10 минут) из-за стремительного гидролиза под действием псевдохолинэстеразы. Наоборот, конечный период полувыведения анестетиков группы амидов колеблется от 100 минут у лидокаина до 200 минут у бупивакаина [2].
Местные анестетики, блокируя чувствительные нервные окончания и (или) проводники, уменьшают либо полностью устраняют поток импульсов с места болезненных вмешательств в центральную нервную систему, снимая боль без выключения сознания, а также контакт больного с доктором.
К местным анестетикам предъявляют ряд требований: они должны обладать отличной диффузной способности, значительную местноанестезирующую активность, избирательность и обратимость действия на нервные окончания и волокна, большую широту действия, быстрое наступление и достаточную длительность эффекта, низкую системную токсичность, иметь оптимальное соотношение сила действия / токсичность, не раздражать и не повреждать ткани в месте применения, выдерживать стерилизацию, быть стабильными в растворе.
С целью подбора результативного и безопасного препарата врач-стоматолог обязан знать основные местные анестетики, особенности их химической структуры, физико-химических свойств, фармакокинетики, механизма действия и фармакодинамики, принимать во внимание вероятность присутствия в местноанестезирующем растворе вазоконстриктора, других вспомогательных компонентов (стабилизаторов, консервантов и др.), уметь выбрать и осуществить адекватное клиникофармакологически обоснованное анестезиологическое пособие с учетом предполагаемого вмешательства, возраста, соматического и психоэмоционального состояния пациента, наличия побочных эффектов на местноанестезирующие средства в анамнезе.
В своем исследовании Daubländer Mainz провела анализ анкет в Германии, что показало препараты артикаина с эпинефрином (адреналином) в концентрации 1:100000 больше вызывали симпатомиметические эффекты, нежели препараты с наиболее невысоким (1:200000) содержанием вазоконстриктора. Сравнительные исследования эффективности и безопасности местноанестезирующих растворов, содержащих различные концентрации вазоконстрикторов, показали, что для стоматологической практики в большинстве случаев добавление эпинефрина (катехоламина) в концентрации 1:100000 не имеет клинически значимых преимуществ перед препаратами, содержащими эпинефрин (адреналин) в концентрации 1:200000 [11]. В то же время увеличение концентрации вазоконстриктора в местноанестезирующем растворе существенно увеличивает риск появление местных и системных нежелательных реакций. Для местных анестетиков группы сложных эфиров (прокаин), а кроме того анестетика группы амидов артикаина фактором риска является недостаток холинэстеразы в плазме крови.
Принципы подбора местного анестетика в группах риска
Для местных анестетиков группы амидов — ранний детский возраст, тяжелые нарушения функции печени и почек, сердечная недостаточность, бронхиальная астма.
Все растворы местных анестетиков, содержащие вазоконстрикторы, необходимо с предосторожностью назначать больным с тяжелыми сердечно-сосудистыми (декомпенсированная сердечная недостаточность, пароксизмальная тахикардия, артериальная гипертензия, нарушение коронарного и мозгового кровообращения и др.) и эндокринными заболеваниями (тиреотоксикоз, сахарный диабет), глаукомой, высокой тревожностью и кроме того принимающим неселективные ß-адреноблокаторы и трициклические антидепрессанты [5].
У пациентов с сердечно-сосудистой патологией прослеживается большой ответ вегетативной нервной системы на любое психоэмоциональное напряжение, по этой причине они в особенности остро реагируют не только на вмешательство в полости рта, но даже на время ожидание лечения.
При подборе местноанестезирующих препаратов для пациентов с сердечно-сосудистыми заболеваниями необходимо принимать во внимание то, что для них может представлять угроза не только МА, но и присутствие вазоконстриктора в местноанестезирующем растворе. У подобных больных необходимо принимать во внимание вероятность увеличения кардиодепрессивного эффекта при сочетании местных анестетиков ß-адреноблокаторами, симпатолитиками и противоаритмическими препаратами. Высокие дозы МА подавляют автоматизм сердечной мышцы, удлиняют промежуток спонтанной деполяризации, проявляют подавляющее влияние на сократимость сердца в степени пропорциональной их анестезирующей активности, подавляют проводимость вплоть до AV-блокады. Увеличение секреции эндогенного адреналина, равно как итог стрессовой реакции на предстоящее стоматологическое вмешательство и боль, а кроме того применение эпинефрина в составе местноанестезирующих растворов у данной группы больных может привести к острой декомпенсации сердечной деятельности, увеличение артериального давления, тахикардии, аритмии, возникновению загрудинных болей и иным осложнениям в том числе и в отсутствии выполнении каких-либо вмешательств и использования местноанестезирующих препаратов, что говорит о необходимости очень внимательного отношения к подбору им анестезиологического пособия. Так как побудительное воздействие адреномиметиков на сердечно-сосудистую систему у больных со сниженными ее резервами, стенокардией либо инфарктом миокарда в анамнезе способен побуждать формирование серьезных побочных эффектов, для них рационально подбирать препараты артикаина, имеющую высокую активность, которые дают возможность уменьшить концентрацию эпинефрина вплоть до 1:400 000, либо применять местноанестезирующие вещества без сосудосуживающего компонента. При оказании стоматологической помощи больным, страдающим ишемической заболеванием сердца, необходимо принимать во внимание то, что адреномиметики уменьшают активность нитратов, а неселективные ß-адреноблокаторы (пропранолол) увеличивают прессорный эффект эпинефрина. При сочетании местноанестезирующих растворов, включающих эпинефрин, с сердечными гликозидами, трициклическими антидепрессантами (амитриптилин) увеличивается угроза появления аритмий. У больных с сердечно-сосудистыми заболеваниями зачастую прослеживается понижение в организме компенсаторно-приспособительных механизмов, что может воздействовать на скорость метаболизма и экскрецию МА, в связи, с чем им рекомендуется выбирать препараты, обладающие невысокую токсичность и стремительно метаболизирующиеся в организме [6].
При сахарном диабете может развиваться у больных во время приема такого осложнения, как кома, которая может быть не только гипергликемической, но и гипогликемической. Рекомендовано принимать этих пациентов с утра через 1–2 часа после еды и как правило применяемых гипогликемических препаратов. Так как катехоламин увеличивает содержание глюкозы в крови, рекомендуется для больных с сахарным диабетом применять местноанестезирующие растворы в отсутствии вазоконстриктора. Введение (в области неба) растворов, содержащих большую концентрацию вазоконстриктора (1:100 000), способен спровоцировать у пациентов сахарным диабетом асептический некроз тканей.
У больных с тиреотоксикозом отмечается увеличенный тонус симпатической нервной системы: высокая эмоциональность, нервозность, эмоциональная лабильность, гипергидроз, дрожание рук, учащение сердцебиение, зоб, высокая восприимчивость к адреналину. Данные признаки имеют все шансы возрасти присутствие повышение секреции адреналина из-за страха и боли во время зуболечебного вмешательства, а кроме того уже после внедрения местноанестезирующих веществ, содержащих эпинефрин, в связи с чем рационально с целью данной категории больных применять местные анестетики в отсутствии вазоконстриктора.
Нарушение функции печени оказывает большое влияние на биотрансформацию местных анестетиков группы амидов. Артикаин обладает не только амидную, но и дополнительную эфирную связь, по этой причине его обмен веществ совершается не только лишь в печени, но и эстеразами тканей и крови. Это делает артикаин препаратом выбора у больных с патологией функции печени.
При нарушении функции почек возможно нарушение выведение местных анестетиков и их активных метаболитов, это в свою очередь увеличивает токсичность препарата. Данным больным рекомендовано применять слаботоксичные вещества, в ходе биотрансформации которых возникают неактивные метаболиты.
Пациенты с аллергическими заболеваниями – это особая группа лиц. С целью постановления проблемы об использовании местных анестетиков у данных пациентов особенно значим развернутый аллергологический и фармакологический анамнез. Нужны данные о сопутствующих болезнях и их базисной терапии. Необходимо учитывать переносимость, как самого местного анестетика, так и содержащихся в растворе вазоконстриктора, консерванта и стабилизатора. У больных с непереносимостью сульфаниламидов не рекомендуется применять эфирные местные анестетики. Пациентам бронхиальной астмой опасно применять местные анестетики, имеющие стабилизаторы (сульфиты натрия и калия), из-за угрозы формирования бронхоспазма. Данные о предыдущих реакциях на лекарственные средства других групп могут помочь исключить формирования перекрестных аллергических реакций. Преимущественне (с учетом анамнеза) назначать местные анестетики группы амидов в отсутствие содержания стабилизаторов и консервантов. Таким пациентам особенно рискованно превышать дозу! Больной обязан обладать «Паспорт больного аллергическим заболеванием».
У беременных имеется угроза выкидыша, в особенности в протяжение первых 3-х месяцев беременности, обусловленная стрессом в период стоматологического приема (страх, боль) и внедрением местноанестезирующих растворов с значительными дозами эпинефрина (адреналина). Вещества, проходящие через плаценту, имеют все шансы причинить ущерб плоду. При применении местноанестезирующих растворов, содержащих вазоконстриктор, необходимо принимать во внимание, что эпинефрин (катехоламин) проходит через плацентарный барьер. В период беременности рекомендовано применять более безопасные артикаинсодержащие МА, меньше проникающие через плацентарный барьер, с содержанием в них эпинефрина (катехоламина) в концентрации 1:200 000 и ниже.
У представительниц слабого пола в период лактации имеется угроза поступления лекарственных препаратов (местных анестетиков и вазоконстриктора) младенцу с молоком матери. Таким пациентам необходимо использовать препараты с содержанием в них эпинефрина в концентрации 1:200000 и ниже, а так же препараты, не содержащие вазоконстриктор (Мепивакаин).
У пожилых пациентов понижаются компенсаторно-приспособительные механизмы в организме, и зачастую отмечаются сопутствующие болезни, в связи с чем имеет важное значение медикаментозная подготовка. Больным данной категории рекомендовано применять вещества без вазоконстриктора или с минимальной концентрацией последних. Данные анестетики должны обладать низкой токсичностью и стремительно метаболизироваться в организме, а кроме того необходимо уменьшать дозу анестетика у больных в возрасте 70 лет на одну треть, в возрасте 80 лет — в 2 раза [12].
Для детей местная анестезия содержащий вазоконстриктор показана старше 4 лет, необходимо подобрать препарат, который позволил бы сделать вмешательство безболезненным, но кроме того чтобы анестезия не была слишком продолжительной после завершения лечения, иначе ребенок часто повреждает слизистую оболочку губ, щек, языка. Скорость всасывания, биотрансформации и выведения медикаментов коррелирует у ребенка с возрастом и массой тела, что необходимо принимать во внимание при выборе дозы препарата у данной группы больных. Вес и физиологические особенности детей регулярно изменяются, что необходимо принимать во внимание с целью уменьшения риска появления побочных реакций и передозировки.
Дозировка.
Артикаин 4% с вазоконстриктором. Максимальная доза 5 мг/кг, в 1 карпуле 1.8 мл. Мепивакаин 3% без вазоконстриктора. Максимальная доза 4.4 мг/кг, в 1 карпуле 1.8 мл
Таким образом, из-за сниженной массы тела угроза передозировки и формирования токсических реакций у ребенка выше, а сниженная способность лекарственных препаратов соединяться с белками крови, несовершенство барьерных механизмов, высокая проницаемость гематоэнцефалического барьера уменьшают прогнозтруемость фармакодинамических особенностей лекарственной терапии, кроме того не следует использовть местные анестетики с значительным содержанием вазоконстриктора.
Выводы:
1. Препараты группы амидов обладают меньшим токсическим действием в отличии от сложных эфиров. В результате анестетики амидной группы являются препаратами выбора в настоящее время.
2. Относительно безопасным местным анестетиком является мепивакаин, который не содержит вазоконстриктор и его можно применять пациентам всех групп риска. Также для пожилых пациентов, пациентов с нарушением функции печени и почек, беременных и женщин в период лактации, детей после 4 лет возможно применение артикаина с содержанием эпинефрина 1:400000.
Анализ рынка местных анестетиков применяемых в стоматологии
Страницы: 1 2
СОДЕРЖАНИЕ
ВВЕДЕНИЕ
1. ОБЩАЯ ХАРАКТЕРИСТИКА МЕСТНЫХ АНЕСТЕТИКОВ ПРИМЕНЯЕМЫХ В СТОМАТОЛОГИИ
1.1 Механизм действия местных анестетиков
1.2 Классификация местной анестезии
2. АНАЛИЗ РЫНКА МЕСТНЫХ АНЕСТЕТИКОВ ПРИМЕНЯЕМЫХ В СТОМАТОЛОГИИ
2.1 Ассортимент и характеристика местных анестетиков для применения в стоматологии
2.2 Анализ предложений на рынке местных анестетиков применяемых в стоматологии
ЗАКЛЮЧЕНИЕ
СПИСОК ЛИТЕРАТУРЫ
ВВЕДЕНИЕ
Актуальность исследования. За последнее время произошли значительные изменения в инструментальном обеспечении местной анестезии. Эти изменения коснулись буквально всех компонентов: лекарственных форм и способа приготовления местно анестезирующих растворов, конструкции шприцев и игл, техники проведения анестезии, а также решения вопроса обеспечения стерильности используемых растворов и инструментов.
Благодаря этому произошло обновление всей технологии местной анестезии в стоматологии, включая даже появление новых и совершенствование известных способов обезболивания, что не только создало дополнительные удобства, но повысило безопасность и упростило требования к стерильности условий работы врача-стоматолога. Если прежняя технология обязывала проводить местную анестезию только в стерильных хирургических отделениях, то современные возможности позволяют применять ее на своих рабочих местах стоматологам всех специальностей.
Последнее обстоятельство оказало влияние на организацию работы стоматологов и требования к уровню их подготовки. Возможность самостоятельного проведения обезболивания позволяет значительно сократить непроизводительные затраты времени, улучшить качество лечения, радикальным образом повысить безопасность местной анестезии, поскольку пациент постоянно находится под наблюдением одного врача, а не ходит по отделениям от одного врача к другому.
Безопасность и эффективность местной анестезии основывается на выполнении врачом-стоматологом ряда основных требований, к которым относятся следующие:
- Клинико-физиологическое обследование общесоматического состояния пациента.
- Выбор местно анестезирующего препарата и способа обезболивания сообразно особенностям предстоящего стоматологического вмешательства (области, продолжительности, объему и травматичности), функционального состояния тканей в месте вмешательства (наличие или отсутствие воспаления) и общесоматического состояния пациента.
- Использование карпул и соответствующих инструментов — шприцев и игл.
- Применение современной техники выполнения инъекций.
Теперь не менее значимым учитываемым фактором является безопасность местной анестезии, достижение надежного обезболивания при наименьшем риске возникновения не только системных, но и местных осложнений. Для этого стоматолог должен располагать удобным и надежным инструментом, необходимым для любого способа обезболивания. Шприцы, иглы и местно анестезирующие средства должны быть в полном комплекте и всегда готовы к использованию, а врач должен располагать полной информацией о характеристиках инструментов и средств, а также технике их применения.
Объект исследования — местные анестетики.
Предмет исследования — рынок местных анестетиков применяемых в стоматологии.
Цель исследования – провести анализ рынка местных анестетиков применяемых в стоматологии.
Задачи исследования:
- Рассмотреть общую характеристику местных анестетиков применяемых в стоматологии;
- Проанализировать ассортимент местных анестетиков для применения в стоматологии;
- Изучить анализ предложений на рынке местных анестетиков применяемых в стоматологии.
1 ОБЩАЯ ХАРАКТЕРИСТИКА МЕСТНЫХ АНЕСТЕТИКОВ ПРИМЕНЯЕМЫХ В СТОМАТОЛОГИИ
1.1 Механизм действия местных анестетиков
Каждый способ, применяемый для обезболивания тканей челюстно-лицевой области, характеризуется путем и местом подведения местноанестезирующего раствора, а также анестезируемыми нервами, что определяет как особенности обезболивающего эффекта (эффективность, продолжительность, область обезболиваемых тканей и др.), так, зачастую, и название способа. Описание конкретных способов местной анестезии целесообразно начать с их общей характеристики, поскольку классификация способов помогает понять их сходные и отличительные особенности, облегчает процесс их изучения. Общая классификация способов местной анестезии подразделяет их на три типа (А.А.Вишневский, 1974; А.Ф.Бизяев, 1998) (рис. 1):
Рисунок 1
- Аппликационная (от лат. Applicatio – прикладывание), терминальная (от лат. Terminus – предел, конец) или поверхностная анестезия, которая осуществляется безинъекционным способом путем нанесения анестезирующих средств на поверхность тканей. Пропитывая поверхностные слои тканей, анестезирующие средства блокируют расположенные в этих слоях рецепторы и терминальные части периферических нервных волокон.
- Инфильтрационная (от лат. Infiltratio – пропитанное) анестезия осуществляется пропитыванием глубоких слоев тканей анестезирующим раствором, вводимым через инъекционную иглу. Область анестезии в этом случае также ограничена областью диффузии раствора, блокирующего рецепторы и периферические нервные волокна в этих слоях тканей. Наиболее часто инфильтрационную анестезию проводят введением анестезирующего раствора под слизистую оболочку, над надкостницей, внутрикостно или в пародонтальные ткани.
- Регионарная (от лат. Region – область) анестезия достигается направленным введением анестезирующего раствора, при котором раствор концентрируется вокруг нервных стволов, сплетений или корешков спинного мозга. Благодаря этому происходит их блокада, и эффект анестезии возникает в той области тела, которая иннервируется анестезируемыми нервными образованиями. Различают три основных вида регионарной местной анестезии: проводниковую, спинномозговую (субарахноидальный блок) и перидуральную (экстрадуральный блок). К регионарной анестезии относят и внутрисосудистую анестезию, при которой анестезирующий раствор достигает тканей с током крови по той части сосудистого русла, в которую вводится раствор. Регионарная анестезия, при которой анестезирующий раствор концентрируется вокруг участка нерва или нервного ствола, в результате чего проведение по нему нервных импульсов нарушается, называется проводниковой анестезией. Эта анестезия осуществляется введением анестезирующего раствора или внутрь нервного ствола – эндоневрально, — или в непосредственной близости от него – периневрально. Эндоневральный способ введения для обезболивания стоматологических вмешательств в настоящее время не применяется ввиду его травматичности и высокого риска постинъекционных местных осложнений.
В стоматологии используются все три типа местной анестезии: поверхностная, инфильтрационная и проводниковая, причем последние два являются основными, наиболее часто используемыми.
В зарубежной литературе используется классификация способов местной анестезии, которая несколько отличается от отечественной. Чтобы избежать терминологической путаницы, приведем сравнительное описание зарубежной классификации (рис. 2), составленное на основании мнения ряда авторов (C.R.Bennett, 1984; T.Jastak, J.A.Yagiela, D.Donaldson, 1995; S.F.Malamed, 1997):
Рисунок 2
- Topical anesthesia (от гр. Topos – место, местность) – анестезия свободных нервных окончаний при поверхностном нанесении (аппликации) местноанестезирующих средств. Этот тип анестезии соответствует поверхностной (аппликационной или терминальной) анестезии в отечественной классификации. Необходимо отметить, что термины «topical anesthesia» и «local anesthesia» (от лат. Localis – местный) обозначают и зачастую переводятся одинаково: местная анестезия.
- Local infiltration (местная инфильтрация) – пропитывание местноанестезирующим раствором концевых частей нервных волокон, расположенных в области предстоящего вмешательства. Этот тип анестезии соответствует инфильтрационной анестезии в отечественной классификации.
- Field block (блок области) – разновидность регионарной анестезии, при которой блокируются небольшие ответвления нервов. Этот тип анестезии соответствует проводниковой анестезии в отечественной классификации (рис.б-3).
- Nerve block (нервный блок) — анестезия, при которой блокируется крупный нерв или нервный ствол. Этот тип анестезии, как и «field block», также соответствует проводниковой анестезии в отечественной классификации.
Сравнивая зарубежную и отечественную классификации способов местной анестезии, можно отметить, что при кажущейся их схожести в них используются различные критерии. В отечественной классификации основным критерием определения способа местной анестезии является способ введения местноанестезирующего раствора в ткани. При поверхностной анестезии анестетик наносится на поверхность тканей, при инфильтрационной – анестетиком пропитывают глубокие слои тканей через введенную в них иглу, а при проводниковой анестезии осуществляют такое введение анестетика в глубокие слои тканей, которое направлено на крупный нерв или нервный ствол. В зарубежной классификации основным критерием для определения способа местной анестезии является тот участок периферической нервной системы, на который действует местноанестезирующий раствор, введенный при данном способе.
В практической работе использование отечественной классификации более целесообразно, поскольку во время проведения анестезии врач-стоматолог не может определить, на какую часть периферической нервной системы подействовал введенный местноанестезирующий раствор. Он может выбирать и управлять лишь способом введения раствора в ткани. В качестве примера использования этих классификаций рассмотрим способ анестезии, который осуществляется на верхней челюсти введением местного анестетика в ткани около верхушки корня над надкостницей (рис.в). По отечественной классификации это инфильтрационная анестезия, тогда как по зарубежной классификации такая анестезия должна относиться к регионарной, точнее к «field block», т.к. анестетик действует на нервы только у верхушки корня, а не на их окончания внутри зуба (T.Jastak, J.A.Yagiela, D.Donaldson, 1995). Однако зарубежные стоматологи обычно классифицируют эту анестезию как инфильтрационную, и это несоответствие вынужден отметить S.F.Malamed (1997) в своем последнем руководстве по местной анестезии. В связи с этим в отличие от некоторых отечественных авторов (С.Ф.Грицук, 1998) при дальнейшем изложении будет использована отечественная классификация способов местной анестезии.
Каковы же основные особенности инфильтрационной и проводниковой анестезии? Как показывает их детальный анализ, между этими двумя типами местной анестезии имеется принципиальные отличия, которое относятся как к технике и клиническим особенностям обезболивания, так и к учебно-методологическим подходам к их освоению:
- Если использовать образное сравнение, то эти типы местной анестезии по технике выполнения отличаются следующим образом: при проводниковом обезболивании надо найти кончиком иглы нервный ствол, расположенный, как правило, глубоко в тканях, а при инфильтрационном — анестетик сам «найдет» нервные волокна в тех тканях, которые пропитает. Поэтому технически проводниковая анестезия значительно сложнее, чем инфильтрационная. Для освоения проводниковыми способами анестезии надо очень хорошо изучить индивидуальные анатомические ориентиры и уметь ими пользоваться для определения нервных стволов глубоко в тканях.
- Наиболее частым местом введения анестезирующего раствора при проводниковых способах обезболивания являются клетчаточные пространства, в которых и проходят крупные нервы и нервные стволы. Достаточное внимание описанию клетчаточных пространств, в том числе в челюстно-лицевой области, уделил еще Н.И.Пирогов. Их тщательное изучение с целью совершенствования способов местной анестезии в стоматологии было проведено П.М.Егоровым (1985). Клетчаточные пространства – промежутки между различными анатомическими образованиями, содержащие рыхлую клетчатку с большим или меньшим количеством жировой ткани (Т.И.Аникина, 1979). Благодаря особенностям строения клетчаточных пространств и окружающих тканей местноанестезирующий раствор, введенный в эти пространства, не растекается, что позволяет создать его высокую концентрацию в окрестности нервного ствола.
Инфильтрационная анестезия обеспечивается пропитыванием местным анестетиком тканей, при котором диффузия раствора происходит в соответствии с градиентом концентрации. В процессе этой диффузии анестетик смешивается с межклеточной жидкостью, в результате чего его концентрация снижается. Поэтому при инфильтрационной анестезии степень торможения возбудительных процессов в нервных волокнах, как правило, ниже, чем при проводниковой анестезии.
- Поскольку эффективность инфильтрационной анестезии определяется возможностью диффузии местноанестезирующего раствора в тканях, то ее применимость для обезболивания твердых тканей верхней и нижней челюстей различна в связи с их анатомическими отличиями. Существенная анатомическая особенность, которая отличает верхнюю челюсть от нижней, состоит в том, что наружная кортикальная пластинка верхней челюсти тонкая и имеет множественные отверстия. Тогда как наружная и внутренняя поверхности тела нижней челюсти состоят из плотных слоев компактного вещества, толщина которого увеличивается в нижнем отделе. По направлению спереди назад наружный кортикальный слой нижней челюсти постепенно утолщается. В области премоляров и особенно моляров он достигает значительных размеров и при этом практически не имеет отверстий. В результате этого диффузия растворов через костную ткань верхней челюсти очень хорошая, а через костную ткань нижней челюсти в области боковых зубов – отсутствует. Поэтому инфильтрационная анестезия на нижней челюсти применяется у взрослых только в области фронтальной группы зубов. У детей костная ткань нижней челюсти не такая плотная, как у взрослых, поэтому у них возможно применение инфильтрационной анестезии при лечебных вмешательствах также и в области боковых зубов.
1.2 Классификация местной анестезии
По мнению Ю.В. Ефимова и Х.Х. Мухаева (2007), внутрикостную анестезию следует выделять в отдельный, самостоятельный вид анестезии.
Связано это с механизмом ее действия. Механизм действия внутрикостной анестезии основан на распространении раствора двумя основными путями:
— через костномозговые канальцы вокруг лунок зубов, включая периапикальные области, где расположены нервные волокна;
— по внутрисосудистому руслу — раствор проникает и распространяется по кровеносным сосудам пародонта и костномозгового пространства.
Характерным признаком внутривенного характера внутрикостной инъекции является положительная аспирационная проба, которая наблюдается почти при каждой инъекции. Отрицательная аспирация свидетельствует о недостаточной перфорации кортикальной пластинки, т. е. непопадании иглы-перфоратора в губчатое вещество кости. В таких ситуациях необходимо иглу продвинуть глубже до появления в шприце капли крови. В противном случае анестезия будет неэффективна.
Механизм внутрикостного обезболивания обусловлен в основном внесосудистым распределением анестетика в периапикальной и перегородочной областях челюстей, прилежащих к месту инъекции. Венозный характер дальнейшего распределения анестетика ответственен главным образом за возникновение токсических реакций. Хотя в литературе вопрос о резорбтивном действии внутрикостно вводимого анестетика практически не обсуждается, тем не менее, к этому моменту следует относиться с предельным вниманием. Необходимо помнить, что ничтожная доза введенного анестетика действительно маскирует возможную реакцию организма.
В отличие от других видов местной анестезии необходимым условием для внутрикостного введения анестетика является перфорация кортикального слоя челюсти. Для этих целей было предложено несколько методов. Так, М.М. Дитерихс (1907) использовал бормашину и шаровидный бор, С.Н. Вайсблат (1962) — инъекционную иглу, B. Lilienhal (1975) — бормашину и дрильбор.
Для перфорации кортикального слоя А.Ж. Петрикас (1974) применил шиловидный граненый инструмент с ограничителем глубины введения до 7 мм. Анестетик вводился посредством укороченной обычной инъекционной иглы.
Однако ни одна из предложенных методик не нашла широкого применения в клинической практике ввиду трудоемкости исполнения и высокой вероятности инфицирования кости, связанной с постоянной заменой перфоратора на инъекционную иглу.
В конце XX в. фирмой Stabident была предложена техника внутрикостной анестезии как альтернатива при недостаточной эффективности мандибулярной анестезии, которая заключалась в следующем. После предварительного обезболивания места внутрикостного введения анестетика бором перфорируют кортикальную пластинку, через сделанное отверстие вводят иглу в губчатое вещество кости и выпускают необходимое количество анестетика.
2 АНАЛИЗ РЫНКА МЕСТНЫХ АНЕСТЕТИКОВ ПРИМЕНЯЕМЫХ В СТОМАТОЛОГИИ
2.1 Ассортимент и характеристика местных анестетиков для применения в стоматологии
В период прохождения практики в аптеке мною был проанализирован рынок местных анестетиков применяемых в стоматологии. Анализу подвиглись такие параметры, как ассортимент, форма выпуска ценовая категория препарата.
Ниже представлена информация по проведенному анализу.
АРТИКАИН, БИОХИМИК (Россия)
Владелец регистрационного удостоверения: БИОХИМИК, ОАО(Россия)
Код ATX: N01BB08 (Articaine)
Активное вещество: артикаин(articaine)
Rec.INN зарегистрированное ВОЗ
Лекарственная форма
| АРТИКАИН | р-р д/инъекц. 40 мг/1 мл: амп. 2 мл 5 или 10 шт.
рег. №: ЛП-001151 от 11.11.11 — Действующее |
Форма выпуска, состав и упаковка
| Раствор для инъекций | 1 мл |
| артикаина гидрохлорид | 40 мг |
2 мл — ампулы бесцветного стекла (5) — пачки картонные.
2 мл — ампулы бесцветного стекла (5) — упаковки контурные ячейковые (1) — пачки картонные.
2 мл — ампулы бесцветного стекла (5) — упаковки контурные ячейковые (2) — пачки картонные.
2 мл — ампулы бесцветного стекла (10) — пачки картонные.
2 мл — ампулы бесцветного стекла (10) — упаковки контурные ячейковые (1) — пачки картонные.
Клинико-фармакологическая группа: Местный анестетик для применения в стоматологии
Фармако-терапевтическая группа: Местноанестезирующее средство
АРТИКАИН, БИНЕРГИЯ, ЗАО (Россия)
Владелец регистрационного удостоверения: БИНЕРГИЯ, ЗАО(Россия)
Произведено: АЛЬТАИР, ООО(Россия)
Код ATX: N01BB08 (Articaine)
Активное вещество: артикаин(articaine)
Rec.INN зарегистрированное ВОЗ
Лекарственная форма
| АРТИКАИН | р-р д/инъекц. 40 мг/1 мл: 1.7 мл картриджи 10, 50 или 100 шт., 1 мл или 2 мл амп. 5, 10, 100 или 250 шт.
рег. №: ЛСР-008522/10 от 23.08.10 — Срок действия рег. уд. не ограничен |
Форма выпуска, состав и упаковка
| Раствор для инъекций прозрачный, бесцветный или с желтоватым оттенком. | 1 мл |
| артикаина гидрохлорид | 40 мг |
Вспомогательные вещества: натрия хлорид — 2.1 мг, вода д/и до 1 мл.
1.7 мл — картриджи (10) — упаковки контурные пластиковые (1) — пачки картонные.
1.7 мл — картриджи (10) — упаковки контурные пластиковые (5) — пачки картонные.
1.7 мл — картриджи (10) — упаковки контурные пластиковые (10) — пачки картонные.
1.7 мл — картриджи (10) — упаковки ячейковые контурные (1) — пачки картонные.
1.7 мл — картриджи (10) — упаковки ячейковые контурные (5) — пачки картонные.
1.7 мл — картриджи (10) — упаковки ячейковые контурные (10) — пачки картонные.
1.7 мл — картриджи (10) — вкладыши картонные (1) — пачки картонные.
1.7 мл — картриджи (10) — вкладыши картонные (5) — пачки картонные.
1.7 мл — картриджи (10) — вкладыши картонные (10) — пачки картонные.
1 мл — ампулы стеклянные (5) — упаковки пластиковые контурные (1) — пачки картонные.
1 мл — ампулы стеклянные (5) — упаковки пластиковые контурные (2) — пачки картонные.
1 мл — ампулы стеклянные (5) — упаковки ячейковые контурные (1) — пачки картонные.
1 мл — ампулы стеклянные (5) — упаковки ячейковые контурные (2) — пачки картонные.
2 мл — ампулы стеклянные (5) — упаковки пластиковые контурные (1) — пачки картонные.
2 мл — ампулы стеклянные (5) — упаковки пластиковые контурные (2) — пачки картонные.
2 мл — ампулы стеклянные (5) — упаковки ячейковые контурные (1) — пачки картонные.
2 мл — ампулы стеклянные (5) — упаковки ячейковые контурные (2) — пачки картонные.
1 мл — ампулы стеклянные (5) — упаковки пластиковые контурные (20) — коробки картонные.
1 мл — ампулы стеклянные (5) — упаковки пластиковые контурные (50) — коробки картонные.
1 мл — ампулы стеклянные (5) — упаковки ячейковые контурные (20) — коробки картонные.
1 мл — ампулы стеклянные (5) — упаковки ячейковые контурные (50) — коробки картонные.
2 мл — ампулы стеклянные (5) — упаковки пластиковые контурные (20) — коробки картонные.
2 мл — ампулы стеклянные (5) — упаковки пластиковые контурные (50) — коробки картонные.
2 мл — ампулы стеклянные (5) — упаковки ячейковые контурные (20) — коробки картонные.
2 мл — ампулы стеклянные (5) — упаковки ячейковые контурные (50) — коробки картонные.
Клинико-фармакологическая группа: Местный анестетик для применения в стоматологии
Фармако-терапевтическая группа: Местноанестезирующее средство
Страницы: 1 2
404 — NetCE
Мы сообщаем о зачетах на непрерывное образование следующим лицам:
Специалисты в области здравоохранения Флориды: NetCE сообщает о зачетных единицах пройденного курса почасово в CE Broker для большинства медицинских профессий. Дата завершения, сообщенная CE Broker, может быть указана на вашем сертификат (ы) об окончании.Мы всегда ведем учет всех действий, выполненных вами с NetCE. Ты можно связаться с CE Broker по телефону 1-877-434-6323.
Совет по медсестринскому делу штата Джорджия: NetCE сообщает о зачетных единицах пройденного курса почасово CE Broker для медсестер Джорджии. Дата завершения, сообщенная CE Broker, может быть указана в вашем сертификате (ах). завершения.Мы всегда ведем учет всех действий, выполненных вами с NetCE. Вы можете связаться с Брокер CE по телефону 1-877-434-6323.
Совет администраторов домов престарелых, штат Джорджия: NetCE сообщает о зачетных единицах пройденного курса почасово CE Broker для администраторов дома престарелых Джорджии. Дату завершения, сообщенную CE Broker, можно увидеть на ваш сертификат (ы) об окончании.Мы всегда ведем учет всех действий, выполненных вами с NetCE. Вы можете связаться с CE Broker по телефону 1-877-434-6323.
Департамент медсестер округа Колумбия: NetCE сообщает о зачетных единицах пройденного курса почасово в CE Broker для медсестер округа Колумбия. Дата завершения, сообщенная CE Broker, может быть указана на вашем сертификат (ы) об окончании.Мы всегда ведем учет всех действий, выполненных вами с NetCE. Ты можно связаться с CE Broker по телефону 1-877-434-6323.
Совет медсестер Арканзаса: NetCE сообщает о зачетных единицах пройденного курса почасово CE Broker для медсестер из Арканзаса. Дата завершения, сообщенная CE Broker, может быть указана в вашем сертификате (ах). завершения.Мы всегда ведем учет всех действий, выполненных вами с NetCE. Вы можете связаться с Брокер CE по телефону 1-877-434-6323.
Совет по медсестринскому делу штата Нью-Мексико: NetCE сообщает о зачетных единицах пройденного курса почасово CE Broker для медсестер из Нью-Мексико. Дата завершения, сообщенная CE Broker, может быть указана на вашем сертификат (ы) об окончании.Мы всегда ведем учет всех действий, выполненных вами с NetCE. Ты можно связаться с CE Broker по телефону 1-877-434-6323.
Медицинский совет Нью-Мексико: NetCE сообщает о зачетных единицах пройденного курса почасово CE Broker для врачей из Нью-Мексико. Дата завершения, сообщенная CE Broker, может быть указана на вашем сертификат (ы) об окончании.Мы всегда ведем учет всех действий, выполненных вами с NetCE. Ты можно связаться с CE Broker по телефону 1-877-434-6323.
Медицинский совет штата Огайо: NetCE сообщает о зачетных единицах пройденного курса почасово в CE Broker для врачей из Огайо. Дата завершения, сообщенная CE Broker, может быть указана в вашем сертификате (ах). завершения.Мы всегда ведем учет всех действий, выполненных вами с NetCE. Вы можете связаться с Брокер CE по телефону 1-877-434-6323.
Совет медсестер Южной Каролины: NetCE сообщает о зачетных единицах пройденного курса почасово CE Broker для медсестер из Южной Каролины. Дата завершения, сообщенная CE Broker, может быть указана на вашем сертификат (ы) об окончании.Мы всегда ведем учет всех действий, выполненных вами с NetCE. Вы можете связаться с CE Broker по телефону 1-877-434-6323.
Совет медицинских экспертов штата Теннесси и Совет по остеопатическим исследованиям штата Теннесси: NetCE сообщает о зачетных единицах пройденного курса почасово в CE Broker для врачей из Теннесси и врачей-остеопатов. Дата завершения, сообщенная CE Broker, может быть просмотренным в вашем сертификате (ах) об окончании.Мы всегда ведем учет всех выполненных вами действий. с NetCE. Вы можете связаться с CE Broker по телефону 1-877-434-6323.
Западная Вирджиния RN / APRN Совет: NetCE сообщает о зачетных единицах пройденного курса почасово CE Broker для RN и APRN Западной Вирджинии. Дата завершения, сообщенная CE Broker, может быть указана на вашем сертификат (ы) об окончании.Мы всегда ведем учет всех действий, выполненных вами с NetCE. Ты можно связаться с CE Broker по телефону 1-877-434-6323.
Медицинская комиссия штата Луизиана: NetCE сообщает о зачетных единицах пройденного курса почасово в CE Broker для врачей из Луизианы. Дата завершения, сообщенная CE Broker, может быть указана на вашем сертификат (ы) об окончании.Мы всегда ведем учет всех действий, выполненных вами с NetCE. Вы можете связаться с CE Broker по телефону 1-877-434-6323.
Стоматологический совет Луизианы: NetCE сообщает о зачетных единицах пройденного курса почасово в CE Broker по стоматологическим профессиям Луизианы. Дата завершения, сообщенная CE Broker, может быть указана на вашем сертификат (ы) об окончании.Мы всегда ведем учет всех действий, выполненных вами с NetCE. Ты можно связаться с CE Broker по телефону 1-877-434-6323.
Медицинский совет штата Миссисипи: NetCE сообщает о зачетных единицах пройденного курса почасово в CE Broker для врачей и помощников врача из Миссисипи. Дата завершения сообщается CE Broker можно увидеть в вашем сертификате (ах) об окончании.Мы всегда ведем учет всех ваших действий укомплектован NetCE. Вы можете связаться с CE Broker по телефону 1-877-434-6323.
Совет медсестер Алабамы: NetCE сообщает о зачетных единицах пройденного курса почасово к Совету медсестер Алабамы. Сообщенную дату завершения можно увидеть в вашем сертификате (ах) об окончании. Мы всегда ведем учет всех действий, выполненных вами с NetCE.Вы можете связаться с Правлением штата Алабама. медсестер по телефону 1-800-656-5318.
Пенсильвания Специалисты в области здравоохранения: NetCE сообщает о зачетных единицах продолжающегося обучения по курсу Выявление жестокого обращения с детьми и сообщение о нем: трехчасовое требование штата Пенсильвания в течение 24 часов в Государственный департамент, который передает информацию о завершении вашей комиссии. Дата завершения сообщенный может быть просмотрен в вашем сертификате (ах) об окончании.Этот курс выполняет как двухчасовое продление, требование и требование начальной лицензии на 3 часа для большинства специалистов в области здравоохранения. Пожалуйста, позвольте 14 до 28 дней для вашей Правления на обработку завершения. Вы можете отслеживать статус своей лицензии в Интернете по адресу www.pals.pa.gov/#/page/default .
Американский совет по внутренней медицине (ABIM): NetCE сообщает ABIM о зачетных единицах непрерывного медицинского образования (CME).Сообщенную дату завершения можно просмотреть в вашем сертификате (ах) об окончании. Участники получат баллы MOC, эквивалентные сумме кредитов CME. заявлен на деятельность. Провайдер мероприятий CME несет ответственность за заполнение участников. информация для ACCME с целью предоставления кредита ABIM MOC. Завершение этого курса составляет разрешение поделиться данными о завершении с ACCME. Вы должны указать свой номер ABIM и дату рождения на страницу лицензии вашего профиля для получения кредита.Вы можете проверить статус своей сертификации на странице www.abim.org .
Американский совет анестезиологии (ABA): NetCE сообщает ABA о зачетных единицах непрерывного медицинского образования (CME). Сообщенную дату завершения можно просмотреть в вашем сертификате (ах) об окончании. Участники получат баллы MOC, эквивалентные сумме кредитов CME. заявлен за деятельность в обновленном Сопровождении сертификации Американского совета анестезиологов (ABA) в программе анестезиологии (MOCA) ®, известной как MOCA 2.0®. Вы должны указать свой номер ABA и дату рождения на Страница лицензии вашего профиля для получения кредита.
Американский совет педиатрии (ABP): NetCE сообщает ABP о зачетных единицах непрерывного медицинского образования (CME). Сообщенную дату завершения можно просмотреть в вашем сертификате (ах) об окончании. Участники получат баллы MOC, эквивалентные сумме кредитов CME. заявлен на участие в программе поддержки сертификации (MOC) Американского совета педиатрии.Провайдер мероприятий CME несет ответственность за предоставление информации о завершении участников в ACCME для цель предоставления кредита ABP MOC. Вы должны указать свой номер ABP и дату рождения на странице лицензии ваш профиль для получения кредита.
Национальная ассоциация фармацевтов (NABP): NetCE сообщит о вашем кредите в Национальную ассоциацию фармацевтических советов (NABP) при условии, что вы добавите ваш идентификатор электронного профиля NABP и дату рождения в вашей учетной записи.Если вы решите отказаться от ввода этой информации, вы соглашаетесь не возлагать на NetCE ответственность за предоставление отчетности по вашему кредиту. Для получения дополнительной информации о преимуществах чтобы зарегистрироваться для получения идентификатора электронного профиля NABP, перейдите по ссылке https://nabp.pharmacy/cpe-monitor-service .
Нью-Йорк: NetCE не сообщать о зачетных единицах непрерывного образования для специалистов здравоохранения Нью-Йорка, завершивших инфекционный контроль, или Жестокое обращение с детьми, хотя оба наших курса одобрены государством.
Для лицензиатов, завершивших наш курс по обращению с детьми в Нью-Йорке, по завершении вы получите Сертификат Окончание Департамента образования Нью-Йорка. Пожалуйста, заполните Часть A: Информация о стажере и вернитесь на NetCE по почте, факсу или электронной почте. После получения NetCE заполнит часть B формы и вернет ее вам. Затем вы должны отправить заполненную форму в Департамент образования штата Нью-Йорк (адрес указан в форме).
Местные анестетики: обзор фармакологических соображений
Abstract
Местные анестетики обладают впечатляющей историей эффективности и безопасности в медицинской и стоматологической практике. Их использование настолько рутинно, а побочные эффекты настолько редки, что медицинские работники могут по понятным причинам упускать из виду многие из своих фармакотерапевтических принципов. Целью данной статьи для повышения квалификации является обзор и обновление основных фармакологических характеристик различных местных анестетиков, используемых в настоящее время.Технические соображения будут рассмотрены в следующей статье.
Ключевые слова: Местные анестетики, Фармакология, Токсичность лекарств, Стоматология
Местные анестетики прерывают нервную проводимость, подавляя приток ионов натрия через каналы или ионофоры в мембранах нейронов. Обычно эти каналы существуют в состоянии покоя, во время которого ионам натрия запрещен доступ. Когда нейрон стимулируется, канал принимает активированное или открытое состояние, в котором ионы натрия диффундируют в клетку, инициируя деполяризацию.После этого внезапного изменения напряжения на мембране натриевой канал переходит в неактивное состояние, во время которого дальнейший приток запрещается, в то время как активные транспортные механизмы возвращают ионы натрия наружу. После этой реполяризации канал принимает нормальное состояние покоя. Понимание этих состояний натриевых каналов помогает объяснить предпочтительную чувствительность местных анестетиков к различным классам нейронных волокон.
Местные анестетики обладают большим сродством к рецепторам внутри натриевых каналов во время их активированного и инактивированного состояний, чем когда они находятся в состоянии покоя. 1 , 2 Следовательно, нервные волокна с более высокой скоростью возбуждения наиболее восприимчивы к действию местного анестетика. Кроме того, волокна меньшего размера, как правило, более восприимчивы, потому что данный объем раствора местного анестетика может более легко блокировать необходимое количество натриевых каналов для полного прерывания передачи импульса. По этим причинам наиболее чувствительными являются крошечные, быстрорастущие вегетативные волокна, за ними следуют сенсорные волокна и, наконец, соматические двигательные волокна. 1 , 2 Анестезиолог, блокирующий смешанные спинномозговые нервы, хорошо осведомлен об этой разной чувствительности. Когда пациенты оправляются от спинномозговой анестезии, они сначала восстанавливают произвольную двигательную функцию, затем возвращаются ощущения и, наконец, они могут мочиться (вегетативный контроль). Дантисту обычно не приходится уделять этому внимание, потому что ветви тройничного нерва, анестезируемые при стоматологических процедурах, состоят только из небольших, быстро возбуждающихся сенсорных волокон. Однако многие классы сенсорных волокон также различаются по диаметру и скорости возбуждения.Например, болевые волокна более чувствительны, чем волокна, несущие давление и проприоцепцию. Пациента может по-прежнему беспокоить чувство давления, несмотря на полную анестезию болевых волокон.
ОБЩИЕ СВОЙСТВА МЕСТНЫХ АНЕСТЕТИКОВ
Молекулярная структура всех местных анестетиков состоит из 3 компонентов: (а) липофильное ароматическое кольцо, (б) промежуточная сложноэфирная или амидная связь и (в) третичный амин. Каждый из этих компонентов придает молекуле различные клинические свойства.(См.)
Местноанестезирующий состав.
Эффективность анестетика
Местные анестетики различаются по эффективности, что позволяет использовать их в концентрациях от 0,5 до 4%. Во многом это является результатом различий в растворимости липидов, что усиливает диффузию через нервные оболочки и нервные мембраны. Это свойство определяется ароматическим кольцом и его замещениями, а также замещениями, добавленными к третичному амину. Например, бупивакаин более растворим в липидах и более эффективен, чем артикаин, что позволяет формулировать его как 0.5% концентрация (5 мг / мл), а не 4% концентрация (40 мг / мл).
Время начала действия
Повышенная растворимость лекарства в липидах не только увеличивает эффективность, но и способствует более быстрой диффузии через клеточные мембраны. Для местных анестетиков это ускоряет начало анестезии изолированных волокон во время исследований in vitro, но следует понимать, что в клинической практике играют роль и другие факторы. Например, присущие сосудорасширяющие свойства могут способствовать системной абсорбции до того, как анестетик достигнет нервной оболочки.Высокая растворимость липидов может препятствовать диспергированию в тканевых жидкостях, а также способствовать секвестрации в соседних жировых тканях или миелиновых оболочках. В любом случае меньшее количество молекул достигает нейрональной мембраны, и начало реакции задерживается. Следовательно, в отличие от исследований изолированных волокон in vitro, большая растворимость липидов обычно замедляет наступление анестезии в клинических условиях. Введение более высоких концентраций, которые позволяют большему количеству молекул достигать мембраны и ускоряют наступление, может компенсировать это влияние.Хотя бупивакаин и артикаин хорошо растворимы в липидах, 4% концентрация артикаина обеспечивает гораздо более быстрое начало.
Несмотря на множество факторов, влияющих на количество местного анестетика, достигающего нервных волокон, наиболее важным фактором, определяющим начало анестезии, является пропорция этих молекул, которые находятся в жирорастворимом, а не в водорастворимом состоянии. Конечный амин, проиллюстрированный на, может существовать в третичной форме (3 связи), которая является растворимой в липидах, или в виде четвертичной формы (4 связи), которая имеет положительный заряд и делает молекулу водорастворимой.Чтобы основа местного анестетика была стабильной в растворе, ее формулируют в виде гидрохлоридной соли. Таким образом, молекулы существуют в четвертичном, водорастворимом состоянии во время инъекции и не могут проникать в нейрон. Следовательно, время начала местной анестезии напрямую связано с долей молекул, которые превращаются в третичную липидорастворимую структуру при воздействии физиологического pH (7,4). Эта пропорция определяется константой ионизации (pKa) анестетика и рассчитывается с использованием уравнения Хендерсона-Хассельбаха:
Проще говоря, если местный анестетик должен иметь pKa 7.4, и для введения в ткани, имеющие физиологический pH 7,4, 50% молекул будут существовать в четвертичной (катионной) форме и 50% будут существовать в третичной (незаряженной) форме; только половина молекул будет жирорастворимой и сможет проникать в нейрон. К сожалению, pKa для всех местных анестетиков превышает 7,4 (физиологический pH), и поэтому большая часть молекул существует в четвертичной водорастворимой форме при введении в нормальную ткань. Клиническая оговорка заключается в том, что чем выше pKa для местного анестетика, тем меньше молекул доступно в их жирорастворимой форме.Это задержит наступление. Кроме того, кислая среда, связанная с воспаленными тканями, снижает их pH значительно ниже 7,4 и еще больше способствует четвертичной водорастворимой конфигурации. Это было предложено как одно из объяснений трудностей при попытке обезболить воспаленные или инфицированные ткани. 1 , 2 В этих ситуациях, например, бупивакаин (pKa 8,1) менее желателен, чем мепивакаин (pKa 7,6).
Следует уточнить, однако, что как только третичные молекулы попадают в нейрон, они реионизируются в четвертичную форму, что считается фактической блокадой натриевого канала.Последовательность событий, которая приводит к нервной блокаде, проиллюстрирована на рисунке.
Местноанестезирующее действие. Введенный местный анестетик находится в равновесии в виде четвертичной соли (BH + ) и третичного основания (B). Доля каждого из них определяется pKa анестетика и pH ткани. Жирорастворимое основание (B) необходимо для проникновения как в эпиневрий, так и в нейрональную мембрану. Как только молекула достигает аксоплазмы нейрона, амин получает ион водорода, и эта ионизированная четвертичная форма (BH + ) отвечает за фактическую блокаду натриевого канала.Равновесие между (BH + ) и (B) определяется pH тканей и pKa анестетика (pH / pKa).
Метаболизм и выведение
Промежуточная цепочка или звено обеспечивает удобную основу для классификации местных анестетиков, а также определяет характер их выведения. Амиды биотрансформируются в печени, но сложные эфиры гидролизуются в кровотоке эстеразами плазмы. Местные анестетики на основе сложного эфира больше не упаковываются в стоматологические картриджи и используются нечасто, за исключением бензокаина, который содержится в некоторых местных анестетических препаратах.Артикаин в этом отношении уникален. Он классифицируется как амид в соответствии с его промежуточной связью, но также содержит боковую цепь сложного эфира на своем ароматическом кольце. Гидролиз этой боковой цепи делает молекулу неактивной, и поэтому она удаляется аналогично сложноэфирным анестетикам.
Продолжительность действия
Местные анестетики различаются по продолжительности действия в основном из-за различий в их сродстве к белку. Как и большинство лекарств, местные анестетики обратимо связываются с белками плазмы, циркулируя в кровотоке.Это свойство выражается в процентах циркулирующего лекарственного средства, связанного с белком, и было обнаружено, что оно коррелирует со сродством анестетика к белку в натриевых каналах. Чем выше тенденция к связыванию белков, тем дольше анестетик будет выдерживать нервную блокаду. Например, бупивакаин демонстрирует 95% связывания с белками по сравнению с 55% для мепивакаина, и это объясняется разницей в продолжительности их нервной блокады.
Продолжительность анестезии также зависит от времени, в течение которого местный анестетик остается в непосредственной близости от нервных волокон.Локальная секвестрация сильно жирорастворимых анестетиков может обеспечить постоянное высвобождение к мембранам нейронов, увеличивая продолжительность, но сужение соседней сосудистой сети в этом отношении более значимо. По этой причине во многие препараты добавляют вазопрессоры, чтобы замедлить абсорбцию и продлить анестезию. Это особенно важно, потому что сами местные анестетики различаются по своей способности вызывать расширение сосудов. Например, при использовании без вазопрессоров лидокаин сокращает свою продолжительность действия за счет расширения местной сосудистой сети, в то время как мепивакаин и бупивакаин этого не делают.Составы простого лидокаина могут быть полезны для кратковременных процедур после инфильтрации, но их эффективность при блокаде нерва невысока.
ТОКСИЧНОСТЬ МЕСТНЫХ АНЕСТЕТИКОВ
Системная токсичность, приписываемая местным анестетикам, зависит от дозы, но понимание этих доз не всегда является простым делом. К сожалению, использование картриджей с анестетиком в стоматологии привело к небрежности в оценке фактического количества анестетика, которое мы вводим нашим пациентам. К сожалению, эту практику продолжают развивать во время бакалавриата и во многих уважаемых стоматологических публикациях.Стоматологический картридж представляет собой объем, а не дозу, которую более правильно выражать в миллиграммах или микрограммах. Кроме того, стоматологические картриджи часто содержат 2 препарата: местный анестетик и вазопрессор, каждый из которых имеет отдельную дозу. Еще больше усложняет ситуацию то, что стоматологические картриджи содержат особые объемы, такие как 1,7 или 1,8 мл. Сумма этих проблем делает попытки вычислений реальных дозировок и позволяет запоминать количества на картридж, а не фактическую оценку правильных доз. Эта практика еще больше усложняется, когда картриджи содержат различные концентрации местных анестетиков и вазопрессоров.Чтобы упростить расчет дозировки, разумно отказаться от концепции картриджей и считать, что каждый из них содержит 2 мл объема. Это приведет к завышению количества, вводимого пациенту, что является безопасной практикой. Например, когда было введено 4½ картриджа, оцените его как 9 мл. Эту единицу объема легче преобразовать в приблизительную дозу каждого лекарства в миллиграммах или микрограммах, как показано на.
Таблица 1.
Приблизительные дозировки *
По мере всасывания местных анестетиков из места инъекции их концентрация в кровотоке повышается, а периферическая нервная система и центральная нервная система (ЦНС) подавляются в зависимости от дозы. манера.(См.) Низкие сывороточные концентрации используются клинически для подавления сердечных аритмий и статусных судорог, но, по иронии судьбы, более высокие концентрации вызывают судорожную активность. Судорожные припадки являются первоначальным опасным для жизни последствием передозировки местного анестетика. Предположительно это происходит из-за избирательного угнетения центральных тормозных путей, которые позволяют возбуждающим трактам работать безумно. По мере того, как концентрации в сыворотке продолжают расти, все метаболические пути ингибируются, что приводит к коме, остановке дыхания и, в конечном итоге, сердечно-сосудистому коллапсу.Признаки токсичности лидокаина могут проявляться при концентрациях> 5 мкг / мл, но для судорожных припадков обычно требуются концентрации> 10 мкг / мл.
Приблизительные концентрации лидокаина в сыворотке и системные эффекты.
Важно, чтобы местные анестетики считались депрессантами ЦНС, и они потенцируют любое угнетение дыхания, связанное с седативными средствами и опиоидами. Кроме того, сывороточные концентрации, необходимые для возникновения судорог, ниже, если присутствует гиперкарбия (повышенный уровень углекислого газа).Это тот случай, когда угнетение дыхания вызывается одновременным приемом седативных средств и опиоидов. Гудсон и Мур задокументировали катастрофические последствия взаимодействия этого лекарственного средства у педиатрических пациентов, получающих процедурную седацию, наряду с чрезмерными дозами местных анестетиков. 3
Хотя все местные анестетики несут сравнимый риск токсичности для ЦНС, следует отметить, что бупивакаин проявляет больший потенциал прямой сердечной токсичности, чем другие агенты. 1 , 2 Объяснение не полностью установлено, но считается, что оно связано с тем фактом, что бупивакаин имеет большее сродство к неактивным и покоящимся конфигурациям натриевых каналов и медленнее диссоциирует из этих каналов. Это задерживает восстановление от потенциалов действия, делая сердечные ткани восприимчивыми к аритмиям. Эта проблема актуальна для определенных медицинских процедур, во время которых бупивакаин вводят в очень высоких дозах. Никогда не было обнаружено, что это происходит при дозах до максимальных, рекомендованных для стоматологической анестезии.
Возникает очевидный вопрос: какая системная концентрация в сыворотке крови следует за введением определенной дозы местного анестетика. В 1972 году Скотт и др. Опубликовали одно из серии знаковых клинических исследований, оценивающих переменные, которые определяют последующие концентрации лидокаина и прилокаина в сыворотке. 4 Неудивительно, что концентрации в сыворотке крови менялись в зависимости от относительной васкулярности тканей, в которые вводили анестетик. При использовании лидокаина в дозе 400 мг самые высокие уровни в сыворотке наблюдались при последующей инфильтрации слизистой оболочки влагалища, а самые низкие — при подкожной инфильтрации брюшной полости.Однако в каждом случае пиковый уровень в сыворотке крови наблюдался через 20–30 минут после инъекции только лидокаина. Независимо от способа введения пиковые уровни были снижены, а скорость абсорбции замедлена путем добавления 1 200 000 эпинефрина к раствору местного анестетика. Разумно предположить, что системные концентрации после подслизистой инъекции в ротовую полость будут приближаться к таковым после инъекции в слизистую оболочку влагалища из-за аналогичной васкулярности. К сожалению, очень мало стоматологических исследований, посвященных более высоким дозам местных анестетиков.Тем не менее, Hersh et al. 5 опубликовали впечатляющее исследование, в котором были получены сопоставимые результаты после нескольких внутриротовых инъекций в общей сложности 7 картриджей (1,7 мл каждый = ~ 480 мг) артикаина, содержащего адреналин 1 ∶ 200 000. (См.) Можно разумно заключить, что соблюдение опубликованных максимальных рекомендуемых доз для местных анестетиков не приведет к системным уровням в сыворотке, которые приближаются к уровням, связанным с токсичностью.
Концентрации местного анестетика в сыворотке крови. (См. Текст для объяснения.По материалам Scott et al. , 4, и Hersh et al. 5 )
Дополнительные переменные также рассматривались Скоттом и др. 4 Как и ожидалось, дозировка и скорость инъекции были напрямую связаны с концентрацией в сыворотке. Концентрация раствора, например, 2% против 4%, не имела значения; концентрации в сыворотке были связаны с общей дозировкой. Введение 20 мл 2% или 10 мл 4% (400 мг) привело к такой же концентрации в сыворотке. При использовании лидокаина или других анестетиков, независимо от их концентрации, необходимо учитывать введенную дозу (миллиграммы), а не объем (миллилитры или картриджи).
Вопреки общепринятому мнению, возраст или вес пациента не позволяют предсказать системную концентрацию в сыворотке после доз, рассчитанных в миллиграммах на возраст (годы) или миллиграммах на килограмм. Однако при ведении педиатрических пациентов максимальные дозировки обычно выражаются в мг / кг, и это следует соблюдать в качестве меры предосторожности. Однако это не имеет большого значения для взрослых, и следует придерживаться рекомендаций, выраженных в максимальной дозе в миллиграммах, независимо от веса и возраста.Очевидно, это максимальное количество не должно превышаться при расчете доз в мг / кг для больших детей.
При рассмотрении токсичности любого класса наркотиков следует помнить о метаболитах, а также о исходном лекарстве. Метаболит прилокаина, o -толуидин, может окислять железо в гемоглобине от двухвалентного (Fe 2+ ) до трехвалентного (Fe 3+ ). Измененные таким образом гемы не связывают кислород, а нормальные гемы на одной и той же молекуле гемоглобина с трудом выделяют свой кислород.Эта форма гемоглобина называется метгемоглобином, и когда таким образом изменяется> 1% общего гемоглобина, состояние называется метгемоглобинемией. Пациенты выглядят синюшными и становятся симптоматичными, когда доля метгемоглобина превышает 15%. 6 Насыщение гемоглобина по данным пульсоксиметрии (SpO 2 ) будет снижаться, несмотря на клинические доказательства эффективной оксигенации и вентиляции. Например, показания пульсоксиметра могут быть <90%, но фактическое давление кислорода в артериальной крови (PaO 2 ) может находиться в пределах нормы (> 80 мм рт.Состояние становится опасным для жизни, когда уровень метгемоглобина превышает 50–60%, и лечится с помощью внутривенного введения метиленового синего, который восстанавливает геммы до нормального состояния. Маловероятно, что метгемоглобинемия, связанная с прилокаином, возникнет после приема рекомендуемых доз. Редко можно встретить пациента с наследственной метгемоглобинемией, что противопоказано к применению прилокаина.
Аллергия на местные анестетики
Пациенты часто заявляют, что у них аллергия на местные анестетики.Однако при тщательном расспросе обычно выясняется, что они испытали либо обморок, связанный с инъекцией, либо учащенное сердцебиение, связанное с адреналином, содержащимся в растворе или высвобожденным эндогенно. Аллергические реакции после инъекций местного анестетика, скорее всего, связаны с консервантами (метилпарабен) или антиоксидантами (сульфитами), содержащимися в растворе. 7 Метилпарабен включен в многодозовые флаконы для предотвращения роста микробов.Его больше нет во флаконах с одной дозой или стоматологических картриджах. Сульфиты предотвращают окисление вазопрессоров и входят только в те стоматологические картриджи, которые содержат адреналин или левонордефрин.
Аллергические реакции вызываются иммунными механизмами, посредством которых лимфоциты сенсибилизируются к антигену и при последующем воздействии опосредуют ряд патофизиологических изменений. Гелл и Кумбс сначала отнесли реакции гиперчувствительности (аллергические) к типам от I до IV, основываясь на различных иммунологических механизмах. 8 Реакции типа I возникают в течение нескольких минут после провокации и опосредуются антителами или иммуноглобулином E (IgE), продуцируемым B-лимфоцитами. Это тип, который чаще всего провоцируется компонентами местных анестетиков. Реакции типа 4 задерживаются на несколько дней после провокации и опосредуются сенсибилизированными Т-лимфоцитами. Этот тип реакции на местные анестетики бывает очень редко.
Чтобы лекарства были иммуногенными, они должны иметь большую молекулярную массу и обладать множественными валентностями, чтобы их могли распознать иммунные клетки. 9 Крупные белки, такие как инсулин животного происхождения, удовлетворяют этим требованиям и хорошо зарекомендовали себя как иммуногенные. Большинство молекул лекарств слишком малы и фактически объединяются с другими молекулами, которые действуют как носители, вызывая аллергическую реакцию. В случае сульфонамидных антибиотиков, например, фенильное кольцо, содержащее аминное замещение, является виновником образования иммуногенного комплекса. Этот фрагмент является общим для других производных парааминобензойной кислоты (ПАБК), таких как метилпарабен и некоторых, но не всех, сложноэфирных местных анестетиков.В этих случаях может существовать потенциал перекрестной аллергенности, поскольку они имеют общую молекулярную структуру, например, сульфамидные антибиотики, метилпарабен и сложные эфиры ПАБК.
Говоря о местных анестетиках, бессмысленно называть сложные эфиры более аллергенными, чем амиды. Сложный эфир представляет собой просто химическую связь и не придает соединению иммуногенности. Скорее всего, виноват молекулярный компонент, соединенный этой связью. Это заблуждение привело к тому, что некоторые агенты были ошибочно названы перекрестно аллергенными с сульфонамидными антибиотиками.Артикаин классифицируется как амидный местный анестетик из-за связи между его жирорастворимым кольцом и концевым амином. Его тиофеновое кольцо содержит атом серы, который не обладает иммуногенными свойствами, и боковую цепь сложного эфира, которая делает соединение неактивным после гидролиза. Однако артикаин не высвобождает метаболит, напоминающий ПАБК, и не вызывает опасений относительно перекрестной иммуногенности с сульфаниламидами. Напротив, прокаин является представителем сложных эфиров, полученных из PABA, и гидролиз высвобождает фрагмент, который является потенциально иммуногенным ().
Молекулярные структуры и аллергенность. Иммуногенность объясняется лекарствами, имеющими фенильное кольцо с пара-аминным замещением. Он содержится в сульфонамидных антибиотиках и соединениях, содержащих парааминобензойную кислоту (ПАБК), таких как некоторые солнцезащитные кремы и косметика. Он также содержится в консервантах на основе метилпарабена и местных анестетиках на основе сложных эфиров, таких как прокаин. Сложноэфирные связи (прокаин) или боковые цепи (артикаин) не являются иммуногенными, как и атом серы тиофенового кольца (артикаин).* указывает на иммуногенный фрагмент.
Последнее заблуждение относится к сульфитам. Их включают в растворы местных анестетиков, содержащие вазопрессоры, чтобы предотвратить их окисление. Это неорганические соединения (-SO 3 ), которые участвуют в аллергических реакциях, но они не имеют никакого отношения к иммуногенности, приписываемой соединениям, родственным PABA. Эти агенты также используются в качестве антиоксидантов в свежих фруктах и овощах, чтобы сохранить их цвет и внешний вид. Важно отметить, что пациенты с аллергией на такие продукты могут испытывать перекрестные реакции с растворами местных анестетиков, содержащих вазопрессоры, поскольку они содержат те же самые сульфиты.
Сообщения об аллергических реакциях на местные анестетики появлялись в научной литературе с некоторой частотой. 10 , 11 Однако трудно понять точность или фактическую частоту из-за несоответствия в методах подтверждения, которые включают кожные уколы, внутрикожные инъекции и провокационные лекарственные препараты. Во многих случаях не было подтверждения фактического виновника, консерванта или местного анестетика. Более того, лишь очень немногие из них действительно подтвердили присутствие IgE к лекарственному средству с помощью иммуноблоттинга.Обширный анализ этой литературы недавно был проведен Speca et al. 12
Практически во всех описаниях случаев у пациентов действительно наблюдались признаки и симптомы, соответствующие аллергической реакции. Был ли реальный патогенез действительно иммуноопосредованным (аллергия), вероятно, скорее академический, чем прагматический. Последнее событие в этих реакциях приписывается синтезу и высвобождению медиаторов, вместе называемых аутакоидами, из которых гистамин и лейкотриены являются наиболее важными.Эти аутакоиды не только оказывают прямое воздействие на ткани, но также могут привлекать различные воспалительные клетки, которые способствуют так называемой реакции поздней фазы, которая может не проявляться в течение нескольких дней после провокации. В самом деле, лекарства нередко генерируют эти аутакоиды в результате действий, которые не являются иммуноопосредованными и поэтому неправильно классифицируются как аллергия. Меперидин стимулирует высвобождение гистамина из тучных клеток, а нестероидные противовоспалительные препараты могут способствовать синтезу лейкотриенов.В таких случаях реакция пациента обычно обозначается как псевдоаллергическая, чтобы отличить ее от истинной аллергии, которая является иммунной.
Если пациент описывает реакцию, которая, по крайней мере, клинически соответствует аллергии, стоматолог должен избегать использования вызывающего заболевания агента до тех пор, пока его не осмотрит аллерголог. В случае, если до получения медицинского разрешения требуется анестетик, самым разумным выбором будет либо мепивакаин, либо прилокаин без вазопрессоров. Согласно общепринятому мнению, если местные анестетики действительно вызывают аллергию, эфиры ПАБК будут более вероятными, чем амидные местные анестетики.Кроме того, избегая растворов, содержащих вазопрессоры, можно избежать любых бисульфитов, которые входят в состав антиоксидантов. Возможна чувствительность к различным сульфитам, особенно у пациентов с астмой или атопией. Эти принципы являются основой блок-схемы, представленной в. Пациенту никогда нельзя отказывать в преимуществах местной анестезии на основании ошибочных предположений относительно аллергии.
Ведение пациентов с аллергией на местные анестетики. Исключите распространенные реакции, ошибочно принимаемые за аллергию, например обмороки и тахикардию.Затем установите, что характер их реакции, по крайней мере, напоминал реакцию гиперчувствительности, например сыпь, зуд, крапивницу или одышку. Если препарат известен, выберите другой амид, не содержащий вазопрессоров, чтобы не было сульфитов. В противном случае направьте пациента к аллергологу для тестирования сульфитов и типичных местных анестетиков, таких как лидокаин, мепивакаин и прилокаин. (Адаптировано из deShazo и Kemp. 13 )
Местная токсичность
Ишемический некроз тканей может возникнуть после инъекций местных анестетиков.Это может быть связано с раздражающим действием раствора, давлением больших объемов или сужением сосудистой сети из-за вазопрессоров. Это особенно опасно при инъекции в прикрепленную слизистую оболочку, например твердое небо. Также растет беспокойство по поводу прямой нейротоксичности, связанной с составами, содержащими высокие концентрации, такие как 4% артикаин и прилокаин.
Хаас и Леннон сообщили о повышении частоты парестезий в Канаде после введения артикаина в середине 1980-х годов. 14 Только в 1993 году было зарегистрировано 14 случаев парестезии, и все они были связаны с применением артикаина или прилокаина. Когда артикаин впервые был представлен на одобрение Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США, было установлено, что он имеет более высокий риск парестезии, чем лидокаин.
Совсем недавно Гаристо и др. 15 рассмотрели заявления о парестезии в Соединенных Штатах в период с ноября 1997 года по август 2008 года и обнаружили 248 случаев парестезии после стоматологических процедур.В большинстве случаев (~ 95%) была задействована блокада нижнечелюстного нерва, и в 89% из них был поражен язычный нерв. По сравнению с другими местными анестетиками, парестезия была в 7,3 раза более вероятна при использовании 4% артикаина и в 3,6 раза более вероятна при использовании 4% прилокаина. Подобные результаты из отчетов о парестезии в Дании были опубликованы Hillerup et al. 16 Эти данные могут быть еще более значимыми, если учесть количество случаев, которые вполне могут остаться незарегистрированными.
Хотя стоматологическое сообщество не спешило прийти к консенсусу по этому вопросу, следует понимать, что в литературе по медицинской анестезии категорически утверждается, что более высокая концентрация растворов местных анестетиков увеличивает риск прямой нейротоксичности для нервных стволов: «Все клинически используемые Местные анестетики могут оказывать прямое токсическое воздействие на нервы, если они достигают достаточно высоких интраневральных концентраций.Клиницисты должны знать, что концентрации приготовленных растворов местных анестетиков сами по себе нейротоксичны и что их разведение in situ или в тканях важно для безопасного использования ». 1
Этот факт дополнительно подтверждается Hillerup et al, которые продемонстрировали большую нервную токсичность 4 по сравнению с 2% артикаином в препаратах седалищного нерва. 17 Как и в случае со всеми лекарствами, каждый практикующий врач должен провести анализ соотношения риска и пользы перед применением лекарства. Только в том случае, если польза от использования артикаина превышает риск для этого практикующего врача, его следует рассматривать для использования.Было бы разумно ограничить использование 4% концентраций для инфильтрации и избегать их использования для нервной блокады, отдав предпочтение агентам, сформулированным в более низких концентрациях. 15 , 16
СРАВНЕНИЯ С МЕСТНЫМИ АНЕСТЕТИКАМИ
Лидокаин продолжает оставаться наиболее широко используемым местным анестетиком в Соединенных Штатах, но все эти агенты имеют сопоставимую эффективность. Они различаются по эффективности и нескольким фармакокинетическим параметрам, которые объясняют различия в начале и продолжительности анестезии.При выборе конкретного агента необходимо учитывать продолжительность запланированной процедуры и проблемы, связанные с концентрацией вазопрессоров. Для длительных процедур логичным выбором является бупивакаин, но, согласно исследованиям, в которых сравнивались различные анестетики, он считается одним из наиболее болезненных агентов во время инъекции. 18 — , 20 Одна из стратегий — обеспечить первые 60–90 минут анестезии с использованием менее раздражающего агента (лидокаин или прилокаин), а затем повторно ввести анестезируемую ткань с бупивакаином, чтобы обеспечить хорошее обезболивание в послеоперационном периоде. период.Такая стратегия наиболее эффективна после нервных блокад; следует ожидать более короткую продолжительность пульпарной анестезии после инфильтрации. (См.)
Таблица 2.
Местные анестетики в картриджах 21 , 22
Несмотря на неофициальные заявления о превосходстве артикаина над лидокаином при блокаде нижних альвеол, опубликованные исследования практически не обнаружили разницы. , особенно при наличии симптомов зубов. 22 — , 24 Любое небольшое преимущество артикаина компенсируется его повышенным риском парестезии, о которой говорилось выше.Однако при инфильтрации нижней челюсти артикаин явно превосходит его и не несет риска нервной токсичности, если не вводится рядом с подбородочным нервом. 22 , 25 , 26 Превосходство артикаина можно объяснить его высокой растворимостью в липидах и концентрацией его препаратов. В отличие от других анестетиков, содержащих бензол в качестве ароматического кольца, артикаин имеет тиофеновое кольцо и замены, которые придают большую растворимость липидов, чем другие местные анестетики, за исключением бупивакаина.Это свойство должно было позволить использовать его в более низкой концентрации, но на самом деле он был составлен в виде 4% раствора. Артикаин не только более растворим в липидах, но и содержит большее количество молекул, чем, например, 2% лидокаин в равном объеме. На сегодняшний день не было опубликованных исследований, сравнивающих артикаин с 4% растворами лидокаина при инфильтрации нижней челюсти. Лидокаин в этой концентрации представляет неприемлемый риск системной токсичности, что дает еще одно привлекательное свойство артикаина: характер клиренса.
Хотя артикаин классифицируется как амид, из-за связи его промежуточной цепи тиофеновое кольцо также содержит сложноэфирную боковую цепь. Эта цепь гидролизуется эстеразами плазмы, что делает молекулу неактивной. В результате период полувыведения артикаина составляет всего 20-40 минут по сравнению с> 90 минутами для лидокаина и других амидов, требующих печеночного клиренса. По этой причине артикаин представляет меньший риск системной токсичности при длительных приемах, когда вводятся дополнительные дозы анестетика.Однако следует помнить, что артикаин с концентрацией 4% содержит удвоенную дозу 2% лидокаина на введенный объем, и их максимальные рекомендуемые дозы идентичны.
ВАЗОПРЕССОРЫ
Вазопрессоры — это препараты, которые обеспечивают сужение кровеносных сосудов путем активации альфа-1-адренорецепторов. Их сочетают с местными анестетиками для обеспечения гемостаза в операционном поле и задержки абсорбции анестетика. Задержка всасывания местных анестетиков не только снижает риск системной токсичности, но и увеличивает продолжительность анестезии.Адреналин является наиболее распространенным агентом, используемым для этой цели, несмотря на то, что он проявляет значительную сердечную стимуляцию из-за его дополнительного действия в качестве агониста бета-1-адренорецепторов.
Несмотря на популярность адреналина 1 100 000, его концентрации выше 1 ∶ 200 000 (5 мкг / мл) практически не дают никаких преимуществ. Более высокие концентрации не обеспечивают лучшего начала или продолжительности блокады нижнего альвеолярного нерва. 29 , 30 Более высокие концентрации также не снижают концентрации местного анестетика в сыворотке. 4 , 5 Однако более высокие концентрации, например, 1 ∶ 100 000 (10 мкг / мл) и 1 50 000 (20 мкг / мл), могут обеспечить лучший гемостаз при инфильтрации в операционном поле, когда это влияние желанный.
Влияния на сердечно-сосудистую систему
Чтобы должным образом решить вопросы безопасности, нужно сначала понять принципы расчета дозировки, представленные в этой статье. Продолжаются дискуссии о пагубном влиянии адреналина на пациентов с сердечно-сосудистыми заболеваниями.Часто этот спор продолжается без полного понимания фактического действия и эффектов этого широко используемого препарата. Адреналин действует как агонист рецепторов альфа, бета-1 и бета-2. Эти действия объясняют его влияние на сердечно-сосудистую систему, как показано на рис. Прежде чем анализировать этот показатель, важно прояснить распространенное заблуждение. Стоматолог рассматривает адреналин как сосудосуживающее средство на основании его эффектов при введении в подслизистые ткани. Это потому, что крошечные сосуды в этом месте содержат только альфа-рецепторы.Более крупные системные артерии, которые определяют артериальное сопротивление и диастолическое артериальное давление, содержат гораздо больше бета-2, чем альфа-рецепторов, и после абсорбции низкие дозы адреналина вызывают расширение этих сосудов.
Сердечно-сосудистые эффекты адреналина. 31 Следующий график иллюстрирует типичную сердечно-сосудистую реакцию на адреналин, вводимый в виде непрерывной внутривенной инфузии 10 мкг / мин. (Это количество содержится в 1 мл концентрации 1 100 000.) Адреналин увеличивает частоту сердечных сокращений (ЧСС) за счет активации рецепторов бета-1 в синоатриальном узле, нормальном кардиостимуляторе сердца. Он также активирует рецепторы бета-1 на клетках миокарда, увеличивая их сократимость и повышая систолическое артериальное давление (САД). Однако он активирует бета-2 рецепторы на системных артериях, вызывая расширение сосудов. Это снижение артериального сопротивления вызывает снижение диастолического давления (ДАД). Эти эффекты приводят к небольшому изменению среднего артериального давления (САД).
Клинические испытания однозначно подтвердили, что даже небольшие дозы адреналина в растворах местных анестетиков влияют на сердечно-сосудистую функцию.Dionne et al. 32 изучали влияние 3 картриджей 2% лидокаина с эпинефрином 1 100 000 (~ 60 мкг адреналина). Подслизистая инъекция этой дозировки увеличивала сердечный выброс, частоту сердечных сокращений и ударный объем. Системное артериальное сопротивление было снижено, а среднее артериальное давление практически не изменилось. Аналогичным образом, Hersh et al. 5 наблюдали аналогичные результаты после введения артикаина, содержащего 1 100 000 (∼120 мкг) и 1 ∶ 200 000 (∼60 мкг) адреналина, с большей реакцией на более высокую дозировку.Эти результаты согласуются с общепризнанными влияниями, как показано на рис.
Результаты исследований, подобных только что упомянутым, следует рассматривать в перспективе. Например, влияние ~ 120 мкг адреналина, опубликованное Hersh et al. 5 , было незначительным: увеличение частоты сердечных сокращений на ~ 8-10 ударов в минуту и изменения артериального давления в среднем на ~ 5 мм рт. Тем не менее, 14 участников были в отличном состоянии, их показатели жизненно важных функций в состоянии покоя составляли в среднем 68 для частоты сердечных сокращений, 125 мм рт. Ст. Для систолического давления и 73 мм рт. Ст. Для диастолического давления.Кроме того, они не принимали никаких серьезных лекарств. Очевидно, что такие люди могут легко переносить введенные дозы, но следует отметить, что двое из этих здоровых участников действительно сообщили о сердцебиении.
Даже небольшие дозы адреналина вызывают сердечно-сосудистые эффекты; это однозначно. Вопрос заключается в том, представляют ли сердечно-сосудистые воздействия адреналина значительный риск для пациентов с различной степенью компрометации. Стандарты и руководства продолжают продвигаться, но на самом деле все они анекдотичны.Наивно предлагать ввести ограничение «2 картриджа» для пациентов с сердечно-сосудистыми заболеваниями. В конечном итоге для принятия решения стоматолог должен вынести здравое клиническое суждение, основанное на тщательном анализе каждого рассматриваемого пациента. Если показана консультация с врачом пациента, обсудите ожидаемый диапазон доз в микрограммах, а не в концентрациях или картриджах. Например, если планируется 2–4 картриджа с местным анестетиком, объясните, что вы будете использовать 40–80 мкг адреналина, инфильтрованного под слизистую оболочку, а не 2–4 картриджа с адреналином 1 ∶ 100 000.Врач не знаком с дозировкой, выраженной в картриджах или концентрациях. Для справки рассмотрите стандартную дозу адреналина для лечения аллергической реакции: 0,3 мг или 300 мкг. Врач, как правило, будет интересоваться дозами 100 мкг или больше.
Левонордефрин (Неокобефрин) — вазопрессор в сочетании с 2% препаратами мепивакаина в США. Он больше похож на норадреналин, чем на адреналин, поскольку не обладает активностью в отношении бета-2-рецепторов. По этой причине он повышает не только систолическое артериальное давление, как адреналин, но также диастолическое и среднее артериальное давление.У некоторых пациентов это может вызвать рефлекторное блуждающее влияние на частоту сердечных сокращений, которое может частично компенсировать прямую стимуляцию сердечного ритма рецепторами бета-1. Однако исследования, оценивающие влияние сердечно-сосудистой системы после внутрикостных инъекций, обнаружили небольшую разницу между адреналином и левонордефрином. 33 , 34 Это, вероятно, объясняется быстрым всасыванием, которое позволяет проводить прямую стимуляцию бета-1 до того, как вмешаются рефлекторные реакции на среднее артериальное давление.Сравнение адреналина и левонордефрина представлено в.
Таблица 3.
Действия адреналина по сравнению с левонордефрином
Максимально допустимые дозы вазопрессоров не установлены. Выражать ограничения в виде назначений нецелесообразно; Время лечения может составлять от 30 минут до 3-4 часов. Кроме того, влияние данной дозы вазопрессора на пациентов сильно различается. Пиковое влияние адреналина обычно наблюдается в течение 5–10 минут после инъекции 5 и быстро снижается; Адреналин и левонордефрин являются катехоламинами и быстро метаболизируются катехол-о-метилтрансферазой.Фактически, период полувыведения большинства катехоламинов составляет всего 1-3 минуты. Как правило, гемодинамические влияния наблюдаются в течение нескольких минут после инъекции и полностью исчезают через 10-15 минут. Доза адреналина 40 мкг (приблизительно 2 картриджа с содержанием адреналина 1 100 000) является наиболее консервативным и часто упоминаемым ограничением дозы для пациентов с серьезными сердечно-сосудистыми заболеваниями. Следует уточнить, что это руководство более точно отражает 30-минутные периоды времени, а не встречи.Более рациональное предложение — основывать дозировку на оценке пациента, а не на максимальных количествах. Например, если по какой-либо причине медицинский статус пациента ставится под сомнение, разумный протокол состоит в том, чтобы записывать исходную частоту сердечных сокращений и артериальное давление до операции и снова после каждого введения 20-40 мкг. Это соответствует 1-2 картриджам с концентрацией адреналина 1 ∶ 100 000. Практически любой пациент может выдержать такое количество сердечно-сосудистых воздействий. Если состояние пациента остается стабильным, могут быть введены дополнительные дозы, после чего следует аналогичная схема повторной оценки показателей жизнедеятельности.
Лекарственные взаимодействия
Возможные лекарственные взаимодействия были подробно рассмотрены в предыдущей статье для повышения квалификации в этом журнале. 35 Наиболее важные из них относятся к возможной усиленной стимуляции сердечно-сосудистой системы. Вазопрессоры, обнаруженные в формах местного анестетика, обладают кардиотоническим действием, и это может стать более значительным, когда пациенты получают лечение любым лекарственным средством, оказывающим подобное влияние. К ним относятся трициклические антидепрессанты и ингибиторы моноаминоксидазы, дигоксин, гормон щитовидной железы или любые симпатомиметики, используемые для контроля веса или нарушений внимания.Вазопрессоры не противопоказаны этим пациентам, но их следует назначать с осторожностью, как описано выше для пациентов с ограниченными возможностями здоровья. Пациентам, у которых есть подозрение на злоупотребление стимуляторами, например кокаином, может быть разумным вообще избегать вазопрессоров.
Осторожное использование вазопрессоров также рекомендуется пациентам, принимающим неселективные бета-блокаторы. В отличие от селективных агентов, которые блокируют только рецепторы бета-1 в сердце, неселективные агенты также блокируют сосудистые рецепторы бета-2.В этом случае альфа-агонистическое действие вазопрессоров становится более выраженным, и как диастолическое, так и среднее артериальное давление могут стать опасно повышенными. Обычно это сопровождается внезапным рефлекторным замедлением сердечного ритма. Существенные последствия этого взаимодействия хорошо задокументированы. 36 — , 38 Взаимодействие с бета-блокаторами происходит во времени, идентичном наблюдаемому для нормальных сердечно-сосудистых реакций на адреналин. Он начинается после абсорбции из места инъекции, которая обычно достигает пика в течение 5 минут и снижается в течение последующих 10–15 минут.Вазопрессоры не противопоказаны пациентам, принимающим неселективные бета-блокаторы, но дозы должны быть консервативными, а артериальное давление периодически контролировать во время приема, как описано выше. Следует избегать использования ретракционных шнуров, пропитанных рацемическим адреналином. Эти продукты содержат адреналин в количествах, намного превышающих те, которые содержатся в составах местных анестетиков.
Местные анестетики: обзор фармакологических аспектов
Abstract
Местные анестетики обладают впечатляющей историей эффективности и безопасности в медицинской и стоматологической практике.Их использование настолько рутинно, а побочные эффекты настолько редки, что медицинские работники могут по понятным причинам упускать из виду многие из своих фармакотерапевтических принципов. Целью данной статьи для повышения квалификации является обзор и обновление основных фармакологических характеристик различных местных анестетиков, используемых в настоящее время. Технические соображения будут рассмотрены в следующей статье.
Ключевые слова: Местные анестетики, Фармакология, Токсичность лекарств, Стоматология
Местные анестетики прерывают нервную проводимость, подавляя приток ионов натрия через каналы или ионофоры в мембранах нейронов.Обычно эти каналы существуют в состоянии покоя, во время которого ионам натрия запрещен доступ. Когда нейрон стимулируется, канал принимает активированное или открытое состояние, в котором ионы натрия диффундируют в клетку, инициируя деполяризацию. После этого внезапного изменения напряжения на мембране натриевой канал переходит в неактивное состояние, во время которого дальнейший приток запрещается, в то время как активные транспортные механизмы возвращают ионы натрия наружу. После этой реполяризации канал принимает нормальное состояние покоя.Понимание этих состояний натриевых каналов помогает объяснить предпочтительную чувствительность местных анестетиков к различным классам нейронных волокон.
Местные анестетики обладают большим сродством к рецепторам внутри натриевых каналов во время их активированного и инактивированного состояний, чем когда они находятся в состоянии покоя. 1 , 2 Следовательно, нервные волокна с более высокой скоростью возбуждения наиболее восприимчивы к действию местного анестетика. Кроме того, волокна меньшего размера, как правило, более восприимчивы, потому что данный объем раствора местного анестетика может более легко блокировать необходимое количество натриевых каналов для полного прерывания передачи импульса.По этим причинам наиболее чувствительными являются крошечные, быстрорастущие вегетативные волокна, за ними следуют сенсорные волокна и, наконец, соматические двигательные волокна. 1 , 2 Анестезиолог, блокирующий смешанные спинномозговые нервы, хорошо осведомлен об этой разной чувствительности. Когда пациенты оправляются от спинномозговой анестезии, они сначала восстанавливают произвольную двигательную функцию, затем возвращаются ощущения и, наконец, они могут мочиться (вегетативный контроль). Дантисту обычно не приходится уделять этому внимание, потому что ветви тройничного нерва, анестезируемые при стоматологических процедурах, состоят только из небольших, быстро возбуждающихся сенсорных волокон.Однако многие классы сенсорных волокон также различаются по диаметру и скорости возбуждения. Например, болевые волокна более чувствительны, чем волокна, несущие давление и проприоцепцию. Пациента может по-прежнему беспокоить чувство давления, несмотря на полную анестезию болевых волокон.
ОБЩИЕ СВОЙСТВА МЕСТНЫХ АНЕСТЕТИКОВ
Молекулярная структура всех местных анестетиков состоит из 3 компонентов: (а) липофильное ароматическое кольцо, (б) промежуточная сложноэфирная или амидная связь и (в) третичный амин.Каждый из этих компонентов придает молекуле различные клинические свойства. (См.)
Местноанестезирующий состав.
Эффективность анестетика
Местные анестетики различаются по эффективности, что позволяет использовать их в концентрациях от 0,5 до 4%. Во многом это является результатом различий в растворимости липидов, что усиливает диффузию через нервные оболочки и нервные мембраны. Это свойство определяется ароматическим кольцом и его замещениями, а также замещениями, добавленными к третичному амину.Например, бупивакаин более жирорастворим и эффективен, чем артикаин, что позволяет составлять его в виде концентрации 0,5% (5 мг / мл), а не 4% (40 мг / мл).
Время начала действия
Повышенная растворимость лекарства в липидах не только увеличивает эффективность, но и способствует более быстрой диффузии через клеточные мембраны. Для местных анестетиков это ускоряет начало анестезии изолированных волокон во время исследований in vitro, но следует понимать, что в клинической практике играют роль и другие факторы.Например, присущие сосудорасширяющие свойства могут способствовать системной абсорбции до того, как анестетик достигнет нервной оболочки. Высокая растворимость липидов может препятствовать диспергированию в тканевых жидкостях, а также способствовать секвестрации в соседних жировых тканях или миелиновых оболочках. В любом случае меньшее количество молекул достигает нейрональной мембраны, и начало реакции задерживается. Следовательно, в отличие от исследований изолированных волокон in vitro, большая растворимость липидов обычно замедляет наступление анестезии в клинических условиях.Введение более высоких концентраций, которые позволяют большему количеству молекул достигать мембраны и ускоряют наступление, может компенсировать это влияние. Хотя бупивакаин и артикаин хорошо растворимы в липидах, 4% концентрация артикаина обеспечивает гораздо более быстрое начало.
Несмотря на множество факторов, влияющих на количество местного анестетика, достигающего нервных волокон, наиболее важным фактором, определяющим начало анестезии, является пропорция этих молекул, которые находятся в жирорастворимом, а не в водорастворимом состоянии.Конечный амин, проиллюстрированный на, может существовать в третичной форме (3 связи), которая является растворимой в липидах, или в виде четвертичной формы (4 связи), которая имеет положительный заряд и делает молекулу водорастворимой. Чтобы основа местного анестетика была стабильной в растворе, ее формулируют в виде гидрохлоридной соли. Таким образом, молекулы существуют в четвертичном, водорастворимом состоянии во время инъекции и не могут проникать в нейрон. Следовательно, время начала местной анестезии напрямую связано с долей молекул, которые превращаются в третичную липидорастворимую структуру при воздействии физиологического pH (7.4). Эта пропорция определяется константой ионизации (pKa) анестетика и рассчитывается с использованием уравнения Хендерсона-Хассельбаха:
Проще говоря, если бы местный анестетик имел pKa 7,4 и вводился в ткани, имеющие физиологические свойства. pH 7,4, 50% молекул будут существовать в четвертичной (катионной) форме и 50% будут существовать в третичной (незаряженной) форме; только половина молекул будет жирорастворимой и сможет проникать в нейрон. К сожалению, pKa для всех местных анестетиков больше 7.4 (физиологический pH), и поэтому большая часть молекул существует в четвертичной водорастворимой форме при введении в нормальную ткань. Клиническая оговорка заключается в том, что чем выше pKa для местного анестетика, тем меньше молекул доступно в их жирорастворимой форме. Это задержит наступление. Кроме того, кислая среда, связанная с воспаленными тканями, снижает их pH значительно ниже 7,4 и еще больше способствует четвертичной водорастворимой конфигурации. Это было предложено как одно из объяснений трудностей при попытке обезболить воспаленные или инфицированные ткани. 1 , 2 В этих ситуациях, например, бупивакаин (pKa 8,1) менее желателен, чем мепивакаин (pKa 7,6).
Следует уточнить, однако, что как только третичные молекулы попадают в нейрон, они реионизируются в четвертичную форму, что считается фактической блокадой натриевого канала. Последовательность событий, которая приводит к нервной блокаде, проиллюстрирована на рисунке.
Местноанестезирующее действие. Введенный местный анестетик находится в равновесии в виде четвертичной соли (BH + ) и третичного основания (B).Доля каждого из них определяется pKa анестетика и pH ткани. Жирорастворимое основание (B) необходимо для проникновения как в эпиневрий, так и в нейрональную мембрану. Как только молекула достигает аксоплазмы нейрона, амин получает ион водорода, и эта ионизированная четвертичная форма (BH + ) отвечает за фактическую блокаду натриевого канала. Равновесие между (BH + ) и (B) определяется pH тканей и pKa анестетика (pH / pKa).
Метаболизм и выведение
Промежуточная цепочка или звено обеспечивает удобную основу для классификации местных анестетиков, а также определяет характер их выведения. Амиды биотрансформируются в печени, но сложные эфиры гидролизуются в кровотоке эстеразами плазмы. Местные анестетики на основе сложного эфира больше не упаковываются в стоматологические картриджи и используются нечасто, за исключением бензокаина, который содержится в некоторых местных анестетических препаратах. Артикаин в этом отношении уникален.Он классифицируется как амид в соответствии с его промежуточной связью, но также содержит боковую цепь сложного эфира на своем ароматическом кольце. Гидролиз этой боковой цепи делает молекулу неактивной, и поэтому она удаляется аналогично сложноэфирным анестетикам.
Продолжительность действия
Местные анестетики различаются по продолжительности действия в основном из-за различий в их сродстве к белку. Как и большинство лекарств, местные анестетики обратимо связываются с белками плазмы, циркулируя в кровотоке.Это свойство выражается в процентах циркулирующего лекарственного средства, связанного с белком, и было обнаружено, что оно коррелирует со сродством анестетика к белку в натриевых каналах. Чем выше тенденция к связыванию белков, тем дольше анестетик будет выдерживать нервную блокаду. Например, бупивакаин демонстрирует 95% связывания с белками по сравнению с 55% для мепивакаина, и это объясняется разницей в продолжительности их нервной блокады.
Продолжительность анестезии также зависит от времени, в течение которого местный анестетик остается в непосредственной близости от нервных волокон.Локальная секвестрация сильно жирорастворимых анестетиков может обеспечить постоянное высвобождение к мембранам нейронов, увеличивая продолжительность, но сужение соседней сосудистой сети в этом отношении более значимо. По этой причине во многие препараты добавляют вазопрессоры, чтобы замедлить абсорбцию и продлить анестезию. Это особенно важно, потому что сами местные анестетики различаются по своей способности вызывать расширение сосудов. Например, при использовании без вазопрессоров лидокаин сокращает свою продолжительность действия за счет расширения местной сосудистой сети, в то время как мепивакаин и бупивакаин этого не делают.Составы простого лидокаина могут быть полезны для кратковременных процедур после инфильтрации, но их эффективность при блокаде нерва невысока.
ТОКСИЧНОСТЬ МЕСТНЫХ АНЕСТЕТИКОВ
Системная токсичность, приписываемая местным анестетикам, зависит от дозы, но понимание этих доз не всегда является простым делом. К сожалению, использование картриджей с анестетиком в стоматологии привело к небрежности в оценке фактического количества анестетика, которое мы вводим нашим пациентам. К сожалению, эту практику продолжают развивать во время бакалавриата и во многих уважаемых стоматологических публикациях.Стоматологический картридж представляет собой объем, а не дозу, которую более правильно выражать в миллиграммах или микрограммах. Кроме того, стоматологические картриджи часто содержат 2 препарата: местный анестетик и вазопрессор, каждый из которых имеет отдельную дозу. Еще больше усложняет ситуацию то, что стоматологические картриджи содержат особые объемы, такие как 1,7 или 1,8 мл. Сумма этих проблем делает попытки вычислений реальных дозировок и позволяет запоминать количества на картридж, а не фактическую оценку правильных доз. Эта практика еще больше усложняется, когда картриджи содержат различные концентрации местных анестетиков и вазопрессоров.Чтобы упростить расчет дозировки, разумно отказаться от концепции картриджей и считать, что каждый из них содержит 2 мл объема. Это приведет к завышению количества, вводимого пациенту, что является безопасной практикой. Например, когда было введено 4½ картриджа, оцените его как 9 мл. Эту единицу объема легче преобразовать в приблизительную дозу каждого лекарства в миллиграммах или микрограммах, как показано на.
Таблица 1.
Приблизительные дозировки *
По мере всасывания местных анестетиков из места инъекции их концентрация в кровотоке повышается, а периферическая нервная система и центральная нервная система (ЦНС) подавляются в зависимости от дозы. манера.(См.) Низкие сывороточные концентрации используются клинически для подавления сердечных аритмий и статусных судорог, но, по иронии судьбы, более высокие концентрации вызывают судорожную активность. Судорожные припадки являются первоначальным опасным для жизни последствием передозировки местного анестетика. Предположительно это происходит из-за избирательного угнетения центральных тормозных путей, которые позволяют возбуждающим трактам работать безумно. По мере того, как концентрации в сыворотке продолжают расти, все метаболические пути ингибируются, что приводит к коме, остановке дыхания и, в конечном итоге, сердечно-сосудистому коллапсу.Признаки токсичности лидокаина могут проявляться при концентрациях> 5 мкг / мл, но для судорожных припадков обычно требуются концентрации> 10 мкг / мл.
Приблизительные концентрации лидокаина в сыворотке и системные эффекты.
Важно, чтобы местные анестетики считались депрессантами ЦНС, и они потенцируют любое угнетение дыхания, связанное с седативными средствами и опиоидами. Кроме того, сывороточные концентрации, необходимые для возникновения судорог, ниже, если присутствует гиперкарбия (повышенный уровень углекислого газа).Это тот случай, когда угнетение дыхания вызывается одновременным приемом седативных средств и опиоидов. Гудсон и Мур задокументировали катастрофические последствия взаимодействия этого лекарственного средства у педиатрических пациентов, получающих процедурную седацию, наряду с чрезмерными дозами местных анестетиков. 3
Хотя все местные анестетики несут сравнимый риск токсичности для ЦНС, следует отметить, что бупивакаин проявляет больший потенциал прямой сердечной токсичности, чем другие агенты. 1 , 2 Объяснение не полностью установлено, но считается, что оно связано с тем фактом, что бупивакаин имеет большее сродство к неактивным и покоящимся конфигурациям натриевых каналов и медленнее диссоциирует из этих каналов. Это задерживает восстановление от потенциалов действия, делая сердечные ткани восприимчивыми к аритмиям. Эта проблема актуальна для определенных медицинских процедур, во время которых бупивакаин вводят в очень высоких дозах. Никогда не было обнаружено, что это происходит при дозах до максимальных, рекомендованных для стоматологической анестезии.
Возникает очевидный вопрос: какая системная концентрация в сыворотке крови следует за введением определенной дозы местного анестетика. В 1972 году Скотт и др. Опубликовали одно из серии знаковых клинических исследований, оценивающих переменные, которые определяют последующие концентрации лидокаина и прилокаина в сыворотке. 4 Неудивительно, что концентрации в сыворотке крови менялись в зависимости от относительной васкулярности тканей, в которые вводили анестетик. При использовании лидокаина в дозе 400 мг самые высокие уровни в сыворотке наблюдались при последующей инфильтрации слизистой оболочки влагалища, а самые низкие — при подкожной инфильтрации брюшной полости.Однако в каждом случае пиковый уровень в сыворотке крови наблюдался через 20–30 минут после инъекции только лидокаина. Независимо от способа введения пиковые уровни были снижены, а скорость абсорбции замедлена путем добавления 1 200 000 эпинефрина к раствору местного анестетика. Разумно предположить, что системные концентрации после подслизистой инъекции в ротовую полость будут приближаться к таковым после инъекции в слизистую оболочку влагалища из-за аналогичной васкулярности. К сожалению, очень мало стоматологических исследований, посвященных более высоким дозам местных анестетиков.Тем не менее, Hersh et al. 5 опубликовали впечатляющее исследование, в котором были получены сопоставимые результаты после нескольких внутриротовых инъекций в общей сложности 7 картриджей (1,7 мл каждый = ~ 480 мг) артикаина, содержащего адреналин 1 ∶ 200 000. (См.) Можно разумно заключить, что соблюдение опубликованных максимальных рекомендуемых доз для местных анестетиков не приведет к системным уровням в сыворотке, которые приближаются к уровням, связанным с токсичностью.
Концентрации местного анестетика в сыворотке крови. (См. Текст для объяснения.По материалам Scott et al. , 4, и Hersh et al. 5 )
Дополнительные переменные также рассматривались Скоттом и др. 4 Как и ожидалось, дозировка и скорость инъекции были напрямую связаны с концентрацией в сыворотке. Концентрация раствора, например, 2% против 4%, не имела значения; концентрации в сыворотке были связаны с общей дозировкой. Введение 20 мл 2% или 10 мл 4% (400 мг) привело к такой же концентрации в сыворотке. При использовании лидокаина или других анестетиков, независимо от их концентрации, необходимо учитывать введенную дозу (миллиграммы), а не объем (миллилитры или картриджи).
Вопреки общепринятому мнению, возраст или вес пациента не позволяют предсказать системную концентрацию в сыворотке после доз, рассчитанных в миллиграммах на возраст (годы) или миллиграммах на килограмм. Однако при ведении педиатрических пациентов максимальные дозировки обычно выражаются в мг / кг, и это следует соблюдать в качестве меры предосторожности. Однако это не имеет большого значения для взрослых, и следует придерживаться рекомендаций, выраженных в максимальной дозе в миллиграммах, независимо от веса и возраста.Очевидно, это максимальное количество не должно превышаться при расчете доз в мг / кг для больших детей.
При рассмотрении токсичности любого класса наркотиков следует помнить о метаболитах, а также о исходном лекарстве. Метаболит прилокаина, o -толуидин, может окислять железо в гемоглобине от двухвалентного (Fe 2+ ) до трехвалентного (Fe 3+ ). Измененные таким образом гемы не связывают кислород, а нормальные гемы на одной и той же молекуле гемоглобина с трудом выделяют свой кислород.Эта форма гемоглобина называется метгемоглобином, и когда таким образом изменяется> 1% общего гемоглобина, состояние называется метгемоглобинемией. Пациенты выглядят синюшными и становятся симптоматичными, когда доля метгемоглобина превышает 15%. 6 Насыщение гемоглобина по данным пульсоксиметрии (SpO 2 ) будет снижаться, несмотря на клинические доказательства эффективной оксигенации и вентиляции. Например, показания пульсоксиметра могут быть <90%, но фактическое давление кислорода в артериальной крови (PaO 2 ) может находиться в пределах нормы (> 80 мм рт.Состояние становится опасным для жизни, когда уровень метгемоглобина превышает 50–60%, и лечится с помощью внутривенного введения метиленового синего, который восстанавливает геммы до нормального состояния. Маловероятно, что метгемоглобинемия, связанная с прилокаином, возникнет после приема рекомендуемых доз. Редко можно встретить пациента с наследственной метгемоглобинемией, что противопоказано к применению прилокаина.
Аллергия на местные анестетики
Пациенты часто заявляют, что у них аллергия на местные анестетики.Однако при тщательном расспросе обычно выясняется, что они испытали либо обморок, связанный с инъекцией, либо учащенное сердцебиение, связанное с адреналином, содержащимся в растворе или высвобожденным эндогенно. Аллергические реакции после инъекций местного анестетика, скорее всего, связаны с консервантами (метилпарабен) или антиоксидантами (сульфитами), содержащимися в растворе. 7 Метилпарабен включен в многодозовые флаконы для предотвращения роста микробов.Его больше нет во флаконах с одной дозой или стоматологических картриджах. Сульфиты предотвращают окисление вазопрессоров и входят только в те стоматологические картриджи, которые содержат адреналин или левонордефрин.
Аллергические реакции вызываются иммунными механизмами, посредством которых лимфоциты сенсибилизируются к антигену и при последующем воздействии опосредуют ряд патофизиологических изменений. Гелл и Кумбс сначала отнесли реакции гиперчувствительности (аллергические) к типам от I до IV, основываясь на различных иммунологических механизмах. 8 Реакции типа I возникают в течение нескольких минут после провокации и опосредуются антителами или иммуноглобулином E (IgE), продуцируемым B-лимфоцитами. Это тип, который чаще всего провоцируется компонентами местных анестетиков. Реакции типа 4 задерживаются на несколько дней после провокации и опосредуются сенсибилизированными Т-лимфоцитами. Этот тип реакции на местные анестетики бывает очень редко.
Чтобы лекарства были иммуногенными, они должны иметь большую молекулярную массу и обладать множественными валентностями, чтобы их могли распознать иммунные клетки. 9 Крупные белки, такие как инсулин животного происхождения, удовлетворяют этим требованиям и хорошо зарекомендовали себя как иммуногенные. Большинство молекул лекарств слишком малы и фактически объединяются с другими молекулами, которые действуют как носители, вызывая аллергическую реакцию. В случае сульфонамидных антибиотиков, например, фенильное кольцо, содержащее аминное замещение, является виновником образования иммуногенного комплекса. Этот фрагмент является общим для других производных парааминобензойной кислоты (ПАБК), таких как метилпарабен и некоторых, но не всех, сложноэфирных местных анестетиков.В этих случаях может существовать потенциал перекрестной аллергенности, поскольку они имеют общую молекулярную структуру, например, сульфамидные антибиотики, метилпарабен и сложные эфиры ПАБК.
Говоря о местных анестетиках, бессмысленно называть сложные эфиры более аллергенными, чем амиды. Сложный эфир представляет собой просто химическую связь и не придает соединению иммуногенности. Скорее всего, виноват молекулярный компонент, соединенный этой связью. Это заблуждение привело к тому, что некоторые агенты были ошибочно названы перекрестно аллергенными с сульфонамидными антибиотиками.Артикаин классифицируется как амидный местный анестетик из-за связи между его жирорастворимым кольцом и концевым амином. Его тиофеновое кольцо содержит атом серы, который не обладает иммуногенными свойствами, и боковую цепь сложного эфира, которая делает соединение неактивным после гидролиза. Однако артикаин не высвобождает метаболит, напоминающий ПАБК, и не вызывает опасений относительно перекрестной иммуногенности с сульфаниламидами. Напротив, прокаин является представителем сложных эфиров, полученных из PABA, и гидролиз высвобождает фрагмент, который является потенциально иммуногенным ().
Молекулярные структуры и аллергенность. Иммуногенность объясняется лекарствами, имеющими фенильное кольцо с пара-аминным замещением. Он содержится в сульфонамидных антибиотиках и соединениях, содержащих парааминобензойную кислоту (ПАБК), таких как некоторые солнцезащитные кремы и косметика. Он также содержится в консервантах на основе метилпарабена и местных анестетиках на основе сложных эфиров, таких как прокаин. Сложноэфирные связи (прокаин) или боковые цепи (артикаин) не являются иммуногенными, как и атом серы тиофенового кольца (артикаин).* указывает на иммуногенный фрагмент.
Последнее заблуждение относится к сульфитам. Их включают в растворы местных анестетиков, содержащие вазопрессоры, чтобы предотвратить их окисление. Это неорганические соединения (-SO 3 ), которые участвуют в аллергических реакциях, но они не имеют никакого отношения к иммуногенности, приписываемой соединениям, родственным PABA. Эти агенты также используются в качестве антиоксидантов в свежих фруктах и овощах, чтобы сохранить их цвет и внешний вид. Важно отметить, что пациенты с аллергией на такие продукты могут испытывать перекрестные реакции с растворами местных анестетиков, содержащих вазопрессоры, поскольку они содержат те же самые сульфиты.
Сообщения об аллергических реакциях на местные анестетики появлялись в научной литературе с некоторой частотой. 10 , 11 Однако трудно понять точность или фактическую частоту из-за несоответствия в методах подтверждения, которые включают кожные уколы, внутрикожные инъекции и провокационные лекарственные препараты. Во многих случаях не было подтверждения фактического виновника, консерванта или местного анестетика. Более того, лишь очень немногие из них действительно подтвердили присутствие IgE к лекарственному средству с помощью иммуноблоттинга.Обширный анализ этой литературы недавно был проведен Speca et al. 12
Практически во всех описаниях случаев у пациентов действительно наблюдались признаки и симптомы, соответствующие аллергической реакции. Был ли реальный патогенез действительно иммуноопосредованным (аллергия), вероятно, скорее академический, чем прагматический. Последнее событие в этих реакциях приписывается синтезу и высвобождению медиаторов, вместе называемых аутакоидами, из которых гистамин и лейкотриены являются наиболее важными.Эти аутакоиды не только оказывают прямое воздействие на ткани, но также могут привлекать различные воспалительные клетки, которые способствуют так называемой реакции поздней фазы, которая может не проявляться в течение нескольких дней после провокации. В самом деле, лекарства нередко генерируют эти аутакоиды в результате действий, которые не являются иммуноопосредованными и поэтому неправильно классифицируются как аллергия. Меперидин стимулирует высвобождение гистамина из тучных клеток, а нестероидные противовоспалительные препараты могут способствовать синтезу лейкотриенов.В таких случаях реакция пациента обычно обозначается как псевдоаллергическая, чтобы отличить ее от истинной аллергии, которая является иммунной.
Если пациент описывает реакцию, которая, по крайней мере, клинически соответствует аллергии, стоматолог должен избегать использования вызывающего заболевания агента до тех пор, пока его не осмотрит аллерголог. В случае, если до получения медицинского разрешения требуется анестетик, самым разумным выбором будет либо мепивакаин, либо прилокаин без вазопрессоров. Согласно общепринятому мнению, если местные анестетики действительно вызывают аллергию, эфиры ПАБК будут более вероятными, чем амидные местные анестетики.Кроме того, избегая растворов, содержащих вазопрессоры, можно избежать любых бисульфитов, которые входят в состав антиоксидантов. Возможна чувствительность к различным сульфитам, особенно у пациентов с астмой или атопией. Эти принципы являются основой блок-схемы, представленной в. Пациенту никогда нельзя отказывать в преимуществах местной анестезии на основании ошибочных предположений относительно аллергии.
Ведение пациентов с аллергией на местные анестетики. Исключите распространенные реакции, ошибочно принимаемые за аллергию, например обмороки и тахикардию.Затем установите, что характер их реакции, по крайней мере, напоминал реакцию гиперчувствительности, например сыпь, зуд, крапивницу или одышку. Если препарат известен, выберите другой амид, не содержащий вазопрессоров, чтобы не было сульфитов. В противном случае направьте пациента к аллергологу для тестирования сульфитов и типичных местных анестетиков, таких как лидокаин, мепивакаин и прилокаин. (Адаптировано из deShazo и Kemp. 13 )
Местная токсичность
Ишемический некроз тканей может возникнуть после инъекций местных анестетиков.Это может быть связано с раздражающим действием раствора, давлением больших объемов или сужением сосудистой сети из-за вазопрессоров. Это особенно опасно при инъекции в прикрепленную слизистую оболочку, например твердое небо. Также растет беспокойство по поводу прямой нейротоксичности, связанной с составами, содержащими высокие концентрации, такие как 4% артикаин и прилокаин.
Хаас и Леннон сообщили о повышении частоты парестезий в Канаде после введения артикаина в середине 1980-х годов. 14 Только в 1993 году было зарегистрировано 14 случаев парестезии, и все они были связаны с применением артикаина или прилокаина. Когда артикаин впервые был представлен на одобрение Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США, было установлено, что он имеет более высокий риск парестезии, чем лидокаин.
Совсем недавно Гаристо и др. 15 рассмотрели заявления о парестезии в Соединенных Штатах в период с ноября 1997 года по август 2008 года и обнаружили 248 случаев парестезии после стоматологических процедур.В большинстве случаев (~ 95%) была задействована блокада нижнечелюстного нерва, и в 89% из них был поражен язычный нерв. По сравнению с другими местными анестетиками, парестезия была в 7,3 раза более вероятна при использовании 4% артикаина и в 3,6 раза более вероятна при использовании 4% прилокаина. Подобные результаты из отчетов о парестезии в Дании были опубликованы Hillerup et al. 16 Эти данные могут быть еще более значимыми, если учесть количество случаев, которые вполне могут остаться незарегистрированными.
Хотя стоматологическое сообщество не спешило прийти к консенсусу по этому вопросу, следует понимать, что в литературе по медицинской анестезии категорически утверждается, что более высокая концентрация растворов местных анестетиков увеличивает риск прямой нейротоксичности для нервных стволов: «Все клинически используемые Местные анестетики могут оказывать прямое токсическое воздействие на нервы, если они достигают достаточно высоких интраневральных концентраций.Клиницисты должны знать, что концентрации приготовленных растворов местных анестетиков сами по себе нейротоксичны и что их разведение in situ или в тканях важно для безопасного использования ». 1
Этот факт дополнительно подтверждается Hillerup et al, которые продемонстрировали большую нервную токсичность 4 по сравнению с 2% артикаином в препаратах седалищного нерва. 17 Как и в случае со всеми лекарствами, каждый практикующий врач должен провести анализ соотношения риска и пользы перед применением лекарства. Только в том случае, если польза от использования артикаина превышает риск для этого практикующего врача, его следует рассматривать для использования.Было бы разумно ограничить использование 4% концентраций для инфильтрации и избегать их использования для нервной блокады, отдав предпочтение агентам, сформулированным в более низких концентрациях. 15 , 16
СРАВНЕНИЯ С МЕСТНЫМИ АНЕСТЕТИКАМИ
Лидокаин продолжает оставаться наиболее широко используемым местным анестетиком в Соединенных Штатах, но все эти агенты имеют сопоставимую эффективность. Они различаются по эффективности и нескольким фармакокинетическим параметрам, которые объясняют различия в начале и продолжительности анестезии.При выборе конкретного агента необходимо учитывать продолжительность запланированной процедуры и проблемы, связанные с концентрацией вазопрессоров. Для длительных процедур логичным выбором является бупивакаин, но, согласно исследованиям, в которых сравнивались различные анестетики, он считается одним из наиболее болезненных агентов во время инъекции. 18 — , 20 Одна из стратегий — обеспечить первые 60–90 минут анестезии с использованием менее раздражающего агента (лидокаин или прилокаин), а затем повторно ввести анестезируемую ткань с бупивакаином, чтобы обеспечить хорошее обезболивание в послеоперационном периоде. период.Такая стратегия наиболее эффективна после нервных блокад; следует ожидать более короткую продолжительность пульпарной анестезии после инфильтрации. (См.)
Таблица 2.
Местные анестетики в картриджах 21 , 22
Несмотря на неофициальные заявления о превосходстве артикаина над лидокаином при блокаде нижних альвеол, опубликованные исследования практически не обнаружили разницы. , особенно при наличии симптомов зубов. 22 — , 24 Любое небольшое преимущество артикаина компенсируется его повышенным риском парестезии, о которой говорилось выше.Однако при инфильтрации нижней челюсти артикаин явно превосходит его и не несет риска нервной токсичности, если не вводится рядом с подбородочным нервом. 22 , 25 , 26 Превосходство артикаина можно объяснить его высокой растворимостью в липидах и концентрацией его препаратов. В отличие от других анестетиков, содержащих бензол в качестве ароматического кольца, артикаин имеет тиофеновое кольцо и замены, которые придают большую растворимость липидов, чем другие местные анестетики, за исключением бупивакаина.Это свойство должно было позволить использовать его в более низкой концентрации, но на самом деле он был составлен в виде 4% раствора. Артикаин не только более растворим в липидах, но и содержит большее количество молекул, чем, например, 2% лидокаин в равном объеме. На сегодняшний день не было опубликованных исследований, сравнивающих артикаин с 4% растворами лидокаина при инфильтрации нижней челюсти. Лидокаин в этой концентрации представляет неприемлемый риск системной токсичности, что дает еще одно привлекательное свойство артикаина: характер клиренса.
Хотя артикаин классифицируется как амид, из-за связи его промежуточной цепи тиофеновое кольцо также содержит сложноэфирную боковую цепь. Эта цепь гидролизуется эстеразами плазмы, что делает молекулу неактивной. В результате период полувыведения артикаина составляет всего 20-40 минут по сравнению с> 90 минутами для лидокаина и других амидов, требующих печеночного клиренса. По этой причине артикаин представляет меньший риск системной токсичности при длительных приемах, когда вводятся дополнительные дозы анестетика.Однако следует помнить, что артикаин с концентрацией 4% содержит удвоенную дозу 2% лидокаина на введенный объем, и их максимальные рекомендуемые дозы идентичны.
ВАЗОПРЕССОРЫ
Вазопрессоры — это препараты, которые обеспечивают сужение кровеносных сосудов путем активации альфа-1-адренорецепторов. Их сочетают с местными анестетиками для обеспечения гемостаза в операционном поле и задержки абсорбции анестетика. Задержка всасывания местных анестетиков не только снижает риск системной токсичности, но и увеличивает продолжительность анестезии.Адреналин является наиболее распространенным агентом, используемым для этой цели, несмотря на то, что он проявляет значительную сердечную стимуляцию из-за его дополнительного действия в качестве агониста бета-1-адренорецепторов.
Несмотря на популярность адреналина 1 100 000, его концентрации выше 1 ∶ 200 000 (5 мкг / мл) практически не дают никаких преимуществ. Более высокие концентрации не обеспечивают лучшего начала или продолжительности блокады нижнего альвеолярного нерва. 29 , 30 Более высокие концентрации также не снижают концентрации местного анестетика в сыворотке. 4 , 5 Однако более высокие концентрации, например, 1 ∶ 100 000 (10 мкг / мл) и 1 50 000 (20 мкг / мл), могут обеспечить лучший гемостаз при инфильтрации в операционном поле, когда это влияние желанный.
Влияния на сердечно-сосудистую систему
Чтобы должным образом решить вопросы безопасности, нужно сначала понять принципы расчета дозировки, представленные в этой статье. Продолжаются дискуссии о пагубном влиянии адреналина на пациентов с сердечно-сосудистыми заболеваниями.Часто этот спор продолжается без полного понимания фактического действия и эффектов этого широко используемого препарата. Адреналин действует как агонист рецепторов альфа, бета-1 и бета-2. Эти действия объясняют его влияние на сердечно-сосудистую систему, как показано на рис. Прежде чем анализировать этот показатель, важно прояснить распространенное заблуждение. Стоматолог рассматривает адреналин как сосудосуживающее средство на основании его эффектов при введении в подслизистые ткани. Это потому, что крошечные сосуды в этом месте содержат только альфа-рецепторы.Более крупные системные артерии, которые определяют артериальное сопротивление и диастолическое артериальное давление, содержат гораздо больше бета-2, чем альфа-рецепторов, и после абсорбции низкие дозы адреналина вызывают расширение этих сосудов.
Сердечно-сосудистые эффекты адреналина. 31 Следующий график иллюстрирует типичную сердечно-сосудистую реакцию на адреналин, вводимый в виде непрерывной внутривенной инфузии 10 мкг / мин. (Это количество содержится в 1 мл концентрации 1 100 000.) Адреналин увеличивает частоту сердечных сокращений (ЧСС) за счет активации рецепторов бета-1 в синоатриальном узле, нормальном кардиостимуляторе сердца. Он также активирует рецепторы бета-1 на клетках миокарда, увеличивая их сократимость и повышая систолическое артериальное давление (САД). Однако он активирует бета-2 рецепторы на системных артериях, вызывая расширение сосудов. Это снижение артериального сопротивления вызывает снижение диастолического давления (ДАД). Эти эффекты приводят к небольшому изменению среднего артериального давления (САД).
Клинические испытания однозначно подтвердили, что даже небольшие дозы адреналина в растворах местных анестетиков влияют на сердечно-сосудистую функцию.Dionne et al. 32 изучали влияние 3 картриджей 2% лидокаина с эпинефрином 1 100 000 (~ 60 мкг адреналина). Подслизистая инъекция этой дозировки увеличивала сердечный выброс, частоту сердечных сокращений и ударный объем. Системное артериальное сопротивление было снижено, а среднее артериальное давление практически не изменилось. Аналогичным образом, Hersh et al. 5 наблюдали аналогичные результаты после введения артикаина, содержащего 1 100 000 (∼120 мкг) и 1 ∶ 200 000 (∼60 мкг) адреналина, с большей реакцией на более высокую дозировку.Эти результаты согласуются с общепризнанными влияниями, как показано на рис.
Результаты исследований, подобных только что упомянутым, следует рассматривать в перспективе. Например, влияние ~ 120 мкг адреналина, опубликованное Hersh et al. 5 , было незначительным: увеличение частоты сердечных сокращений на ~ 8-10 ударов в минуту и изменения артериального давления в среднем на ~ 5 мм рт. Тем не менее, 14 участников были в отличном состоянии, их показатели жизненно важных функций в состоянии покоя составляли в среднем 68 для частоты сердечных сокращений, 125 мм рт. Ст. Для систолического давления и 73 мм рт. Ст. Для диастолического давления.Кроме того, они не принимали никаких серьезных лекарств. Очевидно, что такие люди могут легко переносить введенные дозы, но следует отметить, что двое из этих здоровых участников действительно сообщили о сердцебиении.
Даже небольшие дозы адреналина вызывают сердечно-сосудистые эффекты; это однозначно. Вопрос заключается в том, представляют ли сердечно-сосудистые воздействия адреналина значительный риск для пациентов с различной степенью компрометации. Стандарты и руководства продолжают продвигаться, но на самом деле все они анекдотичны.Наивно предлагать ввести ограничение «2 картриджа» для пациентов с сердечно-сосудистыми заболеваниями. В конечном итоге для принятия решения стоматолог должен вынести здравое клиническое суждение, основанное на тщательном анализе каждого рассматриваемого пациента. Если показана консультация с врачом пациента, обсудите ожидаемый диапазон доз в микрограммах, а не в концентрациях или картриджах. Например, если планируется 2–4 картриджа с местным анестетиком, объясните, что вы будете использовать 40–80 мкг адреналина, инфильтрованного под слизистую оболочку, а не 2–4 картриджа с адреналином 1 ∶ 100 000.Врач не знаком с дозировкой, выраженной в картриджах или концентрациях. Для справки рассмотрите стандартную дозу адреналина для лечения аллергической реакции: 0,3 мг или 300 мкг. Врач, как правило, будет интересоваться дозами 100 мкг или больше.
Левонордефрин (Неокобефрин) — вазопрессор в сочетании с 2% препаратами мепивакаина в США. Он больше похож на норадреналин, чем на адреналин, поскольку не обладает активностью в отношении бета-2-рецепторов. По этой причине он повышает не только систолическое артериальное давление, как адреналин, но также диастолическое и среднее артериальное давление.У некоторых пациентов это может вызвать рефлекторное блуждающее влияние на частоту сердечных сокращений, которое может частично компенсировать прямую стимуляцию сердечного ритма рецепторами бета-1. Однако исследования, оценивающие влияние сердечно-сосудистой системы после внутрикостных инъекций, обнаружили небольшую разницу между адреналином и левонордефрином. 33 , 34 Это, вероятно, объясняется быстрым всасыванием, которое позволяет проводить прямую стимуляцию бета-1 до того, как вмешаются рефлекторные реакции на среднее артериальное давление.Сравнение адреналина и левонордефрина представлено в.
Таблица 3.
Действия адреналина по сравнению с левонордефрином
Максимально допустимые дозы вазопрессоров не установлены. Выражать ограничения в виде назначений нецелесообразно; Время лечения может составлять от 30 минут до 3-4 часов. Кроме того, влияние данной дозы вазопрессора на пациентов сильно различается. Пиковое влияние адреналина обычно наблюдается в течение 5–10 минут после инъекции 5 и быстро снижается; Адреналин и левонордефрин являются катехоламинами и быстро метаболизируются катехол-о-метилтрансферазой.Фактически, период полувыведения большинства катехоламинов составляет всего 1-3 минуты. Как правило, гемодинамические влияния наблюдаются в течение нескольких минут после инъекции и полностью исчезают через 10-15 минут. Доза адреналина 40 мкг (приблизительно 2 картриджа с содержанием адреналина 1 100 000) является наиболее консервативным и часто упоминаемым ограничением дозы для пациентов с серьезными сердечно-сосудистыми заболеваниями. Следует уточнить, что это руководство более точно отражает 30-минутные периоды времени, а не встречи.Более рациональное предложение — основывать дозировку на оценке пациента, а не на максимальных количествах. Например, если по какой-либо причине медицинский статус пациента ставится под сомнение, разумный протокол состоит в том, чтобы записывать исходную частоту сердечных сокращений и артериальное давление до операции и снова после каждого введения 20-40 мкг. Это соответствует 1-2 картриджам с концентрацией адреналина 1 ∶ 100 000. Практически любой пациент может выдержать такое количество сердечно-сосудистых воздействий. Если состояние пациента остается стабильным, могут быть введены дополнительные дозы, после чего следует аналогичная схема повторной оценки показателей жизнедеятельности.
Лекарственные взаимодействия
Возможные лекарственные взаимодействия были подробно рассмотрены в предыдущей статье для повышения квалификации в этом журнале. 35 Наиболее важные из них относятся к возможной усиленной стимуляции сердечно-сосудистой системы. Вазопрессоры, обнаруженные в формах местного анестетика, обладают кардиотоническим действием, и это может стать более значительным, когда пациенты получают лечение любым лекарственным средством, оказывающим подобное влияние. К ним относятся трициклические антидепрессанты и ингибиторы моноаминоксидазы, дигоксин, гормон щитовидной железы или любые симпатомиметики, используемые для контроля веса или нарушений внимания.Вазопрессоры не противопоказаны этим пациентам, но их следует назначать с осторожностью, как описано выше для пациентов с ограниченными возможностями здоровья. Пациентам, у которых есть подозрение на злоупотребление стимуляторами, например кокаином, может быть разумным вообще избегать вазопрессоров.
Осторожное использование вазопрессоров также рекомендуется пациентам, принимающим неселективные бета-блокаторы. В отличие от селективных агентов, которые блокируют только рецепторы бета-1 в сердце, неселективные агенты также блокируют сосудистые рецепторы бета-2.В этом случае альфа-агонистическое действие вазопрессоров становится более выраженным, и как диастолическое, так и среднее артериальное давление могут стать опасно повышенными. Обычно это сопровождается внезапным рефлекторным замедлением сердечного ритма. Существенные последствия этого взаимодействия хорошо задокументированы. 36 — , 38 Взаимодействие с бета-блокаторами происходит во времени, идентичном наблюдаемому для нормальных сердечно-сосудистых реакций на адреналин. Он начинается после абсорбции из места инъекции, которая обычно достигает пика в течение 5 минут и снижается в течение последующих 10–15 минут.Вазопрессоры не противопоказаны пациентам, принимающим неселективные бета-блокаторы, но дозы должны быть консервативными, а артериальное давление периодически контролировать во время приема, как описано выше. Следует избегать использования ретракционных шнуров, пропитанных рацемическим адреналином. Эти продукты содержат адреналин в количествах, намного превышающих те, которые содержатся в составах местных анестетиков.
Местные анестетики: обзор фармакологических аспектов
Abstract
Местные анестетики обладают впечатляющей историей эффективности и безопасности в медицинской и стоматологической практике.Их использование настолько рутинно, а побочные эффекты настолько редки, что медицинские работники могут по понятным причинам упускать из виду многие из своих фармакотерапевтических принципов. Целью данной статьи для повышения квалификации является обзор и обновление основных фармакологических характеристик различных местных анестетиков, используемых в настоящее время. Технические соображения будут рассмотрены в следующей статье.
Ключевые слова: Местные анестетики, Фармакология, Токсичность лекарств, Стоматология
Местные анестетики прерывают нервную проводимость, подавляя приток ионов натрия через каналы или ионофоры в мембранах нейронов.Обычно эти каналы существуют в состоянии покоя, во время которого ионам натрия запрещен доступ. Когда нейрон стимулируется, канал принимает активированное или открытое состояние, в котором ионы натрия диффундируют в клетку, инициируя деполяризацию. После этого внезапного изменения напряжения на мембране натриевой канал переходит в неактивное состояние, во время которого дальнейший приток запрещается, в то время как активные транспортные механизмы возвращают ионы натрия наружу. После этой реполяризации канал принимает нормальное состояние покоя.Понимание этих состояний натриевых каналов помогает объяснить предпочтительную чувствительность местных анестетиков к различным классам нейронных волокон.
Местные анестетики обладают большим сродством к рецепторам внутри натриевых каналов во время их активированного и инактивированного состояний, чем когда они находятся в состоянии покоя. 1 , 2 Следовательно, нервные волокна с более высокой скоростью возбуждения наиболее восприимчивы к действию местного анестетика. Кроме того, волокна меньшего размера, как правило, более восприимчивы, потому что данный объем раствора местного анестетика может более легко блокировать необходимое количество натриевых каналов для полного прерывания передачи импульса.По этим причинам наиболее чувствительными являются крошечные, быстрорастущие вегетативные волокна, за ними следуют сенсорные волокна и, наконец, соматические двигательные волокна. 1 , 2 Анестезиолог, блокирующий смешанные спинномозговые нервы, хорошо осведомлен об этой разной чувствительности. Когда пациенты оправляются от спинномозговой анестезии, они сначала восстанавливают произвольную двигательную функцию, затем возвращаются ощущения и, наконец, они могут мочиться (вегетативный контроль). Дантисту обычно не приходится уделять этому внимание, потому что ветви тройничного нерва, анестезируемые при стоматологических процедурах, состоят только из небольших, быстро возбуждающихся сенсорных волокон.Однако многие классы сенсорных волокон также различаются по диаметру и скорости возбуждения. Например, болевые волокна более чувствительны, чем волокна, несущие давление и проприоцепцию. Пациента может по-прежнему беспокоить чувство давления, несмотря на полную анестезию болевых волокон.
ОБЩИЕ СВОЙСТВА МЕСТНЫХ АНЕСТЕТИКОВ
Молекулярная структура всех местных анестетиков состоит из 3 компонентов: (а) липофильное ароматическое кольцо, (б) промежуточная сложноэфирная или амидная связь и (в) третичный амин.Каждый из этих компонентов придает молекуле различные клинические свойства. (См.)
Местноанестезирующий состав.
Эффективность анестетика
Местные анестетики различаются по эффективности, что позволяет использовать их в концентрациях от 0,5 до 4%. Во многом это является результатом различий в растворимости липидов, что усиливает диффузию через нервные оболочки и нервные мембраны. Это свойство определяется ароматическим кольцом и его замещениями, а также замещениями, добавленными к третичному амину.Например, бупивакаин более жирорастворим и эффективен, чем артикаин, что позволяет составлять его в виде концентрации 0,5% (5 мг / мл), а не 4% (40 мг / мл).
Время начала действия
Повышенная растворимость лекарства в липидах не только увеличивает эффективность, но и способствует более быстрой диффузии через клеточные мембраны. Для местных анестетиков это ускоряет начало анестезии изолированных волокон во время исследований in vitro, но следует понимать, что в клинической практике играют роль и другие факторы.Например, присущие сосудорасширяющие свойства могут способствовать системной абсорбции до того, как анестетик достигнет нервной оболочки. Высокая растворимость липидов может препятствовать диспергированию в тканевых жидкостях, а также способствовать секвестрации в соседних жировых тканях или миелиновых оболочках. В любом случае меньшее количество молекул достигает нейрональной мембраны, и начало реакции задерживается. Следовательно, в отличие от исследований изолированных волокон in vitro, большая растворимость липидов обычно замедляет наступление анестезии в клинических условиях.Введение более высоких концентраций, которые позволяют большему количеству молекул достигать мембраны и ускоряют наступление, может компенсировать это влияние. Хотя бупивакаин и артикаин хорошо растворимы в липидах, 4% концентрация артикаина обеспечивает гораздо более быстрое начало.
Несмотря на множество факторов, влияющих на количество местного анестетика, достигающего нервных волокон, наиболее важным фактором, определяющим начало анестезии, является пропорция этих молекул, которые находятся в жирорастворимом, а не в водорастворимом состоянии.Конечный амин, проиллюстрированный на, может существовать в третичной форме (3 связи), которая является растворимой в липидах, или в виде четвертичной формы (4 связи), которая имеет положительный заряд и делает молекулу водорастворимой. Чтобы основа местного анестетика была стабильной в растворе, ее формулируют в виде гидрохлоридной соли. Таким образом, молекулы существуют в четвертичном, водорастворимом состоянии во время инъекции и не могут проникать в нейрон. Следовательно, время начала местной анестезии напрямую связано с долей молекул, которые превращаются в третичную липидорастворимую структуру при воздействии физиологического pH (7.4). Эта пропорция определяется константой ионизации (pKa) анестетика и рассчитывается с использованием уравнения Хендерсона-Хассельбаха:
Проще говоря, если бы местный анестетик имел pKa 7,4 и вводился в ткани, имеющие физиологические свойства. pH 7,4, 50% молекул будут существовать в четвертичной (катионной) форме и 50% будут существовать в третичной (незаряженной) форме; только половина молекул будет жирорастворимой и сможет проникать в нейрон. К сожалению, pKa для всех местных анестетиков больше 7.4 (физиологический pH), и поэтому большая часть молекул существует в четвертичной водорастворимой форме при введении в нормальную ткань. Клиническая оговорка заключается в том, что чем выше pKa для местного анестетика, тем меньше молекул доступно в их жирорастворимой форме. Это задержит наступление. Кроме того, кислая среда, связанная с воспаленными тканями, снижает их pH значительно ниже 7,4 и еще больше способствует четвертичной водорастворимой конфигурации. Это было предложено как одно из объяснений трудностей при попытке обезболить воспаленные или инфицированные ткани. 1 , 2 В этих ситуациях, например, бупивакаин (pKa 8,1) менее желателен, чем мепивакаин (pKa 7,6).
Следует уточнить, однако, что как только третичные молекулы попадают в нейрон, они реионизируются в четвертичную форму, что считается фактической блокадой натриевого канала. Последовательность событий, которая приводит к нервной блокаде, проиллюстрирована на рисунке.
Местноанестезирующее действие. Введенный местный анестетик находится в равновесии в виде четвертичной соли (BH + ) и третичного основания (B).Доля каждого из них определяется pKa анестетика и pH ткани. Жирорастворимое основание (B) необходимо для проникновения как в эпиневрий, так и в нейрональную мембрану. Как только молекула достигает аксоплазмы нейрона, амин получает ион водорода, и эта ионизированная четвертичная форма (BH + ) отвечает за фактическую блокаду натриевого канала. Равновесие между (BH + ) и (B) определяется pH тканей и pKa анестетика (pH / pKa).
Метаболизм и выведение
Промежуточная цепочка или звено обеспечивает удобную основу для классификации местных анестетиков, а также определяет характер их выведения. Амиды биотрансформируются в печени, но сложные эфиры гидролизуются в кровотоке эстеразами плазмы. Местные анестетики на основе сложного эфира больше не упаковываются в стоматологические картриджи и используются нечасто, за исключением бензокаина, который содержится в некоторых местных анестетических препаратах. Артикаин в этом отношении уникален.Он классифицируется как амид в соответствии с его промежуточной связью, но также содержит боковую цепь сложного эфира на своем ароматическом кольце. Гидролиз этой боковой цепи делает молекулу неактивной, и поэтому она удаляется аналогично сложноэфирным анестетикам.
Продолжительность действия
Местные анестетики различаются по продолжительности действия в основном из-за различий в их сродстве к белку. Как и большинство лекарств, местные анестетики обратимо связываются с белками плазмы, циркулируя в кровотоке.Это свойство выражается в процентах циркулирующего лекарственного средства, связанного с белком, и было обнаружено, что оно коррелирует со сродством анестетика к белку в натриевых каналах. Чем выше тенденция к связыванию белков, тем дольше анестетик будет выдерживать нервную блокаду. Например, бупивакаин демонстрирует 95% связывания с белками по сравнению с 55% для мепивакаина, и это объясняется разницей в продолжительности их нервной блокады.
Продолжительность анестезии также зависит от времени, в течение которого местный анестетик остается в непосредственной близости от нервных волокон.Локальная секвестрация сильно жирорастворимых анестетиков может обеспечить постоянное высвобождение к мембранам нейронов, увеличивая продолжительность, но сужение соседней сосудистой сети в этом отношении более значимо. По этой причине во многие препараты добавляют вазопрессоры, чтобы замедлить абсорбцию и продлить анестезию. Это особенно важно, потому что сами местные анестетики различаются по своей способности вызывать расширение сосудов. Например, при использовании без вазопрессоров лидокаин сокращает свою продолжительность действия за счет расширения местной сосудистой сети, в то время как мепивакаин и бупивакаин этого не делают.Составы простого лидокаина могут быть полезны для кратковременных процедур после инфильтрации, но их эффективность при блокаде нерва невысока.
ТОКСИЧНОСТЬ МЕСТНЫХ АНЕСТЕТИКОВ
Системная токсичность, приписываемая местным анестетикам, зависит от дозы, но понимание этих доз не всегда является простым делом. К сожалению, использование картриджей с анестетиком в стоматологии привело к небрежности в оценке фактического количества анестетика, которое мы вводим нашим пациентам. К сожалению, эту практику продолжают развивать во время бакалавриата и во многих уважаемых стоматологических публикациях.Стоматологический картридж представляет собой объем, а не дозу, которую более правильно выражать в миллиграммах или микрограммах. Кроме того, стоматологические картриджи часто содержат 2 препарата: местный анестетик и вазопрессор, каждый из которых имеет отдельную дозу. Еще больше усложняет ситуацию то, что стоматологические картриджи содержат особые объемы, такие как 1,7 или 1,8 мл. Сумма этих проблем делает попытки вычислений реальных дозировок и позволяет запоминать количества на картридж, а не фактическую оценку правильных доз. Эта практика еще больше усложняется, когда картриджи содержат различные концентрации местных анестетиков и вазопрессоров.Чтобы упростить расчет дозировки, разумно отказаться от концепции картриджей и считать, что каждый из них содержит 2 мл объема. Это приведет к завышению количества, вводимого пациенту, что является безопасной практикой. Например, когда было введено 4½ картриджа, оцените его как 9 мл. Эту единицу объема легче преобразовать в приблизительную дозу каждого лекарства в миллиграммах или микрограммах, как показано на.
Таблица 1.
Приблизительные дозировки *
По мере всасывания местных анестетиков из места инъекции их концентрация в кровотоке повышается, а периферическая нервная система и центральная нервная система (ЦНС) подавляются в зависимости от дозы. манера.(См.) Низкие сывороточные концентрации используются клинически для подавления сердечных аритмий и статусных судорог, но, по иронии судьбы, более высокие концентрации вызывают судорожную активность. Судорожные припадки являются первоначальным опасным для жизни последствием передозировки местного анестетика. Предположительно это происходит из-за избирательного угнетения центральных тормозных путей, которые позволяют возбуждающим трактам работать безумно. По мере того, как концентрации в сыворотке продолжают расти, все метаболические пути ингибируются, что приводит к коме, остановке дыхания и, в конечном итоге, сердечно-сосудистому коллапсу.Признаки токсичности лидокаина могут проявляться при концентрациях> 5 мкг / мл, но для судорожных припадков обычно требуются концентрации> 10 мкг / мл.
Приблизительные концентрации лидокаина в сыворотке и системные эффекты.
Важно, чтобы местные анестетики считались депрессантами ЦНС, и они потенцируют любое угнетение дыхания, связанное с седативными средствами и опиоидами. Кроме того, сывороточные концентрации, необходимые для возникновения судорог, ниже, если присутствует гиперкарбия (повышенный уровень углекислого газа).Это тот случай, когда угнетение дыхания вызывается одновременным приемом седативных средств и опиоидов. Гудсон и Мур задокументировали катастрофические последствия взаимодействия этого лекарственного средства у педиатрических пациентов, получающих процедурную седацию, наряду с чрезмерными дозами местных анестетиков. 3
Хотя все местные анестетики несут сравнимый риск токсичности для ЦНС, следует отметить, что бупивакаин проявляет больший потенциал прямой сердечной токсичности, чем другие агенты. 1 , 2 Объяснение не полностью установлено, но считается, что оно связано с тем фактом, что бупивакаин имеет большее сродство к неактивным и покоящимся конфигурациям натриевых каналов и медленнее диссоциирует из этих каналов. Это задерживает восстановление от потенциалов действия, делая сердечные ткани восприимчивыми к аритмиям. Эта проблема актуальна для определенных медицинских процедур, во время которых бупивакаин вводят в очень высоких дозах. Никогда не было обнаружено, что это происходит при дозах до максимальных, рекомендованных для стоматологической анестезии.
Возникает очевидный вопрос: какая системная концентрация в сыворотке крови следует за введением определенной дозы местного анестетика. В 1972 году Скотт и др. Опубликовали одно из серии знаковых клинических исследований, оценивающих переменные, которые определяют последующие концентрации лидокаина и прилокаина в сыворотке. 4 Неудивительно, что концентрации в сыворотке крови менялись в зависимости от относительной васкулярности тканей, в которые вводили анестетик. При использовании лидокаина в дозе 400 мг самые высокие уровни в сыворотке наблюдались при последующей инфильтрации слизистой оболочки влагалища, а самые низкие — при подкожной инфильтрации брюшной полости.Однако в каждом случае пиковый уровень в сыворотке крови наблюдался через 20–30 минут после инъекции только лидокаина. Независимо от способа введения пиковые уровни были снижены, а скорость абсорбции замедлена путем добавления 1 200 000 эпинефрина к раствору местного анестетика. Разумно предположить, что системные концентрации после подслизистой инъекции в ротовую полость будут приближаться к таковым после инъекции в слизистую оболочку влагалища из-за аналогичной васкулярности. К сожалению, очень мало стоматологических исследований, посвященных более высоким дозам местных анестетиков.Тем не менее, Hersh et al. 5 опубликовали впечатляющее исследование, в котором были получены сопоставимые результаты после нескольких внутриротовых инъекций в общей сложности 7 картриджей (1,7 мл каждый = ~ 480 мг) артикаина, содержащего адреналин 1 ∶ 200 000. (См.) Можно разумно заключить, что соблюдение опубликованных максимальных рекомендуемых доз для местных анестетиков не приведет к системным уровням в сыворотке, которые приближаются к уровням, связанным с токсичностью.
Концентрации местного анестетика в сыворотке крови. (См. Текст для объяснения.По материалам Scott et al. , 4, и Hersh et al. 5 )
Дополнительные переменные также рассматривались Скоттом и др. 4 Как и ожидалось, дозировка и скорость инъекции были напрямую связаны с концентрацией в сыворотке. Концентрация раствора, например, 2% против 4%, не имела значения; концентрации в сыворотке были связаны с общей дозировкой. Введение 20 мл 2% или 10 мл 4% (400 мг) привело к такой же концентрации в сыворотке. При использовании лидокаина или других анестетиков, независимо от их концентрации, необходимо учитывать введенную дозу (миллиграммы), а не объем (миллилитры или картриджи).
Вопреки общепринятому мнению, возраст или вес пациента не позволяют предсказать системную концентрацию в сыворотке после доз, рассчитанных в миллиграммах на возраст (годы) или миллиграммах на килограмм. Однако при ведении педиатрических пациентов максимальные дозировки обычно выражаются в мг / кг, и это следует соблюдать в качестве меры предосторожности. Однако это не имеет большого значения для взрослых, и следует придерживаться рекомендаций, выраженных в максимальной дозе в миллиграммах, независимо от веса и возраста.Очевидно, это максимальное количество не должно превышаться при расчете доз в мг / кг для больших детей.
При рассмотрении токсичности любого класса наркотиков следует помнить о метаболитах, а также о исходном лекарстве. Метаболит прилокаина, o -толуидин, может окислять железо в гемоглобине от двухвалентного (Fe 2+ ) до трехвалентного (Fe 3+ ). Измененные таким образом гемы не связывают кислород, а нормальные гемы на одной и той же молекуле гемоглобина с трудом выделяют свой кислород.Эта форма гемоглобина называется метгемоглобином, и когда таким образом изменяется> 1% общего гемоглобина, состояние называется метгемоглобинемией. Пациенты выглядят синюшными и становятся симптоматичными, когда доля метгемоглобина превышает 15%. 6 Насыщение гемоглобина по данным пульсоксиметрии (SpO 2 ) будет снижаться, несмотря на клинические доказательства эффективной оксигенации и вентиляции. Например, показания пульсоксиметра могут быть <90%, но фактическое давление кислорода в артериальной крови (PaO 2 ) может находиться в пределах нормы (> 80 мм рт.Состояние становится опасным для жизни, когда уровень метгемоглобина превышает 50–60%, и лечится с помощью внутривенного введения метиленового синего, который восстанавливает геммы до нормального состояния. Маловероятно, что метгемоглобинемия, связанная с прилокаином, возникнет после приема рекомендуемых доз. Редко можно встретить пациента с наследственной метгемоглобинемией, что противопоказано к применению прилокаина.
Аллергия на местные анестетики
Пациенты часто заявляют, что у них аллергия на местные анестетики.Однако при тщательном расспросе обычно выясняется, что они испытали либо обморок, связанный с инъекцией, либо учащенное сердцебиение, связанное с адреналином, содержащимся в растворе или высвобожденным эндогенно. Аллергические реакции после инъекций местного анестетика, скорее всего, связаны с консервантами (метилпарабен) или антиоксидантами (сульфитами), содержащимися в растворе. 7 Метилпарабен включен в многодозовые флаконы для предотвращения роста микробов.Его больше нет во флаконах с одной дозой или стоматологических картриджах. Сульфиты предотвращают окисление вазопрессоров и входят только в те стоматологические картриджи, которые содержат адреналин или левонордефрин.
Аллергические реакции вызываются иммунными механизмами, посредством которых лимфоциты сенсибилизируются к антигену и при последующем воздействии опосредуют ряд патофизиологических изменений. Гелл и Кумбс сначала отнесли реакции гиперчувствительности (аллергические) к типам от I до IV, основываясь на различных иммунологических механизмах. 8 Реакции типа I возникают в течение нескольких минут после провокации и опосредуются антителами или иммуноглобулином E (IgE), продуцируемым B-лимфоцитами. Это тип, который чаще всего провоцируется компонентами местных анестетиков. Реакции типа 4 задерживаются на несколько дней после провокации и опосредуются сенсибилизированными Т-лимфоцитами. Этот тип реакции на местные анестетики бывает очень редко.
Чтобы лекарства были иммуногенными, они должны иметь большую молекулярную массу и обладать множественными валентностями, чтобы их могли распознать иммунные клетки. 9 Крупные белки, такие как инсулин животного происхождения, удовлетворяют этим требованиям и хорошо зарекомендовали себя как иммуногенные. Большинство молекул лекарств слишком малы и фактически объединяются с другими молекулами, которые действуют как носители, вызывая аллергическую реакцию. В случае сульфонамидных антибиотиков, например, фенильное кольцо, содержащее аминное замещение, является виновником образования иммуногенного комплекса. Этот фрагмент является общим для других производных парааминобензойной кислоты (ПАБК), таких как метилпарабен и некоторых, но не всех, сложноэфирных местных анестетиков.В этих случаях может существовать потенциал перекрестной аллергенности, поскольку они имеют общую молекулярную структуру, например, сульфамидные антибиотики, метилпарабен и сложные эфиры ПАБК.
Говоря о местных анестетиках, бессмысленно называть сложные эфиры более аллергенными, чем амиды. Сложный эфир представляет собой просто химическую связь и не придает соединению иммуногенности. Скорее всего, виноват молекулярный компонент, соединенный этой связью. Это заблуждение привело к тому, что некоторые агенты были ошибочно названы перекрестно аллергенными с сульфонамидными антибиотиками.Артикаин классифицируется как амидный местный анестетик из-за связи между его жирорастворимым кольцом и концевым амином. Его тиофеновое кольцо содержит атом серы, который не обладает иммуногенными свойствами, и боковую цепь сложного эфира, которая делает соединение неактивным после гидролиза. Однако артикаин не высвобождает метаболит, напоминающий ПАБК, и не вызывает опасений относительно перекрестной иммуногенности с сульфаниламидами. Напротив, прокаин является представителем сложных эфиров, полученных из PABA, и гидролиз высвобождает фрагмент, который является потенциально иммуногенным ().
Молекулярные структуры и аллергенность. Иммуногенность объясняется лекарствами, имеющими фенильное кольцо с пара-аминным замещением. Он содержится в сульфонамидных антибиотиках и соединениях, содержащих парааминобензойную кислоту (ПАБК), таких как некоторые солнцезащитные кремы и косметика. Он также содержится в консервантах на основе метилпарабена и местных анестетиках на основе сложных эфиров, таких как прокаин. Сложноэфирные связи (прокаин) или боковые цепи (артикаин) не являются иммуногенными, как и атом серы тиофенового кольца (артикаин).* указывает на иммуногенный фрагмент.
Последнее заблуждение относится к сульфитам. Их включают в растворы местных анестетиков, содержащие вазопрессоры, чтобы предотвратить их окисление. Это неорганические соединения (-SO 3 ), которые участвуют в аллергических реакциях, но они не имеют никакого отношения к иммуногенности, приписываемой соединениям, родственным PABA. Эти агенты также используются в качестве антиоксидантов в свежих фруктах и овощах, чтобы сохранить их цвет и внешний вид. Важно отметить, что пациенты с аллергией на такие продукты могут испытывать перекрестные реакции с растворами местных анестетиков, содержащих вазопрессоры, поскольку они содержат те же самые сульфиты.
Сообщения об аллергических реакциях на местные анестетики появлялись в научной литературе с некоторой частотой. 10 , 11 Однако трудно понять точность или фактическую частоту из-за несоответствия в методах подтверждения, которые включают кожные уколы, внутрикожные инъекции и провокационные лекарственные препараты. Во многих случаях не было подтверждения фактического виновника, консерванта или местного анестетика. Более того, лишь очень немногие из них действительно подтвердили присутствие IgE к лекарственному средству с помощью иммуноблоттинга.Обширный анализ этой литературы недавно был проведен Speca et al. 12
Практически во всех описаниях случаев у пациентов действительно наблюдались признаки и симптомы, соответствующие аллергической реакции. Был ли реальный патогенез действительно иммуноопосредованным (аллергия), вероятно, скорее академический, чем прагматический. Последнее событие в этих реакциях приписывается синтезу и высвобождению медиаторов, вместе называемых аутакоидами, из которых гистамин и лейкотриены являются наиболее важными.Эти аутакоиды не только оказывают прямое воздействие на ткани, но также могут привлекать различные воспалительные клетки, которые способствуют так называемой реакции поздней фазы, которая может не проявляться в течение нескольких дней после провокации. В самом деле, лекарства нередко генерируют эти аутакоиды в результате действий, которые не являются иммуноопосредованными и поэтому неправильно классифицируются как аллергия. Меперидин стимулирует высвобождение гистамина из тучных клеток, а нестероидные противовоспалительные препараты могут способствовать синтезу лейкотриенов.В таких случаях реакция пациента обычно обозначается как псевдоаллергическая, чтобы отличить ее от истинной аллергии, которая является иммунной.
Если пациент описывает реакцию, которая, по крайней мере, клинически соответствует аллергии, стоматолог должен избегать использования вызывающего заболевания агента до тех пор, пока его не осмотрит аллерголог. В случае, если до получения медицинского разрешения требуется анестетик, самым разумным выбором будет либо мепивакаин, либо прилокаин без вазопрессоров. Согласно общепринятому мнению, если местные анестетики действительно вызывают аллергию, эфиры ПАБК будут более вероятными, чем амидные местные анестетики.Кроме того, избегая растворов, содержащих вазопрессоры, можно избежать любых бисульфитов, которые входят в состав антиоксидантов. Возможна чувствительность к различным сульфитам, особенно у пациентов с астмой или атопией. Эти принципы являются основой блок-схемы, представленной в. Пациенту никогда нельзя отказывать в преимуществах местной анестезии на основании ошибочных предположений относительно аллергии.
Ведение пациентов с аллергией на местные анестетики. Исключите распространенные реакции, ошибочно принимаемые за аллергию, например обмороки и тахикардию.Затем установите, что характер их реакции, по крайней мере, напоминал реакцию гиперчувствительности, например сыпь, зуд, крапивницу или одышку. Если препарат известен, выберите другой амид, не содержащий вазопрессоров, чтобы не было сульфитов. В противном случае направьте пациента к аллергологу для тестирования сульфитов и типичных местных анестетиков, таких как лидокаин, мепивакаин и прилокаин. (Адаптировано из deShazo и Kemp. 13 )
Местная токсичность
Ишемический некроз тканей может возникнуть после инъекций местных анестетиков.Это может быть связано с раздражающим действием раствора, давлением больших объемов или сужением сосудистой сети из-за вазопрессоров. Это особенно опасно при инъекции в прикрепленную слизистую оболочку, например твердое небо. Также растет беспокойство по поводу прямой нейротоксичности, связанной с составами, содержащими высокие концентрации, такие как 4% артикаин и прилокаин.
Хаас и Леннон сообщили о повышении частоты парестезий в Канаде после введения артикаина в середине 1980-х годов. 14 Только в 1993 году было зарегистрировано 14 случаев парестезии, и все они были связаны с применением артикаина или прилокаина. Когда артикаин впервые был представлен на одобрение Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США, было установлено, что он имеет более высокий риск парестезии, чем лидокаин.
Совсем недавно Гаристо и др. 15 рассмотрели заявления о парестезии в Соединенных Штатах в период с ноября 1997 года по август 2008 года и обнаружили 248 случаев парестезии после стоматологических процедур.В большинстве случаев (~ 95%) была задействована блокада нижнечелюстного нерва, и в 89% из них был поражен язычный нерв. По сравнению с другими местными анестетиками, парестезия была в 7,3 раза более вероятна при использовании 4% артикаина и в 3,6 раза более вероятна при использовании 4% прилокаина. Подобные результаты из отчетов о парестезии в Дании были опубликованы Hillerup et al. 16 Эти данные могут быть еще более значимыми, если учесть количество случаев, которые вполне могут остаться незарегистрированными.
Хотя стоматологическое сообщество не спешило прийти к консенсусу по этому вопросу, следует понимать, что в литературе по медицинской анестезии категорически утверждается, что более высокая концентрация растворов местных анестетиков увеличивает риск прямой нейротоксичности для нервных стволов: «Все клинически используемые Местные анестетики могут оказывать прямое токсическое воздействие на нервы, если они достигают достаточно высоких интраневральных концентраций.Клиницисты должны знать, что концентрации приготовленных растворов местных анестетиков сами по себе нейротоксичны и что их разведение in situ или в тканях важно для безопасного использования ». 1
Этот факт дополнительно подтверждается Hillerup et al, которые продемонстрировали большую нервную токсичность 4 по сравнению с 2% артикаином в препаратах седалищного нерва. 17 Как и в случае со всеми лекарствами, каждый практикующий врач должен провести анализ соотношения риска и пользы перед применением лекарства. Только в том случае, если польза от использования артикаина превышает риск для этого практикующего врача, его следует рассматривать для использования.Было бы разумно ограничить использование 4% концентраций для инфильтрации и избегать их использования для нервной блокады, отдав предпочтение агентам, сформулированным в более низких концентрациях. 15 , 16
СРАВНЕНИЯ С МЕСТНЫМИ АНЕСТЕТИКАМИ
Лидокаин продолжает оставаться наиболее широко используемым местным анестетиком в Соединенных Штатах, но все эти агенты имеют сопоставимую эффективность. Они различаются по эффективности и нескольким фармакокинетическим параметрам, которые объясняют различия в начале и продолжительности анестезии.При выборе конкретного агента необходимо учитывать продолжительность запланированной процедуры и проблемы, связанные с концентрацией вазопрессоров. Для длительных процедур логичным выбором является бупивакаин, но, согласно исследованиям, в которых сравнивались различные анестетики, он считается одним из наиболее болезненных агентов во время инъекции. 18 — , 20 Одна из стратегий — обеспечить первые 60–90 минут анестезии с использованием менее раздражающего агента (лидокаин или прилокаин), а затем повторно ввести анестезируемую ткань с бупивакаином, чтобы обеспечить хорошее обезболивание в послеоперационном периоде. период.Такая стратегия наиболее эффективна после нервных блокад; следует ожидать более короткую продолжительность пульпарной анестезии после инфильтрации. (См.)
Таблица 2.
Местные анестетики в картриджах 21 , 22
Несмотря на неофициальные заявления о превосходстве артикаина над лидокаином при блокаде нижних альвеол, опубликованные исследования практически не обнаружили разницы. , особенно при наличии симптомов зубов. 22 — , 24 Любое небольшое преимущество артикаина компенсируется его повышенным риском парестезии, о которой говорилось выше.Однако при инфильтрации нижней челюсти артикаин явно превосходит его и не несет риска нервной токсичности, если не вводится рядом с подбородочным нервом. 22 , 25 , 26 Превосходство артикаина можно объяснить его высокой растворимостью в липидах и концентрацией его препаратов. В отличие от других анестетиков, содержащих бензол в качестве ароматического кольца, артикаин имеет тиофеновое кольцо и замены, которые придают большую растворимость липидов, чем другие местные анестетики, за исключением бупивакаина.Это свойство должно было позволить использовать его в более низкой концентрации, но на самом деле он был составлен в виде 4% раствора. Артикаин не только более растворим в липидах, но и содержит большее количество молекул, чем, например, 2% лидокаин в равном объеме. На сегодняшний день не было опубликованных исследований, сравнивающих артикаин с 4% растворами лидокаина при инфильтрации нижней челюсти. Лидокаин в этой концентрации представляет неприемлемый риск системной токсичности, что дает еще одно привлекательное свойство артикаина: характер клиренса.
Хотя артикаин классифицируется как амид, из-за связи его промежуточной цепи тиофеновое кольцо также содержит сложноэфирную боковую цепь. Эта цепь гидролизуется эстеразами плазмы, что делает молекулу неактивной. В результате период полувыведения артикаина составляет всего 20-40 минут по сравнению с> 90 минутами для лидокаина и других амидов, требующих печеночного клиренса. По этой причине артикаин представляет меньший риск системной токсичности при длительных приемах, когда вводятся дополнительные дозы анестетика.Однако следует помнить, что артикаин с концентрацией 4% содержит удвоенную дозу 2% лидокаина на введенный объем, и их максимальные рекомендуемые дозы идентичны.
ВАЗОПРЕССОРЫ
Вазопрессоры — это препараты, которые обеспечивают сужение кровеносных сосудов путем активации альфа-1-адренорецепторов. Их сочетают с местными анестетиками для обеспечения гемостаза в операционном поле и задержки абсорбции анестетика. Задержка всасывания местных анестетиков не только снижает риск системной токсичности, но и увеличивает продолжительность анестезии.Адреналин является наиболее распространенным агентом, используемым для этой цели, несмотря на то, что он проявляет значительную сердечную стимуляцию из-за его дополнительного действия в качестве агониста бета-1-адренорецепторов.
Несмотря на популярность адреналина 1 100 000, его концентрации выше 1 ∶ 200 000 (5 мкг / мл) практически не дают никаких преимуществ. Более высокие концентрации не обеспечивают лучшего начала или продолжительности блокады нижнего альвеолярного нерва. 29 , 30 Более высокие концентрации также не снижают концентрации местного анестетика в сыворотке. 4 , 5 Однако более высокие концентрации, например, 1 ∶ 100 000 (10 мкг / мл) и 1 50 000 (20 мкг / мл), могут обеспечить лучший гемостаз при инфильтрации в операционном поле, когда это влияние желанный.
Влияния на сердечно-сосудистую систему
Чтобы должным образом решить вопросы безопасности, нужно сначала понять принципы расчета дозировки, представленные в этой статье. Продолжаются дискуссии о пагубном влиянии адреналина на пациентов с сердечно-сосудистыми заболеваниями.Часто этот спор продолжается без полного понимания фактического действия и эффектов этого широко используемого препарата. Адреналин действует как агонист рецепторов альфа, бета-1 и бета-2. Эти действия объясняют его влияние на сердечно-сосудистую систему, как показано на рис. Прежде чем анализировать этот показатель, важно прояснить распространенное заблуждение. Стоматолог рассматривает адреналин как сосудосуживающее средство на основании его эффектов при введении в подслизистые ткани. Это потому, что крошечные сосуды в этом месте содержат только альфа-рецепторы.Более крупные системные артерии, которые определяют артериальное сопротивление и диастолическое артериальное давление, содержат гораздо больше бета-2, чем альфа-рецепторов, и после абсорбции низкие дозы адреналина вызывают расширение этих сосудов.
Сердечно-сосудистые эффекты адреналина. 31 Следующий график иллюстрирует типичную сердечно-сосудистую реакцию на адреналин, вводимый в виде непрерывной внутривенной инфузии 10 мкг / мин. (Это количество содержится в 1 мл концентрации 1 100 000.) Адреналин увеличивает частоту сердечных сокращений (ЧСС) за счет активации рецепторов бета-1 в синоатриальном узле, нормальном кардиостимуляторе сердца. Он также активирует рецепторы бета-1 на клетках миокарда, увеличивая их сократимость и повышая систолическое артериальное давление (САД). Однако он активирует бета-2 рецепторы на системных артериях, вызывая расширение сосудов. Это снижение артериального сопротивления вызывает снижение диастолического давления (ДАД). Эти эффекты приводят к небольшому изменению среднего артериального давления (САД).
Клинические испытания однозначно подтвердили, что даже небольшие дозы адреналина в растворах местных анестетиков влияют на сердечно-сосудистую функцию.Dionne et al. 32 изучали влияние 3 картриджей 2% лидокаина с эпинефрином 1 100 000 (~ 60 мкг адреналина). Подслизистая инъекция этой дозировки увеличивала сердечный выброс, частоту сердечных сокращений и ударный объем. Системное артериальное сопротивление было снижено, а среднее артериальное давление практически не изменилось. Аналогичным образом, Hersh et al. 5 наблюдали аналогичные результаты после введения артикаина, содержащего 1 100 000 (∼120 мкг) и 1 ∶ 200 000 (∼60 мкг) адреналина, с большей реакцией на более высокую дозировку.Эти результаты согласуются с общепризнанными влияниями, как показано на рис.
Результаты исследований, подобных только что упомянутым, следует рассматривать в перспективе. Например, влияние ~ 120 мкг адреналина, опубликованное Hersh et al. 5 , было незначительным: увеличение частоты сердечных сокращений на ~ 8-10 ударов в минуту и изменения артериального давления в среднем на ~ 5 мм рт. Тем не менее, 14 участников были в отличном состоянии, их показатели жизненно важных функций в состоянии покоя составляли в среднем 68 для частоты сердечных сокращений, 125 мм рт. Ст. Для систолического давления и 73 мм рт. Ст. Для диастолического давления.Кроме того, они не принимали никаких серьезных лекарств. Очевидно, что такие люди могут легко переносить введенные дозы, но следует отметить, что двое из этих здоровых участников действительно сообщили о сердцебиении.
Даже небольшие дозы адреналина вызывают сердечно-сосудистые эффекты; это однозначно. Вопрос заключается в том, представляют ли сердечно-сосудистые воздействия адреналина значительный риск для пациентов с различной степенью компрометации. Стандарты и руководства продолжают продвигаться, но на самом деле все они анекдотичны.Наивно предлагать ввести ограничение «2 картриджа» для пациентов с сердечно-сосудистыми заболеваниями. В конечном итоге для принятия решения стоматолог должен вынести здравое клиническое суждение, основанное на тщательном анализе каждого рассматриваемого пациента. Если показана консультация с врачом пациента, обсудите ожидаемый диапазон доз в микрограммах, а не в концентрациях или картриджах. Например, если планируется 2–4 картриджа с местным анестетиком, объясните, что вы будете использовать 40–80 мкг адреналина, инфильтрованного под слизистую оболочку, а не 2–4 картриджа с адреналином 1 ∶ 100 000.Врач не знаком с дозировкой, выраженной в картриджах или концентрациях. Для справки рассмотрите стандартную дозу адреналина для лечения аллергической реакции: 0,3 мг или 300 мкг. Врач, как правило, будет интересоваться дозами 100 мкг или больше.
Левонордефрин (Неокобефрин) — вазопрессор в сочетании с 2% препаратами мепивакаина в США. Он больше похож на норадреналин, чем на адреналин, поскольку не обладает активностью в отношении бета-2-рецепторов. По этой причине он повышает не только систолическое артериальное давление, как адреналин, но также диастолическое и среднее артериальное давление.У некоторых пациентов это может вызвать рефлекторное блуждающее влияние на частоту сердечных сокращений, которое может частично компенсировать прямую стимуляцию сердечного ритма рецепторами бета-1. Однако исследования, оценивающие влияние сердечно-сосудистой системы после внутрикостных инъекций, обнаружили небольшую разницу между адреналином и левонордефрином. 33 , 34 Это, вероятно, объясняется быстрым всасыванием, которое позволяет проводить прямую стимуляцию бета-1 до того, как вмешаются рефлекторные реакции на среднее артериальное давление.Сравнение адреналина и левонордефрина представлено в.
Таблица 3.
Действия адреналина по сравнению с левонордефрином
Максимально допустимые дозы вазопрессоров не установлены. Выражать ограничения в виде назначений нецелесообразно; Время лечения может составлять от 30 минут до 3-4 часов. Кроме того, влияние данной дозы вазопрессора на пациентов сильно различается. Пиковое влияние адреналина обычно наблюдается в течение 5–10 минут после инъекции 5 и быстро снижается; Адреналин и левонордефрин являются катехоламинами и быстро метаболизируются катехол-о-метилтрансферазой.Фактически, период полувыведения большинства катехоламинов составляет всего 1-3 минуты. Как правило, гемодинамические влияния наблюдаются в течение нескольких минут после инъекции и полностью исчезают через 10-15 минут. Доза адреналина 40 мкг (приблизительно 2 картриджа с содержанием адреналина 1 100 000) является наиболее консервативным и часто упоминаемым ограничением дозы для пациентов с серьезными сердечно-сосудистыми заболеваниями. Следует уточнить, что это руководство более точно отражает 30-минутные периоды времени, а не встречи.Более рациональное предложение — основывать дозировку на оценке пациента, а не на максимальных количествах. Например, если по какой-либо причине медицинский статус пациента ставится под сомнение, разумный протокол состоит в том, чтобы записывать исходную частоту сердечных сокращений и артериальное давление до операции и снова после каждого введения 20-40 мкг. Это соответствует 1-2 картриджам с концентрацией адреналина 1 ∶ 100 000. Практически любой пациент может выдержать такое количество сердечно-сосудистых воздействий. Если состояние пациента остается стабильным, могут быть введены дополнительные дозы, после чего следует аналогичная схема повторной оценки показателей жизнедеятельности.
Лекарственные взаимодействия
Возможные лекарственные взаимодействия были подробно рассмотрены в предыдущей статье для повышения квалификации в этом журнале. 35 Наиболее важные из них относятся к возможной усиленной стимуляции сердечно-сосудистой системы. Вазопрессоры, обнаруженные в формах местного анестетика, обладают кардиотоническим действием, и это может стать более значительным, когда пациенты получают лечение любым лекарственным средством, оказывающим подобное влияние. К ним относятся трициклические антидепрессанты и ингибиторы моноаминоксидазы, дигоксин, гормон щитовидной железы или любые симпатомиметики, используемые для контроля веса или нарушений внимания.Вазопрессоры не противопоказаны этим пациентам, но их следует назначать с осторожностью, как описано выше для пациентов с ограниченными возможностями здоровья. Пациентам, у которых есть подозрение на злоупотребление стимуляторами, например кокаином, может быть разумным вообще избегать вазопрессоров.
Осторожное использование вазопрессоров также рекомендуется пациентам, принимающим неселективные бета-блокаторы. В отличие от селективных агентов, которые блокируют только рецепторы бета-1 в сердце, неселективные агенты также блокируют сосудистые рецепторы бета-2.В этом случае альфа-агонистическое действие вазопрессоров становится более выраженным, и как диастолическое, так и среднее артериальное давление могут стать опасно повышенными. Обычно это сопровождается внезапным рефлекторным замедлением сердечного ритма. Существенные последствия этого взаимодействия хорошо задокументированы. 36 — , 38 Взаимодействие с бета-блокаторами происходит во времени, идентичном наблюдаемому для нормальных сердечно-сосудистых реакций на адреналин. Он начинается после абсорбции из места инъекции, которая обычно достигает пика в течение 5 минут и снижается в течение последующих 10–15 минут.Вазопрессоры не противопоказаны пациентам, принимающим неселективные бета-блокаторы, но дозы должны быть консервативными, а артериальное давление периодически контролировать во время приема, как описано выше. Следует избегать использования ретракционных шнуров, пропитанных рацемическим адреналином. Эти продукты содержат адреналин в количествах, намного превышающих те, которые содержатся в составах местных анестетиков.
Местные анестетики: обзор фармакологических аспектов
Abstract
Местные анестетики обладают впечатляющей историей эффективности и безопасности в медицинской и стоматологической практике.Их использование настолько рутинно, а побочные эффекты настолько редки, что медицинские работники могут по понятным причинам упускать из виду многие из своих фармакотерапевтических принципов. Целью данной статьи для повышения квалификации является обзор и обновление основных фармакологических характеристик различных местных анестетиков, используемых в настоящее время. Технические соображения будут рассмотрены в следующей статье.
Ключевые слова: Местные анестетики, Фармакология, Токсичность лекарств, Стоматология
Местные анестетики прерывают нервную проводимость, подавляя приток ионов натрия через каналы или ионофоры в мембранах нейронов.Обычно эти каналы существуют в состоянии покоя, во время которого ионам натрия запрещен доступ. Когда нейрон стимулируется, канал принимает активированное или открытое состояние, в котором ионы натрия диффундируют в клетку, инициируя деполяризацию. После этого внезапного изменения напряжения на мембране натриевой канал переходит в неактивное состояние, во время которого дальнейший приток запрещается, в то время как активные транспортные механизмы возвращают ионы натрия наружу. После этой реполяризации канал принимает нормальное состояние покоя.Понимание этих состояний натриевых каналов помогает объяснить предпочтительную чувствительность местных анестетиков к различным классам нейронных волокон.
Местные анестетики обладают большим сродством к рецепторам внутри натриевых каналов во время их активированного и инактивированного состояний, чем когда они находятся в состоянии покоя. 1 , 2 Следовательно, нервные волокна с более высокой скоростью возбуждения наиболее восприимчивы к действию местного анестетика. Кроме того, волокна меньшего размера, как правило, более восприимчивы, потому что данный объем раствора местного анестетика может более легко блокировать необходимое количество натриевых каналов для полного прерывания передачи импульса.По этим причинам наиболее чувствительными являются крошечные, быстрорастущие вегетативные волокна, за ними следуют сенсорные волокна и, наконец, соматические двигательные волокна. 1 , 2 Анестезиолог, блокирующий смешанные спинномозговые нервы, хорошо осведомлен об этой разной чувствительности. Когда пациенты оправляются от спинномозговой анестезии, они сначала восстанавливают произвольную двигательную функцию, затем возвращаются ощущения и, наконец, они могут мочиться (вегетативный контроль). Дантисту обычно не приходится уделять этому внимание, потому что ветви тройничного нерва, анестезируемые при стоматологических процедурах, состоят только из небольших, быстро возбуждающихся сенсорных волокон.Однако многие классы сенсорных волокон также различаются по диаметру и скорости возбуждения. Например, болевые волокна более чувствительны, чем волокна, несущие давление и проприоцепцию. Пациента может по-прежнему беспокоить чувство давления, несмотря на полную анестезию болевых волокон.
ОБЩИЕ СВОЙСТВА МЕСТНЫХ АНЕСТЕТИКОВ
Молекулярная структура всех местных анестетиков состоит из 3 компонентов: (а) липофильное ароматическое кольцо, (б) промежуточная сложноэфирная или амидная связь и (в) третичный амин.Каждый из этих компонентов придает молекуле различные клинические свойства. (См.)
Местноанестезирующий состав.
Эффективность анестетика
Местные анестетики различаются по эффективности, что позволяет использовать их в концентрациях от 0,5 до 4%. Во многом это является результатом различий в растворимости липидов, что усиливает диффузию через нервные оболочки и нервные мембраны. Это свойство определяется ароматическим кольцом и его замещениями, а также замещениями, добавленными к третичному амину.Например, бупивакаин более жирорастворим и эффективен, чем артикаин, что позволяет составлять его в виде концентрации 0,5% (5 мг / мл), а не 4% (40 мг / мл).
Время начала действия
Повышенная растворимость лекарства в липидах не только увеличивает эффективность, но и способствует более быстрой диффузии через клеточные мембраны. Для местных анестетиков это ускоряет начало анестезии изолированных волокон во время исследований in vitro, но следует понимать, что в клинической практике играют роль и другие факторы.Например, присущие сосудорасширяющие свойства могут способствовать системной абсорбции до того, как анестетик достигнет нервной оболочки. Высокая растворимость липидов может препятствовать диспергированию в тканевых жидкостях, а также способствовать секвестрации в соседних жировых тканях или миелиновых оболочках. В любом случае меньшее количество молекул достигает нейрональной мембраны, и начало реакции задерживается. Следовательно, в отличие от исследований изолированных волокон in vitro, большая растворимость липидов обычно замедляет наступление анестезии в клинических условиях.Введение более высоких концентраций, которые позволяют большему количеству молекул достигать мембраны и ускоряют наступление, может компенсировать это влияние. Хотя бупивакаин и артикаин хорошо растворимы в липидах, 4% концентрация артикаина обеспечивает гораздо более быстрое начало.
Несмотря на множество факторов, влияющих на количество местного анестетика, достигающего нервных волокон, наиболее важным фактором, определяющим начало анестезии, является пропорция этих молекул, которые находятся в жирорастворимом, а не в водорастворимом состоянии.Конечный амин, проиллюстрированный на, может существовать в третичной форме (3 связи), которая является растворимой в липидах, или в виде четвертичной формы (4 связи), которая имеет положительный заряд и делает молекулу водорастворимой. Чтобы основа местного анестетика была стабильной в растворе, ее формулируют в виде гидрохлоридной соли. Таким образом, молекулы существуют в четвертичном, водорастворимом состоянии во время инъекции и не могут проникать в нейрон. Следовательно, время начала местной анестезии напрямую связано с долей молекул, которые превращаются в третичную липидорастворимую структуру при воздействии физиологического pH (7.4). Эта пропорция определяется константой ионизации (pKa) анестетика и рассчитывается с использованием уравнения Хендерсона-Хассельбаха:
Проще говоря, если бы местный анестетик имел pKa 7,4 и вводился в ткани, имеющие физиологические свойства. pH 7,4, 50% молекул будут существовать в четвертичной (катионной) форме и 50% будут существовать в третичной (незаряженной) форме; только половина молекул будет жирорастворимой и сможет проникать в нейрон. К сожалению, pKa для всех местных анестетиков больше 7.4 (физиологический pH), и поэтому большая часть молекул существует в четвертичной водорастворимой форме при введении в нормальную ткань. Клиническая оговорка заключается в том, что чем выше pKa для местного анестетика, тем меньше молекул доступно в их жирорастворимой форме. Это задержит наступление. Кроме того, кислая среда, связанная с воспаленными тканями, снижает их pH значительно ниже 7,4 и еще больше способствует четвертичной водорастворимой конфигурации. Это было предложено как одно из объяснений трудностей при попытке обезболить воспаленные или инфицированные ткани. 1 , 2 В этих ситуациях, например, бупивакаин (pKa 8,1) менее желателен, чем мепивакаин (pKa 7,6).
Следует уточнить, однако, что как только третичные молекулы попадают в нейрон, они реионизируются в четвертичную форму, что считается фактической блокадой натриевого канала. Последовательность событий, которая приводит к нервной блокаде, проиллюстрирована на рисунке.
Местноанестезирующее действие. Введенный местный анестетик находится в равновесии в виде четвертичной соли (BH + ) и третичного основания (B).Доля каждого из них определяется pKa анестетика и pH ткани. Жирорастворимое основание (B) необходимо для проникновения как в эпиневрий, так и в нейрональную мембрану. Как только молекула достигает аксоплазмы нейрона, амин получает ион водорода, и эта ионизированная четвертичная форма (BH + ) отвечает за фактическую блокаду натриевого канала. Равновесие между (BH + ) и (B) определяется pH тканей и pKa анестетика (pH / pKa).
Метаболизм и выведение
Промежуточная цепочка или звено обеспечивает удобную основу для классификации местных анестетиков, а также определяет характер их выведения. Амиды биотрансформируются в печени, но сложные эфиры гидролизуются в кровотоке эстеразами плазмы. Местные анестетики на основе сложного эфира больше не упаковываются в стоматологические картриджи и используются нечасто, за исключением бензокаина, который содержится в некоторых местных анестетических препаратах. Артикаин в этом отношении уникален.Он классифицируется как амид в соответствии с его промежуточной связью, но также содержит боковую цепь сложного эфира на своем ароматическом кольце. Гидролиз этой боковой цепи делает молекулу неактивной, и поэтому она удаляется аналогично сложноэфирным анестетикам.
Продолжительность действия
Местные анестетики различаются по продолжительности действия в основном из-за различий в их сродстве к белку. Как и большинство лекарств, местные анестетики обратимо связываются с белками плазмы, циркулируя в кровотоке.Это свойство выражается в процентах циркулирующего лекарственного средства, связанного с белком, и было обнаружено, что оно коррелирует со сродством анестетика к белку в натриевых каналах. Чем выше тенденция к связыванию белков, тем дольше анестетик будет выдерживать нервную блокаду. Например, бупивакаин демонстрирует 95% связывания с белками по сравнению с 55% для мепивакаина, и это объясняется разницей в продолжительности их нервной блокады.
Продолжительность анестезии также зависит от времени, в течение которого местный анестетик остается в непосредственной близости от нервных волокон.Локальная секвестрация сильно жирорастворимых анестетиков может обеспечить постоянное высвобождение к мембранам нейронов, увеличивая продолжительность, но сужение соседней сосудистой сети в этом отношении более значимо. По этой причине во многие препараты добавляют вазопрессоры, чтобы замедлить абсорбцию и продлить анестезию. Это особенно важно, потому что сами местные анестетики различаются по своей способности вызывать расширение сосудов. Например, при использовании без вазопрессоров лидокаин сокращает свою продолжительность действия за счет расширения местной сосудистой сети, в то время как мепивакаин и бупивакаин этого не делают.Составы простого лидокаина могут быть полезны для кратковременных процедур после инфильтрации, но их эффективность при блокаде нерва невысока.
ТОКСИЧНОСТЬ МЕСТНЫХ АНЕСТЕТИКОВ
Системная токсичность, приписываемая местным анестетикам, зависит от дозы, но понимание этих доз не всегда является простым делом. К сожалению, использование картриджей с анестетиком в стоматологии привело к небрежности в оценке фактического количества анестетика, которое мы вводим нашим пациентам. К сожалению, эту практику продолжают развивать во время бакалавриата и во многих уважаемых стоматологических публикациях.Стоматологический картридж представляет собой объем, а не дозу, которую более правильно выражать в миллиграммах или микрограммах. Кроме того, стоматологические картриджи часто содержат 2 препарата: местный анестетик и вазопрессор, каждый из которых имеет отдельную дозу. Еще больше усложняет ситуацию то, что стоматологические картриджи содержат особые объемы, такие как 1,7 или 1,8 мл. Сумма этих проблем делает попытки вычислений реальных дозировок и позволяет запоминать количества на картридж, а не фактическую оценку правильных доз. Эта практика еще больше усложняется, когда картриджи содержат различные концентрации местных анестетиков и вазопрессоров.Чтобы упростить расчет дозировки, разумно отказаться от концепции картриджей и считать, что каждый из них содержит 2 мл объема. Это приведет к завышению количества, вводимого пациенту, что является безопасной практикой. Например, когда было введено 4½ картриджа, оцените его как 9 мл. Эту единицу объема легче преобразовать в приблизительную дозу каждого лекарства в миллиграммах или микрограммах, как показано на.
Таблица 1.
Приблизительные дозировки *
По мере всасывания местных анестетиков из места инъекции их концентрация в кровотоке повышается, а периферическая нервная система и центральная нервная система (ЦНС) подавляются в зависимости от дозы. манера.(См.) Низкие сывороточные концентрации используются клинически для подавления сердечных аритмий и статусных судорог, но, по иронии судьбы, более высокие концентрации вызывают судорожную активность. Судорожные припадки являются первоначальным опасным для жизни последствием передозировки местного анестетика. Предположительно это происходит из-за избирательного угнетения центральных тормозных путей, которые позволяют возбуждающим трактам работать безумно. По мере того, как концентрации в сыворотке продолжают расти, все метаболические пути ингибируются, что приводит к коме, остановке дыхания и, в конечном итоге, сердечно-сосудистому коллапсу.Признаки токсичности лидокаина могут проявляться при концентрациях> 5 мкг / мл, но для судорожных припадков обычно требуются концентрации> 10 мкг / мл.
Приблизительные концентрации лидокаина в сыворотке и системные эффекты.
Важно, чтобы местные анестетики считались депрессантами ЦНС, и они потенцируют любое угнетение дыхания, связанное с седативными средствами и опиоидами. Кроме того, сывороточные концентрации, необходимые для возникновения судорог, ниже, если присутствует гиперкарбия (повышенный уровень углекислого газа).Это тот случай, когда угнетение дыхания вызывается одновременным приемом седативных средств и опиоидов. Гудсон и Мур задокументировали катастрофические последствия взаимодействия этого лекарственного средства у педиатрических пациентов, получающих процедурную седацию, наряду с чрезмерными дозами местных анестетиков. 3
Хотя все местные анестетики несут сравнимый риск токсичности для ЦНС, следует отметить, что бупивакаин проявляет больший потенциал прямой сердечной токсичности, чем другие агенты. 1 , 2 Объяснение не полностью установлено, но считается, что оно связано с тем фактом, что бупивакаин имеет большее сродство к неактивным и покоящимся конфигурациям натриевых каналов и медленнее диссоциирует из этих каналов. Это задерживает восстановление от потенциалов действия, делая сердечные ткани восприимчивыми к аритмиям. Эта проблема актуальна для определенных медицинских процедур, во время которых бупивакаин вводят в очень высоких дозах. Никогда не было обнаружено, что это происходит при дозах до максимальных, рекомендованных для стоматологической анестезии.
Возникает очевидный вопрос: какая системная концентрация в сыворотке крови следует за введением определенной дозы местного анестетика. В 1972 году Скотт и др. Опубликовали одно из серии знаковых клинических исследований, оценивающих переменные, которые определяют последующие концентрации лидокаина и прилокаина в сыворотке. 4 Неудивительно, что концентрации в сыворотке крови менялись в зависимости от относительной васкулярности тканей, в которые вводили анестетик. При использовании лидокаина в дозе 400 мг самые высокие уровни в сыворотке наблюдались при последующей инфильтрации слизистой оболочки влагалища, а самые низкие — при подкожной инфильтрации брюшной полости.Однако в каждом случае пиковый уровень в сыворотке крови наблюдался через 20–30 минут после инъекции только лидокаина. Независимо от способа введения пиковые уровни были снижены, а скорость абсорбции замедлена путем добавления 1 200 000 эпинефрина к раствору местного анестетика. Разумно предположить, что системные концентрации после подслизистой инъекции в ротовую полость будут приближаться к таковым после инъекции в слизистую оболочку влагалища из-за аналогичной васкулярности. К сожалению, очень мало стоматологических исследований, посвященных более высоким дозам местных анестетиков.Тем не менее, Hersh et al. 5 опубликовали впечатляющее исследование, в котором были получены сопоставимые результаты после нескольких внутриротовых инъекций в общей сложности 7 картриджей (1,7 мл каждый = ~ 480 мг) артикаина, содержащего адреналин 1 ∶ 200 000. (См.) Можно разумно заключить, что соблюдение опубликованных максимальных рекомендуемых доз для местных анестетиков не приведет к системным уровням в сыворотке, которые приближаются к уровням, связанным с токсичностью.
Концентрации местного анестетика в сыворотке крови. (См. Текст для объяснения.По материалам Scott et al. , 4, и Hersh et al. 5 )
Дополнительные переменные также рассматривались Скоттом и др. 4 Как и ожидалось, дозировка и скорость инъекции были напрямую связаны с концентрацией в сыворотке. Концентрация раствора, например, 2% против 4%, не имела значения; концентрации в сыворотке были связаны с общей дозировкой. Введение 20 мл 2% или 10 мл 4% (400 мг) привело к такой же концентрации в сыворотке. При использовании лидокаина или других анестетиков, независимо от их концентрации, необходимо учитывать введенную дозу (миллиграммы), а не объем (миллилитры или картриджи).
Вопреки общепринятому мнению, возраст или вес пациента не позволяют предсказать системную концентрацию в сыворотке после доз, рассчитанных в миллиграммах на возраст (годы) или миллиграммах на килограмм. Однако при ведении педиатрических пациентов максимальные дозировки обычно выражаются в мг / кг, и это следует соблюдать в качестве меры предосторожности. Однако это не имеет большого значения для взрослых, и следует придерживаться рекомендаций, выраженных в максимальной дозе в миллиграммах, независимо от веса и возраста.Очевидно, это максимальное количество не должно превышаться при расчете доз в мг / кг для больших детей.
При рассмотрении токсичности любого класса наркотиков следует помнить о метаболитах, а также о исходном лекарстве. Метаболит прилокаина, o -толуидин, может окислять железо в гемоглобине от двухвалентного (Fe 2+ ) до трехвалентного (Fe 3+ ). Измененные таким образом гемы не связывают кислород, а нормальные гемы на одной и той же молекуле гемоглобина с трудом выделяют свой кислород.Эта форма гемоглобина называется метгемоглобином, и когда таким образом изменяется> 1% общего гемоглобина, состояние называется метгемоглобинемией. Пациенты выглядят синюшными и становятся симптоматичными, когда доля метгемоглобина превышает 15%. 6 Насыщение гемоглобина по данным пульсоксиметрии (SpO 2 ) будет снижаться, несмотря на клинические доказательства эффективной оксигенации и вентиляции. Например, показания пульсоксиметра могут быть <90%, но фактическое давление кислорода в артериальной крови (PaO 2 ) может находиться в пределах нормы (> 80 мм рт.Состояние становится опасным для жизни, когда уровень метгемоглобина превышает 50–60%, и лечится с помощью внутривенного введения метиленового синего, который восстанавливает геммы до нормального состояния. Маловероятно, что метгемоглобинемия, связанная с прилокаином, возникнет после приема рекомендуемых доз. Редко можно встретить пациента с наследственной метгемоглобинемией, что противопоказано к применению прилокаина.
Аллергия на местные анестетики
Пациенты часто заявляют, что у них аллергия на местные анестетики.Однако при тщательном расспросе обычно выясняется, что они испытали либо обморок, связанный с инъекцией, либо учащенное сердцебиение, связанное с адреналином, содержащимся в растворе или высвобожденным эндогенно. Аллергические реакции после инъекций местного анестетика, скорее всего, связаны с консервантами (метилпарабен) или антиоксидантами (сульфитами), содержащимися в растворе. 7 Метилпарабен включен в многодозовые флаконы для предотвращения роста микробов.Его больше нет во флаконах с одной дозой или стоматологических картриджах. Сульфиты предотвращают окисление вазопрессоров и входят только в те стоматологические картриджи, которые содержат адреналин или левонордефрин.
Аллергические реакции вызываются иммунными механизмами, посредством которых лимфоциты сенсибилизируются к антигену и при последующем воздействии опосредуют ряд патофизиологических изменений. Гелл и Кумбс сначала отнесли реакции гиперчувствительности (аллергические) к типам от I до IV, основываясь на различных иммунологических механизмах. 8 Реакции типа I возникают в течение нескольких минут после провокации и опосредуются антителами или иммуноглобулином E (IgE), продуцируемым B-лимфоцитами. Это тип, который чаще всего провоцируется компонентами местных анестетиков. Реакции типа 4 задерживаются на несколько дней после провокации и опосредуются сенсибилизированными Т-лимфоцитами. Этот тип реакции на местные анестетики бывает очень редко.
Чтобы лекарства были иммуногенными, они должны иметь большую молекулярную массу и обладать множественными валентностями, чтобы их могли распознать иммунные клетки. 9 Крупные белки, такие как инсулин животного происхождения, удовлетворяют этим требованиям и хорошо зарекомендовали себя как иммуногенные. Большинство молекул лекарств слишком малы и фактически объединяются с другими молекулами, которые действуют как носители, вызывая аллергическую реакцию. В случае сульфонамидных антибиотиков, например, фенильное кольцо, содержащее аминное замещение, является виновником образования иммуногенного комплекса. Этот фрагмент является общим для других производных парааминобензойной кислоты (ПАБК), таких как метилпарабен и некоторых, но не всех, сложноэфирных местных анестетиков.В этих случаях может существовать потенциал перекрестной аллергенности, поскольку они имеют общую молекулярную структуру, например, сульфамидные антибиотики, метилпарабен и сложные эфиры ПАБК.
Говоря о местных анестетиках, бессмысленно называть сложные эфиры более аллергенными, чем амиды. Сложный эфир представляет собой просто химическую связь и не придает соединению иммуногенности. Скорее всего, виноват молекулярный компонент, соединенный этой связью. Это заблуждение привело к тому, что некоторые агенты были ошибочно названы перекрестно аллергенными с сульфонамидными антибиотиками.Артикаин классифицируется как амидный местный анестетик из-за связи между его жирорастворимым кольцом и концевым амином. Его тиофеновое кольцо содержит атом серы, который не обладает иммуногенными свойствами, и боковую цепь сложного эфира, которая делает соединение неактивным после гидролиза. Однако артикаин не высвобождает метаболит, напоминающий ПАБК, и не вызывает опасений относительно перекрестной иммуногенности с сульфаниламидами. Напротив, прокаин является представителем сложных эфиров, полученных из PABA, и гидролиз высвобождает фрагмент, который является потенциально иммуногенным ().
Молекулярные структуры и аллергенность. Иммуногенность объясняется лекарствами, имеющими фенильное кольцо с пара-аминным замещением. Он содержится в сульфонамидных антибиотиках и соединениях, содержащих парааминобензойную кислоту (ПАБК), таких как некоторые солнцезащитные кремы и косметика. Он также содержится в консервантах на основе метилпарабена и местных анестетиках на основе сложных эфиров, таких как прокаин. Сложноэфирные связи (прокаин) или боковые цепи (артикаин) не являются иммуногенными, как и атом серы тиофенового кольца (артикаин).* указывает на иммуногенный фрагмент.
Последнее заблуждение относится к сульфитам. Их включают в растворы местных анестетиков, содержащие вазопрессоры, чтобы предотвратить их окисление. Это неорганические соединения (-SO 3 ), которые участвуют в аллергических реакциях, но они не имеют никакого отношения к иммуногенности, приписываемой соединениям, родственным PABA. Эти агенты также используются в качестве антиоксидантов в свежих фруктах и овощах, чтобы сохранить их цвет и внешний вид. Важно отметить, что пациенты с аллергией на такие продукты могут испытывать перекрестные реакции с растворами местных анестетиков, содержащих вазопрессоры, поскольку они содержат те же самые сульфиты.
Сообщения об аллергических реакциях на местные анестетики появлялись в научной литературе с некоторой частотой. 10 , 11 Однако трудно понять точность или фактическую частоту из-за несоответствия в методах подтверждения, которые включают кожные уколы, внутрикожные инъекции и провокационные лекарственные препараты. Во многих случаях не было подтверждения фактического виновника, консерванта или местного анестетика. Более того, лишь очень немногие из них действительно подтвердили присутствие IgE к лекарственному средству с помощью иммуноблоттинга.Обширный анализ этой литературы недавно был проведен Speca et al. 12
Практически во всех описаниях случаев у пациентов действительно наблюдались признаки и симптомы, соответствующие аллергической реакции. Был ли реальный патогенез действительно иммуноопосредованным (аллергия), вероятно, скорее академический, чем прагматический. Последнее событие в этих реакциях приписывается синтезу и высвобождению медиаторов, вместе называемых аутакоидами, из которых гистамин и лейкотриены являются наиболее важными.Эти аутакоиды не только оказывают прямое воздействие на ткани, но также могут привлекать различные воспалительные клетки, которые способствуют так называемой реакции поздней фазы, которая может не проявляться в течение нескольких дней после провокации. В самом деле, лекарства нередко генерируют эти аутакоиды в результате действий, которые не являются иммуноопосредованными и поэтому неправильно классифицируются как аллергия. Меперидин стимулирует высвобождение гистамина из тучных клеток, а нестероидные противовоспалительные препараты могут способствовать синтезу лейкотриенов.В таких случаях реакция пациента обычно обозначается как псевдоаллергическая, чтобы отличить ее от истинной аллергии, которая является иммунной.
Если пациент описывает реакцию, которая, по крайней мере, клинически соответствует аллергии, стоматолог должен избегать использования вызывающего заболевания агента до тех пор, пока его не осмотрит аллерголог. В случае, если до получения медицинского разрешения требуется анестетик, самым разумным выбором будет либо мепивакаин, либо прилокаин без вазопрессоров. Согласно общепринятому мнению, если местные анестетики действительно вызывают аллергию, эфиры ПАБК будут более вероятными, чем амидные местные анестетики.Кроме того, избегая растворов, содержащих вазопрессоры, можно избежать любых бисульфитов, которые входят в состав антиоксидантов. Возможна чувствительность к различным сульфитам, особенно у пациентов с астмой или атопией. Эти принципы являются основой блок-схемы, представленной в. Пациенту никогда нельзя отказывать в преимуществах местной анестезии на основании ошибочных предположений относительно аллергии.
Ведение пациентов с аллергией на местные анестетики. Исключите распространенные реакции, ошибочно принимаемые за аллергию, например обмороки и тахикардию.Затем установите, что характер их реакции, по крайней мере, напоминал реакцию гиперчувствительности, например сыпь, зуд, крапивницу или одышку. Если препарат известен, выберите другой амид, не содержащий вазопрессоров, чтобы не было сульфитов. В противном случае направьте пациента к аллергологу для тестирования сульфитов и типичных местных анестетиков, таких как лидокаин, мепивакаин и прилокаин. (Адаптировано из deShazo и Kemp. 13 )
Местная токсичность
Ишемический некроз тканей может возникнуть после инъекций местных анестетиков.Это может быть связано с раздражающим действием раствора, давлением больших объемов или сужением сосудистой сети из-за вазопрессоров. Это особенно опасно при инъекции в прикрепленную слизистую оболочку, например твердое небо. Также растет беспокойство по поводу прямой нейротоксичности, связанной с составами, содержащими высокие концентрации, такие как 4% артикаин и прилокаин.
Хаас и Леннон сообщили о повышении частоты парестезий в Канаде после введения артикаина в середине 1980-х годов. 14 Только в 1993 году было зарегистрировано 14 случаев парестезии, и все они были связаны с применением артикаина или прилокаина. Когда артикаин впервые был представлен на одобрение Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США, было установлено, что он имеет более высокий риск парестезии, чем лидокаин.
Совсем недавно Гаристо и др. 15 рассмотрели заявления о парестезии в Соединенных Штатах в период с ноября 1997 года по август 2008 года и обнаружили 248 случаев парестезии после стоматологических процедур.В большинстве случаев (~ 95%) была задействована блокада нижнечелюстного нерва, и в 89% из них был поражен язычный нерв. По сравнению с другими местными анестетиками, парестезия была в 7,3 раза более вероятна при использовании 4% артикаина и в 3,6 раза более вероятна при использовании 4% прилокаина. Подобные результаты из отчетов о парестезии в Дании были опубликованы Hillerup et al. 16 Эти данные могут быть еще более значимыми, если учесть количество случаев, которые вполне могут остаться незарегистрированными.
Хотя стоматологическое сообщество не спешило прийти к консенсусу по этому вопросу, следует понимать, что в литературе по медицинской анестезии категорически утверждается, что более высокая концентрация растворов местных анестетиков увеличивает риск прямой нейротоксичности для нервных стволов: «Все клинически используемые Местные анестетики могут оказывать прямое токсическое воздействие на нервы, если они достигают достаточно высоких интраневральных концентраций.Клиницисты должны знать, что концентрации приготовленных растворов местных анестетиков сами по себе нейротоксичны и что их разведение in situ или в тканях важно для безопасного использования ». 1
Этот факт дополнительно подтверждается Hillerup et al, которые продемонстрировали большую нервную токсичность 4 по сравнению с 2% артикаином в препаратах седалищного нерва. 17 Как и в случае со всеми лекарствами, каждый практикующий врач должен провести анализ соотношения риска и пользы перед применением лекарства. Только в том случае, если польза от использования артикаина превышает риск для этого практикующего врача, его следует рассматривать для использования.Было бы разумно ограничить использование 4% концентраций для инфильтрации и избегать их использования для нервной блокады, отдав предпочтение агентам, сформулированным в более низких концентрациях. 15 , 16
СРАВНЕНИЯ С МЕСТНЫМИ АНЕСТЕТИКАМИ
Лидокаин продолжает оставаться наиболее широко используемым местным анестетиком в Соединенных Штатах, но все эти агенты имеют сопоставимую эффективность. Они различаются по эффективности и нескольким фармакокинетическим параметрам, которые объясняют различия в начале и продолжительности анестезии.При выборе конкретного агента необходимо учитывать продолжительность запланированной процедуры и проблемы, связанные с концентрацией вазопрессоров. Для длительных процедур логичным выбором является бупивакаин, но, согласно исследованиям, в которых сравнивались различные анестетики, он считается одним из наиболее болезненных агентов во время инъекции. 18 — , 20 Одна из стратегий — обеспечить первые 60–90 минут анестезии с использованием менее раздражающего агента (лидокаин или прилокаин), а затем повторно ввести анестезируемую ткань с бупивакаином, чтобы обеспечить хорошее обезболивание в послеоперационном периоде. период.Такая стратегия наиболее эффективна после нервных блокад; следует ожидать более короткую продолжительность пульпарной анестезии после инфильтрации. (См.)
Таблица 2.
Местные анестетики в картриджах 21 , 22
Несмотря на неофициальные заявления о превосходстве артикаина над лидокаином при блокаде нижних альвеол, опубликованные исследования практически не обнаружили разницы. , особенно при наличии симптомов зубов. 22 — , 24 Любое небольшое преимущество артикаина компенсируется его повышенным риском парестезии, о которой говорилось выше.Однако при инфильтрации нижней челюсти артикаин явно превосходит его и не несет риска нервной токсичности, если не вводится рядом с подбородочным нервом. 22 , 25 , 26 Превосходство артикаина можно объяснить его высокой растворимостью в липидах и концентрацией его препаратов. В отличие от других анестетиков, содержащих бензол в качестве ароматического кольца, артикаин имеет тиофеновое кольцо и замены, которые придают большую растворимость липидов, чем другие местные анестетики, за исключением бупивакаина.Это свойство должно было позволить использовать его в более низкой концентрации, но на самом деле он был составлен в виде 4% раствора. Артикаин не только более растворим в липидах, но и содержит большее количество молекул, чем, например, 2% лидокаин в равном объеме. На сегодняшний день не было опубликованных исследований, сравнивающих артикаин с 4% растворами лидокаина при инфильтрации нижней челюсти. Лидокаин в этой концентрации представляет неприемлемый риск системной токсичности, что дает еще одно привлекательное свойство артикаина: характер клиренса.
Хотя артикаин классифицируется как амид, из-за связи его промежуточной цепи тиофеновое кольцо также содержит сложноэфирную боковую цепь. Эта цепь гидролизуется эстеразами плазмы, что делает молекулу неактивной. В результате период полувыведения артикаина составляет всего 20-40 минут по сравнению с> 90 минутами для лидокаина и других амидов, требующих печеночного клиренса. По этой причине артикаин представляет меньший риск системной токсичности при длительных приемах, когда вводятся дополнительные дозы анестетика.Однако следует помнить, что артикаин с концентрацией 4% содержит удвоенную дозу 2% лидокаина на введенный объем, и их максимальные рекомендуемые дозы идентичны.
ВАЗОПРЕССОРЫ
Вазопрессоры — это препараты, которые обеспечивают сужение кровеносных сосудов путем активации альфа-1-адренорецепторов. Их сочетают с местными анестетиками для обеспечения гемостаза в операционном поле и задержки абсорбции анестетика. Задержка всасывания местных анестетиков не только снижает риск системной токсичности, но и увеличивает продолжительность анестезии.Адреналин является наиболее распространенным агентом, используемым для этой цели, несмотря на то, что он проявляет значительную сердечную стимуляцию из-за его дополнительного действия в качестве агониста бета-1-адренорецепторов.
Несмотря на популярность адреналина 1 100 000, его концентрации выше 1 ∶ 200 000 (5 мкг / мл) практически не дают никаких преимуществ. Более высокие концентрации не обеспечивают лучшего начала или продолжительности блокады нижнего альвеолярного нерва. 29 , 30 Более высокие концентрации также не снижают концентрации местного анестетика в сыворотке. 4 , 5 Однако более высокие концентрации, например, 1 ∶ 100 000 (10 мкг / мл) и 1 50 000 (20 мкг / мл), могут обеспечить лучший гемостаз при инфильтрации в операционном поле, когда это влияние желанный.
Влияния на сердечно-сосудистую систему
Чтобы должным образом решить вопросы безопасности, нужно сначала понять принципы расчета дозировки, представленные в этой статье. Продолжаются дискуссии о пагубном влиянии адреналина на пациентов с сердечно-сосудистыми заболеваниями.Часто этот спор продолжается без полного понимания фактического действия и эффектов этого широко используемого препарата. Адреналин действует как агонист рецепторов альфа, бета-1 и бета-2. Эти действия объясняют его влияние на сердечно-сосудистую систему, как показано на рис. Прежде чем анализировать этот показатель, важно прояснить распространенное заблуждение. Стоматолог рассматривает адреналин как сосудосуживающее средство на основании его эффектов при введении в подслизистые ткани. Это потому, что крошечные сосуды в этом месте содержат только альфа-рецепторы.Более крупные системные артерии, которые определяют артериальное сопротивление и диастолическое артериальное давление, содержат гораздо больше бета-2, чем альфа-рецепторов, и после абсорбции низкие дозы адреналина вызывают расширение этих сосудов.
Сердечно-сосудистые эффекты адреналина. 31 Следующий график иллюстрирует типичную сердечно-сосудистую реакцию на адреналин, вводимый в виде непрерывной внутривенной инфузии 10 мкг / мин. (Это количество содержится в 1 мл концентрации 1 100 000.) Адреналин увеличивает частоту сердечных сокращений (ЧСС) за счет активации рецепторов бета-1 в синоатриальном узле, нормальном кардиостимуляторе сердца. Он также активирует рецепторы бета-1 на клетках миокарда, увеличивая их сократимость и повышая систолическое артериальное давление (САД). Однако он активирует бета-2 рецепторы на системных артериях, вызывая расширение сосудов. Это снижение артериального сопротивления вызывает снижение диастолического давления (ДАД). Эти эффекты приводят к небольшому изменению среднего артериального давления (САД).
Клинические испытания однозначно подтвердили, что даже небольшие дозы адреналина в растворах местных анестетиков влияют на сердечно-сосудистую функцию.Dionne et al. 32 изучали влияние 3 картриджей 2% лидокаина с эпинефрином 1 100 000 (~ 60 мкг адреналина). Подслизистая инъекция этой дозировки увеличивала сердечный выброс, частоту сердечных сокращений и ударный объем. Системное артериальное сопротивление было снижено, а среднее артериальное давление практически не изменилось. Аналогичным образом, Hersh et al. 5 наблюдали аналогичные результаты после введения артикаина, содержащего 1 100 000 (∼120 мкг) и 1 ∶ 200 000 (∼60 мкг) адреналина, с большей реакцией на более высокую дозировку.Эти результаты согласуются с общепризнанными влияниями, как показано на рис.
Результаты исследований, подобных только что упомянутым, следует рассматривать в перспективе. Например, влияние ~ 120 мкг адреналина, опубликованное Hersh et al. 5 , было незначительным: увеличение частоты сердечных сокращений на ~ 8-10 ударов в минуту и изменения артериального давления в среднем на ~ 5 мм рт. Тем не менее, 14 участников были в отличном состоянии, их показатели жизненно важных функций в состоянии покоя составляли в среднем 68 для частоты сердечных сокращений, 125 мм рт. Ст. Для систолического давления и 73 мм рт. Ст. Для диастолического давления.Кроме того, они не принимали никаких серьезных лекарств. Очевидно, что такие люди могут легко переносить введенные дозы, но следует отметить, что двое из этих здоровых участников действительно сообщили о сердцебиении.
Даже небольшие дозы адреналина вызывают сердечно-сосудистые эффекты; это однозначно. Вопрос заключается в том, представляют ли сердечно-сосудистые воздействия адреналина значительный риск для пациентов с различной степенью компрометации. Стандарты и руководства продолжают продвигаться, но на самом деле все они анекдотичны.Наивно предлагать ввести ограничение «2 картриджа» для пациентов с сердечно-сосудистыми заболеваниями. В конечном итоге для принятия решения стоматолог должен вынести здравое клиническое суждение, основанное на тщательном анализе каждого рассматриваемого пациента. Если показана консультация с врачом пациента, обсудите ожидаемый диапазон доз в микрограммах, а не в концентрациях или картриджах. Например, если планируется 2–4 картриджа с местным анестетиком, объясните, что вы будете использовать 40–80 мкг адреналина, инфильтрованного под слизистую оболочку, а не 2–4 картриджа с адреналином 1 ∶ 100 000.Врач не знаком с дозировкой, выраженной в картриджах или концентрациях. Для справки рассмотрите стандартную дозу адреналина для лечения аллергической реакции: 0,3 мг или 300 мкг. Врач, как правило, будет интересоваться дозами 100 мкг или больше.
Левонордефрин (Неокобефрин) — вазопрессор в сочетании с 2% препаратами мепивакаина в США. Он больше похож на норадреналин, чем на адреналин, поскольку не обладает активностью в отношении бета-2-рецепторов. По этой причине он повышает не только систолическое артериальное давление, как адреналин, но также диастолическое и среднее артериальное давление.У некоторых пациентов это может вызвать рефлекторное блуждающее влияние на частоту сердечных сокращений, которое может частично компенсировать прямую стимуляцию сердечного ритма рецепторами бета-1. Однако исследования, оценивающие влияние сердечно-сосудистой системы после внутрикостных инъекций, обнаружили небольшую разницу между адреналином и левонордефрином. 33 , 34 Это, вероятно, объясняется быстрым всасыванием, которое позволяет проводить прямую стимуляцию бета-1 до того, как вмешаются рефлекторные реакции на среднее артериальное давление.Сравнение адреналина и левонордефрина представлено в.
Таблица 3.
Действия адреналина по сравнению с левонордефрином
Максимально допустимые дозы вазопрессоров не установлены. Выражать ограничения в виде назначений нецелесообразно; Время лечения может составлять от 30 минут до 3-4 часов. Кроме того, влияние данной дозы вазопрессора на пациентов сильно различается. Пиковое влияние адреналина обычно наблюдается в течение 5–10 минут после инъекции 5 и быстро снижается; Адреналин и левонордефрин являются катехоламинами и быстро метаболизируются катехол-о-метилтрансферазой.Фактически, период полувыведения большинства катехоламинов составляет всего 1-3 минуты. Как правило, гемодинамические влияния наблюдаются в течение нескольких минут после инъекции и полностью исчезают через 10-15 минут. Доза адреналина 40 мкг (приблизительно 2 картриджа с содержанием адреналина 1 100 000) является наиболее консервативным и часто упоминаемым ограничением дозы для пациентов с серьезными сердечно-сосудистыми заболеваниями. Следует уточнить, что это руководство более точно отражает 30-минутные периоды времени, а не встречи.Более рациональное предложение — основывать дозировку на оценке пациента, а не на максимальных количествах. Например, если по какой-либо причине медицинский статус пациента ставится под сомнение, разумный протокол состоит в том, чтобы записывать исходную частоту сердечных сокращений и артериальное давление до операции и снова после каждого введения 20-40 мкг. Это соответствует 1-2 картриджам с концентрацией адреналина 1 ∶ 100 000. Практически любой пациент может выдержать такое количество сердечно-сосудистых воздействий. Если состояние пациента остается стабильным, могут быть введены дополнительные дозы, после чего следует аналогичная схема повторной оценки показателей жизнедеятельности.
Лекарственные взаимодействия
Возможные лекарственные взаимодействия были подробно рассмотрены в предыдущей статье для повышения квалификации в этом журнале. 35 Наиболее важные из них относятся к возможной усиленной стимуляции сердечно-сосудистой системы. Вазопрессоры, обнаруженные в формах местного анестетика, обладают кардиотоническим действием, и это может стать более значительным, когда пациенты получают лечение любым лекарственным средством, оказывающим подобное влияние. К ним относятся трициклические антидепрессанты и ингибиторы моноаминоксидазы, дигоксин, гормон щитовидной железы или любые симпатомиметики, используемые для контроля веса или нарушений внимания.Вазопрессоры не противопоказаны этим пациентам, но их следует назначать с осторожностью, как описано выше для пациентов с ограниченными возможностями здоровья. Пациентам, у которых есть подозрение на злоупотребление стимуляторами, например кокаином, может быть разумным вообще избегать вазопрессоров.
Осторожное использование вазопрессоров также рекомендуется пациентам, принимающим неселективные бета-блокаторы. В отличие от селективных агентов, которые блокируют только рецепторы бета-1 в сердце, неселективные агенты также блокируют сосудистые рецепторы бета-2.В этом случае альфа-агонистическое действие вазопрессоров становится более выраженным, и как диастолическое, так и среднее артериальное давление могут стать опасно повышенными. Обычно это сопровождается внезапным рефлекторным замедлением сердечного ритма. Существенные последствия этого взаимодействия хорошо задокументированы. 36 — , 38 Взаимодействие с бета-блокаторами происходит во времени, идентичном наблюдаемому для нормальных сердечно-сосудистых реакций на адреналин. Он начинается после абсорбции из места инъекции, которая обычно достигает пика в течение 5 минут и снижается в течение последующих 10–15 минут.Вазопрессоры не противопоказаны пациентам, принимающим неселективные бета-блокаторы, но дозы должны быть консервативными, а артериальное давление периодически контролировать во время приема, как описано выше. Следует избегать использования ретракционных шнуров, пропитанных рацемическим адреналином. Эти продукты содержат адреналин в количествах, намного превышающих те, которые содержатся в составах местных анестетиков.
Местная анестезия | DermNet NZ
Авторы: Филиппа Дикисон, кандидат наук, Северная клиническая школа, Сиднейский университет, Сидней, Новый Южный Уэльс, Австралия; и Саксон Д. Смит, клинический доцент отделения дерматологии Королевской больницы Северного побережья, Сидней, Новый Южный Уэльс, Австралия.Главный редактор DermNet NZ: адъюнкт A / профессор Аманда Окли, дерматолог, Гамильтон, Новая Зеландия. Копия отредактирована Марией МакГиверн / Гасом Митчеллом. Июль 2018.
Что такое местные анестетики?
«Местная анестезия» означает обратимую потерю чувствительности в определенной области тела. Эта потеря чувствительности достигается путем местного применения или инъекции агентов, которые блокируют натриевые каналы, которые облегчают нервные импульсы в ткани.
- Использование «регионарной анестезии» или «нервной блокады» относится к случаям, когда местные анестетики вводятся рядом с более крупными нервами, что приводит к анестезии больших участков, снабжаемых этим нервом.
- «Тумесцентная анестезия» проводится путем инъекции большого количества жидкости, содержащей разбавленный местный анестетик и адреналин (адреналин). Он используется для липосакции и других пластических, косметических и дерматологических хирургических процедур, затрагивающих большие участки кожи.
Местная анестезия используется во многих дерматологических процедурах, хирургических операциях и стоматологических процедурах. Цель состоит в том, чтобы свести к минимуму боль, чтобы процедуры можно было проводить с максимальной эффективностью и комфортом.
Местные анестетики
Какие существуют виды местных анестетиков?
Местные анестетики делятся на два разных класса в зависимости от их структуры: анестетики на основе парааминобензойной кислоты (ПАБК), известные как сложные эфиры, и анестетики, не содержащие ПАБК, называются амидными местными анестетиками [1].
Сложные местные анестетики включают:
- бензокаин
- Хлоропрокаин
- Кокаин
- прокаин
- Пропаракаин
- Тетракаин
- Эмилокаин
- Оксибупрокаин.
Амидные местные анестетики включают:
- Артикаин
- Бупивакаин
- Дибукаин
- Этидокаин
- Левобупивакаин
- Лидокаин (также известный как лигнокаин)
- Мепивакаин
- Прилокаин
- Ропивакаин
- Самеридин
- Тоникаин
- Цинчокаин.
Лигнокаин (лидокаин)
Местные анестетики на основе сложного эфира и амида доступны в различных формах, включая мази, пластыри и инъекции.
Лигнокаин (лидокаин) является наиболее часто используемым анестетиком в хирургических условиях. Он эффективен, действует быстро и относительно не токсичен и не чувствителен. Он доступен во многих различных формах, включая местные аппликации (например, крем EMLA® и пластыри) и растворы для инъекций. Его часто комбинируют с адреналином (адреналином) для увеличения продолжительности анестезии, уменьшения связанного кровотечения и увеличения интенсивности нервной блокады за счет снижения системной абсорбции.
Какая максимальная доза лигнокаина?
Максимальная доза лигнокаина варьируется в зависимости от площади и кровоснабжения анестезируемой кожи, а также состояния пациента. Если используются лигнокаин и адреналин, можно использовать более высокую дозу.
При кожной инфильтрации максимальная доза без адреналина составляет 3 мг / кг [2].
Каковы побочные эффекты или осложнения при использовании местного анестетика?
Местные анестетики хорошо переносятся и при правильном применении имеют минимальные побочные эффекты.Местные побочные эффекты включают временное покалывание, жжение и синяки после инъекции.
Более серьезные побочные эффекты связаны с инфузией или инъекцией высоких доз местных анестетиков. Риск системной токсичности местных анестетиков варьирует и зависит от таких факторов пациента, как возраст, дисфункция органов-мишеней и область анестезии [3]. В большинстве случаев системная токсичность местных анестетиков возникает после случайной внутривенной инъекции.
Симптомы и признаки системной токсичности местных анестетиков подразделяются на центральную нервную систему (ЦНС) и сердечную токсичность [3].Первоначальные симптомы со стороны ЦНС являются результатом возбуждения и могут включать:
- Звон в ушах
- Онемение периоральной полости
- Металлический вкус
- Изменение психического статуса
- Подергивание мышц
- изъятий.
В конце концов, по мере того, как токсичность прогрессирует, происходит угнетение ЦНС.
Признаки сердечной деятельности могут возникать независимо от признаков ЦНС или в дополнение к ним. Сердечные признаки могут включать:
- Тахикардию
- Гипертония
- Брадикардия
- Гипотония.
По мере того, как токсичность становится более серьезной, сердечные симптомы могут прогрессировать до аритмий (сердцебиения) и асистолии (остановки сердца).
Возможна ли аллергия на местные анестетики?
Местные анестетики на основе сложного эфира являются известными сенсибилизаторами и поэтому вызывают аллергические реакции [1,4]. Перекрестная реактивность местных анестетиков на основе сложных эфиров также является обычным явлением (см. Нашу страницу «Аллергия на бензокаин»). Гиперчувствительность к амидным местным анестетикам встречается гораздо реже, а перекрестная реактивность непредсказуема.
Повышенная чувствительность к местным анестетикам почти всегда является реакцией гиперчувствительности замедленного типа (см. Нашу страницу «Объяснение аллергии»). Это требует предварительной сенсибилизации. При повторном контакте с аллергеном у пациентов разовьется локальная эритема и отек в области, подвергшейся воздействию местного анестетика.
Повышенная чувствительность к местным анестетикам, вводимым в слизистую оболочку рта, может проявляться диффузным отеком лица, который может проявляться как крапивница. Реакции гиперчувствительности, опосредованные иммуноглобулином Е (например, анафилаксия), очень редки.
Как диагностируется аллергия на местные анестетики?
Диагностика аллергии на местные анестетики затруднена, поскольку встречается редко. Также может произойти реакция на консерванты в растворе [4,5]. Патч-тестирование может использоваться для выявления причины гиперчувствительности замедленного типа, а также наличия перекрестной реактивности [4].
Как лечится аллергия на местные анестетики?
Лучшее лечение аллергии на местные анестетики — это избегать выявленного аллергена пациентом и его врачами (а также любых аллергенов, демонстрирующих перекрестную реактивность).
Местные анестетики — передовые методы и местная анестезия | Модуль 1: Расширенный контроль боли и седация
.Расширенные методы и местная анестезия
Местные анестетики
Местные анестетики действуют, изменяя потенциал покоя нерва, изменяя пороговый потенциал, при котором нерв срабатывает, уменьшая скорость деполяризации и продлевая фазу реполяризации. Местные анестетики связываются с рецепторами натриевого канала, вытесняя кальций.Блокируя натриевые каналы, они уменьшают натриевую проводимость, тем самым снижая скорость деполяризации. Если натрий не может течь, нерв не сработает, и пороговый потенциал не будет достигнут, что приведет к блокированию проводимости.
См. Механизм действия в «Обзоре местных анестетиков».
Существует два разных типа местных анестетиков, определяемых химическими связями между группами.
Лекарства со сложноэфирными связями включают такие препараты, как прокаин, хлоропрокаин и тетракаин.Они легко гидролизуются псевдохолинэстеразой, и пациенты могут проявлять аллергию на сложные эфиры, но на самом деле аллергия на ПАБК, который является метаболитом сложного эфира. Те с амидными связями, которые более популярны и широко используются из-за проблем с аллергией, включают прилокаин, артикаин, мепивикаин, лидокаин, бупивакаин, этидокаин.
Совет
Легкий способ запомнить, какие местные анестетики являются амидами, — это помнить, что все амидные агенты имеют в своем названии «Я», помимо «Я» в окончании «каин».
Местные анестетики, как правило, представляют собой основные соединения с pKa от 7,6 до 8,9 и плохо растворяются в воде. (См. «Клиническая фармакология» в обзоре местных анестетиков *). Они объединяются с кислотами с образованием солей и распределяются в виде соли соляной кислоты, растворенной либо в физиологическом растворе, либо в воде; поэтому внеклеточный pH имеет решающее значение для действия местного анестетика.
Как и все агенты, местные анестетики могут диссоциировать на основание и кислоту, и по мере падения pH будет существовать больше анестетика в катионной форме.Катионная форма не является гидрофобной и поэтому не будет легко диффундировать через клеточную мембрану; это составляет химическое обоснование того, почему инъекции в инфицированную область не обеспечивают превосходного уровня местной анестезии. Действие на нервную мембрану, конечно, зависит от pKa и pH внеклеточной жидкости, и внутриклеточная жидкость при инфекции стабильна. Внеклеточный pH, скорее, нестабилен в зоне инфекции. Изменяется внеклеточный pH.
Клинические предостережения:
- Амиды метаболизируются в печени. Пациенты со значительным заболеванием печени или застойной сердечной недостаточностью с плохим кровотоком в печени будут иметь проблемы с метаболизмом амидов и других агентов.
- У пациентов, которым вводили прилокаин, возможно развитие метгемоглобинемии.
- Лидокаин используется в качестве лекарственного средства ACLS для пациентов с желудочковой дизритмией. Однако высокий уровень лидокаина снижает сократительную способность и сердечный выброс, а также может привести к коллапсу кровообращения.Системное воздействие на центральную нервную систему включает угнетение ЦНС, судороги и обезболивание.
- Кроме того, один из метаболитов лидокаина может вызывать некоторое седативное действие. Эти метаболиты выводятся через почки.
Вазоконстрикторы в местных анестетиках
Многие из этих агентов содержат вазоконстрикторы, которые компенсируют сосудорасширяющие свойства, присущие местному анестетику.Имейте в виду, что вазоконстрикторы имеют три разных типа адронергических рецепторов:
Адреналин, вазоконстриктор в местных анестетиках, действует на рецепторы a½, 1 и 2, вызывая сужение сосудов, сердечную стимуляцию и расширение бронхов. Обычно адреналин 1/1000 используется в экстренной ситуации либо внутримышечно, либо подкожно.
Дозы могут варьироваться в зависимости от пациента:
- ASA I или II: 0.2 мг на прием
- ASA III или IV: 04 мг на прием
Например, пациенту с астмой, у которого нет небулайзера с альбутуролом, в экстренной ситуации можно ввести 0,3 или 0,4 СС адреналина 1/1000 подкожно в качестве бронхорасширяющего средства. При остановке сердца обычно используется разведение 1/10 000.
Вазоконстрикторы следует применять с осторожностью или вообще не применять пациентам с неконтролируемой артериальной гипертензией, пациентам, недавно перенесшим M.I. или инсульт, или пациенты, недавно перенесшие коронарное шунтирование. Пациенты с дизритмией или нестабильной стенокардией также не подходят для приема сосудосуживающих средств. В операционной пациентам, которым вводят галогенированный ингаляционный агент, такой как галотан, не следует вводить экзогенный адреналин локально, поскольку он может предрасполагать пациента к желудочковой дисритмии. Пациенты, принимающие неспецифические бета-адреноблокаторы, ингибиторы МАО, трициклические антидепрессанты, также не должны получать вазоконстрикторы с местными анестетиками.Другим сосудосуживающим средством, которое используется помимо адреналина, является левонордефрин или неокобефрин. Его эффективность как вазопрессора составляет 15% от эффективности адреналина.
Общие местные анестетики
Лидокаин имеет период полураспада анестетика около 1,6 часа. К его преимуществам можно отнести очень быстрое начало.
- рКа = 7,9
- Максимальная рекомендуемая доза: 4,4 мг / кг; 300 мг за визит.
Мепивикаин выпускается в виде 3% карбокаина.Он также имеет очень быстрое начало и рекомендованная дозировка аналогична лидокаину; однако карбаин не содержит сосудосуживающих средств.
Прилокаин обычно доступен в виде 4% и может содержать или не содержать 1/200 000 адреналина. Прилокаин может вызывать метебоглобинемию, особенно у предрасположенных пациентов при приеме высоких доз. Также считается, что он менее токсичен, чем лидокаин, и подходит для длительной анестезии.
Артикаин следует применять с осторожностью у пациентов с метгемоглобинемией.Пациентам, страдающим аллергией на препараты серы, нельзя принимать артикаин, и он также противопоказан пациентам с ASA III и IV.
Бупивикаин или маркаин — это средство длительного действия. Максимальная рекомендуемая доза составляет 1,3 мг / кг, а начало действия — 6-10 минут, что дольше, чем у лидокаина.
Этидокаин — еще один местный препарат длительного действия, действие которого начинается через 3 минуты.

 Фармакологические свойства мепивакаина сходны с лидокаином, но менее выражена токсичность.
Фармакологические свойства мепивакаина сходны с лидокаином, но менее выражена токсичность. Большинство инъекций осуществляются посредством специального карпульного шприца.
Большинство инъекций осуществляются посредством специального карпульного шприца. Обезболивание при оказании стоматологической помощи пациентам детского возраста, безусловно, играет одну из важнейших ролей, однако представляет большую сложность для врача.
Обезболивание при оказании стоматологической помощи пациентам детского возраста, безусловно, играет одну из важнейших ролей, однако представляет большую сложность для врача.