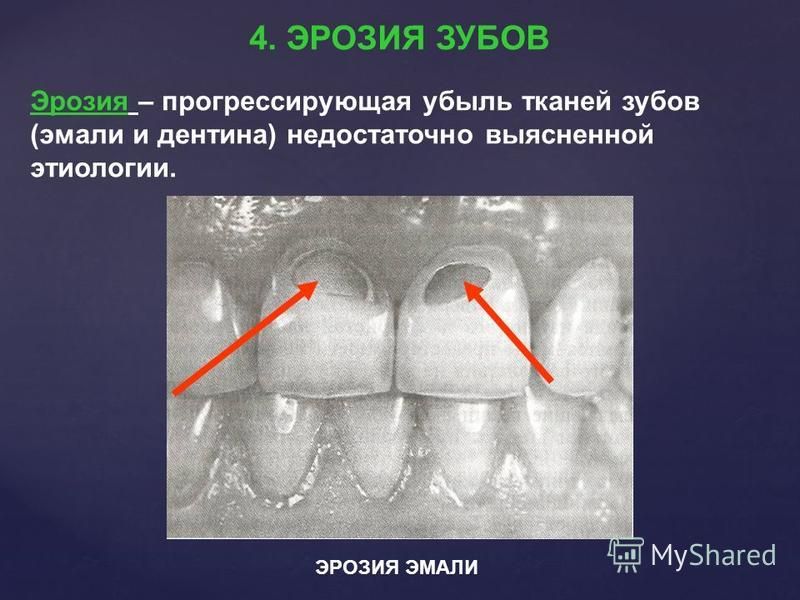
37.Клиновидный дефект
Клиновидный дефект — некариозное поражение, возникающее на твёрдых тканях зубов, характеризующееся образованием в области шейки зуба дефекта клиновидной формы. Такая патология чаще появляется у фронтальной группы зубов с вестибулярной стороны, премоляры также подвержены возникновению патологии. Внешне поражение проявляется как «ступенька» в виде клина (отсюда — «клиновидный дефект»), образуется она в пришеечной области. Выражаются подобные дефекты от небольшого дефекта эмали до откола всей коронковой части. Поражение зубов клиновидным дефектом чаще происходит у людей среднего и пожилого возраста.
Считается,
что причина развития клиновидного
дефекта заключается в механическом
воздействии зубной щеткой на поверхность
зуба. Установлено, что у правшей
клиновидные дефекты выражены сильнее
слева, т. е. там, где прикладываются
более значительные усилия при чистке.
Влияние могут оказать и чрезмерные
нагрузки, вызывающие в области шеек
деформацию эмалевых призм в виде изгиба
или растяжения.
Клиническая картина.
Стенки дефекта гладкие, блестящие, нередко сквозь ткани зуба просвечивает пульпа, однако она никогда не вскрывается. Зондирование, как правило, безболезненное. В большинстве случаев клиновидный дефект не сопровождается болевыми ощущениями, так как процесс прогрессирует очень медленно и сопровождается отложением заместительного дентина. Боли от температурных и химических раздражителей появляются в тех случаях, когда поражение развивается быстро или достигает значительной глубины. При глубоких клиновидных дефектах возникает риск отлома коронки зуба. Чаще всего пациенты жалуются на эстетический дефект, если клиновидные дефекты заметны при улыбке. Клиновидные дефекты нередко сочетаются с рецессией десны
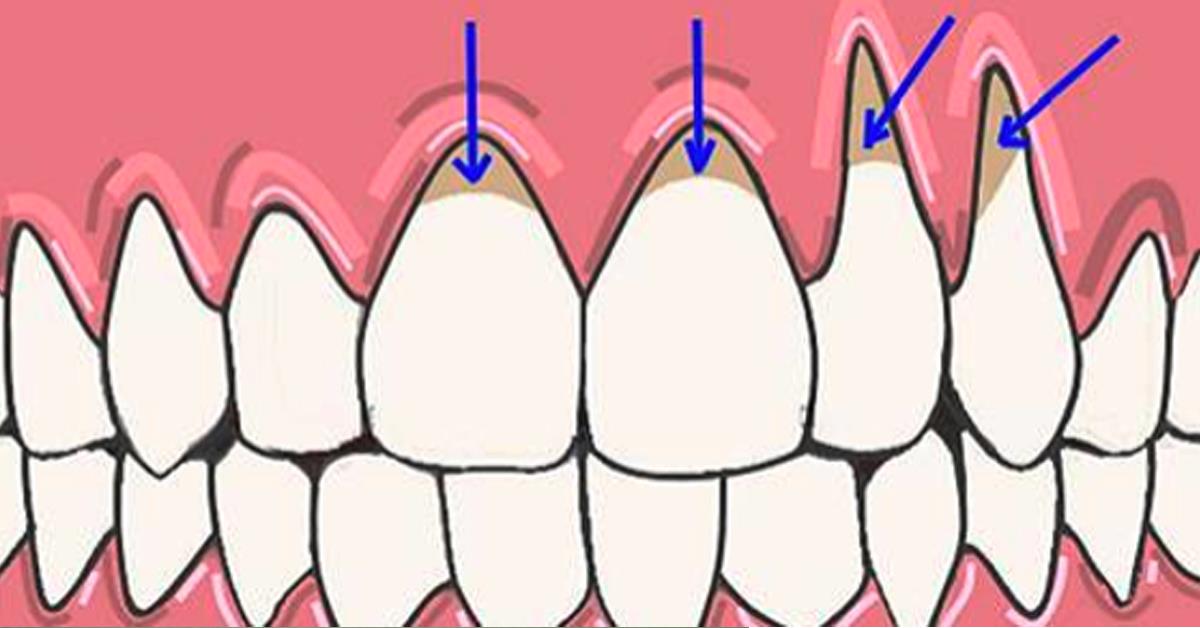
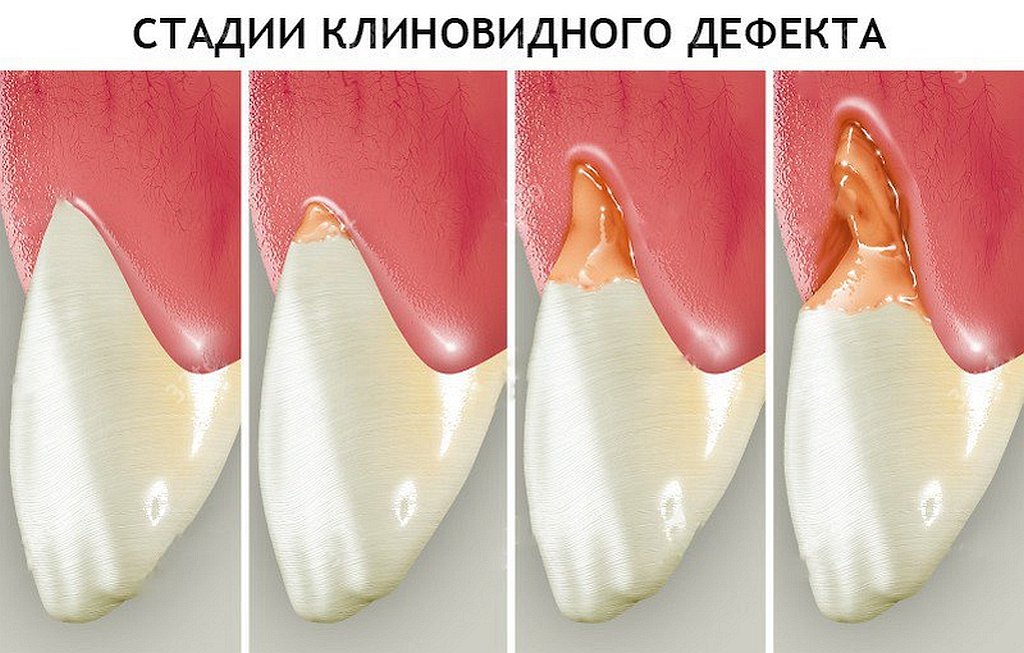
В своем развитии клиновидный дефект проходит 4 стадии:
I
стадия (начальных
изменений) – клиновидный дефект еще
не виден простым глазом, его можно
различить только под увеличительным
прибором.
II стадия (поверхностного поражения) – клиновидный дефект определяется визуально в виде поверхностной ссадины или трещины глубиной до 0,2 мм и длиной 3-3,5 мм. Отмечается гиперестезия пораженных зубов.
III стадия (средне выраженных изменений) — клиновидный дефект глубиной 0,2-0,3 мм, длиной до 3,5-4 мм; дефект образован двумя плоскостями, сходящимися под углом 45º.
IV стадия (глубокого распространения) – длина клиновидного дефекта превышает 5 мм. Убыль ткани нередко захватывает глубокие слои дентина; в тяжелых случаях может достигать пульпарной камеры.
Первые две стадии клиновидного дефекта наблюдаются у молодых людей (до 30-35 лет), последние — у людей зрелого возраста (после 40 лет).
Дифференцируют клиновидный дефект от заболеваний некариозного происхождения: эрозии твердых тканей зубов, пришеечного некроза эмали, кариеса зубов (поверхностного и даже среднего).
При
дифференциации от кариеса необходимо
учитывать типичную локализацию
клиновидного дефекта на обнаженных
шейках зубов и более разнообразную
локализацию кариозных очагов. Характерна
также форма клина при выраженном
истирании твердых тканей. Начальные
проявления этих двух заболеваний весьма
сходны и выражаются в шероховатости и
незначительной убыли тканей зуба. Тем
не менее при клиновидном дефекте
шероховатость постепенно сглаживается,
а стенки и дно уплотняются, при
поверхностном кариесе углубление очага
деминерализации сопровождается
образованием размягченной ткани с
неровными, как бы подрытыми краями
эмали. При поверхностном кариесе более
характерна боль от химических факторов,
а при клиновидном дефекте — от всех
видов раздражителей.
Характерна
также форма клина при выраженном
истирании твердых тканей. Начальные
проявления этих двух заболеваний весьма
сходны и выражаются в шероховатости и
незначительной убыли тканей зуба. Тем
не менее при клиновидном дефекте
шероховатость постепенно сглаживается,
а стенки и дно уплотняются, при
поверхностном кариесе углубление очага
деминерализации сопровождается
образованием размягченной ткани с
неровными, как бы подрытыми краями
эмали. При поверхностном кариесе более
характерна боль от химических факторов,
а при клиновидном дефекте — от всех
видов раздражителей.
Более сложна дифференциальная диагностика клиновидного дефекта и эрозии твердых тканей зуба. И при одном, и при другом заболевании убыль зубных тканей не сопровождается размягчением дна и стенок элемента поражения. Оба заболевания нередко сопровождаются гиперестезией твердых тканей.
Различием
для указанных заболеваний является
локализация очага поражения и его
внешний вид. Клиновидный дефект никогда
не распространяется по всей вестибулярной
поверхности коронки зуба, как это иногда
наблюдается при эрозиях. Форма дефекта
при типичной эрозии блюдцеобразная,
при клиновидном дефекте истирание
твердых тканей имеет V-образную форму.
Резцы нижней челюсти эрозиями не
поражаются, а истирание при клиновидных
дефектах отмечается именно на этих
зубах.
Форма дефекта
при типичной эрозии блюдцеобразная,
при клиновидном дефекте истирание
твердых тканей имеет V-образную форму.
Резцы нижней челюсти эрозиями не
поражаются, а истирание при клиновидных
дефектах отмечается именно на этих
зубах.
Лечение в начальных стадиях клиновидного дефекта заключается в устранении травмирующих факторов (исключение щетки с жесткой щетиной и абразивных зубных порошков и паст, отказ от горизонтальных движений при чистке зубов). Назначают препараты, укрепляющие твердые ткани зубов и повышающие их резистентность — аппликации 10 % раствора глюконата кальция, 2 % фторида натрия («SodiumFluorideSolution» — «PD»), При наличии выраженных дефектов их пломбируют после обязательного препарирования как полости V класса. При глубоких клиновидных дефектах, когда существует риск отлома коронки зуба, рекомендуют протезирование.
Лечение клиновидных дефектов в Уфе – цена от стоматологии «Dental Hall»
Клиновидный дефект — заболевание, у которого до сих пор не установлена этиология, поэтому сказать, что могло послужить причиной к его появлению крайне трудно. Проявляется оно по большей части бессимптомно и, как правило, у категории людей, находящихся в преклонном возрасте.
Проявляется оно по большей части бессимптомно и, как правило, у категории людей, находящихся в преклонном возрасте.
Клиновидный дефект получил такое название, благодаря своему внешнему виду. Его образование происходит в пришеечной части зуба в виде клина. Иногда может проявить себя при помощи гиперестезии (повышенной чувствительности к внешним раздражителям). По мере убывания дентина в области поражения зуб становится более подверженным к образованию кариеса, а также при физическом воздействии способен в этом месте обломаться.
Преимущества Dental Hall
Итальянское оборудование
Комплексная диагностика
Финансовая доступность
Гарантированное обезболивание
Стерильность помещения и воздуха
План лечения
Лечение клиновидных дефектов
Различают 4 стадии клиновидного дефекта:
- Начальная (пораженная область становится матовой, изменение заметно только при использовании дентального микроскопа)
- Поверхностная (на месте поражения появляется небольшая трещина глубиной до 0,2 мм, отмечается гиперестезия)
- Прогрессирующая (дефект обретает более отчётливую форму и в длину составляет не более 4 мм)
- Глубокая (пораженная эмаль начинает менять оттенок, воздействию заболевания подвержены уже более глубокие слои твёрдой ткани, дефект увеличивается в размере на 1-2 мм)
Именно на глубокой стадии при давлении на поражённый зуб, есть риск его облома в области дефекта. На любой из стадий зуб поддается восстановлению.
На любой из стадий зуб поддается восстановлению.
- На начальной стадии развития заболевания стоматологи в качестве лечения прописывают пациенту курс фторирования и реминерализации. При комплексном воздействии фтора и минералов эмаль в области поражения обретает защитный слой, предотвращающий дальнейшее течение заболевания и обеспечивающий защиту зуба от внешних воздействий.
- При поверхностном и прогрессирующем поражении самым распространённым решением является пломбирование. При этом данный дефект эффективно исправляется при помощи специального материала и техники пломбирования.
- При глубоком поражении восстановление зуба при помощи пломбирования крайне затруднительно, потому что, как правило, на этой стадии чаще всего эмаль уже поражена кариесом и дальнейшее его вычищение чревато поломкой зуба. Поэтому в таких случаях на выбор предлагается 2 варианта: либо установка коронки, либо — винира. В первом случае, если зуб восстановлению не подлежит, во втором — если не произошло заражения кариесом.
 Тогда зуб предварительно обтачивается, обрабатывается и после уже устанавливается винир.
Тогда зуб предварительно обтачивается, обрабатывается и после уже устанавливается винир. - Также, если дефект образовался из-за каких-либо ортодонтических нарушений, то в качестве лечения прописываются брекеты, либо другие ортодонтические конструкции.
- Возможно проведение лечения лазером.
Стоит отметить, что только исходя из вашего анамнеза, стоматолог сможет подобрать для вас верное лечение. В любом случае предварительно необходима консультация специалиста.
Стратегии лечения утечек спинномозговой жидкости из бокового кармана клиновидной пазухи | Врожденные дефекты | JAMA Отоларингология – Хирургия головы и шеи
Абстрактный
Цель Осветить концепции, имеющие решающее значение для успешного восстановления и предотвращения внутричерепных осложнений при лечении истечения спинномозговой жидкости (ЦСЖ) из латерального кармана клиновидной пазухи (ЛРС).
Дизайн Исследование результатов.
Установка Третичная специализированная университетская больница.
Пациенты
Одиннадцать пациентов с ЛРС Утечки СМЖ с июня 2008 г. по июнь 2010 г.Вмешательства Эндоскопический трансптеригоидный доступ и многослойная пластика дефекта основания черепа в ЛРП.
Показатели основных результатов Рецидив, методы трансплантации, послеоперационное внутричерепное давление (ВЧД) и использование вентрикулоперитонеального (ВП) шунта.
Результаты Тринадцать утечек спинномозговой жидкости из LRS были хирургически устранены у 11 пациентов; У 2 пациентов потребовалось устранение двусторонней несостоятельности. Эндоскопический трансптеригоидный доступ использовался в 12 из 13 операций. У восьми пациентов были неудачные попытки реконструкции до обращения (4 эндоскопических сфеноидотомии и 4 доступа к средней черепной ямке [MCF]). У одного пациента развился абсцесс височной доли после «облитерации» гидроксиапатитом для герметизации LRS. Это потребовало комбинированного MCF/трансптеригоидного доступа для дренирования абсцесса, удаления энцефалоцеле и гидроксиапатита и герметизации дефекта основания черепа. В 2 случаях LRS был оставлен открытым из-за проблем с неадекватной экстирпацией слизистой оболочки. Медиана продолжительности наблюдения составила 10,8 месяца (диапазон от 2 до 29 месяцев).месяцы). У одного пациента произошел сбой (через 2 месяца после ремонта), который был успешно запломбирован со второй попытки. В послеоперационном периоде 5 пациентам потребовалось венозное шунтирование, а 5 пациентов получали ацетазоламид из-за повышенного ВЧД (в среднем 26,7 см H
У одного пациента развился абсцесс височной доли после «облитерации» гидроксиапатитом для герметизации LRS. Это потребовало комбинированного MCF/трансптеригоидного доступа для дренирования абсцесса, удаления энцефалоцеле и гидроксиапатита и герметизации дефекта основания черепа. В 2 случаях LRS был оставлен открытым из-за проблем с неадекватной экстирпацией слизистой оболочки. Медиана продолжительности наблюдения составила 10,8 месяца (диапазон от 2 до 29 месяцев).месяцы). У одного пациента произошел сбой (через 2 месяца после ремонта), который был успешно запломбирован со второй попытки. В послеоперационном периоде 5 пациентам потребовалось венозное шунтирование, а 5 пациентов получали ацетазоламид из-за повышенного ВЧД (в среднем 26,7 см H
Выводы Настоящее исследование продемонстрировало 92% успешность эндоскопического трансптеригоидного доступа при дефектах основания черепа при LRS, что подтверждает рутинное использование в алгоритме лечения. Плохие исходы наблюдались при предыдущих хирургических попытках обструкции LRS без восстановления дефекта основания черепа.
Плохие исходы наблюдались при предыдущих хирургических попытках обструкции LRS без восстановления дефекта основания черепа.
Стратегии лечения утечек спинномозговой жидкости (ЦСЖ) резко изменились за последние 20 лет. В то время как открытые краниотомии при ликвореи и связанных с ней энцефалоцеле когда-то были стандартными процедурами при дефектах основания черепа, трансназальные эндоскопические методы стали золотым стандартом для устранения ликвореи с частотой успеха более 90% в большинстве серий. 1 Истечение спинномозговой жидкости и энцефалоцеле обычно подразделяют на 4 общие классификации, основанные на этиологии: врожденные, опухолевые, травматические (включая ятрогенные) или идиопатические. 2 -5 Идиопатическая, также называемая «спонтанной» этиологией, в значительной степени связана с наличием повышенного внутричерепного давления (ВЧД) и часто рассматривается как вариант доброкачественной (также называемой идиопатической) внутричерепной гипертензии. . 2 Наличие дефекта основания черепа может увеличить риск развития пневмоцефалии, менингита и абсцесса головного мозга. 6 За исключением некоторых утечек спинномозговой жидкости в результате тупой травмы, обычно требуется хирургическое вмешательство, и выявление дефекта имеет решающее значение для успеха восстановления, особенно в частом контексте повышенного внутричерепного давления. 1 ,7 Расположение дефекта основания черепа диктует эндоскопический доступ и методы хирургического лечения. При наличии в клиновидной пазухе вблизи средней линии для закрытия обычно достаточно стандартных транссептальных или трансназальных эндоскопических методов. 8 Однако, когда имеется широко пневматизированная клиновидная пазуха, простирающаяся в латеральный карман клиновидной пазухи (LRS), этих доступов часто недостаточно для удовлетворительной пластики. Рисунок 1 демонстрирует наш алгоритм лечения для устранения утечек LRS CSF. В целом, LRS является редким местом, где возникает утечка спинномозговой жидкости, но наши предыдущие исследования показали, что это место является одной из наиболее распространенных областей (35%) для утечки спинномозговой жидкости спонтанной этиологии (повышенное внутричерепное давление).
. 2 Наличие дефекта основания черепа может увеличить риск развития пневмоцефалии, менингита и абсцесса головного мозга. 6 За исключением некоторых утечек спинномозговой жидкости в результате тупой травмы, обычно требуется хирургическое вмешательство, и выявление дефекта имеет решающее значение для успеха восстановления, особенно в частом контексте повышенного внутричерепного давления. 1 ,7 Расположение дефекта основания черепа диктует эндоскопический доступ и методы хирургического лечения. При наличии в клиновидной пазухе вблизи средней линии для закрытия обычно достаточно стандартных транссептальных или трансназальных эндоскопических методов. 8 Однако, когда имеется широко пневматизированная клиновидная пазуха, простирающаяся в латеральный карман клиновидной пазухи (LRS), этих доступов часто недостаточно для удовлетворительной пластики. Рисунок 1 демонстрирует наш алгоритм лечения для устранения утечек LRS CSF. В целом, LRS является редким местом, где возникает утечка спинномозговой жидкости, но наши предыдущие исследования показали, что это место является одной из наиболее распространенных областей (35%) для утечки спинномозговой жидкости спонтанной этиологии (повышенное внутричерепное давление). 2
2
В связи с латеральным расположением ЛРС позади крылонебной ямки, близостью критических структур, таких как зрительный нерв и сонная артерия, и сложностью трансназального эндоскопического доступа к этой области некоторые авторы рекомендуют облитерацию клиновидной кости sinus без непосредственного устранения дефекта основания черепа. 6 Однако эндоскопический трансптеригоидный доступ (TPTG) к LRS позволяет напрямую выявить дефект путем полного или частичного удаления крыловидного отростка (рис. 2). 9 ,10 Здесь мы выделяем соответствующие стратегии лечения с помощью различных представлений пациентов и сосредотачиваемся на концепциях, имеющих решающее значение для успешного восстановления дефектов основания черепа в этой области.
Методы
Университет Алабамы в Бирмингеме До начала этого исследования было получено одобрение институционального наблюдательного совета. Проведена проспективная оценка пациентов, перенесших хирургическую коррекцию ликвореи ЛСР старшими авторами (К. О.Р. и Б.А.В.) с июня 2008 г. по июнь 2010 г. Были рассмотрены демографические параметры пациентов и индекс массы тела (ИМТ), рассчитанный как вес в килограммах, деленный на рост в метрах в квадрате. Другие клинические параметры включали наличие симптомов, сопутствующие внутричерепные осложнения, историю предыдущих попыток восстановления (доступ, техника и осложнения), диагностическую рентгенографию, хирургические доступы, расположение дефекта(ов) основания черепа, патологический процесс, синхронные дефекты основания черепа, тип трансплантата. (s) и люмбальные дренажи. Послеоперационные переменные включали ВЧД, использование ацетазоламида или вентрикулоперитонеального (ВП) шунта для снижения давления, продолжительность наблюдения, сопутствующие осложнения и/или рецидивы, а также проходимость LRS.
О.Р. и Б.А.В.) с июня 2008 г. по июнь 2010 г. Были рассмотрены демографические параметры пациентов и индекс массы тела (ИМТ), рассчитанный как вес в килограммах, деленный на рост в метрах в квадрате. Другие клинические параметры включали наличие симптомов, сопутствующие внутричерепные осложнения, историю предыдущих попыток восстановления (доступ, техника и осложнения), диагностическую рентгенографию, хирургические доступы, расположение дефекта(ов) основания черепа, патологический процесс, синхронные дефекты основания черепа, тип трансплантата. (s) и люмбальные дренажи. Послеоперационные переменные включали ВЧД, использование ацетазоламида или вентрикулоперитонеального (ВП) шунта для снижения давления, продолжительность наблюдения, сопутствующие осложнения и/или рецидивы, а также проходимость LRS.
Хирургическая техника
Хирургическая техника (рис. 2), используемая старшим автором (B.A.W.) почти у всех пациентов, адаптирована из подхода, впервые описанного Bolger. 10 Варианты метода восстановления (как правило, в зависимости от анатомии и патологического процесса) описаны в следующем подразделе. В рамках стандартного хирургического лечения пациентов со спонтанной ликвореей нашей нейрохирургической бригадой были установлены люмбальные дренажи. Размещение дренажей у этой подгруппы пациентов обеспечивает средства для (1) измерения ВЧД, (2) введения флуоресцеина для локализации дефекта и (3) забора от 5 до 10 мл спинномозговой жидкости во время абляции энцефалоцеле, чтобы помочь с ретракцией и облегчить установка эпидуральных трансплантатов.
10 Варианты метода восстановления (как правило, в зависимости от анатомии и патологического процесса) описаны в следующем подразделе. В рамках стандартного хирургического лечения пациентов со спонтанной ликвореей нашей нейрохирургической бригадой были установлены люмбальные дренажи. Размещение дренажей у этой подгруппы пациентов обеспечивает средства для (1) измерения ВЧД, (2) введения флуоресцеина для локализации дефекта и (3) забора от 5 до 10 мл спинномозговой жидкости во время абляции энцефалоцеле, чтобы помочь с ретракцией и облегчить установка эпидуральных трансплантатов.
Инъекция 0,1 см 3 10% флуоресцеина, разведенного в 10 см 3 собственной спинномозговой жидкости пациента, вводилась в течение 10 минут, как описано ранее. 2 ,3,7 ,8,11 Зажимается и крепится к коже перед возвращением пациента в положение лежа на спине. Компьютерная стереотаксическая хирургическая навигация (InstaTrak, GE Healthcare или Fusion, Medtronic) использовалась во всех случаях, кроме одного, в настоящем исследовании.
Стандартная функциональная эндоскопическая хирургия околоносовых пазух выполняется с широкой верхнечелюстной антростомой до задней стенки верхней челюсти, полной этмоидэктомией и сфеноидотомией. Эндоскоп под углом 45° или 70° используется для первоначальной визуализации бокового кармана через сфеноидотомию и подтверждения наличия утечки спинномозговой жидкости. Затем внимание направляется на заднюю стенку верхнечелюстной пазухи с помощью эндоскопов 0° или 30°. После подъема слизистой оболочки с задней стенки верхней челюсти идентификацию и диссекцию клиновидно-небного сосудисто-нервного пучка проводят медиально-латерально. Крыло-небную ямку обнажают с удалением задней стенки верхней челюсти с помощью 2-мм пуансонов Керрисона и алмазного бора 15°. Жировая ткань тщательно удаляется, а тупая диссекция определяет внутреннюю верхнечелюстную артерию для перевязки и позволяет сохранить видиевый нерв, подглазничный нерв и клиновидно-небные ганглии. Вскрывают заднюю стенку крыловидно-небной ямки и удаляют поверхность пневматизированного крыловидного отростка верхомедиально до прикрепления крыловидной мышцы с помощью бормашины или кусачек Керрисона. Целью после завершения доступа является не только полное обнажение энцефалоцеле и связанного с ним дефекта основания черепа, но и полная экстирпация слизистой оболочки из LRS. Уверенность хирурга в способности удалить всю слизистую диктует необходимость облитерации или сохранения проходимости пазухи.
Целью после завершения доступа является не только полное обнажение энцефалоцеле и связанного с ним дефекта основания черепа, но и полная экстирпация слизистой оболочки из LRS. Уверенность хирурга в способности удалить всю слизистую диктует необходимость облитерации или сохранения проходимости пазухи.
При обнажении энцефалоцеле опухоль удаляют до уровня дефекта основания черепа с помощью радиочастотной коблации 12 -14 (Coblator; ArthroCare ENT) или транссфеноидального биполярного прижигания.
Реконструкция
Дефект основания черепа после удаления энцефалоцеле диктует нашу реконструктивную технику (рис. 3). Поскольку 12 из 13 истечений спинномозговой жидкости в наших случаях были спонтанными, почти во всех этих дефектах использовалось многослойное закрытие септальными костными и тканевыми трансплантатами. В этой серии трансплантатов вставок использовались либо Alloderm (LifeCell), Duragen (Integra), либо Surgisis (Cook Medical). 1 -4,7 ,8,11 ,15 ,16 После чего наложили накладной тканевый трансплантат со свободным жировым трансплантатом или без него с дополнительным слоем перегородочного лоскута на ножке в определенные случаи для окончательного закрытия углубления.
1 -4,7 ,8,11 ,15 ,16 После чего наложили накладной тканевый трансплантат со свободным жировым трансплантатом или без него с дополнительным слоем перегородочного лоскута на ножке в определенные случаи для окончательного закрытия углубления.
Полученные результаты
Хирургическим путем устранены 13 утечек СМЖ у 11 пациентов, возникших из ЛРП. Учитывая расположение дефектов и руководствуясь нашим алгоритмом доступа (рис. 1), эндоскопическая процедура ТПТГ была использована при 12 ликвореях. Демографические переменные и анамнез включены в Таблицу 1. Средний возраст на момент обращения составил 56 лет (диапазон 43–65 лет). Восемь из 11 пациентов были женщинами. Медиана ИМТ составила 35,6 (диапазон 28,0–46,6). Медиана продолжительности наблюдения составила 10,8 месяца (диапазон от 2 до 29 месяцев).месяцев) с 92% успеха с первой попытки. Клинический симптом у всех пациентов включал ликворный компонент ринореи.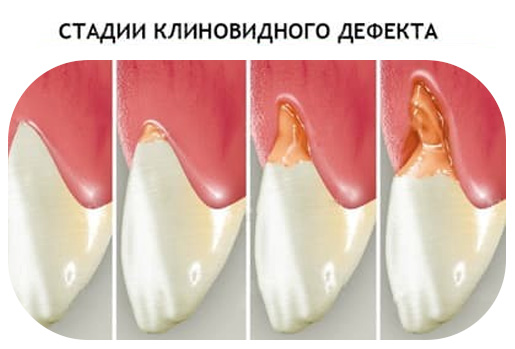 Три пациента отметили менингит в анамнезе до поступления. Компьютерная томография придаточных пазух у всех пациентов подтвердила подозрение на основании анамнеза и физикального обследования; магнитно-резонансная томография (МРТ) также была полезна при планировании операции и подтверждении диагноза у 8 пациентов. У семи пациентов на МРТ был выявлен синдром пустого турецкого седла.
Три пациента отметили менингит в анамнезе до поступления. Компьютерная томография придаточных пазух у всех пациентов подтвердила подозрение на основании анамнеза и физикального обследования; магнитно-резонансная томография (МРТ) также была полезна при планировании операции и подтверждении диагноза у 8 пациентов. У семи пациентов на МРТ был выявлен синдром пустого турецкого седла.
Все дефекты основания черепа были связаны с энцефалоцеле и подходили к ним с использованием техники TPTG, как описано. Только у 3 пациентов не было предшествующих хирургических попыток устранения ликвореи (пациенты 1, 5 и 11) (табл. 2). Трем пациентам (пациенты 6, 8 и 10) было выполнено в общей сложности 4 предыдущих краниотомии средней черепной ямки, которые не смогли контролировать ликворную утечку. Три пациента (2, 4 и 7) ранее безуспешно получали сфеноидотомную тампонацию; эти процедуры не обеспечивали эндоскопического доступа к латеральному карману и не затрагивали непосредственно дефект. У одной такой пациентки (пациентка 7) клиновидная пазуха была закупорена гидроксиапатитом; это привело к абсцессу височной доли, что потребовало доступа к средней черепной ямке и TPTG (сверху и снизу) для дренирования абсцесса и устранения дефекта. Один пациент был доставлен на операцию по устранению возможной утечки спинномозговой жидкости через решетчатую крышу до поступления в наше учреждение, но дефект LRS не был идентифицирован до операции на МРТ основным хирургом. Другой пациент предпринял 4 предшествующие попытки тампонады LRS до направления к врачу из-за сохраняющейся неудачи (рис. 4 и рис. 5). Доступ TPTG был предпринят у пациента 9.в стороннем учреждении, но не было предпринято никаких попыток удалить энцефалоцеле, исправить дефект или удалить слизистую оболочку углубления. Вместо этого над областью TPTG был помещен трансплантат слизистой оболочки нижней носовой раковины в попытке запечатать LRS, что привело к рецидивирующей ликворной утечке в течение 24 часов.
Один пациент был доставлен на операцию по устранению возможной утечки спинномозговой жидкости через решетчатую крышу до поступления в наше учреждение, но дефект LRS не был идентифицирован до операции на МРТ основным хирургом. Другой пациент предпринял 4 предшествующие попытки тампонады LRS до направления к врачу из-за сохраняющейся неудачи (рис. 4 и рис. 5). Доступ TPTG был предпринят у пациента 9.в стороннем учреждении, но не было предпринято никаких попыток удалить энцефалоцеле, исправить дефект или удалить слизистую оболочку углубления. Вместо этого над областью TPTG был помещен трансплантат слизистой оболочки нижней носовой раковины в попытке запечатать LRS, что привело к рецидивирующей ликворной утечке в течение 24 часов.
В нашей серии исследований был 1 пациент (пациент 6) с рецидивирующей ликвореей. Интересно, что это была поздняя неудача через 2 месяца после операции и была в контексте функционального шунта VP. При вторичной пластике дефект был снова устранен с использованием подложки из твердой мозговой оболочки Surgisis, подложки из септальной кости, замещающей накладки Surgisis из твердой мозговой оболочки, облитерации свободного жирового трансплантата и, наконец, контралатерального перегородочного лоскута на ножке, чтобы полностью закрыть облитерированный боковой карман. Трансплантационные материалы показаны в таблице 2.
Трансплантационные материалы показаны в таблице 2.
Шесть пациентов имели второй синхронный дефект основания черепа. У пациента 3 имелся дефект основания черепа в ипсилатеральной решетчатой области, который был устранен одновременно. У пациентов 5, 8, 9, 10 и 11 были синхронные контралатеральные дефекты LRS; у пациентов 5 и 10 они были восстановлены одновременно (Рисунок 6 и Рисунок 7). У пациента 8 пуля от огнестрельного ранения, нанесенного самому себе, застряла в левом ЛРП, но был отмечен контралатеральный синхронный спонтанный дефект ЛРП. Поскольку контралатеральный перегородочный лоскут на ножке использовался для восстановления большого дефекта, вызванного пулей, выполнение одновременного доступа TPTG привело бы к нарушению кровоснабжения перегородочного лоскута. Когда этой пациентке был имплантирован ВП-шунт для лечения высокого ВЧД, ее правая «спонтанная» ликворная утечка клинически отсутствовала, и она выбрала тщательное клиническое наблюдение.
У восьми пациентов после операции было измерено ВЧД, и среднее значение ВЧД составило 26,7 см H 2 O (диапазон 11-35 см H 2 O). У трех пациентов не было измерено поясничное давление из-за (1) невозможности получить записи до установки шунта VP по поводу предполагаемой идиопатической внутричерепной гипертензии (субъективная нейрохирургическая оценка: высокое ВЧД во время установки вентрикулостомического катетера) у пациента 3, (2) замена известного неисправного шунта VP за день до операции у пациента 6 и (3) показания давления после комбинированного эндоскопического и MCF доступа для абсцесса височной доли, которые были сочтены неточными в условиях инфекции у пациента 7. В целом, Терапия ацетазоламидом была начата у 5 пациентов, в то время как 5 пациентам потребовалась замена неисправного шунта (пациенты 6 и 10) или плановая установка шунта VP при резко повышенном ВЧД. Только 1 больная (пациентка 11) не потребовала послеоперационного вмешательства, так как у нее было установлено послеоперационное ВЧД 11 см H 2 О.
У трех пациентов не было измерено поясничное давление из-за (1) невозможности получить записи до установки шунта VP по поводу предполагаемой идиопатической внутричерепной гипертензии (субъективная нейрохирургическая оценка: высокое ВЧД во время установки вентрикулостомического катетера) у пациента 3, (2) замена известного неисправного шунта VP за день до операции у пациента 6 и (3) показания давления после комбинированного эндоскопического и MCF доступа для абсцесса височной доли, которые были сочтены неточными в условиях инфекции у пациента 7. В целом, Терапия ацетазоламидом была начата у 5 пациентов, в то время как 5 пациентам потребовалась замена неисправного шунта (пациенты 6 и 10) или плановая установка шунта VP при резко повышенном ВЧД. Только 1 больная (пациентка 11) не потребовала послеоперационного вмешательства, так как у нее было установлено послеоперационное ВЧД 11 см H 2 О.
Комментарий
В целом, LRS является редким местом, где возникает утечка спинномозговой жидкости, но наши предыдущие исследования показали, что наиболее частым местом для спонтанной клиновидной утечки CSF была LRS (35%). 2 ,7 Хотя некоторые авторы считали, что LRS утечки ликвора вторичны по отношению к открытому латеральному краниофарингеальному (Штернберговскому) каналу, 17 преобладающее место утечки — латеральнее мест слияния центров окостенения и латеральнее второго ветвь тройничного нерва. Латеральный краниофарингеальный канал расположен медиальнее верхней глазничной щели, что означает, что энцефалоцеле, возникающее через этот теоретический канал, должно не только пройти через кавернозный синус, но и проникнуть в 2 слоя твердой мозговой оболочки, прежде чем выйти из основания черепа. Текущее исследование и наша предыдущая работа предполагают, что эти утечки действительно приобретены, а не являются прямым результатом запатентованного канала Штернберга. 18 У девяти из 11 пациентов, участвовавших в настоящем исследовании, ранее предпринимались безуспешные попытки лечения патологического процесса в LRS. Это позволяет понять и повторить некоторые ключевые принципы в стратегиях эффективного лечения этой области.
2 ,7 Хотя некоторые авторы считали, что LRS утечки ликвора вторичны по отношению к открытому латеральному краниофарингеальному (Штернберговскому) каналу, 17 преобладающее место утечки — латеральнее мест слияния центров окостенения и латеральнее второго ветвь тройничного нерва. Латеральный краниофарингеальный канал расположен медиальнее верхней глазничной щели, что означает, что энцефалоцеле, возникающее через этот теоретический канал, должно не только пройти через кавернозный синус, но и проникнуть в 2 слоя твердой мозговой оболочки, прежде чем выйти из основания черепа. Текущее исследование и наша предыдущая работа предполагают, что эти утечки действительно приобретены, а не являются прямым результатом запатентованного канала Штернберга. 18 У девяти из 11 пациентов, участвовавших в настоящем исследовании, ранее предпринимались безуспешные попытки лечения патологического процесса в LRS. Это позволяет понять и повторить некоторые ключевые принципы в стратегиях эффективного лечения этой области.
Контроль повышенного ВЧД
Все 11 пациентов в нашем исследовании имели спонтанную ликворную утечку с ассоциированным энцефалоцеле, а 7 пациентов имели рентгенологические признаки синдрома пустого турецкого седла на МРТ, что часто наблюдается в контексте идиопатической внутричерепной гипертензии. Эти данные согласуются с данными других опубликованных отчетов. 16 Важнейшим фактором успешного восстановления является снижение ВЧД любыми необходимыми средствами, включая питание (значительная потеря веса), медикаментозное (ацетазоламид) или хирургическое вмешательство (шунт ВП). 2 ,7 Пять пациентов в нашей серии имели плановое размещение шунта VP. Двум из этих пациентов ранее были проведены шунты VP, которые оказались неудачными, что явилось основанием для персистирования или рецидива их утечки СМЖ. У трех пациентов было повышенное ВЧД (> 30 см H 2 O) путем мониторинга поясничного давления в послеоперационном периоде, несмотря на использование ацетазоламида, ингибитора карбоангидразы, который снижает выработку спинномозговой жидкости. Четыре пациента получали только ацетазоламид.
Четыре пациента получали только ацетазоламид.
Техника и размещение трансплантата
В то время как используемый материал для трансплантата варьируется в зависимости от пациента, принцип наложения нижнего и верхнего слоя представлен во всех наших операциях в этой серии. Как показано в нашем реконструктивном алгоритме (рис. 3), наш типичный метод восстановления свободного трансплантата включает использование дурального замещающего трансплантата, помещенного через дефект интракраниально в качестве подстилочного трансплантата. Затем в дефект помещают небольшой костный трансплантат. Трансплантат (слизистая оболочка/фасция/трупный материал или ксенотрансплантат) первоначально удерживается на месте с помощью тканевого герметика Evicel (Ethicon) (рис. 8). Если мы чувствуем, что слизистая оболочка может быть полностью удалена из LRS, облитерация выполняется после восстановления основания черепа с помощью трехслойной пластики. Свободный жировой трансплантат помещается в LRS, а рассасывающаяся тампона и тампон с напальчником помещаются в верхнечелюстную пазуху к облитерированной стенке на 1-2 недели. Мы считаем, что LRS следует полностью облитерировать жиром только в том случае, если можно получить доступ ко всей слизистой оболочке и удалить ее. Если слизистую не удается уверенно удалить, рекомендуется попытаться открыть LRS. Это должно снизить вероятность образования мукоцеле вблизи места устранения дефекта основания черепа. Как показано в нашей серии, тампонирование клиновидной пазухи (особенно гидроксиапатитом) без выявления фактического дефекта основания черепа и без экстирпации слизистой оболочки пазухи нецелесообразно.
Мы считаем, что LRS следует полностью облитерировать жиром только в том случае, если можно получить доступ ко всей слизистой оболочке и удалить ее. Если слизистую не удается уверенно удалить, рекомендуется попытаться открыть LRS. Это должно снизить вероятность образования мукоцеле вблизи места устранения дефекта основания черепа. Как показано в нашей серии, тампонирование клиновидной пазухи (особенно гидроксиапатитом) без выявления фактического дефекта основания черепа и без экстирпации слизистой оболочки пазухи нецелесообразно.
Мы полагаем, что наш высокий уровень успеха (92%) связан с превосходной экспозицией, достигаемой с помощью подхода TPTG, контролем внутричерепного давления и нашим многослойным закрытием. Мы предпочитаем использовать кость для поддержки дефекта от пульсаций давления спинномозговой жидкости. Это может быть дополнительным фактором для предотвращения рецидива ликвореи из-за стойкого повышения внутричерепного давления. В нашем 1 неудачном ремонте, используя наш реконструктивный алгоритм (рис. 3), мы добавили контралатеральный септальный лоскут, чтобы закрыть облитерированный LRS. Мы наблюдали за пациенткой еще 18 месяцев без рецидивов.
3), мы добавили контралатеральный септальный лоскут, чтобы закрыть облитерированный LRS. Мы наблюдали за пациенткой еще 18 месяцев без рецидивов.
Двусторонние дефекты lrs
У пяти пациентов в нашей группе были двусторонние дефекты основания черепа в LRS. Одному пациенту (пациент 10) был выполнен двусторонний TPTG-доступ. Другой пациент (пациент 5) подвергся TPTG доступу к 1 дефекту, но имел контралатеральный дефект, который был доступен через сфеноидотомию из-за сагиттальной ориентации. Он получил восстановление ипсилатерального септального лоскута для устранения этого дефекта (фото 6 и фото 7). У пациента 9 не было признаков утечки спинномозговой жидкости из контралатерального энцефалоцеле. Во время предыдущей попытки восстановить активно подтекающую сторону с помощью доступа TPTG во внешнем учреждении был поврежден подглазничный нерв. Пациент не хотел, чтобы контралатеральный дефект был устранен во время операции. Он решил продолжить терапию ацетазоламидом после окончательного восстановления несостоятельной стороны для лечения внутричерепной гипертензии и в настоящее время проходит лечение по снижению веса. У другого пациента (пациент 8) была утечка спинномозговой жидкости из-за огнестрельного ранения, нанесенного самому себе пулей, застрявшей в левом ЛП. Из-за обширности дефекта контралатеральный септальный лоскут был помещен после пластики и облитерации жировой ткани. Мы также идентифицировали контралатеральный дефект до операции, соответствующий паутинным ямкам и повышенному ВЧД. Это подтекало во время операции, но подход TPTG пожертвовал бы кровоснабжением септального лоскута, используемого для герметизации углубления слева. Случайный дефект этого пациента и связанная с ним утечка спинномозговой жидкости должны были быть устранены поэтапно; однако на сегодняшний день у нее не было клинических случаев подтекания, и она предпочитает, чтобы с этим справились посредством тщательного динамического наблюдения.
У другого пациента (пациент 8) была утечка спинномозговой жидкости из-за огнестрельного ранения, нанесенного самому себе пулей, застрявшей в левом ЛП. Из-за обширности дефекта контралатеральный септальный лоскут был помещен после пластики и облитерации жировой ткани. Мы также идентифицировали контралатеральный дефект до операции, соответствующий паутинным ямкам и повышенному ВЧД. Это подтекало во время операции, но подход TPTG пожертвовал бы кровоснабжением септального лоскута, используемого для герметизации углубления слева. Случайный дефект этого пациента и связанная с ним утечка спинномозговой жидкости должны были быть устранены поэтапно; однако на сегодняшний день у нее не было клинических случаев подтекания, и она предпочитает, чтобы с этим справились посредством тщательного динамического наблюдения.
В заключение, в этой серии статей освещаются несколько ключевых принципов восстановления дефектов основания черепа при LRS. Экстирпация слизистой оболочки клиновидной пазухи перед облитерацией должна помочь предотвратить образование мукоцеле и снизить вероятность абсцессов височной доли или других внутричерепных осложнений. Трансптеригоидное обнажение и идентификация всего дефекта основания черепа после абляции энцефалоцеле, по-видимому, являются отличным подходом для успешного восстановления дефектов LRS с низкой частотой неудач, как показано в этой серии случаев.
Трансптеригоидное обнажение и идентификация всего дефекта основания черепа после абляции энцефалоцеле, по-видимому, являются отличным подходом для успешного восстановления дефектов LRS с низкой частотой неудач, как показано в этой серии случаев.
Наверх
Информация о статье
Адрес для переписки: Брэдфорд А. Вудворт, доктор медицинских наук, отделение отоларингологии – хирургии головы и шеи, отделение хирургии, BDB Suite 563, 1808 Seventh Ave South, Birmingham, AL 35294-0012 ([email protected]).
Подано для публикации: 7 сентября 2011 г.; окончательная версия получена 29 февраля 2012 г.; принято 9 марта 2012 г.
Сообщений автора: Все авторы имели полный доступ ко всем данным исследования и несут ответственность за целостность данных и точность анализа данных. Изучение концепции и дизайна : Александр, Райли и Вудворт.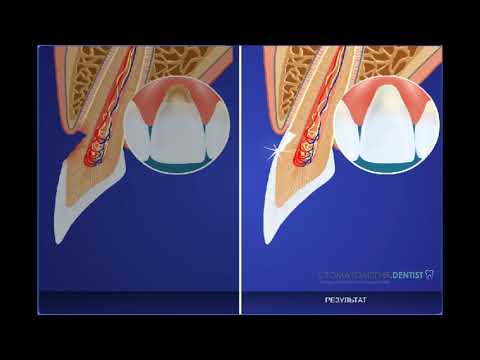 Сбор данных : Александр, Райли и Вудворт. Анализ и интерпретация данных : Александр, Чаабан, Райли и Вудворт. Составление рукописи : Александр и Вудворт. Критическая проверка рукописи на наличие важного интеллектуального содержания : Райли и Вудворт. Статистический анализ : Александр и Чаабан. Получено финансирование : Вудворт. Административная, техническая и материальная поддержка : Чаабан и Вудворт. Надзор за исследованием : Райли и Вудворт.
Сбор данных : Александр, Райли и Вудворт. Анализ и интерпретация данных : Александр, Чаабан, Райли и Вудворт. Составление рукописи : Александр и Вудворт. Критическая проверка рукописи на наличие важного интеллектуального содержания : Райли и Вудворт. Статистический анализ : Александр и Чаабан. Получено финансирование : Вудворт. Административная, техническая и материальная поддержка : Чаабан и Вудворт. Надзор за исследованием : Райли и Вудворт.
Раскрытие финансовой информации: Доктор Вудворт является консультантом ArthroCare ENT и Gyrus ENT.
Рекомендации
1.
Banks CA, Palmer JN, Chiu AG, O’Malley BW Jr, Woodworth BA, Kennedy DW. Эндоскопическое закрытие ликворной ринореи: 193 случая за 21 год. Отоларингол Head Neck Surg . 2009;140(6):826-83319467398PubMedGoogle ScholarCrossref
2.
Woodworth BA, Prince A, Chiu AG, и другие. Спонтанные утечки спинномозговой жидкости: парадигма окончательного восстановления и лечения внутричерепной гипертензии. Отоларингол Head Neck Surg . 2008;138(6):715-72018503841PubMedGoogle ScholarCrossref
3.
Woodworth BA, Schlosser RJ, Palmer JN. Эндоскопическая коррекция истечения цереброспинальной жидкости из лобных пазух. Ж Ларынгол Отол . 2005;119(9):709-71316156912PubMedGoogle ScholarCrossref
4.
Woodworth B, Schlosser RJ. Эндоскопическая коррекция врожденного интраназального энцефалоцеле у ребенка в возрасте 23 месяцев. Int J Pediatr Otorhinolaryngol . 2005;69(7):1007-100915911024PubMedGoogle ScholarCrossref
5.
Woodworth BA, Schlosser RJ, Faust RA, Bolger WE.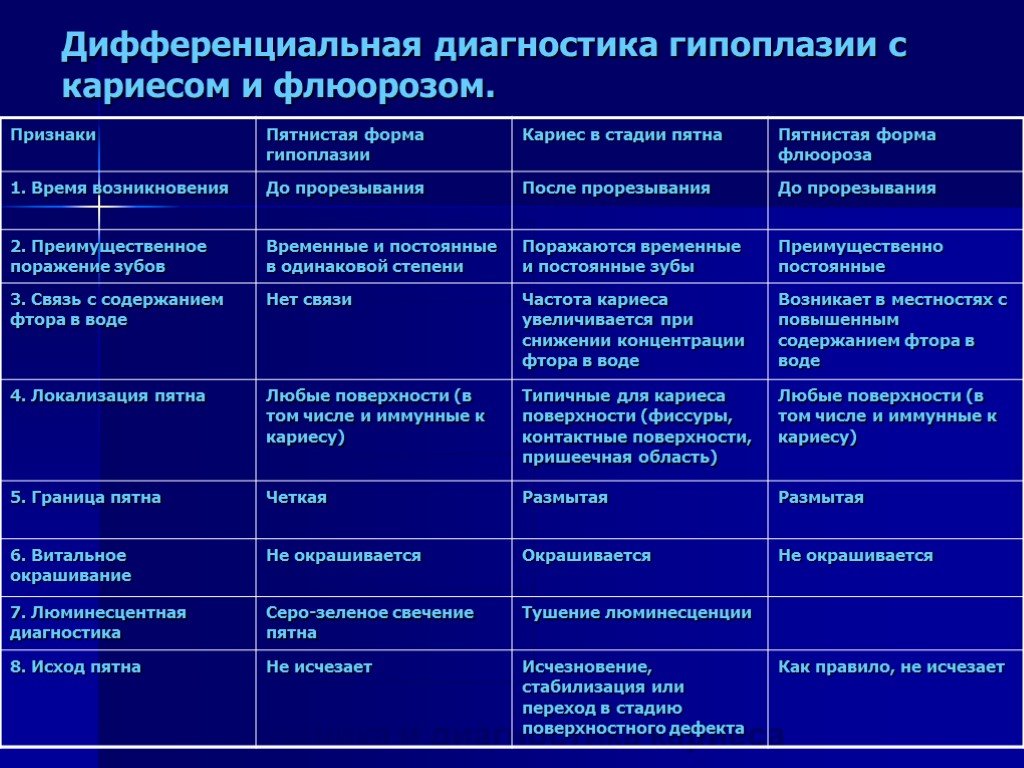 Эволюция в лечении врожденных интраназальных дефектов основания черепа. Arch Otolaryngol Head Neck Surg . 2004;130(11):1283-128815545582PubMedGoogle ScholarCrossref
Эволюция в лечении врожденных интраназальных дефектов основания черепа. Arch Otolaryngol Head Neck Surg . 2004;130(11):1283-128815545582PubMedGoogle ScholarCrossref
6.
Forer B, Sethi DS. Эндоскопическая коррекция истечения цереброспинальной жидкости в латеральный карман клиновидной пазухи. J Нейрохирург . 2010;112(2):444-44819698040PubMedGoogle ScholarCrossref
7.
Woodworth BA, Palmer JN. Самопроизвольное истечение спинномозговой жидкости. Curr Opin Otolaryngol Head Neck Surg . 2009;17(1):59-6519225307PubMedGoogle ScholarCrossref
8.
Вудворт BA, Нил Дж. Г., Шлоссер Р. Дж. Подтекание ликвора в клиновидную пазуху. Отоларингол Op Tech . 2006;17(1):37-42Google ScholarCrossref
9.
Bachmann-Harildstad G, Kloster R, Bajic R. Трансптеригоидный трансклиновидный доступ к латеральному расширению клиновидной пазухи для устранения спонтанной утечки спинномозговой жидкости. Подставка для черепа . 2006;16(4):207-21217471320PubMedGoogle ScholarCrossref
10.
Bolger WE. Эндоскопический трансптеригоидный доступ к латеральному клиновидному карману: хирургический доступ и клинический опыт. Отоларингол Хирургия головы и шеи . 2005;133(1):20-2616025047PubMedGoogle ScholarCrossref
11.
Woodworth BA, Bolger WE, Schlosser RJ. Истечение спинномозговой жидкости из носа и энцефалоцеле. Oper Tech Отоларингол . 2006;17(2):111-116Google ScholarCrossref
12.
Смит Н., Райли К.О., Вудворт Б.А. Эндоскопическое лечение энцефалоцеле с помощью коблатора.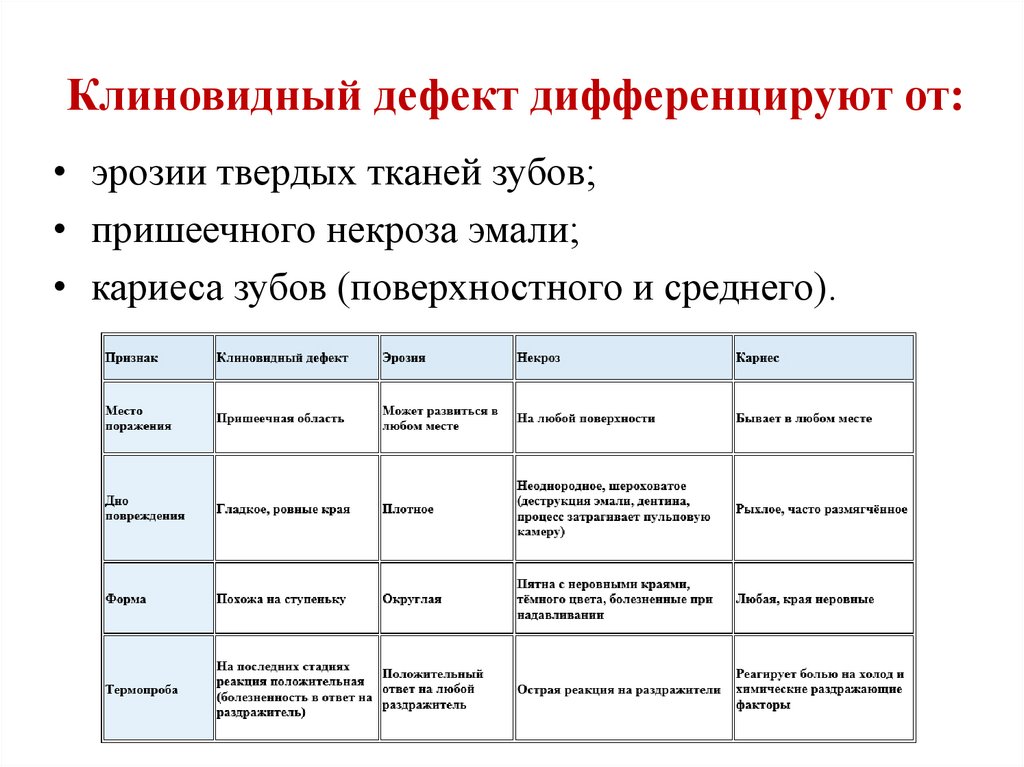 Ларингоскоп . 2010;120(12):2535-253921072754PubMedGoogle ScholarCrossref
Ларингоскоп . 2010;120(12):2535-253921072754PubMedGoogle ScholarCrossref
13.
Kostrzewa JP, Sunde J, Riley KO, Woodworth BA. Радиочастотная коблация снижает кровопотерю при эндоскопическом удалении синоназальной опухоли и опухоли основания черепа. ORL J Оториноларингол Relat Spec . 2010;72(1):38-4320299815PubMedGoogle ScholarCrossref
14.
Virgin FW, Bleier BS, Woodworth BA. Новые материалы и методы эндоскопической хирургии носовых пазух. Отоларингол Clin North Am . 2010;43(3):653-672, xi20525517PubMedGoogle ScholarCrossref
15.
Purkey MT, Woodworth BA, Hahn S, Palmer JN, Chiu AG. Эндоскопическая коррекция супраорбитальной решетчатой ликвореи. ORL J Оториноларингол Relat Spec . 2009;71(2):93-9819153530PubMedGoogle ScholarCrossref
2009;71(2):93-9819153530PubMedGoogle ScholarCrossref
16.
Schlosser RJ, Woodworth BA, Wilensky EM, Grady MS, Bolger WE. Спонтанные истечения ликвора: вариант доброкачественной внутричерепной гипертензии. Энн Отол Ринол Ларингол . 2006;115(7):495-500163PubMedGoogle Scholar
17.
Табаи А., Ананд В.К., Каппабьянка П., Штамм А., Эспозито Ф., Шварц Т.Х. Эндоскопическое лечение спонтанного менингоэнцефалоцеле латеральной клиновидной пазухи. J Нейрохирург . 2010;112(5):1070-107719698044PubMedGoogle ScholarCrossref
18.
Barañano CF, Curé J, Palmer JN, Woodworth BA. Канал Штернберга: правда или вымысел? Am J Rhinol Allergy . 2009;23(2):167-17119401043PubMedGoogle ScholarCrossref
Синдром Гарсена, вызванный метастазами рака легкого в клиновидную кость: тематическое исследование | Всемирный журнал хирургической онкологии
- История болезни
- Открытый доступ
- Опубликовано:
- Satoshi Fukai 1 ,
- Naoyuki Okabe 1 ,
- Hayato Mine 1 ,
- Hironori Takagi 1 &
- …
- Hiroyuki Suzuki 2
Всемирный журнал хирургической онкологии том 16 , Номер статьи: 46 (2018) Процитировать эту статью
-
2138 доступов
-
5 цитирований
-
Сведения о показателях
Abstract
История вопроса
Синдром Гарсена, который проявляется односторонним параличом почти всех черепных нервов без чувствительных или двигательных нарушений длинных трактов или внутричерепной гипертензии, может быть вызван злокачественными опухолями в основании черепа. Представлено наблюдение больного раком легкого с метастазами в клиновидную кость с развитием синдрома Гарсена.
Представлено наблюдение больного раком легкого с метастазами в клиновидную кость с развитием синдрома Гарсена.
Описание клинического случая
У женщины 76 лет диагностирован немелкоклеточный рак легкого с инфильтрацией перикарда и диафрагмы, cT4N1M0, стадия 3А. Выполнена нижняя лобэктомия слева с резекцией перикарда и диафрагмы. Патологоанатомический диагноз: плеоморфная карцинома, pT2bN0M0, стадия 1В. Затем ее наблюдали в хирургической клинике, а через 2 месяца после операции она обратилась в отделение неотложной помощи с жалобами на головную боль и двоение в глазах. При неврологическом осмотре выявлен паралич левого IV, V1 и VI черепно-мозговых нервов. На компьютерной томографии (КТ) головы и контрастной магнитно-резонансной томографии (МРТ) обнаружена метастатическая опухоль с деструкцией кости в левой клиновидной пазухе головы, у нее диагностирован синдром Гарсена, обусловленный метастазами рака легкого в клиновидную кость. Облучение было проведено в качестве паллиативного лечения, но ее неврологические симптомы не улучшились. Ее общее состояние постепенно ухудшалось, и она умерла через 5 месяцев после операции.
Ее общее состояние постепенно ухудшалось, и она умерла через 5 месяцев после операции.
Выводы
Метастазы рака легкого в кости встречаются часто, но метастазы в клиновидную кость встречаются крайне редко. В этом клиническом случае синдром Гарсена, вызванный раком легких, обсуждается в контексте нескольких предыдущих сообщений.
Исходная информация
Синдром Гийена-Алажуанина-Гарсена (синдром Гарсена) — редкий синдром, впервые описанный Гарсеном в 1926 году [1]. Синдром Гарсена состоит из односторонних параличей почти всех черепных нервов без чувствительных или двигательных нарушений длинных трактов или внутричерепной гипертензии, которая может быть вызвана злокачественными опухолями в основании черепа. В отчете Гарсена написано «почти» все черепно-мозговые нервы, и хотя конкретное количество черепно-мозговых нервов не уточняется, могут возникать все параличи черепно-мозговых нервов от I до XII.
Синдром Гарцина может быть вызван первичными опухолями основания черепа, такими как опухоли носоглотки [1] и эпифарингеальная рабдомиосаркома [2]; метастатические опухоли, такие как рак молочной железы [3], рак предстательной железы [4] и рак легких [5,6,7,8,9,10]; и воспалительные заболевания, такие как мукормикоз [11]. Описан случай метастазирования рака легкого в клиновидную кость с синдромом Гарсена.
Описан случай метастазирования рака легкого в клиновидную кость с синдромом Гарсена.
Представление клинического случая
76-летняя женщина потеряла 3 кг за 3 месяца и обратилась в клинику первичной медико-санитарной помощи в сентябре 2014 г. Она никогда не курила, и ее функциональный статус (PS) по Восточной кооперативной онкологической группе (ECOG) был 1 , Компьютерная томография (КТ) показала опухоль размером около 6 см в левой нижней доле. Бронхоскопическая биопсия не выявила злокачественных клеток, но был заподозрен саркоматоидный рак с помощью жидкости бронхоальвеолярного лаважа (БАЛ). Предоперационная магнитно-резонансная томография головного мозга (МРТ) не выявила метастазов в головной мозг, а метастазы не были обнаружены при позитронно-эмиссионной томографии (ПЭТ) всего тела. В отличие от КТ опухоль широко контактировала с перикардом и диафрагмой. После обследования диагностирован немелкоклеточный рак легкого с перикардиальной и диафрагмальной инвазией, cT4N1M0, стадия 3А. Затем была выполнена нижняя лобэктомия слева с сочетанной резекцией перикарда и диафрагмы и узловой диссекцией (ND)2a-2. Патологоанатомический диагноз: плеоморфная карцинома (рис. 1), pT2bN0M0, стадия 1В. Пациент наблюдался в хирургической клинике без химиотерапии или лучевой терапии. Через два месяца после операции обратилась в приемный покой с основными жалобами на головную боль, пульсацию в левом виске, не позволяющую открыть глаза и диплопию.
Затем была выполнена нижняя лобэктомия слева с сочетанной резекцией перикарда и диафрагмы и узловой диссекцией (ND)2a-2. Патологоанатомический диагноз: плеоморфная карцинома (рис. 1), pT2bN0M0, стадия 1В. Пациент наблюдался в хирургической клинике без химиотерапии или лучевой терапии. Через два месяца после операции обратилась в приемный покой с основными жалобами на головную боль, пульсацию в левом виске, не позволяющую открыть глаза и диплопию.
a Патоморфологическое исследование показывает плеоморфную карциному с гигантскими клетками (окрашивание H&E). b Наблюдается много веретенообразных клеток (окрашивание H&E)
Изображение в натуральную величину
При неврологическом обследовании у нее обнаружен паралич левого блокового (IV) и отводящего (VI) нервов и боль в области первой ветви левого тройничного нерва (V1). ). КТ головы показала деструкцию кости в левой клиновидной пазухе (рис. 2а). МРТ головного мозга с усилением гадолинием показала опухоль с контрастным усилением (рис. 2b). На основании неврологического обследования и данных визуализации был диагностирован синдром Гарсена, обусловленный метастазами рака легкого в клиновидную кость. Облучение пятью серыми проводилось четыре раза для купирования ее неврологической симптоматики, но они не улучшились. Впоследствии в хирургической клинике ей назначали золедроновую кислоту, но это было неэффективно. Через три месяца после операции ПЭТ и КТ всего тела показали распространение рака на правое девятое ребро и левый надпочечник. Ее общее состояние постепенно ухудшалось, и она умерла в марте 2015 года, примерно через 5 месяцев после операции.
2b). На основании неврологического обследования и данных визуализации был диагностирован синдром Гарсена, обусловленный метастазами рака легкого в клиновидную кость. Облучение пятью серыми проводилось четыре раза для купирования ее неврологической симптоматики, но они не улучшились. Впоследствии в хирургической клинике ей назначали золедроновую кислоту, но это было неэффективно. Через три месяца после операции ПЭТ и КТ всего тела показали распространение рака на правое девятое ребро и левый надпочечник. Ее общее состояние постепенно ухудшалось, и она умерла в марте 2015 года, примерно через 5 месяцев после операции.
a КТ головы показывает деструкцию кости в левой клиновидной пазухе. (1) ) односторонний паралич черепных нервов, (2) ни чувствительных, ни двигательных нарушений длинных путей, (3) отсутствие внутричерепной гипертензии и (4) остеобластическое поражение в основании черепа [1]. Он имеет уникальные клинические симптомы и является редким синдромом.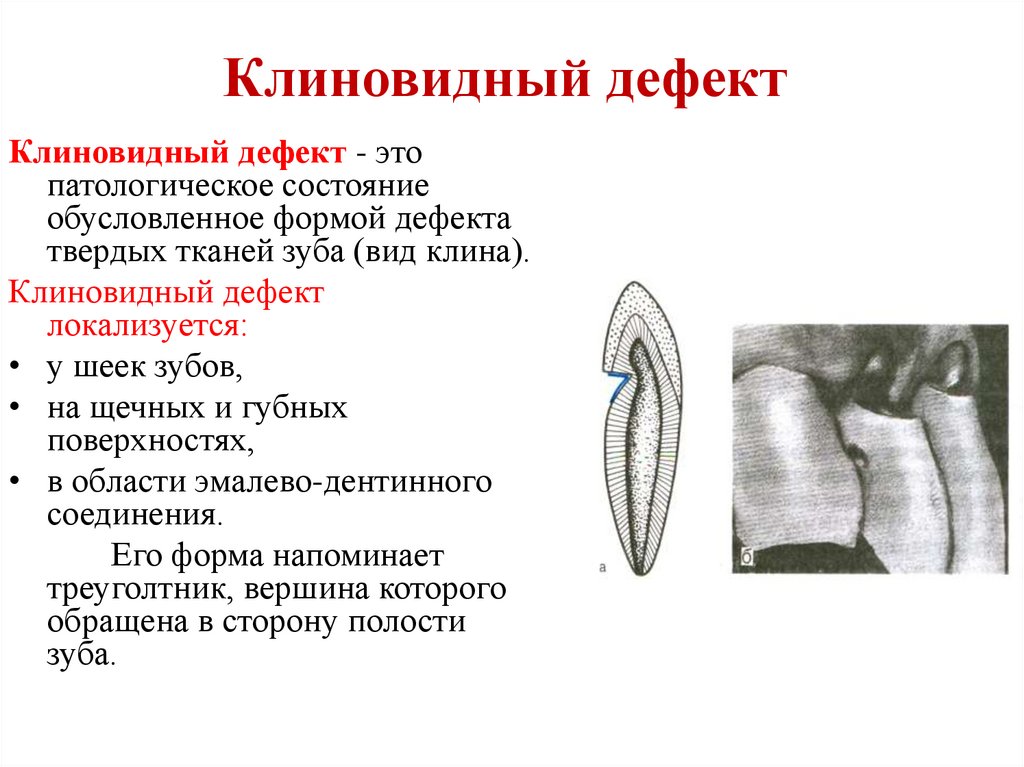 Существуют синдром Колле-Сикара, синдром кавернозного синуса, синдром Толоса-Ханта, которые имеют сходные клинические проявления с синдромом Гарсена, но эти синдромы представляют собой паралич определенного черепного нерва (например, синдром Колле-Сикара от IX до XII) и определяются также воспаление нерва. Синдром Гарсена, как показано, отличается от этих синдромов тем, что он может возникать во всех черепных нервах и не может быть диагностирован без остеокластических поражений. Клиновидная пазуха представляет собой полость внутри кости бабочки по средней линии основания черепа и является одной из придаточных пазух носа. Клиновидная пазуха расположена медиальнее верхней глазничной щели, через которую проходят III, IV, V1 и VI черепные нервы, в данном случае черепно-мозговые нервы были сдавлены опухолью. Во многих сообщениях о синдроме Гарсена предполагается, что он возникает из-за прорастания кости злокачественной опухолью, такой как опухоль ядра основания черепа и носоглотки, или метастатической опухоли из отдаленного органа в череп.
Существуют синдром Колле-Сикара, синдром кавернозного синуса, синдром Толоса-Ханта, которые имеют сходные клинические проявления с синдромом Гарсена, но эти синдромы представляют собой паралич определенного черепного нерва (например, синдром Колле-Сикара от IX до XII) и определяются также воспаление нерва. Синдром Гарсена, как показано, отличается от этих синдромов тем, что он может возникать во всех черепных нервах и не может быть диагностирован без остеокластических поражений. Клиновидная пазуха представляет собой полость внутри кости бабочки по средней линии основания черепа и является одной из придаточных пазух носа. Клиновидная пазуха расположена медиальнее верхней глазничной щели, через которую проходят III, IV, V1 и VI черепные нервы, в данном случае черепно-мозговые нервы были сдавлены опухолью. Во многих сообщениях о синдроме Гарсена предполагается, что он возникает из-за прорастания кости злокачественной опухолью, такой как опухоль ядра основания черепа и носоглотки, или метастатической опухоли из отдаленного органа в череп.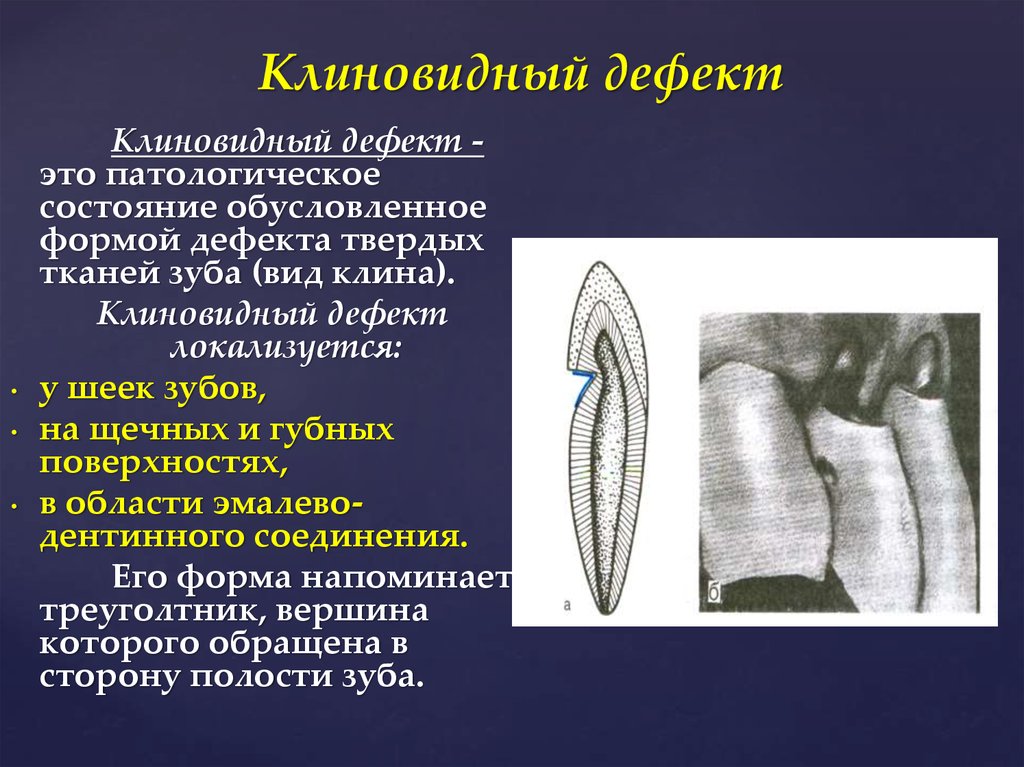 Рак легких занимает третье место по вероятности развития костных метастазов после рака молочной железы и рака предстательной железы [12]. Сообщается, что частота костных метастазов при вскрытии рака легкого составляет около 20–50 [13]. Кроме того, гистопатологический диагноз в этом случае был плеоморфной карциномой, которая, как сообщается, с большей вероятностью вызывает отдаленные метастазы, чем другие типы немелкоклеточного рака легкого [14]. Сообщается, что метастазы рака легкого в череп составляют 5 случаев из 611 случаев (0,4%) одиночного метастазирования рака легкого в кости [12]. Поскольку метастазы в кости основания черепа встречаются реже, чем метастазы в череп, общая частота синдрома Гарсена, вызванного раком легкого, оценивается намного меньше, чем 0,4%. В предыдущих отчетах было шесть случаев синдрома Гарсена из-за рака легкого, включая подтипы, которые не удовлетворяли всем диагностическим критериям (таблица 1) [5,6,7,8,9].,10]. На сегодняшний день специфической терапии синдрома Гарсэна не существует.
Рак легких занимает третье место по вероятности развития костных метастазов после рака молочной железы и рака предстательной железы [12]. Сообщается, что частота костных метастазов при вскрытии рака легкого составляет около 20–50 [13]. Кроме того, гистопатологический диагноз в этом случае был плеоморфной карциномой, которая, как сообщается, с большей вероятностью вызывает отдаленные метастазы, чем другие типы немелкоклеточного рака легкого [14]. Сообщается, что метастазы рака легкого в череп составляют 5 случаев из 611 случаев (0,4%) одиночного метастазирования рака легкого в кости [12]. Поскольку метастазы в кости основания черепа встречаются реже, чем метастазы в череп, общая частота синдрома Гарсена, вызванного раком легкого, оценивается намного меньше, чем 0,4%. В предыдущих отчетах было шесть случаев синдрома Гарсена из-за рака легкого, включая подтипы, которые не удовлетворяли всем диагностическим критериям (таблица 1) [5,6,7,8,9].,10]. На сегодняшний день специфической терапии синдрома Гарсэна не существует.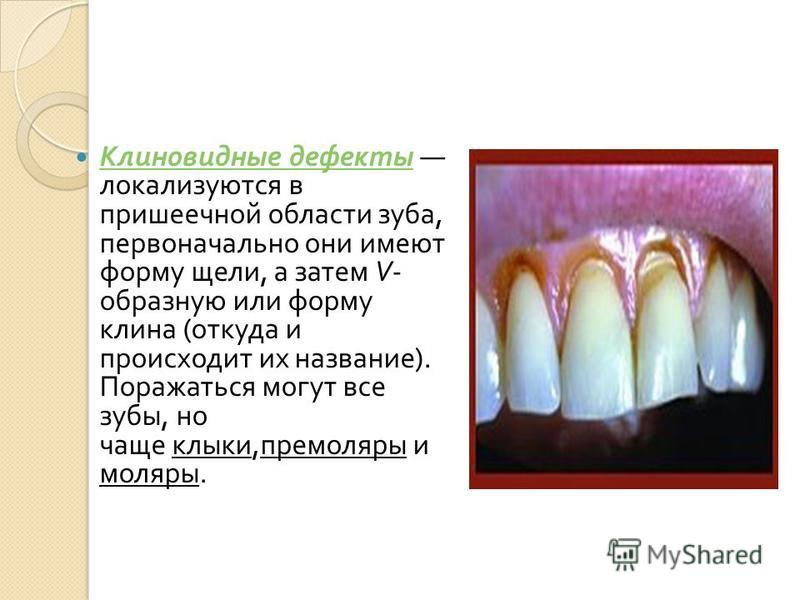 В данном случае лучевая терапия и золедроновая кислота применялись для лечения костных метастазов, но неврологического улучшения не наблюдалось. Сообщалось о случае мелкоклеточного рака легкого с неврологическим улучшением только после терапии карбоплатином + этопозидом [10]. Есть несколько случаев, сообщающих о неврологическом улучшении, но есть вероятность, что симптомы могут быть улучшены путем правильной диагностики синдрома Гарцина.
В данном случае лучевая терапия и золедроновая кислота применялись для лечения костных метастазов, но неврологического улучшения не наблюдалось. Сообщалось о случае мелкоклеточного рака легкого с неврологическим улучшением только после терапии карбоплатином + этопозидом [10]. Есть несколько случаев, сообщающих о неврологическом улучшении, но есть вероятность, что симптомы могут быть улучшены путем правильной диагностики синдрома Гарцина.
Полная таблица
Описан случай рецидива рака легкого с метастазами в клиновидную кость и синдромом Гарсена. Если у пациента с раком легкого развиваются странные неврологические проявления, следует учитывать синдром Гарсена с метастазами в основание черепа, даже если это необычный синдром. При подозрении на синдром Гарсена необходимо предварительно выполнить МРТ с контрастом и проконсультироваться с неврологом для уточнения неврологической картины. Хотя в экстренных случаях лечения не требуется, нейрохирургия и лучевая терапия рассматриваются в зависимости от причины заболевания.
Хотя в экстренных случаях лечения не требуется, нейрохирургия и лучевая терапия рассматриваются в зависимости от причины заболевания.
Сокращения
- БАЛФ:
-
Жидкость бронхоальвеолярного лаважа
- КТ:
-
Компьютерная томография
- ECOG PS:
-
Статус деятельности Восточной кооперативной онкологической группы
- МРТ:
-
Магнитно-резонансная томография
- НД:
-
Узловая диссекция
- ПЭТ:
-
Позитронно-эмиссионная томография
Ссылки
- «>
Guillan R AT, Garcin R. Le syndrom paralytique unilateral global des nerfs craniens. Bull Med Hop (Париж). 1926; 50: 456–460.
-
Hakusui S, Fujishiro K, Takahashi A. Вскрытие первичной эпифарингеальной рабдомиосаркомы с синдромом Гарцина. Jpn J Med. 1991; 30: 379–82.
Артикул КАС пабмед Google Scholar
-
Кавайда М., Канзаки Дж., Инуяма Ю. Случай синдрома Гарцина из-за метастазов рака молочной железы в височную кость, проявляющийся начальным симптомом лицевого паралича. лица N Res Jpn. 1986; 6: 113–6.
Google Scholar
-
Какимото С., Фурукава М., Кондо А. Рак предстательной железы с синдромом Гарцина: клинический случай. Нишинихон Дж. Урол. 1991;53:1051–1055.3.
Google Scholar
-
Imanishi J, Adachi H, Kaibara H, Mizukami Y, Kitagawa M.
 Случай множественного паралича черепных нервов из-за метастазов легочной аденокарциномы в основание черепа. Ирио. 1975; 29: 637–42.
Случай множественного паралича черепных нервов из-за метастазов легочной аденокарциномы в основание черепа. Ирио. 1975; 29: 637–42. Google Scholar
-
Фуджи М., Киура К., Такигава Н., Юмото Т., Сехара Ю., Табата М., Танимото М. Представление о синдроме Гарцина из-за рака легких. Дж. Торак Онкол. 2007; 2: 877–8.
Артикул пабмед Google Scholar
-
Тох Т., Ямабе М., Хагивара С., Ватанабе К., Цурусако С., Уэда М. Случай аденокарциномы легкого с начальными симптомами паралича подъязычного нерва. J Oral Maxillofac Surg. 2007; 53: 439–43.
Google Scholar
-
Aida Y, Igarashi A, Inoue S, Abe S, Shibata Y, Kubota I. Случай аденокарциномы легкого с синдромом Гарсена. Дж. Дж. Пн. Дыхание соц. 2010;48:66–9.
Google Scholar
- «>
Нагашима О., Нанба Й., Курияма С., Такекава Х., Кадоя К., Кацура Й., Нандзё Й., Тору К., Йошимура Й., Сасаки С., Томинага С. Случай крайне сомнительного рака легких, обнаруженный по одной боковой характеристике- краниальная невропатия (синдром Гарсена). Jpn J Chest Dis. 2011;70:192–7.
Google Scholar
-
Морияма Ю., Ватанабэ К., Синкай М., Гото Х., Ишигатубо Ю., Канеко Т. Случай мелкоклеточного рака легкого с синдромом Гарцина. Япония. Дж. Рак легких. 2013; 53:755–9.
Артикул Google Scholar
-
Муцукура К., Цубои Ю., Имамура А. Синдром Гарцина у пациента с риноцеребральным мукормикозом. Мозговой нерв. 2004; 56: 231–5.
ПабМед Google Scholar
-
Sugiura I. Хирургическое лечение метастатического поражения костей раком легких. Jpn J Chest Dis.
 1985; 44: 521–8.
1985; 44: 521–8. Google Scholar
-
Eguchi K, Saijo N, Shinkai T. Недавнее состояние диагностики и лечения костных метастазов у пациентов с распространенным раком легких. Япония. Дж. Рак Чемотер. 1987; 14:1696–703.
КАС Google Scholar
-
Mochizuki T, Ishii G, Nagai K. Плеоморфная карцинома легкого: клинико-патологические характеристики 70 случаев. Ам Дж. Сург Патол. 2008; 32: 1727–35.
Артикул пабмед Google Scholar
Ссылки на скачивание
Благодарности
Неприменимо.
Финансирование
Финансирование исследования отсутствует.
Доступность данных и материалов
Обмен данными не применим к этой статье, так как в ходе текущего исследования наборы данных не создавались и не анализировались.
Информация о авторе
Авторы и принадлежности
-
Департамент хирургии грудной клетки, Общая больница Takeda, 3-27 Yamaga, Aizuwakamatsu, 965-8585, Japan
Satoshi Fukai, Naoyuki, hayor,
.
Кафедра грудной хирургии, Медицинский университет Фукусима, 1 Hikarigaoka Fukushima, Fukushima, 960-1295, Japan
Hiroyuki Suzuki
Авторы
- Satoshi Fukai
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Naoyuki Okabe
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Hayato Mine
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Hironori Takagi
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Hiroyuki Suzuki
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Contributions
SF собрала и обобщила данные и подготовила статью. NO построил концепцию и дизайн статьи. HM и HT помогали в сборе данных и создании статей. HS помог составить проект статьи и, наконец, утвердил ее. Все авторы прочитали и одобрили окончательный вариант рукописи.
NO построил концепцию и дизайн статьи. HM и HT помогали в сборе данных и создании статей. HS помог составить проект статьи и, наконец, утвердил ее. Все авторы прочитали и одобрили окончательный вариант рукописи.
Автор, ответственный за переписку
Переписка с Хироюки Судзуки.
Декларация этики
Одобрение этики и согласие на участие
Неприменимо.
Согласие на публикацию
От пациента было получено письменное информированное согласие на публикацию данного клинического случая и прилагаемых изображений. Копия письменного согласия доступна для ознакомления главному редактору этого журнала.
Конкурирующие интересы
Авторы заявляют, что у них нет конкурирующих интересов.
Примечание издателя
Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Права и разрешения
Открытый доступ Эта статья распространяется на условиях международной лицензии Creative Commons Attribution 4.
