Новые возможности местной антибактериальной терапии воспалительных заболеваний пародонта на фоне патологии органов пищеварения | Булкина Н.В., Островская Л.Ю.
Многочисленные клинические наблюдения свидетельствуют о том, что заболевания желудочно–кишечного тракта (ЖКТ) сопровождаются патологическими изменениями тканей пародонта [2]. Патология полости рта диагностируется у 92% больных с заболеваниями ЖКТ, и в основном она представлена пародонтитом.
Главной особенностью заболеваний пародонта на фоне хронического поражения ЖКТ является более ранняя, чем у лиц без фоновой патологии, генерализация патологического процесса, т.е. уже на ранних стадиях в патологический процесс вовлекается пародонт всех зубов, отмечаются более интенсивные явления воспаления, нередко сопровождающиеся выделением гноя из пародонтальных карманов. У больных с сочетанной гастродуоденальной патологией течение пародонтита часто носит непрерывно рецидивирующий характер, отмечается резистентность к традиционной терапии, ремиссия заболевания отличается нестойкостью [1].
Согласно современной точке зрения воспалительные заболевания пародонта относятся к инфекционным хроническим воспалительным заболеваниям, поэтому нормализация микрофлоры является непременным условием их рациональной терапии. Хорошо известно, что при хроническом гингивите и пародонтите происходит отчетливый сдвиг в сторону преобладания анаэробной флоры: по данным Slots J., при воспалении в пародонтальных карманах количество штаммов анаэробных бактерий увеличивается до 70–80%, тогда как в норме количество анаэробов не превышает 20–30%.
Ряд исследователей рассматривают присутствие НР в полости рта, как источник реинфекции слизистой оболочки желудка у больных язвенной болезнью двенадцатиперстной кишки (ЯБДК) [4,11]. Другие [7], обнаружив тотальную инфицированность НР, полагают, что данный микроорганизм в полости рта является комменсалом.
Таким образом, наиболее мощным фактором, способствующим развитию и поддержанию болезней пародонта, является развитие дисбиоза в полости рта, который развивается или на фоне сниженного иммунитета, или сам приводит к его изменению [9].
Этим и объясняется целесообразность применения антибактериальных средств. Вместе с тем широкое (а подчас необоснованное и бесконтрольное) применение химиопрепаратов приводит к формированию штаммов с резистентностью к антибиотикам. Установлено, что их селекция происходит, в частности, при резких перепадах концентрации препаратов, что наблюдается при местном применении различных антибактериальных лекарственных форм (в виде полосканий, паст и гелей, легко смываемых слюной).

– использование антисептических препаратов, которые в отличие от антибиотиков обладают широким антибактериальным спектром и не индуцируют резистентность микробов;
– создание пролонгированных лекарственных форм на основе компонентов, сорбирующихся на слизистой оболочке полости рта или создающих депо длительное время в пародонтальных карманах.
На сегодняшний день «золотым стандартом» анаэробицидных средств является метронидазол, демонстрирующий, в частности, высокую эффективность при воспалительных заболеваниях пародонта, в особенности в сочетании с хлоргекседином.
Метронидазол – производное нитроимидазола, обладающего антипротозойным и антибактериальным действием против анаэробных бактерий, простейших, вызывающих пародонтит: Porphyromonas gingivalis, Prevotella intermedia, P. denticola, Fusobacterium fusiformis, Wolinella recta, Treponema sp., Eikenella corrodens, Borrelia vincenti, Bacteroides melaninogenicus, Selenomonas sp.
 Восстановленная 5–нитрогруппа метронидазола взаимодействует с ДНК клетки микроорганизмов, ингибируя синтез их нуклеиновых кислот, что ведет к гибели микроорганизмов.
Восстановленная 5–нитрогруппа метронидазола взаимодействует с ДНК клетки микроорганизмов, ингибируя синтез их нуклеиновых кислот, что ведет к гибели микроорганизмов.Хлоргекседин – антисептик бактерицидного действия против широкого круга вегетативных форм грамотрицательных и грамположительных микроорганизмов, а также дрожжей, дерматофитов и липофильных вирусов. На споры бактерий действует только при повышенной температуре. В низких концентрациях хлоргекседин вызывает нарушение осмотического равновесия бактериальных клеток и выход из них калия и фосфора, что приводит к бактериостатическому эффекту. Сохраняет активность в присутствии крови и гноя. Не токсичен, не кумулируется в организме, отсутствует канцерогенное действие.
«Метрогил дента профессиональный» имеет приятный вкус, водорастворим, поэтому не препятствует оттоку экссудата.
 Гель обладает высокой текучестью, поэтому может полностью заполнять пародонтальный карман. После контакта с десневой жидкостью, содержащей эстеразы, происходит гидролиз неактивного метронидазола бензоата. Метронидазол оказывает анаэробицидное действие на бактерии, находящиеся в пародонтальных карманах или зубодесневой борозде.
Гель обладает высокой текучестью, поэтому может полностью заполнять пародонтальный карман. После контакта с десневой жидкостью, содержащей эстеразы, происходит гидролиз неактивного метронидазола бензоата. Метронидазол оказывает анаэробицидное действие на бактерии, находящиеся в пародонтальных карманах или зубодесневой борозде. В своей работе мы изучили особенности состояния тканей пародонта у больных язвенной болезнью, а также оценили эффективность влияния местного применения препарата «Метрогил дента профессиональный» с целью стабилизации данной сочетанной патологии.
Нами были обследованы 70 больных ЯБДК, ассоциированной с НР, в сочетании с воспалительными заболеваниями пародонта в возрасте от 18 до 45 лет, из них с хроническим катаральным гингивитом – 30, генерализованным пародонтитом легкой степени – 19, средней – 11, тяжелой – 10.
Все больные были разделены по группам. В первой группе (группа сравнения) местное лечение заболеваний пародонта включало снятие зубных отложений с последующим полированием поверхностей.
 Во второй группе (35 человек) наряду с общепринятыми мероприятиями проводили аппликацию «Метрогил дента профессиональный».
Во второй группе (35 человек) наряду с общепринятыми мероприятиями проводили аппликацию «Метрогил дента профессиональный». При гингивите и пародонтите легкой степени после удаления зубных отложений, проведения кюретажа и медикаментозной обработки десневого края, гель «Метрогил дента профессиональный» вводился в пародонтальные карманы 2 раза в сутки, курс лечения составил 5–7 дней. Отмечалось выраженное противовоспалительное действие препарата, которое выражалось в уменьшении гиперемии и отека десневого края уже на 2–й день применения препарата у больных катаральным гингивитом, в снижении кровоточивости десен, что подтверждалось положительной динамикой индексных показателей (ГИ, РМА).

Лечебный эффект при пародонтите легкой степени достигался на 5–7–й день аппликаций препаратом «Метрогил дента профессиональный» на приеме с одновременными аппликациями «Метрогил дента» в домашних условиях в течение 5–7 дней. Десневые сосочки приобрели нормальную форму и величину, восстановился их цвет, исчезла кровоточивость. У 87,3% больных с хроническим генерализованным пародонтитом к 5–7 дню индекс гигиены достоверно снижался и составил 1,8±0,07. Также уменьшался индекс РМА, который составил 9,8±0,6 по сравнению с началом лечения 67,8±2,3. Кровоточивость десен исчезла. Индекс ПИ достоверно не изменялся.
Проведение стоматологических мероприятий в сочетании с лечением заболеваний органов пищеварения, в том числе и эрадикационной терапией, привело к восстановлению структуры пародонта у обследованных пациентов.
Анализ результатов терапии больных группы сравнения показал, что продолжительность курса лечения удлинялась на 7–9 дней. Наблюдалось снижение индексов гигиены и РМА до 1,9±0,1 и 12,01±0,48 соответственно.

В течение месяца у всех пациентов с фоновой патологией пищеварительного тракта также была достигнута клинико–эндоскопическая ремиссия. Положительная динамика клинической картины подтверждена данными морфологического исследования слизистой оболочки желудка.
При исследовании мазков–отпечатков с зубного налета отмечено, что частота обнаружения НР у пациентов с хроническим гингивитом составляет 25%, у пациентов с хроническим пародонтитом – 32,3%.
Эрадикация НР в антральном отделе желудка была достигнута у 80% пациентов с НР–ассоциированной ЯБДК в сочетании с хроническим гингивитом и у 78,5% в сочетании с хроническим пародонтитом.
В течение полугода у 30,8% больных наблюдалось рецидивирование ЯБДК, что сочеталось с обострением хронического пародонтита. Среди пациентов с ЯБДК с развитием рецидива заболевания у 70% больных эрадикация НР в антральном отделе желудка и ротовой полости была неэффективной, а у 30% пациентов, несмотря на уничтожение микроорганизма в антральном отделе желудка, сохранялось персистирование НР в полости рта, что, очевидно, служило источником реинфекции слизистой оболочки желудка и причиной рецидива пептической язвы.

Следовательно, одним из факторов достижения стабильной ремиссии заболеваний пародонта у больных с фоновой H. pylori–ассоциированной патологией верхних отделов пищеварительного тракта является успешная эрадикация микроорганизма в желудке и полости рта с ликвидацией на этом фоне воспалительных изменений в слизистой оболочке желудка.
Заключение
Проведенное исследование подтверждает важность комплексного лечения заболеваний пародонта и НР–ассоциированной патологии верхних отделов пищеварительного тракта с проведением эрадикационной терапии, направленной на уничтожение микроорганизма и в полости рта, и в антральном отделе желудка. Эрадикация НР в полости рта служит важным звеном вторичной профилактики как язвенной болезни двенадцатиперстной кишки, так и воспалительных заболеваний пародонта. Использование геля «Метрогил дента профессиональный» позволяет сократить сроки наступления стабилизации воспалительно–деструктивных процессов в тканях пародонта и способствует эрадикации Нр в полости рта.

Литература
1. Балобанова И.Г., Чуршина Т.В., Балобанов В.Ю. О взаимосвязи пародонтита с гастродуоденальной и гепатобилиарной патологией у лиц молодого возраста // Современные тенденции развития гастроэнтерологии: (Тез. докл. науч.– практич. конф., 20–21 апр. 1995 г.) Ижевск, 1995. С.11–12.
2. Григорьян А.С., Грудянов А.И., Рабухина Н.А., Фролова О.А. Болезни пародонта //Руководство для врачей. – Москва, 2004. – 287с.
3. Ивашкин В.Т., Лапина Т.Л. Инфекция Helicobacter pylori:современное состояние проблемы // Русский медицинский журнал. – 1996. – №3. – С.140–150.
4. Цимбалистов А.В., Робакидзе Н.С. Влияние стоматологического статуса больных язвенной болезнью на инфицированность полости рта и слизистой оболочки желудка Helicobacter pylori // Клиническая стоматология. – 2001. – №1. – С.16–18.
5. Desai H.G., Gill H.H., Shankarai K., Mehta P.R., Prabhu S.R. Dental plaque: a permanent reservoir of Helycobacter pylori?// Scand. J. Gastroenterol. – 1991. – 26(11): 1205–8.
– 1991. – 26(11): 1205–8.
6. Graham D.Y. Campylobacter pylori and peptic ulcer disease // Gastroenterology. – 1989. – Vol.96. – P.615–625.
7. Karczewska E., Konturek J.E., Konturek P.C. et al. Oral cavity as a potential source of gastric reinfection by Helicobacter pylori // Dig. Dis. Sci. – 2002. – Vol.47, N5. – P.978–986.
8. Price A.B., Levi J., Dolby J.M. et al. Campylobacter pyloridis in peptic ulcer disease: microbyology, pathology and scanning electron microscopy // Cut. – 1985. – Vol.21, N3. – P.1183–1188.
9. Schein W., Meryn S. Helycobacter pylori and the mouth cavity – overview and perspectives // Wien – Klin. – Wochenschr. – 1994. – 106(17): 547–9.
10. Shames B., Krajden S., Fuksa M., Babida C., Penner J.L. Evidance for the occurance of the same strain of Campylobacter pylori in the stomach and dental plaque // J. Clin. Microbiol. – 1989. – 27(12): 2849–50.
11. Song Q., Haller B., Ulrich D., A. et al. Quantitation of Helicobacter pylori in dental plaque samples by competitive polymerase chain reaction // J. Clin. Pathol. – 2000. – Vol.53, N3. – P.218–222.
Clin. Pathol. – 2000. – Vol.53, N3. – P.218–222.
12. Thomas J.E., Gibson G.R., Darboe M.K., Dale A., Weaver L.T. Isolation of Helycobacter pylori from human faeces // Lancet. – 1992. – 340(8829): 1194–5.
13. Wyatt J.I. Campylobacter pylori, duodenitis and duodenal ulceration./ In: Rathbone B.J., Heatley R.V.(eds) Campylobacter pylori and gastroduodenal disease. – Blackwell. – Oxford, 1989. – P.117–124.
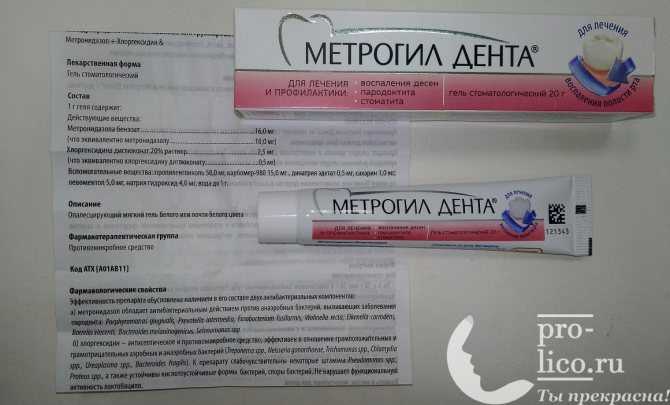
инструкция по применению, цена, аналоги, состав, показания
Гель от белого до белого с желтоватым оттенком цвета однородной консистенции.
Каждая туба (20 г) содержит: действующих веществ: метронидазола – 200 мг, хлоргексидина диглюконата (в виде хлоргексидина диклюконата 20 % раствора) – 10 мг; вспомогательные вещества: пропиленгликоль, карбомер 980, динатрия эдетат, сахарин натрия, левоментол, натрия гидроксид, воду очищенную.
Противомикробные и антисептические средства для наружного применения при заболеваниях полости рта.
Код АТХ: А01АВ11.
Комбинированный противомикробный препарат для лечения и профилактики инфекционно-воспалительных заболеваний полости рта. Действие препарата обусловлено свойствами компонентов, входящих в его состав.
Метронидазол биохимически восстанавливается за счет 5-нитрогруппы внутриклеточными транспортными протеинами анаэробных микроорганизмов. Восстановленная 5-нитрогруппа метронидазола взаимодействует с ДНК клетки микроорганизмов, ингибируя синтез их нуклеиновых кислот, что ведет к гибели бактерий. Метронидазол активен в отношении анаэробных бактерий, вызывающих заболевания пародонта: Porphyromonas gingivalis, Prevotella intermedia, Fusobacterium fusiformis, Wolinella recta, Eikenella corrodens, Borrelia vincenti, Bacteroides melaninogenicus, Selenomonas spp.
К метронидазолу нечувствительны аэробные микроорганизмы и факультативные анаэробы, но в присутствии смешанной флоры (аэробы и анаэробы) метронидазол проявляет синергизм действия с антибиотиками, эффективными против обычных аэробов.
Хлоргексидин — антисептик широкого спектра, обладает бактерицидным действием. Активен в отношении вегетативных форм грамотрицательных и грамположительных микроорганизмов (Treponema spp., Neisseria gonorrhoeae, Trichomonas spp., Chlamydia spp., Ureaplasma spp., Bacteroides fragilis), к препарату слабочувствительны некоторые штаммы Pseudomonas spp., Proteus spp. К хлоргексидину резистентны кислотоустойчивые формы бактерий, споровые формы и лактобациллы.
Фармакокинетика: После применения геля абсорбция его компонентов минимальная. В плазме крови обнаруживаются следовые количества препарата.
Инфекционно-воспалительные заболевания пародонта и слизистой оболочки полости рта:
— острый и хронический (отечный, гиперпластический, атрофический) гингивит;
— острый язвенно-некротический гингивит Венсана;
— острый и хронический пародонтит;
— периодонтит, периодонтальный абсцесс (в составе комбинированный терапии).
Индивидуальная непереносимость метронидазола, хлоргексидина, а также производных нитроимидазола. Непереносимость любых компонентов, входящих в состав лекарственного средства. Детский возраст до 6 лет.
Непереносимость любых компонентов, входящих в состав лекарственного средства. Детский возраст до 6 лет.
Местно, только для стоматологического применения. Доза геля на участок десны окружающей один зуб составляет каплю размером с горошину.
Взрослым и детям старше 6 лет при воспалении десен (гингивит) гель наносится на область десен 2 раза в день тонким слоем пальцем или ватной палочкой, смывать гель не рекомендуется. После нанесения геля следует воздержаться от питья и приема пищи в течение 30 мин. Длительность курса лечения составляет в среднем 7–10 дней.
При пародонтите после снятия зубных отложений, пародонтальные карманы обрабатываются гелем и производится аппликация геля на область десен. Время экспозиции – 30 мин. Количество процедур зависит от тяжести заболевания. В дальнейшем аппликации геля пациент может проводить самостоятельно, нанося гель на область десен 2 раза в день в течение 7–10 дней.
Для профилактики обострений хронического гингивита и пародонтита гель наносят на область десен 2 раза в день в течение 7–10 дней. Профилактические курсы лечения проводятся 2–3 раза в год.
Профилактические курсы лечения проводятся 2–3 раза в год.
У пациентов с нарушениями функции печени или почек коррекция дозы препарата не требуется.
У пожилых пациентов коррекция дозы препарата не требуется.
Случаи передозировки при местном применении маловероятны.
Применение геля не заменяет гигиенической чистки зубов, поэтому во время курса лечения чистка зубов должна быть продолжена. Следует избегать попадания геля в глаза. Не следует применять гель более 10 дней без консультации со стоматологом.
Во время применения лекарственного средства не допускается применение алкогольсодержащих напитков и лекарственных средств, поскольку это может привести к возникновению тетурамоподобной реакции в виде спазмов в области желудка, тошноты и рвоты, головной боли, приливов крови к лицу.
Лекарственное средство не рекомендуется использовать у детей в возрасте до 6 лет в связи с отсутствием информации по безопасности лекарственного средства у данной категории пациентов.
Не рекомендуется назначать препарат беременным женщинам в первом триместре беременности. В период лактации следует решить вопрос о прекращении грудного вскармливания.
Лекарственное средство не влияет на способность к управлению автотранспортом, механизмами и операторскую деятельность.
При местном применении в рекомендованных дозах системного взаимодействия геля с другими лекарственными средствами не выявлено.
Тем не менее, следует соблюдать осторожность при использовании геля у лиц, которые применяют непрямые антикоагулянты (возможно увеличение протромбинового времени и повышение риска кровотечений). Может повысить нейротоксичность дисульфирама при одновременном применении. Прием фенобарбиталсодержащих препаратов, фенитоина снижает антимикробную эффективность лекарственного средства, прием циметидина увеличивает риск развития нежелательных побочных эффектов лекарственного средства.
При местном применении геля риск развития системных побочных явлений невелик, редко (с частотой 1 реакция на 1 000–10 000 курсов применения препарата) могут наблюдаться: головокружение или головная боль, аллергические реакции (кожная сыпь, зуд, крапивница), нарушения вкуса, затрудненное глотание, тошнота и рвота, лекарственный стоматит и гингивит.
20 г в тубах алюминиевых с бушонами. Каждую тубу вместе с листком-вкладышем помещают в пачку из картона (упаковка № 1).
При температуре не выше 25 ºС. Хранить в недоступном для детей месте.
2 года. Лекарственное средство не использовать после окончания срока годности.
Без рецепта.
Информация о производителе
Открытое акционерное общество «Борисовский завод медицинских препаратов», Республика Беларусь, Минская обл., г. Борисов, ул. Чапаева, 64, тел/факс +375(177)735612, 731156.
Кратковременный эффект системного дополнительного введения Метронидазола и Азитромицина при нехирургическом лечении пародонта у пациентов с рефрактерным хроническим пародонтитом
Введение
Пародонтит является многофакторным заболеванием, в основе которого лежит бактериальная инфекция. На дисбаланс между бактериальной инфекцией и реакцией хозяина могут влиять многие факторы окружающей среды, образа жизни и генетические факторы. Сокранский и др. 1998 классифицировали поддесневую бактериальную флору на комплексы по времени заселения биопленки и их роли в патогенетическом механизме пародонтита. Черные палочки, продуцирующие пигмент (BPR), принадлежащие к красному комплексу (Porphyromonas gingivalis, Tannerella forsythia), играют важную роль в возникновении и развитии прогрессирующего пародонтита.
Сокранский и др. 1998 классифицировали поддесневую бактериальную флору на комплексы по времени заселения биопленки и их роли в патогенетическом механизме пародонтита. Черные палочки, продуцирующие пигмент (BPR), принадлежащие к красному комплексу (Porphyromonas gingivalis, Tannerella forsythia), играют важную роль в возникновении и развитии прогрессирующего пародонтита.
Пациенты, которые не реагируют адекватно на механическое лечение пародонтита, являются первыми кандидатами на дополнительную антимикробную терапию (рис. 1, 2).
Патогены пародонта нельзя удалить только с помощью механической обработки (Mombelli et al 2000, van Winkelhof & Winkel 2009). Комбинация метронидазола и амоксициллина показала свою эффективность в борьбе с Aggregatibacter actinomycetemcomitans (Aa). Несколько авторов сообщают о положительном эффекте дополнительной антибактериальной терапии в сочетании с FMDSRP (van Winkelhof & Winkel 2009)., Эррера и др. 2002, 2008, Haffajee et al. 2003). Метронидазол в течение длительного времени был антибиотиком выбора при лечении пародонтологических пациентов с заболеваниями пародонта, связанными с BPR (Mombelli & Lang 1992). Однако использование метронидазола было связано со многими побочными реакциями на лекарства, как неврологическими, так и желудочно-кишечными (металлический привкус, диарея и др.), изменениями мочи и другими дисфункциями мочевыводящих путей. Другими пораженными органами являются кожа, глаза, печень, кровь и иммунная система. Но самое важное в лечении пародонтоза – это взаимодействие Метронидазола с алкоголем. Помимо возможного ограниченного лекарственного действия, взаимодействие может спровоцировать покраснение кожи, тошноту, рвоту и головные боли. Относительно длительное время приема лекарств (10–14 дней) также может привести к несоблюдению режима лечения пациентом (Greenberg 19).84, Леше и др. 1993) и, в конечном итоге, к безуспешному лечению пародонтоза.
Однако использование метронидазола было связано со многими побочными реакциями на лекарства, как неврологическими, так и желудочно-кишечными (металлический привкус, диарея и др.), изменениями мочи и другими дисфункциями мочевыводящих путей. Другими пораженными органами являются кожа, глаза, печень, кровь и иммунная система. Но самое важное в лечении пародонтоза – это взаимодействие Метронидазола с алкоголем. Помимо возможного ограниченного лекарственного действия, взаимодействие может спровоцировать покраснение кожи, тошноту, рвоту и головные боли. Относительно длительное время приема лекарств (10–14 дней) также может привести к несоблюдению режима лечения пациентом (Greenberg 19).84, Леше и др. 1993) и, в конечном итоге, к безуспешному лечению пародонтоза.
Азитромицин предлагался с середины 90-х годов для лечения пародонтита (Sefton et al., 1996). Его можно вводить перорально. Назначение на короткое время (3 дня), вероятно, улучшает комплаентность пациента. Побочные эффекты AZM могут проявляться при употреблении алкоголя (Mombelli 2008).
Gomi et al (2007) показали, что AZM очень эффективен при лечении заболеваний пародонта и что концентрация AZM остается высокой до 14 дней в GCF.
Поиск подходящего антибиотика с меньшими побочными реакциями имеет большое клиническое значение, особенно для тех пациентов, которые не реагируют адекватно на механическую терапию. Целью нашего исследования было изучить и сравнить клинический эффект системного лечения метронидазолом и азитромицином в сочетании с нехирургической терапией пародонта при полном скейлинге и полировании корней (FMDSRP) для зубов с инфекциями BPR.
Материал и метод
Ретроспективно каждому пациенту был поставлен исходный диагноз (например, генерализованный тяжелый хронический пародонтит) в соответствии с действующей классификацией заболеваний пародонта (Armitage 1999) с потерей прикрепления ≥ 3 мм и/или рентгенологической потерей кости ≥ 30% длины корня при ≥ 30 % сайтов. Пародонтальное обследование включало измерение глубины кармана при зондировании (PPD) и рецессии с точностью до 1 мм с помощью ручного пародонтального зонда (PCPUNC 15; Hu Friedy, Чикаго, Иллинойс, США) в 6 точках на зуб.
Исследование планировалось как ретроспективное, в котором 55 пациентов с полным или частичным соблюдением режима лечения в течение как минимум 5 лет с рефрактерным хроническим пародонтитом в период с 2005 по 2009 год и инфекцией BPR были отобраны и разделены на две группы. Критерии исключения: агрессивный пародонтит, инфицирование Aggregatibacter actinomycetemcomitans, прием антибиотиков или бисфосфонатов в течение последних 6 мес. Пациенты с сахарным диабетом и ожирением с индексом массы тела> 30 также были исключены.
Микробиологический анализ
Для выявления пациентов с BPR был проведен микробный скрининг. Микробиологическое исследование проводилось с помощью 4 бумажных штифтов в 4 самых глубоких пародонтальных карманах разных зубов у каждого пациента (Gomi et al., 2007) за 6 недель до нехирургического лечения пародонта (IAI-Padotest, Zuchwil, Швейцария).
Пациенты с BPR ниже 10 % от общего числа бактерий не получали дополнительных системных антибиотиков и также были исключены из анализа (Weyer et al. 2007).
2007).
Оценка рентгенограмм
До пародонтологического лечения и через 1 год полные наборы периапикальных рентгенограмм (Ultraspeed; Kodac, Рочестер, Нью-Йорк, США) в технике XCP с использованием пленкодержателей (XCP, Kentzler & Kaschner Dental, Ellwangen/Jagst, Germany ) или панорамные рентгенограммы были получены для каждого пациента. Интраоральный размер 0 (верхние клыки и нижнечелюстные передние отделы) и 2 (все остальные области) стоматологические или панорамные снимки подвергались воздействию источника рентгеновского излучения (периапикальный: Heliodent 70Т, 70 кВ, 7 мА, Сирона, Бенсхайм, Германия/панорамный: OrthophosÒplus D 3200, Siemens, Бенсхайм, Германия) и разработаны в стандартных условиях (XR 24 NOVA, Dürr Dental, Битигхайм-Биссинген, Германия).
Все рентгенограммы были просмотрены в затемненной комнате с помощью рентгенографического экрана (DSK, Maier, Garmisch-Patenkirchen, Germany). Относительную потерю костной массы в процентах оценивали в наиболее пораженном периодонтом месте каждого зуба с помощью линейки Шей (Schei et al. , 1959), и зубы относили к одной из 5 групп потери пародонтальной кости (< 20 %, 20/< 40 %). , 40/< 60%, 60/< 80%, 80% и более) (Ким и др., 2007, Претцл и др., 2008). Все рентгенологические оценки были выполнены одним исследователем (AK).
, 1959), и зубы относили к одной из 5 групп потери пародонтальной кости (< 20 %, 20/< 40 %). , 40/< 60%, 60/< 80%, 80% и более) (Ким и др., 2007, Претцл и др., 2008). Все рентгенологические оценки были выполнены одним исследователем (AK).
Оценка историй болезни пациентов
Следующая информация была получена из историй болезни пациентов:
- Основная переменная результата этого исследования (потеря зубов после терапии) оценивалась путем сравнения первой и последней поддерживающей пародонтальной терапии (КПТ). ) обследование.
- Медицинский анамнез: Пациенты были разделены на категории в соответствии с самооценкой артериальной гипертензии, сердечно-сосудистых заболеваний (ССЗ), артрита, остеопороза и сахарного диабета.
- Состояние зубов
- У всех пациентов, потерявших зубы, опрашивались причины (например, кариес, эндодонтия, пародонтология, ортодонтия, протезирование, травма и т. д.)
Ретроспективно каждому пациенту был поставлен исходный диагноз (например, генерализованный тяжелый хронический пародонтит) в актуальная классификация заболеваний пародонта (Armitage 1999). Если информация о PAL-V отсутствовала на исходном уровне, этот параметр заменялся интерпроксимальной потерей кости.
Если информация о PAL-V отсутствовала на исходном уровне, этот параметр заменялся интерпроксимальной потерей кости.
В соответствии с сообщениями о курении в анамнезе пациенты были разделены на действующих и некурящих. Некурящими считались либо пациенты, никогда в жизни не курившие, либо бывшие курильщики, бросившие курить не менее 5 лет. Все остальные пациенты были классифицированы как нынешние курильщики (Lang & Tonetti, 2003).
Для каждого пациента было задокументировано, посещал ли он или она КПТ в отделении VIIA (Специализированный пародонтологический центр) Центрального госпиталя Вооруженных сил Германии в Кобленце, регулярно соблюдая рекомендуемые интервалы. поведение с медицинскими рекомендациями (Wilson 1996). Пациенты, посетившие ≥80% всех посещений КПТ в течение рекомендованного времени ± 1 месяц, считались полностью соблюдающими режим (Demetriou et al., 1995). Если пациент продлил рекомендуемый интервал КПТ хотя бы один раз более чем на 100%, он или она считались несоблюдающими (например, рекомендуемый интервал КПТ составлял 3 месяца, а пациент возвращался на КПТ через 7 месяцев) (Eickholz et al. 2008). ). Пациенты, посетившие от 50 до 80% всех посещений КПТ и продлившие рекомендуемые интервалы на ≥ 1 месяца, но не более чем на 100%, были расценены как частично соблюдающие.
2008). ). Пациенты, посетившие от 50 до 80% всех посещений КПТ и продлившие рекомендуемые интервалы на ≥ 1 месяца, но не более чем на 100%, были расценены как частично соблюдающие.
Нехирургическое пародонтологическое лечение и дополнительный системный курс антибиотиков
Первая группа (30 пациентов) применяла Метронидазол 3 x 400 мг/день в течение 10 дней (Mombelli & Lang 1992), начиная с 24 часов до FMDSRP в 2005-2007 гг. . Вторая группа (25 пациентов) применяла азитромицин по 500 мг/сут в течение 3 дней периоперационно (начиная за 2 дня до СРП) в сочетании с ФМДСРП (Gomi et al., 2007) в 2008-2009 гг. Клинические параметры: глубина пародонтального кармана (PPD), кровоточивость при зондировании (BoP), уровень клинического прикрепления (CAL) оценивались исходно и через 6 недель после FMDSRP. Рентгенологическая потеря костной ткани (RAL) измерялась исходно и через 1 год после операции. Никакой дополнительной хирургической пародонтальной терапии в течение этого периода времени не проводилось. В пяти случаях проведено дополнительное эндодонтическое и в семи случаях необходимое протезирование. Соблюдение индивидуального КПТ измеряли через год после FMDSRP. Всех пациентов лечил один и тот же пародонтолог (TE), клинические данные собирались у одного и того же врача (AK), а весь статистический анализ выполнялся другим автором (RT).
В пяти случаях проведено дополнительное эндодонтическое и в семи случаях необходимое протезирование. Соблюдение индивидуального КПТ измеряли через год после FMDSRP. Всех пациентов лечил один и тот же пародонтолог (TE), клинические данные собирались у одного и того же врача (AK), а весь статистический анализ выполнялся другим автором (RT).
Результаты
Пациенты группы МЕТ были в среднем 53,9 лет (SD 10,0 лет), имели 22,4 зуба (SD 4,5) и общую среднюю рентгенологическую потерю костной массы (RAL) 36,6% (SD 9,4) на исходном уровне. Трое (10 %) из них были женщинами и 40 % курильщиками. Пациенты группы AZM были в среднем 58,4 лет (SD 6,9 лет), имели 21,5 зубов (SD 5,0) и RAL 35,4 % (SD 8,4). Пять (25%) пациентов были женщинами и 28% курильщиками. Две группы были схожи и сопоставимы по возрасту, количеству зубов RAL, курению и другим факторам риска на исходном уровне (табл. 1). Большинство пациентов полностью соблюдали режим лечения и не пропускали ни одного сеанса лечения в течение года исследования (рис. 3). В течение первого года послеоперационного лечения ни один пациент не соблюдал режим лечения.
3). В течение первого года послеоперационного лечения ни один пациент не соблюдал режим лечения.
Обе группы лечения привели к снижению PD и RAL (рис. 4). Количество потерянных зубов в течение первого послеоперационного года было менее 0,4 на одного пациента в обеих группах. Добавочная системная АЗМ уменьшила карманы 5-6 мм на 9,5%, более глубокие карманы на 5,5%. 8 зубов (всего 538) были потеряны у 7 пациентов в течение первого послеоперационного года. Соответствующее снижение в группе МЕТ составило 18,5% для карманов диаметром 5-6 мм и 4,6% для более глубоких карманов. В течение следующего года 11 зубов (всего из 672) были потеряны у 8 пациентов. Прирост рентгенологического прикрепления в остаточном зубном ряду через год после FMDSRP составил 2,3% (AZM) и 2,9% (МЕТ) (рис.2). Курильщики в группе МЕТ имели незначительное большее снижение PD в более глубоких карманах по сравнению с некурящими. Более глубокие карманы (> 7 мм) уменьшились до 0,1-0,4% у курящих и некурящих в обеих группах (табл. 2).
2).
Обсуждение
Quirrynen et al. В 1995 г. была предложена концепция полной дезинфекции полости рта (FMD), чтобы избежать интраоральной передачи пародонтальных патогенов из пародонтальных карманов в недавно обработанные участки. Эта концепция включала дезинфекцию всей полости рта в течение 24 часов (Lang et al. 2008). Результаты в литературе неоднородны в отношении реального клинического эффекта FMD или его модифицированной версии FM-Deep Scaling Root Planing. Ланг и др. 2008 обнаружили различия в клинических параметрах между ящуром или FM-DSRP и традиционной поэтапной хирургической обработкой раны, которые едва ли имеют значение с клинической точки зрения. В нашей клинике мы лечим пациентов через FMSRP из-за больших расстояний, которые большинству из них приходится преодолевать (в среднем > 2 часов). Наши неопубликованные данные показывают, что согласие пациентов с количеством посещений сильно коррелирует с расстоянием, которое им приходится преодолевать до нашей клиники.
Красные комплексные бактерии могут играть важную роль в рефрактерном хроническом пародонтите (Socrascy et al. 1998). В соответствии с результатами других исследований мы показали, что рецидив или персистенция Porphyromonas gingivalis отмечается через 6 месяцев после лечения (Xajigeorgiou et al. 2006, Fleming et al. 1998). Предварительное исследование показало, что рецидив BPR возникает у 30% пролеченных пациентов с пародонтитом после первого года поддерживающей терапии пародонта и более чем у 70% через 5 лет (Weyer J, Eger Th 2007) даже после лечения амоксициллином и метронидазолом после FMDSRP.
В обеих наших лечебных группах наблюдалось снижение остаточного PPD, которое не могло контролироваться в первой фазе только с помощью FMDSRP. Несколько авторов сообщают о положительном эффекте дополнительной антибактериальной терапии в сочетании с FMDSRP. (Ван Винкельхоф и Винкель, 2009 г., Эррера и др., 2002 г., 2008 г., Хаффаджи и др., 2003 г.).
МЕТ – бактерицидный антибиотик, относящийся к группе имидазолов. Он очень эффективен против грамотрицательных периопатогенных бактерий (Loesche et al. 19).84, 1991, Feres et al. 200). AZM является бактериостатическим антибиотиком, а также эффективным против некоторых грамотрицательных палочек. Хотя некоторые авторы предполагают, что бактериостатические препараты могут не подходить для лечения биопленочных инфекций (van Winkelhof et al., 2000), с середины 90-х годов дополнительные исследования показали положительный эффект системного AZM при дополнительном нехирургическом лечении пародонта (Sefton и др., 1996). Было показано, что при введении в течение всего 3 дней он имеет более высокую концентрацию в жидкости десневой борозды, чем в сыворотке крови, в течение 14 дней после перорального приема. AZM преимущественно поглощается фагоцитами, поэтому его уровень в инфицированных тканях выше, чем в неинфицированных (Gomi 2007, Pin-Chuan Lai 2011).
Он очень эффективен против грамотрицательных периопатогенных бактерий (Loesche et al. 19).84, 1991, Feres et al. 200). AZM является бактериостатическим антибиотиком, а также эффективным против некоторых грамотрицательных палочек. Хотя некоторые авторы предполагают, что бактериостатические препараты могут не подходить для лечения биопленочных инфекций (van Winkelhof et al., 2000), с середины 90-х годов дополнительные исследования показали положительный эффект системного AZM при дополнительном нехирургическом лечении пародонта (Sefton и др., 1996). Было показано, что при введении в течение всего 3 дней он имеет более высокую концентрацию в жидкости десневой борозды, чем в сыворотке крови, в течение 14 дней после перорального приема. AZM преимущественно поглощается фагоцитами, поэтому его уровень в инфицированных тканях выше, чем в неинфицированных (Gomi 2007, Pin-Chuan Lai 2011).
Роль дополнительного системного введения обоих антибиотиков сравнивали в лечении гиперплазии десен у пациентов с трансплантацией почки, и было показано, что оба антибиотика эффективны в снижении степени разрастания десен. Однако AZM оказал более последовательное воздействие (Chand DH et al. 2004)
Однако AZM оказал более последовательное воздействие (Chand DH et al. 2004)
Haffajee et al. 2007 сравнили действие четырех антибиотиков, включая MET и AZM. Измеряли PPD и уровень клинического прикрепления, включая неглубокие карманы. Они обнаружили большее снижение CAL для MET, чем для AZM. В наших результатах мы обнаружили большее снижение PD карманов 5-6 мм и увеличение общего RAL для MET. AZM показал лучший результат в карманах > 7 мм. Роль дополнительных антибиотиков становится более важной для уменьшения глубоких карманов при лечении рефрактерного пародонтита, в то время как неглубокие карманы (< 6 мм) можно относительно хорошо контролировать с помощью DSRP (Mongardini et al. 19).99). Обеспечивая дополнительный лечебный эффект, особенно при глубоких карманах, системные антибиотики могут снизить потребность в дальнейшем хирургическом лечении (Mombelli A. 2008).
Dastoor et al. 2007 г. обнаружил значительное усиление клинической привязанности у курильщиков, использующих AZM в качестве дополнительной терапии к SRP, по сравнению с контрольной группой (плацебо) — только SRP. Маскаренас и др. 2005 обнаружили, что добавочный AZM в сочетании с SRP повышает эффективность нехирургической пародонтальной терапии в снижении PD и улучшении AL у курильщиков. С обоими дополнительными системными антибиотиками в нашем лечении карманы > 7 мм у курильщиков значительно сократились до 0,1-0,3%. Мы не обнаружили существенных различий в клинических и радиологических результатах для курильщиков, некурящих, частично или полностью приверженных пациентов в обеих группах лечения антибиотиками. .
Маскаренас и др. 2005 обнаружили, что добавочный AZM в сочетании с SRP повышает эффективность нехирургической пародонтальной терапии в снижении PD и улучшении AL у курильщиков. С обоими дополнительными системными антибиотиками в нашем лечении карманы > 7 мм у курильщиков значительно сократились до 0,1-0,3%. Мы не обнаружили существенных различий в клинических и радиологических результатах для курильщиков, некурящих, частично или полностью приверженных пациентов в обеих группах лечения антибиотиками. .
Ограничения исследования
Короткое время клинической оценки, небольшое количество пациентов с полностью податливым рефрактерным пародонтитом (n: 43) и отсутствие контрольной группы, не получавшей антибиотики (плацебо), важны для интерпретации наших результатов. Необходимы дальнейшие исследования пациентов с диабетом и ожирением, а также пациентов с агрессивным пародонтитом.
Выводы
Использование дополнительных AZM или MET в сочетании с FMDSRP оказывает почти такой же клинический эффект на уменьшение глубоких пародонтальных карманов при рефрактерном локализованном тяжелом хроническом пародонтите. Недостатки МЕТ (неврологические и желудочно-кишечные нежелательные реакции, длительное время приема, что может привести к плохой комплаентности и взаимодействие с алкоголем) и преимущества АЗМ (лучший результат в уменьшении глубоких карманов, короткое время применения) , отсутствие взаимодействия с алкоголем) делают комбинацию AZM с FMDSRP короткой, простой в применении, надежной и привлекательной альтернативой дополнительному лечению антибиотиками рефрактерного хронического периодонтита.
Недостатки МЕТ (неврологические и желудочно-кишечные нежелательные реакции, длительное время приема, что может привести к плохой комплаентности и взаимодействие с алкоголем) и преимущества АЗМ (лучший результат в уменьшении глубоких карманов, короткое время применения) , отсутствие взаимодействия с алкоголем) делают комбинацию AZM с FMDSRP короткой, простой в применении, надежной и привлекательной альтернативой дополнительному лечению антибиотиками рефрактерного хронического периодонтита.
Практическое значение: присутствие полезных видов бактерий может подавлять активность патогенов, особенно у солдат в боевых условиях. Может оказаться выгодным устранить только определенные бактерии-мишени. Наши результаты пропагандируют дополнительное использование системных антибиотиков узкого спектра действия для пародонтальной терапии (Mombelli 2008). Основываясь на этой концепции, перед использованием антибиотиков в терапии заболеваний пародонта для достижения состояния зубов было бы полезно провести микробиологический скрининг.
Адрес для корреспонденции:
Старший лейтенант Альмир Кашта, доктор медицинских наук
Центральный госпиталь Вооруженных сил Германии,
Центр стоматологических специальностей
Отделение VII A — Пародонтология
Ruebenacherstr. 170,
D- 56072 Кобленц
Кашта, Алмир 1, 2, Тирбах, Рене. 2, Mueller, Sabine 2, Eger, Thomas2
1. Вооруженные силы Албании, медицинская служба
2. Центральный госпиталь вооруженных сил Германии, отделение VII A Пародонтология, Ruebenacherstr. 170, D- 56072 Кобленц
Авторы заявляют об отсутствии конфликта интересов. Это исследование финансировалось авторами и их учреждениями. Мнения, выраженные в этой статье, принадлежат авторам и не могут быть истолкованы как отражающие точку зрения Медицинской службы Вооруженных сил Германии, Вооруженных сил Германии в целом или Министерства обороны Германии.
Биографическая справка Лейтенант Альмир Кашта. Медицинская служба албанских вооруженных сил
Медицинская служба албанских вооруженных сил
1997 Медицинская академия Салоники-Греция, 1998 Университет «Аристотель» в Салониках – Медицинский факультет/Стоматологическая школа, 2004 г. Второй лейтенант Медицинская служба вооруженных сил Албании, 2004 г. Обучение челюстно-лицевой хирургии 401 Общевойсковой госпиталь Афины, Греция, 2005 г. Командование тылового обеспечения – Медицинское отделение Тирана Албания, 2006 г. Госпиталь Центрального военного университета Тирана Албания, 2007 г. Повышение до 1-го лейтенанта, 2010 г. Обучение пародонтологии, Центр стоматологических специальностей, Центральный госпиталь Вооруженных сил Германии, Кобленц, Германия.
Дата: 08.12.2011
Источник: MCIF 4/11
Лечение антибиотиками | Plano, TX
Заболевание пародонта — это прогрессирующее заболевание, которое, если его не лечить, приводит к сильному воспалению и потере зубов. Лечение антибиотиками можно использовать в сочетании с удалением зубного камня и планированием корней, кюретажем, хирургическим вмешательством или в качестве самостоятельного лечения, чтобы помочь уменьшить количество бактерий до и/или после многих распространенных пародонтологических процедур.
Лечение антибиотиками бывает нескольких различных типов, включая пероральные формы и гели для местного применения, которые наносят непосредственно на десневые карманы. Исследования показали, что в случае острой пародонтальной инфекции, рефрактерного пародонтита, препубертатного пародонтоза и ювенильного пародонтита лечение антибиотиками было невероятно эффективным.
Антибиотики могут быть назначены в низкой дозе для более длительного применения или в качестве краткосрочного лекарства для предотвращения повторной колонизации бактерий.
Пероральные антибиотики
Пероральные антибиотики, как правило, влияют на весь организм, и их назначают реже, чем гель для местного применения. Вот некоторые конкретные сведения о нескольких различных типах пероральных антибиотиков:
-
Антибиотики тетрациклинового ряда – Антибиотики, включающие гидрохлорид тетрациклина, доксициклин и миноциклин, являются основными препаратами, используемыми при лечении пародонтита.
 Они обладают антибактериальными свойствами, уменьшают воспаление и блокируют коллагеназу (белок, разрушающий соединительную ткань).
Они обладают антибактериальными свойствами, уменьшают воспаление и блокируют коллагеназу (белок, разрушающий соединительную ткань).
-
Макролидные антибиотики – Эта группа антибиотиков доказала свою эффективность в уменьшении воспаления, а также может уменьшить рост бактерий, связанных с пародонтитом.
-
Метронидазол – Этот антибиотик обычно используется в сочетании с амоксициллином или тетрациклином для борьбы с воспалением и ростом бактерий при тяжелом или хроническом пародонтите.
Гели и полоски для местного применения
Самым большим преимуществом прямой доставки антибиотиков к поверхности десен является то, что они не затрагивают весь организм. Гели для местного применения и методы прямой доставки, как правило, предпочтительнее их пероральных аналогов, и они чрезвычайно эффективны при использовании после процедур скейлинга и полировки корней. Вот некоторые из наиболее часто используемых антибиотиков прямого действия:
Вот некоторые из наиболее часто используемых антибиотиков прямого действия:
-
Атридокс ® – Этот гель с доксициклином повторяет контуры поверхности десен и затвердевает на них. В течение нескольких дней этот гель постепенно высвобождает антибиотик.
-
PerioChip ® – Этот чип помещается в фактический десневой карман после процедуры полировки корней. PerioChip® медленно высвобождает хлоргексидин, мощный антибактериальный антисептик. PerioChip ® уменьшает глубину кармана в большинстве случаев у пациентов, страдающих пародонтитом.
-
Actisite ® – Эта тонкая полоска похожа на зубную нить и содержит гидрохлорид тетрациклина. Нить временно помещают непосредственно между зубом и десной, чтобы убить бактерии и уменьшить глубину десневых карманов. Иногда накладывают несколько нитей примерно на 10 дней, чтобы усилить действие антибиотика.