Периодонтит молочных зубов у детей – симптомы и лечение
Периодонтит у детей – воспалительное заболевание, которое поражает ткани вокруг корня и сопровождается разрушением прилегающей костной ткани. По МКБ-10 ему присвоены коды К 04.4 – острый периодонтит, и К 04.5 – хронический периодонтит.
Часто это заболевание является осложнением глубокого кариеса, а также травм. Дети находятся в группе риска по развитию периодонтита, поскольку ткани, окружающие корни зубов, физиологически нестабильны, а кариес развивается быстрее и поражает глубокие ткани зуба.
Причины периодонтита
В целом риск развития периодонтита у детей выше. Это связано с тем, что околозубные ткани более рыхлые, богаты кровеносными сосудами, в связи с чем воспаление распространяется быстро.
Самой распространенной причиной детского периодонтита является кариес. Эмаль молочных зубов тоньше и менее минерализована, поэтому начавшись, кариес сравнительно быстро прогрессирует и распространяется вглубь. Сначала поражаются мягкие ткани зуба – воспаляется пульпа, а после происходит инфицирование и околозубных тканей, когда воспалительный процесс выходит за пределы верхушки корня. Провоцирующим фактором могут быть и другие причины:
Сначала поражаются мягкие ткани зуба – воспаляется пульпа, а после происходит инфицирование и околозубных тканей, когда воспалительный процесс выходит за пределы верхушки корня. Провоцирующим фактором могут быть и другие причины:
- механические травмы;
- неправильно проведенное эндодонтическое лечение;
- очаги инфекции, находящиеся вблизи челюстей (например, лимфаденит, аденоидит).
Следует отметить, что травма может быть связана не только с ударом или некорректно проведенным лечением. Иногда периодонтит развивается на фоне неудачного надкусывания твердой пищи и развития пульпита.
Формы периодонтита
По характеру течения выделяют острый и хронический периодонтит. Но на практике детский стоматолог редко сталкивается с первым видом, в основном только с обострением хронического.
По природе происхождения выделяют инфекционный периодонтит, а также травматический и медикаментозный. Первый связан с проникновением в околозубные ткани инфекции, что, как правило, объясняется кариозным разрушением зуба.
Травматический сопряжен с механическим повреждением, а медикаментозный может быть следствием воздействия медикаментов при некорректном эндодонтическом или ином лечении.
По форме протекания выделяют серозный, гнойный, фиброзный и гранулирующий периодонтит.
Симптомы развития периодонтита
При остром периодонтите отмечаются следующие симптомы:
- постоянная, четко локализованная боль в области одного зуба, которая усиливается при надкусывании им или прикосновении;
- ощущение «выросшего» зуба, который мешает, словно появилось инородное тело;
- покраснение, отек десны;
- иногда развивается лимфаденит – увеличение, воспаление подчелюстных и подбородочных лимфатических узлов.
При хроническом периодонтите у ребенка проявления более стертые. Дети часто не предъявляют никаких жалоб, но во время обострения появляются проявления острого воспаления. Иногда при хронической форме болезни появляются эпизоды незначительного дискомфорта, умеренная боль вокруг зуба. При осмотре можно заметить больной зуб – обычно он или поражен кариесом, или уже был пролечен ранее.
При осмотре можно заметить больной зуб – обычно он или поражен кариесом, или уже был пролечен ранее.
Возможные осложнения
Острый периодонтит, который не вылечили вовремя, трансформируется в хронический. Последний, в свою очередь, может протекать в разных формах. Одной из них является гранулирующий периодонтит. При нем формируется гранулема – воспалительное образование на верхушке корня, которое разрушает зачаток постоянного зуба, может стать причиной проблем со сменой прикуса.
Смещение зачатков зубов приводит к нарушениям прорезывания, ретенции или дистопии зубов. Зачаток постоянного зуба и вовсе может погибнуть, что впоследствии приведет к необходимости протезирования.
Периодонтиты у детей вызывают разрушению тканей. В результате может формироваться кистозная полость, фистула, которая открывается на десне. При поражении постоянных зубов у подростков нарушается формирование и минерализация тканей, может развиться гипоплазия эмали. Коронки теряют свой внешний вид, появляются неприятные ощущения при жевании и психологический дискомфорт.
К более грозным осложнениям относят разрушение костной ткани, развитие флюса, или периостита, а также остеомиелита, образование кист и свищей. Может развиться абсцесс или флегмона, что грозит сепсисом. Поэтому важно своевременно обратиться к стоматологу при наличии характерных жалоб.
Диагностика детского периодонтита
Основную информацию о состоянии полости рта врач-стоматолог получит при осмотре. При подозрении на периодонтит он отметит признаки кариозного поражения или следы проведенного лечения, например, частично разрушенную или выпавшую пломбу.
Также стоматолог простукает причинный зуб, процедура обычно не сопровождается болью. К внешним диагностическим критериям относят также красноту и отечность десны, иногда обнаруживается свищ с отделяемым.
Уточнить вид периодонтита можно с помощью рентгенографии зуба и окружающих его тканей, то есть прицельного снимка. Как правило, этих мероприятий достаточно для постановки точного диагноза.
Особенности лечения
Лечение периодонтита молочных зубов связано с рядом трудностей: обычно диагностика затруднена поздним обращением, когда болезнь уже перешла в хроническую форму. С маленьким пациентом может быть сложно договориться, он неусидчив или капризничает, не выдерживает длительных процедур.
С маленьким пациентом может быть сложно договориться, он неусидчив или капризничает, не выдерживает длительных процедур.
Чтобы повысить успех лечения, детский стоматолог назначит комплексную терапию в несколько посещений. Обычно достаточно трех визитов к врачу.
Выделяют следующие этапы лечения, они же являются и визитами в стоматологический кабинет:
1. Вскрытие полости, удаление размягченных кариесом тканей зуба. Инструментальная и антисептическая обработка.
2. Ревизия очага поражения, установка временной пломбы.
3. Обработка каналов корня рассасывающейся пастой, установка изолирующей прокладки и постоянное пломбирование.
Следует помнить, что такие манипуляции, как вскрытие полости зуба, препарация проводятся под местным обезболиванием. Если маленький пациент боится лечения, может применяться и седация. Она позволяет успокоить ребенка и обеспечить нормальный эмоциональный фон во время лечения, при этом ребенок находится в сознании.
Между визитами проходит обычно от 3 до 7 дней. В это время необходимо принимать назначенные специалистом медикаменты. Например, чтобы устранить воспалительный процесс и справиться с патогенными микроорганизмами, врач назначит ротовые ванночки с антисептическими растворами. При сильной боли специалист назначит обезболивающие препараты из группы нестероидных противовоспалительных средств.
В это время необходимо принимать назначенные специалистом медикаменты. Например, чтобы устранить воспалительный процесс и справиться с патогенными микроорганизмами, врач назначит ротовые ванночки с антисептическими растворами. При сильной боли специалист назначит обезболивающие препараты из группы нестероидных противовоспалительных средств.
Следует помнить, что периодонтит не всегда требует проведения лечения. Иногда зуб целесообразно удалить, и вот в каких случаях:
- Рассасывание корня на 2/3 его длины. Это значит, что молочному зубу осталось служить недолго, и смысла его лечить и сохранять просто нет, скоро произойдет естественная смена.
- Распространение воспалительного процесса с молочного зуба на зачаток постоянного. В таком случае причинный зуб удаляют и проводят противовоспалительную терапию для сохранения постоянного.
- Неудовлетворительные результаты проведенного лечения.
И на время лечения, в том числе между посещениями, а также после удаления врач порекомендует соблюдать щадящую диету. Нужно исключить сильные жевательные нагрузки на больной зуб, есть пищу комфортной температуры.
Нужно исключить сильные жевательные нагрузки на больной зуб, есть пищу комфортной температуры.
Прогноз и профилактика
Полное выздоровление при грамотном лечении периодонтита у детей возможно, если нет осложнений и необратимого поражения корневой системы. Если же гранулематозный периодонтит протекает долгое время, прогнозы не столь благоприятны – могут развиваться нарушения формирования зачатков постоянных зубов, гипоплазия эмали.
Профилактика периодонтита основывается главным образом на профилактике кариеса: необходимо соблюдать гигиену полости рта, регулярно посещать стоматолога и проводить гигиеническую чистку зубов.
Важно включать в рацион ребенка твердые овощи и фрукты для самоочищения полости рта, ограничить простые углеводы, следить, чтобы он тщательно очищал зубы от мягкого налета. При появлении признаков кариеса следует как можно раньше показать ребенка врачу – раннее лечение позволит предотвратить осложнения кариеса в виде пульпита и последующего развития периодонтита.
УСОВЕРШЕНСТВОВАНИЕ ОРГАНИЗАЦИИ РАБОЧЕГО ВРЕМЕНИ ВРАЧА-СТОМАТОЛОГА-ХИРУРГА ПО ВЕДЕНИЮ МЕДИЦИНСКОЙ ДОКУМЕНТАЦИИ. — Научная Конференция, Симпозиум, Конгресс на Проекте SWorld — Апробация, Сборник научных трудов и Монография — Россия, Украина, Казахстан, СНГ
Салахутдинова Г. Р., Садыков А. Р., Малышев Н. В., Ахметов И. И.,
Усовершенствование организации рабочего времени врача-стоматолога-хирурга по ведению медицинской документации.
ОАО «Стоматологическая поликлиника №9 АЗИНО» г. Казань
Эта работа посвящена оптимизации ведения медицинской документации на амбулаторном приеме врача-стоматолога-хирурга
Ключевые слова: хирургическая стоматология, международная классификация болезней (МКБ-10), вкладыш хирургического отделения к форме №043/у.
This work is devoted to the optimization of medical documentation at the out-patient reception of the doctor-stomatologist-surgeon
Key words: dental surgery, the international classification of diseases (ICD-10), insert the surgery department of the form 043/у.
В целях сокращения времени на заполнение медицинской документации в сети клиник ОАО «Стоматологическая поликлиника №9» г. Казани были разработаны и внедрены в деятельность вкладыши к медицинской документации формы №043/у, утвержденной Минздравом СССР 04.10.1980 №1030, по нозологиям: кариес, пульпит, периодонтит. Внедрение данных вкладышей позволило сократить время на оформление медицинской карты для врачей-стоматологов-терапевтов.
Исходя из вышеизложенного, а так же учитывая пожелания и рекомендации врачей-стоматологов-хирургов, нами были разработаны вкладыши хирургического отделения к форме № 043/у по следующим нозологиям: периодонтит, пародонтит, альвеолит.
Вкладыш к форме № 043/У, утв. Минздравом СССР 04.10.1980 № 1030 по нозологии-периодонтит.
Дата «_____»_______________20___г. Первично Повторно
Жалобы: нет, на разрушение зуба, боли при накусывании, на самопроизвольные ноющие боли в течение____________. Припухлость в области верхней, нижней челюсти справа, слева. Нарушение общего самочувствия, повышение температуры тела.
Нарушение общего самочувствия, повышение температуры тела.
Зубная формула:
8 7 6 5 4 3 2 1 1 2 3 4 5 6 7 8
Объективно: лицо симметричное, асимметричное, имеется отек мягких тканей в области________________________________.Температура тела_______. Открывание рта свободное, затруднено. Лимфоузлы: поднижнечелюстные_________________пальпируются, не пальпируются, болезненны, безболезненны. Зуб____ интактен, под пломбой, разрушен на 1/2, 2/3, полностью.
Зондирование безболезненное _______________________
Перкуссия безболезненная, болезненная (горизонтальная, вертикальная)_______________
Реакция на термический раздражитель: безболезненная, болезненная_______________
Слизистая в области___________зуба (зубов) отечна, гиперемирована, болезненна при пальпации, в проекции верхушки корня____ зуба определяется свищевой ход с гнойным содержимым, слизистая оболочка бледно-розового цвета, безболезненна при пальпации_____________________________________
Элетроодонтометрия______________________________________________
Рентгенография_____зуба______________________________________________________________________________________________________________
Диагноз:___________зуб.
Острый серозный периодонтит (МКБ-10, К04.4)
Острый гнойный периодонтит (МКБ-10,К04.4)
Хронический фиброзный периодонтит (МКБ-10,К04.5)
Хронический гранулирующий периодонтит (МКБ-10,К04.6)
Хронический гранулематозный перидонтит (МКБ-10,К04.1)
Обострение верхушечного периодонтита (МКБ-10,К04.4)
Корневая киста (МКБ-10,К04.8)
Периостит (МКБ-10,К10.23)
Хронический периостит челюсти (МКБ-10,К10.23)
Лечение:_________зуб, анестезия (аппликационная, инфильтрационная, проводниковая (внутриротовая, внеротовая))___________________, удаление простое, сложное________________, кюретаж. По переходной складке в области__________зубов произведен разрез, медикаментозная обработка_______________, дренирование____________.Наложены _____ шов (швы)______________.Гемостаз. Рекомендации__________________________________________________________________________________________________________________________________________________________________________________________.
Вкладыш к форме № 043/У, утв. Минздравом СССР 04.10.1980 № 1030 по нозологии-пародонтит
Дата «____»______________20__г. Первично Повторно
Жалобы: нет, на подвижность зуба (зубов), на самопроизвольные ноющие боли, припухлость десны.
Зубная формула:
8 7 6 5 4 3 2 1 1 2 3 4 5 6 7 8
Объективно: лицо симметричное, асимметричное, имеется отек мягких тканей в области________________________________. Температура тела______. Открывание рта свободное, затруднено. Лимфоузлы: поднижнечелюстные_________________пальпируются, не пальпируются, болезненны, безболезненны. Зуб____ интактен, под пломбой, разрушен на 1/2, 2/3, полностью. Подвижность II, III степени. Оголение корня на 1/3, 2/3, на всю длину.
Зондирование безболезненное______________________________________
Перкуссия безболезненная, болезненная (вертикальная, горизонтальная) __________________________________________________________________
Реакция на термический раздражитель: безболезненная, болезненная __________________________________________________________________
Слизистая в области___________зуба (зубов) отечна, гиперемирована, болезненна при пальпации. Пародонтальный карман отсутствует, 3-5 мм, 5-8 мм с гнойным отделяемым. Определяется свищевой ход. Слизистая оболочка бледно-розового цвета, безболезненна при пальпации______________________
Пародонтальный карман отсутствует, 3-5 мм, 5-8 мм с гнойным отделяемым. Определяется свищевой ход. Слизистая оболочка бледно-розового цвета, безболезненна при пальпации______________________
Электроодонтометрия_____________________________________________
Рентгенография_______________________________________________________________________________________________________________________
Диагноз:________ зуб.
Острый пародонтит (МКБ-10, К05.2)
Периодонтальный абсцесс (пародонтальный абсцесс) десневого происхождения без свища (МКБ-10, К05.20)
Периодонтальный абсцесс (пародонтальный абсцесс) десневого происхождения со свищом (МКБ-10, К05.21)
Острый перикоронит (МКБ-10, К05.22)
Хронический пародонтит (МКБ-10, К05.3)
Хронический пародонтит. Локализованный (МКБ-10, К05.30)
Хронический пародонтит. Генерализованный (МКБ-10, К05.31)
Хронический перикоронит (МКБ-10, К05.32)
Пародонтоз (МКБ-10, К05.4)
Лечение:_________зуб, анестезия (аппликационная, инфильтрационная, проводниковая (внутриротовая, внеротовая)) __________________, удаление простое, сложное________, кюретаж. По переходной складке в области__________зубов произведен разрез, медикаментозная обработка_______________, дренирование ____________. Наложены _____ шва (швов)______________. Гемостаз.
По переходной складке в области__________зубов произведен разрез, медикаментозная обработка_______________, дренирование ____________. Наложены _____ шва (швов)______________. Гемостаз.
Рекомендации__________________________________________________________________________________________________________________________________________________________________________________________
Вкладыш к форме № 043/У, утв. Минздравом СССР 04.10.1980 № 1030 по нозологии-альвеолит
Дата «____»______________20__г. Первично Повторно
Жалобы: на боли в области удаленного зуба, припухлость в области верхней, нижней челюсти справа, слева. Нарушение общего самочувствия, повышение температуры тела.
Зубная формула:
8 7 6 5 4 3 2 1 1 2 3 4 5 6 7 8
Объективно: лицо симметричное, асимметричное, имеется отек мягких тканей в области________________________________. Температура тела______. Открывание рта свободное, затруднено. Лимфоузлы: поднижнечелюстные______________пальпируются, не пальпируются, болезненны, безболезненны. Лунка удаленного____зуба покрыта грязно-серым налетом с гнилостным запахом.
Лунка удаленного____зуба покрыта грязно-серым налетом с гнилостным запахом.
Слизистая в области удаленного______зуба (зубов) отечна, гиперемирована, болезненна при пальпации.
Рентгенография_______________________________________________________________________________________________________________________
Диагноз:________ зуб.
Альвеолит челюстей (МКБ-10, К10.3)
Лечение: анестезия (аппликационная, инфильтрационная, проводниковая (внутриротовая, внеротовая))_________________, кюретаж.
Медикаментозная обработка 0,05% р-ром хлоргексидина ______________, альвостаз, рекомендации_____________________________________________ ______________________________________________________________________________________________________________________________________________________________________________________________________
Заключение.
Целью внедрения данных вкладышей к медицинской документации формы 043/У является сокращение времени, затрачиваемого на вспомогательную деятельность (подготовка к манипуляциям и процедурам, работа с учетно-отчетной медицинской документацией и т. д.), и вследствие – увеличение времени на основные виды деятельности (время контакта персонала с больным)
д.), и вследствие – увеличение времени на основные виды деятельности (время контакта персонала с больным)
Литература:
1. Зарипова Э. М. Организационно-методическое совершенствование профилактической работы врача-стоматолога-терапевта / Э. М. Зарипова, Э. Н. Мингазова, Шулаев А. В., Греков А. Х. — К.: УЗ ИКМО, 2009. – 13 с.
2. Робустова Т. Г. Хирургическая стоматология / Т. Г. Робустова, И. С. Карапетян, И. Ф. Ромачева [и др.] — М.: Медицина, 1996. – 688 с.
3. Международная классификация стоматологических болезней на основе МКБ-10: пер. с англ. / А. С. Григорян [и др.]. — 3 –е изд. – Женева, 1997. – 127 с.
Микробная флора при хроническом пародонтите: исследование в Центре третичной медицинской помощи в Северной Карнатаке
J Lab Physicians. 2015 январь-июнь; 7(1): 49–54.
doi: 10.4103/0974-2727.154798
, , 1 , 2 и 1
в Индии с распространенностью 60–80%. При отсутствии лечения действует как фактор риска системных заболеваний. Данные об анаэробной микрофлоре пародонта у населения Индии очень скудны. Следовательно, это исследование было предпринято, чтобы узнать природу микробиоты полости рта при хроническом пародонтите в этом регионе Индии, а также провести полуколичественное исследование в группе до и после лечения, а также определить характер чувствительности к антибиотикам аэробных изолятов.
При отсутствии лечения действует как фактор риска системных заболеваний. Данные об анаэробной микрофлоре пародонта у населения Индии очень скудны. Следовательно, это исследование было предпринято, чтобы узнать природу микробиоты полости рта при хроническом пародонтите в этом регионе Индии, а также провести полуколичественное исследование в группе до и после лечения, а также определить характер чувствительности к антибиотикам аэробных изолятов.
Материалы и методы:
Настоящее исследование было проведено на 60 случаях. Материал забирали из поддесневых карманов у больных хроническим пародонтитом, обратившихся в поликлинику пародонтологии. Клинические образцы доставляли в лабораторию в жидкой тиогликолевой среде. Первоначально были проведены окрашивание по Граму и окрашивание по Фонтана. Высаживали аэробные, анаэробные и микроаэрофильные культуры. Для аэробных изолятов был проведен тест на чувствительность к антибиотикам.
Результаты:
Шестьдесят образцов дали 121 изолят, из которых 78,34% были полимикробными, 11,66% были мономикробными, а оральные комменсалы были выращены в 10% случаев. Из 121 изолята 91,74% были анаэробными, 7,43% — аэробными и 0,83% — микроаэрофильными. видов Fusobacterium был наиболее распространенным изолятом среди анаэробов. При использовании «парного теста t » значение « P » было значимым, что указывало на значительное снижение количества колоний после пародонтальной терапии фазы I.
Из 121 изолята 91,74% были анаэробными, 7,43% — аэробными и 0,83% — микроаэрофильными. видов Fusobacterium был наиболее распространенным изолятом среди анаэробов. При использовании «парного теста t » значение « P » было значимым, что указывало на значительное снижение количества колоний после пародонтальной терапии фазы I.
Заключение:
Это исследование показало, что анаэробные бактерии являются важной причиной хронического периодонтита, наряду с аэробами и микроаэрофильными организмами. Fusobacterium spp , Bacteroides fragilis , Porphyromonas spp и Prevotella intermedia являются наиболее распространенными анаэробными патогенами. Методы бактериального культивирования по-прежнему являются экономичными и золотым стандартом.
Ключевые слова: Аэробы, анаэробы, микробная флора полости рта, пародонтит, поддесневой налет
Симбиоз представляет собой тесную связь между хозяином и одной или несколькими колонизирующими бактериями. Люди колонизированы огромным количеством бактерий; в целом кожа, кишечник, мочеполовой тракт и ротовая полость являются типичными местами. Однако ротовая полость является единственным участком тела, где сотрудничество между бактериями и хозяином нарушается. Если не принять надлежащих мер по удалению бактерий зубного налета, полость рта подвержена очень распространенным заболеваниям, таким как кариес и пародонтит.[1]
Люди колонизированы огромным количеством бактерий; в целом кожа, кишечник, мочеполовой тракт и ротовая полость являются типичными местами. Однако ротовая полость является единственным участком тела, где сотрудничество между бактериями и хозяином нарушается. Если не принять надлежащих мер по удалению бактерий зубного налета, полость рта подвержена очень распространенным заболеваниям, таким как кариес и пародонтит.[1]
Пародонтит определяется как воспалительное заболевание опорных тканей зубов, вызванное определенными микроорганизмами или группой определенных микроорганизмов, приводящее к прогрессирующему разрушению периодонтальной связки и альвеолярной кости с образованием карманов, рецессией или тем и другим [2]. Распространенность заболевания составляет 13–57% во всем мире и 65–80% в Индии, что является серьезной проблемой для здоровья [3,4] 9.0003
Исследование секвенирования бактериальной ДНК показало, что в полости рта существует около 19 000 бактериальных филотипов. Около 500 бактериальных штаммов были выделены из поддесневого налета, но лишь небольшое их число является потенциальными патогенами.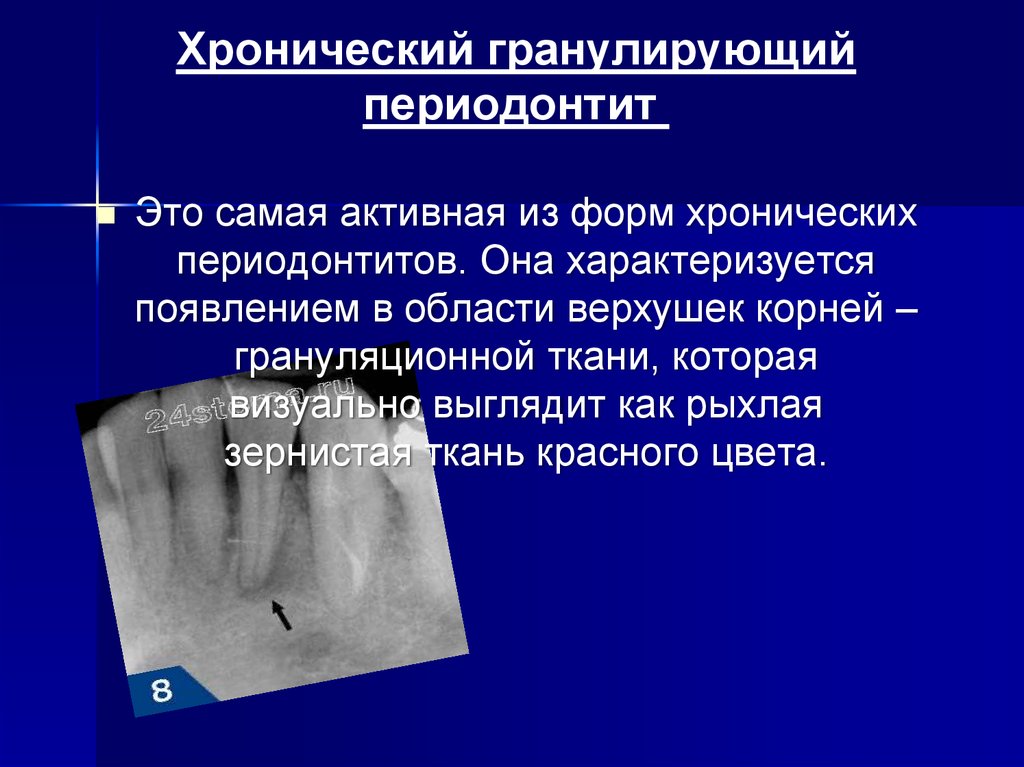 [5]
[5]
Иммунологический анализ, оценка с помощью ДНК-зондов, обнаружение бактериальных ферментов и посев — это методы, доступные для выделения бактерий полости рта, среди которых посев остается экономичным и золотым стандартом.[6]
В западном мире имеется большое количество исследований микробиоты полости рта как в норме, так и при пародонтите, но данные об анаэробной пародонтальной микрофлоре у населения Индии очень скудны. Следовательно, исследование было предпринято для выделения и идентификации преобладающей аэробной и анаэробной микрофлоры, связанной с генерализованным пародонтитом взрослых, полуколичественного исследования изолированной микрофлоры генерализованного пародонтита взрослых в группах до лечения и после лечения, а также для изучения картины чувствительности аэробных изолятов к антибиотикам в группе до лечения.
Это исследование было проведено в отделении микробиологии клинической больницы третичного уровня. Образцы были взяты из поддесневых карманов у пациентов с хроническим пародонтитом, посещающих амбулаторное пародонтологическое отделение нашего Института стоматологических наук, в течение 1 года с января по декабрь 2010 года. Исследование включало 60 случаев (размер выборки был рассчитан по формуле ). 4pq/d 2 , где p — распространенность, q — 100- p и d составляет 10% ошибки).
Исследование включало 60 случаев (размер выборки был рассчитан по формуле ). 4pq/d 2 , где p — распространенность, q — 100- p и d составляет 10% ошибки).
Клинически диагностированные все новые случаи хронического пародонтита были включены в исследование, а также пациенты с системными заболеваниями в анамнезе, такими как сахарный диабет, дефицит питательных веществ, беременные женщины, прием антибиотиков в течение последних 3 месяцев и пациенты, перенесшие какие-либо стоматологические процедуры в анамнезе последние 3 месяца были исключены. Образцы собирали дважды, то есть в периоды до лечения и после лечения после фазы I терапии (скейлинг и планирование корня [SRP] вместе с амоксициллином и метронидазолом в течение 1 недели).
Сбор образцов
Поверхности зубов высушивали стерильной марлей, чтобы избежать загрязнения слюной. Образец поддесневого налета был взят из большинства патологических участков с помощью стерильной пародонтальной кюретки Грейси, помещен в жидкую тиогликолевую среду в пробирку и доставлен в микробиологическую лабораторию для немедленной обработки.
Лабораторные методы
В лабораторной пробе в жидкой тиогликолевой среде переносили 1 мл триптиказо-соевого бульона и встряхивали в течение 1 мин. Прямые мазки были приготовлены из образцов, а затем были применены модификация Хакера по Граму для анаэробов и модифицированные методы окрашивания Фонтана. (SBA), агар Макконки (MA), агар с инфузией мозга и сердца и кровяной агар с добавлением гемина и витамина К, канамицин-ванкомициновый лакированный кровяной агар (KVLB) и бактероидный желчно-эскулиновый агар (BBE). Выращивали на лужайке, и чашки инкубировали при 37°C в течение 24 часов в аэробных условиях (MA, SBA) при 5% CO 2 (БАД и БХИ) и анаэробно (ББК с добавлением витамина К и гемина, КВЛБ, ББЭ). Все аэробные изоляты были идентифицированы и охарактеризованы биохимически с помощью стандартных процедур, описанных Макки и Маккартни в области практической медицинской микробиологии.[9]
Выделение анаэробных микроорганизмов
Полуколичественную оценку микроорганизмов проводили путем подсчета количества колоний и учета значительного числа колоний (>50 колоний) с последующим пересевом на ВВА. Из чистоты колоний на чашках с БА регистрировали морфологию, пигмент, гемолиз, флуоресценцию и питтинг и проводили окрашивание по Граму (модифицированное для анаэробных), точечный тест на индол и тесты на каталазу. Дальнейшая идентификация проводилась с использованием диска с полинетенолсульфонатом натрия, диска с нитратом, дисков с канамицином (1 мг), ванкомицином (5 мкг) и колистином (10 мкг). Метод, используемый для получения анаэробиоза в банке, представлял собой «внутреннюю газогенерирующую систему», описанную Вайдхьялингамом и Лакшминараяной.[10]
Из чистоты колоний на чашках с БА регистрировали морфологию, пигмент, гемолиз, флуоресценцию и питтинг и проводили окрашивание по Граму (модифицированное для анаэробных), точечный тест на индол и тесты на каталазу. Дальнейшая идентификация проводилась с использованием диска с полинетенолсульфонатом натрия, диска с нитратом, дисков с канамицином (1 мг), ванкомицином (5 мкг) и колистином (10 мкг). Метод, используемый для получения анаэробиоза в банке, представлял собой «внутреннюю газогенерирующую систему», описанную Вайдхьялингамом и Лакшминараяной.[10]
Тест на чувствительность к антибиотикам
Тест на чувствительность к противомикробным препаратам был проведен для аэробных изолятов методом дисковой диффузии, как описано Кирби и Бауэром, на агаре Мюллера-Хинтона.[9]
Статистический анализ
Статистический анализ проводили с использованием «парного t -теста», сравнивая две группы.
Всего было взято 120 образцов (60 до лечения и 60 после лечения) у 60 пациентов. Наши случаи варьировались от 22 до 70 лет, максимальное количество случаев (22) было в возрастной группе 38–47 лет и наименьшее (1) в возрастной группе 68–77 лет. Из 60 случаев 33 (55%) были женщинами и 27 (45%) мужчинами. В 60 образцах был выделен 121 изолят, из которых 47 (78,34%) были полимикробными, 7 (11,66%) мономикробными и оральные комменсалы выращены в 6 (10%) случаях.
Наши случаи варьировались от 22 до 70 лет, максимальное количество случаев (22) было в возрастной группе 38–47 лет и наименьшее (1) в возрастной группе 68–77 лет. Из 60 случаев 33 (55%) были женщинами и 27 (45%) мужчинами. В 60 образцах был выделен 121 изолят, из которых 47 (78,34%) были полимикробными, 7 (11,66%) мономикробными и оральные комменсалы выращены в 6 (10%) случаях.
Из 47 полимикробных изолятов 27 (57,45%) были комбинацией 2 изолятов и 20 (42,55%) были комбинацией 3 изолятов. Из 121 изолята 111 (91,74%) были анаэробными, 9 (7,43%) — аэробными и 01 (0,83%) — микроаэрофильными.
Из 111 анаэробных изолятов 87 (78,4%) были грамотрицательными бациллами (ГНБ) и 24 (21,6%) были грамположительными кокками (ГПК). Среди GNB наиболее распространенным изолятом был вид Fusobacterium []. Из 24 GPC, Micromonas micros были наиболее распространенным изолятом 17 (70,83%), за ним следовали Peptostreptococcus anaerobius 4 (16,67%), Schleiferella asaccharolytica 2 (8,33) и Streptococcus mutans 1 (4,17%).
Открыть в отдельном окне
Анаэробные грамотрицательные палочки
Аэробные изоляты представляли собой Staphylococcus aureus, Streptococcus pneumoniae и Klebsiella pneumoniae по три штуки. Характер чувствительности аэробных изолятов к антибиотикам показан на рис. Единственным выделенным микроаэрофильным организмом был Aggregatibacter actinomycetemcomitans []. Спирохеты ( Treponema denticola ) были обнаружены в 19 (31,66%) случаях при модифицированном окрашивании Фонтана из прямых мазков образцов зубного налета. Результат полуколичественного исследования показан на рис.
Таблица 1
Характеристика чувствительности аэробных изолятов к антибиотикам
Открыть в отдельном окне
Открыть в отдельном окне
Микрофотография Aggregatibacter actinomycetemcomitans при малом увеличении показывает центральную колонию в форме звезды
Таблица 2
Результаты полуколичественного исследования
Открыть в отдельном окне пародонтальная терапия I фазы. Парные т = 3,555, Р = 0,001.
Парные т = 3,555, Р = 0,001.
Поиск пародонтальных патогенов продолжается уже более 100 лет и продолжается по сей день. Три фактора, определяющие возникновение активного заболевания пародонта, — это восприимчивый хозяин, наличие патогенных видов и отсутствие так называемых полезных бактерий.[11] Цель настоящего исследования состояла в том, чтобы попытаться понять природу микробных комплексов, существующих в поддесневом налете.
В настоящем исследовании случаи варьировались от 20 до 70 лет с максимальным числом случаев в возрастной группе 38–47 лет. Напротив, Sixou et al .[12] наблюдали случаи пародонтита в возрастной группе 18–52 лет, Antony et al .[13] в возрастной группе 30–60 лет, Kamma et al .[ 14] в возрастной группе 14–35 лет. В литературе существует старая добрая концепция, согласно которой распространенность пародонтита увеличивается с возрастом из-за потери поддержки тканей пародонта, однако максимальное количество случаев в нашем исследовании было во взрослой группе, как наблюдали предыдущие авторы. [15]
[15]
Соотношение мужчин и женщин в нашем исследовании составляло 0,8:1. То есть, женщины были более поражены, чем мужчины, как это наблюдалось в исследованиях Sixou et al ., [12] Салари и Кадхода [16] Daniluk et al ., [5] Nonnenmacher et al .[17] и Socransky et al .[6] В отличие от исследования, проведенного Sixou et al .[18] соотношение M:F::1,3:1. Тем не менее, не существует установленной внутренней разницы между мужчинами и женщинами в их предрасположенности к пародонтиту.[15] 78,34% наших изолятов были полимикробными по своей природе по сравнению с 11,06% мономикробных изолятов. Наши наблюдения согласуются с литературными данными [4,12,16,17,19].] Хорошо известна полимикробная природа пародонтального налета. В исследованиях, проведенных Sixou et al [12] Nonenmacher et al [17] Saini et al [4] и Mane et al [19] 97,14%, 100%, 72,28% и 97,3% их изолятов были полимикробными соответственно. В противоположность этому Салари и Кадхода [16] наблюдали, что 18,28% их изолятов были полимикробными.
В противоположность этому Салари и Кадхода [16] наблюдали, что 18,28% их изолятов были полимикробными.
Из 78,34 % полимикробных изолятов 57,44 % представляли собой комбинацию двух изолятов, а 42,55 % — комбинацию трех изолятов. В исследовании, проведенном Saini et al .[4] в Индии они обнаружили два изолята у 91,66% и три у 8,2%. В другом исследовании, проведенном Mane et al. .[19] в Индии наблюдали два изолята в 8%, три и четыре изолята в 40% каждый и пять изолятов в 12%.
Результаты настоящего исследования показывают разнообразие анаэробных бактерий при хроническом пародонтите. Анаэробные бактерии были выделены в 91,74% случаев пародонтита. Различные исследования, проведенные в Индии и других странах, показали, что уровень выделения строгих анаэробов в случаях пародонтита колеблется от 42% до 100% [4,16,19].,20] В двух разных исследованиях, проведенных во Франции, обнаружено 91,42% и 80,77% анаэробных изолятов. В исследовании Mane et al [19] 83% были анаэробами. В то время как исследования, проведенные Салари и Кадхода [16], Данилук и др. [5], Нонненмахер и др. [17] и Сайни и др. [4], выявили сравнительно меньшее количество анаэробов, то есть 41,22 %, 57,1%, 53,84% и 64,25% соответственно. Различная скорость восстановления изоляции может быть связана с различными критериями отбора пациентов, используемым методом культивирования, географическими различиями и молекулярным методом, используемым для идентификации [4,19].]
В то время как исследования, проведенные Салари и Кадхода [16], Данилук и др. [5], Нонненмахер и др. [17] и Сайни и др. [4], выявили сравнительно меньшее количество анаэробов, то есть 41,22 %, 57,1%, 53,84% и 64,25% соответственно. Различная скорость восстановления изоляции может быть связана с различными критериями отбора пациентов, используемым методом культивирования, географическими различиями и молекулярным методом, используемым для идентификации [4,19].]
В настоящем исследовании в случаях пародонтита преобладали грамотрицательные анаэробы (78,4%), чем грамположительные (21,6%). И наши наблюдения сопоставимы с литературными данными. (9,20%) [], Fusobacterium nucleatum (4,60%) и Prevotella spp (9,20%) были наиболее распространенными микроорганизмами, выделенными в нашем исследовании. Другие исследователи выделили аналогичные анаэробы, но в других пропорциях. В индийском исследовании Шайни и др. . [4] сообщили о гораздо большем количестве этих изолятов Porphyromonas spp 40%, P. intermedia 12%, Prevotella видов 14%, Fusobactrium nucleatum 209% и Bacteroides 029% . В другом индийском исследовании Mane et al [19] сообщалось о более высоком количестве P. intermedia (17,6%), F. nucleatum (41%), Fusobacterium spp (29,41%) в соответствии с нашими полученные результаты. Sixou и др. . [18] сообщили о большем количестве P. intermedia (15,78%) и F. nucleatum (7,01%). В то время как Салари и Кадхода [16] и Нонненмахер и др. [17] сообщили о гораздо меньшем количестве этих изолятов. Сравнение спектра анаэробов в разных исследованиях показано на рис. Beena et al [21] пришли к выводу, что по мере прогрессирования инфекции доля анаэробов, особенно GNB, таких как Prevotella , Porphyromonas и Fusobacterium увеличивается.
intermedia 12%, Prevotella видов 14%, Fusobactrium nucleatum 209% и Bacteroides 029% . В другом индийском исследовании Mane et al [19] сообщалось о более высоком количестве P. intermedia (17,6%), F. nucleatum (41%), Fusobacterium spp (29,41%) в соответствии с нашими полученные результаты. Sixou и др. . [18] сообщили о большем количестве P. intermedia (15,78%) и F. nucleatum (7,01%). В то время как Салари и Кадхода [16] и Нонненмахер и др. [17] сообщили о гораздо меньшем количестве этих изолятов. Сравнение спектра анаэробов в разных исследованиях показано на рис. Beena et al [21] пришли к выводу, что по мере прогрессирования инфекции доля анаэробов, особенно GNB, таких как Prevotella , Porphyromonas и Fusobacterium увеличивается.
Таблица 3
Сравнение спектра грамотрицательных анаэробов в литературе
Открыто в отдельном окне
Грамположительные анаэробные кокки составили 21,6% от общего числа анаэробных изолятов в нашем исследовании. Из них M. micros (70,83%) были наиболее распространенными изолятами. Другими GPC, выделенными в нашем исследовании, были P. anaerobius (16,67%), S. asachrolytica (8,33%) и S. mutans 9.0030 (4,17%).
Из них M. micros (70,83%) были наиболее распространенными изолятами. Другими GPC, выделенными в нашем исследовании, были P. anaerobius (16,67%), S. asachrolytica (8,33%) и S. mutans 9.0030 (4,17%).
Saini et al .[4] и Nonnenmacher et al .[17] сообщили о M. micros в 23% и 51% соответственно, что намного ниже, чем в нашем исследовании. Sixou и др. [12] наблюдали 52,94% M. micros , 5,88% P. anaerobius . В другом исследовании Sixou et al [18] было 14,28% каждого из M. micros и P. anaerobius . Салари и Кадхода [16] сообщили о 2,9%, а ван Винкельхофф о и др. . [20] сообщили о 70%, что соответствует нашему исследованию. M. micros считается возбудителем в этиологии смешанных анаэробных инфекций чаще и в повышенном проценте у пациентов с пародонтитом, особенно у лиц с активным заболеванием. [22,23,24,25,26] Наши результаты: в соответствии с предыдущим наблюдением предполагается, что М. micros могут быть связаны с пародонтитом.
micros могут быть связаны с пародонтитом.
В данной группе аэробы составили 7,43%, а Данилюк et al .[5] и Mane et al .[19] выделили 42,9% и 14% аэробов соответственно. Выделенными аэробами были S. aureus (33,33%), S. pneumoniae (33,33%) и K. pneumoniae (33,33%), и наши результаты согласуются с исследованиями Daniluk и др. . [5 ] которые сообщили о видов Staphylococcus (16,66%) и видов Streptococcus (38,88%). Saini et al . [4] сообщили о 42,85% S. aureus 9.0030 и 44,44% Klebsiella spp. . Они также сообщили о Escherichia coli , Pseudomonas spp (14,28%) и неферментирующих (28,5%), которые не наблюдались в нашем исследовании. [4,5]
.actinomycetemcomitans , на долю которого приходится 0,83% всех бактериальных изолятов. Антоний 9 сообщил, что уровень выделения A. actinomycetemcomitans из пародонтита у взрослых составляет 53%. 0029 et al .,[13] 9 % по Nonnenmacher et al .,[17] 20,6 % по Салари и Кадхода[16] и 14,6 % по Saini et al .[4] Эти результаты показывают, что A .actinomycetemcomitans , по-видимому, играет значительную роль в пародонтите наряду с другими анаэробами.
0029 et al .,[13] 9 % по Nonnenmacher et al .,[17] 20,6 % по Салари и Кадхода[16] и 14,6 % по Saini et al .[4] Эти результаты показывают, что A .actinomycetemcomitans , по-видимому, играет значительную роль в пародонтите наряду с другими анаэробами.
Спирохеты, такие как T. denticola , были обнаружены с помощью модифицированного окрашивания Фонтана в 31,66% случаев. В этом исследовании наблюдалось значительное снижение количества бактерий после SRP с P <0,001, как указано в литературе. Два системных обзора показали, что адъювантное системное введение антибиотиков будет иметь лучший результат, чем только SRP. [27,28] Предрасполагающие факторы для пародонтита включают пожилой возраст, предшествующий анамнез пародонтита, курение, стресс, малое количество лекарств, таких как противосудорожные препараты, кальциевые каналы. блокаторы и оральные контрацептивы, системные факторы, такие как ВИЧ, сахарный диабет и гематологические факторы. сахарный диабет и др. [31,32]
сахарный диабет и др. [31,32]
Поскольку концепция стоматологической инфекции является бактериологически неспецифичной и не предлагает обоснования для антимикробного лечения, тщательная оценка и изоляция как аэробов, так и анаэробов имеет первостепенное значение при лечении ородентальной инфекции.[4]
Это исследование показало, что анаэробные бактерии являются важной причиной хронического периодонтита, наряду с аэробами и микроаэрофильными организмами. Культуральные методы по-прежнему экономичны и являются золотым стандартом. Учитывая скудность данных о микробной флоре населения Индии, необходимо провести дальнейшие исследования по оценке микробного профиля при различных формах пародонтита.
Источник поддержки: Нет.
Конфликт интересов: Не объявлено.
1. Нибали Л., Донос Н., Хендерсон Б. Инфектогеномика пародонта. J Med Microbiol. 2009; 58: 1269–74. [PubMed] [Google Scholar]
2. Новак М.Дж. Классификация заболеваний и состояний, поражающих пародонт. В: Newman MG, Takei HH, Klokkevold PR, Carranza FA, редакторы. Клиническая пародонтология Каррансы. 10-е изд. Сент-Луис, штат Миссури: Эльзевир; 2007. стр. 103–4. [Академия Google]
В: Newman MG, Takei HH, Klokkevold PR, Carranza FA, редакторы. Клиническая пародонтология Каррансы. 10-е изд. Сент-Луис, штат Миссури: Эльзевир; 2007. стр. 103–4. [Академия Google]
3. Рылев М., Килиан М. Распространенность и распространение основных патогенов пародонта во всем мире. Дж. Клин Пародонтол. 2008; 35: 346–61. [PubMed] [Google Scholar]
4. Шайни С., Апарна, Гупта Н., Махаджан А., Арора Д.Р. Микробная флора при ородентальных инфекциях. Индийская J Med Microbiol. 2003; 21:111–4. [PubMed] [Google Scholar]
5. Daniluk T, Tokajuk G, Cylwik-Rokicka D, Rozkiewicz D, Zaremba ML, Stokowska W. Аэробные и анаэробные бактерии в поддесневых и наддесневых бляшках у взрослых пациентов с заболеваниями пародонта. Adv Med Sci. 2006; 51 (Приложение 1): 81–5. [PubMed] [Академия Google]
6. Сокрански С.С., Хаффаджи А.Д., Куджини М.А., Смит С., Кент Р.Л., мл. Микробные комплексы в поддесневом налете. Дж. Клин Пародонтол. 1998; 25: 134–44. [PubMed] [Google Scholar]
7. Forbes BA, Sahm DF, Wiessfeld AS. 11-е изд. Сент-Луис, штат Миссури: Mosby, Inc., филиал Elsevier Science; 2002. Диагностическая микробиология Бейли и Скотта. [Google Scholar]
Forbes BA, Sahm DF, Wiessfeld AS. 11-е изд. Сент-Луис, штат Миссури: Mosby, Inc., филиал Elsevier Science; 2002. Диагностическая микробиология Бейли и Скотта. [Google Scholar]
8. Gangadhar NL, Rajashekhar M. Модифицированное окрашивание лептоспир пропиткой серебром. Индийский ветеринар Дж. 1998; 75:349–51. [Google Scholar]
9. Колли Дж. Г., Фрейзер А. Г., Мармион Б. П., Симмонс А. 14-е изд. Черчилль Левингстон: Эльзевир; 2008. Маки и Маккартни Практическая медицинская микробиология. [Google Scholar]
10. Вайдхьялингам К., Лакшминараяна К.С. Система внутреннего газогенератора подходит для создания анаэробиоза. Индийский Дж. Сург. 1980; 42: 154–159. [Google Scholar]
11. Кесич Л., Миласин Дж., Игич М., Обрадович Р. Микробная этиология заболеваний пародонта. Мини-обзор. мед. биол. 2008; 15:1–6. [Академия Google]
12. Sixou JL, Magaud C, Jolivet-Gougeon A, Cormier M, Bonnaure-Mallet M. Микробиология нижнечелюстного перикоронита третьего моляра: Заболеваемость бета-лактамазопродуцирующими бактериями. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2003; 95: 655–9. [PubMed] [Google Scholar]
Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2003; 95: 655–9. [PubMed] [Google Scholar]
13. Энтони Б., Куриан Р., Файзал М., Верма Б.Р., Шивананда П.Г. Actinobacillus actinomycetemcomitans и анаэробы в периодонтите. Индийская J Med Microbiol. 1997; 15:73–76. [Google Scholar]
14. Камма Дж.Дж., Накоу М., Манти Ф.А. Преобладающая микрофлора тяжелых, средних и минимальных поражений пародонта у лиц молодого возраста с быстропрогрессирующим пародонтитом. J Периодонтальная Рез. 1995;30:66–72. [PubMed] [Google Scholar]
15. Kinane DF, Lindhe J, Trombelli L. Хронический периодонтит. В: Линде Дж., Ланг Н.П., Карринг Т., редакторы. Клиническая пародонтология и имплантология. 5-е изд. Том. 1. Оксфорд: Издательство Блэквелл; 2008. С. 398–495. [Google Scholar]
16. Салари М.Х., Кадхода З. Частота культивируемых поддесневых периодонтопатогенных бактерий при хроническом пародонтите. J Устные науки. 2004; 46: 157–61. [PubMed] [Google Scholar]
17. Nonnenmacher C, Mutters R, de Jacoby LF. Микробиологические характеристики поддесневой микробиоты при пародонтите взрослых, локализованном ювенильном пародонтите и быстро прогрессирующем пародонтите. Клин Микробиол Инфект. 2001; 7: 213–7. [PubMed] [Академия Google]
Микробиологические характеристики поддесневой микробиоты при пародонтите взрослых, локализованном ювенильном пародонтите и быстро прогрессирующем пародонтите. Клин Микробиол Инфект. 2001; 7: 213–7. [PubMed] [Академия Google]
18. Sixou JL, Magaud C, Jolivet-Gougeon A, Cormier M, Bonnaure-Mallet M. Оценка флоры перикоронита третьего моляра нижней челюсти и ее чувствительности к различным антибиотикам, назначаемым во Франции. Дж. Клин Микробиол. 2003;41:5794–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Мане А.К., Кармакар А.П., Бхарадвадж Р.С., Ван Винкельхофф А.Дж., Лосс Б.Г., Ван дер Рейден В.А. и др. Porphyromonas gingivalis , Bacteroids forsythus и другие пародонтальные патогены у субъектов с деструкцией пародонта и без нее. Дж. Клин Пародонтолог. 2002;29:1023. [PubMed] [Google Scholar]
20. Van Winkelhoff AJ, Loss BG, Van der Reijden WA, Van der Velden U. Porphyromonas gingivalis , Bacteroids forsythus и другие пародонтальные патогены у субъектов с деструкцией пародонта и без нее. Дж. Клин Пародонтолог. 2002; 29:1023. [PubMed] [Google Scholar]
Дж. Клин Пародонтолог. 2002; 29:1023. [PubMed] [Google Scholar]
21. Бина В.К., Фрэнсис Дж., Бхат М., Котион М., Шивананда П.Г. Анаэробные бактерии при инфекциях пародонта. J Indian Dent Assoc. 1992; 63: 215–9. [Академия Google]
22. Сокранский С.С., Хаффаджи А.Д. Микробные этиологические агенты деструктивных заболеваний пародонта. В: Сокрански С.С., Хаффаджи А.Д., редакторы. Микробиология и иммунология заболеваний пародонта. Оксфорд: Манксгаард, Блэквелл; 1994. С. 78–111. [PubMed] [Google Scholar]
23. Мердок Д.А., Митчелмор И.Дж., Табакчали С. Peptostreptococcus micros при полимикробных абсцессах. Ланцет. 1988; 1:594. [PubMed] [Google Scholar]
24. Moore WE, Moore LH, Ranney RR, Smibert RM, Burmeister JA, Schenkein HA. Микрофлора пародонтальных участков демонстрирует активное деструктивное прогрессирование. Дж. Клин Пародонтол. 1991;18:729–39. [PubMed] [Google Scholar]
25. Rams TE, Feik D, Listgarten MA, Slots J. Peptostreptococcus micros при пародонтите человека. Оральный микробиол иммунол. 1992; 7: 1–6. [PubMed] [Google Scholar]
Оральный микробиол иммунол. 1992; 7: 1–6. [PubMed] [Google Scholar]
26. Таннер А., Кент Р., Мейден М.Ф., Таубман М.А. Клинический, микробиологический и иммунологический профиль здоровых людей с гингивитом и предполагаемым активным периодонтом. J Периодонтальная Рез. 1996; 31: 195–204. [PubMed] [Google Scholar]
27. Haffajee AD, Socransky SS, Gunsolley JC. Системная противоинфекционная пародонтальная терапия. Систематический обзор. Энн Пародонтолог. 2003; 8: 115–81. [PubMed] [Академия Google]
28. Herrera D, Sanz M, Jepsen S, Needleman I, Roldán S. Систематический обзор влияния системных противомикробных препаратов в качестве дополнения к скейлингу и полированию корней у пациентов с пародонтитом. Дж. Клин Пародонтол. 2002; 29 (Приложение 3): 136–59. [PubMed] [Google Scholar]
29. Новак М.Дж., Новак К.Ф. Хронический пародонтит. В: Newuman MG, Takei HH, Klokkevold PR, Carranza FA, редакторы. Клиническая пародонтология Каррансы. 10-е изд. Сент-Луис, штат Миссури: Эльзевир; 2007.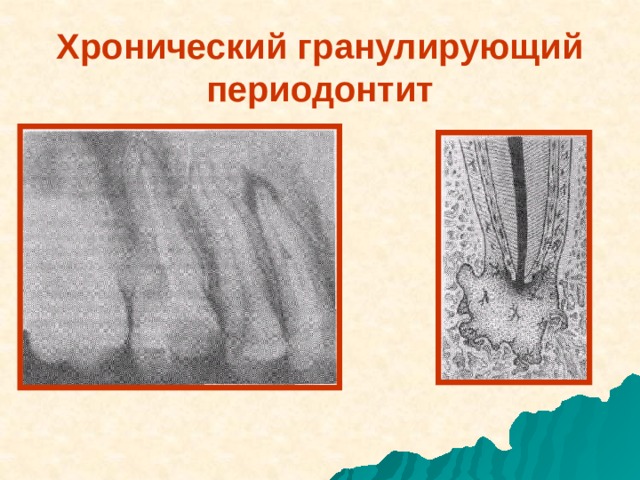 стр. 497–99. [Академия Google]
стр. 497–99. [Академия Google]
30. Кинане Д.Ф., Линде Дж., Тромбелли Л. Хронический пародонтит. В: Lindhe J, Laung NP, редакторы. Клиническая пародонтология и имплантология. 5-е изд. Оксфорд: Издательство Блэквелл; 2008. стр. 424–6. [Google Scholar]
31. Параметр пародонтита, ассоциированного с системными заболеваниями. Американская академия пародонтологии. J Пародонтол. 2000;71(5):876–9. [PubMed] [Google Scholar]
32. Williums RC, Paquette DW. Заболевания пародонта как риск системного заболевания. В: Линде Дж., Ланг Н.П., Карринг Т., редакторы. Клиническая пародонтология и имплантология. 5-е изд. Том. 1. Оксфорд: Издательство Блэквелл; 2008. С. 39.8–495. [Google Scholar]
Сравнительный анализ поддесневого микробиома у пациентов с хроническим пародонтитом с IgA-нефропатией и без нее с помощью высокопроизводительного секвенирования 16S рРНК — FullText — Cellular Physiology and Biochemistry 2018, Vol. 47, № 2
Предпосылки/цели: Пародонтит – распространенное хроническое воспалительное заболевание, вызванное усиленным воспалением, вызванным дисбиотическими микробами, образующимися на поддесневых участках зубов, которые могут нарушать баланс микробного состава в биопленке и, наконец, приводят к прогрессирующему разрушению периодонтальной связки и альвеолярной кости с образованием пародонтального кармана и/или рецессией десны. Методы: Для выяснения корреляции между поддесневым микробиомом и частотой IgAN у пациентов с ХП (хронический пародонтит в тяжелой степени) образцы поддесневого зубного налета были собраны у пациентов с ХП без IgAN (контроль) и у пациентов с ХП с IgAN (заболевание). Было проведено секвенирование 16S рРНК и сравнительный анализ микробиома бактериального налета в контрольной группе и группе больных . Результаты: Поддесневое микробное разнообразие в группе «Болезнь» было немного выше, чем в контроле. Кроме того, были обнаружены значительные различия в поддесневом микробиоме между заболеванием и контролем. По сравнению с таковым в контроле, на уровне типа содержание Proteobacteria и Actinobacteria было значительно выше, в то время как содержание Bacteroidetes, Fusobacteria, Spirochaetae, Synergistetes и Saccharibacteria было значительно ниже при заболевании; на уровне класса содержание Betaproteobacteria, Bacilli, Actinobacteria, Flavobacteriia и Gammaproteobacteria было значительно выше, тогда как содержание Bacteroidia, Fusobacteriia, Negativicutes, Clostridia и Spirochaetes было значительно ниже при заболевании; на уровне рода численность Bergeyella , Capnocytophaga , Actinomyces , Corynebacterium , Comamonas , Lautropia , and Streptococcus were significantly higher while the abundances of Treponema and Prevotella were significantly lower in Disease.
Методы: Для выяснения корреляции между поддесневым микробиомом и частотой IgAN у пациентов с ХП (хронический пародонтит в тяжелой степени) образцы поддесневого зубного налета были собраны у пациентов с ХП без IgAN (контроль) и у пациентов с ХП с IgAN (заболевание). Было проведено секвенирование 16S рРНК и сравнительный анализ микробиома бактериального налета в контрольной группе и группе больных . Результаты: Поддесневое микробное разнообразие в группе «Болезнь» было немного выше, чем в контроле. Кроме того, были обнаружены значительные различия в поддесневом микробиоме между заболеванием и контролем. По сравнению с таковым в контроле, на уровне типа содержание Proteobacteria и Actinobacteria было значительно выше, в то время как содержание Bacteroidetes, Fusobacteria, Spirochaetae, Synergistetes и Saccharibacteria было значительно ниже при заболевании; на уровне класса содержание Betaproteobacteria, Bacilli, Actinobacteria, Flavobacteriia и Gammaproteobacteria было значительно выше, тогда как содержание Bacteroidia, Fusobacteriia, Negativicutes, Clostridia и Spirochaetes было значительно ниже при заболевании; на уровне рода численность Bergeyella , Capnocytophaga , Actinomyces , Corynebacterium , Comamonas , Lautropia , and Streptococcus were significantly higher while the abundances of Treponema and Prevotella were significantly lower in Disease. Выводы: Наши данные указывают на корреляцию между изменениями в поддесневой микробной структуре и заболеваемостью IgAN у пациентов с ХП, что может быть использовано для прогнозирования заболеваемости IgAN у пациентов с ХП.
Выводы: Наши данные указывают на корреляцию между изменениями в поддесневой микробной структуре и заболеваемостью IgAN у пациентов с ХП, что может быть использовано для прогнозирования заболеваемости IgAN у пациентов с ХП.
Введение
В Китае 80-90% взрослых имеют проблемы с пародонтом, такие как зубной камень, зубной налет, кровоточивость десен и пародонтит, и около 15-20% пациентов имеют хронический пародонтит тяжелой степени (ХП) [1, 2]. Заболеваемость пародонтитом в Китае выше, чем в других странах, особенно ХП [2]. Пародонтит — распространенное хроническое воспалительное заболевание, вызванное усиленным воспалением, вызванным дисбиотическими микробами, образующимися на поддесневых участках зубов, которые могут нарушать баланс микробного состава в биопленке и, в конечном итоге, приводить к прогрессирующей деструкции периодонтальной связки и альвеолярной кости с образованием пародонтального кармана. формирование и/или рецессия десны [3]. Механизм, лежащий в основе деструкции тканей пародонта, включает повреждение тканей, вызванное бактериальными продуктами зубного налета, и бактериальную индукцию иммунных ответов хозяина [3]. Пародонтит считается ведущей причиной потери зубов у взрослых и исторически рассматривался отдельно от остальных частей тела [4, 5]. Однако недавние исследования показывают, что пародонтальная инфекция является постоянным потенциальным источником инфекции и связана с многочисленными системными заболеваниями, включая атеросклероз, диабет, рак, ревматоидный артрит, аспирационную пневмонию и неблагоприятными исходами беременности [5-19].]_ENREF_2. Механизмами или путями, связывающими оральные инфекции с вторичными системными эффектами, являются инфекции из полости рта через транзиторную бактериемию, повреждение, вызванное циркулирующими в полости рта микробными токсинами, и воспаление, вызванное иммунологическим повреждением, вызванным оральными микроорганизмами. Поэтому пропаганда гигиены полости рта была предложена как способ укрепления системного здоровья [20].
Пародонтит считается ведущей причиной потери зубов у взрослых и исторически рассматривался отдельно от остальных частей тела [4, 5]. Однако недавние исследования показывают, что пародонтальная инфекция является постоянным потенциальным источником инфекции и связана с многочисленными системными заболеваниями, включая атеросклероз, диабет, рак, ревматоидный артрит, аспирационную пневмонию и неблагоприятными исходами беременности [5-19].]_ENREF_2. Механизмами или путями, связывающими оральные инфекции с вторичными системными эффектами, являются инфекции из полости рта через транзиторную бактериемию, повреждение, вызванное циркулирующими в полости рта микробными токсинами, и воспаление, вызванное иммунологическим повреждением, вызванным оральными микроорганизмами. Поэтому пропаганда гигиены полости рта была предложена как способ укрепления системного здоровья [20].
Нефропатия IgA (IgAN), также известная как болезнь Бергера, представляет собой хроническое заболевание клубочков, которое возникает при отложении IgA в мезангии клубочков [21, 22]. ИГАН обычно прогрессирует медленно в течение многих лет, и у пациентов с ИГАН обычно наблюдаются протеинурия или микроскопическая гематурия, отдельно или в комбинации [23]. Это приводит к локальному воспалению, которое может нарушать функцию почек. Примерно у 25 % взрослых с ИГАН развивается полная почечная недостаточность. Недавнее исследование показывает, что микробиом при IgAN изменяется, например, снижается Clostridium , Enterococcus , Lactobacillus , Leuconostoc и Bifidobacterium , а также увеличение Streptococcus sp . и Firmicutes [24]. До настоящего времени взаимосвязь между пародонтальной инфекцией и IgAN недостаточно изучена. В нашем предыдущем исследовании сообщалось, что распространенность ХП и агрессивного пародонтита у пациентов с ИГАН выше, чем у пациентов без ИГАН (P<0,05), что указывает на то, что пародонтит коррелирует с началом и развитием ИГАН [25]. Для дальнейшего исследования корреляции между бактериальным микробиомом зубного налета и заболеваемостью IgAN у пациентов с ХП были собраны образцы поддесневого зубного налета у пациентов с ХП с IgAN или без него, а затем был проведен сравнительный анализ бактериального микробиома зубного налета с использованием высокопроизводительного секвенирования 16S рРНК.
ИГАН обычно прогрессирует медленно в течение многих лет, и у пациентов с ИГАН обычно наблюдаются протеинурия или микроскопическая гематурия, отдельно или в комбинации [23]. Это приводит к локальному воспалению, которое может нарушать функцию почек. Примерно у 25 % взрослых с ИГАН развивается полная почечная недостаточность. Недавнее исследование показывает, что микробиом при IgAN изменяется, например, снижается Clostridium , Enterococcus , Lactobacillus , Leuconostoc и Bifidobacterium , а также увеличение Streptococcus sp . и Firmicutes [24]. До настоящего времени взаимосвязь между пародонтальной инфекцией и IgAN недостаточно изучена. В нашем предыдущем исследовании сообщалось, что распространенность ХП и агрессивного пародонтита у пациентов с ИГАН выше, чем у пациентов без ИГАН (P<0,05), что указывает на то, что пародонтит коррелирует с началом и развитием ИГАН [25]. Для дальнейшего исследования корреляции между бактериальным микробиомом зубного налета и заболеваемостью IgAN у пациентов с ХП были собраны образцы поддесневого зубного налета у пациентов с ХП с IgAN или без него, а затем был проведен сравнительный анализ бактериального микробиома зубного налета с использованием высокопроизводительного секвенирования 16S рРНК.
Материалы и методы
Заявление об этике
От всех пациентов, участвовавших в этом исследовании, было получено письменное информированное согласие. Дизайн исследования, протокол и информированное согласие были одобрены Комитетом по этике Китайско-японской больницы дружбы (2013-KY-3). Методы проводились в соответствии с соответствующими руководствами.
Сбор образцов поддесневого зубного налета
В общей сложности 20 образцов пациентов, включая 9 пациентов с ХП без ИГАН (контроль) и 11 пациентов с ХП с ИГАН (болезнь), были отобраны и исследованы в Китайско-японской больнице дружбы. Вкратце, для дальнейшего сбора образцов были отобраны пациенты стоматологической клиники и нефрологической клиники без какого-либо лечения. Образцы поддесневого зубного налета собирали с первых моляров с помощью стерильного ручного инструмента в виде ложки, а затем сразу же помещали в пробирку Эппендорфа, содержащую 1 мл раствора тиосульфата натрия. Между тем, клинические диагнозы заболеваний пародонта и почек были выполнены. Образцы, взятые у пациентов с ХП, считали контролем, а образцы, взятые у пациентов с ХП и IgAN, рассматривали как заболевание.
Образцы, взятые у пациентов с ХП, считали контролем, а образцы, взятые у пациентов с ХП и IgAN, рассматривали как заболевание.
Создание библиотек ампликонов и секвенирование Miseq
Геномную ДНК экстрагировали из поддесневых образцов с использованием набора для выделения ДНК PowerSoil® (MO BIO Laboratories, Inc. Кат. 12888-100) в соответствии с инструкциями производителя. Количество тотальной ДНК определяли с помощью Nanodrop ND-2000 (ThermoScientific, Уилмингтон, Делавэр, США). Целостность и размер ДНК проверяли электрофорезом в 1% (масса/объем) агарозном геле. Гипервариабельные области V3-4 бактериального гена 16S рРНК амплифицировали с праймерами 357F (5’-CCTACGGGAGGCAGCAG-3’) и 806R (5’-GGACTACHVGGGTWTC TAAT-3’). Для каждого образца 10-значная последовательность штрих-кода (таблица 1) была добавлена к 5’-концу прямого и обратного праймеров (предоставленных компанией Auwigene, Пекин) для различения каждого образца. ПЦР проводили на приборе Mastercycler Gradient (Eppendorf, Германия) с использованием 50 мкл реакционных объемов, содержащих 5 мкл 10×Ex Taq Buffer (Mg 2+ plus), 4 мкл 12,5 мМ смеси dNTP (каждого), 1,25 ед. ДНК-полимеразы Ex Taq, 2 мкл матричной ДНК, 200 нМ праймеров со штрих-кодом 357F и 806R каждого и 36,75 мкл ddH 2 O. Параметры циклирования: 94°С в течение 2 мин, затем 30 циклов 94°С в течение 30 с, 57°С в течение 30 с и 72°С в течение 30 с с окончательным удлинением при 72°С в течение 10 мин. Три продукта ПЦР на образец были объединены, чтобы смягчить погрешности ПЦР на уровне реакции. Продукты ПЦР очищали с использованием набора для экстракции из геля QIAquick (QIAGEN, Германия), количественно определяли с помощью ПЦР в реальном времени и секвенировали в компании Auwigene, Пекин.
ДНК-полимеразы Ex Taq, 2 мкл матричной ДНК, 200 нМ праймеров со штрих-кодом 357F и 806R каждого и 36,75 мкл ddH 2 O. Параметры циклирования: 94°С в течение 2 мин, затем 30 циклов 94°С в течение 30 с, 57°С в течение 30 с и 72°С в течение 30 с с окончательным удлинением при 72°С в течение 10 мин. Три продукта ПЦР на образец были объединены, чтобы смягчить погрешности ПЦР на уровне реакции. Продукты ПЦР очищали с использованием набора для экстракции из геля QIAquick (QIAGEN, Германия), количественно определяли с помощью ПЦР в реальном времени и секвенировали в компании Auwigene, Пекин.
Таблица 1.
Информация о последовательности штрих-кода.
Обработка данных и статистический анализ
Необработанные данные секвенирования были обработаны компанией Beijing Auwigene Tech, Ltd. (Пекин, Китай) с использованием конвейерных инструментов QIIME и MOTHUR. Перекрывающиеся парные чтения были объединены с помощью FLASH (v 1.2.10). Последовательности исключались из рассмотрения, если они были короче 200 п. н., имели оценку низкого качества (≤ 20), содержали неоднозначные основания или не точно совпадали с последовательностями праймеров и метками штрих-кода с использованием Trimmomatic. Отфильтрованные чтения были отсортированы по разным образцам в соответствии с их штрих-кодами с помощью MOTHUR. Сохраненные высококачественные последовательности были дополнительно проанализированы с использованием MOTHUR и Usearch (версия 8.0.1623). В частности, MOTHUR использовался для удаления штрих-кода и последовательности праймеров, «trim.seqs (maxhomop = 10, minlength = 200)» — для фильтрации качества, а Usearch (версия 8.0.1623) — для удаления de novo химерных прочтений. Все чистые теги всех образцов были сгруппированы в OTU с использованием QIIME (v1.9.1) при сходстве последовательностей 97%. Эти OTU использовались в качестве основы для расчета показателей альфа- и бета-разнообразия с использованием QIIME (v1.9.1). Достаточность усилий по отбору проб оценивали по построению кривых разрежения, разнообразие бактериального сообщества в пределах каждой отдельной пробы оценивали по индексу Шеннона-Винера, видовое богатство — по индексу CHAO1, процент покрытия — по охвату Гуда.
н., имели оценку низкого качества (≤ 20), содержали неоднозначные основания или не точно совпадали с последовательностями праймеров и метками штрих-кода с использованием Trimmomatic. Отфильтрованные чтения были отсортированы по разным образцам в соответствии с их штрих-кодами с помощью MOTHUR. Сохраненные высококачественные последовательности были дополнительно проанализированы с использованием MOTHUR и Usearch (версия 8.0.1623). В частности, MOTHUR использовался для удаления штрих-кода и последовательности праймеров, «trim.seqs (maxhomop = 10, minlength = 200)» — для фильтрации качества, а Usearch (версия 8.0.1623) — для удаления de novo химерных прочтений. Все чистые теги всех образцов были сгруппированы в OTU с использованием QIIME (v1.9.1) при сходстве последовательностей 97%. Эти OTU использовались в качестве основы для расчета показателей альфа- и бета-разнообразия с использованием QIIME (v1.9.1). Достаточность усилий по отбору проб оценивали по построению кривых разрежения, разнообразие бактериального сообщества в пределах каждой отдельной пробы оценивали по индексу Шеннона-Винера, видовое богатство — по индексу CHAO1, процент покрытия — по охвату Гуда. оценщик. Инструмент классификатора Ribosomal Database Project (RDP) использовался для классификации всех последовательностей в различные таксономические группы.
оценщик. Инструмент классификатора Ribosomal Database Project (RDP) использовался для классификации всех последовательностей в различные таксономические группы.
Бета-разнообразие было выполнено с помощью QIIME (v1.9.1) для оценки различий микробных сообществ между контролем и заболеванием на основе их состава. Был проведен анализ основных координат (PCoA) взвешенного UniFrac для сравнения общей структуры поддесневого микробиома всех образцов на основе относительного количества OTU (при уровне сходства 97%). Численность бактериальных типов и родов для каждой группы выражали в процентах от общего числа последовательностей, а структуры бактериальных сообществ контроля и заболевания далее сравнивали на уровне типов и родов с использованием U-критерия Манна-Уитни. P-значения были скорректированы с использованием коррекции частоты ложных открытий (FDR) для учета коррекции множественного тестирования [26]. Статистические различия между контролем и заболеванием анализировали с использованием ANOVA в соответствии с методами, предоставленными Mothur.
Результаты
Демографические и клинические характеристики исследуемых субъектов
Образцы поддесневого налета были взяты у 9 пациентов с ХП без ИГАН (контроль) и у 11 пациентов с ХП с ИГАН (заболевание). Для контроля и заболевания средний возраст составлял 37,3 и 36,1 года соответственно; глубина зондирования (PD) 4,8 мм и 5,2 мм соответственно; уровни клинического прикрепления (CAL) составили 5,1 мм и 4,9 мм соответственно; а процент поверхности бляшки составил 85,2 и 82,9.соответственно (табл. 2). Статистических различий по этим параметрам между контролем и болезнью обнаружено не было.
Таблица 2.
Демографические и клинические характеристики исследуемых субъектов. Р>0,05. CAL, уровни клинической привязанности; ПД, глубина зондирования. CAL и PD измерялись в мм и представляют собой среднее значение для всех участков ротовой полости исследуемых субъектов.
Характеристики результатов секвенирования MiSeq
Всего было получено 408 758 необработанных ридов из всех 20 образцов поддесневого зубного налета. После фильтрации было отфильтровано 350773 чистых тега (17538,65 тега на образец) и 879Из всех образцов было получено 5 OTU (439,75 OTU на образец) (табл. 3). Кривая Шеннона-Винера для всех образцов уже достигла плато на этой глубине секвенирования (рис. 1), а покрытие превысило 95%, что позволяет предположить, что секвенирование было достаточно глубоким. Хотя не было статистически значимых различий в оценке богатства сообщества (Chao) и оценщике разнообразия (индекс Шеннона) между контролем и болезнью (p = 0,34 и 0,59 соответственно), индексы разнообразия в группе заболеваний были немного выше, чем в контроле. (таблица 4).
После фильтрации было отфильтровано 350773 чистых тега (17538,65 тега на образец) и 879Из всех образцов было получено 5 OTU (439,75 OTU на образец) (табл. 3). Кривая Шеннона-Винера для всех образцов уже достигла плато на этой глубине секвенирования (рис. 1), а покрытие превысило 95%, что позволяет предположить, что секвенирование было достаточно глубоким. Хотя не было статистически значимых различий в оценке богатства сообщества (Chao) и оценщике разнообразия (индекс Шеннона) между контролем и болезнью (p = 0,34 и 0,59 соответственно), индексы разнообразия в группе заболеваний были немного выше, чем в контроле. (таблица 4).
Таблица 3.
Количество необработанных меток, чистых меток, конечных меток и OTU в контроле и заболевании по данным секвенирования 16S рРНК.
Таблица 4.
Сводка данных секвенирования MiSeq. Количество прочтений, OTU, оценщик насыщенности Chao и оценщик разнообразия Shannon были рассчитаны на уровне сходства 97%. Контроль, больные пародонтитом без IgA-нефропатии; Болезнь, пародонтит у больных с IgA-нефропатией.
Рис. 1.
Кривые разрежения и кривые Шеннона-Винера для каждого поддесневого образца, взятого из 9пациентов с пародонтитом без ИГАН и 11 пациентов с пародонтитом с ИГАН.
Таксономия на уровне типа, класса и рода в контроле и заболевании
Общий бактериальный состав для каждой группы на уровне типа показан на рис. 2 и в таблице 5. В целом, во всех образцах было получено 23 типа. Доминирующими типами всех групп были Firmicutes, Proteobacteria, Bacteroidetes и Fusobacteria, на долю которых приходилось 81,79% от общего числа последовательностей. Наиболее доминирующими типами были Firmicutes в контроле и Proteobacteria в заболевании. Кроме того, микробный состав, принадлежащий Proteobacteria и Bacteroidetes, сильно различался между контролем и заболеванием (p<0,05). Хотя существенных различий обнаружено не было, количество Actinobacteria было выше, а количество Bacteroidetes, Fusobacteria, Spirochaetae и Synergistetes было ниже в поддесневом микробиоме заболевания, чем в контроле (рис. 1). Общий микробный состав для каждой группы на уровне класса показан на рис. 3 и в таблице 6. Во всех образцах было 37 классов. Доминирующими классами обеих групп были Bacteroidia, Fusobacteriia, Negativicutes, Clostridia, Betaproteobacteria, Spirochaetes, Synergistia, Actinobacteria, Bacilli и Flavobacteriia, представляющие 93% от общего числа последовательностей. Наиболее доминирующим классом были Bacteroidia in Control и Betaproteobacteria in Disease. Однако существенных различий между этими двумя группами не было. На уровне заказа было обнаружено в общей сложности 70 заказов. Bacteroidales, Fusobacteriales, Neisseriales, Selenomonadales и Lactobacillales составляют 58,61 % от общего количества последовательностей. Обилие Bacteroidales в контроле (22,26%) было намного выше, чем в контроле (9,46%), а количество Burkholderiales в контроле (8,23%) было намного выше, чем в контроле (0,86%). На уровне рода численность Treponema_2 и Prevotella была ниже, а численность Bergeyella , Lautropia , Actinomyces , Comamonas , Corynebacterium , Capnocytophaga и Streptococcus , которые были выше, чем в контроле.
1). Общий микробный состав для каждой группы на уровне класса показан на рис. 3 и в таблице 6. Во всех образцах было 37 классов. Доминирующими классами обеих групп были Bacteroidia, Fusobacteriia, Negativicutes, Clostridia, Betaproteobacteria, Spirochaetes, Synergistia, Actinobacteria, Bacilli и Flavobacteriia, представляющие 93% от общего числа последовательностей. Наиболее доминирующим классом были Bacteroidia in Control и Betaproteobacteria in Disease. Однако существенных различий между этими двумя группами не было. На уровне заказа было обнаружено в общей сложности 70 заказов. Bacteroidales, Fusobacteriales, Neisseriales, Selenomonadales и Lactobacillales составляют 58,61 % от общего количества последовательностей. Обилие Bacteroidales в контроле (22,26%) было намного выше, чем в контроле (9,46%), а количество Burkholderiales в контроле (8,23%) было намного выше, чем в контроле (0,86%). На уровне рода численность Treponema_2 и Prevotella была ниже, а численность Bergeyella , Lautropia , Actinomyces , Comamonas , Corynebacterium , Capnocytophaga и Streptococcus , которые были выше, чем в контроле.
Таблица 5.
Относительная численность на уровне типа и статистическая значимость между контролем и заболеванием. Контроль, больные пародонтитом без IgA-нефропатии; Болезнь, пародонтит у больных с IgA-нефропатией. Значимость: NS > 0,05, * < 0,05, ** < 0,01, *** < 0,001.
Таблица 6.
Относительная численность на уровне класса и статистическая значимость между контролем и заболеванием. Контроль, больные пародонтитом без IgA-нефропатии; Болезнь, пародонтит у больных с IgA-нефропатией. Значимость: NS > 0,05, * < 0,05, ** < 0,01, *** < 0,001.
Рис. 2.
Относительная численность бактерий в поддесневом микробиоме контроля и заболевания на уровне типов. Контроль, больные пародонтитом без IgA-нефропатии; Болезнь, пародонтит у больных с IgA-нефропатией.
Рис. 3.
Относительная численность бактерий в поддесневом микробиоме контроля и заболевания на уровне класса. Контроль, больные пародонтитом без IgA-нефропатии; Болезнь, пародонтит у больных с IgA-нефропатией.
Рис. 4.
Относительная численность бактерий в поддесневом микробиоме контроля и заболевания на уровне рода. Контроль, больные пародонтитом без IgA-нефропатии; Болезнь, пародонтит у больных с IgA-нефропатией.
Бета-разнообразие поддесневого микробиома между контролем и заболеванием с многомерным статистическим анализом
PCoA на основе составов OTU в каждом образце был выполнен для сравнения общей структуры поддесневого микробиома между этими двумя группами. Наблюдалось очевидное разделение контроля и заболевания, на ПК1 и ПК2 приходилось 22,14% и 13,74% от общего числа вариаций соответственно (рис. 5). Статистический анализ показал, что микробный состав больных значительно отличался от такового в контроле (p<0,001).
Рис. 5.
Взвешенные показатели бета-разнообразия UniFrac, визуализированные с помощью анализа главных координат (PCoA). Контроль, больные пародонтитом без IgA-нефропатии; Болезнь, пародонтит у больных с IgA-нефропатией.
Обсуждение
Платформа 16S рРНК Miseq использовалась для оценки взаимосвязи между бактериальным сообществом и IgAN. Результаты показали, что бактериальное разнообразие в заболевании было выше, чем в контроле. Некоторые группы бактерий в группе заболеваний также значительно отличались от таковых в контроле. Структура бактерий между двумя группами значительно различалась.
Заболевания пародонта — распространенное хроническое воспалительное заболевание полости рта, являющееся основной причиной потери зубов у взрослых [27]. Почти все формы заболеваний пародонта возникают из-за смешанных микробных инфекций, и многие виды бактерий признаны предполагаемыми патогенами пародонта, например, Porphyromonas gingivalis, Aggregatibacter actinomycetemcomitans, Bacteroides forsythus, Prevotella intermedia, Peptostreptococcus micros, Fusobacterium nucleatum, Filifactor alocis, Desulfobulbus sp. оральный таксон 041 HOT 041 и Synergistetes [28-31]. Недавние исследования показали, что заболевание пародонта и системное здоровье тесно связаны, и лечение заболеваний пародонта может помочь предотвратить ряд других хронических воспалительных состояний, включая IgAN [6, 16-19, 25]. IgAN является наиболее распространенным первичным гломерулонефритом, при котором иммунные комплексы, состоящие из IgA1 с шарнирной областью с дефицитом галактозы и антигликановыми антителами, откладываются в клубочках и вызывают повреждение почек [32]. До сих пор знания о влиянии поддесневого микробиома у пациентов с ХП на заболеваемость IgAN все еще ограничены. В этом исследовании мы использовали секвенирование 16S рРНК для идентификации и сравнения бактерий, присутствующих в контроле и заболевании, и дополнительно исследовали корреляцию между поддесневым микробиомом и частотой IgAN у пациентов с ХП. Субъекты исследования в группах «Контроль и болезнь» были тщательно отобраны таким образом, чтобы не было статистически значимых различий в среднем возрасте, глубине зондирования и уровнях клинической привязанности. Более того, статистически значимые различия были обнаружены в поддесневых микробных сообществах, но не в разнообразии.
IgAN является наиболее распространенным первичным гломерулонефритом, при котором иммунные комплексы, состоящие из IgA1 с шарнирной областью с дефицитом галактозы и антигликановыми антителами, откладываются в клубочках и вызывают повреждение почек [32]. До сих пор знания о влиянии поддесневого микробиома у пациентов с ХП на заболеваемость IgAN все еще ограничены. В этом исследовании мы использовали секвенирование 16S рРНК для идентификации и сравнения бактерий, присутствующих в контроле и заболевании, и дополнительно исследовали корреляцию между поддесневым микробиомом и частотой IgAN у пациентов с ХП. Субъекты исследования в группах «Контроль и болезнь» были тщательно отобраны таким образом, чтобы не было статистически значимых различий в среднем возрасте, глубине зондирования и уровнях клинической привязанности. Более того, статистически значимые различия были обнаружены в поддесневых микробных сообществах, но не в разнообразии.
Состав поддесневого микробиома у пациентов с заболеванием отличался от микробиома в контроле. Болезнь характеризовалась более высокой относительной численностью типов Proteobacteria и Actinobacteria и более низкой относительной численностью типов Bacteroidetes, Fusobacteria, Spirochaetae, Synergistetes и Saccharibacteria. По сравнению с контролем соотношение между Firmicutes/Proteobacteria заметно уменьшилось при заболевании, что согласуется с предыдущим исследованием, которое продемонстрировало снижение соотношения между Firmicutes/Proteobacteria в микробиоме слюны пациентов с IgAN [33]. Изменения типов Proteobacteria, Actinobacteria, Bacteroidetes, Fusobacteria и Spirochaetae при заболевании были в основном связаны со значительными изменениями в классах Betaproteobacteria и Gammaproteobacteria, Actinobacteria, Bacteroidia, Fusobacteriia и Spirochaetes соответственно. Дальнейший сравнительный анализ на уровне рода показал, что по сравнению с контролем роды Treponema и prevotella были меньше, но Bergeyella, Lautropia, Actinomyces, Comamonas, Corynebacterium, Capnocytophaga и Streptococcus были более распространены при заболевании.
Болезнь характеризовалась более высокой относительной численностью типов Proteobacteria и Actinobacteria и более низкой относительной численностью типов Bacteroidetes, Fusobacteria, Spirochaetae, Synergistetes и Saccharibacteria. По сравнению с контролем соотношение между Firmicutes/Proteobacteria заметно уменьшилось при заболевании, что согласуется с предыдущим исследованием, которое продемонстрировало снижение соотношения между Firmicutes/Proteobacteria в микробиоме слюны пациентов с IgAN [33]. Изменения типов Proteobacteria, Actinobacteria, Bacteroidetes, Fusobacteria и Spirochaetae при заболевании были в основном связаны со значительными изменениями в классах Betaproteobacteria и Gammaproteobacteria, Actinobacteria, Bacteroidia, Fusobacteriia и Spirochaetes соответственно. Дальнейший сравнительный анализ на уровне рода показал, что по сравнению с контролем роды Treponema и prevotella были меньше, но Bergeyella, Lautropia, Actinomyces, Comamonas, Corynebacterium, Capnocytophaga и Streptococcus были более распространены при заболевании. Род Treponema принадлежит к типу Spirochaetes. Как сообщается, трепонем вовлечены в этиологию хронического пародонтита и других форм заболеваний пародонта [34]. Treponema denticola обитает в ротовой полости человека и сильно коррелирует с частотой и тяжестью заболеваний пародонта человека [35, 36]. Род Prevotella принадлежит к типу Bacteroidetes. Различные виды Prevotella , в том числе P. melaninogenica, P. intermedia и P. loescheii , обитают в ротовой полости человека [37, 38]. P. intermedia может быть пародонтальным патогеном, тогда как P. nigrescens является маркером относительного пародонтального здоровья [37]. Кроме того, установлено, что в микробиоме слюны относительное содержание Prevotella spp . ( P. nigrescens , P. intermedia , P. pallens и P. salivae ) были выше в контроле здоровья по сравнению с пациентами с ИГАН, и единственным исключением был P. aurantiaca [33].
Род Treponema принадлежит к типу Spirochaetes. Как сообщается, трепонем вовлечены в этиологию хронического пародонтита и других форм заболеваний пародонта [34]. Treponema denticola обитает в ротовой полости человека и сильно коррелирует с частотой и тяжестью заболеваний пародонта человека [35, 36]. Род Prevotella принадлежит к типу Bacteroidetes. Различные виды Prevotella , в том числе P. melaninogenica, P. intermedia и P. loescheii , обитают в ротовой полости человека [37, 38]. P. intermedia может быть пародонтальным патогеном, тогда как P. nigrescens является маркером относительного пародонтального здоровья [37]. Кроме того, установлено, что в микробиоме слюны относительное содержание Prevotella spp . ( P. nigrescens , P. intermedia , P. pallens и P. salivae ) были выше в контроле здоровья по сравнению с пациентами с ИГАН, и единственным исключением был P. aurantiaca [33]. Наши данные также показали, что более высокая численность видов Prevotella . был обнаружен в контроле по сравнению с заболеванием. Род Bergeyella представляет собой труднокультивируемый таксон, относящийся к типу Bacteroidetes. Информация о роли Bergeyella в заболеваниях пародонта и IgAN очень ограничена [39].]. Род Lautropia принадлежит к типу Proteobacteria. Только один вид, L. mirabilis , был идентифицирован, и было обнаружено, что он связан с успехом в пародонтологической терапии [40]. Род Actinomyces принадлежит к типу Actinobacteria (кроме A. meyeri , облигатного анаэроба). Предыдущее исследование показало, что Actinomyces odontolyticus/meyeri и Actinomyces israelii были связаны с хроническим пародонтитом (p=0,003) [41]. Род Comamonas принадлежит к типу Proteobacteria. Отсутствует информация о роли Comamonas в заболеваниях пародонта и IgAN. Род Corynebacterium принадлежит к типу Actinobacteria.
Наши данные также показали, что более высокая численность видов Prevotella . был обнаружен в контроле по сравнению с заболеванием. Род Bergeyella представляет собой труднокультивируемый таксон, относящийся к типу Bacteroidetes. Информация о роли Bergeyella в заболеваниях пародонта и IgAN очень ограничена [39].]. Род Lautropia принадлежит к типу Proteobacteria. Только один вид, L. mirabilis , был идентифицирован, и было обнаружено, что он связан с успехом в пародонтологической терапии [40]. Род Actinomyces принадлежит к типу Actinobacteria (кроме A. meyeri , облигатного анаэроба). Предыдущее исследование показало, что Actinomyces odontolyticus/meyeri и Actinomyces israelii были связаны с хроническим пародонтитом (p=0,003) [41]. Род Comamonas принадлежит к типу Proteobacteria. Отсутствует информация о роли Comamonas в заболеваниях пародонта и IgAN. Род Corynebacterium принадлежит к типу Actinobacteria. Предыдущее исследование показало, что Corynebacterium diphtheria имел более высокую распространенность и уровень в образцах поддесневой биопленки, собранных у пациентов с пародонтитом, что согласуется с нашими данными [42]. Пикколо, М. и др. . обнаружил, что количество Corynebacterium sp. был ниже в образцах слюны пациентов с IgAN по сравнению со здоровым контролем, что свидетельствует об обратном выводе [33]. Род Capnocytophaga принадлежит к типу Bacteroidetes. Capnocytophaga spp. . часто выделяют из пародонтальных карманов, апикальных и пародонтальных абсцессов. Установлено, что видов Capnocytophaga . более распространены при гингивите по сравнению со здоровым пародонтом и пародонтитом. Capnocytophaga spp. . могут вызывать заболевания пародонта [43-46]. Род Streptococcus принадлежит к типу Firmicutes. В 2011 году Хуанг и др. . изучали взаимосвязь между микробиомом полости рта и статусом гингивита и обнаружили, что Streptococcus связаны с гингивитом [47].
Предыдущее исследование показало, что Corynebacterium diphtheria имел более высокую распространенность и уровень в образцах поддесневой биопленки, собранных у пациентов с пародонтитом, что согласуется с нашими данными [42]. Пикколо, М. и др. . обнаружил, что количество Corynebacterium sp. был ниже в образцах слюны пациентов с IgAN по сравнению со здоровым контролем, что свидетельствует об обратном выводе [33]. Род Capnocytophaga принадлежит к типу Bacteroidetes. Capnocytophaga spp. . часто выделяют из пародонтальных карманов, апикальных и пародонтальных абсцессов. Установлено, что видов Capnocytophaga . более распространены при гингивите по сравнению со здоровым пародонтом и пародонтитом. Capnocytophaga spp. . могут вызывать заболевания пародонта [43-46]. Род Streptococcus принадлежит к типу Firmicutes. В 2011 году Хуанг и др. . изучали взаимосвязь между микробиомом полости рта и статусом гингивита и обнаружили, что Streptococcus связаны с гингивитом [47]. Сообщается, что Streptococcus имеет корреляцию с IgAN [48]. Связь между тонзиллярной инфекцией, вызванной Streptococcus sp. и был предположен IgAN. Кроме того, стрептококковые белки распознавались в сыворотке больных ИГАН [48, 49].]. В настоящем исследовании Streptococcus также активировался при заболевании, что означает, что Streptococcus spp . у больных ХП имеет корреляцию с IgAN.
Сообщается, что Streptococcus имеет корреляцию с IgAN [48]. Связь между тонзиллярной инфекцией, вызванной Streptococcus sp. и был предположен IgAN. Кроме того, стрептококковые белки распознавались в сыворотке больных ИГАН [48, 49].]. В настоящем исследовании Streptococcus также активировался при заболевании, что означает, что Streptococcus spp . у больных ХП имеет корреляцию с IgAN.
Таким образом, наши данные показали статистически значимые изменения в поддесневом микробиоме при заболевании по сравнению с контролем, что указывает на корреляцию между изменениями в поддесневой микробной структуре и частотой IgAN у пациентов с ХП. Однако до сих пор знания о роли измененной поддесневой микробной структуры у пациентов с ХП в заболеваемости IgAN все еще ограничены и требуют дальнейшего изучения.
Благодарности
Это исследование было поддержано Пекинской программой Nova (№ xx2014B074).
Заявление о раскрытии информации
Авторы заявляют об отсутствии конкурирующих интересов.
Эта статья находится под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND). Использование и распространение в коммерческих целях, а также любое распространение измененного материала требует письменного разрешения. Дозировка препарата: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор препарата и дозировка, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации. Тем не менее, в связи с продолжающимися исследованиями, изменениями в правительственных постановлениях и постоянным потоком информации, касающейся лекарственной терапии и реакций на лекарства, читателю настоятельно рекомендуется проверять вкладыш в упаковке для каждого лекарства на предмет любых изменений в показаниях и дозировке, а также для дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендуемый агент является новым и/или редко используемым лекарственным средством.
