Можно ли стоматит мазать зеленкой
Содержание
- Основные методы лечения
- Свойства зеленки
- Польза зеленки при стоматите
- Правила использования
- Противопоказания и осложнения
- Народные средства
- Полезное видео
Поражение ротовой полости может возникать у взрослых и детей, каждый старается найти безопасные и недорогие средства для устранения симптомов болезни.
За счет этого появляется вопрос, можно ли стоматит мазать зеленкой. Само заболевание характеризуется воспалением слизистой и появлением сыпи, болезненных ран во рту.
Основные методы лечения
Если диагностирован стоматит, то доктора зачастую рекомендуют лечение медикаментозными методами, а средства народной медицины используются в качестве вспомогательных.
В медицинской практике принято выделять 3 направления для терапии стоматита:
- Лекарства – назначаются препараты, которые надо принимать внутрь. Виды медикаментов определяются исходя из причины патологии и вида стоматита.
 Зачастую назначают средства от бактерий и вируса.
Зачастую назначают средства от бактерий и вируса. - Локальное лечение – суть заключается в удалении визуальных симптомов патологии, а также устранении болей и других неприятных ощущений. Как правило, используют мази, гели и средства для ополаскивания рта. Подобные меры оказывают антисептическое, дезинфицирующее действие. В таком случае стоматит можно лечить народными средствами, среди которых отвары и настои на основе трав.
- Лазерное лечение – метод позволяет быстро продезинфицировать поврежденную слизистую, а нервны окончания будут удалены. Восстановление происходит очень быстро.
Часто используют подручные средства, но можно ли мазать стоматит зеленкой, указывает только врач, исходя из вида болезни и общего состояния больного.
Кроме того, надо знать основную пользу и вред подобного средства, как зеленка при стоматите у детей и взрослых оказывает влияние на организм и раны.
Свойства зеленки
У многих людей дома в аптечке есть зеленка. Данное средство относится к антисептику, который применяют при разных травмах, часто используются для прижигания ран, гнойников и прочего.
Средство способно обеззаразить, подсушить образования на коже, а также снижает зуд. Подобное средство делается на основе синтетических веществ, а именно «бриллиантового зеленого» и этилового спирта.
Раствор не применяют в качестве самостоятельно средства для лечения болезни.
Отвечая на вопрос можно ли прижигать стоматит раствором, стоит отметить, что в медицине нет заболеваний, при которых мажут слизистую рта.
Подобный антисептик можно применять, если есть раны или язвы на внешней стороне губ или в уголках рта.
В таком случае рана прижигается и не позволяет распространяться бактериям на здоровые части кожи.
В дополнение после нанесения происходит подсушивание кожи. Если нет возможности быстро обратиться к доктору для консультации, то зеленка будет хорошей альтернативой. Поэтому можно ли стоматит мазать зеленкой, получит положительный ответ.
Польза зеленки при стоматите
При стоматите многие стоматологи советуют средства, которое по своему действию сходятся с зеленкой, но можно ли лечить стоматит зеленкой, зависит от конкретного случая.
При попадании на раны, раствор легко прижигает очаги, подсушивает их, после чего уничтожается инфекция.
- Оказывает антисептическое действие, что может быть лучше, чем некоторые современные лекарства с высшей стоимостью.
- Если стоматит проявляется не только во рту, но и на внешней стороне губ или в уголках рта, то эффективность будет максимально высокая.
Достоинством можно считать низкую стоимость и доступность раствора. Если стоматит проходит в легкой форме, то зеленка может использоваться, в остальных случаях, лучше отдавать предпочтение боле современным средствам для терапии.
Правила использования
Часто зеленку применяют родители для лечения стоматита. Такое решение возможно в качестве первичных мер, когда только начинает развиваться патология, а антисептик может остановить развитие инфекции и улучшает состояние малыша.
Если у ребенка появляется сыпь в ротовой полости, то нужно знать правила использования зеленого раствора, чтобы не вызвать сильные ожоги:
- Допускается использование только 1% препарата.
- Прижигать такого только воспаленные места, чтобы раствор не попадал на здоровые ткани. Когда зеленка полностью впитается, процедуру можно повторять.
- Обработка ротовой полости проводится ватной палочкой, постоянно используется новая.
- Средство может вызвать легкое жжение пораженных частей, поэтому важно аккуратно обрабатывать ткани, еле дотрагиваясь к ним.
- Для максимального результата, а также длительного воздействия потребуется попросить ребенка или самому держать немного рот в открытом положении.
- Взрослому человеку рекомендуется использовать средство трижды в день курсом до 5 суток.
- У детей слизистая очень нежная, поэтому могут легко появляться повреждения. Чтобы исключить негативных последствий, лучше использовать не спиртовый раствор, а водный.
Зеленка должна использовать как временная мера для облегчения состояния и снятия воспалительного процесса.
Раствор не рекомендуется применять дольше 5 суток, чтобы избежать негативных последствий.
Рекомендуется в максимально короткие сроки обратиться к доктору, чтобы получить правильную схему лечения. Особенно если стоматит развивается у ребенка.
Противопоказания и осложнения
Среди основных противопоказаний можно выделить аллергию, непереносимость активных веществ.
Если пациент не может использовать средство, то развивается сильное жжение, а также появляется сыпь на коже и ткани краснеют.
Кроме того, при неправильном применении могут появляться осложнения, особенно если речь идет о детях.
При злоупотреблении и частом нанесении раствора появляется ожог и травмы слизистой. Если во рту постоянная сухость, то использовать зеленку нельзя.
Она спровоцирует дополнительно пересыхание, что вызывает сильные боли. Если стоматит развивается по причине бактерий или герпеса, то после зеленки состояние может усугубляться. Раствор рекомендуется использовать при инфекционной природе стоматита.
Раствор рекомендуется использовать при инфекционной природе стоматита.
В современной медицине есть аналогичные средства по своему действию. Среди них можно выделить:
- Йод.
- Йодинол.
- Хлорофиллипт.
- Перекись.
- Фармасепт.
Поскольку йод тоже считается эффективным раствором, стоит не дорого и есть почти у всех дома, то многие могут лечить стоматит подобным раствором.
Его свойства сильнее, он агрессивнее действует на слизистую, поэтому строго запрещается для лечения стоматита.
Народные средства
Лечение стоматита зеленкой – это временная мера, позволяющая улучшить общее состояние, и останавливает развитие инфекции.
В любом случае потребуется обратиться к доктору, пройти диагностирование, узнать причину и вид заболевания. От полученной информации зависит дальнейшее лечение и меры профилактики.
Стоматит можно лечить и другими средствами, которые являются альтернативой зеленому раствору.
Нетрадиционная медицина имеет много полезных рецептов, что справляются с заболеванием, поражающем ротовую полость.
Самые популярные из них таковы:
- Смесь из яиц и меда. Для приготовления нужно использовать 1 яичный белок и 1 ч.л. меда. Соединить ингредиенты, добавить ампулу новокаина, витамины В1 и В6, тщательно размешать, использовать до трапезы. Средство не сразу глотается, а рассасывается во рту, удаляя боли и другие неприятные ощущения.
- Настой ромашки. Средство используют для полоскания рта. Готовится просто, на 1 ч.л. цветов добавляется 250 мл кипятка, через 2 часа используется для полоскания по 3 раза в сутки. До применения надо подогреть настой.
- Настой тысячелистника. Используется по аналогии с ромашкой, дли приготовления использовать 1 ч.л. травы и 200 мл кипятка.
- Картошка. Сырую картошку натереть на мелкой терке, использовать по 2 раза в день, держа смесь во рту около 5 минут.
- Чеснок и простокваша. Зубок растительного ингредиента измельчить, добавить в простоквашу, а готовое средство применять для обработки рта по разу в сутки. Для улучшения состояния потребуется сделать 3 процедуры, во время выполнения появляется жжение, которое нужно потерпеть.

- Сок каланхоэ. Используется лист растения для компресса. Из него надо выдавить сок, капнуть на марлю и приложить к воспаленным тканям рта. Компресс использовать на протяжении четверти часа, а до выполнения рот нужно ополоснуть водой или отваром.
Описанные средства нельзя использовать для детей. Народные средства от стоматита для ребенка отличаются, а если использовать рецепты для взрослых, то терапия может наносить только вред.
Ребенка до 1 года при наличии характерных симптомов болезни лучше немедленно показать педиатру, что определит заболевание и назначит нужное лечение.
Если патология развивается у ребенка от 1 года, то можно использовать следующие методы лечения:
- Приготовить отвар на основе календулы, ромашки или шалфея. Если ребенок понимает, попросить его ополоснуть рот, если от мал, то просто протирать слизистую, при помощи, смоченной в настое ваты.
- Использовать подсолнечное, облепиховое масло для смазки ран во рту.
 В дополнение можно готовить смесь из 1 ст.л. меда, белка и новокаина.
В дополнение можно готовить смесь из 1 ст.л. меда, белка и новокаина. - Применять для полоскания и обработки содовый раствор или перекись. После перекиси обязательно протирать раны настойкой прополиса.
При развитии стоматита любому человеку нужно понимать, что визуальные проявления – не основная проблема, поэтому нужно знать точные причины и воздействовать конкретно на них.
Если не избавиться от первопричины заболевания, то стоматит может рецидивировать, переходит в хроническую форму.
При первых признаках болезни лучше отложить самолечение, использование зеленки и альтернатив, а сразу обратиться к специалистам.
Полезное видео
Йод и зеленка: есть ли разница?
28 ноября 2019
Все мы помним, как в детстве после чересчур активных игр мама обрабатывала нам синяки и разбитые коленки йодом или зеленкой.
Что есть что?
“Бриллиантовый зеленый” или попросту «зеленка» представляет из себя зеленый порошковый краситель, растворенный в спирте. Этот антисептик получил признание только в России и странах СНГ. В других странах мира вы едва ли сможете его встретить. Отчасти его непопулярности способствует едкий зеленый цвет, а также слабо изученный состав.
А вот йод, напротив, можно найти в любой аптеке на Земном шаре и не только в форме раствора.
Оба вещества являются антисептиками продолжительного действия (в отличие, например, от перекиси водорода, которая требует частого повторного нанесения).
Как «работает» йод?
Йод вызывает приток крови к тканям, способствуя их быстрой регенерации. Однако он сильно подсушивает кожу, а в больших количествах может даже вызвать ожог. Поэтому им не стоит обрабатывать саму поврежденную поверхность. Чтобы избежать ожога, нанесите йод на кожу вокруг раны: это предотвратит попадание микробов.
Однако он сильно подсушивает кожу, а в больших количествах может даже вызвать ожог. Поэтому им не стоит обрабатывать саму поврежденную поверхность. Чтобы избежать ожога, нанесите йод на кожу вокруг раны: это предотвратит попадание микробов.
Применяйте средство только для небольших царапин и ссадин. Крупные и глубокие раны нуждаются в иной обработке. Однако если под рукой нет другого антисептика, то наносить йод можно и на открытую рану, предварительно разбавив его водой.
При этом йод незаменим, когда речь идет о лечении синяков, отеков и вывихов. Вызывая приток крови, он стимулирует быстрое восстановление тканей. Наносите йод сеткой на поврежденное место и обновляйте “рисунок” по мере того, как он бледнеет. Кроме того, йод, за счет своих подсушивающих свойств, отлично борется с прыщами.
Особенности зеленки
Зеленка наоборот действует мягко и не сжигает кожу, благодаря чему ее можно наносить прямо на открытую рану. Она проникает в ткани глубже, отлично подсушивает и защищает от нагноений. При этом ее действие продолжительнее, чем у йода, благодаря чему зеленка незаменима, когда нужна длительная защита от микробов.
При этом ее действие продолжительнее, чем у йода, благодаря чему зеленка незаменима, когда нужна длительная защита от микробов.
Средство подходит не только для обработки ран, но и для лечения высыпаний во время ветрянки или герпеса. Однако помните, что если зеленка попадет на одежду, то отстирать ее будет фактически невозможно!
Итак, под рукой действительно лучше держать оба средства, но, не заменяя одно другим. Вывод прост: йод — для небольших ссадин, закрытых травм и синяков, зеленка — для более крупных ран и нагноений. Лечитесь правильно!
Обнаружение кислотоустойчивых бацилл в слюне с использованием метода флуоресценции, индуцированной красителем Папаниколау, по сравнению с окрашиванием флуорохромом: оценочное исследование
J Int Oral Health. 2015 июль; 7(7): 115–120.
, 1 , 2 , 3 , 4 , 5, 6 и 7
Авторская информация. Примечания Copyright и лицензионная информация о сборе
Фона:
Пятьдесят годы. после эффективной химиотерапии туберкулез (ТБ) по-прежнему остается ведущей инфекционной причиной смертности среди взрослых.
после эффективной химиотерапии туберкулез (ТБ) по-прежнему остается ведущей инфекционной причиной смертности среди взрослых.
Цель настоящего исследования заключалась в оценке диагностической ценности флуоресцентного микроскопического исследования мазков слюны, индуцированного окрашиванием Папаниколау (Пап), в диагностике туберкулеза легких.
Материалы и методы:
Поперечное исследование 100 лиц с клиническим подозрением на активный туберкулез легких. Контрольная группа – 50 человек, страдающих любым заболеванием легких, кроме туберкулеза, таким как пневмония или бронхогенная карцинома.
Флуоресцентное микроскопическое исследование двух мазков слюны, окрашенных по Папаниколау и аурамин-родамином (A-R) соответственно для каждого пациента. Мазок мокроты, окрашенный по Цилю-Нильсену, исследовали под световым микроскопом у каждого пациента. Всем пациентам проводили посев для микробиологического подтверждения.
Хи-квадрат Макнемара, тест Каппа и Z -тест.
Результаты:
Чувствительность трех методов окрашивания с использованием культуры в качестве эталонного метода составила 93,02%, 88,37% и 87,20% для Pap, A-R и Циля-Нильсона соответственно.
Заключение:
Индуцированная Папаниколау флуоресценция мазков слюны является безопасным, надежным и быстрым методом, который может оказаться ценным диагностическим инструментом для диагностики ТБ.
Ключевые слова: Флуоресцентная микроскопия, окраска флюорохромом, окраска по Папаниколау, туберкулез легких, мазок слюны
Мир медицинской науки изобилует множеством состояний, как физиологических, так и патологических, которые проявляются разнообразными симптомами и обычно имеют пеструю историю. Над некоторыми человек одержал победу. С другими он продолжает вести беспощадную борьбу, одним из таких заболеваний является туберкулез (ТБ). Последние глобальные статистические данные свидетельствуют о 8,6 миллиона случаев заболевания туберкулезом и 1,3 миллиона случаев смерти. 1 Этот кризис, связанный с туберкулезом, еще больше усугубился с началом эпидемии ВИЧ и появлением туберкулеза с множественной лекарственной устойчивостью.2
1 Этот кризис, связанный с туберкулезом, еще больше усугубился с началом эпидемии ВИЧ и появлением туберкулеза с множественной лекарственной устойчивостью.2
Пациенты с положительными мазками несут наибольшее количество туберкулезных бацилл и являются наиболее заразными и, следовательно, наиболее важными пациентами, которых необходимо выявить на ранней стадии. Культура, золотой стандарт в окончательной диагностике, трудоемка и очень медленна. Флуоресцентная микроскопия с использованием флуорохромов (аурамин-родамин [A-R]) более чувствительна и быстра по сравнению с обычной микроскопией с окрашиванием по Цилю-Нильсену (Z-N).3–9 Однако фенол и родамин, используемые в этой методике, токсичны и канцерогенны, результаты также могут возникать из-за окрашивания неодушевленных предметов, поэтому этот метод еще не стал рутинным.10,
Окрашивание по Папаниколау (Пап) широко используется в рутинной цитологической оценке образцов, взятых из дыхательных путей. Его значение для флуоресцентной микроскопии при диагностике различных легочных инфекционных заболеваний хорошо известно. 11 В мазках, окрашенных по Папаниколау, можно легко идентифицировать слегка изогнутые, четкие бациллы туберкулеза.12 Этот новый метод, являющийся рутинным окрашиванием, устраняет необходимость в дополнительном окрашивании, таким образом экономия времени и материала. Это позволяет проводить как проспективный, так и ретроспективный анализ случаев, когда материал для окрашивания другими методами недоступен, и устраняет необходимость реставрировать существующие препараты.
11 В мазках, окрашенных по Папаниколау, можно легко идентифицировать слегка изогнутые, четкие бациллы туберкулеза.12 Этот новый метод, являющийся рутинным окрашиванием, устраняет необходимость в дополнительном окрашивании, таким образом экономия времени и материала. Это позволяет проводить как проспективный, так и ретроспективный анализ случаев, когда материал для окрашивания другими методами недоступен, и устраняет необходимость реставрировать существующие препараты.
Несмотря на достижения в диагностических методах, получение образца мокроты хорошего качества является сложной задачей. Таким образом, изучение альтернативной диагностической среды заслуживает внимания. Значение слюны как индикатора системного заболевания было тщательно изучено Манделем и его коллегами.13,14 Холани и др. .15 успешно продемонстрировали присутствие туберкулезных палочек в слюне с помощью окрашивания флуорохромом. Исследование Гонсалеса Медьеро и др. ,16 с использованием коммерческих методов амплификации нуклеиновых кислот, также указывают на то, что слюна может использоваться в качестве альтернативного биологического образца для экспресс-диагностики легочного ТБ. Кроме того, его прямое отношение к стоматологии побудило его использовать в настоящем исследовании.
Кроме того, его прямое отношение к стоматологии побудило его использовать в настоящем исследовании.
Основная цель этого исследования заключалась в оценке эффективности образцов слюны при обнаружении туберкулезных палочек с помощью флуоресценции Папаниколау и сравнении ее с окрашиванием A-R.
Выбор случая
Исследовательская группа проспективно включала 100 последовательно диагностированных случаев туберкулеза легких. Клинический диагноз был подтвержден рентгенографическим исследованием органов грудной клетки. Эксперименты проводились с пониманием и информированным согласием каждого пациента.
В качестве контроля использовали в общей сложности 50 случаев пневмонии, бронхогенной карциномы или любого другого легочного заболевания, кроме туберкулеза.
Исследование было независимо рассмотрено и одобрено местным советом по этике, связанным с учреждением.
Сбор образцов
Сбор мокроты: Мокроту в течение 24 часов собирали в сухие стерильные флаконы.
Сбор слюны: Цельные, нестимулированные ранним утром образцы слюны, собранные в отдельные стерильные контейнеры с помощью метода сплевывания, используемого для сбора приблизительно 4-5 куб.см.
Из осадка слюны, полученного после центрифугирования, готовили два мазка. Один влажный мазок фиксировали в течение 1 ч из 95% этиловым спиртом и окрашивали красителем по Папаниколау.17 Другой фиксировали всухую, пропуская через пламя 2-3 раза, и окрашивали методом A-R.18 ) и отрицательный контроль мазков слюны готовили из осадка слюны здорового человека для обоих методов окрашивания.
Мазки мокроты окрашивали методом Z-N. Часть образца мокроты также использовали для посева на среду Левенштейна-Дженсона (L-J).
Все культуры инкубировали при 35-37°C в течение 8-12 недель. Культуры проверяли ежедневно в течение 12 недель, прежде чем сообщать об их отрицательном результате. Рост подтвержден микроскопическим исследованием кислотоустойчивых бацилл (КУБ) мазков, приготовленных из колоний.
Мазки мокроты, окрашенные Z-N, и рост культуры были оценены обученным персоналом лаборатории, который не знал клинических данных и результатов окрашенных A-R и Папаниколау мазков слюны. Культура использовалась в качестве эталона/золотого стандарта для оценки чувствительности и специфичности процедур мазка. Загрязненные результаты культур были исключены из исследования.
Оценка мазка
Мазки мокроты, окрашенные Z-N, исследовали под 100-кратным (иммерсионным) объективом и классифицировали в соответствии с классификацией Пересмотренной национальной программы борьбы с туберкулезом.10 наблюдали под флуоресцентным микроскопом отраженного света Olympus. Они были рассмотрены независимо двумя разными наблюдателями, которые не знали результатов микроскопии и посева мокроты.
Также оценивались неокрашенные мазки и мазки, окрашенные каждым из отдельных компонентов окраски по Папаниколау (оранжевый G, эозин, гематоксилин Харриса) по отдельности. Микобактерии не проявляли флуоресценции в неокрашенных мазках или при окрашивании только гематоксилином Харриса. В мазках, окрашенных только Orange G и эозином, микроорганизмы были видны, но с меньшей интенсивностью, чем в мазках, окрашенных по Папаниколау. Мазки сканировали в соответствии с сеткой, предложенной Национальным институтом туберкулеза.10
В мазках, окрашенных только Orange G и эозином, микроорганизмы были видны, но с меньшей интенсивностью, чем в мазках, окрашенных по Папаниколау. Мазки сканировали в соответствии с сеткой, предложенной Национальным институтом туберкулеза.10
Мазки положительного и отрицательного контроля использовались в качестве эталона при оценке мазков исследуемой группы. Сначала мазки сканировали и классифицировали при высоком увеличении (40×), а обнаруженные туберкулезные бациллы затем наблюдали при погружении в масло (100×) и подтверждали морфологию. Поправочный коэффициент увеличения «5» использовался при оценке оценки флуоресцентной микроскопии для обеспечения единообразия исследования и количественного представления результатов.10 Отрицательный отчет не давался до тех пор, пока не было исследовано не менее 100 полей зрения.
Оценка мазков
Открыть в отдельном окне
Чувствительность, специфичность и положительная прогностическая ценность (PPV) и отрицательная прогностическая ценность (NPV) были получены для каждого метода с использованием культуры в качестве эталона. Чувствительность, специфичность, PPV и NPV рассчитывали по следующим формулам: Чувствительность = (а/[а+с])×100; специфичность = (d/[b+d])×100; PPV = (а/[а+b])×100; и NPV = (d/[c+d])×100; где a — количество истинно положительных результатов, b — количество ложноположительных результатов, c — количество ложноотрицательных результатов, а d — количество истинно отрицательных образцов.19Корреляцию между процедурами окрашивания и культурой определяли с помощью теста Каппа и критерия хи-квадрат МакНемара ( х 2 ).19 Тест Z оценивал разницу в пропорции цитологических мазков A-R и флуоресцентного окрашивания Папаниколау. 19
Чувствительность, специфичность, PPV и NPV рассчитывали по следующим формулам: Чувствительность = (а/[а+с])×100; специфичность = (d/[b+d])×100; PPV = (а/[а+b])×100; и NPV = (d/[c+d])×100; где a — количество истинно положительных результатов, b — количество ложноположительных результатов, c — количество ложноотрицательных результатов, а d — количество истинно отрицательных образцов.19Корреляцию между процедурами окрашивания и культурой определяли с помощью теста Каппа и критерия хи-квадрат МакНемара ( х 2 ).19 Тест Z оценивал разницу в пропорции цитологических мазков A-R и флуоресцентного окрашивания Папаниколау. 19
Из 100 оцененных случаев все были в возрасте старше 16 лет с диапазоном от 16 до 65 лет. Пик заболеваемости приходится на вторую-третью декаду. Соотношение мужчин и женщин было 2,7:1.
Результаты окрашивания Z-N
КУМ виден в виде ярко-красных палочек на синем фоне. Они представляли собой прямые или слегка изогнутые стержни размером примерно 0,5 см × 3 см, встречающиеся поодиночке, парами и небольшими группами.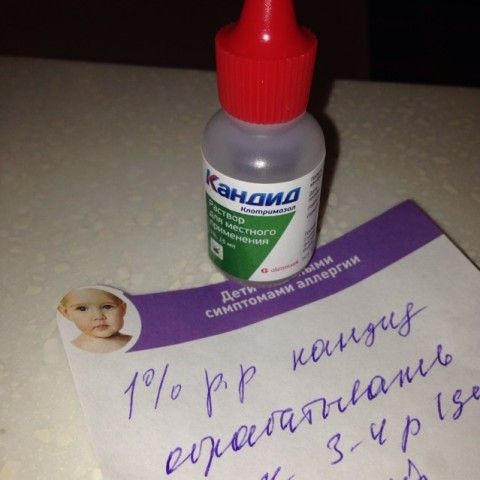 Из 100 мазков мокроты, окрашенных Z-N, 81 был положительным на КУМ.
Из 100 мазков мокроты, окрашенных Z-N, 81 был положительным на КУМ.
Открыть в отдельном окне
Окраска по Цилю-Нильсену В мазке мокроты видны кислотоустойчивые палочки в виде ярко-красных палочек на синем фоне (×1000).
Результаты окрашивания по Папаниколау
Флуоресцентные бациллы выглядели как тонкие, часто четкие, желто-зеленые, прямые или слегка изогнутые палочки относительно одинаковой длины на темном фоне. Некоторые демонстрируют гетерогенную флуоресценцию с более светлыми концами (рис. Из 100 85 случаев были положительными по этому методу.
Открыть в отдельном окне
Флуоресцирующие бациллы выглядели как тонкие, часто четкие, желто-зеленые, либо прямые/слегка изогнутые палочки относительно одинаковой длины на темном фоне. Некоторые демонстрируют гетерогенную флуоресценцию с более светлыми концами (×400).
Дополнительные наблюдения. мазки (×1000).
Фрагменты туберкулезных микобактерий наблюдались у пяти больных, перенесших в анамнезе туберкулез легких и получавших в анамнезе противотуберкулезное лечение.
Окрашивание A-R
Морфологические данные были такими же, как и при флуоресценции по Папаниколау, однако флуоресценция была более оранжевой. Туберкулезные бациллы выглядели как золотисто-желтые флуоресцирующие палочки на бледно-оранжевом темном фоне.
Открыть в отдельном окне
Окрашивание аурамином-родамином, при котором бациллы туберкулеза были видны в виде золотисто-желтых флуоресцирующих палочек на бледно-оранжевом/темном фоне (×1000).
Ни один из пациентов контрольной группы не был зарегистрирован как положительный при любом из трех методов окрашивания (.)
Таблица 1
Распределение различных степеней, полученных тремя методами окрашивания.
Открыть в отдельном окне
Результаты посева
Из 100 случаев исследуемой группы в 86 наблюдался положительный рост в виде сухих, шероховатых приподнятых, неправильной формы, желтоватых или желтоватых колоний с морщинистой поверхностью (). Из 86 случаев положительной культуры 80 были положительными по мазкам слюны, окрашенным по Папаниколау, 76 были положительными по мазкам слюны, окрашенным AR, и 75 были положительными по мазкам мокроты, окрашенным Z-N. Ни у одного из пациентов контрольной группы не было отмечено положительного роста.
Ни у одного из пациентов контрольной группы не было отмечено положительного роста.
Результаты статистического анализа ()
Таблица 2
Сравнение чувствительности, специфичности, PPV и NPV трех методов окрашивания.
Открыть в отдельном окне
Анализ хи-квадрата Макнемара не выявил существенной разницы между результатами трех окрашиваний и результатами посева ( х 2 < 3,84).
Каппа-статистика показала хорошее соответствие между результатами как окрашивания по Папаниколау, так и метода окрашивания A-R и культуры (K > 0,3).
Z -тест показал, что результаты двух методов окрашивания, окрашивания по Папаниколау и окрашивания AR, существенно не отличались ( Z = 0,342, P > 0,05).
Лабораторное тестирование на туберкулез сейчас претерпевает больше изменений, чем когда-либо прежде. Определение того, какой диагностический тест будет наиболее полезным для клинициста, является сложной задачей, а принятие новой технологии медицинским сообществом — еще более сложной задачей.
Несмотря на многие недавние успехи в применении молекулярных методов в микобактериологической лаборатории,16-20 микроскопическое исследование мазков КУМ остается недорогим и быстрым способом выявления высокоинфекционных пациентов. Он позволяет количественно оценить отсутствие выделяемых бацилл и остается краеугольным камнем инфекционного контроля.21,22 Существует консенсус в пользу флуоресцентной микроскопии в отличие от Z-N и других процедур световой микроскопии как метода обнаружения микобактериальной инфекции. .3-9
Диагностическое использование УФ-индуцированной флуоресценции для обнаружения инфекционных патогенов было впервые описано Graham (1983)23, а затем Mann (1983)24
Ghali et al . (1984)25 впервые продемонстрировали аутофлуоресценцию Pneumocystis carinii в мазках, окрашенных по Папаниколау. Их результаты показали, что эозин отвечает за аутофлуоресценцию. Основными компонентами окрашивания по Папаниколау являются OG-6, EA-65 или EA-50 (цитоплазматические пятна).
Шуман и Свенсен (1991),26 обнаружили, что окраска по Папаниколау лучше, чем окраска метенамином серебра по Гомори для цитодиагностики инфекции P. carinii в легких.
Согласно Купперу и др. . в 1995 г.,27 характерная морфология MTB позволяет легко отличить его от других микобактерий и немикобактериальных видов, которые также аутофлуоресцируют.
У пациентов с открытым легочным туберкулезом часто наблюдается изгнание туберкулезных палочек во время кашля.28 Appleton (1994)29 проанализировал появление бацилл туберкулеза во рту. Их часто обнаруживали во рту у больных открытым туберкулезом легких. Присутствие бацилл туберкулеза в слюне связывают с образованием инфицированных капель в глотке и переднем отделе рта. Эти области ранее были загрязнены мокротой, выделяемой из бронхов.28 Yassen et al. .30 также продемонстрировали туберкулезные бациллы в смешанной слюне, хотя и в небольшом количестве, в то время как в слюне околоушных слюнных желез их не было обнаружено, что свидетельствует о том, что микроорганизмы не секретируются в слюне. слюной, а возникают в результате контакта тканей полости рта с инфицированной мокротой.
слюной, а возникают в результате контакта тканей полости рта с инфицированной мокротой.
Исследования количественной оценки, проведенные Йегером и др. . (1967), 31 доказывает присутствие микроорганизмов, поддающихся культивированию изо рта, почти у всех пациентов с сильно положительной мокротой на бациллы туберкулеза. Количество туберкулезных бацилл находилось в приблизительном диапазоне от 1/100 до 1/10 000 от количества, обнаруженного в мокроте. Таким образом, слюна является потенциальной диагностической средой, которая гораздо менее инфекционна и ее легче собрать по сравнению с мокротой.
Этюд Холани и др. . доказали эффективность флуоресцентного метода АР с использованием слюны в качестве диагностической среды. Результаты настоящего исследования также подтверждают, что микроорганизмы обнаруживаются в слюне, как сообщалось ранее15,16,20,22-28, без использования токсичных и канцерогенных материалов, таких как фенол и родамин.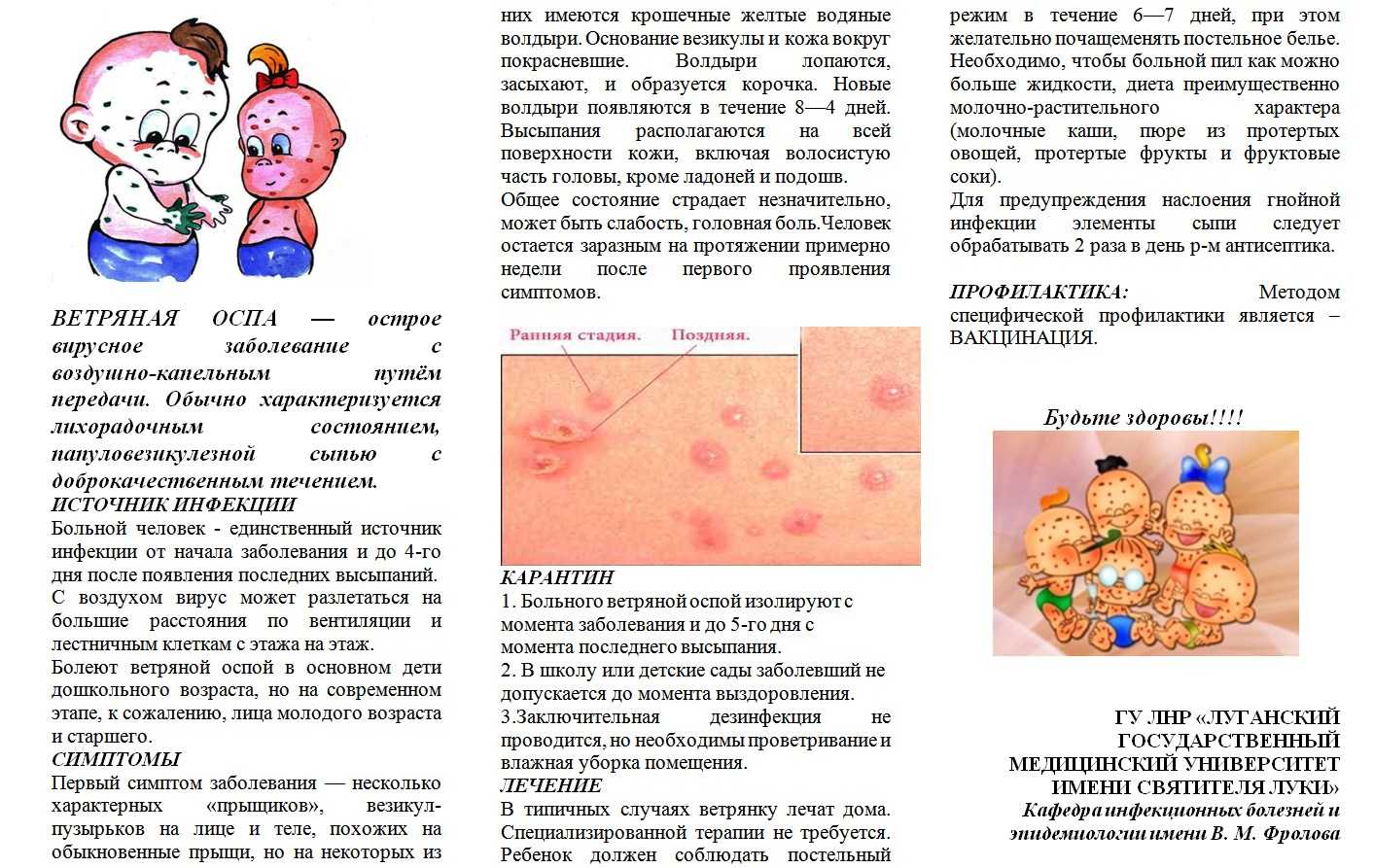
Из 100 пациентов, участвовавших в настоящем исследовании, КУМ удалось обнаружить у 85 с помощью метода флуоресценции Папаниколау. Из них 80 были также положительными при посеве, а 5 были отрицательными при посеве, но положительными при окрашивании Z-N мазков мокроты. Таким образом, 5 отрицательных результатов при культивировании не указывают на ложноположительный результат, но могут быть связаны с задержкой культивирования образцов, поскольку они были культивированы в периодическом режиме, что снижает жизнеспособность бацилл. Из 15, которые были отрицательными, 6 были положительными при культивировании (т.е. 6 не были обнаружены методом флуоресценции по Папаниколау), но показали очень скудный рост (2-4 колонии). Таким образом, отрицательные результаты мазков можно объяснить низкой бациллярной нагрузкой. Посев очень чувствителен и может обнаружить до десяти жизнеспособных бацилл.4,32 Кроме того, бациллы выделяются только периодически в выделениях, что может объяснить отрицательный результат мазка. 32,
32,
Высокая положительная прогностическая ценность в настоящем исследовании может быть частично обусловлена более высокой распространенностью ТБ в популяции пациентов, поскольку оценивались только те, кто обращался в грудную клетку и ТБ отделение.
В настоящем исследовании флуоресценцию Папаниколау сравнивали с методом окрашивания A-R в слюне. Результаты показали, что флуоресценция Папаниколау лишь незначительно превосходила обнаружение КУМ, но разница не была статистически значимой ( P > 0,05).
Сравнение специфичности и чувствительности флуоресценции Папаниколау, о которой сообщается в литературе, затруднено, поскольку исследуемый материал, оцениваемые микроорганизмы и критерии отчетности различаются в каждом исследовании.
Küpper et al .33 сообщили о значительной разнице между чувствительностью флуоресценции Папаниколау (FMP), флуоресценции A-R (FMA) и окрашивания Z-N соответственно для их способности обнаруживать атипичные Mycobacterium kansasi в цитологических образцах.
Хотя Куппер и др. . (1994),34 сообщили о высокой чувствительности и специфичности флуоресценции Папаниколау при обнаружении микобактерий в бронхиальном секрете, они также сообщают, что этот метод бесполезен при исследовании цитологических препаратов образцов плеврального выпота на микобактерии. Возможная причина заключается в том, что среда плеврального выпота повреждает или разрушает целостность структур, ответственных за флуоресценцию микобактерий, которые, таким образом, не могут быть обнаружены.
Слюна, используемая в качестве диагностической среды в настоящем исследовании, не влияла на флуоресценцию микобактерий и, следовательно, является многообещающей в качестве альтернативной диагностической среды. Высокая чувствительность (93,02%), полученная в настоящем исследовании, еще раз подтверждает достоверность этого метода для экспресс-диагностики туберкулеза легких.
Преимущество флуоресцентной микроскопии заключается в простоте обнаружения бацилл благодаря цветовому контрасту, позволяющему сканировать большую площадь мазка при меньшем увеличении по сравнению с обычным окрашиванием Z-N. Поскольку окрашивание по Папаниколау обычно используется в цитологии, оно экономит время и материал, которые потребовались бы для любого дополнительного окрашивания, а также позволяет избежать использования токсичных или канцерогенных веществ, таких как фенол и родамин, которые используются в методе окрашивания AR.
Поскольку окрашивание по Папаниколау обычно используется в цитологии, оно экономит время и материал, которые потребовались бы для любого дополнительного окрашивания, а также позволяет избежать использования токсичных или канцерогенных веществ, таких как фенол и родамин, которые используются в методе окрашивания AR.
Он позволяет проводить как проспективный, так и ретроспективный анализ случаев, когда материал для окрашивания другими методами недоступен, и устраняет необходимость реставрировать существующие предметные стекла.
Он также предлагает преимущество одновременной идентификации других агентов, таких как Pneumocystiis carinii , Aspergilli и Candida , в материале, полученном в первую очередь для диагностики ТБ, особенно у пациентов с ослабленным иммунитетом.20,22,35
К лицам с повышенным риском заболевания туберкулезом относятся стоматологи и их ассистенты, контактирующие с заразными каплями от своих пациентов. Метод, использованный в настоящем исследовании, позволяет быстро идентифицировать эти инфекционные источники и, следовательно, предотвратить дальнейшую передачу, и, таким образом, важен для борьбы с ТБ.
Настоящее исследование, направленное на создание новой области исследований, также еще больше подчеркивает ценность диагностики слюны. Однако этот метод следует использовать в первую очередь как метод скрининга, и каждый диагноз должен быть подтвержден микробиологической культурой.
Области будущих исследований
Результаты этого исследования должны быть дополнительно подтверждены расширенными, хорошо спланированными исследованиями с большим размером выборки. Необходимы исследования для повышения специфичности анализа слюны, чтобы максимизировать его полезность. Влияние флуоресцентной микроскопии необходимо более тщательно изучить на ВИЧ-инфицированных, у которых микроскопия, как правило, дает низкие результаты.
Капитальные затраты, связанные с флуоресцентной микроскопией, в последние годы снизились, однако необходимо провести адекватные исследования того, как флуоресцентная микроскопия будет работать в условиях общего здравоохранения.
Конфликт интересов: Нет
Источник поддержки: нет
1. Всемирный отчет ВОЗ по туберкулезу. ВОЗ/HTM/ТБ/2013.11. 2013. [Последнее обращение: 3 апреля 2013 г.]. Доступно по адресу: http://www.who.int/tb/publications/global_report/en, http://www.who.int/iris/handle/10665/9.1355 .
Всемирный отчет ВОЗ по туберкулезу. ВОЗ/HTM/ТБ/2013.11. 2013. [Последнее обращение: 3 апреля 2013 г.]. Доступно по адресу: http://www.who.int/tb/publications/global_report/en, http://www.who.int/iris/handle/10665/9.1355 .
2. Коннолли С., Дэвис Г.Р., Уилкинсон Д. Влияние эпидемии вируса иммунодефицита человека на смертность среди взрослых больных туберкулезом в сельских районах Южной Африки, 1991–1995 гг. Int J Tuberc Lung Dis. 1989;2(11):919–25. [PubMed] [Google Scholar]
3. Hale YM, Pfyffer GE, Salfinger M. Лабораторная диагностика микобактериальных инфекций: новые инструменты и извлеченные уроки. Клин Инфекция Дис. 2001;15(33):834–46. [PubMed] [Google Scholar]
4. Джейн Н.К. Лабораторная диагностика туберкулеза легких: традиционные и новые подходы. Индиан Джей Туберк. 1996;43:107. [Google Scholar]
5. Кумар Н., Тивари М.С., Верма К. Окрашивание КУМ в цитодиагностике туберкулеза без классических признаков: сравнение методов Циля-Нильсена и флуоресцентных. Цитопатология. 1998;9(3):208–14. [PubMed] [Google Scholar]
Цитопатология. 1998;9(3):208–14. [PubMed] [Google Scholar]
6. Kuper SW, May JR. Обнаружение кислотоустойчивых микроорганизмов в срезах тканей методом флуоресцентной микроскопии. Дж. Патол Бактериол. 1960; 79: 59–68. [PubMed] [Google Scholar]
7. McCarter YS, Robinson A. Обнаружение кислотоустойчивых бацилл в концентрированных мазках первичных образцов, окрашенных аураминродамином при комнатной температуре и при 37°C. Дж. Клин Микробиол. 1994;32(10):2487–89. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Somlo AM, Black TC, Somlo LI. Значение флуоресцентной микроскопии в выявлении кислотоустойчивых бактерий. Ам Джей Клин Патол. 1969; 51: 519–22. [PubMed] [Google Scholar]
9. Kivihya-Ndugga LE, van Cleeff MR, Githui WA, Nganga LW, Kibuga DK, Odhiambo JA, et al. Всестороннее сравнение микроскопии Циля-Нильсена и флуоресцентной микроскопии для диагностики туберкулеза в городских условиях с ограниченными ресурсами. Int J Tuberc Lung Dis. 2003;7(12):1163–71. [PubMed] [Академия Google]
[PubMed] [Академия Google]
10. Вейер К., Кантор И., Ким С.Дж. Лабораторные услуги по борьбе с туберкулезом. ВОЗ/ТБ/98.258. Первое индийское издание. сек. II. Нью-Дели: AITBS; 2002. Микроскопия; стр. 79–111. [Google Scholar]
11. Küpper T, Gore C, Gore R, Wehle K, Marzahn S, Pfitzer P. Флуоресцентная микроскопия микобактерий в плевральных выпотах. Цитопатология. 1999;10:303–7. [PubMed] [Google Scholar]
12. Kupper TH, Wehle K, Pfitzer P. Флуоресцентная микроскопия препаратов, окрашенных по Папаниколау. Акта Цитол. 1994;38(4):64. [Google Scholar]
13. Идентификатор Манделя. Диагностическое использование слюны. Дж Орал Патол Мед. 1990;19(3):119–25. [PubMed] [Google Scholar]
14. Идентификатор Манделя. Слюнный диагноз: Обещания, обещания. Энн Н.Ю. Академия наук. 1993; 694:1–10. [PubMed] [Google Scholar]
15. Holani AG, Ganvir SM, Shah NN, Bansode SC, Shende I, Jawade R, et al. Демонстрация Mycobacterium tuberculosis в мазках мокроты и слюны больных туберкулезом с использованием окраски по Цилю-Нильсену и флуорохрома — сравнительное исследование. J Clin Diagn Res. 2014;8(7):ZC42–5. [Бесплатная статья PMC] [PubMed] [Google Scholar]
J Clin Diagn Res. 2014;8(7):ZC42–5. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. González Mediero G, Vázquez Gallardo R, Pérez Del Molino M, Diz Dios P. Оценка двух коммерческих наборов для амплификации нуклеиновых кислот для обнаружения Mycobacterium tuberculosis в образцах слюны. Оральный Дис. 2014 [PubMed] [Google Scholar]
17. Bourne LD. Эксфолиативная цитология. В: Бэнкрофт Дж. Д., Стивенс А., редакторы. Теория и практика гистологических методов. 2-е изд. Эдинбург: Черчилль Ливингстон; 1996. С. 429–30. [Google Scholar]
18. Matthaei E. Упрощенная флуоресцентная микроскопия туберкулезных палочек. Дж. Клин Микробиол. 1950;4:393-8. [Google Scholar]
19. Махаджан Б.К. Методы биостатистики. 4-е изд. Индия: публикации Инду Махаджана; 1984. [Google Scholar]
20. Phalane KG, Kriel M, Loxton AG, Menezes A, Stanley K, van der Spuy GD, et al. Дифференциальная экспрессия биомаркеров хозяина в образцах слюны и сыворотки от лиц с подозрением на туберкулез легких. Mediators Inflamm 2013. 2013 981984. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Mediators Inflamm 2013. 2013 981984. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Shinnick TM, Good RC. Лабораторная практика диагностической микобактериологии. Клин Инфекция Дис. 1995;21:291–9. [PubMed] [Google Scholar]
22. Aber VR, Allen BW, Mitchison DA, Ayuma P, Edwards EA, Keyes AB. Контроль качества в бактериологии туберкулеза 1. Лабораторные исследования на выделенных положительных культурах и эффективность прямого исследования мазка. бугорок. 1980;61(3):123–33. [PubMed] [Google Scholar]
23. Грэм А.Р. Автофлуоресценция грибов при ультрафиолетовом освещении. Ам Джей Клин Патол. 1983; 79: 231–4. [PubMed] [Google Scholar]
24. Манн Дж.Л. Автофлуоресценция грибов: помощь в обнаружении в срезах тканей. Ам Джей Клин Патол. 1983;79(5):587–90. [PubMed] [Google Scholar]
25. Гали В.С., Гарсия Р.Л., Сколом Дж. Флуоресценция Pneumocystis carinii в мазках Папаниколау. Хум Патол. 1984; 15 (10): 907–9. [PubMed] [Google Scholar]
26. Шуман Г.Б., Свенсен Дж.Дж. Сравнение окраски Папаниколау с окраской Гомори метенамин-серебро (GMS) для цитодиагностики Pneumocystis carinii в жидкости бронхоальвеолярного лаважа (БАЛ). Ам Джей Клин Патол. 1991; 95 (4): 583–6. [PubMed] [Академия Google]
Шуман Г.Б., Свенсен Дж.Дж. Сравнение окраски Папаниколау с окраской Гомори метенамин-серебро (GMS) для цитодиагностики Pneumocystis carinii в жидкости бронхоальвеолярного лаважа (БАЛ). Ам Джей Клин Патол. 1991; 95 (4): 583–6. [PubMed] [Академия Google]
27. Küpper T, Steffen U, Wehle K, Richartz G, Pfitzer P. Морфологическое исследование бактерий дыхательной системы с помощью флуоресцентной микроскопии мазков, окрашенных по Папаниколау, с особым вниманием к идентификации Mycobacteria sp. Цитопатология. 1995;6(6):388–402. [PubMed] [Google Scholar]
28. Duguid JP. Изгнание болезнетворных организмов из дыхательных путей. Br Med J. 1946; 1: 265–8. [PubMed] [Google Scholar]
29. Нильд Н., Данкли Э.В. Роль слюны в передаче туберкулеза. Ланцет. 1909;176:1096. [Google Scholar]
30. Yassen G, Noori J, Sabri N. Обнаружение кислотоустойчивых бацилл в слюне больных туберкулезом легких. Дж. Багдад Колл Дент. 2012;24(3):59–62. [Google Scholar]
31. Yeager H, Jr, Lacy J, Smith LR, LeMaistre CA. Количественные исследования популяций микобактерий в мокроте и слюне. Ам преподобный Респир Дис. 1967; 95 (6): 998–1004. [PubMed] [Google Scholar]
Yeager H, Jr, Lacy J, Smith LR, LeMaistre CA. Количественные исследования популяций микобактерий в мокроте и слюне. Ам преподобный Респир Дис. 1967; 95 (6): 998–1004. [PubMed] [Google Scholar]
32. Dye C, Watt CJ, Bleed D. Низкий доступ к высокоэффективной терапии: проблема международной борьбы с туберкулезом. Всемирный орган здравоохранения Быка. 2002;80(6):437–44. [Бесплатная статья PMC] [PubMed] [Google Scholar]
33. Küpper T, Wehle K, Marzahn S, Pfitzer P. Цитологический диагноз Mycobacterium kansasi tuberculosis с помощью флуоресцентной микроскопии образцов, окрашенных по Папаниколау. Цитопатология. 1995;6(5):331–38. [PubMed] [Google Scholar]
34. Kupper TH, Spies S, Wehle K, Pfitzer P. Обнаружение кристаллов шарко с помощью флуоресцентной микроскопии окрашенных по папаниколау мазков мокроты, жидкости бронхоальвеолярного лаважа и бронхиального секрета. Цитопатология. 1994;5(5):262–9. [PubMed] [Академия Google]
35. Hettlich C, Küpper TH, Wehle K, Pfitzer P. Aspergillus в окраске по Папаниколау: морфология, флуоресценция и диагностическая осуществимость. Цитопатология. 1998;9(6):381–8. [PubMed] [Google Scholar]
Aspergillus в окраске по Папаниколау: морфология, флуоресценция и диагностическая осуществимость. Цитопатология. 1998;9(6):381–8. [PubMed] [Google Scholar]
Методы диагностики плоскоклеточного рака: обширный обзор литературы с учетом толуидинового синего как полезного дополнения
1. Enwonwu CO, Phillips RS, Ibrahim CD, Danfillo IS. Питание и здоровье полости рта в Африке. Инт Дент Дж. 2004; 54: 344–351. [PubMed] [Академия Google]
2. Эпштейн Дж. Б., Чжан Л., Розин М. Достижения в диагностике предраковых и злокачественных поражений полости рта. J Can Dent Assoc. 2002;68(10):617–621. [PubMed] [Google Scholar]
3. Gray MGL, Burls A, Elley K (2000) Клиническая эффективность красителя толуидинового синего в качестве дополнения к скринингу рака ротовой полости в общей стоматологической практике. Отчет службы развития и оценки Уэст-Мидлендса. http://www.pcpoh.bham.ac.uk/publichealth/wmhtac/pdf/toludine_blue.pdf
4. Johnson N, Franceschi S, Ferlay J, et al. (2005) Плоскоклеточный рак: опухоли полости рта и ротоглотки (глава 4). В: Barnes L, Eveson JW, Reichart P, Sidransky D (eds) Классификация опухолей, патологии и генетики опухолей головы и шеи Всемирной организации здравоохранения. Лион: публикация IARC. http://www.iarc.fr/IARCPress/pdfs/bb9/bb9-chap4.pdf.4. Американское онкологическое общество. Факты и цифры 2007. http://www.cancer.org/downloads/STT/2008CAFFfinalsecured.pdf
(2005) Плоскоклеточный рак: опухоли полости рта и ротоглотки (глава 4). В: Barnes L, Eveson JW, Reichart P, Sidransky D (eds) Классификация опухолей, патологии и генетики опухолей головы и шеи Всемирной организации здравоохранения. Лион: публикация IARC. http://www.iarc.fr/IARCPress/pdfs/bb9/bb9-chap4.pdf.4. Американское онкологическое общество. Факты и цифры 2007. http://www.cancer.org/downloads/STT/2008CAFFfinalsecured.pdf
5. Bettendorf O, Piffkò J, Bankfalvi A. Прогностические и прогностические факторы плоскоклеточного рака полости рта: важные инструменты для индивидуального планирования терапия? Оральный онкол. 2004; 40:110–119. doi: 10.1016/j.oraloncology.2003.08.010. [PubMed] [CrossRef] [Google Scholar]
6. Американское онкологическое общество. Факты и цифры 2007. http://www.cancer.org/downloads/STT/2008CAFFfinalsecured.pdf
7. Розенберг Д., Кретин С. Использование метаанализа для оценки хлорида толония при скрининге рака полости рта. Oral Surg Oral Med Oral Pathol. 1989; 67: 621–627. doi: 10.1016/0030-4220(89)
1989; 67: 621–627. doi: 10.1016/0030-4220(89)
8. Машберг А., Самит А. Ранняя диагностика бессимптомного плоскоклеточного рака полости рта и ротоглотки. CA Рак J Clin. 1995; 45: 328–351. doi: 10.3322/canjclin.45.6.328. [PubMed] [CrossRef] [Google Scholar]
9. Epstein JB, Oakley C, Millner A, et al. Полезность применения толуидинового синего в качестве диагностической помощи у пациентов, ранее лечившихся от рака верхней части ротоглотки. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1997;83:537–547. doi: 10.1016/S1079-2104(97)
-7. [PubMed] [CrossRef] [Google Scholar]
10. Scuibba J. Улучшение обнаружения предраковых и раковых поражений полости рта. J Am Dent Assoc. 1999; 130:1445–1457. doi: 10.14219/jada.archive.1999.0055. [PubMed] [CrossRef] [Google Scholar]
11. Epstein JB, Zhang L, Poh C et al (2003) Повышенная потеря аллелей при злокачественных поражениях полости рта с положительным толуидиновым синим. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 95:45–50 [PubMed]
Oral Surg Oral Med Oral Pathol Oral Radiol Endod 95:45–50 [PubMed]
12. Национальный институт рака (2003) Обзор статистики рака SEER 1975–2003
13. Цантулис П.К., Кастринакис Н.Г., Турвас А.Д., и соавт. Достижения в области биологии рака полости рта. Оральный онкол. 2007; 43: 523–534. doi: 10.1016/j.oraloncology.2006.11.010. [PubMed] [CrossRef] [Google Scholar]
14. Yeole BB, Ramanakumar AV, Sankaranarayanan R. Выживание после рака полости рта в Мумбаи (Бомбей), Индия. Рак вызывает контроль. 2003; 14: 945–952. doi: 10.1023/B:CACO.0000007965.61579.b2. [PubMed] [CrossRef] [Google Scholar]
15. Ача А., Руэсга М.Т., Родригес М.Дж., Мартинес де Панкорбо М.А., Агирре Х.М. Применение соскоба (эксфолиативной) цитологии полости рта при раке полости рта и предраке. Med Oral Patol Oral Cir Bucal. 2005;10:95–102. [PubMed] [Google Scholar]
16. Мур С.Р., Джонсон Н.В., Пирс А.М., Уилсон Д.Ф. Эпидемиология рака полости рта: обзор глобальной заболеваемости. Оральный Дис. 2000;6(2):65–74. doi: 10.1111/j.1601-0825.2000.tb00104.x. [PubMed] [CrossRef] [Google Scholar]
2000;6(2):65–74. doi: 10.1111/j.1601-0825.2000.tb00104.x. [PubMed] [CrossRef] [Google Scholar]
17. Shafer WG, Hine MK, Levy BM. Учебник Шафера по патологии полости рта. 5. Нью-Дели: Elsevier India; 2008. [Google Scholar]
18. Su WW-Y, Yen AM-F, Chiu SY-H, Chen TH-H. Местное РКИ по скринингу рака полости рта с помощью толуидинового синего. Джей Дент Рез. 2010;89(9): 933–937. doi: 10.1177/0022034510373763. [PubMed] [CrossRef] [Google Scholar]
19. Bouquot JE, Farthing PM, Speight PM. Патология рака полости рта и предрака. Curr Diag Путь. 2006; 12:11–21. doi: 10.1016/j.cdip.2005.10.008. [CrossRef] [Google Scholar]
20. Sciubba JJ. Улучшение выявления предраковых и раковых поражений полости рта. Компьютерный анализ биопсии ротовой щетки. Совместная исследовательская группа OralCDx в США. J Am Dent Assoc. 2002; 133:272. дои: 10.14219/jada.архив.2002.0248. [PubMed] [CrossRef] [Google Scholar]
21. Bouquot JE, Suarez P, Vigneswaran N. Предраковое состояние полости рта и раннее выявление рака в стоматологическом кабинете — обзор новых технологий. J Implant Adv Clin Dent. 2010;2:47–63. [Google Scholar]
J Implant Adv Clin Dent. 2010;2:47–63. [Google Scholar]
22. Hohlweg-Majert B, Deppe H, Metzger MC, Schumm S, Hoefler H, Kesting MR, Hölzle F, Wolff KD. Чувствительность и специфичность биопсии ротовой полости. Рак Инвест. 2009;27(3):293–297. doi: 10.1080/07357
2266515. [PubMed] [CrossRef] [Академия Google]23. Редди С.Г., Канала С., Чигурупат А., Кумар С.Р., Поосарла С.С., Редди Б.В.Р. Чувствительность и специфичность компьютеризированной щеточной и скальпельной биопсии в диагностике предраковых поражений полости рта: сравнительное исследование. J Оральный челюстно-лицевой патол. 2012;16(3):349–353. doi: 10.4103/0973-029X.102482. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
24. Щеточная биопсия полости рта в раннем выявлении предраковых состояний и рака полости рта. Цитология в диагностике поражений полости рта из PubMed NIH.Gov 2006
25. Бабшет М., Нандимат К., Перватикар С.К., Найкмасур В.Г. Эффективность цитологии щетки полости рта при оценке предраковых и злокачественных поражений полости рта. J Цитол. 2011;28(4):165–172. doi: 10.4103/0970-9371.86342. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
J Цитол. 2011;28(4):165–172. doi: 10.4103/0970-9371.86342. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
26. Керр А.Р., Сируа Д.А., Эпштейн Дж.Б. Клиническая оценка хемилюминесцентного освещения: дополнение к исследованиям слизистой оболочки полости рта. Джей Клин Дент. 2006; 17:59–63. [PubMed] [Google Scholar]
27. Pierre M, Lane PM, Whitehead TGP, Zeng H, et al. Простое устройство для прямой визуализации полости рта. J Биомед Оптика. 2006; 11: 024–026. [PubMed] [Академия Google]
28. О Е.С., Ласкин Д.М. Эффективность системы ViziLite при выявлении поражений полости рта. J Oral Maxillofac Surg. 2007; 65: 424–426. doi: 10.1016/j.joms.2006.10.055. [PubMed] [CrossRef] [Google Scholar]
29. Trullenque-Eriksson A, Muñoz-Corcuera M, Campo-Trapero J, Cano-Sánchez J, Bascones-Martínez A. Анализ новых диагностических методов при подозрительных поражениях полости рта слизистая оболочка. Med Oral Patol Oral Cir Bucal. 2009; 14: 210–216. [PubMed] [Google Scholar]
30. Паттон Л.Л., Эпштейн Дж.Б., Керр А.Р. Дополнительные методы обследования рака полости рта и диагностики поражений: систематический обзор литературы. J Am Dent Assoc. 2008;139: 896–905. doi: 10.14219/jada.archive.2008.0276. [PubMed] [CrossRef] [Google Scholar]
Паттон Л.Л., Эпштейн Дж.Б., Керр А.Р. Дополнительные методы обследования рака полости рта и диагностики поражений: систематический обзор литературы. J Am Dent Assoc. 2008;139: 896–905. doi: 10.14219/jada.archive.2008.0276. [PubMed] [CrossRef] [Google Scholar]
31. Ram S, Siar CH. Хемилюминесценция как диагностический метод выявления рака ротовой полости и потенциально злокачественных поражений эпителия. Int J Oral Maxillofac Surg. 2005;34(5):521–527. doi: 10.1016/j.ijom.2004.10.008. [PubMed] [CrossRef] [Google Scholar]
32. Sambandham T, Masthan KMK, Kumar MS, Jha A. Применение Vizilite при раке полости рта. J Clin Diagn Res. 2013;7(1):185–186. [Бесплатная статья PMC] [PubMed] [Google Scholar]
33. Фара К.С., Маккалоу М.Дж. Экспериментальное исследование случай-контроль эффективности промывания уксусной кислотой и хемилюминесцентного освещения (ViziLite™) при визуализации белых поражений слизистой оболочки полости рта. Оральный онкол. 2007; 43: 820–824. doi: 10. 1016/j.oraloncology.2006.10.005. [PubMed] [CrossRef] [Google Scholar]
1016/j.oraloncology.2006.10.005. [PubMed] [CrossRef] [Google Scholar]
34. De Veld DC, Witjes MJ, Sterenborg HJ, Roodenburg JL. Статус аутофлуоресцентной спектроскопии и визуализации in vivo для онкологии полости рта. Оральный онкол. 2005;41:117–131. doi: 10.1016/j.oraloncology.2004.07.007. [PubMed] [CrossRef] [Академия Google]
35. Roblyer D, Richards-Kortum R, Sokolov K, et al. Мультиспектральное оптическое устройство визуализации для обнаружения неоплазии полости рта in vivo. J Биомед Опт. 2008;13(2):024019. doi: 10.1117/1.2
8. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
36. Skala MC, Riching KM, Gendron-Fitzpatrick A, Eickhoff J, Eliceiri KW, White JG, Ramanujam N. Многофотонная микроскопия NADH и FAD in vivo окислительно-восстановительные состояния, время жизни флуоресценции и клеточная морфология в предраковом эпителии. ПНАС. 2007;104:19494–19499. doi: 10.1073/pnas.0708425104. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
37. Roblyer D, Kurachi C, Stepanek V, Williams MD, El-Naggar AK, Lee JJ, Gillenwater AM, Richards-Kortum R. Объективное обнаружение и разграничение неоплазии полости рта с помощью аутофлуоресцентной визуализации. Cancer Prev Res (Phila Pa) 2009; 2: 423–431. doi: 10.1158/1940-6207.CAPR-08-0229. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Roblyer D, Kurachi C, Stepanek V, Williams MD, El-Naggar AK, Lee JJ, Gillenwater AM, Richards-Kortum R. Объективное обнаружение и разграничение неоплазии полости рта с помощью аутофлуоресцентной визуализации. Cancer Prev Res (Phila Pa) 2009; 2: 423–431. doi: 10.1158/1940-6207.CAPR-08-0229. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
38. Poh CF, Williams PM, Zhang L, Rosin MP. Внимание! Призыв к стоматологам проводить скрининг на рак ротовой полости. J Can Dent Assoc. 2006;72(5):413–416. [PubMed] [Академия Google]
39. Westra WH, Sidransky D. Флуоресцентная визуализация при оральной неоплазии: пролить свет на старую проблему. Клин Рак Рез. 2006;12(22):6594–6597. doi: 10.1158/1078-0432.CCR-06-2253. [PubMed] [CrossRef] [Google Scholar]
40. Laronde DM, Poh CF, Williams PM, et al. Волшебная палочка для муниципального стоматологического кабинета? Наблюдения Программы профилактики рака ротовой полости Британской Колумбии. J Can Dent Assoc. 2007;73(7):607–609. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
41. Rosin MP, Poh CF, Guillard M, Williams PM, Zhang L, MacAulay C. Визуализация и другие новые технологии как факторы, способствующие профилактике рака полости рта. Энн NY Acad Sci. 2007;1098:167–183. doi: 10.1196/annals.1384.039. [PubMed] [CrossRef] [Google Scholar]
42. Williams PM, Poh CF, Hovan AJ, Ng S, Rosin MP. Оценка подозрительного поражения слизистой оболочки полости рта. J Can Dent Assoc. 2008;74(3):275–280. [PubMed] [Google Scholar]
43. Rosin MP, Poh CF, Elwood JM, et al. Новая надежда на решение проблемы рака полости рта: вместе мы можем изменить ситуацию. J Can Dent Assoc. 2008;74(3):261–266. [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Шин Д., Виньесваран Н., Гилленвейт А., Ричардс-Кортум Р. Достижения в области методов флуоресцентной визуализации для обнаружения рака полости рта и его предшественников. Онкол будущего. 2010;6(7):1143–1154. дои: 10.2217/фон.10.79. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
45. Poh CF, Ng SP, Williams PM, et al. Прямая флуоресцентная визуализация клинически скрытого предракового заболевания полости рта высокого риска с использованием простого ручного устройства. Шея головы. 2007;29(1):71–76. doi: 10.1002/hed.20468. [PubMed] [CrossRef] [Google Scholar]
Poh CF, Ng SP, Williams PM, et al. Прямая флуоресцентная визуализация клинически скрытого предракового заболевания полости рта высокого риска с использованием простого ручного устройства. Шея головы. 2007;29(1):71–76. doi: 10.1002/hed.20468. [PubMed] [CrossRef] [Google Scholar]
46. Kois JC, Truelove E (2006) Обнаружение рака полости рта: новый метод и отчеты о случаях. Dent Today 25 (10): 94, 96–97 [PubMed]
47. Дуайер М.О., День А, Пэджетт М., Огден Г.Р., Макларен С., Гудман К.Р. Выявление аномалий слизистой оболочки у пациентов с раком полости рта с помощью фотодинамической техники: пилотное исследование. Br J Oral Maxillofac Surg. 2008;46(1):6–10. doi: 10.1016/j.bjoms.2007.05.009. [PubMed] [CrossRef] [Google Scholar]
48. Шридхаран Г., Шанкар А.А. Толудиновый синий: обзор его химического состава и клинического применения. J Оральный челюстно-лицевой патол. 2012; 6: 251–255. doi: 10.4103/0973-029X.99081. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
49. Lingen MW, Kalmar JR, Karrison T, Speight PM. Критическая оценка диагностических средств для выявления рака полости рта. Оральный онкол. 2008; 44:10–22. doi: 10.1016/j.oraloncology.2007.06.011. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Lingen MW, Kalmar JR, Karrison T, Speight PM. Критическая оценка диагностических средств для выявления рака полости рта. Оральный онкол. 2008; 44:10–22. doi: 10.1016/j.oraloncology.2007.06.011. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
50. Эпштейн Дж. Б., Скалли С., Спинелли Дж. Применение толуидинового синего и йода Люголя при оценке злокачественных заболеваний полости рта и поражений с риском малигнизации. Дж Орал Патол Мед. 1992; 21: 160–163. doi: 10.1111/j.1600-0714.1992.tb00094.x. [PubMed] [CrossRef] [Google Scholar]
51. Лопес М.Л., дель Валье М.О., Куэто А. Знание Европейского кодекса противораковой терапии у учащихся шестого класса и учителей в Астурии (Испания) Eur J Cancer Prev. 1994; 3: 207–213. doi: 10.1097/00008469-199403000-00006. [PubMed] [CrossRef] [Академия Google]
52. Гандольфо С., Пентенеро М., Брокколетти Р., Пагано М., Карроццо М., Скалли С. Поглощение толуидинового синего при потенциально злокачественных поражениях полости рта in vivo: клиническая и гистологическая оценка. Оральный онкол. 2006;42(1):89–95. doi: 10.1016/j.oraloncology.2005.06.016. [PubMed] [CrossRef] [Google Scholar]
Оральный онкол. 2006;42(1):89–95. doi: 10.1016/j.oraloncology.2005.06.016. [PubMed] [CrossRef] [Google Scholar]
53. Patton LL. Эффективность визуального скрининга на уровне сообщества и полезность дополнительных диагностических средств для раннего выявления рака ротовой полости. Оральный онкол. 2003; 39: 708–723. doi: 10.1016/S1368-8375(03)00083-6. [PubMed] [CrossRef] [Академия Google]
54. Missmann M, Jank Siegfried J, Laimer K, Gassner R. Причина использования окрашивания толуидиновым синим в предоперационном лечении пациентов с плоскоклеточным раком полости рта. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2006; 102: 741–743. doi: 10.1016/j.tripleo.2006.03.012. [PubMed] [CrossRef] [Google Scholar]
55. Машберг А. Окончательная оценка ополаскивания хлоридом толония для скрининга пациентов высокого риска с бессимптомной плоскоклеточной карциномой. J Am Dent Assoc. 1983;106:319–323. doi: 10.14219/jada.archive.1983.0063. [PubMed] [CrossRef] [Google Scholar]
56. Martin LC, Kerawala CJ, Reed M. Применение толуидинового синего в качестве диагностического дополнения при обнаружении эпителиальной дисплазии. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1998; 85: 444–446. doi: 10.1016/S1079-2104(98)
Martin LC, Kerawala CJ, Reed M. Применение толуидинового синего в качестве диагностического дополнения при обнаружении эпителиальной дисплазии. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1998; 85: 444–446. doi: 10.1016/S1079-2104(98)
-3. [PubMed] [CrossRef] [Google Scholar]
57. Rodriguez PC, Lapiedra RC, Gomez GE, Martinez SL, Warnakulasuriya S. Использование толудинового синего для выявления предраковых и злокачественных поражений полости рта. Дж Орал Патол Мед. 2011;40:300–304. doi: 10.1111/j.1600-0714.2010.00985.х. [PubMed] [CrossRef] [Google Scholar]
58. Guo Z, Yamaguchi K, Sanchez-Cespedes M et al (2001) Аллельные потери в биопсиях, направленных на тест Ora, у пациентов с предшествующими злокачественными новообразованиями верхних дыхательных путей. Clin Cancer Res 7:1963–1968 [PubMed]
59. Эпштейн Дж. Б., Фельдман Р., Долор Р. Дж., Портер С. Р. Полезность полоскания хлоридом толония в диагностике рецидивирующего или второго первичного рака у пациентов с предшествующим раком верхних отделов пищеварительного тракта. Шея головы. 2003; 25: 911–921. doi: 10.1002/hed.10309. [PubMed] [CrossRef] [Google Scholar]
Шея головы. 2003; 25: 911–921. doi: 10.1002/hed.10309. [PubMed] [CrossRef] [Google Scholar]
60. Zhang L, Williams M, Poh CF, et al. Окрашивание толуидиновым синим выявляет первичные предраковые поражения полости рта с высоким риском и неблагоприятным исходом. Рак рез. 2005; 65:8017–8021. [PubMed] [Google Scholar]
61. Миллер Р.Л., Симмс Б.В., Гулд А.Р. Окрашивание толуидиновым синим для выявления предраковых поражений полости рта и карцином. Дж Орал Патол Мед. 1988; 17: 73–78. doi: 10.1111/j.1600-0714.1988.tb01510.x. [PubMed] [CrossRef] [Google Scholar]
62. Машберг А. Переоценка применения толуидинового синего в качестве диагностического дополнения при обнаружении бессимптомного плоскоклеточного рака полости рта: продолжающееся проспективное исследование рака полости рта III. Рак. 1980;46:758–763. doi: 10.1002/1097-0142(19800815)46:4<758::AID-CNCR2820460420>3.0.CO;2-8. [PubMed] [CrossRef] [Google Scholar]
63. Hegde CM, Kamath PN, Sridharan S, Dannana NK, Raju RM. Суправитальное окрашивание: его роль в выявлении ранних злокачественных новообразований. Indian J Otolaryngol Head Neck Surg. 2006; 58:31–34. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Суправитальное окрашивание: его роль в выявлении ранних злокачественных новообразований. Indian J Otolaryngol Head Neck Surg. 2006; 58:31–34. [Бесплатная статья PMC] [PubMed] [Google Scholar]
64. Эпштейн Дж. Б., Гунери П. (2009) Дополнительная роль толуидинового синего в обнаружении предраковых и злокачественных поражений полости рта. Curr Opin Otolaryngol Head Neck Surg 17:79–87 [PubMed]
65. Onofre MA, Sposto MR, Navarro CM (2001) Надежность применения толуидинового синего при обнаружении дисплазии эпителия полости рта, а также in situ и инвазивной плоскоклеточной карциномы. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 91:535–540 [PubMed]
66. Фонд рака полости рта. Раннее выявление, диагностика и определение стадии. Сайт Фонда рака полости рта. Доступно на: http://www.oralcancerfoundation.org/cdc/cdc_chapter5.php
67. Patton LL, Elter JR, Southerland JH, Strauss RP (2005) Знание факторов риска рака ротовой полости и диагностических концепций среди стоматологов Северной Каролины. J Am Dent Assoc 136: 602–610 [PubMed]
J Am Dent Assoc 136: 602–610 [PubMed]
68. Сиддики И.А., Фарук М.Ю., Сиддики Р.А., РАфи СМТ. Роль толуидинового синего в ранней диагностике рака ротовой полости. Пак J Med Sci. 2006; 22: 184–187. [Google Scholar]
69. Chen YW, Lin JS, Wu CH, Lui MT, Kao SY, Fong Y (2007) Применение окрашивания метиленовым синим in vivo в качестве диагностического средства для раннего обнаружения и скрининга плоскоклеточных клеток полости рта. карциномы и предраковые состояния. J Chin Med Assoc 70(11):497–503 [PubMed]
70. Canto MI, Setrakian S, Willis JE, Chak A, Petras RE, Sivak MV. Окрашивание метиленовым синим диспластического и недиспластического пищевода Барретта: исследование in vivo и ex vivo. Эндоскопия. 2001;33:391–400. doi: 10.1055/s-2001-14427. [PubMed] [CrossRef] [Google Scholar]
71. Canto MI, Setrakian S, Willis J, Chak A, Petras R, Powe NR, Sivak MV., Jr Биопсия под метиленовым синим улучшает обнаружение кишечной метаплазии и дисплазии у пищевод Барретта. Гастроинтест Эндоск. 2000; 51: 560–568. doi: 10.1016/S0016-5107(00)70290-2. [PubMed] [CrossRef] [Google Scholar]
2000; 51: 560–568. doi: 10.1016/S0016-5107(00)70290-2. [PubMed] [CrossRef] [Google Scholar]
72. Canto MI, Setrakian S, Petras RE, Blades E, Chak A, Sivak MV., Jr Метиленовый синий избирательно окрашивает кишечную метаплазию в пищеводе Барретта. Гастроинтест Эндоск. 1996;44:1–7. doi: 10.1016/S0016-5107(96)70221-3. [PubMed] [CrossRef] [Google Scholar]
73. Судзуки С., Мураками Х., Судзуки Х., Сакакибара Н., Эндо М., Накаяма К. Метод эндоскопического окрашивания для выявления и лечения раннего рака желудка. Int Adv Surg Oncol. 1979; 2: 223–241. [PubMed] [Google Scholar]
74. Муфтий Г.Р., Шах П.Дж., Паркинсон М.С., Риддл П.Р. Диагностика клинически скрытого рака мочевого пузыря с помощью окрашивания in vivo метиленовым синим. Бр Дж Урол. 1990; 65: 173–175. дои: 10.1111/j.1464-410X.1990.tb14693.x. [PubMed] [CrossRef] [Google Scholar]
75. Gill WB, Huffman JL, Lyon ES, Bagley DH, Schoenberg HW, Straus FH., 2-е Селективное окрашивание поверхности опухолей мочевого пузыря внутрипузырным метиленовым синим с улучшенной эндоскопической идентификацией. Рак. 1984; 53: 2724–2727. doi: 10.1002/1097-0142(19840615)53:12<2724::AID-CNCR2820531230>3.0.CO;2-B. [PubMed] [CrossRef] [Google Scholar]
Рак. 1984; 53: 2724–2727. doi: 10.1002/1097-0142(19840615)53:12<2724::AID-CNCR2820531230>3.0.CO;2-B. [PubMed] [CrossRef] [Google Scholar]
76. Риаз А., Шридхар Б., Камбой М., Риаз С.Н. Метиленовый синий как ранний диагностический маркер предрака полости рта и рака. Спрингер Плюс. 2013;2:95. doi: 10.1186/2193-1801-2-95. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
77. Невилл Б.В., Day TA. Рак полости рта и предраковые состояния. CA Рак J Clin. 2002; 52: 195–215. doi: 10.3322/canjclin.52.4.195. [PubMed] [CrossRef] [Google Scholar]
78. Kusukawa J, Suefuji Y, Ryu F, Noguchi R, Iwamoto O, Kameyama T. Распространение раковых клеток в кровоток происходит при инцизионной биопсии плоскоклеточного рака полости рта. Дж Орал Патол Мед. 2009; 29: 303–307. doi: 10.1034/j.1600-0714.2000.290703.х. [PubMed] [CrossRef] [Google Scholar]
79. Dyavanagoudar S, Kale A, Bhatt K, Hallikerimath S (2008) Исследование полимеразной цепной реакции с обратной транскриптазой для оценки распространения раковых клеток в кровоток после инцизионной биопсии при плоскоклеточной карциноме полости рта . Indian J Dent Res 19(4):315–319 [PubMed]
Indian J Dent Res 19(4):315–319 [PubMed]
80. Peters LJ. Изучение влияния различных диагностических и терапевтических процедур, применяемых к плоскоклеточной карциноме мышей, на ее метастатическое поведение. Бр Дж Рак. 1975;32:355–372. doi: 10.1038/bjc.1975.235. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
81. Safour IM, Wood NK, Tsiklakis K, Doemling DB, Joseph G. Инцизионная биопсия и посев при карциноме защечного мешка хомяка. Джей Дент Рез. 1984; 63: 1116–1120. doi: 10.1177/002203458406300
. [PubMed] [CrossRef] [Google Scholar]
82. Отаке К., Шингаки С., Накадзима Т. Влияние разреза и облучения на метастазы в регионарные лимфатические узлы при карциноме языка хомяка. Oral Surg Oral Med Oral Pathol. 1990;70:62–69. doi: 10.1016/0030-4220(90)
-Z. [PubMed] [CrossRef] [Google Scholar] 83. Эрикссон О., Хагмар Б., Райд В. Влияние тонкоигольной аспирации и других процедур биопсии на распространение опухоли у мышей. Рак. 1984; 54: 73–78. doi: 10.1002/1097-0142(19840701)54:1<73::AID-CNCR2820540116>3.0.CO;2-2. [PubMed] [CrossRef] [Google Scholar]
doi: 10.1002/1097-0142(19840701)54:1<73::AID-CNCR2820540116>3.0.CO;2-2. [PubMed] [CrossRef] [Google Scholar]
84. Kusukawa J, Kameyama T. Клиническая оценка эксцизионной биопсии плоскоклеточного рака полости рта I и II стадии. J Jpn Soc Рак Ther. 1995;30:1817–1827. [Google Scholar]
85. Kusukawa J, Nakamura Y, Kameyama T. Оценка эксцизионной биопсии при плоскоклеточном раке полости рта I и II стадии. Int J Clin Oncol. 1998; 3: 311–316. doi: 10.1007/BF02628053. [CrossRef] [Google Scholar]
86. Cai WM, Zhang HX, Hu YH, Gu XZ. Влияние биопсии на прогноз рака носоглотки — критическое исследование биоптатов носоглотки и шейных лимфатических узлов у 649 пациентов. Int J Radiol Oncol Biol Phys. 1983;9:1439–1444. doi: 10.1016/0360-3016(83)
-2. [PubMed] [CrossRef] [Google Scholar]
87. Gandolfo S, Carbone M, Carrozzo M, Scamuzzi S. Техника биопсии в оральной онкологии: эксцизионная или инцизионная биопсия? Критический обзор литературы и личный вклад авторов. Минерва Стоматол. 1993; 42: 69–75. [PubMed] [Google Scholar]
1993; 42: 69–75. [PubMed] [Google Scholar]
88. Ramani P, Thomas G, Ahmed S. Использование Rt-PCR для обнаружения диссеминированных раковых клеток после инцизионной биопсии у пациентов с плоскоклеточным раком полости рта. J Рак Res Ther. 2005;1:92–97. дои: 10.4103/0973-1482.16708. [PubMed] [CrossRef] [Google Scholar]
89. Frydrych AM, Parsons R, Threlfall T, Austin N, Davies GR, Booth D. Выживаемость плоскоклеточного рака полости рта по типу биопсии: исследование реестра рака. Ост Дент Дж. 2010; 55: 378–384. doi: 10.1111/j.1834-7819.2010.01257.x. [PubMed] [CrossRef] [Google Scholar]
90. Хеллман К., Хилгард П., Экклс С. Метастазы: клинические и экспериментальные аспекты. Гаага: Мартинус Нийхофф; 1980. С. 50–54. [Академия Google]
91. Варнакуласурия К.А., Джонсон Н.В. Чувствительность и специфичность ополаскивателя для полости рта OraScan с толудиновым синим при выявлении рака ротовой полости и предраковых состояний. Дж Орал Патол Мед. 1996; 25: 97–103. doi: 10. 1111/j.1600-0714.1996.tb00201.x. [PubMed] [CrossRef] [Google Scholar]
1111/j.1600-0714.1996.tb00201.x. [PubMed] [CrossRef] [Google Scholar]
92. Гупта А., Сингх М., Ибрагим Р., Мехротра Р. Полезность окрашивания толуидиновым синим и щеточной биопсии при предраковых и раковых поражениях полости рта. Акта Цитол. 2007;51(5):788–794. doi: 10.1159/000325843. [PubMed] [CrossRef] [Академия Google]
93. Wiersma AC, van der Waal I. Окрашивание толуидиновым синим для выявления плоскоклеточного рака полости рта. Нед Тайдшр Тандхилкд. 1990;97(10):431–432. [PubMed] [Google Scholar]
94. Silverman S, Jr, Migliorati C, Barbosa J. Окрашивание толуидиновым синим при обнаружении предраковых и злокачественных поражений полости рта. Oral Surg Oral Med Oral Pathol. 1984;57(4):379–382. doi: 10.1016/0030-4220(84)
-3. [PubMed] [CrossRef] [Google Scholar] 95. Awan Kh, Yang Y, Morgan P, Warnakulasuriya S. Использование толуидинового синего в качестве диагностического вспомогательного средства при выявлении потенциально злокачественных заболеваний полости рта — клиническое и гистологическое исследование.

 Зачастую назначают средства от бактерий и вируса.
Зачастую назначают средства от бактерий и вируса.