У собаки сильный флюс (воспаление на десне), его лечение в домашних условиях с помощью антибиотиков и других препаратов, что делать при появлении
У собак, как и у людей, иногда болят зубы. Воспаление на десне у питомца может быть признаком нескольких разных состояний. Насколько велика опасность, каковы причины и как лечить флюс у собаки в домашних условиях — об этом в материале ниже.
ПоказатьСкрытьЧто такое флюс (периостит)
Периостит (флюс) у собаки — это состояние, при котором возникает воспаление тканей, окружающих надкостницу. Обычно заболевание бывает доброкачественным и хорошо переносится, а заживление дёсен происходит очень быстро. Но недуг может принимать форму сильного инфекционного заражения. Это гораздо серьёзнее и потребует интенсивной терапии.
Частая причина острого воспаления десны — хирургическое вмешательство в ротовой полости, которое недавно перенёс мохнатый пациент. Пока идёт процесс заживления, рана может воспаляться.
Пока идёт процесс заживления, рана может воспаляться.
Зубной налёт является второй причиной, которая вызывает инфицирование. По своей структуре зубной камень напоминает пористую губку, а это идеальная среда для развития бактерий. По мере увеличения их количества начинается воспаление и нагноение тканей. Этому способствует и то, что зубной камень отодвигает десну от зуба, чем расширяет пространство, в котором могут откладываться кусочки пищи. Смешиваясь со слюной, они образуют налёт, на котором развиваются микроорганизмы.
Разновидности периостита у собак
Воспалительный процесс может протекать по-разному.
Его классифицируют по таким признакам:
- локализации или местоположению;
- степени распространения;
- стадии протекания;
- причине появления.
Знаете ли вы? Первый случай периостита диагностирован палеонтологами у позднемелово-эоценового крокодила Borealosuchus formidabilis. Также есть задокументированные случаи обнаружения этого недуга на костях динозавров.
Также есть задокументированные случаи обнаружения этого недуга на костях динозавров.
По месту положения флюс у собаки может быть локализован на верхней или нижней челюсти. По степени распространения выделяются ограниченный и диффузный флюсы. Первый расположен у одного или двух соседних зубов, а второй распространяется на всю челюсть. По стадии протекания воспалительный процесс делят на острый и хронический.
Существует классификация и по причинам появления флюса у питомца:
- травматический;
- лимфогенный;
- гематогенный;
- одонтогенный.
Первый — результат травмы. Второй — закономерный итог попадания бактерий в лимфу, третий является результатом загрязнения кровотока бактериями из ротовой полости или другими. Четвёртый — это результат имеющихся болезней зубов.
Серозный
Периост (надкостница) — это ткань, которая покрывает челюстные кости снаружи.
Травма в этой области возможна в результате:
- собачьей драки;
- аварии;
- неаккуратной игры с питомцем (ушиб, перелом).
Важно! Собака, у которой образовался флюс, будет избегать развлечений с игрушками, связанных с жеванием или участием в деятельности, требующей укусов (например, ношение палки или перетягивание каната).
Повреждённая область опухает из-за притока серозной жидкости к месту травмы. Поэтому такая форма флюса называется серозной.
Она сопровождается:
- отёчностью;
- иногда болью.
При незначительных повреждениях отёк быстро спадает, ситуация стабилизируется. Эта форма периостита ещё называется простой.
Диффузный
Иногда фиброзная жидкость распространяется по поверхности челюсти. Этому предшествует большая площадь ушиба. Если ничего не предпринимать, то может начаться нагноение. Существует опасность, что при длительном воспалении начнут разрушаться ткани.
Острый и гнойный
Острое воспаление может протекать в двух формах. Оно бывает:
- серозным;
- гнойным.
При серозной форме отёк состоит из прозрачной жидкости. Она быстро рассасывается. Инфицирование отсутствует. Гнойная форма сопровождается нагноением. Образуется флюс, и через время гнойное содержимое может начать вытекать наружу.
Знаете ли вы? Обеспечение вашего питомца хорошей гигиеной ротовой полости может продлить его жизнь на 2–4 года.
Флюс сопровождают:
- высокая температура;
- боль;
- потеря аппетита и активности.
Хронический
 Хроническое воспаление сопровождается разрастанием костной ткани и деформацией формы челюсти. Оно может быть как обратимым, так и необратимым процессом.
Хроническое воспаление сопровождается разрастанием костной ткани и деформацией формы челюсти. Оно может быть как обратимым, так и необратимым процессом.Почему развивается флюс у собак
Воспаление надкостницы вызывается разными причинами.
Самые распространённые:
- травма;
- инфекция.
Знаете ли вы? Большинство собак не прекращают есть даже тогда, когда у них имеются серьёзные заболевания пародонта. Поэтому вялость и отказ от пищи — это чаще признак инфекционного или вирусного заражения, а не заболеваний зубов.
Невылеченная инфекция может распространиться, кроме десны, и на другие ткани ротовой полости. Поэтому для лечения обязательно назначают антибиотики. Домашнее лечение помогает уменьшить дискомфорт, но инфекционный флюс у собаки оно не лечит.
Как проявляются симптомы
Вначале симптомы могут не проявляться, однако болезненные ощущения собака будет испытывать сразу же. В связи с этим изменится её поведение.
В связи с этим изменится её поведение.
Симптомы флюса:
- боль;
- мягкий отёк на десне;
- слюнотечение;
- кровотечение или выделения из флюса или дёсен;
- неприятный запах из пасти;
- тошнота;
- лихорадка;
- боль в ушах; выпадение пищи на пол во время еды;
- отказ от сухого корма.
Как диагностируют заболевание
Вначале ветеринар выслушает владельца животного. Ему важно уточнить, что предшествовало болезни и какие симптомы замечены. Затем будет проведён полный анализ крови и её химического состава. Это необходимо для оценки общего состояния здоровья питомца.
Образец тканей (биопсию) делают не очень часто — только если подозревают развитие опухоли. В этом случае будут устанавливать тип опухоли и степень её развития. Чаще назначают рентгенографию зубов, чтобы выявить изменения в костной ткани и выяснить, в каком состоянии находятся челюстные кости.
Лечение флюса у собак
Обязательно нужно предотвратить дальнейшее развитие воспаления. Чтобы вылечить сильный флюс у собаки, ветеринар может порекомендовать одну из процедур или их комбинацию:
- Антибиотики. Первый шаг к уничтожению бактерий. Отёки образуются ниже линии десны, поэтому локальные средства лечения к ним неприменимы, а антибиотики позволяют «дотянуться» до бактерий, где бы они ни находились.
- Глубокая очистка. Если инфекция является результатом разрушения зуба или зубного налёта, то необходимо удалить источник появления бактерий.
- Дренаж. При большом объёме инфильтрата и гноя внутри надкостницы может понадобиться его слить, чтобы ускорить заживление.
- Операция. Наличие периапикального абсцесса может потребовать обработки десны и удаления зубов, которые находятся на воспалённом участке.
Наиболее распространённый лекарственный курс для собаки с зубной инфекцией — это антибиотики и другие противовоспалительные препараты. Боль и отёк должны уменьшиться через пару дней после начала лечения. При наличии абсцесса зуб необходимо удалять. Особенно это касается ситуаций, когда воспаление началось из-за верхних клыков.
Боль и отёк должны уменьшиться через пару дней после начала лечения. При наличии абсцесса зуб необходимо удалять. Особенно это касается ситуаций, когда воспаление началось из-за верхних клыков.
Важно! Дозировка лекарств и длительность курса лечения варьируются в зависимости от тяжести воспалительного процесса у питомца.
Проведение операции
Перед началом операции по удалению вводят общий наркоз. Затем ветеринар оценит корневую структуру зуба с помощью ультразвукового исследования.
Само удаление происходит методом оттягивания десны и выбивания корня из места его фиксации. Фрагменты корня извлекают пинцетом. Образовавшиеся ранки зашивают. Вся процедура длится около часа. Затем хвостатого пациента выписывают домой и назначают лечение на период заживления.
Питомцу обязательно введут обезболивающее и препарат, останавливающий кровотечение. От хозяина потребуется следить за собакой в течение нескольких недель. Если будет наблюдаться отёк или кровотечение, то об этом нужно сообщить ветеринару. Он проверит правильность заживления разреза, а когда челюсть успешно заживёт, то снимет швы. Процесс заживления будет длиться около 1 месяца.
Он проверит правильность заживления разреза, а когда челюсть успешно заживёт, то снимет швы. Процесс заживления будет длиться около 1 месяца.
Несмотря на то, что удаление зуба является довольно простой операцией, помните следующее:
- Старым собакам общий наркоз может быть вреден, поэтому врач должен ответственно отнеслись к выбору препарата.
- Удаление — это крайняя мера. Если есть возможность вылечить флюс другим путём, то нужно ею воспользоваться.
Знаете ли вы? У мелких пород собак чаще возникают проблемы с зубами, потому что зубы слишком велики для их ротовой полости.
Применение антибиотиков и других лекарств
Тетрациклиновая группа обычно применяется для лечения заболеваний пародонта и других инфекций ротовой полости. Широко используется «Клиндамицин». Он эффективен против большого списка анаэробных патогенов, в том числе тех, которые могут проникать и развиваться внутри костей. Его действие основано на предотвращении роста бактерий.
Часто назначают «Метронидазол», «Амоксициллин». Последний относится к препаратам пенициллиновой группы. Он делает стенки бактерий открытыми для атаки со стороны имунной системы собаки. Побочный эффект «Амоксициллина» — это расстройство пищеварения. «Метронидазол» является как антибиотиком, так и антипротозойным препаратом. Он лечит очень широкий спектр бактерий, которые могут жить без кислорода и развиваться в костях.
Не забывайте, что назначение антибиотика должен делать врач. Он основывается на том, какая инфекция выявлена, и назначает лекарство, которое на неё подействует. Бесконтрольный приём препаратов этой группы может никак не подействовать на вашего питомца.
Прежде чем лечиться антибиотиками, помните о следующих шагах:
- Обязательно получите назначение врача.
- Устраните источник проблемы (лечение корня, удаление зуба, чистка) и только после этого переходите к медикаментозному лечению.
- Исключение составляет острый отёк и невозможность быстрой доставки собаки к ветеринару.
 Тогда дозировка лекарств должна соответствовать весовой категории собаки, что указано в инструкции к применению препарата.
Тогда дозировка лекарств должна соответствовать весовой категории собаки, что указано в инструкции к применению препарата.
Важно! Если флюс расположен на верхней челюсти, то воспаление может задевать нос. Когда в носовой проход попадает жидкость от отёка, иногда наблюдаются носовые выделения.
Народные средства
Народные средства вряд ли вылечат инфекцию в домашних условиях, но они могут облегчить боль и предотвратить образование других флюсов.
Основные обезболивающие средства:
- Окопник (Symphytum officinale) — одна из лучших целебных трав. Обладает противовоспалительными и обезболивающими свойствами, довольно эффективными для того, чтобы снимать даже боль в суставах. Для внутреннего терапевтического применения дайте питомцу 1/2 или 1 чайную ложку измельчённой сухой травы на 1 кг еды.
- Босвеллия (Boswellia serrata) — это смола, полученная из коры дерева. Останавливает выделение веществ, которые провоцируют воспаление.
 Суточная доза — 5–10 мг/кг веса собаки. Побочный эффект от употребления лекарства — метеоризм.
Суточная доза — 5–10 мг/кг веса собаки. Побочный эффект от употребления лекарства — метеоризм. - Солодка (Glycyrrhiza glabra) является членом семейства гороховых. Целебными свойствами обладает её корень. Так как собаки могут не переносить корень, будет правильным купить настойку солодки и добавлять в питьё. Начинайте с дозы 12 капель на 20 кг веса питомца. Увеличивать количество капель можно до 20, но делать это нужно постепенно. Применять не более 2 недель.
Профилактика воспаления десен у собак
Лучший способ предотвратить заболевание дёсен у собаки — это регулярно чистить зубы. В дикой природе налёт с зубов хищники счищают автоматически, когда жуют хрящи. Если в ежедневном рационе питомца их нет, то на зубах образуется налёт из пищи и слюны, который через время затвердевает, образуя зубной камень. На нём всегда развиваются бактерии.
Покупайте питомцу игрушки для жевания. Они помогут удалению зубного налёта. Считается, что жевательные игрушки очищают зубную поверхность на 60–70%.
Важно! Если нет возможности чистить зубы ежедневно, то делайте это 2—3 раза в неделю.
Периодическое ветеринарное обследование зубов и дёсен должно стать частью ежегодной ветеринарной проверки. Врач проверит наличие ранних признаков стоматологических проблем и даст рекомендации, как с ними бороться. Важно поддерживать зубы здоровыми и не допускать развития инфекций в пасти собаки.
Помните, что все питомцы особенные. Не обязательно то, что подходит одному, поможет другому. То же касается предрасположенности к болезням. Поэтому будьте внимательны к здоровью вашей собаки. В экстренных случаях всегда обращайтесь за квалифицированной медицинской помощью. Это позволит питомцу оставаться здоровым и жизнерадостным.
Была ли эта статья полезна?
Да
Нет
33
раза уже
помогла
Бисептол при флюсе
Эффективные способы лечения флюса десен
Многие знают, что флюс на десне очень неприятное явление, которое не всегда поддается быстрому лечению в домашних условиях.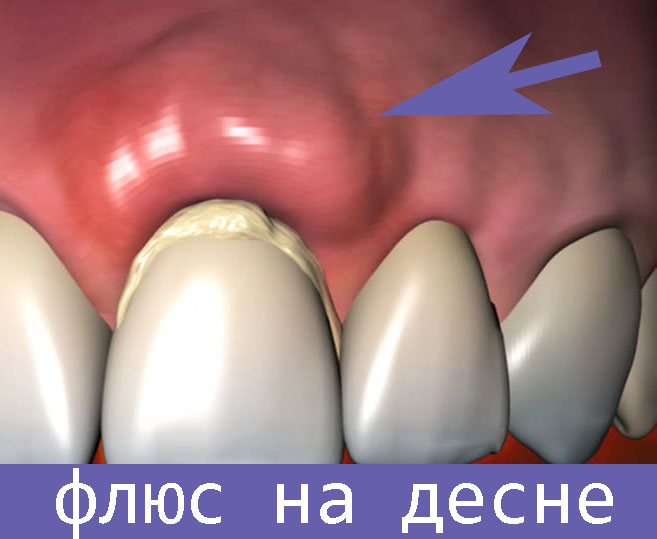 Заболевание может быть как у взрослого человека, так и у ребенка.
Заболевание может быть как у взрослого человека, так и у ребенка.
Флюс говорит об имеющемся воспале нии и поражении близлежащих тканей воспалительными процессами при зубных болезнях. При этом происходит нарыв надкостницы.
Симптомы заболевания
Симптомами этой проблемы являются:
- сильная боль;
- воспаленные десны;
- распухшее образование.
При отсутствии медицинских мер образование способно распространиться на всю нижнюю часть, начиная от области ушей.
Предотвратить эти явления можно при получении квалифицированной врачебной консультации. Доктор пропишет пациенту ряд антибиотиков и противовоспалительных препаратов. В случаях достижения распухшей области большого размера, гной удаляется посредством вмешательства хирурга.
Флюс может возникнуть при развитии острых кариозных поражений. Образование гнойных очагов происходит в области зубного корня, из-за чего болевые ощущения имеют пульсирующий характер.
Протекание заболевания в острой форме сопровождается отеками слизистой и близлежащих тканевых образований около проблемного зуба.
Использование антибиотиков при флюсе
Применять антибиотические препараты необходимо для удаления инфекционных бактерий, устранения гипертермии и уменьшения размера отекшей области. После проведения хирургических манипуляций, зубной специалист прописывает ряд таблеток, устраняющих бактерии в скопившемся очаге, а также для отделения гнойных образований.
Лечение флюса на воспаленной десне у взрослого человека возможно в домашних условиях. Но, зачастую, чтоб быстро вылечиться приходится принимать антибиотические препараты с широким спектром воздействия:
- Давно известный препарат на российском рынке Бисептол.
- Рекомендуемый к приему в сочетании с другими антибиотиками Амоксиклав.
- Бактериостатический препарат Линкомицин.
- Комбинированный Ампиокс.
- Полусинтетический Доксициклин.
Мази при флюсовых отеках
Использовать кремообразные составы и линименты необходимо для снятия отеков, уменьшения размеров распухшей ткани и способствования началу выведения гнойных образований. Применять составы медицинских мазей следует только после врачебного осмотра – попытка самостоятельно вылечить периостит может усугубить протекание недуга.
Применять составы медицинских мазей следует только после врачебного осмотра – попытка самостоятельно вылечить периостит может усугубить протекание недуга.
Поспособствовать уменьшению воспаленной области надкостницы может применение нижеперечисленных препаратов:
- Левомеколь, нанесение которого убивает бактерии в воспаленных очагах. В составе этого противомикробного лекарственного препарата содержится метилурацил.
- Сочетание стрептоцидовой и ихтиоловой мазей смешать на куске марлевой ткани и приложить к распухшему участку.
- Гелевый состав противовоспалительного действия Метрогил дента, втираемый в оболочку слизистой и снимающий отеки и видимые симптомы болезни.
Составы для полоскания рта
Для снятия отека после хирургического вмешательства и ускорения процессов заживления следует полоскать рот при помощи разнообразных настоев и растворов:
- соду издавна используют при лечении воспалений челюстной области – раствор способствует разрыву гнойного скопления.
 В 100 мл воды, температура которой превышает комнатную, следует растворить чайную ложку порошка. Полоскать рот полученным содовым раствором необходимо 4 раза в день;
В 100 мл воды, температура которой превышает комнатную, следует растворить чайную ложку порошка. Полоскать рот полученным содовым раствором необходимо 4 раза в день; - уже готовый жидкий раствор мирамистин, разводить который не требуется. Для полоскания десны используется 15 мл препарата, проводить процедуру следует 2 раза в сутки;
- для ополаскивания рта после приема пищи применяется, разбавленная водой, аптечная спиртовая эссенция прополис;
- залить в термосе кипятком в полулитровом объеме, взять по столовой ложке засушенную дубовую кору, шалфей и зверобой. Плотно закрытую емкость настаивать в течение часа. Процедив, положить на больной зуб. Процедуру повторить 3 раза в день;
- сбор шалфея и зеленого чая с добавлением соли залить горячим кипятком и употребить внутрь в теплом виде;
- смешанные в равном соотношении сборы ромашки, календулы и почек березы добавить в эмалированную емкость, залить литром воды, вскипятить. Настаивать в течение получаса.
Травы для лечения периостита
Липовый отвар
Чтоб быстро вылечить флюс на воспаленной десне у взрослого человека, рекомендовано в домашних условиях приготовить отвар из цветков липы.
Для этого в неглубокую эмалированную кастрюлю следует положить 4 ложки цветков данного растения, и, добавив кипяток в объеме 500 мл, поставить вариться на медленный огонь в течение получаса.
Полоскать рот необходимо процеженным отваром, в котором не должно оставаться фрагментов растительного сырья. Использовать настой следует ежедневно по 4 раза в сутки. Продолжать лечебный курс в течение 10 дней.
Спиртовой настой календулы
Такая настойка, предназначенная для полоскания, может быть изготовлена в домашних условиях или приобретена в любом аптечном пункте. Способ приготовления спиртовой календулы: 2 ложки засушенных ноготков, смешанных с залитой водкой в объеме 200 мл, размешать и неделю настаивать в холодном месте.
Готовый раствор: столовая ложка полученной жидкости, разведенная в стакане с водой комнатной температуры.
Полоскать рот спиртовой настойкой из календулы следует 4 раза в сутки. При остром протекании заболевания, сопровождаемого процессами нагноения, количество процедур увеличивается до 10 раз в день. После проведения трехдневного лечебного курса, число процедур сокращается до 4-х в сутки. Данная терапия длится 10 дней.
После проведения трехдневного лечебного курса, число процедур сокращается до 4-х в сутки. Данная терапия длится 10 дней.
Ниже рассмотрим, как еще быстро можно вылечить флюс на воспаленной десне и что применять в домашних условиях для облегчения боли у взрослых.
Как вылечить флюс при помощи соли и йода
Йод, применяемый для лечения гнойных образований, можно найти в любой домашней аптечке. В данном случае состав используется для двухстороннего смазывания пораженного участка.
Способ приготовления раствора для полоскания: 250 мл кипяченой воды развести 1 чайной ложкой соли и таким же количеством соды.
Разбавить состав парой капель йодного раствора. Процедуру полоскания следует проводить ежечасно.
Противовоспалительный компресс
Главной целью при заболевании периоститом является купирование очага воспаления. При помощи подручных средств можно изготовить лечебные компрессы на луково-капустной, свекольной или картофельной основе. К месту воспаления на полчаса прикладывают марлю, смоченную в полученном соке. В луковый рекомендуется добавить сахар.
К месту воспаления на полчаса прикладывают марлю, смоченную в полученном соке. В луковый рекомендуется добавить сахар.
Сделать капустный компресс можно, ошпарив и размяв свежий лист капусты до получения сока. Приложить компресс из капусты на 20 минут, после этого нанести на поверхность десны сок лука или картофеля.
ПРИМЕЧАНИЕ. Срок лечения с применением каждого из представленных видов компресса составляет 5 дней. Процедуры проводятся по 4 раза в день. При отсутствии улучшений на третий день следует обратиться к стоматологу.
Все вышеперечисленные методы лечения периостита являются эффективными для облегчения протекания симптомов этого недуга.
Однако, качественное лечение может назначить только, квалифицированный в области стоматологии, специалист, зачастую с вынужденным принятием таких мер, как хирургическое вмешательство.
Во избежание сепсиса, способного возникнуть как серьезное осложнение, обращение к врачу является необходимым. Периостит может быть вылечен только при вскрытии нагноившегося нарыва и осуществлении терапевтических мероприятий медикаментозного характера.
Периостит может быть вылечен только при вскрытии нагноившегося нарыва и осуществлении терапевтических мероприятий медикаментозного характера.
Оцените автора материала. Статью уже оценили 89 чел.
Лечим флюс антибиотиками без проблем
Флюсом называется воспалительный процесс надкостницы (гнойный периостит). Для данной патологии характерно появление шишкообразной опухоли на десне, которая требует незамедлительного врачебного вмешательства. Вовремя не проведенное лечение провоцирует развитие гнойного абсцесса, с последующим образованием флегмоны. Теперь вы знаете, чем опасен флюс на десне и немедленно начинайте лечение.
Самым эффективным методом лечения флюса в домашних условиях является применение антибиотиков. Они позволяют предотвратить гнойный и воспалительный процессы.
При флюсе происходит распространение инфекции. По этой причине лечение требуется комплексное. Широкий спектр воздействия антибиотиков позволяет влиять на весь организм целиком, что приводит к скорейшему выздоровлению.
Первопричины развития патологического процесса
Основной причиной развития данной патологии является наличие кариеса, трещин в зубах или механических повреждений. Также к причинам можно отнести повреждение кожи, десен, последствия фурункулеза, тонзиллита. В общем, попадание любой инфекции в полость рта может спровоцировать развитие флюса. При появлении различных признаков инфекции во рту, нужно сразу же обращаться к специалисту.
Если вы решили провести лечение дома, то после этого обязательно нужно обратиться к стоматологу за квалифицированной помощью. Это предотвратит дальнейшее развитие флюса.
Если причина развития флюса больной зуб, то его рекомендовано скорее вылечить, чтобы не возникло различных негативных последствий. Так как повторное развитие флюса может спровоцировать потерю зуба полностью.
Симптоматика процесса
К симптомам проявления такой болезни относят:
- появление припухлости, в зоне формирование гнойного образования;
- болезненные ощущения, отдающие в область уха или глазницы;
- образование экссудата под надкостницей, которое вызывает раздражение различных рецепторов;
- отечность кожных покровов лица, придающих ему ассиметричную форму.

В последующем, при отсутствии терапевтических мероприятий, может наблюдаться снижение аппетита, повышение температуры тела, бессонница, воспаление лимфатических узлов.
Лечение флюса в домашних условиях антибиотиками не ходя к стоматологу
Использование антибиотиков позволяет предотвратить расхождение инфекции по всему организму и снять воспалительный процесс. Очень часто антибиотики используются после удаления зубов.
Медикаменты позволяют предотвратить образование гнойников, то есть они лечат флюс еще до его появления. Если пухнет щека, то это уже нарывает флюс. При поздних этапах гнойного переостита антибиотики используются только после вскрытия флюса, что позволяет быстрее зажить ране.
Обратите внимание! Не стоит проводить лечение самостоятельно, так как это может негативно отобразиться на Вашем здоровье.
Применение лекарственных средств должно проводиться только по рекомендации и под присмотром врача.
Какие антибиотики принимать при флюсе
Для лечения флюсов в медицине применяются такие антибиотики:
- Амоксициллин.
- Амоксилав.
- Трихопол.
- Линкомицин.
- Доксициклин.
- Бисептол.
- Ципролет.
- Левомицетин.
- Ципрофлоксацин.
Курс лечения медикаментами проводится на протяжении 5-7 дней. При длительном использовании возможно развитие привыкания патогенной среды к антибиотикам.
Флюс на десне, что делать
При первом сталкивании с таким заболеванием очень многих интересует вопрос о том, что делать если флюс на десне и как же правильно и быстро лечить флюс в домашних условиях? Началом лечения должен быть день появления первых признаков флюса. Подбором лекарств должен заниматься исключительно специалист-стоматолог. Это гарантирует вам эффективное лечение.
Важно! Читайте, какой врач лечит флюс.
Очень часто развитие флюса провоцируется стафилококками или стрептококками. По этой причине лечение проводится такими видами антибиотиков, как: Цифран, Ампиокс, Диксициклин. Дозировка и все рекомендации по лечению должны проводиться только лечащим врачом.
Какие антибиотики принимать при флюсе зуба
Самыми распространенными препаратами считаются:
- ампиокс – антибиотик, таблетки от флюса на десне, большого спектра воздействия, имеет очень мало побочных эффектов. Не метаболизируется в ЖКТ. К противопоказаниям относится только индивидуальная непереносимость;
- линкомицин – является противомикробным препаратом. Применяется только по назначению стоматолога, так как имеет множество побочных эффектов несмотря на высокую эффективность;
- амоксилав – очень качественно воздействует на стафилококки и стрептококки. Дозирование зависит от проявления болезни;
- доксициклин – применяется антибиотик при флюсе зуба у взрослого, является полусинтетическим препаратом, имеющим широкий спектр воздействия;
- цифран – применяется в виде инъекций, дозировка и длительность терапии зависит от клинических признаков.

Установить, какой антибиотик лучше при флюсе зуба, может только врач, исходя из индивидуальности человека. Лечащим врачом может быть назначен прием медикаментов и в послеоперационном периоде. Лекарства позволяют преодолеть заболевание и предотвратить его последующее появление.
Полоскание рта
Если вы не знаете, чем полоскать рот при флюсе на десне, то вот эффективный рецепт:
Приготовьте раствор из этих компонентов, просто добавьте стакан горячей воды, хорошо размешайте и подождите пока остынет до комнатной температуры. Полоскайте рот каждый час.
Также можно использовать отвар шалфея. Возьмите 1 ч. л. травы и залейте кипятком. Настаивать 30 минут, полоскать каждые два часа.
Противопоказания
Противопоказанием к использованию медикаментов является гиперчувствительность ко входящим в состав веществам. Также не рекомендовано использовать антибиотики в период беременности и кормления грудью.
Обратите внимание! Нельзя использовать антибиотики детям, имеющим слабую иммунную систему, и грудничкам.
Перед использованием обязательно прочитайте инструкцию, во избежание негативных последствий для организма.
Можно ли прокалывать флюс на десне
Некоторые люди задают этот вопрос, когда боль достигает своего пика. Они наивно думают, что такая процедура поможет им избавиться от флюса. Но не стоит забывать, что флюс — это гнойное скопление и даже если он вытечет через прокол, это не избавит от необходимости чистить десну. К тому же во время прокола есть вероятность занесения инфицирования в открытую рану. Поэтому прокалывать флюс категорически запрещается.
Побочные воздействия
Индивидуальность каждого организма и разновидность антибиотиков влияют на формирование побочных явлений. В основном к ним относят:
- отечность, аллергические проявления;
- проблемы с ЖКТ – эзофагит, рвота, метеоризм, дисбактериоз;
- слабость;
- головокружение;
- артериальная гипертензия;
- тромбоцитопению, кровотечение.
Это важно! При появлении любых вышеуказанных симптомов следует прекратить приём медикамента и обратиться к специалисту.
Дозировка и способ применения
Сложность течения данной патологии влияет на дозировку и способ применения препаратов.
Использование мазей подразумевает её нанесение 2-3 раза в день на десну. Таблетки принимают до приёма пищи 2-3 раза в сутки. Инъекции проводятся по назначению стоматолога.
Обратите внимание! Назначение препарата проводится только после тщательного изучения анамнеза пациента.
Передозировка
Передозировка возможна в нескольких ситуациях: несоблюдение правил приема, индивидуальной непереносимости. Среди самых распространенных симптомов отмечаются:
- рвота, тошнота;
- повышение температуры;
- аллергия;
- обострение заболеваний ЖКТ;
- общая слабость.
При появлении вышеуказанных проявлений необходимо прекратить прием и обратиться к своему лечащему врачу.
Флюс, нужен совет
Nord wulf
Ситуация следующая.
Уже 2 дня есть шишка (вспухлость) в верхней части десны (самом верху) над зубом. В зубе над которым это происходит кажется есть дырка.
Болевых ощущений нет ни если просто сидеть, ни если просто живать, если давить на шишку то есть небольшая боль. Обнаружил случайно языком, может она (припухлость) там дольше была.
Лицо не опухло вообще, температура нормальная.
Сам понимаю, что лучше к доктору (поэтому и заволновался хоть и боли нет и других неприятных симптомов нет), но нахожусь в другом городе (захолустном), местных врачей разумеется не знаю никого, полиса нет, денег в притык потому что вынужден ждать человека который неизвестно завтра приедет или через неделю (он мне очень нужен) — ну это все лирика.
Вопросы такие:
1) Какая технология лечения флюсов в традиционной медицине (таблетки, процедуры)? По интернету конечно лажу, но совету доктора все же доверяю больше.
2) В какие сроки примерно лечится это дело от начала лечения до полного пропадания вспухлости?
3) Кроме флюса может быть это еще что то? Почему нет боли, опухлости и температуры?
4) Вчера в аптеки мне фармацевт сказал, что в стоматологии вроде применяется Цифран (ципрофлоксацин), нужно ли мне его пить?
P. S. Доктора, все понимаю человек грамотный, поэтому и волнуюсь, но вы представьте, что я солдат в какой нибудь далекой части и меня ни кто в госпиталь не направит пока рожа не опухнет и температуры не будет (какая болезнь без температуры), а доводить до такого состояния очень не хочется, что делать такому солдату?
S. Доктора, все понимаю человек грамотный, поэтому и волнуюсь, но вы представьте, что я солдат в какой нибудь далекой части и меня ни кто в госпиталь не направит пока рожа не опухнет и температуры не будет (какая болезнь без температуры), а доводить до такого состояния очень не хочется, что делать такому солдату?
nindzj330
Nord Wulf, понятно, что не видя случая что то конкретно поставить нельзя, а уж вылечить тем более. Тут есть 2 варианта, либо вы еще больше опухните, либо просто прорвется свищ. Антибиотики конечно прикроют от образования чего то серьезного но не надолго, так как когда инфекция в каналах, а она там если вы говорите, что там дырка в зубе, антибиотики на инфекцию внутри канала не действуют. В вашем случае, если уж есть такая сложная ситуация с деньгами надо
1.Идти к врачу-объяснить ситуацию, он хотя бы почистит каналы, положит туда пасту временную, прикроет временной пломбой. И тогда уж вы дождетесь друга и денег. Если каналы ранее не лечили, то скорее всего все пройдет без осложнений, даже в этом захолустьи как вы говорите.
Если каналы ранее не лечили, то скорее всего все пройдет без осложнений, даже в этом захолустьи как вы говорите.
2. если же такой вариант, как вы описали, что если бы вообще вокруг помощи не дождешься то тогда пить антибиотики, хотя по деньгам я думаю, в обыкновенной больнице проще будет с врачом договориться.
На самом деле однозначного на ваш вопрос в вашей ситуации нет ответа.
Оно все может остаться как было и вы спокойно дождетесь друга и уже с деньгами решите эту проблему
Nord wulf
nindzj330Как я понял по любому надо лечить канал (само не пройдет даже с антибиотиками), ну а время выбирать по самочувствию?
Оно все может остаться как было и вы спокойно дождетесь друга и уже с деньгами решите эту проблему
doc_ae
лечу по фотографии скоро перерастет в лечу по интернету.
1. болел ли зуб раньше? если болел и прошел а теперь вот шишко — этот сценарий лечиться только двумя путями — либо лечением кистогранулемы на верхушке зуба через канал терапевтом, либо еще и с помошью тов-ща хирурга, вплоть до удаления супостата зуба.
на описанном этапе могу только порекомендовать полоскания рта слабым раствором соды (1 ч ложка на стакан воды темп. тела или чуть теплее), и в отсутствии динамики развития отека, температуры и тд — никаких антибиотиков или чего либо еще. начнет болеть раздувать — вуаля, пейте антибиотик, доводите зуб до 100% удаления.
2. если зуб не болел и не болит, то татарскы радива саапщаит снимак нада делать, ум напрягать и тд. )))
Snark711
как действенный и суперсадистский — могу предложить спустить гной, проткнув десну с стороны загнутой на 90 градусов иголкой от капельницы.
визуально устанавливай место наибольшей припухлости и делай дырку.
ессно, хотя бы водочкой, и рот, и руки, и иголку… ну а потом — содой и почаще 😊
это если реально солдат в поле…
я как-то из миндалин таким макаром гной спускал… с зубом, к счастью, не доводилось…
mad_crow
поласкайте!!!
купите в аптеке хлоргексидин или мирамистин и поласкайте.. чем чаще, тем лучше.. рассосется или лопнет в течение 3-5 дней
nindzj330
doc_aeПрошу прощения что не по теме, Doc_ae, мне как коллеге интересно, почему Вы считаете, что при приеме антибиотиков временно зуб 100% пойдет на удаление. Что бы не развивать полемику можно в личку.на описанном этапе могу только порекомендовать полоскания рта слабым раствором соды (1 ч ложка на стакан воды темп. тела или чуть теплее), и в отсутствии динамики развития отека, температуры и тд — никаких антибиотиков или чего либо еще. начнет болеть раздувать — вуаля, пейте антибиотик, доводите зуб до 100% удаления.
2. если зуб не болел и не болит, то татарскы радива саапщаит снимак нада делать, ум напрягать и тд. )))
doc_ae
слова особенно переданные в цифре никогда не отража. т суть и объем передаваемой инфы )))
т суть и объем передаваемой инфы )))
в связи с некоторым опытом общения с «суровыми мужчинами» ))) могу откомментировать так : если гражданин опробывал препорат и он ему помог, то вместо своевременного похода к зубнику, многоуважаемый дон будет ждать следующего обострения, выпьет опять антибиотик, и так по кругу, пока в один день 2 недели антибиотиков не помогут и ему таки придется идти «сдаваться» ))) вот как то так 😛
raivo54321
Nord wulf
в стоматологии вроде применяется Цифран (ципрофлоксацин)
им лечат все, начиная с сальмонеллеза, но никто никогда не скажет, что его используют в фтизиатрии, и лучше его не трогать!!!
U96_nsk
Snark711а мне приходилось просто иглой от шприца, но все же лучше пропить антибиотики, воспаление спадет, нагноение либо рассосется, либо прорвет. И потом при первой же возможности к стоматологу
как действенный и суперсадистский — могу предложить спустить гной, проткнув десну с стороны загнутой на 90 градусов иголкой от капельницы.
я как-то из миндалин таким макаром гной спускал… с зубом, к счастью, не доводилось…
doc_ae
имхо предыдущий пост должны быть перед АМИНЬ в этой теме )))
doc_ae
и такой маааааленький постскриптум — если вдруг вы таки довели до отека (флюс — «народное»), и таки решили попить антибиотиков (самостоятельно), и таки пьете пьете а оно не то что меньше не становиться — а вроде как и увеличивается — не обессудьте. в условиях обычных «стоматологий» частных клиник и поликлиник вскрытие флегмон и абсцессов вроде как запрещено у нас ))) а там уж как повезет. 36 работает круглосуточно, правда бывает беременным линкомицин назначают но это ж конечно случайность )))
OlegYK
Дырки в зубах лучше лечить чем раньше тем лучше (в этом я убедился на собственном опыте). И каждый день тщательно чистить зубы, включая язык — хорошая гигиена практически позволяет надолго забыть про стоматологов.
Ну и надо понимать, что при воспаление ткани корня зуба разрушаются и челюсти тоже. Работал я с человеком который с зубом больше месяца ходил к врачу на промывания и закладку лекарства чтобы спасти зуб, после того как у него прорвало воспаление. Но не в каждом случае это возможно и не каждый врач возмётся возиться.
doc_ae
да, пациент должен быть готов к тому, что долгое и не самое дешевое лечение воспаления на верхушке корня через канал зуба будет неэффективным. но попытаться стоит, уж поверьте. это я как хирург говорю 😛
medved 73
как действенный и суперсадистский — могу предложить спустить гной, проткнув десну с стороны загнутой на 90 градусов иголкой от капельницы.ну вобщем то так и поступал!!! так как дохтор тоже скажет резать десну и вставлять резинку и такие зубы не лечут пока непройдёт флюс!!!
я как-то из миндалин таким макаром гной спускал… с зубом, к счастью, не доводилось…
doc_ae
2medeved73 — не столь категорично. отечность не всегда предполагает наличие гноя в мягких тканях, а следовательно разрез ничего и не даст. а вот получить гной или отделяемое из канала зуба вполне возможно, и тогда разрез может оказаться не нужен, а лечение зуба уже «будет начато».
на будущее — я каэшн все понимаю — вот тут на часах центральный винт маятника сам подкрутил, круто не спорю тыкать в десны иглами, но не стоит. стоматологов вроде достаточно, что б найти своего и потом не играть в доктора с иголкой 😛
medved 73
не столь категорично. отечность не всегда предполагает наличие гноя в мягких тканях,в моём случае по другому не было ниразу
doc_ae
вам повезло) мне не один раз приходилось по молодости совсем юной вскрывать до опупения и таки удивляться на пару с моим куратором «а де же гной та» 😛 с тех пор утекло много воды)))
Доксициклин при флюсе
Назначение антибиотиков при лечении флюса
Антибиотики при флюсе считаются самым эффективным способом остановить начавшееся гнойное воспаление. При флюсе всегда происходит воспаление и возникают осложнения, поэтому лечить это заболевание необходимо комплексно. Антибактериальные препараты широкого спектра действия распространяются на весь организм, поэтому лечение проходит успешно.Однако лечить антибиотиками флюс самостоятельно не рекомендуется. Нужно срочно обратиться к врачу и вылечить это заболевание.
Как лечить флюс антибиотиками
Как показывает стоматологическая практика, флюс зуба необходимо лечить именно антибиотиками, потому что они замечательно снимают воспалительный процесс и не дают инфекции распространиться на весь организм. Кроме того, антибактериальные препараты часто назначают после удаления зуба.
Кроме того, антибактериальные препараты часто назначают после удаления зуба.
Назначение антибиотиков в самом начале образования флюса помогает предотвратить образования гнойника. Если он уже полностью сформировался, то применение этих препаратов целесообразно назначать после его вскрытия. Они помогают быстрее вылечиться, а также необходимы для профилактики.
Успешность лечения антибиотиками зависит от того, насколько сложно заболевание, от лекарственной непереносимости, возраста пациента и многих других факторов.
Чаще всего для лечения флюса зуба назначают:
- Доксициклин.
- Амоксициллин.
- Амоксилав.
- Линкомицин.
- Ципролет.
- Флемоксин солютаб.
- Левомицетин.
- Ципрофлоксацин.
- Бисептол.
- Трихопол.
Курс лечения антибиотиками составляет 5—7 дней, не больше. Потому что более длительный прием антибактериальных препаратов вызывает привыкание микроорганизмов к определенному виду лекарств и образуется их устойчивость.
Лечение нужно начинать, как только появятся первые признаки флюса зуба, когда гнойник еще не образовался. Именно стоматолог должен подобрать правильный препарат, чтобы лечение прошло успешно. Провоцирует появление флюса стафилококковая и стрептококковая инфекция.
Какой антибиотик лучше?
Ответить на вопрос, какой антибиотик наиболее успешно вылечит флюс, может только стоматолог после того, как осмотрит воспаленную десну. Перед назначением препарата врач проводит полную диагностику полости рта, чтобы обнаружить пораженные участки. Если заболевание запущено, то, помимо антибактериальных препаратов, врач может установить дренаж для вывода гноя.Какой бы ни была степень запущенности флюса зуба, лечение начинается с приема антибиотиков. Для наиболее точного подбора антибактериального препарата, врач делает тест, чтобы идентифицировать возбудителя инфекции. Это является основой для успешного лечения. Так как воспаление возникает из-за стрептококковой и стафилококковой инфекции, врачи назначают доксициклин, цифран, линкомицин, ампиокс и другие.
Кроме антибиотиков, флюс зуба лечат физиотерапией (УВЧ и СВЧ). На воспаленный участок происходит воздействие электрического поля, благодаря этому все быстрее заживает. Нужно обратить внимание на то, что флюс нельзя лечить горячими компрессами, иначе гной начинает растекаться из-за усиления притока крови. Повязки тоже нежелательно накладывать, потому что пока антибиотики борются с возбудителем инфекции, воспаление не пройдет. Опасно принимать аспирин, особенно в послеоперационный период. Это может спровоцировать кровотечение.
Действие различных антибиотиков при флюсе
Самые эффективные антибиотики при флюсе:
- Ампиокс – имеет широкий спектр действия, очень эффективен для лечения различных воспалений полости рта, которые вызываются стрептококковой и стафилококковой инфекцией. Дозировку таблетки назначает врач, учитывая индивидуальные особенности организма пациента.
- Цифран – более сильный антибиотик.
 Достоинство этого антибактериального препарата заключается в том, что у него очень мало побочных действий. Противопоказаний нет совершенно никаких, кроме индивидуальной непереносимости.
Достоинство этого антибактериального препарата заключается в том, что у него очень мало побочных действий. Противопоказаний нет совершенно никаких, кроме индивидуальной непереносимости. - Доксициклин – эффективно уничтожает болезнетворные микроорганизмы. Длительность лечения и дозировка этого препарата зависят от симптоматики заболевания. Не рекомендуется принимать детям до 16 лет. Лечится флюс зуба инъекциями, которые вводят внутривенно.
- Линкомицин – антибиотик широкого спектра действия. Он очень эффективен в отношении болезнетворных микроорганизмов, но имеет очень много побочных действий. Принимать его нужно только по назначению врача.
Помимо этих антибиотиков, которые используются в самом начале заболевания, врачи назначают другие, необходимые после вскрытия гнойника и вычищения гноя.
Показания к назначению антибиотиков
При флюсе антибиотики назначают для профилактики в следующих случаях:
- При возникновении воспаления, вызванного стафилококковой или стрептококковой инфекцией.

- Инфекция мягких тканей.
- Профилактика осложнений после вычищения гнойника.
Антибиотики разных видов назначают в зависимости от стадии заболевания. В самом начале возникновения гнойника применяют такие антибактериальные препараты, которые останавливают распространение инфекции. А на поздних стадиях заболевания антибиотики действуют определенного.
Противопоказания к назначению антибиотиков
Основным противопоказанием к назначению обо всех вида антибактериального препарата является индивидуальная непереносимость какого-либо компонента. Их нельзя принимать при беременности и во время кормления грудью, только если это жизненно необходимо. Грудничкам и детям со слабым иммунитетом эти препараты также запрещены.Прежде чем начинать курс лечения, нужно внимательно изучить инструкцию по применению, в которой указаны все противопоказания и побочные действия. Поэтому стоматолог перед назначением препарата должен узнать от пациента о его заболеваниях.
Побочные действия
Побочные действия возникают из-за индивидуальных особенностей организма больного. Самыми распространенными считаются:
- Нарушения желудочно-кишечного тракта. Это может быть рвота, диарея, тошнота, дисбактериоз, боли в эзофагит области, панцитопения, метеоризм.
- Возникновение кровотечений, прием, тромбоцитопения.
- Слабость в мышцах.
- Головокружения, головная боль.
- Отеки, аллергия.
- Повышение кровяного давления.
При появлении этих побочных действий, необходимо сразу прекратить прием препарата и обратиться к врачу.
Форма выпуска
В зависимости от сложности протекания заболевания используют разные формы антибиотиков.
- Мази. Используют в самом начале образования гнойника и наносят на десну. После приема отек и боль уменьшаются.
- Капсулы, таблетки и порошки для приготовления раствора. Используют как для полоскания, так и для внутрь.
 Обладают рядом противопоказаний, связанными с заболеваниями сердца и желудка.
Обладают рядом противопоказаний, связанными с заболеваниями сердца и желудка. - Инъекции. Наиболее удобная форма выпуска. Вводят их внутривенно или внутримышечно. Из-за этого лечебный эффект наступает очень быстро.
Таким образом, чтобы лечение прошло успешно, назначать антибиотики при флюсе должен только врач, и ни в коем случае нельзя заниматься самолечением.
Будьте в кусе: чем можно полоскать и какие антибиотики принимать при флюсе
Полностью вылечить такое заболевание, как флюс можно только с помощью стоматолога.
После осмотра специалист назначит лечение флюса в домашних условиях антибиотиками и другими препаратами.
Медикаментозная терапия довольно продолжительная и включает комплекс противовоспалительных и антибактериальных средств.
Лечение медикаментами в домашних условиях
Существует несколько форм выпуска препаратов для облегчения симптомов заболевания такие как:
- таблетки;
- растворы для полоскания;
- мази и гели.

Таблетки
Такие формы препарата чаще всего назначают для широкого воздействия, поскольку таблетки принимаются перорально. Они обладают противовоспалительным и антиаллергенным свойством.
Наиболее действенными таблетками являются:
- Нимесил (Нимит) – одно из лучших обезболивающих средств, а также эффективно борется с воспалительными процессами. Продолжительность терапии зависит от формы болезни с дозировкой препарата 1 таблетка 2 раза в день;
- Диазолин – антиаллергический препарат, который воздействует на отеки и уменьшает гнойники. Принимать следует по 1 таблетке до 3 раз в день, в зависимости от состояния воспаления десен;
- Диклофенак – одно из лучших средств устраняющих сильную зубную боль. Применять можно до 2 раз в день 25-50 мл.
Растворы для полоскания
В большинстве случаев растворы и настои назначаются как профилактические меры или дополнительные меры в лечении флюса. В их составе небольшая доля этилового спирта, поэтому они являются хорошими антисептиками.
В их составе небольшая доля этилового спирта, поэтому они являются хорошими антисептиками.
Врачи часто отдают предпочтение таким средствам, как:
- Ротокан – травяной раствор на спиртовой основе. При наличии флюса используется для обеззараживания и снятия воспаления с десен и слизистой оболочки ротовой полости. Для использования следует растворить чайную ложку средства в стакане теплой воды и полоскать рот каждые два часа;
- Малавит – натуральный травяной препарат с добавлением серебрянных и медных частиц, благодаря чему является сильным антибактериальным средством. А также помогает снять отеки и сдерживает инфекцию, препятствуя ее распространению. Для использования нужно 10 капель препарата и стакан теплой воды, сделав раствор, следует полоскать рот до 7 раз в сутки до улучшения состояния;
- Хлоргексидин – сильный антисептик, применяемый не только в стоматологии. Способствует восстановлению тканей и обладает противовоспалительным местным действием.
 Для полоскания следует использовать раствор 0,5 % до 4 раз в сутки.
Для полоскания следует использовать раствор 0,5 % до 4 раз в сутки.
Мази и гели
Препараты такой формы лучше способствуют устранению воспалительных процессов и быстро восстанавливают поврежденные ткани. Некоторые также устраняют болевые ощущения.
При флюсе наиболее популярны следующие препараты:
- Мазь Вишневского – используется при флюсе для воздействия на гнойные образования и снятия отечности. А также снимает боль и благодаря ксероформу входящему в состав эффективно борется с вредными бактериями. Использовать следует для профилактики возникновения инфекции после операции на гнойниках;
- Метрогил дента – гель обладает сильным местным действием – обезболивает и устраняет сильные отеки. Его следует наносить на слизистую оболочку на 30 минут, в это время нельзя употреблять пищу или пить. Действия выполнять 3 раза в сутки до уменьшения воспаления;
- Левомеколь – используется в случаях сильного нагноения, благодаря широкому антибактериальному воздействию.
 Применять следует 3 раза в день с помощью ватного или марлевого тампона.
Применять следует 3 раза в день с помощью ватного или марлевого тампона.
Антибиотики при флюсе
В стоматологии антибиотики являются наиболее эффективным, поскольку сдерживают воспалительный процесс и препятствуют распространению инфекции по организму.
Терапия с помощью антибиотиков предотвращает появление гнойных образований. Если же не удалось этого избежать, то их используют после оперативного срезания гнойника, они помогают ускорить процесс реабилитации.
Эффективность лечения зависит от переносимости препарата, а также степени заболевания и некоторых личностных факторов пациента.
Действенными при флюсе являются:
- Доксициклин;
- Амоксициллин;
- Амоксилав;
- Линкомицин;
- Ципролет;
- Ципрофлоксацин;
- Трихопол.
Курс терапии антибиотиками длится не более недели, поскольку более длительное использование уменьшает эффективность действия препаратов, вызывая привыкание организма.
Какой препарат выбрать?
После осмотра специалист определит степень заболевания и назначит нужный препарат. Вне зависимости от формы или степени флюса лечение обязательно начинается с антибиотиков.
Прежде чем начать лечение флюса в домашних условиях антибиотиками, врач должен провести диагностику для определения возбудителя инфекции.
Если флюс был вызван стрептококами или стафиллококами, то стоматолог назначит доксициклин, цифран, линкомицин или ампиокс.
При флюсе могут быть назначен прием следующих антибиотиков:
- Ампиокс – антибиотик с широким спектром воздействия на воспалительный процесс, особенно вызванный стафилококковыми бактериями.
- Цифран – препарат сильного действия, который практически не вызывает побочных эффектов. Антибиотик можно принимать всем, за исключением пациентов с аллергией на компоненты препарата.
- Доксициклин – жидкий антибиотик, который вводят внутривенно с помощью шприца.
 Борется с бактериями, которые вызывают нагноения. Противопоказан для лиц младше 16 лет, для остальных пациентов курс и частоту приема обозначает врач.
Борется с бактериями, которые вызывают нагноения. Противопоказан для лиц младше 16 лет, для остальных пациентов курс и частоту приема обозначает врач. - Линкомицин – эффективный препарат в борьбе с инфекцией, но имеет множество противопоказаний и побочных эффектов.
- Амоксициллин – сильный антибиотик, который оказывает широкое действие на вредные бактерии способствующие развитию флюса. Имеет противопоказания к применению для беременных, страдающих печеночной недостаточностью или лейкозом лимфы. Можно использовать для детей от 12 лет.
- Амоксилав – препарат в виде порошка и таблеток. Соединяет в себе амоксициллин и клавулоновую кислоту. Благодаря такому тандему оказывает эффективное местное влияние на воспаления и гнойники.
- Ципрофлоксацин – относится к фторхиноловой группе препаратов. Является бактерицидным антибиотиком с широким влиянием. Запрещен к применению для кормящих женщин, пациентам, не достигшим 18 лет, а также людям страдающим колитом.

Наиболее распространенным противопоказанием является непереносимость компонентов препарата.
А также их не рекомендуется принимать при беременности, лактации, возможно лишь в случаях, когда польза для матери превышает вред для ребенка. Средство запрещено для маленьких детей и людям с ослабленным иммунитетом.
Перед назначением курса антибиотиков специалист учесть особенности организма пациента и его заболевания. Если правила назначения не были соблюдены или у пациента возникло новое заболевание во время приема медикаментов, то возможно возникновение побочных эффектов.
- проблемы в роботе желудочно-кишечного тракта;
- прорывные обильные кровотечения;
- слабость мышц;
- аллергическая реакция;
- отечность;
- смена давления.
При возникновении любых побочных эффектов следует незамедлительно прекратить прием антибиотиков и обратиться за медицинской помощью.
Видео по теме
Выпуск телепередачи “Жить здорово!” с Еленой Малышевой, посвященный лечению флюса:
Будьте в кусе: чем можно полоскать и какие антибиотики принимать при флюсе
Полностью вылечить такое заболевание, как флюс можно только с помощью стоматолога.
После осмотра специалист назначит лечение флюса в домашних условиях антибиотиками и другими препаратами.
Медикаментозная терапия довольно продолжительная и включает комплекс противовоспалительных и антибактериальных средств.
Лечение медикаментами в домашних условиях
Существует несколько форм выпуска препаратов для облегчения симптомов заболевания такие как:
- таблетки;
- растворы для полоскания;
- мази и гели.
Таблетки
Такие формы препарата чаще всего назначают для широкого воздействия, поскольку таблетки принимаются перорально. Они обладают противовоспалительным и антиаллергенным свойством.
Наиболее действенными таблетками являются:
- Нимесил (Нимит) – одно из лучших обезболивающих средств, а также эффективно борется с воспалительными процессами. Продолжительность терапии зависит от формы болезни с дозировкой препарата 1 таблетка 2 раза в день;
- Диазолин – антиаллергический препарат, который воздействует на отеки и уменьшает гнойники. Принимать следует по 1 таблетке до 3 раз в день, в зависимости от состояния воспаления десен;
- Диклофенак – одно из лучших средств устраняющих сильную зубную боль. Применять можно до 2 раз в день 25-50 мл.
Растворы для полоскания
В большинстве случаев растворы и настои назначаются как профилактические меры или дополнительные меры в лечении флюса. В их составе небольшая доля этилового спирта, поэтому они являются хорошими антисептиками.
Врачи часто отдают предпочтение таким средствам, как:
- Ротокан – травяной раствор на спиртовой основе. При наличии флюса используется для обеззараживания и снятия воспаления с десен и слизистой оболочки ротовой полости. Для использования следует растворить чайную ложку средства в стакане теплой воды и полоскать рот каждые два часа;
- Малавит – натуральный травяной препарат с добавлением серебрянных и медных частиц, благодаря чему является сильным антибактериальным средством. А также помогает снять отеки и сдерживает инфекцию, препятствуя ее распространению. Для использования нужно 10 капель препарата и стакан теплой воды, сделав раствор, следует полоскать рот до 7 раз в сутки до улучшения состояния;
- Хлоргексидин – сильный антисептик, применяемый не только в стоматологии. Способствует восстановлению тканей и обладает противовоспалительным местным действием. Для полоскания следует использовать раствор 0,5 % до 4 раз в сутки.
Мази и гели
Препараты такой формы лучше способствуют устранению воспалительных процессов и быстро восстанавливают поврежденные ткани. Некоторые также устраняют болевые ощущения.
При флюсе наиболее популярны следующие препараты:
- Мазь Вишневского – используется при флюсе для воздействия на гнойные образования и снятия отечности. А также снимает боль и благодаря ксероформу входящему в состав эффективно борется с вредными бактериями. Использовать следует для профилактики возникновения инфекции после операции на гнойниках;
- Метрогил дента – гель обладает сильным местным действием – обезболивает и устраняет сильные отеки. Его следует наносить на слизистую оболочку на 30 минут, в это время нельзя употреблять пищу или пить. Действия выполнять 3 раза в сутки до уменьшения воспаления;
- Левомеколь – используется в случаях сильного нагноения, благодаря широкому антибактериальному воздействию. Применять следует 3 раза в день с помощью ватного или марлевого тампона.
Антибиотики при флюсе
В стоматологии антибиотики являются наиболее эффективным, поскольку сдерживают воспалительный процесс и препятствуют распространению инфекции по организму.
Терапия с помощью антибиотиков предотвращает появление гнойных образований. Если же не удалось этого избежать, то их используют после оперативного срезания гнойника, они помогают ускорить процесс реабилитации.
Эффективность лечения зависит от переносимости препарата, а также степени заболевания и некоторых личностных факторов пациента.
Действенными при флюсе являются:
- Доксициклин;
- Амоксициллин;
- Амоксилав;
- Линкомицин;
- Ципролет;
- Ципрофлоксацин;
- Трихопол.
Курс терапии антибиотиками длится не более недели, поскольку более длительное использование уменьшает эффективность действия препаратов, вызывая привыкание организма.
Какой препарат выбрать?
После осмотра специалист определит степень заболевания и назначит нужный препарат. Вне зависимости от формы или степени флюса лечение обязательно начинается с антибиотиков.
Прежде чем начать лечение флюса в домашних условиях антибиотиками, врач должен провести диагностику для определения возбудителя инфекции.
Если флюс был вызван стрептококами или стафиллококами, то стоматолог назначит доксициклин, цифран, линкомицин или ампиокс.
При флюсе могут быть назначен прием следующих антибиотиков:
- Ампиокс – антибиотик с широким спектром воздействия на воспалительный процесс, особенно вызванный стафилококковыми бактериями.
- Цифран – препарат сильного действия, который практически не вызывает побочных эффектов. Антибиотик можно принимать всем, за исключением пациентов с аллергией на компоненты препарата.
- Доксициклин – жидкий антибиотик, который вводят внутривенно с помощью шприца. Борется с бактериями, которые вызывают нагноения. Противопоказан для лиц младше 16 лет, для остальных пациентов курс и частоту приема обозначает врач.
- Линкомицин – эффективный препарат в борьбе с инфекцией, но имеет множество противопоказаний и побочных эффектов.
- Амоксициллин – сильный антибиотик, который оказывает широкое действие на вредные бактерии способствующие развитию флюса. Имеет противопоказания к применению для беременных, страдающих печеночной недостаточностью или лейкозом лимфы. Можно использовать для детей от 12 лет.
- Амоксилав – препарат в виде порошка и таблеток. Соединяет в себе амоксициллин и клавулоновую кислоту. Благодаря такому тандему оказывает эффективное местное влияние на воспаления и гнойники.
- Ципрофлоксацин – относится к фторхиноловой группе препаратов. Является бактерицидным антибиотиком с широким влиянием. Запрещен к применению для кормящих женщин, пациентам, не достигшим 18 лет, а также людям страдающим колитом.
Наиболее распространенным противопоказанием является непереносимость компонентов препарата.
А также их не рекомендуется принимать при беременности, лактации, возможно лишь в случаях, когда польза для матери превышает вред для ребенка. Средство запрещено для маленьких детей и людям с ослабленным иммунитетом.
Перед назначением курса антибиотиков специалист учесть особенности организма пациента и его заболевания. Если правила назначения не были соблюдены или у пациента возникло новое заболевание во время приема медикаментов, то возможно возникновение побочных эффектов.
- проблемы в роботе желудочно-кишечного тракта;
- прорывные обильные кровотечения;
- слабость мышц;
- аллергическая реакция;
- отечность;
- смена давления.
При возникновении любых побочных эффектов следует незамедлительно прекратить прием антибиотиков и обратиться за медицинской помощью.
Будьте в кусе: чем можно полоскать и какие антибиотики принимать при флюсе
Полностью вылечить такое заболевание, как флюс можно только с помощью стоматолога.
После осмотра специалист назначит лечение флюса в домашних условиях антибиотиками и другими препаратами.
Медикаментозная терапия довольно продолжительная и включает комплекс противовоспалительных и антибактериальных средств.
Лечение медикаментами в домашних условиях
Существует несколько форм выпуска препаратов для облегчения симптомов заболевания такие как:
- таблетки;
- растворы для полоскания;
- мази и гели.
Таблетки
Такие формы препарата чаще всего назначают для широкого воздействия, поскольку таблетки принимаются перорально. Они обладают противовоспалительным и антиаллергенным свойством.
Наиболее действенными таблетками являются:
- Нимесил (Нимит) – одно из лучших обезболивающих средств, а также эффективно борется с воспалительными процессами. Продолжительность терапии зависит от формы болезни с дозировкой препарата 1 таблетка 2 раза в день;
- Диазолин – антиаллергический препарат, который воздействует на отеки и уменьшает гнойники. Принимать следует по 1 таблетке до 3 раз в день, в зависимости от состояния воспаления десен;
- Диклофенак – одно из лучших средств устраняющих сильную зубную боль. Применять можно до 2 раз в день 25-50 мл.
Растворы для полоскания
В большинстве случаев растворы и настои назначаются как профилактические меры или дополнительные меры в лечении флюса. В их составе небольшая доля этилового спирта, поэтому они являются хорошими антисептиками.
Врачи часто отдают предпочтение таким средствам, как:
- Ротокан – травяной раствор на спиртовой основе. При наличии флюса используется для обеззараживания и снятия воспаления с десен и слизистой оболочки ротовой полости. Для использования следует растворить чайную ложку средства в стакане теплой воды и полоскать рот каждые два часа;
- Малавит – натуральный травяной препарат с добавлением серебрянных и медных частиц, благодаря чему является сильным антибактериальным средством. А также помогает снять отеки и сдерживает инфекцию, препятствуя ее распространению. Для использования нужно 10 капель препарата и стакан теплой воды, сделав раствор, следует полоскать рот до 7 раз в сутки до улучшения состояния;
- Хлоргексидин – сильный антисептик, применяемый не только в стоматологии. Способствует восстановлению тканей и обладает противовоспалительным местным действием. Для полоскания следует использовать раствор 0,5 % до 4 раз в сутки.
Мази и гели
Препараты такой формы лучше способствуют устранению воспалительных процессов и быстро восстанавливают поврежденные ткани. Некоторые также устраняют болевые ощущения.
При флюсе наиболее популярны следующие препараты:
- Мазь Вишневского – используется при флюсе для воздействия на гнойные образования и снятия отечности. А также снимает боль и благодаря ксероформу входящему в состав эффективно борется с вредными бактериями. Использовать следует для профилактики возникновения инфекции после операции на гнойниках;
- Метрогил дента – гель обладает сильным местным действием – обезболивает и устраняет сильные отеки. Его следует наносить на слизистую оболочку на 30 минут, в это время нельзя употреблять пищу или пить. Действия выполнять 3 раза в сутки до уменьшения воспаления;
- Левомеколь – используется в случаях сильного нагноения, благодаря широкому антибактериальному воздействию. Применять следует 3 раза в день с помощью ватного или марлевого тампона.
Антибиотики при флюсе
В стоматологии антибиотики являются наиболее эффективным, поскольку сдерживают воспалительный процесс и препятствуют распространению инфекции по организму.
Терапия с помощью антибиотиков предотвращает появление гнойных образований. Если же не удалось этого избежать, то их используют после оперативного срезания гнойника, они помогают ускорить процесс реабилитации.
Эффективность лечения зависит от переносимости препарата, а также степени заболевания и некоторых личностных факторов пациента.
Действенными при флюсе являются:
- Доксициклин;
- Амоксициллин;
- Амоксилав;
- Линкомицин;
- Ципролет;
- Ципрофлоксацин;
- Трихопол.
Курс терапии антибиотиками длится не более недели, поскольку более длительное использование уменьшает эффективность действия препаратов, вызывая привыкание организма.
Какой препарат выбрать?
После осмотра специалист определит степень заболевания и назначит нужный препарат. Вне зависимости от формы или степени флюса лечение обязательно начинается с антибиотиков.
Прежде чем начать лечение флюса в домашних условиях антибиотиками, врач должен провести диагностику для определения возбудителя инфекции.
Если флюс был вызван стрептококами или стафиллококами, то стоматолог назначит доксициклин, цифран, линкомицин или ампиокс.
При флюсе могут быть назначен прием следующих антибиотиков:
- Ампиокс – антибиотик с широким спектром воздействия на воспалительный процесс, особенно вызванный стафилококковыми бактериями.
- Цифран – препарат сильного действия, который практически не вызывает побочных эффектов. Антибиотик можно принимать всем, за исключением пациентов с аллергией на компоненты препарата.
- Доксициклин – жидкий антибиотик, который вводят внутривенно с помощью шприца. Борется с бактериями, которые вызывают нагноения. Противопоказан для лиц младше 16 лет, для остальных пациентов курс и частоту приема обозначает врач.
- Линкомицин – эффективный препарат в борьбе с инфекцией, но имеет множество противопоказаний и побочных эффектов.
- Амоксициллин – сильный антибиотик, который оказывает широкое действие на вредные бактерии способствующие развитию флюса. Имеет противопоказания к применению для беременных, страдающих печеночной недостаточностью или лейкозом лимфы. Можно использовать для детей от 12 лет.
- Амоксилав – препарат в виде порошка и таблеток. Соединяет в себе амоксициллин и клавулоновую кислоту. Благодаря такому тандему оказывает эффективное местное влияние на воспаления и гнойники.
- Ципрофлоксацин – относится к фторхиноловой группе препаратов. Является бактерицидным антибиотиком с широким влиянием. Запрещен к применению для кормящих женщин, пациентам, не достигшим 18 лет, а также людям страдающим колитом.
Наиболее распространенным противопоказанием является непереносимость компонентов препарата.
А также их не рекомендуется принимать при беременности, лактации, возможно лишь в случаях, когда польза для матери превышает вред для ребенка. Средство запрещено для маленьких детей и людям с ослабленным иммунитетом.
Перед назначением курса антибиотиков специалист учесть особенности организма пациента и его заболевания. Если правила назначения не были соблюдены или у пациента возникло новое заболевание во время приема медикаментов, то возможно возникновение побочных эффектов.
- проблемы в роботе желудочно-кишечного тракта;
- прорывные обильные кровотечения;
- слабость мышц;
- аллергическая реакция;
- отечность;
- смена давления.
При возникновении любых побочных эффектов следует незамедлительно прекратить прием антибиотиков и обратиться за медицинской помощью.
Как лечить флюс, чем быстро вылечить на десне или щеке антибиотиками
Возникновение отечности на десне – первый признак того, что в полости между десной и зубом развивается нагноение, флюс. Эта неприятность часто встречается у тех пациентов, которые имеют кариес, шатающие корни зубов, разрушенные коронки, отколовшиеся пломбы. Спровоцировать флюс может любая патология, где есть инфицирование или высок его риск. Особенно нужно следить за возникновением флюсов тем пациентам, которые страдают гингивитом или пародонтитом. Вылечить флюс можно различными способами, в зависимости от стадии течения заболевания.
При легкой стадии развития заболевания, когда пациент заметил только начавшееся воспаление без признаков формирования гнойной полости, флюс можно вылечить консервативным путем. При незначительном воспалении консервативную терапию можно подкрепить народными средствами. Можно ли лечить флюс с абсцессом, интересуются многие пациенты, не желающие обращаться к врачу. Если нагноение сформировалось быстро, состояние пациента осложнилось повышением температуры, подергиванием в области пораженного зуба и развитием большого отека, тогда флюс немедленно вскрывают у доктора. Если нагноение вскрылось самостоятельно, визит к врачу все равно необходим – стоматолог сделает промывание профессиональными средствами, наложит мазь и даст рекомендации по дальнейшему лечению заболевания.
Консервативные методы лечения флюса
Если у человека возник флюс, это значит, что патогенная микрофлора активизировалась и развитие нагноительного процесса необходимо срочно остановить. Для этого в первую очередь применяют антибактериальные препараты, которые помогут избавить пациента от болезнетворных микроорганизмов. В качестве антибактериальных препаратов можно применять таблетированные средства. Это могут быть Амоксициллин, Флемоксин, Азитромицин, Ципрофлоксацин. Какими антибиотиками лечить флюс, поможет определиться врач-стоматолог.
Препарат содержит множество активных компонентов – мумие, экстракты трав, ионы серебра и меди, смолы пихтовых деревьев и даже горную росу
Кроме таблеток, врач назначит и способы местной обработки флюса – это полоскания, прикладывание различных примочек и аппликаций. Местное лечение имеет большое значение, поэтому именно на нем необходимо сконцентрироваться при консервативной терапии. Местно можно полоскать ротовую полость со стороны поражения растворами Ротокан, Хлоргексидин, Стоматидин, Малавит и другими.
Средство Ротокан содержит в себе растительные экстракты ромашки, тысячелистника и календулы. Поскольку средство настояно на спирту, это необходимо учитывать при применении у детей, автомобилистов и других категорий пациентов. Ротокан отлично справляется с инфекцией в ротовой полости, поэтому он рекомендован и для лечения флюсов. Одну чайную ложку раствора Ротокана разводят с водой до однородной консистенции, а затем полощут рот, особое внимание уделяя стороне, где расположен флюс.
Полоскания с Хлоргексидином и Стоматидином можно чередовать – эти два лекарственных препарата помогут снять воспаление на начальной, серозной, стадии развития флюса. Стоматидин можно не разбавлять, а некоторые врачи советуют еще и примочки из Стоматидина. Средством промакивают марлю, сложенную в несколько слоев, после чего прикладывают к месту нагноения. Держать примочки необходимо по 10-15 минут, время от времени смачивая марлю в лекарстве.
Препараты помогу снять воспаление, отечность и избавиться от зубной боли. Фармацевтические средства дополняют народными методиками. Народное лечение самостоятельно избавить от флюса не может, но в комплексе с лекарственными препаратами полоскания травами будут весьма полезны. Видео, как вылечить флюс и какими травами можно пользоваться, можно посмотреть на специальных сайтах.
Самая простая помощь, которую может оказать себе пациент с флюсом еще до обращения в клинику, – полоскание содовым раствором. Для эффективной борьбы с флюсом необходимо смешать в стакане воды по чайной ложке соли и соды, после чего хорошенько растворить эти компоненты и полоскать ротовую полость как можно чаще, делая основной упор на пораженной стороне. Если негативной реакции на этот раствор нет, то при повторном полоскании туда можно добавить несколько капель йода. Сода поможет устранить отечность, избавит пациента от болезненных ощущений.
Лечить флюс на десне содой может посоветовать и врач, если сочтет этот вариант после осмотра допустимым.
Лечение отварами трав
Многие травы обладают отличным противовоспалительным эффектом, поэтому от их применения тоже отказываться не имеет смысла. Однако не стоит рассчитывать, что от флюса можно избавиться одними лишь народными средствами. Это может привести к затягиванию выздоровления и усугублению заболевания.
Если же врач дал добро на использование трав, можно воспользоваться различными рецептами растворов для полоскания рта. Приобрести компоненты для приготовления растворов можно в аптеке, а в некоторых случаях там продаются уже готовые препараты на спирту, которые нужно будет лишь развести водой. К таким препаратам, например, относится средство Ротокан.
Для приготовления противовоспалительного раствора можно воспользоваться шалфеем. Две столовые ложки травы шалфея необходимо залить двумя стаканами кипятка и протомить средство на водяной бане чуть меньше часа. Затем жидкость остужают до комнатной температуры и полощут ею рот 2-3 раза в день.
Шалфей обладает отличным противовоспалительным свойством и применяется как самостоятельно, так и в комплексе с другими травами
Хороший эффект для лечения заболевания дает не только шалфей, но и кора дуба. Поэтому народники рекомендуют включать в рецепт еще и этот компонент, дополняя рецепт силой зверобоя. Для приготовления средства необходимо смешать по две столовые ложки коры дуба и шалфея, а также добавить туда три столовых ложки зверобоя. Полученную сухую смесь заливают одним литром кипятка, после чего емкость накрывают крышкой и оставляют настаиваться на полчаса. Как только средство остынет, им можно пользоваться для полоскания ротовой полости. Отцедив осадок, средство применяют 6-7 раз в день.
Полезными будут растворы с шалфеем, горечником и синеголовником. Все три компонента необходимо взять в равных пропорциях, перемешать, а затем заварить одну столовую ложку смеси полутора стаканами воды. Емкость плотно укупоривают и ставят в темноту на пару часов настояться. Этим средством полоскают рот три раза в день, также можно прикладывать к больной десне марлю, смоченную в лекарственном растворе.
Лечить флюс на щеке и на десне можно прополисом. Он часто используется в медицине и применяется также при лечении нагноительных заболеваний в ротовой полости. Чтобы максимально помочь пациенту с флюсом, можно применять мазь с прополисом. Для приготовления средства необходимо взять немного растительного масла, пчелиный воск (20 гр), а также немного прополиса. Все компоненты смеси необходимо подогреть до полного растворения, а затем перемешать, чтобы получилась однородная масса. Когда все компоненты разойдутся, средство нужно поместить в небольшую емкость и поставить в холод. Применяют полученную мазь и в виде аппликаций, и в виде втираний в пораженную слизистую воспаленного зуба.
Оперативное лечение флюса
При лечении острого периостита, когда гнойный очаг появился буквально за несколько часов, необходимо быстро вылечить флюс и сделать это можно только хирургическим путем. Оставлять заболевание в таком виде и надеяться на то, что флюс разрешится сам, нельзя. Это может привести к захвату патологическим процессом больших участков кости. Справиться с таким заболеванием будет непросто.
При обращении в клинику врач в первую очередь осматривает причинный зуб и решает вопрос о его сохранении или удалении. Стоматологическая практика показывает, что лучший прогноз дают зубы с одним корнем, который хорошо проходим и поддается пломбированию. За такой зуб можно бороться. В данном случае врачи проводят резекцию верхушки корня, чтобы полностью устранить воспалительные явления в корне зуба. В дальнейшем после заживления лечащему врачу необходимо запломбировать пациенту канал.
Типичный флюс, который подлежит вскрытию у хирурга
Если патологический процесс затронул многокорневые зубы, то большинство врачей настаивают на том, чтобы их полностью удалять. Удаляют зубы либо непосредственно при первом посещении, либо откладывают процедуру на неделю, если есть необходимость ликвидировать обширное воспаление в его области.
Разрезы десен проводятся с учетом локализации нагноения. Оперативное вмешательство проводится под местным наркозом. Если во время вмешательства необходимо и вскрывать абсцесс, и удалять зуб, то врачи начинают с абсцесса, чтобы не травмировать окружающие ткани и не спровоцировать проникновение инфекции в кровь. Врач проводит разрезы максимально аккуратно, особенно в области слизистой щеки – там можно повредить крупные сосуды и спровоцировать обильное кровотечение. Обычно гнойный очаг вскрывается обширно – разрезы составляют не менее 1 см., чтобы можно было ввести трубку для дренажа гнойной полости.
В период после операции врачи лечат гнойные раны по общему принципу. Местно рекомендованы полоскания с антибактериальными растворами. При больших поражениях врачи назначают ежедневные визиты пациента, чтобы перевязывать рану. Так необходимо делать до тех пор, пока флюс перестанет гноиться. Параллельно пациентам назначают антибиотики внутрь, болеутоляющие препараты, сульфаниламиды. Для снятия отечности и признаков воспаления применяют нестероидные противовоспалительные препараты. Полезна будет УВЧ-терапия. Поскольку при лечении флюса рецидивы бывают довольно часто, особенно у ребенка при молочных зубах, врачи дают особые указания по наблюдению за воспаленной областью. Если она снова стала напухать, воспаляться и нагнаиваться, показано повторное обращение к врачу.
При лечении флюса большое внимание необходимо уделять профилактике. Особенно, если флюсы стали появляться довольно часто. С целью профилактики рекомендовано следовать советам стоматологов:
- не переохлаждать зубы, в холодное время года защищать лицо от ветра шарфом или воротником;
- своевременно проходить профилактические осмотры у стоматолога;
- бороться с воспалительными заболеваниями десен, которые часто являются пусковыми механизмами для начала развития флюса;
- своевременно лечить кариес, в том числе и боковой, который некоторые врачи предпочитают не трогать;
- тщательно пережевывать пищу, чтобы не травмировать острыми краями десны;
- постоянно промывать и чистить протезы, каппы, съемные мосты, не допускать попадания под них остатков пищи;
- тщательно чистить зубы, вовремя менять щетку, пользоваться приспособлениями для чистки межзубного пространства, а после приема пищи использовать ополаскиватели для зубов.
Лечить флюс необходимо комплексно – терапевтические меры могут содержать не только лекарственные препараты, но и средства народной медицины. Если же при начавшемся флюсе стремительное воспаление привело к формированию абсцесса, то показано только хирургическое лечение. Ни в коем случае нельзя греть флюс грелкой, так как уже через несколько часов вялотекущий серозный флюс перерастет в крупный гнойник. Терапия флюса должна проводиться в полном объеме.
как лечить в домашних условиях?
Под коротким названием флюс скрывается серьезное заболевание: воспаление надкостницы, или одонтогенный периостит.
В запущенных случаях это состояние может привести к тяжелым осложнениям, таким как остеомиелит, флегмона мягких тканей лица, заражение крови (сепсис).
Поэтому при первых неприятных симптомах в виде опухания десны и щеки, ноющей и дергающей боли в области зуба, повышения температуры следует обратиться к специалисту.
Тем не менее в некоторых ситуациях немедленный визит к стоматологу невозможен, и приходится полагаться на собственные силы. Как лечить флюс в домашних условиях, каким препаратам следует отдать предпочтение и насколько эффективным будет самолечение?
Как вылечить флюс в домашних условиях?
Рассмотрим, как лечить флюс в домашних условиях быстро.
Название одонтогенный периостит указывает на природу заболевания – причиной его развития в большинстве случаев становится глубокий кариозный процесс.
Развитие флюса начинается, когда инфекция из пульпы или периодонта переходит на костную ткань, которая окружает зуб, а потом и на ткани периоста, а также при длительном воспалительном процессе в десневом кармане.
Гематогенный и лимфогенный путь развития, связанный с наличием очага инфекции в организме и ее распространением через кровеносную и лимфатическую систему, возможен, но встречается гораздо реже.
В большинстве случаев флюсу предшествуют:
- нелеченый острый пульпит;
- периодонтит и кисты у корня зуба;
- неправильно проведенное пломбирование зубов – недостаточно тщательно проведенная очистка каналов приводит к тому, что воспалительный процесс под пломбой продолжается;
- тяжелый пародонтит;
- механические повреждения зубов с инфицированием пульпы.
Острый одонтогенный периостит делится на серозный и гнойный. Периостит в хронической форме делится на простой и оссифицирующий.
Самолечение при флюсе часто оказывается неэффективным и даже ухудшает состояние больного, приводя к многочисленным осложнениям, поэтому самое лучшее, что можно сделать при первых признаках воспаления надкостницы – это обратиться к стоматологу. Часто при сильном нагноении требуется вскрытие и санация образовавшейся у корня зуба полости, его лечение или полное удаление, что невозможно сделать в домашних условиях. В особенности это относится к детям, чей слабый иммунитет и ускоренный метаболизм – благодатная почва для быстрого развития любого воспалительного процесса.
Однако если возможности посетить специалиста нет, а флюс еще не успел перейти из начальной серозной стадии в более запущенную, гнойную – можно попытаться купировать воспаление своими силами.
При повышении температуры до 38-39 градусов, сильных болях, патологической подвижности зуба, появлении гнойных свищей и сильных отеках лица можно заподозрить переход периостита в остеомиелит. В таком случае больному требуется госпитализация и оперативное лечение.
Медикаментозное лечение флюса: антибиотики
На ранних стадиях развития зубного флюса его часто удается вылечить консервативным методом. Обычно при удачном снятии воспаления удается сохранить и вылечить послуживший причиной его развития зуб.
Чтобы быстро справиться с воспалением надкостницы, используются антибиотики широкого спектра действия: прежде всего это относительно нетоксичные Амоксиклав и Линкомицин.
Также хорошо зарекомендовали себя такие средства, как Ципрофлоксацин, Ципролет, Доксициклин, Амоксициллин, Ампиокс, Бисептол.
Они уничтожают большую часть болезнетворных микроорганизмов, способных вызвать нагноение, поэтому не требуют предварительного анализа для точного определения возбудителя.
При лечении антибиотиками важно помнить, что у многих из них существует значительный список противопоказаний и побочных эффектов, и не следует применять их без назначения специалиста. Если антибиотикотерапия не дает видимого эффекта в течение нескольких дней, смысла продолжать курс нет – необходимо или сменить препарат, или вскрыть флюс хирургически.
Даже если удалось частично заглушить воспалительный процесс применением антибактериальных препаратов, иногда он переходит в хроническую форму и продолжает разрушать ткани, что рано или поздно приводит к потере зуба или более тяжелым осложнениям. Поэтому после курса антибиотиков обязательно необходимо посетить стоматолога, чтобы убедиться в успехе лечения и ликвидировать находящийся в зубе источник заражения.
Многие больные пренебрегают антибиотиками, боясь ухудшить свой иммунитет. Но периостит – не то заболевание, при котором следует полагаться на силы собственного организма.Поэтому, если противопоказания к их применению отсутствуют, лучше в течение нескольких дней избавиться от флюса с их помощью, чем затягивать болезнь, применяя более слабые средства.
Местное лечение флюса: полоскания, мази
Помимо таблеток и капсул для приема внутрь при флюсе часто используются разнообразные настойки и растворы для полоскания ротовой полости, а также мази для местного применения.
Этот способ безопаснее, особенно для детей, людей с заболеваниями печени и почек и другими противопоказаниями к лечению антибиотиками, а за счет непосредственного воздействия на воспаленную область может оказать достаточно быстрый эффект. И ничто не мешает совмещать разные способы лечения, одновременно принимая антибиотики и орошая воспаленный участок антисептическими средствами.
Для полоскания рта часто используется такое малотоксичное и недорогое средство, как Мирамистин и его еще более бюджетный аналог – Хлоргексидин.
Эти антисептики имеют слабый вкус, не пересушивают слизистые оболочки и безопасны при проглатывании в небольших количествах, поэтому разрешены маленьким детям, пожилым и ослабленным больным.
Они выпускаются в удобных для орошения ротовой полости флаконах со специальными насадками.
Еще одно распространенное средство, использующееся при периостите и других воспалительных заболеваниях, начиная от стоматита и заканчивая ангиной – Фурацилин и его аналоги на основе действующего вещества нитрофурала. Он выпускается в форме таблеток, раствор которых и применяют для полоскания рта, гораздо реже – в виде готового раствора.
Сернисто-желтую жидкость с горьковатым вкусом нельзя хранить под воздействием прямых солнечных лучей, потому что ее активный компонент быстро распадается на свету. Фурацилин достаточно эффективен против анаэробной микрофлоры, но, поскольку это средство используется уже очень давно, существуют устойчивые к нему штаммы болезнетворных бактерий.
Хлорофиллипт – аптечное средство на основе натуральных компонентов, представляющее собой вытяжку из листьев эвкалипта.
Он уничтожает стафилококки, которые обычно и становятся причиной развития флюса, стимулирует регенерацию тканей, а благодаря свежему аромату и приятному вкусу помогает избавиться от запаха изо рта, во многих случаях сопровождающего кариес и присоединившийся к нему периостит.
Как и любые другие растительные средства, Хлорофиллипт иногда становится для больного мощным аллергеном, поэтому склонным к аллергическим реакциям на эфирные масла людям следует принимать его с осторожностью. То же самое можно сказать и про Малавит, другое популярное при флюсе средство.
Крепкий раствор поваренной соли, теплая вода с содой и светло-розовый раствор марганцовки также уничтожают микробов и во многих случаях помогают нарыву быстрее вскрыться. Но антисептическое их действие значительно слабее, чем у аптечных препаратов.
Полоскать рот антисептиками при флюсе следует 4-5 раз в день, после приема пищи, и в течение получаса ничего не есть и не пить, чтобы средство всосалось через слизистые оболочки. А в промежутках между полосканиями для быстрого снятия воспаления следует делать на десну над проблемным зубом аппликации мазей.
Мазь Вишневского и ихтиоловая мазь – едва ли не самые известные средства против гнойных воспалений. Однако при периостите нельзя использовать их во время нагноения – накладывать мази следует или до образования абсцесса, или после его прорыва, чтобы вытянуть гной и поспособствовать заживлению ранки. Так как эти мази имеют крайне неприятный запах и вкус, а проглатывать их нежелательно, часто аппликации накладывают не на десну, а на щеку над больным участком.
Стрептоцидовая мазь также имеет неприятный горький вкус.
Стрептоцид хорошо справляется с грамположительными или грамотрицательными кокками, он малотоксичен.
То же можно сказать и о Левомеколе, антибактериальной и стимулирующей заживление поврежденных инфекцией тканей мази.
Их наносят или на десну, или на ватный тампон, который прикладывается к воспаленному участку. При образовании полости на месте абсцесса эти мази рекомендуют вводить непосредственно внутрь тканевого кармана.
Метрогил дента, часто применяющийся при периостите, отличается приятным вкусом, поэтому станет оптимальным вариантом для лечения ребенка от шести лет.
После нанесения мазей нужно постараться не слизывать их и, как и после полосканий, не есть и не пить в течение получаса или дольше.
Растворы для полоскания при флюсе ни в коем случае не должны быть теплыми. Тепло активизирует процесс деления болезнетворных микробов и ускоряет развитие абсцесса. А так как гнойный периостит чреват тяжелыми осложнениями, наиболее важная цель самостоятельного лечения заключается в том, чтобы не допустить образования заполненной гноем полости, загасив воспаление в самом начале.
Некоторые стоматологические заболевания категорически нельзя игнорировать. Как избавиться от флюса в домашних условиях – тема следующей статьи.
Все о том, как лечить флюс дома, читайте в этом материале.
При флюсе часто назначаются полоскания полости рта. Чем можно полоскать рот при флюсе, читайте в этой теме.
Народные рецепты лечения флюса
Нередко случается Втакая ситуация, когда нет не только возможности попасть к стоматологу, но и возможность попасть в аптеку также отсутствует. Или больному противопоказаны сильнодействующие химические препараты. В таких случаях остается лишь обратиться к народной медицине.
Не все способы избавиться от флюса без применения лекарств одинаково эффективны: некоторые из них, к примеру, выкатывание болезни свежим яйцом, разнообразные заговоры, натирание зуба налетом с раскаленного гвоздя, остуженного в меду, или жжеными волосами, вряд ли помогут снять воспаление и успокоить боль.
Но некоторые из них, напротив, достаточно действенны.
В первую очередь это полоскания рта настоем разнообразных трав. Для того чтобы добиться антибактериального и противовоспалительного эффекта, имеет смысл использовать сборы, в состав которых входит несколько растений. Это могут быть:
- кора дуба, высушенная трава зверобоя и шалфея, взятые в равных пропорциях;
- шалфей и мелисса;
- корень аира – сильный природный антибиотик;
- березовые почки, высушенные листья барвинка малого, перечной мяты и дудника.
Эти настои приятны на вкус, в отличие от большинства аптечных настоев и мазей, и практически не имеют противопоказаний. Но при сильном нагноении они могут оказаться слишком слабыми для того, чтобы справиться с периоститом.
Помимо полосканий, на флюс накладывают компрессы (которые обязательно должны быть холодными). Наиболее распространенные варианты – это мелко нарезанный лук, обернутый марлей, или пропитанная луковым соком ватка. В луке содержится огромное количество фитонцидов, уничтожающих болезнетворные микробы. Однако его жгучий вкус помешает использованию луковых компрессов для лечения ребенка.
Не имеет этого вкуса обыкновенная капуста. Ее отваренные листья прикладывают непосредственно к десне или к щеке с больной стороны.
Рассасывание кусочков прополиса или смазывание его раствором воспаленной десны поможет снять воспаление тем больным, у кого нет аллергии на продукты пчеловодства.Самое простое и доступное из всех народных средств – холодный компресс.
Кубик льда или смоченная в ледяной воде ткань помогут унять боль и замедлить развитие воспаления, позволив без осложнений дождаться возможности посетить врача.
Полоскания, аппликации мазей и прохладные примочки помогут снять воспаление и ускорить заживление поврежденных тканей не только при начинающемся периостите, но и после визита к стоматологу и вскрытия абсцесса или удаления зуба.
Появление флюса доставляет человеку сильный дискомфорт, так как это гнойное поражение десны. Как убрать флюс в домашних условиях – обзор эффективных методов.
О том, как вылечить и как предотвратить образование флюса на щеке, читайте в данной статье.
Для того чтобы не столкнуться внезапно с такой малоприятной проблемой, как флюс, и не искать возможность справиться с ним самостоятельно, следует обратить внимание на вопрос профилактики. Тщательная гигиена полости рта, своевременное и правильное лечение пораженных кариесом зубов позволят избавить себя от развития периостита за счет устранения его возможных первопричин.
Видео на тему
Флюс
Многие люди, даже испытывая зубную боль, терпят, стараясь отложить визит к стоматологу на как можно более далёкое будущее. Однако такое халатное обращение с собственными зубами чревато возникновением флюса.
Как понять, что Вы имеете дело с флюсом? Если зубная боль не прекращается, а при надавливании на зуб и жевании усиливается, при этом наблюдаются отёки слизистой, а также тканей, окружающих зуб, щека со стороны больного зуба припухает — это появился флюс. Причины появления флюса могут быть разными, например, ушиб, зуб, поражённый кариесом или воспаление десневого кармана. Однако, в любом случае флюс вызывается инфекцией. Если же отложить визит к стоматологу, то воспалительные процессы начинают распространяться, при этом боль становится такой, что её практически невозможно терпеть, возможно и повышение температуры тела до 38 градусов.
Как лечить флюс? Обращаться к врачу.
Лечение флюса в домашних условиях не только не помогает, но и, наоборот, может всё усугубить.
Флюс наиболее всего опасен осложнениями, которые может за собой повлечь, поэтому необходимо обратиться к врачу как можно скорее. Только врач может назначить необходимое лечение. А в некоторых случаях ещё требуется вскрыть гнойник, что также может сделать только врач. Поэтому лучше не искать народные рецепты, как вылечить флюс в домашних условиях, а незамедлительно отправляться к врачу.
Некоторые считают, что можно вылечить флюс антибиотиками без назначения их врачом. Однако, не посоветовавшись с врачом, самостоятельно никаких антибиотиков пить нельзя – так можно ещё больше навредить. При флюсе самостоятельно назначать себе лекарства вообще нельзя.
Стоит знать, что даже после обращения к врачу и получения необходимой медицинской помощи флюс и его последствия исчезают не сразу. Отек может даже стать больше, но обычно он исчезает на третьи сутки. Сильная боль должна утихнуть спустя несколько часов после необходимых медицинских процедур, если была температура — она должна спасть.
Помимо того, как избавиться от флюса, многих интересует, как предотвратить его повторное возникновение – ведь наверняка никому не захочется снова испытать такие боли. Для профилактики флюса необходимо не откладывать на потом лечение кариеса, а также заботиться о гигиене полости рта: чистить зубы два раза в день, утром и вечером, а также после каждого употребления пищи полоскать рот.
Counterpoint: длительная терапия антибиотиками улучшает стойкие симптомы, связанные с болезнью Лайма | Клинические инфекционные болезни
Аннотация
Справочная информация . Существуют разногласия относительно диагностики и лечения болезни Лайма. Пациентам со стойкими симптомами после стандартной (2–4-недельной) терапии антибиотиками по поводу этого клещевого заболевания было отказано в дальнейшем лечении антибиотиками в результате восприятия длительной инфекции спирохетами Лайма, Borrelia burgdorferi, и связанными с ними возбудителями клещевых инфекций. встречается редко или отсутствует.
Методы . Я делаю обзор патофизиологии инфекции B. burgdorferi и рецензируемой литературы по диагностическому тестированию болезни Лайма, стандартным результатам лечения и коинфекции клещевыми возбудителями, такими как Babesia, Anaplasma, Ehrlichia, и Bartonella видов. Я также изучаю неконтролируемые и контролируемые испытания длительной антибактериальной терапии у пациентов со стойкими симптомами болезни Лайма.
Результаты .Сложная «скрытая» патология B. burgdorferi позволяет спирохетам проникать в различные ткани, ускользать от иммунного ответа и вызывать длительную инфекцию. Коммерческие тесты на болезнь Лайма очень специфичны, но относительно нечувствительны, особенно на поздних стадиях болезни. Многочисленные исследования документально подтвердили неэффективность стандартной антибактериальной терапии у пациентов с болезнью Лайма. Предыдущие неконтролируемые исследования и недавние плацебо-контролируемые исследования предполагают, что длительная антибактериальная терапия (продолжительность <4 недель) может быть полезной для пациентов со стойкими симптомами болезни Лайма.Коинфекции, передаваемые клещами, могут увеличить тяжесть и продолжительность инфицирования B. burgdorferi .
Выводы . Длительная антибактериальная терапия может быть полезной и оправданной у пациентов со стойкими симптомами болезни Лайма и сочетанной инфекцией клещевых агентов.
Болезнь Лайма является спорным заболеванием [1,2,3,4,5–6]. Классические признаки заболевания включают укус клеща с последующим появлением так называемой мигрирующей эритемы или сыпи типа «яблочко» и значительного отека суставов, типичного для артрита.К сожалению, не всегда присутствуют классические черты этого клещевого заболевания. Например, только 50–60% пациентов с болезнью Лайма вспоминают, что у них был укус клеща, и часто мигрирующая эритема, сыпь отсутствует или не имеет форму яблочка [5, 6]. По данным департаментов здравоохранения США, типичная бычья сыпь встречается только у 35–60% пациентов с болезнью Лайма [7, 8]. Кроме того, явный артрит наблюдается только у 20–30% пациентов с болезнью Лайма [1, 2].Таким образом, классические признаки заболевания могут отсутствовать, а диагноз легко упустить [1,2,3–4].
При отсутствии типичных признаков болезни Лайма у пациентов может развиться синдром с множеством неспецифических симптомов, поражающих различные системы органов, включая суставы, мышцы, нервы, мозг и сердце. Множество симптомов заставляет задуматься о том, является ли это «синдромом после болезни Лайма», плохо определенным субъектом, вызванным болезнью Лайма, или эти симптомы вызваны стойкой инфекцией спирохетами Лайма, Borrelia burgdorferi. Чтобы ответить на этот вопрос, мы должны сначала изучить патофизиологию болезни.
Патофизиология болезни Лайма
B. burgdorferi — интересная бактерия [9, 10]. Он имеет <1500 генных последовательностей, по крайней мере, 132 функционирующих гена. Напротив, Treponema pallidum, спирохетический агент сифилиса, имеет только 22 функционирующих гена. Генетический состав B. burgdorferi весьма необычен. Он имеет линейную хромосому и 21 плазмиду, которые представляют собой внехромосомные цепи ДНК.Это в 3 раза больше плазмид, чем у любых других известных бактерий ( Chlamydia приходит в далекую секунду, с 7 плазмидами). Считается, что плазмиды дают бактериям своего рода систему «быстрого реагирования», которая позволяет им очень быстро адаптироваться к изменениям в окружающей среде, а сложная генетическая структура B. burgdorferi предполагает, что это очень адаптируемый организм [9, 10 ].
Помимо своей сложной генетической структуры, B. burgdorferi участвует в так называемой «скрытой патологии», чтобы избежать иммунного ответа человека [11,12,13,14,15,16,17,18,19,20 , 21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45 , 46,47,48,49–50].Патология скрытности включает 4 основных стратегии: иммуносупрессия; генетическая, фазовая и антигенная изменчивость; физическое уединение; и секретируемые факторы (таблица 1). Эти стратегии описаны ниже.
Таблица 1
Патология «невидимости» Borrelia burgdorferi.
Таблица 1
Патология «невидимости» Borrelia burgdorferi.
Иммуносупрессия
Во время укуса клеща и до передачи спирохеты Лайма слюна клеща, содержащая анальгетики, антикоагулянты и иммунодепрессанты, попадает в рану, позволяя спирохетам проникать через кожу и избегать местного иммунного ответа [11,12–13]. B. burgdorferi также индуцирует иммуносупрессию путем ингибирования комплемента и индукции ингибирующих цитокинов, таких как IL-10. Кроме того, бактерия индуцирует толеризацию моноцитов и лимфоцитов и секвестрацию антител в иммунных комплексах — все механизмы уклонения от иммунного ответа [14,15,16,17,18-19].
Генетические, фазовые и антигенные вариации
B. burgdorferi участвует в генетических, фазовых и антигенных вариациях, которые имеют общие черты с другими организмами [20,21,22–23].Например, переключение генов похоже на то, что наблюдается с трипаносомами, мутации и рекомбинация типичны для ВИЧ, вариабельная экспрессия антигена наблюдается у видов Neisseria , аутоиндукция спящих организмов происходит при микобактериальной инфекции, а связывание фибронектина происходит со стафилококками и стрептококками. инфекционное заболевание.
B. burgdorferi может перейти в состояние покоя с образованием кисты [24,25,26,27,28–29]. Хотя сохранение спирохет в форме кисты является спорным вопросом, недавно было показано, что нейтрофильный кальпротектин может вызывать состояние покоя в спирохете, позволяя ему сохраняться в ткани без репликации и обеспечивая средства, позволяющие избежать применения антибиотиков [30].
Хотя ранее считалось, что резистентность к антибиотикам, связанная с генной мутацией, является редкой при инфекции B. burgdorferi [31], недавние исследования продемонстрировали генные мутации в спирохете Лайма, которые придают in vitro устойчивость к различным антибиотикам [32, 33]. Клиническое значение этих генных мутаций в настоящее время неясно.
Физическая изоляция
Спирохеты Лайма используют физическую изоляцию во внутриклеточных участках как средство уклонения от иммунного ответа во множестве типов клеток, включая синовиальные клетки, эндотелиальные клетки, фибробласты, макрофаги, клетки Купфера и нейронные клетки [34,35,36,37,38 , 39,40,41,42–43].В культуре B. burgdorferi можно выращивать в фибробластах в течение <8 недель, что позволяет предположить, что организм может процветать в течение длительного периода времени в нужном месте и в нужных условиях.
Физическая изоляция внеклеточных участков, включая суставы, глаза и ЦНС, также может способствовать выживанию спирохет Лайма. Кроме того, B. burgdorferi участвует в механизмах «маскировки», связываясь с протеогликаном, коллагеном, плазминогеном, интегрином и фибронектином. Эти вещества могут маскировать бактерию и делать ее невидимой для иммунной системы [38,39,40,41–42].
Секретные факторы
Существует ряд факторов, которые секретируются B. burgdorferi непосредственно или в ответ на инфекцию спирохетами [44,45,46,47,48,49,50–51]. В течение ряда лет было известно, что B. burgdorferi секретирует гемолизин, хотя его функция неизвестна [44]. Совсем недавно было показано, что спирохеты вырабатывают порин и адгезин 2, белки, которые позволяют бактериям прикрепляться к клеткам и пробивать клеточную стенку, чтобы проникнуть внутрь [45].
Еще недавно было обнаружено, что B. burgdorferi секретирует феромоны, включая AI-2, который также секретируется микобактериями [46,47,48,49-50]. Это первый случай, когда спирохеты секретируют аутоиндуктор, и это предполагает, что спирохеты Лайма участвуют в аутореанимации, как и другие спящие организмы, такие как туберкулезная палочка [46,47,48,49–50]. Кроме того, B. burgdorferi может индуцировать секрецию аггреканазы, фермента, повреждающего хрящи [51].Это может быть механизм, с помощью которого бактерия вызывает повреждение и воспаление суставов. Вооруженные этим оружием «патологии скрытности», спирохеты Лайма являются грозным инфекционным агентом.
Лабораторные испытания
Давайте кратко рассмотрим лабораторные исследования болезни Лайма. Основная проблема заключается в том, что современные коммерческие серологические тесты Лайма недостаточно чувствительны для диагностики, особенно на более поздних стадиях заболевания [52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63–64. ].Центры по контролю и профилактике заболеваний (CDC) выступают за «двухуровневую» систему тестирования с использованием ELISA или иммунофлуоресцентного анализа в качестве скринингового теста с последующим вестерн-блоттингом для подтверждения положительного результата ELISA или иммунофлуоресцентного анализа. Однако CDC предупреждает, что двухуровневую систему следует использовать только для целей наблюдения, а не для диагностики, и причина этого предупреждения ясна: хотя двухуровневая система имеет очень высокую специфичность (99–100%). ), что позволяет избежать ложноположительных результатов, которые являются проклятием статистики эпиднадзора, он имеет относительно низкую чувствительность (50–75%), что ограничивает его использование в качестве диагностического теста для отдельных пациентов.
Другие проблемы с текущим тестированием на болезнь Лайма включают пропуск высокоспецифичных полос из коммерческого вестерн-блоттинга, половые различия в реактивности теста и ограничения молекулярного тестирования, и эти вопросы подробно обсуждались в других источниках [1, 56, 60,61 , 62–63]. Таким образом, диагностика болезни Лайма остается проблематичной: до половины пациентов испытывают неудачи при использовании нынешнего двухуровневого подхода к тестированию [52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62,63–64].
Лечение болезни Лайма
На этом фоне касаются клинических диагностических проблем, сложной патофизиологии и трудностей тестирования, связанных с B.burgdorferi, , мы подошли к теме этой дискуссии, а именно к неэффективности лечения болезни Лайма. Документально подтвержденная неудача лечения с подтвержденной посевом инфекцией B. burgdorferi впервые была зарегистрирована <17 лет назад Preac-Mursic et al. [65], поэтому было удивительно увидеть цитату в New York Times двух членов комитета по руководящим принципам Американского общества инфекционных болезней (IDSA), в которых говорится, что «[нет] достоверных научных доказательств стойкости симптоматической Б.burgdorferi после лечения антибиотиками »[66]. Давайте рассмотрим «достоверные научные доказательства» устойчивости этой инфекции, взятые из статей, опубликованных за последние 17 лет.
Модели животных
Мы можем начать с животных моделей болезни Лайма [67,68,69,70,71,72,73,74–75]. Одно исследование на мышах показало, что «сохранение спирохет в макрофагах обеспечивает возможный патогенетический механизм хронической или рецидивирующей болезни Лайма» [67, с.909]. В другом исследовании «через девять месяцев после лечения низкие уровни ДНК спирохет можно было обнаружить с помощью ПЦР в реальном времени у подгруппы мышей, леченных антибиотиками» [68, с. 1430]. Таким образом, по крайней мере, в модели на мышах спирохеты могут сохраняться после соответствующего лечения.
Далее идет модель собаки — особенно убедительная модель, потому что Straubinger et al. [69] показали, что у собак, экспериментально инфицированных B. burgdorferi от клещей, лечение высокими дозами амоксициллина или доксициклина в течение 30 дней уменьшало стойкую инфекцию, но не устраняло ее.Кроме того, когда собак наблюдали в течение 500-дневного периода после инфицирования (эквивалент 3–4 человеческих лет), B. burgdorferi ДНК было обнаружено на низких уровнях в нескольких образцах тканей, полученных от собак, несмотря на введение «адекватного »Лечение антибиотиками [70].
Наконец, в модели с использованием нашего ближайшего родственника, обезьяны-обезьяны-обезьяны-приматы, Пахнер и его коллеги [71,72,73,74–75] обнаружили, что неврологические и сердечные заболевания были связаны с персистирующей инфекцией у этих обезьян, а также цитокинами и экспрессия гена, относящаяся к персистирующему B.burgdorferi можно было выявить менее чем через 3 месяца после заражения. Таким образом, эти модели на животных предоставляют «достоверные научные доказательства» стойкой инфекции при болезни Лайма.
Исследования на людях
Обращаясь к исследованиям на людях, есть ряд отчетов, которые показывают стойкие симптомы болезни Лайма после краткосрочной антибактериальной терапии [76,77,78,79,80,81,82,83,84,85,86,87, 88,89,90,91,92,93,94,95–96]. Устойчивые симптомы отмечались у 25–80% пациентов с болезнью Лайма после 2–4 недель антибактериальной терапии [76,77,78,79,80,81,82,83,84,85,86–87].Кроме того, инфекция, которая была определена как персистирующая на основании данных посева или ПЦР, была зарегистрирована у 40% пациентов после получения «адекватного» лечения антибиотиками, рекомендованного IDSA [88,89,90,91, 92,93,94,95–96]. Например, положительные результаты посева и ПЦР были обнаружены в образцах синовиальной оболочки и синовиальной жидкости, полученных от пациента через 7 лет после лечения [92], а положительный результат был зарегистрирован для посева образца биопсии радужной оболочки, полученного от пролеченного пациента [93] .Эти сообщения предполагают, что краткосрочная антибиотикотерапия может подавить спирохеты Лайма, но не уничтожить их.
В другом случае состояние больного ухудшилось, несмотря на получение повторных курсов лечения антибиотиками в течение 2-х лет. Она получала 12 месяцев внутривенного лечения антибиотиками, затем 11 месяцев пероральных антибиотиков, и ее состояние значительно улучшилось [95]. Таким образом, этот отчет свидетельствует о том, что более длительное лечение может быть полезным для некоторых пациентов с болезнью Лайма.В целом эти исследования предоставляют «достоверные научные доказательства» устойчивости инфекции B. burgdorferi после «адекватного» краткосрочного лечения антибиотиками у людей.
Это поднимает следующий вопрос: помогает ли более длительное лечение антибиотиками при стойкой болезни Лайма? Был проведен ряд неконтролируемых исследований, поддерживающих более длительное лечение стойких симптомов болезни [97,98,99–100]. Самое крупное исследование включало 277 пациентов, получавших тетрациклин в течение 1–11 месяцев (средняя продолжительность — 4 месяца).Исследование показало, что после 2 месяцев терапии у 33% пациентов наблюдалось улучшение симптомов, но после 3 месяцев лечения у 61% пациентов симптомы уменьшились [97]. Таким образом, это исследование предполагает, что более длительное лечение может привести к улучшению симптомов болезни Лайма. Были и другие небольшие неконтролируемые испытания, показывающие, что более длительное лечение может иметь лучшие симптомы у пациентов с болезнью Лайма, в том числе одно испытание, которое показало, что пациенты, которым повторно вводили внутривенную терапию, имели наибольшее улучшение симптомов [98,99– 100].
В отличие от этих неконтролируемых испытаний, в 2 рандомизированных плацебо-контролируемых испытаниях изучалась возможность повторного лечения пациентов со стойкими симптомами болезни Лайма (таблица 2) [101, 102]. Krupp et al. [102] изучали внутривенное введение цефтриаксона в течение 1 месяца, тогда как Klempner et al. [101] изучали 1 месяц внутривенного введения цефтриаксона, а затем 2 месяца перорального доксициклина. Исследование Krupp показало снижение утомляемости при 30-дневном режиме лечения, тогда как исследование Klempner не показало улучшения качества жизни после повторного лечения в течение 90 дней.Основная проблема с этими исследованиями заключается в том, что они включали пациентов, у которых симптомы были в среднем в течение 4–5 лет, а лечение 1-месячным внутривенным введением антибиотиков, с доксициклином в низких дозах или без него, недостаточно для пациентов, которые были больны этим длинные [103, 104]. Таким образом, возможность обобщения результатов у этих тщательно отобранных пациентов с персистирующей болезнью Лайма сомнительна [104].
Таблица 2
Результаты плацебо-контролируемых испытаний лечения антибиотиками хронической болезни Лайма.
Таблица 2
Результаты плацебо-контролируемых испытаний лечения антибиотиками хронической болезни Лайма.
В отличие от этих исследований, 2 плацебо-контролируемых исследования были представлены в 2005 г. на ежегодном собрании Колумбийской ассоциации болезней Лайма (таблица 2) [105, 106]. Одно исследование включало пероральный прием амоксициллина в течение 3 месяцев по сравнению с плацебо для ранее леченных пациентов, и повторное лечение было успешным для двух третей пациентов с наилучшим исходным качеством жизни. Во втором исследовании цефтриаксон вводили внутривенно в течение 10 недель пациентам со стойкими неврологическими симптомами болезни Лайма, и у этих пациентов наблюдалось значительное улучшение когнитивных функций при этом лечении.Мы с нетерпением ждем публикации этих двух плацебо-контролируемых испытаний, которые показывают, что более длительные курсы антибиотикотерапии полезны для пациентов с персистирующей болезнью Лайма.
Коинфекция клещевыми агентами
Помимо инфицирования B. burgdorferi, более часто выявляется клещевых коинфекций. Если пациент проходит лечение от болезни Лайма и у него симптомы сохраняются или ухудшаются, отсутствие улучшения может быть связано с наличием коинфекции Babesia, Anaplasma, Ehrlichia, или Bartonella [107,108,109,110,111,111,112,113,114,115,116,117,118,12112120,120].Коинфекция Babesia и Ehrlichia , как было показано, обостряет болезнь Лайма на моделях мышей [108,109–110], а также у людей [111,112,113,114,115,116,117–118]. Традиционно считается, что Babesia , Anaplasma , Ehrlichia и Bartonella вызывают острые молниеносные инфекции, но на самом деле эти патогены могут вызывать легкие инфекции, которые могут увеличивать тяжесть и продолжительность болезни Лайма [119,120,121,122,123,124–119,120,121,122–123,124] ].
Тревожное исследование, проведенное в Нью-Джерси, изучило распространенность коинфекций у клещей Ixodes , передающих болезнь Лайма [126]. В этом исследовании распространенность инфекции B. burgdorferi составляла 33,6%, а распространенность инфекции Bartonella составляла 34,5%. Таким образом, видов Bartonella встречались у этих клещей чаще, чем спирохеты Лайма. Это наблюдение предвещает большую проблему с инфекцией Bartonella , связанной с воздействием клещей в ближайшем будущем.
Подходы к лечению хронической болезни Лайма
Каков подход к пациенту со стойкими симптомами болезни Лайма [127,128,129,130,131,132,133,134,135,136,137,138,139–140]? Во-первых, следует повторить вестерн-блот Лайма и провести анализ коинфекции в лаборатории, имеющей опыт анализа на клещевые заболевания. В то же время следует исключить другие медицинские проблемы, которые могут вызвать стойкие симптомы. Следует измерить уровень естественных киллеров CD57, который является иммунологическим маркером, который можно использовать для мониторинга лечения хронической болезни Лайма [129,130–131].Если неврологические симптомы тяжелые, необходимо провести однофотонную эмиссионную компьютерную томографию головного мозга, чтобы определить степень воспаления в головном мозге. Также может оказаться полезным нейропсихиатрическое обследование [132].
На основании этих результатов в первую очередь следует лечить коинфекцию, если таковая имеется, а затем применять пероральные или парентеральные антибиотики для лечения симптомов стойкой болезни Лайма. Антибактериальную терапию следует проводить поочередно и без ограничений в сочетании с пробиотиками, чтобы минимизировать побочные эффекты [133, 134, 135–136].Мониторинг клинических симптомов, уровней естественных клеток-киллеров CD57 и маркеров воспаления следует проводить в сочетании с лечением [137,138,139–140].
Этот подход отличается от рекомендаций действующих руководств IDSA, которые не распознают персистирующую инфекцию при хронической болезни Лайма [141]. Однако подход к лечению соответствует руководящим принципам Международного общества болезней Лайма и ассоциированных болезней, которые предписывают лечение хронической инфекции у пациентов с симптомами хронической болезни Лайма [142].Полезно напомнить, что B. burgdorferi имеет определенные патофизиологические особенности с микобактериальной инфекцией и другими хроническими инфекциями (таблица 1), что эти инфекции могут потребовать длительной антибактериальной терапии (6–36 месяцев) и что риски долгосрочного лечение считается оправданным в таких ситуациях (таблица 3) [143,144,145,146–147]. На основании вышеизложенного, длительная антибактериальная терапия представляется полезной и оправданной при хронической болезни Лайма.
Таблица 3
Прецеденты длительной антибактериальной терапии.
Таблица 3
Прецеденты длительной антибактериальной терапии.
Таким образом, о болезни Лайма написано <18 000 научных статей. Некоторые из этих статей посвящены сложной патофизиологии B. burgdorferi, , в то время как другие подчеркивают клиническую неопределенность, связанную с клещевым заболеванием. Поскольку оптимальная терапия этого сложного заболевания все еще остается под вопросом, мы должны непредвзято относиться к лечению пациентов со стойкими симптомами Лайма и связанными с ним заболеваниями, передаваемыми клещами.
Благодарности
Эта статья посвящена памяти доктора Поля Лавуа и Билли Голдберга.
Благодарю докторов. Роберт Брансфилд, Дэвид Дорвард, Брайан Фэллон, Андреа Гайто, Джули Гербердинг, Ник Харрис, Уильям Харви, Барбара Джонсон, Пэт Джозеф, Энн Кьемтруп, Роберт Лейн, Кеннет Лигнер, Роберт Лулл, Алан Макдональд, Дэвид Марц, Дэниел Мур, Скотт Морроу , Стивену Филлипсу, Уолтеру Прену, Джеймсу Шаллеру, Вирджинии Шерр, Гарольду Смиту и Эдварду Уингеру за полезное обсуждение.Я также благодарю Пэта Смита из Ассоциации болезни Лайма; Барб Барсоккини, Лоррейн Джонсон, Пегги Леонард, Ли Лулл, Филлис Мервин и Джинджер Савели из Калифорнийской ассоциации болезни Лайма; и Карен Форшнер из Фонда болезни Лайма за постоянную поддержку.
Возможный конфликт интересов . R.B.S. является консультантом QMedRX.
Список литературы
1,,.Болезнь Лайма: точка / контрапункт
,Expert Rev Anti Infect Ther
,2005
, vol.3
(стр.155
—65
) 2,.Лечение болезни Лайма: судебно-медицинская оценка
,Expert Rev Anti Infect Ther
,2004
, vol.2
(стр.533
—57
) 3,.«Болезнь Лайма»: древний двигатель нераспознанной пандемии боррелиоза?
,Med Hypotheses
,2003
, т.60
(стр.742
—59
) 4,,,,.Противоречие с болезнью Лайма: неправильное использование языка
,Ann Intern Med
,2002
, vol.137
(стр.775
—7
) 5,.Болезнь Лайма без мигрирующей эритемы: повод для беспокойства?
,Am J Med
,2003
, т.115
стр.72
6.Мигрирующая эритема
,Med Clin North Am
,2002
, vol.86
(стр.239
—60
) 7,,,.Занижение сведений о болезни Лайма врачами Коннектикута, 1992 г.
,J Public Health Manag Pract
,1996
, vol.2
(стр.61
—5
) 8,,.Схемы лечения диагноза болезни Лайма семейными врачами в юго-восточном штате
,J Community Health
,2002
, vol.27
(стр.395
—402
) 9,.Borrelia burgdorferi Treponema pallidum: сравнение функциональной геномики, адаптации к окружающей среде, патогенных механизмов
,J Clin Invest
,2001
, vol.107
(стр.651
—6
) 10,,, et al.Бактериальный геном в движении: двенадцать линейных девяти кольцевых внехромосомных ДНК в инфекционном изоляте спирохеты болезни Лайма Borrelia burgdorferi
,Mol Microbiol
,2000
, vol.35
(стр.490
—516
) 11,.Модуляция иммунитета хозяина кроветворными членистоногими
,Ann Trop Med Parasitol
,2001
, vol.95
(стр.755
—71
) 12,,,.Экстракт слюнной железы клеща Ixodes ricinus подавляет секрецию ИЛ-10 Экспрессию CD69 стимулированными митогеном мышиными спленоцитами вызывает гипореактивность В-лимфоцитов.
,Parasite Immunol
,2003
, vol.25
(стр.27
—37
) 13« и др.Возбудитель болезни Лайма использует белок клеща для заражения млекопитающего-хозяина
,Nature
,2005
, vol.436
(стр.573
—7
) 14,,,,.Основы стойких бактериальных инфекций
,Trends Microbiol
,2003
, vol.11
(стр.80
—6
) 15,,,.Иммунный механизм уклонения от спирохетальной персистенции при боррелиозе Лайма
,J Exp Med
,2002
, vol.195
(стр.415
—22
) 16.Уклонение от комплемента спирохетами болезни Лайма Borrelia burgdorferi , выращенная в совместных культурах тканей хозяина: роль фибронектина в устойчивости к комплементу
,Experientia
,1996
, vol.52
(стр.364
—72
) 17« и др.Устойчивость к комплементу Borrelia burgdorferi коррелирует с экспрессией BbCRASP-1, нового линейного кодируемого плазмидой поверхностного белка, который взаимодействует с человеческим фактором H. FHL-1 не связан с белками Erp
,J Biol Chem
,2004
, т.279
(стр.2421
—9
) 18,,,,.bdrF2 спирохет болезни Лайма коэкспрессируется с серией цитоплазматических белков, специфически продуцируемых во время ранней инфекции
,J Bacteriol
,2005
, vol.187
(стр.175
—84
) 19,,,,.Защитная ниша для Borrelia burgdorferi от гуморального иммунитета
,Am J Pathol
,2004
, vol.165
(стр.977
—85
) 20,,, et al.Borrelia burgdorferi изменяет свою поверхностную антигенную экспрессию в ответ на иммунные ответы хозяина
,Infect Immun
,2004
, vol.72
(стр.5759
—67
) 21« и др.Генетический обменный перенос плазмиды в Borrelia burgdorferi sensu stricto, выявленный путем трехстороннего сравнения геномов, мультилокусное типирование последовательностей
,Proc Natl Acad Sci U S A
,2004
, vol.101
(стр.14150
—5
) 22,,,,.Полногеномный транспозонный мутагенез Borrelia burgdorferi для идентификации фенотипических мутантов
,Appl Environ Microbiol
,2004
, vol.70
(стр.5973
—9
) 23« и др.Экспериментальная оценка роли линейных плазмид lp25 lp28-1 из Borrelia burgdorferi на протяжении инфекционного цикла
,Infect Immun
,2004
, vol.72
(стр.5938
—46
) 24,,,.Ультраструктурная характеристика стадий приготовления сферопластов Borrelia burgdorferi
,J Microbiol Methods
,1995
, vol.23
(стр.219
—28
) 25,,,,,.Формирование культивирования Borrelia burgdorferi сферопластов L-формы вариантов
,Инфекция
,1996
, т.24
(стр.218
—26
) 26,,.Изменения морфологии синтеза белка, вызванные сывороточным голоданием Borrelia burgdorferi
,Microbiology
,2000
, vol.146
(стр.119
—27
) 27,.Экспресс-метод создания кистозных форм Borrelia burgdorferi, их превращения в подвижные спирохеты
,APMIS
,1998
, vol.106
(стр.1131
—41
) 28,.Исследование in vitro чувствительности мобильных кистозных форм Borrelia burgdorferi к метронидазолу
,APMIS
,1999
, vol.107
(стр.566
—76
) 29,,,.Влияние пенициллина, цефтриаксона, доксициклина на морфологию Borrelia burgdorferi
,Противомикробные агенты Chemother
,1995
, vol.39
(стр.1127
—33
) 30,,,.Кальпротектин нейтрофилов человека снижает чувствительность Borrelia burgdorferi к пенициллину
,Infect Immun
,2006
, vol.74
(стр.2468
—72
) 31,,,,.Устойчивость к эритромицину у Borrelia burgdorferi
,Противомикробные агенты Chemother
,2002
, vol.46
(стр.3637
—40
) 32,,,,,.мутации parC у устойчивых к фторхинолонам Borrelia burgdorferi
,Противомикробные агенты Chemother
,2005
, vol.49
(стр.4354
—7
) 33,,,.Мутации, придающие устойчивость к аминогликозиду спектиномицину у Borrelia burgdorferi
,Противомикробные агенты Chemother
,2006
, vol.50
(стр.445
—52
) 34« и др.Borrelia burgdorferi , протеазы хозяина, гематоэнцефалический барьер
,Infect Immun
,2005
, т.73
(стр.1014
—22
) 35,,.Внутриклеточная локализация Borrelia burgdorferi в эндотелиальных клетках человека
,Infect Immun
,1991
, vol.59
(стр.671
—8
) 36,,.Инвазия фибробластов кожи человека спирохетами болезни Лайма, Borrelia burgdorferi
,J Infect Dis
,1993
, vol.167
(стр.1074
—81
) 37,,,,.Внутриклеточная персистенция Borrelia burgdorferi в синовиальных клетках человека
,Rheumatol Int
,1996
, vol.16
(стр.125
—30
) 38,,,,.Спиральный фагоцитоз Borrelia burgdorferi первичными макрофагами человека контролируется CDC42Hs Rac1 включает рекрутирование комплекса белка Arp2 / 3 синдрома Вискотта-Олдрича
,Infect Immun
,2001
, vol.69
(стр.1739
—46
) 39,,.Фибробласты защищают спирохеты болезни Лайма, Borrelia burgdorferi, от цефтриаксона in vitro
,J Infect Dis
,1992
, vol.166
(стр.440
—4
) 40,,.Эукариотические клетки защищают Borrelia burgdorferi от действия пенициллина цефтриаксона, но не от действия доксициклина эритромицина
,Противомикробные агенты Chemother
,1996
, vol.40
(стр.1552
—4
) 41,.Инвазия нейрональных глиальных клеток человека инфекционным штаммом Borrelia burgdorferi
,Microbes Infect
,2006
, vol.8
(стр.2832
—40
) 42,,.Почему хронический боррелиоз Лайма является хроническим?
,Clin Infect Dis
,1997
, т.25
Дополнение 1
(стр.S64
—70
) 43,,.Стратегии выживания Borrelia burgdorferi , этиологического агента болезни Лайма
,Microbes Infect
,2004
, vol.6
(стр.312
—8
) 44,.Гемолитическая активность Borrelia burgdorferi
,Infect Immun
,1992
, т.60
(стр.3224
—30
) 45,,.Внеклеточная секреция Borrelia burgdorferi Oms28 порина Bgp, гликозаминогликан-связывающего белка
,Infect Immun
,2004
, vol.72
(стр.6279
—86
) 46,,,,,.Определение кворума спирохетами болезни Лайма
,Microbes Infect
,2003
, vol.5
(стр.991
—7
) 47,,,,.Синтез аутоиндуктора 2 спирохетами болезни Лайма, Borrelia burgdorferi
,J Bacteriol
,2005
, vol.187
(стр.3079
—87
) 48,,,,,.Функциональность Borrelia burgdorferi LuxS: спирохета, вызывающая болезнь Лайма, отвечает на феромонный аутоиндуктор-2, отсутствует полный цикл активированного метила
,Int J Med Microbiol
,2006
, vol.296
Доп. 40
(стр.92
—102
) 49,.Иммунологические аспекты латентного периода при туберкулезе
,Clin Immunol
,2004
, vol.110
(стр.2
—12
) 50,,,,,.Семейство аутокринных факторов роста в Mycobacterium tuberculosis
,Mol Microbiol
,2002
, vol.46
(стр.623
—35
) 51« и др.Роль аггреканазы 1 в Лайм-артрите
,Arthritis Rheum
,2006
, vol.54
(стр.3319
—29
) 52,,,,.Работа 45 лабораторий, участвующих в программе проверки квалификации по серологии болезни Лайма
,JAMA
,1992
, vol.268
(стр.891
—5
) 53,,.Роль серологии в диагностике болезни Лайма
,JAMA
,1999
, vol.282
(стр.62
—6
) 54« и др.Лайм-боррелиоз в Швеции — диагностическая эффективность пяти коммерческих серологических наборов Borrelia с использованием сывороток четко определенных групп пациентов
,APMIS
,2004
, vol.112
(стр.74
—8
) 55,,,.Серодиагностика боррелиоза Лайма методом вестерн-иммуноблоттинга: реактивность различных значимых антител против Borrelia burgdorferi
,J Clin Microbiol
,1992
, vol.30
(стр.370
—6
) 56,,,.Персистенция сывороточных антител к Borrelia burgdorferi у пациентов, леченных от болезни Лайма
,Clin Infect Dis
,1992
, vol.15
(стр.788
—93
) 57,,.Критерии интерпретации иммуноблоттинга для серодиагностики ранней болезни Лайма
,J Clin Microbiol
,1995
, vol.33
(стр.419
—27
) 58,,.Новые лабораторные рекомендации по серологической диагностике болезни Лайма: оценка протокола двух тестов
,J Clin Microbiol
,1996
, vol.34
(стр.2343
—50
) 59« и др.Оценка двухтестовой серодиагностики ранней стадии болезни Лайма в клинической практике
,J Infect Dis
,1999
, vol.179
(стр.931
—8
) 60,,.Рекомендация о включении OspA OspB в новые критерии иммуноблоттинга для серодиагностики болезни Лайма
,J Clin Microbiol
,1996
, vol.34
(стр.1353
—4
) 61.Молекулярная диагностика болезни Лайма: обзорный метаанализ
,Mol Diagn
,2001
, vol.6
(стр.1
—11
) 62.Последние достижения в диагностике болезни Лайма
,Expert Rev Mol Diagn
,2001
, vol.1
(стр.413
—27
) 63,,,.Диагностика боррелиоза Лайма
,Clin Microbiol Rev
,2005
, vol.18
(стр.484
—509
) 64,,,.Диагностика болезни Лайма
,Am Fam Physician
,2005
, vol.72
(стр.297
—304
) 65,,, et al.Выживаемость Borrelia burgdorferi у леченных антибиотиками пациентов с боррелиозом Лайма
,Инфекция
,1989
, vol.17
(стр.355
—9
) 66,.Болезнь Лайма: мифы реальность
,New York Times. 9 июня
,2006
67,,.Судьба Borrelia burgdorferi, возбудителя болезни Лайма, в макрофагах мыши: разрушение, выживание, восстановление
,J Immunol
,1993
, vol.150
(стр.909
—15
) 68,,,,.Обнаружение аттенуированных неинфекционных спирохет у мышей, инфицированных Borrelia burgdorferi , после лечения антибиотиками
,J Infect Dis
,2002
, vol.186
(стр.1430
—7
) 69,,,.Персистенция Borrelia burgdorferi у экспериментально инфицированных собак после лечения антибиотиками
,J Clin Microbiol
,1997
, vol.35
(стр.111
—6
) 70.Количественная оценка организмов Borrelia burgdorferi в тканях собак в течение 500-дневного периода после инфицирования на основе ПЦР
,J Clin Microbiol
,2000
, vol.38
(стр.2191
—9
) 71,,,.Локализация Borrelia burgdorferi в других органах нервной системы у нечеловеческих приматов, модель болезни Лайма
,Lab Invest
,2000
, vol.80
(стр.1043
—54
) 72« и др.Инфекция центральной периферической нервной системы, иммунитет, воспаление в NHP-модели боррелиоза Лайма
,Ann Neurol
,2001
, vol.50
(стр.330
—8
) 73,,,,.Повышенная экспрессия хемоаттрактанта B-лимфоцитов, но не провоспалительных цитокинов, в мышечной ткани при хроническом боррелиозе Лайма резус
,Cytokine
,2002
, vol.19
(стр.297
—307
) 74,,,,,.Поражение сердца у приматов, кроме человека, инфицированных спирохетами болезни Лайма Borrelia burgdorferi
,Lab Invest
,2004
, vol.84
(стр.1439
—50
) 75,,,.Экспрессия генов erp Borrelia burgdorferi при инфицировании нечеловеческих приматов
,Microb Pathog
,2005
, vol.39
(стр.27
—33
) 76,,,,,.Обнаружение ДНК Borrelia burgdorferi с помощью полимеразной цепной реакции в синовиальной жидкости при артрите Лайма
,N Engl J. Med
,1994
, vol.330
(стр.229
—34
) 77« и др.Обнаружение ДНК Borrelia burgdorferi с помощью полимеразной цепной реакции в спинномозговой жидкости у пациентов с нейроборрелиозом Лайма
,J Infect Dis
,1996
, vol.174
(стр.623
—7
) 78,,,.Серонегативный хронический рецидивирующий нейроборрелиоз
,Eur Neurol
,1995
, vol.35
(стр.113
—7
) 79,,.Молекулярное обнаружение стойкого Borrelia burgdorferi у мужчины с дерматомиозитом
,Clin Exp Rheumatol
,1992
, vol.10
(стр.387
—90
) 80,,,,.Пятилетнее катамнестическое исследование пациентов с нейроборрелиозом
,Scand J Infect Dis
,2002
, vol.34
(стр.421
—5
) 81,,, et al.Опорно-двигательные неврологические исходы у пациентов с ранее леченными болезнью Лайма
,Ann Intern Med
,1999
, vol.131
(стр.919
—26
) 82,,,,,.Серологическое клиническое наблюдение пациентов с нейроборрелиозом
,Неврология
,1998
, т.51
(стр.1489
—91
) 83,,,,.Отдаленные результаты у пациентов с Лайм-артритом после лечения цефтриаксоном
,Инфекция
,1996
, т.24
(стр.98
—102
) 84« и др.Долгосрочные клинические исходы болезни Лайма. Популяционное ретроспективное когортное исследование
,Ann Intern Med
,1994
, vol.121
(стр.560
—7
) 85,,,,.Болезнь Лайма: инфекционный постинфекционный синдром
,J Rheumatol
,1994
, vol.21
(стр.454
—61
) 86,,,,,.Рандомизированное сравнение цефтриаксона цефотаксима при нейроборрелиозе Лайма
,J Infect Dis
,1991
, vol.163
(стр.311
—8
) 87,,.Хронические неврологические проявления болезни Лайма
,N Engl J Med
,1990
, vol.323
(стр.1438
—44
) 88,,, et al.Выделение типирования с помощью полимеразной цепной реакции Borrelia afzelii из поражения кожи у серонегативного пациента с генерализованным язвенным буллезным лишаем sclerosus et atrophicus
,Br J Dermatol
,2001
, vol.144
(стр.387
—92
) 89,,,.Borrelia burgdorferi , обнаруженная с помощью ПЦР посевов при клиническом рецидиве диссеминированного боррелиоза Лайма
,Ann Med
,1999
, vol.31
(стр.225
—32
) 90,,.Borrelia burgdorferi ДНК в моче пролеченных пациентов с симптомами хронической болезни Лайма: ПЦР-исследование 97 случаев
,Инфекция
,1996
, vol.24
(стр.347
—53
) 91,,,,,.Обнаружение Borrelia burgdorferi с помощью полимеразной цепной реакции в синовиальной мембране, но не в синовиальной жидкости у пациентов с персистирующим артритом Лайма после антибактериальной терапии
,Ann Rheum Dis
,1998
, vol.57
(стр.118
—21
) 92,,,.Хронический септический артрит, вызванный Borrelia burgdorferi
,Clin Orthop
,1993
, т.297
(стр.238
—41
) 93,,, et al.Первое выделение Borrelia burgdorferi из биопсии радужки
,J Clin Neuroophthalmol
,1993
, vol.13
(стр.155
—61
) 94,,,,,.Лайм-боррелиоз — обзор лечения четырех случаев на поздних стадиях
,Acta Clin Belg
,1998
, vol.53
(стр.178
—83
) 95,,,.Лайм-боррелиоз
,Ланцет
,1995
, т.345
(стр.1436
—7
) 96« и др.Обнаружение ДНК Borrelia burgdorferi в мышцах пациентов с хронической миалгией, связанной с болезнью Лайма
,Am J Med
,1998
, vol.104
(стр.591
—4
) 97.Тетрациклиновая терапия хронической болезни Лайма
,Clin Infect Dis
,1997
, vol.25
Дополнение 1
(стр.S52
—6
) 98,,.Сравнение перорального цефиксима для внутривенного введения цефтриаксона с последующим пероральным приемом амоксициллина при диссеминированном боррелиозе Лайма
,Eur J Clin Microbiol Infect Dis
,1998
, vol.17
(стр.715
—9
) 99,,,,.Лечение позднего боррелиоза Лайма
,J Infect
,1994
, vol.29
(стр.255
—61
) 100.Повторное лечение антибиотиками при хронической болезни Лайма
,J Spiro Tick Dis
,1999
, vol.6
(стр.94
—101
) 101« и др.Два контролируемых испытания лечения антибиотиками у пациентов со стойкими симптомами болезни Лайма в анамнезе
,N Engl J Med
,2001
, vol.345
(стр.85
—92
) 102« и др.Изучение лечения пост-болезни Лайма (STOP-LD): рандомизированное клиническое исследование с двойной маской
,Neurology
,2003
, vol.60
(стр.1923
—30
) 103,,.Лечение пациентов со стойкими симптомами болезни Лайма в анамнезе
,N Engl J Med
,2001
, vol.345
(стр.1424
—5
) 104.Возможность обобщения в двух клинических испытаниях болезни Лайма
,Epidemiol Perspect Innov
,2006
, vol.3
(стр.12
—18
) 105.Предварительные результаты контролируемого Колумбией исследования лечения Лайма
,Программные выдержки из конференции Колумбийского университета / LDA, Лайм и другие клещевые болезни: новые клещевые заболевания (Филадельфия)
,2005
106.Результаты испытаний лечения болезни Лайма
,Выдержки из программы конференции Колумбийского университета / LDA, Лайм и другие клещевые болезни: новые клещевые болезни (Филадельфия)
,2005
107.Болезнь Лайма: потенциальный полимикробный препарат инфекция
,ASM News
,2003
, т.69
стр.265
108,,,.Коинфекция Borrelia burgdorferi возбудителем гранулоцитарного эрлихиоза человека изменяет иммунные ответы мышей, патогенную нагрузку, тяжесть артрита Лайма
,Infect Immun
,2001
, vol.69
(стр.3359
—71
) 109,,,,.Коинфекция Borrelia burgdorferi , агент гранулоцитарного эрлихиоза человека, подавляет продукцию IL-2. IFN-гамма способствует ответу IL-4 у мышей C3H / HeJ
,Parasite Immunol
,2000
, vol.22
(стр.581
—8
) 110,,, et al.Повышенная тяжесть артрита у мышей, коинфицированных Borrelia burgdorferi Babesia microti
,J Infect Dis
,2002
, vol.186
(стр.428
—31
) 111,,,,,.Серологические доказательства одновременного возникновения бабезиоза при болезни Лайма
,J Infect Dis
,1985
, vol.152
(стр.473
—7
) 112,,,,.Смертельный панкардит у пациента с сопутствующим бабезиозом, вызванным болезнью Лайма: проявление спирохет в миокарде
,Ann Intern Med
,1985
, vol.103
(стр.374
—6
) 113« и др.Одновременный гранулоцитарный эрлихиоз человека Лайм-боррелиоз
,N Engl J Med
,1997
, vol.337
(стр.27
—30
) 114,,.Коинфекции с Borrelia burgdorferi возбудителем гранулоцитарного эрлихиоза человека
,N Engl J Med
,2001
, vol.345
(стр.150
—1
) 115,,, et al.Специфическая диагностика коинфекционных клещевых зоонозов: бабезиоз, гранулоцитарный эрлихиоз человека, болезнь Лайма
,Clin Infect Dis
,2002
, vol.34
(стр.1184
—91
) 116,,,.Клинические сероэпидемиологические характеристики коинфекции Babesia WA-1 у пациентов с болезнью Лайма в Калифорнии
,J Invest Med
,2003
, vol.51
Дополнение 1
стр.S145
117,,.Сопутствующая инфекция центральной нервной системы, вызванная Borrelia burgdorferi Bartonella henselae: свидетельств нового комплекса клещевых болезней
,Arch Neurol
,2001
, vol.58
(стр.1357
—63
) 118,,,.Обнаружение Borrelia burgdorferi , Ehrlichia chafeensis , Anaplasma phagocytophilum в клещах (Acari: Ixodidae) из прибрежного региона Калифорнии
,J Med Entomol
,2003
,2003
, vol.40
(стр.534
—9
) 119,,, et al.Сопутствующий бабезиоз с болезнью Лайма: доказательства увеличения продолжительности заболевания
,JAMA
,1996
, vol.275
(стр.1657
—60
) 120,,,.Поперечный миелит, вторичный по отношению к сопутствующему бабезиозу с болезнью Лайма
,J Spinal Cord Med
,2003
, vol.26
(стр.168
—71
) 121« и др.Стойкая паразитемия после острого бабезиоза
,N Engl J Med
,1998
, vol.339
(стр.160
—5
) 122.Бабезиоз: стойкость перед лицом невзгод
,Trends Parasitol
,2003
, vol.19
(стр.51
—5
) 123,,,,,.Амплификация эрлихиальной ДНК собак через 34 месяца после заражения Ehrlichia canis
,J Clin Microbiol
,1998
, vol.36
(стр.73
—6
) 124,.Гранулоцитарный эрлихиоз человека в Висконсине, Миннесота: частая инфекция с потенциалом сохранения
,J Infect Dis
,1996
, vol.173
(стр.1027
—30
) 125,,,,.Клиническое влияние стойкой бактериемии Bartonella у человека и животных
,Ann N Y Acad Sci
,2003
, vol.990
(стр.267
—78
) 126« и др.Распространенность Borrelia burgdorferi, Bartonella spp., Babesia microti, Anaplasma phagocytophila среди клещей Ixodes scapularis , собранных в Северном Нью-Джерси
,J Clin Microbiol
, vol.42
(стр.2799
—801
) 127. .Болезнь Лайма
,Текущая терапия Конна
,1997
Филадельфия
WB Saunders Company
(стр.140
—3
) 128,.Руководство по клинической диагностике болезни Лайма
,Ann Intern Med
,1998
, vol.129
(стр.422
—3
) 129,.Снижение субпопуляции лимфоцитов CD57 у пациентов с хронической болезнью Лайма
,Immunol Lett
,2001
, vol.76
(стр.43
—48
) 130,,.Долгосрочное снижение субпопуляции лимфоцитов CD57 у пациента с хронической болезнью Лайма
,Ann Agric Environ Med
,2002
, vol.9
(стр.111
—3
) 131,.Нормализация субпопуляции естественных киллеров CD57, связанной с длительной антибактериальной терапией у пациентов с хронической болезнью Лайма
,Clin Immunol
,2002
, vol.103
(стр.S117
—8
) 132,,,,,.Функциональное нейропсихологическое исследование головного мозга при болезни Лайма
,Clin Infect Dis
,1997
, vol.25
Дополнение 1
(стр.S57
—63
) 133,.Исследование in vitro чувствительности мобильных кистозных форм Borrelia burgdorferi к тинидазолу
,Int Microbiol
,2004
, vol.7
(стр.139
—42
) 134,,,,,.Сравнение активности кетолидов, макролидов, азалида против спирохеты in vitro Borrelia burgdorferi
,Противомикробные агенты Chemother
,2004
, vol.48
(стр.344
—7
) 135,,,.Эффективность комбинированной терапии кларитромицин / цефдинир у пациентов с хронической болезнью Лайма
,J Invest Med
,2005
, vol.53
стр.S156
136,,,.Пробиотики в профилактике диареи, связанной с антибиотиками: метаанализ
,BMJ
,2002
, т.324
(стр.1361
—6
) 137,,, et al.Цитокины при боррелиозе Лайма: отсутствие ранних ответов TNF-alpha TGF-beta 1 связано с хроническим нейроборрелиозом
,Immunology
,2002
, vol.107
(стр.46
—55
) 138,,, et al.Borrelia -специфическая секреция IFN-гамма IL-4 в спинномозговой жидкости крови во время болезни Лайм-боррелиоза человека: связь с клиническим исходом
,J Infect Dis
,2004
, vol.189
(стр.1881
—1891
) 139« и др.Болезнь Лайма клинический спектр антибиотико-чувствительных хронических менингоэнцефаломиелитов
,J Spiro Tick Dis
,1997
, vol.4
(стр.61
—73
) 140,.Продолжительность антибактериальной терапии болезни Лайма
,Ann Intern Med
,2004
, vol.140
стр.W6
141« и др.Клиническая оценка, лечение, профилактика болезни Лайма, гранулоцитарного анаплазмоза человека, бабезиоза: руководящие принципы клинической практики Американского общества инфекционистов
,Clin Infect Dis
,2006
, vol.43
(стр.1089
—134
) 142« и др.Научно-обоснованное руководство по ведению болезни Лайма
,Expert Rev Anti Infect Ther
,2004
, vol.2
1 Доп.
(стр.S1
—13
) 143,.Ведение туберкулеза в США
,N Engl J Med
,2001
, vol.345
(стр.189
—200
) 144« и др.Устойчивость к противомикробным препаратам при туберкулезе: международная перспектива
,Expert Rev Anti Infect Ther
,2006
, vol.4
(стр.759
—66
) 145,,,,.Эффективность множественной лекарственной терапии при мультибациллярной лепре: долгосрочное наблюдение за 34 пациентами с мультибациллярной лепрой, получавших комбинированные лекарственные схемы до получения отрицательного результата мазка кожи
,Lepr Rev
,2003
, vol.74
(стр.141
—7
) 146,,,.Клиническое испытание кларитромицина при кожной (диссеминированной) инфекции, вызванной Mycobacterium chelonae
,Ann Intern Med
,1993
, vol.119
(стр.482
—6
) 147,,.Корреляция между серологической эволюцией сывороточных концентраций доксициклина у пациентов с Coxiella burnetii эндокардитом
,J Infect Dis
,2003
, vol.188
(стр.1322
—5
)© 2007 Американское общество инфекционных болезней
«Один размер подходит всем»? Оптимизация продолжительности лечения бактериальных инфекций
Abstract
Исторически руководящие принципы лечения антибиотиками были направлены на максимальное повышение эффективности лечения и минимизацию токсичности, но не учитывали эволюцию устойчивости к антибиотикам.Оптимизация продолжительности и дозирования лечения для минимизации продолжительности симптоматической инфекции и давления отбора для резистентности одновременно имеет потенциал для продления полезной терапевтической жизни этих ценных жизненно важных лекарств без ущерба для интересов отдельных пациентов.
Здесь, используя математические модели, мы исследуем теоретическую основу для более коротких курсов лечения, включая ряд экологических динамик бактерий, которые вызывают инфекции или колонизируют хозяев как комменсалов.Мы обнаружили, что иммунитет является важным фактором, определяющим необходимость длительного лечения. Когда ожидается иммунитет к инфекции, скорее всего, будут поддерживаться более короткие сроки, которые уменьшают выбор по устойчивости, не влияя на успешный клинический результат. Корректировка стратегий лечения лекарственными препаратами с учетом влияния различий в экологической нише, занимаемой комменсальной флорой, по сравнению с инвазивными бактериями, может быть эффективным в замедлении распространения устойчивости бактерий.
Образец цитирования: Гели П., Лакшминараян Р., Данн М., Смит Д.Л. (2012) «Один размер подходит всем»? Оптимизация продолжительности лечения бактериальных инфекций. PLoS ONE 7 (1): e29838. https://doi.org/10.1371/journal.pone.0029838
Редактор: Владимир Брусич, Институт рака Дана-Фарбер, США
Поступила: 12 мая 2011 г .; Принята к печати: 6 декабря 2011 г .; Опубликовано: 11 января 2012 г.
Авторские права: © 2012 Geli et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Эта работа была профинансирована главным образом грантом 50914 от Фонда Билла и Мелинды Гейтс (http://www.gatesfoundation.org/Pages/home.aspx) и грантом Пионерского портфеля Роберта Вуда Джонсона. Фундамент. Поддержку проекту оказывает также программа Grand Challenges in Health Принстонского университета (http: // www.princeton.edu/grandchallenges/). DLS также выражает признательность за финансовую поддержку программе RAPIDD Управления науки и технологий Министерства внутренней безопасности (http://www.dhs.gov/index.shtm) и Международного центра Фогарти Национальных институтов здравоохранения (http: / /www.fic.nih.gov/). Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы ознакомились с политикой журнала и имеют следующие конфликты.MD является сотрудником Durata Therapeutics, Inc. и ранее работал в Pfizer, Inc. Это не влияет на соблюдение авторами всех политик PLoS ONE в отношении обмена данными и материалами.
Введение
Устойчивость бактерий к антибиотикам растет и представляет собой все более серьезную угрозу для современной медицины [1], [2], [3]. Сокращение ненужного использования антибиотиков может снизить бремя резистентных патогенов, но трудно сбалансировать это с преимуществами антибиотиков, реальными и предполагаемыми.Недавние исследования показали, что такие стратегии, как множественные методы лечения первой линии или комбинации лекарств, могут быть эффективными в замедлении развития резистентности [4], [5], [6]. Оптимизированное дозирование и продолжительность режима антибиотиков могут сыграть аналогичную роль в минимизации резистентности без необходимости отказывать в лечении пациентам, которым терапия помогает застраховаться от маловероятных и серьезных последствий, таких как мастоидит у детей с острым средним отитом. Однако этим подходам уделялось относительно меньше внимания.Взаимосвязь между дозированием лекарственного средства, продолжительностью лечения, фармакокинетикой и фармакодинамикой лекарственного средства и терапевтической эффективностью, которая будет влиять на принятие решений, только сейчас начинает пониматься [7]. Однако преимущества для человека можно лучше оценить, если учесть более широкие иммунологические, эпидемиологические и экологические последствия использования антибиотиков.
На оптимальную продолжительность и дозировку лечения антибиотиками влияет динамика инфекции и иммунитет.Схема приема лекарств должна быть достаточно высокой и продолжительной, чтобы избавиться от инфекции. Поскольку дозировка должна быть достаточно низкой, чтобы избежать токсичности, рекомендуемая доза препарата обычно устанавливается чуть ниже максимально переносимой дозы и, следовательно, в некоторых случаях чуть выше минимальной концентрации, необходимой для излечения инфекции [8]. Однако по мере роста устойчивости увеличиваются минимальные ингибирующие концентрации (МПК) и количество лекарства, необходимое для достижения излечения. Было высказано предположение, что дозирование лекарств, обеспечивающее концентрации выше минимума, необходимого для ингибирующего действия наиболее устойчивых бактерий на протяжении всего лечения, приведет к меньшему отбору по устойчивости [7].Иммунитет является сильным союзником в этом процессе, поскольку сильный иммунный ответ может значительно ограничить потребность в длительном лечении, и действительно, существует тенденция к более короткому режиму лечения некоторых распространенных острых инфекций [9], [10], [11], [12], [13], [14], [15], [16] у пациентов с интактной первичной и вторичной защитой хозяина.
Склонность патогенов также колонизировать другие части организма-хозяина, не вызывая заболевания, также должна иметь отношение к разработке соответствующего профиля лечения.Большинство бактериальных патогенов способны колонизировать верхние дыхательные пути, кожу, кишечник или другие ткани, не вызывая заболеваний. Когда бактерии заражают стерильные ткани, передача обычно неэффективна. Например, устойчивые к метициллину изоляты Staphylococcus aureus , инфицирующие глубокие тканевые пространства и вызывающие сепсис, не выделяются и, следовательно, не являются инфекционными, в то время как стафилококки, колонизирующие кожу одного и того же хозяина, хорошо подходят для этого в популяции через кожу. контакт с кожей.С точки зрения общественного здравоохранения будет цениться оптимизация схем приема лекарств от бактериальных инфекций, которые приводят к успеху лечения у пациента, но делают это таким образом, чтобы минимизировать риск резистентности в экологическом резервуаре. Фармакодинамические и фармакокинетические свойства многих антибиотиков различаются в местах инфицирования и колонизации, что затрудняет выбор одного режима, который позволяет достичь обеих целей. В настоящее время у нас нет средств для прогнозирования того, изменят ли корректировки доставленной дозы и влияние этой корректировки на успешную терапию инфекции пациента риск для здоровья населения, связанный с развитием резистентности у колонизирующей и потенциально трансмиссивной флоры.
Здесь мы оцениваем оптимальную дозировку, рассматривая более широкую картину факторов, влияющих на выбор устойчивости к антибиотикам. Важные различия между бактериями предполагают, что экологическая теория и математические модели могут помочь выявить и сформулировать соответствующие проблемы. С этой целью мы исследовали простые фармакокинетические и фармакодинамические (PK / PD) модели внутри хозяина, чтобы определить оптимальные стратегии дозирования антибиотиков, которые одновременно минимизируют заболеваемость и отбор по устойчивости.Модели используются для сравнения результатов режимов лечения и классификации фармакодинамики в широком диапазоне состояний, которые, в отличие от более ранних исследований, рассматривают, как лекарство может по-разному действовать на заражающие и колонизирующие бактерии. Это моделирование использовалось для создания теоретической основы для более коротких схем дозирования, определения важных параметров, которые непропорционально влияют на оптимальную стратегию, и создания основы для более широкой повестки дня для разработки стратегий лечения лекарственными препаратами для снижения устойчивости.
Методы
Для описания широкого диапазона возможной динамики хозяина и патогена, которая может иметь клиническое значение, и для понимания того, как эти взаимодействия изменяются присутствием лекарства, принимаемого в различных эффективных концентрациях, мы используем модель бактериальной популяции. динамика основана на описанном Остином и Андерсоном [17]. Модель учитывает конкуренцию между лекарственно-чувствительными и лекарственно-устойчивыми бактериями с размерами популяций S и R соответственно.Эти популяции в некоторой степени ограничены иммунным ответом I . Модель предполагает, что бактерии растут со скоростью λ, но часть чувствительных бактерий μ становится устойчивой в результате мутаций. Чувствительные и резистентные бактерии умирают со скоростью ξ S и ξ R соответственно и ξ R > ξ S из-за биологической стоимости устойчивости. Рост обеих бактериальных популяций ограничен максимальным размером популяции K , а размеры популяции, близкие к максимальному размеру популяции, означают снижение темпов роста.Функции f R и f S описывают связь между концентрацией антибиотика и действием антибиотика на бактерии, то есть фармакодинамику. Иммунный ответ растет в ответ на бактериальный вызов: a — максимальная скорость пролиферации на душу населения, b — бактериальная популяция, которая дает половину максимальной скорости, а 1 / δ — средняя продолжительность иммунного ответа. . Предполагается, что уничтожение бактерий иммунным ответом происходит таким же образом, независимо от устойчивости, со скоростью, прямо пропорциональной силе иммунного ответа, с константой скорости уничтожения γ.
Динамика описывается следующими связанными обыкновенными дифференциальными уравнениями: (1)
Антибиотикотерапия, резистентность и клинические результаты
Чтобы рассмотреть наилучший вариант дозирования для устранения инфекции при минимизации резистентности, мы предполагаем, что нет естественных ограничений для фармакокинетики и что концентрации препарата поддерживаются на постоянном уровне на протяжении всего лечения. Учитывая концентрацию c , действие антибиотика на бактерии описывается с использованием модели E max [18], [19], [20], [21], [22], [23], (2) где E max — максимальный эффект, а c i — препарат, необходимый для получения половины максимального эффекта для штамма i .С c R > c S устойчивые бактерии не полностью устойчивы к лекарству, а вместо этого требуют более высокой концентрации лекарственного средства для выведения.
Влияние лекарственного давления на отбор по устойчивости зависит от дозировки и продолжительности лечения, но также зависит от динамики целевой и нецелевой бактериальной флоры. Каждый бактериальный вид может иметь разную динамику в каждой из сред обитания, в которой он обитает. Следовательно, концентрация антибиотиков в тканях, достигнутая в очаге инфекции, может не совпадать с концентрацией, достигнутой в местах колонизации.Мы варьировали уровни лекарств и их эффекты, чтобы моделировать селекцию бактерий в различных условиях, с которыми могут столкнуться бактерии при воздействии антибиотиков. Концентрации варьировали от ниже МИК чувствительного штамма до выше МИК устойчивого штамма. При μ = 0 и интерпретации, что MIC соответствует концентрации, которая просто подавляет рост бактерий, MIC может быть выражен как. Параметры для моделирования были выбраны для достижения слабого и сильного действия лекарственного средства, определяемого соответственно и.
Хотя термины «колонизация» и «инфекция» имеют клиническое значение, они не охватывают аспекты динамики заболевания, важные для понимания устойчивости. Поэтому мы использовали четыре произвольных, но, надеюсь, полезных определения динамики инфекции, которые мотивированы формальным анализом стабильности математической модели (см. Более подробную информацию в тексте S1): нерегулируемая, регулируемая, оппортунистическая и самоограничивающаяся бактериальная динамика.
Нерегулируемая динамика.
Взаимодействие между бактериальной популяцией и хозяином недостаточно для стимуляции иммунного ответа, и устойчивые и чувствительные бактерии приходят в равновесие.Этот тип взаимодействия может происходить между бактериями, которые используют тело в первую очередь как комменсальную среду обитания [24], например. комменсальная стафилококковая флора кожи. Хотя эти организмы могут взаимодействовать со специфической клеточной поверхностью эпителиальных клеток без прерывания эпидермального слоя, организмы в этом состоянии не вызывают иммунного ответа. Другие примеры этого типа динамики могут включать множество потенциальных патогенных организмов, которые колонизируют желудочно-кишечный тракт, такие как виды Helicobacter, прежде чем вызвать инвазивное заболевание.
Регулируемая динамика.
Рост бактерий сопровождается иммунным ответом, и как популяции бактерий, так и иммунный ответ колеблются перед установлением равновесия. Продолжая пример со стафилококками, если произойдет перерыв в эпидермальном слое, количество стафилококков увеличится и возникнет иммунный ответ. По мере того, как восстанавливается эпидермальный слой, нагрузка на организм возвращается к исходному уровню после всплеска репликации.В той степени, в которой эпидермальный слой не восстанавливается, количество организмов может оставаться выше исходного уровня, в конечном итоге достигая нового состояния равновесия. Клинические состояния, начиная от травмы и заканчивая основными грибковыми инфекциями и атопическим дерматитом и экземой [25], могут нарушить целостность слоя кожи и запустить этот тип динамики. Другой клинический пример может включать инфекцию Mycobacteria tuberculosis , при которой первоначальное воздействие этого организма на легкие приводит к легкому локализованному заболеванию, которое контролируется иммунной системой, но приводит к иммунологической разрядке, при которой относительно спящий организм теперь заключен внутри гранулема, препятствующая продолжению репликации, но не способная полностью устранить угрозу.
Оппортунистическая динамика.
Бактерии достигают стабильного регулируемого равновесия под воздействием лекарств, но по мере развития первоначального иммунного ответа бактерии уменьшаются до очень низкой плотности, которая ниже порогового значения для одного организма, определенного для уничтожения (см. Определение ниже), без воздействия лекарств. Опять же, в случае кожной инфекции воздействие лекарств уменьшило количество организмов, а также клеточные и иммунотоксины, вырабатываемые стафилококками, в локально инфицированном месте, позволяя иммунному ответу вернуться и поддерживать количество бактерий на уровне даже ниже первоначального состояния колонизации.В дыхательных путях подобная динамика может происходить между Streptococci pneumoniae и местной защитой слизистой оболочки хозяина. Хотя S. pneumoniae может находиться в дыхательных путях, не вызывая заболевания, если симптоматическая инфекция возникнет как следствие возрастающего бремени организмов, антибиотикотерапия может снизить количество микроорганизмов до уровней, соответствующих уровню искоренения, или ниже.
Самоограничивающаяся динамика.
Бактерии подавляются иммунным ответом до равновесной плотности ниже порогового значения.В некотором смысле это особый результат регулируемой динамики, при котором нагрузка организма по существу устраняется. Например, вторгшиеся стафилококки уничтожаются комбинацией первичных и вторичных иммунных ответов без вмешательства антибиотиков. В другом клиническом примере избыточный бактериальный рост и инвазия запускают иммунный ответ в среднем ухе, достаточный для снижения бактериальной нагрузки до уровней, равных или ниже равновесной плотности, с симптомами или без них.
Оппортунистическая и самоограничивающаяся динамика различаются тем, что в случае условно-патогенной динамики повторное воздействие бактерий в присутствии уже существующего, примированного иммунного ответа может привести к стабильной регулируемой динамике, но с равновесным значением выше порогового значения. определяется как «искоренение», в то время как самоограничивающаяся инфекция всегда приводит к уничтожению организма.Плотность популяции регулируемой или нерегулируемой комменсальной динамики, как правило, близка к динамическому равновесию популяции во время лечения, тогда как оппортунистическая и самоограничивающаяся динамика обычно находится в фазе геометрического роста инфекции, когда начинается лечение. Различия между этими типами динамики патогенов и их моделированием показаны на Рисунке 1.
Рис. 1. Результаты моделирования, показывающие количество бактерий для четырех различных динамических показателей, предполагая две разные концентрации лекарственного средства (c = 0 черный и c = 10 серый).
Нерегулируемая динамика: в случае нерегулируемой динамики иммунный ответ не стимулируется, и устойчивые и чувствительные бактерии достигают равновесия. Регулируемая динамика: как популяции бактерий, так и иммунный ответ колеблются перед установлением равновесия. Оппортунистическая динамика: бактерии в конечном итоге достигают стабильного регулируемого равновесия под воздействием лекарств, но их плотность снижается до очень низкой плотности, которая ниже порогового значения, определенного для искоренения без воздействия лекарств. Самоограничивающаяся динамика: бактерии уменьшаются до равновесной плотности, которая ниже порогового значения из-за иммунного ответа.
https://doi.org/10.1371/journal.pone.0029838.g001
Для каждого из этих типов бактериальной динамики мы анализируем три различных результата; агрегированная бактериальная нагрузка резистентности (определяемая как интеграл от R (t)), агрегированная доля резистентности (определяемая как интеграл от R (t) / (R (t) + S (t))) и время появления симптомов ( определяется как время с бактериальной нагрузкой> 10 7 ).
Значение отсечки
Чтобы получить более реалистичные результаты из нашего моделирования, мы определили пороговое значение для одной бактерии как минимальное значение, необходимое для выживания бактериальной популяции.Как только последняя бактерия умирает, популяция уничтожается.
Результаты
Выбор по устойчивости к антибиотикам и клинические исходы различаются в зависимости от экологической динамики патогена в зависимости от дозировки и продолжительности лечения (рис. 2).
Рис. 2. Результаты различных стратегий дозирования по совокупному количеству устойчивых бактерий (левая панель) и времени появления симптомов (бактериальная нагрузка> 10 7 , правая панель) противопоставляются для регулируемых, самоограничивающихся и условно-патогенных популяций бактерий. .
Предполагается, что концентрация антибиотика будет постоянной на протяжении всего курса лечения при концентрации, отображаемой на оси y, в течение времени, отображаемого на оси x. Розовым цветом обозначена область с наиболее сильным отбором по сопротивлению и наибольшей продолжительностью симптомов. Резистентность увеличивается с увеличением продолжительности приема антибиотиков для регулируемого комменсала. Для оппортунистической и самоограничивающейся динамики отбор на устойчивость наиболее интенсивен при средней продолжительности приема антибиотиков.Время появления симптомов уменьшается с увеличением продолжительности и концентрации антибиотиков для всех типов бактериальной динамики. Время появления симптомов относительно короткое для оппортунистической и самоограничивающейся динамики по сравнению с регулируемой комменсальной динамикой. Это иллюстрирует важность иммунной системы для уничтожения бактериальных популяций. Результаты моделирования для нерегулируемой динамики (не отображаются) аналогичны результатам моделирования для регулируемой динамики, но отбор по сопротивлению несколько сильнее, а время с симптомами несколько больше.Параметры, используемые для достижения регулируемой комменсальной динамики: E max = 1, a = 0,2, K = 10 15 , λ = 1,8, c 50R = 13,1, c 50S = 1,3, γ = 50, b = 10 6 , δ = 50, μ = 10 −8 , ξ R = 0,2 и ξ S = 0,1. Для нерегулируемой динамики комменсалов и динамики оппортунистических инфекций δ = 0,05, а для динамики самоограничивающейся инфекции δ = 5 10 -8 .Небольшая субпопуляция бактерий изначально устойчива. Начальное значение иммунного ответа равно нулю для нерегулируемой комменсальной динамики и близко к равновесию (0) для других случаев. Концентрация антибиотика остается фиксированной на уровне, отображаемом осью y, в течение времени, отображаемом осью x. Все параметры даны в условных единицах.
https://doi.org/10.1371/journal.pone.0029838.g002
Оптимизация лечения регулируемой или нерегулируемой динамики патогенов
Если патогены, регулируемые или не регулируемые иммунным ответом, вызывают симптомы, для устранения симптомов следует полагаться на антибиотики, и потребуются высокие дозы лекарств в течение длительного времени (правая панель, рис.2). Клинические примеры включают туберкулез, акне и Helicobacter pylori . Эти хронические или рецидивирующие инфекции различаются по степени тяжести симптомов, но требуют длительной или повторной терапии / профилактики антибиотиками. Если устойчивые субпопуляции изначально присутствуют (как в случае с нашим моделированием) или возникают в результате мутации или генетического переноса в ходе лечения, частота устойчивости будет коррелировать со временем, в течение которого сохраняется концентрация лекарственного средства между МПК восприимчивого и резистентные штаммы (левая панель, рис.2), что согласуется с результатами фармако-кинетических исследований in vitro [26], [27]. Хотя мутанты с МПК между чувствительными и устойчивыми штаммами играют важную роль в развитии устойчивости, мы также показали, что частота устойчивости увеличивается с продолжительностью лечения антибиотиками для других стратегий дозирования. Мы приходим к аналогичным качественным выводам независимо от того, измеряются ли результаты в виде агрегированного числа или агрегированной доли бактерий (цифры не показаны).
В то время как эволюция резистентности регулируемых или нерегулируемых инфекций является серьезной проблемой для некоторых инфекций, влияние лечения антибиотиками на комменсальные бактерии часто упускается из виду. Устойчивость комменсалов имеет клиническое значение, потому что каждый эпизод лечения оказывает давление отбора в пользу устойчивости как в инфекционных, так и в комменсальных участках. Более того, для данного уровня концентрации лекарственного средства отбор комменсалов более обширен из-за отсутствия сильно ограничивающего иммунного ответа.Независимо от динамики патогенов маловероятно, что лечение антибиотиками может успешно устранить колонизацию хозяина из-за большого количества организмов в комменсальной флоре. Бактерии, устойчивые к антибиотикам, с большей вероятностью обогащены комменсальной флорой пациентов, принимающих много антибиотиков [28].
Хотя большие, стабильные популяции комменсальных бактерий стремятся к фиксации устойчивости под давлением антибиотиков, частота резистентных организмов снижается до баланса мутации-отбора, когда давление лекарства ослабляется, по предположению, в результате стоимости приспособленности, связанной с генетическими факторами. перегруппировка (см. текст S1).Этот баланс может быть дополнительно усложнен наличием факторов, не рассматриваемых здесь, таких как компенсаторные мутации, которые снижают биологическую стоимость устойчивости [29].
Оптимизация лечения при самоограничении или динамике условно-патогенных микроорганизмов
Самоограничивающаяся динамика патогенов отличается от регулируемой или нерегулируемой динамики по нескольким аспектам. Во-первых, как следует из названия, самоограниченные инфекции по своей природе ограничены по времени, а время появления симптомов значительно короче по сравнению с инфекциями глубоких тканей, с антибиотиками или без них.Важные клинические примеры включают некоторые из наиболее распространенных инфекций, острый средний отит (ОСА) и острый синусит, для которых эмпирические исследования показали, что никакое лечение или короткое трехдневное лечение не является эффективным для излечения инфекции [11], [12] , [15], [16], [30], [31], [32]. Как видно на Рисунке 1 (сравните условно-патогенную динамику с лекарством и без него), лекарства могут изменять динамические результаты. Оппортунистические инфекции могут напоминать по своей динамике самоограниченные инфекции без воздействия лекарств, но лекарства могут изменять динамику, чтобы в конечном итоге достичь стабильного регулируемого равновесия.Возникающая в результате хроническая колонизация или инфекция могут иметь долгосрочные последствия для здоровья пациента. Эта динамика, возможно, может объяснить эмпирические данные о том, что рецидив среднего отита чаще встречается у детей, получающих антибиотики, чем у детей, не получавших лечения [33].
Во-вторых, как для самоограничивающихся, так и для условно-патогенных инфекций выбор устойчивости (по совокупному количеству устойчивых бактерий) наиболее обширен для стратегий промежуточного дозирования, близких к МПК для промежуточных длительностей (см.2). Представленные результаты предполагают слабое действие препарата. Динамика немного отличается при сильном действии препарата (см. Рис. 3), но наши выводы устойчивы к этим вариациям.
Рис. 3. Результаты различных стратегий дозирования по совокупному количеству устойчивых бактерий (левая панель) и времени появления симптомов (бактериальная нагрузка> 10 7 , правая панель) сравниваются для регулируемых, самоограничивающихся и условно-патогенных популяций бактерий. .
Предполагается, что концентрация антибиотика будет постоянной на протяжении всего курса лечения при концентрации, отображаемой на оси y, в течение времени, отображаемого на оси x.Розовым цветом обозначена область с наиболее сильным отбором по сопротивлению и наибольшей продолжительностью симптомов. Резистентность увеличивается с увеличением продолжительности приема антибиотиков для регулируемой комменсальной динамики. Для оппортунистической и самоограничивающейся динамики отбор на устойчивость наиболее интенсивен при средней продолжительности приема антибиотиков. Время появления симптомов уменьшается с увеличением продолжительности и концентрации антибиотиков для всех четырех типов бактериальной динамики. Время появления симптомов относительно короткое для оппортунистической и самоограничивающейся динамики по сравнению с регулируемой комменсальной динамикой.Это иллюстрирует важность иммунной системы для уничтожения бактериальных популяций. Результаты моделирования для нерегулируемой динамики (не отображаются) аналогичны результатам моделирования для регулируемой динамики, но отбор по сопротивлению несколько сильнее, а время с симптомами несколько больше. Параметр E max был установлен на 3, чтобы сопоставить результаты для ситуации с сильным действием лекарств. Другие параметры, используемые для достижения регулируемой комменсальной динамики: a = 0,2, K = 10 15 , λ = 1.8, c 50R = 13,1, c 50S = 1,3, γ = 50, b = 10 6 , δ = 50, μ = 10 −8 , ξ R = 0,2 и ξ S = 0,1. Для нерегулируемой динамики комменсалов и динамики оппортунистических инфекций δ = 0,05, а для динамики самоограничивающейся инфекции δ = 5 10 −8 . Небольшая субпопуляция бактерий изначально устойчива. Начальное значение иммунного ответа равно нулю для нерегулируемой комменсальной динамики и имеет значение, близкое к равновесному (0) для других случаев.Все параметры даны в условных единицах. Нижняя и верхняя пунктирные линии представляют MIC чувствительных и устойчивых бактерий соответственно.
https://doi.org/10.1371/journal.pone.0029838.g003
Таким образом, для инфекций, вызванных организмами, которые являются комменсалами в их нормальной среде обитания, лучшей стратегией было бы кратковременное и агрессивное лечение на ранних этапах инфекции, чтобы удержать популяции бактерий низки до тех пор, пока иммунная система не сможет завершить свою работу, потому что эта стратегия минимизирует отбор по устойчивости среди комменсалов одновременно с минимальным отбором в очаге инфекции.Компромисс при выборе стратегии, минимизирующей резистентность, заключается в том, что время появления симптомов становится больше при более короткой продолжительности приема антибиотиков.
Обсуждение
Недавние разработки в области фармакодинамики антибиотиков привели к лучшему знанию оптимальных стратегий дозирования для максимального уничтожения инфекционного патогена [34], [35]. Кроме того, оптимизация продолжительности и дозировки лечения для снижения вероятности резистентности для данного уровня использования антибиотиков, однако, остается проблемой.Устойчивость к десяткам антибиотиков сформировалась у сотен видов бактерий, но взаимосвязь между режимами дозирования, фармакокинетикой и терапевтической эффективностью в контексте устойчивости бактерий только начинает пониматься [7]. Ответные меры общественного здравоохранения на различные аспекты проблемы устойчивости в значительной степени сосредоточены на одном решении — сокращении чрезмерного использования антибиотиков. Более целостный подход может заключаться в создании функциональной таксономии, классификации бактериальных патогенов, которые функционально подобны для эволюции устойчивости.Функциональная таксономия должна учитывать экологию патогенов, динамику иммунитета, а также другие вопросы, которые являются важными детерминантами передачи и структуры населения. Эти другие важные проблемы могут включать типичные размеры популяции колонизирующих бактерий, их внутреннюю устойчивость к антибиотикам, их тенденцию к накоплению генов устойчивости и видоспецифическую перекрестную устойчивость к доминирующим антибиотикам.
Наше исследование особо подчеркивает важность для общественного здравоохранения понимания динамики бактериальных патогенов в их доминирующем экологическом резервуаре, а также фармакодинамических и фармакокинетических параметров, действующих в этих тканях, в качестве важного дополнения к озабоченности по поводу оптимизации лечения бактериальных инфекций.
В этой статье мы показываем, что 1) любое использование антибиотиков — даже при «идеальной» стратегии дозирования — вызывает отбор на устойчивость и 2) для большинства инфекций оптимальная стратегия дозирования для клинического лечения может быть неоптимальной для предотвращения распространения инфекции. резистентность, которая, вероятно, является следствием тех схем лечения, которые могут не ориентироваться на динамику бактериальных популяций. Общее правило, предложенное нашими исследованиями, заключается в том, что более короткая продолжительность лечения обычно, но не всегда, оптимальна.Более подробные руководящие принципы, в которых учитываются важные различия между бактериями в их экологической динамике, а также в разнообразии экологической динамики одних и тех же бактерий в разных средах обитания в организме, могут способствовать значительному сокращению объема потребляемых антибиотиков и выбора по устойчивости.
Примером может служить лечение АОМ — второй по распространенности инфекции среди детей после простуды и единственной наиболее важной причины назначения антибиотиков в США [36].Здесь ни одно лечение, ни короткий трехдневный курс лечения антибиотиками оказались не менее эффективными, чем десятидневный курс лечения антибиотиками [12], [30], [31]. Мотивация тенденции и устойчивого прогресса в разработке более коротких схем лечения основана на опыте клиницистов, а не на систематической оценке компромисса между успехом лечения и резистентностью, и, тем не менее, многие врачи продолжают рекомендовать пациентам пройти все 10 курсов. дневной курс лечения антибиотиками [37], [38], тем самым потенциально ускоряя темпы развития и распространения устойчивости из других популяций бактерий.Изменение рекомендаций в отношении более короткой продолжительности лечения антибиотиками не только предотвратит резистентность у людей, получающих антибиотики для лечения самоограничивающихся инфекций, но и у большого числа пациентов, получающих антибиотики при небактериальных инфекциях [39].
Для инфекций, которые не могут быть обработаны одной иммунной системой, то есть при которых требуются высокие концентрации антибиотиков в течение длительного времени, важно учитывать функциональную таксономию используемых лекарств.Способ введения антибиотика важен, потому что он влияет на концентрацию препарата в других частях тела; антибиотики обычно достигают гораздо более высоких концентраций в кишечнике, если их вводить перорально, а не внутривенно [40]. Например, есть данные, свидетельствующие о том, что рост числа устойчивых к ванкомицину энтерококков в Соединенных Штатах в 1980-е годы мог быть вызван применением перорального ванкомицина для лечения C. difficile [41]. В Европе, где ванкомицин в основном применялся внутривенно, можно было бы ожидать, что концентрации ванкомицина и селекция на резистентность у кишечных комменсалов будут намного ниже, а устойчивые к ванкомицину энтерококки встречаются гораздо реже.Лечение туберкулеза не требует повышенного отбора на устойчивость, несмотря на обширные схемы приема лекарств, потому что Mycobacterium tuberculosis не является частью комменсальной флоры, и потому что два ключевых агента (изониазид и этамбутол) в тройной комбинации являются активными только против микобактерий, которые не входят в состав комменсальной флоры. Напротив, для лечения акне антибиотиками широкого спектра действия (миноциклином), иногда в течение года и более [42], наши результаты свидетельствуют о значительном давлении отбора на комменсальную флору.Если оставить кишечную флору, флору верхних дыхательных путей и большую часть кожной флоры необнаруженными, местное применение антибиотиков может стать решением. Однако он давно не приветствуется и составляет лишь 1% от системного использования [39].
Поскольку популяции комменсальной флоры могут быть обширными, резистентные бактерии, образованные в результате редких мутаций или событий генетического обмена, вероятно, будут существовать и составлять некоторую часть существующей флоры во время лечения антибиотиками [43]. Следовательно, устойчивые комменсальные бактерии с большей вероятностью сохранятся и вызовут устойчивые инфекции, когда они распространятся на других хозяев.Даже если они не вызывают инфекцию, комменсальные бактерии могут передавать генетический материал, кодирующий устойчивость к другим, более патогенным бактериям.
Отсюда следует, что ценность оптимизации лекарств связана с полным спектром фармакокинетики и фармакодинамики лекарств во всем организме, как с точки зрения способа доставки, так и с точки зрения организмов, на которые она воздействует. Оптимизация обработки в первичном экологическом резервуаре передачи является одновременно лучшим показателем сопутствующего ущерба в моделях передачи и наиболее важным соображением для здоровья населения.Наши результаты подчеркивают необходимость пересмотра местной, внутривенной или фокальной доставки антибиотиков для других комбинаций лекарств и организмов.
Предостережения и ограничения
Как и все математические модели биологических систем, анализируемые здесь модели включают некоторые допущения и упрощения. Мутации в модели производятся в одноэтапный процесс. Генетический перенос обычно приводит к более высокому уровню устойчивости, но маловероятен при самоограничивающихся инфекциях, если нет коинфекции; первый задокументированный случай инфекции, вызванной устойчивым к ванкомицину S.aureus — один из важных примеров [39]. Допуск мутаций к высокому уровню устойчивости в месте колонизации увеличивает промежуток времени, в течение которого проводится обширный отбор на устойчивость, но не меняет наших выводов.
Мы предположили, что концентрация препарата поддерживалась на постоянном уровне на протяжении всего лечения — предположение, которое неестественно для большинства ситуаций, кроме внутривенного лечения [18]. При пероральном и внутримышечном введении концентрации антибиотиков будут постоянно меняться, и динамика может быть дополнительно искажена такими факторами, как несоблюдение.В результате эффект периодического снижения концентраций антибиотиков ниже эффективных МИК не рассматривается в нашем анализе, а вместо этого рассматриваются постоянные концентрации ниже или выше эффективных МИК. Учет периодического снижения концентраций антибиотиков ниже эффективных МПК повлияет на интенсивность отбора по устойчивости и временную шкалу динамики и, следовательно, должен учитываться в будущих анализах руководств по конкретным антибиотикам и патогенам.
МИК использовалась в качестве единственного фармакодинамического параметра в модели. Фармакодинамическая функция отражает действие антибиотика в широком диапазоне концентраций антибиотика, и, как следствие различий в форме этих фармакодинамических функций, антибиотики с одинаковыми МИК и фармакокинетикой могут сильно различаться по своей микробиологической эффективности [23]. Это предположение, возможно, придется ослабить для будущих прогнозов при разработке протоколов лечения антибиотиками для конкретных комбинаций лекарств и организмов.
Важным аспектом нашего исследования было то, что мы подробно рассмотрели различную динамику действия лекарств и бактерий, которые могут возникать в очаге инфекции и в других средах обитания, принимая во внимание влияние иммунного ответа на появление и отбор устойчивости. Ожидается, что популяции бактерий в разных средах обитания в организме не будут иметь сильного прямого взаимодействия, поэтому реакции популяции будут разными и в значительной степени независимыми. Из-за множества взаимозависимых механизмов, таких как разные типы клеток и цитокины, участвующие в иммунных ответах на бактериальные инфекции, эксперименты по измерению вклада различных компонентов были трудными, и точные знания об этих процессах все еще отсутствуют [44].Однако в центре внимания этого исследования было не прогнозирование возникновения резистентности к конкретной инфекции или виду микрофлоры, а скорее концептуальная основа для решения вопросов о влиянии учета как места инфекции, так и места комменсала при оптимизации антибиотика. режимы дозирования препарата для предотвращения резистентности.
В модели иммунный ответ зависит от общей бактериальной популяции. Однако есть свидетельства того, что некоторые патогены могут избегать воздействия антибиотиков, перемещаясь из внеклеточного во внутриклеточное пространство.В отличие от нашего предположения, тогда устойчивость к антибиотикам будет коррелировать с повышенной устойчивостью к иммунному ответу [45], [46]. Доказательства этого явления все еще появляются, и необходимы дальнейшие исследования. Однако, если это наблюдение будет установлено, степень устойчивости до лечения могла бы повлиять на общий иммунный ответ.
Могут быть и другие важные клинические исходы, которые следует учитывать при оценке стратегий дозирования. В некоторых исследованиях, например, сообщается об увеличении числа осложнений в странах с более низкими показателями назначения антибиотиков для лечения АОМ [47].Однако заболеваемость невысока, и риск более серьезных последствий необходимо сопоставлять с риском и последствиями стратегии, которая создает более устойчивые организмы.
Наконец, это исследование охватило только одну из двух перекрывающихся проблем, связанных с устойчивостью: появление и отбор устойчивых штаммов в организме хозяина. Для многих инфекций первичная резистентность, вызванная распространением резистентных штаммов в популяции, является наиболее серьезной проблемой [48], и для будущих исследований остается важным оценить, перевешивает ли польза от лечения пациента риск резистентности в популяции.
Резюме и выводы
Существующие руководства по лечению антибиотиками не учитывают 1) важные различия в экологической динамике между разными видами бактерий или 2) разнообразие экологической динамики в пределах одного и того же вида бактерий в разных средах обитания в организме. Наши результаты бросают вызов общепринятому клиническому мнению о том, что длительная антибактериальная терапия подходит для лечения распространенных инфекций, независимо от того, являются ли они самоограничивающимися, и независимо от возможности отбора резистентности в комменсальной флоре.В заключение, универсальные режимы дозирования не подходят для всех комбинаций организмов и антибиотиков, что требует расширения принципов, используемых при выборе режимов дозирования как для существующих, так и для будущих антибиотиков, чтобы они включали не только успешное лечение основного заболевания. инфекции, но делать это таким образом, чтобы свести к минимуму необходимость отбора патогенов, которые становятся все более устойчивыми к антибиотикам.
Благодарности
Авторы благодарят Саймона Левина, Брюса Р.Левину и Марку Липсичу за полезные комментарии, которые существенно улучшили работу. Ответственность за любые оставшиеся ошибки несут исключительно авторы.
Вклад авторов
Задумал и спроектировал эксперименты: DLS RL. Написал статью: PG. Проанализирована модель: PG. Полученные данные для основных допущений модели: PG DLS MD. Критически переработанная рукопись для интеллектуального содержания: PG RL MD DLS.
Ссылки
- 1. Коэн М.Л. (1992) Эпидемиология лекарственной устойчивости: последствия для пост-антимикробной эры.Наука 257: 1050–1055.
- 2. Guillemot D (1999) Использование антибиотиков у людей и устойчивость к бактериям. Curr Opin Microbiol 2: 494–498.
- 3. Nordberg P, Monnet DL, Cars O (2005) Устойчивость к антибактериальным препаратам. Справочный документ для проекта ВОЗ «Приоритетные лекарственные средства для Европы и мира».
- 4. Bonhoeffer S, Lipsitch M, Levin BR (1997) Оценка протоколов лечения для предотвращения устойчивости к антибиотикам. Proc Natl Acad Sci U S A 94: 12106–12111.
- 5. Бони М.Ф., Смит Д.Л., Лаксминараян Р. (2008) Преимущества использования нескольких препаратов первой линии против малярии. Proc Natl Acad Sci U S A 105: 14216–14221.
- 6. Bergstrom CT, Lo M, Lipsitch M (2004) Экологическая теория предполагает, что цикл антимикробных препаратов не снижает резистентность к противомикробным препаратам в больницах. Proc Natl Acad Sci U S A 101: 13285–13290.
- 7. Olofsson SK, Cars O (2007) Оптимизация воздействия лекарств для минимизации выбора устойчивости к антибиотикам.Clin Infect Dis 45: Suppl 2S129–136.
- 8. Аллен Л.В., Попович Н.Г., Ансель Х.С. (2009) Фармацевтические лекарственные формы и системы доставки лекарств Анселя. Филадельфия: Wolters Kluwer Lippincott Williams & Wilkins Health.
- 9. Иравани А., Тайс А.Д., Маккарти Дж., Сайкс Д.Х., Нолен Т. и др. (1995) Краткосрочное лечение ципрофлоксацином острой неосложненной инфекции мочевыводящих путей у женщин. Минимальная эффективная доза. Группа изучения инфекций мочевыводящих путей [исправлено].Arch Intern Med 155: 485–494.
- 10. Чарльтон Калифорния, Кроутер А., Дэвис Дж. Дж., Дайнс Дж., Хавард М. В. и др. (1976) Трехдневная и десятидневная химиотерапия инфекций мочевыводящих путей в общей практике. Br Med J 1: 124–126.
- 11. де Бок Г.Х., Деккер Ф.В., Столк Дж., Спрингер М.П., Киевит Дж. и др. (1997) Антимикробное лечение острого гайморита: метаанализ. J Clin Epidemiol 50: 881–890.
- 12. de Saintonge DMC, Levine DF, Savage IT, Burgess GW, Sharp J и др.(1982) Испытание трех- и десятидневных курсов амоксициллина при среднем отите. Br Med J (Clin Res Ed) 284: 1078–1081.
- 13. Norrby SR (1990) Кратковременное лечение неосложненных инфекций нижних мочевых путей у женщин. Rev Infect Dis 12: 458–467.
- 14. Saginur R, Nicolle LE (1992) Разовая доза по сравнению с 3-дневным лечением норфлоксацином неосложненной инфекции мочевыводящих путей у женщин. Группа изучения клинических испытаний Канадского общества инфекционных заболеваний.Arch Intern Med 152: 1233–1237.
- 15. Stalman W, van Essen GA, van der Graaf Y, de Melker RA (1997) Конец лечения антибиотиками у взрослых с острыми синуситоподобными жалобами в общей практике? Плацебо-контролируемое двойное слепое рандомизированное исследование доксициклина. Br J Gen Pract 47: 794–799.
- 16. Williams JW, Holleman DR, Samsa GP, Simel DL (1995) Рандомизированное контролируемое испытание 3 и 10 дней триметоприма / сульфаметоксазола для лечения острого гайморита.JAMA 273: 1015–1021.
- 17. Остин Д. Д., Андерсон Р. М. (1999) Исследования устойчивости к антибиотикам у пациентов, больниц и сообщества с использованием простых математических моделей. Philos Trans R Soc Lond B Biol Sci 354: 721–738.
- 18. Остин Д.Дж., Уайт Н.Дж., Андерсон Р.М. (1998) Динамика действия препарата на рост популяции инфекционных агентов внутри хозяина: сочетание фармакокинетики с динамикой популяции патогенов. Дж. Теор Биол. 194: 313–339.
- 19.Hyatt JM, Nix DE, Stratton CW, Schentag JJ (1995) Фармакодинамика in vitro пиперациллина, пиперациллин-тазобактама и ципрофлоксацина по отдельности и в комбинации против Staphylococcus aureus, Klebsiella pneumoniae, Enterobacter cloacae и Pseudomonas aeruginosa. Антимикробные агенты Chemother 39: 1711–1716.
- 20. Nolting A, Dalla Costa T, Rand KH, Derendorf H (1996) Фармакокинетико-фармакодинамическое моделирование антибиотического эффекта пиперациллина in vitro. Pharm Res 13: 91–96.
- 21. Mouton JW, Vinks AA, Punt NC (1997) Фармакокинетико-фармакодинамическое моделирование активности цефтазидима во время непрерывной и периодической инфузии. Антимикробные агенты Chemother 41: 733–738.
- 22. Луи А., Кау П., Лю В., Джамбе Н., Миллер М. Х. и др. (2001) Фармакодинамика даптомицина на мышиной модели бедра Staphylococcus aureus. Антимикробные агенты Chemother 45: 845–851.
- 23. Regoes RR, Wiuff C, Zappala RM, Garner KN, Baquero F и др.(2004) Фармакодинамические функции: многопараметрический подход к разработке схем лечения антибиотиками. Антимикробные агенты Chemother 48: 3670–3676.
- 24. Casadevall A, Pirofski LA (2000) Взаимодействие патогенов и хозяев: основные концепции микробного комменсализма, колонизации, инфекции и болезни. Заражение иммунной 68: 6511–6518.
- 25. Pezesk pour FZ, Miri S, Ghasemi R, Farid R, Ghenaat J (2007) Колонизация кожи с помощью Staphylococcus Aureus у пациентов с атопическим дерматитом.Интернет-журнал дерматологии 5 (1).
- 26. Geli P, Olofsson SK, Andersson DI, Cars O (2005) Фармакодинамическая модель для описания зависимого от концентрации отбора устойчивой к цефотаксиму Escherichia coli. Антимикробные агенты Chemother 49: 5081–5091.
- 27. Negri MC, Lipsitch M, Blázquez J, Levin BR, Baquero F (2000) Зависимый от концентрации выбор небольших фенотипических различий в TEM-бета-лактамазе-опосредованной устойчивости к антибиотикам. Антимикробные агенты Chemother 44: 2485–2491.
- 28. Густафссон И., Шолунд М., Торелл Э., Йоханнессон М., Энгстранд Л. и др. (2003) Бактерии с повышенной частотой мутаций и устойчивостью к антибиотикам обогащены комменсальной флорой пациентов с высоким использованием антибиотиков. J Antimicrob Chemother 52: 645–650.
- 29. Maisnier-Patin S, Andersson DI (2004) Адаптация к пагубным последствиям мутаций устойчивости к противомикробным препаратам путем компенсаторной эволюции. Res Microbiol 155: 360–369.
- 30.Фрум Дж., Калпеппер Л., Гроб П., Бартелдс А., Бауэрс П. и др. (1990) Диагностика и лечение антибиотиками острого среднего отита: отчет Международной сети первичной медико-санитарной помощи. BMJ 300: 582–586.
- 31. Фрум Дж., Калпеппер Л., Джейкобс М., ДеМелкер Р.А., Грин Л.А. и др. (1997) Противомикробные препараты для лечения острого среднего отита? Обзор Международной сети первичной медико-санитарной помощи. BMJ 315: 98–102.
- 32. van Buchem FL, Knottnerus JA, Schrijnemaekers VJ, Peeters MF (1997) Рандомизированное плацебо-контролируемое испытание лечения антибиотиками при остром гайморите на основе первичной медико-санитарной помощи.Ланцет 349: 683–687.
- 33. Безакова Н., Дамуазо Р.А., Хос А.В., Шильдер А.Г., Роверс М.М. (2009) Рецидив до 3,5 лет после лечения антибиотиками острого среднего отита у очень маленьких голландских детей: опрос участников испытания. BMJ 338: b2525.
- 34. Hyatt JM, McKinnon PS, Zimmer GS, Schentag JJ (1995) Важность фармакокинетических / фармакодинамических суррогатных маркеров для результата. Сосредоточьтесь на антибактериальных средствах. Clin Pharmacokinet 28: 143–160.
- 35.Craig WA (1998) Фармакокинетические / фармакодинамические параметры: обоснование антибактериального дозирования мышей и мужчин. Clin Infect Dis 26: 1–10; викторина 11–12.
- 36. McCaig LF, Besser RE, Hughes JM (2002) Тенденции в частоте назначения противомикробных препаратов детям и подросткам. JAMA 287: 3096–3102.
- 37. Подкомитет Американской академии педиатрии по лечению острого среднего отита (2004 г.). Диагностика и лечение острого среднего отита. Педиатрия 113: 1451–1465.
- 38. Медицинский центр детской больницы Цинциннати (2006). Основанное на фактах руководство по ведению острого бактериального синусита у детей в возрасте от 1 до 18 лет. Июль Цинциннати (Огайо): Медицинский центр детской больницы Цинциннати. С. 1–17.
- 39. Департамент здравоохранения: Подгруппа Постоянного медицинского консультативного комитета по устойчивости к противомикробным препаратам (1997 г.) Путь наименьшей устойчивости. Соединенное Королевство: Министерство здравоохранения.
- 40. Drusano GL (2005) Концентрации в очагах инфекции: их терапевтическое значение и макролидный и макролидоподобный класс антибиотиков.Фармакотерапия 25: 150S – 158S.
- 41. Rice LB (2001) Появление устойчивых к ванкомицину энтерококков. Emerg Infect Dis 7: 183–187.
- 42. Лейден Дж. Дж., Макгинли К. Дж., Кавальери С., Вебстер Г. Ф., Миллс Огайо и др. (1983) Устойчивость Propionibacterium acnes к антибиотикам у пациентов с угрями. J Am Acad Dermatol 8: 41–45.
- 43. Huycke MM, Sahm DF, Gilmore MS (1998) Энтерококки с множественной лекарственной устойчивостью: природа проблемы и планы на будущее.Emerg Infect Dis 4: 239–249.
- 44. Handel A, Margolis E, Levin BR (2009) Изучение роли иммунного ответа в предотвращении устойчивости к антибиотикам. Дж. Теор Биол 256: 655–662.
- 45. Craig JE, Nobbs A, High NJ (2002) Экстрацитоплазматический сигма-фактор, final sigma (E), необходим для внутриклеточного выживания нетипируемых Haemophilus influenzae в макрофагах J774. Заражение иммунной 70: 708–715.
- 46. Форсгрен Дж., Самуэльсон А., Ахлин А., Йонассон Дж., Риннель-Даго Б. и др.(1994) Haemophilus influenzae находится и размножается внутриклеточно в аденоидной ткани человека, что продемонстрировано гибридизацией in situ и анализом жизнеспособности бактерий. Инфекция иммунной 62: 673–679.
- 47. Петерсен I, Джонсон А.М., Ислам А., Дакворт Г., Ливермор Д.М. и др. (2007) Защитный эффект антибиотиков против серьезных осложнений распространенных инфекций дыхательных путей: ретроспективное когортное исследование с базой данных исследований общей практики Великобритании. BMJ 335: 982.
- 48.Левин Б.Р., Розен Д.Е. (2006) Ненаследственная устойчивость к антибиотикам. Nat Rev Microbiol 4: 556–562.
Антибиотик бедаквилин активирует врожденную иммунную устойчивость макрофагов хозяина к бактериальной инфекции
[Примечание редакции: авторы повторно представили исправленную версию статьи на рассмотрение. Ниже следует ответ авторов на первый раунд проверки.]
[…]
1) Основная проблема заключается в том, что в рукописи нет четкой демонстрации того, что эффекты BDQ, наблюдаемые на росте MTB в клетках, на самом деле связаны с эффектами BDQ на клетки-хозяева vs.влияние BDQ на MTB. Использование мутанта, устойчивого к BDQ, — хорошая попытка решить эту проблему, но не совсем удовлетворительна. Во-первых, данные, представленные на рисунке 1 — рисунок в приложении 2C, демонстрируют, что BDQ (5 мкг / мл) действительно оказывает влияние на рост устойчивого мутанта. Во-вторых, даже если рост бактерий в бульоне не затруднен, антибиотик может оказывать влияние на бактерии в клетках. Даже незначительное воздействие на MTB (например, лизис нескольких бактерий) может иметь большое влияние на реакцию хозяина.Если не удастся удовлетворительно решить эту главную проблему (а мы опасаемся, что это не так), мы не думаем, что эта статья будет сильным кандидатом для eLife.
Мы благодарим рецензента 2 за то, что он поднял этот вопрос, признавая, что это может быть связано с проблемами в нашем письме. Нашей главной целью было показать, что BDQ может активировать макрофаги, делая их устойчивыми к любым бактериальным инфекциям, а не только к инфекции MTB. В отредактированной рукописи мы представляем новые данные, которые ясно показывают, что BDQ вызывает бактерицидные функции, напрямую воздействуя на хозяина.
Первый вопрос — насколько мутант MTB устойчив к BDQ (BDQr-MTB). МИК 99 мутанта составляет 36 мкг / мл, что намного выше, чем концентрация, которую мы использовали. В нашей статье BDQ используется в максимальной концентрации 5 мкг / мл в течение 48 часов и 1 мкг / мл в течение 5 дней. При этих концентрациях мы никогда не наблюдали уничтожение бактерий или уменьшение роста бактерий в жидкой среде (Рисунок 1 — приложение к рисунку 2B). Мы также показали, что бактериальная нагрузка резистентных MTB внутри макрофагов такая же, как в необработанных клетках, так и в клетках после 18 часов обработки BDQ (момент времени, выбранный для эксперимента RNAseq).Напротив, в том же эксперименте с использованием BDQ-чувствительного MTB наблюдается снижение бактериальной нагрузки на 70% (Рисунок 1 — рисунок в приложении 2C).
Мы согласны с тем, что BDQ может убить несколько внутриклеточных бактерий (даже если мы не обнаружили никаких изменений по КОЕ), но очень маловероятно, что этот эффект мог бы объяснить устойчивость макрофагов к бактериальной инфекции. Во-первых, эффект BDQ также может подавляться 3-MA и BAF, тогда как эти два ингибитора аутофагии не действуют на необработанные клетки (фиг. 6F).Эти результаты свидетельствуют о целевом эффекте BDQ на хозяина. Регулирование лизосомного пути с помощью BDQ также наблюдается в неинфицированных макрофагах и в клетках, стимулированных инактивированными нагреванием MTB или агонистами TLR, такими как LPS и Pam3CSK4 (Рисунок 3 — приложение к рисунку 2). Такие изменения не наблюдались в клетках, обработанных противотуберкулезными препаратами первой линии — этамбутолом (EMB), изониазидом (INH), пиразинамидом (PZA) и рифампицином (RIF) (новый анализ транскриптома представлен на рисунках 5A-C и 5 — рисунок дополнение 2, и окрашивание LysoTracker, проанализированное с помощью проточной цитометрии (рис. 5D).
Если лизис нескольких бактерий под действием BDQ индуцировал активацию макрофагов, то можно было бы ожидать большей реакции, когда клетки стимулируются убитыми нагреванием бактериями или чувствительными к лекарствам MTB, чем с BDQr-MTB. Опять же, как показано на рисунке 3 — приложение к рисунку 2, мы не наблюдали никаких различий в интенсивности окрашивания LysoTracker. Аналогичные результаты были получены и при сравнении уровня экспрессии лизосомных генов. В целом, наши результаты убедительно свидетельствуют о зависимом от хозяина эффекте BDQ.
2) Еще одна серьезная проблема связана с представлением данных RNAseq на рис. 1A-B и в приложении к рис. 3A-B. На рисунке 1AB показано влияние BDQ на макрофаги, инфицированные MTB, тогда как на рисунке в приложении 3A-B показано влияние BDQ на неинфицированные макрофаги. Если BDQ действует на клетки-хозяева независимо от воздействия на бактерии, то можно ожидать, что аналогичные гены будут индуцироваться в обоих условиях. Однако данные представлены только на уровне аннотаций GO-term. Нам требуются данные об экспрессии на уровне генов, сравнивающие индукцию генов во всех четырех условиях (+/- BDQ и +/- MTB) в одном анализе, чтобы мы могли оценить, действительно ли эффекты BDQ аналогичны +/- MTB.Вполне возможно, что MTB модулирует ответ хоста на BDQ, например, посредством активации TLR. В таком случае может быть полезно сравнить ответ клеток, инфицированных живым TB +/- BDQ, с ответом на клетки, обработанные агонистами TLR или убитыми бактериями +/- BDQ. Если, однако, основные эффекты BDQ на экспрессию генов-хозяев проявляются только в сочетании с заражением живым MTB, то мы были бы обеспокоены тем, что эффекты BDQ связаны с их воздействием на MTB, а не с прямыми воздействиями, направленными на хозяина.
Здесь мы представляем новый анализ, сравнивающий уровень экспрессии генов во всех четырех условиях (+/- BDQ и +/- MTB). После обработки BDQ 127 и 1043 гена, соответственно, по-разному экспрессировались в наивных клетках и в макрофагах, инфицированных MTB, и экспрессия 452 генов модулировалась в обоих условиях. Неудивительно, что экспрессия большего количества генов была затронута в клетках, инфицированных MTB, поскольку инфекция MTB вызывает обширное ремоделирование транскриптома (Barreiro et al., 2012; Tailleux et al., 2008). Затем мы классифицировали все эти гены, выполнив анализ обогащения набора генов. Мы показали, что экспрессия 70% лизосомного гена, дифференциально экспрессируемого в макрофагах, инфицированных MTB, также повышалась в наивных клетках после обработки BDQ. Эти результаты теперь включены в рисунки 1D и 3A. Мы также провели дополнительные эксперименты, чтобы определить, зависит ли влияние BDQ на экспрессию гена хозяина от заражения живым MTB. Вкратце, клетки не обрабатывали или стимулировали LPS (агонист TLR4), Pam3CSK4 (агонист TLR1 / 2), убитыми нагреванием бактериями, чувствительными к лекарствам MTB или BDQr-MTB и обрабатывали BDQ.Через 18 часов РНК собирали, и мы проводили RT-qPCR на панели лизосомных генов. Мы также проанализировали интенсивность окрашивания LysoTracker с помощью проточной цитометрии ( Рисунок 3 — приложение к рисунку 2 ). Наши результаты ясно показывают, что основные эффекты на биогенез / активацию лизосом происходили при лечении BDQ и не наблюдались исключительно после заражения живыми MTB.
3) Другой серьезной проблемой является отсутствие прямых доказательств того, что очевидные эффекты BDQ на рост MTB в клетках обусловлены индукцией TFEB.Это должно быть показано на мутантных клетках TFEB. Эти клетки также могут быть использованы для демонстрации того, что индукция генов, связанных с лизосомами, и усиление окрашивания лизотрекеров под действием BDQ происходит из-за активации TFEB.
Используя siRNA-опосредованное подавление гена (Troegeler et al., 2014), мы инактивировали экспрессию TFEB в макрофагах и подтвердили его главную роль в устойчивости к бактериальной инфекции после лечения BDQ. Мы также представляем анализ иммунопреципитации хроматина с антителом против TFEB.Как было предложено авторами обзора 1 и 3, мы показали, что активация TFEB требуется для (i) усиленного окрашивания LysoTracker (рис. 9G), (ii) индукции панели генов, связанных с лизосомами (рис. 9H), и (iii) лучший контроль S. aureus и инфекции MTB после обработки BDQ (рис. 9I-J).
4) Как указано рецензентом 2, необходимо показать, что синергия между BDQ и PZA на мутанте, устойчивом к BDQ, не возникает в бульоне.
Мы провели предложенный эксперимент.Как показано на фиг. 4В, мы не обнаружили синергизма между BDQ и PZA на мутанте, устойчивом к BDQ, культивированном в жидкой среде Миддлбрука 7H9.
— Необходимо указать МИК для BDQ на устойчивом мутанте.
Это было добавлено в исправленной версии. Мы определили MIC 99 (определенную как концентрацию, необходимую для предотвращения роста 99%) как дикого типа, так и устойчивых к BDQ MTB, с помощью колориметрического микротитровального анализа резазурина (Palomino et al., 2002).МИК для чувствительного MTB составляла 0,07 мкг / мл, значение аналогично ранее опубликованным исследованиям (Andries et al., 2005), а MIC 99 для BDQr-MTB составляло 36 мкг / мл.
— Рисунок 1 — в приложении к рисунку 2B отсутствует информация о том, какая концентрация BDQ была использована.
Это исправлено в новой версии.
— Рецензент 2 поднял ряд вопросов относительно данных на Рисунке 1 — дополнении к рисунку 2C, которые следует рассмотреть.
Мы благодарим рецензента за вопросы, поднятые в отношении эксперимента, показанного на Рисунке 1 — рисунок в приложении 2C, который может поставить под сомнение вирулентность как дикого типа, так и BDQ-устойчивых MTB. В предыдущей версии нашей статьи мы только количественно оценили количество внутриклеточных бактерий, исключая внеклеточные бациллы, высвобожденные из некротических клеток. Это создавало ложное впечатление, будто бактерии не размножаются внутри макрофагов. В отредактированной рукописи мы приводим новые данные из КОЕ и конфокальной микроскопии, показывающие, что MTB дикого типа и устойчивые к BDQ являются вирулентными и реплицируются внутри макрофагов (приложение к рисунку 2C-E).
— Как указано в обзоре 3, предлагаемый механизм, связывающий BDQ с кальцием и активацией TFEB, лишь слабо подтвержден данными. Авторам следует подумать о том, чтобы смягчить свои выводы по этой части статьи.
Эксперименты по хелатированию кальция проводились с BAPTA-AM, а не BAPTA (см. Наши комментарии к рецензенту № 3). Мы приносим свои извинения за эту ошибку и исправили ее в отредактированной рукописи.
Рецензент №1:
[…]
1) Транскрипционное профилирование выполняется как на инфицированных MTB, так и на неинфицированных клетках.Утверждается, что эффекты BDQ «похожи» в обеих ситуациях. Однако способ представления данных затрудняет понимание того, насколько похожи или различаются эффекты BDQ +/- MTB. Могут ли авторы представить тепловую карту (с указанием ключевых генов, в частности, лизосомной сигнатуры) со всеми четырьмя состояниями (+/- MTB, +/- BDQ) в одном анализе / панели? Если есть существенные различия, возможно, будет уместно их прокомментировать.
Благодарим рецензента за положительный отзыв и справедливые предложения.В отредактированной рукописи мы представляем новый анализ (рис. 1). Инфекция MTB вызывает важное ремоделирование транскриптома (7093 гена по-разному экспрессировались при инфицировании BDQr-MTB), поэтому неудивительно, что после обработки BDQ инфицированных MTB макрофагов изменилась экспрессия большего количества генов, чем неинфицированных макрофагов. В новой версии мы комментируем их и представляем функциональную кластеризацию аннотаций соответствующих генов (рис. 1A-B). В предыдущей версии нашей рукописи мы писали, что «мы наблюдали аналогичные результаты с неинфицированными Mφs, обработанными BDQ […], что указывает на то, что эффект BDQ не зависит от инфекции MTB».В основном мы имели в виду лизосомный путь и метаболизм липидов. 452 гена по-разному экспрессировались как в неинфицированных, так и в инфицированных МТВ клетках. Классификация этих генов с использованием анализа обогащения набора генов показывает обогащение генов, связанных с лизосомами (рис. 1C-D). Экспрессия 70% лизосомных генов, которые, как было обнаружено, дифференциально экспрессировались в клетках, инфицированных BDQr-MTB, также регулировалась в наивных клетках после обработки BDQ (рис. 3A). Как было предложено, мы добавили первую тепловую карту генов, которые наиболее активны и подавлены в наивных и MTB-инфицированных клетках, обработанных BDQ (рис. 1D), и вторую тепловую карту, сфокусированную на экспрессии лизосомных генов. во всех четырех условиях +/- MTB +/- BDQ (Рисунок 3A).
2) Недостатком рукописи является то, что прямая мишень BDQ — клетка-хозяин не идентифицирована. Таким образом, механизм, приводящий к индукции TFEB, неясен. Однако я склонен полагать, что идентификация цели BDQ выходит за рамки того, что можно было бы разумно спросить об этом исследовании. Однако, возможно, авторы могли бы хотя бы кратко обсудить, что может быть клеткой-мишенью BDQ, и признать, что они не определили ее. Кроме того, доказательства того, что эффекты BDQ требуют TFEB, являются лишь косвенными.Таким образом, было бы желательно, если это возможно, для авторов показать, например, с помощью клеток, нокаутирующих TFEB, что эффекты BDQ на индукцию связанного с лизосомами гена действительно требуют TFEB.
Обнаружение прямой мишени BDQ — клетки-хозяина было бы большим прорывом, но, к сожалению, нам не удалось идентифицировать цель. Однако возможно, что BDQ может модулировать ответ хозяина, вмешиваясь в гомеостаз ионов внутри лизосомы. Greenwood et al. Недавно показали, что BDQ накапливается в основном в липидных каплях клетки-хозяина (Greenwood et al., 2019). Возникает соблазн предположить, что эти капли на самом деле являются лизосомами. Из-за своей высокой гидрофобности BDQ может накапливаться в лизосомальных мембранах и тем самым изменять проницаемость трансмембранных ионов. В соответствии с этой гипотезой было показано, что BDQ может накапливаться на липидной мембране липосом и действовать как ионофор H + / K + (Hards et al., 2018). Последующий лизосомный стресс может затем способствовать диссоциации mTOR от лизосомальной мембраны (Plescher et al., 2015) и активация TFEB. Интересно, что BDQ увеличивает экспрессию гена муколипина 1 ( mcoln1 , Рисунок 3A и Рисунок 3 — приложение к рисунку 2A). Недавно Medina et al. показали, что лизосомальный Ca 2+ высвобождается через MCOLN1 и активирует кальциневрин, который связывает и дефосфорилирует TFEB (Medina et al., 2015) (Medina et al., 2015). Эти две гипотезы теперь упоминаются в разделе «Обсуждение» нашей статьи.
В пересмотренной рукописи мы представляем дополнительные эксперименты, включая подавление экспрессии TFEB с помощью siRNA и очистку хроматина с помощью антитела против TFEB.Результаты показывают, что для воздействия BDQ на индукцию генов, связанных с лизосомами, действительно требуется TFEB (рисунок 9 и рисунок 9 — приложение к рисунку 1).
Рецензент № 2:
[…]
1) Мне кажется вероятным, что транскрипционные (Рисунок 1) и функциональные эффекты (Рисунки 2 — BDQ на инфицированные макрофаги обусловлены косвенным влиянием на физиологию бактерий. Использование мутанта, устойчивого к BDQ, является важным экспериментом, но Я сомневаюсь, что концентрация, использованная для исследований макрофагальной инфекции (5 мкг / мл), не оказывает никакого влияния на бактерии.Эта концентрация, по-видимому, подавляет рост устойчивого мутанта Figure S1C внутри макрофагов, и это может быть связано либо с активацией антимикробных эффектов хозяина, либо с частичным ингибированием роста бактерий. Неясно, какое влияние эта концентрация оказывает на бактерии, мутант был выбран на 0,3 мкг / мл BDQ, и мне не удалось найти МИК, указанную в рукописи. На кривой роста бактерий, выращенных в аксенической культуре +/- BDQ (панель B), отсутствует какая-либо информация об используемой концентрации BDQ, и нет прямого сравнения кинетики роста между бактериями дикого типа и мутантными бактериями при 5 мкг / мл. .Более того, предполагается, что обработка 5 мкг / мл BDQ вообще не меняет бактерии, и, следовательно, любые различия должны быть связаны с модуляцией хозяина, но я думаю, что есть несколько причин сомневаться в этом.
Мы благодарим рецензента 2 за то, что он поднял вопрос, в какой степени мутант MTB устойчив к BDQ (BDQr-MTB). Сначала мы определили MIC 99 (определяемую как концентрация, необходимая для предотвращения роста 99%) как дикого типа, так и резистентных к BDQ MTB с помощью колориметрического микротитровального анализа резазурина (Palomino et al., 2002). MIC для восприимчивого MTB составлял 0,07 мкг / мл, значение, аналогичное ранее опубликованному исследованию (Andries et al., 2005), тогда как MIC 99 для BDQr-MTB составляло 36 мкг / мл. КОЕ и кривые роста как WT, так и BDQr-MTB, с различными концентрациями BDQ и без них, теперь включены в рукопись (Рисунок 1 — приложение к рисунку 2B-C). В отличие от лекарственно-чувствительных MTB, BDQrMTB продолжает расти в присутствии 5 мкг / мл BDQ, и мы наблюдали небольшое снижение роста только после 7 дней лечения.В нашей статье BDQ используется в максимальной концентрации 5 мкг / мл в течение 48 часов и 1 мкг / мл в течение 5 дней. При этих концентрациях мы не наблюдали ни уничтожения бактерий, ни уменьшения роста бактерий в жидкой среде (Рисунок 1 — Рисунок в приложении 2B-C). Мы также показываем, что бактериальная нагрузка резистентных MTB внутри макрофагов такая же, как в необработанных клетках, так и в клетках после 18 часов обработки BDQ (момент времени, выбранный для эксперимента RNAseq). Напротив, в том же эксперименте с использованием BDQ-чувствительного MTB наблюдается снижение бактериальной нагрузки на 70% (Рисунок 1 — рисунок в приложении 2C).
Мы согласны с тем, что мы не можем исключить возможность того, что BDQ может влиять на метаболизм BDQr-MTB, но кажется маловероятным, что это могло бы объяснить устойчивость макрофагов к бактериальной инфекции после лечения BDQ. Во-первых, действие BDQ может подавляться 3-MA и BAF, тогда как эти два ингибитора аутофагии не действуют на необработанные клетки (фиг. 6F). Эти результаты свидетельствуют о целевом эффекте BDQ на хозяина. Регуляция лизосомного пути с помощью BDQ, наблюдаемая в макрофагах, инфицированных MTB, также наблюдалась в наивных макрофагах и в клетках, стимулированных инактивированными нагреванием MTB или агонистами TLR LPS и Pam3CSK4 (Рисунок 3 — приложение к рисунку 2).Эти изменения не наблюдались в клетках, обработанных противотуберкулезными препаратами первой линии — этамбутолом (EMB), изониазидом (INH), пиразинамидом (PZA) и рифампицином (RIF) (новый анализ транскриптома представлен на рис. 5A-BC и рис. 6 — рис. дополнение 2, и окрашивание LysoTracker, проанализированное с помощью проточной цитометрии (рис. 5D).
Если лизис нескольких бактерий с помощью BDQ вызывает активацию макрофагов, мы ожидаем большей реакции, когда клетки стимулируются бактериями, убитыми нагреванием, или чувствительными к лекарствам MTB, чем это наблюдалось с BDQr-MTB.Опять же, как показано на фиг. 3 — приложение к рисунку 2В, мы не наблюдали никаких различий в интенсивности окрашивания LysoTracker. Аналогичные результаты были получены и при сравнении уровня экспрессии лизосомных генов.
В целом, наши результаты убедительно свидетельствуют о зависимом от хозяина эффекте BDQ.
2) Есть ряд других тревожных подробностей эксперимента, показанных на рисунке S1C. Во-первых, любопытно, что ни дикие, ни резистентные бактерии не росли очень хорошо между 18 часами и 5 днями в отсутствие BDQ.Похоже, что в лучшем случае они удваиваются, но можно было бы ожидать гораздо большего. Во-вторых, устойчивый к BDQ мутант вообще не рос в течение этого 4+ дневного курса в присутствии 5 мкг / мл BDQ. Мне кажется маловероятным, что эти эффекты BDQ связаны исключительно с активацией хоста. В-третьих, почему уровни КОЕ у мутантных бактерий намного выше, чем у бактерий дикого типа через 18 часов?
Мы благодарим рецензента за вопросы, поднятые в отношении эксперимента, показанного на предыдущем рисунке 1 — рисунок в приложении 1C, который может поставить под сомнение вирулентность как дикого типа, так и устойчивых к BDQ MTB.В предыдущей версии нашей статьи мы только количественно оценили количество внутриклеточных бактерий, исключая внеклеточную палочку, высвобожденную из некротических клеток. Это создавало ошибочное впечатление, что бактерии не размножаются внутри макрофагов. В отредактированной рукописи мы приводим новые данные из КОЕ и конфокальной микроскопии, показывающие, что МТБ дикого типа и устойчивые к BDQ являются вирулентными и реплицируются в макрофагах.
3) Кажется важным продемонстрировать на всех их бактериальных инфекциях, в том числе на Рисунке 4, что монослои макрофагов не повреждены и имеют одинаковую плотность среди всех обработок.Действительно, хотя авторы тестируют влияние BDQ на жизнеспособность макрофагов в отсутствие бактерий, кажется важным оценить его влияние во время усиленного воспалительного ответа во время инфекции.
Жизнеспособность наивных и инфицированных макрофагов, обработанных различными молекулами, используемыми в этом исследовании, оценивали с помощью анализа MTT или LDH. Как показано на Рисунке 1 — Рисунке в Приложении 1, мы не отметили токсичности соединений. Как и ожидалось, мы наблюдаем снижение жизнеспособности клеток макрофагов, инфицированных MTB, только через 48 часов после заражения.
4) Я считаю, что результаты воздействия BDQ на хозяина были бы более убедительными, если бы они могли показать, что лечение разными антибиотиками дает разные результаты.
В первоначальной версии нашей рукописи мы только проверяли, могут ли противотуберкулезные препараты первого ряда вызывать усиление окрашивания LysoTracker. Мы согласны с тем, что дальнейший анализ эффектов других препаратов на реакцию макрофагов будет более убедительным. Поэтому мы использовали RNAseq для характеристики профилей экспрессии генов наивных клеток и клеток, стимулированных убитым нагреванием MTB и обработанных этамбутолом (EMB), изониазидом (INH), пиразинамидом (PZA) или рифампицином (RIF).Мы выбрали убитые нагреванием МТБ вместо лекарственно-устойчивых МТБ по следующим причинам:
(i) Мы не можем работать с МТБ с множественной лекарственной устойчивостью на нашем предприятии BSL3, и создание устойчивых мутантов для каждого антибиотика было бы нецелесообразным с точки зрения времени для повторной подачи исправленной версии нашей рукописи.
(ii) Большинство генов, которые по-разному экспрессировались после заражения MTB, также модулируются при стимуляции убитыми нагреванием MTB ((Pacis et al., 2015) и Рисунок 6 — приложение к рисунку 1).
(iii) Активация лизосомного пути с помощью BDQ не требует заражения живым MTB, поскольку большинство лизосомных генов также дифференциально экспрессируются в наивных клетках, подвергнутых воздействию BDQ (рис. 3A).
После лечения только RIF и PZA значительно модулируют экспрессию генов в макрофагах. Гены 556 и 752 по-разному экспрессируются в клетках, стимулированных бактериями, убитыми нагреванием, и подвергнутых воздействию PZA и RIF соответственно (фиг. 5A). Мы классифицировали эти гены, выполнив анализ обогащения набора генов, и подтвердили, что гены лизосомного пути не индуцируются при обработке RIF или PZA.Экспрессия только 2 генов, принадлежащих к этому пути, была повышена с помощью RIF, и только одного — с помощью PZA, по сравнению с 46 генами, экспрессия которых модулировалась с помощью BDQ (FDR <5%, absLogFC> 0,1, рис. 5B-C и рис. 5 — дополнение к рисунку 2).
5) Авторы также проводят обработку макрофагов BDQ при отсутствии инфекции и утверждают, что активируются аналогичные пути, предполагая, что эти эффекты не зависят от присутствия бактерий. К сожалению, эти сравнения были оценены на уровне аннотации пути GO, и я твердо уверен, что если BDQ напрямую активирует экспрессию гена, возможно, через PTFB, то сравнение следует проводить на уровне гена, т.е.е. как показано на рисунке 2A.
В отредактированной рукописи мы представляем новые данные, сравнивающие уровень экспрессии генов во всех четырех условиях (+/- BDQ и +/- MTB), и, как было предложено рецензентом 2, мы показываем тепловую карту с дифференциально экспрессируемыми связанными генами. с лизосомным путем (рис. 3А). Экспрессия 70% генов лизосомного пути, дифференциально экспрессируемых в MTB-инфицированных макрофагах, также повышалась в наивных клетках после обработки BDQ.
Мы также провели дополнительные эксперименты, чтобы продемонстрировать, что эффекты BDQ на экспрессию гена-хозяина не зависят от заражения живым MTB.Вкратце, клетки не обрабатывали или стимулировали LPS (агонист TLR4), Pam3CSK4 (агонист TLR1 / 2), убитыми нагреванием бактериями, чувствительными к лекарствам MTB или BDQr-MTB и обрабатывали BDQ. Через 18 ч РНК собирали и проводили ОТ-кПЦР на панели лизосомных генов. Мы также проанализировали интенсивность окрашивания LysoTracker с помощью проточной цитометрии (рисунок 3 — приложение к рисунку 1). Результаты ясно показывают, что эффект BDQ на биогенез / активацию лизосом не зависит от инфекции MTB и стимуляции Toll-подобных рецепторов.
6) Я считаю, что вывод, сделанный из очевидной синергии между PZA и BDQ, вводит в заблуждение по двум причинам. Прежде всего, учитывая остаточную чувствительность устойчивого мутанта к высоким уровням BDQ, кажется необходимым, чтобы этот синергетический эффект был протестирован в культуре. Во-вторых, учитывая модель, согласно которой BDQ активирует антимикробную активность хозяина, я ожидаю, что BDQ также будет синергетически взаимодействовать с другими антибиотиками, помимо PZA.
Мы проверили синергизм между BDQ и PZA в культуральной жидкой среде, используя возрастающие концентрации PZA (от 0 до 400 мкг / мл) с или без BDQ (1 мкг / мл).При этой концентрации BDQ рост BDQr-MTB не зависит от BDQ в течение 12 дней (рисунок 1 — приложение к рисунку 2B), и мы наблюдали усиление окрашивания DQ-BSA в макрофагах (рисунок 3F). Мы не наблюдали синергизма между BDQ и PZA в культуральной жидкой среде, что свидетельствует о механизме зависимости от хозяина. Затем мы проверили, будет ли BDQ синергетически взаимодействовать с другими противотуберкулезными препаратами первой линии в жидкой культуре или в макрофагах, инфицированных BDQr-MTB, и обнаружили, что BDQ не усиливает активность INH, RIF и EMB в любом случае.Хотя мы не можем исключить возможность того, что BDQ может иметь аддитивный эффект с другими противотуберкулезными препаратами, как было описано (Ibrahim et al., 2007), мы не обнаружили доказательств синергизма с какими-либо препаратами первого ряда (Рисунок 4— Приложение к рисунку 1).
7) Большая часть результатов лизосом на рисунке 2 осложняется легкой чувствительностью устойчивого штамма к BDQ. Один интересный эксперимент — это отсутствие инфекции в панели G, но есть только корреляция, нет никаких доказательств при условии, что это эффект хозяина от BDQ.
В пересмотренной версии мы добавляем новый дополнительный рисунок, описывающий регуляцию лизосом в неинфицированных клетках (Рисунок 3 — рисунок в приложении 1). Как мы упоминаем в тексте, биогенез / активация лизосом увеличивается как в наивных, так и в инфицированных BDQr-MTB макрофагах после обработки BDQ.
Рецензент № 3:
[…]
1) Предлагаемый механизм усиления бактерицидной активности осуществляется через TFEB, но единственное представленное доказательство является коррелятивным (иммунофлуоресценция TFEB, показывающая TFEB в ядре).Это должно быть непосредственно протестировано с использованием подходов с потерей функции.
Чтобы изучить роль TFEB в усилении бактерицидной активности после обработки BDQ, мы инактивировали экспрессию TFEB в макрофагах, происходящих из моноцитов человека, с помощью siRNA-опосредованного сайленсинга генов (Troegeler et al., 2014). После обработки клеток BDQ мы выполнили RTqPCR на панели лизосомных генов и проанализировали интенсивность окрашивания LysoTracker с помощью проточной цитометрии. В клетках с подавленным TFEB BDQ не увеличивает окрашивание LysoTracker (фиг. 9G), ни экспрессию trpm2 , scarb1 , atp6v0a1 или mcoln1 (фиг. 9H).Мы также заразили макрофаги S. aureus и MTB и показали, что активация TFEB требуется для лучшего контроля обоих патогенов при лечении BDQ (рис. 9I-J). Кроме того, мы представляем анализ иммунопреципитации хроматина с использованием антител против TFEB (см. Комментарий ниже).
2) Аналогичным образом, значение RNAseq, LysoTracker и TFEB IF состоит в том, что TFEB активирует гены, ответственные за биогенез лизосом и аутофагию, тем самым увеличивая бактериальный клиренс.Индуцируемое привлечение TFEB к соответствующим промоторам должно быть проверено напрямую.
Мы оценили привлечение TFEB к промоторам некоторых лизосомных генов. Вкратце, наивные и убитые нагреванием стимулированные клетки, обработанные BDQ, лизировали, хроматин собирали и фрагментировали с помощью обработки ультразвуком. Затем хроматин подвергали иммунопреципитации с использованием антитела против TFEB. Затем выделенную ДНК анализировали с помощью RT-qPCR с праймерами, специфичными для промоторов gla и mcoln1 .Как и ожидалось, BDQ индуцирует рекрутирование TFEB на эти промоторы (Рисунок 8 — рисунок в приложении 1).
3) Механизм, связывающий BDQ с высвобождением кальция и активацией TFEB, не показан. Также не требуется кальциневрин.
К сожалению, нам не удалось идентифицировать механизм, связывающий BDQ с активацией TFEB.
Greenwood et al. Недавно показали, что BDQ накапливается в основном в липидных каплях клетки-хозяина (Greenwood et al., 2019).Возникает соблазн предположить, что эти капли на самом деле являются лизосомами. Из-за своей высокой гидрофобности BDQ может накапливаться в лизосомальных мембранах и тем самым изменять проницаемость трансмембранных ионов. В соответствии с этой гипотезой было показано, что BDQ может накапливаться на липидной мембране липосом и действовать как ионофор H + / K + (Hards et al., 2018). Последующий лизосомный стресс может затем способствовать диссоциации mTOR от лизосомальной мембраны (Plescher et al., 2015) и активация TFEB. Интересно, что BDQ увеличивает экспрессию гена муколипина 1 ( mcoln1 , Рисунок 3A и Рисунок 3 — приложение к рисунку 2A). Недавно Medina et al. показали, что лизосомальный Ca 2+ высвобождается через MCOLN1 и активирует кальциневрин, который связывает и дефосфорилирует TFEB (Medina et al., 2015). Эти две гипотезы теперь упоминаются в разделе «Обсуждение».
4) Хотя синергетический эффект BDQ с PZA, кажется, приближается к 1 логарифму (~ 10% выживаемости) убийства M.tuberculosis, величина эффекта одного BDQ (рис. 3F) довольно мала. Это поднимает вопрос о том, насколько важны эти наблюдения для туберкулеза. Это важно, поскольку вся установка направлена на поиск новых терапевтических средств для борьбы с МЛУ-ТБ.
На предыдущем рисунке 3F мы использовали низкую концентрацию BDQ (1 мкг / мл), чтобы различать аддитивный и синергический эффект. При более высокой концентрации BDQ (5 мкг / мл, концентрация, обнаруженная в плазме пациентов с ТБ, получавших BDQ (Andries et al., 2005)), мы наблюдали снижение количества жизнеспособных бактерий на 50% (теперь на Рисунке 6F).
5) Авторы используют BAPTA (внеклеточный) для удаления кальция и тестирования влияния потери активации TFEB на бактериальные КОЕ. Это сделано с S. aureus (не TB). Кроме того, если они действительно используют BAPTA, они не будут ингибировать высвобождение внутриклеточного кальция, а будут его импортировать из внеклеточных запасов, что изменит интерпретацию эксперимента.
Эксперименты по хелатированию кальция проводили с BAPTA-AM, а не BAPTA.Мы приносим свои извинения за эту ошибку и исправили ее в отредактированной рукописи. В отличие от BAPTA, который представляет собой непроницаемый для мембран хелатор кальция, который связывает внеклеточные ионы кальция, BAPTA-AM является проницаемым для клеток аналогом BAPTA, который связывает кальций только после того, как ацетоксиметильная группа удаляется цитоплазматическими эстеразами (Tymianski et al., 1994). Он очень селективен в отношении Ca 2+ по сравнению с Mg 2+ и обычно используется для оценки роли внутриклеточного Ca 2+ в передаче сигналов в клетке.
[Примечание редакции: далее следует ответ авторов на второй этап рецензирования.]
Рецензент №1:
[…]
Мой единственный вопрос касается новых данных (рис. 7), показывающих, что человеческие макрофаги индуцируют нитрит, который, по утверждениям авторов, происходит от NO хозяина. Насколько мне известно, было довольно сложно продемонстрировать индукцию NO человеческими макрофагами в культуре. В некоторых случаях наблюдаемый NO2 на самом деле продуцируется самими бактериями (см. Bussel, Zhang and Nathan, 2013).Авторы могут захотеть это учесть.
Мы благодарим рецензента за его / ее положительные комментарии и предложения, которые позволили нам значительно улучшить нашу рукопись. Мы согласны с тем, что роль NO в ингибировании роста M. tuberculosis у человека является спорной. Однако на рисунке 7D мы количественно определили NO2- в неинфицированных клетках после обработки BDQ, что исключает оксид азота, продуцируемый бактериями.
https://doi.org/10.7554/eLife.55692.sa2антибиотиков | Бесплатный полнотекстовый | Язвы диабетической стопы: современные достижения в области антимикробной терапии и новых методов лечения
DFU определяются как поражения стопы (язвы), которые могут поражать кожу, мягкие ткани и кости нижних конечностей, вызывая отягчающую инфекцию у пациентов с диабетом, которая может привести к очень серьезным заболеваниям. такие последствия, как ампутации нижних конечностей. DFU вызываются многофакторной этиологией как часть микрососудистых осложнений сахарного диабета, которые могут привести к серьезным ампутациям, в большинстве случаев из-за отсутствия своевременного и правильного лечения диабетической стопы.Действительно, диабет является ведущей причиной нетравматических ампутаций нижних конечностей во всем мире [1]. Эти серьезные последствия в основном связаны с отсутствием данных по многим вопросам, включая диабетическое просвещение, профилактические меры, гликемический контроль, сопутствующие заболевания, несоответствующую междисциплинарную оценку и лечение язв, а также более поздние неудачи лечения для предотвращения рецидива язвы [4]. На основании данных Международной федерации диабета о распространенности заболевания за 2015 г., язвы стопы развиваются у 9 человек.От 1 миллиона до 26,1 миллиона человек ежегодно страдают диабетом во всем мире [3]. Систематический обзор и метаанализ глобальной распространенности DFUs показал, что глобальная распространенность DFU составила 6,3%, выше у мужчин, чем у женщин, и выше у пациентов с диабетом 2 типа, чем у пациентов с диабетом 1 типа [2]. В Мексике зарегистрировано около 12 миллионов случаев сахарного диабета, и, поскольку общая распространенность DFU составляет 6%, по оценкам, более 700 000 человек страдают DFU любой степени [5]. Во всем мире лечение DFU дорого обходится.В Соединенных Штатах (США) эта стоимость колеблется от 8000 до 17000 долларов в зависимости от степени инфекции и типа ампутации, при этом стоимость возрастает от 43000 долларов в случае частичной ампутации до 63 100 долларов после обширной ампутации [6]. Все эти расходы влияют не только на экономическое и психологическое состояние пациента, но и на экономику семьи, инвалидность пациента и снижение качества жизни, а также на финансовые средства, предоставляемые государством, и медицинское страхование, предназначенное для лечения диабета.Сообщается, что у пациентов с диабетом в большинстве случаев (60–80%) язвы становятся менее агрессивными и при надлежащем уходе заживают. С другой стороны, от 10% до 15% этих язв остаются активными, а от 5% до 24% приводят к ампутации конечности примерно через 6–18 месяцев [1]. До 40% пациентов имеют рецидив в течение одного года после заживления язвы, почти 60% имеют рецидив в течение трех лет и 65% имеют рецидив в течение пяти лет, что делает предыдущий случай язвы стопы самым сильным предиктором диабета. изъязвление стопы [3].Среднее время заживления без хирургического вмешательства составляет около 12 недель [4]. Пятилетний риск смерти у пациентов с диабетом в 2,5 раза выше у пациентов с DFU, чем без них, а пятилетняя смертность после ампутаций, связанных с диабетом, превышает 70%, что хуже, чем при многих распространенных формах рака [3,4] . Остеомиелит — еще одно серьезное осложнение DFU, и от него необходимо отказаться у каждого пациента с инфицированными DFU. Полная оценка с измерением артериального давления и лабораторными исследованиями для общего количества клеток крови, креатинина, гликозилированного гемоглобина, скорости оседания эритроцитов, уровня С-реактивного белка и лодыжечно-плечевого индекса (ЛПИ, нормальный 0.8–1.2), а также визуализацию (рентген и МРТ), а в некоторых случаях можно рассмотреть возможность проведения биопсии кости. Это осложнение отражает плохие программы медицинского обслуживания в учреждениях, оказывающих первичную медико-санитарную помощь, поскольку первичная медико-санитарная помощь обычно не предусматривает обследования стоп во время обычных визитов в офис, а время является основным фактором, препятствующим рутинным оценкам стоп [7]. тяжелая нейропатия обычно имеет более высокий порог механической боли, чем пациенты с диабетом без нее [9].Наличие инфекции является наиболее частой причиной ампутации, поскольку инфицирование происходит у пациентов с тяжелыми инфекциями, большим количеством потерянных тканей и системной дисфункцией органов. Анемия (гемоглобин 10). В Мексике в качестве факторов риска большой ампутации были указаны следующие факторы: лейкоцитоз (> 9), низкий уровень сывороточного альбумина (7) и хроническое заболевание почек в K / DOQI (Инициативы по качеству исходов заболеваний почек) с K / DOQI-III является наиболее частой стадией. Также было обнаружено, что наиболее пораженными DFU областями были передняя часть стопы (48%) и подошвенная область (55%) стопы.У большинства пациентов были поздние стадии ДФУ, при которых 93% поражений относились к III – V степени по классификации Вагнера [11]. В 2016 году в отчете были обнаружены доказательства того, что гемоглобин A1c (HbA1c) 12]. Факторы, связанные с плохим заживлением, включают запущенное заболевание органов-мишеней (застойная сердечная недостаточность, заболевание периферических артерий или терминальная стадия заболевания почек) [3]. Следовательно, крайне важно инвестировать в исследования новых методов лечения, диагностики и технологий, предназначенных для DFU [4]. Сложность физиопатологии DFU и отсутствие единых критериев очевидны в разнообразии и количестве существующих классификаций.Американская диабетическая ассоциация (ADA) рекомендует критерии или переменные для идеальной классификации DFU. Эти критерии включают определение этиологии, размера, глубины и отека, а также определение перилезионного повреждения, состояния и степени инфекции, сосудистых и неврологических факторов, тяжести травмы, а также прогноза и рекомендаций по ведению и лечению. Эта классификация также должна способствовать общению между медицинскими работниками и пониманию пациента и его семьи [13].Однако существуют различные системы классификации DFU, рекомендованные ADA, которые предлагают руководство по необходимому лечению (Таблица 1).2.2. DFU Infection
По данным Международной рабочей группы по диабетической стопе, инфекция — это инвазия и размножение патогенных микроорганизмов в тканях тела [20]. Инфекции диабетической стопы (DFI) увеличивают заболеваемость и могут привести к ампутации конечностей. Инфекции в DFUs — частые и серьезные осложнения язв [21,22].Подсчитано, что 50% DFU инфицированы при поступлении [21,22], а 80% нетравматических ампутаций нижних конечностей являются следствием DFU-инфекции [21,22]. Пациенты с DFI обычно госпитализируются несколько раз и часто получают несколько курсов антибиотиков [23]. Раневые инфекции являются фактором задержки в процессе заживления, и, если их не лечить должным образом, они могут привести к системным нарушениям [21,22]. Различные аспекты микробиологии ран ответственны за развитие инфекции стопы.К ним относятся микробная нагрузка, разнообразие микробов, существование инфекционных организмов и синергетическая ассоциация между видами микробов. Считается, что инфекция возникает, когда микробная нагрузка превышает 105 организмов на грамм ткани [17]. Открытая ткань, оставленная DFU, затем становится мишенью для кожных комменсальных бактерий, которые могут колонизировать рану, хотя, поскольку колонизация не вызывает надлежащего иммунологического ответа хозяина, это нельзя назвать инфекцией [24]. На рисунке 1 показано, что фактор срабатывания внешний.Эти факторы могут быть физическими, химическими и механическими. Ишемия, нейропатия, отек, инфекция и слабый иммунный ответ вызывают сложные и очень трудно заживающие раны или язвы [25], которые предрасполагают к инфекциям диабетической стопы. Очень важно оценить язвенную инфекцию на основе рекомендаций Американского общества инфекционных болезней (IDSA) и классификации DFI [16]. Диагноз инфекции ставится на основании клинического наблюдения и основан на наличии как минимум двух из следующих признаков: воспаление, уплотнение, перилезионная эритема, гиперестезия, боль, местное тепло и гнойный экссудат (таблица 1) [26].Документально подтверждено, что 78% пациентов с ДФУ также имеют ЗПА [19]. Дисфункция эндотелиальных клеток является наиболее важным признаком дисфункции микроциркуляции, так как приводит к уменьшению количества вазодилататоров, особенно синтеза оксида азота. Кроме того, уровни тромбоксана А2 в плазме повышаются с последующей стойкой вазоконстрикцией и гиперкоагуляцией плазмы, что приводит к повышенному риску ишемии и изъязвления [14,16].2.2.1. Микробиота в DFU
Микробиота в DFU в значительной степени изучена.Эта микробиота в основном зависит от иммунного статуса хозяина и его физиопатологических особенностей. Преимущественно идентифицированные бактерии в DFU показаны в таблице 2. Полимикробная природа (состоящая из грамотрицательных и грамположительных бактерий, анаэробных бактерий и некоторых грибов) хронических ран, таких как DFU, недавно описанная с использованием молекулярных методов, является барьером против традиционные методы бактериального культивирования, которые долгое время были нацелены на то, что считалось единственным присутствующим микроорганизмом (грамположительные бактерии) [24].Также сообщалось о различии микробной популяции между диабетическими и недиабетическими язвами, и обнаруженные бактерии были грамотрицательными и грамположительными [33]. Другой автор сообщил о преобладании грамотрицательных бактерий над грамположительными (59% и 41%) при микробиологической оценке DFI [27]. В DFU также есть «любимые места» для микроорганизмов, которые характеризуются потреблением кислорода. Например, аэробные бактерии локализуются на верхней поверхности, где содержание кислорода относительно высокое, в то время как анаэробы локализуются более глубоко в нишах, созданных аэробным потреблением кислорода [34].Из всех микроорганизмов, присутствующих в DFU, наиболее часто выделяемой грамположительной бактерией во всем мире является Staphylococcus aureus, а наиболее часто выделяемой грамотрицательной бактерией — виды Pseudomonas (spp.), За которыми следуют Escherichia coli, Proteus spp., Enterobacter spp. и Citrobacter spp. [23,27,28,29]. В исследовании характеристик микробиома новых и рецидивирующих DFU с использованием секвенирования ампликона 16S (16S AS) S. aureus был выделен в 72% образцов с положительной культурой, тогда как наиболее часто обнаруживаемыми бактериями во всех язвах были Peptoniphilus spp., Anaerococcus spp. И Corynebacterium spp. [35]. География играет важную роль в этиологии DFUs. Сообщается, что в западных странах основными микроорганизмами являются грамположительные аэробные кокки; однако в более теплых местах (особенно в Азии и Африке) грамотрицательные бациллы более распространены. В Мексике основной бактерией, выделенной стандартными методами, был S. aureus, [34]. В Бангладеш было обнаружено, что наиболее распространенными бактериями в образцах DFU были Pseudomonas spp. (22/29%), Enterobacter spp.(22/7%) и Staphylococcus spp. (13/13%) [32]. Кроме того, в исследовании, проведенном в Индии, грамотрицательные патогены оказались наиболее преобладающими (58,5%) [31], что свидетельствует о распространенности грамотрицательных бактерий в странах Востока. Основными анаэробами, выделяемыми до 95% глубоких диабетических ран, являются Peptostreptococcus spp., Bacteroides spp. И Prevotella spp. [24], преимущественно наблюдается при ПФИ с более глубокими, хроническими язвами, связанными с ишемией, некрозом, гангреной или неприятным запахом [30,31].2.2.2. Биопленка
По определению, биопленка — это высокоорганизованная структура бактериальных сообществ, укорененных в экстраполисахаридной матрице с трансформированными фенотипом и моделями роста. Образование биопленок — еще один фактор, приводящий к хронизации ран диабетической стопы. Биопленка очень замедляет процесс заживления ран и затрудняет устранение инфекции, поскольку локальный доступ противомикробных препаратов и иммунной системы хозяина затруднен. Проспективное исследование показало, что биопленки образовывались преимущественно Staphylococcus aureus, а микроорганизмы, вызывающие хронические DFU, обычно имели множественную лекарственную устойчивость [17,24,28].2.2.3. Диагностика инфекций DFU
Существует два основных подхода к диагностике инфекций DFU: микробиологический и молекулярный.
Микробиологические подходы
Крайне важно изолировать микроорганизмы, вызывающие ПФИ, для проведения соответствующего лечения. Для сбора образцов из глубоких тканевых ран используются четыре основных метода. Эти методы включают аспирацию иглой, мазки, биопсию ткани (наиболее удобный и стандартный метод) и выскабливание после хирургической обработки раны.Из-за опасения инфекционного роста и потери прилегающей ишемизированной или здоровой ткани биопсия — очень сложная и деликатная процедура. С другой стороны, с посевом из мазков можно управлять, поскольку сбор образцов становится проще и их можно брать из любой раны. Однако посевы мазков иногда ненадежны, поскольку они обычно включают колонизирующие, но не причинные патогены. Традиционные посевы мазков из раны плохо коррелируют с культурами биопсии тканей и часто приводят к чрезмерному использованию и ненаправленной антимикробной терапии, повышая множественную резистентность бактерий.Таким образом, методы сбора образцов играют решающую роль в идентификации бактериальных культур [17,24]Молекулярные подходы
Инструменты молекулярной биологии предоставляют мощные средства для определения микробных сообществ в хронических ранах. Существенное микробное разнообразие можно выявить в одном клиническом образце с помощью некультурального секвенирования бактериальной ДНК. Идентификация бактериального микробиома стала возможной благодаря открытию последовательности рибосомной ДНК 16S, известной как «универсальный праймер».Идентификация бактериальной ДНК осуществляется путем амплификации и секвенирования ДНК 16S. Затем проводится сравнение между идентифицированными фланкирующими последовательностями и группой известных бактериальных последовательностей из виртуальной библиотеки, которые затем определяют бактериальный вид; с помощью некоторых стандартов можно оценить бактериальную нагрузку. Одним из наиболее важных преимуществ молекулярных подходов по сравнению с традиционными бактериальными культурами является время, затрачиваемое на идентификацию бактерий, поскольку обнаружение микробов возможно в тот же день, когда взят образец, без времени, необходимого для роста бактерий в культуре или давление экологического отбора, присущее процессам культивирования.Молекулярные методы развиваются и становятся все доступнее и доступнее. Теперь можно использовать бактериальную ДНК из раневого участка для идентификации присутствующих патогенов; Следовательно, этот метод должен быть доступен для большинства диабетиков, чтобы обеспечить лучшую микробиологическую оценку ран [17,24].2.2.4. Бактерии с множественной лекарственной устойчивостью
Множественная бактериальная устойчивость к сильнодействующим и новым лекарствам ставит под вопрос клинические критерии и систематизацию знаний и ухода за пациентами.Во всем мире развиваются бактерии с множественной лекарственной устойчивостью, в основном из-за ненадлежащего использования антибиотиков [23]. Эмпирическая противомикробная терапия — это загадка, основанная на опыте, и она должна охватывать устойчивые штаммы микробов, такие как метициллин-устойчивый золотистый стафилококк (MRSA), Pseudomonas и анаэробы. Открыто опубликованные данные свидетельствуют о том, что нет причин назначать антибактериальную терапию для неинфицированной раны стопы в качестве профилактики инфекции или в надежде, что она ускоряет заживление раны [36].В исследовании, проведенном в Бангладеш, большинство изолятов от пациентов с DFI обычно были устойчивы к цефалоспорину (цефтазидим, цефтриаксон, цефуроксим) и карбапенему (азтреонам) [32]. В Мексике наименее эффективными антибиотиками для грамположительных бактерий, выявленных в DFI, были пенициллин и диклоксациллин; для грамотрицательных бактерий цефалотин и пенициллин были наименее эффективными. Левофлоксацин, цефалотин и амикацин были наиболее эффективными антибиотиками для грамположительных и грамотрицательных бактерий соответственно, и 50% штаммов были предположительно устойчивы к ванкомицину [34].В таблице 3 представлена сводная информация о наиболее распространенных бактериях, выделенных из DFI, и о более или менее эффективных антибиотиках в каждой географической локализации.Сепсис: механизмы бактериального поражения пациента | Скандинавский журнал травм, реанимации и неотложной медицины
ВАЗ принимает резолюцию по сепсису. Йена, Германия: Глобальный альянс по сепсису, 26 мая 2017 г. (https://www.global-sepsis-alliance.org/news/2017/5/26/wha-adopts-resolution-on-sepsis).
Ли ЧР, Ли Дж.Х., Пак К.С., Ким И.Б., Чжон Британская Колумбия, Ли Ш.Глобальное распространение Klebsiella pneumoniae, продуцирующей карбапенемазу: эпидемиология, генетический контекст, варианты лечения и методы обнаружения. Front Microbiol. 2016; 7: 895.
PubMed PubMed Central Google Scholar
Ли XZ, Никайдо Х. Лекарственная устойчивость у бактерий, опосредованная оттоком: обновленная информация. Наркотики. 2009. 69 (12): 1555–623.
CAS PubMed PubMed Central Статья Google Scholar
Cirz RT, Chin JK, Andes DR, de Crécy-Lagard V, Craig WA, Romesberg FE. Подавление мутаций и борьба с развитием устойчивости к антибиотикам. PLoS Biol. 2005; 3 (6): e176.
PubMed PubMed Central Статья CAS Google Scholar
Robicsek A, Jacoby GA, Hooper DC. Появление во всем мире плазмид-опосредованной устойчивости к хинолонам. Lancet Infect Dis. 2006. 6 (10): 629–40.
CAS PubMed Статья PubMed Central Google Scholar
Fleischmann C, Scherag A, Adhikari NKJ, et al. Оценка глобальной заболеваемости и смертности от госпитализированного сепсиса: текущие оценки и ограничения. Am J Respir Crit Care Med. 2016; 193: 259–72.
CAS PubMed Статья PubMed Central Google Scholar
Рейнхарт К., Дэниэлс Р., Киссун Н., Мачадо Ф.Р., Шахтер Р.Д., Финфер С. Признание сепсиса глобальным приоритетом здравоохранения — резолюция ВОЗ. N Engl J Med.2017; 377: 414–7.
PubMed Статья PubMed Central Google Scholar
Деллинджер Р.П., Карлет Дж. М., Мазур Х., Герлах Х., Каландра Т., Коэн Дж. И др. Пережить сепсис: рекомендации кампании по ведению тяжелого сепсиса и септического шока. Crit Care Med. 2004. 32: 858–73.
PubMed Статья PubMed Central Google Scholar
Винсент Дж. Л., Маршалл Дж. К., Намендис-Силва С. А. и др.Оценка мирового бремени критических заболеваний: аудит интенсивной терапии над нациями (ICON). Ланцет Респир Мед. 2014; 2: 380–6.
PubMed Статья PubMed Central Google Scholar
Opal SM. Эволюция понимания сепсиса, инфекции и реакции хозяина: краткая история. Crit Care Clin. 2009. 25 (4): 637–63.
PubMed Статья PubMed Central Google Scholar
Деллинджер Р.П., Леви М.М., Родос А., Аннан Д., Герлах Х. и др. Кампания по выживанию после сепсиса: международные рекомендации по ведению тяжелого сепсиса и септического шока: 2012 г. Crit Care Med. 2013; 41: 580–637.
PubMed Статья PubMed Central Google Scholar
Сунг Дж., Сони Н. Сепсис: распознавание и лечение. Clin Med. 2012; 12: 276–80.
CAS Статья Google Scholar
Siddiqui S, Razzak J. Ранняя и поздняя госпитализация в отделении предварительной интенсивной терапии антибиотики широкого спектра действия при тяжелом сепсисе у взрослых. Кокрановская база данных Syst Rev.2010; 10: CD007081.
Google Scholar
Textoris J, Wiramus S, Martin C, Leone M. Обзор антимикробной терапии в отделениях интенсивной терапии. Expert Rev Anti-Infect Ther. 2011; 9: 97–109.
PubMed Статья PubMed Central Google Scholar
Garnacho-Montero J, Ortiz-Leyba C, Herrera-Melero I, Aldabó-Pallás T, Cayuela-Dominguez A, Marquez-Vacaro JA, Carbajal-Guerrero J, Garcia-Garmendia JL. Смертность и заболеваемость, связанные с неадекватной эмпирической антимикробной терапией у пациентов, поступивших в отделение интенсивной терапии с сепсисом: согласованное когортное исследование. J Antimicrob Chemother. 2008. 61 (2): 436–41.
CAS PubMed Статья PubMed Central Google Scholar
Аланис А.Дж.Устойчивость к антибиотикам: мы живем в постантибиотическую эру? Arch Med Res. 2005; 36: 697–705.
PubMed Статья PubMed Central Google Scholar
Спеллберг Б., Бартлетт Дж. Г., Гилберт Д. Н.. Будущее антибиотиков и резистентности. N Engl J Med. 2013. 368 (4): 299–302.
CAS PubMed PubMed Central Статья Google Scholar
Бхуллар К., Ваглехнер Н., Павловски А. и др.Устойчивость к антибиотикам преобладает в изолированном микробиоме пещеры. PLoS One. 2012; 7 (4): e34953.
CAS PubMed PubMed Central Статья Google Scholar
Kendrick SFW, Jones DEJ. Механизмы врожденного иммунитета при сепсисе. В: Бодуэн С.В., редактор. Сепсис; 2008. с. 5–10.
Google Scholar
Hoebe K, Janssen E, Beutler B. Интерфейс между врожденным и адаптивным иммунитетом.Nat Immunol. 2004; 5: 971–4.
CAS PubMed Статья PubMed Central Google Scholar
Mackaness GB. Иммунологические основы приобретенной клеточной резистентности. J Exp Med. 1964; 120: 105–20.
CAS PubMed PubMed Central Статья Google Scholar
Мынасян Х. Фагоцитоз и оксицитоз: две стороны врожденного иммунитета человека.Immunol Res. 2018; 66: I 271–80.
Артикул CAS Google Scholar
Минасян Х. Механизмы и пути удаления бактерий из кровообращения при здоровье и болезнях. Патофизиология. 2016; 23: 61–6.
PubMed Статья PubMed Central Google Scholar
Минасян Х. Сепсис и септический шок: патогенез и перспективы лечения.J Crit Care. 2017; 18 (40): 229–42.
Артикул CAS Google Scholar
Минасян Х. Эритроциты и лейкоциты: два партнера в уничтожении бактерий. Int Rev Immunol. 2014. 33 (6): 490–7.
CAS PubMed Статья PubMed Central Google Scholar
Робертс И.С. Биохимия и генетика образования капсульных полисахаридов у бактерий.Annu Rev Microbiol. 1996. 50: 285–315.
CAS PubMed Статья PubMed Central Google Scholar
Офир Т., Гутник Д.Л. Роль экзополисахаридов в защите микроорганизмов от высыхания. Appl Environ Microbiol. 1994; 60: 740–5.
CAS PubMed PubMed Central Google Scholar
Houdt RV, Michiels CW. Роль структур бактериальной клеточной поверхности в формировании биопленок Escherichia coli.Res Microbiol. 2005; 156: 626–33.
PubMed Статья CAS PubMed Central Google Scholar
Campos MA, Vargas MA, Regueiro V, Llompart CM, Sebastian A, Bengoechea JA. Капсульный полисахарид обеспечивает устойчивость бактерий к антимикробным пептидам. Заражение иммунной. 2004; 72: 7107–14.
CAS PubMed PubMed Central Статья Google Scholar
Smith HE, Damman M, van der Velde J, Wagenaar F, Wisselink H, Stockhofe-Zurwieden N, Smits M. Идентификация и характеристика локуса cps Streptococcus suis серотипа 2: капсула защищает от фагоцитоза и является важным фактором вирулентности . Заражение иммунной. 1999; 67: 1750–6.
CAS PubMed PubMed Central Google Scholar
Кумар А., Schweizer HP. Устойчивость бактерий к антибиотикам: активный отток и пониженное поглощение.Adv Drug Deliv Rev.2005; 57: 1486–513.
CAS PubMed Статья PubMed Central Google Scholar
Delcour AH. Проницаемость внешней мембраны и устойчивость к антибиотикам. Biochim Biophys Acta. 2009; 1794: 808–16.
CAS PubMed Статья PubMed Central Google Scholar
Cheng K, Ren L, Tsai K. Концентрация канамицина в присутствии ppGpp-синтазы RelA обеспечивает защиту от последующих летальных атак антибиотиков в E.coli CP78. J Exp Microbiol Immunol. 2010; 14: 51–6.
Google Scholar
Cho S, Law J, Ng CK. Влияние роста канамицина при сублетальных концентрациях на целостность клеточной мембраны и количество капсулярной глюкароновой кислоты у Escherichia coli дикого типа и штамма с мутацией cpsB. J Exp Microbiol Immunol. 2009; 13: 29–35.
Google Scholar
Naimi I, Nazer M, Ong L, Thong E.Роль wza в уровнях внеклеточного капсульного полисахарида при воздействии сублетальных доз стрептомицина. J Exp Microbiol Immunol. 2009; 13: 36–40.
Google Scholar
Фишер Э., Браун В. Барьер проницаемости оболочек бактериальных клеток как причина устойчивости к антибиотикам. Immun Infekt. 1981. 9 (3): 78–87.
CAS PubMed PubMed Central Google Scholar
Сухитасри В., Ниша Н., Бисвас Л., Анил Кумар В., Бисвас Р. Врожденное иммунное распознавание компонентов микробной клеточной стенки и микробные стратегии уклонения от такого распознавания. Microbiol Res. 2013; 168: 396–406.
CAS PubMed Статья PubMed Central Google Scholar
Адамс Д.В., Эррингтон Дж. Деление бактериальных клеток: сборка, обслуживание и разборка Z-кольца. Nat Rev Microbiol. 2009; 7: 642–53.
CAS PubMed Статья PubMed Central Google Scholar
Аллан Э. Дж., Хойшен С., Гумперт Дж. Бактериальные L-формы. Adv Appl Microbiol. 2009; 68: 1–39.
CAS PubMed Статья PubMed Central Google Scholar
Mercier R, Kawai Y, Errington J. Общие принципы образования и распространения у бактерий состояния, свободного от стенок (L-формы). eLife. 2014; 3: 642.
Артикул Google Scholar
Робертс РБ.Получение L-форм Neisseria meningitidis антибиотиками. Exp Biol Med. 1967. 124 (2): 611–5.
CAS Статья Google Scholar
Yamamoto A, Homma JY. L-форма синегнойной палочки. II антибиотикочувствительность L-форм и их родительских форм. Jpn J Exp Med. 1978; 48: 355–62.
CAS PubMed PubMed Central Google Scholar
Onwuamaegbu ME, Belcher RA, Soare C. Бактерии с дефицитом клеточной стенки как причина инфекций: обзор клинического значения. J Int Med Res. 2005; 33: 1–20.
CAS PubMed Статья PubMed Central Google Scholar
Холл-Стодли Л., Костертон Дж. В., Стодли П. Бактериальные биопленки: от окружающей среды до инфекционных заболеваний. Nat Rev Microbiol. 2004. 2 (2): 95–108.
CAS Статья Google Scholar
Stoodley P, Sauer K, Davies DG, Costerton JW. Биопленки как сложные дифференцированные сообщества. Annu Rev Microbiol. 2002; 56: 187–209.
CAS PubMed Статья PubMed Central Google Scholar
Эрнандес-Хименес Э, дель Кампо Р., Толедано В., Вальехо-Кремадес МТ, Муньос А., Ларго С., Арналич Ф., Гарсия-Рио Ф, Куббилос-Сапата С., Лопес-Колласо Е. Биопленка vs. планктонный бактериальный способ роста: какие макрофаги человека предпочитают? Биохимические и биофизические исследования.Связь. 2013; 441 (4): 947–52.
Google Scholar
Дэвис Д. Понимание устойчивости биопленок к антибактериальным агентам. Nat Rev Drug Discov. 2003; 2: 114–22.
CAS PubMed Статья PubMed Central Google Scholar
Costerton JW. Введение в биопленку. Int J Antimicrob Agents. 1999. 11 (3–4): 217–21.
CAS PubMed Статья PubMed Central Google Scholar
Høiby N, Bjarnsholt T, Givskov M, et al. Устойчивость бактериальных биопленок к антибиотикам. Int J Antimicrob Agents. 2010. 35 (4): 322–32.
PubMed Статья CAS PubMed Central Google Scholar
Hengzhuang W., Wu H, Ciofu O, et al. Фармакокинетика / фармакодинамика колистина и имипенема на мукоидных и немукоидных биопленках Pseudomonas aeruginosa . Противомикробные агенты Chemother. 2011; 55 (9): 4469–74.
PubMed PubMed Central Статья CAS Google Scholar
Куинн Г.А., Малой А.П., Банат М.М., Банат И.М. Сравнение эффектов антибиотиков широкого спектра действия и биосурфактантов на установленные бактериальные биопленки. Curr Microbiol. 2013; 67 (5): 614.
CAS PubMed Статья PubMed Central Google Scholar
Райан Г.Б., Майно Г. Острое воспаление.Обзор. Am J Pathol. 1977; 87 (1): 183–276.
Google Scholar
Ocampo PS, Lázár V, Papp B, et al. Преобладает антагонизм между бактериостатическими и бактерицидными антибиотиками. Противомикробные агенты Chemother. 2014. 58 (8): 4573–82.
PubMed PubMed Central Статья CAS Google Scholar
Панки Г.А., Сабат Л.Д. Клиническая значимость бактериостатических и бактерицидных механизмов действия при лечении грамположительных бактериальных инфекций.Clin Infect Dis. 2004. 38 (6): 864–70.
CAS PubMed Статья PubMed Central Google Scholar
Pradipta IS, Sodik DC, Lestari K, et al. Устойчивость к антибиотикам у пациентов с сепсисом: оценка и рекомендации по применению антибиотиков. N Am J Med Sci. 2013. 5 (6): 344–52.
PubMed PubMed Central Статья Google Scholar
Слигл В., Тейлор Дж., Бриндли П.Г.Пять лет внутрибольничной грамотрицательной бактериемии в отделении общей интенсивной терапии: эпидемиология, характеристики чувствительности к противомикробным препаратам и исходы. Int J Infect Dis. 2006. 10 (4): 320–32.
CAS PubMed Статья PubMed Central Google Scholar
Perez-Chaparro PJ, Meuric V, De Mello G, Bonnaure-Mallet M. Бактериемия орального происхождения. Rev Stomatol Chir Maxillofac. 2011; 112 (5): 300–3.
CAS PubMed Статья PubMed Central Google Scholar
Всемирная организация здравоохранения. Безопасность инъекций, информационный бюллетень № 231. (2006).
Санде М.А., Ли Б.Л., Миллс Дж. Эндокардит у потребителей инъекционных наркотиков. В: Кэй Д., редактор. Инфекционный эндокардит. Нью-Йорк: Raven Press; 1992. стр. 345.
Google Scholar
Spijkerman IJ, van Ameijden EJ, Mientjes GH, et al. Инфекция вируса иммунодефицита человека и другие факторы риска кожных абсцессов и эндокардита среди потребителей инъекционных наркотиков.J Clin Epidemiol. 1996; 49: 1149.
CAS PubMed Статья PubMed Central Google Scholar
Левин Д.П., Крейн Л.Р., Зервос М.Дж. Бактериемия у наркозависимых в Детройте. II. Инфекционный эндокардит: проспективное сравнительное исследование. Rev Infect Dis. 1986. 8 (3): 374–96.
CAS PubMed Статья PubMed Central Google Scholar
Chalmeau J, Monina N, Shin J, Vieu C, Noireaux V. Формирование пор α-гемолизина в поддерживаемом фосфолипидном бислое с использованием бесклеточной экспрессии. Biochim Biophys Acta. 2011; 1808 (1): 271–8.
CAS PubMed Статья PubMed Central Google Scholar
Dalla Serra M, Coraiola M, Viero G, Comai M, Potrich C, Ferreras M, Baba-Moussa L., Colin DA, Menestrina G, Bhakdi S, Prevost G. Staphylococcus aureus bicomponent gamma-hemolys , HlgB и HlgC могут образовывать смешанные поры, содержащие все компоненты.Модель J Chem Inf. 2005. 45 (6): 1539–45.
CAS PubMed Статья PubMed Central Google Scholar
Шембри М.А., Дальсгаард Д., Клемм П. Капсула защищает функцию коротких бактериальных адгезинов. J Bacteriol. 2004. 186 (5): 1249–57.
CAS PubMed PubMed Central Статья Google Scholar
Lammers AJ, de Porto AP, Florquin S, de Boer OJ, Bootsma HJ, Hermans PW, van der Pol T.Повышенная уязвимость сепсиса Streptococcus pneumoniae во время асплении определяется бактериальной капсулой. Иммунология. 2011; 216 (8): 863–70.
CAS Google Scholar
Shirtliff ME, Mader JT. Острый септический артрит. Clin Microbiol Rev.2002; 15 (4): 527–44.
PubMed PubMed Central Статья Google Scholar
Стодли П., Уилсон С., Холл-Стодли Л., Бойл Дж. Д. и др.Рост и отделение кластеров клеток от зрелых биопленок смешанных видов. Appl Environ Microbiol. 2001; 67: 5608–13.
CAS PubMed PubMed Central Статья Google Scholar
Stickler DJ. Бактериальные биопленки и инкрустация уретральных катетеров. Биообрастание. 1996; 94: 293–305.
Артикул Google Scholar
Evans DJ, Allison DG, Brown MRW, Gilbert P.Восприимчивость биопленок Pseudomonas aeruginosa и Escherichia coli к ципрофлоксацину: влияние удельной скорости роста. J Antimicrob Chemother. 1991; 27: 177–84.
CAS PubMed Статья PubMed Central Google Scholar
Suci PA, Mittelman MW, Yu FP, Geesey GG. Исследование проникновения ципрофлоксацина в биопленки синегнойной палочки. Противомикробные агенты Chemother. 1994; 38: 2125–33.
CAS PubMed PubMed Central Статья Google Scholar
Михайлова Л., Куссовский В., Радучева Т., Жорданова М., Маркова Н. Персистентность L-формы Staphylococcus aureus при экспериментальной инфекции легких у крыс. FEMS Microbiol Lett. 2007. 268: 88–97.
CAS PubMed Статья PubMed Central Google Scholar
Девайн КМ. Бактериальные L-формы на выходе: улучшенная методология получения L-форм Bacillus subtilis знаменует новую эру исследований.Mol Microbiol. 2012; 83: 10–1.
CAS PubMed Статья PubMed Central Google Scholar
Маркова Н., Славчев Г., Михайлова Л. Присутствие L-форм микобактерий в крови человека: контрольная проба вакцинации БЦЖ. Hum Vaccin Immunother. 2015; 11: 1192–200.
PubMed PubMed Central Статья Google Scholar
Domingue GJ. Демистификация плеоморфных форм в персистировании и выражении болезни: являются ли они бактериями и является ли пептидогликан решением проблемы? Discov Med.2010; 10: 234–46.
PubMed PubMed Central Google Scholar
Пиз П. Морфологические проявления бактериальной L-формы, растущей вместе с эритроцитами пациентов с артритом. Ann Rheum Dis. 1970. 29 (4): 439–44.
CAS PubMed PubMed Central Статья Google Scholar
Tedeschi GG, Amici D, Santarelli I, Paparelli M, Vitali C.Нестабильные L-формы микрококков в тромбоцитах человека. В: Фуллер Р., Лавлок Д.В., редакторы. Микробная ультраструктура: использование электронного микроскопа. Лондон: Appl Bact Tech Series 10; 1976. с. 325.
Google Scholar
Корнгут М.Л., Кунин СМ. Поглощение антибиотиков эритроцитами человека. J Infect Dis. 1976; 133: 175–84.
CAS PubMed Статья PubMed Central Google Scholar
Браун Н.К., Персиваль А. Проникновение противомикробных препаратов в ткани и лейкоциты. Scand J Infect Dis. 1978; S14: 251–60.
Google Scholar
Эррингтон Дж., Мицкевич К., Кавай Й, Ву Л.Дж. Бактерии L-формы, хронические заболевания и истоки жизни. Philos Trans R Soc Lond Ser B Biol Sci. 2016; 371 (1707): 20150494.
Артикул Google Scholar
Fowler VG, Scheld WM, Bayer AS.Эндокардит и внутрисосудистые инфекции. В: Mandell GL, Bennett JE, Dolin R, редакторы. Принципы и практика инфекционных заболеваний Манделла, Дугласа и Беннета. 6. Филадельфия: Черчилль Ливингстон; 2005. с. 975–1021.
Google Scholar
Verhagen DW, Vedder AC, Speelman P, van der Meer JT. Антимикробное лечение инфекционного эндокардита, вызванного стрептококками viridans, очень чувствительными к пенициллину: исторический обзор и перспективы на будущее.J Antimicrob Chemother. 2006. 57 (5): 819–24.
CAS PubMed Статья PubMed Central Google Scholar
Gutman LT, Turck M, Petersdorf RG, Wedgwood RJ. Значение бактериальных вариантов в моче больных хронической бактериурией. J Clin Invest. 1965. 44 (12): 1945–52.
CAS PubMed PubMed Central Статья Google Scholar
Astrauskiene D, Bernotiene E. Новые взгляды на устойчивость бактерий при реактивном артрите. Clin Exp Rheumatol. 2007; 25: 470–9.
CAS PubMed PubMed Central Google Scholar
Амар Дж., Серино М., Ланге С. и др. Участие тканевых бактерий в развитии диабета у людей: доказательства концепции. Диабетология. 2011; 54: 3055–61.
CAS PubMed Статья PubMed Central Google Scholar
Lanter BB, Sauer K, Davies DG. Бактерии, присутствующие в бляшках сонных артерий, обнаруживаются в виде отложений биопленки, которые могут способствовать повышенному риску разрыва бляшек. mBio. 2014; 5 (3): e01206–14.
PubMed PubMed Central Статья CAS Google Scholar
Hansen GM, Belstrøm D, Nilsson M, Helqvist S, Nielsen CH, Holmstrup P, et al. Pseudomonas aeruginosa микроколонии в коронарных тромбах от пациентов с инфарктом миокарда с подъемом сегмента ST.PLoS One. 2016; 11 (12): e0168771.
PubMed PubMed Central Статья CAS Google Scholar
Кэмпбелл Л.А., Розенфельд М. Инфекция и развитие атеросклероза. Arch Med Res. 2015; 46 (5): 339–50.
CAS PubMed PubMed Central Статья Google Scholar
Либби П., Ридкер П.М., Мазери А. Воспаление и атеросклероз. Тираж.2002; 105: 1135–43.
CAS PubMed PubMed Central Статья Google Scholar
Расмуссен М. Рецидивирующий сепсис, вызванный Streptococcus pyogenes . J Clin Microbiol. 2011. 49 (4): 1671–3.
PubMed PubMed Central Статья Google Scholar
DeMerle KM, Royer S, Mikkelsen ME, Prescott HC. Повторная госпитализация по поводу рецидивирующего сепсиса: новая или рецидивирующая инфекция? Crit Care Med.2017; 45 (10): 1702–8.
PubMed PubMed Central Статья Google Scholar
Гордон П., Грант Л., Ирвин Т. Рецидив пилонидального сепсиса. Ольстер Мед Дж. 2014; 83 (1): 10–2.
PubMed PubMed Central Google Scholar
Tuuminen T, Osterblad M, Hamalainen R, Sironen R. Рецидивирующие эпизоды сепсиса Escherichia coli с CTX-M ESBL или дерепрессированные гены ampC у пациента с хроническим аутоиммунным панкреатитом, осложненным IgG .Новые микробы Новый зараз. 2016; 9: 50–3.
CAS PubMed Статья PubMed Central Google Scholar
Sriskandan S, Cohen J. Грамположительный сепсис: механизмы и отличия от грамотрицательного сепсиса. Заражение Dis Clin N Am. 1999. 13 (2): 397–412.
CAS Статья Google Scholar
Рамачандран Г. Грамположительные и грамотрицательные бактериальные токсины при сепсисе.Вирулентность. 2014; 5 (1): 213–8.
PubMed Статья PubMed Central Google Scholar
Моррисон, округ Колумбия, Райан Дж. Л.. Эндотоксины и механизмы заболевания. Annu Rev Med. 1987. 38: 417–32.
CAS PubMed Статья PubMed Central Google Scholar
Кость RC. Грамотрицательный сепсис: дилемма современной медицины. Clin Microbiol Rev.1993; 6 (1): 57–68.
CAS PubMed PubMed Central Статья Google Scholar
Shepard CC, Levy L, Fasal P. Дальнейший опыт быстрого бактерицидного действия рифампицина на Mycobacterium leprae . Am J Trop Med Hyg. 1974; 23: 1120–4.
CAS PubMed Статья PubMed Central Google Scholar
Grosset JH, Ji B, Guelpa-Lauras CC, Perani EG, N’Deli L.Клинические испытания пефлоксацина и офлоксацина в лечении лепроматозной лепры. Int J Lepr. 1990; 58: 281–95.
CAS Google Scholar
Джи Б., Джамет П., Перани Э. Г., Бобин П., Гроссет Дж. Х. Мощное бактерицидное действие кларитромицина и миноциклина против Mycobacterium leprae при лепроматозной лепре. J Infect Dis. 1993; 168: 188–90.
CAS PubMed Статья PubMed Central Google Scholar
Kahawita IP, Локвуд DN. К пониманию патологии лепрозной узловатой эритемы. Trans R Soc Trop Med Hyg. 2008. 102: 329–37.
CAS PubMed Статья PubMed Central Google Scholar
Walker SL, Waters MF, Lockwood DN. Роль талидомида в лечении лепрозной узловатой эритемы. Лепр Rev.2007; 78: 197–215.
PubMed PubMed Central Google Scholar
Паррилло Дж. Э., Паркер М. М., Натансон С., Суффредини А. Ф., Даннер Р. Л., Каннион Р. Э., Огнибене Ф. П.. Септический шок у человека. Достижения в понимании патогенеза, сердечно-сосудистой дисфункции и терапии. Ann Intern Med. 1990; 113: 227–42.
CAS PubMed Статья PubMed Central Google Scholar
Мартин Г.С., Маннино Д.М., Итон С., Мосс М. Эпидемиология сепсиса в США с 1979 по 2000 год.N Engl J Med. 2003; 348: 1546–54.
PubMed Статья PubMed Central Google Scholar
Опал С.М., Гарбер Г.Е., ЛаРоса С.П., Маки Д.Г., Фриберн Р.С., Кинасевитц Г.Т., Дайнаут Дж.Ф., Ян С.Б., Уильямс М.Д., Грэм Д. Системные ответы хозяина при тяжелом сепсисе проанализированы с помощью возбудителей и лечебных эффектов дротрекогина альфа (активированного). Clin Infect Dis. 2003. 37: 50–8.
CAS PubMed Статья PubMed Central Google Scholar
Алфери Д. Д., Раушер А. Столбняк: обзор. Crit Care Med. 1979; 4: 176–81.
Артикул Google Scholar
Lubran MM. Бактериальные токсины. Ann Clin Lab Sci. 1988; 18: 58–71.
CAS PubMed PubMed Central Google Scholar
Woodford N, Livermore DM. Инфекции, вызываемые грамположительными бактериями: обзор глобальной проблемы. J Inf Secur.2009. 59 (1): 4–16.
Google Scholar
Пул К. Преодоление устойчивости к противомикробным препаратам путем воздействия на механизмы устойчивости. J Pharm Pharmacol. 2001. 53 (3): 283–94.
CAS PubMed Статья PubMed Central Google Scholar
Тиссари П., Зумла А., Таркка Е. и др. Точная и быстрая идентификация видов бактерий из положительных культур крови с помощью платформы микрочипов на основе ДНК: обсервационное исследование.Ланцет. 2010; 375: 224–30.
CAS PubMed Статья PubMed Central Google Scholar
Wllinghausen N, Kochem AJ, Disque C и др. Диагностика бактериемии в образцах цельной крови с использованием коммерческой универсальной ПЦР на основе гена 16S рРНК и анализа последовательностей. J Clin Microbiol. 2009. 47 (9): 2759–65.
Артикул CAS Google Scholar
Sanguinetti M, Posteraro B.Применение масс-спектрометрии в микробиологии помимо идентификации микробов: прогресс и потенциал. Эксперт Rev Proteomics. 2016; 13 (10): 965–77.
CAS Статья Google Scholar
Сандрин Т.Р., Демирев П.А. Использование масс-спектрометрии для идентификации и характеристики бактерий: масс-спектрометрия позволяет исследователям дифференцировать бактериальные штаммы и отличать устойчивые к лекарствам изоляты, чувствительные к лекарствам.Микроб. 2014; 9 (1): 23–9.
Google Scholar
Beutler B. Эндотоксин, фактор некроза опухоли и родственные медиаторы: новые подходы к шоку. New Horiz. 1993; 1: 3–12.
CAS PubMed PubMed Central Google Scholar
Tracey KJ, Fong Y, Hesse DG, Manogue KR, Lee AT, Kuo GC, Lowry SF, Cerami A. Моноклональные антитела против кахектина / TNF предотвращают септический шок во время летальной бактериемии.Природа. 1987. 330: 662–4.
CAS PubMed Статья PubMed Central Google Scholar
Чемпион К., Чиу Л., Фербас Дж., Пепе М. Нейтрализация эндотоксинов как биомонитор воспалительного заболевания кишечника. PLoS One. 2013; 8 (6): e67736.
CAS PubMed PubMed Central Статья Google Scholar
Munford RS. Обзор детоксикации эндотоксина: время, место и человек.J Endotoxin Res. 2005. 11 (2): 69–84.
CAS PubMed PubMed Central Google Scholar
Chaby R. Молекулы, связывающие липополисахариды: переносчики, блокаторы и сенсоры. Cell Mol Life Sci. 2004. 61 (14): 1697–713.
CAS PubMed Статья PubMed Central Google Scholar
Bates JM, Akerlund J, Mittge E, Guillemin K. Щелочная фосфатаза кишечника выводит токсины из липополисахаридов и предотвращает воспаление у рыбок данио в ответ на микробиоту кишечника.Клеточный микроб-хозяин. 2007. 2 (6): 371–82.
CAS PubMed PubMed Central Статья Google Scholar
Munford R, Lu M, Varley AW. Убить бактерии … а также их посланников? Adv Immunol. 2009. 103: 29–48.
CAS PubMed PubMed Central Статья Google Scholar
Джерала Р., Порро М. Пептиды, нейтрализующие эндотоксины. Curr Top Med Chem.2004. 4 (11): 1173–84.
CAS PubMed Статья PubMed Central Google Scholar
Wong KF, Luk JM. Эндотоксин-нейтрализующие пептиды в качестве грамотрицательных терапевтических средств при сепсисе. Protein Pept Lett. 2009. 16 (5): 539–42.
CAS PubMed Статья PubMed Central Google Scholar
Andrä J, Gutsmann T, Garidel P, Brandenburg K. Механизмы нейтрализации эндотоксинов синтетическими катионными соединениями.J Endotoxin Res. 2006; 12 (5): 261–77.
PubMed PubMed Central Google Scholar
van der Poll T, Lowry SF. Фактор некроза опухоли при сепсисе: медиатор полиорганной недостаточности или важная часть защиты хозяина? Шок. 1995; 3: 1–12.
PubMed PubMed Central Google Scholar
Мияке К. Молекулы распознавания эндотоксина MD-2 и толл-подобный рецептор 4 как потенциальные мишени для терапевтического вмешательства при эндотоксиновом шоке.Препарат Curr предназначен для лечения аллергии на воспаление. 2004. 3 (3): 291–7.
CAS PubMed Статья PubMed Central Google Scholar
Кость RC. Как грамположительные организмы вызывают сепсис. J Crit Care. 1993. 8 (1): 51–9.
CAS PubMed Статья PubMed Central Google Scholar
Кульханкова К., Кинг Дж., Сальгадо-Пабон В. Синдром токсического шока стафилококка: суперантиген-опосредованное усиление эндотоксинового шока и адаптивное подавление иммунитета.Immunol Res. 2014; 59 (1-3): 182-7.
Bohach GA, Fast DJ, Nelson RD, Schlievert PM. Обзор стафилококковых и стрептококковых пирогенных токсинов, вызывающих синдром токсического шока и связанные с ним заболевания. Crit Rev Microbiol. 1990. 17 (4): 251–72.
CAS PubMed Статья PubMed Central Google Scholar
Маррак П., Капплер Дж. Стафилококковые энтеротоксины и их родственники. Наука. 1990; 248: 1066.
CAS PubMed Статья PubMed Central Google Scholar
Герман А., Капплер Дж. В., Маррак П., Пуллен А. М.. Суперантигены: механизм стимуляции Т-клеток и роль в иммунных ответах. Анну Рев Иммунол. 1991; 9: 745–72.
CAS PubMed Статья PubMed Central Google Scholar
Стивенс Д. Инвазивные стрептококковые инфекции группы А.Clin Infect Dis. 1992; 14: 2–13.
CAS PubMed Статья PubMed Central Google Scholar
Алуф Дж. Э., Мюллер-Алуф Х. Стафилококковые и стрептококковые суперантигены: молекулярные, биологические и клинические аспекты. Int J Med Microbiol. Февраль 2003 г., 292 (7–8): 429–40.
CAS PubMed Статья PubMed Central Google Scholar
Burnett JC, Henchal EA, Schmaljohn AL, Bavari S.Развивающаяся область биозащиты: терапевтические разработки и диагностика. Nat Rev Drug Discov. 2005; 4: 281–97.
CAS PubMed Статья PubMed Central Google Scholar
Панг Л.Т., Кум В.В., Чоу А.В. Ингибирование пролиферации лимфоцитов, вызванной стафилококковым энтеротоксином B, и секреции фактора некроза опухоли α с помощью MAb5, моноклональных антител к токсину 1 синдрома токсического шока. Заражение иммунной. 2000; 68: 3261–8.
CAS PubMed PubMed Central Статья Google Scholar
Маккормик Дж. К., Ярвуд Дж. М., Шливерт П. М.. Синдром токсического шока и бактериальные суперантигены: обновленная информация. Annu Rev Microbiol. 2001; 55: 77–104.
CAS PubMed Статья PubMed Central Google Scholar
Sidhu SS, Fellouse FA. Синтетические терапевтические антитела. Nat Chem Biol.2007; 2: 682–8.
Артикул CAS Google Scholar
Miersch S, Sidhu SS. Синтетические антитела: концепции, возможности и практические соображения. Методы. 2012. 57 (4): 486–98.
CAS PubMed Статья PubMed Central Google Scholar
Кум WW, Laupland KB, Chow AW. Определение нового домена токсина-1 синдрома токсического шока стафилококка, критического для связывания класса II главного комплекса гистосовместимости, суперантигенной активности и летальности.Может J Microbiol. 2000; 46: 171–9.
CAS PubMed Статья PubMed Central Google Scholar
Эрикссон А., Холм С.Е., Норгрен М. Идентификация доменов, участвующих в суперантигенности стрептококкового пирогенного экзотоксина F (SpeF). Microb Pathog. 1998. 25: 279–90.
CAS PubMed Статья PubMed Central Google Scholar
Вишванатан К., Чарльз А., Баннан Дж., Пугач П., Кашфи К., Забриски Дж.Ингибирование бактериальных суперантигенов пептидами и антителами. Заражение иммунной. 2001. 69 (2): 875–84.
CAS PubMed PubMed Central Статья Google Scholar
Merriman JA, Nemeth KA, Schlievert PM. Новые антимикробные пептиды, ингибирующие синтез грамположительных бактериальных экзотоксинов. PLoS One. 2014; 9 (4): e95661.
PubMed PubMed Central Статья CAS Google Scholar
Ян Х, Буонпаре Р.А., Моза Б., Рахман А.К., Ван Н., Шливерт П.М., Маккормик Дж.К. Нейтрализация нескольких суперантигенов стафилококка одноцепочечным белком, состоящим из повторов вариабельного домена с созревшей аффинностью. J Infect Dis. 2008. 198 (3): 344–8.
CAS PubMed PubMed Central Статья Google Scholar
Лин Ю.К., Шливерт П.М., Андерсон М.Дж., Ярмарка С.Л., Шеферс М.М., Мутьяла Р., Петерсон М.Л. Действие монолаурата глицерина и додецилглицерина на Staphylococcus aureus и токсин-1 синдрома токсического шока in vitro и in vivo.PLoS One. 2009; 4 (10): e7499.
PubMed PubMed Central Статья CAS Google Scholar
Ларкин Е.А., Стайлз Б.Г., Ульрих Р.Г. Ингибирование токсического шока человеческими моноклональными антителами против стафилококкового энтеротоксина B. PLoS One. 2010; 5 (10): e13253.
PubMed PubMed Central Статья CAS Google Scholar
Norrby-Teglund A, Basma H, Andersson J, Mcgeer A, Low D, Koth M.Различные титры нейтрализующих антител к суперантигенам стрептококков в различных препаратах нормального полиспецифического иммуноглобулина G: значение для терапевтической эффективности. Clin Infect Dis. 1998. 26: 631–8.
CAS PubMed Статья PubMed Central Google Scholar
Boucher HW, Talbot GH, Bradley JS, Edwards JE, Gilbert D, et al. Плохие ошибки, никаких лекарств: нет ESKAPE! Новости Общества инфекционных болезней Америки.Clin Infect Dis. 2009; 48: 1–12.
PubMed Статья PubMed Central Google Scholar
Хайамс К., Камберлейн Э, Коэн Дж. М., Бакс К., Браун Дж. С.. Капсула Streptococcus pneumoniae подавляет активность комплемента и фагоцитоз нейтрофилов с помощью множества механизмов. Заражение иммунной. 2010; 78: 704–15.
CAS PubMed Статья PubMed Central Google Scholar
Раско Д.А., Сперандио В. Антивирулентные стратегии для борьбы с болезнями, опосредованными бактериями. Nat Rev Drug Discov. 2010; 9: 117–28.
CAS PubMed Статья PubMed Central Google Scholar
Агарвал С., Васудев С., ДеОливейра Р. Б., Рам С. Ингибирование классического пути комплемента менингококковыми капсульными полисахаридами. J Immunol. 2014; 193 (4): 1855–63.
CAS PubMed PubMed Central Статья Google Scholar
Dinkla K, Sastalla I, Godehardt AW, Janze N, Chhatwal GS, Rohde M, Medina E. Повышающая регуляция капсулы позволяет Streptococcus pyogenes уклоняться от иммунного распознавания антиген-специфическими антителами, направленными на связывание G-связанного альфа2-макроглобулина белок GRAB расположен на бактериальной поверхности. Микробы заражают. 2007; 9: 922–31.
CAS PubMed Статья PubMed Central Google Scholar
Clark SE, Eichelberger KR, Weiser JN.Уклонение от уничтожения человеческими антителами и дополнение посредством множественных вариаций поверхностного олигосахарида Haemophilusinfluenzae . Mol Microbiol. 2013; 88: 603–18.
CAS PubMed PubMed Central Статья Google Scholar
Бендер М.Х., Карти Р.Т., Йотер Дж. Положительная корреляция между фосфорилированием тирозина CpsD и производством капсульного полисахарида в Streptococcus pneumoniae .J Bacteriol. 2003; 185: 6057–66.
CAS PubMed PubMed Central Статья Google Scholar
Soulat D, Jault JM, Duclos B, Geourjon C, Cozzone AJ, et al. Золотистый стафилококк управляет фосфорилированием тирозина с помощью определенного механизма. J Biol Chem. 2006; 281: 14048–56.
CAS PubMed Статья PubMed Central Google Scholar
Standish AJ, Salim AA, Zhang H, Capon RJ, Morona R. Химическое ингибирование бактериальной протеинтирозинфосфатазы подавляет образование капсул. PLoS One. 2012; 7 (5): e36312.
CAS PubMed PubMed Central Статья Google Scholar
Стюарт П.С., Уильям CJ. Устойчивость бактерий к антибиотикам в биопленках. Ланцет. 2013. 58 (9276): 135–8.
Артикул Google Scholar
Донлан Р.М., Костертон Дж. У. Биопленки: механизмы выживания клинически значимых микроорганизмов. Clin Microbiol Rev.2002; 15 (2): 167–93.
CAS PubMed PubMed Central Статья Google Scholar
Simoesa M, Simoesa MJ, Vieirab J. Обзор текущих и возникающих стратегий контроля биопленки. LWT Food Sci Technol. 2010. 43 (4): 573–83.
Артикул CAS Google Scholar
Hentzer M, Riedel K, Rasmussen TB. Ингибирование кворума у бактерий биопленки Pseudomonas aeruginosa галогенированным фураноновым соединением. Микробиология. 2002. 148 (1): 87–102.
CAS PubMed Статья PubMed Central Google Scholar
Stewat PS. Новые способы остановить заражение биопленкой. Ланцет. 2003; 361: 97.
Артикул Google Scholar
Ху Дж.Ф., Гаро Э., Геринг МГ. Ингибиторы бактериальной биопленки из Diospyros dendo . J Nat Prod. 2006. 69 (1): 118–20.
CAS PubMed Статья PubMed Central Google Scholar
Гаро Э., Элдридж Г.Р., Геринг М.Г. Азиатская кислота и корозолевая кислота повышают чувствительность биопленок Pseudomonas aeruginosa к тобрамицину. Противомикробные агенты Chemother. 2007. 51 (5): 1813–7.
CAS PubMed PubMed Central Статья Google Scholar
Ву Х, Ли Б., Ян Л. Влияние женьшеня на подвижность Pseudomonas aeruginosa и образование биопленок. FEMS Immunol Med Microbiol. 2011. 62 (1): 49–56.
CAS PubMed Статья PubMed Central Google Scholar
Lee JH, Cho MH, Lee J. 3-индолилацетонитрил снижает Escherichia coli O157: образование биопленок H7 и вирулентность Pseudomonas aeruginosa . Environ Microbiol. 2011; 13 (1): 62–73.
CAS PubMed Статья PubMed Central Google Scholar
Мартино П.Д., Фурси Р., Брет Л., Сундарараджу Б., Филипс Р.С. Индол может действовать как внеклеточный сигнал для регулирования образования биопленок Escherichia coli и других индолпродуцирующих бактерий. Может J Microbiol. 2003. 49 (7): 443–449.
PubMed Статья PubMed Central Google Scholar
Ли Дж. Х., Ли Дж. Индол как межклеточный сигнал в микробных сообществах. FEMS Microbiol Rev.2010; 34 (4): 426–44.
CAS PubMed Статья PubMed Central Google Scholar
Бансал Т., Энглерт Д., Ли Дж., Хегде М., Вуд Т.К., Джаяраман А. Дифференциальные эффекты адреналина, норадреналина и индола на Escherichia coli O157: хемотаксис, колонизация и экспрессия генов H7. Заражение иммунной. 2007. 75 (9): 4597–607.
CAS PubMed PubMed Central Статья Google Scholar
Геске Г.Д., Веземан Р.Дж., Сигел А.П., Блэквелл Х. Низкомолекулярные ингибиторы обнаружения кворума бактерий и образования биопленок. J Am Chem Soc. 2005. 127 (37): 12762–3.
CAS PubMed Статья PubMed Central Google Scholar
de la Fuente-Núňez C, Korolik V. Bains M Подавление образования бактериальной биопленки и подвижности роения с помощью небольшого синтетического катионного пептида.Противомикробные агенты Chemother. 2012. 56 (5): 2696–704.
PubMed PubMed Central Статья CAS Google Scholar
Колодкин-Гал И., Ромеро Д., Цао С., Кларди Дж., Колтер Р., Лосик Р. D-аминокислоты запускают разборку биопленки. Наука. 2010. 328 (5978): 627–9.
CAS PubMed PubMed Central Статья Google Scholar
Ма Й, Чен М., Джонс Дж. Э., Ритц А. С., Ю Кью, Сун Х.Ингибирование биопленки Staphylococcus epidermidis с помощью плазменного покрытия триметилсиланом. Противомикробные агенты Chemother. 2012. 56 (11): 5923–37.
CAS PubMed PubMed Central Статья Google Scholar
Busetti A, Crawford DE, Earle MJ. Антимикробная и антибиотикопленочная активность ионных жидкостей 1-алкилхинолиния бромида. Green Chem. 2010. 12 (3): 420–5.
CAS Статья Google Scholar
Whitchurch CB, Tolker-Nielsen T, Ragas PC. Внеклеточная ДНК необходима для образования бактериальной биопленки. Наука. 2002; 295: 1487.
CAS PubMed PubMed Central Статья Google Scholar
Iwase T, Uehara Y, Shinji H, Tajima A, Seo H, Takada K, Mizunoe Y. Staphylococcus epidermidis Esp подавляет образование биопленок Staphylococcus aureus и колонизацию в носу. Природа. 2010; 465: 346–9.
CAS PubMed Статья PubMed Central Google Scholar
Каплан Дж. Б., Рагунатх C, Рамасуббу Н., Штраф DH. Отделение клеток биопленки Actinobacillus actinomycetemcomitans за счет эндогенной бета-гексозаминидазной активности. J Bacteriol. 2003; 185: 4693–8.
CAS PubMed PubMed Central Статья Google Scholar
Barraud N, Hassett DJ, Hwang SH, Rice SA, Kjelleberg S, Webb JS. Участие оксида азота в диспергировании биопленок Pseudomonas aeruginosa .J Bacteriol. 2006. 188 (21): 7344–53.
CAS PubMed PubMed Central Статья Google Scholar
Garrison AT, Bai F, Abouelhassan Y, Paciaroni NG, Jin S, Huigens RW III. Производные бромфеназина с сильной ингибирующей, диспергирующей и эрадикационной активностью против биопленок Staphylococcus aureus . RSC Adv. 2015; 5: 1120–4.
CAS Статья Google Scholar
Jennings MC, Ator LE, Paniak TJ, Minbiole KP, Wuest WM. Биопленочные свойства амфифилов четвертичного аммония: простые имитаторы антимикробных пептидов. Chembiochem. 2014; 5 (15): 2211–5.
Артикул CAS Google Scholar
Smith JL. Физиологическая роль ферритиноподобных соединений в бактериях. Crit Rev Microbiol. 2004. 30 (3): 173–85.
CAS PubMed Статья PubMed Central Google Scholar
Парроу Н.Л., Флеминг Р.Э., Минник М. Секвестрация и удаление железа при инфекции. Заражение иммунной. 2013. 81 (10): 3503–14.
CAS PubMed PubMed Central Статья Google Scholar
Чераил Б.Дж. Роль железа в иммунном ответе на бактериальную инфекцию. Immunol Res. 2011; 50 (1): 1–9.
CAS PubMed PubMed Central Статья Google Scholar
Вайс Г. Модификация регуляции железа при воспалительной реакции. Лучшая практика Res Clin Haematol. 2005. 18 (2): 183–201.
CAS PubMed Статья PubMed Central Google Scholar
Krewulak KD, Vogel HJ. Структурная биология поглощения железа бактериями. Biochim Biophys Acta Biomembr. 2008. 1778 (9): 1781–804.
CAS Статья Google Scholar
Эндрюс С.К., Робинсон А.К., Родрикес-Хинонес Ф. Бактериальный гомеостаз железа. FEMS Microbiol Rev.2003 июн; 27 (2–3): 215–37.
CAS PubMed Статья PubMed Central Google Scholar
Donahue JA. Антистафилококковые гемолизины и ингибитор дельта-гемолизина в сыворотке взрослого человека. Может J Microbiol. 1969; 15 (8): 957–9.
CAS PubMed Статья PubMed Central Google Scholar
Рани Н., Сараванан В., Лакшми PTV, Аннамалай А. Ингибирование порообразования путем блокирования сборки Staphylococcus aureus α-гемолизина с помощью нового пептидного ингибитора: подход in Silco. Int J Pept Res Ther. 2014; 20: 575.
CAS Статья Google Scholar
Shi C, Zhao X, Li W, Meng R, Liu Z, Liu M, Guo N, Yu L. Ингибирующее действие тотарола на экзотоксиновые белки, гемолизин и энтеротоксины, секретируемые Staphylococcus aureus .Мир J Microbiol Biotechnol. 2015; 31: 1565.
CAS PubMed Статья PubMed Central Google Scholar
Omae Y, Hanada Y, Sekimizu K, Kaito C. Белок аполипофорина шелкопряда подавляет экспрессию гена гемолизина Staphylococcus aureus посредством связывания с липотейхоевыми кислотами на поверхности клетки. J Biol Chem. 2013. 288 (35): 25542–50.
CAS PubMed PubMed Central Статья Google Scholar
Mestre MB, Коломбо, Мичиган. цАМФ и EPAC являются ключевыми игроками в регуляции пути передачи сигнала, участвующего в аутофагическом ответе α-гемолизина. PLoS Pathog. 2012; 8 (5): e1002664.
CAS PubMed PubMed Central Статья Google Scholar
Холливелл Б. Супероксиддисмутаза, каталаза и глутатионпероксидаза: решения проблем жизни с кислородом. Новый Фитол. 1974; 73: 1075–86.
CAS Статья Google Scholar
Phan TN, Кирш AM, Marquis RE. Селективная сенсибилизация бактерий к перекисному повреждению, связанная с ингибированием фторидом каталазы и псевдокаталазы. Oral Microbiol Immunol. 2001. 16 (1): 28–33.
CAS PubMed Статья PubMed Central Google Scholar
Tamanai-Shacoori Z, Shacoori V, Jolivet-Gougeon A, Vo Van JM, Repère M, Donnio PY, Bonnaure-Mallet M. Антибактериальная активность трамадола против бактерий, связанных с инфекционными осложнениями после местной или региональной анестезии .Anesth Analg. 2007; 105: 524–7.
CAS PubMed Статья PubMed Central Google Scholar
Аль-Кураиши Х.М. Возможные антибактериальные свойства трамадола гидрохлорида при инфекции мочевыводящих путей: исследование in vitro. Int Pharmaceutical Sciencia. 2012; 2: 97–102.
CAS Google Scholar
Минаи-Тегерани Д., Ашрафи И.С., Мохаммади М.К., Дамавандифар З.С., Зонуз Е.Р., Пиршахед Т.Э.Сравнение ингибирующего действия трамадола на каталазу синегнойной палочки и печени мыши. Curr Enzym Inhib. 2014; 10: 54–8.
CAS Статья Google Scholar
Damo S, Chazin WJ, Skaar EP, Kehl-Fie TE. Подавление супероксидной защиты бактерий. Новый фронт борьбы между хозяином и патогеном. Вирулентность. 2012. 3 (3): 325–8.
PubMed PubMed Central Статья Google Scholar
Kehl-Fie TE, Chitayat S, Hood MI, Damo S, Restrepo N, Garcia C и др. Секвестрация питательных металлов кальпротектином ингибирует бактериальную супероксидную защиту, увеличивая нейтрофилы Staphylococcus aureus . Клеточный микроб-хозяин. 2011; 10: 158.
CAS PubMed PubMed Central Статья Google Scholar
Archambaud C, Nahori MA, Pizarro-Cerda J, Cossart P, Dussurget O. Контроль супероксиддисмутазы Listeria путем фосфорилирования.J Biol Chem. 2006. 281 (42): 31812–22.
CAS PubMed Статья PubMed Central Google Scholar
Hayes JD, Flanagan JU, Jowsey IR. Трансферазы глутатиона. Annu Rev Pharmacol Toxicol. 2005. 45: 51–88.
CAS Статья Google Scholar
Бренот А., Кинг К.Ю., Яновяк Б., Гриффит О., Капарон М.Г. Вклад глутатионпероксидазы в вирулентность Streptococcus pyogenes.Заразить Imm. 2004. 72 (1): 408–13.
CAS Статья Google Scholar
Pompella A, Visvikis A, Paolicchi A, De Tata V, Casini AF. Меняющиеся лица глутатиона, главного героя клетки. Biochem Pharmacol. 2003. 66 (8): 1499–503.
CAS PubMed Статья PubMed Central Google Scholar
Иидзука М., Иноуэ Й, Мурата К., Кимура А.Дж..Очистка и некоторые свойства глутатион-S-трансферазы из Escherichia coli B. Bacteriol. 1989; 171: 6039–42.
CAS Статья Google Scholar
Arca P, Garcia P, Hardisson C, Suérez JE. Очистка и исследование бактериальной глутатион-S-трансферазы. FEBS Lett. 1990; 263: 77–9.
CAS PubMed Статья PubMed Central Google Scholar
Perito B, Allocati N, Casalone E, Massuli M, Dragani B, Polsinelli M, Aceto A, Di Ilio C. Молекулярное клонирование и сверхэкспрессия гена глутатионтрансферазы из Proteus mirabilis . Biochem J. 1996; 318: 157–62.
CAS PubMed PubMed Central Статья Google Scholar
Фарр С.Б., Когома Т. Реакции на окислительный стресс у Escherichia coli и Salmonella typhimurium. Microbiol Rev.1991; 55: 561–85.
CAS PubMed PubMed Central Google Scholar
Миллер Р.А., Британ, Бельгия. Роль оксидантов в патофизиологии микробов. Clin Microbiol Rev.1997; 10: 1–18.
CAS PubMed PubMed Central Статья Google Scholar
Moore TDE, Sparling PF. Прерывание гена gpxA увеличивает чувствительность Neisseria meningitidis к параквату.J Bacteriol. 1996; 178: 4301–5.
CAS PubMed PubMed Central Статья Google Scholar
Pérez-Donoso JM, Imlay JA, Vasquez CC. Ген Escherichia coli btuE кодирует глутатионпероксидазу, которая индуцируется в условиях окислительного стресса. Biochem Biophysd Res Comm. 2010. 398 (4): 690–4.
Артикул CAS Google Scholar
Lobritz MA, Belenky P, Porter CBM, Gutierrez A, Yang JH, Schwarz EG, Dwyer DJ, Khalil AS, Collins JJ. Эффективность антибиотиков связана с клеточным дыханием бактерий. PNAS. 2015; 112 (27): 8173–80.
CAS PubMed Статья PubMed Central Google Scholar
Рокко В., Овертурф Г. Ингибирование хлорамфениколом бактерицидного действия ампициллина против Haemophilus influenzae. Противомикробные агенты Chemother.1982. 21 (2): 349–51.
CAS PubMed PubMed Central Статья Google Scholar
Brown TH, Alford RH. Антагонизм левомицетином антибиотиков широкого спектра действия в отношении Klebsiella pneumoniae. Противомикробные агенты Chemother. 1984. 25 (4): 405–7.
CAS PubMed PubMed Central Статья Google Scholar
Мэтис А.В. мл., Лидом Дж. М., Ивлер Д., Верле П. Ф., Портной Б.Антагонизм антибиотиков при бактериальном менингите. Противомикробные агенты Chemother (Bethesda). 1967; 7: 218–24.
Google Scholar
Стивенс Д.Л., Ма Й., Салми Д. Б., МакИнду Е., Уоллес Р. Дж., Брайант А. Е.. Влияние антибиотиков на экспрессию генов экзотоксинов, связанных с вирулентностью, в метициллин-чувствительном и метициллин-резистентном Staphylococcus aureus. J Infect Dis. 2007. 195 (2): 202–11.
CAS PubMed Статья PubMed Central Google Scholar
Stouthamer AH. Теоретическое исследование количества АТФ, необходимого для синтеза микробного клеточного материала. Антони Ван Левенгук. 1973; 39 (3): 545–65.
CAS PubMed Статья PubMed Central Google Scholar
Li GW, Burkhardt D, Gross C., Weissman JS. Количественная оценка абсолютных скоростей синтеза белка раскрывает принципы, лежащие в основе распределения клеточных ресурсов. Клетка. 2014. 157 (3): 624–35.
CAS PubMed PubMed Central Статья Google Scholar
Koebmann BJ, Westerhoff HV, Snoep JL, Nilsson D, Jensen PR. Гликолитический поток в Escherichia coli контролируется спросом на АТФ. J Bacteriol. 2002. 184 (14): 3909–16.
CAS PubMed PubMed Central Статья Google Scholar
Lin X, Kang L, Li H, Peng X. Для Escherichia coli требуется флуктуация множественных метаболических путей в ответ на хлортетрациклиновый стресс. Mol BioSyst. 2014; 10 (4): 901–8.
CAS PubMed Статья PubMed Central Google Scholar
Rittershaus ES, Baek SH, Sassetti CM. Нормальность покоя: общие темы покоя микробов. Клеточный микроб-хозяин. 2013. 13 (6): 643–51.
CAS PubMed PubMed Central Статья Google Scholar
Dwyer DJ, Kohanski MA, Hayete B, Collins JJ. Ингибиторы гиразы вызывают путь гибели клеток при окислительном повреждении у Escherichia coli.Mol Syst Biol. 2007; 3: 91.
PubMed PubMed Central Статья CAS Google Scholar
Kohanski MA, Dwyer DJ, Hayete B, Lawrence CA, Collins JJ. Распространенный механизм гибели клеток, вызванный бактерицидными антибиотиками. Клетка. 2007. 130 (5): 797–810.
CAS PubMed Статья PubMed Central Google Scholar
Kohanski MA, Dwyer DJ, Wierzbowski J, Cottarel G, Collins JJ.Неправильная трансляция мембранных белков и активация двухкомпонентной системы вызывают гибель клеток, опосредованную антибиотиками. Клетка. 2008. 135 (4): 679–90.
CAS PubMed PubMed Central Статья Google Scholar
Мелетис Г. Устойчивость к карбапенему: обзор проблемы и перспективы на будущее. Ther Adv Infect Dis. 2016; 3 (1): 15–21.
CAS PubMed PubMed Central Google Scholar
Рохас Л.Дж., Салим М., Кобер Э., Рихтер С.С., Перес Ф., Салата Р.А., Калайджиан Р.С.Р.Р.Р., Маршалл С., Рудин С.Д. Устойчивость к колистину у устойчивых к карбапенемам Klebsiella pneumoniae: лабораторное обнаружение и влияние на смертность. Clin Infect Dis. 2017; 64: 711–8.
CAS PubMed PubMed Central Google Scholar
Wei H. Бактериофаги, оживленные после 100 лет в тени антибиотиков. Virol Sin. 2015; 30 (1): 1-2.
CAS PubMed Статья PubMed Central Google Scholar
Кляйн ГО. Бактериофаговая терапия может быть спасением, когда антибиотики перестают действовать. Lakartidningen. 2009. 106 (40): 2530–3.
PubMed PubMed Central Google Scholar
Hanlon GW. Бактериофаги: оценка их роли в лечении бактериальных инфекций. Int J Antimicrob Agents. 2007. 30: 118–28.
CAS PubMed Статья PubMed Central Google Scholar
Адхья С., Меррил К. Путь к фаготерапии. Природа. 2006; 443: 754–5.
CAS Статья Google Scholar
Райт А., Хокинс С.Х., Анггард Е.Е., Харпер ДР. Контролируемое клиническое испытание терапевтического препарата бактериофага при хроническом отите, вызванном устойчивостью к антибиотикам Pseudomonas aeruginosa; предварительный отчет об эффективности. Клин Отоларингол. 2009. 34 (4): 349–57.
CAS PubMed Статья PubMed Central Google Scholar
Gaidelytė A, Vaara M, Bamford DH. Бактерии, фаги и септицемия. PLoS ONE. 2007; 2 (11): e1145.
PubMed PubMed Central Статья CAS Google Scholar
Wittebole X, De Roock S, Opal S. Исторический обзор бактериофаговой терапии как альтернативы антибиотикам для лечения бактериальных патогенов. Вирулентность. 2014. 5 (1): 226–35.
PubMed Статья PubMed Central Google Scholar
Kadouri DE, To K, Shanks RM, Doi Y. Хищные бактерии: потенциальный союзник против грамотрицательных патогенов с множественной лекарственной устойчивостью. PLoS One. 2013; 8: e63397.
CAS PubMed PubMed Central Статья Google Scholar
Харини К., Аджила В., Хегде С. Bdellovibrio bacteriovorus : Будущее противомикробное средство? J Indian Soc Periodontol. 2013. 17 (6): 823–5. https://doi.org/10.4103/0972-124X.124534.
CAS Статья PubMed PubMed Central Google Scholar
Sockett RE. Хищный образ жизни Bdellovibrio bacteriovorus. Annu Rev Microbiol. 2009; 63: 523-39.
Monnappa AK, Dwidar M, Seo JK, Hur JH, Mitchell RJ. Bdellovibrio bacteriovorus подавляет образование биопленок Staphylococcus aureus и инвазию в эпителиальные клетки человека. Научный отчет 2014; 22 (4): 3811.
Google Scholar
Dashiff A, Junka RA, Libera M, Kadouri DE. J Appl Microbiol. 2011; 110 (2): 431-44.
Иэбба В., Тотино В., Сантанджело Ф., Гальярди А., Чотоли Л., Вирга А., Амбрози С., Помпили М., Де Биасе Р. В., Селан Л. и др. Bdellovibrio bacteriovorus напрямую атакует изоляты муковисцидоза Pseudomonas aeruginosa и Staphylococcus aureus. Front Microbiol. 2014; 5: 280 Epub 2014 5 июня.
PubMed PubMed Central Статья Google Scholar
Столп Х., Старр М.П. Bdellovibrio bacteriovorus gen.Эцп.н., хищный, эктопаразитарный и бактериолитический микроорганизм. Антони Ван Левенгук. 1963; 29: 217–48.
CAS PubMed Статья PubMed Central Google Scholar
Кадури Д., О’Тул, Джорджия. Восприимчивость биопленок к атаке Bdellovibrio bacteriovorus . Appl Environ Microbiol. 2005. 71: 4044–51.
CAS PubMed PubMed Central Статья Google Scholar
Sockett RE. Хищный образ жизни Bdellovibrio bacteriovorus. Annu Rev Microbiol. 2009; 63: 523–39.
CAS PubMed Статья PubMed Central Google Scholar
Dwidar M, Monnappa AK, Mitchell RJ. Двойная пробиотическая и антибиотическая природа Bdellovibrio bacteriovorus . BMB Rep. 2012; 45: 71–8.
CAS PubMed Статья PubMed Central Google Scholar
McFarland LV, Surawicz CM, Greenberg RN, et al. Рандомизированное плацебо-контролируемое исследование Saccharomyces boulardi в сочетании со стандартным антибиотиком для лечения болезни Clostridium difficile. ДЖАМА. 1994; 271: 1913–8.
CAS PubMed Статья PubMed Central Google Scholar
Bleichner G, Blehaut H, Mentec H, Moyse D. Saccharomyces boulardii предотвращает диарею у тяжелобольных пациентов, находящихся на зондовом питании. Многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование.Intens Care Med. 1997; 23: 517–23.
CAS Статья Google Scholar
Mumy KL, Chen X, Kelly CP, McCormick BA. Saccharomyces boulardii вмешивается в патогенез Shigella посредством постинвазионных сигнальных событий. Am J Physiol Gastrointest Liver Physiol. 2008; 294: G599–609.
CAS PubMed Статья PubMed Central Google Scholar
Zbinden R, Bonczi E, Altwegg M.Ингибирование Saccharomyces boulardii при клеточной инвазии Salmonella typhimurium и Yersinia enterocolitica . Micro Ecol Health Dis. 1999; 11: 158–62.
Google Scholar
Альтвегг М., Шнак Дж., Збинден Р. Влияние Saccharomyces boulardii на гемолизин Aeromonas. Med Microbiol Lett. 1995; 4: 417–25.
CAS Google Scholar
Castagliuolo I, Lamont JT, Nikulasson ST, Pothoulakis C. Протеаза Saccharomyces boulardii подавляет эффекты токсина A Clostridium difficile в подвздошной кишке крысы. Заражение иммунной. 1996. 64: 5225–32.
CAS PubMed PubMed Central Google Scholar
Buts JP, Dekeyser N, StilmanT C, Delem E, Smets F, Sokal E. Saccharomyces boulardii продуцирует в тонком кишечнике крысы новую протеинфосфатазу, которая ингибирует эндотоксин Escherichia coli путем дефосфорилирования.Pediatr Res. 2006; 60: 24–9.
CAS PubMed Статья PubMed Central Google Scholar
Buts J, de Keyser N. Влияние Saccharomyces boulardii на слизистую оболочку кишечника. Digest Dis Sci. 2006; 51: 1485–92.
PubMed Статья PubMed Central Google Scholar
Swidsinski A, Loening-Baucke V, Verstraelen H, Osowska S, Doerffel Y.Биоструктура фекальной микробиоты здоровых людей и пациентов с хронической идиопатической диареей. Гастроэнтерология. 2008; 135: 568–79.
PubMed Статья PubMed Central Google Scholar
Marks DH, Medina F, Lee S, Blackmon A, Schuschereba ST. Удаление бактерий из крови путем гемоперфузии древесным углем. Biomater Artif Cells Artif Organs. 1988. 16 (1–3): 135–40.
CAS PubMed Статья PubMed Central Google Scholar
Д. Зидель, К. Боос. «Устройство для удаления бактериальных токсинов из крови или плазмы, полезное для лечения сепсиса, а также для анализа и диагностики, включает материал из полых волокон для избирательного связывания токсинов». Патент DE 10258944 (Германия), 1 июля 2004 г.
Lee JJ, Jeong KJ, Hashimoto M, Kwon AH, Rwei A, Shankarappa SA, Tsui JH, Kohane DS. Магнитные наночастицы, покрытые синтетическим лигандом, для отделения микрофлюидных бактерий от крови. Nano Lett. 2014; 14 (1): 1–5.
PubMed Статья CAS PubMed Central Google Scholar
Кан Дж. Х., Супер МИ, Юнг К. В., Купер Р. М., Доманский К., Гравелин АР. Аппарат экстракорпоральной очистки крови для терапии сепсиса. Nat Med. 2014; 20: 1211–6. https://doi.org/10.1038/nm.3640.
CAS Статья PubMed PubMed Central Google Scholar
Marshall JC. Сепсис: переосмысление подхода к клиническим исследованиям. J Leukoc Biol. 2008; 83: 471–82.
CAS PubMed Статья PubMed Central Google Scholar
Сандеман С.Р., Хауэлл С.А., Михаловский С.В., Филлипс Г.Дж., Ллойд А.В., Дэвис Дж. Г., Теннисон С.Р., Роулинсон А.П., Козинченко ОП. Удаление воспалительных цитокинов устройством с активированным углем в проточной системе. Биоматериалы. 2008; 29: 1638–44.
CAS PubMed Статья PubMed Central Google Scholar
ДиЛео М.В., Фишер Д.Д., Бертон Б.М., Федершпиль В.Дж. Избирательное улучшение захвата фактора некроза опухоли в устройстве для гемоадсорбции цитокинов с использованием иммобилизованного фактора некроза опухоли.J Biomed Mater Res B Appl Biomater. 2011; 96: 127–33.
PubMed PubMed Central Статья CAS Google Scholar
Шмидт Дж., Манн С., Мор В.Д., Ламперт Р., Фирла У., Цирнгибл Х. Плазмаферез в сочетании с непрерывной венозной гемофильтрацией у хирургических пациентов с сепсисом. Intensive Care Med. 2000; 26: 532.
CAS PubMed Статья PubMed Central Google Scholar
Аннан Д. Заместительная терапия гидрокортизоном при катехоламинзависимом септическом шоке. J Endotoxin Res. 2001. 7 (4): 305–9.
CAS PubMed Статья PubMed Central Google Scholar
Аннан Д. Глюкокортикоиды в лечении тяжелого сепсиса и септического шока. Curr Opin Crit Care. 2005. 11 (5): 449–53.
PubMed Статья PubMed Central Google Scholar
de Kruif MD, Lemaire LC, Giebelen IA, et al. Преднизолон в зависимости от дозы влияет на воспаление и коагуляцию при эндотоксемии человека. J Immunol. 2007. 178 (3): 1845–51.
PubMed Статья PubMed Central Google Scholar
Huh JW, Lim CM, Koh Y, Hong SB. Эффект низких доз гидрокортизона у пациентов с септическим шоком и относительной надпочечниковой недостаточностью: 3 дня против 7 дней лечения [аннотация].Crit Care Med. 2006; 34: A101.
Артикул Google Scholar
Келлум Дж. А., Конг Л., Финк М. П., GenIMS Investigators, et al. Понимание воспалительного цитокинового ответа при пневмонии и сепсисе: результаты исследования генетических и воспалительных маркеров сепсиса (GenIMS). Arch Intern Med. 2007. 167 (15): 1655–63.
CAS PubMed PubMed Central Статья Google Scholar
Russell JA. Вазопрессин при сосудорасширяющем и септическом шоке. Curr Opin Crit Care. 2007; 13: 383–91.
PubMed Статья PubMed Central Google Scholar
Vanhorebeek I, Langouche L, Van den Berghe G. Жесткий контроль уровня глюкозы в крови с помощью инсулина в отделении интенсивной терапии: факты и противоречия. Грудь. 2007; 132: 268–78.
CAS PubMed Статья PubMed Central Google Scholar
Рассел Дж. А., Уолли К. Р., Зингер Дж. И др. Вазопрессин по сравнению с инфузией норадреналина у пациентов с септическим шоком. New Engl J Med. 2008; 358: 877–87.
CAS PubMed Статья PubMed Central Google Scholar
Angelousi A, Karageoropoulos D, Kapaskelis A, Falagas M. Связь между тестами функции щитовидной железы на исходном уровне и исходом пациентов с сепсисом или септическим шоком: систематический обзор. Eur J Endocrinol.2011; 164: 147–55.
CAS PubMed Статья PubMed Central Google Scholar
Takala J, Ruokenen E, Webster N, Nielsen M, Zandstra D, Vundelinckx G, et al. Повышенная смертность, связанная с лечением гормоном роста у взрослых в критическом состоянии. N Engl J Med. 1999; 341: 785–92.
CAS PubMed Статья PubMed Central Google Scholar
Yi C, Cao Y, Mao SH, Liu H, Ji LL, Xu SY, et al. Рекомбинантный гормон роста человека улучшает выживаемость и защищает от острого повреждения легких при сепсисе мышиного Staphylococcus aureus. Inflamm Res. 2009. 58 (12): 855–62.
CAS PubMed Статья PubMed Central Google Scholar
Rettew JA, Huet YM, Marriott I. Эстрогены увеличивают экспрессию TLR4 на клеточной поверхности макрофагов мышей и регулируют восприимчивость к сепсису in vivo.Эндокринология. 2009. 150 (8): 3877–84.
CAS PubMed Статья PubMed Central Google Scholar
Канда Н., Цучида Т., Тамаки К. Тестостерон подавляет выработку иммуноглобулина мононуклеарными клетками периферической крови человека. Clin Exp Immunol. 1996. 106 (2): 410–5.
CAS PubMed PubMed Central Статья Google Scholar
Parienti JJ, Mongardon N, Mégarbane B, Mira JP, Kalfon P, Gros A, Marqué S, Thuong M, Pottier V, Ramakers M, Savary B, Seguin A, Valette X, Terzi N, Sauneuf B , Cattoir V, Mermel LA, du Cheyron D.Внутрисосудистые осложнения катетеризации центральных вен по месту введения. N Engl J Med. 2015; 373 (13): 1220–9.
CAS Статья Google Scholar
Ge X, Cavallazzi R, Li C, Pan SM, Wang YW, Wang FL. Места центрального венозного доступа для профилактики венозного тромбоза, стеноза и инфекции. Кокрановская база данных Syst Rev.2012; 14 (3): CD004084.
Google Scholar
Марик П.Е., Флеммер М., Харрисон В. Риск катетерной инфекции кровотока при использовании бедренных венозных катетеров по сравнению с подключичными и внутренними яремными венозными катетерами: систематический обзор литературы и метаанализ. Crit Care Med. 2012. 40 (8): 2479–85.
PubMed Статья PubMed Central Google Scholar
Raad I, Costerton W., Sabharwal U, Sacilowski M, Anaisse E, Bodey GP. Ультраструктурный анализ постоянных сосудистых катетеров: количественная взаимосвязь между колонизацией просвета и продолжительностью размещения.J Infect Dis. 1993. 168: 400–7.
CAS PubMed Статья PubMed Central Google Scholar
Safdar N, Fine JP, Maki DG. Мета-анализ: методы диагностики инфекции кровотока, связанной с внутрисосудистыми устройствами. Ann Intern Med. 2005. 142 (6): 451–66.
PubMed PubMed Central Статья Google Scholar
Мимоз О., Виллемини С., Рагот С. и др.Антисептический раствор на основе хлоргексидина по сравнению с повидон-йодом на спиртовой основе для ухода за центральным венозным катетером. Arch Intern Med. 2007. 167 (19): 2066–72.
CAS PubMed Статья PubMed Central Google Scholar
Кобб Д.К., Хай КП, Сойер Р.Г. и др. Контролируемое испытание плановой замены катетеров центральных вен и легочной артерии. N Engl J Med. 1992. 327 (15): 1062–8.
CAS PubMed Статья Google Scholar
Frasca D, Dahyot-Fizelier C, Mimoz O. Профилактика инфекций, связанных с центральным венозным катетером, в отделении интенсивной терапии. Crit Care. 2010; 14 (2): 212.
PubMed PubMed Central Статья Google Scholar
Ноэлтинг Дж., Юревич Б., Аллард Дж. П. Неантибиотические антимикробные растворы для фиксации катетера у пациентов, находящихся на домашнем парентеральном питании. Питательные вещества. 2018; 10 (9). https://doi.org/10.3390/nu100
Деллинджер Р.П., Леви М.М., Карлет Дж. М. и др. Кампания по выживанию при сепсисе: международные рекомендации по ведению тяжелого сепсиса и септического шока: 2008 г. [опубликованное исправление опубликовано в журнале интенсивной терапии. 2008. 34 (4): 783–785. Intensive Care Med. 2008. 34 (1): 17–60.
PubMed Статья Google Scholar
Родс А., Эванс Л. Е., Альхазани В., Леви М. М., Антонелли М., Феррер Р., Кумар А., Севрански Д. Е., Спрунг К. Л., Наннелли М. Е. и др.Кампания Surviving Sepsis: международные рекомендации по ведению сепсиса и септического шока: 2016. Intensive Care Med. 2017; 43: 304–77.
Артикул PubMed Google Scholar
Леви М.М., Эванс Л.Э., Родс А. Комплект кампании «Выжившие при сепсисе»: обновление 2018 г. Intensive Care Med. 2018; 44 (6): 925–8.
CAS PubMed Статья PubMed Central Google Scholar
Дизентерия: лечение, симптомы и причины
Дизентерия — это воспаление кишечника, в первую очередь толстой кишки.
Это может привести к легким или сильным спазмам желудка и тяжелой диарее со слизью или кровью в кале.
Без адекватной гидратации это может быть фатальным.
Заражение бациллой Shigella или бактериями является наиболее частой причиной.
Вот несколько ключевых моментов о дизентерии. Более подробно в основной статье.
- Дизентерия — это инфекция кишечного тракта.
- Симптомы включают спазмы желудка и диарею.
- У многих людей симптомы легкие, но дизентерия может быть фатальной без адекватной гидратации.
Дизентерия — это инфекционное заболевание, сопровождающееся тяжелой диареей.
В США признаки и симптомы обычно незначительны и обычно исчезают в течение нескольких дней. Большинство людей не обращаются за медицинской помощью.
Однако, если человек обращается за медицинской помощью по поводу дизентерии в США, необходимо проинформировать власти. Это заболевание, подлежащее регистрации.
Ежегодно во всем мире регистрируется от 120 до 165 миллионов случаев заражения Shigella , из которых 1 миллион приводит к летальному исходу.Более 60 процентов этих смертельных случаев — дети в возрасте до 5 лет в развивающихся странах.
Результаты лабораторных исследований покажут, вызвана ли инфекция инфекцией Shigella или Entamoeba histolyca.
Если лечение необходимо, оно будет зависеть от этих результатов.
Однако любой пациент с диареей или рвотой должен пить много жидкости, чтобы предотвратить обезвоживание.
Если они не могут пить или если диарея и рвота обильные, может потребоваться внутривенное (в / в) восполнение жидкости.Пациент будет помещен на капельницу и под наблюдением.
Лечение легкой бактериальной дизентерии
Легкая бактериальная дизентерия, которая обычно встречается в развитых странах с хорошей санитарией, обычно проходит без лечения.
Однако пациенту следует пить много жидкости.
В более тяжелых случаях доступны антибиотики.
Лечение амебной дизентерии
Для лечения Entamoeba histolyca используются амебицидные препараты.Это гарантирует, что амеба не выживет в организме после исчезновения симптомов.
Флагил или метронидазол часто используется для лечения дизентерии. Он лечит как бактерии, так и паразитов.
Если результаты лабораторных исследований неясны, пациенту может быть назначена комбинация антибиотиков и амебицидных препаратов, в зависимости от степени тяжести симптомов.
Симптомы дизентерии варьируются от легких до тяжелых, во многом в зависимости от качества санитарии в районах, где распространилась инфекция.
В развитых странах признаки и симптомы дизентерии обычно более легкие, чем в развивающихся странах или тропических регионах.
Легкие симптомы включают:
- небольшую боль в животе
- спазмы
- диарею
Обычно они появляются через 1-3 дня после заражения, и пациент выздоравливает в течение недели.
У некоторых людей также развивается непереносимость лактозы, которая может длиться долго, иногда годами.
Симптомы бактериальной дизентерии
Симптомы обычно появляются в течение 1–3 дней после заражения.Обычно наблюдается легкая боль в животе и диарея, но нет крови или слизи в кале. Поначалу может быть частым понос.
Реже может быть:
- кровь или слизь в кале
- сильная боль в животе
- лихорадка
- тошнота
- рвота
Часто симптомы настолько легкие, что посещение врача не требуется, и проблема решается за несколько дней.
Симптомы амебной дизентерии
У человека с амебной дизентерией могут быть:
- боль в животе
- лихорадка и озноб
- тошнота и рвота
- водянистая диарея, которая может содержать кровь, 924 или гнойник 32 стула
- усталость
- прерывистый запор
Если амебы проходят через стенку кишечника, они могут распространиться в кровоток и инфицировать другие органы.
Могут развиться язвы. Они могут кровоточить, вызывая кровь в стуле.
Симптомы могут сохраняться в течение нескольких недель.
Амебы могут продолжать жить в организме человека-хозяина после исчезновения симптомов. Затем симптомы могут повториться, когда иммунная система человека ослабнет.
Лечение снижает риск выживания амеб.
Бациллярная дизентерия или шигеллез
Этот тип вызывает наиболее серьезные симптомы. Это вызвано бациллой Shigella .
Основной причиной является плохая гигиена. Шигеллез также может передаваться из-за испорченной пищи.
В Западной Европе и США это самый распространенный тип дизентерии у людей, не посещавших тропики незадолго до заражения.
Амебная дизентерия или амебиаз
Этот тип вызывается амебой Entamoeba histolytica (E. histolytica) .
Амебы группируются вместе, образуя кисту, и эти кисты выходят из организма с фекалиями человека.
В районах с плохой санитарией амебы могут заражать пищу и воду, а также заражать других людей, поскольку они могут долгое время выживать вне тела.
Они также могут задерживаться на руках людей после посещения туалета. Соблюдение правил гигиены снижает риск распространения инфекции.
Чаще встречается в тропиках, но иногда встречается в некоторых сельских районах Канады.
Другие причины
Другие причины включают заражение паразитарным червем, химическое раздражение или вирусную инфекцию.
Врач спросит пациента об их признаках и симптомах и проведет медицинский осмотр.
Может потребоваться образец стула, особенно если пациент недавно вернулся из тропиков.
Если симптомы серьезные, может быть рекомендована диагностическая визуализация. Это может быть УЗИ или эндоскопия.
Осложнения дизентерии немногочисленны, но могут быть серьезными.
Обезвоживание : Частая диарея и рвота могут быстро привести к обезвоживанию.У младенцев и маленьких детей это может быстро стать опасным для жизни.
Абсцесс печени : Если амебы распространяются на печень, там может образоваться абсцесс.
Постинфекционный артрит : боль в суставах может возникнуть после инфекции.
Гемолитико-уремический синдром : Shigella dysenteriae может вызывать блокировку эритроцитами входа в почки, что приводит к анемии, низкому количеству тромбоцитов и почечной недостаточности.
У пациентов также наблюдались судороги после заражения.
Дизентерия в основном возникает из-за плохой гигиены.
Чтобы снизить риск заражения, люди должны регулярно мыть руки с мылом, особенно до и после посещения туалета и приготовления пищи.
Это может снизить частоту инфекций Shigella и других типов диареи до 35 процентов.
Другие меры, которые следует предпринять, когда риск повышен, например, во время путешествия, включают:
- Пейте только воду из надежных источников, например воду в бутылках
- Наблюдайте за открытием бутылки и очищайте верхнюю часть обода перед употреблением
- Убедитесь, что пища тщательно приготовлена.
Лучше всего использовать очищенную воду для чистки зубов и избегать кубиков льда, так как источник воды может быть неизвестен.
Постдиализная парентеральная противомикробная терапия у пациентов, получающих прерывистый высокопоточный гемодиализ
Ванкомицин
Ванкомицин — гликопептидный антибиотик со спектром активности, ограниченным грамположительными бактериями, включая MRSA, который с недавнего времени используется в клинической практике. 1950-е годы. В настоящее время принятый фармакодинамический индекс (PD), связанный с эффективностью ванкомицина против S. aureus , представляет собой площадь под кривой для отношения минимальной ингибирующей концентрации (AUC / MIC) ≥ 400 [13].Следует отметить, что эта цель PK / PD в значительной степени основана на данных ретроспективных наблюдений и остается недоказанной в условиях ТПН, требующей ИБС [13]. Ванкомицин в основном выводится через почки, при этом почечный клиренс составляет ~ 70% от общего клиренса у пациентов с нормальной функцией почек и достигает 95% от общего клиренса у пациентов с ТПН [10]. Повышенная доля почечного клиренса при ХПН может быть связана с метаболическими изменениями из-за присутствия уремических токсинов [10]. Диализируемость ванкомицина при использовании высокопроницаемых мембран составляет 25–50% [11, 14, 15].Благодаря высокой степени почечного клиренса, низкой стоимости, длительности клинического периода, возможности мониторинга терапевтических препаратов (TDM) и повышенной заболеваемости MRSA-инфекциями среди пациентов с ESRD, которым требуется ИБС, существует обширный опыт применения ванкомицина с или после ИБС.
Дозирование ванкомицина при ИБС с высокой интенсивностью потока хорошо описано, а общий подход к терапии кратко изложен в Таблице 1 [9,10,11, 13]. Пациентам, нуждающимся в ИБС, рекомендуется нагрузочная доза 15-25 мг / кг для быстрого достижения терапевтических концентраций [13, 16].TDM рекомендуется использовать для определения поддерживающих доз, которые обычно составляют 5–10 мг / кг [9, 13]. Следует отметить, что требования к дозировке обычно выше, если ванкомицин вводится интрадиалитически (в течение последних 1-2 часов ИБС в зависимости от дозы), поскольку такая практика, как было показано, снижает уровни ванкомицина в сыворотке крови на 25-35% [13, 17, 18]. После ИБС с высоким потоком концентрации ванкомицина в плазме восстанавливаются в течение 3–6 часов из-за перераспределения препарата из мест связывания с белками.Поэтому рекомендуется контролировать уровень ванкомицина в сыворотке до ИБС [10]. Как правило, при уровне сыворотки до ИБС <25 мкг / мл ванкомицин будет вводиться после ИБС с выбором дозы в зависимости от следующих факторов: концентрация ванкомицина в сыворотке, вес пациента, место и тяжесть инфекции, а также вероятность достижения цели. Рекомендуется повторное введение ванкомицина при уровне сыворотки до ИБС> 25 мкг / мл [9]. Частота TDM может быть изменена на еженедельную после регистрации нескольких последовательных терапевтических уровней сыворотки до ИБС [19].
Таблица 1 Предлагаемые режимы постдиалитического дозирования для внутривенных антимикробных препаратов, вводимых после трехнедельного интенсивного гемодиализа у пациентов с хронической ТПНХотя частая TDM для ванкомицина обычно выполняется в клинических условиях для пациентов с ТПН, требующих ИБС, несколько алгоритмов были предложены для упрощения дозирования и уменьшения количества определений концентрации. Старые алгоритмы продемонстрировали экономическую выгоду за счет снижения количества получаемых уровней ванкомицина в сыворотке.Хотя исследователям удавалось достичь желаемых уровней сыворотки до ИБС> 95% времени, в этих исследованиях использовались устаревшие мишени PK / PD [11, 13, 15]. Целевые диапазоны концентраций в сыворотке до ИБС составляли 5–15 мкг / мл или 5–20 мкг / мл в двух из этих исследований, что ниже рекомендованного в настоящее время целевого диапазона до ИБС в 15–20 мкг / мл в качестве суррогата для достижения AUC 400–600 мкг * ч / мл [11, 13, 15]. В более недавнем исследовании, оценивающем эффективность алгоритмического дозирования ванкомицина, вводимого после ИБС, использовалось моделирование Монте-Карло для прогнозирования доли пациентов, которые достигли бы целевых уровней сывороточного уровня с использованием существующего протокола.Результаты показали, что только 15,6% пациентов достигли концентрации 15–20 мкг / мл перед ИБС при дозировке нагрузки 1 г с последующим интрадиализным введением поддерживающих доз 500 мг в течение последнего часа. Новый протокол, использующий индивидуальную стратегию дозирования, основанную на диапазонах веса, был разработан и проспективно утвержден у 29 пациентов. При использовании этого обновленного протокола 65,5% поддерживающих минимальных значений до ИБС находились между 10 и 20 мкг / мл, а 37,9% — между 15 и 20 мкг / мл [20].Недавний систематический обзор, посвященный оценке стратегий дозирования ванкомицина в условиях ИБС с высоким потоком, показал, что индивидуализированное дозирование на основе веса (WBD), по-видимому, превосходит не-WBD, такое как алгоритмическое дозирование, в достижении цели PK / PD. Концентрация до ИБС 15–20 мкг / мл была достигнута в 50–67% исследований с использованием WBD по сравнению с 37–38% исследований без WBD для поддерживающей дозы. Авторы пришли к выводу, что необходимы дальнейшие исследования для оценки достижения AUC / MIC ≥ 400 и оценки клинических исходов в этой популяции пациентов [21].
Хотя алгоритмы дозирования ванкомицина при ИБС продемонстрировали ограниченный потенциал в достижении изученных целевых уровней, полученные результаты неоднозначны, и, безусловно, необходимы дополнительные данные об использовании алгоритмов, которые надежно достигают уровней до ИБС 15-20 мкг / мл, суррогат современного целевого достижения PK / PD AUC / MIC 400–600 мкг * ч / мл [13] для тяжелых инвазивных инфекций MRSA. Существуют и другие ограничения, связанные с доступными данными, включая небольшие размеры выборок, различия во времени введения ванкомицина, несоответствия протоколов мониторинга и вариабельность PK в этой популяции пациентов [19].Поэтому рекомендуется использовать индивидуализированный TDM, чтобы определить подходящий график поддерживающей дозировки ванкомицина для пациентов с ТПН, нуждающихся в ИБС [19].
Телаванцин
Телаванцин представляет собой липогликопептид и производное ванкомицина со спектром активности, охватывающим грамположительные организмы, включая виды с повышенной устойчивостью, такие как промежуточное соединение с ванкомицином S. aureus (VISA) [22]. Подобно ванкомицину, телаванцин обладает антимикробной активностью в отношении S . aureus , по-видимому, лучше всего коррелирует с AUC 24 / MIC [23]. Минимальное соотношение свободных (несвязанных) AUC 24 / МИК (fAUC 24 / МИК) примерно 50 требуется для бактериостатической активности против чувствительных к ванкомицину изолятов S. aureus , тогда как fAUC 24 / МИК > 150 необходимо для максимальной бактерицидной активности [24]. Используя существующие данные PK для однократной дозы, была рассчитана доза телаванцина 10 мг / кг на основе фактической массы тела, чтобы обеспечить fAUC 24 / MIC 90 ~ 800 против клинических изолятов S. aureus [24]. Показания к применению телаванцина, одобренные FDA США, включают осложненные инфекции кожи и кожных структур (cSSSI), а также внутрибольничную (HABP) и связанную с вентилятором бактериальную пневмонию (VABP) [23]. Повышенная эффективность телаванцина против S. aureus по сравнению с ванкомицином подтверждает его роль в качестве альтернативного агента для трудно поддающихся лечению грамположительных инфекций, которые представляют собой серьезное бремя для многих пациентов с ТПН, получающих ИБС.В информации о назначении телаванцина FDA не приводится рекомендуемая стратегия дозирования телаванцина при ИБС, что свидетельствует о недостаточности данных. Однако в последние годы в нескольких исследованиях была предпринята попытка описать потенциальные стратегии дозирования для этой популяции пациентов и предоставить предварительную поддержку для использования телаванцина при приеме доз три раза в неделю после ИБС [25, 26, 27].
Было проведено исследование 44 неинфицированных взрослых с целью определения PK-параметров телаванцина при различной степени почечной дисфункции.Пациенты были разделены на три группы: с нормальной функцией почек (клиренс креатинина [CrCl]> 80 мл / мин, n = 15), тяжелой почечной недостаточностью (CrCl <30 мл / мин, n = 15) и ЭПРД на ИБС ( n = 14). Все субъекты получили одну дозу телаванцина 7,5 мг / кг в течение 1-часовой инфузии. Среднее значение AUC 48 , основанное на общих концентрациях лекарственного средства для пациентов с ТПН, составило 1336 мкг * ч / мл, что примерно в 2,5 раза выше, чем у пациентов с нормальной функцией почек (539 мкг * ч / мл) [25].
В отдельном сборнике двух ФК-исследований фазы I оценивали медицински стабильных взрослых с различной степенью почечной функции, от нормальной (CrCl> 80 мл / мин) до ТПН (требующей ИБС). Всего между двумя исследованиями было включено 72 пациента ( n = 29 для исследования A и n = 43 для исследования B), в том числе 6 с ESRD, получавших ИБС, все из которых были включены в исследование A. А получил однократную дозу телаванцина 7,5 мг / кг в течение 1-часовой инфузии, а субъекты в исследовании B получили однократную дозу телаванцина 10 мг / кг в течение 1-часовой инфузии.Пациенты с ESRD получали 4-часовой сеанс гемодиализа с низким потоком, который начинали через 2–4 часа после введения телаванцина. Средняя AUC ∞ для субъектов с ESRD в исследовании A составляла 1010 мкг * ч / мл, что почти вдвое больше, чем у субъектов с нормальной функцией почек (560 мкг * ч / мл). Кроме того, клиренс телаванцина был снижен у пациентов с ТПН до 8,18 мл / ч / кг по сравнению с 13,7 мл / ч / кг (исследование A) и 17,0 мл / ч / кг (исследование B) у пациентов с нормальной функцией почек. У пациентов с ТПН 4-часовой сеанс ИБС с низким потоком элиминировал ~ 6% дозы телаванцина.Возникшие за время лечения побочные эффекты были схожими для пациентов с ТПН и встречались у 2/6 (33%) по сравнению с 24/72 (33%) всех пациентов, включенных в исследование [26].
Совсем недавно была проведена ретроспективная двухцентровая серия случаев восьми госпитализированных пациентов с исходной ТПН, нуждающихся в ИБС, которые получали монотерапию телаванцином от рефрактерной бактериемии MRSA, для количественной оценки клинических исходов, связанных с использованием дозировок телаванцина не по инструкции. в этой популяции пациентов. Тип диализатора в этом исследовании не упоминался.Стратегия дозирования телаванцина составляла 10 мг / кг трижды в неделю после ИБС у пяти пациентов и 10 мг / кг каждые 48 часов для остальных трех пациентов. О продолжительности терапии не сообщалось. Все включенные пациенты имели рецидивирующую или стойкую (≥ 3 дней) бактериемию MRSA с МИК ванкомицина ≥ 2 мг / л в семи из восьми случаев (87,5%). Источником инфекции считался артериовенозный (АВ) трансплантат или свищ в семи из восьми случаев (87,5%) и эндокардит митрального клапана в оставшемся случае.Микробиологическое излечение и 30-дневная выживаемость отмечены у семи из восьми пациентов (87,5%). Средняя продолжительность бактериемии была значительно короче после перехода на терапию телаванцином (1 день) по сравнению с терапией антибиотиками, предшествовавшей телаванцину (16 дней). В этом исследовании не было отмечено никаких побочных эффектов [27].
Основываясь на профиле воздействия телаванцина при ESRD, доступные PK-данные, по-видимому, подтверждают осуществимость дозирования телаванцина после ИБС трижды в неделю. Однако клинические данные крайне ограничены, а типы диализаторов были либо низкопоточными, либо не зарегистрированными [25,26,27].Оптимальная дозировка телаванцина после ИБС с высоким потоком остается неизвестной, а профиль безопасности дозирования телаванцина при ИБС плохо охарактеризован. Кроме того, доступные данные PK у пациентов, нуждающихся в ИБС, ограничены анализами однократной дозы, и, безусловно, существует вероятность накопления препарата после повторных доз после ИБС. Это актуально с токсикологической точки зрения при рассмотрении возможных побочных эффектов телаванцина, которые включают удлинение интервала QTc [23].
Кроме того, необходимо отметить, что пациенты с ранее существовавшей умеренно-тяжелой почечной дисфункцией имели более низкие показатели успеха лечения в подгрупповом анализе испытаний фазы III, оценивающих телаванцин для cSSSI, а также испытали повышенную смертность в исследованиях фазы III, оценивающих телаванцин. для HABP / VABP [27, 28]. Эти результаты, по-видимому, оспаривают данные, показывающие, что средние сывороточные ингибирующие титры телаванцина (SIT) по сравнению с эталонным штаммом S. aureus коррелировали со средними концентрациями телаванцина в плазме у пациентов с различной степенью почечной недостаточности, что свидетельствует об отсутствии компромисса в отношении антимикробной активности, связанной с к ESRD [27].Тем не менее, перед рассмотрением применения телаванцина в таких условиях следует провести тщательную оценку соотношения риск / польза.
Даптомицин
Даптомицин — циклический липопептидный антибиотик с широким спектром активности против грамположительных бактерий, включая MRSA и устойчивые к ванкомицину энтерококки (VRE). Даптомицин сильно связывается с белками, имеет относительно низкий Vd и выводится в основном почками [29]. В одном из отчетов было высказано предположение, что параметр PD AUC 24 / MIC> 666, основанный на общих концентрациях лекарственного средства, коррелирует с улучшенными исходами у пациентов, получавших даптомицин, но это требует дальнейшей проверки, и окончательный порог еще не определен [30].У пациентов с ТПН, которым требуется ИБС, одобренная FDA стратегия дозирования составляет 4 или 6 мг / кг каждые 48 ч, независимо от режима диализа [29]. В клинической практике высокие дозы даптомицина, не указанные по назначению, 8–12 мг / кг каждые 24 часа для нормальной функции почек и 8–12 мг / кг каждые 48 часов для CrCl <30 мл / мин и ESRD иногда используются при тяжелых инфекциях, вызванных по Staphylococcus spp . и Enterococcus spp . В информации о назначении указано среднее значение AUC ∞ , равное 1193 мкг * ч / мл у пациентов, получающих гемодиализ после однократного введения 4 мг / кг, по сравнению с AUC ∞ , равным 417 мкг * час / мл у пациентов с CrCl> 80 мл / мин [29].Неблагоприятным событием, связанным с приемом даптомицина, является повышение уровня креатинфосфокиназы (КФК) с последствиями миопатии и даже рабдомиолиза в редких случаях. Ограниченные данные предполагают, что повышение уровня КФК связано с длительным минимальным уровнем даптомицина> 25 мкг / мл [31]. Учитывая нехватку альтернатив ванкомицину, которые можно назначать три раза в неделю после ИБС при инвазивных грамположительных инфекциях, в нескольких исследованиях за последние 10 лет оценивалась способность даптомицина соответствовать этой нише.
Возможность дозирования трижды в неделю была первоначально предложена в пилотном исследовании PK с участием шести неинфицированных пациентов, нуждающихся в хронической ИБС, которое продемонстрировало минимальные концентрации до 68 часов, которые превышали MIC 90 для S . aureus после введения дозы даптомицина 6 мг / кг после ИБС [32]. Средняя смоделированная концентрация через 68 часов составляла 10,9 ± 3,3 мкг / мл, а средняя AUC ∞ при отсутствии ИБС составляла 2168 мкг * ч / мл. В этом исследовании было отмечено, что процент удаления даптомицина после 4-часового сеанса высокопроизводительного гемодиализа составил 52% [32].Эта цифра заметно превышает указанное в предписании значение 15% при использовании диализатора неуказанного типа [29]. Авторы отметили, что проспективная валидация PK требуется для даптомицина, вводимого после гемодиализа.
Было проведено отдельное PK-исследование 16 неинфицированных пациентов с хронической ИБС, получавших даптомицин 6 мг / кг трижды в неделю после ИБС. Было обнаружено, что доля даптомицина, удаляемая HD с высоким потоком (HFHD), составила 39%. Среднее общее лекарство в стационарном состоянии C мин за 72 часа, полученное до ИБС, составило 15.3 мкг / мл [33]. Несмотря на то, что он значительно выше стабильного состояния C мин 6,7 мкг / мл при дозе 6 мг / кг для здоровых добровольцев, он остается ниже предлагаемого порогового значения токсичности> 25 мкг / мл [29, 31]. Данные также предполагают, что концентрации останутся выше S . aureus Предел чувствительности к даптомицину (1 мкг / мл) в течение 72-часового интердиалитического периода без превышения дозы 6 мг / кг, исходя из расчетной минимальной концентрации свободного лекарственного средства, равной 1.5 мкг / мл [33].
Анализ Монте-Карло был направлен на определение оптимальной схемы дозирования даптомицина после диализа путем определения значений AUC, найденных в S . aureus исследование бактериально-инфекционного эндокардита (SAB-IE). Пациенты получали 3,5-часовой сеанс HD с использованием высокопроницаемых мембран трижды в неделю, и несколько образцов крови были собраны в течение 3-дневного периода. Основываясь на результатах, авторы рекомендовали рассмотреть возможность введения более высокой дозы на 50% в течение 72-часового интердиалитического периода [34].Хотя такая стратегия может привести к получению одной дозы даптомицина в неделю 9 мг / кг или выше, потенциально высокие концентрации C max не связаны с повышенным риском токсичности [34, 35].
PK даптомицина после ИБС были дополнительно выяснены в отдельном анализе PK / PD с участием 5000 субъектов, в котором моделировались данные 26 пациентов, получающих ИБС с высокой интенсивностью трижды в неделю из трех предыдущих публикаций [33, 35,36,37]. Целью этого анализа было определение схемы дозирования, которая обеспечила бы сопоставимые профили AUC со значениями, наблюдаемыми в исследовании SAB-IE, для достижения аналогичной эффективности и токсичности.Средние значения AUC 48 и AUC 72 для дозы 6 мг / кг после ИБС составили 1236,9 и 1497,6 соответственно. Эти значения превышали значения AUC 48 и AUC 72 в исследовании SAB-IE, составляющие 860,0 и 1374,7, соответственно. Однако значения AUC имели тенденцию быть ниже в интервале от 48 до 72 часов при дозировании после диализа. AUC 48–72 для дозы 6 мг / кг, введенной после ИБС, составляла 260,7, что почти вдвое меньше значения AUC 48–72 , равного 514.7 для исследования SAB-IE. При введении дозы 9 мг / кг после ИБС значение AUC 48–72 увеличилось до 391,1. Совокупные результаты этого объединенного анализа подтверждают предыдущие выводы о том, что доза 4-6 мг / кг может быть введена после ИБС в течение 48-часового интердиалитического периода, и следует рассмотреть возможность введения более высокой дозы на 50% в течение 72-часового интердиалитического периода для инфекции, вызванные S. aureus . На основании полученных результатов ожидается, что эта стратегия позволит достичь адекватного воздействия антибиотиков на протяжении всего интервала дозирования при сохранении очень низкой вероятности минимальных концентраций, превышающих предлагаемый порог [36].Авторы этого анализа также предлагают рассмотреть возможность более частого мониторинга КФК в этой популяции пациентов, учитывая повышенный исходный риск миопатий и более высокую вероятность того, что концентрации C мин превышают оцененный порог — 72 часа C мин ~ 25 мкг / мл — в одном из исследований [36].
Хотя в нескольких исследованиях PK предлагались стратегии дозирования даптомицина после ИБС, парентеральные антибиотики можно вводить в течение последнего часа сеанса диализа в сообществе, что может поставить под угрозу активность зависимого от концентрации антибиотика, такого как даптомицин.Действительно, PK-исследование семи неинфицированных субъектов, получающих ИБС трижды в неделю по поводу ТПН, оценивало введение даптомицина 6 мг / кг в течение 30 минут в конце сеанса диализа. Снижение на 35% как C max , так и AUC было описано с использованием мембран с высокой проницаемостью. Чтобы компенсировать это, авторы предложили увеличить дозу с 6 до 9 мг / кг при интрадиалитическом введении [37]. Недавний обзор дозирования антимикробных препаратов с различными формами заместительной почечной терапии предлагает аналогичную стратегию и рекомендует увеличение дозы даптомицина на 15–20% при интрадиалитическом введении [33, 35, 37, 38, 39].Хотя было описано интрадиализное дозирование даптомицина, оно менее предпочтительно по сравнению с дозированием после ИБС, поскольку оно усложняет и без того сильно варьирующуюся PK в этой популяции пациентов.
В недавнем проспективном пилотном исследовании оценивалась ФК даптомицина, вводимого в дозе 10 мг / кг в течение 2-минутной инфузии трижды в неделю после 4-часовой ИБС с высокой проницаемостью. В исследование были включены одиннадцать пациентов с грамположительными инфекциями и длительно установленным постоянным катетером или несъемным протезом. Все пациенты достигли клинического разрешения, и ни у одного пациента не было повышенных значений креатинкиназы.Среднее соотношение AUC / MIC составляло 11 516 и варьировалось от 2248 до 36 908. Значения AUC были основаны на 48 или 72 часах в зависимости от интердиалитического окна. Принимая во внимание сообщенный MIC 90 0,5 мкг / мл и предел чувствительности 1 мкг / мл для даптомицина против изолятов S. aureus , авторы пришли к выводу, что стратегия высоких доз позволила достичь целевого показателя AUC для PK / PD. 24 / МИК> 666 для оптимальной бактерицидной активности более эффективно, чем стандартные дозы, и оказались хорошо переносимыми [32, 40].
Хотя имеющиеся данные PK, по-видимому, подтверждают схему дозирования даптомицина после HD трижды в неделю, исследуемые популяции обычно ограничиваются небольшими когортами неинфицированных пациентов, получающих высокопоточный гемодиализ в течение относительно короткого периода, за некоторыми исключениями. Хотя дозирование при ИБС, по-видимому, хорошо переносится [39], данные о клинических исходах у инфицированных пациентов, использующих эту стратегию дозирования, ограничены. Если используется дозировка даптомицина на основе диализа, важно убедиться, что он вводится после ИБС, и следует рассмотреть возможность увеличения дозы (50%) в течение 72-часового интердиалитического периода для оптимизации AUC в течение 48-72 часов. окно.
Цефазолин
Цефазолин — цефалоспорин первого поколения, который используется для лечения многих инфекций, связанных с грамположительными организмами, включая чувствительный к метициллину золотистый стафилококк (MSSA) и некоторые очень чувствительные энтеробактерии. Подобно другим цефалоспоринам, фактор PK / PD эффективности цефазолина — это пропорция времени, в течение которого концентрации свободного лекарственного средства остаются выше MIC в течение интервала дозирования, также обозначаемого как f T> MIC.Целевой показатель> 50% f T> MIC для цефазолина часто упоминается [41,42,43,44], хотя для максимального бактерицидного эффекта цефалоспоринов может потребоваться> 60–70% f T> MIC [45, 46]. Эти исследования не оценивали дозирование цефазолина после ИБС, и неизвестно, подходят ли эти цели, наряду с целями, предложенными для других β-лактамов в этом обзоре, для особых групп населения, в том числе с ТПН. Пациентам в критическом состоянии может потребоваться более высокая цель, о чем свидетельствует одно исследование PK / PD, демонстрирующее улучшение показателей клинического излечения и бактериологической эрадикации при 100% T> MIC для цефтазидима и цефепима [47].В других исследованиях предлагалось использовать минимальные (минимальные) концентрации β-лактама, по крайней мере, в два-пять раз выше МПК ( f C мин / МПК> 2–5), что было связано с улучшением исходов у пациентов, получавших лечение от инфекции нижних дыхательных путей, вызванные грамотрицательными патогенами [48,49,50,51].
FDA не дает четких рекомендаций по дозированию цефазолина у пациентов, перенесших ИБС, однако дает комментарии для пациентов с CrCl ≤ 10 мл / мин, рекомендуя половину обычной дозы каждые 18–24 ч [52].Цефазолин широко распределяется в большинстве тканей организма с высоким уровнем связывания с белками (80%), и до 80% выводится в неизмененном виде через почки. Учитывая, что цефазолин является часто назначаемым антибиотиком при инвазивных грамположительных инфекциях как в стационарных, так и в амбулаторных условиях, в нескольких исследованиях за последние пару десятилетий оценивались различные стратегии дозирования у пациентов, перенесших ИБС [53,54,55,56]. В справочниках по дозированию противомикробных препаратов в настоящее время признается прием цефазолина после диализа трижды в неделю, поскольку многочисленные исследования продемонстрировали благоприятные клинические результаты с этой стратегией [53, 56, 57].
Ранние данные в поддержку постдиалитического дозирования цефазолина включают проспективный PK-анализ пациентов с анурией с хронической ТПН, нуждающихся в ИБС в амбулаторном диализном центре, которые лечились цефазолином 1 г ( n = 11) или 2 г ( n = 4) после диализа трижды в неделю для различных положительных культур крови и ран [58]. Продолжительность терапии не указана. В этом исследовании использовались диализаторы из полисульфона с высокой текучестью. Средний пиковый уровень цефазолина составил 193 мкг / мл, что ниже порогового значения> 470 мкг / мл, связанного с цефазолин-индуцированной энцефалопатией и судорогами [59].После экстраполяции на 48 и 72 часа все преддиализные общие уровни сыворотки оставались значительно выше 8 мкг / мл, контрольной точки МИК, использованной в этом исследовании. У всех инфицированных пациентов, получавших цефазолин, наблюдалось клиническое выздоровление с одним прекращением лечения из-за сыпи. Токсических эффектов цефазолина среди исследуемых пациентов не наблюдалось [58]. Авторы пришли к выводу, что цефазолин 1 г (~ 15 мг / кг) после диализа хорошо переносится и эффективен против чувствительных изолятов у пациентов с анурией и хронической ТПН, требующих ИБС.
Дополнительные ранние доказательства, подтверждающие постдиализное дозирование цефазолина, включают PK-исследование 15 пациентов с ТПН и подозреваемой или задокументированной инфекцией, получивших либо обычную ИБС ( n = 5), либо высокоэффективную ИБС ( n = 5), либо высокопоточный ИГД ( n = 5) в течение ~ 4 ч. Также оценивались конечные точки безопасности и эффективности. Пациенты получали цефазолин в дозе 20 мг / кг, исходя из фактической массы тела (доза в диапазоне 1-2 г) после ИБС, как минимум в трех дозах. Были получены концентрации цефазолина до и после диализа.Средняя концентрация общего цефазолина перед диализом составляла 41,6 (± 23,9) мкг / мл для тех, кто получал ИБС с высоким потоком в течение трех сеансов диализа, что соответствует примерно ≥ 2,5-кратному пределу МИК 16 мкг / мл для чувствительных бактерий, используемых в эта учеба. Диализируемость цефазолина составляла ~ 60% у пациентов, получавших ИБС с высоким потоком. У всех пациентов после лечения цефазолином отмечено клиническое исчезновение инфекции без каких-либо побочных реакций. Авторы пришли к выводу, что введение цефазолина в дозе 20 мг / кг три раза в неделю после ИБС является хорошо переносимой и эффективной стратегией дозирования и позволяет достичь адекватных уровней в сыворотке [60].Оптимальная корректировка веса дозирования у пациентов с ожирением с ТПН, нуждающихся в ИБС, не была определена.
Впоследствии в исследовании PK оценивали фиксированную дозу цефазолина 2 г трижды в неделю у 15 неинфицированных пациентов с хронической ТПН, нуждающихся в ИБС. Все пациенты получили ИБС с высоким потоком, за одним исключением ИБС со средним потоком. Примерно половина пациентов страдала анурией. Средняя доза, основанная на фактической массе тела, составляла 28,7 ± 5,22 мг / кг, а средняя минимальная общая концентрация цефазолина на 7 день составляла 61 ± 22 мкг / мл.Все включенные пациенты достигли преддиализных общих концентраций в сыворотке от 3 до 18 раз по сравнению с МИК для восприимчивых организмов, определяемой в этом исследовании как ≤ 8 мкг / мл. Следует отметить увеличение количества побочных реакций по сравнению с вышеупомянутым исследованием Marx et al., Что могло быть связано с использованием фиксированных доз, приводящих к более высоким концентрациям [60]. Из 15 исследованных пациентов сообщалось о реакциях на язвы во рту ( n = 1), крапивницу ( n = 1) и инфекцию Clostridioides difficile ( n = 1) [54].
В отдельном исследовании оценивалась ФК цефазолина у пациентов, перенесших ИБС с высокоэффективной HD (HEHD, n = 15) или HFHD ( n = 10), с акцентом на диализный клиренс. Пациенты получали цефазолин в дозе 15 мг / кг после каждого сеанса ИБС. Примерно 60% включенных пациентов страдали анурией. Средние значения диалитического клиренса и коэффициенты снижения для цефазолина были значительно выше в группе с высоким потоком по сравнению с группой с высокой эффективностью. Средние коэффициенты восстановления цефазолина были равны 0.62 ± 0,08 против 0,50 ± 0,07 соответственно. Эти данные пациентов затем были использованы для разработки PK-модели для моделирования концентраций цефазолина в сыворотке для обоих типов диализаторов с использованием постдиалитических доз цефазолина 15 мг / кг и 20 мг / кг. Основываясь на результатах этой модели, авторы пришли к выводу, что дозы 15-20 мг / кг после каждого сеанса ИБС поддерживали терапевтические концентрации в сыворотке, определяемые как> 8 мкг / мл, в течение 48- или 72-часового интердиалитического периода, независимо от тип диализатора или наличие остаточной функции почек [61].
В дополнительном отчете описывается проспективное исследование режима дозирования цефазолина трижды в неделю в рамках недавно разработанного протокола дозирования у инфицированных пациентов, получающих длительную ИБС с чувствительными микроорганизмами. В исследовательском центре использовались диализаторы с низким и высоким потоком, с коэффициентом ультрафильтрации от 4,9 до 55 мл / мм рт. Ст. / Ч. Наличие остаточной функции почек не определялось. Концентрации цефазолина в сыворотке крови собирали в конце 72-часового интердиалитического интервала.Пациенты с ИБС получали трижды в неделю дозы 20 мг / кг (максимальная доза 2 г) в зависимости от фактической массы тела. Все 72-часовые концентрации цефазолина в сыворотке оставались выше контрольной точки чувствительности 8 мкг / мл при средней концентрации 42,9 ± 25,8 мкг / мл. О побочных реакциях с этой стратегией дозирования не сообщалось. Авторы предположили, что прием цефазолина в дозе 20 мг / кг трижды в неделю является адекватным для пациентов, страдающих хронической ИБС [55].
Дополнительные клинические данные, подтверждающие стратегию постдиалитического дозирования, включают проспективное исследование, проведенное в течение 84 месяцев с участием пациентов, инфицированных бактериемией MSSA и находящихся на хроническом высокопоточном гемодиализе.Было проведено сравнение терапии ванкомицином ( n = 77) и цефазолином ( n = 46), при этом неудача лечения была определена через 12 недель после первоначального результата посева крови. Пациенты в группе ванкомицина получали нагрузочную дозу 15 мг / кг и дозу 500 мг после каждого сеанса ИБС с целевой концентрацией в сыворотке 10–15 мкг / мл. Цефазолин вводили в дозе 2 г после диализа в течение 48-часового интердиализа и 3 г в течение 72-часового интердиализа в соответствии со стандартной практикой в этом учреждении.Неудача лечения была значительно чаще в группе ванкомицина (31,2% против 13%). В целом, пациенты с бактериемией MSSA, получавшие цефазолин, имели меньшую продолжительность пребывания (6,5 против 13 дней), смертность (4,4% против 10,4%) и рецидив инфекции (8,7% против 20,8%) по сравнению с пациентами, получавшими ванкомицин. Авторы этого исследования пришли к выводу, что дозирование цефазолина после ИБС по схеме 2 г / 2 г / 3 г хорошо переносится и эффективно для лечения инфекций MSSA у пациентов с ТПН, нуждающихся в ИБС [53].
Дополнительные клинические данные собраны ретроспективным исследованием пациентов с подтвержденной бактериемией MSSA, которые трижды в неделю получали постдиализный цефазолин по 2-3 г в соответствии с протоколом дозирования, по сравнению с пациентами, получавшими клоксациллин 500-2000 мг четыре раза в день до завершите 2 недели терапии. Оцениваемые исходы включали смерть или повторную госпитализацию в течение 30 дней после бактериемии MSSA, наличие метастатических осложнений, рецидив, побочные реакции и расходы на больницу. Всего было включено 27 пациентов, 14 из которых получали терапию цефазолином.Два пациента в группе клоксациллина и один пациент в группе цефазолина умерли. Все рецидивы инфекции произошли в группе клоксациллина, и 7/8 метастатических осложнений были связаны с лечением клоксациллином. В группе цефазолина была более низкая средняя продолжительность госпитализации (10 дней по сравнению с 20 днями) и стоимость госпитализации. Авторы признали, что использование цефазолина в дозе 3 г трижды в неделю приводит к чрезмерным уровням в сыворотке и может увеличить риск токсичности. У трех пациентов, получавших цефазолин, наблюдались идиосинкразические реакции, а именно синдром Стивенса-Джонсона ( n = 2) и лейкопения ( n = 1), все они наблюдались при дозе 3 г трижды в неделю.Учитывая идиосинкразический характер, эти реакции вряд ли были связаны с дозой. Авторы пришли к выводу, что введение цефазолина после ИБС в дозе 2 г трижды в неделю было оправдано с учетом клинических и экономических результатов [56].
На основании обзора доступной литературы, стратегия дозирования цефазолина 2 г трижды в неделю после ИБС может использоваться для большинства инфекций, независимо от наличия остаточной функции почек. Следует рассмотреть дозу 3 г для 72-часового интердиалитического окна, особенно при тяжелых и / или глубоко укоренившихся инфекциях, чтобы улучшить достижение минимальных концентраций выше МПК.Хотя положительные клинические результаты были продемонстрированы при применении цефазолина после ИБС, для подтверждения этой дозировки все же необходимы более масштабные исследования. Кроме того, в этих исследованиях собирали общие концентрации цефазолина. Следовательно, долю интервала дозирования, в которой свободные концентрации превышают контрольную точку МПК, невозможно полностью оценить. Несмотря на доступность ограниченных данных, оценивающих стратегию WBD 20 мг / кг после ИБС, авторы отдают предпочтение стандартизированной стратегии дозирования, рекомендованной ранее, учитывая простоту дозирования, улучшенное удобство, благоприятный профиль безопасности цефазолина и сравнительно более высокий средний общий минимум. концентрации [54, 60].
Цефтазидим
Цефтазидим представляет собой недорогой и часто используемый цефалоспорин третьего поколения с сильной бактерицидной активностью в отношении широкого спектра грамотрицательных патогенов, таких как Enterobacterales, Burkholderia pseudomallei и Pseudomonas54. Он показывает связывание с белком примерно на 20% и Vd 0,23 л / кг. Примерно 80–90% цефтазидима выводится в неизмененном виде с мочой с периодом полувыведения 1-2 часа у пациентов с нормальной функцией почек [62].У пациентов с ТПН это время увеличивается до 28–45 часов, так как выведение практически полностью зависит от почечной экскреции [63]. Цефтазидим значительно удаляется различными методами диализа. Используя фильтры с низким потоком, 6-8-часовой сеанс ИБС удалил примерно 88% цефтазидима в плазме в одном исследовании и 55% цефтазидима во время 4-часового сеанса ИБС в другом [64, 65]. Диализируемость с использованием высокопоточных фильтров неизвестна. Параметром, соответствующим эффективной PD-активности цефтазидима, является достижение концентраций свободного лекарственного средства, превышающих МИК для> 45% стационарного дозирования или интердиалитического интервала ( f T> МИК) [66, 67], с максимальным бактерицидным действием. активность, требующая> 60–70% f T> MIC [45, 46].Одно исследование PK / PD у пациентов в критическом состоянии продемонстрировало улучшение показателей клинического излечения и бактериологической эрадикации с достижением 100% T> MIC для цефтазидима и цефепима [47]. В других исследованиях, посвященных оценке цефепима или меропенема, минимальные (минимальные) концентрации β-лактама в свободном желобе, по крайней мере, в два-пять раз превышающие МПК ( fC мин / МПК> 2–5) были связаны с улучшением исходов у пациентов. лечится от инфекций нижних дыхательных путей, вызванных грамотрицательными патогенами [48,49,50].Модели PK in vitro специально оценивают непрерывные инфузии цефтазидима против P . aeruginosa продемонстрировали эффективность при концентрациях, по крайней мере, в четыре раза превышающих МИК ( C мин / МИК> 4) [68, 69].
В начале 1980-х было проведено несколько исследований PK, направленных на описание элиминации цефтазидима при различной степени почечной функции. Однако диализаторы, используемые в этих исследованиях, а именно капиллярный поток или спираль с купрофановой мембраной, по современным стандартам будут считаться «низкопоточными», что ограничивает экстраполяцию этих данных на текущую практику.Раннее PK-исследование девяти пациентов с анурией с ТПН, нуждающихся в ИБС, продемонстрировало период полувыведения цефтазидима примерно 34 часа после введения 1 г цефтазидима [65]. Постдиализные концентрации препарата были снижены на 55%, в результате чего период полувыведения цефтазидима во время гемодиализа составил 3 часа. Результаты подготовили почву для изучения дозировки цефтазидима после трехнедельной ИБС. Последующее исследование, в котором были выведены данные PK, экстраполированные от 14 пациентов с ТПН, 2 из которых не нуждались в диализе, показало, что доза цефтазидима равнялась 0.5–2 г каждые 36–48 ч, скорректированные по показаниям, будут подходящей дозой для пациентов с клиренсом креатинина <15 мл / мин [63]. Третье исследование, проведенное Hoffler et al. включал PK-анализ однократной дозы цефтазидима 2 г у 29 пациентов с различной степенью почечной функции, от нормальной до ТПН, требующей ИБС. Основываясь на установленных факторах корректировки дозы, можно снизить дозу цефтазидима до 0,5 г в день для пациентов с ТПН, которые обычно получали бы цефтазидим в суточной дозе 6 г [70].
Эти рекомендации сохранялись примерно 30 лет до недавнего времени, когда Loo et al. использовали необработанные данные шести взрослых анефриков из исследования Hoffler et al. исследование, в котором использовались мембраны с низким потоком, чтобы моделировать эффективность дозирования с точки зрения более современных и эффективных методов гемодиализа с высоким потоком [71]. Моделирование основывалось на известных показателях элиминации, не связанной с почками, и удалении диализного препарата 55–88%. Путем повторной оценки вероятностей достижения цели (PTA) различных рекомендаций по дозировке цефтазидима с использованием моделирования методом Монте-Карло авторы смогли предсказать, что PTA 70% T> MIC для MIC ≤ 8 мкг / мл может быть достигнуто в течение 48 -h междиализный период с дозами цефтазидима 1 и 2 г.Однако авторы пришли к выводу, что аналогичная ПТА была возможна только при дозе 2 г в течение более длительного междиалитического периода 72 часа при МПК> 4 мкг / мл. Дозировка 1 г в день позволяет достичь 100% PTA, даже для резистентных организмов с MIC 32 мг / л, и может быть предпочтительным, когда MIC неизвестен или для пациентов в критическом состоянии, которым может быть полезно более высокое% T> MIC [47, 71] .
Клинические отчеты о применении цефтазидима три раза в неделю после ИБС немногочисленны. Недавно случай P . aeruginosa был представлен инфекционный эндокардит с предыдущей неудачей лечения у пациента с анурией с ТПН, требующей высокопотоковой ИБС [72]. МИК цефтазидима для изолята составляла 2 мкг / мл. Концентрации цефтазидима в сыворотке собирали с различными интервалами до 72 часов. Авторы заметили падение концентраций до ИБС ниже 8 мкг / мл через 70 ч при использовании стратегии дозирования цефтазидима 2 г / 2 г / 2 г трижды в неделю после ИБС. В предыдущих исследованиях, документально подтверждающих оптимальную бактерицидную активность цефалоспоринов при минимальных концентрациях, превышающих МИК в четыре раза (что в данном случае соответствует 8 мкг / мл), доза была впоследствии скорректирована до 2 г / 2 г / 3 г, чтобы максимизировать ЧТА в течение 72-часового интердиалитического интервала. [48,49,50,51, 68, 69, 72].Корректировка привела к улучшению минимума на 15 мкг / мл для 72-часового междиалитического окна. Этот режим в сочетании с пероральным ципрофлоксацином использовался в течение 6 недель, хорошо переносился и давал положительный клинический результат [72].
В настоящее время существует очень мало опубликованной литературы по оценке дозирования цефтазидима после ИБС. Также имеется мало данных о клиренсе цефтазидима при использовании высокоинтенсивного диализа по сравнению с низкотемпературным диализом и клиническом влиянии различных стратегий дозирования.Дополнительные исследования, оценивающие достижение более агрессивных целей PK / PD, таких как fC min / MIC> 2–5, были бы очень ценными. Исходя из имеющихся данных, прием цефтазидима в дозе 2 г трижды в неделю после ИБС может быть целесообразным для большинства пациентов в некритическом состоянии с восприимчивыми инфекциями, вызванными Enterobacterales. Стратегия дозирования цефтазидима 2 г / 2 г / 3 г трижды в неделю после ИБС с использованием более высокой дозы для 72-часового интердиалитического окна может быть рассмотрена для пациентов с устойчивыми микроорганизмами, такими как P. aeruginosa или глубоко укоренившиеся инфекции, хотя недостаточно данных, чтобы оправдать широкое применение этих стратегий дозирования.
Цефепим
Цефепим — цефалоспорин четвертого поколения, разработанный в начале 1990-х годов и обладающий широким спектром активности против грамположительных и грамотрицательных бактерий, включая Enterobacter spp ., Citrobacter spp . , и P . aeruginosa , но не действует на строго анаэробные бактерии или MRSA [73, 74].Предлагаемая цель PK / PD для оптимальной бактерицидной активности цефепима — это достижение концентраций свободного лекарства выше МИК ( f T> МИК) в течение ≥ 60% интервала дозирования [45, 46, 75]. Однако цель 100% T> MIC для цефепима и цефтазидима продемонстрировала улучшение показателей клинического излечения в одном исследовании пациентов в критическом состоянии, предполагая, что достижение этой цели может быть необходимо для оптимизации результатов в этой популяции [47]. В других исследованиях PK / PD, оценивающих цефепим для грамотрицательных инфекций, свободные минимальные концентрации по меньшей мере в два раза превышают МПК ( fC мин / МПК> 2) и общие минимальные концентрации не менее четырехкратны МПК ( C ). min / MIC> 4) были связаны со снижением риска неудачи лечения и улучшением микробиологического успеха соответственно [48, 49].
Цефепим в основном выводится почками в неизмененном виде (85%) с периодом полувыведения около 2 часов у субъектов с нормальной функцией почек. У пациентов с анурией и ИБС период полувыведения увеличивается до 22 часов [76]. Было показано, что цефепим демонстрирует зависимый от потока клиренс у пациентов, получающих ИБС с высоким потоком, с диализным клиренсом 120 мл / мин и 179 мл / мин при скорости потока диализа 300 мл / мин и 400 мл / мин соответственно [77 ]. Цефепим слабо связывается с белками плазмы (16–19%) и эффективно выводится при диализе [76].Информация о назначении содержит различные рекомендации по дозировке для пациентов с ИБС: 1 г в 1-й день и 500 мг в день в дальнейшем, предлагаемые для большинства пациентов, и 1 г в день для пациентов с тяжелыми инфекциями [78]. Более того, отдельные рекомендации по дозировке предлагают снижение дозы на 50–75% при введении один раз в день [79].
Множественные фармакокинетические исследования оценивали PK / PD цефепима у пациентов с ТПН, нуждающихся в ИБС, с учетом возможности введения доз три раза в неделю после ИБС. Было проведено мультидозовое фармакологическое исследование, в которое вошли шесть инфицированных пациентов с хронической ИБС без остаточной функции почек, получавших 2 г цефепима в конце трехнедельной ИБС с использованием диализатора полисульфона с высокой пропускной способностью.Были получены минимальные и пиковые уровни сывороточных концентраций, а также процент элиминированного лекарственного средства и период полувыведения во время диализа. У этих пациентов средние пиковые и минимальные общие концентрации в сыворотке составляли 166 ± 49 мкг / мл и 23 ± 7 мкг / мл соответственно. Среднее удаление цефепима составило примерно 70% после 3,5-часового сеанса диализа. Авторы пришли к выводу, что в 2 г цефепима после каждого сеанса ИБС достигается уровень лекарственного средства, значительно превышающий МИК 90 , равный 8 мкг / мл для большинства целевых патогенов, и служит эффективной и экономичной стратегией для пациентов с хронической анурической ИБС с тяжелыми инфекциями [ 80].Учитывая отсутствие клинической корреляции с пациентами с активной инфекцией, 5 лет спустя исследователи из той же группы сообщили о своем клиническом опыте лечения цефепимом 11 пациентов с анурией с ИБС в соответствии с предлагаемым протоколом дозирования и сообщили об успешности 82% [81] .
Несмотря на в целом хорошую переносимость лечения на сегодняшний день, сохраняется некоторая озабоченность по поводу нейротоксичности, вызванной цефепимом, с повышенными минимальными концентрациями в плазме при использовании этой стратегии дозирования. Ранее сообщалось о нейротоксичности, вызванной цефепимом при использовании более высоких доз при ТПН, в том числе об одном случае пациента с анурией, нуждающегося в ИБС с септицемией, который испытал тонико-клонический приступ после 5 дней приема цефепима в дозе 1 г каждые 12 ч, что составляет считается более высокой, чем рекомендуемая доза при ИБС.Уровни цефепима в сыворотке до ИБС в течение трех срочных ежедневных сеансов диализа после начала токсичности и отмены цефепима составляли 105 мкг / мл, 66 мкг / мл и 9,7 мкг / мл соответственно. О типе диализатора не сообщалось [82]. Исследование пациентов с фебрильной нейтропенией и легким нарушением функции почек показало, что вероятность связанной с цефепимом неврологической токсичности, проявляющейся в изменении психического статуса, спутанности сознания или миоклонии, неуклонно возрастает с минимальными уровнями в плазме, превышающими 22 мкг / мл [83].Однако в исследовательском письме сообщается о клиническом опыте и безопасности 33 пациентов, получавших стратегию дозирования цефепима 2 г трижды в неделю после ИБС, по сравнению с альтернативными схемами, включая 13 пациентов, получающих 1 г цефепима в день, у пациентов с грамотрицательной бактериемией. В целом, различий в клиническом успехе у пациентов, получавших 2 г цефепима после ИБС, по сравнению с группой сравнения не наблюдалось (94% против 87%; p = 0,4). Кроме того, цефепим хорошо переносился, и не сообщалось о различиях в результатах по безопасности между группами [84].
Совсем недавно в PK-исследовании девяти пациентов, перенесших ИБС с высоким потоком трижды в неделю, оценивали дозировку цефепима с использованием TDM [85]. Используемая начальная доза составляла 15 мг / кг (от 750 до 1500 мг), а последующие дозы, вводимые трижды в неделю после ИБС, основывались на минимальных уровнях сыворотки, полученных до следующего сеанса диализа. Средние дозы цефепима до 48- и 72-часового интердиализа составляли 775 ± 210 мг и 1125 ± 225 мг соответственно. У пяти пациентов в исследовании был остаточный диурез> 400 мг / день, а у остальных четырех была анурия.Несмотря на это, предписанные дозы цефепима достигли минимальных концентраций, значительно превышающих контрольные точки EUCAST и MIC 90 для всех контрольных организмов, за исключением P . aeruginosa . Референс-лаборатория (Лаборатория клинической фармакологии, Университетская больница CHUV, Швейцария) рекомендовала диапазон минимальных значений 2–15 мкг / мл, и только один пациент с анурией с минимальными значениями ~ 23 мкг / мл достиг ранее предложенного минимального порогового значения 22 мкг / мл. мл для токсичности [83]. Стоит отметить, что дозы цефепима, которые применялись у этих пациентов, были в среднем на ~ 50% ниже, чем фиксированная постдиализная доза 2 г, предложенная Schmaldienst et al.[80]. Другим важным открытием было то, что ~ 80% препарата было выведено в течение 4-часового сеанса интенсивного диализа, что подразумевает потенциальный вариант лечения для пациентов, страдающих от накопления и токсичности. Средние концентрации цефепима были намного ниже у пациентов без анурии. У пациентов с остаточным диурезом следует рассмотреть возможность применения более высоких доз цефепима. Авторы пришли к выводу, что у пациентов с высокочувствительными патогенами стратегия дозирования цефепима трижды в неделю 1 г / 1 г / 1,5 г может быть хорошо переносимой и эффективной.Однако у пациентов с инфекциями, вызванными менее восприимчивыми организмами, такими как P . aeruginosa следует применять стратегию дозирования 1,5 г / 1,5 г / 2 г наряду с мониторингом уровня сыворотки во избежание токсичности. Уместно подчеркнуть, что средние дозы, использованные в этом исследовании, были ниже, чем рекомендованные авторами, и составляли 775 ± 210 мг и 1125 ± 225 мг в течение 48 и 72-часовых междиалитических интервалов, соответственно [85]. Хотя TDM цефепима может быть полезным инструментом для этой особой группы населения, он не всегда доступен в большинстве учреждений, и необходимы дополнительные данные о рентабельности этого вмешательства до его широкого внедрения.
Подобно цефтазидиму, доступные данные, подтверждающие дозирование цефепима после ИБС, немногочисленны. Хотя это очевидно осуществимо с точки зрения ФК / ФД и хорошо переносится в небольших исследуемых группах, необходимы более крупные исследования для проверки доз цефепима, вводимых трижды в неделю после ИБС, до широкого внедрения в текущей практике. На основании доступной литературы, доза цефепима 1 г трижды в неделю после ИБС с увеличенной дозой 1,5 г в течение 72-часового интердиалитического интервала может быть рассмотрена при нетяжелых высокочувствительных инфекциях у пациентов с анурией.Однако клиницистам следует рассмотреть возможность увеличения дозы цефепима до 2 г после ИБС трижды в неделю для тяжелых инфекций и / или инфекций, вызванных менее чувствительными патогенами, такими как P. , aeruginosa , особенно при остаточной почечной функции. Срочно необходимы дополнительные данные по безопасности при использовании этой увеличенной дозы, поскольку средняя минимальная концентрация цефепима, продемонстрированная в одном исследовании (23 мкг / мл), немного превышала предполагаемый минимальный порог токсичности в 22 мкг / мл [81].
Эртапенем
Эртапенем — это парентеральный карбапенем длительного действия, принимаемый один раз в сутки, с широким спектром активности против грамотрицательных бактерий, включая продуценты β-лактамазы расширенного спектра (ESβL), грамположительные бактерии и анаэробы, но не содержащий активность против P. aeruginosa, Acinetobacter baumannii и Enterococcus spp. Широкий спектр действия Эртапенема делает его предпочтительным средством для лечения хронических, сложных, смешанных инфекций, требующих длительной терапии [86,87,88,89].Эртапенем имеет относительно низкий Vd (Vd в стабильном состоянии = 0,12 л / кг у взрослых), и 80% выводится через почки [86]. Эртапенем демонстрирует нелинейную ПК из-за зависящего от концентрации связывания с белками плазмы, которая колеблется от 90 до 95% при терапевтических концентрациях. После введения дозы 1 г общая концентрация лекарственного средства в плазме составляет приблизительно 150 мкг / мл, и около 92% связывается с белками. В ранних исследованиях фармакокинетики вводили более высокие дозы 2–3 г, что приводило к более высоким общим концентрациям (> 150 мкг / мл) и более высоким концентрациям свободного лекарственного средства из-за того, что только 85% лекарства было связано с белком [88].У пациентов с нормальной функцией почек период полувыведения из плазмы составляет примерно 4 часа [86]. Для карбапенемов концентрации свободных лекарственных средств, превышающие МПК организма ( f T> МПК), должны поддерживаться в течение ≥ 40% интервала дозирования для оптимального бактерицидного эффекта, что является более низким целевым показателем, чем требуется для пенициллинов и цефалоспоринов [45, 46, 89 , 90,91,92]. В исследованиях, посвященных оценке PK / PD β-лактама в условиях инвазивных инфекций, вызванных грамотрицательными патогенами, минимальные концентрации свободных лекарств в ≥ 4–5 раз превышали МПК ( fC мин / МПК> 4–5) для β -лактамы были предложены для максимального уничтожения бактерий и ограничения появления резистентности [49, 50, 93, 94].Требуются дополнительные данные, чтобы подтвердить, применимы ли эти цели, в частности, для эртапенема. Контрольные точки чувствительности к МИК для эртапенема для клинически значимых организмов включают 0,5 мкг / мл для Enterobacterales, 4 мкг / мл для анаэробов и 1 мкг / мл для стрептококка [95]. Следует отметить, что для многих исследований, приведенных ниже, указаны общие концентрации лекарственного средства.
У пациентов с тяжелой почечной недостаточностью (CrCl <30 мл / мин / 1,73 м 2 ) и ТПН, требующих ИБС, одобренная FDA стратегия дозирования составляет 500 мг в день по сравнению со стандартной дозой 1 г в день [86].Эта стратегия дозирования была основана на начальном открытом исследовании ФК с участием 26 здоровых добровольцев с различной степенью почечной функции (7 из которых имели ТПН), которым вводили однократную дозу 1 г эртапенема, и сравнивали с историческим контролем. здоровые молодые и пожилые люди [87]. AUC ∞ для пациентов с ESRD была увеличена на 192% по сравнению со здоровым контролем, а период полувыведения увеличился до 14,1 часа. Основываясь на соотношении AUC ∞ (объединенный контроль / ТПН) для всего лекарственного средства, оценочная скорректированная доза в 500 мг в день была рекомендована для достижения терапевтического эффекта без ущерба для безопасности и достижения общего воздействия лекарственного средства, незначительно превышающего наблюдаемое при дозе 1 г. суточная доза в объединенной контрольной группе.Концентрации свободного лекарственного средства измеряли в середине интервала дозирования (12 ч), чтобы гарантировать соблюдение параметров PD, и в результате у пациентов с ESRD они составили 6,7 мкг / мл, что выше контрольных точек MIC для целевых патогенов. Авторы также продемонстрировали, что примерно 30% эртапенема было удалено с помощью 4-часового сеанса гемодиализа с низким потоком. Таким образом, рекомендуется дополнительная доза 150 мг, если начальная доза 500 мг была введена до диализа [87]. Поскольку это исследование оценивало только введение однократной дозы, накопление при ежедневном дозировании не оценивалось.
С точки зрения безопасности, были сообщения о нейротоксичности эртапенема, потенциально связанной с накоплением у пациентов с тяжелой почечной недостаточностью и ТПН, получающих 500 мг эртапенема в день [96,97,98]. Нейротоксичность может проявляться в разной степени, включая судороги, галлюцинации и когнитивную дисфункцию. Возможно, что увеличенный период полувыведения и снижение почечного клиренса при повторных ежедневных дозах может привести к накоплению препарата [76]. Механизм нейротоксичности до конца не изучен, но липофильность и сродство эртапенема к нейромедиаторам γ-аминомасляной кислоты в сочетании с повышенной проницаемостью гематоэнцефалического барьера для β-лактамов при нарушении функции почек могут играть роль [98].Кроме того, среди 13 пациентов, упомянутых в обзоре литературы, нейротоксичность проявлялась после приема 3–7 последовательных ежедневных доз и разрешалась в течение 7–14 дней [96]. Эти пациенты получали диализ с низким потоком, который, как упоминалось ранее, удаляет ~ 30% концентраций эртапенема в плазме по сравнению с диализом с высоким потоком, который может удалить до 70% [97]. Однако сообщалось о нейротоксичности при дозировании эртапенема после ИБС с высоким потоком. Недавний обзор 99 пациентов, получающих гемодиализ, сообщил о 10 пациентах (10%), у которых развилась нейротоксичность, определяемая как судороги или ларингоспазм.Из этих 10 пациентов 6 получали 500 мг в день, а 2 получали 1 г, а затем 500 мг в день. Остальным 2 пациентам потребовалась непрерывная венозно-венозная гемофильтрация (CVVH), и они получали дозу 1 г в день [98]. Были предложены альтернативные стратегии дозирования эртапенема в условиях ИБС, в диапазоне от 500 мг до 1 г трижды в неделю после ИБС, с введением более удобного режима дозирования, который уменьшит количество инфузий, улучшит приверженность и, возможно, сведет к минимуму возможность токсического воздействия. накопление [99,100,101].
Три раза в неделю дозировка 1 г после ИБС была впервые оценена в пилотном исследовании с участием 10 пациентов [99]. Тип диализатора не указан. Общие концентрации эртапенема в желобах были измерены через 44 и 68 часов и составили 3,4–22,6 мкг / мл и 0,5–9,6 мкг / мл, соответственно. Авторы отметили, что все минимальные уровни поддерживались выше МПК для каждого патогена во время интрадиалитических периодов. Средний период полувыведения был больше, чем было впервые установлено Mistry et al. [87], 19,9 ± 5,5 ч.Побочных эффектов не наблюдалось, и клинический успех был достигнут у 8 из 10 пациентов.
ФК-исследование оптимальной дозировки эртапенема у пациентов с ИБС было впоследствии оценено с использованием однократной дозы 1 г эртапенема, вводимой семи госпитализированным неинфицированным пациентам, подвергающимся высокопоточному гемодиализу [100]. Средний период полувыведения был аналогичен тому, который наблюдался ранее при введении 1 г после гемодиализа через 19,3 ± 6,6 часа. Общие концентрации эртапенема, оцененные через 48 часов (в среднем 42 мкг / мл), превышали МИК для Streptococcus, Enterobacterales и анаэробных бактерий.Шесть пациентов испытали побочные эффекты во время исследования, но во всех случаях было установлено, что они, возможно, не связаны с исследуемым препаратом. Авторы пришли к выводу, что режим трижды в неделю, вероятно, обеспечит фармакодинамически достаточное воздействие для противомикробной эффективности и снизит возможность накопления побочных эффектов лекарств при менее частом дозировании. Авторы также определили дополнительные факторы, связанные с пациентом, которые могут потребовать внимания при рассмотрении различных режимов дозирования при ТПН, включая связывание с белками, непочечный клиренс эртапенема и факторы, влияющие на распределение, такие как статус жидкости [100].Как и в первоначальном исследовании PK, применялись только разовые дозы, поэтому невозможно точно оценить потенциал к накоплению. Провалы через 72 ч также не измерялись. Как отмечалось ранее, концентрации в плазме через 48 часов, две трети 72-часового интервала дозирования, поддерживались выше МПК для целевых патогенов.
Более консервативный режим дозирования — 500 мг трижды в неделю после ИБС — был предложен на основе тайваньского проспективного исследования, в котором оценивали интрадиализные концентрации в плазме [101].Двадцать два госпитализированных инфицированных пациента с ТПН получали либо 500 мг в день (контрольная группа), либо 500 мг трижды в неделю после каждого сеанса диализа. При сравнении средние уровни общего и свободного эртапенема в плазме были значительно выше в контрольной группе по сравнению с экспериментальной группой, и примерно 50% эртапенема выводилось с каждым сеансом гемодиализа. О типе диализатора в этом исследовании не сообщалось. Данные из контрольной группы были собраны и использованы для моделирования трех различных режимов дозирования — 500 мг в день, 250 мг в день и 500 мг через день, — которые сравнивались с наблюдаемыми данными в экспериментальной группе.Минимальные концентрации свободного эртапенема в плазме как через 48, так и через 72 часа для экспериментальной группы были выше 2 мкг / мл и хорошо коррелировали с результатами моделирования. Кроме того, в контрольной группе концентрации значительно превышали эти минимальные значения. Следует отметить, что 2 мкг / мл были контрольной точкой МИК для Enterobacterales до 2012 г., когда она была изменена на текущее значение 0,5 мкг / мл [95]. Данные о клинической эффективности и безопасности не сообщались, за исключением двух случаев нейротоксичности, наблюдаемых в контрольной группе на 7 и 9 дни.Авторы пришли к выводу, что режим дозирования 500 мг трижды в неделю после ИБС достаточен для поддержания минимальных концентраций для эффективности и снижения потенциала накопления токсинов [101].
Доступные данные PK предполагают, что текущий режим дозирования ESRD 500 мг в день превышает необходимые концентрации для эффективности и имеет потенциал для токсического накопления. Хотя доступные исследования ограничены, упрощенная схема дозирования трижды в неделю после ИБС предлагает более удобное дозирование при сохранении уровней в плазме, необходимых для противомикробной активности.Эртапенем в дозе 500 мг, введенный после ИБС, продемонстрировал минимальные концентрации, адекватные для большинства организмов, но эти данные нельзя экстраполировать на все типы диализаторов [101]. Минимальные уровни, наблюдаемые при однократном введении 1 г после ИБС, также превышают необходимые концентрации для эффективности [99, 100]. Дополнительная стратегия: ударная доза 1 г после ИБС с последующим введением 500 мг после последующих сеансов ИБС также была предложена на основе отчета, в котором использовалась эта схема дозирования для лечения инфекций мочевыводящих путей у пациентов с анурией, нуждающихся в ИБС [102].В настоящее время необходимы дополнительные исследования, оценивающие последовательное дозирование как 500 мг, так и 1 г пост-HD в отношении PK / PD и клинических конечных точек до широкого внедрения этих альтернативных стратегий дозирования.
Аминогликозиды
Аминогликозиды — это бактерицидные антибиотики широкого спектра действия, которые используются в клинической практике с 1940-х годов. В этом обзоре мы ограничимся обсуждением гентамицина, тобрамицина и амикацина, наиболее часто используемых на практике аминогликозидов.В основном из-за узкого терапевтического индекса и предупреждений о нефротоксичности и ототоксичности в рамке, их нынешнее место в терапии обычно отводится аэробным грамотрицательным бактериям с МЛУ и синергической терапии грамположительного инфекционного эндокардита. Благодаря высокой степени клиренса клубочков, низкой стоимости, десятилетиям клинического использования и выполнимости TDM, существует богатый клинический опыт применения диализных доз аминогликозидов, особенно гентамицина [103, 104]. Тем не менее, безопасность вызывает ощутимое беспокойство: сообщается, что частота ототоксичности достигает 60% у пациентов, получающих гемодиализ [105].Сообщаемая диализируемость аминогликозидов широко варьируется от 20 до 75%, в зависимости от метода диализа, типа фильтра, скорости потока и продолжительности [8, 104, 106]. Фармакокинетические характеристики аминогликозидов также сильно варьируют в условиях ТПН из-за различий между пациентами в Vd, остаточной функции почек и модальностях диализа [104]. Задержка тканевого распределения в пределах 2 часов также описана у пациентов с почечной недостаточностью, получающих аминогликозиды [104]. Дозирование аминогликозидов было описано как после ИБС (суммировано в Таблице 1), так и перед ИБС, где аминогликозиды, как было показано, обеспечивают более высокую вероятность достижения целевых значений PK / PD, таких как C max > 8 мкг / мл. , и ограничить воздействие (AUC) в некоторых моделях PK [9, 104, 107, 108, 109].Однако профиль безопасности дозирования аминогликозидов до ИБС неясен и недавно был поставлен под сомнение [110]. Кроме того, все больше данных свидетельствует о том, что соотношение AUC / MIC может быть наиболее надежным индексом PK / PD, связанным с антибактериальной активностью аминогликозидов [111]. Несмотря на сохранение пиковых концентраций, дозирование аминогликозидов до ИБС естественным образом ограничивало бы значения AUC с учетом диализируемости этих агентов.
Логистика с дозированием до ИБС также ограничивает практичность из-за потенциальных проблем с расписанием и связанных рисков с короткими или прерванными сеансами диализа [112].Чтобы оптимизировать вероятность успеха лечения и ограничить токсичность, TDM рекомендуется для терапии аминогликозидами. Пиковые концентрации 7–10 мкг / мл и концентрации перед ИБС 3,5–5 мкг / мл были предложены для гентамицина и тобрамицина в условиях ТПН, требующей ИБС, при лечении серьезных инфекций, вызванных грамотрицательными бациллами [104]. Соответствующие рекомендуемые пиковые концентрации амикацина и пред-ИБС составляют 20 мкг / мл и <10 мкг / мл соответственно. Следует избегать выполнения TDM сразу после ИБС из-за выраженного восстановления концентраций аминогликозидов [104].
PK-характеристики аминогликозидов были выяснены в проспективном обсервационном исследовании 167 пациентов, получавших 216 полных курсов аминогликозидов и нуждающихся в ИБС при ХБП 5 стадии или острой почечной недостаточности. Для пациентов с ТПН среднее значение Vd с использованием идеальной массы тела (IBW) и периода полувыведения без ИБС составило 0,37 л / кг и 45,7 ч, соответственно. Из-за продолжительной фазы распределения в этой популяции пациентов концентрации для определения скорости выведения были собраны по крайней мере через 18 часов после начальной дозы.Также были собраны данные о клинических исходах, которые включали 110 пациентов, пролеченных в общей сложности 117 курсами продолжительностью не менее 5 дней лечения. Общий показатель успешности лечения составил 91% при пневмонии и Pseudomonas spp. представляют собой наиболее частые очаги заражения и изолированные организмы соответственно. Средняя пиковая концентрация гентамицина и тобрамицина в сыворотке составляла 7,7 мкг / мл, а средняя концентрация в сыворотке до ИБС составляла 3,9 мкг / мл. Авторы пришли к выводу, что при использовании аминогликозидов в этой популяции пациентов требуется тщательное внимание из-за большого количества непредсказуемых переменных, включая вариабельность PK между пациентами, тип почечной недостаточности и характеристики диализатора [104].
Параметры PK для гентамицина при использовании высокопоточных диализаторов были охарактеризованы в нескольких исследованиях PK [104, 106, 107, 108, 110]. Было проведено исследование восьми пациентов с ТПН, нуждающихся в ИБС и получавших аминогликозиды по поводу подозреваемой или известной инфекции, вызванной грамотрицательными бациллами, с использованием диализаторов с полисульфоновыми мембранами с высокой пропускной способностью. Средний период полувыведения в диализе составил 2,24 часа, а концентрация гентамицина увеличилась примерно на 28% через 1,5 часа после завершения ИБС.Диализируемость гентамицина составила 54% [106]. Отдельное исследование 8 неинфицированных субъектов с ТПН, нуждающихся в ИБС, было проведено для оценки PK гентамицина с использованием высокоэффективных диализаторов из ацетата целлюлозы. Среднее значение Vd в стационарном состоянии составило 13,5 л, а конечный период полувыведения — 39,4 ч [108]. Клинические и фармакологические данные об использовании тобрамицина и амикацина при ИБС гораздо более ограничены и не будут подробно обсуждаться [9, 109, 113, 114].
Хотя дозирование аминогликозидов при ТПН, требующей ИБС, хорошо известно, оптимальная стратегия дозирования для лечения инвазивных, опасных для жизни инфекций, вызываемых грамотрицательными бациллами, неизвестна и зависит от ряда специфических для пациента и микробиологических факторов. .Кроме того, клинические исходы пациентов с ТПН, нуждающихся в терапии аминогликозидами, могут быть неоптимальными, при этом смертность превышает 40% в одной группе диализных пациентов, получающих терапию аминогликозидами по поводу системных инфекций [2, 115]. В этом исследовании у умерших пациентов были значительно более низкие и часто субтерапевтические концентрации в сыворотке по сравнению с выжившими [2]. Поэтому для повышения вероятности успеха лечения настоятельно рекомендуется индивидуальное постдиализное дозирование TDM.
Флуконазол
Флуконазол — широко используемый и хорошо переносимый азольный противогрибковый препарат с активностью против Cryptococcus spp. и несколько видов Candida , в частности, за исключением C . krusei [116, 117]. Связывание флуконазола с белками плазмы относительно низкое (<15%), и он демонстрирует большое проникновение в ткани во всех исследованных участках тела, включая спинномозговую жидкость. Почечная экскреция составляет примерно 80% клиренса флуконазола, а 3-часовой сеанс ИБС снижает экспозицию флуконазола примерно на 50%, хотя в информации о назначении диализатора не указаны характеристики диализатора, связанные с этим показателем [116].Диализируемость флуконазола обусловлена его высокой степенью почечного клиренса и низкой молекулярной массой. При наличии ТПН, требующей ИБС, в инструкции по применению флуконазола рекомендуется вводить 100% рекомендованной дозы после каждого сеанса ИБС. Учитывая его превосходную биодоступность> 90%, флуконазол следует вводить энтерально, когда это клинически возможно.
Первоначально было проведено исследование пяти пациентов с ТПН и подозрением на грибковую инфекцию, чтобы описать ФК флуконазола на фоне ИБС.Были использованы различные диализные мембраны, причем у двух пациентов использовался этиленвиниловый спирт (EVAL) и полиметилметакрилат (PMMA), а у оставшегося пациента — полиакрилнитрил (PAN). После каждого сеанса ИБС вводили флуконазол в дозах 100–200 мг. В среднем, 4-часовой сеанс диализа снизил экспозицию флуконазола на 39%. Коэффициент экстракции за один проход составлял 59% при скорости потока крови в диализаторе 180 мл / мин. После нескольких недель терапии флуконазол достиг концентрации в четыре раза выше, чем C max после начальной дозы.Основываясь на профиле PK, достижении предложенных эффективных концентраций против кандидоза и изменениях концентраций флуконазола в сыворотке после повторного введения, авторы пришли к выводу, что обычные дозы флуконазола можно вводить после каждого сеанса ИБС [118].
Последующее исследование с участием 40 добровольцев, 10 из которых страдали ТПН, требующей ИБС, было предпринято для оценки ФК многократных доз перорального флуконазола в четырех когортах, разделенных по степени почечной функции. Пациенты, получавшие ИБС трижды в неделю, получали нагрузочную дозу флуконазола 200 мг, а затем 100 мг после каждого сеанса ИБС.Образцы крови собирали через несколько интервалов после нескольких доз и включали концентрации флуконазола до и после ИБС. Концентрация флуконазола снижалась на ~ 40-50% во время диализа, а концентрация через 24 часа после каждой дозы составляла ~ 4 мкг / мл, что заметно ниже, чем рекомендуемые уровни, по крайней мере, 7-8 мкг / мл для лечения инвазивного кандидоза [117,118,119]. Среднее значение AUC 24 на 10-й день для субъектов с ТПН, получающих поддерживающую дозу флуконазола 100 мг с каждым сеансом ИБС, составляло 107.5 мкг * ч / мл. Примечательно, что это значение составляет примерно половину среднего значения AUC 24 в день 10, равного 217,7 мкг * ч / мл для пациентов с нормальной функцией почек (CrCl> 50 мл / мин), получающих флуконазол 200 мг в день.

 Тогда дозировка лекарств должна соответствовать весовой категории собаки, что указано в инструкции к применению препарата.
Тогда дозировка лекарств должна соответствовать весовой категории собаки, что указано в инструкции к применению препарата. Суточная доза — 5–10 мг/кг веса собаки. Побочный эффект от употребления лекарства — метеоризм.
Суточная доза — 5–10 мг/кг веса собаки. Побочный эффект от употребления лекарства — метеоризм. В 100 мл воды, температура которой превышает комнатную, следует растворить чайную ложку порошка. Полоскать рот полученным содовым раствором необходимо 4 раза в день;
В 100 мл воды, температура которой превышает комнатную, следует растворить чайную ложку порошка. Полоскать рот полученным содовым раствором необходимо 4 раза в день;
 Применение лекарственных средств должно проводиться только по рекомендации и под присмотром врача.
Применение лекарственных средств должно проводиться только по рекомендации и под присмотром врача.





 Достоинство этого антибактериального препарата заключается в том, что у него очень мало побочных действий. Противопоказаний нет совершенно никаких, кроме индивидуальной непереносимости.
Достоинство этого антибактериального препарата заключается в том, что у него очень мало побочных действий. Противопоказаний нет совершенно никаких, кроме индивидуальной непереносимости.
 Обладают рядом противопоказаний, связанными с заболеваниями сердца и желудка.
Обладают рядом противопоказаний, связанными с заболеваниями сердца и желудка.
 Для полоскания следует использовать раствор 0,5 % до 4 раз в сутки.
Для полоскания следует использовать раствор 0,5 % до 4 раз в сутки.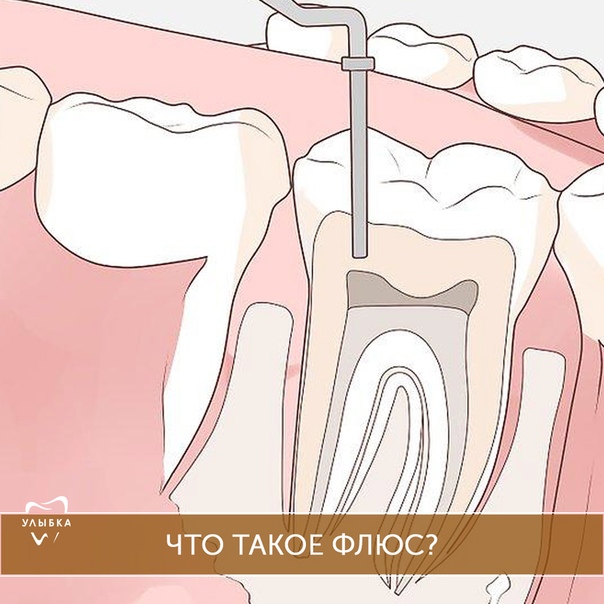 Применять следует 3 раза в день с помощью ватного или марлевого тампона.
Применять следует 3 раза в день с помощью ватного или марлевого тампона.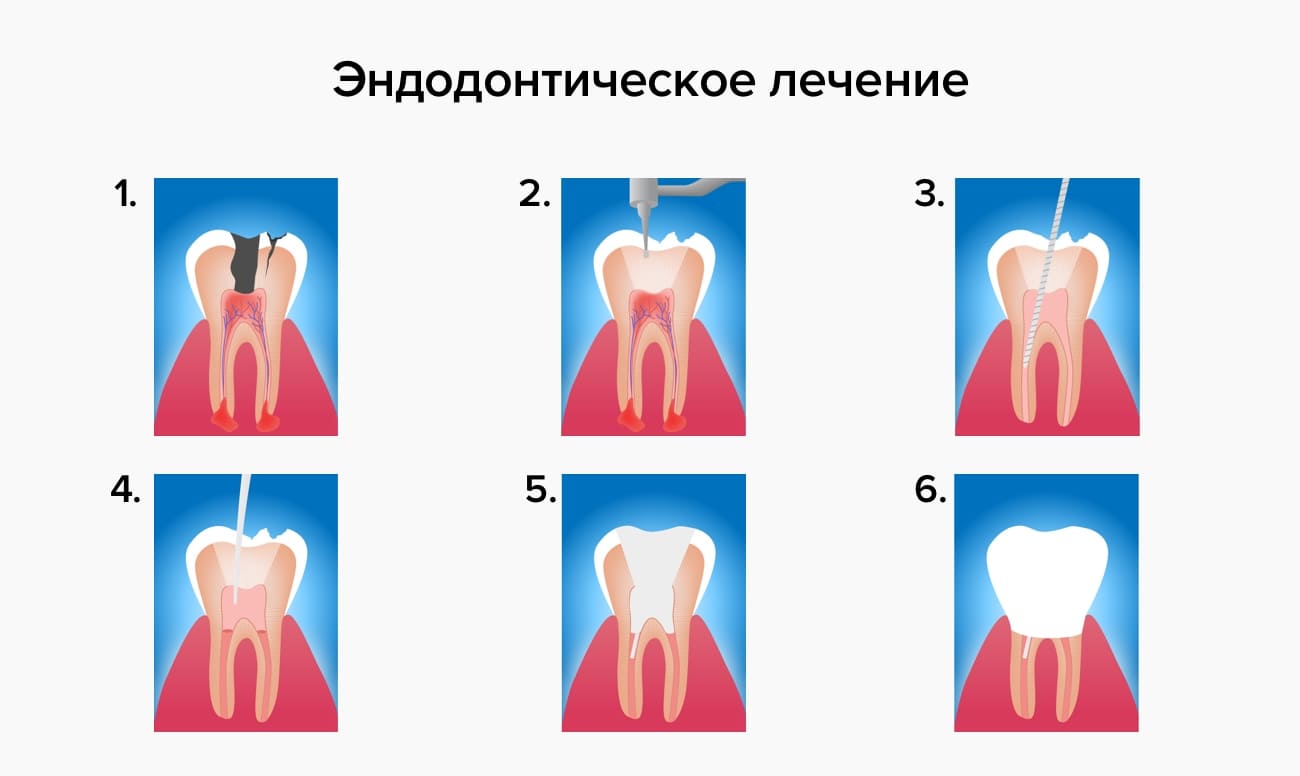 Борется с бактериями, которые вызывают нагноения. Противопоказан для лиц младше 16 лет, для остальных пациентов курс и частоту приема обозначает врач.
Борется с бактериями, которые вызывают нагноения. Противопоказан для лиц младше 16 лет, для остальных пациентов курс и частоту приема обозначает врач.