Тетраборат натрия, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Описание и растворимость
Кислота борная – бесцветные, блестящие, слегка жирные на ощупь чешуйки или мелкий кристаллический порошок без запаха.
Растворима в 25 частях воды, в 4 частях кипящей воды, в 25 частях спирта и медленно в 7 частях глицерина.
Натрия тетраборат – бесцветные, прозрачные, легко выветривающиеся кристаллы или белый кристаллический порошок.
Растворим в воде, очень легко в кипящей воде, практически не растворим в спирте, легко растворим в глицерине.
Физические и химические свойства
1. Отношение кислоты борной к нагреванию.
Кристаллическая
кислота борная при длительном нагревании
до 100
0С
теряет воду и превращается в кислоту
метаборную HBO2,
при более сильном нагревании образуется
кислота тетраборная H2B4O7
в виде стекловидной сплавленной массы,
а при полной потере воды образуется
борный ангидрид B2O3.
При нагревании водных или спиртовых растворов кислоты борной она улетучивается с парами растворителя.
2. Кислотно-основные.
Кислота борная относится к очень слабым кислотам. Кдис = 6,4 • 10-10
Водные растворы кислоты борной имеют слабокислую реакцию среды. При взаимодействии со щелочами образует соли: метабораты (NaBO2) или тетрабораты (Na2B4O7). Соли ортоборной кислоты H3BO3 не образуются.
Водные растворы натрия тетрабората имеют щелочную реакцию среды, так как происходит гидролиз:
Na2B4O7 + 7H2O ↔ 4H3BO3 + 2NaOH
3. Кислота борная с одноатомными алифатическими спиртами образует эфиры, с многоатомными спиртами и полифенолами – комплексные соединения.
При
взаимодействии с глицерином кислота
борная образует кислоту глицеринборную,
которая проявляет более сильные кислотные
свойства.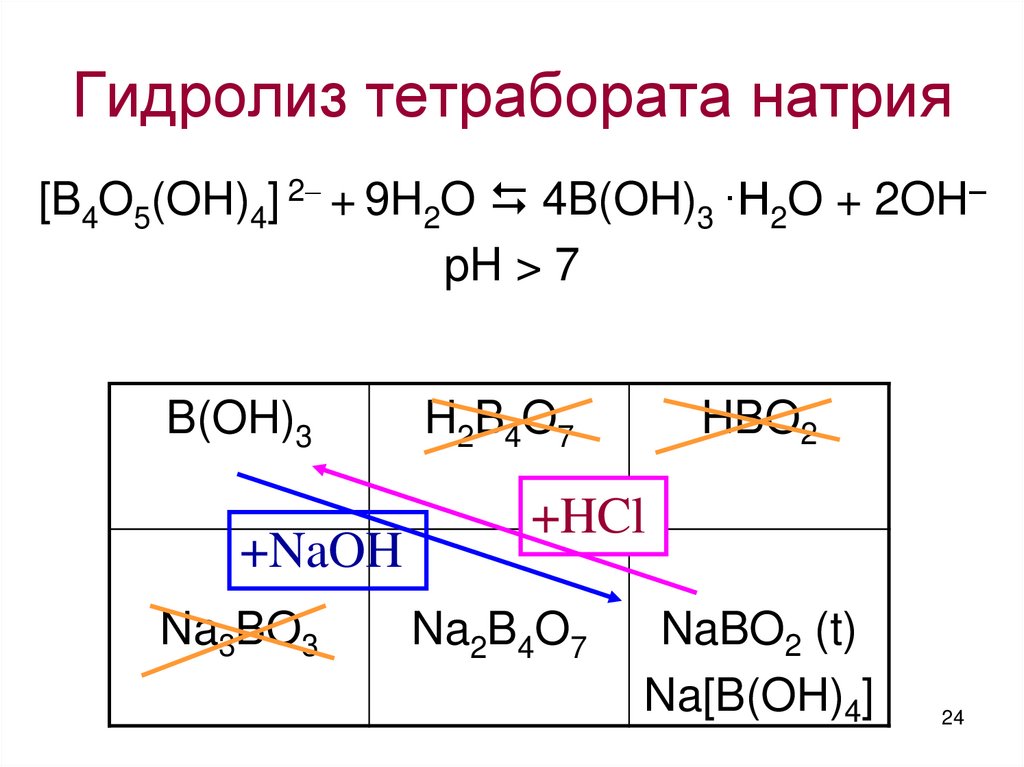 Растворы кислоты борной в
глицерине имеют кислую реакцию среды.
Растворы кислоты борной в
глицерине имеют кислую реакцию среды.
Натрия тетраборат тоже взаимодействует с глицерином. При этом образуются натриевая соль глицеринборной кислоты и свободная глицеринборная кислота, поэтому растворы натрия тетрабората в глицерине имеют кислую реакцию среды.
Подлинность
1. Общие реакции.
1.1. Реакция образования борноэтилового эфира. Раствор кислоты борной в этаноле горит пламенем, окаймленным зеленым цветом.
Для натрия тетрабората реакция образования борноэтилового эфира проводится в присутствии кислоты серной концентрированной.
2. Реакция с куркумином – образование комплексных соединений.
Для
проведения реакции используется
куркумовая бумага (фильтровальная
бумага, пропитанная раствором куркумина),
на которую наносится раствор ЛВ и кислота
хлороводородная разведенная. После
высушивания бумага окрашивается в
розовый цвет, при смачивании раствором
аммиака окраска переходит в
зеленовато-черную.
После
высушивания бумага окрашивается в
розовый цвет, при смачивании раствором
аммиака окраска переходит в
зеленовато-черную.
2. Специфические реакции.
Натрия тетраборат – реакции на катион натрия (см. с. 24).
Чистота
Определяют общие примеси: хлориды, сульфаты, железо, тяжелые металлы.
Для кислоты борной определяют:
1. Прозрачность и цветность водного и спиртового растворов – должны быть прозрачными и бесцветными.
2. Примесь минеральных кислот (используются при получении кислоты борной). При добавлении к водному извлечению из лекарственного вещества индикатора метилового оранжевого не должно быть розового окрашивания. Сама борная кислота, как очень слабая, не дает розового окрашивания с этим индикатором.
Тетраборат натрия | 1330-43-4
Химические свойства
Борат натрия, Na2B407. 10h30, также известный как тетраборат натрия и пиробомат натрия, представляет собой белый кристаллический порошок, который плавится при 120°C (248°F). Борат натрия в своей природной нечистой форме также известен как бура. Бура представляет собой негорючий (природный антипирен), голубовато-серый или зеленый кристаллический порошок или гранулы без запаха. Борат натрия используется в смесях для стекла и керамической эмали, моющих средствах, удобрениях, фармацевтических препаратах и фотографиях.
10h30, также известный как тетраборат натрия и пиробомат натрия, представляет собой белый кристаллический порошок, который плавится при 120°C (248°F). Борат натрия в своей природной нечистой форме также известен как бура. Бура представляет собой негорючий (природный антипирен), голубовато-серый или зеленый кристаллический порошок или гранулы без запаха. Борат натрия используется в смесях для стекла и керамической эмали, моющих средствах, удобрениях, фармацевтических препаратах и фотографиях.
Использование
Рафинированная бура (Na2B4O7) является добавкой в средства для стирки, такие как мыло и средства для смягчения воды. соединения. Также используется для косметики, пудры для тела и производства бумаги и кожа. Бура является экологически безопасным природным гербицидом и инсектицидом.
Использование
Тетраборат натрия — важное соединение бора, имеющее широкий спектр применений. Он входит в состав многих моющих средств, косметики и эмалевых глазурей. Он также используется для приготовления буферных растворов в биохимии, в качестве антипирена, в качестве противогрибкового соединения для стекловолокна, в качестве флюса в металлургии, защиты от нейтронов для радиоактивных источников, текстурирующего агента в кулинарии и в качестве прекурсора для другие соединения бора.
Он входит в состав многих моющих средств, косметики и эмалевых глазурей. Он также используется для приготовления буферных растворов в биохимии, в качестве антипирена, в качестве противогрибкового соединения для стекловолокна, в качестве флюса в металлургии, защиты от нейтронов для радиоактивных источников, текстурирующего агента в кулинарии и в качестве прекурсора для другие соединения бора.
Методы производства
Безводная бура производится из буры путем температурный сплав. При охлаждении прозрачный стекловидный материал измельчается в мелкие белые гранулы. Из-за большей массы плотность, предпочтительнее там, где место для хранения ограничено. Это используется в основном в производстве стекла, керамики и эмаль.
Общее описание
Бледно-желтое твердое вещество или густая жидкость со слабым запахом моющего средства. Смешивается с водой. Могут образовываться мыльные пузыри.
Реакции воздуха и воды
Водорастворимый.
Профиль реактивности
НАТРИЯ ПЕРОКСОБОРАТ несовместим со следующими веществами: Цирконий, сильные кислоты, соли металлов. Сообщается, что настоящий пероксоборат детонирует при легком трении. Обычный «тетрагидрат» не является пероксоборатом. Тетраборат натрия относительно стабилен при мягком измельчении с другими веществами.
Опасность для здоровья
О побочных эффектах от вдыхания буры не сообщалось. Проглатывание может вызвать острые или хронические эффекты; начальными симптомами являются тошнота, рвота и диарея; за ними могут последовать слабость, депрессия, головные боли, кожная сыпь, сухость кожи, трещины на губах и выпадение волос; шок может следовать за проглатыванием больших доз и может мешать дыханию. Попадание в глаза порошка или растворов может вызвать раздражение; никаких хронических эффектов выявлено не было, но следует избегать продолжительного контакта. Местное раздражение кожи может возникнуть в результате контакта с порошком или крепкими растворами; последний может вызвать хронический дерматит при длительном контакте, а при повреждении кожи может абсорбироваться достаточное количество бора, чтобы вызвать отравление бором (симптомы аналогичны симптомам при приеме внутрь).
Местное раздражение кожи может возникнуть в результате контакта с порошком или крепкими растворами; последний может вызвать хронический дерматит при длительном контакте, а при повреждении кожи может абсорбироваться достаточное количество бора, чтобы вызвать отравление бором (симптомы аналогичны симптомам при приеме внутрь).
Сельскохозяйственное использование
Тетраборат натрия, также называемый бурой, боратом натрия, пироборатом натрия и декагидратом тетрабората натрия (Na2B4O7.10h3O), представляет собой тип бората и используется в качестве удобрения для уменьшения дефицита бора. Это белая соль мелкого помола для применения в качестве удобрения.
Тетраборат натрия (Na2B4O7) и метаборат натрия (Na2B2O4) неселективны, поглощаются корнями и имеют неизвестный механизм действия. Бор накапливается в репродуктивных структурах после транслокации из корней. Соединения бора используются для долговременной неселективной борьбы с сорняками в промышленных зонах и зонах линий электропередач в сочетании с триазиновыми и мочевинными гербицидами.
Профиль безопасности
Неприятная пыль. Экспериментальные репродуктивные эффекты. Когда нагревается до разложения, выделяет ядовитые пары Б.
Потенциальное воздействие
Бура используется в качестве флюса для пайки, консервант против древесного грибка; и как антисептик. Используется в ядах для муравьев, для борьбы с мухами вокруг мусора и навозные кучи, как ларвицид. Он используется в производстве эмалей и глазурей, изоляция из стекловолокна; перборат натрия отбеливать; в дубильных, чистящих составах; для огнезащиты ткани и дерево; и при искусственном старении древесина.
Методы очистки
Большая часть воды гидратации удаляется из декагидрата (см. ниже) вакуумированием при 25° в течение трех дней с последующим нагревом до 100° и откачкой высокоскоростным диффузионным насосом. Затем высушенный образец постепенно нагревают до плавления (выше 966°), дают ему постепенно остыть до 200°, затем переносят в эксикатор, содержащий P2O5 [Grenier & Westrum J Am Chem Soc 78 6226 1956]. [Бехер в Справочнике по препаративной неорганической химии (под ред. Брауэра) Academic Press, том I, стр. 79.4-795 1963.]
Затем высушенный образец постепенно нагревают до плавления (выше 966°), дают ему постепенно остыть до 200°, затем переносят в эксикатор, содержащий P2O5 [Grenier & Westrum J Am Chem Soc 78 6226 1956]. [Бехер в Справочнике по препаративной неорганической химии (под ред. Брауэра) Academic Press, том I, стр. 79.4-795 1963.]
Несовместимость
Растворяется в воде с образованием основного раствора. Борная пыль может образовывать с воздухом взрывоопасную смесь. Контакт с сильными окислителями может быть насильственным. Бор несовместим с аммиаком, тетрафторидом брома, цезием карбид, хлор, фтор, интергалогены, йодистая кислота, свинец диоксид, азотная кислота, оксид азота, нитрозилфторид, закись азота оксид, нитрит калия, карбид рубидия, фторид серебра.
Удаление отходов
Бура обезвоженная: материал
разбавлен до рекомендованного предварительного предела
(0,10 мг/л) в воде. рН доводят до 6,5.
и 9.1, а затем материал может быть сброшен в канализацию.
или естественные ручьи.
рН доводят до 6,5.
и 9.1, а затем материал может быть сброшен в канализацию.
или естественные ручьи.
Свойства буры — Infinity Learn
Бура представляет собой гидратированную соль борной кислоты, известную как борат натрия, декагидрат бората натрия или декагидрат тетрабората натрия. Он растворяется в воде с образованием основного водного раствора и обычно доступен в виде порошка или гранул. Он растворим и имеет широкий спектр промышленного и бытового применения в качестве компонента различных продуктов. пестицид; пайка металла; производство глазури и эмали; дубление шкур и шкур; искусственное старение древесины; как консервант против древесного грибка; аналитическая химия в качестве буферного агента; и фармацевтическая помощь в качестве подщелачивателя — вот некоторые из применений. В этой статье мы обсудим некоторые свойства буры.
Бура была обнаружена в руслах высохших озер в Тибете и была завезена на Аравийский полуостров по Шелковому пути в восьмом веке нашей эры. Когда компания Pacific Coast Borax Company Фрэнсиса Мариона Смита начала продавать и популяризировать широкий спектр приложений под торговой маркой 20 Mule Team Borax, названной в честь метода, с помощью которого бура первоначально вывозилась из пустынь Калифорнии и Невады, бура впервые стала широко использоваться в конец девятнадцатого века.
Когда компания Pacific Coast Borax Company Фрэнсиса Мариона Смита начала продавать и популяризировать широкий спектр приложений под торговой маркой 20 Mule Team Borax, названной в честь метода, с помощью которого бура первоначально вывозилась из пустынь Калифорнии и Невады, бура впервые стала широко использоваться в конец девятнадцатого века.
Зарегистрируйтесь, чтобы получить бесплатный пробный тест и учебный материал
+91
Подтвердить OTP-код (обязательно)
Я согласен с условиями и политикой конфиденциальности.
Нагревание кристаллической твердой буры сначала вызывает ее набухание из-за потери гидратированной воды, но дальнейшее нагревание приводит к образованию метабората и триоксида бора. Физические свойства и химический состав буры очень похожи на свойства борной кислоты. Его получают путем нагревания раствора борной кислоты и карбоната натрия. Бура – природный минерал, представляющий собой соль борной кислоты. Борат натрия, тетраборат натрия и тетраборат динатрия — все это другие его названия.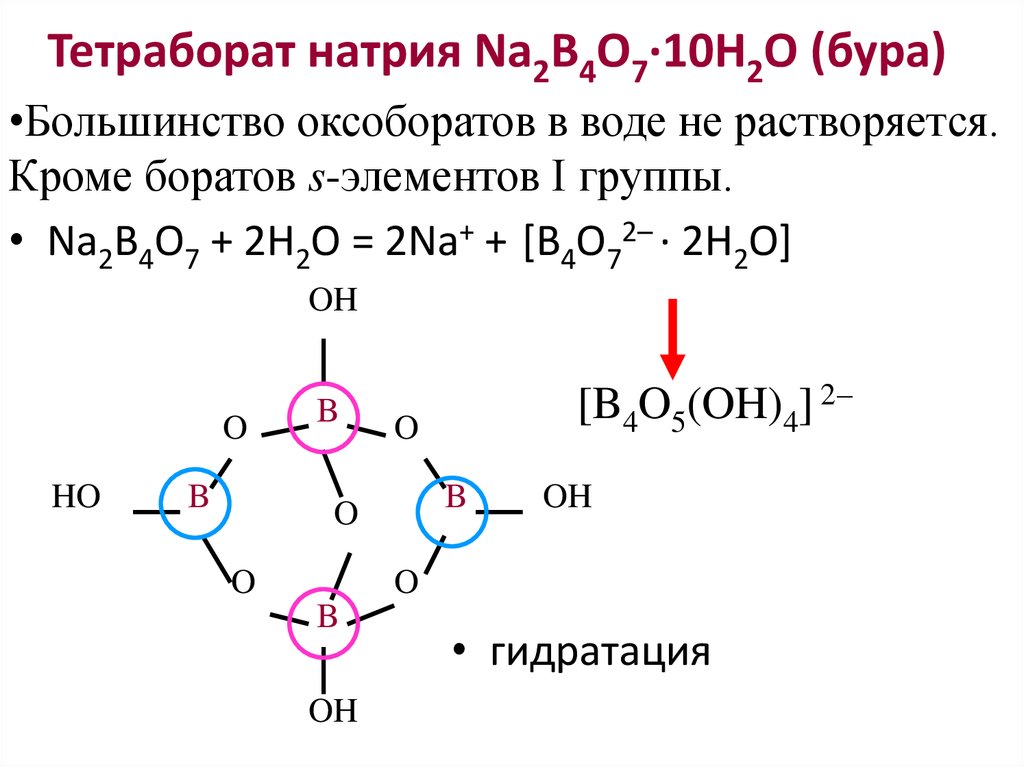 Это важное соединение бора. Бура относится к группе минералов, которые тесно связаны между собой, но различаются по содержанию кристаллической воды, например декагидратные, пентагидратные и октагидратные соли. Он также известен как бура в безводной форме.
Это важное соединение бора. Бура относится к группе минералов, которые тесно связаны между собой, но различаются по содержанию кристаллической воды, например декагидратные, пентагидратные и октагидратные соли. Он также известен как бура в безводной форме.
Обзор
Многие свойства буры обусловлены ее составом в виде соединения бора. Бура — это минерал и соль борной кислоты, встречающаяся в природе в виде кристаллического минерала. По данным Калифорнийского университета в Беркли, бор представляет собой металлоидный химический элемент со свойствами «между свойствами углерода и алюминия». Бор — редкий элемент, который можно найти в буре и кените. По данным Science Lab, химическая формула буры, бората натрия, Na 9.0081 2 -В 4 -О 7 . Бура представляет собой твердое вещество без запаха и массой 201,22 г/моль. Плавится при температуре 741 градус Цельсия. В присутствии стекла бура стабильна и не вызывает коррозии. По данным Science Lab, он несовместим с солями алкалоидов, хлоридом ртути, сульфатом цинка и другими солями металлов. Он также несовместим с водой. Борная кислота, динатриевая соль, декагидрат тетрабората динатрия, борат натрия, декагидрат бората натрия, тетраборат натрия и декагидрат тетрабората натрия — все это названия буры. Минерал представляет собой кристаллы белого, серого, голубоватого или зеленовато-белого цвета с прожилками, растворимостью в воде от 6 г до 100 г. Плотность бората натрия составляет 1,73, а его температура кипения составляет 320 градусов по Цельсию. Уровень pH щелочной.
Он также несовместим с водой. Борная кислота, динатриевая соль, декагидрат тетрабората динатрия, борат натрия, декагидрат бората натрия, тетраборат натрия и декагидрат тетрабората натрия — все это названия буры. Минерал представляет собой кристаллы белого, серого, голубоватого или зеленовато-белого цвета с прожилками, растворимостью в воде от 6 г до 100 г. Плотность бората натрия составляет 1,73, а его температура кипения составляет 320 градусов по Цельсию. Уровень pH щелочной.
Бура имеет широкий спектр применения. Он содержится в различных моющих средствах, косметике и эмалевых глазурях. Он также используется в биохимии для приготовления буферных растворов, в качестве антипирена, противогрибкового соединения для изоляции из стекловолокна, инсектицида, флюса в металлургии и в качестве прекурсора для других соединений бора.
Аномальные свойства буры
Соединения бора имеют очень похожий химический состав, свойства и структуру. Химические свойства кристаллического порошка буры и борной кислоты очень похожи. Эти химические вещества растворяются в жидкости, прежде всего в горячей воде. При комнатной температуре молекулярная формула кристаллического порошка буры содержит десять молекул гидратированной воды. Он имеет пять молекул гидратирующей воды в своей молекулярной структуре при 62°C. Вследствие гидролиза водный раствор имеет щелочные свойства. Он соединяется с водой с образованием заменителя борной кислоты H 3 БО 3 . Это слабая кислота, которую тритировали против сильных кислот с использованием метилового оранжевого в качестве индикатора по шкале pH в диапазоне от 3,1 до 4,4).
Эти химические вещества растворяются в жидкости, прежде всего в горячей воде. При комнатной температуре молекулярная формула кристаллического порошка буры содержит десять молекул гидратированной воды. Он имеет пять молекул гидратирующей воды в своей молекулярной структуре при 62°C. Вследствие гидролиза водный раствор имеет щелочные свойства. Он соединяется с водой с образованием заменителя борной кислоты H 3 БО 3 . Это слабая кислота, которую тритировали против сильных кислот с использованием метилового оранжевого в качестве индикатора по шкале pH в диапазоне от 3,1 до 4,4).
По данным Калифорнийского университета, бура соединяется с кобальтом, медью, хромом, марганцем и никелем, образуя красочные соединения. Из-за этого свойства минерал использовался в качестве глазури для гончарных изделий со времен средневековья. Бура является слабым основанием, которое также используется в фотопроявителях и буферных растворах. Он также присутствует во всем: от стирального порошка и бытовых чистящих средств до корма для комнатных растений и зубной пасты для собак. Бура имеет низкую химическую проводимость, которая значительно увеличивается при нагревании из-за содержания в ней бора. При определенных температурах бор ведет себя как полупроводник. По данным Калифорнийского университета, его также добавляют к германию и кремнию для повышения проводимости.
Бура имеет низкую химическую проводимость, которая значительно увеличивается при нагревании из-за содержания в ней бора. При определенных температурах бор ведет себя как полупроводник. По данным Калифорнийского университета, его также добавляют к германию и кремнию для повышения проводимости.
Физические свойства Буры –
- Молекулярная масса 202,22 (безводный) и молекулярная масса 381,38. (декагидрат).
- Это твердое вещество белого цвета.
- Имеет плотность 2,4 г/см 3 (безводный) и 1,73 г/см 3 (водный) (декагидрат).
- Температура плавления составляет 743 °C (безводный) и 75 °C (водный) (декагидрат).
- Растворяется в воде.
- Температура кипения 1575°C (безводный).
Химические свойства буры –
- Бура реагирует с кислотами и легко превращается в борную кислоту, очень полезное соединение.
 Реакция заключается в следующем —
Реакция заключается в следующем —
NA 2 B 4 O 7 · 1OH 2 O+2HCL 4 B (OH) 3 +2NACL+5H 2 2 2 2 2 2 2 2 2 2 2 . Бура в основном содержится в стиральном порошке и других чистящих средствах. Он также используется для получения борной кислоты путем взаимодействия с соляной кислотой, также известной как HCl. Вильгельм Хомберг был пионером этого метода. Бура также используется в пищевой, химической и фармацевтической промышленности. Борная кислота образуется при взаимодействии буры с соляной кислотой. Na 2 B 4 O 7 ·1OH 2 O+2HCl 4 B(OH) 3 +2NaCl+5H 2 O Borax Reaction – Each sugar residue в полимере присутствуют две гидроксильные группы, находящиеся в цис-форме. Это приводит к интересной и ценной реакции с диссоциированными ионами бората, что типично для таких полимеров. Одним из важнейших соединений бора является бура. Наиболее распространенной формой буры является декагидрат тетрабората натрия. Это кристаллическое белое твердое вещество. Бура встречается в природе в виде тинкаля. Это один из видов сырья, используемого при производстве буры. Мы узнали больше о буре в этой статье. Формула, строение, способы получения, физико-химические свойства. Бура имеет более высокую коммерческую ценность. В результате он используется в различных областях. Мы также рассмотрели различные области применения буры. Читайте также: Аномальные свойства гидридов бора Crack NEET с программой обучения, ориентированной на результат от Infinity Learn Целью структур Льюиса является предоставление химикам простого способа просмотра молекул, который позволяет им делать точные прогнозы о реальных молекулах, структуре и свойствах.
Химический состав буры  Вот реакция:
Вот реакция:
Часто задаваемые вопросы Для чего нужна бура?

