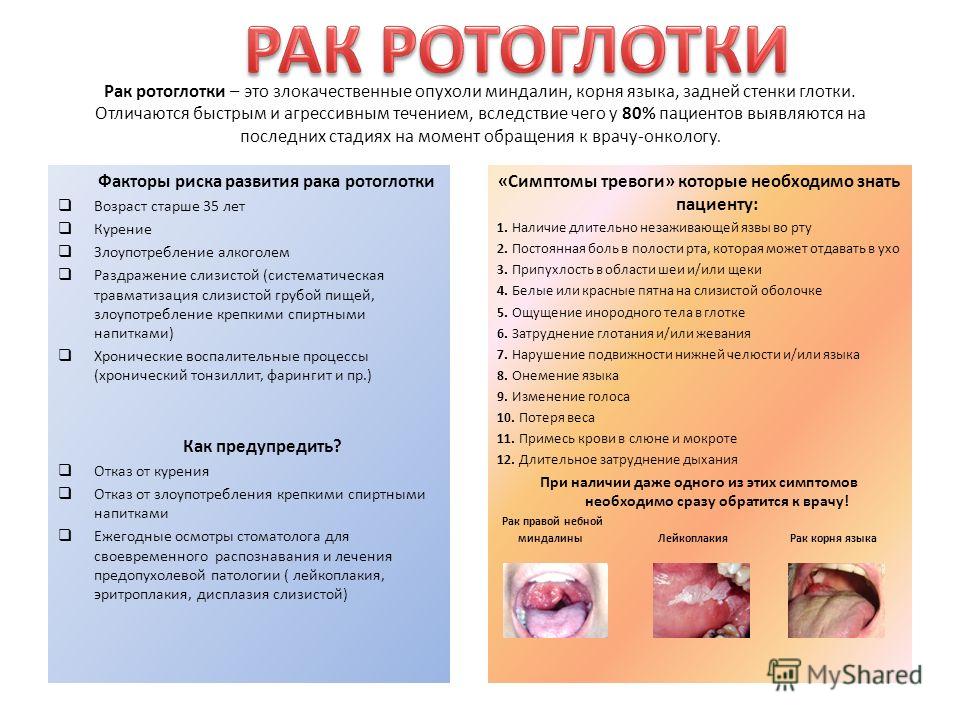
D10 Доброкачественное новообразование рта и глотки…
- D10.0 Губы
- D10.1 Языка
-
D10.
 2 Дна полости рта
2 Дна полости рта
- D10.3 Других и неуточненных частей рта
- D10.4 Миндалины
-
D10.
 5 Других частей ротоглотки
5 Других частей ротоглотки
- D10.6 Носоглотки
- D10.7 Гортаноглотки
-
D10.
 9 Глотки неуточненной локализации
9 Глотки неуточненной локализации
- Выбор препаратов
Подобрать препарат можно с помощью фильтров. Чтобы увидеть в перечне лекарства, входящие в подгруппы, отметьте галочкой «включить препараты подгрупп». Нажав на иконку , можно добавить препарат в избранное и проверить на дубли и межлекарственные взаимодействия.
Полужирным начертанием выделены лекарства, входящие в справочники текущего года. Рядом с названием препарата может быть указан еженедельный уровень индекса информационного спроса (показатель, который отражает степень интереса потребителей к информации о лекарстве).
Сбросить фильтры
включить препараты подгрупп
Войти через:
| Новообразования (C00 — D48) | |||
| Стандарт первичной медико-санитарной помощи при злокачественных новообразованиях губы I — IV стадии (обследование в целях установления диагноза заболевания и подготовки к противоопухолевому лечению) | C00 Злокачественное новообразование губы | взрослые | Приказ Минздрава России от 20.12.2012 N 1155н |
| Стандарт первичной медико-санитарной помощи при злокачественных новообразованиях полости рта 0 — IV стадии (обследование в целях установления диагноза заболевания и подготовки к противоопухолевому лечению) | C01 Злокачественное новообразование основания языка C02 Злокачественное новообразование других и неуточненных частей языка C03 Злокачественное новообразование десны C04 Злокачественное новообразование дна полости рта C05 Злокачественное новообразование неба C06 Злокачественное новообразование других и неуточненных отделов рта | взрослые | Приказ Минздрава России от 20. 12.2012 N 1121н 12.2012 N 1121н |
| Стандарт первичной медико-санитарной помощи при злокачественных новообразованиях ротоглотки 0 — IV стадии (обследование в целях установления диагноза заболевания и подготовки к противоопухолевому лечению) | C10 Зокачественное новообразование ротоглотки | Приказ Минздрава России от 20.12.2012 N 1195н | |
| Стандарт первичной медико-санитарной помощи при злокачественных новообразованиях гортаноглотки 0 — IV стадии (обследование в целях установления диагноза заболевания и подготовки к противоопухолевому лечению) | C14.1 Гортаноглотки C12 Злокачественное новообразование грушевидного синуса C13 Злокачественное новообразование нижней части глотки | взрослые | Приказ Минздрава России от 20.12.2012 N 1194н |
| Стандарт первичной медико-санитарной помощи при злокачественных новообразованиях пищевода I — IV стадии (обследование в целях установления диагноза заболевания и подготовки к противоопухолевому лечению) | C15 Злокачественное новообразование пищевода | взрослые | Приказ Минздрава России от 20. 12.2012 N 1173н
12.2012 N 1173н |
| Стандарт первичной медико-санитарной помощи при злокачественных новообразованиях желудка I — IV стадии (обследование в целях установления диагноза заболевания и подготовки к противоопухолевому лечению) | C16 Злокачественное новообразование желудка | взрослые | Приказ Минздрава России от 20.12.2012 N 1136н |
| Стандарт первичной медико-санитарной помощи при злокачественных новообразованиях ободочной кишки I — IV стадии (обследование в целях установления диагноза заболевания и подготовки к противоопухолевому лечению) | C18 Злокачественное новообразование ободочной кишки C19 Злокачественное новообразование ректосигмоидного соединения | взрослые | |
| Стандарт первичной медико-санитарной помощи при злокачественных новообразованиях прямой кишки I — IV стадии (обследование в целях установления диагноза заболевания и подготовки к противоопухолевому лечению) | C20 Злокачественное новообразование прямой кишки | взрослые | Приказ Минздрава России от 20. 12.2012 N 1196н 12.2012 N 1196н |
| Стандарт первичной медико-санитарной помощи при злокачественных новообразованиях печени и внутрипеченочных желчных протоков I — IV стадии (обследование в целях установления диагноза заболевания и подготовки к противоопухолевому лечению) | C22 Злокачественное новообразование печени и внутрипеченочных желчных протоков | взрослые | Приказ Минздрава России от 20.12.2012 N 1154н |
| Стандарт первичной медико-санитарной помощи при злокачественных новообразованиях печени и внутрипеченочных желчных протоков I — IV стадии (обследование в целях установления диагноза заболевания и подготовки к противоопухолевому лечению) | C22 Злокачественное новообразование печени и внутрипеченочных желчных протоков | взрослые | Приказ Минздрава России от 20.12.2012 N 1161н |
| Стандарт первичной медико-санитарной помощи при злокачественных новообразованиях поджелудочной железы (обследование в целям установления диагноза заболевания и подготовки к противоопухолевому лечению) | C25 Злокачественное новообразование поджелудочной железы | взрослые | Приказ Минздрава России от 20. |
| Стандарт первичной медико-санитарной помощи при злокачественных новообразованиях поджелудочной железы IIB — IV стадии (нерезектабельный процесс, химиотерапевтическое лечение) | C25 Злокачественное новообразование поджелудочной железы | взрослые | Приказ Минздрава России от 24.12.2012 N 1527н |
| Стандарт первичной медико-санитарной помощи при злокачественных новообразованиях носа и придаточных пазух 0 — IV стадии (обследование в целях установления диагноза заболевания и подготовки к противоопухолевому лечению) | C30 Злокачественное новообразование полости носа и среднего уха C31 Злокачественное новообразование придаточных пазух | взрослые | Приказ Минздрава России от 20.12.2012 N 1158н |
| Стандарт первичной медико-санитарной помощи при злокачественных новообразованиях гортани 0 — IV стадии (обследование в целях установления диагноза заболевания и подготовки к противоопухолевому лечению) | C32 Злокачественное новообразование гортани | взрослые | Приказ Минздрава России от 24. 12.2012 N 1477н 12.2012 N 1477н |
| Стандарт первичной медико-санитарной помощи при злокачественных новообразованиях трахеи I — IV стадии (обследование в целях установления диагноза заболевания и подготовки к противоопухолевому лечению) | C33 Злокачественное новообразование трахеи | взрослые | Приказ Минздрава России от 20.12.2012 N 1151н |
| Стандарт первичной медико-санитарной помощи при злокачественных новообразованиях костей и суставных хрящей I — IV стадии (обследование в целях установления диагноза заболевания и подготовки к противоопухолевому лечению) | C40 Злокачественное новообразование костей и суставных хрящей C41 Злокачественное новообразование костей и суставных хрящей других и неуточненных локализаций | взрослые | Приказ Минздрава России от 20.12.2012 N 1149н |
| Стандарт первичной медико-санитарной помощи при злокачественных новообразованиях кожи (меланома, рак) I — IV стадии (обследование в целях установления диагноза заболевания и подготовки к противоопухолевому лечению) | C43 Злокачественная меланома кожи C44 Другие злокачественные новообразования кожи | взрослые | Приказ Минздрава России от 20. 12.2012 N 1143н 12.2012 N 1143н |
| Стандарт первичной медико-санитарной помощи при злокачественных новообразованиях соединительной и мягких тканей I — IV стадии (обследование в целях установления диагноза заболевания и подготовки к противоопухолевому лечению) | C49 Злокачественное новообразование других типов соединительной и мягких тканей C47 Злокачественное новообразование периферических нервов и вегетативной нервной системы | взрослые | Приказ Минздрава России от 20.12.2012 N 1159н |
| Стандарт первичной медико-санитарной помощи при злокачественных новообразованиях шейки матки 0 — IV стадии (обследование в целях установления диагноза заболевания и подготовки к противоопухолевому лечению) | C53 Злокачественное новообразование шейки матки | взрослые | Приказ Минздрава России от 20.12.2012 N 1193н |
| Стандарт первичной медико-санитарной помощи при злокачественных новообразованиях тела матки 0 — IV стадии (обследование в целях установления диагноза заболевания и подготовки к противоопухолевому лечению) | C54 Злокачественное новообразование тела матки | взрослые | Приказ Минздрава России от 20. 12.2012 N 1152н 12.2012 N 1152н |
| Стандарт первичной медико-санитарной помощи при злокачественных новообразованиях яичников I — IV стадии (обследование в целях установления диагноза заболевания и подготовки к противоопухолевому лечению) | C56 Злокачественное новообразование яичника | взрослые | Приказ Минздрава России от 20.12.2012 N 1150н |
| Стандарт первичной медико-санитарной помощи при злокачественных новообразованиях почки 0 — IV стадии (обследование в целях установления диагноза заболевания и подготовки к противоопухолевому лечению) | C64 Злокачественное новообразование почки, кроме почечной лоханки | взрослые | Приказ Минздрава России от 20.12.2012 N 1197н |
| Стандарт первичной медико-санитарной помощи при злокачественных новообразованиях мочевого пузыря 0 — IV стадии (обследование в целях установления диагноза заболевания и подготовки к противоопухолевому лечению) | C67 Злокачественное новообразование мочевого пузыря | взрослые | Приказ Минздрава России от 20. 12.2012 N 1157н 12.2012 N 1157н |
| Стандарт первичной медико-санитарной помощи при злокачественных новообразованиях щитовидной железы 0 — IV стадии (обследование в целях установления диагноза заболевания и подготовки к противоопухолевому лечению) | C73 Злокачественное новообразование щитовидной железы | взрослые | Приказ Минздрава России от 20.12.2012 N 1156н |
Редкая опухоль в необычном месте
На этой странице
АннотацияВведениеИстория болезниОбсуждениеСсылкиСсылкиАвторское правоСтатьи по теме
Веретеноклеточная карцинома — редкая двухфазная опухоль, состоящая из эпителиального и мезенхимального компонентов. Наличие этого
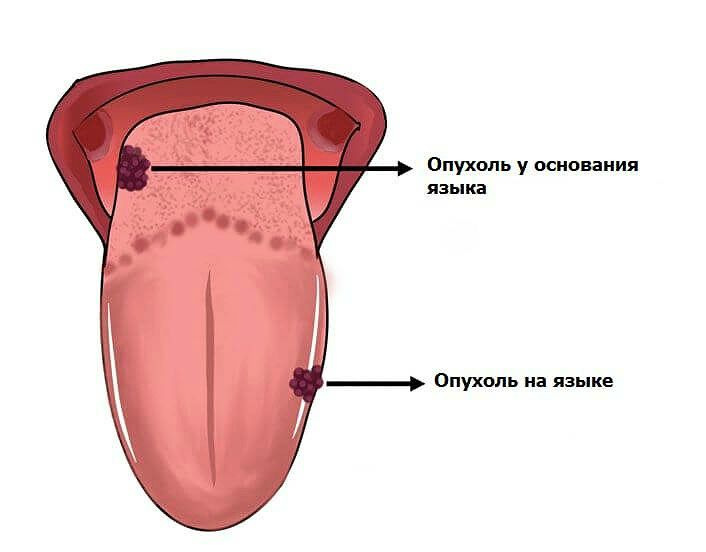
Тип опухоли на языке редко сообщается. Здесь представлен случай 55-летней женщины с полиповидным поражением.
на ее языке было сообщено. Была проведена операция, патологоанатомическое исследование выявило веретеноклеточный рак. Мы представляем
эта редкая опухоль с необычным расположением частично способствовала лучшему пониманию и осведомленности об этой редкой злокачественной опухоли.
Мы представляем
эта редкая опухоль с необычным расположением частично способствовала лучшему пониманию и осведомленности об этой редкой злокачественной опухоли.
1. Введение
Веретеноклеточная карцинома (SpCC) является относительно редкой злокачественной опухолью, поражающей верхние отделы пищеварительного тракта. Наиболее частым местом возникновения в области головы и шеи является гортань (особенно голосовые связки) и гортаноглотка. Обычно полость рта не поражается. SpCC обычно возникает в 6-7-м десятилетии жизни и представляет собой преобладание мужчин. Предрасполагающими факторами являются курение, употребление алкоголя и предшествующее облучение области головы и шеи. Это низкодифференцированный вариант плоскоклеточного рака (SCC) [1] с более агрессивным течением [2–4]. Эта двухфазная опухоль состоит из злокачественного эпителиального и злокачественного мезенхимального компонентов. Несмотря на несколько иммуногистохимических, электронно-микроскопических и генетических исследований, точный гистогенез SpCC весьма спорен. Это противоречие отразилось в широком спектре номенклатуры этого типа опухоли, такой как карциносаркома, псевдосаркома, саркоматоидная карцинома, коллизионная опухоль и псевдосаркоматозная карцинома.
Это противоречие отразилось в широком спектре номенклатуры этого типа опухоли, такой как карциносаркома, псевдосаркома, саркоматоидная карцинома, коллизионная опухоль и псевдосаркоматозная карцинома.
Имеется ограниченное количество литературы о SpCC, возникающем в пищеварительном тракте. Более того, имеется лишь несколько литературных данных о локализации этих опухолей на языке. Мы сообщаем здесь о случае SpCC, возникшем из языка у пациента, который ранее был оперирован по поводу SCC и лечился лучевой терапией (ЛТ).
2. История болезни
В оториноларингологическое отделение поступила женщина 55 лет с безболезненным полиповидным образованием на языке (рис. 1, а). Клинический анамнез показал, что у нее было незаживающее поражение правой боковой границы языка с диагнозом SCC, и она была дважды прооперирована в 2000 и 2002 годах. У нее не было метастазов в лимфатических узлах при выполненной диссекции шеи. После последней операции ей была проведена послеоперационная ЛТ.
При физикальном обследовании в ранее прооперированной области наблюдалось полиповидное экзофитное образование размером 5 × 3,5 см, твердое, эластичное, безболезненное. Лабораторные результаты были в пределах нормы. Компьютерная томография (КТ) выявила асимметричное, неравномерное, мягкое уплотнение, локализованное в области правого края языка (рис. 1(б)). КТ и физикальное обследование области шеи не выявили аномалий, но изменения были совместимы с предыдущей операцией. Рентгенограмма грудной клетки не выявила каких-либо отклонений от нормы. Была выполнена инцизионная биопсия, которая показала плеоморфные веретенообразные клетки. Вместе с предыдущим диагнозом SCC биопсия была диагностирована как SpCC. Больному сделали операцию; рецидивирующая полиповидная масса была удалена с широким хирургическим краем и дополнительно выполнена билатеральная резекция дна полости рта в сочетании с расширенной надподъязычной диссекцией шейки слева. Операцию закончили реконструкцией кожно-мышечным грудным лоскутом. При динамическом наблюдении через 3 мес отмечен локальный рецидив, выполнена повторная операция. При патологоанатомическом исследовании препарата определялся только плоскоклеточный рак.
При динамическом наблюдении через 3 мес отмечен локальный рецидив, выполнена повторная операция. При патологоанатомическом исследовании препарата определялся только плоскоклеточный рак.
Макроскопически выпуклая масса была рассечена хирургом на две части. Они были размером 2 × 1,8 × 0,5 см и 5 × 3,5 × 3 см и иногда имели участки изъязвления. Поверхность разреза резецированного препарата имела неоднородный вид, была твердой и беловатого цвета (рис. 1(в)). Основной образец состоял из 4 резцов, частично нижней челюсти и глоссэктомического материала. На правом боковом крае языка определяется плотная, грязно-беловатого цвета полиповидная опухоль с ножкой, прикрепляющей ее к языку. Он был размером 3 × 2 см и глубиной 1,4 см на поверхности разреза.
При микроскопическом исследовании обнаружена двухфазная опухоль, состоящая из ороговевающего плоскоклеточного рака и саркоматозной стромы веретенообразных клеток. Злокачественные веретенообразные клетки, составляющие основную часть опухоли, имели гипо- и гиперклеточные области и случайный сториформный рисунок (рис. 2(b)). Эти клетки были плеоморфными с большими, овально-округлыми, везикулированными ядрами и обильной цитоплазмой (рис. 2(b)). Причудливые клетки, многоядерные гигантские клетки и частые митотические фигуры, некоторые из которых были атипичными, также наблюдались в саркоматозном компоненте (рис. 2(а)). Эпителиальный компонент, который представлял собой плоскоклеточный рак от умеренной до высокодифференцированной, был легко распознан на всех срезах, но особенно наблюдался в ножке опухоли. Опухолевые клетки были атипичными, с повышенным ядерно-цитоплазматическим соотношением, имели крупные, плеоморфные, гиперхроматические, везикулированные ядра и умеренную эозинофильную цитоплазму. Между двумя компонентами не было четкой границы; переходную зону можно было легко увидеть при окрашивании гематоксилин-эозином (рис. 2(с)). Иммуногистохимические маркеры, такие как panCK, EMA и p63, были положительными в клетках, составляющих эпителиальный компонент, и отрицательными в веретенообразных клетках саркоматозного компонента (рис.
2(b)). Эти клетки были плеоморфными с большими, овально-округлыми, везикулированными ядрами и обильной цитоплазмой (рис. 2(b)). Причудливые клетки, многоядерные гигантские клетки и частые митотические фигуры, некоторые из которых были атипичными, также наблюдались в саркоматозном компоненте (рис. 2(а)). Эпителиальный компонент, который представлял собой плоскоклеточный рак от умеренной до высокодифференцированной, был легко распознан на всех срезах, но особенно наблюдался в ножке опухоли. Опухолевые клетки были атипичными, с повышенным ядерно-цитоплазматическим соотношением, имели крупные, плеоморфные, гиперхроматические, везикулированные ядра и умеренную эозинофильную цитоплазму. Между двумя компонентами не было четкой границы; переходную зону можно было легко увидеть при окрашивании гематоксилин-эозином (рис. 2(с)). Иммуногистохимические маркеры, такие как panCK, EMA и p63, были положительными в клетках, составляющих эпителиальный компонент, и отрицательными в веретенообразных клетках саркоматозного компонента (рис. 2(d)). Последние были сильно положительными для виментина и отрицательными для SMA, десмина и HMB-45 (рис. 2(e)). Пролиферативный индекс составлял 60–70% при окрашивании MIB1 (рис. 2(f)). Мы диагностировали этот случай как веретеноклеточный рак языка в соответствии с классификацией ВОЗ 2005 г., в которой диагностические критерии определялись как наличие злокачественных веретенообразных клеток в дополнение к демонстрации инвазивной или плоскоклеточной карциномы in situ или любым признакам эпителиальная дифференцировка веретенообразных клеток [5]. Лимфатическая, сосудистая, нервная инвазия и метастазы в лимфатические узлы не наблюдались, но нижняя челюсть была поражена опухолью. Пациент был классифицирован как стадия IVa в соответствии с рекомендациями AJCC [6] и не имел никаких признаков заболевания после последующего наблюдения в течение 13 месяцев.
2(d)). Последние были сильно положительными для виментина и отрицательными для SMA, десмина и HMB-45 (рис. 2(e)). Пролиферативный индекс составлял 60–70% при окрашивании MIB1 (рис. 2(f)). Мы диагностировали этот случай как веретеноклеточный рак языка в соответствии с классификацией ВОЗ 2005 г., в которой диагностические критерии определялись как наличие злокачественных веретенообразных клеток в дополнение к демонстрации инвазивной или плоскоклеточной карциномы in situ или любым признакам эпителиальная дифференцировка веретенообразных клеток [5]. Лимфатическая, сосудистая, нервная инвазия и метастазы в лимфатические узлы не наблюдались, но нижняя челюсть была поражена опухолью. Пациент был классифицирован как стадия IVa в соответствии с рекомендациями AJCC [6] и не имел никаких признаков заболевания после последующего наблюдения в течение 13 месяцев.
3. Обсуждение
SpCC является редким вариантом SCC, который имеет как злокачественные плоскоклеточные клетки, так и злокачественные веретенообразные клетки эпителиального происхождения. Компонент веретенообразных клеток отвечает за внешний вид мезенхимы. И диагностика может быть сложной, особенно когда компонент плоскоклеточного рака не очевиден. Компонент веретенообразных клеток может напоминать многие поражения, начиная от доброкачественных реактивных, таких как радиационно-индуцированная грануляционная ткань, до злокачественных поражений, таких как фибросаркома. Таким образом, для установления правильного диагноза следует тщательно искать любую информацию об эпителиальном компоненте при подозрении на поражение [5]. Для объяснения гистогенетической природы веретенообразных клеток были предложены в основном три различные теории. Первая теория состоит в том, что веретенообразные клетки и эпителиальные клетки возникают одновременно из отдельных стволовых клеток, заслуживающих названия «столкновение» опухоли. Вторая теория объясняет природу компонента веретенообразных клеток как атипичную реактивную пролиферацию стромы и поэтому называется «псевдосаркомой». Наконец, согласно последней теории, клетки как веретенообразных, так и эпителиальных компонентов имеют одинаковое моноклональное происхождение, и произошла «дедифференцировка» или «трансформация» в веретенообразные клетки [7–9].
Компонент веретенообразных клеток отвечает за внешний вид мезенхимы. И диагностика может быть сложной, особенно когда компонент плоскоклеточного рака не очевиден. Компонент веретенообразных клеток может напоминать многие поражения, начиная от доброкачественных реактивных, таких как радиационно-индуцированная грануляционная ткань, до злокачественных поражений, таких как фибросаркома. Таким образом, для установления правильного диагноза следует тщательно искать любую информацию об эпителиальном компоненте при подозрении на поражение [5]. Для объяснения гистогенетической природы веретенообразных клеток были предложены в основном три различные теории. Первая теория состоит в том, что веретенообразные клетки и эпителиальные клетки возникают одновременно из отдельных стволовых клеток, заслуживающих названия «столкновение» опухоли. Вторая теория объясняет природу компонента веретенообразных клеток как атипичную реактивную пролиферацию стромы и поэтому называется «псевдосаркомой». Наконец, согласно последней теории, клетки как веретенообразных, так и эпителиальных компонентов имеют одинаковое моноклональное происхождение, и произошла «дедифференцировка» или «трансформация» в веретенообразные клетки [7–9]. ]. Со временем несколько исследований показали, что веретенообразные клетки имеют сходные характерные черты с плоскоклеточными клетками во всех иммуногистохимических, ультраструктурных, молекулярных и генетических аспектах [10]. Наличие отчетливой демаркационной зоны и разной картины иммуногистохимического окрашивания между эпителиальными и веретенообразными компонентами побудило некоторых исследователей предположить различное происхождение этих компонентов [11]. Однако в последнее время моноклональная гипотеза получила широкое признание и решительно подтверждается некоторыми исследованиями [12–16]. Гистохимические и ультраструктурные исследования показали, что веретенообразные клетки имеют те же характеристики, что и эпителиальные клетки [15]. Кроме того, Гупта и соавт. описали, что некоторые из веретенообразных или транзиторных клеток с мезенхимальным внешним видом экспрессируют двойную антиген-позитивность как с эпителиальными (цитокератин), так и с мезенхимальными (виментин) маркерами [15].
]. Со временем несколько исследований показали, что веретенообразные клетки имеют сходные характерные черты с плоскоклеточными клетками во всех иммуногистохимических, ультраструктурных, молекулярных и генетических аспектах [10]. Наличие отчетливой демаркационной зоны и разной картины иммуногистохимического окрашивания между эпителиальными и веретенообразными компонентами побудило некоторых исследователей предположить различное происхождение этих компонентов [11]. Однако в последнее время моноклональная гипотеза получила широкое признание и решительно подтверждается некоторыми исследованиями [12–16]. Гистохимические и ультраструктурные исследования показали, что веретенообразные клетки имеют те же характеристики, что и эпителиальные клетки [15]. Кроме того, Гупта и соавт. описали, что некоторые из веретенообразных или транзиторных клеток с мезенхимальным внешним видом экспрессируют двойную антиген-позитивность как с эпителиальными (цитокератин), так и с мезенхимальными (виментин) маркерами [15].
Как уже упоминалось выше, СпКХ, как и ПКР, поражает преимущественно мужчин 6-7-го десятилетия жизни и тесно связан с курением и употреблением алкоголя [1, 4, 5]. В нашем случае возраст был в пределах типичного диапазона, но необычно пациентом была женщина. О злоупотреблении алкоголем не сообщалось, но она была заядлым курильщиком, у нее был диагностирован плоскоклеточный рак, и 7 лет назад она получила послеоперационную лучевую терапию. Воздействие радиации на область головы и шеи описывается как предрасполагающий фактор. SpCC, возникающий из менее агрессивных типов плоскоклеточного рака после ЛТ, редко описан [1, 16–19].]. Объединив результаты пяти крупных связанных исследований [17–21], Льюис-младший сообщил, что 18% SpCC в аэро-пищеварительном тракте ранее получали лучевую терапию [10]. Что касается конкретно ротовой области, в предыдущей литературе указывалось на наличие радиационно-индуцированного SpCC, как в нашем случае [22, 23]. Также существует противоречивая литература [24, 25], причем одна из них является самой последней с серией из 103 оральных случаев SpCC, и, что интересно, ни один из пациентов не имел предшествующей истории облучения [24]. Автор предположил, что это может быть связано с разницей в выборе лечения рака полости рта и гортани, поскольку при SpCC полости рта хирургическое лечение предпочтительнее адъювантной лучевой терапии в отличие от рака гортани [24]. В области головы и шеи наиболее частыми локализациями СпРК являются гортань, полость рта, кожа, миндалины и глотка [4, 26]. В нашем случае SpCC возникла из языка, который является одним из редких мест. Опухоли гортани клинически представляют собой полиповидные экзофитные массы и проявляют типичные симптомы, такие как охриплость, изменение голоса, обструкция дыхательных путей и дисфагия. Опухоли полости рта и ротоглотки представляют собой болезненные или безболезненные образования с длительно незаживающей язвой, дисфагией или кровотечением [4, 10]. Опухоли обычно быстро растут. Хотя у нашего пациента не было быстрого роста, поражение имело классический полиповидный и иногда изъязвленный вид. Гистологически мезенхимальный компонент обычно составляет основную часть опухоли, а эпителиальный компонент часто сливается с ней [1].
Автор предположил, что это может быть связано с разницей в выборе лечения рака полости рта и гортани, поскольку при SpCC полости рта хирургическое лечение предпочтительнее адъювантной лучевой терапии в отличие от рака гортани [24]. В области головы и шеи наиболее частыми локализациями СпРК являются гортань, полость рта, кожа, миндалины и глотка [4, 26]. В нашем случае SpCC возникла из языка, который является одним из редких мест. Опухоли гортани клинически представляют собой полиповидные экзофитные массы и проявляют типичные симптомы, такие как охриплость, изменение голоса, обструкция дыхательных путей и дисфагия. Опухоли полости рта и ротоглотки представляют собой болезненные или безболезненные образования с длительно незаживающей язвой, дисфагией или кровотечением [4, 10]. Опухоли обычно быстро растут. Хотя у нашего пациента не было быстрого роста, поражение имело классический полиповидный и иногда изъязвленный вид. Гистологически мезенхимальный компонент обычно составляет основную часть опухоли, а эпителиальный компонент часто сливается с ней [1]. Злокачественные плеоморфные клетки могут иметь участки гипо- и гиперцеллюлярности, а иногда и сториформный рисунок. Обычно хорошо видны типичные и атипичные митотические фигуры. Также могут быть обнаружены гигантские клетки. Наш случай показал характерные микроскопические особенности, указанные выше, включая наличие большого количества гигантских клеток (рис. 2 (а), 2 (б), 2 (в), 2 (г), 2 (д) и 2 (е)). Хотя остеосаркоматозная, хондросаркоматозная или рабдомиосаркоматозная дифференцировка может присутствовать у особенно ранее облученных пациентов, мы не наблюдали таких участков [5, 27]. О метастазах в регионарные лимфатические узлы сообщают до 25% случаев, а отдаленные метастазы встречаются реже [5]. У нашего пациента не было метастазов в лимфатические узлы, но была поражена нижнечелюстная кость. Когда SpCC метастазирует, метастатические очаги могут содержать только SCC или оба компонента, и редко только компонент веретенообразных клеток [7]. Сильвестри и др. показали, что иммунологически саркоматоидные элементы всегда сильно положительны на виментин, но цитокератиновая реактивность веретенообразных клеток вариабельна и может полностью отсутствовать [7], как в нашем случае.
Злокачественные плеоморфные клетки могут иметь участки гипо- и гиперцеллюлярности, а иногда и сториформный рисунок. Обычно хорошо видны типичные и атипичные митотические фигуры. Также могут быть обнаружены гигантские клетки. Наш случай показал характерные микроскопические особенности, указанные выше, включая наличие большого количества гигантских клеток (рис. 2 (а), 2 (б), 2 (в), 2 (г), 2 (д) и 2 (е)). Хотя остеосаркоматозная, хондросаркоматозная или рабдомиосаркоматозная дифференцировка может присутствовать у особенно ранее облученных пациентов, мы не наблюдали таких участков [5, 27]. О метастазах в регионарные лимфатические узлы сообщают до 25% случаев, а отдаленные метастазы встречаются реже [5]. У нашего пациента не было метастазов в лимфатические узлы, но была поражена нижнечелюстная кость. Когда SpCC метастазирует, метастатические очаги могут содержать только SCC или оба компонента, и редко только компонент веретенообразных клеток [7]. Сильвестри и др. показали, что иммунологически саркоматоидные элементы всегда сильно положительны на виментин, но цитокератиновая реактивность веретенообразных клеток вариабельна и может полностью отсутствовать [7], как в нашем случае.
Веретеноклеточный рак следует лечить так же, как и плоскоклеточный рак на той же стадии. При опухолях гортани лечением выбора в первую очередь является хирургическое вмешательство с возможной диссекцией шеи с последующей лучевой терапией или химиотерапией [4, 11, 28–30]. Однако Томпсон и соавт. сообщили, что у пациентов, пролеченных хирургическим путем, прогноз был лучше, чем у пациентов, получавших только лучевую терапию [17]. В области полости рта хирургическое вмешательство считается лучшим методом лечения. Хотя в целом нарастает тенденция к консервативным подходам в лечении рака. Также существуют разногласия по поводу применения ЛТ, особенно при раке ротовой полости [31]. Роль химиотерапии пока не ясна [3, 11, 32]. Низкая стадия, небольшой размер, голосовое расположение в гортани, отсутствие предшествующей лучевой терапии, поверхностное расположение и полиповидный и экзофитный рост связаны с лучшим прогнозом [8, 28]. Кроме того, указано, что экспрессия кератина веретенообразных клеток отрицательно влияет на выживаемость [20]. Хотя SpCC имеет много сходных клинических и гистопатологических особенностей с SCC, первый более агрессивен и, следовательно, имеет более низкую общую выживаемость, как и низкодифференцированные SCC [2, 3, 25]. Еще одним важным фактором, влияющим на выживаемость, является высокая частота рецидивов опухоли даже на ранних стадиях [3]. У нашего пациента, несмотря на резекцию с широким хирургическим краем, в последующем наблюдался рецидив опухоли, и пациенту была проведена спасительная операция. Нет единого мнения о лечении рецидивирующих опухолей. Су и др. сообщили, что существует статистически значимая связь между общей выживаемостью и спасительной операцией [3, 22]. Однако Томпсон и соавт. сообщили о худшем прогнозе у пациентов, перенесших процедуру спасения [17].
Хотя SpCC имеет много сходных клинических и гистопатологических особенностей с SCC, первый более агрессивен и, следовательно, имеет более низкую общую выживаемость, как и низкодифференцированные SCC [2, 3, 25]. Еще одним важным фактором, влияющим на выживаемость, является высокая частота рецидивов опухоли даже на ранних стадиях [3]. У нашего пациента, несмотря на резекцию с широким хирургическим краем, в последующем наблюдался рецидив опухоли, и пациенту была проведена спасительная операция. Нет единого мнения о лечении рецидивирующих опухолей. Су и др. сообщили, что существует статистически значимая связь между общей выживаемостью и спасительной операцией [3, 22]. Однако Томпсон и соавт. сообщили о худшем прогнозе у пациентов, перенесших процедуру спасения [17].
Дифференциальная диагностика может быть проблематичной, особенно в случаях проявления только компонента веретенообразных клеток. Основной диагностической ошибкой является наличие обильной грануляционной ткани, особенно на замороженных срезах, цитологии тонкоигольной аспирационной (FNA) и послеоперационной биопсии [16, 33]. Материал инцизионной биопсии в нашем случае также содержал только веретенообразные клетки, но в клиническом анамнезе важнейшими данными были предыдущий диагноз SCC и лечение лучевой терапией. Кроме того, опухоль может отчетливо имитировать истинную фибросаркому или иметь много кровеносных сосудов, что может указывать на ангиосаркому [18]. Мы также наблюдали участки, подобные фибросаркоме, и опухоль была богата кровеносными сосудами; но наличие злокачественных плоскоклеточных клеток и история болезни пациента привели нас к правильному диагнозу. Кроме того, высокий пролиферативный индекс с окрашиванием ki-67 (MIB1) поддерживал злокачественный стромальный компонент, а не доброкачественную грануляционную ткань.
Материал инцизионной биопсии в нашем случае также содержал только веретенообразные клетки, но в клиническом анамнезе важнейшими данными были предыдущий диагноз SCC и лечение лучевой терапией. Кроме того, опухоль может отчетливо имитировать истинную фибросаркому или иметь много кровеносных сосудов, что может указывать на ангиосаркому [18]. Мы также наблюдали участки, подобные фибросаркоме, и опухоль была богата кровеносными сосудами; но наличие злокачественных плоскоклеточных клеток и история болезни пациента привели нас к правильному диагнозу. Кроме того, высокий пролиферативный индекс с окрашиванием ki-67 (MIB1) поддерживал злокачественный стромальный компонент, а не доброкачественную грануляционную ткань.
Таким образом, мы представляем здесь редкий случай SpCC, возникающий из языка. Основываясь на ограниченном количестве исследований в литературе, его точный патогенез, клиническое поведение и долгосрочный прогноз еще недостаточно изучены. В связи с усилением консервативных подходов в лечении и, следовательно, вероятным использованием радиотерапевтических методов [34, 35], SpCC, вероятно, будет диагнозом, с которым патолог-хирург может чаще сталкиваться в будущем. Несмотря на сложный характер, клинический анамнез и наличие плоскоклеточного компонента или определение эпителиальной природы веретенообразных клеток помогут патологу поставить диагноз. Наконец, следует помнить, что чистые саркомы головы и шеи встречаются крайне редко [5], и поэтому при оценке полиповидных поражений этой области, содержащих веретенообразные клетки, всегда следует учитывать карциному веретенообразных клеток.
Несмотря на сложный характер, клинический анамнез и наличие плоскоклеточного компонента или определение эпителиальной природы веретенообразных клеток помогут патологу поставить диагноз. Наконец, следует помнить, что чистые саркомы головы и шеи встречаются крайне редко [5], и поэтому при оценке полиповидных поражений этой области, содержащих веретенообразные клетки, всегда следует учитывать карциному веретенообразных клеток.
Благодарность
Авторы благодарят г-жу Лесли Дукато за языковой обзор рукописи.
Ссылки
-
E.B. Stelow и S.E. Mills, «Варианты плоскоклеточной карциномы верхних дыхательных путей», American Journal of Clinical Pathology , vol. 124, приложение, стр. S96–S109, 2005.
Просмотр по адресу:
Google Scholar
-
С. Б. Минами, С. Шинден и Т. Ямасита, «Веретеноклеточный рак небной миндалины: отчет о диагностике подводный камень и обзор литературы», Американский журнал отоларингологии , том.
 29, нет. 2, стр. 123–125, 2008 г.
29, нет. 2, стр. 123–125, 2008 г. Посмотреть по адресу:
Сайт издателя | Google Scholar
-
HH Su, ST Chu, YUY Hou, KP Chang и CJ Chen, «Веретеноклеточный рак полости рта и ротоглотки: фактор, влияющий на исход», Журнал Китайской медицинской ассоциации , том. 69, нет. 10, pp. 478–483, 2006.
Просмотр по адресу:
Google Scholar
-
B.M. Wenig, «Плоскоклеточный рак верхних дыхательных путей: предшественники и проблемные варианты», Современная патология , том. 15, нет. 3, стр. 229–254, 2002.
Посмотреть по адресу:
Сайт издателя | Google Scholar
-
А. Кардеса и Н. Зидар, «Веретеноклеточная карцинома», в Всемирной организации здравоохранения по опухолям. Патология и генетика опухолей головы и шеи , L.
 Barnes, JW Eveson, P. Reichart, and D. Sidransky, Eds., стр. 127–128, IARC Press, Lyon, France, 2005.
Barnes, JW Eveson, P. Reichart, and D. Sidransky, Eds., стр. 127–128, IARC Press, Lyon, France, 2005. Просмотр по адресу:
Google Scholar
-
Дж. Купер, И. Д. Флеминг и Д. Э. Хенсон, ред., Руководство Американского объединенного комитета по раку для определения стадии рака , J. B. Lippincott, Philadelphia, Pa, USA, 6th edition, 2002.
-
S.B. Silvestri, R.L. гортани с актиномицетами хондрита гортани и трахеи», Otolaryngology—Head and Neck Surgery , vol. 134, нет. 2, стр. 345–347, 2006 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
-
H. Miyahara, Y. Tsuruta, K. Yane, and Y. Ogawa, «Веретеноклеточный рак гортани», стр. 9.0045 Auris Nasus Гортань , vol. 31, нет. 2, стр. 177–182, 2004 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
-
P.
 Singh, JP Kanotra, D. Luthra, G. Singh, and S. Kotwal, «Саркоматоидная карцинома гортани», Indian Journal of Otolaryngology and Head and Neck Surgery , vol. 52, нет. 2, pp. 189–190, 2000.
Singh, JP Kanotra, D. Luthra, G. Singh, and S. Kotwal, «Саркоматоидная карцинома гортани», Indian Journal of Otolaryngology and Head and Neck Surgery , vol. 52, нет. 2, pp. 189–190, 2000. Посмотреть по адресу:
Google Scholar
-
Дж. С. Льюис мл., «Опухолевые или неопухолевые поражения веретеноклеточных клеток?: веретеноклеточная карцинома и другие атипичные веретеноклеточные поражения голова и шея» Патология головы и шеи , vol. 2, нет. 2, стр. 103–110, 2008 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
-
Y. Miyajima, K. Onizawa, H. Kamma и H. Yoshida, «Carcinosasarcoma of the language», Oral Oncology Extra , vol. 42, нет. 2, стр. 78–81, 2006 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
-
Ким Э.
 Дж., Че З. М., Парк Ю. Дж. и др., «Морфогенез и биологическое значение трансформации веретенообразных клеток при веретеноклеточной карциноме», стр. 9.0045 Рак Письма , том. 275, нет. 1, стр. 61–71, 2009 г.
Дж., Че З. М., Парк Ю. Дж. и др., «Морфогенез и биологическое значение трансформации веретенообразных клеток при веретеноклеточной карциноме», стр. 9.0045 Рак Письма , том. 275, нет. 1, стр. 61–71, 2009 г. Посмотреть по адресу:
Сайт издателя | Google Scholar
-
N. Zidar, N. Gale, N. Kojc et al., «Кадгерин-катениновый комплекс и фактор транскрипции Snail-1 при веретеноклеточной карциноме головы и шеи», Virchows Archiv , vol. 453, нет. 3, стр. 267–274, 2008 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
-
С. Самдхани, А. Чоудхари, В. Р. Маханта и С. П. Шривастава, «Веретеноклеточная саркома гортани», стр. 9.0045 Индийский журнал отоларингологии и хирургии головы и шеи , том. 58, нет. 3, стр. 305–306, 2006 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
-
R.
 Gupta, S. Singh, S. Hedau et al., «Веретеноклеточная карцинома головы и шеи: иммуногистохимический и молекулярный подход к ее патогенезу», Journal of Clinical Pathology , vol. 60, нет. 5, стр. 472–475, 2007.
Gupta, S. Singh, S. Hedau et al., «Веретеноклеточная карцинома головы и шеи: иммуногистохимический и молекулярный подход к ее патогенезу», Journal of Clinical Pathology , vol. 60, нет. 5, стр. 472–475, 2007. Посмотреть по адресу:
Сайт издателя | Академия Google
-
D. J. Chute и E. B. Stelow, «Цитология вариантов плоскоклеточного рака головы и шеи», Diagnostic Cytopathology , vol. 38, нет. 1, стр. 65–80, 2010 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
-
Л. Д. Р. Томпсон, Дж. А. Винеке, М. Миеттинен и Д. К. Хеффнер, «Веретеноклеточный (саркоматоидный) рак гортани: клинико-патологическое исследование 187 случаев», , Американский журнал хирургической патологии, , том. 26, нет. 2, стр. 153–170, 2002.
Посмотреть по адресу:
Сайт издателя | Google Scholar
-
Дж.
 Э. Льюис, К. Д. Олсен и Т. Дж. Себо, «Веретеноклеточная карцинома гортани: обзор 26 случаев, включая содержание ДНК и иммуногистохимию», Human Pathology , vol. 28, нет. 6, стр. 664–673, 1997.
Э. Льюис, К. Д. Олсен и Т. Дж. Себо, «Веретеноклеточная карцинома гортани: обзор 26 случаев, включая содержание ДНК и иммуногистохимию», Human Pathology , vol. 28, нет. 6, стр. 664–673, 1997. Посмотреть по адресу:
Сайт издателя | Google Scholar
-
Г. С. Левентон и Х. Л. Эванс, «Саркоматоидный плоскоклеточный рак слизистых оболочек головы и шеи: клинико-патологическое исследование 20 случаев», Рак , том. 48, нет. 4, pp. 994–1003, 1981.
Посмотреть по адресу:
Google Scholar
-
К. Д. Олсен, Дж. Э. Льюис и В. Дж. Суман, «Веретеноклеточный рак гортани и гортани», Отоларингология Хирургия , том. 116, нет. 1, стр. 47–52, 1997.
Посмотреть по адресу:
Сайт издателя | Google Scholar
-
Г.
 Л. Эллис и Р. Л. Корио, «Веретеноклеточный рак полости рта. Клинико-патологическая оценка пятидесяти девяти случаев» Хирургия полости рта Оральная медицина и патология полости рта , vol. 50, нет. 6, pp. 523–534, 1980.
Л. Эллис и Р. Л. Корио, «Веретеноклеточный рак полости рта. Клинико-патологическая оценка пятидесяти девяти случаев» Хирургия полости рта Оральная медицина и патология полости рта , vol. 50, нет. 6, pp. 523–534, 1980. Посмотреть по адресу:
Google Scholar
-
M. Takagi and G. Ishikawa, «Веретеноклеточный рак полости рта», The Bulletin of Tokyo Medical and Dental Университет , вып. 29, нет. 4, pp. 103–111, 1982.
Просмотр по адресу:
Google Scholar
-
H. Iguchi, T. Uyama, A. Kanazawa et al., «Веретеноклеточная карцинома как местно-рецидивирующая злокачественная опухоль после операции по поводу ранняя плоскоклеточная карцинома языка» Acta Oto-Laryngologica , vol. 128, нет. 11, стр. 1273–1276, 2008.
Посмотреть по адресу:
Сайт издателя | Google Scholar
-
С.
 Вишванатан, К. Рахман, С. Паллави и др., «Саркоматоидная (веретенообразная) карцинома области слизистой оболочки головы и шеи: клинико-патологический обзор 103 случаев из третичного специализированного онкологического центра». Патология головы и шеи , vol. 4, нет. 4, стр. 265–275, 2010.
Вишванатан, К. Рахман, С. Паллави и др., «Саркоматоидная (веретенообразная) карцинома области слизистой оболочки головы и шеи: клинико-патологический обзор 103 случаев из третичного специализированного онкологического центра». Патология головы и шеи , vol. 4, нет. 4, стр. 265–275, 2010. Посмотреть по адресу:
Сайт издателя | Академия Google
-
М. Дж. Романьяч, Р. С. Азеведо, Р. Карлос, О. П. Де Алмейда и Ф. Р. Пирес, «Клиникопатологические и иммуногистохимические особенности карциномы веретенообразных клеток полости рта», Journal of Oral Pathology and Medicine , vol. 39, нет. 4, стр. 335–341, 2010.
Посмотреть по адресу:
Сайт издателя | Google Scholar
-
Н. Гейл и Н. Зидар, «Веретеноклеточная карцинома», в патологии головы и шеи , А. Кардеса и П. Дж. Слотвег, ред., стр. 16–17, Спрингер, Нью-Йорк , Нью-Йорк, США, 2006.

Просмотр по адресу:
Google Scholar
-
Н. Катасэ, Р. Тамамура, М. Гундуз и др., «Веретеноклеточный рак с костной метаплазией в деснах: клинический случай с иммуногистохимическим анализом», Медицина головы и лица , том. 4, нет. 1, статья 28, 2008 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
-
М. Беккер, Г. Мулен, А. М. Курт и др., «Атипичный плоскоклеточный рак гортани и гортаноглотки: рентгенологические особенности и патологическая корреляция», Европейская радиология , том. 8, нет. 9, pp. 1541–1551, 1998.
Посмотреть по адресу:
Google Scholar
-
A. Franzen and D. Theegarten, «Karzinosarkome des Larynx und Hypophorynx. Der interessante Fall», Laryngo-Rhino-Otologie , vol.
 86, стр. 209–212, 2007.
86, стр. 209–212, 2007. Просмотр по адресу:
Google Scholar
-
С. Кубота, Т. Морита, К. Муракава и др., «Случай или псевдосаркома, связанная с плоскоклеточным раком 3 типа пищевода: описание случая», Хирургия сегодня , том. 29, нет. 8, стр. 777–781, 1999.
Посмотреть по адресу:
Сайт издателя | Google Scholar
-
М. Хашибе, Б. Ритц, А. Д. Ле, Г. Ли, Р. Санкаранараянан и З. Ф. Чжан, «Лучевая терапия рака полости рта как фактор риска вторичного первичного рака», Cancer Letters , vol. . 220, нет. 2, стр. 185–195, 2005 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
-
H. Onishi, K. Kuriyama, T. Komiyama et al., «Саркоматоидная карцинома гортани T1N0 с быстрым системным метастазированием после радикальной лучевой терапии: клинический случай и обзор литературы», Американский журнал отоларингологии , том.
 26, нет. 6, стр. 400–402, 2005.
26, нет. 6, стр. 400–402, 2005. Посмотреть по адресу:
Сайт издателя | Google Scholar
-
Н. Сингхал, Н. Дхингра, У. Ханда, Х. Мохан и С. Сингхал, «Тонкоигольная аспирационная цитология веретеноклеточной карциномы языка: отчет о клиническом случае с акцентом на диагностические трудности, Цитопатология , том. 21, нет. 2, стр. 130–132, 2010 г.
Посмотреть по адресу:
Сайт издателя | Академия Google
-
Р. Корво, «Доказательная радиационная онкология при плоскоклеточном раке головы и шеи», Лучевая терапия и онкология , том. 85, нет. 1, стр. 156–170, 2007 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
-
J. P. Shah and W. Lydiatt, «Лечение рака головы и шеи», Ca-A Cancer Journal for Clinicians , vol.
 45, нет. 6, стр. 352–368, 1995.
45, нет. 6, стр. 352–368, 1995. Посмотреть по адресу:
Google Scholar
Copyright
Copyright © 2011 Murat Oktay et al. Это статья в открытом доступе, распространяемая под Лицензия Creative Commons Attribution, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии надлежащего цитирования оригинальной работы.
Новообразование неопределенного характера языка
- Коды МКБ-10-СМ ›
- C00-D49 ›
- Д37-Д48 ›
- Д37- ›
- 2023 Код диагноза по МКБ-10-CM D37.02
Новообразование неопределенного поведения языка
- 2016 2017 2018 2019 2020 2021 2022 2023 Платный/специфический код целей.
- Редакция МКБ-10-КМ D37.
 02 2023 г. вступила в силу 1 октября 2022 г.
02 2023 г. вступила в силу 1 октября 2022 г. - Это американская версия МКБ-10-СМ D37.02 — другие международные версии МКБ-10 D37.02 могут отличаться.
Следующие коды выше D37.02 содержат обратные ссылки на аннотации
обратные ссылки на аннотации
В этом контексте обратные ссылки на аннотации относятся к кодам, которые содержат:
- Применимо к аннотациям или
- Код также также аннотации, или
- код первые аннотации, или
- , исключающие 1 аннотации, или
- ExcudEs2 Аннотации, или
- , включает в себя аннотации, или
- , или
- . к D37.02:
- C00-D49
2023 ICD-10-CM Диапазон C00-D49
Новообразования
Примечание
- Функциональная активность
- Все новообразования классифицируются в этой группе, независимо от того, являются они функционально активными или нет.
 Дополнительный код из главы 4 может использоваться для идентификации функциональной активности, связанной с любым новообразованием.
Дополнительный код из главы 4 может использоваться для идентификации функциональной активности, связанной с любым новообразованием. - Морфология [гистология]
- В Главе 2 новообразования классифицируются главным образом по локализации (топографии) с широкими группами по поведению, злокачественным, in situ, доброкачественным и т. д. Для определения правильного топографического кода следует использовать Таблицу новообразований. В некоторых случаях, таких как злокачественная меланома и некоторые нейроэндокринные опухоли, морфология (гистологический тип) включается в категорию и коды.
- Первичные злокачественные новообразования, перекрывающие границы очагов
- Первичные злокачественные новообразования, перекрывающие два или более смежных (рядом друг с другом) очага, должны быть отнесены к подкатегории/коду .8 («перекрывающееся поражение»), если комбинация специально не проиндексирована в другом месте. Для множественных новообразований одной и той же локализации, которые не являются смежными, например, опухоли в разных квадрантах одной и той же молочной железы, следует присвоить коды для каждой локализации.

- Злокачественное новообразование эктопической ткани
- Злокачественное новообразование эктопической ткани следует кодировать по указанному месту, например, эктопические злокачественные новообразования поджелудочной железы кодируют как поджелудочную железу, неуточненную (С25.9).
- D37-D48
2023 МКБ-10-СМ Диапазон D37-D48
Новообразования неопределенного характера, истинная полицитемия и миелодиспластические синдромы поведение, то есть гистологическое подтверждение того, является ли новообразование злокачественным или доброкачественным, невозможно.
Тип 1 исключает
- Неоплазмы неопределенного поведения. полость рта и органы пищеварения
- 2016 2017 2018 2019 2020 2021 2022 20230052
- D37.0
Код диагноза по МКБ-10 D37.0
Новообразование губы, полости рта и глотки неопределенной формы
- 2012 2017 2018 2019 202120
- новообразование черпало-надгортанной складки или межчерпаловидной складки, со стороны гортани (D38.
 0)
0) - новообразование неопределенного поведения надгортанника БДУ (D38.0)
- новообразование неопределенного характера кожи губы (D48.5)
- новообразование неопределенного характера надподъязычной части надгортанника (D38.0)
- новообразование черпало-надгортанной складки или межчерпаловидной складки, со стороны гортани (D38.
МКБ-10-CM D37.02 сгруппирована в группу (группы), связанные с диагностикой (MS-DRG v40.0):
- 011 Трахеостомия для диагностики лица, рта и шеи или ларингэктомия с mcc
- 012 Трахеостомия для диагностики лица, рта и шеи или ларингэктомия с cc
- 013 Трахеостомия для диагностики лица, рта и шеи или ларингэктомия без cc/mcc
- 146 Злокачественные новообразования уха, носа, рта и горла с mcc
- 147 Злокачественные новообразования уха, носа, рта и горла с cc
- 148 Злокачественные новообразования уха, носа, рта и горла без cc/mcc
Преобразование D37.
 02 в МКБ-9-СМ
02 в МКБ-9-СМ История кода
- 2016 (действует с 01.10.2015) : Новый код (первый год не-проекта МКБ-10-КМ)
- 2017 (действует с 01.10.2016) : без изменений
- 2018 (действует с 01.10.2017) : без изменений
- 2019 (действует с 01.10.2018) : без изменений
- 2020 (действует с 01.10.2019) : Без изменений
- 2021 (действует с 01.10.2020) : Без изменений
- 2022 (действует с 01.10.2021) : Без изменений
- 2023 (действует с 01.10.2022) : Без изменений
Коды МКБ-10-СМ, смежные с D37.02
D3A.
 092 Доброкачественная карциноидная опухоль желудка
092 Доброкачественная карциноидная опухоль желудка D3A.093 Доброкачественная карциноидная опухоль почки
D3A.094 Доброкачественная карциноидная опухоль передней кишки неуточненная
D3A.095 Доброкачественная карциноидная опухоль средней кишки неуточненная
D3A.
 096 Доброкачественная карциноидная опухоль задней кишки неуточненная
096 Доброкачественная карциноидная опухоль задней кишки неуточненная D3A.098 Доброкачественные карциноидные опухоли других локализаций
D3A.8 Другие доброкачественные нейроэндокринные опухоли
D37 Новообразование неопределенной формы полости рта и органов пищеварения
D37.0 Новообразование неопределенной формы губы, полости рта и глотки
D37.
 01 Новообразование губы неопределенного характера
01 Новообразование губы неопределенного характера Д37.02 Новообразование неопределенного поведения языка
D37.03 Новообразование неопределенного характера больших слюнных желез
D37.030 Новообразование неопределенного характера околоушных слюнных желез0003
D37.
 031 Новообразование неопределенного характера подъязычных слюнных желез
031 Новообразование неопределенного характера подъязычных слюнных желез D37.032 Новообразование неопределенного характера поднижнечелюстных слюнных желез
D37.039 …… не указано
D37.04 Новообразование неопределенного характера малых слюнных желез0003
D37.

- C00-D49

 2 Дна полости рта
2 Дна полости рта