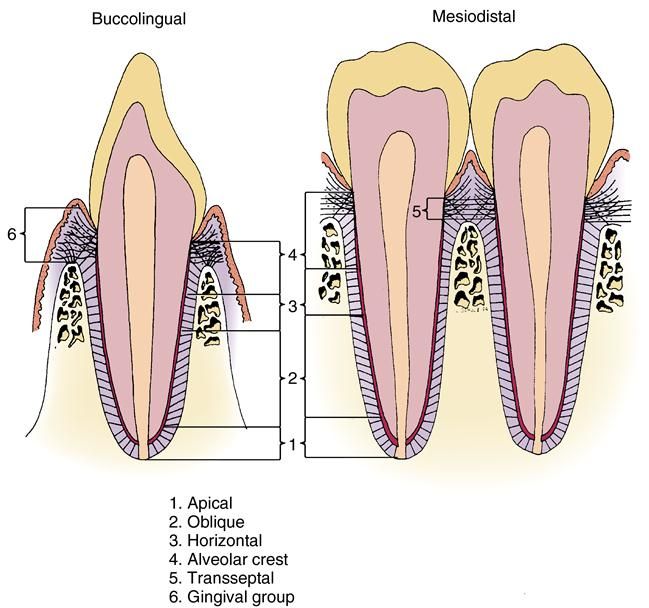
9.3. Уровень деструкции периодонтальной ткани, наличие периодонтальных карманов.
Наличие периодонтальных карманов оценивают с помощью периодонтального зонда, а полученные данные учитывают при определении индексов: ПИ (Russel, 1956; Ramfjord, 1959) и комбинированных индексов CPITN (BO3,1980), КПИ (Леус, 1988).
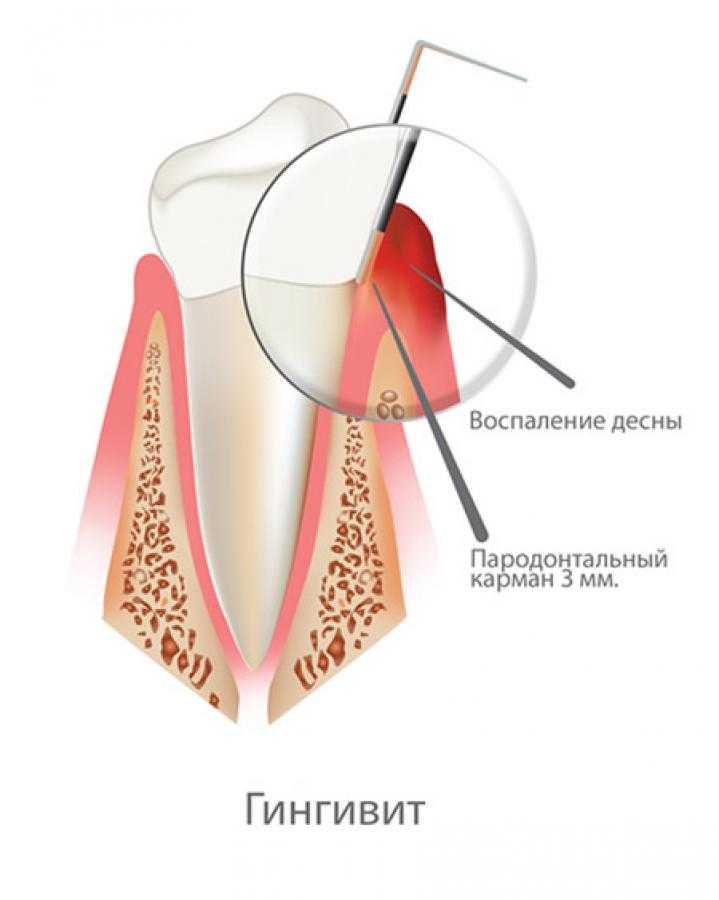
— Карман (клинический) — состояние периодонта, диагностируемое с помощью легкого зондирования, когда глубина кармана от десневого края превышает 3 мм.
— Карман (гисто — патологический) — патологически измененная десневая борозда, выстланная эпителием десневого кармана. Его обозначают как десневой, внутрикостный, надкостный, периодонтальный, простой, сложный, комбинированный.
— Десневой — карман, не выходящий за пределы десневой ткани, который может быть не связан с деструкцией кости.
—
Периодонтальный
— карман, выходящий за пределы десны,
проникая в более глубокие разрушенные
периодонтальные ткани.
— Внутрикостный — карман, в котором апикальные края деструктивно измененных окружающих тканей находятся внутри альвеолярного отростка, т.е. апикально к прилегающему альвеолярному гребню.
— Надкостный — карман, в котором апикальные края деструктивно измененных окружающих тканей примыкают к альвеолярному гребню в области корней. Это состояние связано с горизонтальной деструкцией кости.
— Простой — карман, определяется с одной поверхности зуба.
— Комбинированный — карман, определяется с двух или более поверхностей зуба. Основание кармана находится на уровне маргинальной десны.
— Сложный или спиралевидный — карман, который охватывает зуб со всех его сторон.
Окклюзионная травма может быть вызвана окклюзионными чрезмерными силами, уменьшением резервных сил периодонта или суммой вышеперечисленных признаков.
Окклюзионную
травму находят тогда, когда есть
повреждение тканей периодонта. Однако,
возможно наличие чрезмерных окклюзионных
сил с компенсированием резервных
способностей периодонта. Если резервные
силы не могут справиться с окклюзионными
чрезмерными силами — наступает их
повреждение. Это состояние называет
окклюзионной травмой.
Однако,
возможно наличие чрезмерных окклюзионных
сил с компенсированием резервных
способностей периодонта. Если резервные
силы не могут справиться с окклюзионными
чрезмерными силами — наступает их
повреждение. Это состояние называет
окклюзионной травмой.
Окклюзионная травма может быть первичной и вторичной.
9.4.1. Первичная окклюзионная травма. Определяется при завышении прикуса протезом, пломбой, ортодонтическим перемещением зубов и др.
9.4.2. Вторичная окклюзионная травма. Определяется при уменьшении резервных способностей периодонта, который не может справиться с окклюзионными силами, вследствие этого повреждается.
9.4.3.Факторы, влияющие на резервные силы периодонта:
— воспаление периодонтальной связки;
— частичная деструкция поддерживающих тканей;
— патологическая миграция зубов, при этом они подвергаются чрезмерным окклюзионными силам;
— перемещение зубов в результате потери соседних;
— гипофункция ведет к атрофии поддерживающего аппарата;
—
возраст и системные заболевания.
9.4.4. Клинические признаки окклюзионной травмы: остатки пищи, вредные привычки, эрозия эмали, прикусывание щеки, чувствительность дентина моляров и премоляров на жевательных поверхностях, гиперплазия десны, бруксизм, жевание на одной стороне, ограничение подвижности нижней челюсти, интрапроксимальный кариес, тенденция и образование эпулиса, гиперемия пульпы, некроз пульпы, дентиклы в пульпе.
9.4.5. Rо-картина при окклюзионной травме. На Rо-грамме отмечают:
— расширение периодонтальной щели с утолщением компактной пластинки вдоль латеральной стенки корня, апикальной области его и в зоне бифуркации, трифуркации зуба;
— вертикальную резорбцию межальвеолярных перегородок с образованием внутрикостных дефектов;
— резорбцию корня;
— рентгеноконтрастность и плотность альвеолярной кости.
9.5.
Состояние микроциркуляции периодонта.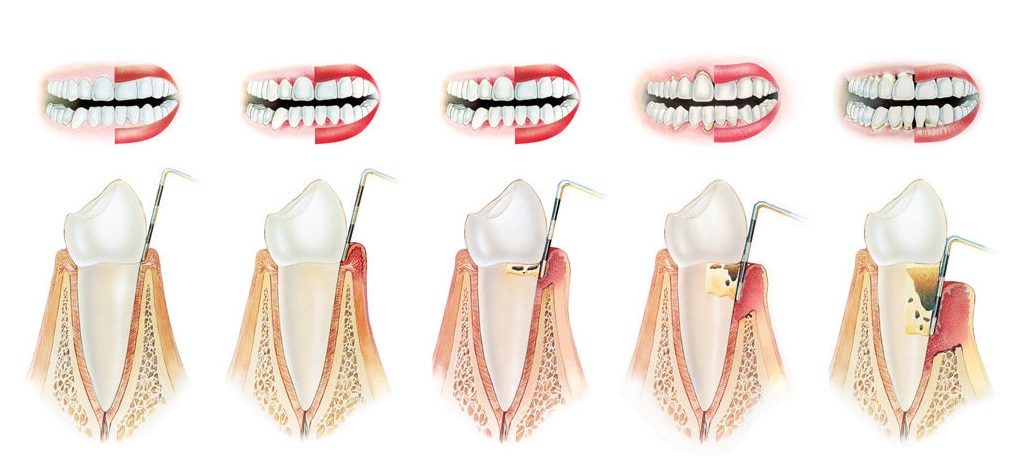
Результаты специальных исследований показали, что существует связь между характером разбалансировки локальной гемодинамики и активного воспаления. Чем больше выражены эти связи, тем интенсивнее протекает деструктивный процесс в тканях периодонта. В случаях, когда есть затруднения в диагностике характера патологического процесса или назначении адекватного лечения, определяют состояние кровообращения в тканях периодонта. Для этого используют капилляроскопические и реопериодонтографические, био- и микроскопические исследования для определения количества функционирующих капилляров, их построения, рядности и интенсивности кровотока в них. Однако, это требует специальной аппаратуры и подготовки врача.
Наибольшее
распространение в стоматологической
практике получила вакуумная проба на
стойкость капилляров десны (В.И.Кулаженко,
1960). Методика, проведение которой
заключается в образовании вакуумных
гематом на слизистой альвеолярного
отростка челюсти в области проекции
корней зубов. По времени их образования
судят о стойкости капилляров к воздействию
очагового дозированного вакуума. С
целью повышения точности способа
учитывают внутрикапиллярное давление
пациента, а после этого устанавливают
полученное значение на шкале вакуумметра
вакуумной системы (Денисов Л.А., Дедова
Л.Н., патент РФ N 2029494).
По времени их образования
судят о стойкости капилляров к воздействию
очагового дозированного вакуума. С
целью повышения точности способа
учитывают внутрикапиллярное давление
пациента, а после этого устанавливают
полученное значение на шкале вакуумметра
вакуумной системы (Денисов Л.А., Дедова
Л.Н., патент РФ N 2029494).
Существует более информативная характеристика состояния микроциркуляции, например, определение ИПК — индекса периферического кровообращения (Дедова Л.Н., 1982). При этом учитывают показатели стойкости капилляров десны и времени рассасывания гематом .
Журнал «Стоматолог»
Стоматолог № 3 (34) — 2019, стр. 22-28 Научные публикации
Л.Н. Дедоваa, Ю.Л. Денисоваb, А.С. Соломевичc, О.В. Кандрукевичd, П.
 А. Семижонe, М.В. Апанасовичf
А. Семижонe, М.В. Апанасовичf a,bд-р мед. наук, профессор, Белорусский государственный медицинский университет, Минск, Беларусь
c,dканд. мед. наук, доцент, Белорусский государственный медицинский университет, Минск, Беларусь
eканд. биол. наук, РНПЦ эпидемиологии и микробиологии, Минск, Беларусь
fБелорусский государственный медицинский университет, Минск, Беларусь
https://doi.org/10.32993/stomatologist.2019.3(34).2
РЕЗЮМЕ
Цель исследования. Обозначить основные клинико-лабораторные принципы микробиологической диагностики в периодонтологии и определить стоматологические инструменты для рационального извлечения содержимого из периодонтальных карманов у пациентов с болезнями периодонта.
Объекты и методы. Проведено стоматологическое обследование 60 пациентов с клиническими признаками генерализованного периодонтита и глубиной периодонтального кармана 5–6 мм в возрасте 35–44 лет (основная группа) и 140 пациентов без признаков болезней периодонта в возрасте 20–24 года (контрольная группа), обратившихся за стоматологической помощью в ГУ «Республиканская клиническая стоматологическая поликлиника».
 Для определения рациональности выбора инструментов для извлечения содержимого из периодонтального кармана применяли метод ПЦР-диагностики. Для извлечения содержимого из периодонтального кармана в исследование включили стерильные инструменты: стоматологический зонд, экскаватор №1, периодонтальный пуговчатый зонд ВОЗ, периодонтальный зонд Северная Каролина, межзубной ершик, бумажный штифт.
Для определения рациональности выбора инструментов для извлечения содержимого из периодонтального кармана применяли метод ПЦР-диагностики. Для извлечения содержимого из периодонтального кармана в исследование включили стерильные инструменты: стоматологический зонд, экскаватор №1, периодонтальный пуговчатый зонд ВОЗ, периодонтальный зонд Северная Каролина, межзубной ершик, бумажный штифт.Результаты исследования и их обсуждение. Представлены основные клинико-лабораторные принципы микробиологической диагностики в периодонтологии: правильный выбор объекта исследования; выбор адекватных диагностических средств; выбор методики исследования; компетенция результатов исследования микробиологической диагностики в периодонтологии. Полученный с помощью всех инструментов биоматериал содержал ДНК микроорганизмов, что свидетельствует о возможности использования для извлечения содержимого из периодонтальных карманов всех инструментов, включенных в исследование. Однако в образцах, прошедших отбор с помощью бумажного штифта, выявлено наибольшее количество ДНК микроорганизмов.

Заключение. Основные принципы микробиологической диагностики в периодонтологии дают возможность в постановке диагноза, планировании и оценке результатов лечения. Компетенции диагностики в выборе объекта исследований свидетельствуют о целесообразности изучения содержимого десневой борозды и/или периодонтального кармана у пациентов с болезнями периодонта. ПЦР – среди современных молекулярно-биологических методов – относят к приоритетным. Для извлечения содержимого из периодонтального кармана у пациентов с болезнями периодонта врачу рекомендован дифференцированный выбор рациональных стоматологических инструментов с соблюдением их приоритетности в следующем порядке: бумажный штифт, межзубной ершик (размер 0), периодонтальный пуговчатый зонд ВОЗ, периодонтальный зонд Северная Каролина, стоматологический зонд, экскаватор стоматологический № 1.
Ключевые слова: лабораторная диагностика, периодонтология, микробиология
Литература
- Axelson, P. Periodontal disease. Diagnosis and risk prediction. Quintessense, 2002, vol. 3, pp. 95–119.
- Balaban N.Q. [et al.] Bacterial Persistence as a Phenotypic Switch. Science, 2004, vol. 305, no. 5690, pp. 1622–1625.
- Dahlen, G. Microbiological diagnostics in oral diseases. Acta Odontol. Scand., 2006, vol. 64, no. 3, pp. 164–168.
- Davey M.E., O’Toole G.A. Microbial biofilms: from ecology to molecular genetics. Microbiol. Mol. Biol. Rev., 2000, no.64, pp. 847–867.
- Donlan R.M., Costerton J.W. Biofilms: Survival Mechanisms of Clinically Relevant Microorganisms. CLIN. MIC. REV., 2002, vol. 15, no. 2, pp. 167–193.
- Elander R. Industrial production of beta-lactam antibiotics. Applied microbiology and biotechnology, 2003, vol. 61 (56), pp. 385–392.
- Elisabeth M., Clara D., Gary C. [et al.
 ] Bacterial diversity in the oral cavity of ten healthy individuals. ISME J., 2010, vol. 4 (8), pp. 962–974.
] Bacterial diversity in the oral cavity of ten healthy individuals. ISME J., 2010, vol. 4 (8), pp. 962–974. - Fujinaka, H., Takeshita T., Sato H. Relationship of periodontal clinical parameters with bacterial composition in human dental plaque. Archives of Microbiology, 2013, vol. 195, no. 6, pp. 371–383.
- Guobis Ž., Kareivienė V., Basevičienė N. [et al.] Microflora of the oral cavity in patients with xerostomia. Medicina (Kaunas), 2011, vol. 47 (12), pp. 646–651.
- Haase, G. Investigation of infectious organisms causing pericoronitis of the mandibular third molar. Journal of Oral &Maxillofacial Surgery, 2000, vol. 58, no. 6, pp. 611–616.
- Haffajee, A.D., Yaskell T., Torresyap G. et al. Comparison between polymerase chain reaction based and checkerboard DNA hybridization techniques for microbial assessment of subgingival plaque samples. J. Clin. Periodontol., 2009, vol. 36, pp. 642–649.
- Haffajee, A.D., Teles R.P., Socransky S.S. Association of Eubacterium nodatum and Treponema denticola with human periodontitis lesions.
 Oral Microbiol. Immunol., 2006, vol.21, pp. 269¬282.
Oral Microbiol. Immunol., 2006, vol.21, pp. 269¬282. - Haffajee, A.D., Socransky S.S. Microbial etiological agents of destructive periodontal diseases. Periodontol., 1994, vol. 5, pp. 78–111.
- Holt. S.C., Ebersole J.L. Porphyromonas gingivalis, Treponema denticola, and Tannerella forsythia: the’red complex’, a prototype polybacterial pathogenicconsortium in periodontitis. Periodontology 2000, 2005, vol. 38, pp. 72–122.
- Loesche, W. J., Kazor C.E., Taylor G.W. The optimization of the BANA test as a screening instrument for gingivitis among subjects seeking dental treatment. Journal of Clinical Periodontology, 1997, vol. 24, pp. 718–726.
- Palmer R.J.Jr., Stoodley P. Biofilms 2007: broadened horizons and new emphases. J. Bacteriol., 2007, no. 189 (22), pp. 7948–7960.
- Perez-Chaparro, P.J., Rouillon A., Minet J., Lafaurie G.I., Bonnaure-Mallet M. A genotypes and PFGE profile patterns in Porphyromonas gingivalis isolates from subjectswith periodontitis.
 Oral Microbiol Immunol., 2009, vol. 24, pp. 423–426.
Oral Microbiol Immunol., 2009, vol. 24, pp. 423–426. - Riep, B., Edesi-Neuss L., Claessen F., Skarabis H., Ehmke B., Flemmig T.F., Bernimoulin J.P., Gobel U.B., Moter A. Are putative periodontal pathogens reliable diagnostic markers? J. Clin. Microbiol., 2009, vol. 47, pp. 1705–1711.
- Rice S.A. [et al.] Biofilm formation and sloughing in Serratia marcescens are controlled by quorum sensing and nutrient cues. J. Bacteriol, 2005, no. 187, pp. 3477–3485.
- Sawhney R., Sharma R., Sharma K. Microbial Colonization on Elastomeric Ligatures during Orthodontic Therapeutics: An Overview. Turk. J. Orthod., 2018, no. 31 (1), pp. 21–25.
- Stewart P.S., Costerton J.W. Antibiotic resistance of bacteria in biofilms Lancet, 2001, no. 358, pp. 135–138.
- Sukontapatipark W., Agroudi M. A., Selliseth N.J. Bacterial colonization associated with fixed orthodontic appliances: a scanning electron microscopy study. Eur. J. Orthod., 2001, vol. 23, no. 5, pp. 475–484.
- Socransky, S.
 S., Haffajee A.D. Periodontal microbial ecology. Periodontology. 2000, 2005, vol. 38, pp. 135–187.
S., Haffajee A.D. Periodontal microbial ecology. Periodontology. 2000, 2005, vol. 38, pp. 135–187. - Suchett-Kaye, G., Jacques Morrier J., Barsotti O. Clinical usefulness of microbiological diagnosis tools in the management of periodontal disease. Research in Microbiology, 2001, vol. 152, pp. 631–639.
- Tets V.V., Tets G.V., Vikina D.S. [et al.] Unknown pathogens from the human oral microflora of interest for otorhinolaryngology. Vestn. Otorinolaringol., 2014, vol. 1, pp. 33–36.
- Van Winkelhoff, A.J. Loos B.G., Van der Reijden W.A. Porphyromonas gingivalis, Bacteroides forsythus and other putative periodontal pathogens in subjects with and without periodontal destruction. J. Clin. Periodontol., 2002, vol. 29, pp. 1023–1028.
- Vandesompele, J., De Preter K., Pattyn F., Poppe B., van Roy N., De Paepe A., Speleman F. Accurate normalization of real time quantitative RT-PCR data by geometric averaging of multiple internal control genes. Genome Biol., 2002, vol. 3, pp.
 88–110.
88–110.
Адрес для корреспонденции: Е-mail: [email protected]
Пародонтальный карман: патогенез, гистопатология и последствия
Обзор
. 2018 февраль;76(1):43-50.
doi: 10.1111/prd.12153. Epub 2017 30 ноября.
Дитер Д. Босхардт
- PMID: 29194796
- DOI: 10.1111/прд.12153
Обзор
Дитер Д. Босхардт. Пародонтол 2000. 2018 Февраль
. 2018 февраль;76(1):43-50.
doi: 10.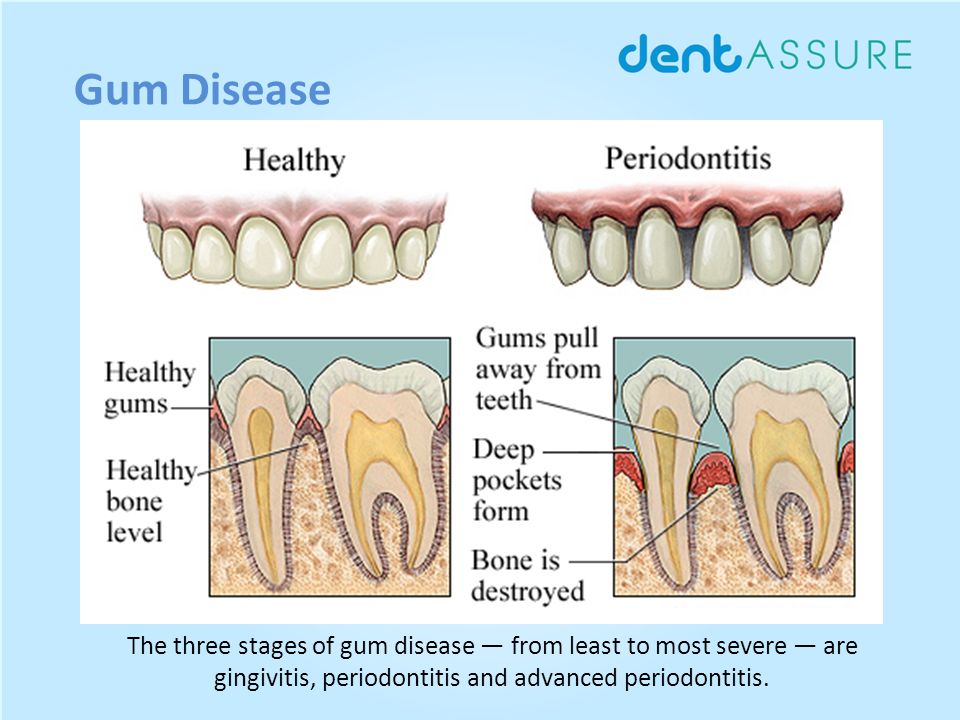 1111/prd.12153.
Epub 2017 30 ноября.
1111/prd.12153.
Epub 2017 30 ноября.
Автор
Дитер Д. Босхардт
- PMID: 29194796
- DOI: 10.1111/прд.12153
Абстрактный
Превращение соединительного эпителия в эпителий кармана считается отличительной чертой развития пародонтита. Знание факторов, способствующих инициированию и прогрессированию образования карманов, важно и может привести к разработке более эффективных профилактических мер и улучшению результатов заживления после терапевтических вмешательств. Пародонтальный карман представляет собой патологически углубленную десневую борозду. В здоровых условиях пародонта защитных механизмов обычно достаточно для контроля постоянной микробиологической нагрузки через нормально функционирующий соединительный эпителий и концентрированную мощную массу воспалительных и иммунных клеток и макромолекул, мигрирующих через этот эпителий. Напротив, нарушение структурной целостности соединительного эпителия, включающее нарушение межклеточных контактов и отслоение от поверхности зуба, приводящее к образованию карманов, выводит из равновесия эту деликатную защитную систему. Углубление кармана апикально, а также горизонтальное расширение биопленки на корне зуба подвергают эту систему изнурительному испытанию. Больше нет этой мощной концентрации защитных клеток и макромолекул, которые выделяются на дне борозды и обращены к относительно небольшой поверхности биопленки в десневой борозде. В ситуации кармана защитные клетки и макромолекулы выводятся непосредственно в пародонтальный карман, и большинство эпителиальных клеток обращены непосредственно к биопленке. Истончение эпителия и его изъязвление повышают вероятность инвазии микроорганизмов и их продуктов в мягкую соединительную ткань, что усугубляет ситуацию. В зависимости от тяжести и продолжительности заболевания в карманной среде может сложиться порочный круг, разорвать который без терапевтического вмешательства сложно или невозможно.
Напротив, нарушение структурной целостности соединительного эпителия, включающее нарушение межклеточных контактов и отслоение от поверхности зуба, приводящее к образованию карманов, выводит из равновесия эту деликатную защитную систему. Углубление кармана апикально, а также горизонтальное расширение биопленки на корне зуба подвергают эту систему изнурительному испытанию. Больше нет этой мощной концентрации защитных клеток и макромолекул, которые выделяются на дне борозды и обращены к относительно небольшой поверхности биопленки в десневой борозде. В ситуации кармана защитные клетки и макромолекулы выводятся непосредственно в пародонтальный карман, и большинство эпителиальных клеток обращены непосредственно к биопленке. Истончение эпителия и его изъязвление повышают вероятность инвазии микроорганизмов и их продуктов в мягкую соединительную ткань, что усугубляет ситуацию. В зависимости от тяжести и продолжительности заболевания в карманной среде может сложиться порочный круг, разорвать который без терапевтического вмешательства сложно или невозможно.
© 2017 John Wiley & Sons A/S. Опубликовано John Wiley & Sons Ltd.
Похожие статьи
-
Иммуногистохимическая экспрессия синдекана-1 в тканях десен у больных хроническим пародонтитом коррелирует с различными предполагаемыми факторами.
Коцовилис С., Целени-Балафута С., Харонис А., Фурмусис И., Николидакис Д., Вроцос Я.А. Коцовилис С. и соавт. J Периодонтальная Рез. 2010 авг; 45 (4): 520-31. doi: 10.1111/j.1600-0765.2009.01267.х. Epub 2010 19 апр. J Периодонтальная Рез. 2010. PMID: 20412418
-
Механизм образования карманов. Световое микроскопическое исследование некальцинированного человеческого материала.
Таката Т., Донат К. Таката Т. и др. J Пародонтол. 1988 г., апрель; 59 (4): 215–21.
 doi: 10.1902/jop.1988.59.4.215.
J Пародонтол. 1988 год.
PMID: 3164372
doi: 10.1902/jop.1988.59.4.215.
J Пародонтол. 1988 год.
PMID: 3164372 -
Бактериальная пенетрация мягких тканей кармана при хроническом взрослом и ювенильном пародонтите. Ультраструктурное исследование.
Лиакони Х., Барбер П., Ньюман Х.Н. Лиакони Х. и др. Дж. Клин Пародонтол. 1987 Январь; 14 (1): 22-8. doi: 10.1111/j.1600-051x.1987.tb01508.x. Дж. Клин Пародонтол. 1987. PMID: 3468125
-
Соединительный эпителий: от здоровья к болезни.
Босхардт Д.Д., Ланг Н.П. Босхардт Д.Д. и соавт. Джей Дент Рез. 2005 г., январь; 84 (1): 9–20. дои: 10.1177/154405910508400102. Джей Дент Рез. 2005. PMID: 15615869 Рассмотрение.
-
Нейтрофилы организуют пародонтальный карман.
Витков Л., Муньос Л.Е., Шон Дж., Кнопф Дж., Шауэр С., Минних Б., Херрманн М., Ханниг М. Витков Л. и соавт. Фронт Иммунол. 2021 24 ноя; 12:788766. дои: 10.3389/fimmu.2021.788766. Электронная коллекция 2021. Фронт Иммунол. 2021. PMID: 34899756 Бесплатная статья ЧВК. Рассмотрение.
Посмотреть все похожие статьи
Цитируется
-
Последствия гепатита B и D для полости рта и пародонта. Современное состояние знаний и перспективы на будущее.
Георге Д.Н., Беннардо Ф., Попеску Д.М., Николае Ф.М., Ионеле К.М., Болдяну М.В., Камен А., Роговяну И., Сурлин П. Георге Д.Н. и соавт. J Pers Med. 2022 сен 26;12(10):1580. дои: 10.3390/jpm12101580. J Pers Med. 2022. PMID: 36294719 Бесплатная статья ЧВК. Рассмотрение.
-
Доказательное исследование, предполагающее потенциальную противовоспалительную активность бутирата и пропионата в клетках пародонта.

Сантос AFP, Cervantes LCC, Panahipour L, Souza FÁ, Gruber R. Сантос АФП и др. Int J Mol Sci. 2022 сен 20;23(19):11006. дои: 10.3390/ijms231911006. Int J Mol Sci. 2022. PMID: 36232340 Бесплатная статья ЧВК.
-
Роль инфламмасомы NLPR3 в развитии и терапии пародонтита.
Чжао Ю, Цюань Ю, Лэй Т, Фань Л, Гэ Х, Ху С. Чжао Ю и др. Int J Med Sci. 2022 21 сентября; 19 (10): 1603-1614. doi: 10.7150/ijms.74575. Электронная коллекция 2022. Int J Med Sci. 2022. PMID: 36185327 Бесплатная статья ЧВК. Рассмотрение.
-
Измененный состав ротового микробиома у мышей с дефицитом интегрина бета 6.
Уэхара О., Би Дж., Чжуан Д., Койвисто Л., Абико Ю., Хаккинен Л., Ларджава Х. Уэхара О и др.
 J Оральный микробиол. 2022 12 сентября; 14 (1): 2122283. дои: 10.1080/20002297.2022.2122283. Электронная коллекция 2022.
J Оральный микробиол. 2022.
PMID: 36117552
Бесплатная статья ЧВК.
J Оральный микробиол. 2022 12 сентября; 14 (1): 2122283. дои: 10.1080/20002297.2022.2122283. Электронная коллекция 2022.
J Оральный микробиол. 2022.
PMID: 36117552
Бесплатная статья ЧВК. -
Сохранение грануляционной ткани пародонта при хирургическом лечении заболеваний пародонта: пилотное проспективное когортное исследование.
Морено Родригес JA, Ортис Руис AJ. Морено Родригес Дж. А. и соавт. J Пародонтальные имплантаты Sci. 2022 авг; 52 (4): 298-311. doi: 10.5051/jpis.2105780289. J Пародонтальные имплантаты Sci. 2022. PMID: 36047583 Бесплатная статья ЧВК.
Просмотреть все статьи «Цитируется по»
Типы публикаций
термины MeSH
Уменьшение глубины кармана при пародонтальной хирургии в Keene, NH
Уменьшение глубины кармана для пародонтальной хирургии
Главная » Уменьшение глубины кармана для пародонтальной хирургии
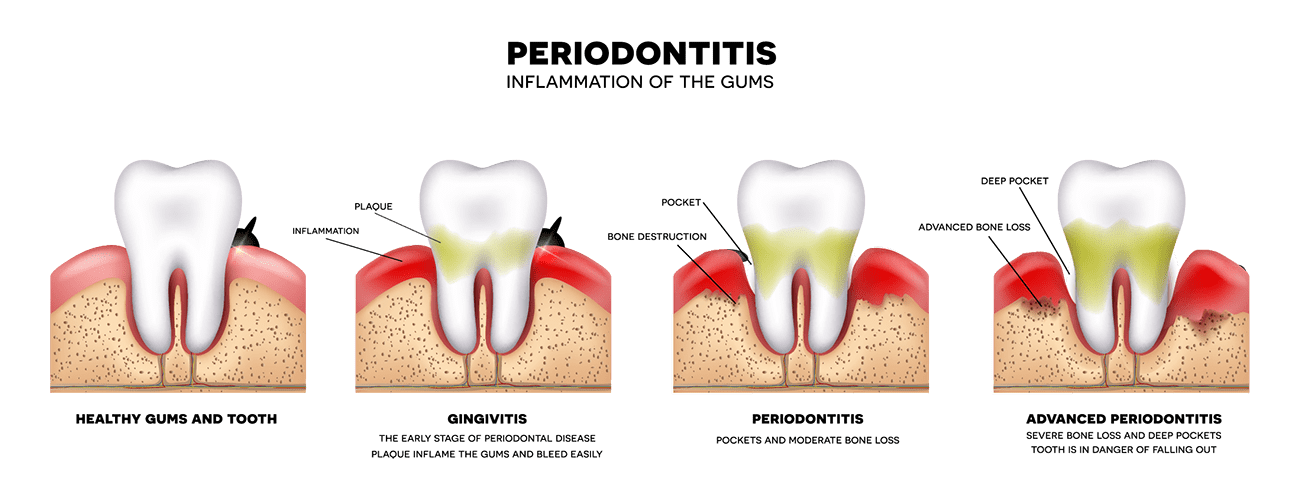
Болезнь десен развивается поэтапно, начиная с более легкой формы, называемой гингивитом, которая может иметь лишь незначительные симптомы, такие как кровоточивость при чистке зубов или опухшие, красные десны. Однако, если его не лечить, гингивит перерастет в более тяжелую форму заболевания пародонта, что в конечном итоге может привести к серьезным проблемам со здоровьем полости рта, таким как потеря ткани десны (опущение десны), потеря костной массы и потеря зубов. Команда стоматологов Monadnock Perio & Implant Center в Keene, NH , специализируется на оказании помощи пациентам в лечении заболеваний десен с помощью индивидуального плана лечения. Наши врачи могут порекомендовать вам операцию по уменьшению глубины кармана .
Однако, если его не лечить, гингивит перерастет в более тяжелую форму заболевания пародонта, что в конечном итоге может привести к серьезным проблемам со здоровьем полости рта, таким как потеря ткани десны (опущение десны), потеря костной массы и потеря зубов. Команда стоматологов Monadnock Perio & Implant Center в Keene, NH , специализируется на оказании помощи пациентам в лечении заболеваний десен с помощью индивидуального плана лечения. Наши врачи могут порекомендовать вам операцию по уменьшению глубины кармана .
Что такое пародонтальные карманы?
Пародонтальные карманы — это пространства, которые образуются между деснами и зубами по мере прогрессирования заболевания пародонта. Заболевание десен начинается из-за чрезмерного роста бактерий и зубного налета на линии десен, что вызывает раздражение и воспаление десен и заставляет их отрываться от зубов. Предположим, что налет и зубной камень не удалены с зубов. Затем они начинают проникать в эти карманы, что способствует прогрессированию заболевания, поскольку обычная чистка зубной щеткой и зубная нить не могут удалить эти болезнетворные вещества из карманов десен.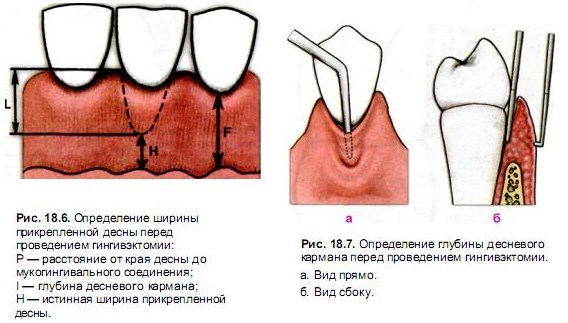 В результате крайне важно работать с опытным стоматологом, который может очистить и продезинфицировать карманы и помочь им восстановить здоровое уплотнение с зубами.
В результате крайне важно работать с опытным стоматологом, который может очистить и продезинфицировать карманы и помочь им восстановить здоровое уплотнение с зубами.
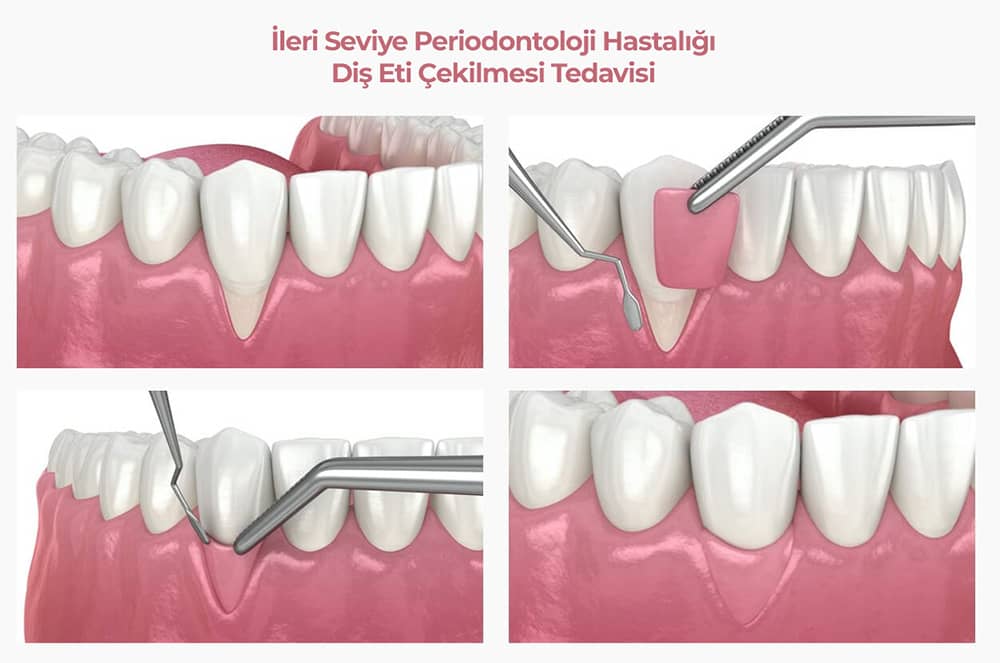
Пародонтальный карман Хирургия уменьшения глубины
Операция по уменьшению глубины пародонтальных карманов — это лечение пародонтальных карманов, предназначенное для устранения бактерий и уменьшения глубины карманов с общей целью минимизировать последствия заболевания и остановить его прогрессирование.
- Сначала мы обезболим область лечения, чтобы вы чувствовали себя комфортно и не чувствовали боли на протяжении всего лечения.
- Затем стоматолог делает небольшой надрез в ткани десны и загибает ее назад, чтобы обнажить корень зуба и кость.
- Область тщательно очищается и дезинфицируется, и, при необходимости, корень зуба и кость будут сглажены («строганы»), чтобы способствовать здоровому повторному прикреплению и ограничить площадь поверхности для размножения бактерий.