МОЛЕКУЛЯРНЫЕ ОСНОВЫ СОВРЕМЕННОЙ ТАРГЕТНОЙ ТЕРАПИИ ПЛОСКОКЛЕТОЧНОГО РАКА ЯЗЫКА И СЛИЗИСТОЙ ДНА ПОЛОСТИ РТА МОНОКЛОНАЛЬНЫМИ АНТИТЕЛАМИ | Льянова
1. Гельфанд И.М., Романов И.С., Минкин А.У. Тактика лечения плоскоклеточного рака полости рта стадий сT1-2сN0M0. Опухоли головы и шеи. 2014. №2. С. 33–36. [Gelfand I.M., Romanov I.S., Minkin A.U., Treatment policy for stages cT1-2cN0M10 oral squamous carcinoma, Opukholi golovy i shei, 2014, No. 2, pp. 33–36 (In Russ.)].
2. GBD 2013 Mortality Causes of Death Collaborators. Global, regional, and national age – sex specific all-cause and cause-specific mortality for 240 causes of death, 1990-2013: a systematic analysis for the Global Burden of Disease Study 2013, The Lancet, 2015, Vol. 385 (9963), pp. 117–171.
3. Каприн А.Д., Старинский В.В., Петрова Г.В. Состояние онкологической помощи населению России в 2015 году. М.: МНИОИ им. П.А. Герцена, филиал ФГБУ «НМИРЦ» Минздрава России, 2016. 236 с. [Kaprin A.D., Starinskiy V.V., Petrova G. V. Sostoyanie onkologicheskoy pomoshchi naseleniyu Rossii v 2015 godu, Moscow: MNIOI im. P.A. Gertsena, filial FGBU “NMIRTs” Minzdrava Rossii, 2016, 236 p. (In Russ.)]. А. А. Льянова, Л. Ю. Владимирова, Е. М. Франциянц, Д. С. Кутилин, М. А. Енгибарян Молекулярные основы современной таргетной терапии плоскоклеточного рака языка и слизистой дна полости рта моноклональными антителами
V. Sostoyanie onkologicheskoy pomoshchi naseleniyu Rossii v 2015 godu, Moscow: MNIOI im. P.A. Gertsena, filial FGBU “NMIRTs” Minzdrava Rossii, 2016, 236 p. (In Russ.)]. А. А. Льянова, Л. Ю. Владимирова, Е. М. Франциянц, Д. С. Кутилин, М. А. Енгибарян Молекулярные основы современной таргетной терапии плоскоклеточного рака языка и слизистой дна полости рта моноклональными антителами
4. Архипова О. Е., Черногубова Е.А., Лихтанская Н.В., Тарасов В.А., Кит О.И., Еремеева А.А., Матишов Д. Г. Анализ встречаемости онкологических заболеваний в Ростовской области. Пространственно-временная статистика. Наука Юга России. 2013. Т. 9. №3. С. 7–14. [Arkhipova O. E., Chernogubova E.A., Likhtanskaya N.V., Tarasov V.A., Kit O. I., Eremeeva A.A., Matishov D.G. Analiz vstrechaemosti onkologicheskikh zabolevaniy v Rostovskoy oblasti. Prostranstvenno-vremennaya statistika, Nauka Yuga Rossii, 2013, Vol. 9, No. 3, pp. 7–14 (In Russ.)].
5. Жуков Н.В., Тюляндин С.А. Целевая терапия в лечении солидных опухолей: практика противоречит теории. Биохимия. 2008. №. 73. С. 751–768. [Zhukov N.V., Tyulyandin S.A. Tselevaya terapiya v lechenii solidnykh opukholey: praktika protivorechit teorii, Biokhimiya, 2008, No. 73. pp. 751–768 (In Russ.)].
Биохимия. 2008. №. 73. С. 751–768. [Zhukov N.V., Tyulyandin S.A. Tselevaya terapiya v lechenii solidnykh opukholey: praktika protivorechit teorii, Biokhimiya, 2008, No. 73. pp. 751–768 (In Russ.)].
6. Бесова Н.С. Таргетные препараты: рациональный выбор первой линии лекарственной терапии диссеминированного колоректального рака. Совр. онкология. 2010. №12. С. 43–51. [Besova N.S. Targetnye preparaty: ratsional’nyy vybor pervoy linii lekarstvennoy terapii disseminirovannogo kolorektal’nogo raka, Sovr. Onkologiya, 2010, No. 12. pp. 43–51 (In Russ.)].
7. Blaszczak W., Barczak W., Wegner A., Golusinski W., Suchorska W.M. Clinical value of monoclonal antibodies and tyrosine kinase inhibitors in the treatment of head and neck squamous cell carcinoma, Med. Oncol., 2017, Vol. 34 (4), p. 60.
8. Северин Е.С., Саватеева М.В. Молекулярно-физиологические механизмы функционирования мембранных рецепторных систем. Acta Naturae. 2011. Т. 3. №1 (8). С. 20–29. [Severin E.S., Savvateeva M.V. Molecular and Physiological Mechanisms of Membrane Receptor Systems Functioning, Acta Naturae, 2011. Vol. 3, No. 1 (8), pp. 20–29].
Molecular and Physiological Mechanisms of Membrane Receptor Systems Functioning, Acta Naturae, 2011. Vol. 3, No. 1 (8), pp. 20–29].
9. Поляновский О.Л., Лебеденко Е.Н., Деев С.М. ERBB онкогены – мишени моноклональных антител. Биохимия. 2012. №77 (3). С. 289–311. [Polyanovskiy O. L., Lebedenko E.N., Deev S.M. ERBB onkogeny – misheni monoklonal’nykh antitel, Biokhimiya, 2012, No. 77 (3), pp. 289–311 (In Russ.)].
10. Masunaga H., Sugimoto Y., Magi S., Itasaki R., Okada-Hatakeyama M., Kurata H. Robustness analysis of the detailed kinetic model of an ErbB signaling network by using dynamic sensitivity, PLoS One, 2017, Vol. 12 (5), e0178250.
11. Wilson K. J., Gilmore J. L., Foley J., Lemmon M.A., Riese D. J., 2nd Pharmacol. Ther., 2009, Vol. 122, pp. 1–8.
12. Lemmon M.A. Ligand-induced ErbB receptor dimerization, Exp. Cell Res., 2009, Vol. 315, pp. 638-648.
13. Citri A., Gan J., Mosseson J. et al. Hsp90 restrains ErbB-2/HER2 signalling by limiting heterodimer formation, EMBO Rep. , 2004, Vol. 5, p. 3943.
, 2004, Vol. 5, p. 3943.
14. Ochoa D., Jonikas M., Lawrence R. T. et al. An atlas of human kinase regulation, Mol. Syst. Biol., 2016, Vol. 12 (12), p. 888.
15. Ohnishi Y., Yasui H., Kakudo K., Nozaki M. Regulation of cell migration via the EGFR signaling pathway in oral squamous cell carcinoma cells, Oncology Letters, 2017, Vol. 13 (2), pp. 930–936.
16. Kaushansky A., Gordus A., Budnik B.A., Lane W.S., Rush J., MacBeath G. System-wide investigation of ErbB4 reveals 19 sites of Tyr phosphorylation that are unusually selective in their recruitment properties, Chem. Biol., 2008, Vol. 15, pp. 808–817.
17. Berger M.B., Mendrola J.M., Lemmon M.A. ErbB3/HER3 does not homodimerize upon neuregulin binding at the cell surface, FEBS Lett., 2004, Vol. 569, pp. 332-336.
18. Austin C.D., De Maziere A.M., Pisacane P. I. et al. Endocytosis and sorting of ErbB2 and the site of action of cancer therapeutics trastuzumab and geldanamycin, Mol. Biol. Cell., 2004, Vol. 15, pp. 5268–5282.
19. Красильников М.А. Сигнальные пути, регулируемые фосфатидилинозит-3-киназой и их значение для роста, выживаемости и злокачественной трансформации клеток // Биохимия. 2000. Т. 65 (1), С. 68–78. [Krasilnikov M.A. Signalnye puti, reguliruemye fosfatidilinozit-3-kinazoy i ikh znachenie dlya rosta, vyzhivaemosti i zlokachestvennoy transformatsii kletok, Biokhimiya, 2000, Vol. 65 (1), pp. 68–78 (In Russ.)].
20. Wang Y., Kristensen G.B., Helland A. et al. Protein expression and prognostic value of genes in the erb-b signaling pathway in advanced ovarian carcinomas, J. Clin. Pathol., 2005, Vol. 124, pp. 392–401.
21. Subramaniam S., Unsicker K. Extracellular signal-regulated kinase as an inducer of non-apoptotic neuronal death, Neuroscience, 2006, Vol. 138, pp. 1055–1065
22. Hsu S.C., Hung M.C. Characterization of a novel tripartite nuclear localization sequence in the EGFR family, J. Biol. Chem., 2007, Vol. 282, pp. 10432–10440.
23. Zhang Z., Stiegler A. L., Boggon T. J., Kobayashi S., Halmos B. EGFR-mutated lung cancer: a paradigm of molecular oncology, Oncotarget, 2010, Vol. 1, pp. 497–514.
J., Kobayashi S., Halmos B. EGFR-mutated lung cancer: a paradigm of molecular oncology, Oncotarget, 2010, Vol. 1, pp. 497–514.
24. Sharma S.V., Bell D.W., Settleman J., Haber D.A. Epidermal growth factor receptor mutations in lung cancer, Nat.Rev. Cancer, 2007, Vol. 8, pp. 169–181
25. Wang X., Schneider A. HIF-2-mediated activation of the epidermal growth factor receptor potentiates head and neck cancer cell migration in response to hypoxia, Carcinogenesis, 2010, Vol. 31, pp. 1202–1210.
26. Krajewski K.M., Braschi-Amirfarzan M., DiPiro P. J., Jagannathan J.P., Shinagare A.B. Molecular Targeted Therapy in Modern Oncology: Imaging Assessment of Treatment Response and Toxicities, Korean J. Radiol., 2017, Vol. 18 (1), pp. 28–41.
27. Тырсина Е. Г., Никулицкий С.И. Роль регуляторной VEGF/VEGF-R1-системы в опухолевом ангиогенезе (обзор литературы) Онкогинекология. 2015. №4. C. 4–12. [Tyrsina E.G., Nikulitskiy S. I. Rol’ regulyatornoy VEGF/VEGF-R1-sistemy v opukholevom angiogeneze (obzor literatury), Onkoginekologiya, 2015, No. 4, pp. 4–12 (In Russ.)].
4, pp. 4–12 (In Russ.)].
28. Wey J.S., Fan F., Gray M. J. et al. Vascular endothelial growth factor receptor-1 promotes migration and invasion in pancreatic carcinoma cell lines, Cancer, 2005, Vol. 104, pp. 427–438.
29. Ferrara N., Gerber H.P., LeCouter J. The biology of VEGF and its receptors, Nature Med., 2003, Vol. 9 (6), pp. 669–676
30. Miletic H., Niclou S.P., Johansson M., Bjerkvig R. Anti-VEGF therapies for malignant glioma: treatment effects and escape mechanisms, Expert Opin., 2009, Vol. 13 (4), pp. 455–468.
31. Кит О.И., Франциянц Е.М., Никипелова Е.А., Комарова Е.Ф., Козлова Л.С., Таварян И.С., Аверкин М.А., Черярина Н.Д. Изменения маркеров пролиферации, неоангиогенеза и системы активации плазминогена в ткани рака прямой кишки. Экспериментальная и клиническая гатсроэнтерология. 2015. №. 2. С. 40–45. [Kit O.I., Frantsiyants E.M., Nikipelova E.A., Komarova E.F., Kozlova L.S., Tavaryan I.S., Averkin M.A., Cheryarina N.D. Izmeneniya markerov proliferatsii, neoangiogeneza i sistemy aktivatsii plazminogena v tkani raka pryamoy kishki, Eksperimental’naya i klinicheskaya gatsroenterologiya, 2015, No. 2, pp. 40–45 (In Russ.)].
2, pp. 40–45 (In Russ.)].
32. Rak J., Yu J. L., Klement G. et al. Oncogenes and angiogenesis: signaling three-dimensional tumor growth, J. Invest. Dermatol. Symp. Proc., 2000, Vol. 5 (1), pp. 24–33.
33. Чехонин В.П., Шеин С.А., Корчагина А.А., Гурина О.И. Роль VEGF в развитии неопластического ангиогенеза. Вестник РАМН, 2012. №2. С. 23–34. [Chekhonin V.P., Shein S.A., Korchagina A.A., Gurina O. I. Rol’ VEGF v razvitii neoplasticheskogo angiogenezam Vestnik RAMN, 2012, No. 2. pp. 23–34 (In Russ.)].
34. Шушанов C.C., Кравцова Т.А., Черных Ю.Б. Влияние инсулиноподобного фактора роста 1 типа (IGF-1) на выживаемость клеток множественной миеломы человек. Российский биотерапевтический журнал. 2013. Т. 12. №3. С. 29–38. [Shushanov C.C., Kravtsova T.A., Chernykh Yu.B. Vliyanie insulinopodobnogo faktora rosta 1 tipa (IGF-1) na vyzhivaemost’ kletok mnozhestvennoy mielomy chelovek, Rossiyskiy bioterapevticheskiy zhurnal, 2013, Vol. 12, No. 3, pp. 29–38 (In Russ.)].
35. Brahmkhatri V. P., Prasanna C., Atreya H.S. Insulin-Like Growth Factor System in Cancer: Novel Targeted Therapies, BioMed Research International, 2015, Vol. 2015, p. 538019.
P., Prasanna C., Atreya H.S. Insulin-Like Growth Factor System in Cancer: Novel Targeted Therapies, BioMed Research International, 2015, Vol. 2015, p. 538019.
36. Liu J., Brown R. E. Immunohistochemical expressions of fatty acid synthase and phosphorylated c-Met in thyroid carcinomas of follicular origin, Int. J. Clin. Exp. Pathol., 2011, Vol. 4 (8), pp. 755–764.
37. Gual P., Giordano S., Anguissola S., Parker P. J., Comoglio P.M. Gab1 phosphorylation: a novel mechanism for negative regulation of HGF receptor signaling, Oncogene, 2001, Vol. 20 (2), pp. 156–166.
38. Sierra J.R., Tsao M.S. c-MET as a potential therapeutic target and biomarker in cancer, Ther.Adv. Med. Oncol., 2011, Vol. 3, pp. S21 – S35.
39. Knowles L.M., Stabile L.P., Egloff A.M. et al. HGF and c-Met participate in paracrine tumorigenic pathways in head and neck squamous cell cancer, Clin. Cancer Res., 2009, Vol. 15, pp. 3740–3750.
40. Seiwert T.Y., Jagadeeswaran R., Faoro L. et al. The met receptor tyrosine kinase is a potential novel therapeutic target for head and neck squamous cell carcinoma, Cancer Res. , 2009, Vol. 69, pp. 3021–3031.
, 2009, Vol. 69, pp. 3021–3031.
41. Деев С.М., Лебеденко Е.Н. Современные технологии создания неприродных антител для клинического применения. Acta Naturae. 2009. №1, pp. 32–50. [Deev S.M., Lebedenko E.N. Sovremennye tekhnologii sozdaniya neprirodnykh antitel dlya klinicheskogo primeneniya, Acta Naturae, 2009, No. 1, pp. 32–50 (In Russ.)] .
42. Martinelli E., De Palma R., Orditura M., De Vita F., Ciardiello F. Clin. Exp. Immunol., 2009, Vol. 158, pp. 1–9.
43. Socinski M.A. Antibodies to the Epidermal Growth Factor Receptor in Non – Small Cell Lung Cancer: Current Status of Matuzumab and Panitumumab, Clin. Cancer Res., 2007, Vol. 13, pp. 4597–4601.
44. Xu S, Ramos-Suzarte M, Bai X, Xu B. Treatment outcome of nimotuzumab plus chemotherapy in advanced cancer patients: a single institute experience, Oncotarget, 2016, Vol. 7 (22), pp. 33391–33407.
45. Argyriou A.A., Kalofonos H.P. Recent advances relating to the clinical application of naked monoclonal antibodies in solid tumors, Mol. Med., 2009, Vol. 15, pp. 183–191.
Med., 2009, Vol. 15, pp. 183–191.
46. Wehrman T.S., Raab W. J., Casipit C. L., Doyonnas R., Pomerantz J.H., Blau H.M. Proc. Natl. Acad.Sci. USA, 2006, Vol. 103, pp. 19063–19068.
47. Nahta R., Esteva F. J. Herceptin: mechanisms of action and resistance, Cancer Lett., 2006, Vol. 232, pp. 123–138.
48. Hopper-Borge E.A., Nasto R. E., Ratushny V., Weiner L.M., Golemis E.A., Astsaturov I. Expert Opin. Ther. Targets, 2009, Vol. 13, pp. 339–362.
49. de Jong R.N., Beurskens F. J., Verploegen S., Strumane K., van Kampen M.D., Voorhorst M., Horstman W., Engelberts P. J., Oostindie S.C., Wang G., Heck A. J., Schuurman J., Parren P.W. A Novel Platform for the Potentiation of Therapeutic Antibodies Based on Antigen-Dependent Formation of IgG Hexamers at the Cell Surface, PLoS Biol., 2016, Vol. 14 (1), e1002344.
50. Орлов С.В., Фогт С.Н., Шустова М.С. Успешная регистрация отечественного биоаналога бевацизумаба – новые возможности эффективной терапии больных неплоскоклеточным немелколеточным раком легкого. Исследования и практика в медицине. 2015. №2 (4), С. 132–136. [Orlov S.V., Fogt S.N., Shustova M.S. Successful registration of domestic bioanalogue of bevacizumab – new opportunities for effective treatment of patients with non-squamous cell non-small cell lung cancer, Research’n Practical Medicine Journal, 2015, No. 2 (4), pp. 132–136 (In Russ.)].
Исследования и практика в медицине. 2015. №2 (4), С. 132–136. [Orlov S.V., Fogt S.N., Shustova M.S. Successful registration of domestic bioanalogue of bevacizumab – new opportunities for effective treatment of patients with non-squamous cell non-small cell lung cancer, Research’n Practical Medicine Journal, 2015, No. 2 (4), pp. 132–136 (In Russ.)].
51. Norden A.D., Drappatz J., Wen P.Y. Antiangiogenic therapies for high-grade glioma, Nature Rev. Neurol., 2009, Vol. 5 (11), pp. 610–620.
52. Lee C.G., Heijn M., di Tomaso E. et al. Anti-Vascular endothelial growth factor treatment augments tumor radiation response under normoxic or hypoxic conditions, Cancer Res., 2000, Vol. 60 (19), pp. 5565–5570.
53. Gomez-Manzano C., Holash J., Fueyo J. et al. VEGF Trap induces antiglioma effect at different stages of disease, Neuro Oncol., 2008, Vol. 10 (6), pp. 940–945.
54. Chung C.H., Pohlmann P.R., Rothenberg M. L. et al. Insulin-like growth factor-1 receptor inhibitor, AMG-479, in cetuximab-refractory head and neck squamous cell carcinoma, Head Neck, 2011, Vol. 33, pp. 1804–1808.
33, pp. 1804–1808.
55. van der Horst E.H., Chinn L., Wang M., Velilla T., Tran H., Madrona Y., Lam A., Ji M., Hoey T.C., Sato A.K. Discovery of Fully Human Anti-MET Monoclonal Antibodies with Antitumor Activity against Colon Cancer Tumor Models In Vivo, Neoplasia, 2009, Vol. 11, pp. 355–364.
56. Cao B., Su Y., Oskarsson M., Zhao P., Kort E. J., Fisher R. J., Wang L.M., Vande Woude G. F. Neutralizing monoclonal antibodies to hepatocyte growth factor/scatter factor (HGF/SF) display antitumor activity in animal models, Proc. Natl. Acad.Sci. U. S. A., 2001, Vol. 98 (13), pp. 7443–7448.
57. Burgess T., Coxon A., Meyer S., Sun J., Rex K. et al. Fully human monoclonal antibodies to hepatocyte growth factor with therapeutic potential against hepatocyte growth factor/c-Met-dependent human tumors. Cancer Res.. 2006, Vol. 66 (3), pp. 1721–1729.
СОВРЕМЕННЫЕ ПОДХОДЫ К ЛУЧЕВОМУ ЛЕЧЕНИЮ ОПУХОЛЕЙ ПОЛОСТИ РТА | Титова
1. Корытова Л.И., Сокуренко В.П., Масленникова А.В. Современные тенденции в терапии местнораспространенного рака ротоглотки и полости рта.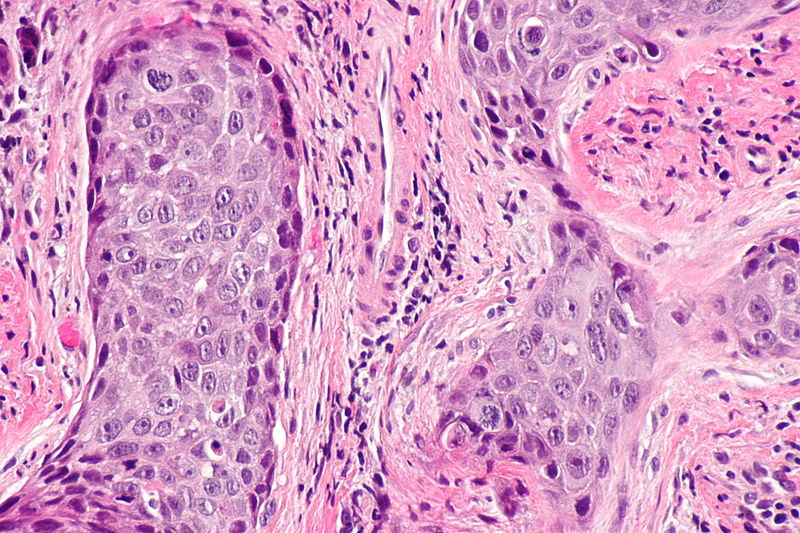 СПб.: Фолиант; 2011, 110 с.
СПб.: Фолиант; 2011, 110 с.
2. Романов И.С., Алиева С.Б. Эволюция применения химиотерапии при плоскоклеточном раке полости рта. Сибирский онкологический журнал. 2010; 3: 77– 78.
3. Чойнзонов Е.Л., Старцева Ж.А., Мухамедов М.Р., Спивакова И.О., Черемисина О.В., Грибова О.В., Кульбакин Д.Е., Суркова П.В. Локальная гипертермия в комбинированном лечении больных раком гортани и гортаноглотки. Сибирский онкологический журнал. 2014; 5: 5–9.
4. Алиева С.Б., Ткачев С.И., Задеренко И.А., Романов И.С. Варианты проведения химиолучевой терапии у больных местнораспространенным плоскоклеточным раком глотки. Опухоли головы и шеи. 2011; № 1: 26–31.
5. Статистика злокачественных новообразований в России и странах СНГ в 2012 г. / Под ред. М.И. Давыдова, Е.М. Аксель. М.: Издательская группа РОНЦ; 2014, 226 с.
6. Worden F.P., Urba S.G., Bradford C. Induction chemotherapy to select for concomitant chemoradiation as organ preservation for patients with advanced squamous carcinoma of the oral cavity/oropharynx.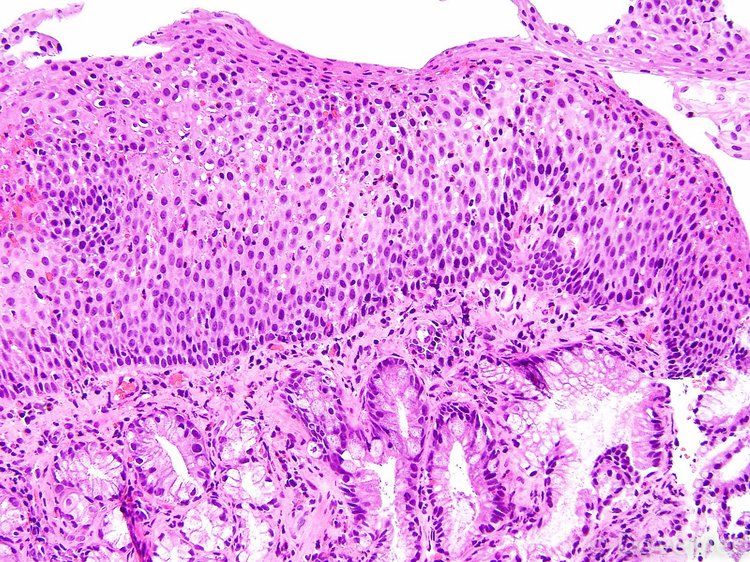 ASCO.2002. P. 952.
ASCO.2002. P. 952.
7. Бржезовский В.Ж., Любаев В.Л., Хасанов Р.А. Выбор тактики лечения при плоскоклеточном раке слизистой оболочки полости рта и ротоглотки. Сибирский онкологический журнал. 2010; 3: 58–59.
8. Жарков О.А., Федотенко С.П., Алиева С.Б. Хирургическое лечение больных раком слизистой оболочки полости рта после ранее проведенной лучевой терапии. Сибирский онкологический журнал. 2010; 3: 63–64.
9. Кропотов М.А., Епихина А.В. Хирургические аспекты лечения рака ротоглотки. Опухоли головы и шеи. 2011; 2: 5–14.
10. Решетов И.В., Кравцов С.А. Микрохирургическая реконструкция языка у онкологических больных. Онкохирургия. 2010. Приложение № 1. С. 178.
11. Titova V.A., Kharchenko N.V., Petrovsky V.Y., Kreynina Ju.M., Dykhno A.Y. Photodynamic therapy and laser interstitial thermotherapy in organ-preserve multimodal treatment of primary and recurrent oral cancer. Intern. J. Brachytherapy. 2008; 7 (2): 158.
12. Цыб А.Ф., Гулидов И.А. Современное состояние лучевой терапии злокачественных новообразований // Терапевтическая радиология: руководство для врачей / Под ред. А.Ф. Цыба, Ю.С. Мардынского. М.: Медицинская книга; 2010, С. 7–12.
А.Ф. Цыба, Ю.С. Мардынского. М.: Медицинская книга; 2010, С. 7–12.
13. Bonner J.A., Harari P.M., Giralt J., Azarnia N., Shin D.M., Cohen R.B., Jones C.U., Sur R., Raben D., Jassem J., Ove R., Kies M.S., Baselga J., Youssoufian H., Amellal N., Rowinsky E.K., Ang K.K. Radiotherapy plus cetuximab for squamous-sell carcinoma of the head and neck. N Engl J Med. 2006 Feb 9; 354 (6): 567–78.
14. Chen W.C., Hwang T.Z., Wang W.H., Lu C.H., Chen C.C., Chen C.M., Weng H.H., Lai C.H., Chen M.F. Comparison between conventional and intensity-modulated post-operative radiotherapy for stage III and IV oral cavity cancer in terms of treatment results and toxicity. Oral Oncol. 2009 Jun; 45 (6): 505–10. doi: 10.1016/j.oraloncology.2008.07.002.
15. Hitt R., Martin P., Hidalgo M. Cetuximab in squamous carcinoma of head and neck. Future Oncol. 2006. Vol. 2, № 4: 449–457.
16. Johnson K. Brachytherapy Boost an Opinion for Base of Tongue Cancer. www/medscapemedical news/com.-2013/803037.
17. Lindholm P., Valavaara R., Aitasalo K., Kulmala J., Laine J., Elomaa L., Sillanmäki L., Minn H., Grénman R. Preoperative hyperfractionated accelerated radiotherapy and radical surgery in advanced head and neck cancer: a prospective phase II study. Radiother Oncol. 2006 Feb; 78 (2): 146–51.
18. Setton J., Caria N., Romanyshyn J., Koutcher L., Wolden S.L., Zelefsky M.J., Rowan N., Sherman E.J., Fury M.G., Pfister D.G., Wong R.J., Shah J.P., Kraus D.H., Shi W., Zhang Z., Schupak K.D., Gelblum D.Y., Rao S.D., Lee N.Y. Intensity-modulated radiotherapy in the treatment of oropharyngeal cancer: an update of the Memorial Sloan-Kettering Cancer Center experience. Int J Radiat Oncol Biol Phys. 2012 Jan 1; 82 (1): 291–8. doi: 10.1016/j.ijrobp.2010.10.041.
19. Бойко А.В., Болотина Л.В., Черниченко А.В., Геворков А.Р., Смирнов А.К. Первый опыт лучевой терапии рака орофарингеальной зоны с радиомодификацией цетуксимабом и цисплатином. Современная онкология. 2010; 2: 26–31.
20. Геворков А.Р., Бойко А.В., Черниченко А.В. Таргетная модификация в лучевом лечении плоскоклеточного рака орофарингеальной зоны. Вестник РНЦРР. 2012. № 2 (3). С. 171.
Геворков А.Р., Бойко А.В., Черниченко А.В. Таргетная модификация в лучевом лечении плоскоклеточного рака орофарингеальной зоны. Вестник РНЦРР. 2012. № 2 (3). С. 171.
21. van den Bent M.J., Brandes A.A., Rampling R., Kouwenhoven M.C., Kros J.M., Carpentier A.F., Clement P.M., Frenay M., Campone M., Baurain J.F., Armand J.P., Taphoorn M.J., Tosoni A., Kletzl H., Klughammer B., Lacombe D., Gorlia T. Randomized phase II trial of erlotinib versus temozolomide or carmustine in recurrent glioblastoma: EORTC brain tumor group study 26034. J Clin Oncol. 2009 Mar 10; 27 (8): 1268–74. doi: 10.1200/JCO.2008.17.5984.
22. Polgár C., Jánváry L., Major T., Somogyi A., Takácsi-Nagy Z., Fröhlich G., Fodor J. The role of high-dose-rate brachytherapy boost in breast-conserving therapy: Long-term results of the Hungarian National Institute of Oncology. Rep Pract Oncol Radiother. 2010 Feb 18; 15 (1): 1–7. doi: 10.1016/j.rpor.2010.01.002.
23. Bahassi el M., Li Y.Q., Wise-Draper T.M., Deng L. , Wang J., Darnell C.N., Wilson K.M., Wells S.I., Stambrook P.J., Rixe O. A patientderived somatic mutation in the epidermal growth factor receptor ligandbinding domain confers increased sensitivity to cetuximab in head and neck cancer. Eur J Cancer. 2013 Jul; 49 (10): 2345–55. doi: 10.1016/j.ejca.2013.03.005.
, Wang J., Darnell C.N., Wilson K.M., Wells S.I., Stambrook P.J., Rixe O. A patientderived somatic mutation in the epidermal growth factor receptor ligandbinding domain confers increased sensitivity to cetuximab in head and neck cancer. Eur J Cancer. 2013 Jul; 49 (10): 2345–55. doi: 10.1016/j.ejca.2013.03.005.
24. Lynch T.J., Bell D.W., Sordella R., Gurubhagavatula S., Okimoto R.A., Brannigan B.W., Harris P.L., Haserlat S.M., Supko J.G., Haluska F.G., Louis D.N., Christiani D.C., Settleman J., Haber D.A. Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib. N Engl J Med. 2004 May 20; 350 (21): 2129–39.
25. Soulieres D.S., Senze N.N., Vokes E.E., Hidalgo M., Agarwala S.S., Siu L.L. Multicenter phase II study of erlotinib, an oral epidermal growth factor receptor tyrosine kinase inhibitor, in patients with recurrent or metastatic squamous cell cancer of the head and neck. J Clin Oncol. 2004 Jan 1; 22 (1): 77–85.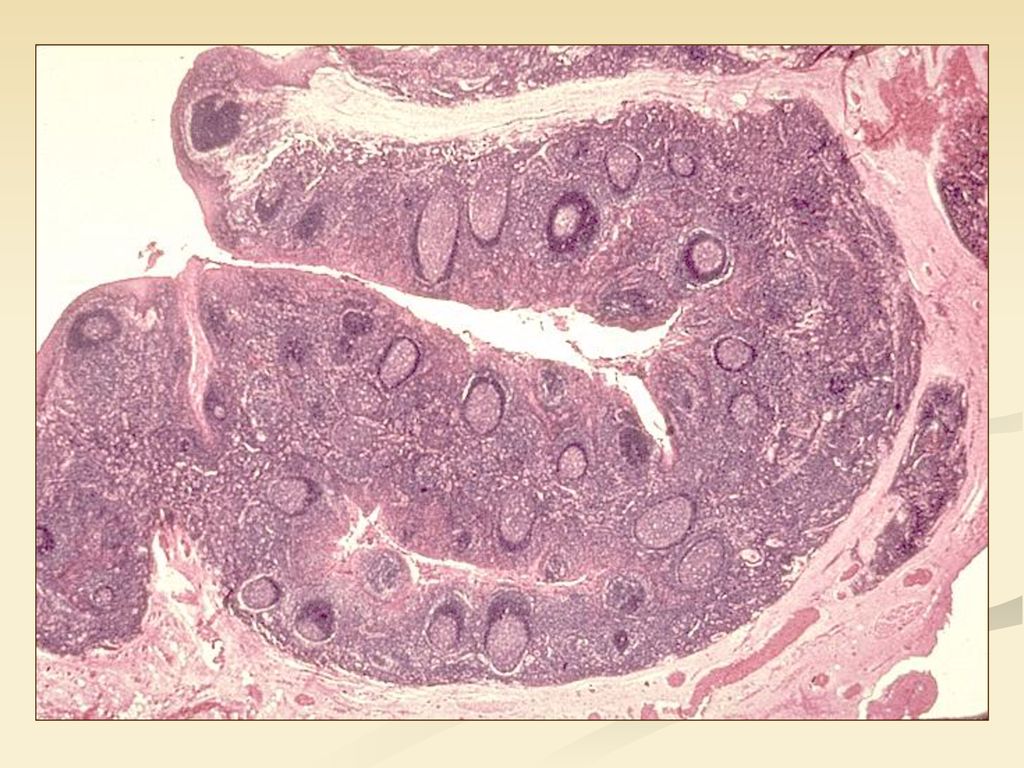
26. Na I.I., Kang H.J., Cho S.Y., Koh J.S., Lee J.K., Lee B.C., Lee G.H., Lee Y.S., Yoo H.J., Ryoo B.Y., Yang S.H., Shim Y.S. EGFR mutations and human papillomavirus in squamous cell carcinoma of tongue and tonsil. Eur J Cancer. 2007 Feb; 43 (3): 520–6.
27. Mellinghoff I.K., Wang M.Y., Vivanco I., Haas-Kogan D.A., Zhu S., Dia E.Q., Lu K.V., Yoshimoto K., Huang J.H., Chute D.J., Riggs B.L., Horvath S., Liau L.M., Cavenee W.K., Rao P.N., Beroukhim R., Peck T.C., Lee J.C., Sellers W.R., Stokoe D., Prados M., Cloughesy T.F., Sawyers C.L., Mischel P.S. Molecular determinants of the response of glioblastomas to EGFR kinase inhibitors. N Engl J Med. 2005 Nov 10; 353 (19): 2012–24.
28. Титова В.А., Аванесов А.М., Петровский В.Ю. Возможности оптимизации контактной лучевой терапии злокачественных опухолей с использованием индивидуальных фиксирующих систем из современных стоматологических масс. Труды НК РУДН МО РФ. М., 2014.
29. Дронова Е.Л. Лучевая диагностика опухолей орофарингеальной зоны. Сибирский онкологический журнал. 2010; 3: 63–64.
Сибирский онкологический журнал. 2010; 3: 63–64.
30. Ukpo O.C., Pritchett C.V., Lewis J.E., Weaver A.L., Smith D.I., Moore E.J. Human papillomavirus-associated oropharyngeal squamous cell carcinomas: primary tumor burden and survival in surgical patients. Ann Otol Rhinol Laryngol. 2009 May; 118 (5): 368–73.
Текущие аспекты плоскоклеточного рака полости рта
1. Williams HK. Молекулярный патогенез плоскоклеточного рака полости рта. Мол Патол. 2000; 53: 165–72. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2. Сиддики И.А., Фарук М.Ю., Сиддики Р.А., Рафи СМТ. Роль толуидина синий в раннем выявлении рака полости рта. Пак J Med Sci. 2006; 22: 184–7. [Google Scholar]
3. Шарма П., Саксена С., Аггарвал П. Тенденции в эпидемиологии плоскоклеточный рак полости рта в Western UP: институциональный исследование. Индиана Джей Дент Рез. 2010; 21: 316–9.. [PubMed] [Google Scholar]
4. Choi S, Myers JN. Молекулярный патогенез плоскоклеточного рака полости рта
карцинома: последствия для терапии. Джей Дент Рез. 2008; 87: 14–32. [PubMed] [Google Scholar]
Джей Дент Рез. 2008; 87: 14–32. [PubMed] [Google Scholar]
5. Mehrotra R, Yadav S, et al. Плоскоклеточный рак полости рта: этиология, патогенез и прогностическое значение геномных изменений. индийский J Рак. 2006;43:60–6. [PubMed] [Google Scholar]
6. Patel SC, Carpenter WR, Tyree S, et al. Рост заболеваемости плоскоклеточный рак полости рта у молодых белых женщин, возраст от 18 до 44 лет. Дж. Клин Онкол. 2011;29(11): 1488–94. [PubMed] [Google Scholar]
7. Scott SE, Grunfeld EA, Main J, McGurk M. рак: качественное исследование опыта пациентов. Психоонкология . 2006; 15: 474–85. [PubMed] [Google Scholar]
8. Чоле Р.Х., Патил Р.Н., Басак А., Паландуркар К., Бховате Р. Оценка малонового диальдегида в сыворотке крови при раке полости рта и предраковых состояниях и его ассоциации со здоровыми людьми, полом, алкоголем и табаком злоупотреблять. J Рак Res Ther. 2010; 6: 487–91. [PubMed] [Академия Google]
9. де Фрейташ Кордейро-Силва М., Оливейра ЗФ, де Подеста Дж. Р., Гувеа
С.А., фон Зейдлер С.В., Лоуро И.Д. Анализ метилирования связанных с раком
генов в неопухолевых клетках пациентов с оральным
плоскоклеточная карцинома. Mol Biol Rep. 2011;38(8):5435–41. [PubMed] [Google Scholar]
Р., Гувеа
С.А., фон Зейдлер С.В., Лоуро И.Д. Анализ метилирования связанных с раком
генов в неопухолевых клетках пациентов с оральным
плоскоклеточная карцинома. Mol Biol Rep. 2011;38(8):5435–41. [PubMed] [Google Scholar]
10. Marichalar-Mendia X, Acha-Sagredo A, Rodriguez-Tojo MJ, et al. Алкогольдегидрогеназа (ADh2B) Arg48His полиморфизм в Пациенты Страны Басков с раком полости рта и гортани: предварительные данные исследование. Противораковый Рез. 2011; 31: 677–80. [PubMed] [Академия Google]
11. Варнакуласурия С., Сазерленд Г., Скалли К. Табак, рак ротовой полости и лечение зависимости. Оральный онкол. 2005; 41: 244–60. [PubMed] [Google Scholar]
12. Zygogianni AG, Kyrgias G, Karakitsos P, et al. Плоскоклеточный рак полости рта рак: раннее выявление и роль алкоголя и курения. Глава Онкол. шеи. 2011;3:2. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Ogden GR. Алкоголь и рак ротовой полости. Алкоголь. 2005; 35: 169–73. [PubMed] [Google Scholar]
14. Su CC, Yang HF, Huang SJ, LianIe B. Отличительные особенности устного
рак в округе Чанхуа: высокая заболеваемость, преобладание слизистой оболочки щек,
и близкая связь с привычкой жевать бетель. Дж
Формос Мед Ассоц. 2007; 106: 225–33. [PubMed] [Академия Google]
Su CC, Yang HF, Huang SJ, LianIe B. Отличительные особенности устного
рак в округе Чанхуа: высокая заболеваемость, преобладание слизистой оболочки щек,
и близкая связь с привычкой жевать бетель. Дж
Формос Мед Ассоц. 2007; 106: 225–33. [PubMed] [Академия Google]
15. Ко Ю.С., Хуан Ю.Л., Ли Ч., Чен М.Дж., Лин Л.М., Цай К.С. Бетель жевание quid, курение сигарет и употребление алкоголя, связанные с к раку полости рта на Тайване. Дж Орал Патол Мед. 1995;24(10):450–3. [PubMed] [Google Scholar]
16. Субаприя Р., Тангавелу А., Матаван Б., Рамачандран Ч.Р., Нагини С. Оценка факторов риска плоскоклеточного рака полости рта в Чидамбараме, Южная Индия: исследование случай-контроль. евро J Рак Пред. 2007; 16: 251–6. [PubMed] [Google Scholar]
17. Thavarajah R, Rao A, Raman U, Rajasekaran ST, Joshua ERH, Каннан Р. Поражения полости рта у 500 человек, привыкших употреблять психоактивные вещества. в Ченнаи, Индия. Arch Oral Biol. 2006; 51: 512–9. [PubMed] [Google Scholar]
18. Кулкарни Д.П., Вадиа П.П., Прадхан Т.Н., Патхак А.К., Чиплункар С.В.
Механизмы, участвующие в подавлении дзета-цепи TCR в
опухоль по сравнению с периферической кровью больных раком ротовой полости. Int J Рак
. 2009; 124:1605–13. [PubMed] [Google Scholar]
Кулкарни Д.П., Вадиа П.П., Прадхан Т.Н., Патхак А.К., Чиплункар С.В.
Механизмы, участвующие в подавлении дзета-цепи TCR в
опухоль по сравнению с периферической кровью больных раком ротовой полости. Int J Рак
. 2009; 124:1605–13. [PubMed] [Google Scholar]
19. Angiero F, Gatta LB, Seramondi R, et al. Частота и роль ВПЧ при прогрессировании эпителиальной дисплазии в рак полости рта. Противораковый Рез. 2010;30:3435–40. [PubMed] [Google Scholar]
20. Nuovo GJ. In situ обнаружение ДНК вируса папилломы человека после ПЦР-амплификация. Методы Мол Биол. 2011; 688: 35–46. [PubMed] [Google Scholar]
21. Скалли С., Феликс Д.Х. Оральная медицина: обновление для практикующего стоматолога. Рак ротовой полости. Британский Дент Дж. 2006; 200: 13–7. [PubMed] [Google Scholar]
22. Syrjänen S. Роль папилломавирусной инфекции в головном мозге и рак шеи. Энн Онкол. 2010;21(Suppl 7):vii 243–vii 245. [PubMed] [Google Scholar]
23. Jalouli J, Ibrahim SO, Mehrotra R, et al.
24. Гонсалес-Молез М.А., Гутьеррес Х., Родригес М.Дж., Руис-Авила И., Родригес-Арчилла А. Экспрессия латентного мембранного белка-1 (LMP-1) вируса Эпштейна-Барра при плоскоклеточной карциноме полости рта. Ларингоскоп . 2002; 112: 482–7. [PubMed] [Google Scholar]
25. Nagao Y, Sata M. Высокая частота множественных первичных карцином у HCV-инфицированных пациентов с плоскоклеточным раком полости рта. Мед Научный Монит. 2009; 15:CR453–9. [PubMed] [Google Scholar]
26. Ван дер Вааль И. Потенциально злокачественные заболевания полости рта и слизистая оболочка ротоглотки, терминология, классификация и настоящее концепции менеджмента. Оральный онкол. 2009 г.;45:317–23. [PubMed] [Google Scholar]
27. Garavello W, Foschi R, Talamini R, et al. Семейная история и
риск развития рака полости рта и глотки.
28. Шрилеха Т.Т., Рамадас К., Пандей М., Томас Г., Налинакумари КР, Пиллаи МР. Генетический полиморфизм CYPIA1, GSTM1 и Гены GSTT1 при раке полости рта в Индии. Оральный онкол. 2001; 37: 593–598. [PubMed] [Google Scholar]
29. Li H, Chen XL, Li HQ. Полиморфизм CYPIA1 и GSTM1 гены, связанные с предрасположенностью к раку желудка в провинции Шаньдун Провинция Китая. Мир J Гастроэнтерол. 2005; 11: 5757–62. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Harty LC, Caporaso NE, Hayes RB, et al. Алкогольдегидрогеназа 3 генотип и риск рака полости рта и глотки. Джей Натл Рак инст. 1997; 89: 1698–705. [PubMed] [Google Scholar]
31. Solomon PR, Selvam GS, Shanmugam G. Полиморфизм в ADH и гены MTHFR при плоскоклеточной карциноме полости рта у индейцев. Оральный Дис. 2008; 14: 633–9. [PubMed] [Google Scholar]
32. Califano J, van der Riet P, Westra W, et al. Генетическая прогрессия
модель рака головы и шеи: значение для полевой канцеризации. Рак рез. 1996;56:2488–92. [PubMed] [Google Scholar]
Рак рез. 1996;56:2488–92. [PubMed] [Google Scholar]
33. Маркопулос А., Албаниду-Фармаки Э., Каявис И. Актинический хейлит: клинико-патологические характеристики в 65 случаях. Заболевания полости рта . 2004; 10: 212–6. [PubMed] [Google Scholar]
34. Preston DL, Ron E, Tokuoka S, et al. Заболеваемость солидным раком в пережившие атомную бомбардировку: 1958-1998 гг. Радиационное разрешение 2007; 168:1–64. [PubMed] [Google Scholar]
35. O’Grady JF, Reade PC. Candida albicans как стимулятор перорального неоплазия слизистой оболочки. Канцерогенез. 1992;13:783–786. [PubMed] [Google Scholar]
36. Huang M, Spitz MR, Gu J, et al. Полиморфизм гена циклина D1 фактор риска предраковых поражений полости рта. Канцерогенез. 2006 г.; 27:2034–7. [PubMed] [Google Scholar]
37. Díez-Pérez R, Campo-Trapero J, Cano-Sánchez J, et al. Метилирование при раке полости рта и предраковых поражениях (обзор) ncol Rep . 2011;25(5):1203–9. [PubMed] [Google Scholar]
38. Сидранский Д. Молекулярная генетика рака головы и шеи. Карр
Опин Онкол. 1995;7:229–33. [PubMed] [Google Scholar]
Сидранский Д. Молекулярная генетика рака головы и шеи. Карр
Опин Онкол. 1995;7:229–33. [PubMed] [Google Scholar]
39. Михайлиду Э., Маркопулос А.К., Антониадес Д.З. Тучные клетки и Ангиогенез при злокачественных и предраковых поражениях полости рта. Открытым Дент Дж. 2008; 2:120–6. [Бесплатная статья PMC] [PubMed] [Google Scholar]
40. Слотер Д.П., Саутвик Х.В., Смейкал В. Канцеризация поля в Многослойный плоский эпителий полости рта: клинические проявления многоочагового источник. Рак. 1953; 6: 963–8. [PubMed] [Google Scholar]
41. Bedi GC, Westra WH, Gabrielson E, Koch W, Sidransky D. Multiple опухоли головы и шеи: свидетельство общего клонального происхождения. Рак рез. 1996;56:2484–7. [PubMed] [Google Scholar]
42. Braakhuis BJ, Tabor MP, Kummer JA, Leemans R, Brakenhoff РХ. Генетическое объяснение концепции Слотера о полевой канцеризации: доказательства и клинические последствия. Рак рез. 2003 г.; 63: 1727–30. [PubMed] [Google Scholar]
43. Braakhuis BJ, Leemans CR, Brakenhoff RH. Генетическая прогрессия
модель рака полости рта: текущие данные и клинические последствия. Дж
Орал Патол Мед. 2004; 33: 317–22. [PubMed] [Google Scholar]
Генетическая прогрессия
модель рака полости рта: текущие данные и клинические последствия. Дж
Орал Патол Мед. 2004; 33: 317–22. [PubMed] [Google Scholar]
44. Lacy PD, Spitznagel EL, Piccirillo JF. Разработка новой постановки система для рецидива ротовой полости и ротоглотки плоскоклеточного клеточная карцинома. Рак. 1999;86:1387–95. [PubMed] [Google Scholar]
45. Marsh D,suchak K, Moutasim KA, et al. Стромальные особенности прогнозирование смертности от болезней у больных раком полости рта. Дж. Патол . 2011; 223:470–81. [PubMed] [Google Scholar]
46. де Араужо РФ, Барбоза младший К.А., Клебис Н.К., де Моура С.А., Лопес Коста Аде Л. Прогностическое значение анатомического расположения и клиническая классификация TNM плоскоклеточного рака полости рта. Med Oral Pathol Oral Cir Bucal. 2008; 13: E344–7. [PubMed] [Академия Google]
47. Хилл БТ, Прайс Л.А. Отсутствие преимущества в выживаемости у пациентов с
распространенный плоскоклеточный рак полости рта, получающий
неоадъювантной химиотерапии до местной терапии, несмотря на достижение
начальная высокая клиническая частота полной ремиссии. Ам Дж. Клин Онкол
. 1994; 17:1–5. [PubMed] [Google Scholar]
Ам Дж. Клин Онкол
. 1994; 17:1–5. [PubMed] [Google Scholar]
48. Зини А., Чернинский Р., Сган-Коэн Х.Д. Рак полости рта за четыре десятилетия: эпидемиология, тенденции, гистология и выживаемость по анатомическим места. Дж Орал Патол Мед. 2010; 39: 299–305. [PubMed] [Академия Google]
49. Shah JP, Gil Z. Современные концепции лечения рака полости рта: операция. Оральный онкол. 2009; 45: 394–401. [Бесплатная статья PMC] [PubMed] [Google Scholar]
50. Pagedar NA, Gilbert RW. Селективная диссекция шеи: обзор доказательство. Оральный онкол. 2009;45:416–20. [PubMed] [Google Scholar]
51. Mazeron R, Tao Y, Lusinchi A, Bourhis J. Современные концепции в лечение рака головы и шеи, лучевая терапия. Оральный Онкол . 2009;45:402–8. [PubMed] [Академия Google]
52. Specenier PM, Vermorken JB. Современные концепции управления рака головы и шеи: Химиотерапия. Оральный онкол. 2009 г.; 45:409–15. [PubMed] [Google Scholar]
53. Hamakawa H, Nakashiro K, Sumida T, et al. Основные доказательства
Молекулярно-таргетная терапия рака полости рта и рака слюнных желез.
Шея головы. 2008; 30:800–9. [PubMed] [Google Scholar]
Основные доказательства
Молекулярно-таргетная терапия рака полости рта и рака слюнных желез.
Шея головы. 2008; 30:800–9. [PubMed] [Google Scholar]
54. Маркопулос А.К., Михайлиду Э.З., Цимагиоргис Г. Слюнный маркеры для выявления рака ротовой полости. Open Dent J. 2010; 4:72–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Биомаркеры для иммунотерапии плоскоклеточного рака полости рта: текущее состояние и проблемы
Введение
Выживаемость при плоскоклеточном раке полости рта (OSCC) составляет около 50% пораженных случаев. Достижения в традиционных методах лечения OSCC (хирургия, лучевая терапия, химиотерапия) не смогли увеличить выживаемость, и в то же время они были связаны со значительными побочными эффектами. Прогноз выживаемости при раке ротовой полости зависит от классических параметров, таких как степень опухоли и глубина инвазии, хотя многие биомаркеры были введены в качестве потенциальных прогностических факторов OSCC (1, 2).
Недавнее исследование представило иммунотерапию как эффективный вариант лечения OSCC. Гипотеза иммунотерапии была основана на теории, которая была представлена более века назад, постулируя способность иммунной системы подавлять раковые клетки и способствовать выздоровлению пациента (3). Значение иммунотерапии рака было признано более широко, когда в 2018 году за разработку таких методов лечения была присуждена Нобелевская премия по физиологии и медицине (4). Для OSCC иммунотерапия была впервые одобрена для рецидивирующих/метастатических случаев (аналогично другим видам рака головы и шеи) (5). Следует отметить, что неоадъювантная иммунотерапия, назначаемая до операции, была недавно введена для нелеченого OSCC (6).
Гипотеза иммунотерапии была основана на теории, которая была представлена более века назад, постулируя способность иммунной системы подавлять раковые клетки и способствовать выздоровлению пациента (3). Значение иммунотерапии рака было признано более широко, когда в 2018 году за разработку таких методов лечения была присуждена Нобелевская премия по физиологии и медицине (4). Для OSCC иммунотерапия была впервые одобрена для рецидивирующих/метастатических случаев (аналогично другим видам рака головы и шеи) (5). Следует отметить, что неоадъювантная иммунотерапия, назначаемая до операции, была недавно введена для нелеченого OSCC (6).
С успехом иммунотерапии в лечении OSCC стало важным найти параметры для выбора пациентов, которым может быть полезна эта стратегия лечения, а также найти прогностический маркер(ы) для последующего ответа на лечение. В этом мини-обзоре мы обсудим различные методы, которые были введены для оценки иммунного ответа и иммунных биомаркеров при OSCC.
Оценка иммунного ответа как часть системы классификации OSCC
Иммунные клетки являются одними из основных клеточных компонентов ткани стромы рака (7). Взаимодействие иммунных клеток с опухолевыми клетками широко изучалось как один из факторов, влияющих на прогрессирование опухоли (8, 9).). Сообщалось, что при многих видах рака активный противоопухолевый иммунный ответ является признаком хорошего прогноза (9, 10). Во многих предложениях предлагалось оценивать иммунный ответ как часть гистопатологической классификации OSCC. Например, раннее исследование Anneroth et al. (11) предложили включить оценку воспалительного клеточного инфильтрата в свою систему оценки злокачественности (11). Они разделили лимфоплазмоцитарные инфильтраты на четыре категории: выраженные, умеренные, незначительные или отсутствующие (11). Позднее эта система была изменена Bryne et al. (12), которые оценивали степень злокачественности (включая лимфоплазмоцитарный инфильтрат) на инвазивном фронте OSCC (12). Брандвейн-Генслер и соавт. (13) оценивали иммунный ответ как часть гистологического показателя риска, включающего три параметра: наихудший вариант инвазии, периневральную инвазию и лимфоцитарную реакцию хозяина (13).
Взаимодействие иммунных клеток с опухолевыми клетками широко изучалось как один из факторов, влияющих на прогрессирование опухоли (8, 9).). Сообщалось, что при многих видах рака активный противоопухолевый иммунный ответ является признаком хорошего прогноза (9, 10). Во многих предложениях предлагалось оценивать иммунный ответ как часть гистопатологической классификации OSCC. Например, раннее исследование Anneroth et al. (11) предложили включить оценку воспалительного клеточного инфильтрата в свою систему оценки злокачественности (11). Они разделили лимфоплазмоцитарные инфильтраты на четыре категории: выраженные, умеренные, незначительные или отсутствующие (11). Позднее эта система была изменена Bryne et al. (12), которые оценивали степень злокачественности (включая лимфоплазмоцитарный инфильтрат) на инвазивном фронте OSCC (12). Брандвейн-Генслер и соавт. (13) оценивали иммунный ответ как часть гистологического показателя риска, включающего три параметра: наихудший вариант инвазии, периневральную инвазию и лимфоцитарную реакцию хозяина (13). Совсем недавно (2020 г.) Бьеркли и соавт. предложил гистологическую оценку, основанную на оценке лимфоцитарного инфильтрата и дифференцировки опухоли, и показал, что эта оценка дает хороший прогноз выживаемости при раке языка полости рта (14). Наша группа (15) предложила стромальную классификацию, основанную на оценке инфильтрирующих опухоль лимфоцитов и соотношении опухоль-строма, с многообещающей прогностической ценностью при раннем раке языка полости рта.
Совсем недавно (2020 г.) Бьеркли и соавт. предложил гистологическую оценку, основанную на оценке лимфоцитарного инфильтрата и дифференцировки опухоли, и показал, что эта оценка дает хороший прогноз выживаемости при раке языка полости рта (14). Наша группа (15) предложила стромальную классификацию, основанную на оценке инфильтрирующих опухоль лимфоцитов и соотношении опухоль-строма, с многообещающей прогностической ценностью при раннем раке языка полости рта.
Из приведенных выше исторически накопленных данных кажется, что включение иммунного ответа как части системы классификации OSCC является полезным и важным шагом, который еще не был реализован в практике патологии. Ожидается, что клинически значимая система классификации с надежной связью с поведением опухоли и исходом, которая учитывает иммунный ответ, станет очень полезной для будущей иммунотерапии OSCC.
Гистологическая полуколичественная оценка инфильтрирующих опухоль лимфоцитов
Морфологическая оценка опухоль-инфильтрирующих лимфоцитов (TIL) с использованием стандартных окрашенных гематоксилин-эозином (HE) срезов опухоли проводилась при многих видах рака, включая OSCC (16). Стандартизированный метод оценки TIL был представлен Международной рабочей группой по TIL (9). Накопленные данные показали важность этого метода при различных видах рака (17–19). В OSCC наша группа (15) недавно сообщила, что оценка стромальных TIL [предложенная Рабочей группой TILs (9)] может использоваться в качестве важного прогностического инструмента для прогнозирования общей выживаемости, выживаемости по конкретным заболеваниям и выживаемости без признаков заболевания в большой многоцентровой когорте раннего рака полости рта. Этот метод оценки также успешно применялся для других локализаций рака головы и шеи (16). После дальнейшей проверки в больших когортах этот простой метод оценки TIL можно использовать для мониторинга ответа на иммунотерапию. В дополнение к валидации важно преодолеть некоторые ограничения, такие как отсутствие консенсуса в отношении морфологической оценки TIL при OSCC и трудности в оценке TIL с использованием предоперационных диагностических биопсий (20).
Стандартизированный метод оценки TIL был представлен Международной рабочей группой по TIL (9). Накопленные данные показали важность этого метода при различных видах рака (17–19). В OSCC наша группа (15) недавно сообщила, что оценка стромальных TIL [предложенная Рабочей группой TILs (9)] может использоваться в качестве важного прогностического инструмента для прогнозирования общей выживаемости, выживаемости по конкретным заболеваниям и выживаемости без признаков заболевания в большой многоцентровой когорте раннего рака полости рта. Этот метод оценки также успешно применялся для других локализаций рака головы и шеи (16). После дальнейшей проверки в больших когортах этот простой метод оценки TIL можно использовать для мониторинга ответа на иммунотерапию. В дополнение к валидации важно преодолеть некоторые ограничения, такие как отсутствие консенсуса в отношении морфологической оценки TIL при OSCC и трудности в оценке TIL с использованием предоперационных диагностических биопсий (20).
Прогресс исследований иммунных биомаркеров OSCC
Чтобы предсказать реакцию рака на иммунотерапию, в недавнем исследовании (21) была предпринята попытка определить иммунный профиль опухолей, классифицированных как холодная опухоль (также известная как иммунная пустыня) или горячая опухоль ( также известный как воспаленная опухоль). Используя иммуногистохимию, несколько исследователей изучили молекулы иммунных контрольных точек и экспрессию специфических TIL для определения иммунного профиля OSCC. Механизмы таких иммунных молекул описаны в других статьях (22, 23). Поскольку было опубликовано очень много исследований иммунных биомаркеров, мы сосредоточимся здесь на накопленных данных из систематических обзоров и метаанализов. Например, Sievilainen et al. (24) в их недавнем систематическом обзоре, охватывающем период с 19с 85 по 2017 г., о прогностической ценности иммунных контрольных точек OSCC отметили, что семь иммунных контрольных точек (PD-L1, FKBP51, B7-h5, B7-H6, ALHD1, IDO1 и B7-h4) имеют связь с худшей выживаемостью. В метаанализе прогностического значения TIL при OSCC Huang et al. (25) обнаружили, что высокая инфильтрация CD8+ TIL, CD45RO+ TIL и CD57+ TIL связана с хорошей выживаемостью; в то время как высокая инфильтрация макрофагами CD163+ и CD68+ была связана с плохим прогнозом. В другом метаанализе Hadler-Olsen et al.
Используя иммуногистохимию, несколько исследователей изучили молекулы иммунных контрольных точек и экспрессию специфических TIL для определения иммунного профиля OSCC. Механизмы таких иммунных молекул описаны в других статьях (22, 23). Поскольку было опубликовано очень много исследований иммунных биомаркеров, мы сосредоточимся здесь на накопленных данных из систематических обзоров и метаанализов. Например, Sievilainen et al. (24) в их недавнем систематическом обзоре, охватывающем период с 19с 85 по 2017 г., о прогностической ценности иммунных контрольных точек OSCC отметили, что семь иммунных контрольных точек (PD-L1, FKBP51, B7-h5, B7-H6, ALHD1, IDO1 и B7-h4) имеют связь с худшей выживаемостью. В метаанализе прогностического значения TIL при OSCC Huang et al. (25) обнаружили, что высокая инфильтрация CD8+ TIL, CD45RO+ TIL и CD57+ TIL связана с хорошей выживаемостью; в то время как высокая инфильтрация макрофагами CD163+ и CD68+ была связана с плохим прогнозом. В другом метаанализе Hadler-Olsen et al. (26) обнаружили, что CD163+ M2 и CD57+ имеют многообещающую связь с исходом у пациентов с OSCC. Результаты этих систематических обзоров и метаанализов следует рассматривать как краеугольный камень для будущих исследований по выявлению клинически наиболее значимых иммунных биомаркеров. Необходимо признать, что вышеупомянутые результаты были получены в ходе исследований, включающих в основном образцы пациентов, получавших хирургическое вмешательство и другие традиционные стратегии, такие как лучевая терапия и/или химиотерапия.
(26) обнаружили, что CD163+ M2 и CD57+ имеют многообещающую связь с исходом у пациентов с OSCC. Результаты этих систематических обзоров и метаанализов следует рассматривать как краеугольный камень для будущих исследований по выявлению клинически наиболее значимых иммунных биомаркеров. Необходимо признать, что вышеупомянутые результаты были получены в ходе исследований, включающих в основном образцы пациентов, получавших хирургическое вмешательство и другие традиционные стратегии, такие как лучевая терапия и/или химиотерапия.
Для рака головы и шеи, включая OSCC, лечение антителами против запрограммированной гибели клеток-1 (анти-PD-1) и против лиганда запрограммированной гибели клеток-1 (анти-PD-L1) имеет решающее значение в одобренной в настоящее время иммунотерапии (27, 28). Чтобы определить, в каких случаях такое лечение с большей вероятностью принесет пользу, многие исследователи изучили два соответствующих биомаркера (то есть PD-1 и PD-L1) с использованием образцов пациентов, получавших иммунотерапию. Например, экспрессия PD-L1 показала значительную связь с реакцией на дурвалумаб (антитело против PD-L1) в недавних исследованиях рака головы и шеи (5, 29).). Эти исследования показали, что пороговое значение 25% окрашивания раковых клеток с помощью PD-L1 подходит для определения ответа пациента на иммунотерапию дурвалумабом (5, 29). Однако в другом исследовании противоопухолевой активности иммунотерапии на основе пембролизумаба Chow et al. (30) предложили рассматривать оценку PD-L1 как в раковых, так и в иммунных клетках с точкой отсечения 1%. Точно так же Emancipator et al. (31) сообщили, что «комбинированная положительная оценка», которая оценивает отношение количества клеток, экспрессирующих PD-L1 (включая раковые клетки и иммунные клетки), к количеству всех жизнеспособных раковых клеток, умноженное на 100, является мощным инструментом. при оценке ответа на пембролизумаб.
Например, экспрессия PD-L1 показала значительную связь с реакцией на дурвалумаб (антитело против PD-L1) в недавних исследованиях рака головы и шеи (5, 29).). Эти исследования показали, что пороговое значение 25% окрашивания раковых клеток с помощью PD-L1 подходит для определения ответа пациента на иммунотерапию дурвалумабом (5, 29). Однако в другом исследовании противоопухолевой активности иммунотерапии на основе пембролизумаба Chow et al. (30) предложили рассматривать оценку PD-L1 как в раковых, так и в иммунных клетках с точкой отсечения 1%. Точно так же Emancipator et al. (31) сообщили, что «комбинированная положительная оценка», которая оценивает отношение количества клеток, экспрессирующих PD-L1 (включая раковые клетки и иммунные клетки), к количеству всех жизнеспособных раковых клеток, умноженное на 100, является мощным инструментом. при оценке ответа на пембролизумаб.
В исследовании фазы 3, включавшем 361 пациента с рецидивирующим ПРГШ, которые получали ниволумаб, выживаемость пациентов была улучшена с помощью этого вида иммунотерапии (32). Однако экспрессия PD-L1 не была столь значимой при оценке ответа на лечение (32). Это может подчеркнуть сложность сравнения результатов исследований, в которых PD-L1 использовался в качестве прогностического маркера, если бы иммунотерапевтические агенты были разными. Кроме того, важно принять во внимание, что вышеупомянутые данные о PD-1 и/или PD-L1 были получены в исследованиях, включавших различные локализации рака головы и шеи с хорошо известными вариациями их клинического поведения. Следовательно, в дальнейших исследованиях следует рассмотреть конкретные исследования OSCC, чтобы подтвердить полезность PD-1 и PD-L1 для прогнозирования ответа на иммунотерапию. Кроме того, на основе будущих исследований необходимо определить, следует ли оценивать экспрессию PD-L1 как в раковых клетках, так и в иммунных клетках, или только в иммунных клетках. Кроме того, методы, отличные от иммуногистохимии, для оценки иммунных биомаркеров, таких как иммунная сигнатура, должны быть протестированы в случаях OSCC, получавших иммунотерапию, поскольку этот метод показал хорошую прогностическую ценность для иммунотерапии при других опухолях (33, 34).
Однако экспрессия PD-L1 не была столь значимой при оценке ответа на лечение (32). Это может подчеркнуть сложность сравнения результатов исследований, в которых PD-L1 использовался в качестве прогностического маркера, если бы иммунотерапевтические агенты были разными. Кроме того, важно принять во внимание, что вышеупомянутые данные о PD-1 и/или PD-L1 были получены в исследованиях, включавших различные локализации рака головы и шеи с хорошо известными вариациями их клинического поведения. Следовательно, в дальнейших исследованиях следует рассмотреть конкретные исследования OSCC, чтобы подтвердить полезность PD-1 и PD-L1 для прогнозирования ответа на иммунотерапию. Кроме того, на основе будущих исследований необходимо определить, следует ли оценивать экспрессию PD-L1 как в раковых клетках, так и в иммунных клетках, или только в иммунных клетках. Кроме того, методы, отличные от иммуногистохимии, для оценки иммунных биомаркеров, таких как иммунная сигнатура, должны быть протестированы в случаях OSCC, получавших иммунотерапию, поскольку этот метод показал хорошую прогностическую ценность для иммунотерапии при других опухолях (33, 34).
Immunoscore для OSCC
Недавние исследовательские усилия представили иммунный анализ, известный как иммуноскорость, основанный на оценке комбинации иммунных биомаркеров для определения исхода рака (35). Наиболее многообещающие результаты с иммуноскорой были получены при колоректальном раке, где система подсчета количества CD3 и CD8 была стандартизирована и продемонстрировала многообещающую прогностическую силу, превосходящую систему стадирования TNM (36), и показала успешные результаты в клинических испытаниях фазы 3 (37). ). Для карциномы полости рта идентификация прогностической оценки на основе иммунных признаков была недавно введена Zhou et al. (38), которые сообщили о многообещающей прогностической ценности иммунопоказателя, основанного на оценке CD3 в центральных областях и на инвазивных краях OSCC; CD8, CD45RO и FOXP3 в центральной части OSCC; FOXP3 и CD45RO на инвазивных границах OSCC. Однако предложенная иммуноскора для OSCC потребует дальнейшей проверки.
Дигитальная патология и иммунные биомаркеры
Автоматизированная оценка иммунных биомаркеров успешно изучалась при различных видах рака (39–41). В OSCC такая оценка все еще находится на ранней стадии, поскольку об этой концепции сообщается лишь в нескольких исследованиях. Тем не менее, эти несколько отчетов показали многообещающие результаты. Шабан и др. (2019) сообщили о цифровой оценке для объективной количественной оценки TIL, которая может успешно предсказать безрецидивную выживаемость при OSCC и показала лучшую прогностическую ценность, чем ручная оценка TIL (42). Следует отметить, что этот метод оценки TIL с использованием изображений всего предметного стекла срезов, окрашенных гематоксилином и эозином (HE), также успешно использовался при других видах рака (43). В другом недавнем исследовании Huang et al. (44) сообщили о многообещающем значении цифрового анализа изображений CD8 в большой группе больных раком языка. Этот подход к оценке иммунных маркеров с использованием цифрового анализа может быть простым инструментом для оценки иммунного ответа OSCC, и поэтому необходимы подтверждающие исследования.
В OSCC такая оценка все еще находится на ранней стадии, поскольку об этой концепции сообщается лишь в нескольких исследованиях. Тем не менее, эти несколько отчетов показали многообещающие результаты. Шабан и др. (2019) сообщили о цифровой оценке для объективной количественной оценки TIL, которая может успешно предсказать безрецидивную выживаемость при OSCC и показала лучшую прогностическую ценность, чем ручная оценка TIL (42). Следует отметить, что этот метод оценки TIL с использованием изображений всего предметного стекла срезов, окрашенных гематоксилином и эозином (HE), также успешно использовался при других видах рака (43). В другом недавнем исследовании Huang et al. (44) сообщили о многообещающем значении цифрового анализа изображений CD8 в большой группе больных раком языка. Этот подход к оценке иммунных маркеров с использованием цифрового анализа может быть простым инструментом для оценки иммунного ответа OSCC, и поэтому необходимы подтверждающие исследования.
Другие факторы для оценки ответа на иммунотерапию
В дополнение к иммунному ответу и иммунным биомаркерам с ответом на иммунотерапию могут быть связаны другие существующие факторы, включая мутационную нагрузку опухоли и мутационные сигнатуры (45). Мутационная нагрузка опухоли, относящаяся к числу соматических мутаций на кодирующую область генома опухоли, имеет прогностическое значение при многих видах рака (46). Следует отметить, что недавние исследования показали, что мутационная нагрузка опухоли имеет важное значение для прогнозирования ответа на иммунотерапию (45). В когорте, включающей случаи рака головы и шеи, Cristescu et al. (47) обнаружили, что мутационная нагрузка опухоли и профиль экспрессии генов воспаленных Т-клеток могут вместе предсказать клинический ответ на иммунотерапию пембролизумабом, и сообщалось о более длительной выживаемости при более высоких уровнях этих двух факторов. Хотя пембролизумаб был рекомендован для лечения случаев с высокой мутационной нагрузкой опухоли (≥ 10 мутаций на мегабазу), некоторые исследователи возражали против такого универсального порога и подчеркивали тот факт, что пациенты с раком часто получают цитотоксическую химиотерапию, которая может вызвать более высокий уровень мутационной нагрузки опухоли.
Мутационная нагрузка опухоли, относящаяся к числу соматических мутаций на кодирующую область генома опухоли, имеет прогностическое значение при многих видах рака (46). Следует отметить, что недавние исследования показали, что мутационная нагрузка опухоли имеет важное значение для прогнозирования ответа на иммунотерапию (45). В когорте, включающей случаи рака головы и шеи, Cristescu et al. (47) обнаружили, что мутационная нагрузка опухоли и профиль экспрессии генов воспаленных Т-клеток могут вместе предсказать клинический ответ на иммунотерапию пембролизумабом, и сообщалось о более длительной выживаемости при более высоких уровнях этих двух факторов. Хотя пембролизумаб был рекомендован для лечения случаев с высокой мутационной нагрузкой опухоли (≥ 10 мутаций на мегабазу), некоторые исследователи возражали против такого универсального порога и подчеркивали тот факт, что пациенты с раком часто получают цитотоксическую химиотерапию, которая может вызвать более высокий уровень мутационной нагрузки опухоли. бремя (48). Таким образом, по-прежнему необходимо определить оптимальную точку отсечения для мутационной нагрузки опухоли в каждом типе опухоли, чтобы определить группу, которая может получить пользу от иммунотерапии. Кроме того, необходимо учитывать, что иммунное микроокружение опухоли характеризуется сложностью, что требует оценки клинического ответа с разных сторон, и измерение мутационной нагрузки опухоли является одной из них.
бремя (48). Таким образом, по-прежнему необходимо определить оптимальную точку отсечения для мутационной нагрузки опухоли в каждом типе опухоли, чтобы определить группу, которая может получить пользу от иммунотерапии. Кроме того, необходимо учитывать, что иммунное микроокружение опухоли характеризуется сложностью, что требует оценки клинического ответа с разных сторон, и измерение мутационной нагрузки опухоли является одной из них.
Выводы и перспективы
В быстро развивающейся области иммунотерапии идентификация биомаркеров для прогнозирования иммунного ответа может сделать такую терапию одним из клинически эффективных методов лечения OSCC. Существует множество параметров/биомаркеров и методов, которые были введены в течение последних трех десятилетий для оценки иммунного ответа. Текущие исследовательские усилия включают использование иммунного ответа для классификации OSCC и определение иммунопоказателя для OSCC. Успешная клинически значимая оценка иммунного ответа может рассматриваться как краеугольный камень в выявлении пациентов, которым будет полезна иммунотерапия, а также в последующем наблюдении за ответом на лечение. Данные недавних совместных исследований и/или метаанализов, подчеркивающие важность оценки TIL и других иммунных биомаркеров в качестве надежного инструмента, раскрывающего состояние иммунного ответа и имеющего сильную корреляцию с исходом выживания. Существует острая необходимость в валидационных исследованиях, чтобы подтвердить результаты этих биомаркеров, таким образом, чтобы помочь в идентификации идеального биомаркера для выбора случаев OSCC, которые могут получить пользу от иммунотерапии, и для оценки ответа пациента. Цифровая оценка иммунных биомаркеров при OSCC все еще находится на ранней стадии и требует дальнейших исследований. Точно так же данные о прогностической ценности мутационной нагрузки опухоли и мутационных сигнатур все еще требуют дальнейших исследований, прежде чем их можно будет добавить в персонализированное прогнозирование ответа на лечение OSCC.
Данные недавних совместных исследований и/или метаанализов, подчеркивающие важность оценки TIL и других иммунных биомаркеров в качестве надежного инструмента, раскрывающего состояние иммунного ответа и имеющего сильную корреляцию с исходом выживания. Существует острая необходимость в валидационных исследованиях, чтобы подтвердить результаты этих биомаркеров, таким образом, чтобы помочь в идентификации идеального биомаркера для выбора случаев OSCC, которые могут получить пользу от иммунотерапии, и для оценки ответа пациента. Цифровая оценка иммунных биомаркеров при OSCC все еще находится на ранней стадии и требует дальнейших исследований. Точно так же данные о прогностической ценности мутационной нагрузки опухоли и мутационных сигнатур все еще требуют дальнейших исследований, прежде чем их можно будет добавить в персонализированное прогнозирование ответа на лечение OSCC.
Вклад авторов
Все перечисленные авторы внесли существенный, непосредственный и интеллектуальный вклад в работу и одобрили ее для публикации.
Конфликт интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Ссылки
1. Almangush A, Heikkinen I, Makitie AA, Coletta RD, Laara E, Leivo I, et al. Прогностические биомаркеры плоскоклеточного рака языка полости рта: систематический обзор и метаанализ. BrJ Рак (2017) 117:856–66. doi: 10.1038/bjc.2017.244
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
2. Ривера С., Оливейра А.К., Коста Р.П., Де Росси Т., Паес Леме А.Ф. Прогностические биомаркеры плоскоклеточного рака полости рта: систематический обзор. Oral Oncol (2017) 72:38–47. doi: 10.1016/j.oraloncology.2017.07.003
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
3. Adams JL, Smothers J, Srinivasan R, Hoos A. Большие возможности малых молекул в иммуноонкологии. Nat Rev Drug Discovery (2015) 14:603–22. doi: 10.1038/nrd4596
doi: 10.1038/nrd4596
CrossRef Полный текст | Google Scholar
4. Хуан П.В., Чанг Дж.В. Ингибиторы иммунных контрольных точек получили Нобелевскую премию 2018 года. BioMed J (2019) 42:299–306. doi: 10.1016/j.bj.2019.09.002
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
5. Zandberg DP, Algazi AP, Jimeno A, Good JS, Fayette J, Bouganim N, et al. Дурвалумаб при рецидивирующей или метастатической плоскоклеточной карциноме головы и шеи: результаты исследования II фазы с участием одной группы пациентов с экспрессией PD-L1 в опухолевых клетках >/= 25 %, прогрессировавших на фоне химиотерапии на основе препаратов платины. Eur J Cancer (2019) 107: 142–52. doi: 10.1016/j.ejca.2018.11.015
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
6. Schoenfeld JD, Hanna GJ, Jo VY, Rawal B, Chen YH, Catalano PS, et al. Неоадъювантный ниволумаб или ниволумаб плюс ипилимумаб при нелеченой плоскоклеточной карциноме полости рта: открытое рандомизированное клиническое исследование фазы 2. JAMA Oncol (2020) 6:1563–70. doi: 10.1001/jamaoncol.2020.2955
JAMA Oncol (2020) 6:1563–70. doi: 10.1001/jamaoncol.2020.2955
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
7. Маман С., Витц И.П. История изучения рака в контексте. Nat Rev Cancer (2018) 18:359–76. doi: 10.1038/s41568-018-0006-7
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
8. Giraldo NA, Sanchez-Salas R, Peske JD, Vano Y, Becht E, Petitprez F, et al. Клиническая роль ТМЭ при солидном раке. BrJ Рак (2019) 120:45–53. doi: 10.1038/s41416-018-0327-z
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
9. Salgado R, Denkert C, Demaria S, Sirtaine N, Klauschen F, Pruneri G, et al. Оценка инфильтрирующих опухоль лимфоцитов (TIL) при раке молочной железы: рекомендации Международной рабочей группы TIL, 2014 г. Ann Oncol (2015) 26:259–71. doi: 10.1093/annonc/mdu450
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
10. Fridman WH, Zitvogel L, Sautes-Fridman C, Kroemer G. Иммунный контекст в прогнозировании и лечении рака. Нат Рев Клин Онкол (2017) 14:717–34. doi: 10.1038/nrclinonc.2017.101
Fridman WH, Zitvogel L, Sautes-Fridman C, Kroemer G. Иммунный контекст в прогнозировании и лечении рака. Нат Рев Клин Онкол (2017) 14:717–34. doi: 10.1038/nrclinonc.2017.101
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
11. Anneroth G, Batsakis J, Luna M. Обзор литературы и рекомендуемая система классификации злокачественности плоскоклеточного рака полости рта. Scand J Dent Res (1987) 95:229–49. doi: 10.1111/j.1600-0722.1987.tb01836.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
12. Bryne M, Koppang HS, Lilleng R, Kjaerheim A. Оценка злокачественности глубоких инвазивных краев плоскоклеточного рака полости рта имеет высокую прогностическую ценность. J Pathol (1992) 166:375–81. doi: 10.1002/path.1711660409
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
13. Brandwein-Gensler M, Teixeira MS, Lewis CM, Lee B, Rolnitzky L, Hille JJ, et al. Плоскоклеточная карцинома полости рта: гистологическая оценка риска, но не краевой статус, является сильным прогностическим фактором локальной безрецидивной и общей выживаемости. Am J Surg Pathol (2005) 29:167–78. doi: 10.1097/01.pas.0000149687.90710.21
Am J Surg Pathol (2005) 29:167–78. doi: 10.1097/01.pas.0000149687.90710.21
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
14. Bjerkli IH, Hadler-Olsen E, Nginamau ES, Laurvik H, Soland TM, Costea DE, et al. Комбинированная гисто-оценка, основанная на дифференцировке опухоли и лимфоцитарном инфильтрате, является надежным прогностическим маркером подвижного рака языка. Арка Вирхова (2020) 477(6):865–72. doi: 10.1007/s00428-020-02875-9
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
15. Almangush A, Bello IO, Heikkinen I, Hagstrom J, Haglund C, Kowalski LP, et al. Стромальная категоризация раннего рака полости рта. Арка Вирхова (2020). doi: 10.1007/s00428-020-02930-5
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
16. Альмангуш А., Лейво И., Макитие А.А. Общая оценка инфильтрирующих опухоль лимфоцитов при плоскоклеточном раке головы и шеи: время обратить на это внимание. Acta Otolaryngol (2020) 140:246–8. doi: 10.1080/00016489.2020.1720284
Acta Otolaryngol (2020) 140:246–8. doi: 10.1080/00016489.2020.1720284
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
17. Hwang C, Lee SJ, Lee JH, Kim KH, Suh DS, Kwon BS, et al. Лимфоциты, инфильтрирующие стромальную опухоль, оцениваемые на предметных стеклах, окрашенных гематоксилин-эозином, являются независимым прогностическим фактором эпителиального рака яичников и серозной карциномы яичников. Oncol Lett (2019) 17:4557–65. doi: 10.3892/ol.2019.10095
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
18. Liu JY, Yang GF, Chen FF, Peng CW. Оценка прогностического значения инфильтрирующих опухоль лимфоцитов в солидной опухоли: практика стандартизированного метода Международной рабочей группы по иммуноонкологическим биомаркерам. Cancer Manag Res (2019) 11:6815–27. doi: 10.2147/CMAR.S201538
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
19. Fuchs TL, Sioson L, Sheen A, Jafari-Nejad K, Renaud CJ, Andrici J, et al.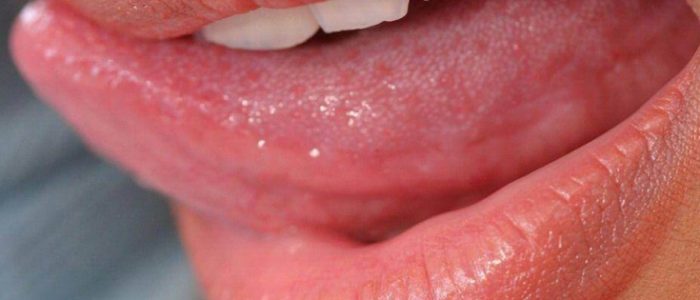 Оценка инфильтрирующих опухоль лимфоцитов с использованием системы Международной рабочей группы TIL (ITWG) является надежным предиктором общей выживаемости при колоректальной карциноме: исследование 1034 пациентов. Am J Surg Pathol (2020) 44: 536–44. doi: 10.1097/PAS.0000000000001409
Оценка инфильтрирующих опухоль лимфоцитов с использованием системы Международной рабочей группы TIL (ITWG) является надежным предиктором общей выживаемости при колоректальной карциноме: исследование 1034 пациентов. Am J Surg Pathol (2020) 44: 536–44. doi: 10.1097/PAS.0000000000001409
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
20. Bello IO, Wennerstrand PM, Suleymanova I, Siponen M, Qannam A, Nieminen P, et al. Качество биопсии имеет важное значение для предоперационного прогнозирования рака полости рта. АПМИС (2020) 129(3):118–27. doi: 10.1111/apm.13104
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
21. Чен Д.С., Меллман И. Элементы иммунитета против рака и уставка иммунитета против рака. Природа (2017) 541:321–30. doi: 10.1038/nature21349
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
22. Wei SC, Duffy CR, Allison JP. Фундаментальные механизмы терапии блокады иммунных контрольных точек. Открытие рака (2018) 8:1069–86. doi: 10.1158/2159-8290.CD-18-0367
Открытие рака (2018) 8:1069–86. doi: 10.1158/2159-8290.CD-18-0367
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
23. Хиральдо Н.А., Песке Дж.Д., Сотес-Фридман С., Фридман В.Х. Интеграция гистопатологии, иммунных биомаркеров и молекулярных подгрупп при солидном раке: следующий шаг в прецизионной онкологии. Арка Вирхова (2019) 474: 463–74. doi: 10.1007/s00428-018-02517-1
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
24. Sievilainen M, Almahmoudi R, Al-Samadi A, Salo T, Pirinen M, Almangush A. Прогностическое значение иммунных контрольных точек при плоскоклеточном раке полости рта. Oral Dis (2019) 25:1435–45. doi: 10.1111/odi.12991
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
25. Huang Z, Xie N, Liu H, Wan Y, Zhu Y, Zhang M, et al. Прогностическая роль инфильтрирующих опухоль лимфоцитов при плоскоклеточном раке полости рта: метаанализ. J Oral Pathol Med (2019) 48:788–98. doi: 10.1111/jop.12927
doi: 10.1111/jop.12927
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
26. Hadler-Olsen E, Wirsing AM. Тканевые инфильтрирующие иммунные клетки как прогностические маркеры плоскоклеточного рака полости рта: систематический обзор и метаанализ. Br J Рак (2019) 120: 714–27. doi: 10.1038/s41416-019-0409-6
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
27. Крамер Дж. Д., Бертнесс Б., Феррис Р. Л. Иммунотерапия рака головы и шеи: последние достижения и будущие направления. Oral Oncol (2019) 99:104460. doi: 10.1016/j.oraloncology.2019.104460
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
28. Московиц Дж.М., Феррис Р.Л. Опухолевая иммунология и иммунотерапия плоскоклеточного рака головы и шеи. J Dent Res (2018) 97:622–6. doi: 10.1177/0022034518759464
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
29. Rebelatto MC, Midha A, Mistry A, Sabalos C, Schechter N, Li X, et al. Разработка иммуногистохимического анализа лиганда-1 запрограммированной гибели клеток, утвержденного для анализа немелкоклеточного рака легкого и плоскоклеточного рака головы и шеи. Диагн Патол (2016) 11:95. doi: 10.1186/s13000-016-0545-8
Разработка иммуногистохимического анализа лиганда-1 запрограммированной гибели клеток, утвержденного для анализа немелкоклеточного рака легкого и плоскоклеточного рака головы и шеи. Диагн Патол (2016) 11:95. doi: 10.1186/s13000-016-0545-8
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
30. Chow LQM, Haddad R, Gupta S, Mahipal A, Mehra R, Tahara M, et al. Противоопухолевая активность пембролизумаба у пациентов с невыбранным биомаркером с рецидивирующей и/или метастатической плоскоклеточной карциномой головы и шеи: результаты расширенной когорты фазы Ib KEYNOTE-012. J Clin Oncol (2016) 34:3838–45. doi: 10.1200/JCO.2016.68.1478
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
31. Emancipator K, Huang L, Aurora-Garg D, Bal T, Cohen EEW, Harrington K, et al. Сравнение показателей лиганда программируемой смерти 1 для прогнозирования эффективности пембролизумаба при раке головы и шеи. Mod Pathol (2020) 34(3):532–41. doi: 10.1038/s41379-020-00710-9
doi: 10.1038/s41379-020-00710-9
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
32. Ferris RL, Blumenschein G Jr, Fayette J, Guigay J, Colevas AD, Licitra L, et al. Ниволумаб при рецидивирующем плоскоклеточном раке головы и шеи. N Engl J Med (2016) 375:1856–67. doi: 10.1056/NEJMoa1602252
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
33. Wang Y, Chen L, Yu M, Fang Y, Qian K, Wang G, et al. Иммунная сигнатура предсказывает прогноз и пользу иммунотерапии при раке мочевого пузыря. Cancer Med (2020) 9:7729–41. doi: 10.1002/cam4.3400
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
34. Xiao Y, Cui G, Ren X, Hao J, Zhang Y, Yang X и др. Новая четырехгенная сигнатура, связанная с контрольной точкой иммунитета, для прогнозирования прогноза при глиоме более низкой степени. Передний Oncol (2020) 10:605737. doi: 10.3389/fonc.2020.605737
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
35. Бруни Д., Энджелл Х.К., Галон Дж. Иммунный контекст и иммуноскоры в прогнозировании рака и терапевтической эффективности. Nat Rev Cancer (2020) 20 (11): 662–80. doi: 10.1038/s41568-020-0285-7
Бруни Д., Энджелл Х.К., Галон Дж. Иммунный контекст и иммуноскоры в прогнозировании рака и терапевтической эффективности. Nat Rev Cancer (2020) 20 (11): 662–80. doi: 10.1038/s41568-020-0285-7
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
36. Galon J, Bruni D. Подходы к лечению иммунных горячих, измененных и холодовых опухолей с помощью комбинированной иммунотерапии. Nat Rev Drug Discovery (2019) 18:197–218. doi: 10.1038/s41573-018-0007-y
CrossRef Полный текст | Google Scholar
37. Pages F, Taieb J, Laurent-Puig P, Galon J. Консенсус Immunoscore в клинических испытаниях фазы 3; потенциальное влияние на решения по ведению пациентов. Онкоиммунология (2020) 9:1812221. doi: 10.1080/2162402X.2020.1812221
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
38. Zhou C, Diao P, Wu Y, Wei Z, Jiang L, Zhang W, et al. Разработка и валидация основанной на семи иммунных признаках прогностической оценки плоскоклеточного рака полости рта после лечебной резекции.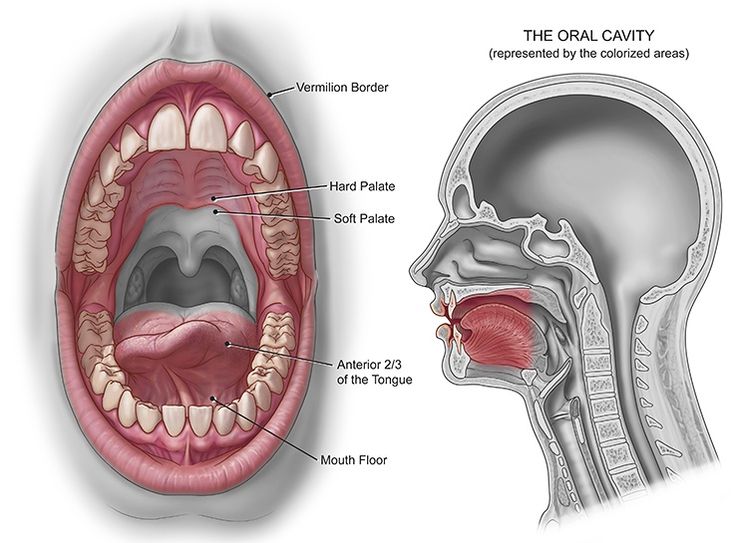 Int J Cancer (2020) 146:1152–63. doi: 10.1002/ijc.32571
Int J Cancer (2020) 146:1152–63. doi: 10.1002/ijc.32571
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
39. Зиленайте Д., Расмуссон А., Аугулис Р., Бесуспарис Дж., Лауринавичене А., Планкулин Б. и др. Независимая прогностическая ценность внутриопухолевой гетерогенности и особенностей иммунного ответа с помощью автоматизированного цифрового иммуногистохимического анализа при ранней гормонорецептор-позитивной карциноме молочной железы. Передний Oncol (2020) 10:950. doi: 10.3389/fonc.2020.00950
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
40. Humphries MP, Craig SG, Kacprzyk R, Fisher NC, Bingham V, McQuaid S, et al. Адаптивный иммунный и иммунный ландшафт контрольных точек неоадъювантной терапии аденокарциномы пищевода с использованием количественного анализа цифровой патологии. BMC Рак (2020) 20:500. doi: 10.1186/s12885-020-06987-y
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
41. Parra ER, Behrens C, Rodriguez-Canales J, Lin H, Mino B, Blando J, et al. Оценка плотности PD-L1 и опухолевых иммунных клеток на основе анализа изображений поддерживает различные группы внутриопухолевого микроокружения у пациентов с немелкоклеточной карциномой легкого. Clin Cancer Res (2016) 22:6278–89. doi: 10.1158/1078-0432.CCR-15-2443
Parra ER, Behrens C, Rodriguez-Canales J, Lin H, Mino B, Blando J, et al. Оценка плотности PD-L1 и опухолевых иммунных клеток на основе анализа изображений поддерживает различные группы внутриопухолевого микроокружения у пациентов с немелкоклеточной карциномой легкого. Clin Cancer Res (2016) 22:6278–89. doi: 10.1158/1078-0432.CCR-15-2443
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
42. Shaban M, Khurram SA, Fraz MM, Alsubaie N, Masood I, Mushtaq S, et al. Новый цифровой показатель обилия лимфоцитов, инфильтрирующих опухоль, позволяет прогнозировать безрецидивную выживаемость при плоскоклеточной карциноме полости рта. Научный представитель (2019) 9:13341. doi: 10.1038/s41598-019-49710-z
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
43. Linder N, Taylor JC, Colling R, Pell R, Alvelyn E, Joseph J, et al. Глубокое обучение для обнаружения инфильтрирующих опухоль лимфоцитов в опухолях зародышевых клеток яичка. Дж. Клин Патол (2019) 72:157–64. doi: 10.1136/jclinpath-2018-205328
Дж. Клин Патол (2019) 72:157–64. doi: 10.1136/jclinpath-2018-205328
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
44. Huang Y, Lin C, Kao HK, Hung SY, Ko HJ, Huang YC, et al. Анализ цифровых изображений CD8+ и CD3+ инфильтрирующих опухоль лимфоцитов при плоскоклеточной карциноме языка. Cancer Manag Res (2020) 12:8275–85. doi: 10.2147/CMAR.S255816
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
45. Oliva M, Spreafico A, Taberna M, Alemany L, Coburn B, Mesia R, et al. Иммунные биомаркеры ответа на ингибиторы иммунных контрольных точек при плоскоклеточном раке головы и шеи. Энн Онкол (2019) 30:57–67. doi: 10.1093/annonc/mdy507
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
46. Sha D, Jin Z, Budcies J, Kluck K, Stenzinger A, Sinicrope FA. Мутационная нагрузка опухоли как прогностический биомаркер солидных опухолей. Cancer Discovery (2020) 10:1808–25.