Удаление нерва зуба в Москве. Цены на удаление нерва из зуба. Отзывы, фото
Когда терапевтический метод не подходит для лечения зуба, если нет возможности вылечить или восстановить нерв, используют удаление нерва зуба. Например, при кариесе, который поразил части нерва, мягкие зубные ткани. Поврежденная пульпа дает о себе знать пульсирующей нестерпимой болью, и решением в таком случае может быть только удаление зубного нерва.
Содержание
Специалисты по удалению нервов
Юрина Светлана Викторовна
Опыт работы — 18 лет
Маметьев Евгений Сергеевич
Опыт работы — 15 лет
Литвин Ирина Борисовна
Опыт работы — 32 года
Радько Оксана Юрьевна
Опыт работы — 18 лет
Рачкова Ульяна Вячеславовна
Опыт работы — 15 лет
Гусарова Еленa Сергеевнa
Опыт работы — 12 лет
Карагулова Милана Зауровна
Опыт работы — 6 лет
Полунина Анастасия Викторовна
Опыт работы — 9 лет
Сорокина Алеся Николаевна
Опыт работы — 18 лет
Герасимова Яна Олеговна
Опыт работы — 15 лет
Юнаева Стелла Владимировна
Опыт работы — 22 года
Горбачева Ирина Ивановна
Опыт работы — 27 лет
Сорокин Александр Максимович
Опыт работы — 10 лет
Метод удаления применяют в крайнем случае, когда другие способы помощи невозможны. Удаление нерва лишает зуб питания, приводит его к безжизненности, омертвению, потому эта мера является крайней. Удаление нерва зуба является достаточно травматичной процедурой, восстановление может продлиться до четырех недель.
Удаление нерва лишает зуб питания, приводит его к безжизненности, омертвению, потому эта мера является крайней. Удаление нерва зуба является достаточно травматичной процедурой, восстановление может продлиться до четырех недель.
| Вопрос | Ответ |
| Когда требуется удаление нерва | Сильная боль, ночная боль, поражение зубного нерва, выявленное в ходе осмотра |
| Необходимое количество визитов | 1 — 2 |
| Длительность приема, часов | 1 — 1,5 |
| Период восстановления | Незначительный дискомфорт при приемах пищи 1-2 дня |
| Вид обезболивания | Местная анестезия |
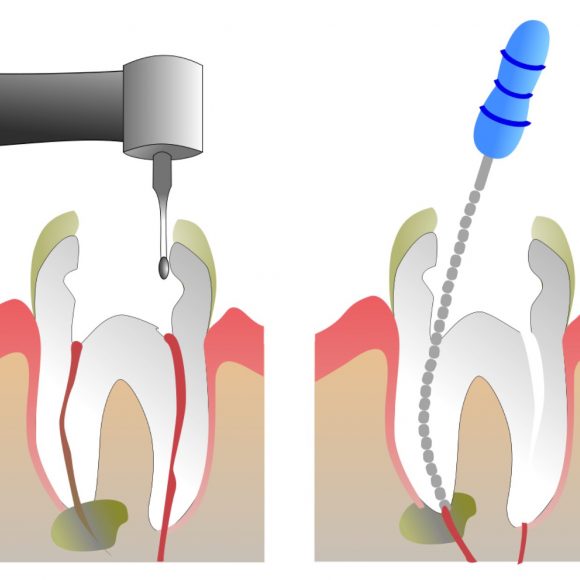
Итак, как удаляют нерв из зуба? Процедура, в результате которой происходит удаление нерва зуба, имеет несколько этапов:
- посещение стоматолога;
- удаление пораженных кариесом тканей зуба;
- хирургическое удаление нерва с использованием анестезии;
- очистка стоматологом каналов с использованием антисептических средств;
- пломбирование каналов зуба;
- пломбирование зубной верхушки.
 Такой метод называется витальным, он предполагает удаление нерва за один сеанс. К тому же зуб можно сохранить частично живым.
Такой метод называется витальным, он предполагает удаление нерва за один сеанс. К тому же зуб можно сохранить частично живым.
Видео про удаление нерва зуба
Если удаление нерва происходит с помощью мышьяка, то добавляются такие этапы:
- наложение мышьяковой пасты под временную пломбу;
- установка временной пломбы на несколько дней;
- еще одно посещение стоматолога для установки постоянной пломбы;
- снятие пломбы временного типа;
- удаление нерва, который уже погиб под воздействием мышьяка.
Перед установкой постоянной пломбы стоматолог может предложить сделать рентген, чтобы убедиться, что пломбирование каналов проведено качественно. Удаление нерва посредством мышьяка болезненно, в современных клиниках используют более щадящий метод, который позволяет сохранять жизнь зубу, что особенно важно при обслуживании детей.
Если удалить нерв, то зуб станет хрупким?
Есть целый ряд показаний, по которым проводят удаление нерва зуба. К ним относят следующие ситуации:
К ним относят следующие ситуации:
- гнойный пульпит;
- острое воспаление пульпы;
- гранулемы;
- повреждение нерва в результате сильного разрушения зуба;
- кистозные образования;
- периодонтит; частичное удаление нерва зуба показано при нечаянном вскрытии стоматологом пульповой камеры;
- удаление зубного нерва – способ вылечить глубокий кариес, предотвратить деструктивные изменения;
- удаление нерва зуба может потребоваться при протезировании зубов, растущих под наклоном, поскольку требуется вскрытие пульпы;
- удаление нерва зуба показано при хроническом пульпите, который может в ряде случаев протекать без симптомов.
Бесплатная консультация
Задайте вопросы по телефону +7 (495) 150-27-16 или оставьте заявку, мы перезвоним в течение рабочего дня.
Как вас зовут Номер телефона
Нажимая кнопку «Записаться», я даю согласие на обработку моих персональных данных в соответствии c
Закрыть
Заявка отправлена
, спасибо за проявленный интерес.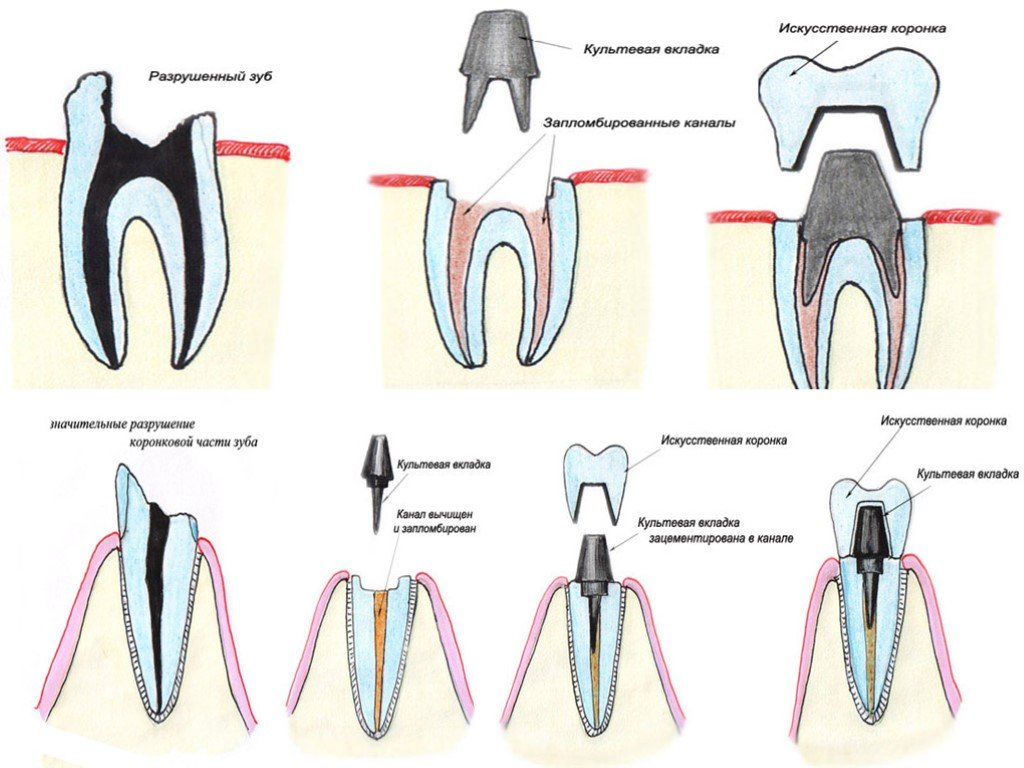 В течение 15 минут наш менеджер перезвонит вам.
В течение 15 минут наш менеджер перезвонит вам.
Закрыть
Многие заболевания являются противопоказанием к такой процедуре, как удаление нерва из зуба. К их числу относятся следующие:
- вирусные гепатиты А, В, С;
- острые респираторные заболевания;
- сердечнососудистые патологии;
- удаление нерва не проводят в стадии острого лейкоза;
- первые три месяца и последний триместр беременности удаление нерва не рекомендуют;
- острый стоматит;
- психические заболевания.
Удаление нерва имеет ряд особенностей, которые связаны с методом процедуры.
Витальный способ предоставляет стоматологу возможность удалить пульту частично, это позволяет нерву зуба в дальнейшем участвовать в росте зуба, что важно для детей. Использование мышьяковой пасты может быть слишком болезненным для пациента. К тому же такой метод предполагает неоднократное посещение стоматолога, что для многих пациентов нежелательно. Для многих более предпочтительно удаление нерва в рамках одного посещения стоматологии.
В ряде случаев может наблюдаться боль после удаления нерва. Болью может сопровождаться заживление мягких тканей, но иногда зуб болит при надавливании и после окончания восстановительного периода. Почему ноет зуб после удаления нерва? Для этого есть ряд причин:
- выведение материала пломбировки за верхушку корня;
- неполноценное пломбирование каналов;
- попадание осколка хрупкого инструмента в зубной канал, в результате чего в канале развивается инфекция;
- травмирование в процессе пломбировки зубного корня.
Все эти причины имеют в своей основе человеческий фактор. Сеть клиник «Центр Эстетической Стоматологии» в Москве предлагает услугу удаления нерва самыми современными и безболезненными методами. Отзывы пациентов, фото и видео наших клиентов до и после лечения – лучшая реклама нашей работы.
Отзывы после удаления нервов зуба
Обращалась в клинику с острой болью.
Ксения | 13.10.2022
На прошлой недели мне провели удаление нерва зуба, цена в Центре эстетической стоматологии была приемлемой. Осложнений не было, зуб не беспокоил. За 5 дней ранка полностью затянулась.
Виктория, 22 года | 07.06.2019
Удаление нерва в зубе мне провели за один раз. Все думал, больно ли удалять нерв из зуба, но все прошло безболезненно, с хорошим анестетиком. Прошло две недели — нет никаких болезненных ощущений, забыл о проблеме. Надо сказать, что цены нормальные, и все, с кем успел пообщаться и кто обращался в этот Центр, дают только хорошие отзывы.
Иван, 45 лет | 31. 08.2016
08.2016
Пришел к стоматологу, все сделал в один прием под анестезией: удалили нерв, каналы и сам зуб запломбировали. Цены вполне устроили. Вообще стоимость всех процедур адекватная. За неделю ранка полностью затянулась, никаких последствий и осложнений. Все хорошо.
Сергей. 35 лет | 08.03.2016
Вопросы и ответы по удалению зубных нервов
Задать вопрос
✅ Подскажите, сколько стоит удалить нерв и поставить пломбу? Беспокоит один зуб, там гнойный пульпит.
Удаление нерва и пломбирование канала – доступная процедура. Точная стоимость зависит от ряда факторов. К примеру, была проведена инструментальная и медикаментозная обработка корневого канала с помощью операционного микроскопа или без него. На приеме врач проведет осмотр и рассчитает стоимость услуги. удал
✅ Мне врач сказал, что у меня пульпит и неизбежна процедура по удалению нерва, но я не чувствовал никакой боли. Может, меня развели?
Может, меня развели?
Иногда пульпит протекает без симптомов, но врач видит его признаки. Так что если сказал – депульпировать, то надо делать. Это проводят в крайних случаях. Никто не будет такого придумывать. А вообще надо ходить к тем врачам, которым доверяешь.
✅ Скажите, почему болит зуб, если нерва нет? Больно кусать этим зубом, надавливать на него – в чем причина? Что можно сделать?
Если боль в зубе после удаления нерва не проходит больше месяца – это свидетельство воспалительного процесса, инфекции, которые могут начаться из-за некачественного обеззараживания больных тканей, из-за оставления кусочка инструмента, из-за того, что стоматолог поранил зубной корень при манипуляциях по удалению нерва. Требуется обследование, рентген и потом можно сказать, что требуется сделать.
✅ Сколько болит зуб после удаления? Может ли болеть зуб через два месяца после того, как нерв под анестезией был удален, а каналы запломбировали?
Боль через такой промежуток времени может свидетельствовать о том, что в канале есть инородное тело – кусочек инструмента, идет воспаление по этой причине или по причине травмирования корня во время обработки каналов и дальнейшего пломбирования. Если сильно болит зуб после удаления нерва, это показатель воспаления.
Если сильно болит зуб после удаления нерва, это показатель воспаления.
Значит, удаление нерва прошло некачественно.
Задайте вопрос
Оставьте свой вопрос, а мы перенаправим его компетентному специалисту
Как вас зовут Эл. почта (не будет опубликована) Номер телефона (не обязательно)
Нажимая кнопку «Отправить», я даю согласие на обработку моих персональных данных в соответствии c Политикой конфиденциальности
Вопрос успешно отправлен
, мы передадим ваш вопрос специалисту и дадим на него ответ в ближайшее время.
Закрыть
Статью проверил эксперт
Климович Виктория Борисовна
Квалифицированный специалист в области ортодонтии, челюстно-лицевой хирургии и эстетической реставрации зубов, опыт работы — 11 лет
Оцените качество страницы:
7 голосов, 3.7 из 5
Удаление зубного нерва | DentaBravo |
Ваш гид по безболезненному удалению зубного нерва
Согласитесь, «удаление зубного нерва и пломбирование каналов» звучит не так уж хорошо, чтобы хотелось повторять эту процедуру. Но вы можете перенести ее абсолютно легко и спокойно.
Но вы можете перенести ее абсолютно легко и спокойно.
Мы попросили лучших стоматологов клиники подготовить ответы на важные вопросы об удалении нервов. Вместо того, чтобы напрасно волноваться, прочитайте одну страницу и приходите на безболезненное лечение в «ДентаБраво»!
Воспаление зубного нерва обычно сопровождается болевыми ощущениями. Зуб реагирует на механическое раздражение — на прикосновение, постукивание, давление во время приема пищи. Боль усиливается в ночное время и нередко имеет пульсирующий характер. Во многих случаях чтобы избавиться от боли приходится удалять нерв.
Что такое зубной нерв?
Зубным нервом в просторечии называют пульпу — рыхлую волокнистую ткань, которая заполняет полость зуба. В пульпе находятся нервные волокна, кровеносные и лимфатические сосуды. Именно благодаря пульпе зуб способен реагировать на всевозможные раздражители.
Каковы причины воспаления зубного нерва?
Чаще всего зубной нерв воспаляется из-за кариеса — под воздействием микробов, продуктов их жизнедеятельности и токсинов, вызванных распадом дентина.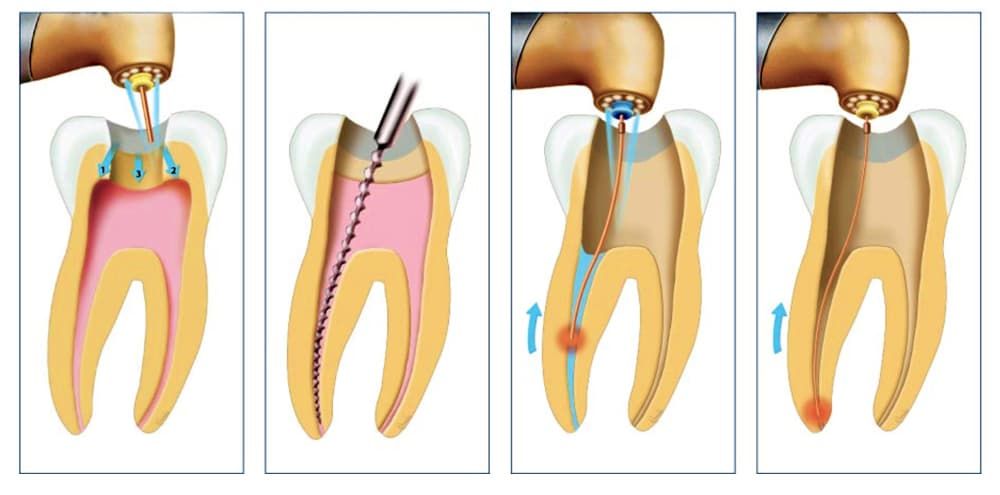 Помимо этого поражение зубного нерва может быть связано с травмами, проникновением микробов через инфицированный корень, а также с некачественной механической обработкой кариозной полости. Среди других причин можно назвать тепловое воздействие при лечении кариеса, влияние химических веществ, оперативные вмешательства в области пародонта и т.д.
Помимо этого поражение зубного нерва может быть связано с травмами, проникновением микробов через инфицированный корень, а также с некачественной механической обработкой кариозной полости. Среди других причин можно назвать тепловое воздействие при лечении кариеса, влияние химических веществ, оперативные вмешательства в области пародонта и т.д.
Каковы показания к удалению зубного нерва (депульпированию)?
Удаление зубного нерва необходимо в случае диагностики пульпита. В этих ситуациях депульпирование является единственным шансом сохранить больной зуб, чтобы с помощью дальнейшей реставрации восстановить его функциональность.
Реже нерв удаляют при лечении тяжелой формы пародонтита, чтобы стабилизировать течение процесса и снять болевые симптомы оголившихся корней зуба.
Удаление нерва по ортопедическим показаниям применяется в тех случаях, когда есть риск повреждения нерва, при обточке зубов под ортопедическую конструкцию. Например, при наклоне зуба или широкой пульпарной полости, при препарировании зубов под металлокерамические коронки. Депульпирование таких зубов позволяет избежать отдалённых осложнений.
Депульпирование таких зубов позволяет избежать отдалённых осложнений.
Какова методика удаления зубного нерва под анестезией?
Под действием обезболивающего препарата стоматолог вскрывает корневой канал зуба, расширяет его с помощью специальных инструментов, удаляет пораженные ткани пульпы и стенок корневого канала. Затем каналу зуба придаётся цилиндрическая форма, проводится медикаментозная обработка и пломбирование.
Что такое «мышьяк», аналоги?
Под «мышьяком» подразумевается мышьяковистая паста, в которой содержится небольшая концентрация действующего вещества. Паста помещается в кариозную полость на несколько дней, после чего производится удаление омертвевшего нерва. В современной медицине применение мышьяка не применяется из за его высокой токсичности. В настоящее время существует ряд аналогов мышьяку. Это препараты на основе параформальдегида. Обладая меньшей токсичностью, они более безопасны, поэтому при удалении нерва зуба осложнения минимальны.
Удаление зубного нерва это больно?
Благодаря современной анестезии боль не чувствуется ни во время удаления нерва, ни после него. А если пациент боится уколов, врач использует специальный гель, который наносится на десну и обезболивает место, куда будет сделана инъекция.
А если пациент боится уколов, врач использует специальный гель, который наносится на десну и обезболивает место, куда будет сделана инъекция.
Зачем пломбируют каналы зуба после удаления нерва?
В пустом корневом канале создаются идеальные условия для размножения патогенных микроорганизмов, вызывающих воспаление в околокорневых тканях. Поэтому канал зуба должен быть закрыт. И здесь крайне важна герметичность, в противном случае в результате удаления нерва зуба осложнения не избежать. Корневые каналы заполняются антисептическими герметизирующими пастами и гуттаперчей, которые препятствуют возникновению инфекции.
Какова стоимость удаления зубного нерва?
Стоимость депульпирования отражена в прайс-листе. Но нужно учитывать, что при удалении нерва в зубе цена услуги зависит от количества корневых каналов, поэтому сумма лечения рассчитывается индивидуально.
Токсичность мышьяка: клиническая оценка | Медицина окружающей среды
Ранняя клиническая диагностика отравления мышьяком часто затруднена; ключевым лабораторным тестом при недавнем воздействии является экскреция мышьяка с мочой.
Клиническая диагностика интоксикации мышьяком часто затруднена, поскольку как острое, так и хроническое отравление имеют широкий спектр признаков и симптомов, которые в значительной степени зависят от
- пути воздействия,
- химическая форма,
- доза и
- раз прошло с момента воздействия.
Во многих случаях пациент или человек, предоставивший анамнез, может скрывать информацию, или источник воздействия может быть неочевидным. Объединив результаты лабораторных исследований с анамнезом и клиническими данными, часто можно подтвердить диагноз.
Сразу после стабилизации состояния пациента следует провести лабораторные анализы для получения исходных значений с периодическим контролем по показаниям.
Поскольку уровни мышьяка в моче могут быстро снижаться в первые 24-48 часов после острого воздействия, следует незамедлительно получить образец мочи для анализа мышьяка.
В зависимости от клинического состояния пациента могут потребоваться общие тесты на биомаркеры эффекта, специальные тесты на биомаркеры воздействия и конкретные биомаркеры эффекта.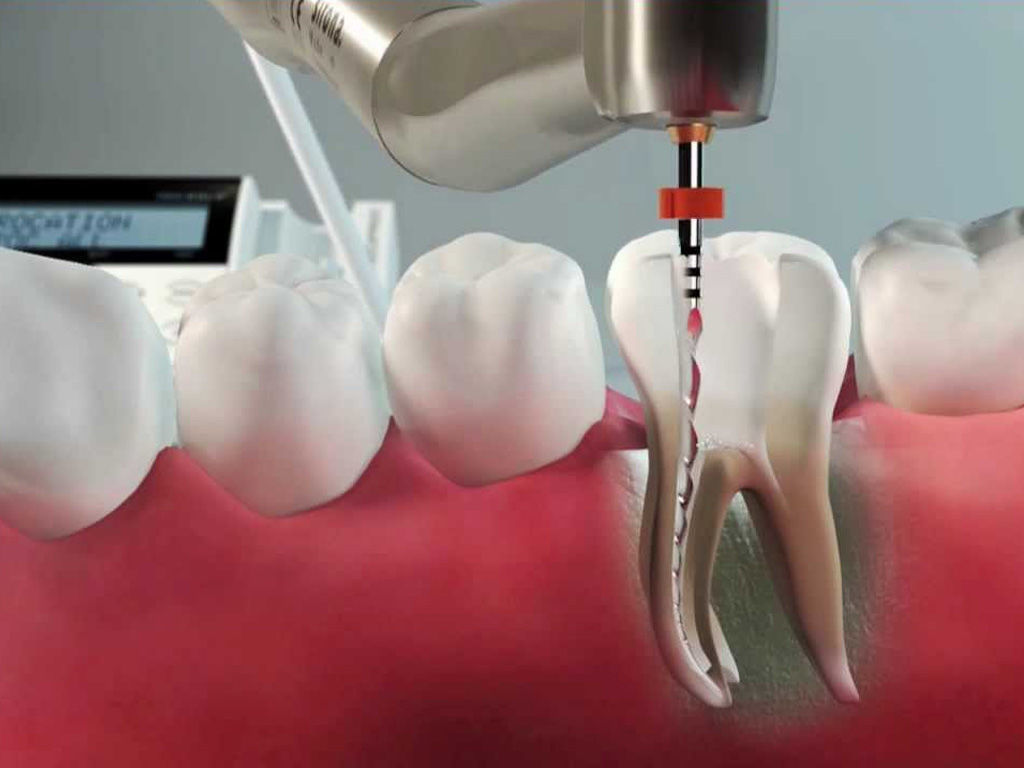
- Общие тесты на биомаркеры эффекта
- Общий анализ крови (CBC) с мазком периферической крови.
- АМК и креатинин.
- Ферменты печени.
- Исследования нервной проводимости (при наличии периферических неврологических симптомов).
- Электрокардиограмма.
- Рентген брюшной полости.
- Рентген грудной клетки.
- Специальные тесты для биомаркеров воздействия
- Ключевым диагностическим лабораторным тестом на недавнее воздействие является измерение содержания мышьяка в моче.
- Лучшим образцом является 24-часовой сбор мочи на мышьяк и креатинин, поскольку он более точно отражает истинное количество выделения мышьяка. (Не все лаборатории регулируют содержание мышьяка на грамм креатинина, которое учитывает разбавление и концентрацию образца).
- Разовые образцы мочи (также на мышьяк и креатинин) могут быть полезны в экстренных случаях. Разовую мочу следует отправить на мышьяк и креатинин.
 Разделив концентрацию мышьяка на граммы креатинина, можно получить разбавление или концентрацию мочи.
Разделив концентрацию мышьяка на граммы креатинина, можно получить разбавление или концентрацию мочи. - Общее содержание мышьяка, превышающее 100 микрограммов (мкг) на литр (л) (мкг/л), считается ненормальным [ATSDR 2007].
- Однако измерение общего содержания мышьяка в моче человека позволяет оценить комбинированное воздействие всех путей воздействия и всех видов мышьяка.
- Поэтому при измерении общего содержания мышьяка в моче важно выяснить, какие морепродукты (двустворчатые моллюски, ракообразные) и морские водоросли употреблялись в пищу в последние 48 часов, поскольку мышьяк из морепродуктов или морских водорослей может значительно повысить общий уровень мышьяка в моче (иногда на несколько тысячи мкг/л после употребления морепродуктов) [Kales et al. 2006]
- Если общий уровень мышьяка в моче высок, а морепродукты считаются возможным источником, может быть рассмотрен запрос на уточнение содержания мышьяка (т.
- Не все лаборатории, выполняющие измерения уровня мышьяка, также выполняют определение состава.
 Если ваша лаборатория не проводит этот тест, вы можете обратиться за этой информацией в местный токсикологический центр.
Если ваша лаборатория не проводит этот тест, вы можете обратиться за этой информацией в местный токсикологический центр. - Если видообразование невозможно, можно прекратить употребление морепродуктов с повторением общего теста на мышьяк в моче через 2 или 3 дня.
- Национальное обследование состояния здоровья и питания (NHANES) (2003-2004) измерило уровни общего мышьяка и определенного мышьяка в моче репрезентативной выборки населения США. Данные отражают относительный фоновый вклад неорганического и связанного с морепродуктами воздействия мышьяка на население США. Результаты биомониторинга с момента публикации обновленных таблиц 2015 г. можно найти по адресу: http://www.cdc.gov/biomonitoring/pdf/FourthReport_UpdatedTables_Feb2015.pdfзначок pdf [PDF – 59.7MB] [CDC 2009, Caldwell et al. 2008].
- Данные NHANES за 2003–2004 годы показывают, что по мере увеличения общего уровня мышьяка в моче с <20 до 20–50 микрограммов на литр и до >50 мкг/л процентное содержание общего мышьяка в моче в большей степени связано с арсенобетаином (мышьяк из рыб), при этом средний процент составляет 62,7% для общего уровня мышьяка в моче > 50 мкг/л [CDC 2009].

- Некоторые исследования предполагают, что небольшой риск для здоровья может быть связан с общим уровнем мочи > 50 мкг/л [ACGIH 2001; ВОЗ 2001 г.; Ценг и др. 2005, Валенсуэла и др. 2005].
- Выводы из данных NHANES за 2003-2004 гг. показывают, что содержание органических соединений мышьяка в образце мочи < 20 мкг/л, вероятно, незначительно [CDC 2009].
- Для всех участников в возрасте старше 6 лет 95-й процентиль для общего содержания мышьяка в моче и суммы мышьяка, связанного с неорганическими соединениями, составил 65,4 и 18,9 мкг/л соответственно [CDC 2009].
- 95-й процентиль подвыборки NHANES за 2003-2004 гг. по сумме неорганических видов мышьяка (18,9 мкг/л) ниже индекса биологического воздействия ACGIH (BEI) для рабочих, содержащих 35 мкг мышьяка на литр (неорганические плюс метилированные метаболиты в моче). измеряется в конце рабочей недели. (Обратите внимание, что BEI — это не значение начала токсичности, а значение скрининга, основанное на неканцерогенных последствиях для здоровья.
 Они были разработаны для лиц, обученных промышленной гигиене, для использования, интерпретации и применения в зависимости от обстоятельств.) [ACGIH 2005]
Они были разработаны для лиц, обученных промышленной гигиене, для использования, интерпретации и применения в зависимости от обстоятельств.) [ACGIH 2005] - Сумма родственных неорганическим веществам является важным верхним эталоном для населения США, поскольку она представляет собой дозу более токсичного неорганического мышьяка, который, скорее всего, поступает с питьевой водой [Caldwell et al. 2008].
- Если 18,9 мкг считается приблизительным суточным воздействием (0,27 мкг/кг/день), то около 95% взрослого населения США, вероятно, будет ниже эталонной дозы Агентства по охране окружающей среды США [EPA 2001] для потребления неорганического мышьяка ( 0,3 мкг/кг/день) [Caldwell et al. 2008.].
- Спустя долгое время после того, как уровни мочи вернулись к исходному уровню, содержание мышьяка в волосах и ногтях может быть единственным признаком воздействия мышьяка.
- Однако, поскольку содержание мышьяка в волосах и ногтях может увеличиваться при внешнем загрязнении, следует проявлять осторожность при использовании содержания мышьяка в этих образцах для диагностики отравления мышьяком.

- Уровни мышьяка в крови, обычно менее 1 мкг на децилитр (мкг/дл) у лиц, не подвергшихся воздействию, менее полезны, чем измерения содержания мышьяка в моче при отслеживании клинического течения случая острого отравления из-за быстрого выведения мышьяка из крови [ATSDR 2007].
- Биомаркеры эффекта
- При подозрении на токсичность мышьяка можно провести несколько тестов для оценки клинического состояния. Если это ненормально, это может помочь подтвердить клиническое подозрение.
- CBC может предоставить доказательства
- анемия, вызванная мышьяком,
- лейкопения,
- тромбоцитопения или
- эозинофилия.
Хотя базофильная зернистость в мазке периферической крови не является специфическим признаком отравления мышьяком, она согласуется с диагнозом.
Трансаминазы печени часто повышены при остром и хроническом воздействии мышьяка и могут помочь подтвердить клиническое подозрение.
При подозрении на нейропатию, связанную с мышьяком, следует провести тесты скорости нервной проводимости. Такие тесты могут изначально показать снижение амплитуды, а также замедление проводимости.
При поражении кожи у пациентов с хроническим воздействием мышьяка может потребоваться биопсия для выявления рака кожи.
Некоторые соединения мышьяка, особенно соединения с низкой растворимостью, рентгеноконтрастны и при проглатывании могут быть видны на рентгенограмме брюшной полости.
Биологические эффекты и эпидемиологические последствия воздействия мышьяка, а также реагенты, которые могут уменьшить повреждение мышьяком in vivo
1. Abdul KS, Jayasinghe SS, Chandana EP, Jayasumana C, De Silva PM. Влияние мышьяка на здоровье человека: обзор. Environ Toxicol Pharmacol. 2015;40:828–46. [PubMed] [Google Scholar]
2. Карагас М.Р., Тостесон Т.Д., Блюм Дж., Моррис Дж.С., Барон Дж.А., Клауэ Б. Дизайн эпидемиологического исследования воздействия мышьяка на питьевую воду и риска рака кожи и мочевого пузыря у населения США. Перспектива охраны окружающей среды. 1998;106:1047–50. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Перспектива охраны окружающей среды. 1998;106:1047–50. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Карлин Д.Дж., Науйокас М.Ф., Брэдхэм К.Д., Кауден Дж., Хикок М., Генри Х.Ф., Ли Дж.С., Томас Д.Дж., Томпсон С., Токар Э.Дж., Ваалкес М.П., Бирнбаум Л.С., Сук В.А. Мышьяк и здоровье окружающей среды: состояние науки и возможности будущих исследований. Перспектива охраны окружающей среды. 2016; 124:890–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
4. Ratnaike RN. Острая и хроническая токсичность мышьяка. Postgrad Med J. 2003; 79: 391–6. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Катцунг Б.Г., Мастерс С.Б., Тревор А.Дж. Фармакологическая экспертиза Катцунга и Тревора и обзор Совета. 12. Макгроу-Хилл; США: 2012. стр. 1017–1019. [Google Scholar]
6. Xu H, Zhou X, Wen X, Lauer FT, Liu KJ, Hudson LG, Aleksunes LM, Burchiel SW. Экологически значимые концентрации арсенита вызывают дозозависимую дифференциальную генотоксичность посредством ингибирования поли(АДФ-рибозы) полимеразы и окислительного стресса в клетках тимуса мыши. Токсикол науч. 2016; 149:31–41. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Токсикол науч. 2016; 149:31–41. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Li Z, Lu Y, Ahmad N, Strebhardt K, Liu X. Опосредованный низкими дозами мышьяка метаболический сдвиг связан с активацией Polo-подобной киназы 1 (Plk1). Клеточный цикл. 2015;14:3030–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Чоудхури С., Гупта П., Гош С., Мукерджи С., Чакраборти П., Чаттерджи У., Чаттопадхай С. Дозозависимая модуляция NF-κB, индуцированная мышьяком. Ось IL-6 в тимоцитах запускает дифференциальные иммунные ответы. Токсикология. 2016; 357–358: 85–96. [PubMed] [Академия Google]
9. Guan H, Li S, Guo Y, Liu X, Yang Y, Guo J, Li S, Zhang C, Shang L, Piao F. Субхроническое воздействие мышьяка подавляет сигнальный путь TH/TRβ1-CaMK IV у мышей Мозжечок. Int J Mol Sci. 2016:17. [Бесплатная статья PMC] [PubMed] [Google Scholar]
10. Tyler CR, Hafez AK, Solomon ER, Allan AM. Воздействие мышьяка в концентрации 50 частей на миллиард в процессе развития влияет на модификации гистонов и связанные с ними эпигенетические механизмы в зависимости от региона и пола в мозге взрослых мышей. Toxicol Appl Pharmacol. 2015; 288:40–51. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Toxicol Appl Pharmacol. 2015; 288:40–51. [Бесплатная статья PMC] [PubMed] [Google Scholar]
11. Адебайо А.О., Зандберген Ф., Козул-Хорват К.Д., Группусо П.А., Гамильтон Дж.В. Хроническое воздействие малых доз мышьяка модулирует экспрессию липогенных генов у мышей. J Biochem Mol Toxicol. 2015; 29:1–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Li B, Giambelli C, Tang B, Winterbottom E, Long J, Jin K, Wang Z, Fei DL, Nguyen DM, Athar M, Wang B, Subbarayan PR, Ван Л. и др. Мышьяк ослабляет передачу сигналов GLI, увеличивая или уменьшая его транскрипционную программу контекстно-зависимым образом. Мол Фармакол. 2016;89: 226–32. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Xu M, Rui D, Yan Y, Xu S, Niu Q, Feng G, Wang Y, Li S, Jing M. Окислительное повреждение, вызванное мышьяком у мышей или Крысы: систематический обзор и метаанализ. Биол Трейс Элем Рез. 2017; 176: 154–175. [PubMed] [Google Scholar]
14. Pi J, Yamauchi H, Kumagai Y, Sun G, Yoshida T, Aikawa H, Hopenhayn-Rich C, Shimojo N. Доказательства индукции окислительного стресса, вызванного хроническим воздействием на жителей Китая. к мышьяку, содержащемуся в питьевой воде. Перспектива охраны окружающей среды. 2002; 110:331–6. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Доказательства индукции окислительного стресса, вызванного хроническим воздействием на жителей Китая. к мышьяку, содержащемуся в питьевой воде. Перспектива охраны окружающей среды. 2002; 110:331–6. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. Sciandrello G, Caradonna F, Mauro M, Barbata G. Вызванное мышьяком гипометилирование ДНК влияет на хромосомную нестабильность в клетках млекопитающих. Канцерогенез. 2004; 25:413–7. [PubMed] [Google Scholar]
16. Кларк С.Дж., Мелки Дж. Метилирование ДНК и молчание генов при раке: кто виноват? Онкоген. 2002;21:5380–7. [PubMed] [Google Scholar]
17. Бхаттачарджи П., Банерджи М., Гири А.К. Роль геномной нестабильности в канцерогенности, вызванной мышьяком. Обзор. Окружающая среда Интерн. 2013;53:29–40. [PubMed] [Google Scholar]
18. Rao CV, Yamada HY. Геномная нестабильность и канцерогенез толстой кишки: с точки зрения генов. Фронт Онкол. 2013;3:130. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Шелк А.Д., Засадил Л.М., Холланд А.Дж., Витре Б., Кливленд Д.В., Уивер Б.А. Скорость хромосомной неправильной сегрегации предсказывает, будет ли анеуплоидия способствовать или подавлять опухоли. Proc Natl Acad Sci U S A. 2013;110:E4134–41. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Шелк А.Д., Засадил Л.М., Холланд А.Дж., Витре Б., Кливленд Д.В., Уивер Б.А. Скорость хромосомной неправильной сегрегации предсказывает, будет ли анеуплоидия способствовать или подавлять опухоли. Proc Natl Acad Sci U S A. 2013;110:E4134–41. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Chou WC, Hawkins AL, Barrett JF, Griffin CA, Dang CV. Ингибирование мышьяком транскрипции теломеразы приводит к генетической нестабильности. Джей Клин Инвест. 2001; 108:1541–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Li Y, Ling M, Xu Y, Wang S, Li Z, Zhou J, Wang X, Liu Q. Репрессивный эффект NF-kappaB на p53 с помощью mot-2 участвует в трансформации кератиноцитов человека, индуцированной низким уровень арсенита. Токсикол науч. 2010; 116: 174–82. [PubMed] [Google Scholar]
22. Peremartí J, Ramos F, Marcos R, Hernandez A. Воздействие мышьяка нарушает нормальную функцию пути восстановления FA/BRCA. Токсикол науч. 2014; 142:93–104. [PubMed] [Google Scholar]
23. Calatayud M, Gimeno-Alcañiz JV, Vélez D, Devesa V. Виды трехвалентного мышьяка вызывают изменения экспрессии и уровней провоспалительных цитокинов в эпителиальных клетках кишечника. Токсикол Летт. 2014; 224:40–6. [PubMed] [Академия Google]
Calatayud M, Gimeno-Alcañiz JV, Vélez D, Devesa V. Виды трехвалентного мышьяка вызывают изменения экспрессии и уровней провоспалительных цитокинов в эпителиальных клетках кишечника. Токсикол Летт. 2014; 224:40–6. [PubMed] [Академия Google]
24. Xu Y, Zhao Y, Xu W, Luo F, Wang B, Li Y, Pang Y, Liu Q. Участие HIF-2α-опосредованного воспаления в индуцированной арсенитом трансформации бронхиальных эпителиальных клеток человека. Toxicol Appl Pharmacol. 2013; 272: 542–50. [PubMed] [Google Scholar]
25. Дас Д., Биндхани Б., Мукерджи Б., Саха Х., Бисвас П., Датта К., Прасад П., Синха Д., Рэй М.Р. Хроническое воздействие мышьяка в малых дозах снижает функцию легких у мужчин без кожных поражений. Int J Общественное здравоохранение. 2014;59:655–63. [PubMed] [Академия Google]
26. Синха Д., Мукерджи Б., Биндхани Б., Датта К., Саха Х., Прасад П., Рэй М.Р. Хроническое воздействие мышьяка в низких концентрациях вызывает легочное и системное воспаление. J Cancer Sci Ther. 2014; 6: 062–069.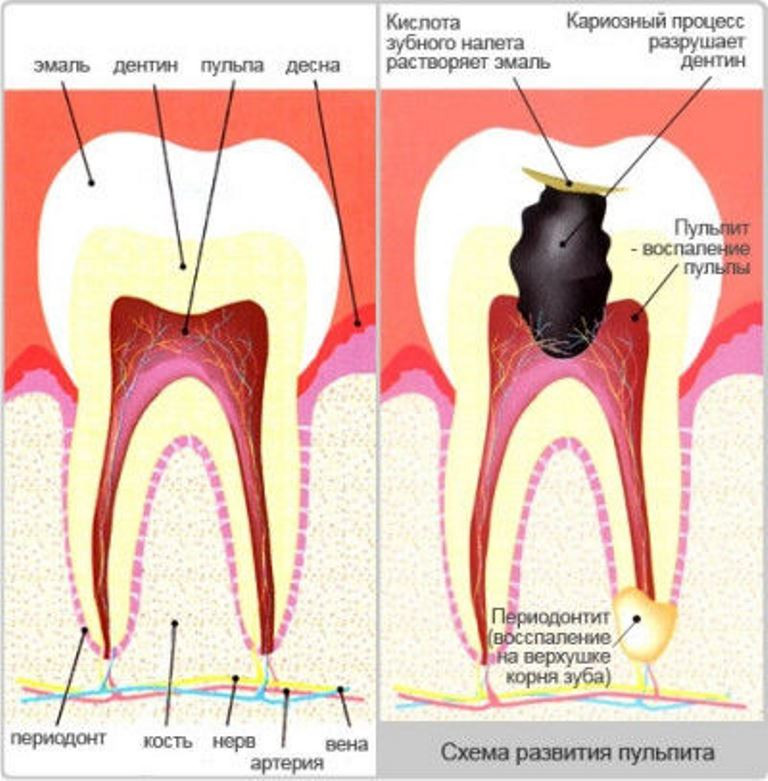 [Google Scholar]
[Google Scholar]
27. Датта К., Прасад П., Синха Д. Хроническое воздействие мышьяка в малых дозах вызывает воспалительные реакции и повреждение ДНК. Int J Hyg Environ Health. 2015; 218: 564–574. [PubMed] [Google Scholar]
28. Ramsey KA, Bosco A, McKenna KL, Carter KW, Elliot JG, Berry LJ, Sly PD, Larcombe AN, Zosky GR. Внутриутробное воздействие мышьяка изменяет развитие легких и гены, связанные с иммунной и мукоцилиарной функцией у мышей. Перспектива охраны окружающей среды. 2013; 121: 244–50. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. Хант К.М., Шривастава Р.К., Элметс К.А., Атар М. Механистическая основа арсеникоза: патогенез рака кожи. Рак Летт. 2014; 354:211–9. [Статья бесплатно PMC] [PubMed] [Google Scholar]
30. Мукерджи С., Дас Д., Дарбар С., Мукерджи М., Дас А.С., Митра С. Триоксид мышьяка вызывает окислительный стресс и токсичность островковых клеток у кролика. Curr Sci. 2004; 86: 854–857. [Google Scholar]
31. Коннелли С., Занкоски К. , Фарах К. Панкреатит, вызванный мышьяком. Представитель Gastrointest Med. 2011;2011:758947. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Фарах К. Панкреатит, вызванный мышьяком. Представитель Gastrointest Med. 2011;2011:758947. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Залога Г.П., Дил Дж., Сперлинг Т., Рихтер Дж., Черноу Б. Необычные проявления отравления мышьяком. Am J Med Sci. 1985; 289: 210–4. [PubMed] [Google Scholar]
33. Yamano T, Yokote T, Akioka T, Hara S, Oka T, Tsuji M, Hanafusa T. [Острый панкреатит при лечении рецидива острого промиелоцитарного лейкоза As2O3]. [Статья на японском языке] Ринсё Кетсуэки. 2006; 47: 23–5. [PubMed] [Google Scholar]
34. Hantson P, Haufroid V, Buchet JP, Mahieu P. Острое отравление мышьяком, лечение внутривенным введением димеркаптоянтарной кислоты (DMSA) и комбинированными методами внепочечной эпурации. J Toxicol Clin Toxicol. 2003;41:1–6. [PubMed] [Академия Google]
35. Мохаммед А., Джанакирам Н.Б., Мадка В., Ли М., Аш А.С., Рао К.В. Современные проблемы и возможности химиопрофилактики рака поджелудочной железы. Курр Мед Хим. 8 февраля 2017 г.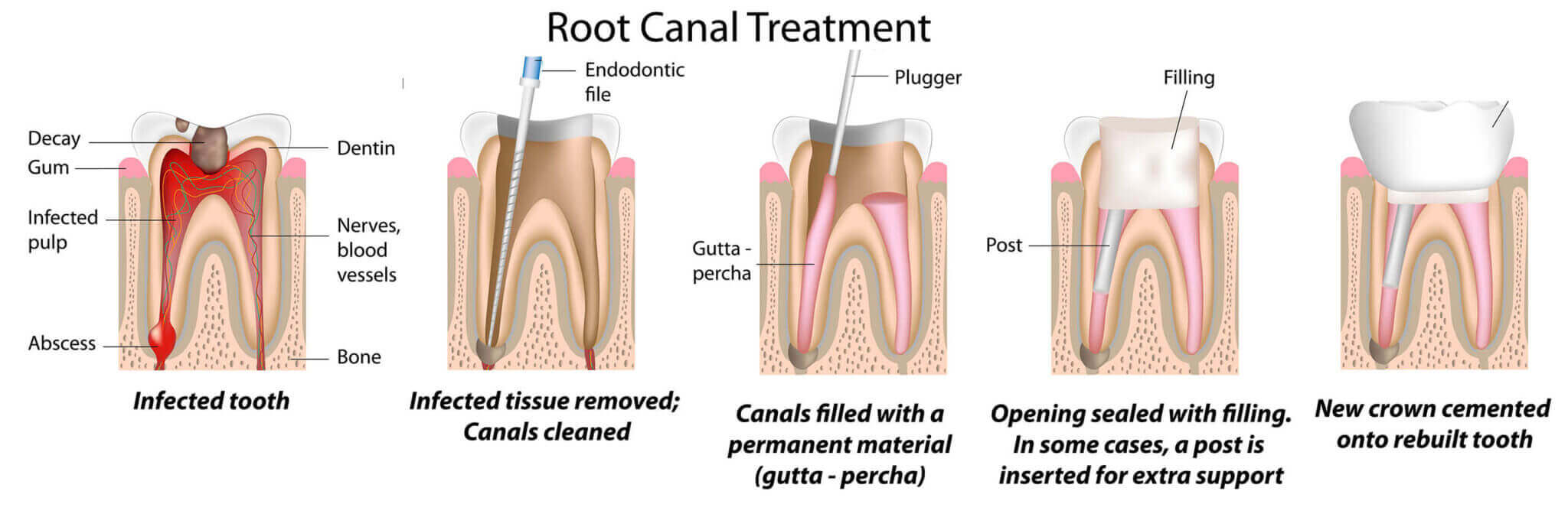 doi: 10.2174/0929867324666170209104453. [Epub перед печатью] [PubMed] [CrossRef] [Google Scholar]
doi: 10.2174/0929867324666170209104453. [Epub перед печатью] [PubMed] [CrossRef] [Google Scholar]
36. Dangleben NL, Skibola CF, Smith MT. Иммунотоксичность мышьяка: обзор. Здоровье окружающей среды. 2013;12:73. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Nadeau KC, Li Z, Farzan S, Koestler D, Robbins D, Fei DL, Malipatlolla M, Maecker H, Enelow R, Korrick S, Karagas MR. Внутриутробное воздействие мышьяка и иммунный репертуар плода в когорте беременных в США. Клин Иммунол. 2014; 155:188–97. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Науйокас М.Ф., Андерсон Б., Ахсан Х., Апосян Х.В., Грациано Дж.Х., Томпсон С., Сук В.А. Широкий спектр последствий для здоровья от хронического воздействия мышьяка: обновленная информация о всемирной проблеме общественного здравоохранения. Перспектива охраны окружающей среды. 2013; 121: 295–302. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Baris D, Waddell R, Beane Freeman LE, Schwenn M, Colt JS, Ayotte JD, Ward MH, Nuckols J, Schned A, Jackson B, Clerkin C, Ротман Н. , Мур Л.Э. и соавт. Повышенный рак мочевого пузыря в Северной Новой Англии: роль питьевой воды и мышьяка. J Natl Cancer Inst. 2016:108. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Мур Л.Э. и соавт. Повышенный рак мочевого пузыря в Северной Новой Англии: роль питьевой воды и мышьяка. J Natl Cancer Inst. 2016:108. [Бесплатная статья PMC] [PubMed] [Google Scholar]
40. Хек Дж. Э., Эндрю А. С., Онега Т., Ригас Дж. Р., Джексон Б. П., Карагас М. Р., Дуэлл Э. Дж. Рак легких у населения США с воздействием мышьяка от низкого до умеренного. Перспектива охраны окружающей среды. 2009; 117:1718–23. [Бесплатная статья PMC] [PubMed] [Google Scholar]
41. Mayer JE, Goldman RH. Мышьяк и рак кожи в США: современные данные о загрязненной мышьяком питьевой воде. Int J Дерматол. 2016; 55:e585–e591. [PubMed] [Google Scholar]
42. Liu-Mares W, Mackinnon JA, Sherman R, Fleming LE, Rocha-Lima C, Hu JJ, Lee DJ. Кластеры рака поджелудочной железы и загрязненные мышьяком колодцы с питьевой водой во Флориде. БМК Рак. 2013;13:111. [Бесплатная статья PMC] [PubMed] [Google Scholar]
43. Ферреччио С., Санча А.М. Воздействие мышьяка и его влияние на здоровье в Чили. J Health Popul Nutr. 2006; 24:164–75. [PubMed] [Google Scholar]
J Health Popul Nutr. 2006; 24:164–75. [PubMed] [Google Scholar]
44. Steinmaus CM, Ferreccio C, Romo JA, Yuan Y, Cortes S, Marshall G, Moore LE, Balmes JR, Liaw J, Golden T, Smith AH. Мышьяк в питьевой воде на севере Чили: высокий риск развития рака через 40 лет после прекращения воздействия. Эпидемиологические биомаркеры рака Prev. 2013; 22: 623–30. [Бесплатная статья PMC] [PubMed] [Google Scholar]
45. Steinmaus C, Ferreccio C, Acevedo J, Yuan Y, Liaw J, Duran V, Cuevas S, García J, Meza R, Valdés R, Valdés G, Benitez H, Вандерлинде В. и др. Увеличение заболеваемости раком легких и мочевого пузыря у взрослых после воздействия мышьяка внутриутробно и в раннем возрасте. Эпидемиологические биомаркеры рака Prev. 2014;23:1529–38. [Бесплатная статья PMC] [PubMed] [Google Scholar]
46. Ferreccio C, Smith AH, Durán V, Barlaro T, Benitez H, Valdés R, Aguirre JJ, Moore LE, Acevedo J, Vásquez MI, Pérez L, Yuan Y, Liaw J и др. Исследование случай-контроль содержания мышьяка в питьевой воде и рака почки в северной части Чили, подвергшейся уникальному воздействию. Am J Эпидемиол. 2013; 178:813–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Am J Эпидемиол. 2013; 178:813–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
47. Ferreccio C, Gonzalez C, Milosavjlevic V, Marshall G, Sancha AM, Smith AH. Рак легких и концентрация мышьяка в питьевой воде в Чили. Эпидемиология. 2000; 11: 673–9.. [PubMed] [Google Scholar]
48. Амарал А.Ф., Порта М., Сильверман Д.Т., Милн Р.Л., Кожевинас М., Ротман Н., Кантор К.П., Джексон Б.П., Пумарега Дж.А., Лопес Т., Каррато А., Гарнер Л., Real FX, и другие. Риск рака поджелудочной железы и уровни микроэлементов. Кишка. 2012;61:1583–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
49. Qiao YL, Taylor PR, Yao SX, Erozan YS, Luo XC, Barrett MJ, Yan QY, Giffen CA, Huang SQ, Maher MM, Forman MR, Tockman РС. Факторы риска и раннее выявление рака легких в когорте китайских добытчиков олова. Энн Эпидемиол. 1997;7:533–41. [PubMed] [Google Scholar]
50. Taylor PR, Qiao YL, Schatzkin A, Yao SX, Lubin J, Mao BL, Rao JY, McAdams M, Xuan XZ, Li JY. Связь воздействия мышьяка с раком легких среди добытчиков олова в провинции Юньнань, Китай.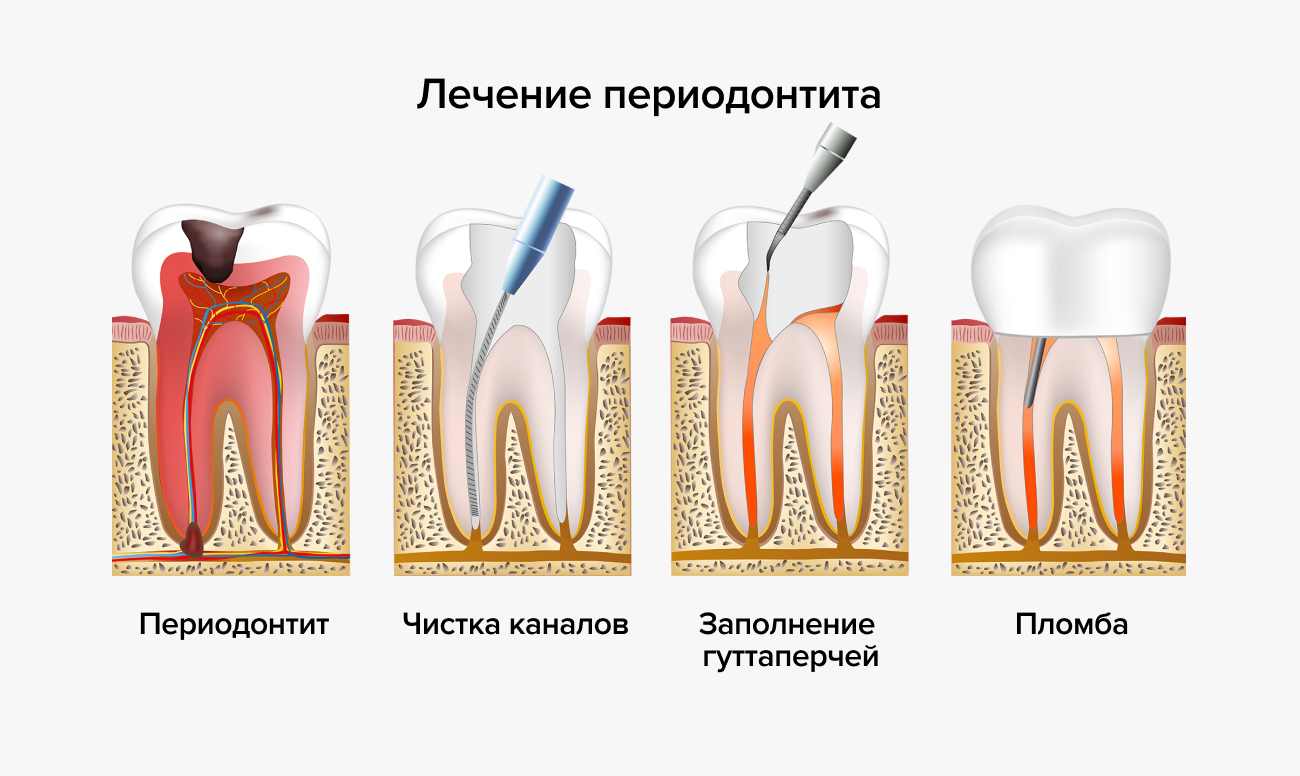 Br J Ind Med. 1989; 46: 881–6. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Br J Ind Med. 1989; 46: 881–6. [Бесплатная статья PMC] [PubMed] [Google Scholar]
51. Хопенхайн-Рич С., Биггс М.Л., Смит А.Х. Смертность от рака легких и почек, связанная с содержанием мышьяка в питьевой воде, в Кордове, Аргентина. Int J Эпидемиол. 1998; 27: 561–9. [PubMed] [Академия Google]
52. Хопенхайн-Рич С., Биггс М.Л., Фукс А., Бергольо Р., Телло Э.Е., Николли Х., Смит А.Х. Смертность от рака мочевого пузыря, связанная с мышьяком в питьевой воде в Аргентине. Эпидемиология. 1996; 7: 117–24. [PubMed] [Google Scholar]
53. Цуда Т., Бабазоно А., Ямамото Э., Куруматани Н., Мино Ю., Огава Т., Киши Ю., Аояма Х. Проглатывание мышьяка и рак внутренних органов: историческое когортное исследование, продолжавшееся 33 года. Am J Эпидемиол. 1995; 141:198–209. [PubMed] [Google Scholar]
54. Yorifuji T, Tsuda T, Doi H, Grandjean P. Избыток рака после воздействия мышьяка из загрязненного сухого молока. Environment Health Prev Med. 2011;16:164–70. [Бесплатная статья PMC] [PubMed] [Google Scholar]
55. Chen Y, Ahsan H. Бремя рака из-за мышьяка в питьевой воде в Бангладеш. Am J Общественное здравоохранение. 2004; 94:741–4. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Chen Y, Ahsan H. Бремя рака из-за мышьяка в питьевой воде в Бангладеш. Am J Общественное здравоохранение. 2004; 94:741–4. [Бесплатная статья PMC] [PubMed] [Google Scholar]
56. Моралес К.Х., Райан Л., Куо Т.Л., Ву М.М., Чен С.Дж. Риск рака внутренних органов из-за мышьяка в питьевой воде. Перспектива охраны окружающей среды. 2000; 108: 655–61. [Бесплатная статья PMC] [PubMed] [Google Scholar]
57. Chen CL, Hsu LI, Chiou HY, Hsueh YM, Chen SY, Wu MM, Chen CJ, Исследовательская группа по изучению болезни черноногих Проглатывание мышьяка, курение сигарет и рак легких риск: последующее исследование в эндемичных по арсениазу районах Тайваня. ДЖАМА. 2004;292: 2984–90. [PubMed] [Google Scholar]
58. Смит А.Х., Хопенхайн-Рич С., Бейтс М.Н., Геден Х.М., Герц-Пиччиотто I, Дагган Х.М., Вуд Р., Коснетт М.Дж., Смит М.Т. Риск рака от мышьяка в питьевой воде. Перспектива охраны окружающей среды. 1992; 97: 259–67. [Бесплатная статья PMC] [PubMed] [Google Scholar]
59. Chen CJ, Chen CW, Wu MM, Kuo TL. Потенциал рака печени, легких, мочевого пузыря и почек из-за попадания неорганического мышьяка в питьевую воду. Бр Дж Рак. 1992; 66: 888–92. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Потенциал рака печени, легких, мочевого пузыря и почек из-за попадания неорганического мышьяка в питьевую воду. Бр Дж Рак. 1992; 66: 888–92. [Бесплатная статья PMC] [PubMed] [Google Scholar]
60. Zhang XW, Yan XJ, Zhou ZR, Yang FF, Wu ZY, Sun HB, Liang WX, Song AX, Lallemand-Breitenbach V, Jeanne M, Zhang QY, Yang HY, Huang QH и др. Триоксид мышьяка контролирует судьбу онкобелка PML-RARalpha, напрямую связывая PML. Наука. 2010;328:240–3. [PubMed] [Google Scholar]
61. Lo-Coco F, Cicconi L, Breccia M. Текущий стандарт лечения острого промиелоцитарного лейкоза у взрослых. Бр Дж Гематол. 2016; 172:841–54. [PubMed] [Google Scholar]
62. Wang ZY, Chen Z. Острый промиелоцитарный лейкоз: от крайне фатального до излечимого. Кровь. 2008;111:2505–2515. [PubMed] [Академия Google]
63. Норсуорти К.Дж., Альтман Дж.К. Оптимальные стратегии лечения острого промиелоцитарного лейкоза высокого риска. Карр Опин Гематол. 2016;23:127–36. [PubMed] [Google Scholar]
64. Фалчи Л., Верстовсек С., Раванди-Кашани Ф., Кантарджян Х.М. Эволюция мышьяка в лечении острого промиелоцитарного лейкоза и других миелоидных новообразований: переход к эффективной пероральной амбулаторной терапии. Рак. 2016; 122:1160–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Фалчи Л., Верстовсек С., Раванди-Кашани Ф., Кантарджян Х.М. Эволюция мышьяка в лечении острого промиелоцитарного лейкоза и других миелоидных новообразований: переход к эффективной пероральной амбулаторной терапии. Рак. 2016; 122:1160–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
65. Li W, Wang M, Wang L, Ji S, Zhang J, Zhang C. Икариин взаимодействует с триоксидом мышьяка для подавления гепатоцеллюлярной карциномы человека. Клеточная биохимия Биофиз. 2014;68:427–36. [PubMed] [Академия Google]
66. Lang M, Wang X, Wang H, Dong J, Lan C, Hao J, Huang C, Li X, Yu M, Yang Y, Yang S, Ren H. Триоксид мышьяка плюс PX-478 обеспечивает эффективное лечение в аденокарцинома протоков поджелудочной железы. Рак Летт. 2016; 378:87–96. [PubMed] [Google Scholar]
67. Национальный институт здравоохранения США (https://clinicaltrials.gov/) (поиск проведен 7 марта 2017 г.)
68. Аламолходаи Н.С., Ширани К., Карими Г. Кардиотоксичность мышьяка: обзор. Environ Toxicol Pharmacol. 2015;40:1005–14. [PubMed] [Академия Google]
2015;40:1005–14. [PubMed] [Академия Google]
69. Эллинсворт, округ Колумбия. Мышьяк, реактивный кислород и эндотелиальная дисфункция. J Pharmacol Exp Ther. 2015; 353:458–64. [PubMed] [Google Scholar]
70. Jyoti U, Kansal SK, Kumar P, Goyal S. Возможная васкулопротекторная роль линаглиптина в отношении дисфункции эндотелия сосудов, вызванной арсенитом натрия. Naunyn Schmiedebergs Arch Pharmacol. 2016; 389: 167–75. [PubMed] [Google Scholar]
71. Нирване А., Павар В., Маджумдар А. Терапевтические вмешательства с использованием комбинации телмисартана и омега-3-жирных кислот при вызванной арсенитом натрия сосудистой эндотелиальной дисфункции у крыс: модуляция с помощью АТФ-чувствительного К+ каналы и eNOS. J Комплемент Интегр Мед. 2015;12:143–51. [PubMed] [Академия Google]
72. Кесаван М., Сарат Т.С., Каннан К., Суреш С., Гупта П., Виджаякаран К., Санкар П., Кураде Н.П., Мишра С.К., Саркар С.Н. Аторвастатин восстанавливает вызванную мышьяком дисфункцию сосудов у крыс: модуляцию передачи сигналов оксида азота и медиаторов воспаления.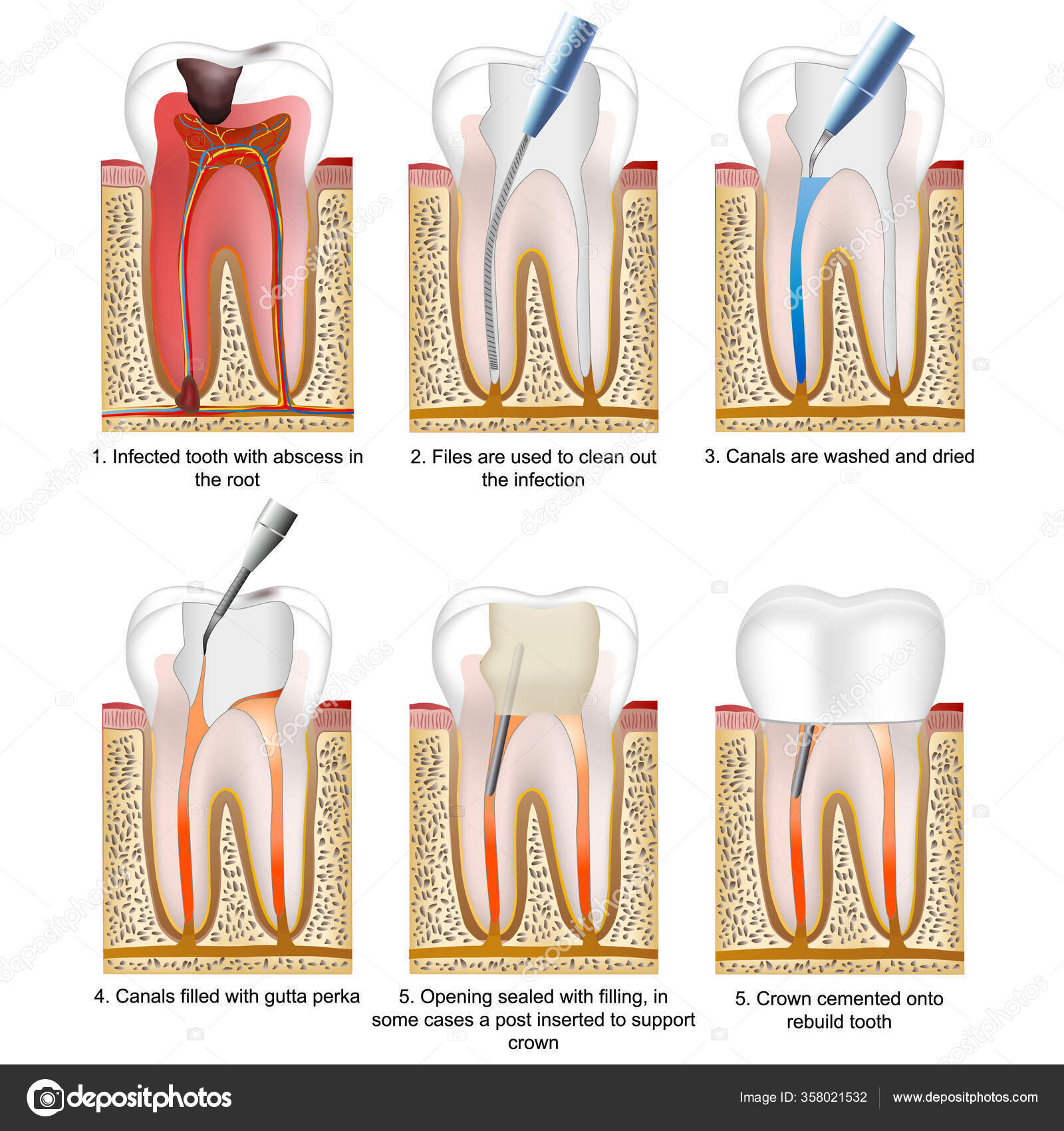 Toxicol Appl Pharmacol. 2014; 280:107–16. [PubMed] [Google Scholar]
Toxicol Appl Pharmacol. 2014; 280:107–16. [PubMed] [Google Scholar]
73. Каур Т., Гоэль Р.К., Балакумар П. Влияние розиглитазона на экспериментальную сосудистую эндотелиальную дисфункцию, вызванную арсенитом натрия. Арч Фарм Рез. 2010;33:611–8. [PubMed] [Академия Google]
74. Верма С., Редди К., Балакумар П. Защитный эффект бенфотиамина при экспериментальной сосудистой эндотелиальной дисфункции, вызванной арсенитом натрия. Биол Трейс Элем Рез. 2010; 137:96–109. [PubMed] [Google Scholar]
75. Андерсен О., Аасет Дж. Обзор подводных камней и прогресса в лечении отравлений металлами хелаторами. J Трейс Элем Мед Биол. 2016; 38:74–80. [PubMed] [Google Scholar]
76. Бейкер Д.Х., Чарнецкий-Молден Г.Л. Фармакологическая роль цистеина в уменьшении или усилении минеральной токсичности. Дж Нутр. 1987;117:1003–10. [PubMed] [Google Scholar]
77. Доминго Дж.Л. Профилактика хелатирующими агентами токсического воздействия металлов на развитие. Репрод Токсикол. 1995; 9: 105–13. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
78. Kosnett MJ. Роль хелаторов в лечении отравлений мышьяком и ртутью. J Med Toxicol. 2013;9:347–354. [Бесплатная статья PMC] [PubMed] [Google Scholar]
79. Guha Mazumder DN, Ghoshal UC, Saha J, Santra A, De BK, Chatterjee A, Dutta S, Angle CR, Centeno JA. Рандомизированное плацебо-контролируемое исследование 2,3-димеркаптоянтарной кислоты в терапии хронического арсеникоза, вызванного употреблением загрязненных мышьяком грунтовых вод. J Toxicol Clin Toxicol. 1998;36:683–90. [PubMed] [Google Scholar]
80. Гуха Мазумдер Д.Н., Де Б.К., Сантра А., Гош Н., Дас С., Лахири С., Дас Т. Рандомизированное плацебо-контролируемое исследование 2,3-димеркапто-1-пропансульфоната (DMPS). ) при лечении хронического арсеникоза из-за употребления загрязненной мышьяком воды. J Toxicol Clin Toxicol. 2001; 39: 665–74. [PubMed] [Google Scholar]
81. Kadirvel R, Sundaram K, Mani S, Samuel S, Elango N, Panneerselvam C. Добавление аскорбиновой кислоты и альфа-токоферола предотвращает вызванное мышьяком окисление белка и повреждение ДНК, вызванное мышьяком в крысы.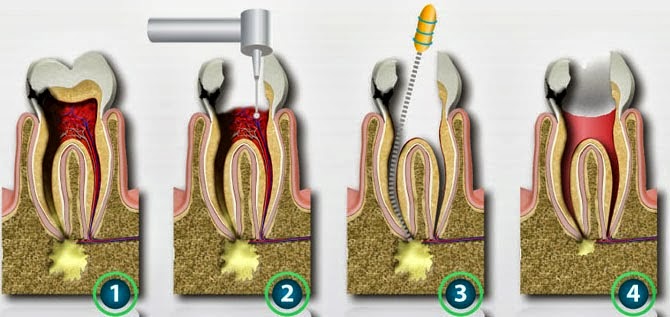 Hum Exp Toxicol. 2007;26:939–46. [PubMed] [Google Scholar]
Hum Exp Toxicol. 2007;26:939–46. [PubMed] [Google Scholar]
82. Мукерджи С., Дас Д., Мукерджи М., Дас А.С., Митра С. Синергетический эффект фолиевой кислоты и витамина B12 в уменьшении вызванного мышьяком окислительного повреждения ткани поджелудочной железы крысы. Дж. Нутр Биохим. 2006; 17: 319–27. [PubMed] [Google Scholar]
83. Пауэлл С.Р. Антиоксидантные свойства цинка. Дж Нутр. 2000; 130:1447С–54С. [PubMed] [Google Scholar]
84. Кумар А., Малхотра А., Наир П., Гарг М., Дхаван Д.К. Защитная роль цинка в уменьшении вызванного мышьяком окислительного стресса и гистологических изменений в печени крыс. J Environ Pathol Toxicol Oncol. 2010;29: 91–100. [PubMed] [Google Scholar]
85. Ахмад М., Вадаа М.А., Фарук М., Дагестанский М.Х., Сами А.С. Эффективность цинка в модулировании перинатальных эффектов мышьяка на тератологические эффекты у потомства мышей. Биол рез. 2013;46:131–8. [PubMed] [Google Scholar]
86. Xu Z, Wang Z, Li JJ, Chen C, Zhang PC, Dong L, Chen JH, Chen Q, Zhang XT, Wang ZL. Защитное действие селена на окислительное повреждение и экспрессию генов, связанных с окислительным стрессом, в печени крыс при хроническом отравлении мышьяком. Пищевая химическая токсикол. 2013; 58:1–7. [PubMed] [Академия Google]
Защитное действие селена на окислительное повреждение и экспрессию генов, связанных с окислительным стрессом, в печени крыс при хроническом отравлении мышьяком. Пищевая химическая токсикол. 2013; 58:1–7. [PubMed] [Академия Google]
87. Ван Д., Линь Л., Ли С., Сун Г.Ф. Влияние глутатиона на метаболизм in vivo и окислительный стресс мышьяка у мышей. J Toxicol Sci. 2015;40:577–83. [PubMed] [Google Scholar]
88. Ramírez T, Stopper H, Hock R, Herrera LA. Предотвращение анеуплоидии с помощью S-аденозилметионина в клетках человека, обработанных арсенитом натрия. Мутат Рез. 2007; 617:16–22. [PubMed] [Google Scholar]
89. Zhang J, Pan X, Li N, Li X, Wang Y, Liu X, Yin X, Yu Z. Экстракт виноградных косточек ослабляет вызванную мышьяком нефротоксичность у крыс. Эксперт Тер Мед. 2014;7:260–266. [Бесплатная статья PMC] [PubMed] [Google Scholar]
90. Синха Д., Рой М. Антагонистическая роль чая в отношении индуцированного арсенитом натрия окислительного повреждения ДНК и ингибирования восстановления ДНК у швейцарских мышей-альбиносов. J Environ Pathol Toxicol Oncol. 2011;30:311–22. [PubMed] [Google Scholar]
J Environ Pathol Toxicol Oncol. 2011;30:311–22. [PubMed] [Google Scholar]
91. Синха Д., Рой С., Рой М. Антиоксидантный потенциал чая снижает вызванный арсенитом окислительный стресс у мышей-альбиносов Swiss. Пищевая химическая токсикол. 2010;48:1032–9. [PubMed] [Google Scholar]
92. Патра М., Гальдер А., Бховмик Н., Де М. Использование черного чая для модуляции кластогенных эффектов мышьяка у мышей in vivo. J Environ Pathol Toxicol Oncol. 2005; 24:201–10. [PubMed] [Академия Google]
93. Саркози К., Папп А., Хорват Э., Мате З., Ференц А., Гермес Э., Криш Дж., Паулик Э., Сабо А. Зеленый чай и витамин С улучшают некоторые нейрофункциональные и биохимические признаки отравления мышьяком у крыс. Нутр Невроски. 2016;19:102–9. [PubMed] [Google Scholar]
94. Yu M, Xue J, Li Y, Zhang W, Ma D, Liu L, Zhang Z. Ресвератрол защищает от нефротоксичности, вызванной триоксидом мышьяка, облегчая метаболизм мышьяка и уменьшая окислительный стресс. Арх Токсикол. 2013;87:1025–35. [PubMed] [Академия Google]
[PubMed] [Академия Google]
95. Fan Y, Chen M, Meng J, Yu L, Tu Y, Wan L, Fang K, Zhu W. Триоксид мышьяка и ресвератрол проявляют синергическую антилейкемическую активность и нейтрализуют кардиотоксичность. ПЛОС Один. 2014;9:e105890. [Бесплатная статья PMC] [PubMed] [Google Scholar]
96. Гош А., Мандал А.К., Саркар С., Дас Н. Гепатопротекторная и нейропротекторная активность липосомального кверцетина в борьбе с хроническим индуцированным мышьяком окислительным повреждением печени и мозга крыс. Наркотик Делив. 2011;18:451–9. [PubMed] [Академия Google]
97. Bongiovanni GA, Soria EA, Eynard AR. Влияние растительных флавоноидов силимарина и кверцетина на вызванный арсенитом окислительный стресс в клетках CHO-K1. Пищевая химическая токсикол. 2007;45:971–6. [PubMed] [Google Scholar]
98. Джахан С., Ифтихар Н., Улла Х., Рух Г., Хуссейн И. Смягчающее действие кверцетина на семенники крыс против мышьяка: гистологическое и биохимическое исследование. Сист Биол Репрод Мед.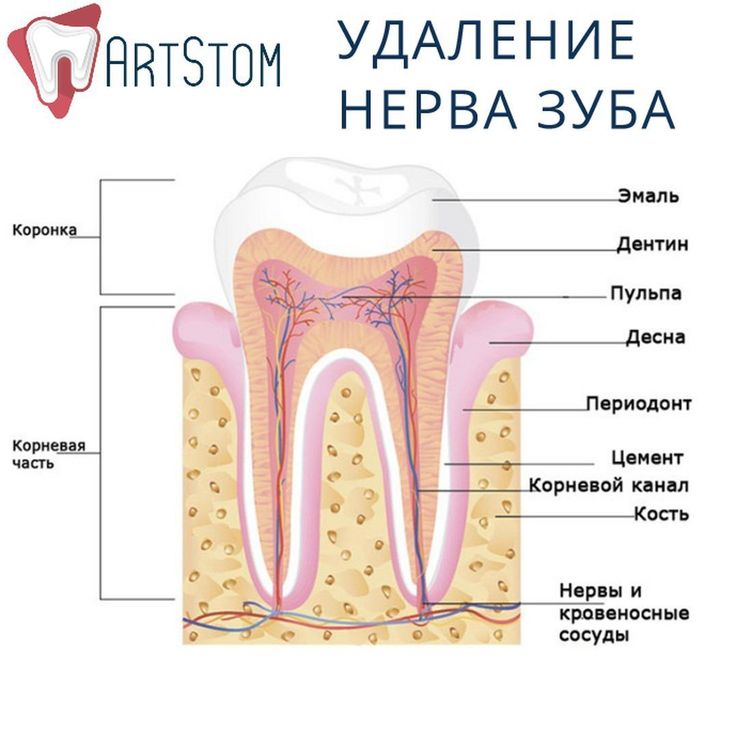 2015;61:89–95. [PubMed] [Google Scholar]
2015;61:89–95. [PubMed] [Google Scholar]
99. Gao S, Duan X, Wang X, Dong D, Liu D, Li X, Sun G, Li B. Куркумин ослабляет вызванные мышьяком повреждения печени и окислительный стресс у экспериментальных мышей посредством активации. пути Nrf2, стимулирование метилирования мышьяка и экскреции с мочой. Пищевая химическая токсикол. 2013;59: 739–47. [PubMed] [Google Scholar]
100. Эль-Демердаш FM, Юсеф М.И., Радван FM. Улучшающее действие куркумина на индуцированное арсенитом натрия окислительное повреждение и перекисное окисление липидов в различных органах крыс. Пищевая химическая токсикол. 2009; 47: 249–54. [PubMed] [Google Scholar]
101. Бисвас Дж., Синха Д., Мукерджи С., Рой С., Сиддики М., Рой М. Куркумин защищает ДНК от повреждений у жителей Западной Бенгалии, постоянно подвергающихся воздействию мышьяка. Hum Exp Toxicol. 2010; 29: 513–24. [PubMed] [Академия Google]
102. Пуджан С., Кумар С., Верма В., Дасмана А., Лохани М., Верма М.К. Нарушение гомеостаза стволовых клеток кожи после трансплацентарного арсеникоза; Облегчение за счет комбинированного приема селена и куркумина.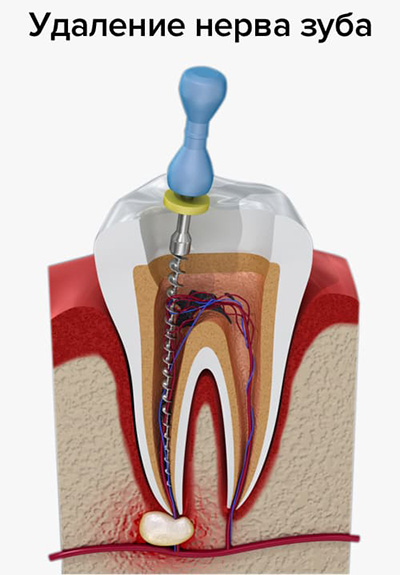 ПЛОС Один. 2015;10:e0142818. [Бесплатная статья PMC] [PubMed] [Google Scholar]
ПЛОС Один. 2015;10:e0142818. [Бесплатная статья PMC] [PubMed] [Google Scholar]
103. Чоудхури С., Гош С., Мукерджи С., Гупта П., Бхаттачарья С., Адхикари А., Чаттопадхьяй С. Гранат защищает от вызванного мышьяком p53-зависимого воспаления, опосредованного АФК. и апоптоз в клетках печени. Дж. Нутр Биохим. 2016;38:25–40. [PubMed] [Академия Google]
104. Шафик Н.М., Эль Батш М.М. Защитные эффекты комбинированного лечения селеном и Punica granatum на некоторые маркеры воспалительного и окислительного стресса при гепатотоксичности, вызванной мышьяком, у крыс. Биол Трейс Элем Рез. 2016; 169:121–8. [PubMed] [Google Scholar]
105. Самаддер А., Дас Дж., Дас С., Худа-Бухш А.Р. Дигидрокси-изостевиол-метиловый эфир, активный биологический компонент Pulsatilla nigricans, уменьшает вызванную мышьяком клеточную дисфункцию в семенниках самцов мышей. Environ Toxicol Pharmacol. 2012; 34: 743–52. [PubMed] [Академия Google]
106. Дас Дж., Гош Дж., Манна П., Синха М., Сил П.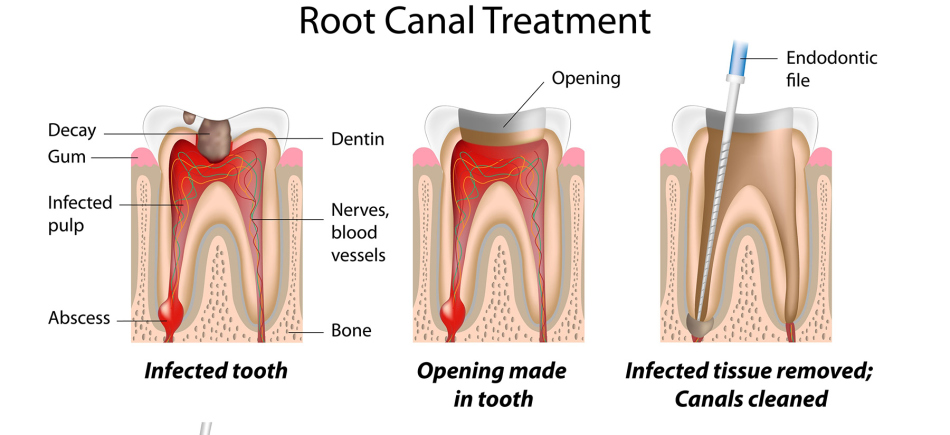 С. Таурин защищает семенники крыс от вызванного NaAsO(2) окислительного стресса и апоптоза через митохондриально-зависимые и независимые пути. Токсикол Летт. 2009; 187: 201–10. [PubMed] [Google Scholar]
С. Таурин защищает семенники крыс от вызванного NaAsO(2) окислительного стресса и апоптоза через митохондриально-зависимые и независимые пути. Токсикол Летт. 2009; 187: 201–10. [PubMed] [Google Scholar]
107. Сепанд М.Р., Разави-Азархиави К., Омиди А., Зирак М.Р., Сабзевари С., Каземи А.Р., Сабзевари О. Влияние ацетил-L-карнитина на антиоксидантный статус, перекисное окисление липидов и окислительные процессы. Вред мышьяка у крыс. Биол Трейс Элем Рез. 2016; 171:107–15. [PubMed] [Академия Google]
108. Рана Т., Бера А.К., Дас С., Бхаттачарья Д., Пан Д., Бандйопадхьяй С., Мондал Д.К., Саманта С., Бандйопадхьяй С., Дас С.К. Лектин Pleurotus florida нормализует зависимые от длительности реакции печени на окислительный стресс, вызванные мышьяком у крыс. Опыт Токсикол Патол. 2012; 64: 665–71. [PubMed] [Google Scholar]
109. Диксит С., Дхар П., Мехра Р.Д. Защитная роль экзогенной α-липоевой кислоты (АЛК) на антиоксидантный статус гиппокампа и функцию памяти у крысят, подвергшихся воздействию арсенита натрия в раннем постнатальном периоде. Токсикомеханические методы. 2011;21:216–24. [PubMed] [Академия Google]
Токсикомеханические методы. 2011;21:216–24. [PubMed] [Академия Google]
110. Биомаркеры в оценке рисков: достоверность и валидация. Всемирная организация здравоохранения; Женева: 2001. [Google Scholar]
111. Zhang J, Shen H, Xu W, Xia Y, Barr DB, Mu X, Wang X, Liu L, Huang Q, Tian M. Метаболомика мочи выявила внутреннюю дозозависимую связь мышьяка. метаболические изменения: экспериментальное исследование среди китайских мужчин. Технологии экологических наук. 2014;48:12265–74. [Бесплатная статья PMC] [PubMed] [Google Scholar]
112. Оливас-Кальдерон Э., Ресио-Вега Р., Гандольфи А.Дж., Ланц Р.С., Гонсалес-Кортес Т., Гонсалес-Де Альба С., Фройнс Дж. Р., Эспиноса-Фематт Дж. А. . Биомаркеры воспаления легких и функция легких у детей, хронически подвергающихся воздействию мышьяка. Toxicol Appl Pharmacol. 2015; 287:161–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
113. Halatek T, Sinczuk-Walczak H, Janasik B, Trzcinka-Ochocka M, Winnicka R, Wasowicz W. Воздействие на здоровье и виды мышьяка в моче рабочих медеплавильного завода. J Environ Sci Health A Tox Hazard Subst Environ Eng. 2014;49:787–97. [PubMed] [Google Scholar]
J Environ Sci Health A Tox Hazard Subst Environ Eng. 2014;49:787–97. [PubMed] [Google Scholar]
114. Rager JE, Bailey KA, Smeester L, Miller SK, Parker JS, Laine JE, Drobná Z, Currier J, Douillet C, Olshan AF, Rubio-Andrade M, Stýblo M, García -Варгас Г. и др. Пренатальное воздействие мышьяка и эпигеном: измененные микроРНК, связанные с передачей сигналов врожденного и адаптивного иммунитета в пуповинной крови новорожденных. Энвайрон Мол Мутаген. 2014;55:196–208. [Бесплатная статья PMC] [PubMed] [Google Scholar]
115. Chou WC, Chung YT, Chen HY, Wang CJ, Ying TH, Chuang CY, Tseng YC, Wang SL. Воздействие мышьяка на мать и биомаркеры повреждения ДНК, а также связь с исходами родов у населения Тайваня в целом. ПЛОС Один. 2014;9:e86398. [Бесплатная статья PMC] [PubMed] [Google Scholar]
116. Ислам М.С., Моханто Н.К., Карим М.Р., Актар С., Хок М.М., Рахман А., Джахан М., Хатун Р., Азиз А., Салам К.А., Сауд З.А., Хоссейн М., Рахман А. и др. Повышенные концентрации сывороточной матриксной металлопротеиназы-2 и -9и их связи с циркулирующими маркерами сердечно-сосудистых заболеваний у лиц, постоянно подвергающихся воздействию мышьяка.
