Флюс (периостит) на десне – лечение без осложнений
Как распознать периостит
Самые яркие признаки флюса — отёк и пульсирующая боль в районе воспаления, которая усиливается при давлении на зуб. Со временем болевые ощущения не поддаются обезболивающим средствам, щека и челюсть со стороны воспаления опухают, десна становится красной, боль может отдавать в глаз, ухо или горло (трудно глотать, поворачивать шею), температура тела повышается, увеличиваются лимфатические узлы, ощущается слабость в организме.
Причины воспаления:
- запущенный или недолеченный кариес — наиболее частая причина;
- стоматологическое вмешательство — флюс после удаления зуба, некачественного лечения;
- гайморит;
- ангина;
- переохлаждение;
- инфекции и травмы зубов и дёсен;
- недостаточная гигиена;
-
болезни полости рта — пародонтит, пульпит, гингивит и другие.

Как вылечить флюс
При периостите ни о каком домашнем лечении не может быть речи. Требуется оперативная медицинская помощь. Домашние методы лечения в лучшем случае ненадолго ослабят симптомы, в худшем — ускорят течение воспаления. Категорически запрещено нагревать участок поражения (так гной быстрее распространяется), принимать антибиотики и обезболивающие без назначения врача (есть риск кровотечения). Если игнорировать проблему, можно добиться сепсиса — заражения крови — и даже летального исхода.
В клинике врач проводит осмотр, консультацию, при необходимости назначает рентген и анализ крови для определения степени распространения заболевания и уровня лейкоцитов. Если пациент обратился за помощью на ранней стадии периостита, специалист назначает терапевтическое лечение. Это — приём антибиотиков и противовоспалительных препаратов, которые уничтожают возбудителей заболевания.
Далее следует период реабилитации: приём антибиотиков, иммуномодуляторов, полоскания с использованием антисептиков. В течение 3-4 суток — наблюдение за состоянием полости рта. Если за это время симптомы не ослабнут, и отёк не сойдёт, необходимо повторно обратиться к врачу. При разрушении коронки зуба более чем на 50%, а также в случае рецидива периостита зуб придётся удалить.
Чем опасен периостит, и как его избежать
Причины заболевания не появляются за один день, а копятся в организме в течение нескольких месяцев или лет. Поэтому противостоять появлению флюса зуба у взрослого человека очень просто:
-
Проходите плановый осмотр стоматолога раз в 6 месяцев.
 Так вы сможете выявить патологии и аномалии полости рта в зачатке и простыми процедурами предотвратить их преобразование во флюс.
Так вы сможете выявить патологии и аномалии полости рта в зачатке и простыми процедурами предотвратить их преобразование во флюс. - Пользуйтесь услугой профессиональной гигиены полости рта раз в полгода. Зубной камень и твёрдый налёт нельзя удалить в домашних условиях, при этом они становятся причиной многих заболеваний полости рта.
- Потребляйте больше овощей и фруктов. Они снабжают организм полезными веществами, а также проводят механическую чистку зубов и межзубных пространств в процессе пережёвывания.
Возможные осложнения периостита при отсутствии лечения: сепсис, менингит, абсцесс, флегмона, остеомиелит и другие, вплоть до попадания в отделение челюстно-лицевой хирургии.
Любое заболевание, в том числе и флюс на десне, проще предотвратить, чем лечить. Если же воспалительный процесс начался, не полагайтесь на народные методы и самостоятельное лечение. Гнойное образование не пропадёт самостоятельно, только качественное медицинское вмешательство поможет устранить воспаление и избежать серьёзных последствий.
Гнойное образование не пропадёт самостоятельно, только качественное медицинское вмешательство поможет устранить воспаление и избежать серьёзных последствий.
Лечение флюса в стоматологической клинике «Rudomin» в Москве
Флюс или периостит — это воспалительный процесс в надкостнице зуба. Чаще всего инфекция развивается, когда в карманы десны или внутрь зуба попадают остатки пищи. Результат разложения — скопление большого количества гноя, отек тканей, пульсирующая боль, а также повышение температуры в особо запущенных случаях. Еще одна причина возникновения периостита — запущенный кариес.
Стадии периостита и методы лечения флюса
Чем менее запущено воспаление, тем легче будет лечение периостита зуба, цена на которое также зависит от стадии заболевания. Есть три стадии развития периостита:
- Начальная стадия флюса.
- Воспаление с гноем и отеком.
- Проникновение инфекции в глубокие ткани и их разложение.
В первом случае врач пропишет пациенту антибиотики и противовоспалительные препараты. Иногда на ранних стадиях этого будет достаточно чтобы убрать инфекцию, после этого специалист сможет заняться лечением кариеса или чисткой карманов десны.
Иногда на ранних стадиях этого будет достаточно чтобы убрать инфекцию, после этого специалист сможет заняться лечением кариеса или чисткой карманов десны.
Во втором случае очаг воспаления обязательно вскрывают и тщательно обрабатывают антисептиком. При большом количестве гноя в рану вставляется дренаж. Он помогает тканям не затянуться раньше времени. Если проигнорировать данный нюанс, есть риск повторного флюса, стоимость лечения в таком случае возрастет, поэтому наши врачи предпримут все для сохранения здоровья зуба и полости рта каждого пациента.
В третьем случае не обойтись без хирургического вмешательства. После процедуры доктор назначит антибиотики для предотвращения распространения инфекции и обработку полости рта специальными растворами. Если операция была серьезной, дальнейшие физиотерапевтические процедуры помогут быстрее восстановить здоровье. Например, йодно-калиевый электрофорез помогает быстрее восстановить поврежденные ткани, уменьшить неприятные ощущения.
Цена на лечение флюса в клинике
Какая будет цена на лечение периостита, сможет ответить доктор на консультации и при осмотре.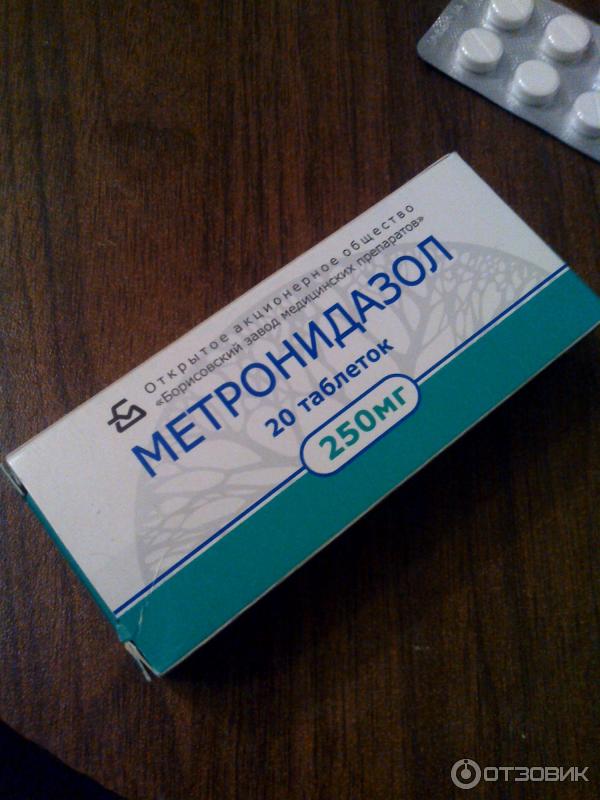 Наша стоматология предлагает устранить флюс, провести лечение, цена будет низкой. Чтобы периостит не вернулся, врачи требуют соблюдения правил после операционного вмешательства:
Наша стоматология предлагает устранить флюс, провести лечение, цена будет низкой. Чтобы периостит не вернулся, врачи требуют соблюдения правил после операционного вмешательства:
- Не согревать и не переохлаждать полость рта.
- Не пить горячий чая или холодные напитки.
- Антибиотики нужно принимать до конца, бросать на середине курса нельзя.
- Пока рана не заживет, нельзя принимать аспирин и лекарства, содержащие его.
- Интенсивная боль через 8 часов после операции — прямой повод немедленно приехать на осмотр.
В качестве дальнейшей профилактики рекомендуется посещать стоматолога 2 раза в год, употреблять твердые фрукты и овощи для естественного массажа дёсен, тщательно следить за гигиеной полости рта и регулярно удалять камни.
Лечение флюса в Москве
Нельзя откладывать лечение флюса, цена за это может быть слишком высокой. Например, воспаление может затронуть более глубокие ткани, что приведет к необходимости проведения серьезной операции.
Наша клиника обладает следующими преимуществами:
- Самая низкая цена на лечение флюса в Москве.
- Опытные специалисты с многолетним стажем работы.
- Лечение всех видов заболеваний.
- Новейшая аппаратура для установки точного диагноза.
- Уют и комфорт для каждого пациента.
- В штате есть детские стоматологи.
Записаться на прием можно по телефону или воспользоваться онлайн-формой на сайте. После отправки контактных данных, наш сотрудник сам перезвонит для уточнения деталей заявки.
Быстрое лечение флюса (периостита). Стоимость
Хирургическое лечение периостита
Хирургическое лечение периостита может проводиться с сохранением или удалением зуба, который стал источником воспаления. Лечение проводят под местной анестезией или с применением общего наркоза.
- Если пациент обратился в начальной (серозной) стадии заболевания, лечение заключается в устранении основной причины возникновения флюса ‒ пульпита или периодонтита.
 Врач выполняет депульпирование или распломбировку ранее запломбированных каналов, проводит их очистку от некротического содержимого. Назначает противовоспалительную терапию;
Врач выполняет депульпирование или распломбировку ранее запломбированных каналов, проводит их очистку от некротического содержимого. Назначает противовоспалительную терапию; - При выраженном гнойном воспалении хирург вскрывает очаг нагноения. После вскрытия пациенту дают прополоскать рот бледно-розовым раствором калия перманганата (марганцовки) или 1% раствором натрия гидрокарбоната (пищевой соды), затем рана промывается 0,05% раствором хлоргексидина;
- Следующий этап – создание условий для оттока гнойного экссудата (выделений). Для этого в разрез, образовавшийся после вскрытия абсцесса, устанавливают дренаж – полоску из тонкой резины, которая препятствует слипанию краев раны и обеспечивает свободный отток гноя. После полного отхождения гноя и ликвидации воспалительного процесса разрез ушивается;
- После того, как полностью устранены признаки воспаления, приступают к лечению зуба: проводят лечение хронического периодонтита, пломбируют каналы, ставят временную, а затем постоянную пломбу;
- В некоторых случаях, когда нет смысла или возможности распломбировать каналы (если установлены коронки или внутриканальный штифт), после выполнения разреза на десне и ликвидации воспаления проводят резекцию верхушки корня.
 Этот способ лечения хронического периодонтита применяют при наличии на верхушке корня зуба кисты или гранулемы.
Этот способ лечения хронического периодонтита применяют при наличии на верхушке корня зуба кисты или гранулемы.
Блок быстрых: миркоскоп, периодонтит, пульпить, резекция, имплантация, имплантация по шаблонам
С удалением зуба
Если зуб-источник инфекции сильно разрушен и не подлежит восстановлению, проводят его удаление с одновременным вскрытием гнойного абсцесса. Разрез выполняют на протяжении трех зубов, рану дренируют. Удаление больного зуба приводит к быстрому затиханию воспалительного процесса и выздоровлению.
На второй день после операции пациент должен прийти на перевязку, во время которой проводится местное лечение раны.
Медикаментозное лечение периостита
Следующий этап после хирургического вмешательства — медикаментозное лечение. Приведенная ниже информация носит исключительно описательный характер. Назначение препарата осуществляется только лечащим врачом с учетом аллергостатуса и индивидуальных особенностей организма. Для внутреннего приема могут быть рекомендованы:
Для внутреннего приема могут быть рекомендованы:
- Антибактериальные средства – антибиотики широкого спектра действия, метронидазол. Их назначение необходимо, так как воспаление при периостите всегда вызвано различными видами стафилококков и стрептококков, нередко – гнилостными бактериями.
- Нестероидные противовоспалительные средства – помогают уменьшить степень воспаления, устранить болевые ощущения. Это препараты, в состав которых входят парацетамол, ибупрофен, нимесулид, кеторолак.
- Витаминные препараты – для ускорения восстановления тканей требуется повышенное количество витамина C (аскорбиновой кислоты). Эффективен прием витаминно-минеральных комплексов, например, Супрадин, Компливит и других, аналогичных им.
- Антигистаминные (противоаллергические) препараты – помогают устранить признаки микробной сенсибилизации, уменьшить отечность тканей. Назначают Диазолин, Супрастин и т.
 п.
п. - Седативные (успокоительные) лекарственные средства – назначают пациентам, у которых на фоне заболевания наблюдаются раздражительность и нарушения сна. Это могут быть экстракты пустырника, валерианы, пассифлоры.
Наружное лечение периостита после оперативного вмешательства направлено на удаление гноя и снижение уровня воспаления. Для этого проводят полоскания слабым раствором перманганата калия, 0,02% водным раствором фурацилина, содо-солевым раствором, 0,05% раствором хлоргексидина, настоями календулы, шалфея и ромашки аптечной. Растворы для полоскания должны быть теплыми, применение горячих растворов приводит к развитию застойных явлений в области воспаления.
Во время перевязок для ускорения заживления используют мазевые повязки с маслом облепихи и шиповника, антибиотиками.
Физиотерапевтическое лечение (нажмите, чтобы раскрыть)- Облучение гелий-неоновым лазером – излучение стимулирует регенерационные процессы, улучшает кровообращение в тканях, способствует очищению ран от патогенной микрофлоры.

- Облучение ультрафиолетовыми лучами – УФ-излучение оказывает противовоспалительное, бактерицидное действие, стимулирует клеточные биохимические процессы.
- Гальванизация – процедуру назначают, когда рана, образовавшаяся после вскрытия абсцесса, начала заживать. Гальванический ток улучшает обменные процессы в тканях, ускоряет заживление и предотвращает грубое рубцевание тканей.
- УВЧ-терапия – применяется при наличии регионарного лимфаденита, так как состояние угрожает переходом в самостоятельное заболевание, что значительно удлиняет период выздоровления пациента. Также УВЧ-терапию назначают на область верхнечелюстного синуса для предупреждения развития острого гайморита, если был диагностирован острый периостит коренных и малых коренных зубов верхней челюсти.
- Электрофорез – процедуру проводят с 1-2% раствором калия йодида. Калия йодид улучшает процессы резорбции (рассасывания) при наличии воспалительных экссудатов, улучшает регенерацию тканей.
 Особенно активно электрофорез применятся для лечения лимфаденита, возникшего как осложнение острого периостита.
Особенно активно электрофорез применятся для лечения лимфаденита, возникшего как осложнение острого периостита.
Лечебная физкультура
Лечебную физкультуру назначают в случае нарушения функции мышц лица, которое часто наблюдается при остром периостите верхней челюсти. Комплекс упражнений включает в себя такие элементы как надувание и расслабление щек, движения губами и языком, произношение гласных звуков, открывание и закрывание рта, наклоны головы.
Лечение хронического периостита
Хронический периостит может развиться вследствие травм, острого периостита, а также сопутствовать хроническому периодонтиту. Заболевание носит вялотекущий характер, проявляется легкими болями. Очаг воспаления чаще всего локализуется в области нижней челюсти, при этом наблюдается небольшая припухлость, при прощупывании которой определяется эластичный инфильтрат. Пациенты чувствуют себя удовлетворительно.
В результате хронического воспаления происходит раздражение периоста, следствием этого становится избыточное построение молодой кости. Для лечения хронического периостита необходимо устранить первичный очаг инфекции, чаще всего приходится удалять зуб, который является причиной воспаления. Впоследствии назначают электрофорез с йодидом калия, витаминные препараты.
Для лечения хронического периостита необходимо устранить первичный очаг инфекции, чаще всего приходится удалять зуб, который является причиной воспаления. Впоследствии назначают электрофорез с йодидом калия, витаминные препараты.
Результаты лечения зависят от формы хронического периостита:
После проведенного лечения простой формы хронического периостита новообразованная остеоидная ткань способна к обратному развитию.
Если была диагностирована оссифицирующая форма хронического периостита, развивается гиперостоз – состояние, характеризующееся увеличенным количеством костного вещества.
При рарефицирующем хроническом периостите, который развивается после травм, наблюдаются перестройка костных структур и выраженные явления остеопороза. Цель лечения этой формы периостита – удаление гематомы, образовавшейся в результате травмирования челюсти.
Наличие хронической формы заболевания требует постоянного наблюдения у стоматолога.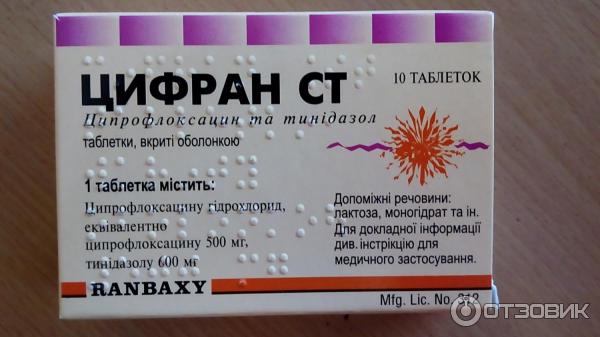
Осложнения
Периостит может стать причиной таких осложнений:
- Острый гайморит – развивается при локализации периостита на верхней челюсти;
- Воспаление лимфатических узлов ‒ чаще развивается воспаление поднижнечелюстных узлов при периостите на нижней челюсти;
- Одонтогенный остеомиелит – гнойно-некротическое воспаление челюстной кости;
- Околочелюстная флегмона – гнойное воспаление подкожной клетчатки, локализующееся в челюстно-лицевой области;
- Сепсис – заражение крови.
Профилактика периостита
Для профилактики периостита (флюса) врачи рекомендуют соблюдать следующие правила:
- Вовремя проходить профилактический осмотр у стоматолога (каждые полгода).
- Не отказываться от лечения кариеса – проблемы, которая на начальной стадии многим пациентам кажется незначительной.

- Устранить хронические очаги воспаления в периодонте.
- Тщательно соблюдать гигиену полости рта, 1-2 раза в год проводить профессиональную чистку зубов.
- При возникновении любых жалоб, связанных со здоровьем ротовой полости, немедленно обращаться к врачу.
Стоимость лечения периостита
Стоимость лечения зависит от стадии развития заболевания, от источника воспаления и от дальнейших мероприятий.
Разница в итоговой цене может быть существенной, сравните: при лечении достаточно обеспечить отток гноя, произвести пломбировку канала и установить пломбу, и второй вариант – после удаления гноя и воспаления, произвести лечение периодонтита, пломбировку четырех канального зуба, установить вкладку и коронку. В случае потери зуба, в дальнейшем может потребоваться в т.ч.
Для ориентира, ниже приведена стоимость на некоторые манипуляции в нашей клинике.
Флюс на десне — как быстро снять опухоль
Гнойное образование на десне в народе принято называть флюсом. Очень часто к нему относятся несерьезно, но это не просто небольшая припухлость, которая пройдет сама собой. Флюс – это онтогенный периостит, сложное инфекционное заболевание, поражающее надкостницу и челюстную кость. Встречается периостит достаточно часто, но без адекватного лечения оно чревато серьезными осложнениями, вплоть до заражения крови.
Очень часто к нему относятся несерьезно, но это не просто небольшая припухлость, которая пройдет сама собой. Флюс – это онтогенный периостит, сложное инфекционное заболевание, поражающее надкостницу и челюстную кость. Встречается периостит достаточно часто, но без адекватного лечения оно чревато серьезными осложнениями, вплоть до заражения крови.
Без помощи стоматолога вылечить флюс практически невозможно. Лечебная программа включает в себя терапевтические, физиотерапевтические, хирургические методы.
Заметили гнойные образования на деснах и припухлость щек? Появилась острая боль в зубе или десне? Приходите на консультацию стоматолога нашей клиники. Вовремя начатое лечение флюса позволяет избавиться от проблемы в течение примерно 7 дней.
Почему образуется флюс
Предшественником флюса всегда являются стоматологические заболевания. Чаще всего к нагноению приводят:
- Невылеченный кариес. Если кариес не лечить, воспалительный процесс начинает распространяться на другие ткани.
 Постепенно развиваются пульпит и периодонтит.
Постепенно развиваются пульпит и периодонтит. - Механическая травма. Травмирование может привести не только к разрушению коронки. Очень часто в травмированных тканях зуба или десны развивается воспалительный процесс. Без лечения развиваются гнойные процессы, формируется флюс.
- Периодонтит. Больше чем в половине случаев флюс развивается именно на фоне периодонтита, как его осложнение. Это связано с тем, что гнойные процессы из пародонтальных карманов могут распространяться на шейку зуба.
- Некачественно запломбированные каналы. Перед пломбированием каналы должны быть полностью очищены, а пломбировочный материал полностью заполнять полость. Если нарушено хотя бы одно из условий, инфекция из канала распространяется на другие ткани.
Когда нужна помощь стоматолога
Флюс имеет ярко выраженные симптомы. Основной из них – появление гнойника на десне рядом с больным зубом. Гнойник развивается постепенно. Сначала десна немного припухает, на ней заметна небольшая шишка красного или белесого цвета. Через какое-то время на шишке образуется заметный свищевой ход, из которого вытекает гной. Развитие периостита сопровождают и другие симптомы:
Через какое-то время на шишке образуется заметный свищевой ход, из которого вытекает гной. Развитие периостита сопровождают и другие симптомы:
- Припухлость и отечность десен, губ, щек. Иногда они могут быть такими большими, что искажаются черты лица.
- Сильная резка боль в области зуба. Иннервирует в височную область, глазницы.
- Больной зуб начинает сильно шататься, даже если раньше не отмечалось подвижности или она была незначительной.
Так как флюс вызывает инфекция, для него характерны симптомы, проявляющиеся при любом инфекционном процессе. Пациент чувствует недомогание, у него повышается температура, болит голова, появляется слабость. На голове и шее увеличиваются лимфоузлы.
Любой из этих симптомов – повод обратиться к врачу. Чем более запущен случай, тем выше риск развития осложнений. Это заболевание нередко сопровождается и другими патологическими процессами. Например, в тканях, пораженных инфекцией, может образоваться киста.
Методы лечения флюса
Начинать лечение нужно как можно раньше. Если абсцесс на десне вскрывается самопроизвольно, есть риск попадания инфекции в кровеносное русло. При таком инфицировании развивается заражение крови, а такое осложнение может привести к серьезным последствиям, вплоть до смерти пациента.
Лечение флюса всегда комплексное. Лечебная программа зависит от степени разрушения зуба и распространения инфекции.
Вскрытие гнойника на десне
Гнойник вскрывают всегда. Это позволяет снизить риск самопроизвольного вскрытия, которое может стать причиной развития осложнений. Флюс вскрывают под местной анестезией. Если у пациента есть панический страх или другие показания, врач может выбрать другой способ анестезии.
На обезболенной десне в районе флюса делают небольшой разрез, не больше 2 см в длину. После рассечения врач полностью очищает и стерилизует гнойную полость, обрабатывает ее антисептиками. Нельзя допустить образования корочки в районе разреза, так как она будет препятствовать оттоку сукровицы и гнойного содержимого. Для этого в разрез вставляют дренаж. После того, как полость очищена от гноя, можно приступать к общему лечению, цель которого – устранить причины, вызвавшие периостит.
Нельзя допустить образования корочки в районе разреза, так как она будет препятствовать оттоку сукровицы и гнойного содержимого. Для этого в разрез вставляют дренаж. После того, как полость очищена от гноя, можно приступать к общему лечению, цель которого – устранить причины, вызвавшие периостит.
Общее лечение
Методы зависят от причин, вызвавших флюс. Единственное исключение – периостит, развивающийся на фоне периодонтита. В этом случае сразу после вскрытия абсцесса врач приступает к пародонтологическому лечению. Никаких лечебных манипуляций с зубом проводить не требуется. В остальных случаях болезни зуба нужно лечить:
- Пульпит. Сначала стоматолог высверливает кариозные полости и проводит депульпирование. После этого делают эндодонтическое лечение каналов.
- Периодонтит. Лечение зависит от того, было ли ранее проведено депульпирование и пломбирование каналов. Если периодонтит развился впервые, врач удалит пульпу, очистит и запломбирует каналы.
 Если пломбирование каналов уже было выполнено ранее, их нужно распломбировать и лечить заново. Так как очень важно, чтобы гной из флюса вышел полностью, при лечении осложненного пульпита и периодонтита не ставят временную пломбу.
Если пломбирование каналов уже было выполнено ранее, их нужно распломбировать и лечить заново. Так как очень важно, чтобы гной из флюса вышел полностью, при лечении осложненного пульпита и периодонтита не ставят временную пломбу. - Зуб после реставрации. На первом этапе перед врачом стоит задача полностью снять воспаление. После этого поврежденные ткани верхушки корня удаляют. Если состояние корня позволяет, зуб повторно реставрируют с помощью культевой вкладки или штифта и искусственной коронки. Когда повреждение очень сильно, целесообразнее удалять зуб.
Физиотерапия
Физиотерапевтические методы используют как дополнительные. Они позволяют быстрее справиться с инфекцией, остановить воспалительный процесс. Хороших результатов позволяют добиться следующие методы:
- Флюктуоризация. На воспаленные ткани воздействуют током слабого напряжения.
- Электрофорез с лидазой. На ткани воздействуют током, что позволяет эффективно распространять лекарственный препарат.

- Ультравысокочастотная терапия. Метод строится на воздействии электромагнитного поля.
- Ультразвуковая терапия. Воздействие ультразвука на инфицированные ткани ускоряет их регенерацию.
- Лазеротерапия. Поврежденные ткани зуба обрабатывают лазерным лучом.
Медикаментозная терапия
В лечении гнойных процессов обязательно используют антибиотики. Они снижают риск повторного развития инфекции. Обычно врач назначает метронидазол с линкомицином или клиндамицином. Такая комбинация препаратов позволяет воздействовать на граммположительные и анаэробные бактерии.
Метронидазол назначают перорально, линкомицин и клиндамицин – в виде таблеток или внутримышечных инъекций. Линкомицин применяют с осторожностью, так как этот препарат может вызвать аллергию.
Метронидазол назначают перорально, линкомицин и клиндамицин – в виде таблеток или внутримышечных инъекций. Линкомицин применяют с осторожностью, так как этот препарат может вызвать аллергию.
Цифровая стоматология
Новейшая технология для протезирования и микропротезирования
Дентальный цифровой томограф
Единственный в Москве томограф KaVo OP 3D Vision с 9 области сканирования
Ультразвуковая пьезохирургия
Микрометрические разрезы высокой точности. Защита мягких тканей, нервов и сосудов. Быстрое послеоперационное выздоровление.
Цифровой протокол лечения
Погрешность измерения до 6 микромиллиметров
Фото и видео протокол лечения
Полный контроль на каждом этапе лечения.
Интраоральный сканер
3D изображение челюстей и всех зубов (цифровой слепок)
Компьютерная анестезия STA
Компьютеризированная система подачи анестетика
Парковка
Своя парковка для клиентов в центре Москвы
Стерилизаторы премиум-класса
Безопасность пациентов наша главная задача!
Обезболивающие препараты
Флюс сопровождается сильной болью, поэтому во время лечения можно использовать обезболивающие препараты, чтобы снизить болевые ощущения и облегчить общее состояние. Такие лекарства тоже должен назначать врач. Снизить сильную боль помогают нимесил, кетанов, нурофет и т.д.
Такие лекарства тоже должен назначать врач. Снизить сильную боль помогают нимесил, кетанов, нурофет и т.д.
Полоскания
Их применяют как дополнительное средство лечения для того, чтобы полностью удалить из вскрытого абсцесса гной и сукровицу и не позволить инфекции распространиться на здоровые участки. Сделать лечение более эффективным и ускорить заживление десны помогают содо-солевые ванночки и полоскания растворами антисептиков. При полосканиях нужно придерживаться следующих правил:
- В течение дня делать 4-5 неинтенсивных полосканий или ванночек. Для этого достаточно набрать в рот раствор и подержать его около 30 секунд.
- В течение дня делать 4-5 неинтенсивных полосканий или ванночек. Для этого достаточно набрать в рот раствор и подержать его около 30 секунд.
Мази
Мази помогают ускорить заживление после вскрытого абсцесса. Для этого используют:
- Левомеколь.
- Холисал.

- Асепта.
- Стоматофит.
- Метрогил Дента.
Мазь нужно осторожно нанести на место разреза с помощью ватной палочки. Нельзя делать это пальцами, так как можно дополнительно инфицировать рану.
Как лечить флюс у детей
У детей флюс встречается редко, но может привести к более серьезным осложнениям. Это связано с тем, что провоцирующим фактором для развития периостита в детском возрасте является ослабленный иммунитет. Кроме того, инфекция у малыша может распространяться очень быстро. Поэтому крайне важно обратиться к врачу при появлении малейшего подозрения на нагноение. Детей до 5 лет нужно госпитализировать.
Процесс лечения периостита у детей и взрослых практически не отличается. Но очень важно одновременное лечение у педиатра, направленное на повышение иммунитета и общее укрепление здоровья малыша.
Репутация клиники и стоматологов — важный критерий при выборе места лечения.
Нам нечего скрывать! Узнайте, что думают пациенты об «American Russian Dental Center» на популярных интернет-порталах.
полный обзор, особенности применения, состав и отзывы
Не каждый человек считает посещение стоматологического кабинета приятной процедурой. Откладывая визит к врачу, мы затягиваем развитие воспалительных процессов. Как результат, появляется отек, боль и более продолжительное лечение. Визит к доктору неизбежен. Развивается флюс, который не вылечить одними полосканиями. Рассмотрим далее, что такое флюс, лечение, таблетки, которые используют при терапии, каков их состав, особенности применения и отзывы пациентов.
Прежде чем рассмотреть, какие таблетки от флюса необходимы, узнаем, что представляет собой данная патология и каковы ее симптомы:
Все это признаки того, что развивается флюс. В переводе с немецкого fluss означает «поток, течение».
Как лечат флюс
Лечение флюса может проводиться двумя способами:
- Медикаментозным.
- Оперативным.
Если случай очень сложный, запущенный, врач может назначить удаление зуба, а затем ставят дренаж для оттока гноя.
При медикаментозном способе лечения назначают такие виды препаратов:
- Антибиотики.
- Противовоспалительные препараты.
- Препараты для обработки полости рта.
- Мази и гели для снятия боли и отека.
Широко используются рецепты народных лекарей, но необходимо иметь в виду, что их можно применять только на ранних стадиях. Запущенные случаи не лечатся полосканиями, необходимо пройти специальное стоматологическое лечение у хорошего специалиста.
Далее рассмотрим, какие таблетки при флюсе может назначить врач.
Какие необходимы таблетки
Для того чтобы уменьшить воспаление, снять отечность, необходимы такие таблетки от флюса:
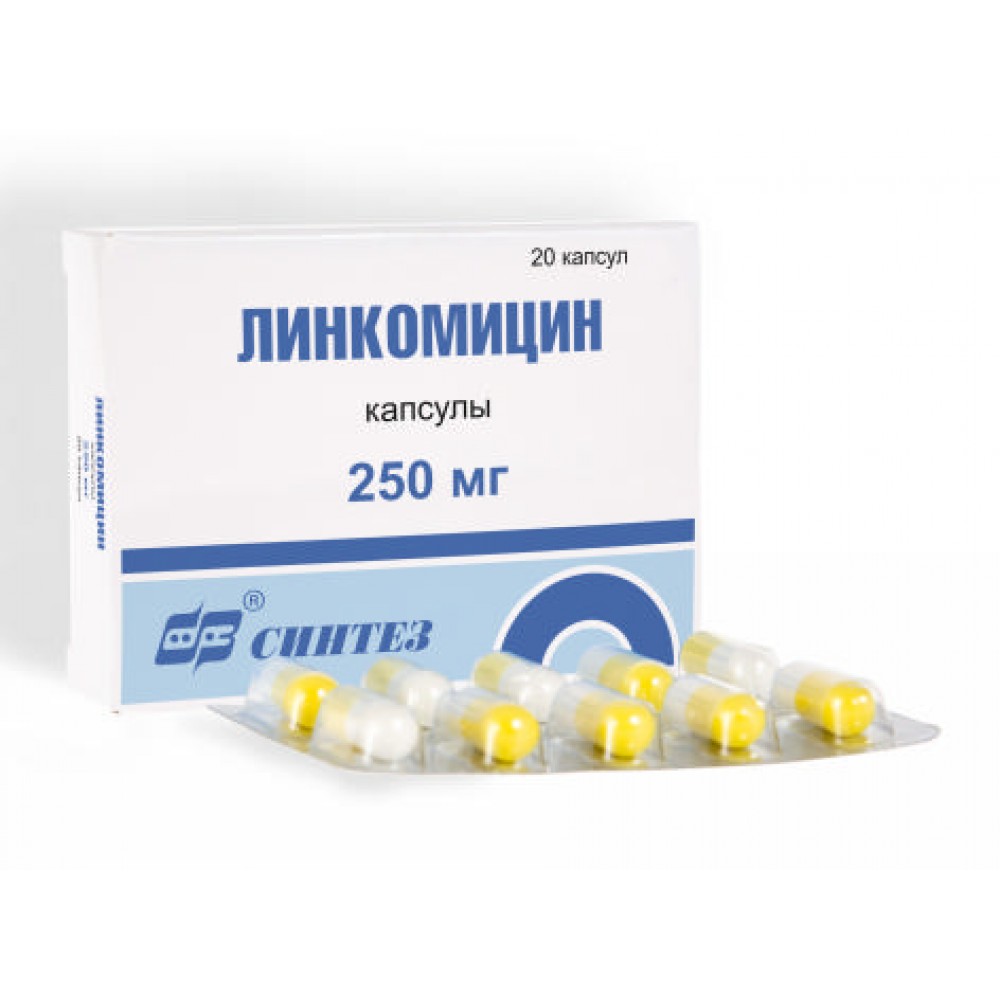
- Антибиотики, которые позволяют избавиться от инфекции: «Линкомицин», «Амоксиклав», «Ципрофлоксацин».

- Противовоспалительные препараты позволяют бороться с болью и уменьшают воспалительный процесс.
- Антигистаминные средства помогают снять отечность: «Диазолин», «Супрастин».
Особенности действия и состав антибиотиков
Рассмотрим особенности использования некоторых антибиотиков в терапии флюса.
Препарат «Линкомицин» представляет собой антибиотик бактериостатического действия против широкого спектра микроорганизмов. Высокие дозы лекарственного средства действуют как бактерицидное вещество. В составе активный компонент — линкомицин.
«Амоксиклав» способен уничтожать большое количество возбудителей. Активные вещества амоксициллин и клавулоновая кислота. Хорошо помогает при гнойно-септических осложнениях.
«Ципрофлоксацин» содержит в качестве основного действующего вещества ципрофлоксацин. Относится к группе фторхинолов. Оказывает влияние на грамотрицательные бактерии. Оказывает бактерицидное действие и антибактериальное. Эффективен препарат при инфекциях мягких тканей.
Для того чтобы правильно назначить антибактериальные таблетки при флюсе зуба, стоматолог должен сделать тест на определение возбудителя инфекции. Так можно подобрать более эффективный препарат.
Особенности применения антибиотиков
Рассмотрим, как принимают таблетки при флюсе зуба. Терапия данной патологии обязательна, чтобы избежать осложнений.
Только стоматолог после обследования и изучения течения патологии назначает антибиотики при флюсе. Инструкция по применению описывает, как необходимо принимать препарат и в какой дозировке.
«Линкомицин» надо принимать за полчаса-час до еды или через 2 часа после приема пищи. При этом таблетки не рекомендуется разжевывать или делить на несколько частей, запить водой. Средство разрешено давать детям после 6 лет. Дозировку рассчитывают 30 мг на кг массы тела малыша.
Взрослым прописывают по 500 мг 3 раза в сутки, желательно делать это через одинаковые временные промежутки. При тяжелом течении заболевания кратность приема может быть увеличена до 4 раза в сутки.
«Амоксиклав» принимают перед едой, не разжевывая таблетки и запивая достаточным количеством жидкости. Лекарство можно назначать и детям с 6 лет. Взрослым средство принимать по 250+125 мг утром и вечером при легком течении заболевания. В осложненных 875+125 мг каждые 12 часов. Максимальная дозировка препарата для взрослого составляет 6000 мг амоксицилина и 600 мг клавулановой кислоты.
«Ципрофлоксацин» принимают на голодный желудок, запивая водой. Обычно врач прописывает по 250 мг 2 раза в сутки. В сложных случаях 500 мг 2 раза в сутки. При лечении препаратом необходимо употреблять большое количество жидкости в день. Во время терапии желательно не находиться под воздействием солнечных лучей.
Стоит уделить внимание противопоказаниям для приема антибиотиков.
Противопоказания для приема антибиотиков
Каждый антибиотик имеет группу заболеваний, при которых применение его может быть опасным:
- Так, не следует назначать антибиотик «Линкомицин», если есть нарушения в работе почек и печени.
 Женщинам в положении и кормящим матерям его лучше не использовать для лечения.
Женщинам в положении и кормящим матерям его лучше не использовать для лечения.
- Антибиотик «Амоксиклав» нельзя принимать при гепатите и холестатической желтухе. Во время вынашивания малыша и в период кормления грудью препарат может не назначаться.
- «Ципрофлоксацин» не назначают при эпилепсии. Беременным и кормящим матерям детям и подросткам до 15 лет. С особой осторожностью лекарственное средство назначают при патологиях почек.
Любой антибиотик не следует использовать, если есть непереносимость составляющих компонентов или основного действующего вещества.
При приеме любого препарата возможно проявление нежелательных явлений. Следует быть осторожными. Какие они могут быть при приеме антибиотиков, рассмотрим далее.
Возможные побочные проявления
Как правило, препараты, описанные ранее, хорошо переносятся и при правильном приеме редко проявляются побочные реакции. Но все же стоит о них сказать.
Возможны следующие нежелательные проявления:
- Нарушения в работе ЖКТ: рвота, тошнота, расстройство стула, метеоризм.

- Головные боли, головокружение.
- Аллергические реакции в виде высыпаний на коже, зуда.
- Повышение артериального давления.
- Мышечная слабость.
Препараты для снятия воспаления при флюсе
Противовоспалительные таблетки при флюсе зуба необходимы для снятия боли и воспалительного процесса. Это важно на начальной стадии и в процессе выздоровления. Очень часто при флюсе может повышаться температура тела. Что можно принять до посещения врача в домашних условиях.
Назовем, какие противовоспалительные таблетки от флюса и зубной боли можно использовать:
- «Нимесил».
- «Кетонал».
- «Наклофен».
- «Ибупрофен».
Рассмотрим, как их нужно принимать, далее.
Особенности применения противовоспалительных препаратов при флюсе
Хочется отметить, что, какие таблетки пить при флюсе, может решить только врач. Не стоит откладывать визит к доктору.
Но при боли можно принять «Нимесил», но только после еды 2 раза в день. Использовать можно только пациентам старше 12 лет. Активное вещество в составе нимесулид. Препарат прекрасно справляется с болевым синдромом, нормализует температуру тела, уменьшает отек.
Использовать можно только пациентам старше 12 лет. Активное вещество в составе нимесулид. Препарат прекрасно справляется с болевым синдромом, нормализует температуру тела, уменьшает отек.
Хорошо снимает боль препарат «Кетонал». В состав входит кетопрофен. Лекарство принимают по 1-2 таблетки в день после приема пищи, запивая большим количеством воды. Его также можно запивать молоком. Средство эффективно устраняет боль, нормализует температуру тела.
Препарат «Наклофен» с активным веществом диклофенак натрия в составе. Хорошо снимает отеки, боли. Имеет много противопоказаний. Принимать нужно после или во время еды по 50 мг 2 раза в сутки. Для достижения более быстрого эффекта допускается прием за полчаса до еды.
«Ибупрофен» используют для снятия лихорадочного и болевого симптома. Активное вещество ибупрофен уменьшает воспаление и боль. Принимать можно с детского возраста. Взрослые принимают по 200 мг 3-4 раза в сутки. Утром для быстрого всасывания принимают препарат на голодный желудок, в дневное время после приема пищи.
Стоит заметить, что все противовоспалительные и обезболивающие препараты необходимо принимать после консультации врача. Ознакомимся, какие противопоказания они имеют.
Кому нельзя принимать противовоспалительные препараты
Как правило, людям, имеющим следующие нарушения в работе организма, с большой осторожностью необходимо относиться к приему лекарственных средств:
- Эрозивно-язвенные заболевания желудка и кишечника.
- Болезни с нарушением свертываемости крови.
- Прогрессирующие заболевания почек, печени.
- Гиперчувствительность к составляющим препаратов.
- Женщинам в интересном положении и в период грудного вскармливания.
С осторожностью назначают таблетки от флюса людям с заболеваниями сердечно-сосудистой системы, с сахарным диабетом и пожилым пациентам.
Антигистаминные препараты против отека
Хочется отметить, что таблетки от флюса на щеке могут включать и антигистаминные препараты:
- «Супрастин».
- «Диазолин».

Эти препараты эффективно устраняют отек при воспалительном процессе, так как воздействуют на биологических возбудителей в очаге нагноения. «Диазолин» назначают по 0,1 г 1-3 раза в день, а «Супрастин» по 100 мг 3-4 раза в сутки. Прием этих средств в комплексе с антибиотиками и противовоспалительными лекарствами ускорит выздоровление.
Также врачи рекомендуют использовать и домашние рецепты лечения флюса, но только комбинируя с медикаментозной терапией.
Избавление от флюса в домашних условиях
При возникновении флюса на начальной стадии некоторые пытаются вылечиться в домашних условиях, но стоит помнить, что это не безопасно.
Лечение антибактериальными препаратами должно быть согласовано с врачом, если имеется флюс зубной. Лечение в домашних условиях, таблетки, конечно же, не исключает. Устранить болевые ощущения, а также снизить температуру тела помогут противовоспалительные препараты: «Нимесил», «Кетонал», «Наклофен» или «Ибупрофен». Выбирая обезболивающий препарат, стоит учитывать его противопоказания и способы применения.
Для облегчения симптомов можно использовать такие народные рецепты:
- Раствор для полоскания полости рта из соли и соды. На стакан теплой воды необходимо брать по чайной ложке соды и соли. Полоскания проводить после приема пищи в течение дня. Раствор ускоряет процесс выхода гноя, обезболивает.
- Раствор календулы и шалфея прекрасно устраняет воспаление, вытягивает гной. Шалфей обладает ранозаживляющими свойствами. 3 столовые ложки смеси растений заливают пол литрами кипятка. Спиртовую настойку растворяют на 200 мл теплой воды 30-40 капель настойки.
- Сок алоэ. Кашицу заворачивают в марлю и прикладывают к пораженному месту. Держать не более 2 часов. Снижает болевой синдром, уменьшает отек.
Если лечение в домашних условиях не оказывает должного эффекта, и самочувствие только становится хуже, нужно срочно обратиться за медицинской помощью, так как инфекция из ротовой полости может быстро распространиться по кровеносной и лимфатической системе.
Отзывы о препаратах от флюса
Отзывы о препаратах для лечения флюса во многом положительные. Так после вскрытия применение антибактериальных средств ускоряет процесс выздоровления. При сильных болях эффективны противовоспалительные препараты, описанные выше. Но стоит отметить, что обезболивающими средствами нельзя увлекаться, так как частый прием может закончиться развитием побочных эффектов. Использовать их только при болевых ощущениях и по назначению врача. Некоторые пациенты считают, что препараты от боли не всегда оказывают желаемый эффект. Результат от правильно подобранного антибиотика виден сразу. Пациенты отмечают улучшение общего состояния, нормализацию температуры тела.
Многие отмечают, что правильно подобранные таблетки от флюса на десне не дают распространиться инфекции, и возможно вылечиться без оперативного вмешательства.
Вскрытие флюса и лечение таблетками пациенты считают очень эффективным методом, но более продолжительным, чем удаление больного зуба. Однако оно не эффективно при сильном поражении зуба.
Однако оно не эффективно при сильном поражении зуба.
Если проводить терапию народными средствами в домашних условиях и использовать только противовоспалительные таблетки от флюса, как правило, это облегчает состояние, но не решает проблему, а может только усугубить ситуацию, вызвать осложнения, если не обратиться вовремя к врачу.
Прохождение регулярного осмотра у стоматолога убережет от такой неприятной проблемы, и зубы всегда будут здоровы, а улыбка белоснежной.
Антибиотики при зубной боли 🦷 Когда можно, а когда нельзя принимать антибиотики 💊
Когда принимать антибиотик для зубов
Антибиотики – препараты, которые используются для лечения бактериальных инфекций. Важно отметить, что речь идет именно о бактериальных заболеваниях, не вирусных или грибковых. Против вирусов или грибков антибиотики бессильны. Поэтому, если речь идет о вирусном или грибковом заболевании, то в таких случаях уместно применение противовирусных и противогрибковых препаратов соответственно.
Антибиотики применяются и в стоматологической практике, когда болит зуб. При этом важно понимать, в каких случаях боль инфекционного (бактериального) происхождения, а в каких – неинфекционного.
Распространенный тип зубной боли – при пульпите. Возникает она, когда кариес уже разъел верхний слой эмали. Образовавшаяся дырка достает до пульпы зуба, из-за чего последний начинает болеть при воздействии различных раздражителей – термических, химических или механических. В данном случае антибиотики бесполезны. Для того чтобы унять боль при пульпите, применяются противовоспалительные препараты.
В случаях, когда болит мертвый зуб, высока вероятность того, что причина в бактериях. Как известно, мертвый зубы (с запломбированными каналами) не может болеть сам по себе. Если такая боль возникает, значит, в трещинах или полостях зуба завелись бактерии. Микроорганизмы размножаются, заражают десны и приводят к скапливанию гноя. Последний оказывает давление, что и приводит к боли. Вышеописанная патология – не что иное, как флюс. Антибиотик при флюсе подбирает врач после проведения диагностики. Ведь надлежит установить и вид патогенной бактерии, чтобы антибиотик при флюсе сработал наверняка.
Антибиотик при флюсе подбирает врач после проведения диагностики. Ведь надлежит установить и вид патогенной бактерии, чтобы антибиотик при флюсе сработал наверняка.
Антибиотики в стоматологической практике также применяются в следующих ситуациях:
- После хирургических операций. Удаление зуба и другие хирургические вмешательства иногда осложняются инфекционным процессом. Во избежание бактериального заражения хирургическое лечение сопровождается и антибиотикотерапией.
- Заболевания периодонта. Запущенные варианты патологий периодонта иногда осложняются гнойным периоститом (флюсом). Во избежание такого развития событий лечение заболеваний периодонта иногда сопровождается приемом антибиотиков.
Вышеперечисленные случаи – не единственные, при которых применяются антибактериальные препараты. Эти лекарства назначает врач исходя из клинической картины, а также индивидуальных особенностей пациента. В ряде случаев антибиотики назначаются и в профилактических целях – когда есть вероятность присоединения бактериальной инфекции. Эти риски оценивает врач.
Эти риски оценивает врач.
Антибиотики при флюсе и зубной боли: виды препаратов
Сегодня в стоматологической практике применяются различные антибиотики при флюсе и зубной боли. Напомним, что антибиотики принято делить на классы. Рассмотрим самые популярные виды антибиотиков при гнойном поражении десен.
Нитроимидазолы
Нитроимидазолы – это синтетические антибактериальные препараты, проявляющие высокую активность в отношении анаэробных микроорганизмов (бактерий, живущих в условиях без кислорода). Самым популярным препаратом этой группы является метронидазол, который используется с 60-х годов прошлого столетия.
Механизм действия нитроимидазолов связан нарушением репликации ДНК и синтеза белка микробных клеток. Такие нарушения несовместимы с жизнью бактерии.
Представители этой группы антибиотиков проявляют активность в отношении большинства анаэробных бактерий (как грамположительных, так и грамотрицательных). К нитроимидазолам также чувствительны некоторые виды простейших микроорганизмов и бактерия Helicobacter pylori. Последняя является причиной развития гастрита и язвенной болезни желудка (а также опухолевых поражений слизистых органов желудочно-кишечного тракта).
Фторхинолоны
Это группа лекарственных средств, проявляющих антибактериальную активность в отношении широкого спектра бактерий. Примечательно, что фторхинолоны не считаются антибиотики в классическом смысле этого слова. Дело в том, что у антибиотиков (даже синтетических) всегда имеются аналоги природного происхождения. У фторхинолонов природного аналога нет.
К наиболее популярным представителям фторхинолонов относятся ципрофлоксацин, офлоксаацин, моксифлоксацин, ломефлоксацин, левофлоксацин и другие.
Механизм действия фторхинолонов сводится к угнетению ряда важных ферментов микробов. Это приводит к нарушению синтеза ДНК и гибели бактериальной клетки.
Линкозамиды
Линкозамиды – группа антибактериальных препаратов, куда входят такие антибиотики как линкомицин и клиндамицин.
Механизм действия линкозамидов сводится к подавлению синтеза белка в бактериальных стенках.
Антибиотики при воспалении корня зуба
При зубной боли, вызванной воспалением корня зуба, врачи также назначают фторхинолоны (как и при флюсе). Кроме того, при воспалительных патологиях корня зуба применяются также антибиотики пенициллинового и тетрациклинового ряда. Рассмотрим их подробнее.
Пенициллины
Это первые антибиотики, которые были открыты Александром Флемингом в 1928 году. Основной механизм действия пенициллинов – бактерицидный. Эти препараты нарушают синтез пептидогликана – составляющего компонента клеточной стенки бактерии. Это приводит к гибели бактерии.
В настоящее время в стоматологической практике применяются разные виды антибиотики пенициллинового ряда. Самые распространенные – это амоксициллин и ампициллин.
Тетрациклины
Еще один класс антибиотиков, который был открыт давно – еще в 40-х годах прошлого века. Тетрациклины действуют против широкого спектра бактерий, как в отношении грамотрицательных, так и грамположительных микроорганизмов.
Механизм действия тетрациклинов – угнетение белкового синтеза в клетках бактерий. Микроорганизмы перестают синтезировать жизненно важные белки, из-за чего – погибают.
Как долго работают антибиотики при зубной боли
Лечебный эффект от антибиотиков наступает в течение первых трех суток. Если облегчения за это время не наступает, то в таком случае часто принимается решение о назначении другого препарата.
Минимальный курс приема антибиотиков составляет 5 суток. При этом для каждого пациента устанавливается индивидуальный курс терапии в зависимости от ряда факторов.
Иногда антибиотики не срабатывают, пациент не ощущает терапевтического эффекта от их приема. Рассмотрим типичные случаи, когда антибактериальные препараты не работают:
- Недостаточная доза лекарства. При проведении антибиотикотерапии важным условием является четкое соблюдение дозировки. Если принимать меньше прописанного врачом, то и эффекта не будет. Другими словами, для подавления патогенной флоры не хватило действующего вещества. Учтите, что дозировка антибиотика зависит и от возраста и веса пациента. Чем больше вес пациента, тем больше препарата требуется для достижения нужно концентрации препарата в крови.
- Недостаточная продолжительность терапии. Строго придерживайтесь режима и длительности приема препарата. Некоторые пациенты, почувствовав облегчение, решают прерывать курс, чем совершают ошибку. Преждевременное прерывание курса антибиотикотерапии чревато развитием антибиотикорезистентности – устойчивости патогенной и условно-патогенной флоры к антибактериальным препаратам.
- Некоторые сопутствующие заболевания. Перед назначением лекарств врач должен владеть исчерпывающей информацией относительно здоровья пациента. Важно сообщить доктору обо всех хронических и недавно перенесенных острых заболеваниях, которые могут оказать влияние на эффективность антибиотикотерапии.
- Непереносимость антибиотика. На некоторые виды антибиотиков у пациента может быть индивидуальная непереносимость. Не стоит отчаиваться. Если не подходит один антибиотик, то всегда найдется альтернативный антибактериальный препарат. Иногда у пациента возникают проблемы с приемом антибиотика внутрь (в виде таблеток, капсул или растворов). В таких случаях принимается решение об инъекционном применении антибиотиков, минуя желудочно-кишечный тракт.
- Взаимодействие с другими активными веществами. Врачу нужно сообщить о лекарствах, которые пациент принимает. Некоторые препараты нельзя принимать вместе с антибиотиками, поскольку они нивелируют эффект последних. Кроме того, во время антибиотикотерапии воспрещается и прием спиртных напитков. В противном случае, лечение не принесет желаемого эффекта.
Что нужно знать, принимая антибиотики
Рассмотрим некоторые факты об антибиотиках, которые помогут пациенту не допускать ошибок при антибиотикотерапии:
- Прием антибиотиков нельзя сочетать с алкоголем. Врачи запрещают принимать спиртное, поскольку алкоголь увеличивает вероятность побочных действий. Установлено, что распивание спиртных напитков на фоне антибиотикотерапии повышает вероятность головной боли, болей в животе, тахикардии, повышения давления. Кроме того, алкоголь – это дополнительная нагрузка на печень, которой и без того тяжело справляться с лекарствами. Таким образом, прием алкогольных напитков увеличивает время выздоровления.
- Антибиотики, апельсиновый сок и молоко. Мало кому об этом известно, но антибиотики нежелательно запивать фруктовыми соками (в частности, апельсиновым, грейпфрутовым, яблочным или ананасовым), а также молоком или молочными продуктами. Связано это с тем, что вышеперечисленные напитки ухудшают процесс всасывания антибиотиков. По этой причине ухудшается эффективность лечения антибиотиками. Поэтому, после приема лекарств воздержитесь от употребления соков и молока минимум в течение 3-х часов.
- Антибиотики во время еды. Некоторые виды антибиотиков следует принимать натощак. Для других жестких ограничений нет, и их разрешено принимать во время еды. Внимательно читайте инструкции к препаратам и проконсультируйтесь с врачом относительно режима приема лекарства.
- Лекарства и антибиотики. В инструкциях к антибиотику указан список препаратов, с которыми нежелательно его сочетать. Некоторые сочетания могут ослаблять действие антибиотика или же увеличивать вероятность и интенсивность побочных эффектов.
- Грамотное распределение дозы антибиотика. Кратность приема антибиотиков в сутки напрямую связана с его эффективной концентрацией в крови. Например, если в инструкции сказано, что препарат принимать 1 раз в сутки, то это значит, что после приема он сохраняет эффективность в течение 24 часов. Таким образом, второй раз антибиотик нужно выпить на следующий день, примерно в такое же время. Если в инструкции сказано, что принимать препарат нужно 2 раза в сутки, то тогда промежуток между приемами должен составлять 12 часов; если 3 раза в сутки – промежуток должен составлять 8 часов.
Побочные реакции от антибиотиков
От антибиотиков, как и других лекарств, бывают побочные реакции. Рассмотрим самые частые проблемы, с которыми сталкиваются пациенты от приема этих препаратов:
- Проблемы с пищеварением. Связано это с нарушением нормальной микрофлоры. Антибиотики поражают не только патогенную и условно-патогенную флоры, но и нормофлору. Изменение баланса микрофлоры приводит к развитию желудочно-кишечных расстройств. В частности, это диарея, вздутие живота, иногда запоры.
- Аллергические реакции. После приема антибиотиков некоторые пациенты отмечают аллергические реакции. Это кожная сыпь, насморк, чихание, слезоточивость и отеки. В тяжелых случаях возможны сильные аллергические реакции вплоть до анафилактического шока. Примечательно, что сбои в работе иммунитета (и связанные с этим аллергические реакции) часто являются следствием кишечных расстройств. Напомним, что огромное количество кишечных бактерий принимает непосредственное участие в работе иммунитета.
- Головные боли. Это относительно распространенный побочный эффект от приема антибиотиков. Некоторые пациенты, которые ранее никогда не жаловались на головные боли, отмечают у себя этот симптом на фоне приема антибиотиков.
- Чувствительность к солнцу. На фоне приема антибиотиков не рекомендуют загорать или посещать солярии. Связано это с тем, что некоторые антибактериальные препараты проявляют себя как фотосенсибилизаторы – светочувствительные компоненты. Это заметно увеличивает вероятность получить ожог.
- Грибковые инфекции. Поскольку антибиотики подавляют и нормальную флору слизистых оболочек, то на этом фоне повышается вероятность развития грибковых инфекций. Например, кандидоз полости рта (молочница) часто возникает из-за приема антибиотиков.
- Окрашивание зубов. Еще одна неприятность от антибиотиков – пигментация зубов. Чаще всего с этой проблемой сталкиваются пациенты, принимающие антибиотики тетрациклинового ряда. В ряде случаев такое окрашивание носит необратимый характер, особенно в детском возрасте.
- Другие побочные эффекты. Спектр побочных реакций от антибиотиков не ограничивается вышеперечисленными эффектами. На фоне приема этих лекарств у пациента может возникнуть боль в суставах, двоение в глазах, проблемы с работой печени и почек (из-за интоксикации) и даже подавленное настроение и депрессия.
Иные способы лечения инфекций зубов и ротовой полости
Целесообразность антибиотикотерапии определяется исключительно врачом после проведения диагностики. В ряде случаев обойтись без антибиотиков нельзя, поскольку иными способами избавиться от патогенной инфекции не представляется возможным.
В некоторых случаях при воспалительных патологиях зубов и ротовой полости могут использоваться антисептические препараты и противовоспалительные средства. В лечении и профилактике воспалительных заболеваний полости рта неплохо зарекомендовали себя и народные средства, например, полоскания отварами трав. Однако помните, что средства народной медицины нельзя использовать в качестве основного вида лечения. Их допустимо использовать в качестве дополнительной меры к основному лечению.
Антибиотики для детей
Антибиотики применяются и в педиатрической практике, однако для маленьких пациентов врач подбирает эти препараты с большой осторожностью. Учитывается не только возраст ребенка и его вес, но также и спектр возможных побочных действий. Есть антибиотики, которые запрещены для использования в педиатрической практике. Подбором необходимого препарата занимается врач исходя из ряда факторов.
Вместо заключения
Напоследок читателям следует рассказать и о важности грамотного восстановления после антибиотиков. Особое внимание следует уделить улучшению работы кишечника. Для скорейшего восстановления микрофлоры пациенту назначают пробиотики и пребиотики. Первые представляют собой живые культуры бактерий (например, йогурты). Поскольку далеко не все бактерии преодолеют барьер желудочного сока, то эффективность пробиотиков все еще под вопросом.
Пребиотики – это пища с большим содержанием клетчатки (например, отруби). Попадая в кишечник, клетчатка способствует росту полезных бактерий, восстанавливая тем самым баланс микрофлоры.
Что делать при флюсе? Устраняем воспаление максимально быстро
- Время чтения статьи: 1 минута
Флюс или периостит – это крайне неприятное заболевание полости рта. Факторами возникновения флюса выступает травма десны, инфекция, постепенно разрушающийся от кариеса зуб, в котором уже уничтожен дентин под воздействием патогенных микроорганизмов.
Большинство людей попросту не обращаются к стоматологу при зубной боли, предпочитая применять обезболивающие препараты. Но это может привести к серьезному воспалению зуба и его дальнейшей потере!
Виды флюса
Подобная патология характеризуется несколькими стадиями своего клинического развития. На первой стадии появляются незначительные болевые ощущения. Вторая стадия характеризуется припухлостью и покраснением десны в области попадания инфекции.
При третьей стадии появляется гной, повышается температура, заметно опухает щека и область десны. При четвертой стадии человек ощущает резкую пульсирующую боль, отек усиливается, может начаться обширный воспалительный процесс. Существуют следующие виды флюса:
-
Обыкновенный. Патологический процесс происходит без инфильтрации гноем надкостницы;
-
Фиброзный. При таком виде периостита воспаление переходит на ткани надкостницы;
-
Ортодогенный периостит. Болезнь проявляется в виде остеомиелита, который является серьезным осложнением, требующим оперативного удаления зуба;
-
Альбуминозный флюс. Хроническая патология, которая отличается вялым течением, субферильной температурой и нагноением.
Установить тип заболевания и назначить грамотное лечение может лишь стоматолог, но перед посещением надо обязательно купировать процесс.
Полоскание при флюсе
Растворы для полоскания оказывают регенерирующее и противовоспалительное действие на патологический очаг. Можно использовать раствор соды, который уменьшает боль и воспаление. Делать полоскание надо каждые два часа. Сода в объеме двух чайных ложек растворяется в 200 мл теплой воды и используется в течение всего дня.
Хорошую терапевтическую эффективность имеет раствор марганца. Он позволят уменьшать отеки, устраняя патогенные микроорганизмы. Можно применять препарат Ротокан, который включает в себя ромашку, тысячелистник и календулу. Для приготовления раствора в теплую воду достаточно добавить одну ложку Ротокана. Полоскать полость рта следует не менее 4-5 раз в день.
Также используются антисептические средства, такие как Хлоргекседин и Мирамистин. Их можно не растворять в воде. Достаточно делать орошения пораженной полости для того, чтобы снизить отеки, боль и воспаление. К средствам для полоскания, сходных по своему терапевтическому воздействию с Мирамистином и Хлоргексидином можно отнести еще Фурацилин, который продается в таблетках. Пары таблеток достаточно для приготовления 200 мл раствора для обработки полости рта.
Компрессы и примочки при периостите
Компрессы и примочки оказывают местное противовоспалительное и обеззараживающее действие, они уничтожают болезнетворные микробы и позволят избавиться от отека на слизистой. Можно применять препарат Димексид, который разводится с водой до достижения 20-30% концентрации. Компресс накладывается на область воспаления и держится около часа времени.
Также хорошо помогают примочки с содой. Пищевая сода разводится в объеме двух чайных ложек в 200 мл воды. Раствором можно смочить ватный диск или несколько слоев марли и затем приложить примочку к пораженному участку десны.
Хорошая терапевтическая эффективность наблюдается и при использовании солевых компрессов. Достаточно растворить пару чайных ложек в 100 мл теплой воды. Смоченный в растворе тампон из марли надо приложить к воспаленному участку и подержать между десной и щекой не менее получаса времени.
Противовоспалительные препараты и антибиотики
Использование антибиотиков помогает снять боль и купировать острый очаг воспаления. Можно применять такие антибиотики, как Трихопол, Линкомицин, Ципрофлоксацин, Флемоксин, Бисептол, Амоксиклав, Ципролет. Антибактериальные препараты нельзя использовать более пяти дней во избежание микробной устойчивости организма.
Для снижения отечности и покраснения дополнительно можно пропить Диазолин, Нимесил или Диклофенак, которые оказывают местное противовопалительное и противоотечное действие.
Гели и мази
Для местного применения используются мази. В частности, это мазь Вишневского, которая останавливает развитие гнойного процесса. Входящий в ее состав березовый деготь усиливает кровообращение тканей и ускоряет их естественную регенерацию.
Из современных гелей рекомендовано применять препарат Метрогил Дента, в состав которого входят антибактериальные компоненты в виде Хлоргексидина и Метронидазола.
Эта статья носит информативный характер, за подробностями просим вас обращаться к врачу! О противопоказаниях и побочных действиях спрашивайте у врача.
Сравнение проницаемости кожи и предполагаемой противовоспалительной активности
Введение
Нестероидные противовоспалительные препараты (НПВП) часто назначают для купирования острой и хронической боли у пациентов, страдающих различными нарушениями опорно-двигательного аппарата, включая остеоартрит, ревматоидный артрит и состояния, связанные с травмами, например растяжения связок. 1
Общие НПВП включают ибупрофен, диклофенак и ацетилсалициловую кислоту (аспирин). Эти препараты облегчают боль и уменьшают воспаление за счет ингибирования изоформ циклооксигеназы (ЦОГ) ЦОГ-2, индуцибельной изоформы фермента, которая обычно активируется в воспаленной ткани, и ЦОГ-1, конститутивно экспрессируемой изоформы, которая обычно более широко распространена. . 2 НПВП, такие как ибупрофен и диклофенак, имеют разную относительную селективность в отношении ЦОГ-1 или ЦОГ-2, причем диклофенак является более селективным ингибитором ЦОГ-2 по сравнению с ЦОГ-1, в то время как ибупрофен одинаково ингибирует обе изоформы ЦОГ. 3 Клиническая эффективность ибупрофена и диклофенака для местного применения для лечения острой (например, растяжения / растяжения) и хронической боли была продемонстрирована ранее. 4,5
Пероральные и внутривенные НПВП связаны с риском системных побочных эффектов, включая желудочно-кишечные, сердечно-сосудистые и почечные события; 6–8 Таким образом, местные НПВП часто используются в качестве эффективных альтернатив с пониженным риском системных нежелательных явлений. 9–11 Помимо фармакологической активности в отношении изоформ ЦОГ, абсорбция лекарств кожей является критическим признаком для местных НПВП. 12–15 Эти препараты должны проникать в роговой слой и проникать через эпидермис и дерму, чтобы достичь места воспаления и боли в количествах, достаточных для оказания клинического эффекта. На проникновение и проникновение может влиять множество факторов, включая место нанесения, химический состав препарата и свойства лекарства. 14,16,17
Хотя клиническая эффективность и кожная проницаемость in vitro некоторых НПВП для местного применения были оценены ранее, прямых сравнений проницаемости и активности нескольких коммерчески доступных составов с использованием одних и тех же протоколов тестирования не проводилось.Поскольку при использовании различных НПВП для местного применения были продемонстрированы различия в эффективности (включая интенсивность и стойкость эффекта) и побочных реакциях, важно понимать параметры и источники потенциальных различий при выборе подходящей лекарственной формы для местного применения для лечения боли у пациента.
В этом исследовании 12 имеющихся в продаже НПВП для местного применения (6 на основе ибупрофена и 6 на основе диклофенака) были оценены с использованием тестов проникновения через кожу человека in vitro.Эти анализы были разработаны для определения количества лекарственного средства, достигающего первого слоя дермы (400 мкм кожи, покрытой дерматом). Проникновение лекарственного средства, то есть количество лекарственного средства, высвобождаемое составом, проходящим через первый слой кожи (т.е. роговой слой), количественно не оценивалось.
Каждый состав применялся в дозе, призванной имитировать рекомендуемые условия «использования». 18 Эти данные были объединены с ранее опубликованными значениями эффективности ингибирования ЦОГ-2 для диклофенака и ибупрофена для определения модифицированного индекса местной противовоспалительной активности (mITAA).MITAA был основан на ранее описанном ITAA, 13 , значении индекса, который учитывает биофармацевтические и фармакодинамические свойства местного НПВП, чтобы оценить его внутреннюю эффективность (то есть противовоспалительную активность) и позволить сравнения с другими НПВП. Насколько известно автору, это первое прямое сравнение имеющихся в продаже препаратов для местного применения, содержащих диклофенак и ибупрофен, с использованием этого метода.
Материалы и методы
Материалы
Двенадцать коммерчески доступных НПВП для местного применения были использованы в этом исследовании (качественные составы составов представлены в Таблице 1).Продукты на основе 6 диклофенака в дальнейшем обозначаются от дикло-1 до дикло-6, а продукты на основе 6 ибупрофена обозначаются от Ibu-1 до Ibu-6.
Таблица 1 Качественный состав продуктов диклофенака и ибупрофена, указанный на упаковке |
Проникновение через кожу in vitro
Кожа человека
Кожа была получена из брюшной полости у 6 пациентов во время пластической операции (пациенты дали информированное письменное согласие).Было получено одобрение 2 этических комитетов (Комитет по этике исследований Лотиана, Эдинбург, Великобритания (06 / S1101 / 19), и Служба этики исследований Западной Шотландии, Глазго, Великобритания (08 / S0704 / 30)). После сбора образцы кожи замораживали при -20 ° C до использования. В день эксперимента препараты кожи оттаивали и подвергали дерматомизации до толщины ~ 400 мкм, начиная с рогового слоя. Барьерная целостность образцов кожи была проверена с использованием внутренней процедуры. Все образцы, использованные в этом исследовании, показали электрическое сопротивление> 10.9 кОм и <35 кОм в соответствии с критериями приемлемости для процедуры.
Размер выборки
Образцы кожи живота разделенной толщины были предоставлены 6 донорами кожи человека. Каждую композицию наносили на 2 повторных образца кожи от каждого донора; Таким образом, для каждой композиции было протестировано 12 образцов кожи. Размер выборки был выбран для обеспечения приемлемой уверенности в оценке средних геометрических соотношений (т.е. 95% доверительный интервал [ДИ] -30% / + 43% вокруг среднего геометрического отношения, предполагая, что стандартное отклонение внутри донора равно 0.40 по шкале журнала, основанной на предыдущих внутренних данных [данные в файле, не показаны]).
Процедура проникновения через кожу in vitro
Статические диффузионные клетки Франца (PermeGear, Hellertown, PA, USA) с открытой площадью кожи 0,64 см 2 и объемом рецепторной камеры ~ 5 мл использовали для оценки проницаемости кожи in vitro. В качестве рецепторной жидкости использовали фосфатно-солевой буферный раствор (PBS), содержащий 5% бычьего сывороточного альбумина (BSA) (вес / объем). Эти компоненты рецепторной жидкости были выбраны для обеспечения растворимости лекарственного средства и предотвращения насыщения лекарственным средством в рецепторной жидкости.На основании оценок во время валидации метода растворимость в рецепторной жидкости составила 5,15 мг / мл для диклофенака и 575 мкг / мл для ибупрофена. Исследование проницаемости для обоих препаратов проводилось в условиях погружения.
Образцы кожи помещали между донорской и рецепторной камерами, клетки помещали в коллектор, нагретый для поддержания температуры поверхности кожи 32 ± 1 ° C, и рецепторные жидкости смешивали с использованием магнитной мешалки. Была проведена оценка целостности барьера электрического сопротивления, и образцы кожи не соответствовали критериям приемлемости (электрическое сопротивление> 10.9 кОм и <35 кОм) были исключены.
Чтобы имитировать нанесение однократной рекомендованной дозы (условия «использования») и обеспечить справедливое сравнение между продуктами, составы наносили на поверхность рогового слоя иссеченной кожи живота человека с расщепленной толщиной разовой конечной дозы 10 мг / см 2 для тестируемых продуктов. 19 Образцы рецепторной жидкости (300 мкл) собирали в 0 (перед введением дозы), 2, 4, 8, 16 и 24 часа. Удаленный объем рецепторной жидкости (300 мкл) пополнялся свежим раствором рецепторной жидкости после каждого изъятия.
Все экспериментальные исследования были выполнены Charles River Laboratories (Эдинбург, Великобритания). Проверенные аналитические методы были использованы для анализа образцов рецепторной жидкости методом жидкостной хроматографии и тандемной масс-спектрометрии (LC-MS / MS). Хроматографическое разделение обоих препаратов проводили на колонке Poroshell EC-C18 (50 мм × 2,1 мм, сферические частицы 2,7 мкм).
Для диклофенака подвижная фаза состояла из смеси метанол / муравьиная кислота (100 / 0,5, об. / Об., A) и вода / муравьиная кислота (100/0.5, об. / Об., В) с использованием градиентного элюирования. Скорость потока растворителя составляла 500 мкл / мин. Определение диклофенака в 5% BSA в PBS было подтверждено в диапазоне от 1,00 до 10 000 нг / мл. Нижний предел количественного определения составлял 1 нг / мл. Точность и прецизионность анализа составляли ± 20% и ≤20% соответственно.
Для ибупрофена подвижная фаза состояла из смеси ацетонитрил / аммиак (100 / 0,2, об. / Об., A) и вода / аммиак (100 / 0,2, об. / Об., B) с использованием градиентного элюирования. Скорость потока растворителя составляла 600 мкл / мин. Определение ибупрофена в 5% BSA в PBS было подтверждено в диапазоне 5.От 00 до 5000 нг / мл. Нижний предел количественного определения составлял 5 нг / мл. Точность и прецизионность анализа составляли ± 15% и ≤15% соответственно.
Для обоих препаратов в качестве внутреннего стандарта использовали индометацин (2,50 мкг / мл). Объем впрыска составлял 10 мкл, температура колонки составляла 60 ° C.
Анализ данных
Кумулятивная абсорбция (СА) диклофенака и ибупрофена определялась в каждый момент времени (2, 4, 8, 16 и 24 часа) следующим образом:
, где CA t = кумулятивная абсорбция за время t в нг / см 2 , C t = концентрация лекарственного средства в аликвоте рецепторной жидкости за время t, V = объем рецепторной камеры (~ 5 мл), Q i = количество активного фармацевтического ингредиента в аликвоте рецепторной жидкости в момент времени t, и S = площадь поверхности кожной мембраны (0.64 см 2 ).
Поток диклофенака и ибупрофена для каждого препарата определяли в каждый момент времени (F t ) следующим образом:
Статистический анализ
Ранее было установлено, что значения проницаемости кожи человека имеют логарифмически нормальное (или искаженное ненормальное) распределение, 20 поддерживает использование геометрических средств для сравнения составов. Логарифмически преобразованное среднее значение CA за 24 часа каждого лекарственного средства сравнивали между препаратами с использованием апостериорного тестирования.Поскольку в модель должны были быть включены как фиксированный эффект, так и случайный эффект, была использована модель смешанных эффектов, основанная на оценке остаточного максимального правдоподобия, с формулировкой в качестве фиксированного эффекта и донором в качестве случайного эффекта. Поскольку доверительный интервал (ДИ) для среднего геометрического отношения является рекомендуемым методом для определения эквивалентности исследований проникновения через кожу в соответствии с проектом Руководства EMA по качеству и эквивалентности продуктов для местного применения, для этих анализов использовалось 21 ДИ вместо стандартного отклонения.95% ДИ для средних геометрических соотношений были получены путем обратного преобразования ДИ для различий между составами по шкале с логарифмическим преобразованием, полученной в результате анализа. Никакой поправки на множественность не производилось, и для исследовательских целей был сделан вывод о статистической значимости, если 95% доверительный интервал для отношения среднего геометрического не включал 1.
Оценка mITAA
Ранее Кордеро и др. Рассчитали ITAA с использованием насыщенных растворов НПВП, которые обеспечили составной показатель противовоспалительной активности, который включает как биофармацевтический компонент (максимальный поток), так и фармакодинамический компонент (эффективность ингибирования ЦОГ-2). 13 В текущем исследовании максимальный поток не был достигнут во всех составах в течение 24-часового окна тестирования из-за использования однократного применения лекарства, которое имитировало условия «использования». Следовательно, медианы кумулятивных поглощений, наблюдаемых через 24 часа (CA 24 часа ), были использованы для определения модифицированного ITAA (mITAA) следующим образом:
, где значения IC 50 были взяты из Esser et al. 22 и соответствуют концентрации лекарственного средства, которая вызывает 50% максимального эффекта.Значения IC 50 , сообщенные Esser et al, были измерены в цельной крови человека с использованием продукции простагландина E 2 в качестве суррогата активности ЦОГ-2. Значения IC 50 для диклофенака и ибупрофена составляли 0,013 мкМ и 9 мкМ соответственно.
Результаты
Проникновение через кожу — кумулятивное поглощение
Диклофенак и ибупрофен из всех составов проникают через кожу человека за 24 часа. В абсолютном выражении во всех случаях ибупрофен проникал в большей степени, чем диклофенак.Дикло-1 и Ibu-6 показали самые высокие значения CA за 24 часа в их соответствующих группах, со средним геометрическим значением CA за 24 часа 849 нг / см 2 и 25 282 нг / см 2 , соответственно (Рисунок 1) .
Рис. 1 Кумулятивная абсорбция диклофенака и ибупрофена для местного применения за 24 часа (средние геометрические и 95% доверительный интервал). |
Степень проникновения через кожу сильно различалась в зависимости от состава с одним и тем же лекарством и концентрацией.Среднее геометрическое значение CA за 24 часа колебалось от 119 до 747 нг / см 2 для продуктов, содержащих 1% диклофенака натрия или 1,16% диклофенака диэтиламина (ДЭА) (Рисунок 1). Разница в среднем геометрическом CA за 24 часа между гелевыми препаратами диклофенака DEA (Diclo-5) и диклофенака натрия (Diclo-6) была значительной, при этом натриевая соль абсорбировалась лучше (отношение среднего геометрического CA за 24 часа : 0,16; 95% ДИ 0,10–0,26; таблица 2). Для составов диклофенака DEA 1,16%, хотя между средним геометрическим CA за 24 часа для гелевого состава (Дикло-5) и каждой из эмульсионных составов (Дикло-2, Дикло-3 и Дикло-4) наблюдалась значительная разница , поскольку эмульсии лучше абсорбируют, эмульсии также содержат пропиленгликоль, который является сорастворителем с некоторыми улучшающими проницаемость свойствами.
Таблица 2 Отношения (95% ДИ) скорректированных геометрических средних кумулятивных абсорбций за 24 часа для составов диклофенака и ибупрофена |
Среднее геометрическое CA за 24 часа варьировалось от 5944 до 9293 нг / см 2 для продуктов, содержащих 5% ибупрофена. Разница между средним геометрическим CA за 24 часа для составов кремов с 5% ибупрофеном (Ibu-1, Ibu-2) по сравнению с составами гелей с 5% ибупрофеном (Ibu-3, Ibu-4) была значительной (Таблица 2), с большей абсорбцией при 24 часа для кремов, хотя кремы также содержали пропиленгликоль, который обладает улучшающими проницаемость свойствами.Также наблюдалась значительная разница между средним геометрическим CA за 24 часа для 10% гелевых композиций ибупрофена (Ibu-5 и Ibu-6; отношение среднего геометрического CA за 24 часа : 1,64; 95% ДИ от 1,26 до 2,14), что могло отражают влияние различий в составе препаратов даже при использовании одной и той же лекарственной формы.
Абсорбция не была пропорциональна концентрации препарата. Дикло-6 (1% диклофенак натрия) имел среднее геометрическое CA 24h 747 нг / см 2 , что было аналогично дикло-1 (2.32% диклофенака ДЭА) при 849 нг / см 2 . Это приводит к среднему геометрическому соотношению 0,88 (95% ДИ: от 0,55 до 1,41; Таблица 2), несмотря на 2-кратную разницу в концентрации. Отношение средних геометрических значений CA за 24 часа для составов для местного применения, содержащих 1,16% и 2,32% диклофенака и 5% и 10% ибупрофена (каждый из которых отличается в 2 раза), варьировалось от 2,5 до 7,1 и от 1,7 до 4,3, соответственно (таблица 2). .
Флюс
Все препараты диклофенака приводили к проникновению диклофенака (через роговой слой) и проникновению (через оставшийся эпидермис и первые слои дермы) через кожу к 8 часам, при этом дикло-6 (содержащий 1% диклофенака натрия) доставлял диклофенак раньше (через 4 часа). ), чем другие составы (Рисунок 2).Было два типа профиля потока: составы, не показывающие плато потока к 24 часам (Дикло-1, Дикло-2, Дикло-3 и Дикло-5), и составы, которые выходили на плато около 16 часов (Дикло-4 и Дикло-6). Дикло-1 (содержащий 2,32% диклофенака ДЭА и 2 усилителя проницаемости) имел самый высокий поток через 24 часа.
Рис. 2 Медианные потоки препаратов диклофенака ( A ) и ибупрофена ( B ) для местного применения. |
Все составы ибупрофена приводили к потоку проникновения ибупрофена через кожу, начиная с 2 часов и достигая плато через 8 часов, за исключением Ibu-6, который продолжал увеличивать поток проникновения в течение 24 часов (Рисунок 2).Составы с более высокими концентрациями ибупрофена (Ibu-5 и Ibu-6) имели более высокие значения текучести, чем составы с более низкими концентрациями. Между профилями текучести 5% составов ибупрофена не было большой разницы, независимо от того, были ли они кремами или гелями.
mITAA
значения mITAA варьировались от 4 до 32 для диклофенака и от 0,37 до 2 для ибупрофена, причем значения mITAA для препаратов диклофенака были выше, чем для препаратов ибупрофена во всех случаях (рис. 3).
Рисунок 3 Модифицированный индекс противовоспалительной активности для препаратов диклофенака и ибупрофена для местного применения. |
Среди препаратов диклофенака ДЭА Дикло-1 с более высокой концентрацией лекарственного средства и 2 усилителями проницаемости имел более высокий mITAA, чем композиции с более низкими концентрациями лекарственного средства и меньшим количеством усилителей проницаемости (Дикло-2, Дикло-3, Дикло-4 , и Дикло-5). Диклофенак натрия (Дикло-6) имел более высокий mITAA, чем диклофенак ДЭА (Дикло-5), несмотря на аналогичные концентрации диклофенака и ту же лекарственную форму (гель).
Среди гелевых составов ибупрофена более высокая концентрация лекарства (10% ибупрофен; Ibu-5 и Ibu-6) была связана с более высокими значениями mITAA по сравнению с гелями с более низкой концентрацией лекарства (5% ибупрофен; Ibu-3 и Ibu-4). Пятипроцентные кремы с ибупрофеном с усилителями проницаемости (Ibu-1 и Ibu-2) также имели более высокий mITAA, чем гели ибупрофена (Ibu-3 и Ibu-4) с той же концентрацией лекарства.
Обсуждение
После оценок in vitro, имитирующих рекомендуемые дозы для нанесения, были обнаружены значительные различия в абсорбции через кожу, измеренной с помощью CA 24h , и в потоке между составами.Это справедливо не только для препаратов ибупрофена и диклофенака, но и для этих групп.
Известно, что если лекарство имеет низкий IC 50 , связанная с ним эффективность (связанная с mITAA) будет высокой. Более того, ибупрофен проникает через кожу человека в большей степени, чем диклофенак. Эти результаты согласуются с предыдущими выводами и, вероятно, обусловлены, по крайней мере частично, более низкой молекулярной массой ибупрофена (~ 206 г / моль) по сравнению с диклофенаком (~ 296 г / моль) 23 и значениями pKa этих препараты (3.9 для диклофенака по сравнению с 4,6 для ибупрофена). 24–26 Степень ионизации лекарства влияет на скорость проникновения лекарства. Действительно, неионизированные частицы лекарства имеют более высокий коэффициент проницаемости, чем соответствующие ионизированные частицы. Следовательно, значение pKa лекарственного средства, pH препарата и физиологический pH кожи являются важными параметрами, влияющими на проникновение лекарственного средства. Кроме того, более высокие концентрации ибупрофена (5% и 10%) по сравнению с диклофенаком (1% и 2%) в этих составах также должны вносить вклад в самые высокие наблюдаемые значения для CA 24h и флюса.
Среди составов, содержащих одно и то же лекарство, по-видимому, существует несколько факторов, способствующих различиям в проницаемости, которые выходят за рамки концентрации лекарства в каждом составе, что подтверждается предыдущими выводами. 27–30 Сюда входит выбор вспомогательных веществ, таких как усилители проникновения, используемая лекарственная соль и лекарственная форма.
Например, несмотря на 2-кратную разницу в концентрации диклофенака, CA 24ч был в 4 раза больше для дикло-1 (2.32% диклофенака ДЭА), чем Дикло-2 (1,16% диклофенака ДЭА). Это различие можно объяснить наличием в Дикло-1 дополнительного усилителя проницаемости, олеилового спирта, 31 .
Кроме того, была значительная разница в CA 24h между дикло-5 и дикло-6 (среднее геометрическое соотношение дикло-5: дикло-6 0,16), несмотря на схожие концентрации препарата (1,16% диклофенака ДЭА и 1,0% диклофенак натрия соответственно), качественно аналогичные составы и такую же лекарственную форму (гель).Эти различия могут быть объяснены различными солевыми формами лекарственного средства в каждом составе, как было предложено О’Коннором и др., 28 , которые наблюдали, что диклофенак натрия имеет более высокую скорость мембранного транспорта, чем диклофенак ДЭА, из-за более высокой растворимости при насыщении. натриевой соли. В предыдущей публикации 27 из нашей группы для этих солевых форм диклофенака наблюдался противоположный результат. В частности, через кожу человека проникало в 7 раз больше диклофенака ДЭА (1,16%) по сравнению с диклофенаком натрия (5%), несмотря на более высокую концентрацию лекарственного средства в последнем.Важно отметить, что в этом исследовании диклофенак DEA содержался в составе эмульсии, в то время как диклофенак натрия находился в геле. Вместе эти результаты подтверждают идею о том, что состав, лекарственная форма, форма соли и другие факторы могут по-разному влиять на проницаемость диклофенака, причем одни ее усиливают, а другие уменьшают.
Наибольший вклад в увеличение абсорбции в составах ибупрофена внесла повышенная концентрация лекарственного средства. Однако это не объясняет различия в абсорбции и потоке между составами с самой высокой концентрацией ибупрофена, Ibu-5 и Ibu-6 (оба 10% гелей ибупрофена).Другие различия в составе, такие как гелеобразующий полимер (гидроксиэтилцеллюлоза по сравнению с карбомером) или другой наполнитель, могут быть причиной. Среди 5% составов ибупрофена гелевые составы (Ibu-3 и Ibu-4) имели более низкое CA за 24 часа , чем кремы (Ibu-1 и Ibu-2), что согласуется с предыдущими результатами. 29,30 Это говорит о том, что лекарственная форма является важным параметром проницаемости препаратов ибупрофена.
Целью данного исследования было определение превосходных лекарственных форм НПВП для местного применения на основе mITAA, который обеспечивает оценку внутренней противовоспалительной эффективности НПВП, которая включает как биофармацевтическую (проницаемость, измеряемую CA 24 часа ), так и фармакодинамическую (СОХ- 2 ингибирования) компонентов.MITAA позволяет сравнивать разные НПВП и составы одного и того же НПВП. Когда NSAID разные, mITAA зависит как от эффективности против ЦОГ-2, так и от абсорбции; поэтому считается, что состав с наилучшим сочетанием этих переменных обладает наибольшей противовоспалительной активностью. В случаях, когда значения IC 50 сильно различаются, как это справедливо для диклофенака и ибупрофена, эффективность будет основным фактором противовоспалительной активности (если только лекарство с более высокой активностью не всасывается очень плохо или совсем не всасывается, а лекарство с более низкой активностью препарат очень хорошо всасывается, что делает абсорбцию критической).Когда значения IC 50 одинаковы для разных НПВП, абсорбция будет иметь большее влияние на противовоспалительную активность. Точно так же, когда НПВП в разных препаратах одинаковы, то есть эффективность будет одинаковой, любое различие в противовоспалительной активности полностью зависит от абсорбции; таким образом, состав с большей абсорбцией будет обладать большей противовоспалительной активностью, что отражается более высоким mITAA.
В то время как более высокий CA за 24 часа соответствовал более высокому mITAA в составах, включающих одно и то же лекарство, этого не было при сравнении между лекарствами.Все препараты диклофенака продемонстрировали более высокий уровень mITAA, чем препараты ибупрофена, несмотря на более низкую абсорбцию, что напрямую отражает значительно большую эффективность диклофенака как ингибитора ЦОГ-2 (подтверждено многочисленными исследованиями 13,22,32 ). Поскольку IC 50 диклофенака примерно в 900 раз ниже, чем у ибупрофена, совокупная абсорбция препаратов, содержащих ибупрофен, должна быть в 700 раз больше, чем у диклофенака, чтобы компенсировать эту разницу и достичь сопоставимой противовоспалительной активности.Согласно закону Фика, для продуктов ибупрофена, содержащих 5% или 10% лекарственного средства, по сравнению с 1% или 2% лекарственного средства в продуктах диклофенака, для достижения такой же противовоспалительной активности, как и у продуктов диклофенака, потребуется 150–300-кратный поток. .
Заключение
Диклофенак обладает большей внутренней противовоспалительной активностью, чем ибупрофен. Кроме того, на проницаемость кожи могут влиять различия в составе, включая концентрацию лекарственного средства и форму соли, выбор наполнителей и лекарственную форму.Каждый из этих факторов следует учитывать при выборе НПВП для местного применения для лечения боли и воспаления у пациента. При сравнении составов, содержащих один и тот же НПВП, степень абсорбции будет определять, какой состав проявляет лучшую противовоспалительную активность. Когда НПВП различаются, это определение будет зависеть от баланса всасывания и эффективности ингибирования ЦОГ-2, при этом требуется существенно большее всасывание для компенсации, когда активности сильно различаются, как в случае диклофенака и ибупрофена.Таким образом, эффективность как всасывания, так и ингибирования ЦОГ-2 являются важными факторами противовоспалительной активности для продуктов местного применения, но степень важности каждого из них зависит от того, какие продукты сравниваются.
Благодарности
Автор выражает признательность компании Charles River Laboratories (Эдинбург, Великобритания), выполнившей исследование in vitro. Автор выражает благодарность Корали Валле, Марии-Стелле Ломбарди, Мако Арага и Гийому Фраппену за их вклад в это исследование.Автор благодарит Клотильду Шейнон за рецензию на рукопись. Редакционная помощь была предоставлена Nuventra, США, и профинансирована GlaxoSmithKline Consumer Healthcare, Ньон, Швейцария.
Раскрытие информации
Автор является сотрудником GlaxoSmithKline Consumer Healthcare и не сообщает о других конфликтах интересов в связи с этой работой.
Список литературы
1. Наир Б., Тейлор-Гжевр, РА. Обзор местного применения диклофенака при заболеваниях опорно-двигательного аппарата. Фармацевтические препараты (Базель) .2010. 3 (6): 1892–1908. DOI: 10.3390 / ph4061892
2. Гунайдин Ц., Трюмная СС. Действие нестероидных противовоспалительных средств на молекулярном уровне. Евразийский журнал J Med . 2018; 50 (2): 116–121. DOI: 10.5152 / eurasianjmed.2018.0010
3. Ван Хекен А., Шварц Дж. И., Депре М. и др. Сравнительная ингибирующая активность рофекоксиба, мелоксикама, диклофенака, ибупрофена и напроксена в отношении ЦОГ-2 по сравнению с ЦОГ-1 у здоровых добровольцев. J Clin Pharmacol . 2000. 40 (10): 1109–1120.
4.Дерри С., Конаган П., Да Силва Дж. А., Виффен П. Дж., Мур Р. А.. Актуальные НПВП при хронической скелетно-мышечной боли у взрослых. Кокрановская база данных Syst Rev . 2016; 4: Cd007400.
5. Захер Дж., Альтман Р., Беллами Н. и др. Диклофенак для местного применения и его роль при боли и воспалении: обзор, основанный на фактах. Curr Med Res Opin . 2008. 24 (4): 925–950. DOI: 10.1185 / 030079908X273066
6. МакГеттиган П., Генри Д., Стром Б.Л. Сердечно-сосудистый риск при применении нестероидных противовоспалительных препаратов: систематический обзор популяционных контролируемых наблюдательных исследований. ПЛоС Мед . 2011; 8 (9): e1001098. DOI: 10.1371 / journal.pmed.1001098
7. Salvo F, Fourrier-Reglat A, Bazin F и др. Сердечно-сосудистая и желудочно-кишечная безопасность НПВП: систематический обзор метаанализов рандомизированных клинических исследований. Clin Pharmacol Ther . 2011. 89 (6): 855–866. DOI: 10.1038 / clpt.2011.45
8. Братер Д.К. Противовоспалительные средства и функция почек. Семин Артрит Rheum . 2002; 32 (3 Suppl 1): 33–42. DOI: 10.1053 / sarh.2002.37216
9.Альтман Р., Бош Б., Брун К., Патриньяни П., Янг К. Достижения в разработке НПВП: эволюция продуктов диклофенака с использованием фармацевтических технологий. Наркотики . 2015; 75 (8): 859–877.
10. Evans JM, McMahon AD, McGilchrist MM, et al. Местные нестероидные противовоспалительные препараты и госпитализация по поводу кровотечения и перфорации верхних отделов желудочно-кишечного тракта: рекордное исследование случай-контроль. BMJ . 1995. 311 (6996): 22–26. DOI: 10.1136 / bmj.311.6996.22
11.Тисо Р.Л., Тонг-Нгорк С., Фредлунд К.Л. Пероральный и местный ибупрофен при хронической боли в коленях: проспективное рандомизированное пилотное исследование. Врач-обезболивающий . 2010. 13 (5): 457–467.
12. Кордеро Дж. А., Аларкон Л., Эскрибано Е., Обач Р., Доменек Дж. Сравнительное исследование трансдермального проникновения ряда нестероидных противовоспалительных препаратов. J Pharm Sci . 1997. 86 (4): 503–508. DOI: 10.1021 / js950346l
13. Кордеро Дж. А., Камачо М., Обач Р., Доменек Дж., Вила Л. Индекс местной противовоспалительной активности на основе in vitro для сравнения ряда НПВП. Eur J Pharm Biopharm . 2001. 51 (2): 135–142. DOI: 10.1016 / S0939-6411 (00) 00149-1
14. Goh CF, Lane ME. Состав диклофенака для доставки через кожу. Int J Pharm . 2014. 473 (1–2): 607–616. DOI: 10.1016 / j.ijpharm.2014.07.052
15. Heyneman CA, Lawless-Liday C., Wall GC. Пероральные и местные НПВП при ревматических заболеваниях: сравнение. Наркотики . 2000. 60 (3): 555–574. DOI: 10.2165 / 00003495-200060030-00004
16. Хэдграфт Дж., Уайтфилд М., Рошер PH.Проникновение через кожу препаратов ибупрофена 5% для местного применения: сравнительное исследование in vitro. Skin Pharmacol Appl Skin Physiol . 2003. 16 (3): 137–142. DOI: 10.1159 / 000069759
17. Хаген М., Бейкер М. Проникновение через кожу и ткани после местного применения диклофенака. Curr Med Res Opin . 2017; 33 (9): 1623–1634. DOI: 10.1080 / 03007995.2017.1352497
18. ОЭСР. Руководство по кожной абсорбции . 2019.
19. ОЭСР. OECD Guidelines for the Testing of Chemicals: Absorption Skin Absorption: In vitro Method .2004 г.
20. Уильямс А.С., Корнуэлл, Пенсильвания, Барри Б.В. О негауссовском распределении проницаемости кожи человека. Int J Pharm . 1992. 86 (1): 69–77. DOI: 10.1016 / 0378-5173 (92) -W
21. Ema CHMP. Проект руководства по качеству и эквивалентности продуктов для местного применения . 2018.
22. Esser R, Berry C, Du Z, et al. Доклиническая фармакология люмиракоксиба: нового селективного ингибитора циклооксигеназы-2. Br J Pharmacol . 2005. 144 (4): 538–550.DOI: 10.1038 / sj.bjp.0706078
23. Fini A, Laus M, Orienti I., Zecchi V. Термодинамические функции растворения и распределения некоторых нестероидных противовоспалительных препаратов. J Pharm Sci . 1986. 75 (1): 23–25. DOI: 10.1002 / jps.2600750106
24. Браун М.Б., Мартин Г.П., Джонс С.А., Акомеа Ф.К. Кожные и трансдермальные системы доставки лекарств: текущие и будущие перспективы. Доставка лекарств . 2006. 13 (3): 175–187. DOI: 10.1080 / 10717540500455975
25. Ламберс Х., Писсенс С., Блум А., Пронк Х., Финкель П.Естественный pH поверхности кожи в среднем ниже 5, что благоприятно для местной флоры. Int J Cosmet Sci . 2006. 28 (5): 359–370. DOI: 10.1111 / j.1467-2494.2006.00344.x
26. Сенгупта С. Диклофенак натрия. В: Противовоспалительные и противоревматические препараты, Том II: Новые противовоспалительные препараты . Бока-Ратон, Флорида: CRC Press; 1985: 49–63.
27. Прадал Дж., Валле С.М., Фраппин Дж., Баригуян Ф., Ломбарди М.С. Важность препарата для доставки через кожу диклофенака для местного применения: не все препараты диклофенака для местного применения одинаковы. J Pain Res . 2019; 12: 1149–1154. DOI: 10.2147 / JPR.S1
28. О’Коннор К.М., Корриган О.И. Сравнение физико-химических свойств N- (2-гидроксиэтил) пирролидиновой, диэтиламиновой и натриевой солевых форм диклофенака. Int J Pharm . 2001. 222 (2): 281–293. DOI: 10.1016 / S0378-5173 (01) 00717-7
29. Khullar R, Kumar D, Seth N, Saini S. Составление и оценка эмульгеля мефенаминовой кислоты для местного применения. Саудовская Фарм J . 2012. 20 (1): 63–67.DOI: 10.1016 / j.jsps.2011.08.001
30. Шталь Дж., Волерт М., Кицманн М. Влияние носителей состава на чрескожное проникновение ибупрофена in vitro. BMC Pharmacol . 2011; 11 (1): 12. DOI: 10.1186 / 1471-2210-11-12
31. Kim MJ, Doh HJ, Choi MK, et al. Повышение проницаемости диклофенака жирными кислотами через кожу. Доставка лекарств . 2008. 15 (6): 373–379. DOI: 10.1080 / 10717540802006898
32. Gan TJ. Диклофенак: обновленная информация о его механизме действия и профиле безопасности. Curr Med Res Opin . 2010. 26 (7): 1715–1731. DOI: 10.1185 / 03007995.2010.486301
Индометацин нарушает аутофагический поток, индуцируя дисфункцию лизосом в клетках рака желудка и повышая их чувствительность к цитотоксическим препаратам
Настоящее исследование демонстрирует, что индометацин повышает чувствительность раковых клеток к токсическому действию химиотерапевтических агентов и что это действие связано с недостаточной аутофагией, вызванной ингибирующее действие на лизосомы, органеллы с очевидным потенциалом в качестве мишеней для химиотерапии 16,17 .
Клетки, обработанные индометацином, представили более высокие количества трех различных субстратов аутофагии — компонента мембраны аутофагосомы LC3-II и грузовых рецепторов p62 и NBR1, что позволяет предположить, что индометацин ингибирует процесс аутофагической деградации. Индометацин, по-видимому, нарушил позднюю стадию аутофагического пути, поскольку субстраты накапливались без изменения активности главного регулятора аутофагии mTOR и продолжали накапливаться, когда аутофагия стимулировалась ингибитором mTOR рапамицином.Кроме того, уровни фагофорного компонента LC3-II были снижены, когда аутофагический поток ниже по течению от mTOR ингибировался блокатором PI3K вортманнином. Мы протестировали лизосомную функцию клеток, обработанных индометацином, и наблюдали снижение флуоресцентного сигнала, испускаемого двумя различными ацидофильными зондами, лизотрекером и акридиновым оранжевым, что указывало на базификацию лизосом. Уменьшение соотношения между красной лизосомной и зеленой цитоплазматической флуоресцентными сигналами, испускаемыми акридиновым оранжевым в обработанных индометацином клетках, также свидетельствует об увеличении проницаемости лизосомальной мембраны.Интересно, что эти изменения были связаны с центробежным движением лизосом от их нормального перинуклеарного положения к периферии клетки, что недавно было связано с пониженной кислотностью и повышенной проницаемостью, как наблюдалось в настоящем исследовании 18,19 . В соответствии с подщелачиванием лизосом мы наблюдали снижение активности катепсинов в обработанных индометацином клетках, что объясняет недостаточную деградацию аутофагических субстратов.
Для дальнейшего анализа роли лизосомального действия индометацина на аутофагическое ингибирование мы оценили его эффекты в присутствии двух лизосомальных ингибиторов: бафиломицина B1 и хлорохина.Первый обладает хорошо изученным двойным механизмом действия, включающим блокаду как V-АТФазы, ответственной за закисление лизосом, так и слияния лизосомы и аутофагосомы 7 . В наших экспериментах бафиломицин B1 индуцировал значительное ингибирование всех лизосомных параметров и логически вызывал накопление всех трех аутофагических субстратов (LC3-II, p62 и NBR1). Ни один из этих эффектов не был усилен совместным лечением с индометацином, что предполагает, что нарушение лизосомальной функции бафиломицином перевешивает активность индометацина и дополнительно подтверждает гипотезу о том, что лизосомы являются мишенью индометацина.
Комбинация индометацина и хлорохина, по-видимому, создает более сложную ситуацию. Хлорохин вызывал легкую дисфункцию лизосом, которая усиливалась индометацином. Соответственно, накопление p62, вызванное бафиломицином B1, было выше, чем накопление, индуцированное хлорохином, но сравнялось с комбинацией хлорохина и индометацина. Что касается LC3-II, эффекты хлорохина были сопоставимы с эффектами, вызванными бафиломицином B1, и даже в этом случае уровни LC3-II имели тенденцию быть выше в клетках, обработанных комбинацией хлорохина и индометацина.Фактически, эта комбинация препаратов привела к накоплению большего количества точек LC3-II. Поскольку активация аутофагического потока в качестве компенсаторного ответа на лизосомальную блокаду кажется маловероятной в свете результатов, полученных с бафиломицином B1 и неизменной активностью mTOR 20 , возможно, что хлорохин, отдельно или в комбинации с индометацином, вызывает неканонические Липидирование LC3 21 , процесс, который не может происходить в присутствии бафиломицина B1, потому что он зависит от активности V-АТФазы.Несмотря на это, в целом, наши результаты показывают, что индометацин усиливает действие хлорохина, препарата, который традиционно используется против малярии и проходит клинические испытания в качестве дополнительного средства к противоопухолевым режимам 22,23 . В соответствии с нашими результатами, предыдущие исследования сообщают о параллелизме между индометацином и хлорохином в отношении их воздействия на раковые эпителиальные клетки 24 и синергии между двумя препаратами в их действии против малярии 25 .
Обоснование включения хлорохина в противоопухолевые схемы основано на том факте, что аутофагия возникает как механизм устойчивости раковых клеток к цитотоксическим препаратам 22,23 . Мы наблюдали, что оксалиплатин, противоопухолевый препарат, обычно используемый при раке желудка, имеет тенденцию увеличивать присутствие точки LC3-II в клетках AGS, и что это увеличение более выражено в присутствии индометацина, отдельно или в сочетании с хлорохином. Таким образом, кажется, что оксалиплатин способствует аутофагии в этих раковых клетках желудка и что индометацин, сам по себе и особенно в присутствии хлорохина, ингибирует деградацию вновь образованных аутофагосом.Когда мы добавляли индометацин в питательную среду после периода в присутствии оксалиплатина, этот НПВП усиливал токсический эффект оксалиплатина и вызывал сопутствующее снижение аутофагической активности, что может объяснить синергизм, наблюдаемый между двумя препаратами в настоящем исследовании и ранее. в модели рака in vivo 26 . Таким образом, подавление лизосомной функции и последующее вмешательство в аутофагическую деградацию могут частично отвечать за положительные эффекты индометацина при раковых процессах, о которых сообщалось в некоторых исследованиях 4,26,27 .
В отличие от того, что происходит в раковых эпителиальных клетках желудка, сообщалось о токсическом эффекте аутофагии в нетрансформированных клетках желудка и кишечника 10,11,28 . Эти исследования показывают, что ингибирование аутофагии фармакологическими или генетическими средствами защищает клетки от цитотоксичности индометацина, и предполагается, что индометацин вызывает повреждение, стимулируя аутофагию. Однако некоторые из их результатов ставят под сомнение идею активированной аутофагии. Клетки, обработанные индометацином, показали более высокое соотношение LC3-II / LC3-I и повышенные уровни LC3-II, общего LC3 и ATG5 10,11 , возможно, из-за индукции аутофагии или ингибирования аутофагической деградации.Чтобы определить, кто из двух является ответственным, необходимо оценить аутофагический поток в присутствии лизосомального ингибитора 7 . Единственный результат, сообщенный в этом отношении, свидетельствует об ингибирующем действии, поскольку индометацин не увеличивал количество аутофагосом в обработанных хлорохином клетках 10 . Это подтверждается сообщениями о накоплении убиквитинированных белков в клетках, обработанных индометацином 28 . В других исследованиях с использованием ингибитора ЦОГ-1 SC-560 29 или сулиндака 30 было предложено стимулирующее действие на аутофагию без анализа аутофагического потока, что делает их неубедительными.С другой стороны, хорошо контрастирующее стимулирующее действие ингибитора ЦОГ-2 целекоксиба на этот процесс наблюдалось в нескольких линиях колоректальных клеток человека 31 . Таким образом, влияние НПВП на аутофагию в эпителиальных клетках желудочно-кишечного тракта далеко не ясно, но, по-видимому, зависит от лекарственного средства.
Независимо от воздействия индометацина на аутофагический поток, тот факт, что ингибирование аутофагии оказывает защитный эффект против его пагубного действия 10,11,28 , является интригующим.Возможно, что ингибирование аутофагической деградации и последующее накопление аутофагосом / аутолизосом вызывает токсический эффект, который снижается за счет предотвращения образования этих структур, несмотря на накопление аутофагических субстратов в цитозоле. В соответствии с этим аргументом, различные ингибиторы аутофагии могут по-разному влиять на выживаемость клеток в зависимости от фазы (ранней или поздней) целевого процесса. Это необходимо для получения дополнительных знаний о сложной взаимосвязи между аутофагией и выживанием / смертью клеток, особенно в контексте рака 32,33 .Наши результаты указывают на хорошо известный НПВП индометацин, отдельно или в сочетании с классическим лекарственным средством хлорохином, как лекарство-кандидат, способность которого повышать чувствительность раковых клеток к цитотоксическим агентам требует дальнейшего изучения.
НПВП нарушают гомеостаз кишечника путем подавления макроаутофагии в эпителиальных клетках кишечника
Культура клеток
Клетки YAMC были любезно предоставлены доктором Робертом Уайтхедом 16 . Если не указано иное, клетки YAMC культивировали в среде RPMI 1640, содержащей GlutaMAX, Hepes (Thermo Fisher Scientific, Waltham, MA), с добавлением 5% фетальной бычьей сыворотки (Thermo Fisher Scientific), ITS (Corning, Tewksbury, MA) и интерферона мыши. гамма (Sigma-Aldrich, St.Луис, Миссури).
Аутофагический поток
Для определения влияния НПВП на аутофагический поток клетки YAMC высевали в 6-луночные планшеты (8,5 × 10 5 клеток / лунку) и инкубировали в недопустимых условиях при 37 ° C / 5%. СО 2 . На следующий день среду заменили на соответствующий препарат и вернули в инкубатор. Через 24 часа после добавления лекарства клетки промывали один раз DPBS. Для проточной цитометрии клетки отделяли и переносили в центрифужную пробирку для окрашивания.Для вестерн-блоттинга 250 мкл буфера для анализа радиоиммунопреципитации (RIPA; 150 мМ хлорид натрия, 1,0% NP-40, 0,5% дезоксихолат натрия, 0,1% додецилсульфат натрия (SDS), 50 мМ Трис, pH 8,0) с добавлением коктейля ингибиторов протеаз. (Sigma Aldrich) были добавлены непосредственно в скважину. Планшеты инкубировали при 4 ° C в течение 10–20 минут. Лизаты переносили в пробирку и центрифугировали при 14000 × g в течение 15 мин. Концентрацию белка измеряли в супернатанте с использованием анализа бицинхониновой кислоты (Thermo Fisher Scientific).
Анализы на инфекцию
SalmonellaАнализы на заражение Salmonella проводили, как описано ранее 51,52 . Вкратце, свежую колонию Salmonella enterica серовара Typhimurium (ATCC 14028) использовали для инокуляции 2 мл бульона Лурия (LB; BD Biosciences, Сан-Хосе, Калифорния) и выращивали в течение 16–18 часов при 37 ° C и 220 об / мин. . На следующий день ночную культуру разводили в 40 раз в 10 мл свежего LB и выращивали в течение 3 раз.5 ч при 37 ° C и 220 об / мин. Культивированные бактерии промывали один раз DPBS, ресуспендировали до желаемой оптической плотности и использовали для инфицирования ранее засеянных клеток YAMC (8,5 × 10 5 клеток / лунку в 6-луночных планшетах) при множественности инфицирования (MOI) 100 при отсутствии -разрешительные условия. Через 30 минут после инфицирования клетки промывали и заменяли средой, содержащей гентамицин (100 мкг / мл) и соответствующим лекарственным средством. Через час среду заменили гентамицином с более низкой концентрацией (10 мкг / мл) и соответствующей обработкой.В указанные моменты времени клетки промывали один раз DPBS, отделяли и переносили в центрифужную пробирку для окрашивания.
Секреция IL-18
клеток YAMC, высеянных в 96-луночные планшеты из расчета 4 × 10 4 клеток / лунку, инфицировали Salmonella при MOI 100 и обрабатывали соответствующим соединением, как описано выше ( Salmonella анализа инфекции). Через 18 часов после инфицирования концентрацию секретируемого IL-18 в супернатанте измеряли с помощью ELISA (ab218808, Abcam Cambridge, MA) в соответствии с протоколом производителя.Концентрации IL-18 были нормализованы по количеству клеток, как определено с помощью анализа Janus green 53 .
Вестерн-блот анализ
Лизаты белков (6,5–9 мкг для клеток и 25 мкг для соскобов слизистой оболочки тонкого кишечника) в 1X SDS / β-меркаптоэтанольном буфере растворяли в 4–20% геле, не содержащем пятен TGS (BioRad, Hercules, CA) и переносится электропереносом на переносящую мембрану из поливинилидендифторида (Thermo Fisher Scientific). Вестерн-блоттинг выполняли с использованием кроличьих анти-LC3A / B (1: 1000; Cell Signaling Technology # 4108, Danvers, MA), кроличьих анти-SQSTM1 / p62 (1: 1000; Cell Signaling Technology # 5114) или кроличьих анти-GAPDH. (1: 1000; Cell Signaling Technology # 5174) и козьи антикроличьи антитела, конъюгированные с пероксидазой хрена (1: 2000; Cell Signaling Technology # 7074).Полосы белка визуализировали с помощью хемилюминесценции с использованием системы визуализации ChemiDocTouch (BioRad). Полосы были количественно определены с использованием программного обеспечения ImageLab версии 5.2.1.
Проточная цитометрия
Собранные клетки фиксировали и повышали проницаемость с помощью раствора CytoFix / CytoPerm (BD Biosciences) в течение 1 часа при 4 ° C. Клетки промывали один раз буфером Perm / Wash (BD Biosciences) и инкубировали в том же буфере в течение 30 минут при 4 ° C. После инкубации клетки центрифугировали, окрашивали кроличьими анти-SQSTM1 / p62 (1: 100; Cell Signaling Technology # 5114) или антисывороткой Salmonella O группы B (1: 250; BD Biosciences # 229481) в течение ночи при 4 ° C, а затем Alexa Fluor 488-конъюгированные антикроличьи (1: 500; Cell Signaling Technology # 4412) антитела в течение 1 ч при комнатной температуре.Образцы анализировали с помощью проточного цитометра BD FACScan (BD Biosciences).
Для экспериментов с LysoTracker® клетки YAMC высевали в 24-луночные планшеты (1,9 × 10 5 клеток / лунку) и инкубировали в недопустимых условиях (37 ° C, 5% CO 2 ). На следующий день среду заменяли соответствующей лекарственной обработкой, и клетки возвращали в инкубатор (37 ° C, 5% CO 2 ). Через 24 часа клетки окрашивали 50 нМ LysoTracker® Red DND-99 (Invitrogen, Carlsbad, CA) в течение 30 минут при 37 ° C.Клетки отделяли от планшетов, центрифугировали и ресуспендировали в PBS. Образцы анализировали с помощью проточного цитометра BD FACScan (BD Biosciences).
Микроскопия
Для экспериментов с LysoTracker® клетки YAMC высевали в покровное стекло 2-луночной камеры (2,1–5,1 × 10 5 клеток / лунку) и инкубировали в недопустимых условиях (37 ° C, 5% CO 2). ). Лечение было добавлено за 24 часа до получения изображения. Лизосомные везикулы и ДНК окрашивали 50 нМ LysoTracker® Red DND-99 (Invitrogen) и Hoechst 33342 (Invitrogen) в течение 30 и 15 минут соответственно при 37 ° C.Клетки получали с помощью конфокального микроскопа Zeiss LSM 780. Для количественной оценки воздействия на лизосомальные везикулы измеряли площадь положительных везикул Lysotracker® на поле и нормализовали по отношению к контролю DMF.
Для окрашивания клеток LAMP-1 клетки YAMC высевали в покровное стекло 8-луночной камеры (3,2–7,7 × 10 4 клеток / лунку) и инкубировали в недопустимых условиях (37 ° C, 5% CO 2). ). На следующий день СМИ заменили на соответствующую обработку. Через 24 часа после добавления лекарства клетки промывали, фиксировали 4% параформальдегидом, блокировали 5% нормальной козьей сывороткой (NGS) и окрашивали мышиным антителом против LAMP1 / CD107a (1: 400; Thermo Fisher # MA1-25620) при температуре 4 ° C в течение ночи, а затем антимыши, конъюгированные с Alexa Fluor 488 (1: 600; Cell Signaling Technologies # 4408) в течение 1 ч при комнатной температуре.Клетки получали с помощью конфокального микроскопа Zeiss LSM 780. Для количественной оценки воздействия на лизосомальные везикулы измеряли площадь LAMP-1-положительных везикул на поле и нормировали на площадь контроля DMF.
Для окрашивания LAMP-1 в фиксированной формалином залитой парафином ткани (FFPE) срезы (толщиной 5 мкм) инкубировали при 55 ° C в течение 15 минут, депарафинизировали (D-лимонен) и подвергали поиску антигена (Diva Decloaker, 100 ° C в течение 10 мин). Срезы были проницаемы с помощью DPBS / 1% NGS / 0,4% тритона, заблокированы DPBS / 5% NGS / 0.4% тритоном и окрашивали крысиным анти-LAMP-1 (3,5 мкг / мл; DSHB 1D4B) и кроличьим анти-p62 (1: 125; Novus Biologicals # NBP1-49956, Литтлтон, Колорадо) при 4 ° C в течение ночи с последующим использованием Alexa Конъюгированные с Fluor 488 антитела против крысы (1: 125, Invitrogen # A11006) и антитела против кроликов, конъюгированные с Alexa Fluor 594 (1: 500; Cell Signaling Technologies # 8889) в DPBS / 1% NGS / 0,4% тритоне для 1-2 ч при комнатной температуре. Изображения тканей получали с помощью конфокального микроскопа Zeiss LSM 780.
Для количественной оценки площади бокаловидных клеток фиксированные срезы ткани FFPE или метакарна (толщиной 5 мкм) окрашивали альциановым синим.Десять репрезентативных изображений (400x) для каждой ткани были получены с использованием светлопольного микроскопа Olympus BX40 с камерой микроскопа 18MP (AmScope) и программного обеспечения ToupView v3.7.7934 (ToupTek, Чжэцзян, Китай. С помощью программного обеспечения TopView были нарисованы границы вокруг каждой ячейки и Используется для расчета площади клеток (4912 пикселей = 230 мкм с использованием калибровочного слайда микроскопа 1 мм). Кубковидные клетки без определенных границ или в контакте с краями поля не анализировались.
Для визуализации бактерий фиксированные срезы тканей метакарном (толщиной 5 мкм ) были окрашены зондом EUB-338, конъюгированным с AlexaFluor 594, как описано ранее 54,55 .Изображения тканей получали с помощью конфокального микроскопа Zeiss LSM 780. Для количественной оценки доли инфицированных крипт было исследовано восемь репрезентативных изображений каждой ткани на наличие бактерий, положительных на общее количество крипт в поле.
Для анализа с помощью электронной микроскопии готовили срезы подвздошной кишки аналогично описанным ранее 56 . Сегменты свежей слизистой оболочки длиной примерно 1 см были разрезаны в продольном направлении, плоско прикреплены в покрытых сильгардом чашках Петри слизистой оболочкой вверх и погружены в раствор альдегидного фиксатора (1.25% глутаральдегида и 4% параформальдегида в 0,1 М какодилатном буфере, pH 7,4) в течение 1,5 ч на шейкере при комнатной температуре. Затем ткани пост-фиксировали в 1% растворе четырехокиси осмия в 0,1 М какодилатном буфере в течение 1 часа на шейкере при комнатной температуре и окрашивали насыщенным уранилацетатом в течение 1 часа на шейкере при комнатной температуре. После обезвоживания в увеличивающихся концентрациях этилового спирта (30%, 50%, 80%, 95% и 100%) ткани были пропитаны пропиленоксидом и введены в Eponate 12.Срезы тканей делали (толщиной ~ 100 нм) с использованием ультрамикротома Leica EM UC6 и алмазного ножа Diatome, и срезы окрашивали уранилацетатом и цитратом свинца по Рейнольдсу. Клетки Панета и бокаловидные клетки получали с помощью просвечивающего электронного микроскопа FEI Morgagni 268, оборудованного камерой Imageview III CCD. Пакет программ Photoshop использовался для настройки яркости и контрастности изображений, а также для расстановки панелей фигур.
Диаметр гранул клеток Панета, диаметр пузырьков бокаловидных клеток и толщина эндоплазматического ретикулума измеряли с помощью функции «Анализ-Измерение» в программном пакете Image J.Для учета неоднородностей формы диаметры гранул клеток Панета (внутренний и внешний диаметры) и пузырьков бокаловидных клеток выражали как среднее значение диаметров по 4 осям (каждая ось вращалась с шагом 45 градусов). Кроме того, толщину слоя эндоплазматического ретикулума выражали как среднее значение 5 различных измерений, выполненных в случайных местах по его длине.
In vivo исследованияПротоколы на животных были одобрены Комитетом по уходу и использованию животных Техасского университета A&M в соответствии с руководящими принципами соответствующих институциональных и регулирующих органов (AUPs 2017-0140, 2017-0142, 2017-0290).С животными обращались и лечили, как описано ранее 57 . Вкратце, мышей C57BL / 6J в возрасте от 8 до 10 недель, не содержащих специфических патогенов, были приобретены у Envigo и позволили им акклиматизироваться в течение 1-2 недель. Мышей кормили стандартизированной диетой для лабораторных грызунов (рацион для грызунов Teklad, продукт Envigo номер 8604) и стерильной водой ad libitum. Мышей случайным образом разделили на 2 группы (n = 3–6 мышей / группа / клетка): индометацин 10 мг / кг или контрольный носитель и переселили в соответствии с распределением по группам. Для приготовления обработки исходный раствор индометацина в ДМФ или NMP разбавляли в DPBS до желаемой конечной концентрации.Индометацин и контрольный носитель (200 мкл 2,4% ДМФ или 0,5% NMP) вводили через желудочный зонд. Фекалии собирали до, через 24 и 48 ч после введения через желудочный зонд, помещая отдельных животных в вентилируемые чашки для образцов до тех пор, пока они не выходили из фекалий, и немедленно замораживали их при -80 ° C. Через 24 часа после последнего желудочного зондирования мышей умерщвляли посредством удушения CO 2 . Последнюю треть тонкой кишки собирали, открывали в продольном направлении, промывали холодным PBS с добавлением ингибиторов протеаз и фосфатаз и разрезали пополам.Дистальную половину фиксировали i) в метакарне или ii) 10% формалином и свернули в швейцарский рулон, залили парафином и окрашивали гематоксилином и эозином (H&E), альциановым синим или использовали для иммунофлуоресцентных исследований. Срезы, окрашенные H&E, оценивали на воспаление кишечника аттестованным слепым анатомическим ветеринарным патологом, как описано ранее 23 . Для проксимальной половины соскоб со слизистой оболочки собирали и замораживали при -80 ° C для последующего анализа экспрессии генов и количественного определения белка.
Для тестов in vivo на заражение Salmonella мышам (в возрасте от 12 до 15 недель, n = 6 / группа) перорально вводили через зонд 200 мкл НПВП, индометацина (10 мг / кг в носителе), стрептомицина (20 мг в носителе) или контрольном носителе (DPBS / 5% ДМФ / 0,5% карбоксиметилцеллюлоза). Через 24 часа мышей инокулировали 200 мкл 5 × 10 8 КОЕ / мл Salmonella enterica серовара Typhimurium (ATCC 14028) в DPBS. Через 24 часа после инокуляции фекалии собирали, как описано выше, и переносили в чистую пробирку, заполненную PBS.Мышей умерщвляли путем асфиксии CO 2 . Отдельный пластырь Пейера (PP), ближайший к слепой кишке, и содержимое слепой кишки собирали и переносили в чистую пробирку, содержащую PBS. Образцы фекалий и слепой кишки гомогенизировали встряхиванием, при необходимости разбавляли и помещали в LB-агар с добавлением 25 мкг / мл налидиксовой кислоты. PP измельчали, при необходимости разбавляли и высевали в LB-Agar с добавлением 25 мкг / мл налидиксовой кислоты. Планшеты инкубировали в течение ночи при 37 ° C. Колонии подсчитывали на следующий день и нормализовали по массе образца.
Кальпротектин ELISA
Уровни кальпротектина в фекалиях измеряли с помощью ELISA согласно протоколу производителя с небольшими изменениями. Вкратце, ~ 100 мг фекалий добавляли к 4,9 мл буфера для экстракции (0,1 М Трис, 15 мМ NaCl, 1 М мочевина, 1 мМ CaCl 2 , 0,1 М лимонная кислота, 0,5% БСА, 0,25% гентамицин, pH 8. ), встряхивают и центрифугируют при 3000 × g в течение 5 минут. Супернатант собирали, разбавляли (в 250–25 000 раз) 1% BSA / PBS и использовали для измерения концентраций кальпротектина.Значения выражены в количестве кальпротектина на грамм фекалий.
qRT-PCR
РНКиз соскобов кишечника экстрагировали с использованием набора EZNA Total RNA (Omega Bio-Tek) в соответствии с протоколом производителя. Уровни экспрессии генов измеряли с помощью количественной ПЦР с обратной транскрипцией в реальном времени (qRT-PCR) (qScript One-Step Kit, Quanta Biosciences, Gaithersburg, MD) с использованием праймеров, показанных в таблице 1.
Tablee 1 Название гена и праймеры, используемые в эта рукопись.Распространение бактерий
Для измерения распространения бактерий собирали правую латеральную или медиальную долю печени, погружали в этанол, затем в PBS, измельчали в свежем PBS и помещали в LB-агар в аэробных условиях на 24–48 часов.Подсчитанные колонии нормализовали по массе ткани. Для чашек без видимого или слишком большого роста количество колоний было произвольно установлено на 1 и 1000 соответственно.
Анализ данных
Данные анализировали с использованием статистического программного обеспечения S-PLUS (версия 8.2, TIBCO Inc., Сиэтл, Вашингтон), если не указано иное. Результаты, измеренные в один момент времени ( i , и ., Микроскопия, проточная цитометрия, экспрессия генов и экспрессия белка), сравнивались между группами лечения с использованием обобщенной линейной модели с апостериорным тестированием на попарные различия между группами с использованием Метод Сидака 58 .Данные были зарегистрированы как 10 — при необходимости преобразованы в соответствии со статистическими допущениями. Для повторных измерений ( i , и ., Калпротектин и Salmonella, КОЕ) для учета повторных измерений на отдельных мышах использовалась линейная регрессия со смешанными эффектами ( i . e ., Мышь моделировалась как случайный эффект). При необходимости данные были преобразованы в журнал 10 для улучшения соответствия модели. Апостериорные сравнения попарных различий между обработками и днями проводились с использованием метода Sidak 47 .Показатели микроскопической патологии сравнивали с тестом суммы рангов Вилкоксона. Для всех анализов была установлена значимость P <0,05.
Моделирование действия нестероидных противовоспалительных препаратов в сигнальных путях и путях регуляции miRNA
Abstract
На сегодняшний день широко признано, что нестероидные противовоспалительные препараты (НПВП) могут оказывать значительное противоопухолевое действие в отношении многих типов рака. Длительное использование НПВП тесно связано с различными побочными эффектами.Поэтому адаптация приложения NSAID к отдельным пациентам стала необходимым и актуальным шагом на пути к персонализированной медицине. В этом исследовании используется системно-биологический подход для построения молекулярной модели (модели NSAID), содержащей путь циклооксигеназы (ЦОГ) и связанные с ним сигнальные пути. Четыре признака рака интегрированы в модель, чтобы отразить различные аспекты онкогенеза, связанные с развитием. Кроме того, разработан сравнительный анализ потоков (FCA) на основе сети Петри для переноса в модель динамических свойств (включая чувствительность к лекарствам) отдельной клеточной системы.Профили экспрессии генов различных типов опухолей с доступной информацией о лекарственном ответе применяются для подтверждения прогностической способности модели НПВП. Кроме того, на основе пути ЦОГ исследуются две терапевтические стратегии развития: синтетическая летальность и открытие биомаркеров микроРНК (миРНК). В заключение, результат этого исследования демонстрирует, что модель NSAID, включающая экспрессию генов, регуляцию генов, передачу сигналов, взаимодействие белков и другие клеточные процессы, способна предсказать индивидуальные клеточные ответы на различные терапевтические вмешательства (такие как NS-398 и COX -2 специфическое ингибирование siRNA).Это убедительно свидетельствует о том, что этот тип модели может отражать физиологические, патологические процессы и процессы развития человека. Подход к открытию биомаркера miRNA продемонстрирован для идентификации miRNA с онкогенными и опухолевыми супрессивными функциями для отдельных клеточных линий опухолей молочной железы, толстой кишки и легких. Достигнутые результаты согласуются с различными независимыми исследованиями, в которых изучались биомаркеры miRNA, связанные с диагностикой лечения рака, поэтому они могут пролить свет на развитие открытия биомаркеров на индивидуальном уровне.Конкретные результаты этого исследования могут способствовать дальнейшему развитию персонализированной медицины с системно-биологическим подходом.
Образец цитирования: Li J, Mansmann UR (2013) Моделирование действия нестероидных противовоспалительных препаратов в сигнальных путях и путях регуляции miRNA. PLoS ONE 8 (8): e72477. https://doi.org/10.1371/journal.pone.0072477
Редактор: Хулио Вера, Университет Эрлангена-Нюрнберга, Германия
Поступила: 28 февраля 2013 г .; Одобрена: 10 июля 2013 г .; Опубликован: 14 августа 2013 г.
Авторские права: © 2013 Li et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Эта работа была поддержана Немецким институтом исследований рака (DKFZ) (http://www.dkfz.de) и Немецким консорциумом трансляционных исследований рака (DKTK). Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
НПВП — это класс лекарств с различными химическими структурами. Однако они могут вызывать общий терапевтический эффект: противовоспалительный и противоопухолевый эффект [1]. Ключевым молекулярным механизмом для этого типа противоопухолевого препарата является ингибирование пути циклооксигеназы (ЦОГ), центральные компоненты которого включают циклооксигеназу-2 (ЦОГ-2), цитозольные трансферазы глутатиона (GSTM2, 3) и простагландин E 2 (ПГЕ 2 ).На этом пути ключевыми этапами являются ферментативное превращение арахидоновой кислоты в простагландин G 2 (PGG 2 ), катализируемое ЦОГ (ЦОГ-1 и -2), и последующее преобразование из PGG 2 в простагландин H 2 (PGH 2 ) катализируется теми же ферментами. Каждый нижестоящий компонент (включая PGE 2 , PGI 2 , PGD 2 , PGF 2 и TXA 2 ), полученный из PGH 2 , имеет свои уникальные биологические функции, чтобы опосредовать воспалительные реакции и вовлекать патофизиологические процессы. [2,3].
На сегодняшний день широко признано, что НПВП могут оказывать значительное противоопухолевое действие в отношении многих типов рака, таких как рак толстой кишки [4], легких [5], простаты [6], головы и шеи [7] и желудка [ 8]. Было подсчитано, что регулярное использование НПВП в течение 10-15 лет может снизить более чем на 40% случаев рака толстой кишки [9]. Кроме того, было подсчитано, что только в США ежегодно закупается более 20 миллиардов таблеток аспирина (НПВП 1-го поколения) и что более 1% населения мира потребляет по крайней мере одну таблетку аспирина в день [10].К сожалению, частое и продолжительное использование НПВП было связано с различными побочными эффектами лекарств, включая гастрит, боль в животе, язвенную болезнь, желудочно-кишечное кровотечение, тошноту и другие [11]. Чтобы свести к минимуму побочные эффекты препарата и произвести высококачественные НПВП, главным интересом было выявление путей, связанных с НПВП, а также их физиологических и патологических функций.
До сих пор было проведено множество исследований для достижения цели понимания молекулярного механизма действия НПВП, например, Данненберг и Заким [12] сосредоточили внимание на том факте, что НПВП первого поколения ингибируют ЦОГ-1 и ЦОГ-2, которые являются ключевыми ферментами, ответственными за биосинтез простагландина из арахидоновой кислоты, и они обнаружили разнообразную биологическую активность простагладинов и соответствующих производных продуктов; Fosslien [13] резюмировал, что активность ЦОГ-2, которая не обнаруживается в большинстве нормальных тканей, может сильно индуцироваться цитокинами, факторами роста, онкогенами и промоторами опухолей.Эти результаты указывают на вклад СОХ-2 в канцерогенез; впоследствии во многих исследованиях было обнаружено, что PGE2 может активировать сигнальные каскады для выполнения перекрестных помех и синергетического эффекта с различными сигнальными путями, такими как передача сигналов рецептора эпидермального фактора роста (EGFR) [14], передача сигналов ядерного рецептора [15], ядерный фактор гена каппа-легкого полипептида. энхансер в B-клетках (NfκB) -сигнализация [16], саркома крысы (Ras) -митоген-активированная протеинкиназа (MAPK), сигнализирующая о факторах роста эндотелия сосудов (VEGFR) [19], янус-киназа / преобразователь сигналов и активатор транскрипции (JAK-STAT) -сигнализация [20] и другие.
Хотя детали молекулярных механизмов НПВП были выяснены, существует потребность в рассмотрении интегративных систематических подходов для реконструкции и математического анализа крупномасштабных сигнальных сетей, связанных с НПВП. Мы хотим исследовать, может ли такой подход к моделированию, включающий внеклеточные и внутриклеточные сигнальные механизмы, обеспечить понимание динамического поведения отдельной клеточной системы на системном уровне. Мы также намерены исследовать, может ли моделирование молекулярных механизмов НПВП помочь адаптировать применение НПВП к индивидуальному уровню, чтобы предсказать эффект НПВП в зависимости от индивидуума.
Кроме того, биомаркеры определяются как измеряемые молекулярные, клеточные или функциональные параметры, которые могут указывать на конкретный генетический, физиологический или функциональный статус клеточной системы [21]. На сегодняшний день не представлен эффективный подход in silico для обнаружения биомаркеров miRNA высокого качества. Следовательно, мы хотим исследовать, может ли моделирование сетей регуляции miRNA помочь нам продвинуться дальше к этой цели.
Впервые в этом исследовании строится молекулярная модель на основе литературной информации о пути ЦОГ и связанных с ним путей.Мы назвали ее моделью NSAID, содержащей 3874 компонента и 6398 биохимических реакций. Кроме того, мы разработали сравнительный анализ потоков (FCA) для включения индивидуальной генетической информации и различных значений кинетических параметров в модель для моделирования. Применяя этот подход, мы демонстрируем эффект НПВП in silico и его дальнейшее терапевтическое применение с удовлетворительными результатами.
Результаты
Конструкция модели
Модель NSAID содержит три слоя: слой генов, слой РНК и еще один слой (включает белок, комплекс, метаболит).В модели каждый ген принимает участие в соответствующей реакции транскрипции, чтобы генерировать свою мРНК, которая, в свою очередь, производит свой белковый продукт посредством соответствующей трансляции. Факторы транскрипции могут быть перемещены в нуклеоплазму для контроля своих генов-мишеней путем стимулирования / подавления реакций транскрипции (дополнительная информация S1). Следовательно, все три слоя в модели взаимосвязаны друг с другом. В таблице 1 приведены компоненты модели и реакции. Центральная часть этой модели — путь ЦОГ, где он начинается с транскрипции генов ЦОГ.Они приводят к белковым продуктам COX, которые связываются с доступной арахидоновой кислотой в модели и катализируют ее превращение в PGG2 в условиях кислорода (рис. 1). PGG2 затем превращается в нестабильный промежуточный продукт PGh3 посредством второй ферментативной катализации СОХ. Впоследствии различные простагландины (PGE 2 , PGI 2 , PGD 2 , PGF 2 и TXA 2 ) могут быть получены из PGh3 с присутствием соответствующих тканеспецифичных простагландинсинтаз (PTGES, PTGIS, PTGDS, PTGFS и TBXAS1) [2].Различные простагландины могут связываться с соответствующими рецепторами, и специфическое связывание между простагландинами и их рецепторами может вызывать сигнальные каскады, которые участвуют в различных сигнальных путях для осуществления клеточных функций и сигнальных ответов [3] (Рисунок 1). Модель содержит 20 сигнальных путей, а дополнительная информация S2 перечисляет литературу и информацию о компонентах каждого пути в модели.
| Компонент | No. | Реакция | № | ||
|---|---|---|---|---|---|
| ген | 766 | транскрипция | 1145 | ||
| мРНК | 1530 | трансляция | 572 | ||
| 1003 | 1796 | ||||
| миРНК | 18 | комплексообразование | 363 | ||
| соединение | 44 | транслокация | 995 | ||
| комплекс | 486 | фосфорилирование 7139 pphorylation 46 -объект | 21 | дефосфорилирование | 212 |
| миРНК | 1 | активация | 240 | ||
| miRNA-связывание | 721 | ||||
| Сумма: сумма: | 6757 |
Таблица 1.Сводка компонентов / реакций модели НПВП.
Интеграция признаков рака
Ханахан и Вайнберг [22,23] предложили различные признаки рака и разъяснили структуру для принципа биологической организации развития рака, который подробно объясняет, что развитие рака у человека представляет собой многоступенчатый биологический процесс злокачественного новообразования. Различные независимые исследования показывают, что нарушение регуляции пути ЦОГ может вносить вклад в онкогенез по крайней мере с помощью четырех механизмов: (1) устойчивый ангиогенез [24]; (2) тканевая инвазия и метастазирование [25]; (3) распространение [26]; (4) избегая апоптоза [27], мы включили эти четыре признака рака (устойчивый ангиогенез, инвазивность и метастазирование, пролиферация и апоптоз) в модель NSAID.Отличительный признак пролиферации определяется в модели как сумма предполагаемых пролиферативных биомаркеров, включая повышающую регуляцию пролиферации клеток (URGCP), антиген, идентифицированный моноклональным антителом Ki-67 (MKI67), трехчастный мотив, содержащий белок 21 (TRIM21), ДНК-топоизомеразу. 2-альфа (TOP2A), вилка M1 (FOXM1), поло-подобная киназа 1 (PLK1) и другие, что отражает пролиферативную способность модели и непосредственно встроено в MAPK-, семейство сайтов интеграции MMTV бескрылого типа ( WNT) -, механистическая мишень рапамицина (MTOR) — и путь индуцируемого гипоксией фактора 1 (HIF1).Признак тканевой инвазии представлен в сумме всех матричных металлопротеиназ в модели и, следовательно, символизирует уровень инвазии и процесса метастазирования и непосредственно встроен в MAPK-, трансформирующий фактор роста бета (TGFbeta) — инсулин- как рецептор фактора роста 1 (IGF1R) — и путь NfκB. Отличительный признак уклонения от апоптоза определяется как сумма антиапоптотических факторов по сравнению с проапоптотическими факторами в модели, чтобы представить потенциал уклонения от апоптоза в модели, и напрямую связан с рецептором смерти-, IGF1R-, Toll- как Рецептор (TLR) — и ЦОГ-путь.Отличительный признак устойчивого ангиогенеза также определяется как сумма факторов проангиогенеза по сравнению с факторами антиангиогенеза, чтобы символизировать потенциал для поддержания ангиогенеза в модели, и непосредственно участвует в пути VEGF и фактора роста фибробластов (FGF). Все четыре клейма определены в модели как псевдокомпоненты (Таблица 2). Закон действия масс применяется к уравнениям для интеграции этих четырех отличительных черт в модель NSAID (см. Материалы и методы).Цель этого типа моделирования — отразить важную роль пути ЦОГ в развитии рака и подчеркнуть его способность влиять и приписывать процесс туморогенеза в различных аспектах. В настоящее время не учитываются степени влияния различных компонентов на клейма в уравнениях пробирки; таким образом, все коэффициенты в уравнениях отличительного признака установлены на 1 (см. Материалы и методы).
| Признак | Реализация | Ссылки (PudMed) |
|---|---|---|
| Уклонение от апоптоза (EA) | EA = (TNF1: TNFRSF1B + P-IGF IGF2 + BCL2L1 + BCL2 + MCL1) / (1+ FAS: FASLG + TNFSF10: DR4_5 + TNF1: TNFRSF1A + BAX + BAK1 + PMAIP1 + BBC3) | 14634624,17846171,2160 POLIFE | P = EIF4E + P-MYC: MAX + URGCP + MKI67 + TRIM21 + MYBL2 + TOP2A + STK6 + PLK1 + FOXM1 + PCNA | 15184677,10430922,12454650,12620412,11018017,17217616 9 Устойчивый к развитию ангиогенеза (SA) | SA = (P-FGFR: FGF + P – KDR_dimer: VEGFC + P – KDR_dimer: FIGF + P – KDR_dimer: VEGFA + IL8 + GM-CSF + TIMP) / (1 + CD36: THBS1) | 18560389,17933680,20010945,21248359,21742222 |
| Тканевая инвазия (TI) | TI = MMP7 + MMP9 + MMP2 + MMP1 + MMP13 + MMP10 | 14967450,16680569,11349215,11344033 |
Таблица 2.Осуществление клейма.
Подтверждение функциональной индикации признаков рака
В 2003 году Денкерт и его коллеги провели исследование in vitro для изучения терапевтического ингибирующего эффекта между ЦОГ-изоформ-специфической миРНК и селективным к ЦОГ-2 препаратом NS-398 в клеточной линии карциномы яичников человека (OVCAR-3) [28 ]. Это был первый случай, когда было показано, что селективный к СОХ-2 лекарственный препарат NS-398 имел явные эффекты ингибирования пролиферации клеток OVCAR-3, тогда как миРНК, специфичная для СОХ-изоформы, не оказывала никакого эффекта ингибирования пролиферации на эту клеточную линию.Чтобы проверить качество нашей модели NSAID и реализацию признаков рака, мы инициализировали модель NSAID с данными экспрессии генов линии клеток OVCAR-3 (см. Материалы и методы). Таким образом, мы ожидали, что модель должна быть способна отражать динамическое поведение линии клеток OVCAR-3 во время моделирования in silico . После этого мы провели сравнительный анализ потоков (FCA), который сосредоточен на сравнении потоков между состоянием опухоли (контрольное состояние) и состоянием терапевтического вмешательства (состояние возмущения) (см. Материалы и методы).В этом случае мы исследовали состояние опухоли + миРНК ЦОГ-2 по сравнению с состоянием опухоли (сравнение КТ) и состояние опухоль + NS-398 по сравнению с опухолью (сравнение NT), чтобы проверить, может ли модель NSAID раскрывают различия этих двух типов терапевтического торможения, как Denkert et al. [28] продемонстрировали в своем исследовании.
Результат FCA показывает, что распространение отличительных признаков остается неизменным при сравнении CT, тогда как при сравнении NT количество признаков снижается до 79.8% пролиферации от состояния опухоли (рис. 2), что указывает на то, что модель NSAID может изменять эффект ингибирования между миРНК COX-2 и лекарственным средством NS-398 в отношении линии клеток OVCAR-3. FCA также показывает, что оба типа ингибирования могут привести к значительному сокращению сигнального пути, начиная с PGG 2 до PGE 2 , что приводит к уменьшению перекрестных помех между сигнальными путями COX-пути со многими другими сигнальными путями. Однако этот тип уменьшения перекрестных помех при передаче сигналов не оказывает большого влияния на модель, потому что функционально зависимые рецепторы EP1-4 PGE 2 являются низкими (P <0.001) экспрессируется в клеточной линии OVCAR-3. Следовательно, только нацеливание на COX-2 в OVCAR-3 не может снизить высокую клеточную активность сигнальных путей, таких как MAPK-, WNT- и NfκB-путь (рис. 2A), что приводит к высокому уровню экспрессии нескольких факторов транскрипции, включая v- Гомолог вирусного онкогена myc миелоцитоматоза (MYC), протоонкоген jun (JUN), гомология вирусного онкогена остеосаркомы мыши fbj (FOS) и белок специфичности (SP) 1,3. Эти важные факторы транскрипции, как известно, участвуют в различных сигнальных путях, включая путь MTOR-, WNT- и Hedgehog, для поддержания высокой клеточной пролиферации.Напротив, препарат NS-398 одновременно ингибирует ЦОГ-2, VEGF, интерлейкин (IL) 1 и фактор некроза опухоли (TNF) [29], что приводит к снижению активности клеточного цикла, сигнала в путях VEGF-, TLR- и JAK_STAT. и сигналы, передаваемые гамма-фосфолипазой C (PLCG) и протеинтирозинкиназой 2 PTK2 (PTK2), так что пролиферация клеток может быть уменьшена во время моделирования in silico (рис. 2B) (математическая реализация этого препарата объяснена в материалах и методах) . Кроме того, признак уклонения от апоптоза снижается на 14.4% и 25,8% при сравнении CT и NT соответственно, потому что в обоих случаях ингибирования FCA показывает, что активность TLR- и пути рецептора смерти была снижена (Рисунок 2). FCA также показывает, что из-за снижения активности путей VEGF и FGF показатель устойчивого ангиогенеза снижается до 59,8% и 65,6% в обоих случаях (рис. 2). Эти результаты предполагают, что и миРНК ЦОГ-2, и лекарственное средство NS-398 могут успешно снижать клеточную функцию ЦОГ-2, которая участвует в патологических процессах уклонения от апоптоза и устойчивого ангиогенеза.Однако лекарство NS-398 может проявлять лучший ингибирующий эффект, чем миРНК СОХ-2, за счет уменьшения обоих патологических процессов в отношении этой линии раковых клеток. Признак инвазии в ткани и метастазирования остается неизменным как при сравнении компьютерной томографии, так и при сравнении NT.
Рисунок 2. Упрощенная визуализация ингибирования ЦОГ-2 в сети моделей NSAID.
A : Ингибирование пути ЦОГ с помощью специфической для ЦОГ-2 интерференции миРНК. B : Ингибирование пути ЦОГ с помощью препарата NS-398 (селективный ингибитор ЦОГ-2). C : Результат тепловой карты FCA включает сравнение CT (первая строка), сравнение NT (вторая строка) и сравнение CT2 (последняя строка). Цветовая полоса предназначена для A, , B и C, а цветовые соотношения признаков рака являются результатами анализа FCA, который поясняется в разделе «Материалы и методы» на рис. 5.
https://doi.org/10.1371/journal.pone.0072477.g002
В 2006 году Стриллаччи и его коллеги применили технику интерференции РНК для подавления сверхэкспрессированного ЦОГ-2 в клеточных линиях рака толстой кишки (HT-29) и обнаружили что этот нокдаун ЦОГ-2 не оказывает никакого эффекта на пролиферацию клеток HT-29 [30].Кроме того, в то же время Charames и Bapat провели эксперимент siRNA для ингибирования уровня экспрессии COX-2 в клеточных линиях HT-29 и обнаружили, что этот тип ингибирования siRNA не влияет на апоптоз HT-29 [31]. Для дальнейшей проверки отличительных признаков в модели NSAID мы инициализировали модель NSAID с данными экспрессии генов клеточной линии HT-29 (см. Материалы и методы) и выполнили анализ FCA для линии клеток HT-29 в состоянии Опухоль + состояние ЦОГ-2сиРНК vs.Состояние опухоли (сравнение CT2). Результат показывает, что признаки пролиферации остались неизменными, поскольку низкая экспрессия PGE 2 родственного рецептора EP1-4 вызывает меньший эффект воздействия резкого снижения сигнала пути ЦОГ в модели, многие важные факторы транскрипции, включая SP3, c -myb гомолог вирусного онкогена (MYB), цинковый палец семейства GLI (Gli) и катенин (белок, связанный с кадгерином), бета (CTNNB), участвующие в путях MAPK-, Hedgehog- и WNT, не подвержены влиянию этого COX-2 siRNA в Клеточная линия HT-29.Более того, предотвращение апоптоза лишь немного снижается (99,3% от состояния опухоли) (рис. 2C), потому что многие белки каспазы (CASP) в модели поддерживают высокую клеточную активность. Эти результаты качественно согласуются с результатами обоих исследований Strillacci et al. [30] и Чарамс и Бапат [31]. Основываясь на том факте, что интерференция миРНК СОХ-2 не может влиять на клеточную пролиферацию в линиях раковых клеток OVCAR-3 и HT-29, мы хотели бы предложить ограничение интерференции миРНК СОХ-2 для клеточных линий и ксенотрансплантатов, которые имеют низкую экспрессию. уровень рецепторов EP1-4.Однако это предположение следует дополнительно проверить в будущих исследованиях.
Анализ синтетической летальности на основе СОХ для опухолей груди, толстой кишки и легких
Синтетическая летальность описывает взаимосвязь пары генов, когда одновременные мутации обоих генов могут привести к гибели клетки, в то время как мутация каждого гена все еще совместима с жизнеспособностью клетки [32]. Эта концепция синтетической летальности может предоставить важную молекулярную информацию для разработки высококачественных противораковых препаратов, которые могут повысить эффективность попадания в цель и свести к минимуму побочные эффекты.Основываясь на противоопухолевом эффекте ЦОГ-пути, многие доклинические исследования показали, что лечение путем ингибирования ЦОГ-2 (ключевого компонента ЦОГ-пути) и рецепторной тирозинкиназы, такой как EGFR, v-erb-b2, эритробластный лейкоз вирусный гомолог онкогена 2 (ERBB2) может давать аддитивный эффект, который намного более эффективен, чем любой отдельный агент по отдельности [33–35]. Поэтому мы стремились применить модель NSAID для исследования влияния синтетической летальности на основе COX на все рецепторные тирозинкиназы, определенные в этой модели, для различных типов опухолей.Мы использовали данные об экспрессии генов 60 линий опухолевых клеток, которые предоставлены атласом генома рака (https://tcga-data.nci.nih.gov), и выполнили in silico симуляций для исследования комбинации на основе COX-2. торможение. Эти линии опухолевых клеток включают 20 линий опухолевых клеток груди, 20 линий опухолевых клеток толстой кишки и 20 линий опухолевых клеток легких (дополнительная информация S3). Все комбинации ингибирования COX-2 и рецепторных тирозинкиназ в модели NSAID анализировали для каждой линии опухолевых клеток.Метод анализа основан на FCA. В этом случае контрольным состоянием является устойчивое состояние, которого модель NSAID достигает во время моделирования in silico с инициализацией данных экспрессии генов соответствующих линий опухолевых клеток. Состояние возмущения — это устойчивое состояние, которого модель NSAID достигает с той же инициализацией данных и дополнительным комбинированным ингибированием ЦОГ-2 и рецепторной тирозинкиназы. Компоненты считывания FCA — это четыре интегрированных признака рака в модели.Каждое комбинационное ингибирование (такое как COX-2 + EGFR и COX-2 + ERBB2) представляет собой тип терапевтического нарушения для линии опухолевых клеток.
Ангиогенез — это процесс образования новых кровеносных сосудов, и в ходе развития солидной опухоли опухолевые ткани, такие как грудь, толстая кишка и легкие, становятся сильно зависимыми от ангиогенеза для поддержания и прогрессирования [36]. Комбинированное ингибирование ЦОГ-2 и рецепторных тирозинкиназ может привести к более значительному снижению ангиогенеза, чем однократное ингибирование ЦОГ-2 во время моделирования in silico , особенно для линий опухолевых клеток толстой кишки и легких (рис. 3А), где комбинированное ингибирование ЦОГ- 2 приводят к менее чем 30% оставшимся процессам ангиогенеза (68.84% и 43,72% ангиогенеза для одиночного ингибирования ЦОГ-2 в опухолях толстой кишки и легких соответственно). Эти результаты показывают, что комбинированное ингибирование пути ЦОГ и рецепторной тирозинкиназы может резко снизить ангиогенез, что приводит к ингибированию роста опухоли толстой кишки и легких. Эти результаты согласуются с исследованием Tuccillo et al. [37], которые исследовали аддитивный эффект комбинации противораковых препаратов ZD6474 (ингибитор EGFR и VEGFR) и SC-236 (селективный ингибитор COX-2) на ксенотрансплантатных моделях рака легких и толстой кишки, и эти результаты также согласуются с исследованием Mann et al.[33] и Tortora et al. [34]. В обоих исследованиях применялось комбинированное лечение для ингибирования COX-2 и ERBB2, а также COX-2 и EGFR для оказания антиангиогенного эффекта на клеточные линии рака толстой кишки и модели ксенотрансплантатов.
Рис. 3. Эффект комбинированного ингибирования на основе ЦОГ на признаки рака.
Ангиогенез ( A ), уклонение от апоптоза ( B ), пролиферация ( C ) и метастаз ( D ). Синий, красный и желтый столбцы на каждой гистограмме показывают средние значения относительных изменений отличительных признаков рака для 20 образцов карциномы молочной железы, 20 образцов карциномы прямой кишки и 20 образцов карциномы легких соответственно.Относительное изменение каждого признака рака относится к сравнению между состоянием терапевтического нарушения (ингибирование на основе СОХ) и контрольным состоянием (состояние опухоли), которое рассчитывается с помощью сравнительного анализа потоков (FCA).
https://doi.org/10.1371/journal.pone.0072477.g003
Для опухоли груди комбинированное ингибирование ЦОГ-2 и рецепторных тирозинкиназ может достигать от 40% до 60% оставшегося ангиогенеза, что намного лучше, чем 81,13% оставшегося ангиогенеза от одного ингибирования ЦОГ-2 (фиг. 3А).Этот аддитивный эффект предполагает, что комбинированное лечение ЦОГ-2 и рецепторными тирозинкиназами может быть эффективной терапевтической стратегией для лечения опухоли груди. Однако по сравнению с двумя другими опухолями опухоль молочной железы демонстрирует более сильную устойчивость к ингибиторам комбинации на основе ЦОГ-2 (рис. 3А). Мы сравнили интенсивность сигнала между путями в модели NSAID, чтобы исследовать, какие пути могут обладать высокой активностью, чтобы способствовать этому типу устойчивости к ингибированию. Мы обнаружили, что при комбинированном ингибировании в среднем клеточные линии опухоли груди все еще обладают относительно более высокой активностью (> 1.В 4 раза) пути Hedgehog (1,75 раза), пути EGFR (1,64 раза), пути JAK / STAT (1,49 раза), пути WNT (1,43 раза) по сравнению с линиями опухолевых клеток толстой кишки; в то время как по сравнению с линиями опухолевых клеток легких, линии клеток опухоли молочной железы обладают относительно более высокой активностью (> 1,4 раза) пути JAK / STAT (1,67 раза), пути клеточного цикла (1,59 раза), пути ERBB (1,5 раза).
Апоптоз, процесс запрограммированной гибели клеток, является важным клеточным механизмом для эффективного удаления избыточных, поврежденных или инфицированных клеток.Нарушения аппарата апоптоза могут привести к чрезмерному выживанию клеток или их гибели, что может привести к ряду патологических состояний, включая онкогенез [38,39]. Все комбинации ингибирования ЦОГ-2 и рецепторных тирозинкиназ могут достигать менее 61%, что позволяет избежать апоптоза для этих трех типов опухолей. В частности, для рака легких оставшийся апоптоз, который удается избежать, составляет даже менее 40% (рис. 3B). Интересно, что по сравнению со средним оставшимся уклонением от апоптоза за счет однократного ингибирования ЦОГ-2 этих трех типов опухолей, комбинированное ингибирование ЦОГ-2 + ERBB2, ЦОГ-2 + ERBB3, ЦОГ-2 + EGFR и ЦОГ-2 + PDGFRB (тромбоцитов -производный рецептор фактора роста бета), демонстрируют явный аддитивный эффект для опухолей молочной железы и толстой кишки, тогда как для опухолей легких комбинированное ингибирование COX-2 + EPHB (рецептор EPH) и COX-2 + FGFR имеет четкий аддитивный эффект.Все другие комбинации ингибирования для этих трех типов опухолей остаются почти такими же, как и одиночное ингибирование COX-2, что указывает на отсутствие аддитивного терапевтического эффекта этих комбинационных ингибирований. Интересно, что комбинированное ингибирование COX-2 + INSR демонстрирует даже более высокий уклонение от апоптоза, чем одиночное ингибирование COX-2. Причина этого в том, что ингибирование INSR сильно снижает передачу сигналов инсулина, что приводит к снижению фосфорилированной протеинкиназы C (PKC). Снижение активной PKC приводит к снижению сигнала пути NfκB, чьи нижестоящие гены-мишени включают различные проапоптотические лиганды и рецепторы, такие как Fas (суперсемейство рецепторов TNF, член 6) (FAS), TNF-1, рецептор фактора некроза опухоли. надсемейство, член 1A (TNFRSF1A).
Пролиферация — это клеточный процесс роста и развития клеток. При достаточном питании и подходящей микросреде скорость клеточной пролиферации становится стабильной, что приводит к увеличению популяции клеток под контролем нормальной клеточной системы. Основная задача развития рака — оставаться в патологическом состоянии строго контролируемого распространения. К сожалению, для этих трех типов опухолей все комбинации ингибирования ЦОГ-2 и рецепторных тирозинкиназ могут оказывать лишь очень небольшое влияние на процесс пролиферации, что подразумевает результат, что оставшийся процесс пролиферации превышает 90% для всех этих комбинаций. запреты.Кроме того, никакое комбинированное ингибирование не дает явно лучшего (снижение на 30%; p <0,05) пролиферативного ингибирования, чем одиночное ингибирование COX-2 соответствующего типа опухоли во время моделирования in silico (рис. 3C). Только три комбинированных ингибирования показали небольшое улучшение (снижение 4%; p <0,05) по сравнению с одним ингибированием ЦОГ-2. Это COX-2 + RET (ret протоонкоген), COX-2 + ERBB2 и COX-2 + PDGFRA.
Тканевая инвазия, также называемая метастазами, является основным течением смертности от рака, а также является одним из наиболее важных признаков рака с терапевтической точки зрения [40].Во время моделирования in silico все комбинации ингибирования, за исключением трех комбинационных ингибиторов (COX-2 + ERBB2 для опухоли груди, COX-2 + ERBB3 для опухоли груди и COX-2 + EPHA для опухоли толстой кишки), не оказывают никакого влияния на метастаз. Кроме того, одиночное ингибирование ЦОГ-2 не влияет на метастазирование трех опухолей в модели. Комбинированное ингибирование ЦОГ-2 + ERBB2 и ЦОГ-2 + ERBB3 может исключительно незначительно влиять на метастазирование опухоли молочной железы, что отражается в ~ 98% оставшихся метастазов после ингибирования.Комбинированное ингибирование ЦОГ-2 + EPHA может иметь даже небольшой ингибирующий эффект с достижением ~ 99% оставшихся метастазов.
РегуляцияMiRNA на пути ЦОГ и потенциал для открытия биомаркеров
В последние годы многие исследования показали, что miRNAs играют важную роль в различных клеточных процессах, таких как ангиогенез, пролиферация, клеточный цикл и апоптоз, поэтому вносят вклад в онкогенез [41,42]. Некоторые недавние исследования предоставляют доказательства того, что более низкий уровень экспрессии определенных miRNAs (miR-101a и miR-199a) связан с высокой экспрессией COX-2 во время различных клеточных процессов [43,44].Мы включили 18 miRNA с соответствующей подтвержденной информацией о мишени (дополнительная информация S4) в модель NSAID, все мишени которой включают ключевой компонент COX-2. Подход к моделированию miRNA представлен в предыдущем исследовании [45]. Мы использовали опубликованные данные об экспрессии miRNA для тех же трех типов опухолей из атласа генома рака и исследовали, может ли сверхэкспрессия этих miRNA дать удовлетворительный терапевтический эффект с помощью подхода in silico (FCA). Для каждой miRNA мы создали контрольное состояние (устойчивое состояние модели NSAID с инициализацией данных экспрессии генов) и состояние возмущения (устойчивое состояние модели NSAID с той же инициализацией и дополнительной в 100 раз более высокой экспрессией miRNA), и мы повторили это FCA сверхэкспрессии miRNA для тех же 60 линий опухолевых клеток.Целью этого FCA является изучение влияния каждой miRNA на системном уровне, когда ее сверхэкспрессия репрессирует обычно сверхэкспрессируемый COX-2 и дополнительно снижает уровень экспрессии других мишеней для получения эффекта «One Hit Multiple Targets» [46]. Основываясь на результатах FCA, мы выполнили знаковый ранговый тест Вилкоксона для расчета оценки влияния каждой miRNA для 60 линий опухолевых клеток (см. Материалы и методы), оценка показывает, как сверхэкспрессия miRNA может оказывать влияние на модель.После этого мы усреднили количество miRNA в зависимости от типа опухоли (рис. 4. A, B и C).
Примечательно, что многие miRNA-супрессоры опухолей, такие как mir-101, mir-10b, mir-200a, mir-205, mir-23, в опухоли молочной железы имеют высокие оценки влияния (> 20) (рис. 4A). Например, mir-10b вносит основной вклад в метастазирование рака груди [47]; mir-101 является ключевым регулятором аутофагии и модулирует эпигеном рака [48,49]; mir-205 отвечает за подавление роста и инвазии клеток в опухоли груди [50].Результат FCA показывает, что сверхэкспрессия этих miRNA имеет общий эффект ингибирования на путь COX, что приводит к сильному влиянию на модель NSAID. Этот результат согласуется с фактом важной роли, которую этот путь играет в развитии рака груди [51,52].
Интересно, что мы обнаружили, что многие miRNA, которые обычно активируются в стволовых клетках рака толстой кишки, имеют низкие оценки влияния (<4) (Рисунок 4B), такие как mir-155 [53], mir-16 [53], mir-17 [54] и МИР-21 [55] (рис. 4Б).Этот результат подразумевает, что эффект сверхэкспрессии этих обычно связанных miRNA в клеточной системе рака толстой кишки может быть насыщенным, поэтому дальнейшее их избыточное давление может оказывать лишь небольшое влияние на модель NSAID. Более того, этот результат может также указывать на менее значительную роль ЦОГ-пути в стволовых клетках рака толстой кишки. В опухолях легких только 4 miRNA (mir-10b, mir-101, mir-152 и mir-26b) имеют относительно высокие оценки влияния (13
Материалы и методы
Внедрение онкологических клейм
Четыре признака рака (устойчивый ангиогенез, тканевая инвазия и метастазирование, пролиферация и уклонение от апоптоза) определены как псевдокомпоненты в модели НПВП, и они также считаются компонентом считывания для сравнительного анализа потоков (объяснено ниже). Каждый из них должен уметь суммировать сигнал от сигнальных путей и представлять аспект развития физиологии раковых клеток.Реализация моделирования этих четырех признаков рака приведена ниже со ссылками на литературу, а для реализации интеграции применяется закон массового действия. В настоящее время не учитываются степени влияния компонентов на признаки рака.
Сравнительный анализ потоков (FCA)
Поток биохимической реакции определяет массовый расход от субстратов к продуктам. Например, субстрат A превращается в продукт B в реакции R.Для простоты обозначим концентрации c [A] и c [B] A и B соответственно. Начальная концентрация c [A] = m и c [B] = 0. Применяя закон действия масс с кинетическим параметром k, после того, как реакция R происходит один раз, c [B] = m * k и c [A ] = (1-м) * k. Теперь c [B] может описывать величину потока реакции R. В этом случае продукт B является компонентом считывания для реализованной модели. Таким образом, мы приписываем всем реакциям в модели стандартный закон скорости, кинетику действия массы, чтобы принять прагматическое решение для моделирования модели (Таблица 3).
| Реакция | Биохимическая презентация | Закон кинетической скорости | Значение параметра |
|---|---|---|---|
| Транскрипция | G → m | v = 9095 транскрипция 0,25 | |
| Смещение | м → P | v = [м] * K смещение | 0,35 |
| Распад | S1 → | v = [S] * K распад | 0 .1 |
| Комплексное образование | S1 + S2 → S1: S2 | v = [S1] * [S2] * K комплекс | 0,7 |
| Транслокация | S1 (A) → S1 (B ) | v = [S1 (A)] * K в — [S1 (B)] * K out | 0,5 |
| Фосфорилирование | P → фос-P (с ингибитором фермента а) | v = [P] * [E] * K e / (1 + K i ) * [I] | 0,35 / 0,2 |
| Активация | P → active-P (с ферментом a .Ингибитор) | v = [P] * [E] * K e / (1 + K i ) * [I] | 0,4 / 0,2 |
| регуляция miRNA | m → (регуляция miRNA) | v = [m] * [miRNA] * K mi | 0,01 |
Таблица 3. Сводка математических реализаций реакций в модели NSAID.
Как следует из названия этого подхода, во время моделирования мы сравниваем поток компонента считывания в реализованной модели из состояния управления с потоком того же компонента из состояния возмущения.Мы используем четыре признака рака в модели в качестве компонентов считывания, чтобы исследовать, может ли какое-либо терапевтическое вмешательство повлиять на эти компоненты считывания. Цель этого подхода — относительно выявить влияние состояния возмущения (например, состояния лечения лекарствами) по сравнению с контрольным состоянием (например, патологическим клеточным состоянием) на модели, чтобы предсказать терапевтический эффект различных видов возмущения. На рис. 5А представлена модельная сеть с пустым сигнальным потоком. Рисунки 5B и 5C символизируют состояние управления и возмущения одной и той же модельной сети с одним и тем же входным потоком на основе генетической информации (в настоящее время данные по экспрессии генов).После того, как поток в модельной системе достигает установившегося состояния, соответствующие компоненты анализируются (рисунок 5D, гистограмма), который показывает, может ли этот вид возмущения повлиять на ключевой компонент считывания модели и как это сделать. Как показано на рисунке 5D, компонент c в контрольном состоянии имеет концентрацию 36 (а.е.), а в возмущении он имеет концентрацию 5 (а.е.), поэтому результат FCA для компонента c равен 0,14. Аналогично, результаты FCA для компонентов a, b, d, e и f равны 1.0, 0,40, 0,67, 0,62 и 1,0 соответственно (рис. 5D). Следовательно, абсолютная ценность генетической информации не имеет значения для анализа FCA, для этого подхода важна только пропорциональность данных. Процедура моделирования основана на расширении сети Петри, описанном в предыдущем исследовании [45].
Рис. 5. Визуализация сравнительного анализа потоков.
A : состояние пустого потока модельной сети; B : контроль состояния модельной сети; C : состояние возмущения (ингибирование лекарственным средством) модельной сети. D : сравнение компонентов модели между состоянием управления и состоянием возмущения. Описана математическая реализация обоих состояний в модели.
https://doi.org/10.1371/journal.pone.0072477.g005
Математическая реализация siRNA, специфичной для изоформ ЦОГ, и лекарственного эффекта NS-398
Лекарственный эффект специфической миРНК ЦОГ-2 заключается в снижении концентрации мРНК ЦОГ-2, в то время как лекарственный эффект препарата NS-398 состоит из эффектов, генерируемых четырьмя ингибиторами, которые способствуют процессам деградации белка ЦОГ-2, VEGFA, IL1. и TNF соответственно.Этот тип реализации лекарственного эффекта вдохновлен исследованием in vitro Hidvegi et al. [61], где авторы успешно продемонстрировали на мышиной модели, что карбамазепин может снижать альфа-антитрипсин Z (ATZ), способствуя его деградации, что приводит к снижению фиброза печени. Обе математические реализации перечислены в таблице 4.
| Сравнение КТ | Опухоль + состояние миРНК ЦОГ-2 | Состояние опухоли |
|---|---|---|
| Закон кинетической скорости | v = [COX-2 (K9596 трансляция)] / [siRNA] | v = [COX-2 (mRNA)] * K трансляция |
| Сравнение NT | Опухоль + состояние NS-398 | Состояние опухоли |
| Кинетическое Закон скорости | v = [COX-2 (белок)] * K распад * [Inhibit1] | v = [COX-2 (Protein)] * K распад |
| v = [VEGF ( Белок)] * K распад * [Inhibit2] | v = [VEGF (белок)] * K распад | |
| v = [IL1 (белок)] * K распад * [Inhibit3] | v = [IL1 (белок)] * K распад | |
| v = [TNF (белок)] * K распад * [ингибировать it4] | v = [TNF (белок)] * K распад |
Таблица 4.Различие математической реализации различных состояний для анализа FCA.
Инициализация модели с данными экспрессии генов
Модель содержит различные типы объектов, включая ген, РНК (мРНК, миРНК), белок, сложное соединение и псевдообъект, и каждый тип связан с соответствующим идентификатором. Например, ген и объект мРНК являются ensembl-id; белок и составной объект связаны с uniProt-id и ChEBI-id соответственно; miRNA- и miRNA ген-объект связаны с присоединением miRNA; другие объекты связаны с внутренним идентификатором модели.Все объекты, кроме объекта гена, установлены в 0. В процессе моделирования сигнал модели генерируется только с уровня транскрипции и направляется на уровень трансляции. После этого сигнал можно распространить на остальную часть модели.
Процедура инициализации выполняется в соответствии с ensembl-id генных объектов в модели; всем объектам гена в модели итеративно присваивается соответствующее значение экспрессии гена в соответствии с этим идентификатором. Поскольку значение данных экспрессии генов из Атласа генома рака является логарифмическим соотношением, мы должны модифицировать данные путем возведения в степень, чтобы получить первоначально измеренные значения экспрессии генов, поскольку отрицательное логарифмическое соотношение не подходит для моделирования сети Петри.После этого для инициализации модели NSAID применяется вышеупомянутая процедура инициализации (псевдоисточник).
Псевдоисточник:
1. м ← сигнальная модель
2. Инициализация (м) {
3. Если доступны данные об экспрессии генов {
4. гены-сущности ← m.getAllGene_Entities ()
5. для генной сущности в генной сущности {
6. установить ген-объект с данными в соответствии с Ensembl id
7.}
8.}
9.если доступны данные об экспрессии miRNA {
10. miRNA-объекты ← m.getAllmiRNA_Entities ()
11. для микроРНК-сущностей в миРНК-сущностях {
12. Установить miRNA-сущности с данными в соответствии с miRNA id
13.}
14.}
15. обнулить все остальные сущности в модели.
16.}
17. simulate (m) {# процесс распространения потока сигнала в расширении сети Петри [45]
18.}
Расчет балла влияния miRNA
Предположим, что модель, имеющая n компонентов и C x (1 <= x <= n), определяется как концентрация одного компонента модели.Обозначим массивы C = [C1, C 2 , C 3 … C n ] и C ‘= [C’ 1 , C ‘ 2 , C’ 3 … C ‘ n ] — концентрации всех компонентов модели в состоянии управления и состоянии возмущения, соответственно, в отношении анализа FCA. Значение p (P), вычисленное с помощью критерия знакового ранга Вилкоксона (C, C ‘), подразумевает влияние на системном уровне между компонентами модели в обоих состояниях из-за регуляции miRNA. (Следует отметить, что вычисленное таким образом p-значение не следует рассматривать как возможность получения статистического теста для принятия или отклонения нулевой гипотезы.)
баллов влияния miRNA (MIS) = (-1) * log (P, 10)
Наличие модели
Модель NSAID доступна по ftp://138.245.80.137/NSAID_model.xml в форме XML.
Обсуждение и заключение
Общая цель этого исследования — оценить возможность применения построения молекулярной модели для терапевтических разработок, включая идентификацию новых потенциальных целей и открытие высококачественных биомаркеров.Таким образом, в этом исследовании была представлена первая молекулярная модель NSAID, конструкция которой основана на литературных ссылках, касающихся пути ЦОГ и связанных с ним путей. Эта модель объединяет четыре признака рака для реализации принципа биологической организации онкогенеза, который представляет собой многоступенчатый процесс в клетках человека [22,23]. Каждый признак рака в модели NSAID должен отражать соответствующий аспект развития злокачественной трансформации клеток. В этом исследовании были использованы данные различных исследований in vitro для подтверждения функциональных признаков этих признаков рака и согласовано с результатами этих исследований in vitro [28,30,31].Кроме того, мы предлагаем критерий ограничения применения ЦОГ-изоформы специфической siRNA интерференции в линиях опухолевых клеток. Результат также указывает на то, что модель NSAID может унаследовать динамическое поведение соответствующих опухолевых клеточных систем и реагировать аналогичным ответом при столкновении с терапевтическим вмешательством (интерференция siRNA и лекарство NS-398), которое может служить «виртуальным пациентом» для прогнозирования терапевтические ответы от отдельной линии опухолевых клеток.
Применяя модель NSAID, мы попытались изучить новую концепцию синтетической летальности, относящуюся к ключевому компоненту (ЦОГ-2) пути ЦОГ, для 60 клеточных линий опухолей молочной железы, толстой кишки и легких.Многие исследования in vitro и in vivo предоставили доказательства того, что комбинированное лечение путем ингибирования ключевого компонента пути ЦОГ и соответствующей рецепторной тирозинкиназы, такой как EGFR и ERBB2, может дать значительный дополнительный терапевтический эффект. Наш подход in silico показывает, что этот тип комбинированного ингибирования (ЦОГ-2 и рецепторная тирозинкиназа) может достичь гораздо лучшего снижения ангиогенеза, чем однократное ингибирование ЦОГ-2 для 40 клеточных линий как опухолей толстой кишки, так и легких, которые достигает согласия с различными независимыми исследованиями in vitro [33–35,37].Кроме того, мы указали, что аддитивный эффект комбинированного ингибирования на опухоль груди должен быть подтвержден последующими исследованиями.
Кроме того, мы интегрировали 18 miRNAs в модель NSAID, чтобы исследовать влияние регуляции miRNA на модельную систему. Посредством анализа оценки влияния miRNA мы пришли к выводу, что miRNA с более высокой оценкой влияния имеют более высокую вероятность быть miRNA-супрессором опухоли в соответствующей опухоли, в то время как miRNA с более низкой оценкой влияния имеют более высокую вероятность быть онкогенными miRNA.Те miRNAs с чрезвычайно высокими или низкими оценками влияния предлагается рассматривать как биомаркеры miRNA. Этот результат открытия биомаркера in silico согласуется с недавними независимыми исследованиями [58–60]. Этот анализ оценок влияния может пролить свет на разработку подхода in silico для идентификации биомаркеров на индивидуальном уровне. Многие недавние исследования предоставляют доказательства дерегуляции профилей экспрессии miRNA при различных раковых заболеваниях и выясняют, что дерегуляция множественных miRNAs принадлежит к общему сценарию при раках [41,62,63].Следовательно, биомаркер группы miRNA со схожими функциями должен быть более значимым и значимым, чем биомаркер одиночной miRNA. Основываясь на этом факте, можно расширить нынешний подход in silico для идентификации групповых miRNAs с экстремальными значениями для определения группового биомаркера miRNA. Однако точная процедура все еще расследуется.
Во многих исследованиях представлены математические модели с применением анализа, сбалансированного по потоку, и режимов элементарного потока [64–66].Эти типы приложений не принимают во внимание факт динамических свойств, которые описывают физиологические, связанные с развитием и патологические процессы клеточной системы. Напротив, в этом исследовании представлен сравнительный анализ потоков (FCA) для объединения генетических данных (например, данных экспрессии генов), сетевой структуры (модель NSAID) и кинетических параметров биохимических реакций, чтобы отразить основные аспекты клеточного злокачественного новообразования. разработка и прогнозирование эффекта препарата и клинического исхода.Удовлетворительные результаты означают, что на основе закона действия масс модель NSAID может достичь определенного приближения, чтобы с достаточной точностью представить динамику отдельной клеточной системы. Однако применяемые в настоящее время кинетические параметры основаны на эмпирическом опыте и учитывают информацию о кинетических параметрах, перечисленную в исследовании Papin et al. [67]. В будущих исследованиях следует сделать акцент на обнаружении и измерении значений кинетических параметров в различных условиях окружающей среды, чтобы определить конкретное значение интервала в отношении различных типов биохимических реакций.
Хотя построение текущей модели НПВП основано на литературной информации, все еще существует множество ограничений на нее, например, в модели зафиксированы концентрации многих метаболитов, включая АДФ, H 2 O, ортофосфат и другие. чтобы предотвратить падение сигнала в сигнальных путях, когда эти побочные продукты метаболизма заканчиваются. Для всех определенных реакций фосфорилирования в модели мы не учитываем функциональные различия между разными фосфорилированными сайтами в пределах одних и тех же белков.Более того, биологические функции различных паралогов, таких как ERK1 и ERK2, также не рассматривались. Различные исследования показывают, что эпигенетика играет важную роль в биологии рака [68,69], например, гиперметилирование и гипометилирование ДНК может коррелировать с диагнозом и прогнозом лечения рака [70–72]. Однако до сих пор неясно, как эффективно преобразовать эту специфическую эпигенетическую информацию в системно-биологическую модель. В настоящее время не учитываются различные степени влияния компонентов модели, которые действуют непосредственно на признаки рака.В будущих исследованиях следует сделать акцент на этом моменте, чтобы улучшить интеграцию признаков рака за счет набора больных раком для дальнейшего изучения основных эффектов и побочных эффектов НПВП с применением этой модели.
Наконец, модель опухоль-ксенотрансплантат представляет собой текущий стандарт для доклинических испытаний противоопухолевых агентов; однако у этого типа модели слишком много ограничений, чтобы оставаться приемлемым входом в клинические испытания [73]. Это исследование дает системно-биологический пример применения, показывающий, что молекулярная модель, содержащая биологическую информацию, относящуюся к экспрессии генов, регуляции генов, взаимодействию белков, передаче сигналов и другим клеточным процессам, может привести к предсказанию поведения клеточной системы на системном уровне, лежащей в основе человека. клеточная линия (или пациент).Несмотря на упомянутые ограничения, модель NSAID с FCA может стать альтернативой для доклинического тестирования противоопухолевых агентов, связанных с путем COX, для сокращения затрат времени, затрат и технических проблем.
Дополнительная информация
Информация S4.
Проверенные мишени miRNA, которые включены в модель NSAID; для каждой мишени miRNA существует соответствующая литература ( PubMed ID ), подтверждающая ее валидацию мишени. Эта таблица содержит три столбца. Первый столбец — это имя и идентификатор miRNA, определенные в модели NSAID. Второй столбец содержит ensembl-ID соответствующих целевых генов, а третий столбец отображает PubMed ID, связанный с соответствующими целевыми объектами.
https://doi.org/10.1371/journal.pone.0072477.s004
(CSV)
Благодарности
Мы благодарим Атлас генома рака за профессиональную и мгновенную техническую поддержку. Мы благодарим Анну Ригер за ее статистическую поддержку и Франциску Шратт за вычитку рукописи.
Вклад авторов
Задумал и спроектировал эксперименты: JL UM. Проведены эксперименты: JL. Проанализированы данные: JL. Предоставленные реагенты / материалы / инструменты анализа: JL. Написал рукопись: JL UM.
Ссылки
- 1. Vane JR (1971) Ингибирование синтеза простагландинов как механизм действия аспириноподобных препаратов. Нат Нью Биол 231: 232-235. DOI: https: //doi.org/10.1038/newbio231232a0. PubMed: 5284360.
- 2. Needleman P, Turk J, Jakschik BA, Morrison AR, Lefkowith JB (1986) Метаболизм арахидоновой кислоты.Анну Рев Биохим 55: 69-102. DOI: https: //doi.org/10.1146/annurev.bi.55.070186.000441. PubMed: 3017195.
- 3. Ван Д., Манн Дж. Р., Дюбуа Р. Н. (2005) Роль простагландинов и других эйкозаноидов в желудочно-кишечном тракте. Гастроэнтерология 128: 1445-1461. DOI: https: //doi.org/10.1053/j.gastro.2004.09.080. PubMed: 15887126.
- 4. Sandler RS, Halabi S, Baron JA, Budinger S, Paskett E et al. (2003) Рандомизированное исследование аспирина для профилактики колоректальных аденом у пациентов с колоректальным раком в прошлом.N Engl J Med 348 (10): 883-890. DOI: https: //doi.org/10.1056/NEJMoa021633. PubMed: 12621132.
- 5. Randall H, Beebe-Donk J, Alshafie GA (2007) Снижение риска рака легких человека с помощью селективной блокады циклооксигеназы 2 (Cox-2): результаты исследования случай-контроль. Int J Biol Sci 3 (5): 328-334. PubMed: 17589567.
- 6. Wynne S, Djakiew D (2010) NSAID-ингибирование миграции клеток рака простаты опосредуется индукцией Nag-1 через путь p38 MAPK-p75NTR. Mol Cancer Res 8: 1656–1664.DOI: https: //doi.org/10.1158/1541-7786.MCR-10-0342. PubMed: 21097678.
- 7. Джаяпракаш В., Ригуал Р., Мойсич К.Б., Лори Т.Р., Наска М.А. и др. (2006) Химиопрофилактика рака головы и шеи с помощью аспирина: исследование случай-контроль. Хирургия головы и шеи Arch Otolaryngol 132 (11): 1231-1236. DOI: https: //doi.org/10.1001/archotol.132.11.1231. PubMed: 17116820.
- 8. Uefuji K, Ichikura T, Mochizuki H (2000) Экспрессия циклооксигеназы-2 связана с биосинтезом простагландинов и ангиогенезом при раке желудка человека.Clin Cancer Res 6: 135-138. PubMed: 10656441.
- 9. Smalley WE, DuBois RN (1997) Колоректальный рак и нестероидные противовоспалительные препараты. Adv Pharmacol 39: 1-20. DOI: https: //doi.org/10.1016/S1054-3589 (08) 60067-8. PubMed: 11.
- 10. Lichtenberger LM (2001) Где доказательства того, что ингибирование циклооксигеназы является основной причиной повреждения желудочно-кишечного тракта, вызванного приемом нестероидных противовоспалительных препаратов (НПВП)? Повторение актуальной травмы. Biochem Pharmacol 61: 631-637.DOI: https: //doi.org/10.1016/S0006-2952 (00) 00576-1. PubMed: 11266647.
- 11. Wolfe MM, Lichtenstein DR, Singh G (1999) Желудочно-кишечная токсичность нестероидных противовоспалительных препаратов. N Engl J Med 340: 1888-1899. DOI: https: //doi.org/10.1056/NEJM1993402407. PubMed: 10369853.
- 12. Данненберг А.Дж., Заким Д. (1999) Химиопрофилактика колоректального рака посредством ингибирования циклооксигеназы-2. Семин Онкол 26: 499-504. PubMed: 10528897.
- 13. Fosslien E (2000) Молекулярная патология циклооксигеназы-2 при неоплазии.Энн Клин Лаборатория Sci 30: 3-21. PubMed: 10678579.
- 14. Ёсимото Т., Такахаши Ю., Киношита Т., Сакашита Т., Иноуэ Х и др. (2002) Стимуляция роста и индукция рецептора эпидермального фактора роста в клетках карциномы толстой кишки человека, сверхэкспрессирующих циклооксигеназу. Adv Exp Med Biol 507: 403-407. PubMed: 12664617.
- 15. Ван Д., Ван Х., Ши К., Каткури С., Вали В. и др. (2004) Простагландин E (2) способствует росту колоректальной аденомы посредством трансактивации дельта рецептора, активируемого пролифератором ядерной пероксисомы.Cancer Cell 6: 285-295. DOI: https: //doi.org/10.1016/j.ccr.2004.08.011. PubMed: 15380519.
- 16. Poligone B, Baldwin AS (2001) Положительная и отрицательная регуляция NF-kappaB с помощью COX-2: роли различных простагландинов. J Biol Chem 276: 38658-38664. DOI: https: //doi.org/10.1074/jbc.M106599200. PubMed: 11509575.
- 17. Хусейн С.С., Сабо И.Л., Пай Р., Сореган Б., Джонс М.К. и др. (2001) Киназа MAPK (ERK2) — ключевая мишень для индуцированного НПВП ингибирования пролиферации и роста клеток рака желудка.Life Sci 69: 3045-3054. DOI: https: //doi.org/10.1016/S0024-3205 (01) 01411-4. PubMed: 11758830.
- 18. Wong BC, Jiang XH, Lin MC, Tu SP, Cui JT et al. (2004) Ингибитор циклооксигеназы-2 (SC-236) подавляет протеин-активатор-1 через c-Jun Nh3-концевую киназу. Гастроэнтерология 126: 136-147. DOI: https: //doi.org/10.1053/j.gastro.2003.10.063. PubMed: 14699495.
- 19. Iñiguez MA, Rodríguez A, Volpert OV, Fresno M, Redondo JM (2003) Циклооксигеназа-2: терапевтическая мишень в ангиогенезе.Trends Mol Med 9: 73-78. DOI: https: //doi.org/10.1016/S1471-4914 (02) 00011-4. PubMed: 12615041.
- 20. Shreedhar V, Giese T, Sung VW, Ullrich SE (1998) Цитокиновый каскад, включающий простагландин E2, IL-4 и IL-10, отвечает за УФ-индуцированное системное подавление иммунитета. J Immunol 160: 3783-3789. PubMed: 9558081.
- 21. Людвиг Дж. А., Вайнштейн Дж. Н. (2005) Биомаркеры в определении стадии рака, прогнозах и выборе лечения. Нат Рев Рак 5: 845-856. doi: https: // doi.org / 10.1038 / nrc1739. PubMed: 16239904.
- 22. Ханахан Д., Вайнберг Р.А. (2000) Признаки рака. Cell 100: 57-70. DOI: https: //doi.org/10.1016/S0092-8674 (00) 81683-9. PubMed: 10647931.
- 23. Ханахан Д., Вайнберг Р.А. (2011) Признаки рака: следующее поколение. Ячейка 144: 646-674. DOI: https: //doi.org/10.1016/j.cell.2011.02.013. PubMed: 21376230.
- 24. Цудзи М., Кавано С., Цудзи С., Саваока Х., Хори М. и др. (1998) Циклооксигеназа регулирует ангиогенез, индуцированный клетками рака толстой кишки.Ячейка 93: 705-716. DOI: https: //doi.org/10.1016/S0092-8674 (00) 81433-6. PubMed: 9630216.
- 25. Hiraga T, Myoui A, Choi ME, Yoshikawa H, Yoneda T (2006) Стимуляция экспрессии циклооксигеназы-2 с помощью костного трансформирующего фактора роста-бета усиливает метастазы в кости при раке груди. Cancer Res 66: 2067-2073. DOI: https: //doi.org/10.1158/0008-5472.CAN-05-2012. PubMed: 16489006.
- 26.
Ван Р, Ван Х, Лин Ф, Гао П, Донг К. и др. (2008) нацеленная на shRNA циклооксигеназа (COX) -2 ингибирует пролиферацию, снижает инвазию и повышает химиочувствительность в клетках карциномы гортани.Mol Cell Biochem 317 (1-2): 179-188. DOI: https: //doi.org/10.1007/s11010-008-9847-9. PubMed: 185
.
- 27. Яна Н.Р. (2008) НПВП и апоптоз. Cell Mol Life Sci 65 (9): 1295-1301. DOI: https://doi.org/10.1007/s00018-008-7511-x. PubMed: 18292966.
- 28. Denkert C, Fürstenberg A, Daniel PT, Koch I, Köbel M et al. (2003) Индуцирование остановки клеточного цикла G0 / G1 в клетках карциномы яичников противовоспалительным препаратом NS-398, но не вмешательством ЦОГ-2-специфической РНК.Онкоген 22 (54): 8653-8661. DOI: https: //doi.org/10.1038/sj.onc.1206920. PubMed: 14647459.
- 29. Ferrario A, Fisher AM, Rucker N, Gomer CJ (2005) Целекоксиб и NS-398 усиливают фотодинамическую терапию за счет увеличения апоптоза in vitro и уменьшения воспалительных и ангиогенных факторов in vivo. Cancer Res 65 (20): 9473-9478. DOI: https://doi.org/10.1158/0008-5472.CAN-05-1659. PubMed: 16230411.
- 30. Strillacci A, Griffoni C, Spisni E, Manara MC, Tomasi V (2006) РНК-интерференция как ключ к нокдауну сверхэкспрессированного гена циклокигеназы-2 в опухолевых клетках.Br J Cancer 94 (9): 1300-1310. DOI: https: //doi.org/10.1038/sj.bjc.6603094. PubMed: 16622456.
- 31. Charames GS, Bapat B (2006) Нокдаун циклооксигеназы-2 посредством РНК-интерференции при раке толстой кишки. Int J Oncol 28 (2): 543-549. PubMed: 163.
- 32. Kaelin WG Jr. (2005) Концепция синтетической летальности в контексте противоопухолевой терапии. Нат Рев Рак 5: 689-698. DOI: https: //doi.org/10.1038/nrc1691. PubMed: 16110319.
- 33. Манн М., Шенг Х., Шао Дж., Уильямс С.С., Писакан П.Л. и др.(2001) Нацеливание на пути циклооксигеназы 2 и her-2 / neu подавляет рост колоректальной карциномы. Гастроэнтерология 120: 1713-1719. DOI: https: //doi.org/10.1053/gast.2001.24844. PubMed: 11375952.
- 34. Tortora G, Caputo R, Damiano V, Melisi D, Bianco R et al. (2003) Комбинация селективного ингибитора циклооксигеназы-2 с ингибитором тирозинкиназы рецептора эпидермального фактора роста ZD1839 и антисмысловой протеинкиназой A вызывает кооперативный противоопухолевый и антиангиогенный эффект. Clin Cancer Res 9: 1566-1572.PubMed: 12684433.
- 35. Торранс К.Дж., Джексон П.Е., Монтгомери Э., Кинзлер К.В., Фогельштейн Б. и др. (2000) Комбинаторная химиопрофилактика новообразований кишечника. Нат Мед 6: 1024-1028. DOI: https: //doi.org/10.1038/79534. PubMed: 10973323.
- 36. Hanahan D, Folkman J (1996) Паттерны и новые механизмы ангиогенного переключения во время туморогенеза. Ячейка 86: 353-364. DOI: https: //doi.org/10.1016/S0092-8674 (00) 80108-7. PubMed: 8756718.
- 37. Туччилло С., Романо М., Троиани Т., Мартинелли Э., Моргилло Ф. и др.(2005) Противоопухолевая активность ZD6474, фактора роста-2 сосудистого эндотелия и низкомолекулярного ингибитора тирозинкиназы рецептора эпидермального фактора роста, в комбинации с SC-236, ингибитором циклооксигеназы-2. Clin Cancer Res 11 (3): 1268-1276. PubMed: 15709198.
- 38. Адамс Дж. М. (2003) Пути смерти: множественные пути к апоптозу. Genes Dev 17: 2481-2495. DOI: https: //doi.org/10.1101/gad.1126903. PubMed: 14561771.
- 39. Green DR (1998) Пути апоптоза: дороги к гибели.Ячейка 94: 695-698. DOI: https: //doi.org/10.1016/S0092-8674 (00) 81728-6. PubMed: 9753316.
- 40. Вайнберг Р.А. (2008) Механизмы злокачественного прогрессирования. Канцерогенез 29: 1092-1095. DOI: https: //doi.org/10.1093/carcin/bgn104. PubMed: 18453542.
- 41. Лу Дж., Гетц Дж., Миска Э.А., Альварес-Сааведра Э., Лэмб Дж. И др. (2005) Профили экспрессии микроРНК позволяют классифицировать рак человека. Nature 435 (7043): 834-838. DOI: https: //doi.org/10.1038/nature03702. PubMed: 15944708.
- 42.Schetter AJ, Leung SY, Sohn JJ, Zanetti KA, Bowman ED et al. (2008) Профили экспрессии микроРНК, связанные с прогнозом и терапевтическим результатом аденокарциномы толстой кишки. J Am Med Assoc 299 (4): 425-436. DOI: https: //doi.org/10.1001/jama.299.4.425. PubMed: 18230780.
- 43. Chakrabarty A, Tranguch S, Daikoku T, Jensen K, Furneaux H et al. (2007) МикроРНК-регуляция циклооксигеназы-2 во время имплантации эмбриона. Proc Natl Acad Sci USA 104 (38): 15144-15149. doi: https: // doi.org / 10.1073 / pnas.07054. PubMed: 17848513.
- 44. Дайкоку Т., Хирота Ю., Трангуч С., Джоши А.Р., ДеМайо Ф.Дж. и др. (2008) Условная потеря маточного Птен неизменно и быстро вызывает рак эндометрия у мышей. Cancer Res 68 (14): 5619-5627. DOI: https: //doi.org/10.1158/0008-5472.CAN-08-1274. PubMed: 18632614.
- 45. Li J, Pandey V, Kessler T, Lehrach H, Wierling C (2012) Моделирование miRNA и действия лекарств в сигнальном пути EGFR. PLOS ONE 7 (1): e30140.DOI: https: //doi.org/10.1371/journal.pone.0030140. PubMed: 22253908.
- 46. Wurdinger T, Costa FF (2007) Молекулярная терапия в микроРНК. Фармакогеномика J 7: 297-304. DOI: https: //doi.org/10.1038/sj.tpj.6500429. PubMed: 17189960.
- 47. Ли М. (2010) Роль miR-10b в метастазировании рака груди. Рак молочной железы Res 12: 210. DOI: https: //doi.org/10.1186/bcr2720. PubMed: 21067538.
- 48. Friedman JM, Liang G, Liu CC, Wolff EM, Tsai YC et al.(2009) Предполагаемый опухолевый супрессор microRNA-101 модулирует эпигеном рака путем репрессии белка EZh3 группы Polycomb. Cancer Res 69: 2623–2629. DOI: https://doi.org/10.1158/0008-5472.CAN-08-3114. PubMed: 19258506.
- 49. Франкель Л. Б., Вен Дж., Лис М., Хёйер-Хансен М., Фаркас Т. и др. (2011) микроРНК-101 является мощным ингибитором аутофагии. EMBO J 30 (22): 4628-4641. DOI: https: //doi.org/10.1038/emboj.2011.331. PubMed: 21 8.
- 50. Wu H, Zhu S, Mo YY (2009) Подавление роста и инвазии клеток с помощью miR-205 при раке груди.Cell Res 19 (4): 439-448. DOI: https://doi.org/10.1038/cr.2009.18. PubMed: 19238171.
- 51. Richards JA, Petrel TA, Brueggemeier RW (2002) Сигнальные пути, регулирующие ароматазу и циклооксигеназу в нормальных и злокачественных клетках груди. Дж. Стероид Биохим Мол Биол 80 (2): 203-212. DOI: https: //doi.org/10.1016/S0960-0760 (01) 00187-X. PubMed: 11897504.
- 52. Stasinopoulos I, Mori N, Bhujwalla MZ (2008) Злокачественный фенотип клеток рака груди снижается за счет молчания COX-2.Неоплазия. 10 (11): 1163-1169. PubMed: 18953425.
- 53. Чжан Х., Ли В., Нань Ф., Рен Ф., Ван Х и др. (2006) Профиль экспрессии микроРНК стволовых клеток рака толстой кишки в клеточной линии аденокарциномы HT29. Biochem Biophys Res Commun 404: 273-278. PubMed: 21130073.
- 54. Yu XF, Zou J, Bao ZJ, Dong J (2011) miR-93 подавляет пролиферацию и образование колоний стволовых клеток рака толстой кишки человека. World J Gastroenterol 17: 4711-4717. DOI: https: //doi.org/10.3748/wjg.v17.i42.4711. PubMed: 22180714.
- 55. Yu Y, Kanwar SS, Patel BB, Oh PS, Nautiyal J, Sarkar FH, Majumdar AP (2012) MicroRNA-21 индуцирует стволовость путем подавления бета-рецептора 2 трансформирующего фактора роста (TGFbetaR2) в клетках рака толстой кишки. Канцерогенез, 33: 68-76. DOI: https: //doi.org/10.1093/carcin/bgr246. PubMed: 22072622.
- 56. Zhang JG, Guo JF, Liu DL, Liu Q, Wang JJ (2011) microRNA-101 оказывает опухолевые супрессивные функции при немелкоклеточном раке легкого посредством прямого нацеливания на энхансер гомолога zeste 2.J Thorac Oncol 6 (4): 671-678. DOI: https: //doi.org/10.1097/JTO.0b013e318208eb35. PubMed: 21270667.
- 57. Arora H, Qureshi R, Park AK, Park WY (2011) Скоординированная регуляция ATF-2 с помощью miR-26b в гамма-облученных клетках рака легких. PLOS ONE 6 (8): e23802. DOI: https: //doi.org/10.1371/journal.pone.0023802. PubMed: 217.
- 58. Канаан З., Рай С.Н., Эйхенбергер М.Р., Робертс Х., Кески Б. и др. (2012) Плазма miR-21: потенциальный диагностический маркер колоректального рака.Энн Сург 256 (3): 544-551. DOI: https: //doi.org/10.1097/SLA.0b013e318265bd6f. PubMed: 22868372.
- 59. Вэй Дж., Гао В., Чжу Си-Джей, Лю YQ, Мэй З и др. (2011) Идентификация микроРНК-21 плазмы в качестве биомаркера для раннего выявления и химиочувствительности немелкоклеточного рака легкого. Чин Дж. Рак 30 (6): 407-414. DOI: https: //doi.org/10.5732/cjc.010.10522. PubMed: 21627863.
- 60. Прейс М., Гарднер Т. Б., Гордон С. Р., Пипас Дж. М., Маккензи Т. А. и др. (2011) экспрессия микроРНК-10b коррелирует с ответом на неоадъювантную терапию и выживаемостью при аденокарциноме протока поджелудочной железы.Clin Cancer Res 17 (17): 5812-5821. DOI: https: //doi.org/10.1158/1078-0432.CCR-11-0695. PubMed: 21652542.
- 61. Хидвеги Т., Юинг М., Хейл П., Диппольд С., Беккет С. и др. (2010) Лекарство, усиливающее аутофагию, способствует деградации мутантного альфа1-антитрипсина Z и снижает фиброз печени. Наука 329 (5988): 229-32.
- 62. Калин Г.А., Феррацин М., Чиммино А., Ди Лева Г., Шимицу М. и др. (2005) Сигнатура микроРНК, связанная с прогнозом и прогрессированием хронического лимфолейкоза.N Engl J Med 353 (17): 1793-1801. DOI: https: //doi.org/10.1056/NEJMoa050995. PubMed: 16251535.
- 63. Volinia S, Calin GA, Liu CG, Ambs S, Cimmino A et al. (2006) Сигнатура экспрессии микроРНК солидных опухолей человека определяет мишени для раковых генов. Proc Natl Acad Sci USA 103 (7): 2257-2261. DOI: https: //doi.org/10.1073/pnas.0510565103. PubMed: 16461460.
- 64. Сегре Д., Виткуп Д., Чёрч Г. М. (2002) Анализ оптимальности в естественных и нарушенных метаболических сетях.Proc Natl Acad Sci USA 99: 15112-15117. DOI: https: //doi.org/10.1073/pnas.232349399. PubMed: 12415116.
- 65. Шломи Т., Беркман О., Руппин Э. (2005) Регуляторное включение / выключение минимизации изменений метаболического потока после генетических нарушений. Proc Natl Acad Sci USA 102: 7695-7700. DOI: https: //doi.org/10.1073/pnas.0406346102. PubMed: 15897462.
- 66. Durot M, Bourguignon PY, Schachter V (2009) Модели бактериального метаболизма в масштабе генома: реконструкция и приложения.FEMS Microbiol Rev, 33: 164-190. DOI: https: //doi.org/10.1111/j.1574-6976.2008.00146.x. PubMed: 149.
- 67. Папин Дж. А., Хантер Т., Палссон Б. О., Субраманиам С. (2005) Реконструкция сотовых сигнальных сетей и анализ их свойств. Нат Рев Мол Cell Biol 6: 99-111. DOI: https: //doi.org/10.1038/nrm1570. PubMed: 15654321.
- 68. Джонс П.А., Бейлин С.Б. (2002) Фундаментальная роль эпигенетических событий при раке. Нат Рев Генет 3: 415-428. PubMed: 12042769.
- 69. Laird PW (2003) Сила и перспективы маркеров метилирования ДНК. Nat Rev Cancer 3: 253-266. DOI: https: //doi.org/10.1038/nrc1045. PubMed: 12671664.
- 70. Ли Л.К., Чуй Р., Накадзима К., О БР, Ау ХУ и др. (2000) Частое метилирование рецептора эстрогена при раке простаты: корреляция с прогрессированием опухоли. Cancer Res 60 (3): 702-706. PubMed: 10676656.
- 71. Leone G, Teofili L, Voso MT, Luebbert M (2002) препараты для метилирования и деметилирования ДНК при миелодиспластических синдромах и вторичных лейкозах.Haematologica 87 (12): 1342-1341. PubMed: 12495906.
- 72. Так-Мюллер С.М., Нараян А., Цзянь Ф., Смитс Д.Ф., Сойер Дж. И др. (2000) Гипометилирование ДНК и необычная хромосомная нестабильность в клеточных линиях пациентов с синдромом ICF. Cytogenet Cell Genet 89 (1-2): 121-128. DOI: https: //doi.org/10.1159/000015590. PubMed: 10894953.
- 73. Троиани Т., Скеттино С., Мартинелли Э., Моргилло Ф., Тортора Дж. И др. (2008) Использование моделей ксенотрансплантатов для выбора лечения рака на примере EGFR.Crit Rev Oncol / Hematol 65 (3): 200-211. DOI: https://doi.org/10.1016/j.critrevonc.2007.10.003. PubMed: 18389522.
Нестероидные противовоспалительные препараты усиливают функцию CFTR дикого типа и мутанта
Реферат
Мелкомасштабные клинические испытания показывают, что лечение пациентов с муковисцидозом (CF) ибупрофеном, нестероидным противовоспалительным препаратом, улучшает симптомы CF и замедляет снижение функции легких. Парадоксально, но ибупрофен ингибирует стимулируемую лигандом активность регулятора трансмембрантной проводимости (CFTR).Целью настоящего исследования было изучить влияние ибупрофена на функцию CFTR в различных условиях.
Patch-Clamp записи были выполнены в двух линиях эпителиальных клеток дыхательных путей человека: клетки IB3-8-3-7, которые экспрессируют CFTR дикого типа; и клетки IB3-1, которые экспрессируют вариант CFTR с делецией фенилаланина 580 (ΔF580CFTR).
Добавление ибупрофена к внеклеточному раствору вызывало быстрое ингибирование активности CFTR в клетках IB3-8-3-7 в присутствии высокой внутриклеточной концентрации цАМФ, тогда как ибупрофен усиливал проводимость CFTR при низких уровнях цАМФ.Введение ибупрофена внутрь клеток блокировало усиливающий эффект ибупрофена. Примечательно, что вариантная проводимость, опосредованная CFTR, была обнаружена в клетках IB3-1, обработанных миоинозитом, и была усилена ибупрофеном на эндогенных уровнях цАМФ.
Таким образом, нестероидные противовоспалительные препараты увеличивают функцию как регулятора трансмембранной проводимости при муковисцидозе дикого типа, так и делеции фенилаланина 580 в культивируемых эпителиальных клетках дыхательных путей человека при эндогенных уровнях цАМФ.
Муковисцидоз (CF) является одним из наиболее распространенных генетических заболеваний со смертельным исходом и вызывается мутациями в гене, кодирующем регулятор трансмембранной проводимости CF (CFTR), цАМФ-управляемый канал Cl –. Дисфункция варианта CFTR приводит к снижению секреции Cl — различными эпителиальными клетками, что, в свою очередь, приводит к уменьшению объема жидкости на поверхности дыхательных путей и, как следствие, к адгезии слизи, воспалению и образованию бактериальной биопленки. возникают в легких.Хотя муковисцидоз связан с измененной функцией эпителия во многих внутренних органах, включая легкие, кишечник и поджелудочную железу, легочные осложнения, такие как хроническое воспаление и закупорка слизистой, являются основными причинами заболеваемости и смертности при этом заболевании 1. В этом отношении фармакологические лечение по-прежнему является основным подходом к лечению легочных осложнений у пациентов с МВ 1.
CF в первую очередь вызывается дисфункцией варианта CFTR в эпителиальных клетках пораженных органов; таким образом, усиление или восстановление функции варианта CFTR у пациентов с МВ должно быть основной целью лечения МВ.Небольшие клинические исследования показали, что ибупрофен, нестероидный противовоспалительный препарат (НПВП), не только улучшает симптомы, но и сохраняет функцию легких у пациентов с МВ 2, если тщательно контролировать желудочно-кишечные побочные эффекты этого лекарства. Преимущество лечения ибупрофеном в значительной степени объясняется его противовоспалительным действием. Предыдущее исследование показало, что ибупрофен ингибирует активированные цАМФ токи CFTR в эпителиальных клетках неизвестным механизмом 3. Это ингибирующее действие на CFTR парадоксальным образом можно было бы ожидать, что оно усугубит симптомы CF.Принимая во внимание эту озабоченность, было повторно исследовано влияние НПВП, в частности ибупрофена, на функцию CFTR дикого типа и варианта с делецией фенилаланина 508 (ΔF580CFTR).
МЕТОДИКА ЭКСПЕРИМЕНТА
Клеточная культура
КлеткиIB3-1 4 были первоначально получены из эпителиальных клеток дыхательных путей пациента с МВ, который экспрессировал ΔF580CFTR 5. Путем создания контролируемой доксициклином системы экспрессии в клетках IB3-1 появилась новая линия клеток, названная IB3-8-3-7, который экспрессирует CFTR 6 дикого типа.Клетки IB3-1 и клетки IB3-8-3-7 культивировали в среде LHC-8 (Invitrogen, Carlsbad, CA, USA) с добавлением 5% фетальной бычьей сыворотки (Invitrogen) и 150 мкг · мл -1 гигромицина B (Сигма, Сент-Луис, Миссури, США). Индуцируемая экспрессия CFTR в клетках IB3-8-3-7 запускалась добавлением доксициклина (1 мкг · мл -1 ), и экспрессия CFTR была подтверждена с помощью ПЦР в реальном времени 6 и иммуноцитохимического анализа. Клетки IB3-8-3-7 использовали через 18–21 ч обработки доксициклином. Некоторые клетки IB3-1 обрабатывали 3 ммоль · л -1 миоинозитола (Sigma) и использовали через 18–21 ч обработки миоинозитом.
Гетерологичная экспрессия рецепторов γ-аминомасляной кислоты КлеткиIB3-8-3-7 были временно трансфицированы кДНК, кодирующими человеческие рецепторы A-типа, γ-аминомасляной кислоты (GABA) (GABA A R) -α1, -β2 и изоформы субъединиц -γ2L (1: 1). : 1) с помощью Lipofectamine 2000 (Invitrogen). Все кДНК были субклонированы в векторы экспрессии млекопитающих pCDM8 для гетерологичной экспрессии. Трансфицированные клетки выращивали и инкубировали в течение 24–48 ч перед использованием.
Патч-зажим записи
Перфорированные или обычные записи целых клеток с помощью патч-зажима выполняли в клетках IB3-1 и IB3-8-37 с использованием усилителя Axopatch-1D (Axon Instruments, Фостер-Сити, Калифорния, США). Метод перфорированного пластыря использовался, чтобы избежать нарушения внутриклеточных концентраций ионов и метаболизма. Следовательно, эндогенное мембранное напряжение (V m ) клеток могло быть обнаружено. Обычные записи целых клеток использовали для управления внутриклеточными концентрациями ионов и цАМФ, а также для доставки определенных тестируемых соединений в клетки.Перед использованием для регистрации клетки промывали и вымывали в стандартном внеклеточном растворе (ECS), содержащем: 145 ммоль · л -1 NaCl, 1,3 ммоль · л -1 CaCl 2 , 5,4 ммоль · л -1 KCl, 25 ммоль · л -1 HEPES и 10 мМ глюкозы (выдерживали при 35 ° C). Если иное специально не указано в разделе «Результаты», стандартный внутриклеточный раствор (ICS) для регистрации целых клеток состоял из: 150 ммоль · л −1 KCl, 10 ммоль · л −1 HEPES, 2 ммоль · л — 1 MgCl 2 , 1 ммоль · л -1 CaCl 2 и 0.005 ммоль · л -1 K 2 АТФ, с добавлением цАМФ или без него. ICS для записи перфорированных пластырей состоял из: 150 ммоль · л −1 KCl, 10 ммоль · л −1 HEPES, 2 ммоль · л −1 MgCl 2 , 1 ммоль · л −1 CaCl 2 и порообразующий агент грамицидин (50 мкг · мл -1 ; Sigma) 7. pH ECS и ICS был доведен до 7,4 и 7,3 соответственно, а осмолярность была скорректирована до диапазона 310 –315 мОсм. Патч-электроды (3–5 МОм) были изготовлены из тонкостенного стекла (1.Диаметр 5 мм; World Precision Instruments, Сарасота, Флорида, США) с помощью двухступенчатого съемника (PP-830; Narishige, East Meadow, NY, USA).
Запись перфорированного патча началась в режиме фиксации напряжения. Перфорация мембраны наблюдалась как постоянное снижение последовательного сопротивления после герметизации электрода. В большинстве записей сопротивление снижалось до значения в диапазоне 30–35 МОм в течение 5–8 минут после герметизации, а затем сопротивление могло оставаться стабильным в течение ~ 40–80 минут. Чтобы отслеживать возможное формирование конфигурации целых клеток, во время записи приблизительно каждые 5 мин исследовали серийное сопротивление.Регистрацию всей клетки проводили, как описано ранее 8, 9.
V m ячейки измеряли с помощью токовых клещей. В режиме фиксации напряжения трансмембранную проводимость клетки определяли по ступеням гиперполяризации или деполяризации или по нарастанию напряжения (постоянное изменение напряжения от -100 до 100 мВ в течение 1,5 с). В соответствии с экспериментальной целью в ICS или ECS добавляли тестируемые препараты. Контрольный ECS и внеклеточно использованное лекарство (а) наносили на клетку с использованием управляемой компьютером системы перфузии с двумя цилиндрами (SF-77B; Warner Instruments, Хамден, Коннектикут, США).Тестируемые препараты добавляли в ЭКС через 8–12 мин после цельноклеточной конфигурации, при которой амплитуда токов была постоянной.
Анализ данных
Все записанные электрические сигналы были оцифрованы, отфильтрованы (полосовой фильтр 1 кГц) и получены онлайн с использованием программного обеспечения Clampex и проанализированы в автономном режиме с использованием программного обеспечения Clampfit (оба Axon Instruments). Данные представлены как среднее ± средн. Средние значения сравнивали с непарными или парными t-критериями, где это было необходимо.Значение p <0,05 считалось значимым.
РЕЗУЛЬТАТЫ
Электрофизиологическая характеристика CFTR дикого типа, экспрессируемого в эпителиальных клетках дыхательных путей человека
Вызванная доксициклином экспрессия CFTR дикого типа в клетках IB3-8-3-7 6 была определена иммуноцитохимическим методом (фиг. 1). Записи перфорированного пластыря показали, что V m необработанных клеток IB3-8-3-7 составлял -11,6 ± 3,1 мВ, тогда как V m обработанных доксициклином клеток составлял -32.2 ± 3,0 мВ (рис. 2a⇓), что близко к V m первичных эпителиальных клеток дыхательных путей человека 10. Вероятно, что это изменение V m было связано с подавлением эндогенных эпителиальных натриевых каналов ( ENaC), которые связаны с повышенной экспрессией CFTR 11, 12. Активность CFTR регулируется внутриклеточным цАМФ, а концентрация эндогенного цАМФ контролируется аденилатциклазой (AC) 13. Применение активатора AC форсколина (3 мкмоль · л) -1 ) вызывали значительную и длительную деполяризацию (рис. 2a⇓ и b).Эта деполяризация согласуется с вызванным цАМФ CFTR-опосредованным оттоком Cl —.
Рис. 1—Иммуноцитохимическое окрашивание регулятора трансмембранной проводимости муковисцидоза (CFTR) в а) контрольных клетках IB3-8-3-7 и б) клетках, обработанных доксициклином. Клетки, обработанные доксициклином, являются иммунопозитивными к CFTR. Масштабные линейки = 25 мкм.
Рис. 2–а) Напряжение на мембране (В м ) ячеек IB3-8-3-7, измеренное с помощью токовых клещей с перфорированной пластиной: в отсутствие (-; -11.6 ± 3,1 мВ; n = 6) и присутствие (+; -32,2 ± 3,0 мВ; n = 9) доксициклина; и в обработанных доксициклином клетках IB3-8-3-7 до (-; -30,4 ± 3,9 мВ) и после (+; -15,6 ± 4,9 мВ; n = 5) добавления 3 мкМ форсколина. Данные представлены как среднее ± средн. б) В условиях токового зажима с перфорированным пластырем кратковременное добавление 3 мкМ форсколина (□) к внеклеточному раствору вызывало длительную деполяризацию. — — -: исходное значение -30 мВ. *: р <0,05.
Затем были выполнены записи целых клеток с цАМФ или без него (100 мкмоль · л -1 ) в ICS (рис.3а⇓ и б). Каждая ячейка (при -60 мВ; n = 16) ответила медленно развивающимся внутренним током в присутствии цАМФ (рис. 3b⇓). Этот ток постепенно увеличивался, достигая максимального уровня через 4–6 мин после цельноклеточной конфигурации, а затем неуклонно снижался, достигая стабильного значения через 8–10 мин. Напротив, в отсутствие цАМФ ток не регистрировался (рис. 3a⇓). Чтобы выяснить, опосредован ли этот ток проводимостью Cl — , Cl — в ICS был заменен глюконатом, непроницаемым для мембран анионом.В этом состоянии клетки генерируют наружные токи, когда их удерживают на уровне 0 мВ (рис. 3c⇓). Если Cl – в ECS также был заменен глюконатом, исходящий ток постепенно уменьшался до исходного уровня (рис. 3c⇓). Этот результат подтверждает, что ток, индуцированный цАМФ, опосредуется проводимостью Cl —. Трансмембранную проводимость также исследовали путем ступенчатого увеличения V m (от -100 до 100 мВ; рис. 4). В отсутствие цАМФ проводимости не обнаружено (рис.4a⇓), тогда как независимая от напряжения проводимость наблюдалась, когда цАМФ (100 мкмоль · л -1 ) был включен в ICS (рис. 4b⇓ и d). Кроме того, когда V m удерживалось ниже 0 мВ, эта проводимость сильно ингибировалась глибенкламидом (100 мкмоль · л -1 ), блокатором 14 CFTR (рис. 4c⇓ и d). Взятые вместе, эти данные демонстрируют, что обработанные доксициклином клетки IB3-8-3-7 экспрессируют функциональные каналы CFTR.
Рис. 3–Типичные трансмембранные токи в обработанных доксициклином клетках IB3-8-3-7 (при -60 мВ) в а) отсутствии или б) в присутствии 100 мкМ внутриклеточного цАМФ.c) примерный график показывает переключение направления трансмембранного тока в ответ на глюконат, а не на Cl — во внеклеточном растворе; на ячейке было зафиксировано напряжение 0 мВ, и внутриклеточный раствор содержал глюконат, а не Cl —, повсюду. — — -: базальный ток 0 A.
Рис. 4—a) В отсутствие внутриклеточного цАМФ, ступенчатое увеличение мембранного напряжения (V m ) от -100 до 100 мВ не выявило трансмембранной проводимости в доксициклине- обработанные клетки IB3-8-3-7.б) В присутствии 100 мкМ внутриклеточного цАМФ изменение V m показало независимую от напряжения проводимость в обработанных доксициклином клетках IB3-8-3-7, которая в) ингибировалась трансмембранной проводимостью при муковисцидозе. ингибитор регулятора, глибенкламид (100 мкМ), когда клетка поддерживалась при отрицательном V m . г) Вольт-амперная зависимость в отсутствие (○) и в присутствии (•) глибенкламида.
Ибупрофен регулирует функцию CFTR в зависимости от концентрации цАМФ
Действие ибупрофена изучали на проводимость CFTR с цАМФ (100 мкмоль · л -1 ) в ICS.Каждая ячейка выдерживалась при 0 мВ, и для определения проводимости CFTR использовался протокол линейного нарастания напряжения (рис. 5⇓). Как только наблюдалась стабильная проводимость CFTR, добавление ибупрофена (300 мкмоль · л -1 ) к ECS приводило к быстрому подавлению проводимости при V m более гиперполяризовано, чем -20 мВ (фиг. 5a 5 и b). Примечательно, что ибупрофен также индуцировал устойчивое и прогрессивное усиление тока CFTR (рис. 5⇓), включая чистое увеличение входящего тока в покоящейся клетке V m (-30 мВ; рис. 5b – e⇓ и 6a). .
Рис. 5–a) В присутствии 100 мкМ внутриклеточного цАМФ, токи регулятора трансмембранной проводимости (CFTR) цельноклеточного муковисцидоза в обработанных доксициклином клетках IB3-8-3-7 были выявлены с помощью протокола линейного нарастания напряжения. (для пилообразной формы волны от -100 до 100 мВ). Сразу после добавления 300 мкМ ибупрофена () к внеклеточному раствору он вызывал блокаду тока CFTR, обнаруживаемого при отрицательном мембранном напряжении (V m ). Помимо блокады, зависящей от напряжения, ибупрофен постепенно увеличивал ток CFTR независимо от V m .Двойное влияние ибупрофена на соотношение тока и напряжения CFTR в определенные моменты времени было следующим: б) ¶ по сравнению с # , в) + по сравнению с # , г) § по сравнению с # и e) ƒ по сравнению с # .
Активность CFTR может быть повышена или понижена с помощью соединения в зависимости от концентрации внутриклеточного цАМФ 15, и концентрации эндогенного цАМФ в эпителиальных клетках предположительно находятся на уровне нМ или низких мкМ в физиологических условиях 16.В качестве альтернативы ибупрофен имеет высокое сродство к белкам плазмы, и свободный ибупрофен составляет <1% от общей концентрации в плазме 17. При клинических дозах, достигающих 50–100 мкг · мл –1 2, свободный ибупрофен в плазме составляет всего ∼1– 2 мкмоль · л −1 . Поэтому влияние ибупрофена в низкой концентрации (5 мкмоль · л -1 ) на активность CFTR было протестировано в присутствии высокой (100 мкмоль · л -1 ) и низкой (5 мкмоль · л — 1 ) концентрации внутриклеточного цАМФ.При высокой концентрации цАМФ ибупрофен вызывал зависимое от напряжения ингибирование проводимости CFTR (рис. 6b⇓). Напротив, при низких концентрациях цАМФ ибупрофен индуцировал усиление токов CFTR без какого-либо ингибирования.
Рис. 6—a) Токи регулятора трансмембранной проводимости при муковисцидозе (CFTR) (при напряжении на мембране -30 мВ; n = 12), зарегистрированные до, во время и после нанесения 300 мкМ ибупрофена (). Амплитуда тока в одной и той же ячейке в разные моменты времени была нормализована к амплитуде тока непосредственно перед применением ибупрофена.б) Обобщение влияния 5 мкМ ибупрофена на нормализованный ток CFTR всей клетки (измеренный при напряжении мембраны -90 мВ) в присутствии 100 мкМ (76 ± 8,7% контроля; n = 11) и 5 мкМ (148 мВ). ± 15,6% от контроля; n = 5) внутриклеточный цАМФ. *: p <0,05 по сравнению с контролем .
Затем изучали влияние ибупрофена на активность CFTR в условиях записи перфорированного пластыря. Нарастание напряжения выявило независимую от напряжения проводимость в клетках IB3-8-3-7, обработанных доксициклином, которая была усилена добавлением форсколина (5 мкмоль · л -1 ) к ECS (рис.7а⇓). Чтобы подтвердить, что эта чувствительная к форсколину проводимость в клетках IB3-8-3-7 опосредована потоком Cl —, клетки трансфицировали субъединицами GABA A R, которые образуют проницаемые каналы для Cl — 18. Применение ГАМК (30 мкмоль · л -1 ) вызывал токи в трансфицированных клетках при различных значениях V m (рис. 7b⇓). Построение графика индуцированных ГАМК токов относительно удержания V m дало линейную зависимость тока от напряжения (I – V) (рис.7c⇓), а рассчитанные значения обратного потенциала ГАМК-токов (E GABA ) составили -23 ± 2,2 мВ (рис. 7d⇓). В качестве альтернативы, обратный потенциал чувствительной к форсколину проводимости (E forsk ; рис. 7a⇓) составлял -22,4 ± 2,3 мВ (рис. 7d⇓), что почти идентично E GABA . Эти данные показывают, что токи Cl — лежат в основе чувствительной к форсколину линейной проводимости. Примечательно, что ибупрофен (5 мкмоль · л -1 ) значительно увеличил эту проводимость Cl — (рис.8a⇓ и b) без блокады при гиперполяризованных значениях V m (рис. 8a⇓). Эта усиленная ибупрофеном проводимость Cl — подавлялась глибенкламидом (200 мкмоль · л -1 ; рис. 8a⇓), но сохранялась в присутствии 10 мкмоль · л -1 амилорида (блокатор ENaC) и 10 мкмоль · L -1 буметанид, ингибитор Na + -K + -2Cl — -котранспортер (n = 3 клетки, данные не показаны), что указывает на то, что он опосредуется каналами CFTR. Более того, быстрое применение ибупрофена вызывало токи в обработанной доксициклином клетке IB3-8-3-7 (см. Дополнительный рисунок 1a⇑ в Интернете) с реверсивным потенциалом ~ -20 мВ (см. Дополнительный рисунок 1b⇑ в Интернете).Эти объединенные данные подтверждают, что ибупрофен усиливает тоническую активность CFTR при эндогенной концентрации цАМФ.
Рис. 7—Ибупрофен усиливает активность канала регулятора трансмембранной проводимости при муковисцидозе при физиологическом метаболическом состоянии, измеренном с помощью записи перфорированного пластыря в условиях фиксации напряжения с мембранным напряжением (V m ), поддерживаемым на уровне 0 мВ. а). Нарастание напряжения показало линейную (не зависящую от напряжения) трансмембранную проводимость в клетках IB3-8-3-7, обработанных доксициклином ( # ), которая была усилена добавлением 5 мкМ форсколина к внеклеточному раствору ( ). .б) Типичные токи, вызванные гамма-аминомасляной кислотой (ГАМК) при различных выдержках V м (от -80 до 10 мВ; например, + : -20 мВ; и § : -30 мВ) в доксициклине. -обработанная клетка IB3-8-3-7, трансфицированная кДНК, кодирующей субъединицы α1, β2 и γ2L рецепторов GABA A . в) Вольт-амперная зависимость токов ГАМК. г) Инверсия V m ГАМК-тока (E GABA ; -23,4 ± 2,2 мВ; n = 6) и токов, чувствительных к форсколину (E forsk ; -22.4 ± 2,3 мВ; п = 5). ·····: 0. Данные представлены как среднее ± средн.
Рис. 8—Ибупрофен усиливает активность канала регулятора трансмембранной проводимости при муковисцидозе при физиологическом метаболическом состоянии, измеренном с помощью записи с перфорированной пластырем в условиях фиксации напряжения с мембранным напряжением (V m ), поддерживаемым на уровне 0 мВ. а) Добавление 5 мкМ ибупрофена () к внеклеточному раствору (ECS) усиливало эндогенный неуправляемый по напряжению ток как при отрицательном, так и при положительном мембранном напряжении.Добавление 100 мкМ глибенкламида (▪) к ECS ингибировало ток, усиленный ибупрофеном. б) Нормализованная амплитуда вызванных токов нарастания напряжения (измеренная при -30 мВ) до и во время добавления ибупрофена (). Данные отображаются как среднее ± средн. c) Эффект усиления эпителиальных клеток тонкого кишечника крыс на ток, вызванный нарастанием напряжения. г) Амплитуда тока в эпителиальных клетках кишечника до (контроль; 260 ± 26 пА; n = 5) и через 3 мин после (393 ± 46 пА; n = 5) применения ибупрофена. Данные отображаются как среднее ± средн.*: р <0,05.
Ибупрофен также усиливал активность CFTR в эпителиальных клетках тонкого кишечника крыс (фиг. 8c⇑ и d). Авторы пришли к выводу, что ибупрофен усиливает функцию канала CFTR в физиологических внутриклеточных условиях. Более того, меклофенамовая кислота, другой НПВП, аналогичным образом увеличивала CFTR-проводимость обработанных доксициклином клеток IB3-8-3-7 при деполяризованном V m , но подавляла проводимость при гиперполяризованном V m (см. Дополнительный рисунок 2 в Интернете).Усиление функции CFTR НПВС, по-видимому, напрямую не связано с блокадой циклооксигеназы, фермента, который превращает арахидоновую кислоту в простагландины, поскольку первый ингибирует активность CFTR 19.
Ибупрофен активирует функцию ▵F580-CFTR
Были сделаны записи целых клеток на клетках IB3-1 CF, в которых несколько белков ΔF580CFTR нацелены на поверхность мембраны. Действительно, в присутствии 100 мкмоль · л -1 цАМФ в ICS последовательные линейные изменения напряжения не смогли выявить CFTR-подобную проводимость в этих клетках даже через 10 минут после конформации цельной клетки ( # на рис.9а⇓).
Рис. 9—Ибупрофен усиливает функцию канала регулятора трансмембранной проводимости кистозного фиброза ΔF508 в клетках IB3-1. a) Запись нарастания напряжения целых клеток с 5 мкМ цАМФ во внутриклеточном растворе выявила проводимость в обработанных миоинозитом клетках IB3-1, но не в необработанных клетках IB3-1 ( # : в присутствии 100 мкМ цАМФ). Эта вызванная линейным изменением напряжения проводимость была увеличена добавлением 300 мкМ ибупрофена (), а ток, усиленный ибупрофеном, можно было подавить добавлением 100 мкМ глибенкламида (▪).б) В условиях записи с перфорированным пластырем нарастание напряжения выявило нелинейную проводимость в клетках IB3-1, обработанных миоинозитом, которая была усилена добавлением 5 мкМ ибупрофена () к внеклеточному раствору. c) Среднее ± полутвердое напряжение эндогенной мембраны, измеренное при записи с помощью перфорированного пластыря в отсутствие (-1,1 ± 2,3 мВ; n = 6) и присутствие (-32 ± 4,8 мВ; n = 5) миоинозита в клетках IB3-1. Нормализованная амплитуда токов, вызванных нарастанием напряжения (измеренная при -30 мВ) в клетках IB3-1, обработанных миоинозиталом, до, во время и после добавления d) 300 мкМ (n = 6) и e) 5 мкМ (n = 10) ибупрофена .*: р <0,05.
Обработка эпителиальных клеток миоинозитом, входящим в состав фосфолипидов, может защитить ΔF508CFTR от деградации и усилить его поверхностную экспрессию 20. Клетки IB3-1 обрабатывали миоинозитолом в течение 18 часов, и изменение напряжения показало CFTR-подобную проводимость в клетках, обработанных миоинозитом. (рис. 9a⇑, n = 9), когда 5 мкмоль · л -1 цАМФ было включено в ICS; эта проводимость не была очевидна, когда цАМФ был исключен из ICS. Также он блокировался глибенкламидом (рис.9а⇑). Учитывая, что белки ΔF508CFTR являются функциональными каналами, когда нацелены на цитоплазматическую мембрану 21, авторы настоящего изобретения заключают, что эта цАМФ-индуцированная чувствительная к глибенкламиду проводимость в клетках IB3-1 опосредуется ΔF508CFTR; хотя он обнаруживает нелинейные отношения ВАХ на гиперполяризованной V m 22. Важно отметить, что эта опосредованная ΔF508CFTR проводимость усиливалась ибупрофеном (фиг. 9a и d).
Также были сделаны записиперфорированных пластырей из клеток IB3-1, обработанных миоинозитом или без него.Эндогенный V m необработанных клеток IB3-1 составлял -1,1 ± 2,3 мВ, тогда как обработка миоинозитом увеличивала V m до -32 ± 4,8 мВ (фиг. 9c⇑). Примечательно, что изменение напряжения выявило проводимость в клетках, обработанных миоинозитом, которая была увеличена ибупрофеном (5 мкмоль · л -1 ; рис. 9b⇑ и e). Эти результаты предполагают, что ибупрофен усиливает функцию ΔF508CFTR.
Ибупрофен усиливает активность CFTR через внутриклеточный механизм
Увеличение проводимости CFTR под действием ибупрофена развивалось медленно (рис.5⇑), предполагая, что усиливающее действие может потребовать доступа во внутриклеточный компартмент. Чтобы проверить эту идею, активность CFTR в обработанных доксициклином клетках IB3-8-3-7 оценивали последовательно с использованием протокола линейного изменения напряжения сразу после компиляции целых клеток. Используя преимущества цельноклеточной конфигурации, ибупрофен был доставлен в клетку (300 мкмоль · л -1 вместе со 100 мкмоль · л -1 цАМФ). Наблюдалось постепенное увеличение амплитуды трансмембранной проводимости, достигающее пика ∼4–6 мин после цельноклеточного архетипа, а затем снижалось до устойчивого уровня ∼8–10 мин после цельноклеточной модели (рис.10⇓). Примечательно, что зависимость I – V повышенных токов была линейной (рис. 10a⇓), что указывает на то, что внутриклеточный ибупрофен не вызывает зависимую от напряжения блокаду CFTR. Более того, нанесение на график нормализованной амплитуды (измеренной при V m , равной -90 мВ) последовательно обнаруженных токов показало большую проводимость в присутствии внутриклеточного ибупрофена, чем в отсутствие ибупрофена (рис. 10b⇓). Эти данные предполагают, что ибупрофен активирует активность CFTR через внутриклеточные механизмы .Также было обнаружено, что в присутствии внутриклеточного ибупрофена добавление ибупрофена к ECS вызывает быстрое подавление тока при отрицательных значениях V m без усиления при деполяризованном V m (фиг. 11a и b). Эти данные не только подтверждают, что ибупрофен усиливает CFTR, взаимодействуя с внутриклеточным механизмом, но также указывают на то, что его потенциал-зависимый блокирующий эффект на CFTR, вероятно, будет составлять через внеклеточный доступ к каналу.
Рис. 10—Ибупрофен оказывает усиливающее и ингибирующее действие на проводимость регулятора трансмембранной проводимости при муковисцидозе посредством внутриклеточных и внеклеточных механизмов. а) Типичные следы токов, вызванных нарастанием напряжения, записанные в различные моменты времени записи в присутствии 300 мкМ ибупрофена во внутриклеточном растворе. б) Нормализованные амплитуды токов, вызванных нарастанием напряжения, при V m -90 мВ клеток в отсутствие (○: n = 6 клеток) и в присутствии (•: n = 6 клеток) 300 мкМ ибупрофена во внутриклеточном растворе. .Токи были нормализованы к току, зарегистрированному сразу после конфигурирования целых клеток.
Рис. 11—Ибупрофен оказывает усиливающее и ингибирующее действие на проводимость регулятора трансмембранной проводимости (CFTR) при муковисцидозе через внутриклеточные и внеклеточные механизмы . а) В присутствии 300 мкМ ибупрофена во внутриклеточном растворе к внеклеточному раствору (▓) добавляли 300 мкМ ибупрофена через 11 мин после конфигурации всей клетки, и последовательные кривые иллюстрируют влияние внеклеточного ибупрофена на вызванные токи CFTR.б) Средние ± полуамплитуды тока, зарегистрированные во время перфузии ибупрофена, были нормализованы в соответствии с током, вызванным за 30 с до добавления ибупрофена во внеклеточный раствор. Амплитуды тока во время перфузии ибупрофена составляли 55 ± 6,5, 84 ± 3,0 и 97 ± 2,6% от контрольного размера при -90, -60 и -30 мВ напряжения удерживающей мембраны (В м ), соответственно (n = 4). . c) Последовательные кривые показывают влияние добавления 300 мкМ ибупрофена к внеклеточному раствору () на вызванные токи CFTR в присутствии 10 мкМ генистеина во внутриклеточном растворе.г) Нормализованное среднее ± полуамплитуда тока, зарегистрированного во время перфузии ибупрофена. Амплитуды тока во время перфузии ибупрофена составляли 50 ± 2,6, 81 ± 3,4 и 98 ± 2,5% от контрольного размера при -90, -60 и -30 мВ в помещении V m , соответственно (n = 4). **: p <0,001; ***: p <0,0001.
Генистеин представляет собой известный реагент 23, 24, модулирующий CFTR, который усиливает CFTR за счет связывания с внутриклеточным доменом 25 белка CFTR. С генистеином (10 мкмоль · л -1 ) и цАМФ (100 мкмоль · л -1 ), включенными в ICS, добавлением ибупрофена (200 мкмоль · л -1 ) к ECS, блокировка, зависящая от напряжения , без какого-либо сопутствующего потенцирования тока CFTR (рис. 11c⇑ и d).Используя записи перфорированного пластыря, было дополнительно подтверждено, что нанесение генистеина на ECS увеличивало проводимость CFTR и блокировало усиление ибупрофеном (данные не показаны).
ОБСУЖДЕНИЕ
Результаты текущего исследования показывают, что ибупрофен оказывает по крайней мере два различных эффекта на проводимость CFTR. Во-первых, в концентрациях, превышающих клинические дозы, он может вызывать быстрое и зависимое от напряжения ингибирование активности CFTR, что, вероятно, связано с прямой блокадой каналов.Примечательно, что ибупрофен вызывает потенциал-зависимую блокаду CFTR только тогда, когда канал стимулируется высокой концентрацией цАМФ. Это согласуется с предыдущим исследованием, которое показало, что высокие концентрации ибупрофена подавляли проводимость CFTR при условии, что каналы были сильно активированы форсколином или с использованием высоких концентраций внутриклеточного цАМФ 3. Во-вторых, что наиболее важно, клинически значимые дозы ибупрофена существенно усиливают токи CFTR в присутствии низкого внутриклеточного цАМФ или в ненарушенных внутриклеточных условиях, которые лучше отражают физиологию клеток in vivo и .Взятые вместе, настоящие результаты не только выявили мощные и новые действия ибупрофена в повышении активности CFTR, но также доказали, что НПВП регулируют функцию CFTR зависимым от активности каналов образом посредством внутриклеточного взаимодействия с этим трансмембранным белком.
Наиболее распространенным генетическим дефектом при МВ является мутация ΔF508 26. Настоящие данные показывают, что ибупрофен может повышать активность ΔF508CFTR при условии, что они экспрессируются на поверхности клетки.Авторы утверждают, что пациенты с МВ, у которых снижен уровень ΔF508CFTR на поверхности эпителиальных клеток, выиграют от лечения ибупрофеном. Кроме того, предыдущие клинические исследования по определению оптимальных доз ибупрофена для лечения МВ были основаны на его влиянии на блокирование инфильтрации нейтрофилов. Настоящие результаты демонстрируют, что ибупрофен в клинических дозах усиливает активность канала CFTR in vitro . Чтобы оценить его потенциальную клиническую пользу у пациентов с МВ, необходимо будет подтвердить эти результаты, используя измерения разности назальных потенциалов.
Огромные усилия были направлены на поиск лекарств-кандидатов для лечения муковисцидоза. Например, генистеин рассматривается как реагент 23–25 , усиливающий трансмембранный регулятор проводимости при муковисцидозе, через прямых взаимодействий с молекулами трансмембранного регулятора проводимости при муковисцидозе. Индуцированное ибупрофеном усиление регулятора трансмембранной проводимости при муковисцидозе может блокироваться генистеином, что предполагает, что ибупрофен регулирует активность регулятора трансмембранной проводимости при муковисцидозе, возможно, путем взаимодействия с сайтом (-ами) связывания «генистеин» на регуляторе трансмембранной проводимости при муковисцидозе. молекула.Это представление необходимо продемонстрировать в ходе дальнейших экспериментов. Генистеин активирует функцию регулятора трансмембранной проводимости при муковисцидозе 23, 24. Однако это соединение нерастворимо в воде и сильно влияет на эндокринную и иммунную системы новорожденных крыс 27, что делает его непригодным для клинического использования. Напротив, ибупрофен, широко используемый и клинически одобренный нестероидный противовоспалительный препарат, будет намного лучшим выбором для лечения пациентов с муковисцидозом.
Заявление о поддержке
Настоящее исследование было поддержано Канадским институтом исследований в области здравоохранения (CIHR) с операционными грантами (MOP-74653 и MOP-84517) для W-Y. Лу и грантами от CIHR и Canadian Cystic Fibrosis Foundation J. Hu.
Заявление о заинтересованности
Не объявлено.
Благодарности
Авторы благодарят B. Ye (Центр медицинских наук Саннибрук, Торонто, Онтарио, Канада) за помощь в культивировании клеток.Авторы также хотели бы поблагодарить М. Джексона (кафедра физиологии, Университет Торонто, Торонто, Онтарио, Канада) за комментарии к рукописи.
- Получено 13 декабря 2007 г.
- Принято 13 марта 2008 г.
Список литературы
- ↵
Koehler DR, Downey GP, Sweezey NB, Tanswell AK, Hu J. Воспаление легких как терапевтическая мишень при муковисцидозе. Am J Respir Cell Mol Biol 2004; 31: 377–381.
- ↵
Констан МВт, Бьярд П.Дж., Хоппель К.Л., Дэвис ПБ.Эффект высоких доз ибупрофена у пациентов с муковисцидозом. N Engl J Med 1995; 332: 848–854.
- ↵
Devor DC, Schultz BD. Ибупрофен подавляет секрецию Cl — , опосредованную регулятором трансмембранной проводимости при муковисцидозе. Дж. Клин Инвест 1998; 102: 679–687.
- ↵
Rubenstein RC, Zeitlin PL. 4-фенилбутират натрия подавляет Hsc70: влияние на внутриклеточный трафик ΔF508-CFTR.Am J Physiol Cell Physiol 2000; 278: C259 – C267.
- ↵
Дженсен Т.Дж., Лу, Массачусетс, Пинд С., Уильямс Д. Б., Голдберг А. Л., Риордан Дж. Р. Множественные протеолитические системы, включая протеасому, вносят вклад в процессинг CFTR. Cell 1995; 83: 129–135.
- ↵
Ye L, Chan S, Chow YH, Tsui LC, Hu J. Регулируемая экспрессия гена CFTR человека в эпителиальных клетках. Мол Тер 2001; 3: 723–733.
- ↵
Sugita M, Hirono C, Shiba Y.Запись перфорированного грамицидином пластыря выявила колебательный характер секреторных движений Cl — в ацинарных клетках слюны. J Gen Physiol 2004; 124: 59–69.
- ↵
Dong H, Kumar M, Zhang Y, et al. γ-Аминомасляная кислота повышает и понижает секрецию инсулина β-клетками в соответствии с изменениями концентрации глюкозы. Диабетология 2006; 49: 697–705.
- ↵
Dong H, Xiang YY, Farchi N, et al. Избыточная экспрессия ацетилхолинэстеразы нарушает глутаматергический синаптогенез в нейронах гиппокампа. J Neurosci 2004; 24: 8950–8960.
- ↵
Xiang YY, Wang S, Liu M, et al. ГАМКергическая система в эпителии дыхательных путей важна для гиперпродукции слизи при астме. Нат Мед 2007; 13: 862–867.
- ↵
Kunzelmann K, Kiser GL, Schreiber R, Riordan JR. Ингибирование эпителиальных токов Na + внутриклеточными доменами регулятора трансмембранной проводимости при муковисцидозе.FEBS Lett 1997; 400: 341–344.
- ↵
Chabot H, Vives MF, Dagenais A, Grygorczyk C, Berthiaume Y, Grygorczyk R. Подавление эпителиального натриевого канала (ENaC) с помощью CFTR, коэкспрессируемого в ооцитах Xenopus , не зависит от проводимости Cl —. J Membr Biol 1999; 169: 175–188.
- ↵
Купер ДМ. Компартментализация передачи сигналов аденилатциклазы и цАМФ. Biochem Soc Trans 2005; 33: 1319–1322.
- ↵
Шеппард Д.Н., Робинсон К.А. Механизм ингибирования глибенкламидом трансмембранного регулятора проводимости при муковисцидозе Cl — каналов, экспрессируемых в линии мышиных клеток. J. Physiol 1997; 503: 333–346.
- ↵
Ван В., Ли Дж., Клэнси Дж. П., Кирк К.Л. Активация каналов регуляторов трансмембранной проводимости при муковисцидозе аналогами блокаторов пор. J. Biol Chem. 2005; 280: 23622–23630.
- ↵
Кувер Р., Савард С., Ода Д., Ли СП. PGE генерирует внутриклеточный цАМФ и ускоряет секрецию муцина культивированными эпителиальными клетками желчного пузыря собак. Am J Physiol 1994; 267: G998 – G1003.
- ↵
Локвуд GF, Альберт KS, Szpunar GJ, Wagner JG. Фармакокинетика ибупрофена у человека — III: Связывание с белками плазмы. J. Pharmacokinet Biopharm, 1983; 11: 469–482.
- ↵
Вичини С.Фармакологическое значение структурной неоднородности комплекса рецептор-хлорид-ионный канал GABA A . Нейропсихофармакология 1991; 4: 9–15.
- ↵
Чжоу Дж. Дж., Линсделл П. Молекулярный механизм ингибирования арахидоновой кислотой хлоридного канала CFTR. Eur J Pharmacol 2007; 563: 88–91.
- ↵
Zhang XM, Wang XT, Yue H, et al. Органические растворенные вещества восстанавливают функциональный дефект в регуляторе трансмембранной проводимости кистозного фиброза ΔF508.J Biol Chem 2003; 278: 51232-51242.
- ↵
Li C, Ramjeesingh M, Reyes E, et al. Мутация муковисцидоза (ΔF508) не влияет на активность хлоридных каналов CFTR. Нат Генет 1993; 3: 311–316.
- ↵
Ван Ф, Зельтвангер С, Ху С, Хван ТС. Делеция фенилаланина 508 вызывает ослабленную зависимую от фосфорилирования активацию хлоридных каналов CFTR. J. Physiol 2000; 524: 637–648.
- ↵
Иллек Б., Янкаскас-младший, Мачен Т.Э. цАМФ и генистеин стимулируют проводимость HCO 3 — через CFTR в эпителии дыхательных путей человека. Am J Physiol 1997; 272: L752 – L761.
- ↵
Hwang TC, Wang F, Yang IC, Reenstra WW. Генистеин усиливает активность каналов дикого типа и ΔF508-CFTR. Am J Physiol 1997; 273: C988 – C998.
- ↵
Лансделл К.А., Кай З., Кидд Дж.Ф., Шеппард Д.Н.Два механизма генистеина ингибирования трансмембранного регулятора проводимости при муковисцидозе Cl — каналов, экспрессируемых в линии мышиных клеток. J. Physiol 2000; 524: 317–330.
- ↵
Пауэлл К., Цейтлин ПЛ. Терапевтические подходы к исправлению дефектов сворачивания ΔF508 CFTR и нацеливания на клетки. Adv Drug Deliv Rev 2002; 54: 1395–1408.
- ↵
Klein SL, Wisniewski AB, Marson AL, Glass GE, Gearhart JP.Раннее воздействие генистеина оказывает долгосрочное воздействие на эндокринную и иммунную системы крыс. Мол Мед 2002; 8: 742–749.
Влияние втирания на проникновение через кожу in vitro геля диклофенак-диэтиламин 1,16% | Примечания к исследованиям BMC
Продукт
Voltaren Emulgel (Novartis Consumer Health, Ньон, Швейцария), содержащий 1,16% диклофенак-диэтиламина.
Нанесение продукта
Однократная доза 5 мг / см 2 была нанесена на иссеченную кожу человека, установленную в диффузионных ячейках типа Франца, в неокклюзионных условиях.Втирание осуществляли в течение 45 с с использованием закругленного конца поршня шприца, в то время как стандартное нанесение (рассматриваемое как «без втирания» в этих экспериментальных условиях) продукта на кожу длилось 5 с.
Донор кожи
Этический комитет Международного института развития медицины (IIAM; США) одобрил использование человеческих тканей в этом исследовании. Кожа живота человека полной толщины от 6 доноров, взятая при вскрытии, была криоконсервирована IIAM.Кожу поддерживали замороженной при -80 ° C. Перед использованием кожу разморозили и осторожно удалили подкожную клетчатку. Кожу подвергали дерматомизации до 600 мкм с помощью дерматома Вагнера (модель GB-231 Aesculap, Германия) для получения ткани с разделенной толщиной, состоящей из рогового слоя (10–20 мкм), эпидермиса (100 мкм) и части дермы (1200 мкм). мкм) [9, 10].
Тест целостности кожи
Проникновение меченной тритием воды оценивали для определения целостности кожи, как описано Bronaugh et al.[11]. Вкратце, на поверхность кожи наносили меченную тритием воду (2,7 мкКи / мл). Через 30 мин воду с радиоактивной меткой удаляли с кожи ватными кончиками. Количество меченной тритием воды (%), которая проникала через кожу, измеряли в фазе рецептора (2 мл) с использованием жидкостного сцинтилляционного счетчика. Через кожу проникает менее 1% примененной дозы тритированной воды. Кожа с проницаемостью для меченной тритием воды выше 1% была исключена из эксперимента. Экспериментальная процедура проводилась с образцами кожи, имеющими аналогичные значения проницаемости меченной тритием воды.
Кожная проницаемость
Кожная проницаемость измерялась с использованием статической диффузионной ячейки Франца 1,75 см 2 для каждого образца кожи, подвергавшегося воздействию 5 мг / см 2 продукта в соответствии с рекомендациями по тестированию OECD 428 [12].
Оттаявшие образцы кожи человека с дерматомом (600 мкм) помещали горизонтально на клетки Франца дермой вниз. Ячейки для диффузии Франца были подключены к циркулирующей водяной бане при 37 ° C, что давало температуру ткани 32 ° C, что сравнимо с физиологической температурой поверхности кожи.Площадь диффузии составляла 1,75 см 2 , а фаза рецептора PBS pH 7,4 (фосфатно-солевой буфер; 7,58 г / л Na 2 HPO 4 , 1,62 г / л NaH 2 PO 4 и 4,4 г / Л NaCl), содержащийся в каждой диффузионной ячейке (приблизительно 8 мл), смешивали с использованием устройства для магнитной мешалки для обеспечения соответствующей гомогенизации высвобожденного лекарственного средства в акцепторной фазе на протяжении всего эксперимента. Образцы рецепторной фазы были собраны и проанализированы для определения концентрации диклофенака на исходном уровне, через 2 часа, 4 часа, 8 часов и 24 часа (Таблица 1).
Таблица 1 Сравнение потока лекарственного средства из геляРаспределение по коже
Распределение по коже определяли путем измерения количества лекарственного средства, находящегося в различных слоях кожи. Через час (1 час) после нанесения 5 мг / см 2 образцы кожи смывали мыльной водой и ватными наконечниками. Верхний слой рогового слоя удаляли липкой лентой (3 M Scotch n ° 550) и анализировали отдельно. Дополнительные слои рогового слоя были удалены до 12 последовательных полос липкой ленты.
После сбора всех полосок первую и вторую полоски поместили в отдельные флаконы, содержащие 10 мл воды. Полоски с 3 по 7 объединяли в одном флаконе, содержащем 20 мл воды. Оставшуюся очищенную кожу измельчали и помещали во флакон, содержащий 15 мл PBS, pH 7,4. Смеси перемешивали в течение ночи, чтобы гарантировать адекватное извлечение лекарственного средства из ленты и кожи.
Анализ образцов
Содержание диклофенака в различных образцах измеряли с помощью сверхвысокопроизводительной жидкостной хроматографии (Waters Acquity) на приборе Waters Aquity UPLC®BEH C18 1.Фазовая колонка 7 мкм (2,1 × 50 мм) при 35 ° C с использованием скорости потока 0,5 мл / мин подвижной фазы смеси очищенной воды с 1% уксусной кислотой и ацетонитрилом 4,2: 5,8 (об: об) с УФ обнаружение при 275 нм. Образец вводили напрямую в объеме 10 мкл. Время удерживания диклофенака составляло 3,2 мин. Площадь под пиком использовали для расчета концентрации диклофенака с использованием внешних стандартов, которые показали линейность в диапазоне концентраций от 0,03 до 1 мкг / мл.
Измерение сопротивления тканей
Диски иссеченной расщепленной кожи живота человека толщиной 600 мкм помещали на вставку Transwell без мембраны.Площадь диффузии составляла 1,1 см 2 , и фаза приемника состояла из PBS pH 7,4 при 32 ° C (1,5 мл) с донорной фазой 0,5 мл PBS pH 7,4 при 32 ° C. Сопротивление кожи измеряли перед трением. После предварительной обработки добавляли 0,5 мл донорной фазы, предварительно нагретой до 32 ° C. Через 5 мин — 2 ч сопротивление ткани определяли с помощью EVOMX (World Precision Instruments, Сарасота, Флорида). Отношение сопротивления до и после трения вычисляли и сравнивали с той же самой не натертой кожей.
Статистический анализ
Непарный тест Стьюдента t был проведен для определения значения P между приложениями с трением или без него. Значение P менее 0,05 считалось статистически значимым.
Ученые изучают роль микробов, «летучего дисбиоза» в болезни Крона и связанных с ней состояниях — ScienceDaily
Пациенты с воспалительным заболеванием кишечника с большей вероятностью увидят резкие изменения в составе сообщества микробов в кишечнике, чем здоровые люди , согласно результатам исследования, опубликованного в Интернете, февраль.13 в Nature Microbiology .
Хотя ученым известно, что существуют различия в бактериях и других микробах, составляющих микробиом кишечника у пациентов с ВЗК, это одно из крупнейших исследований по наблюдению за микробиомом в течение определенного периода времени. Результаты показывают, что самая большая разница в микробиоме пациентов — это то, как он колеблется — то, что исследователи называют «летучим дисбиозом».
Результаты помогают врачам и ученым более полно понять болезнь и потенциально предлагают новые способы отслеживания болезни и наблюдения за пациентами.
Результаты получены группой ученых из Швеции, Испании, Германии и США. Автор статьи — Джанет Янссон из Тихоокеанской северо-западной национальной лаборатории Министерства энергетики США.
«Мы знаем, что есть некоторые ключевые полезные микробы, которых меньше у людей с воспалительными заболеваниями кишечника. Иногда различия весьма существенны», — сказал Янссон. «Наши последние результаты показывают, что пациенты, страдающие этим заболеванием, также имеют гораздо менее стабильный микробиом кишечника, чем здоровые люди.«
Колебательный микробиом, колеблющиеся симптомы
ВЗК включает группу заболеваний, при которых иммунная система организма атакует микробы в кишечнике, вызывая хроническое воспаление пищеварительного тракта и вызывая такие симптомы, как диарея, боль в животе и другие неприятные, а иногда и опасные для жизни симптомы. У многих пациентов бывают периоды, когда состояние вызывает незначительные проблемы, затем обостряется и становится более серьезным. Лекарства, такие как сильнодействующие противовоспалительные препараты и стероиды, являются обычным лечением, а в тяжелых случаях возможно хирургическое лечение.
Ученые знают, что есть некоторые различия в микробиомах пациентов с ВЗК по сравнению со здоровыми людьми — например, у пациентов, как правило, меньше полезных микробов, и они с большей вероятностью являются переносчиками таких бактерий, как Enterobacteriaceae и E. coli . Но остаются вопросы.
«Важно знать не только, какие микробы присутствуют, но и понимать, как меняется микробное сообщество по мере того, как симптомы пациентов улучшаются или ухудшаются с течением времени», — сказал автор Колин Брислон, ученый PNNL, внесший свой вклад в статистический анализ.«Мы исследовали динамическую природу болезни, поскольку она связана с динамической природой микробиома кишечника человека».
Для проведения исследования гастроэнтеролог Йонас Халфварсон из Университета Эребру в Швеции и его коллеги изучили 137 человек в течение двух лет. В число участников входили пациенты с язвенным колитом, болезнью Крона толстой кишки, болезнью Крона подвздошной кишки и здоровые люди из контрольной группы. Врачи собирали образцы кала у пациентов каждые три месяца в течение до двух лет и контролировали симптомы пациентов.Всего было собрано 683 пробы фекалий. Затем ученые использовали технологию генетического секвенирования, чтобы идентифицировать микробы в образцах.
Команда обнаружила, что у здоровых людей микробное сообщество кишечника гораздо более стабильно с течением времени, чем у пациентов с ВЗК. У пациентов с ВЗК наблюдаются резкие изменения в микробиоме: некоторые бактерии иногда почти полностью исчезают — что редко случалось у здоровых людей, изучаемых исследователями. У некоторых пациентов с ВЗК более половины их микробиома было замещено другими микробами всего за несколько месяцев.Наибольшие колебания наблюдались у пациентов с болезнью Крона подвздошной кишки, у которых была удалена часть кишечника для облегчения симптомов.
Ученые также отметили, что изменения в лекарствах для лечения болезни повлияли на микробиом; например, пациенты, которые принимали стероиды в рамках лечения, имели больше колебаний в микробиоме, чем пациенты, которые этого не делали. А пациенты, у которых обострились симптомы, с большей вероятностью столкнулись с резкими колебаниями микробиома.
Ученые говорят, что открытия могут однажды помочь в диагностике пациентов или позволить врачам следить за течением болезни и более внимательно отслеживать эффективность лекарств у пациентов.
«Результаты являются важным шагом в нашей цели понять, как микробиом соотносится с динамикой воспалительного заболевания кишечника», — сказал Халфварсон. «В конечном итоге, манипуляции с микробиомом с целью имитировать ситуацию и траектории здоровых людей могут стать привлекательной стратегией лечения для поддержания пациентов с ВЗК в ремиссии, особенно если можно избежать иммунодепрессантов, таких как кортикостероиды.

 Так вы сможете выявить патологии и аномалии полости рта в зачатке и простыми процедурами предотвратить их преобразование во флюс.
Так вы сможете выявить патологии и аномалии полости рта в зачатке и простыми процедурами предотвратить их преобразование во флюс. Врач выполняет депульпирование или распломбировку ранее запломбированных каналов, проводит их очистку от некротического содержимого. Назначает противовоспалительную терапию;
Врач выполняет депульпирование или распломбировку ранее запломбированных каналов, проводит их очистку от некротического содержимого. Назначает противовоспалительную терапию; Этот способ лечения хронического периодонтита применяют при наличии на верхушке корня зуба кисты или гранулемы.
Этот способ лечения хронического периодонтита применяют при наличии на верхушке корня зуба кисты или гранулемы. п.
п.
 Особенно активно электрофорез применятся для лечения лимфаденита, возникшего как осложнение острого периостита.
Особенно активно электрофорез применятся для лечения лимфаденита, возникшего как осложнение острого периостита.
 Постепенно развиваются пульпит и периодонтит.
Постепенно развиваются пульпит и периодонтит. Если пломбирование каналов уже было выполнено ранее, их нужно распломбировать и лечить заново. Так как очень важно, чтобы гной из флюса вышел полностью, при лечении осложненного пульпита и периодонтита не ставят временную пломбу.
Если пломбирование каналов уже было выполнено ранее, их нужно распломбировать и лечить заново. Так как очень важно, чтобы гной из флюса вышел полностью, при лечении осложненного пульпита и периодонтита не ставят временную пломбу.


 Женщинам в положении и кормящим матерям его лучше не использовать для лечения.
Женщинам в положении и кормящим матерям его лучше не использовать для лечения.