Использование местных ранозаживляющих средств в терапии эрозивных поражений слизистой оболочки полости рта при вульгарной пузырчатке Текст научной статьи по специальности «Клиническая медицина»
УДК 616.735.8.002.61:34
ИСПОЛЬЗОВАНИЕ МЕСТНЫХ РАНОЗАЖИВЛЯЮЩИХ СРЕДСТВ В ТЕРАПИИ ЭРОЗИВНЫХ ПОРАЖЕНИЙ СЛИЗИСТОЙ ОБОЛОЧКИ ПОЛОСТИ РТА
ПРИ ВУЛЬГАРНОЙ ПУЗЫРЧАТКЕ
Е. М. Максимова1, Аль Асфари Ферас Мохаммед Сами1, А. В. Михальченко2
1 Ставропольский государственный медицинский университет, Ставрополь, 2Волгоградский государственный медицинский университет, Волгоград
Проведены исследования пациентов, имеющие различные формы проявления пузырчатки на губах и слизистой оболочки полости рта. Исследования проводились в 3 группах заболевших, с применением различных схем лечения данного заболевания. Результаты исследования доказали, что разработанные мази в сочетании с «Исмигеном» являются наиболее эффективными.
Ключевые слова: пузырчатка, эрозия, эпителизация, кожа, акантолиз, слизистая оболочка полости рта, синдром Сенира-Ашера, клетки Тцанка.
DOI 10.19163/1994-9480-2017-3(63)-71-74
LOCAL WOUND HEALING AGENTS IN THE TREATMENT OF ORAL EROSIVE LESIONS IN PATIENTS WITH PEMPHIGUS VULGARIS
E. M. Maksimova1, Al Asfari Feras Mohammed Sami1, A. V. Mikhalchenko2
1Stavropol State Medical University, Stavropol, 2Volgograd State Medical University, Volgograd
The article presents the results of a comparative assessment of different treatment options for labial and oral pemphigus vulgaris.
Key words: pemphigus, erosion, epithelialization, skin, acantholysis, oral mucosa, Senear-Usher syndrome, tzanck cells.
Пузырчатка относится к группе тяжелых аутоиммунных дерматологических заболеваний и характеризуется появлением пузырей на кожных покровах и слизистых оболочках в сочетании с появлением в крови циркулирующих иммуноглобулинов против кератиноцитов [1, 17]. Болезни подвержены лица среднего и старшего возраста. Женщины болеют чаще, чем мужчины. Провоцирующими факторами являются наследственная предрасположенность, вирусная инфекция, условия вредного производства, химические реагенты, пестициды, некоторые металлы, определенные пищевые продукты [2, 4].
Основной особенностью пузырчатки при гистологическом исследовании является наличие акантолиза -нарушение нормальной связи между клетками шиповатого слоя эпителия, создающей основу для последующего образования пузырей, расположенных внут-риэпителиально. Характерными признаками заболевания служит симптом отслоения эпителия (симптом Никольского) и клетки Тцанка в цитологическом мазке содержимого пузыря [5, 10].
В полости рта процесс течет иначе, чем на коже, что объясняется анатомическими особенностями эпителия полости рта [3, 12].
Вульгарная пузырчатка в полости рта протекает по-разному. В одном случае вначале на месте поражения эпителий мутнеет, в центре очага возникает эрозия, быстро распространяющаяся по периферии [6, 13]. Если по такому помутневшему эпителию провести там-
поном, то верхний слой его легко снимается, обнажая эрозивную поверхность.
В других случаях поражение слизистой оболочки в виде появления пузырей различной локализации обусловлено нередко изоморфной реакцией в результате раздражения в полости рта микротравмами. Пузыри размером от 1-2 до 30-40 мм (от чечевичных зерен до голубиного яйца) имеют вначале прозрачное содержимое, в последующем могут принимать желтоватый и мутноватый оттенок [1, 15]. Покрышка пузырей вначале напряжена, затем становится дряблой, вскрытие пузыря происходит в результате разрыва покрышки или рассасывания экссудата (на кожных покровах при ссы-хании пузырей образуются корки, на слизистой оболочке — плотные налеты). В полости рта элементы поражения располагаются по всей слизистой оболочке, особенно в легко травмируемых складках (рис.).
Лечение больных начинают с «ударных» доз глю-кокортикоидов — 120-180 мг, а иногда с 200-240 мг пред-низолона (дексаметазона, триамциналона в эквивалентных дозах) в сутки. При улучшении состояния больного, прекращении появления свежих пузырей, эпителиза-ции эрозий начинают постепенное снижение суточной дозы. При достижении клинической ремиссии дозу снижают до поддерживающей. В процессе снижения доз кортикостероидов целесообразно назначать противомалярийные препараты, препараты калия, цитос-татики и поливитамины.
Рис. Эрозии и язвы слизистой оболочки щек (а), десен (б) и языка (в) при вульгарной пузырчатке
Использование устаревших схем лечения пемфигуса полосканиями полости рта растворами антисептиков, использования обезболивающих средств, обработка эрозий масляными растворами не давало желаемого лечебного эффекта, за счет смывания слюной этих препаратов [3, 4, 6, 9]. Это привело к необходимости применения средств, имеющих более эффективные свойства.
ЦЕЛЬ РАБОТЫ
Использование новых методов местной терапии поражений слизистой оболочки полости рта при вульгарной пузырчатке с применением адгезивной поликомпонентной мази в сочетании с «Исмигеном».
МЕТОДИКА ИССЛЕДОВАНИЯ
Исследования проводились в трех группах. Основными жалобами пациентов были появление пузырей и эрозий на слизистой оболочке полости рта и губ, вызывающих боль.
Группы формировались в зависимости от проводимого лечения. Обследования проходили 24 мужчины и 35 женщин — всего 59 пациентов в возрасте от 34 до 70 лет. Пациенты были разделены на 3 группы, в зависимости от проводимого местного лечения. Всем обследуемым трех группы был назначен преднизолон от 80-120 мг в сутки. 19 пациентам первой группы были назначены частые полоскания рта растворами 0,05%-го перманганата калия, 2%-го соды, 0,5%-го новокаина, настоем чая. Эрозии смазывали 1%-м раствором метиленового синего, фукорцином, фукасептолом, облепиховым маслом. Во второй группе, где обследования проводились 19 пациентам, лечение проводили с использованием запатентованной мази (положительное решение о выдаче патента РФ на изобретение по заявке № 2011145561 (068218) от 01.11.2011). Состав мази: гель «Лидоксор», «Солкосерил дентальная адгезивная паста», Полисорб-МП, облепиховое масло. 21 пациенту третьей группы проведено лечение запате-нованной мазью в сочетании с «Исмигеном».
«Исмиген» — иммуностимулирующий препарат, представляет собой антигенный комплекс, включаю-
щий лизаты бактерий наиболее часто встречающихся возбудителей заболеваний полости рта и глотки. Активирует процессы перекисного окисления и экспрессию молекул адгезии на макрофагально-моноцитарных клетках и гранулоцитах, что обеспечивает кооперацию с Т-лимфоцитами и антигенпрезентирующими клетками и способствует уничтожению инфекционных агентов. Стимулирует высвобождение противовоспалительных цитокинов — ИЛ-1, ИЛ-2, ИЛ-6, ИЛ-8, гамма интерферона, угнетает синтез ИЛ-4, ИЛ-12; повышает концентрацию секреторного 1дА, 1дМ; уменьшает концентрацию сывороточного 1дЕ. mpfe ©©СаГГГМЩ
mpfe ©©СаГГГМЩ
эрозий, на 21-е сутки — 43,7 %, на фоне заживления старых эрозий у 8 пациентов первой группы (29,4 %) появлялись новые. На 28-е сутки отмечалось эпители-зация 57,3 % образований, у 4 пациентов (15,8 %) появились единичные пузыри (табл.). Было отмечено, что у 3 пациентов (12,7 %) полное заживление эрозий наступило к концу второго месяца после начала лечения, а у 20 пациентов первой группы (88,2 %) полная эпите-лизация эрозий слизистой оболочки полости рта наступила в течение от 2 до 3 месяцев.
У пациентов второй группы процессы заживления проходили быстрее, чем в первой, в том числе и за счет хорошего прилипания мази к слизистой оболочке полости рта. Введение в состав мази геля «Ли-доксор» обезболило и произвело облегчение при приеме пищи.
Контроль пациентов второй группы показал, что на 7-е сутки у заболевших наступила эпителизация 39,7 % эрозий, на 14-е отмечено заживление 53,3 % образований и на 21-е сутки — 63,8 % эрозий. У 2 пациентов (7,9 %) на фоне старых эрозий появились новые очаги. На 28-е сутки наблюдалось заживление 73,2 % эрозий. У 6 заболевших (26 %) второй группы полное заживление эрозий слизистой оболочки отмечено к концу второго месяца лечения. В третьей группе на 7-е сутки у всех пациентов наблюдалась эпителизация 43,7 % образований, на 14-е сутки — 73,8 % эрозий, на 21 -е сутки -89,8 %, у 1 пациента (4,6 %) появились новые образования. На 28-е сутки у 96,6 % пациентов отмечено полное заживление эрозий слизистой оболочки полости рта. При проведении лечения пациентов используемыми методами осложнений не выявлено.
Контроль заживления эрозий в группах наблюдения
Группы наблюдения Сроки
7-е сутки 14-е сутки 21-е сутки 28-е сутки
1-я группа 14,60 ± 2,01 39,70 ± 2,25 pi < 0,05 44,6 ± 0,9 Р2 < 0,05 55,70 ± 1,94 рз > 0,05
2-я группа 21,80 ± 2,34 55,30 ± 1,26 pi < 0,05 63,80 ± 2,05 Р2 < 0,05 73,20 ± 3,04 рз < 0,05
3-я группа 43,70 ± 1,64 73,80 ± 2,86 pi > 0,05 89,80 ± 2,35 Р2 < 0,05 96,60 ± 1,38 рз > 0,05
Примечание. р1 — возможная допустимость ошибки при сравнении с показателями на 7-е сутки; р2 — возможная допустимость ошибки при сравнении с показателями на 14-е сутки; р3 — возможная допустимость ошибки при сравнении с показателями на 21-е сутки.
р1 — возможная допустимость ошибки при сравнении с показателями на 7-е сутки; р2 — возможная допустимость ошибки при сравнении с показателями на 14-е сутки; р3 — возможная допустимость ошибки при сравнении с показателями на 21-е сутки.
ЗАКЛЮЧЕНИЕ
На основании полученных данных, при проведении исследований в лечении пузырчатки в трех группах оказалось, что терапия в первой группе была менее эффективна по сравнению со второй и третьей группами. Использование запатентованной мази (вторая группа), особенно в сочетании с «Исмигеном» (третья группа) позволило ускорить заживление эрозий, предотвратить развитие воспалительных осложнений и сократить период полной эпителизации пораженной слизистой оболочки при пузырчатке.
ЛИТЕРАТУРА
1. Сирак С.В., Копылова И.А., Чеботарев В.В., Аль-асфари Ф.М.С. Использование поликомпонентной адгезивной мази в сочетании с иммуномодулирующим препаратом в комплексной терапии пузырчатки // Пародонтология. — 2012. -Т. 17, № 2. — С. 62-65.
2. Сирак С.В., Чеботарев В.В., Сирак А.Г., Гоигорьян А.А. Опыт использования местных ранозаживляющих средств при лечении вульгарной пузырчатки с локализацией на слизистой оболочке полости рта и губах // Медицинский вестник Северного Кавказа. — 2013. — Т. 8, № 1. -С. 59-62.
3. Сирак С.В., Шаповалова И.А., Локтионова М.В., Лолае-ва А.К. Изучение эффективности ранозаживляющего средства для лечения заболеваний слизистой оболочки полости рта у детей и подростков // Стоматология детского возраста и профилактика. — 2008. — Т. 7, № 2. — С. 79-81.
4. Сирак С.В., Чеботарев В.В., Караков К.Г., Копылова И.А., Аль Асфари Ферас М.С., Григорьян А.А. Поликомпонентная
адгезивная мазь для лечения эрозивных поражений слизистой оболочки полости рта при обыкновенной пузырчатке // Патент на изобретение RUS 2486901 23. 03.2012
03.2012
5. Щетинин Е.В., Сирак С.В., Батурин В.А., Сирак А.Г., Иг-натиади О.Н., Вафиади М.Ю., Петросян Г.Г., Паразян Л.А., Дыгов Э.А., Арутюнов А.В., Цховребов А.Ч. Результаты мониторинга потребления противомикробных препаратов в амбулаторной практике // Медицинский вестник Северного Кавказа. — 2015. — Т. 10, № 1 (37). — С. 80-84.
6. Щетинин Е.В., Сирак С.В., Игнатиади О.Н., Сирак А.Г., Демурова М.К., Дыгов Э.А. Экспериментально-лабораторное обоснование выбора антибактериальных средств для лечения периодонтита // Медицинский вестник Северного Кавказа. — 2014. — Т. 9, № 4 (36). — С. 349-351.
7. Mikhalchenko D.V., Poroshin A.V., Mikhalchenko V.F., Firsova I.V., Sirak S.V. Influence of transcranial electrostimulation on the osseointegration of dental implant in the experiment // Research Journal of Pharmaceutical, Biological and Chemical Sciences. -2014. — Т.5, № 5. — С. 705-711.
8. Grimm WD,, Arnold W.A., Sirak S.W., Vukovich M.A., Videra D., Giesenhagen B. Clinical, radiographic, and histological analyses after transplantation of crest-related palatal-derived ectomesenchymal stem cells (paldscs) for improving vertical alveolar bone augmentation in critical size alveolar defects // Journal of Clinical Periodontology. — 2015. — 42 (S17): 366b-366.
9. Sirak S.V., Avanesyan R.A., Akkalaev A.B., Demurova M.K., Dyagtyar E.A., Sirak A.G. Microbiocenosis of oral cavity in patients with dental implants and over-dentures // Research Journal of Pharmaceutical, Biological and Chemical Sciences. — 2014. — Т. 5, № 5. — С. 698-704.
10. Sirak S.V., Sletov A.A., Shchetinin E.V., Mikhalchenko D.V. Teatment and rehabilitation of patients with subtotal mandible defects // Research Journal of Pharmaceutical, Biological and Chemical Sciences.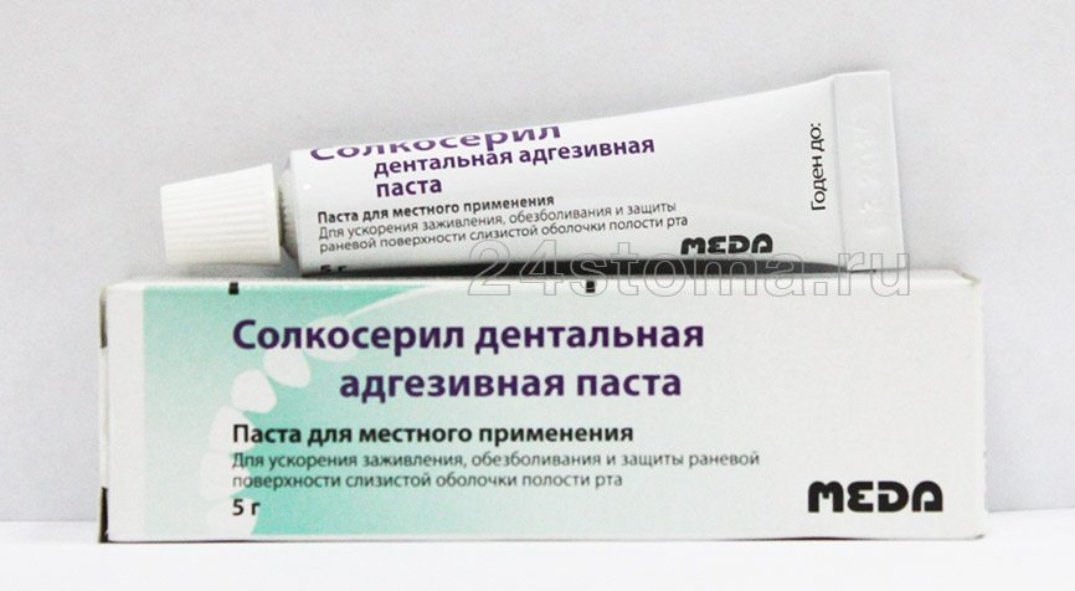
11. Sirak S.V., Arutyunov A.V, Shchetinin E.V., Sirak A.G., Akkalaev A.B., Mikhalchenko D.V. Clinical and morphological substantiation of treatment of odontogenic cysts of the maxilla // Research Journal of Pharmaceutical, Biological and Chemical Sciences. — 2014. — Т. 5, № 5. — C. 682-690.
12. Sirak S.V., Shchetinin E.V. Prevention of complications in patients suffering from pathological mandibular fractures due to bisphosphonate-associated osteonecroses // Research Journal of Pharmaceutical, Biological and Chemical Sciences. — 2015. -Т. 6, № 5. — C. 1678-1684.
13. Sirak S.W., Entschladen F., Shchetinin E.W., Grimm WD. Low-level laser irradiation (810 nm) with toluidinblue photosensitizer promotes proliferation and differentiation of human oral fibroblasts evaluated in vitro // Journal of Clinical Periodontology. 2015. — Т. 42, № S17. — C. 328a-328.
14. Shchetinin E.V., Sirak S.V., Khodzhayan A.B., Dilekova O.V., SirakA.G., VafiadiM.Yu., Parazyan L.A., ArutyunovA.V. Pathogenetic aspects of dental pulp pathology // Медицинский вестник Северного Кавказа. — 2015. — Т. 10, № 2 (38). — С. 187-191.
15. Firsova I.V., Makedonova Iu.A., Mikhalchenko D.V., Poroiskii S.V., Sirak S.V. Clinical and experimental study of the regenerative features of oral mucosa under autohemotherapy // Research Journal of Pharmaceutical, Biological and Chemical Sciences. -2015. — Т. 6, № 6. — C. 1711-1716.
REFERENCES
1. Sirak S.V., Kopylova I.A., Chebotarev V.V., Al’-asfari F.M.S. Ispol’zovanie polikomponentnoj adgezivnoj mazi v sochetanii s immunomodulirujushhim preparatom v kompleksnoj terapii puzyrchatki [The use of a polycomponent adhesive ointment in combination with an immunomodulating drug in the complex therapy of pemphigus] Parodontologija. 2012, T. 17, no2, S. 6265 (In Russ.)
2012, T. 17, no2, S. 6265 (In Russ.)
2. Sirak S.V., Chebotarev V.V., Sirak A.G., Grigor’jan A.A. Opyt ispol’zovanija mestnyh ranozazhivljajushhih sredstv pri lechenii vul’garnoj puzyrchatki s lokalizaciej na slizistoj obolochke polosti rta i gubah [Experience in the use of local wound healing agents in the treatment of vulgar pemphigus with localization on the mucosa of the oral cavity and lips] Medicinskij vestnik Severnogo Kavkaza. 2013, T. 8, no1, S. 59-62 (In Russ.)
3. Sirak S.V., Shapovalova I.A., Loktionova M.V., Lolaeva A.K. Izuche-nie jeffektivnosti ranozazhivljajushhego sredstva dlja lechenija zabolevanij slizistoj obolochki polosti rta u detej i podrostkov [A study of the effectiveness of wound healing remedy for the treatment of diseases of the oral mucosa in children and adolescents] Stomatologija detskogo vozrasta i profilaktika. 2008, T. 7, no2, S. 79-81 (In Russ.)
4. Sirak S.V., Chebotarev V.V., Karakov K.G., Kopylova I.A., Al’ Asfa-ri Feras M.S., Grigor’jan A.A. Polikomponentnaja adgezivnaja maz’ dlja lechenija jerozivnyh porazhenij slizistoj obolochki polosti rta pri obyknovennoj puzyrchatke [ ] Patent na izobretenie RUS 2486901 23.03.2012
5. Shhetinin E.V., Sirak S.V., Baturin V.A., Sirak A.G., Ignatiadi O.N., Vafiadi M.Ju., Petrosjan G.G., Parazjan L.A., Dygov Je.A.,
Arutju-nov A.V., Chovrebov A.Ch. Rezul’taty monitoringa potreblenija protivomikrobnyh preparatov v ambulatornoj praktike [The results of monitoring the consumption of antimicrobials in outpatient practice] Medicinskij vestnik Severnogo Kavkaza. 2015, T. 10, no1 (37), S. 80-84 (In Russ.)
6. Shhetinin E.V., Sirak S.V., Ignatiadi O.N., Sirak A.G., Demurova M.K., Dygov Je. A. Jeksperimental’no-laboratornoe obosnovanie vybora antibakterial’nyh sredstv dlja lechenija periodontita [Experimental-laboratory substantiation of the choice of antibacterial agents for the treatment of periodontitis] Medicinskij vestnik Severnogo Kavkaza. 2014, T. 9, no4 (36), S. 349-351 (In Russ.)
A. Jeksperimental’no-laboratornoe obosnovanie vybora antibakterial’nyh sredstv dlja lechenija periodontita [Experimental-laboratory substantiation of the choice of antibacterial agents for the treatment of periodontitis] Medicinskij vestnik Severnogo Kavkaza. 2014, T. 9, no4 (36), S. 349-351 (In Russ.)
7. Mikhalchenko D.V., Poroshin A.V., Mikhalchenko V.F., Firsova I.V., Sirak S.V. Influence of transcranial electrostimulation on the osseointegration of dental implant in the experiment. Research Journal of Pharmaceutical, Biological and Chemical Sciences. 2014. T.5, no5. S. 705-711.
8. Grimm W.D., Arnold W.A., Sirak S.W., Vukovich M.A., Videra D., Giesenhagen B. Slinical, radiographic, and histological analyses after transplantation of crest-related palatal-derived ectomesenchymal stem cells (paldscs) for improving vertical alveolar bone augmentation in critical size alveolar defects. Journal of Clinical Periodontology. 2015. 42 (S17): 366b-366.
9. Sirak S.V., Avanesyan R.A., Akkalaev A.B., Demurova M.K., Dyagtyar E.A., Sirak A.G. Microbiocenosis of oral cavity in patients with dental im-plants and over-dentures. Research Journal of Pharmaceutical, Biological and Chemical Sciences. 2014. T. 5, no5. S. 698-704.
10. Sirak S.V., Sletov A.A., Shchetinin E.V., Mikhalchenko D.V. Teatment and rehabilitation of patients with subtotal mandible defects. Research Journal of Pharmaceutical, Biological and Chemical Sciences. 2015. T. 6, no6. S. 1803-1810.
11. Sirak S.V., Arutyunov A.V., Shchetinin E.V., Sirak A.G., Akkalaev A.B., Mikhalchenko D.V. Slinical and morphological substantiation of treatment of odontogenic cysts of the maxilla. Research Journal of Pharmaceutical, Biological and Chemical Sciences. 2014. T. 5, no5. S. 682-690.
S. 682-690.
12. Sirak S.V., Shchetinin E.V. Rrevention of complications in patients suffering from pathological mandibular fractures due to bisphosphonate-associated osteonecroses. Research Journal of Pharmaceutical, Biological and Chemical Sciences. 2015. T. 6, no5. S. 1678-1684.
13. Sirak S.W., Entschladen F., Shchetinin E.W., Grimm W.D. Low-level la-ser irradiation (810 nm) with toluidinblue photosensitizer promotes proliferation and differentiation of human oral fibroblasts evaluated in vitro. Journal of Clinical Periodontology. 2015. T. 42, noS17. S. 328a-328.
14. Shchetinin E.V., Sirak S.V., Khodzhayan A.B., Dilekova O.V., Sirak A.G., Vafiadi M.Yu., Parazyan L.A., Arutyunov A.V. Rathogenetic aspects of dental pulp pathology. Medicinskij vestnik Severnogo Kavkaza. 2015. T. 10, no2 (38). S. 187-191.
15. Firsova I.V., Makedonova Iu.A., Mikhalchenko D.V., Poroiskii S.V., Sirak S.V. Slinical and experimental study of the regenerative features of oral mucosa under autohemotherapy. Research Journal of Pharmaceutical, Biological and Chemical Sciences. 2015. T. 6, no6. S. 1711-1716.
Контактная информация
Михальченко Алексей Валерьевич — к. м. н., ассистент кафедры терапевтической стоматологии, Волгоградский государственный медицинский университет, e-mail: [email protected]
Лечение травм и воспалений слизистой оболочки полости рта на ортопедическом приеме Текст научной статьи по специальности «Ветеринарные науки»
обмен опытом
Kovetskaya E.E., Nazarov I.E.
Treatment of injuries and inflammations of mucous membrane of oral cavity on orthopedic reception
ЛЕЧЕНИЕ ТРАВМ И ВОСПАЛЕНИЙ СЛИЗИСТОЙ ОБОЛОЧКИ ПОЛОСТИ РТА НА ОРТОПЕДИЧЕСКОМ ПРИЕМЕ
Ковецкая Е. Е., канд. мед. наук, ассистент кафедры терапевтической стоматологии БелМАПО Назаров И.Е., заведующий ортопедическим отделением 8-й городской клинической стоматологической поликлиники, г. Минск
Е., канд. мед. наук, ассистент кафедры терапевтической стоматологии БелМАПО Назаров И.Е., заведующий ортопедическим отделением 8-й городской клинической стоматологической поликлиники, г. Минск
Любые стоматологические вмешательства в полости рта могут вызвать повреждение слизистой оболочки. Травмы в полости рта могут быть обусловлены беспокойным поведением пациентов в стоматологическом кресле, особенностями строения или ограниченным открыванием рта (например, у полных людей). Некоторые пациенты склонны к агравации (преувеличению), поэтому их пугает даже незначительная кровоточивость и болезненность слизистой оболочки полости рта. В некоторых случаях, например у гипертоников, даже незначительная травма вызывает обильное кровотечение. Провоцирует инфицирование слизистой оболочки полости рта плохая гигиена полости рта.
В практике ортопедической стоматологии при обширном препарировании зубов под искусственные коронки, снятии слепков зубных рядов возможно повреждение и кровоточивость десен, слизистой оболочки щек, нёба, что сопровождается отеком, гиперемией и выраженным болевым синдромом. Слизистая оболочка полости рта может быть травмирована на этапе адаптации пациента к съемным протезам. Болезненность в полости рта приводит к нарушению функции жевания, глотания и отказу пациентов от пользования протезами.
Для лечения повреждений слизистой оболочки полости рта чаще всего применяют полоскание растворами антисептиков (например, 0,05% раствор хлоргексидина биглюконата), отварами и настойками трав (шалфей, зверобой, ромашка), растительными препаратами (хлорофиллипт, сок алое, каланхое), препаратами пчелиного меда (прополис). Однако полоскания не всегда бывают эффективными, поскольку воздействуют на слизистую кратковременно, только в момент нанесения, затем они растворяются в слюне, их концентрация и лечебный эффект снижаются. Следовательно,
Следовательно,
актуальны лекарственные средства, которые препятствовали бы инфицированию поврежденной слизистой оболочки полости рта, надежно защищали её, а также обладали обезболивающим и эпи-телизирующим действием.
Солкосерил дентальная адгезивная паста (СДАП) представляет собой комбинацию двух активных ингредиентов — солкосерила и полидоканола на связывающей основе.
Солкосерил — низкомолекулярный безбелковый гемодиализат, полученый из крови молодых телят. Содержит аминокислоты, оксикислоты, дезоксирибо-зиды и полипептиды. Он способствует утилизации кислорода в митохондриях, снижению содержания жирных кислот в крови и поэтому с успехом применяется при многих заболеваниях для ускорения регенерации тканей. Под воздействием солкосерила уменьшается спазм артерий и артериол, происходит рост коллатеральных сосудов, улучшается трофическая функция тканей. Он усиливает пролиферацию и миграцию фиброблас-тов, а также повышает синтез коллагена. Солкосерил способен ускорять заживление ран на 30% по сравнению с традиционно используемыми препаратами.
Полидоканол — безазотистый неионо-генный поверхностный алифатический анестетик, который не всасывается слизистой оболочкой, но хорошо связывается с ней благодаря комбинации липо-фильных и гидрофильных групп с водой и маслами. При местном применении он обратимо блокирует периферические нервные окончания. Обезболивающий эффект (в 400 раз превышает действие новокаина и в 4 раза — дикаина) наступает уже через 1-3 минуты, а сохраняется в течение 3-5 часов.
Связывающая основа пасты состоит из желатина, пектина и карбоксиметил-целлюлозы, не содержит воды. После адсорбции слюны или раневого секрета
¡нная @т®мшш@гая ni
il
Обмен ©пыт©м
Рис. 1. Высушить рану ватным или марлевым Рис. 2, 3. Выдавить пасту на кончик пальца или шпатель, ватную палочку тампоном
1. Высушить рану ватным или марлевым Рис. 2, 3. Выдавить пасту на кончик пальца или шпатель, ватную палочку тампоном
Рис. 4. Нанести на слизистую, не придавливая
Рис. 7. Результат применения СДАП
она образует пленку, которая защищает рану от ротовой жидкости, микрофлоры и остатков пищи.
Солкосерил дентальная адгезивная паста широко применяется в терапевтической стоматологии. Например, СДАП можно использовать в качестве защитной десневой повязки после проведения профессиональной гигиены полости рта для предотвращения попадания микроорганизмов из слюны в зубодесневые карманы. Её можно применять для лечения травматических поражений слизистой оболочки полости рта, возникающих при лечении кариеса и его осложнений (кариозные полости 11—V классов по Блеку). СДАП хорошо фиксируется на слизистой, поэтому этот препарат можно использовать как десневую повязку при лечении гингивитов и пародонтита. СДАП оказывает выраженное обезболивающее и ранозаживляющее действие, поэтому ее можно использовать для лечения ост-
Рис. 5. Смочить кончик пальца или шпатель в воде
рого герпетического стоматита, красного плоского лишая, пузырчатки и других заболеваний слизистой оболочки полости рта, заболеваний губ (хейлиты, заеды).
Солкосерил дентальная адгезивная паста нашла применение в хирургической стоматологии. В частности, в качестве десневой повязки после удаления зубов и при лечении альвеолита. Солко-серил ускоряет заживление ран после хирургических вмешательств на пародонте, после установки имплантатов и при наращивании кости. СДАП способствуют предотвращению инфицирования при всех хирургических вмешательствах на тканях полости рта. Препарат успешно применяется при лечении затрудненного прорезывания молочных зубов и зуба мудрости.
Препарат успешно применяется при лечении затрудненного прорезывания молочных зубов и зуба мудрости.
Цель настоящего исследования — оценка эффективности использования Сол-косерил дентальной адгезивной пасты при лечении травматических и воспалительных поражений слизистой оболочки полости рта на ортопедическом приеме.
Сотрудниками кафедры терапевтической стоматологии БелМАПО совместно с врачами ортопедического отделения 8-й городской клинической стоматологической поликлиники г. Минска обследовано и пролечено 64 человека в возрасте 18-72 года. Все пациенты жаловались на боль, кровоточивость и дискомфорт в области слизистой оболочки полости рта, которые возникли после ортопеди-
Рис. 6. Придавить пасту разглаживающими движениями к слизистой
ческих вмешательств. На боли в деснах, кровоточивость после подготовки зубов под искусственные коронки жаловались 29 человек, после изготовления слепков — 5 человек. Дискомфорт и боли в деснах при пользовании съемными и несъемными протезами отмечали 30 пациентов.
При обследовании полости рта в 22 случаях выявлена гиперемия и отечность слизистой, в 42 случаях имело место нарушение целостности слизистой (у 13 пациентов наблюдалась небольшая кровоточивость, у 29 раны были покрыты фибриновым налетом).
Пораженная поверхность слизистой была обработана Солкосерил дентальной адгезивной пастой у всех больных. Если пациенты нуждались в коррекции протезов, то сначала адаптировали протезные конструкции в полости рта, а затем лечили слизистую.
Схема применения Солкосерил дентальной адгезивной пасты на слизистой оболочке полости рта состояла из нескольких этапов (рис. 1-7).
Сначала просушивали раневую поверхность ватным тампоном или бумажной салфеткой. Затем выдавливали пасту на шпатель и наносили на раневую поверхность, распределяли тонким слоем, не придавливая. Смачивали шпатель водой и разглаживающими движениями придавливали Солкосерил дентальную адгезивную пасту к раневой поверхности.
Затем выдавливали пасту на шпатель и наносили на раневую поверхность, распределяли тонким слоем, не придавливая. Смачивали шпатель водой и разглаживающими движениями придавливали Солкосерил дентальную адгезивную пасту к раневой поверхности.
©©вре
¡нная ©т®мат®л@™я N1
]1
Обмен ©пыт©м
В случаях, когда проводили коррекцию протезов, пасту наносили как на слизистую, так и на ту область протеза, где проводили адаптацию.
Пациентов обучали приемам нанесения Солкосерил дентальной адгезивной пасты в домашних условиях, рекомендовали проводить лечение 2-3 раз в день в течение 3-7 дней. Каждому больному выдавали листок-памятку с названием препарата и инструкцией по применению.
Как показали результаты исследования, Солкосерил дентальная адгезивная паста хорошо прилипала к слизистой оболочке полости рта, не растворялась в слюне в течение 3-5 часов. Почти все пациенты могли наносить препарат самостоятельно, и лишь некоторые прибегали к посторонней помощи (в силу возрастных сопутствующих заболеваний).
Препарат оказывал выраженное обезболивающее действие в 100% случаев. Благодаря входящему в его состав по-
верхностному анестетику уже через 1-3 минуты боль исчезала и не возвращалась в течение 3-5 часов. Пациенты могли пользоваться протезами, пить и кушать. Паста предохраняла слизистую полости рта от раздражающего действия пищи за счет образования защитной пленки. Использование препарата 2-3 раза позволяло достичь полного обезболивания в течение всего дня.
При применении Солкосерил дентальной адгезивной пасты положительный эффект наблюдался у 92% пациентов в течение 3-5 дней. Кровоточивость, отёк и гиперемия исчезали в первые 1-3 дня, а затем в среднем в течение 3-5 дней происходило заживление раневой поверхности.
Кровоточивость, отёк и гиперемия исчезали в первые 1-3 дня, а затем в среднем в течение 3-5 дней происходило заживление раневой поверхности.
Как показал опрос пациентов, использование СДАП не вызывало побочных эффектов, таких как тошнота, жжение, раздражение слизистой. Многие больные отмечали приятный мятный вкус пасты,
что способствовало соблюдению кратности ее использования в течение дня. Переносимость препарата напрямую зависит от его органолептических свойств. Многие отказались бы от использования лекарственного препарата, неприятного на вкус или горького.
Таким образом, СДАП имеет выраженные обезболивающие и адгезивные свойства, что позволяет быстро купировать болезненность слизистой, травмированной во время ортопедических манипуляций. Пациенты могут полноценно пользоваться протезами. Препарат обладает хорошей переносимостью. Сол-косерил дентальная адгезивная паста способствует быстрому заживлению ран и травм слизистой оболочки полости рта. Данные свойства позволяют рекомендовать СДАП в качестве препарата выбора при лечении травматических поражений СОПР при изготовлении и пользовании ортопедическими конструкциями.
Поступила 10.01.2011
—
Календарь выставок и конференций по стоматологии, 2011 г.*
7-10 сентября. 54-я международная специализированная выставка. Киев, Украина
13-16 сентября. 17-я Международная специализированная выставка медицинского оборудования, медикаментов и стоматологии. Кишинев, Молдова
22-24 сентября. CEDE. 31-я Центрально-Европейская стоматологическая выставка. Лодзь, Познань, Польша
23-24 сентября. Восточногерманская международная выставка оборудования и технологий в области хирургии и стоматологии. Лейпциг, 1ермания
Восточногерманская международная выставка оборудования и технологий в области хирургии и стоматологии. Лейпциг, 1ермания
26-29 сентября. Международная выставка технологий, оборудования и материалов для стоматологии. Москва, Россия
27-30 сентября. 15-я специализированная выставка с международным участием. Одесса, Украина
28-30 сентября. 17-я Азербайджанская международная выставка «Здравоохранение». Баку, Азербайджан 1 октября. Международная выставка и конференция по стоматологии. Венгрия, Будапешт
1-3 октября. IDEM. Международная стоматологическая выставка и конференция. Индия, Бомбей
6-8 октября. Международная стоматологическая выставка. Милан, Италия
8 октября. Ежегодная северогерманская отраслевая выставка-ярмарка оборудования для зубоврачебных кабинетов. 1анновер, Германия
13-15 октября. Международная стоматологическая выставка. Прага, Чехия
14-15 октября. Международная выставка-ярмарка стоматологической отрасли. Штутгарт, 1ермания
25-27 октября. Выставка оборудования, инструментов и материалов для стоматологии. Санкт-Петербург; Россия
27-29 октября. IX Международная стоматологическая выставка. Львов, Украина
Октябрь. Стоматология Беларуси. 7-я Международная специализированная выставка. Минск, Беларусь
16-19 ноября. Международная выставка стоматологических технологий и оборудования. Бухарест, Румыния.
17-19 ноября. Южно-Российский курортно-медицинский форум с секцией «Стоматологические материалы и оборудование. Эстетическая медицина». Пятигорск, Россия
Южно-Российский курортно-медицинский форум с секцией «Стоматологические материалы и оборудование. Эстетическая медицина». Пятигорск, Россия
17-19 ноября. Международная специализированная выставка и стоматологический конгресс. Стокгольм, Гётеборг Швеция 22-26 ноября. Ежегодная конференция Стоматологической ассоциации Франции и международная специализированная выставка. Париж, франция
7-10 декабря. 55-я международная специализированная выставка — итоговая выставка АСУ 2011 г. Киев, Украина
Продолжение. Начало в №2 2010 г. Полная версия на сайте www.mednovosti.by
m (ШРШШШШШ мишт
Фитотерапия в стоматологии.
А вы знали, что у нас с вами во рту находиться рай? Рай для проживания и процветания различных бактерий. А все потому, что во рту невероятно комфортные условия — тепло, влажно и полно еды. Это ли не рай?! И стоит только нам с вами проявить слабину в непрекращающейся гигиенической войне и пару раз пропустить чистку зубов, как тут же появляются симптомы курортного отдыха бактерий — запах, налет, покраснение и кровоточивость десен и прочие неприятности.
Надо сказать, что в этой борьбе у человека есть целый арсенал эффективных средств фармацевтической продукции, которые не перестают пополняться новинками. Антибиотики, антисептики, иммуномодуляторы прекрасно справляются с поставленной задачей: убивают вредные бактерии, снимают воспаление, стимулируют иммунитет. Специалист назначает и подбирает самые эффективные препараты для каждого пациента индивидуально в процессе лечения.
После того как кризис миновал и нам уже нужно просто поддерживать и сохранять здоровье полости рта, тут антибиотики становятся лишними. Синтетические препараты не рекомендованы к длительному применению, потому что они губительно влияют на здоровую микрофлору, создающую в нашей ротовой полости нормальный, естественный микроклимат. Если говорить о бесчисленных ополаскивателях для рта, которые стоят на полках супермаркетах и косметических магазинах, то они не смогут оказать должного терапевтического эффекта, а только лишь кратковременно устранят неприятный запаха изо рта.
Синтетические препараты не рекомендованы к длительному применению, потому что они губительно влияют на здоровую микрофлору, создающую в нашей ротовой полости нормальный, естественный микроклимат. Если говорить о бесчисленных ополаскивателях для рта, которые стоят на полках супермаркетах и косметических магазинах, то они не смогут оказать должного терапевтического эффекта, а только лишь кратковременно устранят неприятный запаха изо рта.
Так вот, на данном этапе нам на помощь спешит эффективная и проверенная фитотерапия. Укрепление десен, профилактика заболеваний, сохранение здоровой микрофлоры полости рта — со всеми этими задачами успешно справляются лекарственные растения. Уже не одного столетие врачи рекомендуют своим пациентам полоскания различными настоями, экстрактами, отварами лечебных трав.
На основе растений изготавливается половина всех лекарств, применяемых в стоматологии для лечения различных болезней полости рта, в том числе и в рамках лечения детей.
Реальные возможности фитотерапии крайне велики, ведь то или иное растение имеет широкий диапазон лечебных свойств: противовоспалительное, бактериостатическое, укрепляет и стимулирует иммунитет и пр. Применение фитотерапии позволяет значительно снижать вероятность рецидива, а иногда обеспечивает многолетнюю ремиссию. Фактор успеха — правильно подобранные растения и регулярность их применения.
В стоматологии фитотерапия в основном применяется для лечения заболеваний десен, слизистой полости рта. Косвенно фитотерапия помогает в лечении кариеса. Рассмотрим растения которые с успехом используются в стоматологии для лечения болезней десен и слизистой оболочки полости рта. Здесь стоит отметить, что консультация с вашим специалистом по поводу применения любых препаратов всегда необходима, так как нужно учитывать особенности работы вашего организма, наличие сопутствующих заболеваний и возможные аллергические реакции.
Растения с антимикробным и противовоспалительным эффектом (назначаются при стоматите, гингивите). Наиболее частая причина — патогенные микроорганизмы и, чем их меньше у нас во рту, тем меньше риск развития воспаления и осложнений.
Листья шалфея лекарственного.
Шалфей популярное растение в стоматологии. Входит в состав многих средств по уходу за полостью рта. Шалфей содержит эфирное масло, богатое камфарой, цинеолом, пиненами, дубильными веществами, и за счет этого оказывает свой эффект: вяжущий, противовоспалительный и антимикробный. Также этот природный лекарственный препарат помогает и при воспалениях десен и слизистой полости рта. Часто назначается в виде полосканий.
Гвоздичное дерево.
Благодаря содержанию эфирных масел, флавоноидов и дубильных веществ гвоздика является прекрасным антисептиком и обезболивающим, поэтому ее часто включают в лечебные пасты с обезболивающим эффектом. Сейчас можно встретить рекомендации по жеванию бутона гвоздики при эпидемиях ОРВИ, гриппа и просто для здоровья десен.
Тимьян ползучий (чабрец, богородская трава).
Всем известная трава. В кулинарии и в медицине чабрец очень популярен. В составе чабреца целый кладезь биологически активных веществ, в том числе и тимол, обладающий отличным антимикробным и противовоспалительным действием. Тимол активен в отношении патогенных кокков, грибков.
Листья эвкалипта.
Эвкалипт – природное антисептическое и противовоспалительное средство. Благодаря содержанию эфирного масла, а также дубильных и многих других активных веществ эвкалипт используют для сдерживания роста патогенных бактерий. Имеет высокую активность в лечении гингивитов и стоматитов микробной этиологии.
Имеет высокую активность в лечении гингивитов и стоматитов микробной этиологии.
Маклея (боккония).
Изготовленные на основе цветка препараты применяют для избавления от большого количества заболеваний: болезни кожи, воспаление ротовой полости, инфекции. Уникальную особенность маклеи — избавлять от различных заболеваний, можно объяснить имеющейся в её составе алкалоидов, сангвинарина и хелеритрина. Маклея эффективна в отношении многих стрептококков, в том числе и вызывающих кариес: Streptococcus mutans и Streptococcus salivarius. Свойства травянистого растения активно используют в лечении грибковые поражений, стоматита. В аптеке можно найти популярный препарат на основе маклеи Сангвиритрин® (Sanguiritrin, ), который стоматологии назначается при пародонтите, афтозном стоматите, язвенно-некротическом гингивостоматите
Мята перечная.
Мята — уникальное растение, включающее в себя эфирные масла: ментол, лимонен и другие терпены. В стоматологии лечебные свойства перечной мяты позволяют быстро и эффективно уменьшать явления воспаления в области языка, десен и верхнего неба. Используются отвары для полоскания, эфирное масло, настойка. Эффективная профилактика против кариеса. Препараты на их основе успокаивают, оказывают выраженное бактерицидное, противовоспалительное и обезболивающее действие.
Другая группа растений с противовоспалительным эффектом, которым обладает большая часть лекарственных растений, способны воздействовать на сам механизм его формирования.
Кора дуба.
Кора дуба — натуральный антисептик. В фитотерапии считается одним из самых уникальных фитокомплексов. В ее состав входят различные кислоты, белки, пектин, смолы, дубильные вещества, которые позволяют сформировать на поверхности слизистой оболочкой пленку, предотвращающую местное раздражение. Полезные свойства коры дуба помогут справиться с гингивитом, стоматитом, снимут флюс и даже помогут избавиться от неприятного запаха изо рта. При регулярных курсовых полосканиях кора дуба может стать профилактикой многих заболеваний полости рта.
Полезные свойства коры дуба помогут справиться с гингивитом, стоматитом, снимут флюс и даже помогут избавиться от неприятного запаха изо рта. При регулярных курсовых полосканиях кора дуба может стать профилактикой многих заболеваний полости рта.
Календула лекарственная («ноготки»).
Календула — активное природное средство с антисептическими и противовоспалительными свойствами. Содержит в своем составе каротиноиды и флавоноиды, чем и обусловлена фармакологическая значимость и активность растения. Чаще всего его применяют в виде полосканий полости рта при воспалениях десен и слизистых оболочек. При местном использовании календулы можно достигнуть регенеративного, противовоспалительного, антимикробного и противовирусного эффекта.
С помощью растений мы можем также стимулировать работу местного иммунитета, который будет защищать непосредственно полость рта.
Корень имбиря.
Имбирь обладает уникальным сочетанием вкусовых и лекарственных свойств, подобных сочетаний нет ни в одном другом растении. Порой даже общепризнанные лечебные растения уступают ему в своих полезных свойствах. Имбирь обладает большим списком полезных свойств: обезболивающим, противовоспалительным, рассасывающим, спазмолитическим, возбуждающим, заживляющим, потогонным, тонизирующим, бактерицидным, желчегонным, антибактериальным действием. Имеет сильное антиоксидантное и успокоительное воздействие, укрепляет иммунитет, задерживает рост бактерий. Корневище обладает противовоспалительными свойствами для ротовой полости и горла. Способен стимулировать выработку и выделение слюны — основного защитника полости рта. Благодаря этому удается противостоять воспалению, сдерживать рост бактерий, даже вызывающих кариес. Если после еды пожевать свежий имбирный корень, он на долгое время сделает ваше дыхание свежим и избавит от множества проблем в полости рта.
Родиола розовая.
Экстракт родиолы розовый проявляют выраженное адаптогенное действие и повышает резистентность тканей различных органов к повреждению При использовании происходит активация звеньев иммунитета, выработка интерферонов и стимуляция местного иммунитета. Кроме иммуностимулирующего действия, родиола розовая оказывает и обезболивающее действие. Настой родиолы применяют в виде полосканий при инфекционных заболеваниях горла.
Женьшень.
Фармакологическая активность обусловлена содержанием сапониновых гликозидов-гинсенозидов, эфирных и жирных масел, стеролов, пептидов, витаминов и минералов. При его использовании происходит стимуляция иммунитета. Кроме основного предназначения, женьшень оказывает еще тонизирующее и обезболивающее действие.
Масло облепихи.
Чтобы стимулировать восстановление слизистой оболочки в аптеках можно приобрести всем известное масло облепихи . Облепиховое масло рекомендуется как противовоспалительное и антибактериальное средство, стимулирующее восстановительные процессы в мягких тканях. Оказывает ранозаживляющее действие. Целебно облепиховое масло при лечении воспаления пульпы зубов и десен. Эффективно стимулирует заживление слизистой рта, что обусловлено наличием в нем каротина и токоферола (витамина Е).
Фитотерапия в стоматологии применяется со времен самого зарождения медицины, и до сих пор является актуальным методом при лечении стоматологических заболеваний. На протяжении долгого времени в арсенале стоматологов были только растительные лекарственные средства, применявшиеся при лечении целого ряда патологий. За этот громадный промежуток времени стоматологическая практика, в том числе и детская, накопила поистине колоссальный опыт эффективного применения фитопрепаратов.
Так что, мы с вами можем спокойно положиться на силу и мудрость природы, которая уже давно помогает нам в вопросах сохранения нашего здоровья.
адгезивная мазь для лечения поражений слизистой оболочки полости рта при красном плоском лишае — патент РФ 2508120
Изобретение относится к фармацевтической промышленности, а именно к средству для лечения поражений слизистой оболочки полости рта при красном плоском лишае. Адгезивная мазь для лечения поражений слизистой оболочки полости рта при красном плоском лишае, содержащая облепиховое масло и 0,5% преднизолоновую мазь, солкосерил дентальную адгезивную пасту и витамин А, при определенном соотношении компонентов. Вышеописанная мазь эффективна для лечения поражений слизистой оболочки полости рта при красном плоском лишае. 3 пр.
Формула изобретения
Адгезивная мазь для лечения поражений слизистой оболочки полости рта при красном плоском лишае, содержащая облепиховое масло и 0,5% преднизолоновую мазь, отличающаяся тем, что дополнительно содержит солкосерил дентальную адгезивную пасту и витамин А при следующем соотношении компонентов, %:
| облепиховое масло | 20 |
| 0,5% преднизолоновая мазь | 20 |
| солкосерил дентальная адгезивная паста | 40 |
| витамин А | 20 |
Описание изобретения к патенту
Изобретение относится к области клинической медицины, а именно к дерматологии и стоматологии, и может быть использовано для лечения слизистой оболочки полости рта у больных красным плоским лишаем.
Красный плоский лишай (код по МКБ-10: L43) — хронический зудящий дерматоз мультифакторной природы, характеризующийся моноформными папулезными высыпаниями на коже и слизистых оболочках [1].
Поражение слизистой оболочки рта и губ характеризуется появлением мелких узелков, размером с булавочную головку, плоских многоугольных, плотных, серовато-белого цвета с блеском [2]. Чаще всего поражается слизистая оболочка внутренней поверхности щек и язык. Прием пищи и речь становятся затрудненным, отмечается специфический запах изо рта.
Местное лечение при поражении слизистой оболочки полости рта (СОПР) заключается в использовании мазей с использованием кортикостероидов. Кроме этого, в клинике при лечении поражений слизистой оболочки полости рта при красном плоском лишае используют полоскания с антисептиками и местными анестетиками, аппликации кератопластическими средствами: облепиховым маслом, маслом шиповника [3].
Известен способ лечения плоского лишая (КПЛ) слизистой оболочки полости рта (патент изобретение RU 2356551 С1 от 17.03.2008 г.). Для этого используют мексидол в таблетках и виде зубной пасты «Мексидол dent fito». Мексидол в таблетках вводят по одной два раза в день в течение месяца. Зубную пасту используют два раза в день в течение 1-1,5 месяцев. Изобретение позволяет повысить эффективность лечения и удлинить период ремиссии за счет общего и местного влияния мексидола на патогенез заболевания.
Также известен способ лечения плоского лишая путем комплексной терапии с применением десенсибилизирующих средств, местном нанесении на слизистую оболочку полости рта гормонального и кератопластического средства 4% водонерастворимого коллоидного раствора хитозана со степенью деацетилирования 0,95 молекулярной массой 100-120 кД, который наносят на предварительно обработанную 1% раствором перекиси водорода и высушенную слизистую оболочку полости рта на пораженных участках тонким слоем 3 раза в день после еды 1 раз на ночь в течение 30 дней, после чего для профилактики в течение еще 30 дней продолжают лечение раствором хитозана 1 раз в день после еды и 1 раз на ночь (патент на изобретение RU 2258516 С1).
Известен способ лечения плоского лишая слизистой оболочки полости рта с использованием витаминов А, Е, С, поливитаминов как для общего лечения, так и для местного (аппликации масляных растворов витаминов А, Е, каротолина, масла шиповника, облепихи и т.д.) с целью нормализации обменных процессов в организме и эпителии слизистой оболочки полости рта [5].
Однако данная терапия применима только при типичной форме красного плоского лишая, она не учитывает особенностей процесса заживления пораженной слизистой оболочки полости рта при экссудативно-гиперемической и эрозивно-язвенной формах КПЛ. Кроме этого, известна методика местного лечения КПЛ СОПР с применением кортикостероидных мазей (синалар, флуцинар — «средства, регулирующие метаболические процессы, относятся к гормонам коры надпочечников и к их синтетическим аналогам»), стимулирующих препаратов (метилурацил — «препараты, стимулирующие метаболические процессы»), а в качестве кератопластического препарата использовали каротолин («витамины и родственные препараты, препарат группы каротина») [1, 2].
Этот метод лечения оказывает выраженный противовоспалительный эффект и стимулирует репаративные процессы в СОПР.
Однако длительное применение гормональных мазей может вызывать побочное действие в виде атрофии эпителия, угнетения процессов регенерации, есть противопоказания к использованию при вирусной инфекции. Стимулирующие и эпителизирующие препараты имеют слабую адгезию к слизистой оболочке полости рта и не подавляют присоединившуюся вторичную инфекцию [1].
Некоторые авторы отмечают хороший ранозаживляющий эффект при использовании витамина А для лечения поражений слизистой оболочки полости рта при КПЛ, регуляцию процессов пролиферации и дифференцировки клеток эпителия, но недостатком метода можно считать слабую адгезию масляного раствора витамина А к СОПР, отсутствие антибактериального действия, что приводит к увеличению сроков лечения и может привести к возможным рецидивам заболевания [6].
Наиболее близкой по технической сущности и выбранная в качестве прототипа является мазь, состоящая из 2 компонентов: облепихового масла и 0,5% преднизолоновой мази [7]. Однако, наносимая на слизистую оболочку мазь также легко смываются слюной и пищей, поэтому ее противовоспалительное и кератопластическое действие не имеет стойкого терапевтического эффекта, приводящего к ускорению заживления эрозивных поражений слизистой оболочки.
Поставлена задача создания мази для лечения поражений слизистой оболочки полости рта при красном плоском лишае, обладающей высоким адгезивным, кератопластическим и противовоспалительным эффектом.
Технический результат — повышение эффективности лечения поражений слизистой оболочки полости рта при КПЛ за счет сокращения сроков эпителизации пораженной слизистой оболочки при использовании заявляемой мази, сочетающей высокую адгезивную, кератопластическую и противовоспалительную активность своих компонентов.
Поставленная задача достигается использованием мази, содержащей облепиховое масло и 0,5% преднизолоновую мазь, солкосерил дентальную адгезивную пасту, витамин А, при следующем % соотношении компонентов:
| облепиховое масло | 20 |
| 0,5% преднизолоновая мазь | 20 |
| солкосерил дентальная адгезивная паста | 40 |
| витамин А | 20 |
Заявляемую мазь для лечения поражений слизистой оболочки полости рта при КПЛ готовят следующим образом. Все необходимые компоненты готовят в рецептурном количестве и перемешивают при комнатной температуре.
На 100 г готового продукта необходимо: к 20 г облепихового масла добавляют
20 г 0,5% преднизолоновой мази, тщательно перемешивают. В полученный состав вносят 40 г солкосерил дентальная адгезивная пасты и 20 г витамина А. Тщательно перемешивают до образования однородной массы.
В полученный состав вносят 40 г солкосерил дентальная адгезивная пасты и 20 г витамина А. Тщательно перемешивают до образования однородной массы.
Характеристика компонентов заявляемой мази.
Облепиховое масло обеспечивает кератопластическое действие за счет содержания необходимых макро- и микроэлементов, включая витамины Е, С, В1, В2, В6, F, Р, фолиевую кислоту, флавоноиды (рутин), дубильные вещества, нормализует местный обмен веществ.
0,5% преднизолоновая мазь оказывает противовоспалительное, противоаллергическое и антиэкксу дативное действие.
Солкосерил дентальная адгезивная паста (Рег. № 015194/01-2003) обеспечивает ускорение заживления, обезболивание и защиту раневой поверхности. Кроме этого, паста обеспечивает высокую адгезию (прилипание) лекарственных компонентов, введенных в состав композиции к влажной слизистой оболочке, и, как следствие, — гарантирует длительное депонирование всех лекарственных компонентов мази в слизистой, необходимое для стимуляции процессов регенерации, обезболивания, сорбции и заживления.
Витамин А (ретинол) — жирорастворимый витамин, антиоксидант, участвует в окислительно-восстановительных процессах, регуляции синтеза белков, способствует нормальному обмену веществ, функции клеточных и субклеточных мембран, играет важную роль в формировании костей и зубов, а также жировых отложений; необходим для роста новых клеток.
Параметры компонентов вводимых в состав заявляемого средства определяли опытным путем. Введение компонентов ниже нижнего или выше верхнего пределов не обеспечивает оптимального воздействия, а также ухудшает товарный вид.
Срок годности полученной мази — 1 месяц. Параметры мази стабильны в процессе хранения. Мазь представляет собой светло-желтую массу с приятным запахом.
Технический результат предлагаемого решения достигается сочетанием высокой адгезивной, кератопластической, противовоспалительной и сорбционной активности компонентов.
Лечебное действие заявляемого средства апробировано в клинике. Осложнений, аллергических реакций и побочных явлений при использовании данной мази выявлено не было. Мазь хорошо фиксируется на слизистой, даже при наличии слюны и экссудата, обеспечивая длительное депонирование лекарственных веществ на поверхности поражений слизистой оболочки, сокращает сроки эпителизации СОПР.
Заявляемая мазь прошла клинические испытания на базе ГБУ «Краевой клинический венерологический диспансер» г.Ставрополя.
Примеры конкретного выполнения.
Пример 1. Больная А., 65 лет, амб. карта № 1719.
Жалобы на болезненность при приеме пищи. Объективно: на слизистой оболочке щек множественные папулезные элементы, серовато-белого цвета, сливаясь, образуют сетчатый рисунок, слизистая гиперимирована, болезненная при приеме пищи.
Диагноз: распространенный красный плоский лишай типичная форма, экссудативно-гиперимическая на слизистой оболочке полости рта, был поставлен на основании жалоб, анамнеза, объективных данных биопсии. Больная получала традиционный курс терапии с назначением внутрь стимулирующих (нуклеинат натрия) и десенсибилизирующих (тавегил) средств и местного нанесения на слизистую оболочку полости рта гормональных (синалар) препаратов.
Лечение. Для лечения поражений слизистой оболочки полости рта больной назначена заявляемая адгезивная мазь — наносить 2-3 раза в сутки на поврежденные участки слизистой оболочки.
Сразу после начала применения мази отмечен ее высокий адгезионный и кератопластический эффект. После однократного нанесения мазь фиксируется на слизистой даже после приема пищи. Эпителизация пораженной СОПР значительно ускорилась, облегчен прием пищи, речь, больная указывает на улучшение общего состояния.
При осмотре на 3 сутки отмечается уменьшение воспалительных очагов, болезненность сохраняется при приеме горячей пищи, на 5 сутки слизистая оболочка безболезненная бледно-розового цвета, влажная, на 14 сутки единичные папулезные высыпания, на 21 сутки папулы сохранились только в ретромолярной области. Через месяц после окончания лечения больная жалоб не предъявляет, слизистая оболочка полости рта бледно-розового цвета, влажная, по линии смыкания зубов единичные папулы без признаков воспаления, уплощенные.
Через месяц после окончания лечения больная жалоб не предъявляет, слизистая оболочка полости рта бледно-розового цвета, влажная, по линии смыкания зубов единичные папулы без признаков воспаления, уплощенные.
Пример 2. Больная С., 45 лет, амб. карта № 1975.
Больная поступила с диагнозом распространенный красный плоский лишай, типичная форма на слизистой оболочке полости рта. Диагноз был поставлен на основании жалоб, анамнеза, объективных данных биопсии и контактной микроскопии. Больная получала традиционный курс общей терапии с назначением внутрь стимулирующих (нуклеинат натрия) и десенсибилизирующих (тавегил) средств.
На фоне проводимой общей терапии больной была назначена заявляемая мазь для лечения поражений слизистой оболочки полости рта — наносить 2-3 раза в сутки на поврежденные участки СОПР.
Эпителизация эрозий значительно ускорилась, особенно выраженным был лечебный эффект в ретромолярной области, где располагались наиболее глубокие очаги, был значительно облегчен прием пищи и речь, уже через 3 суток после начала лечения больная указала на улучшение общего состояния.
При осмотре на 5 сутки отмечалось наличие воспалительных очагов, болезненность сохраняется при приеме горячей пищи, на 7 сутки слизистая оболочка болезненная, гиперимированная в области папулезных элементов, на 14 сутки папулезные высыпания сохраняются, на 21 сутки уменьшение воспаления, папулы сохранились. Через месяц после окончания лечения больная жалуется на дискомфорт в полости рта, слизистая оболочка полости рта бледно-розового цвета, влажная, по линии смыкания зубов единичные папулы без признаков воспаления.
Пример 3. Больной С., 45 лет, амб. карта № 12247 (по методу «прототипа»).
Больной поступил с диагнозом красный плоский лишай, типичная форма на слизистой оболочке полости рта. Диагноз был поставлен на основании жалоб больного, собранного анамнеза, объективных данных биопсии и контактной микроскопии. Больной получал традиционный курс общей терапии с назначением внутрь стимулирующих (нуклеинат натрия) и десенсибилизирующих (тавегил) средств.
Больной получал традиционный курс общей терапии с назначением внутрь стимулирующих (нуклеинат натрия) и десенсибилизирующих (тавегил) средств.
На фоне проводимой общей терапии пациенту была назначена мазь-прототип для лечения поражений слизистой оболочки полости рта.
Эффект проводимого местного лечения был значительно ниже, чем при использовании разработанной мази. Основным недостатком мази-прототипа являлось то, что наносимая мазь легко смывалась слюной и пищей, поэтому ее противовоспалительное и кератопластическое действие не имело стойкого терапевтического эффекта, ускорения заживления поражений слизистой оболочки не происходило. Мазь-прототип не обеспечивала кератопластического эффекта, больной постоянно жаловался на боли при приеме пищи и разговоре.
После 35 суток лечения на фоне полного исчезновения клинических проявления КПЛ на коже, в полости рта продолжали сохраняться папулы, что привело к увеличению длительности лечения до 60 суток.
Клинические испытания предлагаемой мази проведены у 46 пациентов в период с 2009 по 2011 гг. на базе ГБУЗ «Краевой клинический венерологический диспансер» г.Ставрополя. Ни у одного больного, которому использовали заявляемую мазь для лечения поражений слизистой оболочки полости рта при КПЛ, воспалительных осложнений отмечено не было, а сроки эпителизации эрозий, в среднем, сократились на 50%. Высокий кератопластический и противовоспалительный эффект разработанной мази был особенно выражен за счет ее высокой адгезии к слизистой оболочке полости рта.
Полученные данные показали высокие адгезивные, кератопластические и противовоспалительные свойства разработанной мази, позволяющие ускорить заживление СОПР, предотвратить развитие воспалительных осложнений и сократить период полной эпителизации пораженной слизистой оболочки при КПЛ, что позволяет рекомендовать более широкое применение данной мази в клинике.
Таким образом, предлагаемое техническое решение позволяет получить недорогое, экономически выгодное высокоэффективное средство для лечения поражений слизистой оболочки полости рта при красном плоском лишае, а также сократить сроки лечения.
Средства по уходу за полостью рта
Дополнительные средства для очищения полости рта
О необходимости чистки зубов зубными щетками с применением специальных паст, гелей или порошков известно давно всем. Но многие еще не знают о той пользе для полости рта, которую дает использование таких средств как ополаскиватели, лосьоны, спреи. Они также выполняют как гигиеническую, так и лечебную функцию. Важно лишь правильно их выбрать и соблюдать технику безопасности при применении.
Ополаскиватели для рта
Специальные растворы с содержанием активных компонентов называются ополаскивателями и применяются для обработки (полоскания) ротовой полости. С их помощью можно устранить с зубов, языка и слизистой остатки еды, снизив тем самым количество бактерий. Различаю два вида ополаскивателей:
- гигиенические — содержащиеся в таких растворах мята и ментол способны освежить дыхание, но не устранить причину его возникновения;
- лечебные — входящие в их состав компоненты помогают бороться с болезнями ротовой полости, укрепляют эмаль зубов, частично устраняют зубные камни, улучшают кровообращение в деснах.
Лечебные ополаскиватели могут использоваться при таких заболеваниях полости рта как стоматит, пародонтит, гингивит. Однако важно помнить, что неправильное применение таких средств может только навредить.
Безопасность применения
В состав лечебных очищающих средств входят активные вещества, которые при неправильном применении могут разрушать нормальную микрофлору полости рта, а также вызвать аллергические реакции. Также в них могут содержаться достаточно агрессивные компоненты, например, перекись водорода или метиловый спирт, которые не предназначены для попадания в глотку и желудок человека.
Чтобы дополнительные очищающие средства для ротовой полости принесли только пользу, следует придерживаться следующих правил:
- при их выборе консультироваться со специалистами;
- приобретать в аптеках;
- следовать аннотации к раствору, особо обращая внимания на разрешенную частоту применения;
- быть осторожным при применении, чтобы исключить попадания внутрь организма.
Обращаться за консультацией при выборе средств можно к нашим специалистам.
Средства от ожогов и ран
Заказать средства для заживления ран на коже
Поражение кожных покровов — часто встречающийся недуг. Чтобы избежать развития инфекции и ускорить регенерацию кожи, применяют ранозаживляющие и антибактериальные средства. Приобрести такие препараты можно в одной из более чем 1200 аптек «36,6» в Москве, Санкт-Петербурге, Московской и Ленинградской областях.
Удобный интернет-сервис позволяет ознакомиться с ассортиментом, изучить инструкции, найти более дешевые или дорогие аналоги по действующему веществу, организовать доставку лекарственных средств в аптеку, расположенную недалеко от дома. Оплата заказа производится в аптеке при получении.
Сайт аптеки «36,6» поможет сэкономить время на поиске необходимого препарата. В нашем каталоге в широком ассортименте представлены средства для заживления ран на коже. Понятный интерфейс и удобная система поиска позволяют быстро найти препарат по наименованию, производителю или действующему веществу, подобрать более дорогие или дешевые аналоги. Любой препарат можно заказать онлайн, он будет доставлен в одну из аптек, где его можно будет забрать и оплатить.
Показания
Порезы, царапины, ожоги могут появиться при выполнении привычных бытовых задач, поэтому средства для обработки ран и заживления кожи обязательно должны быть в домашней аптечке.
В зависимости от характера повреждения могут потребоваться препараты различного действия [i]:
- Противовоспалительные при ушибах и растяжениях;
- Обеззараживающие при трещинах, порезах и царапинах;
- Мази с антибиотиком для кровоточащих ран и язв;
- Регенерирующие крема при ссадинах, открытых ранах;
- Подсушивающие мази для обработки мокнущих и гнойных ран.

Ранозаживляющие препараты для лечения глубоких порезов, серьёзных ожогов большой площади, укусов животных и опасных насекомых должны назначаться врачом.
Противопоказания
Наружный способ применения ранозаживляющих и антибактериальных средств не исключает возможности негативных последствий, самым частым из которых является аллергия.
Основными противопоказаниями употребления отдельных препаратов являются:
- непереносимость компонентов;
- тяжёлая почечная недостаточность;
- воспалительные заболевания кожи.
Формы выпуска
Ранозаживляющие и антибактериальные препараты предназначены для нанесения на повреждённые участки кожи. При обработке травмированных участков могут применяться сухие или жидкие смеси, для ускорения регенерации и образования рубца назначаются мазеобразные средства.
В нашем каталоге представлены лекарственные средства в форме:
- мазей и кремов;
- растворов, суспензий или клея;
- порошков, спреев;
- гелей и бальзамов.
Страны изготовители
Выпуском ранозаживляющих средств занимаются многие российские фармакологические заводы.
Также на сайте можно найти кремы и мази, выпущенные в:
- Австрии;
- Венгрии;
- Германии;
- Хорватии и других странах.
ПЕРЕД ПРИМЕНЕНИЕМ ПРЕПАРАТОВ НЕОБХОДИМО ОЗНАКОМИТЬСЯ С ИНСТРУКЦИЕЙ ПО ПРИМЕНЕНИЮ ИЛИ ПРОКОНСУЛЬТИРОВАТЬСЯ СО СПЕЦИАЛИСТОМ.
Список литературы:
- [i] Першин Г.Н., Гвоздева Е.И. ‘Учебник фармакологии’ — Москва: Медгиз , 1961 — с.405
инструкция по применению, аналоги, состав, показания
Репарэф-2 – ранозаживляющее и противоожоговое средство, обладает регенерантными и репаративными свойствами. Действующим началом мази Репарэф-2 является биен – комплекс этиловых эфиров полиненасыщенных жирных кислот, стабилизированный α-токоферола ацетатом (витамин Е). В состав биена входят эссенциальные жирные кислоты – арахидоновая (предшественник простагландинов и лейкотриенов), олеиновая, линолевая и линоленовая (витамин F), являющиеся важнейшими компонентами биологических мембран и источником биорегуляторов клеток и тканей. Мазь Репарэф-2 оказывает выраженное стимулирующее влияние на заживление ран и ожогов, ускоряет все фазы раневого процесса, активирует пролиферацию фибробластов, фибриллогенез, эпителизацию раневого дефекта, способствует усилению роста капилляров и грануляционной ткани, обеспечивает быстрое заживление небольших по площади и неглубоких ран с хорошим функциональным и косметическим эффектом. Применение мази у больных с эрозивно-язвенными поражениями слизистой оболочки рта способствует уменьшению болевого синдрома, снижению воспалительных явлений, уменьшению эритемы, существенному ускорению эпителизации и более быстрому заживлению.
Мазь Репарэф-2 оказывает выраженное стимулирующее влияние на заживление ран и ожогов, ускоряет все фазы раневого процесса, активирует пролиферацию фибробластов, фибриллогенез, эпителизацию раневого дефекта, способствует усилению роста капилляров и грануляционной ткани, обеспечивает быстрое заживление небольших по площади и неглубоких ран с хорошим функциональным и косметическим эффектом. Применение мази у больных с эрозивно-язвенными поражениями слизистой оболочки рта способствует уменьшению болевого синдрома, снижению воспалительных явлений, уменьшению эритемы, существенному ускорению эпителизации и более быстрому заживлению.
Диоксидин – антибактериальный бактерицидный препарат широкого спектра действия. Диоксидин оказывает бактерицидное действие, механизм которого до конца не изучен. Активность диоксидина усиливается в анаэробной среде за счет индукции образования активных форм кислорода. Активен в отношении Proteus vulgaris, Pseudomonas aeruginosa, Klebsiella pneumoniae, Escherichia coli, Shigella dysenteria, Shigella flexneri, Shigella boydii, Shigella sonnei, Salmonella spp., Staphylococcus spp., Streptococcus spp., патогенных анаэробов (Clostridium perfringens). Действует на штаммы бактерий, устойчивых к другим 1 противомикробным лекарственным средствам, включая антибиотики. Не оказывает местнораздражающего действия. Возможно развитие лекарственной устойчивости бактерий. В экспериментальных исследованиях продемонстрировано наличие тератогенного, эмбриотоксического, мутагенного и повреждающего действия на кору надпочечников.
Оценка заживления ран и послеоперационной боли после лазерной биопсии слизистой оболочки полости рта с помощью соединения с хлоргексидином и гиалуронатом натрия: рандомизированное двойное слепое клиническое исследование
Это рандомизированное двойное слепое клиническое исследование было проведено для оценки эффективности раствора, состоящего из путем сравнения гиалуроната натрия и диглюконата хлоргексидина с раствором хлоргексидина диглюконата и раствором плацебо в процессе вторичного намеренного заживления и послеоперационной боли после эксцизионной биопсии слизистой оболочки полости рта.
РКИ с тремя группами было запланировано вместо двухгруппового из-за оценки эффективности одного хлоргексидина или в комбинации с гиалуронатом натрия. Группа плацебо была фундаментальной, особенно для оценки восприятия боли.
Обработка послеоперационных ран направлена на скорейшее заживление ран, получение гладкой поверхности, без шрамов или втягивающей травмы, а также на минимизацию боли и дискомфорта для пациента. Улучшение процесса восстановления и уменьшение боли может повысить послеоперационный комфорт пациентов.На восстановление тканей могут отрицательно повлиять многие факторы, такие как инфекции, гипоксия, метаболические нарушения, такие как сахарный диабет, и наличие некротической ткани [20].
Присутствие большего или меньшего количества гиалуроновой кислоты влияет на клиническую реакцию процессов заживления. То есть разница в ответе зависит от уровней и концентраций гиалуроновой кислоты [21].
Из этих клинических данных ясно, что во время заживления тканей наличие гиалуроновой кислоты дает ткани постоянный источник фактора риска для восстановления первоначальной архитектуры ткани [22].
Из-за роли гиалуроновой кислоты в более быстром разрешении послеоперационной раны, недавно был систематически использован раствор с хлоргексидина диглюконатом и гиалуронатом натрия с четкими протоколами, чтобы проверить реальные преимущества, которые он может привести как к сроки разрешения патологии и правильного и по возможности менее травматичного послеоперационного течения. Используемое соединение содержит очищенную воду, ксилит, пропиленгликоль, гидрогенизированное касторовое масло Peg-40, аскорбиновую кислоту, хлоргексидина диглюконат, гиалуронат натрия, ароматизатор, полоксамер 407, метабисульфит натрия, цитрат натрия и лимонную кислоту.
По данным заживления ран, было показано, что через 7 дней после лазерной операции в SG средний процент заживления был выше, чем у CG, обработанного только хлоргексидином, и PG, обработанного нейтральным раствором, с незначительная разница между группами. Более того, через 14 дней результаты показали еще более заметные различия между SG и двумя оставшимися группами и степенью заживления, близкой к 100%, со статистически значимой разницей ( p = 0.001).
Более того, через 14 дней результаты показали еще более заметные различия между SG и двумя оставшимися группами и степенью заживления, близкой к 100%, со статистически значимой разницей ( p = 0.001).
Эффект соединения, особенно в отношении присутствия гиалуроната натрия, по-видимому, проявляет большую эффективность на поздней стадии заживления раны, вероятно, из-за того, что фибробласты и их продукты вовлечены в третью фазу раны. исцеление, определенное разрастание. Таким образом, в исследуемой группе, где пациенты подвергались введению соединения с гиалуронатом натрия и хлоргексидином, наблюдалось более быстрое заживление хирургической раны благодаря его химико-физическим и биологическим характеристикам, способствующим восстановлению технологических ран. с точки зрения пролиферации фибробластов, образования грануляционной ткани, отложения коллагена и стимуляции выработки факторов роста, участвующих в отложении внеклеточного матрикса и в сосудистой сети.
Результаты, полученные в этом исследовании, в целом соответствуют результатам, описанным в литературе, где хорошо показано действие гиалуроната натрия.
Colella et al. [23, 24] изучили и проанализировали механизмы, участвующие в заживлении ран, и молекулярные изменения, индуцированные в кератиноцитах и фибробластах за счет использования гиалуроната натрия отдельно или в сочетании с синтетическими аминокислотами, и пришли к выводу, что HA может вызывать изменения в экспрессии генов, связанных с мигрирующим фенотипом кератиноцитов, и способствуют активности фибробластов, способствуя реэпителизации и закрытию ран.Как сообщают другие исследования [25], применение геля с гиалуронатом натрия и аминокислотами при заживлении ран мягких и твердых тканей после удаления зуба показало более высокий средний процент заживления как мягких, так и твердых тканей.
В этом исследовании область раны, обработанная только хлоргексидином (CG), показала более высокий PHI, чем PG в T1, в то время как в T2 (14 дней) средний показатель процентного индекса заживления был ниже, чем PG с незначительной разницей в тесте множественного сравнения. .Вероятно, это связано с влиянием хлоргексидина как на бактериальную нагрузку на ранней стадии заживления ран, особенно в фазе воспаления, так и на фибробласты, более присутствующие на поздней стадии, особенно в фазе пролиферации.
.Вероятно, это связано с влиянием хлоргексидина как на бактериальную нагрузку на ранней стадии заживления ран, особенно в фазе воспаления, так и на фибробласты, более присутствующие на поздней стадии, особенно в фазе пролиферации.
Фактически, использование хлоргексидина во время заживления ран основано на концепции, что он способен снизить бактериальную нагрузку на область раны. Установлена роль бактерий в замедлении заживления ран [26]. Инфекция раны мешает нормальному процессу заживления раны [27, 28]; и наоборот, низкая бактериальная нагрузка может положительно влиять на заживление ран, усиливая воспалительную реакцию, необходимую для заживления тканей [29].
В дополнение к этому существует несколько исследований использования и возможностей хлоргексидина, показывающих важное противоречие в его влиянии на заживление ран. Различные исследования in vitro показали, что хлоргексидин отрицательно влияет на пролиферацию фибробластов и кератиноцитов в зависимости от концентрации и времени [30,31,32,33]. С другой стороны, лишь несколько исследований in vivo показали отрицательный эффект хлоргексидина [34, 35]. Это противоречие можно объяснить различными клеточными и молекулярными взаимодействиями, происходящими in vitro и in vivo.
В частности, в полости рта хлоргексидин в первую очередь связывается с бактериями, а дополнительное количество нанесенного хлоргексидина осаждается белками [36, 37]. Следовательно, оставшийся хлоргексидин, предназначенный для связывания клеток в области раны, уменьшается [38].
Козловский и др. [38] обнаружили, что хлоргексидин значительно улучшает заживление ран на гистологическом уровне, но не на клиническом. Другое исследование заживления ран на крысах показало, что заживление ран нарушалось на 0.5% хлоргексидина и пролонгированного действия с концентрацией 0,1% и 0,2% [34].
Для измерения заживления ран была проведена традиционная оценка с помощью цифровых фотографий. В настоящее время это наиболее используемый метод, хотя в литературе сообщалось о других методах, использующих устройство для измерения ран с помощью лазера (LAWM) [39].
Кроме того, если рассматривать боль как субъективное чувство, реакция на болезненные стимулы зависит от личных, культурных и социальных факторов [40]. В этом исследовании используется субъективная оценка послеоперационной боли, о которой пациент сообщает через NRS, простой метод самооценки субъективных ощущений, который считается действенным методом оценки боли [41, 42].
Пилотное исследование Vescovi et al. [43] показали, что соединение аминокислот и геля на основе гиалуроната натрия способствует не только улучшению процесса заживления, но и снижению, а значит, лучшему восприятию боли в ближайшем послеоперационном периоде. Эти авторы выполнили лазерную биопсию доброкачественных поражений полости рта, разделив пациентов на две группы. Лучшая аллергическая реакция была показана у пациентов, которым вводили и рекомендовали нанесение на основе аминокислот и геля гиалуроната натрия.
По результатам нашего исследования воспринимаемая боль значительно варьируется. Фактически, использование соединения показало аналогичное уменьшение боли в трех группах. Однако значения среди них не кажутся статистически значимыми.
Таким образом, оценка восприятия послеоперационной боли имеет тенденцию различаться в зависимости не только от используемого соединения, но также и от индивидуального восприятия, от местоположения поражения в полости рта и от размера поражения, которое может иметь большое влияние на восприятие.
Ограничения нашего исследования в основном касаются количества образцов и сравнения заживления ран в различных анатомических областях полости рта. Каждый участок полости рта может иметь разное время заживления, в зависимости от типа эпителия и типа функции, поэтому для окончательной оценки требуется большое количество пациентов.
Молекулярная анатомия заживления ран полости рта — Просмотр полного текста
ИСТОРИЯ:
Процесс заживления ран слизистой оболочки рта и кожи отличается двумя важными свойствами: более быстрое заживление и отсутствие образования рубцовой ткани. Это примечательно, учитывая очевидное сходство двух тканей. Однако существуют заметные различия в среде заживления, такие как гидратация, доступность факторов роста, воспалительная реакция и воздействие микробов. Знания о причинном вкладе каждого из этих факторов в дифференциальную реакцию заживления двух эпителиев в основном анекдотичны, а заживление ран в полости рта, как правило, мало изучено. Это исследование стремится дать глобальное молекулярное определение заживления ран полости рта по сравнению с заживлением кожи.Общая цель будет заключаться в выявлении конкретных факторов, способствующих быстрому заживлению слизистой оболочки полости рта практически без шрамов. Выявление этих физиологических и молекулярных детерминант будет иметь широкие последствия для здоровья полости рта человека. Среди прочего, он предоставит места для целевого изучения процедур для ускорения заживления критических повреждений полости рта, образованных травмой, операцией, лучевой терапией, инфекцией и другими патологиями полости рта, которые, если их не лечить, приводят к необратимой инвалидности и дисфункции. .Более того, пути и / или молекулы, идентифицированные в этих исследованиях, которые могут способствовать быстрому заживлению без рубцов, могут быть рассмотрены для применения на участках слизистой оболочки вне полости рта для ускорения заживления и минимизации некрасивых рубцов, которые также могут нарушить функциональную целостность ткани.
Это примечательно, учитывая очевидное сходство двух тканей. Однако существуют заметные различия в среде заживления, такие как гидратация, доступность факторов роста, воспалительная реакция и воздействие микробов. Знания о причинном вкладе каждого из этих факторов в дифференциальную реакцию заживления двух эпителиев в основном анекдотичны, а заживление ран в полости рта, как правило, мало изучено. Это исследование стремится дать глобальное молекулярное определение заживления ран полости рта по сравнению с заживлением кожи.Общая цель будет заключаться в выявлении конкретных факторов, способствующих быстрому заживлению слизистой оболочки полости рта практически без шрамов. Выявление этих физиологических и молекулярных детерминант будет иметь широкие последствия для здоровья полости рта человека. Среди прочего, он предоставит места для целевого изучения процедур для ускорения заживления критических повреждений полости рта, образованных травмой, операцией, лучевой терапией, инфекцией и другими патологиями полости рта, которые, если их не лечить, приводят к необратимой инвалидности и дисфункции. .Более того, пути и / или молекулы, идентифицированные в этих исследованиях, которые могут способствовать быстрому заживлению без рубцов, могут быть рассмотрены для применения на участках слизистой оболочки вне полости рта для ускорения заживления и минимизации некрасивых рубцов, которые также могут нарушить функциональную целостность ткани.
Гипотез:
- Существуют значительные различия в экспрессии генов и белков при заживлении ран на коже и слизистой оболочке полости рта.
- Привлечение воспалительных клеток, связанных с большой активацией генов, связанных с воспалением, включая цитокины и хемокины, в эпителиальных клетках кожных ран может объяснить эти различия.
- Существуют специальные генные программы, которые могут объяснить наличие значительных рубцов в тканях кожи, но не на слизистой оболочке полости рта.
ЦЕЛИ:
Общая цель этого предложения по пилотному исследованию — установить профили экспрессии генов и белков на ранних стадиях (1-6 дней) нормального заживления ран полости рта. Сравнивая эти профили с профилями заживления кожных ран, мы можем идентифицировать молекулы, предназначенные исключительно для заживления ран полости рта, которые могут представлять биомаркеры процесса заживления или служить новыми терапевтическими мишенями при патологическом заживлении ран и раке.Одна конкретная гипотеза, которая должна быть проверена, заключается в том, что уровень экспрессии провоспалительных генных сетей проникающими в рану кератиноцитами составляет наиболее существенное различие между транскриптомами оральной и кожной раны человека. Конкретная гипотеза была разработана на основе данных, полученных в результате наших недавних дополнительных исследований заживления ран полости рта и кожи на животных.
Сравнивая эти профили с профилями заживления кожных ран, мы можем идентифицировать молекулы, предназначенные исключительно для заживления ран полости рта, которые могут представлять биомаркеры процесса заживления или служить новыми терапевтическими мишенями при патологическом заживлении ран и раке.Одна конкретная гипотеза, которая должна быть проверена, заключается в том, что уровень экспрессии провоспалительных генных сетей проникающими в рану кератиноцитами составляет наиболее существенное различие между транскриптомами оральной и кожной раны человека. Конкретная гипотеза была разработана на основе данных, полученных в результате наших недавних дополнительных исследований заживления ран полости рта и кожи на животных.
ПРАВО:
В исследование будут включеныздоровых добровольцев мужского пола в возрасте от 18 до 40 лет.
ДИЗАЙН:
Образцы слизистой оболочки полости рта: стерильный дермальный перфоратор диаметром 3 мм будет использоваться для создания однородной биопсии на всю толщину слизистой оболочки щеки чуть выше окклюзионной плоскости.Круглые кусочки ткани толщиной примерно 2 мм будут удалены в день биопсии (день 1). Эти субъекты будут впоследствии случайным образом сгруппированы следующим образом:
Группа 1: дальнейший сбор образцов не производится; фотографии будут сделаны в дни 3, 6, 9, 13 и 15 (см. расписание). Эта группа поможет задокументировать нормальный процесс заживления в условиях настоящего исследования, включая отсутствие рубцов в области, выбранной для первоначальной раны на слизистой оболочке полости рта, по сравнению с кожей.
Группа 2: вторая биопсия будет взята на 3-й день, которая будет включать область первой биопсии стерильным 5-миллиметровым перфоратором, следуя той же процедуре, что и для 0-го дня; фотографии будут сделаны в соответствии с расписанием, установленным в Расписании. Эта вторая биопсия позволит отобрать пробу из области заживления, вызванной первой биопсией. Выбрав размер пуансона на два миллиметра шире и взяв образец соосно первому, мы можем гарантировать полное удаление интересующей области.
Группа 3: вторая биопсия будет взята на 6 день, соответственно, аналогично тому, как описано для группы 2; фотографии будут сделаны согласно расписанию.
Образцы кожи: параллельно с биопсией полости рта биопсии кожи того же размера и глубины, что и биопсия полости рта у тех же субъектов, будут взяты из подмышечной области в соответствии с тем же графиком и процедурой, включая вторую биопсию для групп 2 и 3.
Раны будут сфотографированы цифровой камерой, а их заживление будет контролироваться при посещении клиники в соответствии с указанным выше графиком.Иссеченные ткани в каждом случае немедленно рассекают на льду; половина образца будет зафиксирована в 4% формальдегиде / PBS и залита парафином для стандартной гистологии и иммуногистохимии, а оставшаяся половина будет помещена в формы для пластиковой основы с ОКТ, мгновенно заморожена в жидком азоте и хранится при 80 (бесконечное ) C до обработки для геномного и протеомного анализа.
Гуминовая кислота способствует заживлению ран на нёбе крыс
Введение . Ранее было показано, что гуминовая кислота улучшает заживление кожных ран и проявляет антибактериальные свойства; однако он не использовался для заживления ран в полости рта.Таким образом, целью данного исследования была оценка влияния гуминовой кислоты на заживление эксцизионных ран в экспериментальном исследовании на крысах. Материалы и методы . Циркулярная рана на средне-небной поверхности была сделана в общей сложности 77 крысам Wistar с использованием 3-мм биопсийного стержня под анестезией. Животные были разделены на 4 группы: исходный уровень, контрольный солевой раствор (0,09%), глюконат хлоргексидина (0,05%) и гуминовая кислота (80 мг / кг), и их обрабатывали этими материалами в течение 7 дней. Результатов .За крысами наблюдали в течение 3 недель, чтобы отслеживать скорость закрытия ран. Как обработка гуминовой кислотой, так и обработка хлоргексидин-глюконатом приводили к статистически значимому увеличению скорости закрытия ран по сравнению с контролем солевым раствором как на 1-й, так и на 2-й неделях лечения. Обработка гуминовой кислотой ран на нёбе привела к лучшему выздоровлению по сравнению не только с контрольным физиологическим раствором, но и с обработкой хлоргексидина глюконатом. Заключение . В этом исследовании впервые в литературе было показано, что гуминовая кислота улучшает заживление ран ротовой полости.Эти данные показывают, что гуминовая кислота может использоваться в качестве альтернативы существующим методам лечения ран ротовой полости.
Обработка гуминовой кислотой ран на нёбе привела к лучшему выздоровлению по сравнению не только с контрольным физиологическим раствором, но и с обработкой хлоргексидина глюконатом. Заключение . В этом исследовании впервые в литературе было показано, что гуминовая кислота улучшает заживление ран ротовой полости.Эти данные показывают, что гуминовая кислота может использоваться в качестве альтернативы существующим методам лечения ран ротовой полости.
1. Введение
Раны в полости рта представляют собой серьезную проблему для здоровья многих людей из-за теплой микросреды полости рта, в которой обитают многие бактерии, и постоянного износа, возникающего из-за физической активности, вызванной едой и питьем [ 1, 2]. Заживление ран — сложный процесс, который характеризуется тремя стадиями: воспаление, разрастание и ремоделирование [3].Во время фазы воспаления область раны защищена от патогенов, и мертвые клетки удаляются, тогда как во время фазы пролиферации клетки, которые секретируют материалы внеклеточного матрикса, пролиферируют и секретируют большое количество белков волокнистого внеклеточного матрикса, чтобы быстро блокировать и защищать область раны против болезнетворных микроорганизмов [4]. Во время фазы ремоделирования эти фиброзные блокирующие компоненты удаляются, и образуется больше функциональной ткани.
Поскольку очень влажная и теплая среда ротовой полости является благоприятной средой для роста микробов, принято использовать антибактериальные продукты, чтобы способствовать быстрому и безинфекционному заживлению ран на небе [5, 6].Помимо уже имеющихся в продаже антибактериальных продуктов, ранее было показано, что несколько факторов способствуют заживлению небных ран [5–7].
Гуминовые вещества, которые присутствуют в основном в лигните, торфе, почве и воде, обладают противовирусными, антибактериальными, антитоксическими, противояльцерогенными, противоартритными, противоаллергическими, иммуномодулирующими и противовоспалительными свойствами [8–15]. Микроорганизмы превращают ткани растений и животных в торф [16], а гуминовые вещества, такие как перегной, торф, сапропель и мумие, использовались в медицине для различных целей против различных болезней еще 3000 лет назад [11].Токсичность гуминовой кислоты очень низкая [17]. Использование гумата приводит к уменьшению объема лапы при вызванном каррагенаном отеке у крыс [18], а гумат натрия улучшает заживление ран у крыс [19].
Микроорганизмы превращают ткани растений и животных в торф [16], а гуминовые вещества, такие как перегной, торф, сапропель и мумие, использовались в медицине для различных целей против различных болезней еще 3000 лет назад [11].Токсичность гуминовой кислоты очень низкая [17]. Использование гумата приводит к уменьшению объема лапы при вызванном каррагенаном отеке у крыс [18], а гумат натрия улучшает заживление ран у крыс [19].
В полости рта мы ранее показали, что гуминовая кислота предотвращает потерю альвеолярной кости и уменьшает воспаление у крыс [20]. Кроме того, было показано, что фульвокислота, полученная из углеводов, которая является основным компонентом гуминовых кислот, обладает антимикробной активностью широкого спектра против перорально активных микроорганизмов [21].Хотя эти результаты предполагают возможность того, что эти специфические свойства гуматов могут быть полезны для заживления ран на нёбе, в настоящее время нет доказательств, показывающих влияние гуматов на заживление ран в полости рта. Таким образом, целью данного исследования была оценка влияния гуминовой кислоты на заживление эксцизионных ран неба у крыс.
2. Материалы и методы
2.1. Животные и исследовательские группы
Протокол исследования и экспериментальный план были одобрены Комитетом по этике животных Медицинской школы Университета Джумхуриет (номер одобрения: B.30.2.CUM.0.01.00.00-50 / 59, 312). Всего в эксперименте использовали 77 трехмесячных крыс-самцов линии Вистар. Их масса тела в начале эксперимента составляла от 280 до 320 г. Крыс в каждой группе кормили в разных клетках в одинаковых условиях в хорошо освещенном и хорошо вентилируемом помещении. Всех крыс кормили ad libitum и содержали при цикле свет / темнота 12 часов / 12 часов, температуре 21 ± 1 ° C и влажности 40-60%. Крысы были акклиматизированы к окружающей среде за 10 дней до исследования, чтобы уменьшить влияние стресса на экспериментальную установку.Экспериментальные этапы этого исследования были выполнены в лаборатории животных медицинского факультета Университета Джумхуриет. Животные были случайным образом разделены на четыре группы следующим образом: (i) контрольная (C) группа (n = 5) (ii) физиологический раствор (0,9%) (S) группа (n = 24) (iii) глюконат хлоргексидина (0,05%) Группа (CHG) (n = 24) (iv) Группа гуминовой кислоты (HA) (n = 24)
Животные были случайным образом разделены на четыре группы следующим образом: (i) контрольная (C) группа (n = 5) (ii) физиологический раствор (0,9%) (S) группа (n = 24) (iii) глюконат хлоргексидина (0,05%) Группа (CHG) (n = 24) (iv) Группа гуминовой кислоты (HA) (n = 24)
Каждая основная группа была разделена на три подгруппы по 8 крыс в каждой для наблюдения изменений через 1, 2 и 3 недели.
2.2. Формирование экспериментальной небной раневой поверхности
После периода адаптации в течение 10 дней животных анестезировали гидрохлоридом ксилазина (Rompun; 10 мг / кг, Bayer Animal Health GmbH, Леверкузен, Германия) и гидрохлоридом кетамина (Ketalar; 40 мг / кг, Eczacibasi Ilac Sanayi, Стамбул, Турция) внутрибрюшинно.Инструмент для пункционной биопсии диаметром 3 мм использовался для создания стандартного кругового контура раны на переднем небе в слизистой надкостницы средней линии твердого неба. Мягкие ткани были удалены резким разрезом, чтобы обнажить подлежащую кость. На рану накладывали ватную марлю до достижения гемостаза. На протяжении всего эксперимента лекарства не использовались.
2.3. Приготовление гуминовой кислоты
Гуминовая кислота была получена из торфа, поступающего из западного региона Черного моря, и разбавлена стерильным физиологическим раствором для достижения исследуемых концентраций (80 мг / кг) [20].Концентрация микроэлементов в растворе гуминовой кислоты, таких как Si, Se, Ca, Mg, Fe и Zn, представлена в таблице 1. Титриметрический метод использовался для оценки Cl, тогда как атомно-эмиссионная спектрометрия с индуктивно связанной плазмой ( ICP-AES) использовался для всех остальных элементов.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
2.4. Процесс исследования
Пять животных были немедленно умерщвлены для получения исходных значений (группа C).Остальные 72 животных были случайным образом разделены на три экспериментальные группы. 0,5 мл 0,09% солевого раствора, 0,05% глюконата хлоргексидина (Irrisept, Irrimax Corporation, Innovation Technologies, Inc., Lawrenceville, GA) или препарата гуминовой кислоты 80 мг / кг наносили на соответствующее место раны один раз в день в течение 1 минуты каждое. день, используя ватные шарики. Восемь животных из каждой группы были умерщвлены через 7, 14 и 21 день после операции. Верхнечелюстные кости иссекали, образцы оценивали фотографически и сравнивали с гистологическими данными.
2,5. Оценка фотографий
Фотографии образцов были сделаны (25-кратное увеличение) с использованием стереомикроскопа (Stemi DV4, Carl Zeiss, Jena, Germany). Площадь поверхности раны измеряли морфометрически с помощью программы «Biowizard — D Winter, Version 3». Фотографическую оценку выполнял один эксперт (доктор Талмак), который не знал идентичности образцов.
2.6. Гистопатологическая оценка
Гистологический анализ был выполнен одним исследователем (Dr. Гозе), который также не знал, что это за образцы. Образцы фиксировали в 10% нейтральном формалине на 48 ч. Затем образцы декальцинировали в муравьиной кислоте (10%) и азотной кислоте (10%) в течение 72 часов. Затем образцы заливали парафином. Серийные срезы размером 5 мкм и м были приготовлены перпендикулярно средней линии неба на наибольшем диаметре раны с использованием микротома. Срезы окрашивали эозином и гематоксилином. Слайды оценивали на предмет гистологических изменений под световой микроскопией (Nikon Eclipse, E 600, Tokyo, Japan).
Гозе), который также не знал, что это за образцы. Образцы фиксировали в 10% нейтральном формалине на 48 ч. Затем образцы декальцинировали в муравьиной кислоте (10%) и азотной кислоте (10%) в течение 72 часов. Затем образцы заливали парафином. Серийные срезы размером 5 мкм и м были приготовлены перпендикулярно средней линии неба на наибольшем диаметре раны с использованием микротома. Срезы окрашивали эозином и гематоксилином. Слайды оценивали на предмет гистологических изменений под световой микроскопией (Nikon Eclipse, E 600, Tokyo, Japan).
2.7. Статистический анализ
Данные контрольной и экспериментальной групп сравнивали друг с другом и с исходными значениями. Статистический анализ проводился с использованием программного обеспечения SPSS и программы GraphPad Prism. Применяли двусторонний ANOVA или односторонний ANOVA с анализом множественных сравнений Тьюки и t-критерием Стьюдента.
3. Результаты
Гуминовая кислота была получена в виде пасты и дополнительно разбавлена до концентрации 80 мг / кг в физиологическом растворе. После хирургической операции фотографии участков ран были получены с помощью светового микроскопа, и изображения были измерены наблюдателем, который не знал исследуемых групп.Отрицательный контроль «физиологический раствор», положительный контроль «раствор хлоргексидина глюконата» и раствор гуминовой кислоты наносили на область раны ежедневно в течение одной минуты. Репрезентативные фотографии областей раны, сделанные с помощью светового микроскопа, показаны на рисунке 1.
После первой недели лечения была выявлена статистически значимая разница между группами с помощью однофакторного анализа ANOVA со значением p 1,89. x 10 −17 (таблица 2). Когда группы индивидуально сравнивали друг с другом с помощью теста множественных сравнений Тьюки, наблюдалась статистически значимая разница между контрольным солевым раствором и группой гуминовой кислоты, а также контрольным солевым раствором и группой хлоргексидина глюконата со значениями p 2. 06 x 10 −13 и 5,01 x 10 −13 соответственно. С другой стороны, не было статистически значимой разницы между группой гуминовой кислоты и группой хлоргексидина глюконата после одной недели лечения.
06 x 10 −13 и 5,01 x 10 −13 соответственно. С другой стороны, не было статистически значимой разницы между группой гуминовой кислоты и группой хлоргексидина глюконата после одной недели лечения.
| ||||||||||||||||||||||||||||||||||||||||||
sem = стандартная ошибка среднего и CI = доверительный интервал. | ||||||||||||||||||||||||||||||||||||||||||
В конце второй недели лечения снова измеряли площади раны и статистически анализировали группы с помощью однофакторного дисперсионного анализа. Между группами была статистически значимая разница со значением p 4,61 x 10 -10 (таблица 2).Как и в первую неделю лечения, наблюдалась статистически значимая разница между контролем с физиологическим раствором и группой гуминовой кислоты, а также контролем с физиологическим раствором и группой хлоргексидина глюконата со значениями p 9,21 x 10 -8 и 3,05 x 10 . −8 соответственно. Однако по истечении двух недель лечения статистически значимая разница между группой гуминовой кислоты и группой хлоргексидина глюконата все еще отсутствовала.
−8 соответственно. Однако по истечении двух недель лечения статистически значимая разница между группой гуминовой кислоты и группой хлоргексидина глюконата все еще отсутствовала.
Исследование проводилось в течение трех недель, и в конце исследования измерения площади раны снова сравнивали с помощью однофакторного дисперсионного анализа ANOVA, а множественные сравнения между группами выполняли с помощью критерия Тьюки.В целом, была статистически значимая разница между группами со значением p 1,94 x 10 −14 (таблица 2). Подобно измерениям на первой и второй неделе, наблюдалась статистически значимая разница между контролем с физиологическим раствором и группой гуминовой кислоты, а также контрольной группой с физиологическим раствором и группой хлоргексидина глюконата. Значения p этих сравнений составляли 3,83 x 10 −11 и 3,78 x 10 −10 , соответственно. Поразительно, но по прошествии трех недель также наблюдалась статистически значимая разница между группой гуминовой кислоты и группой хлоргексидина глюконата со значением p, равным 0.0001 (3,95 x 10 −5 ).
Когда измерения всех трех недель сравнивались с использованием двухфакторного дисперсионного анализа с повторными измерениями, была выявлена статистически значимая разница не только между неделями, но и группами лечения со значениями p 1,55 x 10 −41 и 1,68 x 10. −64 соответственно.
Когда срезы ткани были проанализированы после обработки гематоксилином и окрашиванием эозином, срезы из группы, получавшей недельную обработку, показали некротические и воспаленные области.Однако после трех недель лечения гуминовой кислотой области воспаления были значительно уменьшены, и наблюдалась грануляционная ткань с суженным эпителиальным слоем слизистой оболочки. В конце исследования срезы животных, получавших гуминовую кислоту, показали полное восстановление и заживление эпителия слизистой оболочки (рис. 2).
4.
 Обсуждение
ОбсуждениеВ этом исследовании впервые в литературе было показано, что гуминовая кислота улучшает заживление ран полости рта. Эксперименты проводились на крысах, и обработка гуминовой кислотой сравнивалась с обработкой физиологическим раствором и традиционной обработкой хлоргексидином глюконатом.
Бактериальная микрофлора полости рта очень разнообразна, и эти бактерии колонизируют раны [22]. Раны неба обычно лечат антибактериальными средствами для предотвращения инфекций. В этом исследовании мы также использовали антибактериальный материал, хлоргексидина глюконат, в качестве положительного контроля. Ранее сообщалось, что гуминовая кислота обладает антибактериальными свойствами [9, 12]; Таким образом, этот контроль позволил нам сравнить эффективность антибактериального лечения для заживления ран.В первые две недели лечения мы наблюдали положительное влияние антибактериального препарата на заживление ран в полости рта как при лечении гуминовой кислотой, так и при лечении хлоргексидин глюконатом, которые были намного более эффективными в улучшении заживления ран, чем контрольный раствор физиологического раствора. С другой стороны, в течение первых двух недель почти не было различий между группой лечения гуминовой кислотой и группой лечения хлоргексидин глюконатом, что показывает важность антибактериальных свойств для начальных стадий заживления ран.Гистологический анализ, который показал грануляционную ткань со суженным эпителиальным слоем слизистой оболочки и полное восстановление и заживление эпителия слизистой оболочки после лечения гуминовой кислотой, также подтверждает критическое влияние гуминовой кислоты на заживление ран в ранах неба.
Гуминовая кислота также обладает противовоспалительными свойствами, которые могут способствовать заживлению ран на различных тканях [10, 15, 18, 23]. Это свойство может быть более важным на более поздних стадиях заживления ран, поскольку мы наблюдали, что рана, обработанная гуминовой кислотой, заживала статистически значительно быстрее, чем раны, обработанные хлоргексидин глюконатом, на третьей неделе лечения. Кроме того, в конце трехнедельного периода лечения в ранах, обработанных гуминовой кислотой, наблюдалось уменьшение площадей воспаления по сравнению как с контрольной группой, обработанной физиологическим раствором, так и с группой, обработанной хлоргексидином, когда образцы анализировали посредством гистологического окрашивания.
Кроме того, в конце трехнедельного периода лечения в ранах, обработанных гуминовой кислотой, наблюдалось уменьшение площадей воспаления по сравнению как с контрольной группой, обработанной физиологическим раствором, так и с группой, обработанной хлоргексидином, когда образцы анализировали посредством гистологического окрашивания.
Гуминовые кислоты могут оказывать положительное влияние на заживление ран и лечение рака, как предполагает Юрчик [24]. Процесс заживления требует дополнительного кислорода, и эта потребность появляется в первую минуту после ранения из-за фагоцитоза, основного события в процессе заживления ран, который требует значительного расхода кислорода [24].
Состав гуминовой кислоты сложный, и образцы из разных регионов отличаются друг от друга. Хотя лекарственные вещества, приготовленные с использованием природных материалов в качестве исходных материалов, обычно используются и могут различаться в определенной степени в зависимости от партии, может быть полезно использовать синтетические препараты гуминовой кислоты для будущих экспериментов по заживлению ран в качестве альтернативы. к этим природным образцам, чтобы получить более химически определенные лекарственные препараты.
5. Заключение
В целом результаты этого исследования показали, что гуминовая кислота, обладающая антибактериальными и противовоспалительными свойствами, улучшает заживление ран в полости рта. Обработка гуминовой кислотой превосходила даже глюконат хлоргексидина, который широко используется для лечения ран полости рта. Насколько нам известно, это первое исследование, показывающее, что лечение гуминовой кислотой можно использовать для лечения ран в полости рта.
Доступность данных
Никакие данные не использовались для поддержки этого исследования.
Конфликт интересов
У авторов нет конфликта интересов, о котором следует раскрывать.
Модель заживления ран с уменьшенным рубцеванием
10. Фергюсон MWJ, Whitby DJ, Shah M, Armstrong J,
Siebert JW, Longaker MT. Образование рубцов: спектральная природа заживления ран у плода и взрослого человека. Пласт Реконстр
Образование рубцов: спектральная природа заживления ран у плода и взрослого человека. Пласт Реконстр
Сург 1996; 97: 854–60.
11. Суонн Д.А., Гарг Х.Г., Юнг В., Германн Х.Исследования
протеогликанов рубцовой ткани человека. J Invest Dermatol
1985; 84: 527–31.
12. Гарг Х.Г., Бурд Дар, Суонн Д.А. Малый дерматан
сульфатных протеогликанов в эпидермисе человека и
дерме. Биомед Рес 1989; 10: 197–207.
13. Longas M, Garg HG. Сульфатный состав дерматана
сульфат из рубцовой ткани. Carbohydr Res
1992; 237: 319–24.
14. Мачесни М., Тидман Н., Васим А., Кирби Л.,
Ли И.Активированные кератиноциты в эпидермисе
гипертрофических рубцов. Am J Pathol 1998; 152:
1133–41.
15. Sawicki G, Marcoux Y, Sarkhosh K, Tredget EE,
Ghahary A. Взаимодействие кератиноцитов и
фибробластовмодулирует экспрессию матричных
металлопротеиназ-2 и -9 и их ингибиторов.
Mol Cell Biochem 2005; 269: 209–16.
16. Рассел С.Б., Трупин К.М., Родригес-Итон С.,
Рассел Дж. Д., Трупин Дж. С..Пониженная потребность в факторах роста
келоидных фибробластов
может объяснить рост опухоли. Proc Natl Acad Sci USA
1998; 85: 587.
17. Чин Г.С., Лю В., Пелед З., Ли Т.Й., Штейнбрех Д.С., Сюй М
и др. Дифференциальная экспрессия трансформирующих факторов роста
-брецепторов I и II и активации Smad 3 в
келоидных фибробластах. Пласт Реконстр Сург
2001; 108: 423–9.
18. Омо-Даре П. Генетические исследования келоидов.J Natl Med
Assoc 1975; 67: 428.
19. Рамакришнан К.М., Томас К.П., Сундарараджан ЧР.
Исследование 1000 пациентов с келоидами в Южной Индии.
Пласт Реконстр Сург 1974; 51: 276.
20. Мартин К.В., Мьюир ИФК. Роль лимфоцитов в
заживлении ран. Br J Plast Surg 1990; 43: 655–62.
21. Ян Г.П., Лим И.Дж., Фан Т-Т, Лоренц Х.П., Лонгакер М.Т.
От ран плода без рубцов до келоидов: молекулярные
исследования в области заживления ран.Восстановление раны
2003; 11: 411–18.
22. Sayah DN, Soo C, Shaw VWV, Watson J, Messadi D,
Longaker MT et al. Подавление апоптоза-
родственных генов в келоидных тканях. J Surg Res 1999; 87:
209–16.
23. Burrington JD. Заживление ран у плодов ягненка.
J Pediatr Surg 1971; 6: 523–8.
24. Госс АН. Внутриматочное заживление плодных крыс орально
ран слизистой оболочки, кожи и хрящей. J Oral Pathol
1977; 6: 35–43.
25. Уитби Д. Д., Фергюсон М. В. Дж. Внеклеточный матрикс
ран губ у эмбрионов, новорожденных и взрослых мышей.
Развитие 1991; 112: 651–68.
26. Адзик Н.С., Лонгакер М.Т. Характеристики восстановления тканей плода
. В: Adzick HS, Longaker MT, редакторы:
Заживление ран плода. Нью-Йорк: издательство Elsevier,
1992: 53–70.
27. Лоренц Х.П., Лонгакер М.Т., Адзик Х.С. Плод человека
кожа: онтогенез и ремонт. В: Adzick HS, Longaker
MT, редакторы: Fetal Wound Healing.Нью-Йорк: Elsevier
Publishers, 1992: 137–47.
28. Лонгакер М.Т., Уитби Д.Д., Фергюсон М.В., Лоренц Х.П.,
Харрисон М.Р., Адзик Н.С. Раны на коже взрослого человека в среде плода
заживают с образованием рубцов. Энн Сург
1994; 219: 65–72.
29. Армстронг-младший, Фергюсон М.В.Дж. Онтогенез кожи
и переход от фенотипа без рубцов к рубцовому
во время заживления ран в сумке молодых
сумчатых Monodelphis domestica.Девл Биол
1995; 169: 242–60.
30. Армстронг-младший, Фергюсон М.В.Дж. Онтологические раны
исследования заживления у Monodelphis domestica от рождения до
зрелого возраста. В: Сондерс Н., Хайндс Л., редактор: Марсу-
Биология: последние исследования, новые перспективы.
Сидней: Издательство Университета Нового Южного Уэльса,
1997: 254–71.
31. McCallion RL, Fergusson MWJ. Заживление ран плода
и разработка методов лечения ран у взрослых
.В: Clark RAF, редактор: The
Molecular and Cellular Biology of Wound Repair,
Vol xxiii. Нью-Йорк: Plenum Press, 1996: 561–600.
32. Olutoye OO, Alaish SM, Carr Jr. ME, Paik M, Yager
DR, Cohen IK et al. Агрегативные характеристики и экспрессия рецептора адгезии коллагена
в
тромбоцитах плода
свиней. J Pediatr Surg 1995; 30: 1649–53.
33. Олутое О.О., Ягер Д.Р., Коэн И.К., Дигельманн Р.Ф.
Пониженное высвобождение цитокинов тромбоцитами плода свиньи:
возможное объяснение снижения воспаления после
ранения плода.J Pediatr Surg 1996; 31: 91–5.
34. Adzick NS, Harrison MR, Glick PL, Beckstead JH,
Villa RL, Scheuenstuhl H et al. Сравнение заживления ран плода,
новорожденного и взрослого с помощью гистологического, ферментно-гистохимического определения
и определения гидроксипролина
. J Pediatr Surg 1985; 20: 315–19.
35. Krummel TM, Nelson JM, Diegelmann RF, Lindblad
WJ, Salzberg AM, Greenfield LJ et al. Реакция плода
на травму у кролика.J Pediatr Surg 1987; 22:
640–4.
36. Коуин А.Дж., Броснан М.П., Холмс Т.М., Фергюсон М.В.
Эндогенный воспалительный ответ на кожную рану
заживление у плода и взрослой мыши. Дев Дин
1998; 212: 385–93.
37. Гавронска-Козак Б. Регенерация в ушах
иммунодефицитных мышей: идентификация и линия
Анализмезенхимальных стволовых клеток. Tiss Eng
2004; 10: 1251–65.
38. Гавронска-Козак Б, Богацки М, Рим JS,
Монро В.Т., Мануэль Дж.А.Восстановление кожи без рубцов в
Слизистая оболочка полости рта Enoch et al.
18 Хирургия полости рта 1 (2008) 11–21. © 2008 Авторы
Составление журнала © 2008 Blackwell Munksgaard
% PDF-1.3 % 56 0 объект > эндобдж xref 56 91 0000000016 00000 н. 0000002599 00000 н. 0000002662 00000 н. 0000003377 00000 н. 0000003576 00000 н. 0000003787 00000 н. 0000004006 00000 н. 0000004587 00000 н. 0000004799 00000 н. 0000004858 00000 н. 0000005319 00000 н. 0000005946 00000 н. 0000006233 00000 н. 0000006677 00000 н. 0000006721 00000 н. 0000007381 00000 п. 0000007812 00000 н. 0000008019 00000 п. 0000008475 00000 н. 0000008941 00000 н. 0000009287 00000 н. 0000009752 00000 н. 0000009951 00000 н. 0000010663 00000 п. 0000011537 00000 п. 0000012018 00000 н. 0000012487 00000 п. 0000012847 00000 п. 0000013206 00000 п. 0000013938 00000 п. 0000014695 00000 п. 0000015072 00000 п. 0000015320 00000 н. 0000015499 00000 н. 0000015849 00000 п. 0000016127 00000 п. 0000016179 00000 п. 0000016233 00000 п. 0000016992 00000 н. 0000017391 00000 п. 0000020166 00000 п. 0000022086 00000 п. 0000022313 00000 п. 0000025606 00000 п. 0000028038 00000 п. 0000028084 00000 п. 0000028318 00000 п. 0000031693 00000 п. 0000032059 00000 п. 0000032424 00000 п. 0000032521 00000 п. 0000033850 00000 п. 0000034099 00000 п. 0000034443 00000 п. 0000034515 00000 п. 0000035478 00000 п. 0000035706 00000 п. 0000036020 00000 п. 0000036075 00000 п. 0000036671 00000 п. 0000036902 00000 н. 0000037196 00000 п. 0000037260 00000 п. 0000038084 00000 п. 0000038313 00000 п. 0000038619 00000 п. 0000039296 00000 п. 0000039513 00000 п. 0000040886 00000 п. 0000041119 00000 п. 0000041539 00000 п. 0000041750 00000 п. 0000044278 00000 п. 0000044544 00000 п. 0000046551 00000 п. 0000046805 00000 п. 0000049506 00000 п. 0000049771 00000 п. 0000050217 00000 п. 0000050332 00000 п. 0000051122 00000 п. 0000051161 00000 п. 0000051573 00000 п. 0000051664 00000 п. 0000052395 00000 п. 0000052434 00000 п. 0000052880 00000 п. 0000052995 00000 п. 0000053782 00000 п. 0000053821 00000 п. 0000002116 00000 н. трейлер ] / Назад 141262 >> startxref 0 %% EOF 146 0 объект > поток hb«f`hf`g`Pz
Влияние антисептических гелей на микробиологическую колонизацию шовных нитей после челюстно-лицевой хирургии
Wes, J. T., Verweij, J. P., van der Ploeg, T., van Merkesteyn, J. P. R. и de Mol van Otterloo, J. J. Разрез третьего моляра в Нидерландах. Техника разрезов для удаления ретинированных третьих моляров нижней челюсти. Нед Тейдшр Тандхилкд 124 , 639–643 (2017).
CAS PubMed Статья Google ученый
Шварц-Арад, Д., Липовский, А., Пардо, М., Адут, О., Долев, Э.Интерпретация осложнений после удаления третьего моляра. Quintessence Int , 41-47 (2017).
Торторичи, С. и др. . Распространенность и распространение одонтогенных кист на Сицилии: 1986-2005 гг. J. Oral Sci. 50 , 15–18 (2008).
PubMed Статья Google ученый
Алвес-Перейра, Д., Перейра-Силва, Д., Фигейредо, Р., Гей-Эскода, К. и Вальмаседа-Кастельон, Э.Факторы, связанные с клиницистом, обуславливающие решение об удалении бессимптомного нижнего третьего моляра. Поперечное исследование, проведенное испанскими и португальскими дантистами. Med Oral Patol Oral Cir Bucal 22 , e60 – e615 (2017).
Google ученый
Лопес В., Муменя Р., Фейнманн К. и Харрис М. Хирургия третьего моляра: проверка показаний к операции, послеоперационных жалоб и удовлетворенности пациентов. руб. J. Oral Maxillofac. Surg. 33 , 33–35 (1995).
CAS PubMed Статья Google ученый
Jo, Y. et al. . Ускоренное биоразложение шелковых швов за счет активации матричной металлопротеиназы за счет включения 4-гексилрезорцина. Научный сотрудник 7 , 42441 (2017).
ADS CAS PubMed PubMed Central Статья Google ученый
Khoorjestan, S. M., Rouhi, G. & Toolabi, K. Исследование влияния рисунков швов на механическую прочность кишечного анастомоза: экспериментальное исследование. Biomed Tech (Berl) 62 , 429–437 (2017).
Артикул Google ученый
Гонсалес-Барнадас, А. и др. . In vitro Исследование прочности на разрыв техники и материала наложения швов. J Oral Implantol 43 , 169–174 (2017).
PubMed Статья Google ученый
Canales, J., Espinoza-Montes, C. & Alarcón-Palacios, M. Material de suturas en periodoncia e implantes. Rev.estomatol.Hered 23 , 148–153 (2013).
Google ученый
Уэйт, П. Д. и Черала, С. Хирургические результаты хирургических вмешательств без наложения швов у 366 пациентов с поражением третьего моляра. J. Oral Maxillofac. Surg. 64 , 669–673 (2006).
PubMed Статья Google ученый
Фариа, Р. Л. и др. . Противомикробная активность календулы лекарственной, камелии китайской и хлоргексидина против прикрепления микроорганизмов к швам после удаления непрорезавшихся третьих моляров. J. Appl. Oral Sci. 19 , 476–482 (2011).
CAS PubMed PubMed Central Статья Google ученый
Banche, G. и др. . Микробная адгезия к различным внутриротовым шовным материалам у пациентов, перенесших стоматологические операции. J. Oral Maxillofac. Surg. 65 , 1503–1507 (2007).
PubMed Статья Google ученый
Салинас, Б. М., Риу, Н. К., Айтес, Л. Б. и Эскода, К. Г. Чувствительность бактерий, вызывающих одонтогенные инфекции, к антибиотикам. Med Oral Patol Oral Cir Bucal 11 , 70 (2006).
Google ученый
Родригес Санчес, Ф., Родригес Андрес, К. и Артеагоитиа Кальво, И. Предотвращает ли хлоргексидин альвеолярный остит после удаления третьего моляра? Систематический обзор и метаанализ. J. Oral Maxillofac. Surg. 75 , 901–914 (2017).
PubMed Статья Google ученый
Ларсен П. Э. Влияние полоскания хлоргексидином на частоту альвеолярного остита после хирургического удаления ретинированных третьих моляров нижней челюсти. J. Oral Maxillofac. Surg. 49 , 932–937 (1991).
CAS PubMed Статья Google ученый
Tomas, I. et al. . Влияние жидкости для полоскания рта с хлоргексидином на риск постэкстракционной бактериемии. Заражение. Control Hosp. Эпидемиол. 28 , 577–582 (2007).
CAS PubMed Статья Google ученый
Isoshima, D. и др. . Оценка патогенеза инфекционного эндокардита по тесту титра антител IgG к пародонту. Clin Case Rep 5 , 1580–1586 (2017).
PubMed PubMed Central Статья Google ученый
Lockhart, P. B. & Durack, D. T. Микрофлора полости рта как причина эндокардита и других инфекций отдаленных участков. Заражение. Дис. Clin.North Am. 13 , 83–50, vi (1999).
Артикул Google ученый
Балехо, Р. Д. П. и др. . Эффекты предварительного полоскания хлоргексидином на бактериемию у пациентов с пародонтом: рандомизированное клиническое исследование. J Appl Oral Sci 25 , 586–595 (2017).
CAS PubMed PubMed Central Статья Google ученый
Groppo, F. C., Ramacciato, J. C., Simoes, R. P., Florio, F. M. & Sartoratto, A. Антимикробная активность чеснока, масла чайного дерева и хлоргексидина в отношении микроорганизмов полости рта. Внутр. Вмятина. J. 52 , 433–437 (2002).
CAS PubMed Статья Google ученый
Риндом Шиотт, К. и др. . Влияние ополаскивателей с хлоргексидином на микрофлору ротовой полости человека. J. Periodont.Res. 5 , 84–89 (1970).
Артикул Google ученый
Marrelli, M., Amantea, M. & Tatullo, M. Сравнительное, рандомизированное, контролируемое исследование клинической эффективности и уменьшения окрашивания зубов жидкости для полоскания рта, содержащей хлоргексидин 0,20% и систему против обесцвечивания (ADS). Ann Stomatol (Roma) 6 , 35–42 (2015).
Google ученый
Watts, A. & Addy, M. Изменение цвета и окрашивание зубов: обзор литературы. руб. Вмятина. J. 190 , 309–316 (2001).
CAS PubMed Статья Google ученый
Ван, М., Маркс, Л. Э. и Франк, М. Е. Кодирование вкуса после селективного ингибирования хлоргексидином. Chem. Чувства 34 , 653–666 (2009).
CAS PubMed PubMed Central Статья Google ученый
Hepso, H.U., Bjornland, T. & Skoglund, L.A. Побочные эффекты и приемлемость для пациентов 0,2% против 0,1% хлоргексидина, используемого в качестве послеоперационной профилактической жидкости для полоскания рта. Внутр. J. Oral Maxillofac. Surg. 17 , 17–20 (1988).
CAS PubMed Статья Google ученый
Ван дер Вейден, Г. А., Тен Хеггелер, Дж. М., Слот, Д. Э., Розема, Н. А. и Ван дер Фельден, У. Набухание околоушной железы после использования полоскания для рта. Внутр. J. Dent. Hyg. 8 , 276–279 (2010).
PubMed Статья Google ученый
Filoche, S. K., Soma, K. & Sissons, C. H. Противомикробные эффекты эфирных масел в сочетании с диглюконатом хлоргексидина. Oral Microbiol. Иммунол. 20 , 221–225 (2005).
CAS PubMed Статья Google ученый
Марья, К.М. и др. . Эффективность хлоргексидина, ксилита и хлоргексидина + ксилита против зубного налета, гингивита и Streptococcus mutans в слюне Загрузить: рандомизированное контролируемое исследование. Oral Health Prev Dent 15 , 529–536 (2017).
PubMed Google ученый
Flotra, L., Gjermo, P., Rolla, G. & Waerhaug, J. Побочные эффекты жидкостей для полоскания рта с хлоргексидином. Сканд. Дж.Вмятина. Res. 79 , 119–125 (1971).
CAS PubMed Google ученый
Motamedi, M. R. K. & Khazaei, S. Биоадгезивный гель хлоргексидина для снижения заболеваемости альвеолярным оститом: систематический обзор и метаанализ рандомизированных контролируемых исследований. Стоматологические гипотезы 5 , 35 (2014).
Артикул Google ученый
Сенель, С. и др. . Хитозановые пленки и гидрогели хлоргексидина глюконата для доставки через слизистые оболочки полости рта. Внутр. J. Pharm. 193 , 197–203 (2000).
CAS PubMed Статья Google ученый
Decker, E. M., von Ohle, C., Weiger, R., Wiech, I. & Brecx, M. Синергетическая комбинация хлоргексидин / хитозан для улучшенных стратегий борьбы с зубным налетом. J. Пародонтология. Res. 40 , 373–377 (2005).
CAS PubMed Статья Google ученый
Франк, Л. А. и др. . Использование хитозана в качестве катионного покрытия или гелевого носителя для полимерных нанокапсул: увеличение проникновения и адгезии имиквимода в ткани влагалища. Eur J Pharm Biopharm 114 , 202–212 (2017).
CAS PubMed Статья Google ученый
Рамирес, М. А., Кабрера, Г., Гутьеррес, А. и Родригес, Т. Методология для обеспечения качества жизни в бахасе температурас в части жизни на лангосте. Cultivos Tropicales 21 , 81–84 (2000).
Google ученый
Kamjumphol, W., Chareonsudjai, P. & Chareonsudjai, S. Антибактериальная активность хитозана против Burkholderia pseudomallei. Microbiologyopen (2017).
D’Almeida, M. et al. . Хитозановое покрытие как антибактериальная поверхность для биомедицинских применений. PLoS ONE 12 , e0189537 (2017).
PubMed PubMed Central Статья CAS Google ученый
Zheng, L. & Zhu, J. Исследование антимикробной активности хитозана с разной молекулярной массой. Carbohydr. Polym. 54 , 527–530 (2003).
CAS Статья Google ученый
Leuba, J. L. & Stossel, P. в Хитин в природе и технологии 215-222 (Springer, 1986).
Мораес, П. К. Д. и др. . Восстановление костных дефектов с помощью хитозан-коллагеновой биомембраны и каркаса, содержащего алюминатный цемент кальция. Braz Dent J 28 , 287–295 (2017).
PubMed Статья Google ученый
Живанович, С., Ли, Дж., Дэвидсон, П.М. и Кит, К. Физические, механические и антибактериальные свойства пленок из смеси хитозан / ПЭО. Биомакромолекулы 8 , 1505–1510 (2007).
CAS PubMed Статья Google ученый
Shamloo, A., Sarmadi, M., Aghababaie, Z. & Vossoughi, M. Ускоренное заживление ран на всю толщину за счет длительной доставки bFGF на основе гидрогеля PVA / хитозана / желатина, включающего микросферы PCL. Int J Pharm (2017).
Berce, C. et al. . Заживление кожных ран с использованием полимерных хирургических повязок на основе хитозана, гиалуроната натрия и ресвератрола. Доклиническое экспериментальное исследование. Colloids Surf B Biointerfaces 163 , 155–166 (2017).
PubMed Статья CAS Google ученый
Уэно, Х., Мори, Т. и Фуджинага, Т. Актуальные составы и применение хитозана для заживления ран. Adv. Препарат Делив. Ред. 52 , 105–115 (2001).
CAS PubMed Статья Google ученый
Raval, N., Khunt, D. & Misra, M. Доставка триамцинолона ацетонида в задний сегмент глаза на основе микроэмульсии с использованием хитозана и сливочного масла в качестве усилителя проницаемости: An in vitro и in vivo изучение. J Microencapsul , 1-37 (2018).
Ван, Т. и др. . Гидрогели, содержащие наночастицы хитозана, способствуют заживлению кожных ран за счет модуляции активных форм кислорода. Artif Cells Nanomed Biotechnol , 1-12 (2017).
Али А. и Ахмед С. Обзор хитозана и его нанокомпозитов в доставке лекарств. Внутр. J. Biol. Макромол. 109 , 273–286 (2017).
PubMed Статья CAS Google ученый
Леффлер К. и Мюллер Б. В. Влияние типа кислоты на физические свойства хитозано-желатиновых губок и свойства высвобождения лекарств. Внутр. J. Pharm. 194 , 229–237 (2000).
CAS PubMed Статья Google ученый
Прабахаран, М. и Мано, Дж. Ф. Частицы на основе хитозана как системы контролируемой доставки лекарств. Drug Deliv. 12 , 41–57 (2005).
CAS PubMed Статья Google ученый
Wang, X. и др. . Исследование свертывания крови N-алкил хитозановой нановолоконной мембраны in vitro . Биомакромолекулы (2018).
Рао, С. Б. и Шарма, С. П. Использование хитозана в качестве биоматериала: исследования его безопасности и гемостатического потенциала. J. Biomed. Матер. Res. 34 , 21–28 (1997).
CAS PubMed Статья Google ученый
Ли З., Рамай Х. Р., Хауч К. Д., Сяо Д. и Чжан М. Гибридные каркасы хитозан-альгинат для инженерии костной ткани. Биоматериалы 26 , 3919–3928 (2005).
CAS PubMed Статья Google ученый
Liang, X. et al. . Каучуковые гидрогели хитозана / каррагинана, сконструированные с помощью системы электронейтральности, и их возможное применение в качестве хрящевых каркасов. Биомакромолекулы (2018).
Хсу, С. Х. и др. . Оценка комплексов хитозан-альгинат-гиалуронат, модифицированных RGD-содержащим белком, в качестве каркасов тканевой инженерии для регенерации хряща. Artif. Органы 28 , 693–703 (2004).
CAS PubMed Статья Google ученый
Shin, S. Y. et al. . Биологическая оценка хитозановой нановолоконной мембраны для управляемой регенерации кости. J. Periodontol. 76 , 1778–1784 (2005).
CAS PubMed Статья Google ученый
Lin, DM, Kalachandra, S., Valiyaparambil, J. & Offenbacher, S. Полимерное устройство для доставки антимикробных и противогрибковых препаратов в среду полости рта: влияние температуры и среды на скорость высвобождения лекарства. Вмятина. Матер. 19 , 589–596 (2003).
CAS PubMed Статья Google ученый
Бертолами, С. в Ремонт мягких и твердых тканей (Praeger Press, 1984).
Casale, M. et al. . Систематический обзор: эффективность местного применения гиалуроновой кислоты при язвах в полости рта. J. Biol. Regul. Гомеост. Агенты 31 (2017).
Casale, M. et al. . Гиалуроновая кислота: перспективы в стоматологии. Систематический обзор. Int J Immunopathol Pharmacol 29 , 572–582 (2016).
CAS PubMed PubMed Central Статья Google ученый
Ансари, С. и др. . Мезенхимальные стволовые клетки человека, происходящие из пародонтальных связок и десен, способствуют регенерации нервов при инкапсулировании в трехмерный каркас из альгината / гиалуроновой кислоты. Adv Healthc Mater 6 (2017).
Lopez, M. A. et al. . Использование гиалуроновой кислоты в качестве адъюванта при лечении пародонтита. J. Biol. Regul. Гомеост. Агенты 31 (2017).
Пирназар, П. и др. . Бактериостатическое действие гиалуроновой кислоты. J. Periodontol. 70 , 370–374 (1999).
CAS PubMed Статья Google ученый
Sakai, A. et al. . Возможная роль высокомолекулярного гиалуронана в антикандидозной активности эпителиальных клеток ротовой полости человека. Med. Mycol. 45 , 73–79 (2007).
CAS PubMed Статья Google ученый
Ли, Дж. Х., Юнг, Дж. Ю. и Банг, Д. Эффективность местного 0,2% геля гиалуроновой кислоты при рецидивирующих язвах ротовой полости: сравнение рецидивирующих афтозных язв и язв во рту при болезни Бехчета. J. Eur. Акад. Дерматол. Венереол. 22 , 590–595 (2008).
CAS PubMed Статья Google ученый
Бансал, Дж., Кедидже, С. Д. и Ананд, С. Гиалуроновая кислота: многообещающий медиатор для регенерации пародонта. Индиан Дж. Дент. Res. 21 , 575–578 (2010).
PubMed Статья Google ученый
Szolnoky, G., Szendi-Horváth, K., Seres, L., Boda, K. & Kemény, L. Ручной лимфодренаж эффективно уменьшает послеоперационный отек лица и дискомфорт после удаления поврежденных третьих моляров. Лимфология 40 , 138–142 (2007).
CAS PubMed Google ученый
Латт, М. М., Киаттаворнчароен, С., Бунсирисет, К., Пааручвей, В. и Вонгсирихат, Н. Эффективность инъекции дексаметазона при послеоперационной боли при хирургии третьего моляра нижней челюсти. Журнал стоматологической анестезии и медицины боли 16 , 95 (2016).
PubMed PubMed Central Статья Google ученый
Пелл, Г. Дж. И Грегори, Б. Т. Ретинированные третьи моляры нижней челюсти: классификация и модифицированные методы удаления. Дент Дайджест 39 , 330–338 (1933).
Google ученый
Winter, G. B. in Принципы экзодонтии в применении к ретинированному третьему моляру нижней челюсти: полный трактат по оперативной технике с клиническими диагнозами и рентгенографическими интерпретациями (American Medical Book Company, 1926).
Bloemen, M. C., Boekema, B. K., Vlig, M., van Zuijlen, P. P. & Middelkoop, E.Анализ цифровых изображений по сравнению с клинической оценкой эпителизации раны: валидационное исследование. Бернс 38 , 501–505 (2012).
CAS PubMed Статья Google ученый
Falci, S. G. et al. . Связь между наличием частично прорезавшегося третьего моляра нижней челюсти и наличием кариеса в дистальной части вторых моляров. Внутр. J. Oral Maxillofac. Surg. 41 , 1270–1274 (2012).
CAS PubMed Статья Google ученый
Раафат Д. и Сахл Х. Хитозан и его противомикробный потенциал — критический обзор литературы. Микробная биотехнология 2 , 186–201 (2009).
CAS PubMed PubMed Central Статья Google ученый
Эмилсон, К. Г. Потенциальная эффективность хлоргексидина против стрептококков mutans и кариеса зубов человека. J. Dent. Res. 73 , 682–691 (1994).
CAS PubMed Статья Google ученый
Чавес де Пас, Л. Э., Ресин, А., Ховард, К. А., Сазерленд, Д. С. и Вейсе, П. Л. Антимикробное действие наночастиц хитозана на биопленки стрептококка mutans. Заявл. Environ. Microbiol. 77 , 3892–3895 (2011).
CAS PubMed PubMed Central Статья Google ученый
Ким, Дж. И Шин, Д. Ингибирующее действие на Streptococcus mutans и механические свойства хитозан-содержащей композитной смолы. Восстановительная стоматология и эндодонтия 38 , 36–42 (2013).
Артикул Google ученый
Малик, С., Танежа, С., Чадха, Р. и Кумари, М. Влияние хитозана на замедленное высвобождение хлоргексидина — исследование in vitro . Journal of Dental Specialties 4 , 21–25 (2016).
Артикул Google ученый
Мадрасо-Хименес, М. и др. . Влияние местного геля, содержащего хитозан, 0,2% хлоргексидин, аллантоин и десантенол, на процесс заживления ран после экстракции поврежденного третьего моляра нижней челюсти. Med. Oral Patol. Oral Cir. Bucal 21 , e69 – e702 (2016).
Google ученый
Перес-Саянс, М., Сомоса-Мартин, Дж. М., Баррос-Ангуейра, Ф., Рей, Дж. М. и Гарсиа-Гарсиа, А. Роль RANK / RANKL / OPG в дистракционном остеогенезе. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Эндод. 109 , 679–686 (2010).
PubMed Статья Google ученый
Дай Т., Танака М., Хуанг Ю. и Хамблин М. Р. Хитозановые препараты для лечения ран и ожогов: антимикробные и ранозаживляющие эффекты. Экспертный обзор противоинфекционной терапии 9 , 857–879 (2011).
CAS PubMed PubMed Central Статья Google ученый
Сила слюны: противомикробные средства и не только
Образец цитирования: Вила Т., Ризк А.М., Султан А.С., Джабра-Ризк М.А. (2019) Сила слюны: противомикробное средство и не только. PLoS Pathog 15 (11): e1008058. https://doi.org/10.1371 / journal.ppat.1008058
Редактор: Дебора А. Хоган, Медицинская школа Гейзеля в Дартмуте, США
Опубликовано: 14 ноября 2019 г.
Авторские права: © 2019 Vila et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Работа в этой публикации была поддержана Национальным институтом аллергии и инфекционных заболеваний NIH под номером R01AI130170 (NIAID).Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Привратник полости рта
Полость рта — главный портал проникновения патогенов, которые могут привести к изменению нормальной микрофлоры [1]. Гомеостаз полости рта поддерживается слюной, внеклеточной жидкостью, вырабатываемой слюнными железами и секретируемой во рту через отверстия, называемые слюнными протоками [2].Есть три пары больших слюнных желез и сотни маленьких (второстепенных) желез; главными железами являются околоушные (расположены перед каждым ухом и чуть ниже), подчелюстные (расположены под челюстью) и подъязычные железы (расположены под языком) (рис. 1). Человеческая слюна на 99% состоит из воды, и, по оценкам, здоровый человек производит 600 мл в день; однако во время сна количество падает почти до 0 [3, 4]. Слюна выполняет ключевые функции во рту, включая поддержание гигиены полости рта, смазку, жевание и проглатывание пищи (рис. 2).Кроме того, слюна содержит несколько важных ферментов, таких как амилаза, лизоцим и липаза, и поэтому процесс пищеварения начинается в тот момент, когда пища попадает в рот [4]. Важно отметить, что слюна имеет решающее значение для защиты от микробов, поскольку она богата антимикробными соединениями, такими как перекись водорода, лактоферрин и лизоцимы [3, 5]. Следовательно, помимо влияния на вкус, жевание и глотание, нарушения секреции слюны увеличивают частоту заболеваний полости рта, таких как кандидоз полости рта, болезни десен и кариес, а также инфекции дыхательных путей [4, 6].Ксеростомия (субъективное ощущение сухости во рту) и гипофункция слюны (клинически объективное снижение выработки слюны) являются наиболее частыми побочными эффектами лекарств; однако ВИЧ-СПИД и аутоиммунные заболевания также могут приводить к дисфункции слюнной железы [2]. Кроме того, хотя и нечасто, камни (сиалолиты) в протоках желез могут препятствовать оттоку слюны, а инфекции или опухоли в слюнных железах также могут влиять на функцию слюны. Важно отметить, что люди со всеми этими состояниями, как правило, очень предрасположены к кандидозу полости рта, вероятно, из-за нарушения антимикробных эффекторов слюны [6].Таким образом, стало очевидно, что слюна обладает бесконечным множеством полезных защитных и лечебных свойств, особенно в отношении защиты от микробных обитателей полости рта, как комменсалов, так и патогенов.
Рис. 1. Анатомическое расположение основных слюнных желез человека и их слюнный вклад.
На второстепенные слюнные железы (не показаны) также приходится примерно 10% общего слюнного секрета. Вклад слюны в круговую диаграмму показан в состоянии покоя; различия в слюне / железе могут наблюдаться при анализе слюны из стимулированных состояний.
https://doi.org/10.1371/journal.ppat.1008058.g001
Microbial curator
Теплая, богатая питательными веществами и влажная среда в полости рта способствует росту разнообразной микрофлоры, включая постоянные и временные бактерии и грибы [1]. Слюна играет двойную роль в модулировании прикрепления и колонизации микробов во рту. Зубная эмаль покрыта пленкой из слюнных пленок и белков, богатых пролином, которые бактерии (такие как Streptococcus gordonii , Actinomyces naeslundii и Porphyromonas gingivalis и дрожжи) используют как рецепторы для прилипания к поверхности зубов и предотвращения их уничтожения. [7].С другой стороны, связывание микроорганизмов с подобными рецепторами в слюне растворимой фазы увеличивает микробный клиренс, способствуя агглютинации и блокируя поверхностные адгезины [7]. Хорошо известно, что слюна участвует в манипулировании колонизацией и ограничивает прикрепление микроорганизмов к тканям полости рта; однако важность слюны как компонента иммунитета хозяина недооценивается. Фактически слюна богата эффекторами, которые проявляют прямую антимикробную активность, например, ферментативное разрушение стенок бактериальных клеток лизоцимом и секвестирование железа лактоферрином [4, 5].Однако наиболее значимыми компонентами слюны, участвующими в защите от микробных видов, являются антимикробные пептиды, которые играют жизненно важную роль в врожденном иммунитете, поскольку они часто составляют первую линию защиты от микробных захватчиков [5, 8]. Из-за их положительного заряда общий механизм действия этих пептидов включает связывание с отрицательно заряженной поверхностью микробных мембран, формирование пор, что в конечном итоге приводит к летальному исходу жизненно важных компонентов клетки [9, 10]. Среди наиболее охарактеризованных антимикробных пептидов в слюне — дефенсины, кателицидины и гистатины; эти разнообразные пептиды могут также синергетически взаимодействовать, ограничивая микробную колонизацию [11].Человеческие β-дефенсины представляют собой семейство эволюционно консервативных катионных пептидов, в основном продуцируемых популяциями эпителиальных и иммунных клеток [12]. Эти многофункциональные пептиды обеспечивают взаимодействие между хозяином и микробами и, следовательно, играют ключевую роль в поддержании здорового и динамического равновесия в системе слизистой оболочки полости рта [13]. Кателицидины — еще одна группа антимикробных пептидов широкого спектра действия, происходящих как из нейтрофилов, так и из слюнных желез, которые играют важную роль в заживлении ран, иммуномодуляции и ангиогенезе [2, 11].Однако гистатины, семейство из 12 богатых гистидином катионных пептидов, уникальны тем, что они вырабатываются исключительно слюнными железами людей и высших приматов [14]. Хотя гистатины проявляют антимикробную активность широкого спектра против широкого круга микроорганизмов полости рта, гистатин-5, в частности, обладает мощной противогрибковой активностью, в первую очередь против грибкового патогена Candida albicans [15]. Хотя механизм действия гистатина-5 на грибковую клетку, вероятно, является многофакторным, было показано, что этот процесс включает связывание гистатина-5 со специфическими рецепторами на клеточной стенке грибов и последующее внутриклеточное поглощение, при котором он нацеливается на митохондрии, в конечном итоге нарушая клеточный гомеостаз [16, 17].Помимо гистатина-5, статерин — еще один пептид слюны, секретируемый околоушными и подчелюстными железами, обладающий важной противогрибковой активностью. Было показано, что Statherin при определенных условиях индуцирует C . albicans переход гиф из гиф в дрожжи, что может оказывать защитное действие на слизистую оболочку полости рта, сохраняя C . albicans в форме комменсальных дрожжей [18].
Кандидоз слюны и полости рта
C . albicans — плеоморфный вид грибов, который растет как шаровидные дрожжи в своей комменсальной форме, но может переходить в инвазивную нитчатую форму, способную проникать в ткани и вызывать различные заболевания слизистой оболочки, такие как кандидоз полости рта или молочница [19].Секреция слюны важна для поддержания комменсального состояния C . albicans во рту, поскольку он сильно обогащен противогрибковыми белками, такими как гистатин-5, что помогает ограничить C . albicans и прикрепления к оральному эпителию [20]. Поэтому неудивительно, что гипофункция слюны, характеризующаяся уменьшением или отсутствием слюноотделения, предрасполагает к кандидозу. Гипофункция слюны, как следствие химиолучевой терапии, является частым ятрогенным осложнением, связанным с лечением, у пациентов с раком головы и шеи [6].Однако гипофункция слюны также считается признаком синдрома Шегрена (СС), хронического воспалительного аутоиммунного заболевания, которым страдают 1–4 миллиона человек в США, при котором иммунные клетки атакуют и разрушают слюнные железы [21]. Напротив, пациенты с СС и кандидозом полости рта также показали повышенный уровень кальпротектина в слюне, другого антимикробного пептида, возможно, из-за транссудации слизистой оболочки воспаленной слизистой [22]. Кроме того, сообщается, что на функцию слюнных желез влияет ВИЧ-инфекция [23].Интересно, что хотя связь еще предстоит полностью изучить, клиническое исследование по оценке продукции гистатина-5 продемонстрировало значительно сниженные уровни пептида в слюне ВИЧ- + индивидуумов, что сопровождалось усилением кандидозной колонизации [24]. Точно так же у пациентов с синдромом гипер-IgE, редким врожденным иммунодефицитом, который приводит к резкому дефициту Th27, также было показано нарушение продукции антимикробных пептидов, включая β-дефенсин 2 и гистатины слюны [25].Несмотря на то, что этиология заболевания сильно различается, пациенты с этими разными нарушениями слюнной системы, как известно, очень предрасположены к кандидозу полости рта, отчасти из-за нарушения защитных сил организма, что, помимо снижения уровня антимикробных пептидов в слюне, может включать потерю функции клеток врожденного иммунитета. и / или вербовка [5, 26].
Beyond
Хотя полость рта подвержена многочисленным травмам, которые приводят к ранам или изъязвлениям, таким как прикус языка и щек, травмы в результате стоматологических процедур или случайные травмы, известно, что раны полости рта обычно заживают в значительной степени. быстрее кожных повреждений [27].Эта глубокая заживляющая способность полости рта в основном объясняется ранозаживляющими свойствами слюны и, в частности, естественными факторами роста, которые играют наиболее важную роль в процессе заживления ран [28]. Основные факторы роста, обнаруженные в слюне с заявленными ранозаживляющими свойствами, включают эпидермальный фактор роста (EGF), фактор роста эндотелия сосудов (VEGF), трансформирующий фактор роста альфа (TFG-α), трансформирующий фактор роста бета (TFG-β), рост нервов. фактор (NGF), фактор роста фибробластов (FGF) и инсулиноподобный фактор роста (IGF) [4, 27].Более того, многие дополнительные факторы способствуют регенерации ран полости рта, такие как ингибитор секреторной лейкоцитарной протеазы (SLPI), который предотвращает деградацию ключевых белков, участвующих в восстановлении соединительной ткани, и фактор трилистника 3 (TFF3), который увеличивает миграцию ротовой полости эпителиальные клетки [4]. Интересно, что в дополнение к их антимикробной активности было показано, что гистатины обладают свойствами заживления ран, усиливая процесс реэпителизации и способствуя адгезии эндотелиальных клеток [28, 29].Примечательно, что опиорфин, сильнодействующее натуральное обезболивающее, также присутствует в слюне; это эндогенное соединение, впервые выделенное из слюны человека, продлевает собственные защитные силы организма, предотвращая расщепление химических веществ, которые активируют опиатные рецепторы, которые блокируют поступление сигналов боли в мозг [30].
Слюномика: биомаркеры и молекулярные сигнатуры
Традиционно для скрининга, диагностики и прогнозирования многих заболеваний используются образцы крови.Однако слюна человека является богатым резервуаром различных белков и пептидов, и в последние годы стало очевидно, что составляющие слюны заметно изменяются в ответ на определенные болезненные состояния. Благодаря недавним достижениям в молекулярной биологии более 100 молекул, обнаруженных в образцах слюны, оцениваются как потенциальные диагностические или прогностические биомаркеры для различных состояний, включая кариес зубов, пародонтоз, рак, диабет и многие другие системные заболевания [3].Фактически, по инициативе Национального института стоматологических и черепно-лицевых исследований была создана дорожная карта по использованию пероральных жидкостей в качестве диагностической среды для тщательного изучения здоровья и статуса болезни пациентов [31]. Введенный в 2008 году термин «слюномика» был направлен на то, чтобы подчеркнуть быстрое развитие знаний о различных «омических» составляющих слюны, включая протеом, транскриптом, метаболом и микробиом [32]. Благодаря интеграции этих технологий в анализ слюны, слювомика представляет собой новый подход к диагностике, прогнозу и мониторингу заболеваний полости рта [33].Разработка надежных биосенсоров для измерения уровней метаболических соединений, микроорганизмов, онкологических маркеров и лекарств в слюне открыла новые горизонты для изучения взаимодействий хозяин-патоген и клинической диагностики слюны [34]. Важно отметить, что в качестве диагностической среды слюна имеет несколько преимуществ, поскольку ее сбор, отбор и обработка являются быстрыми, недорогими и неинвазивными; и, таким образом, эта пероральная биожидкость может заменить кровь при скрининге, диагностике и прогнозировании заболеваний [3].По мере того, как эта область продолжает развиваться, некоторые из проблем, которые необходимо будет решить, включают корреляцию между уровнями маркеров в слюне и сыворотке, влияние скорости потока слюны и стимуляции на концентрацию маркеров слюны, а также влияние протеолитических ферментов. полученных из организма-хозяина и микроорганизмов полости рта на стабильность определенных диагностических маркеров. Кроме того, определенные системные расстройства, многочисленные лекарства и химиолучевое лечение могут влиять на функцию слюнных желез и, следовательно, на объем и состав слюны, что в конечном итоге может влиять на диагностическую ценность многих компонентов слюны [31].
Заключительные замечания
Впечатляющий набор разнообразных функций слюны ясно демонстрирует способность этой пероральной биожидкости выйти за рамки «антимикробной» функции. Важно отметить, что недооцененное богатство полезных и целебных свойств слюны на слизистой оболочке полости рта отражается на истинной пользе выделений нашего хозяина.
Ссылки
- 1. Султан А.С., Конг Э.Ф., Джабра-Ризк МА. Микробиом полости рта: урок сосуществования.PLoS Pathog. 2018; 14 (1): e1006719. pmid: 29370304
- 2. Амеронген А., Веерман Э. Слюна: защитник полости рта. Oral Dis. 2002. 8 (1): 12–22. pmid: 11936451
- 3. Zhang CZ, Cheng XQ, Li JY, Zhang P, Yi P, Xu X и др. Слюна в диагностике болезней. Int J Oral Sci. 2016 8 (3): 133–7. pmid: 27585820
- 4. Dawes C, Pedersen AM, Villa A, Ekström J, Proctor GB, Vissink A, et al. Функции слюны человека: обзор, спонсируемый Всемирным семинаром по оральной медицине VI.Arch Oral Biol 2015; 60 (6): 863–74. pmid: 25841068
- 5. Salvatori O, Puri S, Tati S, Edgerton M. Врожденный иммунитет и слюна при заболеваниях полости рта, опосредованных Candida albicans. J Dent Res. 2016; 95 (4): 365–71. pmid: 26747422
- 6. Sroussi HY, Epstein JB, Bensadoun RJ, Saunders DP, Lalla RV, Migliorati CA и др. Общие оральные осложнения лучевой терапии рака головы и шеи: мукозит, инфекции, изменение слюны, фиброз, сенсорные дисфункции, кариес зубов, заболевания пародонта и остеорадионекроз.Cancer Med. 2017; 6 (12): 2918–31. pmid: 201
- 7. van ‘t Hof W., Veerman EC, Nieuw Amerongen AV, Ligtenberg AJ. Системы антимикробной защиты в слюне. Monogr Oral Sci 2014; 24: 52–60. 2014; 24: 40–51.
- 8. Горр С. Противомикробные пептиды полости рта. Периодонтол 2000. 2009; 51: 152–80. pmid: 19878474
- 9. Мочон А.Б., Лю Х. Антимикробный пептид гистатин-5 вызывает пространственно ограниченное разрушение на поверхности Candida albicans , обеспечивая быстрое проникновение пептида в цитоплазму.PLoS Pathog. 2008; 4 (10): e1000190. pmid: 18974864
- 10. Edgerton M, Koshlukova SE, Araujo MWB, Patel RC, Dong J, Bruenn J. Гистатин 5 слюны и дефенсин 1 нейтрофилов человека убивают Candida albicans через общие пути. Анимикробные агенты и химиотерапия. 2000. 44 (12): 3310–6.
- 11. Хуршид З., Насим М., Яхья Ф., Мали М., Саннам К.Р., Сахибзада Х.А. и др. Значение и диагностическая роль пептидов антимикробных кателицидинов (LL-37) для здоровья полости рта.Биомолекулы. 2017; 7 (4): pmid: 29206168
- 12. Абико Ю., Нисимура М., Каку Т. Дефенсины в слюне и слюнных железах. Средняя электронная микроскопия. 2003. 36: 247–52.
- 13. Мид К.Г., О’Фаррелли С. β-Дефенсины: выращивание микробиома для гомеостаза и здоровья. Фронт Иммунол. 2019 25 (9): 3072.
- 14. Оппенгейм Ф.Г., Сюй Т., Макмиллиан Ф.М., Левиц С.М., Даймонд Р.Д., Оффнер Г.Д. и др. Гистатины, новое семейство белков, богатых гистидином, в околоушной секреции человека.Журнал биологической химии. 1988. 263 (16): 7472–7. pmid: 3286634
- 15. Edgerton M, Koshlukova S, Lo T, Chrzan B, Straubinger R, Raj P. Кандидацидная активность гистатинов слюны. J Biol Chem. 1998. 272 (32): 20438–47.
- 16. Ли XS, Редди М.С., Баев Д., Эдгертон М. Candida albicans Ssa1 / 2p — белок, связывающий клеточную оболочку гистатина 5 слюны человека. Журнал биологической химии. 2003. 278 (31): 28553–61. pmid: 12761219
- 17.Гюрко Ц., Ленденманн У., Хелмерхорст Э. Дж., Трокслер РФ, Оппенгейм Ф.Г. Убийство Candida albicans гистатином 5: поглощение клетками и потребность в энергии. Антони ван Левенгук. 2001. 79: 297–309. pmid: 11816973
- 18. Leito JT, Ligtenberg AJ, Nazmi K, Veerman EC. Идентификация компонентов слюны, которые вызывают переход гиф в дрожжи у Candida albicans. FEMS Yeast Res. 2009. 9 (7): 1102–10. pmid: 19799638
- 19. Джабра-Ризк М.А., Конг Э., Цуй С., Нгуен М., Клэнси С., Фидель П. и др.Патогенез Candida albicans: соответствие структуре ответа на повреждение микробом-хозяином. Заражение иммунной. 2016; 84 (10): 2724–39. pmid: 27430274
- 20. Моффа Е.Б., Мусси МСМ, Сяо Й., Гарридо С.С., Мачадо МААМ, Джампаоло Е.Т. и др. Гистатин 5 ингибирует адгезию C. albicans к реконструированному эпителию ротовой полости человека. Front Microbiol. 2015; 6 (885): pmid: 26379655
- 21. Vivino F, Bunya VY, Massaro-Giordano G, Johr CR, Giattino SL, Schorpion A и др. Синдром Шегрена: обновленная информация о патогенезе заболевания, клинических проявлениях и лечении.Clin Immunol. 2019 22: pmid: 31022578
- 22. Sweet SP, Denbury AN, Challacombe SJ. Уровни кальпротектина в слюне повышаются у пациентов с кандидозом полости рта или синдромом Шегрена, но снижаются из-за ВИЧ-инфекции. Oral Microbiol Immunol 2001; 16 (2): 119–23. pmid: 11240866
- 23. Лин А.Л., Джонсон Д.А., Стефан К.Т., Йе СК. Изменение функции слюны на ранней стадии ВИЧ-инфекции. J Dent Res. 2003 8; 2 (9): 719–24.
- 24. Хан С.А., Фидель П. Младший, Аль Тунайян А., Мейлер Т., Джабра-Ризк М.А.Нарушение уровня гистатина-5 и антимикробной активности слюны против C. albicans у ВИЧ-инфицированных. J AIDS Clin Res. 2013; 4 (2): 1–6.
- 25. Гаффен С. Х-СН, Петерсон А. Передача сигналов IL-17 в защите хозяина от Candida albicans. Immunol Res. 2011; 50: 181–7. pmid: 21717069
- 26. Линден С.К., Саттон П., Карлссон Н.Г., Королик В., Макгукин М.А. Муцины в слизистой оболочке барьера для инфекции. Mucosal Immunol. 2008; 1 (3): 183–97. pmid: 1
- 78
- 27.Brand H, Ligtenberg A, Veerman E. Слюна и заживление ран. Monogr Oral Sci. 2014: 24 52–60. pmid: 24862594
- 28. Торрес П., Кастро М., Рейес М., Торрес В.А. Гистатины, заживление ран и миграция клеток. Oral Dis. 2018; 24: 1150–60. pmid: 29230909
- 29. Oudhoff MJ, Bolscher JGM, Nazmi K, Kalay H, van ‘t Hof W., Nieuw Amerongen AV, et al. Гистатины являются основными факторами, стимулирующими закрытие ран в слюне человека, как было выявлено в анализе клеточных культур.Журнал FASEB. 2008. 22: 3805–12. pmid: 18650243
- 30. Wisner A, Dufour E, Messaoudi M, Nejdi A, Marcel A, Ungeheuer MN и др. Опиорфин человека, естественный антиноцицептивный модулятор опиоид-зависимых путей. Proc Natl Acad Sci U S. A. 2006; 103 (47): 17979–84. pmid: 17101991
- 31. Шах С. Саливаомика: текущий сценарий. Журнал J Oral Maxillofac Pathol 2018 22 (3): 375–81. pmid: 30651683
- 32. Вонг Д.Т. Слюваомика. J Am Dent Assoc.2012; 143 (10 доп.): 19С – 24С.
- 33. Тасулас Дж., Пацурис Э., Гиагинис С., Теохарис С. Слюваомика для обнаружения биомаркеров заболеваний полости рта. Эксперт Rev Molec Diag 2016 16 (3): 285–95
- 34. Илеа А., Андрей В., Феурдин С.Н., Бэбцан А.М., Петреску Н.Б., Кампиан Р.С. и др. Слюна, волшебная биожидкость, доступная для многоуровневой оценки и зеркало общего состояния здоровья — систематический обзор. Биосенсоры. 2019; 9 (1): pmid: 30769890

 Так что, мы с вами можем спокойно положиться на силу и мудрость природы, которая уже давно помогает нам в вопросах сохранения нашего здоровья.
Так что, мы с вами можем спокойно положиться на силу и мудрость природы, которая уже давно помогает нам в вопросах сохранения нашего здоровья.

 5
5