Гипоталамус.
Гипоталамус (hypothalamus, подбугорье) — структура промежуточного мозга, входящая в лимбическую систему, организующая эмоциональные, поведенческие, гомеостатические реакции организма.
Гипоталамус имеет большое число нервных связей с корой большого мозга, подкорковыми узлами, зрительным бугром, средним мозгом, мостом, продолговатым и спинным мозгом.
В состав гипоталамуса входят серый бугор, воронка с нейрогипофизом и сосцевидные тела. В нейронных структурах гипоталамуса можно выделить около 50 пар ядер. Топографически эти ядра можно объединить в 5 групп:
1) преоптическая группа имеет выраженные связи с конечным мозгом и делится на медиальное и латеральное предоптические ядра;
2) передняя группа, в состав которой входят супраоптические, паравентрикулярные ядра;
3) средняя группа состоит из нижнемедиального и верхнемедиального ядер;
5) задняя группа
сформирована из медиальных и латеральных
ядер сосцевидных тел и заднего
гипоталамического ядра.
Гипоталамус имеет богатое кровоснабжение, подтверждением чему служит тот факт, что ряд ядер гипоталамуса обладает изолированным дублирующим кровоснабжением из сосудов артериального круга большого мозга (виллизиев круг). На 1 мм2 площади гипоталамуса приходится до 2600 капилляров, в то время как на той же площади V слоя предцентральной извилины (моторной коры) их 440, в гиппокампе — 350, в бледном шаре — 550, в затылочной доле коры большого мозга (зрительной коре) — 90 Капилляры гипоталамуса высокопроницаемы для крупномолекулярных белковых соединений, т.е. здесь слабо выражен гематоэнцефалический барьер, поэтому через стенки капилляров относительно легко проникают гормоны и другие физиологически активные вещества. Гипоталамус высоко чувствителен к нейровирусным инфекциям, интоксикациям, гуморальным сдвигам.
У человека
гипоталамус окончательно созревает к
возрасту 13-14 лет, когда заканчивается
формирование гипоталамо-гипофизарных
нейросекреторных связей. За счет мощных
афферентных связей с обонятельным
мозгом, базальными ганглиями, таламусом,
гиппокампом, корой большого мозга
гипоталамус получает информацию о
состоянии практически всех структур
мозга. В то же время гипоталамус посылает
информацию к таламусу, ретикулярной
формации, вегетативным центрам ствола
мозга и спинного мозга.
За счет мощных
афферентных связей с обонятельным
мозгом, базальными ганглиями, таламусом,
гиппокампом, корой большого мозга
гипоталамус получает информацию о
состоянии практически всех структур
мозга. В то же время гипоталамус посылает
информацию к таламусу, ретикулярной
формации, вегетативным центрам ствола
мозга и спинного мозга.
Нейроны гипоталамуса имеют специфику функций и высоко чувствительны к составу омывающей их крови, они способны к нейросекреции пептидов, нейромедиаторов и др.
Влияние на
симпатическую и парасимпатическую
регуляцию позволяет гипоталамусу
воздействовать на вегетативные функции
организма гуморальным и нервным путями.
Во многих руководствах отмечается, что
раздражение ядер передней группы
сопровождается парасимпатическими
эффектами, а раздражение ядер задней
группы вызывает симпатические эффекты
в работе органов. Эти представления
устарели, т.к. в гипоталамусе нейронные
ансамбли, расположенные в разных его
отделах, могут вовлекаться в реализацию
регуляторных процессов в зависимости
от сенсорной или биологической
модальностей воздействий.
В целом за счет
большого количества связей,
полифункциональности структур гипоталамус
выполняет интегрирующую функцию
вегетативной, соматической и эндокринной
регуляции, что проявляется и в организации
его ядрами ряда конкретных функций.
Так, в гипоталамусе располагаются центры
гомеостаза, теплорегуляции, голода
(латеральный отдел) и насыщения
(вентромедиальный), жажды и ее
удовлетворения, полового поведения,
страха, ярости, регуляции цикла
бодрствование — сон. Все эти центры
реализуют свои функции путем активации
или торможения вегетативного отдела
нервной системы, эндокринной системы,
структур ствола и переднего мозга.
Нейроны ядер передней группы гипоталамуса
продуцируют вазопрессин, или
антидиуретический гормон (АДГ), окситоцин
и другие пептиды, которые по аксонам
попадают в заднюю долю гипофиза —
нейрогипофиз.
Нейроны ядер срединной группы гипоталамуса продуцируют так называемые рилизинг-факторы (либерины) и ингибирующие факторы (статины), которые регулируют активность передней доли гипофиза — аденогипофиз. В нем образуются тропные гормоны (соматотропный, тиреотропный, адренокортикотропный и другие гормоны). Наличие такого набора пептидов в структурах гипоталамуса свидетельствует о присущей им нейросекреторной функции.
Нейроны гипоталамуса высокочувствительны к изменениям температуры крови, электролитного состава и осмотического давления плазмы, количества и состав гормонов крови и принимают прямое или опосредованное влияние в сохранении гомеостатических констант
Олдс
(Olds) описал
поведение крыс, которым вживляли
электроды в ядра гипоталамуса и давали
возможность самостоятельно стимулировать
эти ядра. Оказалось, что стимуляция
некоторых ядер приводила к реакции
избегания, т.е. животное после однократной
стимуляции больше не подходили к педали,
замыкающей стимулирующий ток.
Дельгадо (Delgado) во время хирургических операций, у человека обнаружил, что раздражение аналогичных участков вызывало эйфорию, эротические переживания. В клинике показано также, что патологические процессы в гипоталамусе могут сопровождаться ускорением полового созревания, нарушением менструального цикла, половой функции.
Раздражение
передних отделов гипоталамуса может
вызывать у животных пассивно-оборонительную
реакцию, а раздражение вентромедиального
ядра – ярость, агрессию или страх;
раздражение заднего гипоталамуса
вызывает также активную агрессию. При
этом повышается артериальное давление,
внутриглазное давление, увеличивается
содержание гормонов надпочечников
(адреналина, кортизола), т.е. проявляются
признаки эмоционального стресса.
Уколы в области гипоталамуса вызывают глюкозурию, полиурию. В ряде случаев раздражение вызывало нарушение теплорегуляции: животные становились пойкилотермными, у них не возникало лихорадочное состояние.
Гипоталамус является также центром регуляции цикла бодрствование — сон. При этом задний гипоталамус активизирует бодрствование, стимуляция переднего вызывает сон. Повреждение заднего гипоталамуса может вызвать так называемый летаргический сон.
Особое место в функциях гипоталамуса занимает регуляция деятельности гипофиза. В гипоталамусе и гипофизе образуются также нейрорегуляторные пептиды — энкефалины, эндорфины, обладающие морфиноподобным действием и способствующие снижению стресса и т.д.
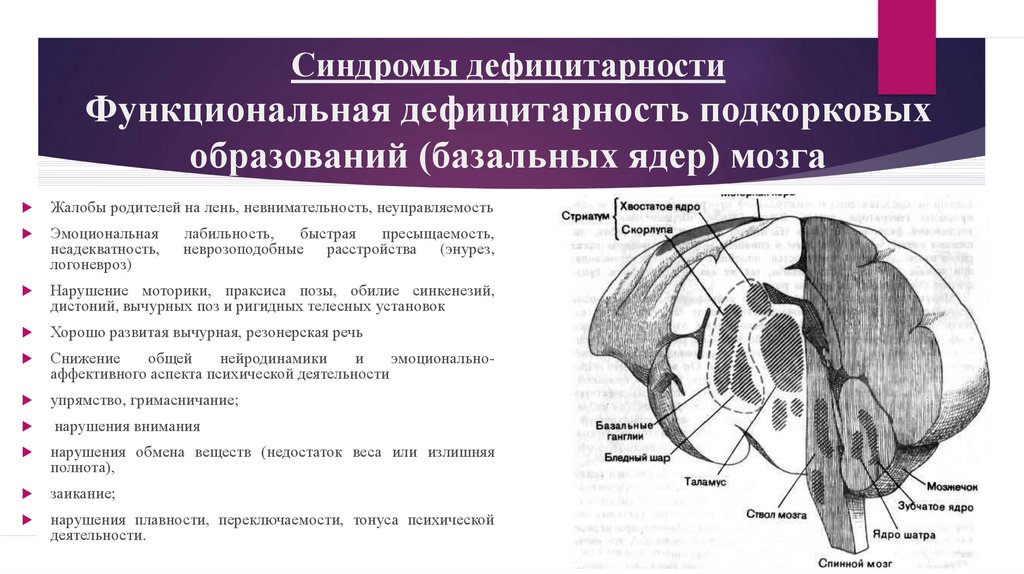
Базальные ядра
— стрио–паллидарная система. Базальные
(подкорковые) ядра
головного
мозга располагаются под белым веществом
внутри переднего мозга, преимущественно
в лобных долях. К базальным ядрам относят
хвостатое ядро
(nucleus caudatus),
скорлупу
(putamen),
ограду
(claustrum), бледный
шар
(globus pallidus).
К базальным ядрам относят
хвостатое ядро
(nucleus caudatus),
скорлупу
(putamen),
ограду
(claustrum), бледный
шар
(globus pallidus).
Хвостатое ядро и скорлупа являются эволюционно более поздними, чем бледный шар и функционально оказывают на него тормозящее влияние.
Нисходящие связи они получают преимущественно от экстрапирамидной коры через подмозолистый пучок. Другие поля коры большого мозга также посылают большое количество аксонов к хвостатому ядру и скорлупе.
Основная часть аксонов этих образований идет к бледному шару, отсюда — к таламусу и от последнего к сенсорным полям. Между этими образованиями имеется замкнутый круг связей. Они имеют также функциональные связи со структурами, лежащими вне этого круга: с черной субстанцией, красным ядром, люисовым телом, ядрами преддверия, мозжечком.
Множество связей
хвостатого ядра и скорлупы указывают
на участие в интегративных процессах,
организации и регуляции движений,
регуляции работы вегетативных органов. Различные участки коры головного мозга
оказывают неодинаковое влияние на
активность нейронов хвостатого ядра.
Раздражение поля 8 коры большого мозга
вызывает возбуждение нейронов его, а
поля 6 — возбуждение нейронов хвостатого
ядра и скорлупы. Одиночное раздражение
сенсомоторной области коры большого
мозга может вызывать возбуждение или
торможение активности нейронов хвостатого
ядра.
Различные участки коры головного мозга
оказывают неодинаковое влияние на
активность нейронов хвостатого ядра.
Раздражение поля 8 коры большого мозга
вызывает возбуждение нейронов его, а
поля 6 — возбуждение нейронов хвостатого
ядра и скорлупы. Одиночное раздражение
сенсомоторной области коры большого
мозга может вызывать возбуждение или
торможение активности нейронов хвостатого
ядра.
Медиальные ядра таламуса имеют прямые связи с хвостатым ядром, показателем чего является активация нейронов через 2-4 мс после раздражения таламуса. Активацию нейронов вызывают раздражения кожи, световые, звуковые стимулы.
Во взаимодействиях хвостатого ядра и бледного шара превалируют тормозные влияния. Если раздражать хвостатое ядро, то большая часть нейронов бледного шара тормозится, а меньшая возбуждается. В случае повреждения хвостатого ядра у животного появляется двигательная гиперактивность.
Взаимодействие
черного вещества и хвостатого ядра
основано на прямых и обратных связях
между ними. Установлено, что стимуляция
хвостатого ядра усиливает активность
нейронов черного вещества. Стимуляция
черного вещества приводит к увеличению,
а разрушение — к уменьшению количества
дофамина в хвостатом ядре. Установлено,
что дофамин синтезируется в клетках
черного вещества, а затем со скоростью
0,8 мм/ч транспортируется к синапсам
нейронов хвостатого ядра. В хвостатом
ядре в 1 г нервной ткани накапливается
до 10 мкг дофамина, что в 6 раз больше, чем
в других отделах переднего мозга, бледном
шаре, в 19 раз больше, чем в мозжечке.
Благодаря дофамину проявляется
растормаживающий механизм взаимодействия
хвостатого ядра и бледного шара.
Установлено, что стимуляция
хвостатого ядра усиливает активность
нейронов черного вещества. Стимуляция
черного вещества приводит к увеличению,
а разрушение — к уменьшению количества
дофамина в хвостатом ядре. Установлено,
что дофамин синтезируется в клетках
черного вещества, а затем со скоростью
0,8 мм/ч транспортируется к синапсам
нейронов хвостатого ядра. В хвостатом
ядре в 1 г нервной ткани накапливается
до 10 мкг дофамина, что в 6 раз больше, чем
в других отделах переднего мозга, бледном
шаре, в 19 раз больше, чем в мозжечке.
Благодаря дофамину проявляется
растормаживающий механизм взаимодействия
хвостатого ядра и бледного шара.
При недостатке дофамина в хвостатом ядре (например, при дисфункции черного вещества) бледный шар растормаживается, активизирует спинно-стволовые системы, что приводит к двигательным нарушениям в виде ригидности мышц гиперкинезов, тремора.
Кортико-стриарные
связи топически локализованы. Так,
передние области мозга связаны с головкой
хвостатого ядра.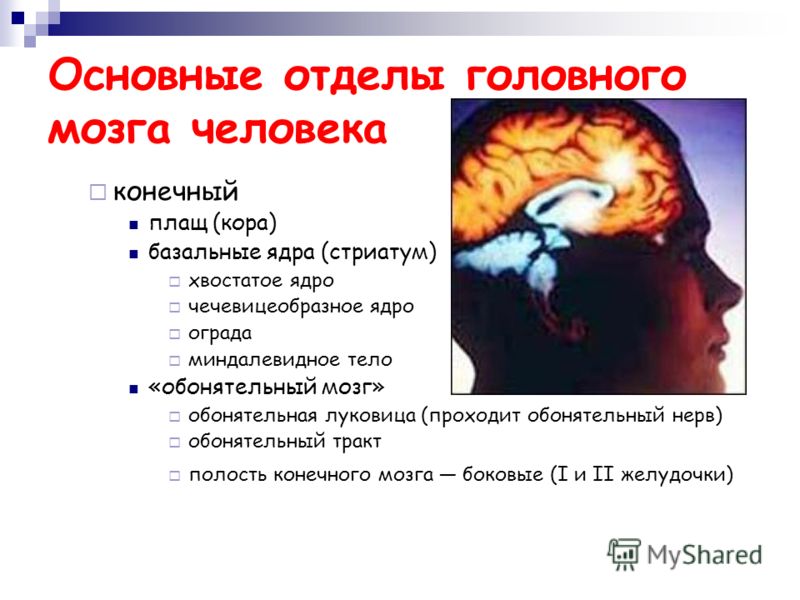 Патология, возникающая
в одной из взаимосвязанных областей
кора — хвостатое ядро, функционально
компенсируется сохранившейся структурой.
Патология, возникающая
в одной из взаимосвязанных областей
кора — хвостатое ядро, функционально
компенсируется сохранившейся структурой.
Хвостатое ядро и бледный шар принимают участие в таких интегративных процессах, как условнорефлекторная деятельность, двигательная активность. Это выявляется при стимуляции хвостатого ядра, скорлупы и бледного шара, деструкции и при регистрации электрической активности. Прямое раздражение некоторых зон хвостатого ядра вызывает поворот головы в сторону, противоположную раздражаемому полушарию, животное начинает двигаться по кругу, т.е. возникает так называемая циркуляторная реакция.
Раздражение других областей хвостатого ядра и скорлупы вызывает прекращение всех видов активности человека или животного: ориентировочной, эмоциональной, двигательной, пищевой. При этом в коре большого мозга наблюдается медленноволновая активность.
У человека стимуляция
хвостатого ядра во время нейрохирургической
операции нарушает речевой контакт с
больным: если больной что-то говорил,
то он замолкает, а после прекращения
раздражения не помнит, что к нему
обращались.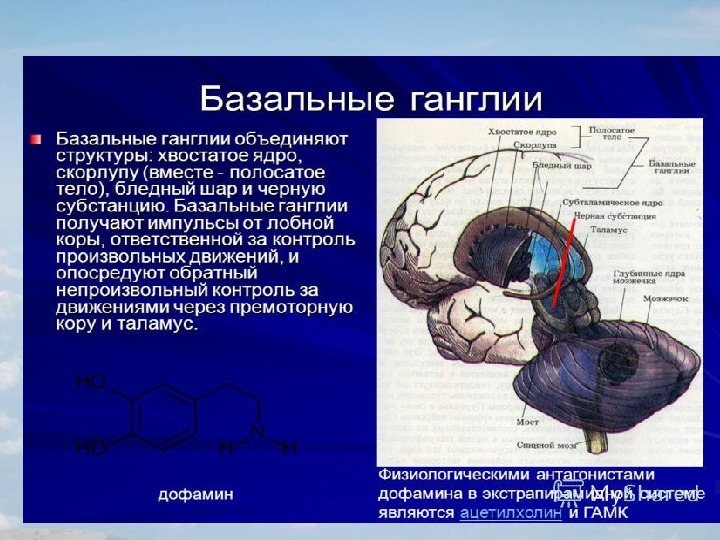 В случаях травм головного
мозга с раздражением головки хвостатого
ядра у больных отмечается ретро-, антеро-
или ретроантероградная амнезия.
В случаях травм головного
мозга с раздражением головки хвостатого
ядра у больных отмечается ретро-, антеро-
или ретроантероградная амнезия.
У таких животных, как обезьяны, раздражения хвостатого ядра на разных этапах реализации условного рефлекса приводят к торможению выполнения данного рефлекса. Например, если у обезьяны через вживленные электроды раздражать хвостатое ядро перед подачей условного сигнала, то обезьяна не реагирует на сигнал, как будто не слышала его; раздражение ядра после того, как обезьяна на сигнал направляется к кормушке или уже начинает брать пищу из кормушки, приводит к остановке животного, после прекращения раздражения обезьяна, не завершив условной реакции, возвращается на место, т.е. она «забывает», что был раздражающий сигнал (ретроградная амнезия).
Раздражение
хвостатого ядра может полностью
предотвратить восприятие болевых,
зрительных, слуховых и других видов
стимуляции. Раздражение вентральной
области хвостатого ядра снижает, а
дорсальной — повышает слюноотделение.
При стимуляции хвостатого ядра удлиняются латентные периоды рефлексов, нарушается переделка условных рефлексов. Выработка условных рефлексов на фоне стимуляции хвостатого ядра становится невозможной. Видимо, это объясняется тем, что стимуляция хвостатого ядра вызывает торможение активности коры большого мозга.
Ряд подкорковых структур также получает тормозное влияние хвостатого ядра. Наиболее специфичным для раздражения хвостатого ядра является преимущественно торможение активности коры большого мозга, подкорковых образований, торможение безусловного и условнорефлекторного поведения.
В то же время при раздражении хвостатого ядра могут появляться некоторые виды изолированных движений. Видимо, хвостатое ядро имеет наряду с тормозящими и возбуждающие структуры.
Выключение
хвостатого ядра сопровождается развитием
гиперкинезов типа непроизвольных
мимических реакций, тремора, атетоза,
хореи (подергивания конечностей;
туловища, как при некоординированном
танце), двигательной гиперактивности
в форме бесцельного перемещения с места
на место.
В случае повреждения хвостатого ядра наблюдаются существенные расстройства высшей нервной деятельности, затруднение ориентации в пространстве, нарушение памяти, замедление роста организма. После двустороннего повреждения хвостатого ядра условные рефлексы исчезают на длительный срок, выработка новых рефлексов затрудняется, общее поведение отличается застойностью, инертностью, трудностью переключений. У обезьян после одностороннего повреждения хвостатого ядра условная реакция восстанавливалась через 30-50 дней, латентные периоды рефлексов удлинялись, появлялись межсигнальные реакции. Двустороннее повреждение приводило к полному торможению условных рефлексов. Видимо, двустороннее повреждение истощает компенсаторные механизмы.
При воздействиях
на хвостатое ядро, помимо нарушений
высшей нервной деятельности, отмечаются
расстройства движения. Многие авторы
отмечают, что у разных животных при
двустороннем повреждении полосатого
тела появляется безудержное стремление
двигаться вперед, при одностороннем —
возникают манежные движения.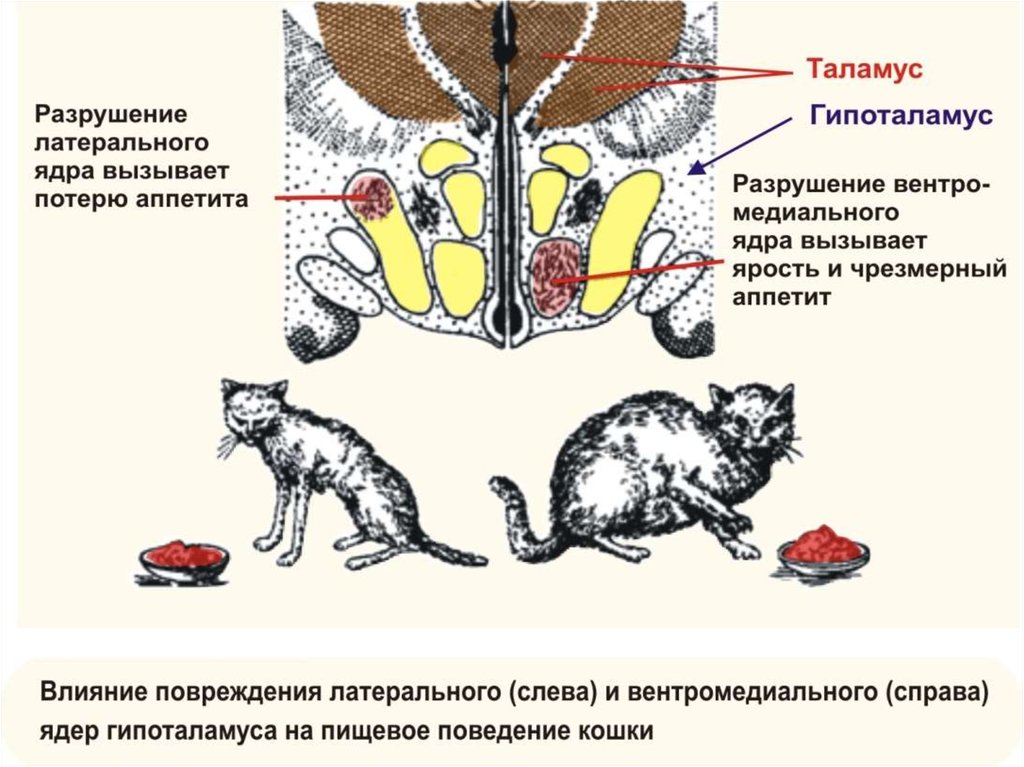 Несмотря
на большое функциональное сходство
хвостатого ядра и скорлупы, имеется ряд
функций, специфичных для последней.
Несмотря
на большое функциональное сходство
хвостатого ядра и скорлупы, имеется ряд
функций, специфичных для последней.
Эволюционно скорлупа появляется раньше хвостатого ядра), зачатки есть уже у рыб). Для скорлупы характерно участие в организации пищевого поведения: поиска, направленности к пище, захвата и –владения пищей. При нарушениях функции скорлупы возникает ряд нарушений трофики кожи, внутренних органов. Раздражения скорлупы приводят к изменениям дыхания, слюноотделения, к нарушениям условнорефлекторной деятельности.
Базальные ганглии (стриарные тела) | Doctor-V.ru
Базальные ганглии
text_fields
text_fields
arrow_upward
Базальные ганглии головного мозга (стриарные тела) включают в себя три парных образования:
- Неостриатум (хвостатое ядро и скорлупа),
- Палеостриатум (бледный шар),
- Ограда.

Функции неостриатума
text_fields
text_fields
arrow_upward
Неостриатум эволюционно более позднее образование, чем палеостриатум и функционально оказывает на него тормозящее влияние.
Функции любых образований головного мозга определяются, прежде всего, их связями с неостриатумом. Связи неостриатума имеют четкую топографическую направленность и функциональную очер-ченность.
Хвостатое ядро и скорлупа получают нисходящие связи преимущественно от экстрапирамидной коры, но и другие поля коры посылают к ним большое количество аксонов. Основная часть аксонов хвостового ядра и скорлупы идет к бледному шару, отсюда — к таламусу и только от него — к сенсорным полям.
Следовательно, между этими образованиями имеется замкнутый круг:
- неостриатум — палеостриатум — таламус — кора —неостриатум.
Неостриатум имеет также функциональные связи со структурами, лежащими вне этого круга: с черной субстанцией, красным ядром, люисовым телом, вестибулярными ядрами, мозжечком, гамма-клетками спинного мозга.
Обилие и характер связей неостриатума свидетельствуют о его участии в интегративных процессах, в организации и регуляции движений, регуляции работы вегетативных органов.
Во взаимодействиях неостриатума и палеостриатума между собой превалируют тормозные влияния. Если раздражать хвостатое ядро, то большая часть нейронов бледного шара тормозится, часть вначале возбуждается — затем тормозится, меньшая часть нейронов возбуждается. В случае повреждения хвостатого ядра у животного появляется двигательная гиперактивность.
Взаимодействие черной субстанции с неостриатумом основано на прямых и обратных связях между ними. Стимуляция хвостатого ядра усиливает активность нейронов черного вещества. Стимуляция черного вещества приводит к увеличению, а его разрушение —уменьшает количество дофамина в хвостатом ядре. Дофамин синтезируется в клетках черной субстанции, а затем со скоростью 0,8 мм в час транспортируется к синапсам нейронов хвостатого ядра. В неостриатуме на 1 г нервной ткани накапливается до 10 мкг дофамина, что в 6 раз больше, чем в других отделах переднего мозга, например, в бледном шаре и в 19 раз больше, чем в мозжечке. Дофамин подавляет фоновую активность большинства нейронов хвостатого ядра, а это позволяет снять тормозящее действие этого ядра на активность бледного шара. Благодаря дофамину проявляется растормаживающий механизм взаимодействия между нео- и палео-стриатумом. При недостатке дофамина в неостриатуме, что наблюдается при дисфункции черного вещества, нейроны бледного шара растормаживаются, активизируют спино-стволовые системы, это приводит к двигательным нарушениям в виде ригидности мышц.
Дофамин подавляет фоновую активность большинства нейронов хвостатого ядра, а это позволяет снять тормозящее действие этого ядра на активность бледного шара. Благодаря дофамину проявляется растормаживающий механизм взаимодействия между нео- и палео-стриатумом. При недостатке дофамина в неостриатуме, что наблюдается при дисфункции черного вещества, нейроны бледного шара растормаживаются, активизируют спино-стволовые системы, это приводит к двигательным нарушениям в виде ригидности мышц.
Кортикостриарные связи топически локализованы. Так, передние области мозга связаны с головкой хвостатого ядра. Патология, возникающая в одной из взаимосвязанных областей: кора-неостриатум, функционально компенсируется сохранившейся структурой.
Неостриатум и палеостриатум принимают участие в таких интег-ративных процессах как условнорефлекторная деятельность, двигательная активность. Это выявляется при их стимуляции, деструкции и при регистрации электрической активности.
Прямое раздражение некоторых зон неостриатума вызывает поворот головы в сторону, противоположную раздражаемому полушарию, животное начинает двигаться по кругу, т.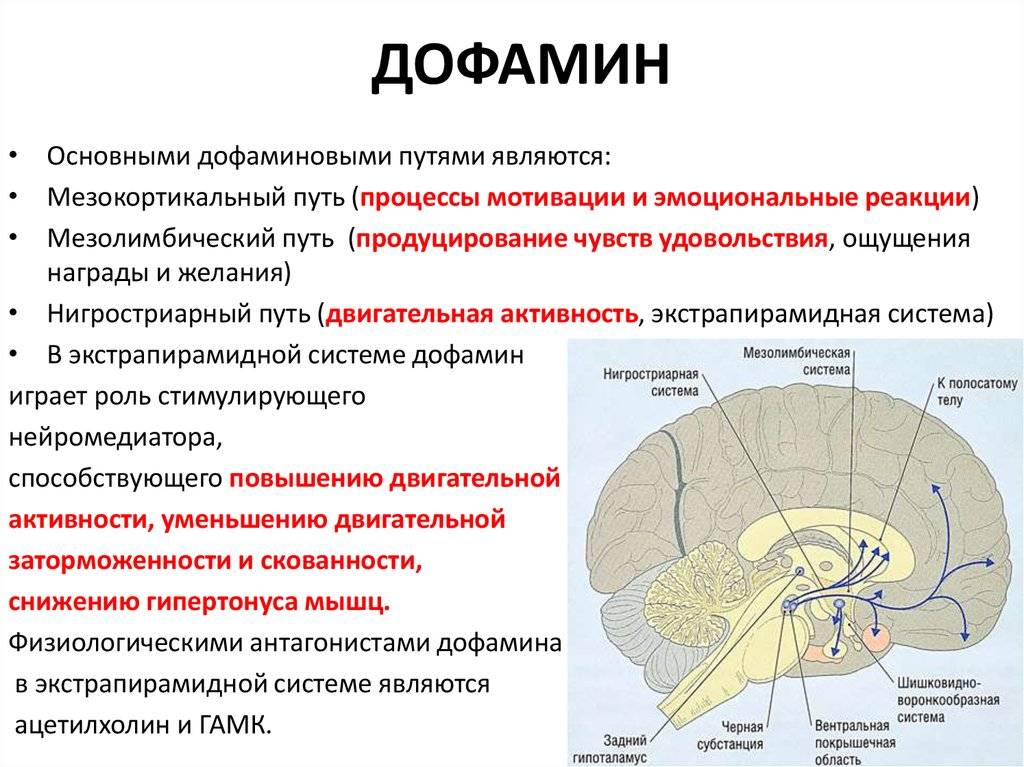 е. возникает так называемая циркуляторная реакция.
е. возникает так называемая циркуляторная реакция.
Раздражение других областей неостриатума вызывает прекращение всех видов активности человека или животного:
- ориентировочной,
- эмоциональной,
- двигательной,
- пищевой.
При этом в коре мозга наблюдается медленно-волновая электрическая активность.
У человека, во время нейрохирургической операции, стимуляция хвостатого ядра нарушает речевой контакт с больным: если больной что-то говорил, то он замолкает, а после прекращения раздражения не помнит, что к нему обращались. В случаях травм черепа с симптомами раздражения неостриатума у больных отмечается ретро-, антеро- или ретроантероградная амнезия. Раздражение хвостатого ядра на разных этапах выработки рефлекса приводит к торможению выполнения этого рефлекса.
Раздражение хвостатого ядра может полностью предотвратить восприятие болевых, зрительных, слуховых и других видов стимуляции.
Раздражение вентральной области хвостатого ядра снижает, а дорсальной — повышает слюноотделение.
Ряд подкорковых структур также получает тормозное влияние со стороны хвостатого ядра. Так, стимуляция хвостатых ядер вызывала веретенообразную активность в зрительном бугре, бледном шаре, субталамическом теле, черном веществе и др.
Таким образом, специфичным для раздражения хвостатого ядра является торможение активности коры, подкорки, торможение безусловного и условно-рефлекторного поведения.
Хвостатое ядро имеет наряду с тормозящими структурами и возбуждающие. Поскольку возбуждение неостриатума тормозит движения, вызываемые с других пунктов мозга, то оно может тормозить и движения, вызываемые раздражением самого неостриатума. В то же время, если его возбудительные системы стимулируются изолированно, они вызывают то или иное движение. Если считать, что функция хвостатого ядра заключается в обеспечении перехода одного вида движения в другое, т.е. прекращении одного движения и обеспечении нового путем создания позы, условий для изолированных движений, то становится понятным существование двух функций хвостатого ядра — тормозной и возбуждающей.
Эффекты выключения неостриатума показали, что функция его ядер связана с регуляцией тонуса мускулатуры. Так, при повреждении этих ядер наблюдались гиперкинезы типа: непроизвольных мимических реакций, тремора, атетоза, торсионного спазма, хореи (подергивания конечностей, туловища, как при некоординированном танце), двигательной гиперактивности в форме бесцельного перемещения с места на место.
При повреждении неостриатума имеют место расстройства высшей нервной деятельности, затруднение ориентации в пространстве, нарушение памяти, замедление роста организма. После двустороннего повреждения хвостатого ядра условные рефлексы исчезают на длительный срок, выработка новых рефлексов затрудняется, дифференцировка, если и образуется, то отличается непрочностью, отсроченные реакции выработать не удается.
При повреждении хвостатого ядра общее поведение отличается застойностью, инертностью, трудностью переключений с одной формы поведения на другую.
При воздействиях на хвостатое ядро имеют место расстройства движения:
- двустороннее повреждение полосатого тела ведет к безудержному стремлению движения вперед,
- одностороннее повреждение — приводит к манежным движениям.

Несмотря на большое функциональное сходство хвостатого ядра и скорлупы, все же имеется ряд функций, специфичных для последней. Для скорлупы характерно участие в организации пищевого поведения; ряд трофических нарушений кожи, внутренних органов (например, гепатолектикулярная дегенерация) возникает при дефиците функции скорлупы. Раздражения скорлупы приводят к изменениям дыхания, слюноотделения.
Из фактов о том, что стимуляция неостриатума приводит к торможению условного рефлекса, следовало бы ожидать, что разрушение хвостатого ядра вызовет облегчение условнорефлекторной деятельности. Но оказалось, что разрушение хвостатого ядра также приводит к торможению условнорефлекторной деятельности. Видимо, функция хвостатого ядра не является просто тормозной, а заключается в корреляции и интеграции процессов оперативной памяти. Об этом свидетельствует также тот факт, что на нейронах хвостатого ядра конвергирует информация различных сенсорных систем, так как большая часть этих нейронов полисенсорна. Таким образом, неостриатум является подкорковым интегративным и ассоциативным центром.
Таким образом, неостриатум является подкорковым интегративным и ассоциативным центром.
Функции палеостриатума (бледный шар)
text_fields
text_fields
arrow_upward
В отличие от неостриатума, стимуляция палеостриатума не вызывает торможения, а провоцирует ориентировочную реакцию, движения конечностей, пищевое поведение (жевание, глотание и т.д.).
Разрушение бледного шара приводит к гипомимии, гиподинамии, эмоциональной тупости. Повреждение бледного шара вызывает у людей маскообразность лица, тремор головы, конечностей, причем этот тремор исчезает в покое, во сне и усиливается при движениях, речь становится монотонной. При повреждении бледного шара имеет место миоклония — быстрые подергивания отдельных мышечных групп или отдельных мышц рук, спины, лица. У человека с дисфункцией бледного шара начало движений становится трудным, исчезают вспомогательные и реактивные движения при вставании, нарушаются содружественные движения рук при ходьбе.
Локализация и малые размеры ограды представляют определенные трудности в ее физиологическом исследовании. Это ядро имеет форму узкой полоски серого вещества. Медиально она граничит с наружной капсулой, латерально — с капсулой экстрема.
Ограда тесно связана с островковой корой как прямыми, так и обратными связями. Кроме того, прослеживаются связи от ограды к лобной, затылочной, височной коре, показаны обратные связи от коры к ограде. Ограда связана с обонятельной луковицей, с обонятельной корой своей и контралатеральной стороны, а также с оградой другого полушария. Из подкорковых образований ограда связана со скорлупой, хвостатым ядром, черным веществом, миндалевидным комплексом, зрительным бугром, бледным шаром.
Реакции нейронов ограды широко представлены на соматические, слуховые, зрительные раздражения, причем эти реакции, в основном, возбудительного характера.
В случае полного перерождения ограды больные не могут говорить, хотя находятся в полном сознании. Стимуляция ограды вызывает ориентировочную реакцию, поворот головы, жевательные, глотательные, иногда рвотные движения. Эффекты раздражения ограды на условный рефлекс, предъявление стимуляции в разные фазы условного рефлекса тормозит условный рефлекс на счет, мало сказывается при условном рефлексе на звук. Если раздражение производилось одновременно с подачей условного сигнала, то условный рефлекс тормозился. Стимуляция ограды во время еды тормозит поедание пищи. При повреждении ограды левого полушария у человека наблюдаются расстройства речи.
Стимуляция ограды вызывает ориентировочную реакцию, поворот головы, жевательные, глотательные, иногда рвотные движения. Эффекты раздражения ограды на условный рефлекс, предъявление стимуляции в разные фазы условного рефлекса тормозит условный рефлекс на счет, мало сказывается при условном рефлексе на звук. Если раздражение производилось одновременно с подачей условного сигнала, то условный рефлекс тормозился. Стимуляция ограды во время еды тормозит поедание пищи. При повреждении ограды левого полушария у человека наблюдаются расстройства речи.
Таким образом, базальные ганглии головного мозга являются интегративными центрами организации моторики, эмоций, высшей нервной деятельности.
Причем, каждая из этих функций может быть усилена или заторможена активацией отдельных образований базальных ядер.
Покровский Возбудимые ткани Глава 2. ВОЗБУДИМЫЕ ТКАНИ
2.
Основным свойством живых клеток является раздражимость, т. е. их способность реагировать изменением обмена веществ в ответ на действие раздражителей. Возбудимость — свойство клеток отвечать на раздражение возбуждением. К возбудимым относят нервные, мышечные и некоторые секреторные клетки. Возбуждение — ответ ткани на ее раздражение, проявляющийся в специфической для нее функции (проведение возбуждения нервной тканью, сокращение мышцы, секреция железы) и неспецифических реакциях (генерация потенциала действия, метаболические изменения). Одним из важных свойств живых клеток является их электрическая возбудимость, т.е. способность возбуждаться в ответ на действие электрического тока. Высокая чувствительность возбудимых тканей к действию слабого электрического тока впервые была продемонстрирована Гальвани в опытах на нервно-мышечном препарате задних лапок лягушки. Если к нервно-мышечному препарату лягушки приложить две соединенные между собой пластинки из различных металлов, например медь—цинк, таким образом, что бы одна пластинка касалась мышцы, а другая — нерва, то мышца будет сокращаться (первый опыт Гальвани). Детальный анализ результатов опытов Гальвани, проведенный А. Вольта, позволил сделать другое заключение: электрический ток возникает не в живых клетках, а в месте контакта разнородных металлов с электролитом, поскольку тканевые жидкости представляют собой раствор солей. В результате своих исследований А.Вольта создал устройство, получившее название «вольтов столб» — набор по следовательно чередующихся цинковых и серебряных пластинок, раз деленных бумагой, смоченной солевым раствором. В доказательство справедливости своей точки зрения Гальвани предложил другой опыт: набрасывать на мышцу дистальный отрезок нерва, который иннервирует эту мышцу, при этом мышца также сокращалась (второй опыт Гальвани, или опыт без металла). Отсутствие металлических про водников при проведении опыта позволило Гальвани подтвердить свою точку зрения и развить представления о «животном электричестве», т. е. электрических явлениях, возникающих в живых клетках. Окончательное доказательство существования электрических явлений в живых тканях было получено в опыте «вторичного тетануса» Маттеуччи, в котором один нервно-мышечный препарат возбуждался током, а биотоки сокращающейся мышцы раздражал нерв второго нервно-мышечного препарата. В конце XIX века благодаря работам Л. Германа, Э. Дюбуа-Раймона, Ю. Бернштейна стало очевидно, что электрические явления, которые возникают в возбудимых тканях, обусловлены электрическими свойствами клеточных мембран.
2.1.1. Строение и основные свойства клеточных мембран и ионных каналов
Согласно современным представлениям, биологические мембраны образуют наружную оболочку всех животных клеток и формируют многочисленные внутриклеточные органеллы. Наиболее характерным структурным признаком является то, что мембраны всегда образуют замкнутые пространства, и такая микроструктурная организация мембран позволяет им выполнять важнейшие функции. Строение и функции клеточных мембран. 1.Барьерная функция выражается в том, что мембрана при помощи соответствующих механизмов участвует в создании концентрационных градиентов, препятствуя свободной диффузии. При этом мембрана принимает участие в механизмах электрогенеза. К ним относятся механизмы создания потенциала покоя, генерация потенциала действия, механизмы распространения биоэлектрических импульсов по однородной и неоднородной возбудимым структурам. 2.Регуляторная функция клеточной мембраны заключается в тонкой регуляции внутриклеточного содержимого и внутриклеточных реакций за счет рецепции внеклеточных биологически активных веществ, что приводит к изменению активности ферментных систем мембраны и запуску механизмов вторичных «месенджеров» («посредников»). 3.Преобразование внешних стимулов неэлектрической природы в электрические сигналы (в рецепторах). 4.Высвобождение нейромедиаторов в синаптических окончаниях. Современными методами электронной микроскопии была определена толщина клеточных мембран (6—12 нм). Химический анализ показал, что мембраны в основном состоят из липидов и белков, количество которых неодинаково у разных типов клеток. Сложность изучения молекулярных механизмов функционирования клеточных мембран обусловлена тем, что при выделении и очистке клеточных мембран нарушается их нормальное функционирование. В настоящее время можно говорить о нескольких видах моделей клеточной мембраны, среди которых наибольшее распространение получила жидкостно-мозаичная модель. Согласно этой модели, мембрана представлена бислоем фосфолипидных молекул, ориентированных таким образом, что гидрофобные концы молекул находятся внутри бислоя, а гидрофильные направлены в водную фазу (рис. 2.1). Такая структура идеально подходит для образования раздела двух фаз: вне- и внутриклеточной.
В фосфолипидном бислое интегрированы глобулярные белки, полярные участки которых образуют гидрофильную поверхность в водной фазе. Эти интегрированные белки выполняют различные функции, в том числе рецепторную, ферментативную, образуют ионные каналы, являются мембранными насосами и переносчиками ионов и молекул. Некоторые белковые молекулы свободно диффундируют в плоскости липидного слоя; в обычном состоянии части белковых молекул, выходящие по разные стороны клеточной мембраны, не изменяют своего положения. Здесь описана только общая схема строения клеточной мембраны и для других типов клеточных мембран возможны значительные различия. Электрические характеристики мембран. Особая морфология клеточных мембран определяет их электрические характеристики, среди которых наиболее важными являются емкость и проводимость. Емкостные свойства в основном определяются фосфолипидным бислоем, который непроницаем для гидратированных ионов и в то же время достаточно тонок (около 5 нм), чтобы обеспечивать эффективное разделение и накопление зарядов и электростатическое взаимодействие катионов и анионов. Кроме того, емкостные свойства клеточных мембран являются одной из причин, определяющих временные характеристики электрических процессов, протекающихщих на клеточных мембранах. Проводимость (g) — величина, обратная электрическому сопротивлению и равная отношению величины общего трансмембранного тока для данного иона к величине, обусловившей его трансмембранной разности потенциалов. Через фосфолипидный бислой могут диффундировать различные вещества, причем степень проницаемости (Р), т. е. способность клеточной мембраны пропускать эти вещества, зависит от разности концентраций диффундирующего вещества по обе стороны мембраны, его растворимости в липидах и свойств клеточной мембраны. Скорость диффузии для заряженных ионов в условиях постоянного поля в мембране определяется подвижностью ионов, толщиной мембраны, распределением ионов в мембране. Для неэлектролитов проницаемость мембраны не влияет на ее проводимость, поскольку неэлектролиты не несут зарядов, т. е. не могут переносить электрический ток. Проводимость мембраны является мерой ее ионной проницаемости. Увеличение проводимости свидетельствует об увеличении количества ионов, проходящих через мембрану. Строение и функции ионных каналов. Ионы Na+, K+, Са2+, Сl— проникают внутрь клетки и выходят наружу через специальные, заполненные жидкостью каналы. Функцию ионных каналов изучают различными способами. Наиболее распространенным является метод фиксации напряжения, или «voltage-clamp» (рис. 2.2). Сущность метода заключается в том, что с помощью специальных электронных систем в процессе опыта изменяют и фиксируют на определенном уровне мембранный потенциал. При этом измеряют величину ионного тока, протекающего через мембрану. Если разность потенциалов постоянна, то в соответствии с законом Ома величина тока пропорциональна проводимости ионных каналов. В ответ на ступенчатую деполяризацию открываются те или иные каналы, соответствующие ионы входят в клетку по электрохимическому градиенту, т. е. возникает ионный ток, который деполяризует клетку. Это изменение регистрируется с помощью управляющего усилителя и через мембрану пропускается электрический ток, равный по величине, но противоположный по направлению мембранному ионному току.
В настоящее время установлены многие типы каналов для различных ионов (табл. 2.1). Одни из них весьма специфичны, вторые, кроме основного иона, могут пропускать и другие ионы. Изучение функции отдельных каналов возможно методом локальной фиксации потенциала «path-clamp»; рис. 2.3, А). Стеклянный микроэлектрод (микропипетка) заполняют солевым раствором, прижимают к поверхности мембраны и создают небольшое разрежение. Таблица 2.1. Важнейшие ионные каналы и ионные токи возбудимых клеток
Примечание.
Ток через одиночный ионный канал имеет прямоугольную форму и одинаков по амплитуде для каналов различных типов (рис. 2.3, Б). Длительность пребывания канала в открытом состоянии имеет вероятностный характер, но зависит от величины мембранного потенциала. Суммарный ионный ток определяется вероятностью нахождения в открытом состоянии в каждый конкретный период времени определенного числа каналов (рис. 2.3, В).
Наружная часть канала сравнительно доступна для изучения, исследование внутренней части представляет значительные трудности. П. Г. Костюком был разработан метод внутриклеточного диализа, который позволяет изучать функцию входных и выходных структур ионных каналов без применения микроэлектродов. Оказалось, что часть ионного канала, открытая во внеклеточное пространство, по своим функциональным свойствам отличается от части канала, обращенной во внутриклеточную среду. Именно ионные каналы обеспечивают два важных свойства мембраны: селективность и проводимость. Селективность, или избирательность, канала обеспечивается его особой белковой структурой. Большинство каналов являются электроуправляемыми, т. е. их способность проводить ионы зависит от величины мембранного потенциала. Канал неоднороден по своим функциональным характеристикам, особенно это касается белковых структур, находящихся у входа в канал и у его выхода (так называемые воротные механизмы).
Рассмотрим принцип работы ионных каналов на примере натриевого канала. Полагают, что в состоянии покоя натриевый канал закрыт. При деполяризации клеточной мембраны до определенного уровня происходит открытие m-активационных ворот (активация) и усиление поступления ионов Na+ внутрь клетки. Через несколько миллисекунд после открытия m-ворот происходит закрытие п-ворот, расположенных у выхода натриевых каналов (инактивация) (рис. 2.4). Инактивация развивается в клеточной мембране очень быстро и степень инактивации зависит от величины и времени действия деполяризующего стимула. Работа натриевых каналов определяется величиной мембранного потенциала в соответствии с определенными законами вероятности. Рассчитано, что активированный натриевый канал пропускает всего 6000 ионов за 1 мс. При этом весьма существенный натриевый ток, который проходит через мембраны во время возбуждения, представляет собой сумму тысяч одиночных токов. При генерации одиночного потенциала действия в толстом нервном волокне изменение концентрации ионов Na+ во внутренней среде составляет всего 1/100000 от внутреннего содержания ионов Na гигантского аксона кальмара. Однако для тонких нервных волокон это изменение концентрации может быть весьма существенным. Кроме натриевых, в клеточных мембранах установлены другие виды каналов, избирательно проницаемых для отдельных ионов: К+, Са2+, причем существуют разновидности каналов для этих ионов (см. табл. 2.1). Ходжкин и Хаксли сформулировали принцип «независимости» каналов, согласно которому потоки натрия и калия через мембрану независимы друг от друга. Свойство проводимости различных каналов неодинаково. В частности, для калиевых каналов процесс инактивации, как для натриевых каналов, не существует. Имеются особые калиевые каналы, активирующиеся при повышении внутриклеточной концентрации кальция и деполяризации клеточной мембраны. Активация калий-кальцийзависимых каналов ускоряет реполяризацию, тем самым восстанавливая исходное значение потенциала покоя. Особый интерес представляют кальциевые каналы. Входящий кальциевый ток, как правило, недостаточно велик, чтобы нормально деполяризовать клеточную мембрану. Чаще всего поступающий в клетку кальций выступает в роли «мессенджера», или вторичного посредника. Активация кальциевых каналов обеспечивается деполяризацией клеточной мембраны, например входящим натриевым током. Процесс инактивации кальциевых каналов достаточно сложен. С одной стороны, повышение внутриклеточной концентрации свободного кальция приводит к инактивации кальциевых каналов. С другой стороны, белки цитоплазмы клеток связывают кальций, что позволяет поддерживать длительное время стабильную величину кальциевого тока, хотя и на низком уровне; при этом натриевый ток полностью подавляется.
2.1.2. Методы изучения возбудимых клеток
Электрические явления, которые возникают в возбудимых тканях, обусловлены электрическими свойствами клеточных мембран. Поэтому необходимо остановиться на методических подходах современной физиологии возбудимых тканей, используемых при исследовании электрических характеристик клеточных мембран. Любая физиологическая установка, предназначенная для изучения возбудимых клеток и тканей, должна содержать следующие основные элементы: 1) электроды для регистрации и стимуляции; 2) усилители биоэлектрических сигналов; 3) регистратор; 4) стимулятор; 5) систему для обработки физиологической информации. В зависимости от задач исследования обычно требуется дополнительное оборудование. Поскольку в современной медицине широко используются методы электрофизиологического исследования и воздействия электрическим током, необходимо кратко познакомиться с основными методическими приемами. При работе на изолированных органах, тканях и отдельных клетках применяют специальные камеры и растворы определенного состава, например Рингера-Локка, Тироде, Хэнкса, позволяющие в течение длительного времени поддерживать нормальную жизнедеятельность биологического объекта. Во время эксперимента раствор должен быть насыщен кислородом и иметь соответствующую температуру (для хладнокровных животных +20°С, для теплокровных +37°С). В процессе эксперимента необходимо использовать проточные камеры для непрерывного обновления раствора, в котором находится биологический объект. При электрофизиологических исследованиях используют различные типы электродов, детальное описание которых можно найти в соответствующих руководствах. В то же время есть определенные требования ко всем без исключения электродным системам. Электроды, которые используют в эксперименте, должны оказывать минимальное влияние на объект исследования, т. е. они должны только передавать информацию от объекта или на объект. Если в электрофизиологическом эксперименте исследуют собственно процесс возбуждения, то необходимо применять два электрода с различной величиной площади контактной поверхности (желательно в соотношении не менее 1:100), при этом электрод меньшей площади называют активным, или референтным, большей площади — пассивным, или индифферентным. При исследовании процесса распространения возбуждения необходимо использовать два активиых электрода с одинаковой площадью контактных поверхностей, устанавливаемых на возбудимой ткани на некотором расстоянии друг от друга, и индифферентный электрод, который устанавливается в отдалении. В первом случае говорят о моно-(уни-) полярном способе отведения потенциала (раздражении), во втором — о биполярном способе. Необходимо подчеркнуть, что термин «униполярный» способ весьма условен, поскольку всегда регистрируется разность потенциалов, а не абсолютное значение потенциала. Поскольку работа с биологическим объектом подразумевает контакт электрода с жидкостью, содержащейся в биологическом объекте, высока вероятность возникновения контактных поляризационных потенциалов, которые могут существенно исказить результаты исследования. При исследовании электрофизиологических характеристик отдельных клеток используют стеклянные микроэлектроды. Они представляют собой микропипетку с диаметром кончика менее 0,5 мкм, заполненные ЗМ раствором хлорида калия. В электрофизиологических экспериментах применяют самые различные усилители биологических сигналов, позволяющие измерять минимальные изменения тока (до 10 А) и напряжения (до 10 -7 В) В связи с тем что регистрируемые сигналы могут иметь высокую скорость нарастания переднего фронта, усилители должны иметь достаточно широкую полосу пропускания (сотни кГц). Наибольшие требования предъявляются ко входным каскадам усилителей, которые должны быть согласованы с внутренним сопротивлением измерительного электрода, причем наибольшие трудности экспериментатор встречает при использовании микроэлектродов для регистрации быстрых изменений тока или потенциала, поскольку микроэлектроды могут иметь очень высокое внутреннее сопротивление (до 150 мОм). Стимулвторы, регистраторы, системы управления экспериментом и обработки физиологической информации еще более разнообразны и их описание можно найти в специальной литературе.
Каталог: 2014 жүктеу/скачать 2.86 Mb. Достарыңызбен бөлісу: |
Лимбическая система: миндалевидное тело (раздел 4, глава 6) Неврология онлайн: электронный учебник по неврологии | Кафедра нейробиологии и анатомии
6.1 Миндалевидное тело – общие положения
Миндалевидное тело является интегративным центром эмоций, эмоционального поведения и мотивации. Если мозг перевернуть вверх дном, конец структуры, продолжающейся с гиппокампом, называется крючком. Если вы оторвете ункус, вы обнаружите миндалевидное тело, которое примыкает к передней части гиппокампа. Как и в случае с гиппокампом, основные пути взаимодействуют в двух направлениях и содержат как эфферентные, так и афферентные волокна.
Если вы оторвете ункус, вы обнаружите миндалевидное тело, которое примыкает к передней части гиппокампа. Как и в случае с гиппокампом, основные пути взаимодействуют в двух направлениях и содержат как эфферентные, так и афферентные волокна.
Рисунок 6.1 |
6.2 Входы в миндалевидное тело
Рисунок 6.2 |
Как и в случае с гиппокампом, волокна, несущие входы в миндалину, практически во всех случаях сочетаются с волокнами, несущими выходы из миндалины.
Миндалевидное тело получает информацию от всех органов чувств, а также от внутренних органов. Поскольку миндалевидное тело играет очень важную роль в эмоциональном обучении, неудивительно, что висцеральные входы являются основным источником входных данных. Висцеральные входы исходят от гипоталамуса, области перегородки, орбитальной коры и парабрахиального ядра. Обонятельная сенсорная информация поступает из обонятельной луковицы. Слуховая, зрительная и соматосенсорная информация поступает из височной и передней поясной коры.
Поскольку миндалевидное тело играет очень важную роль в эмоциональном обучении, неудивительно, что висцеральные входы являются основным источником входных данных. Висцеральные входы исходят от гипоталамуса, области перегородки, орбитальной коры и парабрахиального ядра. Обонятельная сенсорная информация поступает из обонятельной луковицы. Слуховая, зрительная и соматосенсорная информация поступает из височной и передней поясной коры.
Рисунок 6.3 |
6.3 Основные выходные пути миндалевидного тела
- Вентральный миндалевидный путь
- Терминальная полоска
- Непосредственно в гиппокамп
- Непосредственно в энторинальную кору
- Непосредственно к дорсомедиальному ядру таламуса
6. 4 Вентральный миндалевидный путь
4 Вентральный миндалевидный путь
Вентральный миндалевидный путь. Термин «фугал» происходит от слова «фуге» — отгонять — как в слове «беглец». Этот путь продолжается к переднему обонятельному ядру, переднему продырявленному веществу, грушевидной коре, орбитофронтальной коре, передней поясной коре и вентральному полосатому телу. Вентральный стриатум включает в себя часть хвостатого ядра, скорлупу и прилежащее ядро перегородки (ядро, лежащее на перегородке). Отростки вентрального полосатого тела являются звеньями цепи базальных ганглиев, которые важны для ассоциативного обучения «стимул-реакция». Вентральный миндалевидно-фугальный путь также соединяется с гипоталамусом и ядром перегородки, но основная связь миндалевидного тела с гипоталамусом и ядром перегородки осуществляется через терминальную полоску.
Вентральный миндалевидный путь важен, потому что он является связующим звеном, посредством которого мотивация и побуждения через лимбическую систему могут влиять на реакцию. Это также связь, по которой узнаются ответы. В данном случае это звено, посредством которого происходит ассоциативное обучение. Именно здесь ответы связаны с аппетитными и аверсивными последствиями, то есть с вознаграждением и наказанием.
Это также связь, по которой узнаются ответы. В данном случае это звено, посредством которого происходит ассоциативное обучение. Именно здесь ответы связаны с аппетитными и аверсивными последствиями, то есть с вознаграждением и наказанием.
Три упрощения:
- Конечная полоска по форме, функциям и расположению аналогична своду пути гиппокампа. Таким образом, по аналогии можно сказать, что конечная полоска относится к миндалевидному телу так же, как свод к гиппокампу. Stria — это латинское слово, означающее линию, канавку или полосу. Относится к слову «полосатый».
- Конечная полоска соединяется только с подкорковыми структурами. (Соединение со структурами коры осуществляется через вентральный миндалевидный путь.)
- Конечная полоска перекрывается с вентральным миндалевидным путем в том смысле, что он также соединяется с ядрами перегородки и гипоталамусом и, таким образом, образует петлю.
Подробнее о сходстве со сводом:
Как и свод, терминальная полоска имеет прекомиссуральные и посткомиссуральные ответвления относительно передней комиссуры. Прекомиссуральная ветвь идет в септальную область. Это именно то, что делает fornix. Посткомиссуральная ветвь идет к гипоталамусу. Это именно то, что делает fornix. В то время как постспаечная ветвь свода проецируется на сосцевидные тела гипоталамуса, посткомиссуральная ветвь концевой полоски проецируется на латеральное ядро и вентрально-медиальное ядро гипоталамуса.
Прекомиссуральная ветвь идет в септальную область. Это именно то, что делает fornix. Посткомиссуральная ветвь идет к гипоталамусу. Это именно то, что делает fornix. В то время как постспаечная ветвь свода проецируется на сосцевидные тела гипоталамуса, посткомиссуральная ветвь концевой полоски проецируется на латеральное ядро и вентрально-медиальное ядро гипоталамуса.
Как и в своде, некоторые волокна входят в переднюю комиссуру креста на противоположной стороне. Как и в случае двух гиппокампов, сообщающихся друг с другом через переднюю спайку, две миндалины сообщаются друг с другом через переднюю спайку.
Конечная полоска также проецируется на хабенулу, которая является частью эпиталамуса.
Центральное ядро миндалевидного тела производит вегетативные компоненты эмоций (например, изменения частоты сердечных сокращений, артериального давления и дыхания) главным образом через выходные пути к латеральному гипоталамусу и стволу головного мозга.
Центральное ядро миндалевидного тела также производит сознательное восприятие эмоций, главным образом, через вентральный выходной путь миндалевидного тела к передней поясной коре, орбитофронтальной коре и префронтальной коре.
6.5 Подробнее о функциях миндалевидного тела
Стимуляция миндалевидного тела вызывает сильные эмоции, такие как агрессия или страх.
Ирритативные поражения височной эпилепсии имеют эффект стимуляции миндалевидного тела. В своей крайней форме ирритативные поражения височной эпилепсии могут вызывать панические атаки. Панические атаки — это короткие спонтанно повторяющиеся приступы ужаса, которые вызывают ощущение надвигающейся катастрофы без четко определенной причины. ПЭТ-сканирование показало увеличение притока крови к парагиппокампальной извилине, начиная с правой парагиппокампальной извилины. Аналогичное, но ослабленное увеличение кровотока происходит во время приступов тревоги.
Деструктивные поражения, такие как абляция миндалины, вызывают эффект, противоположный ирритативным поражениям височной эпилепсии. Деструктивные поражения миндалины вызывают у животных укрощенность, а у человека — безмятежное спокойствие, характеризующееся уплощением аффекта. Поражения миндалевидного тела могут возникать в результате болезни Урбаха-Вите, когда кальций откладывается в миндалевидном теле. Если это заболевание возникает в раннем возрасте, то эти пациенты с двусторонним поражением миндалины не могут различать эмоции по выражению лица, но их способность идентифицировать лица сохраняется. Анатомическая область распознавания лиц и памяти находится в мультимодальной ассоциативной области нижневисочной коры. Это хороший пример того, как эмоции в одной области (миндалевидное тело) связаны с восприятием в другой области (нижневисочной коре), создавая интенсивную эмоционально заряженную память.
Поражения миндалевидного тела могут возникать в результате болезни Урбаха-Вите, когда кальций откладывается в миндалевидном теле. Если это заболевание возникает в раннем возрасте, то эти пациенты с двусторонним поражением миндалины не могут различать эмоции по выражению лица, но их способность идентифицировать лица сохраняется. Анатомическая область распознавания лиц и памяти находится в мультимодальной ассоциативной области нижневисочной коры. Это хороший пример того, как эмоции в одной области (миндалевидное тело) связаны с восприятием в другой области (нижневисочной коре), создавая интенсивную эмоционально заряженную память.
Рисунок 6.4. Результаты фМРТ |
Уплощение аффекта является одним из симптомов ранее упомянутого синдрома Клювера-Бьюси, при котором у обезьян удаляли все височные доли.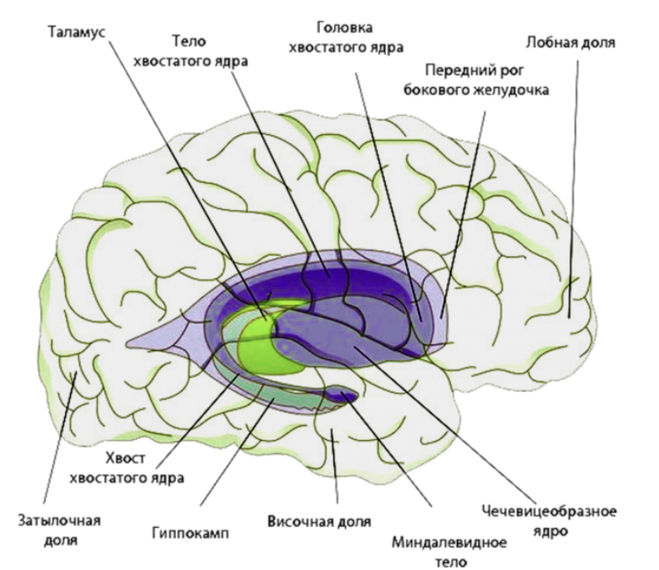 На самом деле было показано, что именно поражения миндалевидного тела в первую очередь ответственны за уплощение аффекта. Эта работа в конечном итоге привела к психохирургической технике префронтальной лоботомии. Вспомните фильм с Джеком Николсоном «Пролетая над гнездом кукушки». Префронтальная кора входит в миндалевидное тело. Разъединение этого входа вызывает уплощение аффекта, которое считалось желательным у пациентов с шизофренией, которые были агрессивно агрессивны или эмоционально возбуждены.
На самом деле было показано, что именно поражения миндалевидного тела в первую очередь ответственны за уплощение аффекта. Эта работа в конечном итоге привела к психохирургической технике префронтальной лоботомии. Вспомните фильм с Джеком Николсоном «Пролетая над гнездом кукушки». Префронтальная кора входит в миндалевидное тело. Разъединение этого входа вызывает уплощение аффекта, которое считалось желательным у пациентов с шизофренией, которые были агрессивно агрессивны или эмоционально возбуждены.
Миндалевидное тело объединяет множество различных сенсорных сигналов. Подобно гиппокампу, он сочетает в себе внешние и внутренние раздражители. Каждая сенсорная модальность имеет вход. Они интегрированы с соматосенсорными и висцеральными входами — здесь вы получаете свою «инстинктивную реакцию». Связь между префронтальной корой, областью перегородки, гипоталамусом и миндалевидным телом, вероятно, дает нам наши внутренние ощущения, эти субъективные ощущения, о том, что хорошо, а что плохо.
Здесь также соединяются память и эмоции. Когда награда особенно сладка, такое поведение и ассоциация могут длиться всю жизнь. Так же и травма и унижение наказания могут запомниться надолго.
6.6 Обусловливание страхом: пример роли миндалевидного тела в обучении
Другим примером связи эмоций с некоторым опытом восприятия является обусловливание страхом. В этом примере сенсорный опыт является слуховым, а не визуальным, как в эмоциях лиц. Многое из того, что мы знаем об миндалевидном теле и его роли в эмоциональном обучении и памяти, исходит из обусловленности страхом, в основном, но не исключительно, с животными. Это пример классической обусловленности или павловской обусловленности. В классических опытах, проведенных Павловым на рубеже веков, звучал нейтральный раздражитель — звонок, и через короткий промежуток времени собаке клали в рот пищевой порошок — безусловный раздражитель. После нескольких таких пар у собаки выделялась слюна на звук колокольчика. Важнейшим аспектом классического обусловливания является то, что это сочетание двух стимулов.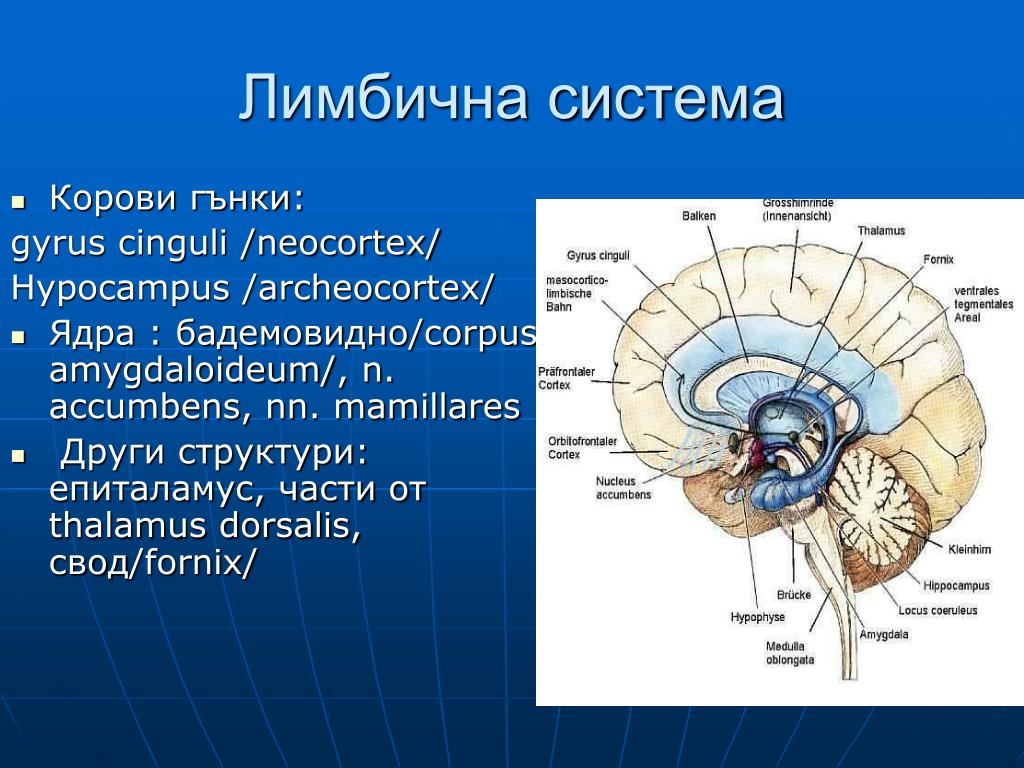 Для получения награды ответ не требуется. При обусловливании страха организм слышит шум или видит визуальный стимул. Через несколько секунд он получает легкий шок. Реакции включают замирание, повышенное кровяное давление и частоту сердечных сокращений, и он становится нервным — легко вздрагивает.
Для получения награды ответ не требуется. При обусловливании страха организм слышит шум или видит визуальный стимул. Через несколько секунд он получает легкий шок. Реакции включают замирание, повышенное кровяное давление и частоту сердечных сокращений, и он становится нервным — легко вздрагивает.
Рисунок 6.5
| ||
Рисунок 6.6 (вверху) и 6.7 (внизу) |
Пути от таламуса к миндалевидному телу особенно важны для эмоционального обучения. Выходные пути из центрального ядра миндалевидного тела образуют обширные связи со стволом мозга для эмоциональных реакций и обширные связи с областями коры через базальное ядро.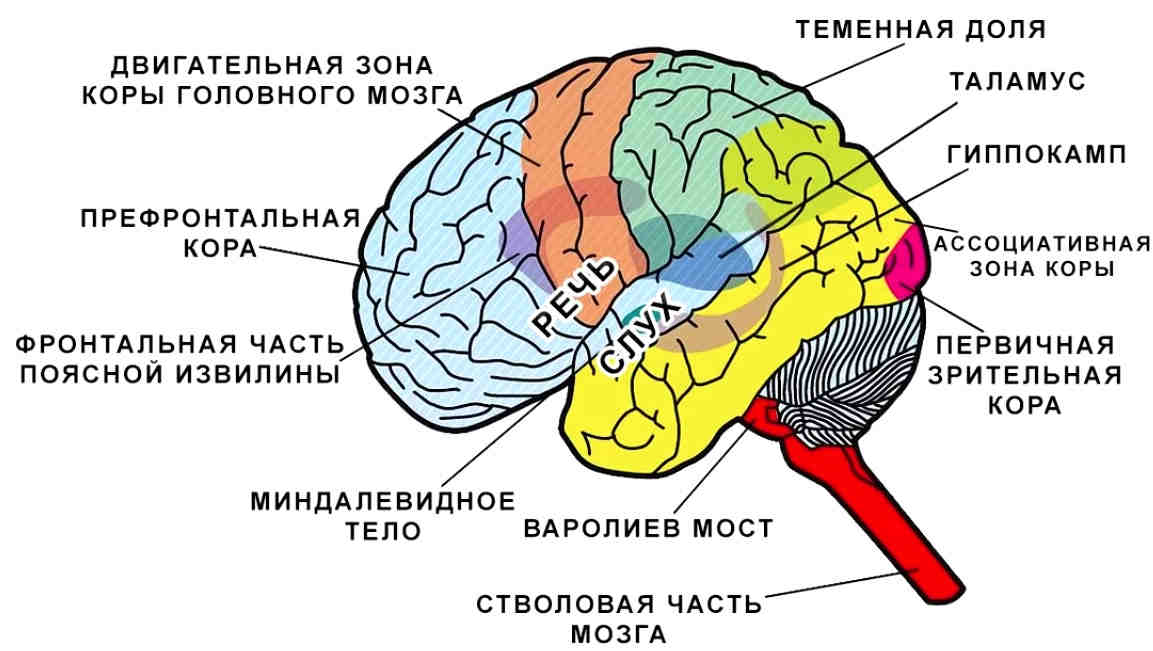 Считается, что холинергические проекции от базального ядра к коре возбуждают кору.
Считается, что холинергические проекции от базального ядра к коре возбуждают кору.
Следующая диаграмма предоставляет дополнительную информацию о выходных сигналах, контролируемых миндалевидным телом во время кондиционирования страха.
Рисунок 6.8 |
Были обнаружены некоторые пути формирования условного рефлекса страха, и это горячая тема для исследований в нейробиологии. Если, например, поврежден путь слуховой коры, базовое обусловливание страха не изменяется, но изменяется различение. В процедуре различения один звук сочетается с ударом, а другой звук не сочетается с ударом. Животные должны были полагаться исключительно на таламус и миндалевидное тело для обучения, и они не могли научиться различению; по-видимому, эти два стимула были неразличимы.
Итак, кора головного мозга не нужна для простого обусловливания страха; вместо этого он позволяет нам узнавать объект по зрению или звуку — интерпретировать окружающую среду.
Таким образом, пути от сенсорного таламуса обеспечивают лишь грубое восприятие мира, но поскольку они включают только одно нервное звено, они являются быстрыми путями. Почему FAST может быть важен? Нужна быстрая реакция на потенциальную опасность. Путь таламус-миндалевидное тело дает нам это, а также может подготовить миндалину к получению более тщательно обработанной информации от коры.
С другой стороны, пути, идущие от коры, дают подробные и точные представления об окружающей среде. Поскольку эти пути имеют несколько нейронных связей, по сравнению с ними они медленные.
Если, например, мы видим тонкую изогнутую форму за деревом, гораздо лучше отпрыгнуть назад и позже узнать, что это садовый шланг, чем не суметь быстро отпрыгнуть назад, если это была змея. Позже у нас будет достаточно времени, чтобы подумать о том, как глупо было испугаться в нашем собственном безопасном саду, где нет змей.
Рисунок 6. | Рисунок 6.10 |
Корковые и подкорковые пути обусловливания страха. | |
Зрительные стимулы, вызывающие страх, быстро обрабатываются таламусом, и эта информация передается в миндалевидное тело (красное), производя быструю реакцию (зеленое) на опасность. Таламус также передает информацию в кору, чтобы можно было сделать более осторожные (и более медленные) суждения о реальной потенциальной опасности.
Миндалевидное тело вовлечено в эмоциональное обучение, приносящее удовольствие, а также в эмоциональное обучение, связанное со страхом. Рассмотрим инструментальное обучение. В отличие от классического обусловливания, когда два стимула объединены в пары, при инструментальном обусловливании реакции сопровождаются вознаграждением, а ассоциации стимул-реакция изучаются. Таким образом, есть три события: стимул, реакция и вознаграждение. Стало ясно, что все три парные комбинации усваиваются в инструментальной обусловленности. В дело вступает миндалевидное тело, так как поражения базолатеральных ядер миндалины нарушают связь со стимулом и атрибутами вознаграждения пищи.
В дело вступает миндалевидное тело, так как поражения базолатеральных ядер миндалины нарушают связь со стимулом и атрибутами вознаграждения пищи.
Эта система памяти миндалевидного тела служит примером систем памяти в целом. Создание воспоминаний является функцией всей сети, а не какого-либо отдельного компонента. Миндалевидное тело участвует в примитивной эмоциональной памяти, которая, вероятно, сохранилась в ходе эволюции. Согласно схеме систем памяти (например, Нольте, стр. 577), декларативная память опосредована гиппокампом и корой. Но, как и в случае с корой, поражения гиппокампа мало влияют на формирование условного рефлекса страха, за исключением различения внешних раздражителей.
Исследование пациентов с повреждением миндалевидного тела, гиппокампа или того и другого ясно демонстрирует отличительную роль этих двух структур в памяти. Этим пациентам показывали слайды зеленого, синего, желтого или красного цветов. После нескольких цветов раздался громкий и пугающий звук рога. Регистрировались вегетативные ответы (через записи GSR) для определения обучения. Пациенты с миндалевидным телом не привыкли к цветам, сопровождаемым громким рогом. Но когда их спросили, сколько цветов было представлено и за какими следовал рог, их воспоминания были правильными. То есть у них была явная память о событиях. С другой стороны, пациенты с гиппокампом демонстрировали обучение и обусловливание цветов, за которыми следовал рог, но не могли вспомнить, какие именно. То есть у них была имплицитная память о событиях. Пациенты с обоими типами поражений не демонстрировали никакой обусловленности и не имели явных воспоминаний о том, за какими цветами следует рог. Глава «Обучение и память» расскажет больше о явной памяти и гиппокампе.
Регистрировались вегетативные ответы (через записи GSR) для определения обучения. Пациенты с миндалевидным телом не привыкли к цветам, сопровождаемым громким рогом. Но когда их спросили, сколько цветов было представлено и за какими следовал рог, их воспоминания были правильными. То есть у них была явная память о событиях. С другой стороны, пациенты с гиппокампом демонстрировали обучение и обусловливание цветов, за которыми следовал рог, но не могли вспомнить, какие именно. То есть у них была имплицитная память о событиях. Пациенты с обоими типами поражений не демонстрировали никакой обусловленности и не имели явных воспоминаний о том, за какими цветами следует рог. Глава «Обучение и память» расскажет больше о явной памяти и гиппокампе.
Хирургия болезни Паркинсона | Mayfield Brain & Spine, Cincinnati, Ohio
Обзор
Хирургическое лечение болезни Паркинсона (БП) и других двигательных расстройств преобладало в 1950-х и 60-х годах, но после того, как в конце 60-х годов были разработаны эффективные лекарства, оно сократилось. Возвращение к хирургическим методам лечения (паллидотомия и таламотомия) двигательных нарушений в 1990-е годы стало результатом прогресса в понимании этих нарушений, разработки сложных хирургических инструментов и снижения эффективности лекарств, которое со временем происходит в результате толерантности или побочных эффектов. последствия. Еще более перспективным является развитие глубокая стимуляция мозга (DBS), которая является своего рода кардиостимулятором для мозга. Эти хирургические процедуры могут помочь в лечении симптомов, вызванных следующими двигательными расстройствами:
Возвращение к хирургическим методам лечения (паллидотомия и таламотомия) двигательных нарушений в 1990-е годы стало результатом прогресса в понимании этих нарушений, разработки сложных хирургических инструментов и снижения эффективности лекарств, которое со временем происходит в результате толерантности или побочных эффектов. последствия. Еще более перспективным является развитие глубокая стимуляция мозга (DBS), которая является своего рода кардиостимулятором для мозга. Эти хирургические процедуры могут помочь в лечении симптомов, вызванных следующими двигательными расстройствами:
- Болезнь Паркинсона: тремор, ригидность и замедленность движений, вызванные преждевременным старением и гибелью нервных клеток, вырабатывающих дофамин, в головном мозге.
- Эссенциальный тремор : непроизвольный ритмический тремор кистей и предплечий, возникающий как в покое, так и при целенаправленных движениях. Также может поражать голову при движении «нет-нет».
Часто наследственное заболевание.
- Дистония: непроизвольные движения и длительные мышечные сокращения, приводящие к скручиванию или корчащимся движениям тела, тремору и ненормальной позе. Может затрагивать все тело или только отдельные участки. Спазмы часто можно подавить «сенсорными уловками», такими как прикосновение к лицу, бровям или рукам.
Что такое болезнь Паркинсона?
Болезнь Паркинсона (БП) — медленно прогрессирующее дегенеративное заболевание головного мозга. Он поражает нервные клетки в областях головного мозга, называемых базальными ганглиями и черной субстанцией (рис. 1). Нервные клетки черной субстанции вырабатывают дофамин, нейротрансмиттер, который действует как химический мессенджер в цепях мозга, важных для планирования и контроля движений тела. По еще не выясненным причинам дофамин-продуцирующие нервные клетки черной субстанции у некоторых людей преждевременно отмирают.
Рис. 1. Поперечный срез головного мозга. Базальные ганглии отвечают за активацию и ингибирование определенных цепей или петель обратной связи.
Базальные ганглии отвечают за активацию и ингибирование определенных цепей или петель обратной связи.Когда дофаминовые рецепторы в полосатом теле не стимулируются адекватно, части базальных ганглиев либо недостаточно, либо чрезмерно стимулируются. В частности, субталамическое ядро (STN) становится сверхактивным и действует как ускоритель на внутренний бледный шар (GPi). Чрезмерная стимуляция GPi оказывает чрезмерно тормозящее действие на таламус, что, в свою очередь, снижает его выход и вызывает замедление движения и ригидность.
Действие дофамина уравновешивается другим нейротрансмиттером, называемым ацетилхолином. При БП гибнут нервные клетки, вырабатывающие дофамин. Симптомы БП в виде тремора и скованности возникают, когда нервные клетки возбуждаются, а дофамина недостаточно для передачи сообщений. Высокий уровень глутамата, другого нейротрансмиттера, также проявляется при болезни Паркинсона, поскольку организм пытается компенсировать недостаток дофамина.
При потере 80% дофамина возникают такие симптомы, как тремор, замедленность движений, скованность и проблемы с равновесием. Лекарства являются первой линией лечения для облегчения симптомов БП. Когда медикаментозное лечение не помогает, для лечения симптомов тремора и ригидности можно использовать хирургическое лечение.
Лекарства являются первой линией лечения для облегчения симптомов БП. Когда медикаментозное лечение не помогает, для лечения симптомов тремора и ригидности можно использовать хирургическое лечение.
Я кандидат на операцию?
Если у вас есть болезнь Паркинсона, вам следует рассмотреть вопрос об операции, когда ваши лекарства становятся недостаточными для контроля ваших симптомов, если вы испытываете сильные подъемы и спады («колебания «выкл-вкл») или если ваша переносимость лекарства плохая и у вас развиваются побочные эффекты. эффекты, включая дискинезии (чрезмерное покачивание туловищем, головой и/или конечностями). Вам следует , а не рассмотреть вопрос об операции, если у вас тяжелая депрессия, прогрессирующая деменция или нестабильное состояние здоровья, или если у вас есть симптомы, которые нетипичны для болезни Паркинсона и которые могут представлять собой атипичный паркинсонизм или «Паркинсон плюс», такие как прогрессирующий надъядерный паралич или множественная системная атрофия. Важно понимать, что операция будет , а не устраняют потребность в лекарствах; это поможет сделать ваши симптомы менее серьезными, чтобы можно было использовать более низкие дозы.
Важно понимать, что операция будет , а не устраняют потребность в лекарствах; это поможет сделать ваши симптомы менее серьезными, чтобы можно было использовать более низкие дозы.
Перед тем, как принять решение о целесообразности хирургического вмешательства, ваше состояние будет тщательно оценено и оценено. Нейропсихолог оценит ваше мышление и память, а невролог рассмотрит ваш текущий режим приема лекарств и оценит ваше физическое состояние с использованием шкалы Хоэна и Яра и Единой шкалы оценки болезни Паркинсона (UPDRS), которые исследуют:
- мышление, настроение и поведение
- повседневная деятельность
- функция двигателя
- двигательные осложнения (стирание и дискинезии)
Какие хирургические варианты доступны?
Для лечения болезни Паркинсона и других двигательных нарушений доступно несколько вариантов хирургического вмешательства. Каждая процедура нацелена на определенную структуру мозга, вызывающую неконтролируемые симптомы. Поскольку левое полушарие мозга контролирует правое полушарие тела и наоборот, эти процедуры могут потребоваться для обоих полушарий мозга. Паллидотомия и таламотомия в настоящее время выполняются реже, учитывая безопасность и эффективность глубокой стимуляции мозга:
Каждая процедура нацелена на определенную структуру мозга, вызывающую неконтролируемые симптомы. Поскольку левое полушарие мозга контролирует правое полушарие тела и наоборот, эти процедуры могут потребоваться для обоих полушарий мозга. Паллидотомия и таламотомия в настоящее время выполняются реже, учитывая безопасность и эффективность глубокой стимуляции мозга:
Глубокая стимуляция мозга (DBS)
При глубокой стимуляции мозга (DBS) электрод имплантируется в нужную область мозга (субталамическое ядро, бледный шар или таламус), а затем подключается к генератору импульсов/батарее. который имплантируется под кожу ниже ключицы (рис. 2). Генератор посылает электрические сигналы для регулирования активности в нужной структуре мозга. DBS работает как кардиостимулятор для мозга. Врач может контролировать параметры стимуляции с помощью внешнего компьютера, который программирует кардиостимулятор. Поскольку DBS не разрушает навсегда какие-либо структуры мозга, он обратим, если симптомы меняются по мере прогрессирования заболевания или если будущие методы лечения требуют сохранения этих структур.
Стимуляция субталамического ядра и бледного шара контролирует замедленность движений, тремор, ригидность, а также может уменьшить дискинезии у пациентов с БП. Стимуляция бледного шара также может помочь пациентам с различными формами дистонии. Таламическая стимуляция в основном используется для пациентов с эссенциальным тремором или другими видами тремора.
Паллидотомия
Целевой структурой является внутренняя часть бледного шара (GPi), размером примерно с тик-так глубоко внутри мозга. Хирург осторожно разрушает GPi, пропуская через него высокочастотный энергетический поток и нагревая его до нужной температуры. Процедура в основном используется для облегчения дискинезии, вызванной более высокими дозами лекарств.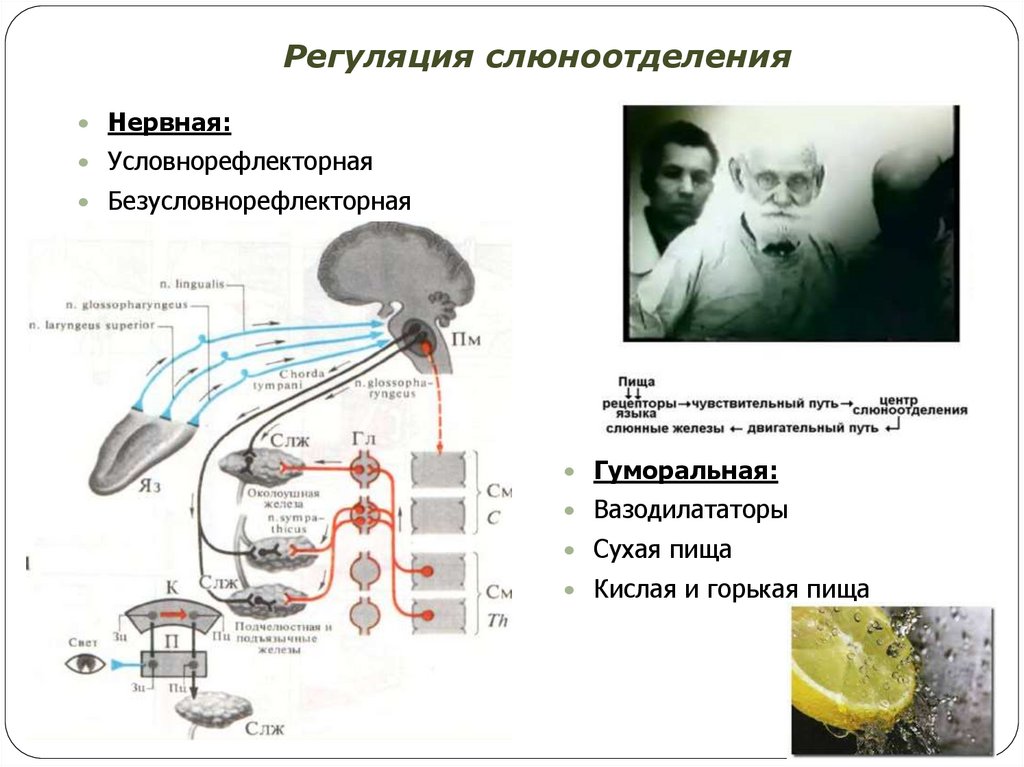
Таламотомия
Целевой структурой является заднелатеральная часть таламуса, которая находится почти в центре головного мозга. Хирург разрушает структуру, пропуская через нее высокочастотный энергетический поток и нагревая ее до нужной температуры. Процедура облегчает симптомы тремора, но, учитывая ее ограниченный эффект на ригидность и дискинезию, используется только в определенных случаях.
Трансплантация
При трансплантации ткань плода (человека или свиньи) имплантируется в структуру, называемую хвостатым ядром, которое затем прорастает и выделяет необходимые вещества, которых не хватает при БП. Трансплантация не одобрена FDA и проводится только в рамках клинических испытаний, поскольку считается экспериментальной.
Что происходит до лечения?
Во время визита в офис нейрохирург обсудит с вами преимущества и риски процедуры, ответит на ваши вопросы и попросит вас подписать формы согласия.
Пациентов госпитализируют утром перед процедурой.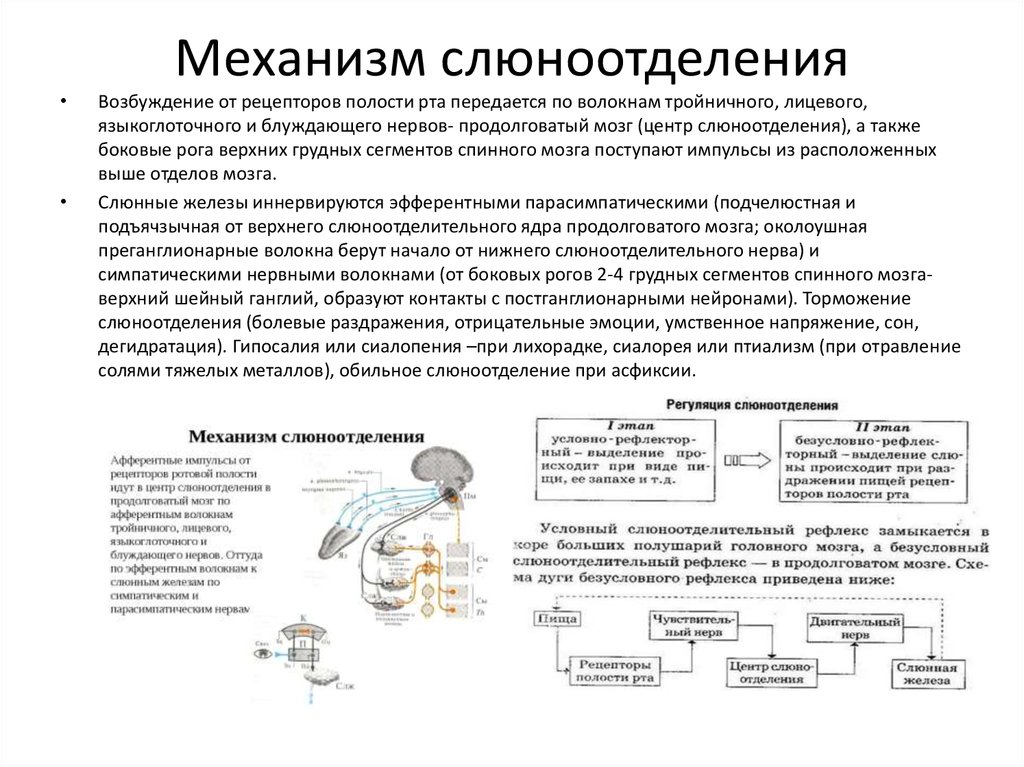 Никакая еда или питье, в том числе лекарства от болезни Паркинсона, не допускаются после полуночи в ночь перед операцией. Выполняется несколько рутинных тестов (например, анализ крови, электрокардиограмма, рентгенография грудной клетки) и вводится внутривенный катетер в руку. Анестезиолог объяснит последствия анестезии и связанные с ней риски.
Никакая еда или питье, в том числе лекарства от болезни Паркинсона, не допускаются после полуночи в ночь перед операцией. Выполняется несколько рутинных тестов (например, анализ крови, электрокардиограмма, рентгенография грудной клетки) и вводится внутривенный катетер в руку. Анестезиолог объяснит последствия анестезии и связанные с ней риски.
Что происходит во время лечения?
Процедура включает пять основных этапов. Весь процесс занимает от 5 до 7 часов; операция обычно занимает от 3 до 4 часов.
Шаг 1. Прикрепите стереотаксическую рамку
Процедура проводится стереотаксически, для чего необходимо прикрепить к голове рамку (или нимб). В места введения штифтов вводят местную анестезию, чтобы свести к минимуму дискомфорт. Вы почувствуете некоторое давление, когда штифты затянуты. На раме размещена металлическая клетка, имеющая вид птичьей клетки (рис. 3).
 Во время МРТ-сканирования поверх рамы помещается клетка-локализатор.
Во время МРТ-сканирования поверх рамы помещается клетка-локализатор. Шаг 2. МРТ или КТ
Вам сделают сканирование с использованием компьютерной томографии (КТ) или магнитно-резонансной томографии (МРТ). Стержни «птичьей клетки» отображаются на сканограмме и помогают хирургу создавать «ориентиры», которые помогут точно определить желаемую структуру мозга. Клетка удаляется после сканирования, но каркас остается на месте, чтобы зафиксировать голову во время операции.
Шаг 3. Выполните трепанацию черепа
Далее вас отвезут в операционную (ИЛИ). Вы будете размещены на операционном столе, и стереотаксическая рама будет прикреплена к столу. Это предотвращает любые небольшие движения во время этой очень точной процедуры. Вы будете бодрствовать на протяжении всей процедуры, и вам не будут давать седативные средства, поскольку они могут замаскировать симптомы Паркинсона, источник которых хирург пытается найти в головном мозге. Затем в участок на макушке вводится местный анестетик.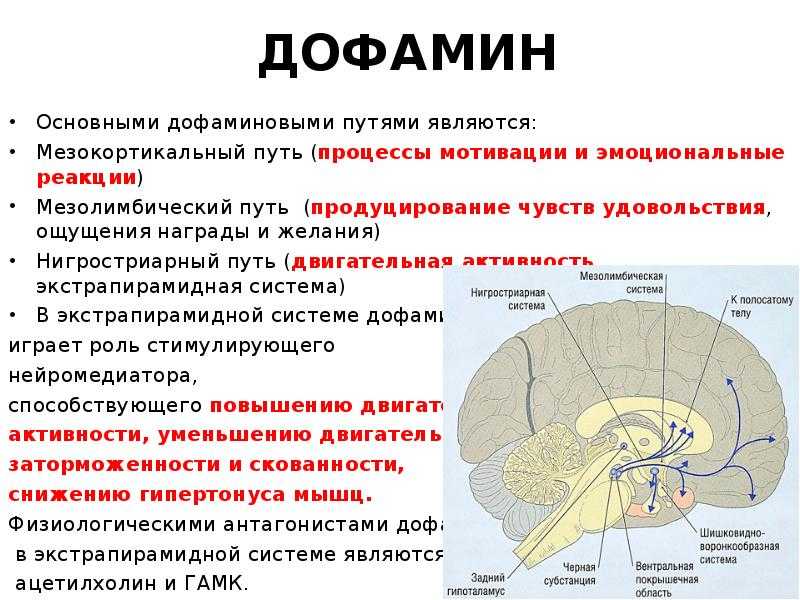 Делается небольшой разрез кожи и в черепе просверливается отверстие размером примерно с четвертак.
Делается небольшой разрез кожи и в черепе просверливается отверстие размером примерно с четвертак.
Шаг 4. Вставьте электрод в мишень
Через маленькое отверстие в ваш мозг вводится записывающий электрод. Основываясь на расчетах МРТ, электрод вводится на определенную глубину и угол внутри мозга. Точность размещения электродов подтверждена рядом испытаний. Эти тесты могут включать мигающие огни, команды поднять руки или ноги и считать числа. Кроме того, хирургическая бригада будет прослушивать правильные нервные клетки с помощью компьютерной программы, которая позволяет им слышать возбуждение клеток и видеть частоту их волн (прослушивание нервных клеток) (рис. 4). Это самая трудоемкая часть процедуры и самая важная. Ваше терпение и сотрудничество помогут хирургической бригаде выполнить свою работу.
Этап 5. Разрушение или стимуляция клеток-мишеней
При паллидотомии и таламотомии хирург определяет местонахождение нервных клеток, которые необходимо разрушить, а затем уничтожает их нагревающим током. Затем электрод удаляют.
Затем электрод удаляют.
При DBS, как только точно определены нервные клетки, хирург заменяет регистрирующий электрод постоянным отведением DBS (рис. 5). Выполняется тестовая стимуляция, и хирург с помощью пациента определяет, насколько хорошо стимуляция подавляет симптомы БП. Точная калибровка параметров стимулятора будет произведена позже при последующем визите в клинику.
Рисунок 5. Электрод точно помещается в конкретную мишень головного мозга, на этой иллюстрации в субталамическое ядро (STN).Электрод крепится к удлинителю, который необходимо провести под кожей головы, вниз по шее, к генератору, который будет имплантирован под ключицу. Для этой части процедуры вам будет дана общая анестезия. Рядом с ключицей делается небольшой надрез и вживляется нейростимулятор. Нейростимулятор/батарейка будет видна как небольшая выпуклость под кожей, но обычно ее не видно под одеждой.
Что происходит после процедуры?
После операции вы можете немедленно принять обычную дозу лекарства от болезни Паркинсона. В течение ночи вы находитесь под пристальным наблюдением в отделении интенсивной терапии. Большинство пациентов обычно выписываются домой на следующий день. Примерно через 10 дней после процедуры вам снимут швы во время визита в клинику. Если у вас была операция DBS, нейростимулятор будет запрограммирован, и дозировка вашего лекарства будет скорректирована. Важно, чтобы вы работали с неврологом и медсестрой, чтобы скорректировать лекарства и уточнить программирование стимулятора.
В течение ночи вы находитесь под пристальным наблюдением в отделении интенсивной терапии. Большинство пациентов обычно выписываются домой на следующий день. Примерно через 10 дней после процедуры вам снимут швы во время визита в клинику. Если у вас была операция DBS, нейростимулятор будет запрограммирован, и дозировка вашего лекарства будет скорректирована. Важно, чтобы вы работали с неврологом и медсестрой, чтобы скорректировать лекарства и уточнить программирование стимулятора.
Какая процедура мне подходит?
Если основной проблемой является тремор, то DBS или таламотомия предлагают наилучшие возможности для контроля тремора; однако паллидотомия также может быть эффективной. Если необходим контроль над другими симптомами, такими как ригидность, дискинезия или ходьба, то могут быть эффективными паллидотомия или DBS. Эффект DBS зависит от местоположения имплантированного электрода. В отличие от паллидотомии и таламотомии, DBS является потенциально обратимой процедурой; однако он несет в себе несколько более высокий риск заражения, а также неудобство, связанное с помехами от некоторых магнитных и высокочастотных полей.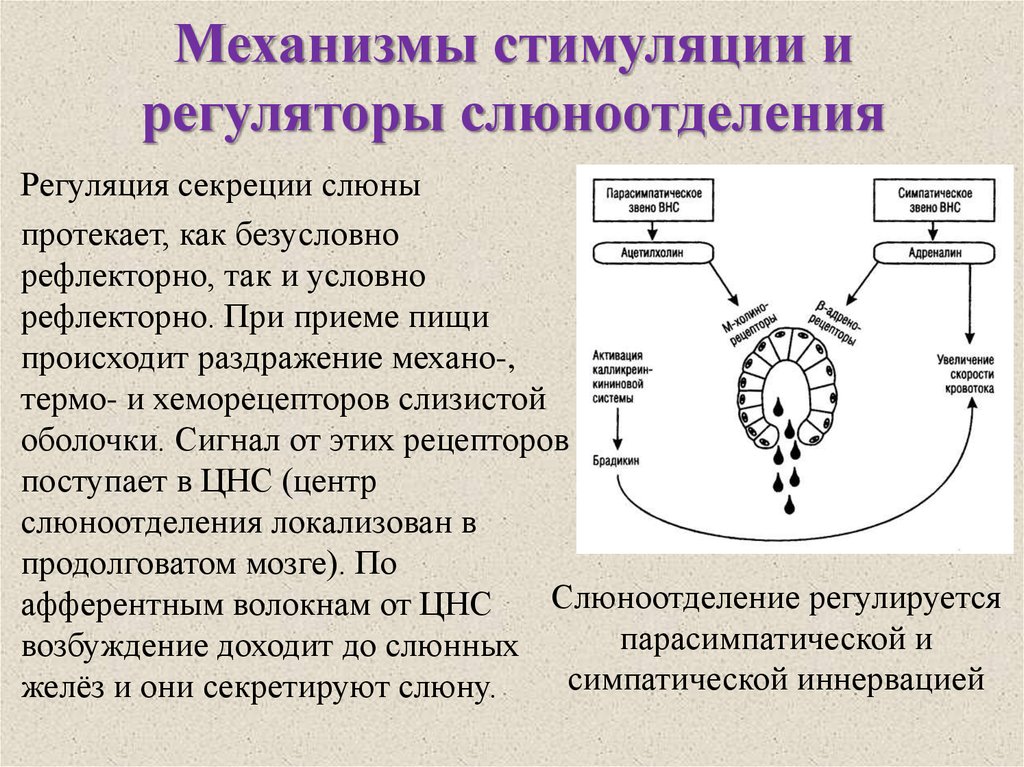 По этим и другим причинам вам следует обсудить со своим врачом, какая операция лучше всего соответствует вашим потребностям.
По этим и другим причинам вам следует обсудить со своим врачом, какая операция лучше всего соответствует вашим потребностям.
Каковы результаты?
Паллидотомия и таламотомия
Предварительные исследования показывают, что у большинства пациентов улучшение симптомов длится несколько лет. Однако, поскольку болезнь Паркинсона прогрессирует, некоторые из ваших симптомов могут вернуться, а другие симптомы могут появиться после операции.
При повторном появлении симптомов можно обсудить другие хирургические варианты; однако это определяется индивидуально в зависимости от местоположения и размера старого поражения / стимуляции, характера рецидива симптомов и вашего общего состояния здоровья.
DBS таламуса
Исследования показали, что эта процедура может значительно уменьшить тремор примерно у двух третей пациентов с БП. Тремор не может быть устранен и может продолжать вызывать некоторые нарушения.
DBS бледного шара (GPi)
Эта процедура наиболее эффективна при лечении дискинезий (непроизвольных колебательных движений), а также других видов тремора. При DBS GPi у пациентов наблюдается в среднем улучшение симптомов на 33% в состоянии «выключено» (без эффекта леводопы) и улучшение на 26% во время состояния «включено» (при таком воздействии). Их время приема лекарств увеличилось с 28 до 64% (1).
При DBS GPi у пациентов наблюдается в среднем улучшение симптомов на 33% в состоянии «выключено» (без эффекта леводопы) и улучшение на 26% во время состояния «включено» (при таком воздействии). Их время приема лекарств увеличилось с 28 до 64% (1).
DBS субталамического ядра (STN)
Эта процедура влияет на большинство двигательных признаков БП, включая брадикинезию, тремор и ригидность. При DBS STN у пациентов наблюдается в среднем улучшение симптомов на 51% в «выключенном» состоянии и на 25% — во «включенном» состоянии. Их время приема лекарств увеличилось с 27 до 74% (1).
Каковы побочные эффекты?
Побочные эффекты, связанные с процедурой, возникают менее чем в 1 из 20 случаев. К ним относятся судороги, инфекция и 1% вероятность кровоизлияния в мозг. Целевой участок находится очень близко к зрительному тракту, и повреждение тракта может привести к частичной слепоте.
Побочными эффектами, связанными с устройством DBS, являются инфекция, смещение электрода и разрыв провода, соединяющего электрод с генератором импульсов.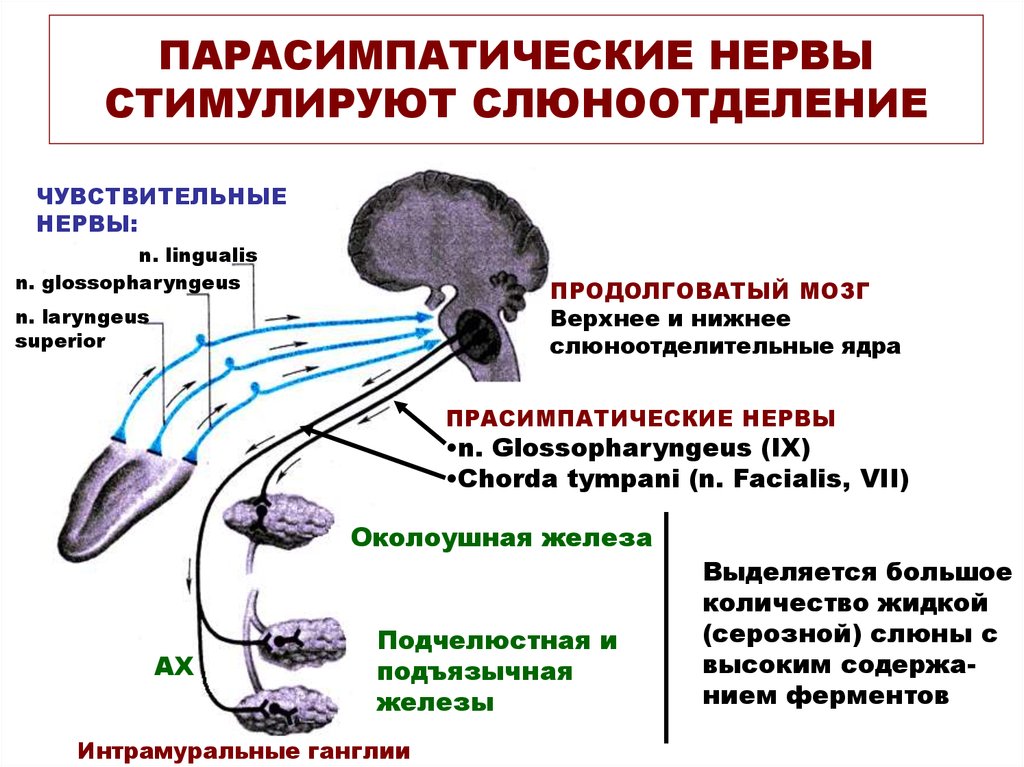 Кроме того, батарейку, имплантированную под ключицу, необходимо заменять каждые 3–5 лет.
Кроме того, батарейку, имплантированную под ключицу, необходимо заменять каждые 3–5 лет.
Жизнь с DBS
Сотовые телефоны, пейджеры, микроволновые печи, защитные двери и противоугонные датчики не повлияют на ваш стимулятор. Обязательно носите с собой удостоверение личности пациента во время полета, так как устройство обнаруживается у ворот службы безопасности аэропорта.
Клинические испытания
Клинические испытания — это научные исследования, в ходе которых новые методы лечения — лекарства, средства диагностики, процедуры, вакцины и другие методы лечения — тестируются на людях, чтобы убедиться, что они безопасны и эффективны. Всегда проводятся исследования для улучшения стандартов медицинской помощи и изучения новых лекарств и хирургических методов лечения. Вы можете найти информацию о текущих клинических исследованиях, включая их квалификационные требования, протокол и места участия в Интернете: Национальные институты здравоохранения (NIH) на сайте Clinicaltrials.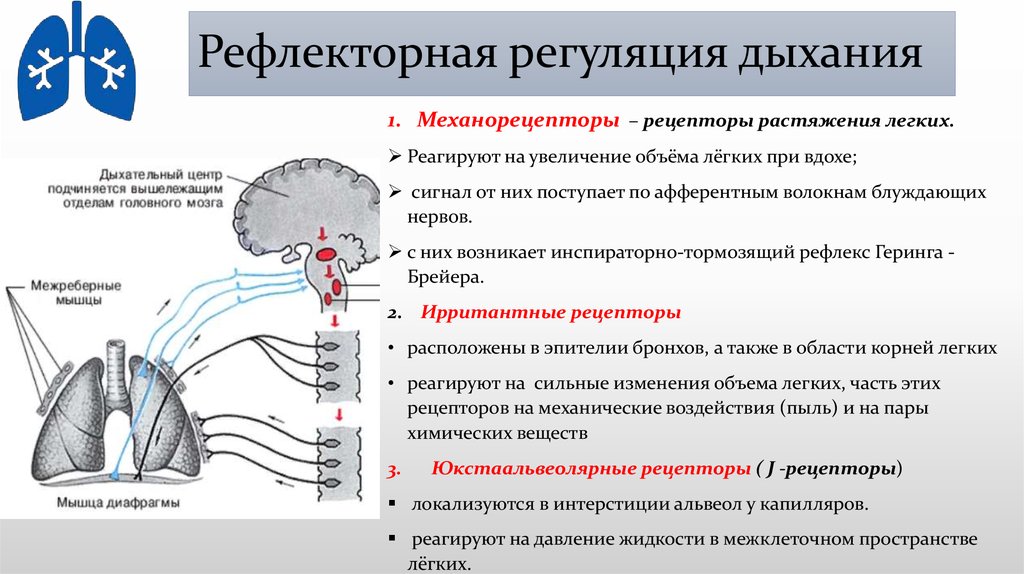 gov спонсируют многие испытания; частные предприятия и фармацевтические компании также спонсируют испытания Centerwatch.com
gov спонсируют многие испытания; частные предприятия и фармацевтические компании также спонсируют испытания Centerwatch.com
Текущие исследования
Щелкните здесь, чтобы получить информацию о клинических испытаниях, проведенных нашими врачами в местных больницах Цинциннати, или позвоните по телефону 1-800-325-7787.
Источники и ссылки
Если у вас есть какие-либо вопросы, позвоните в клинику Мэйфилд по телефону 800-325-7787.
Служба поддержки
Местные группы поддержки в Огайо, Кентукки, Индиане и Мичигане можно найти в отделении здоровья Паркинсона в штате Тристейт по телефону 513-9.48-1100 или 800-840-2732. Для всех остальных штатов обращайтесь в Американскую ассоциацию болезни Паркинсона по телефону 800-223-2732. Настройка группы поддержки позволяет пациентам и их семьям делиться опытом, получать поддержку и узнавать о достижениях в лечении и лекарствах.
Источники
- Глубокая стимуляция мозга при болезни Паркинсона Исследовательская группа: Глубокая стимуляция субталамического ядра или внутренней части бледного шара при болезни Паркинсона.
N Engl J Med 345:956-63, 2001
- Favre J, Burchiel KJ, Taha JM, Hammerstad J: Результат односторонней и двусторонней паллидотомии при болезни Паркинсона: оценка пациента. Дж. Нейрохирург 46(2):344-355, 2000
- Andaluz N, Taha JM, Dalvi A: Двусторонняя паллидная глубокая стимуляция мозга при цервикальной и туловищной дистонии. Дж. Нейрол 57: 557-558, 2001
- Taha JM, Janszen MA, Favre J: Глубокая таламическая стимуляция мозга для лечения тремора головы, голоса и двустороннего тремора конечностей. Джей Нейрохирург 91:68-72, 1999
Ссылки
Фонд болезни Паркинсона PDF.org
Национальный фонд болезни Паркинсона Parkinson.org
Американская ассоциация болезни Паркинсона APDAparkinson.org Thepi.org
Essential Tremor Foundation Essentialtremor.org
Medtronic Inc. Medtronic.com/neuro/parkinsons/activa_qa.html
Глоссарий
базальные ганглии : масса тел нервных клеток (серое вещество), расположенная глубоко в белом веществе головного мозга.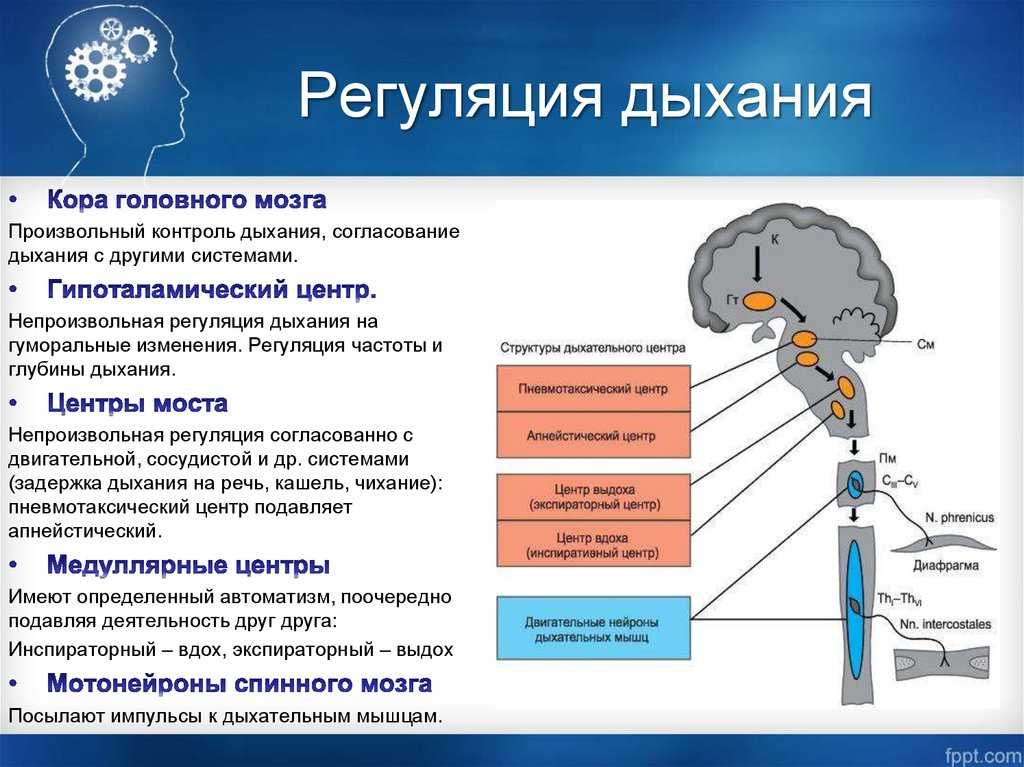 Имеет связи с областями, которые подсознательно контролируют движение.
Имеет связи с областями, которые подсознательно контролируют движение.
брадикинезия : замедленность движений, нарушение ловкости, уменьшение моргания, слюнотечение, невыразительное лицо.
хвостатое ядро: часть базальных ганглиев, участвующих в произвольном контроле движений.
дофамин : нейротрансмиттер, который передает сообщения от нейрона к нейрону через синапс.
дискинезия: аномальные непроизвольные движения, которые могут быть вызваны высокими или низкими дозами противопаркинсонических препаратов у пациентов с БП.
электрод: проводник, по которому течет электрический ток.
globus pallidus interna (GPi) : ядра головного мозга, регулирующие мышечный тонус; часть базальных ганглиев.
нейрон : основная единица нервной системы, состоящая из тела клетки, дендритов и аксона; также называется нервной клеткой.
нейротрансмиттер : химическое вещество, позволяющее передавать электрические импульсы от одной нервной клетки к другой через синапсы.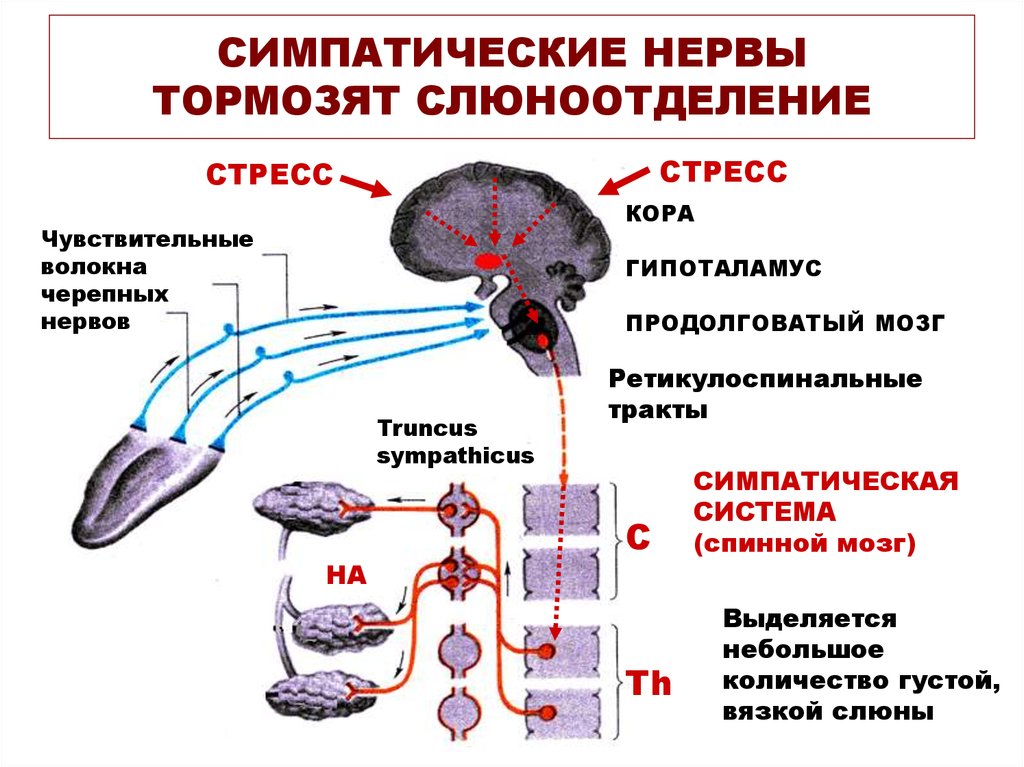 Некоторые нейротрансмиттеры включают ацетилхолин, норадреналин, дофамин, серотонин, гамма-аминомасляную кислоту и глутамат.
Некоторые нейротрансмиттеры включают ацетилхолин, норадреналин, дофамин, серотонин, гамма-аминомасляную кислоту и глутамат.
заднебоковой : сзади и сбоку.
стереотаксический: точный метод обнаружения глубоких структур мозга с использованием трехмерных координат.
черная субстанция : область мозга, где вырабатывается дофамин.
синапс : крошечный промежуток между двумя нервными клетками; высвобождение нейротрансмиттеров позволяет импульсам преодолевать эти промежутки. Некоторые клетки мозга имеют более 15 000 синапсов.
таламус : ретрансляционная станция для всех сенсорных сообщений, поступающих в мозг; часть базальных ганглиев.
обновлено: 2.2009
проверено: Alberto Espay, MD
Материалы Mayfield Certified Health Info написаны и разработаны клиникой Mayfield. Эта информация не предназначена для замены медицинской консультации вашего поставщика медицинских услуг.
Болезни базальных ганглиев
Болезни базальных ганглиев CODI 555 Двигательные расстройства речиЛекция 4.
 Заболевания базальных ганглиев: гипокинетический/гиперкинетический
Дизартрия
Заболевания базальных ганглиев: гипокинетический/гиперкинетический
Дизартрия Цепи управления базальными ганглиями
- Состоят из нескольких переплетающихся петель среди ядер базальных ганглиев. и ядра таламуса
- Полосатое тело (хвостатое тело и скорлупа) является получателем входных данных для базальных ганглиев
- Фронтальная кора, особенно премоторная область
- Ядра таламуса
- Черная субстанция
- Полосатое тело посылает выходные данные в существенную черную и бледный шар
- Globus pallidus является местом или источником главного эфферента (выходного) из базальные ганглии
- Петли
- Стриатум к бледному шару к таламусу к коре к полосатому телу
- Стриатум к черной субстанции к полосатому телу
- Бледный шар к субталамусу к бледному шару
- Эфферентные пути — основной путь от бледного шара к вентролатеральному.
 ядра таламуса, а затем обратно в кору
ядра таламуса, а затем обратно в кору
- Сайт для 2 влиятельных нейротрансмиттеров — допамина и ацетилхолина
- Баланс между этими двумя NT в стриатуме важен для управление двигателем
- Регулирование амплитуды, скорости и начала движения
- Вероятно, помощь в формировании компонентов моторных речевых программ
- Модулирование корковых разрядов/подавление нежелательных движений
- Гипокинезия — снижение подвижности
- Повышение мышечного тонуса
- Сопротивление движению
- Движения медленные, скованные, их трудно начать или остановить
- Результаты недостатка дофамина в цепях базальных ганглиев
- Гиперкинезия — непроизвольные движения
- Чрезмерное, непредсказуемое увеличение мышечного тонуса и движения
- Результат чрезмерной активности дофаминергических нервных волокон
- Дегенеративные заболевания — болезнь Паркинсона, нигростриарная дегенерация, деменционные заболевания, такие как болезни Альцгеймера и Пикса
- Множественные или двусторонние инсульты с поражением базальных ганглиев
- Токсико-метаболические — нейролептики, МФТП, хронические тяжелые воздействие металла, болезнь Вильсона
- ЧМТ — повторная травма головы как у боксеров
- Инфекционно — вирусный энцефалит
- Тремор покоя челюсти, губ, языка
- Жесткость — жесткость зубчатого колеса
- Брадикинезия — замирание
- Гипокинезия/акинезия — снижение частоты глотания
- Тремор головы, конечностей в покое, перекатывание таблеток
- Праздничная походка
- Снижение спонтанных движений, таких как взмахи руками, жесты конечностей во время речи моргание, движения головы, сопровождающие движения глаз
- Микрография
- Маскированные лица
- Потеря постуральных рефлексов
- Лицо в маске или без выражения в состоянии покоя
- Редкие глотки, приводящие к слюнотечению
- Тремор челюсти, губ, языка в покое и в длительных позах
- Направление и ритм движений в норме
- Скорость отдельных движений может быть низкой, повторяющиеся движения могут будь быстрым
- Дальность и сила уменьшены; тон чрезмерный
- Слабый или тихий голос
- Не слышно в шуме
- Скорость слишком высокая — речь неразборчивая
- Проблемы с началом речи или заикание
- Голосу не хватает эмоционального тона
- Проблемы со слюнотечением или глотанием
- Просодическая недостаточность (монотональность, монотонность, пониженное ударение, короткие фразы, переменная скорость, короткие порывы речи и неточные согласные)
- Моношаг
- Моногромкость
- Уменьшена общая громкость
- Переменная ставка
- Короткие порывы речи
- Некоторые неуместные молчания
- Повреждение цепей управления базальными ганглиями, участков мозжечка цепи управления или непрямые пути активации
- Часто является результатом нейрохимических аномалий, а не структурных поражения
- Дегенеративные заболевания — Huntingtons
- Токсико-метаболические — нейролептики или нейролептики, поздняя дискинезия
- Неизвестной этиологии — синдром Туретта, синдром Мейжа
- Аномальные непроизвольные движения возникают в состоянии покоя, во время устойчивых поз.
 или во время произвольного движения
или во время произвольного движения - гипер относится к чрезмерным или дополнительным движениям и не подразумевает что скорость непроизвольных движений высока
- Скорость движений может варьироваться от очень быстрой до медленной
- Паттерн движений может быть ритмичным или нерегулярным
- Как правило, произвольные движения пораженных частей тела замедлены
- Дискинезия
- Миоклонус
- Тики
- Хорея
- Баллизм
- Атетоз
- Дистония
- Спазм
- Тремор
- Неритмичные гиперкинезы — невнятная, медленная или прерывистая речь — жесткая выйти
- Чувство стеснения, невозможность пошевелить пораженной структурой
- Гортанные гиперкинезы – голос дрожит, голос сдавлен или смыкается, голос не хочет выходить
- Одышка/утомляемость во время речи, но не во время неречевой деятельности
- Развитие сенсорных трюков
- Возможные проблемы со слюнотечением, жеванием и глотанием
- Временные и непредсказуемые симптомы, включая гиперназальность, резкое напряжение, хрипы, артикуляционные искажения, вариации громкости и внезапные форсированные вдох и выдох
- Вышеупомянутое в сочетании с попытками избежать/компенсировать часто приводит к длительные интервалы и фонемы, переменная скорость, неуместные паузы, остановка голоса и нарушенный стресс
- Жалобы на застревание пищи в горле; трудности с жеванием
- Движения, наиболее заметные в покое или в длительных позах
- Нарушены почти все аспекты движения
- Неточность и нерегулярные артикуляционные нарушения
- Недопустимые изменения громкости и скорости
- Натужная резкость, преходящая хрипота, слышимое вдохновение
- Поражает шейные мышцы шеи
- Воздействие на речь считается вторичным по отношению к аномальному положению шеи
- Обычно артикуляционно-ларингеальный характер
- Медленное начало речи, уменьшенная максимальная продолжительность, пониженный тон и вариабельность высоты тона, дисфония и сниженный темп
- Пт.




 1. ФИЗИОЛОГИЯ ВОЗБУДИМЫХ ТКАНЕЙ
1. ФИЗИОЛОГИЯ ВОЗБУДИМЫХ ТКАНЕЙ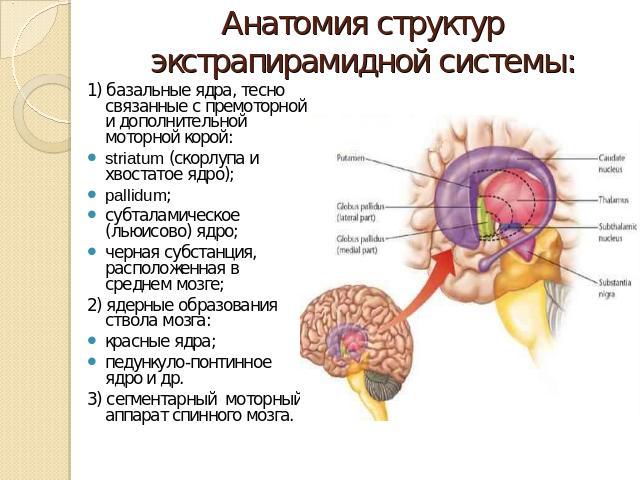
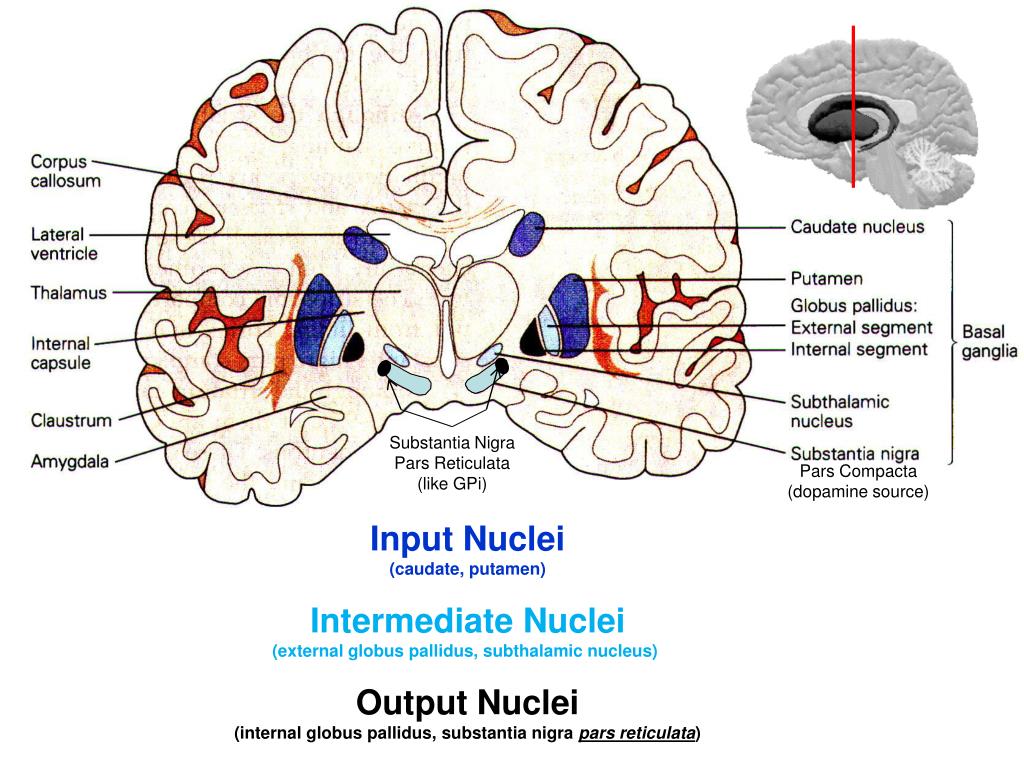
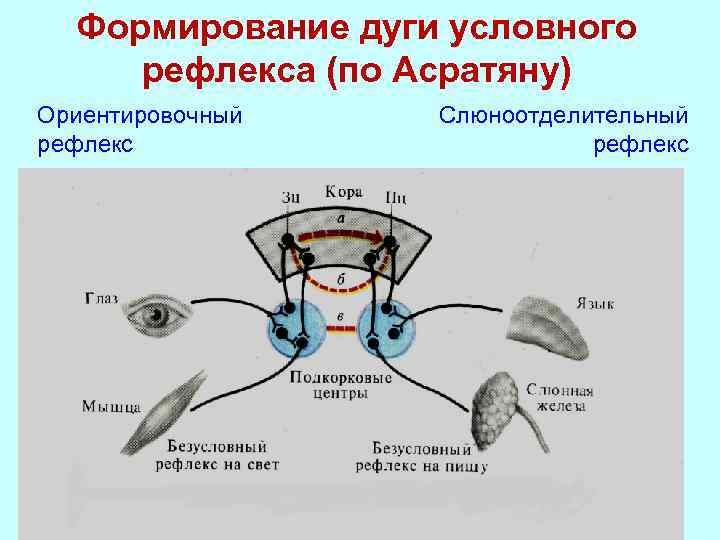

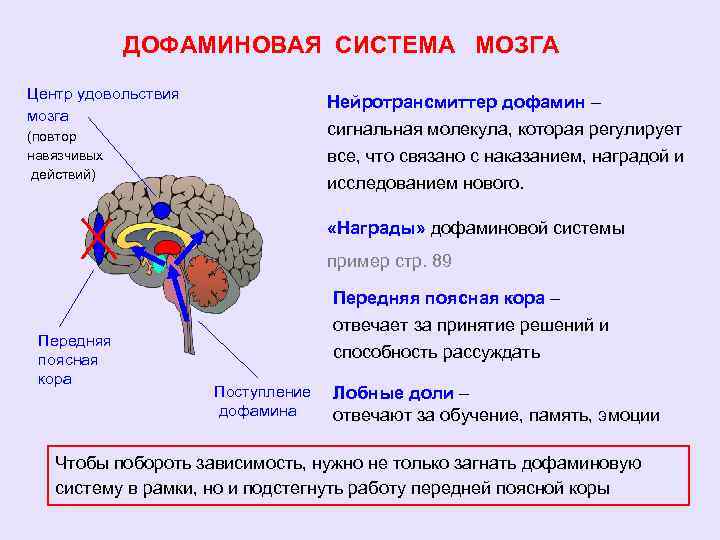
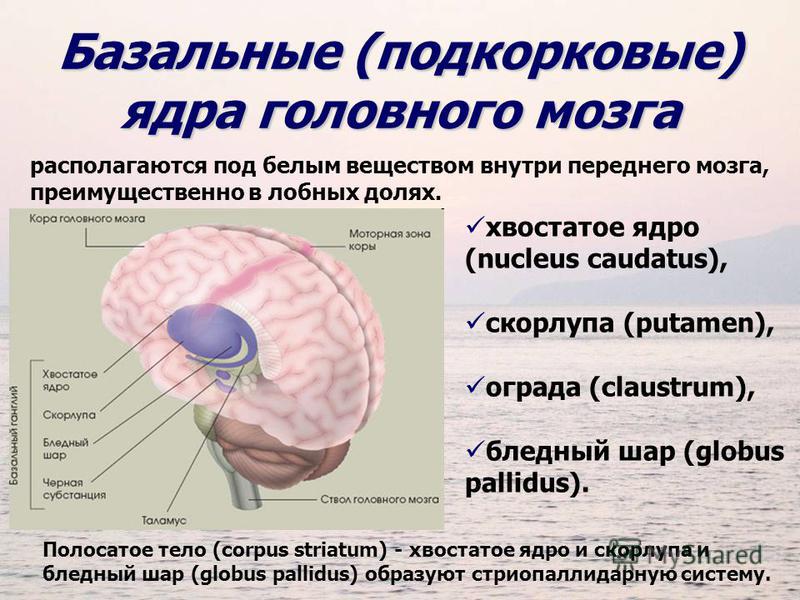 Размер каналов довольно мал (диаметр 0,5—0,7 нм). Расчеты показывают, что суммарная площадь каналов занимает незначительную часть поверхности клеточной мембраны.
Размер каналов довольно мал (диаметр 0,5—0,7 нм). Расчеты показывают, что суммарная площадь каналов занимает незначительную часть поверхности клеточной мембраны. При этом трансмембранная разность потенциалов не изменяется. Совместное использование метода фиксации потенциала и специфических блокаторов ионных каналов привело к открытию различных типов ионных каналов в клеточной мембране.
При этом трансмембранная разность потенциалов не изменяется. Совместное использование метода фиксации потенциала и специфических блокаторов ионных каналов привело к открытию различных типов ионных каналов в клеточной мембране.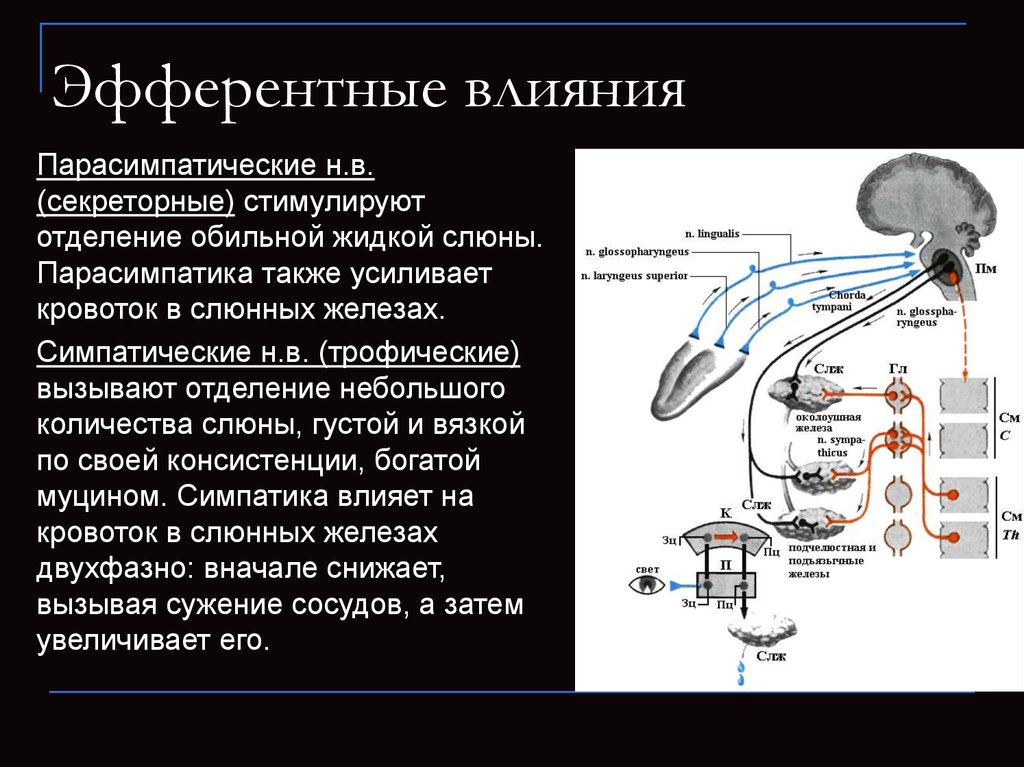 При этом часть мембраны подсасывается к микроэлектроду. Если в зоне присасывания оказывается ионный канал, то регистрируют активность одиночного канала. Система раздражения и регистрации активности канала мало отличается от системы фиксации напряжения.
При этом часть мембраны подсасывается к микроэлектроду. Если в зоне присасывания оказывается ионный канал, то регистрируют активность одиночного канала. Система раздражения и регистрации активности канала мало отличается от системы фиксации напряжения. ТЭА — тетраэтиламмоний; ТТХ — тетродотоксин.
ТЭА — тетраэтиламмоний; ТТХ — тетродотоксин. Horn, 1982).
Horn, 1982).


 Кальциевые каналы играют существенную роль в клетках сердца. Электрогенез кардиомиоцитов рассматривается в главе 7. Электрофизиологические характеристики клеточных мембран исследуют с помощью специальных методов.
Кальциевые каналы играют существенную роль в клетках сердца. Электрогенез кардиомиоцитов рассматривается в главе 7. Электрофизиологические характеристики клеточных мембран исследуют с помощью специальных методов.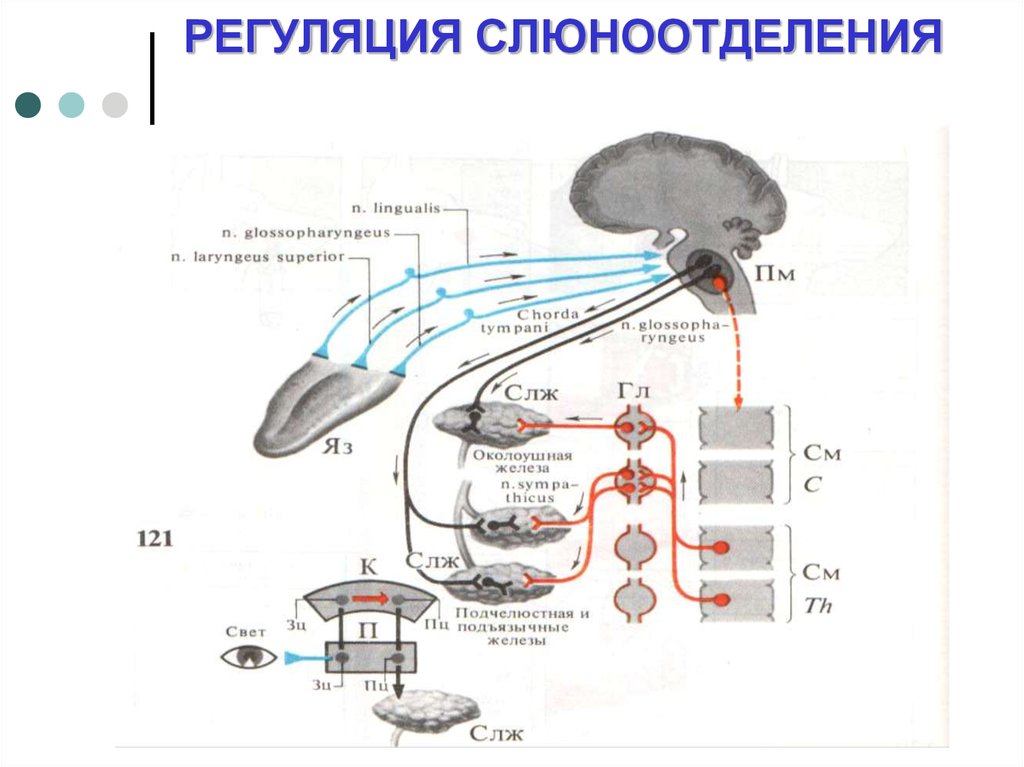
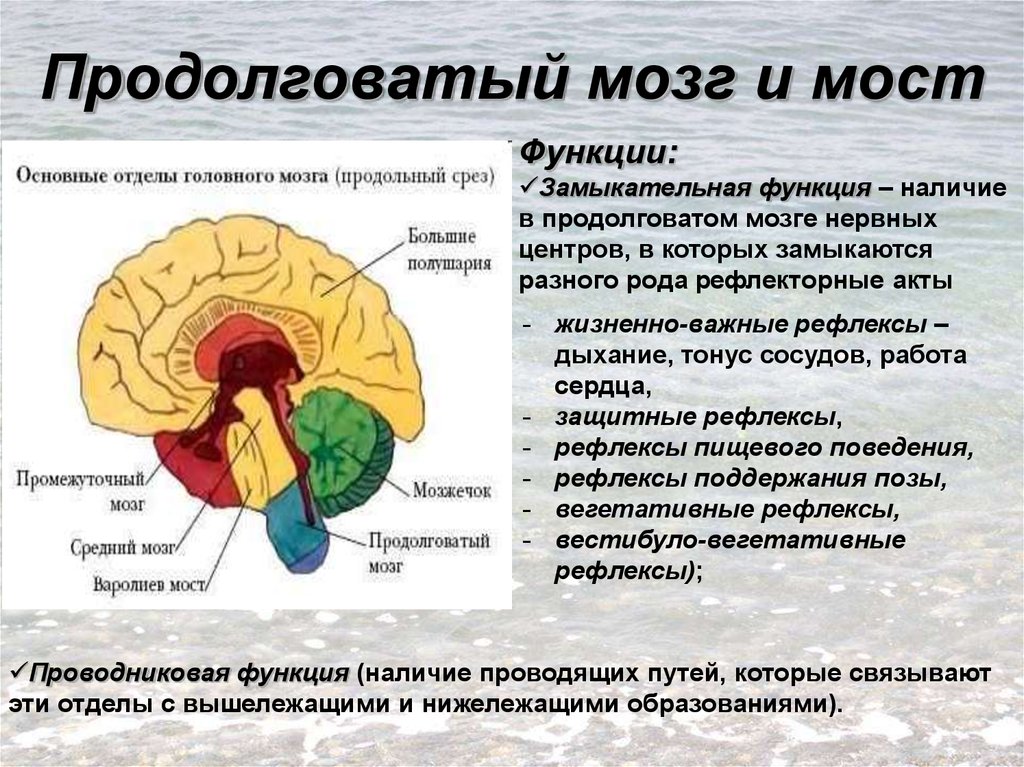
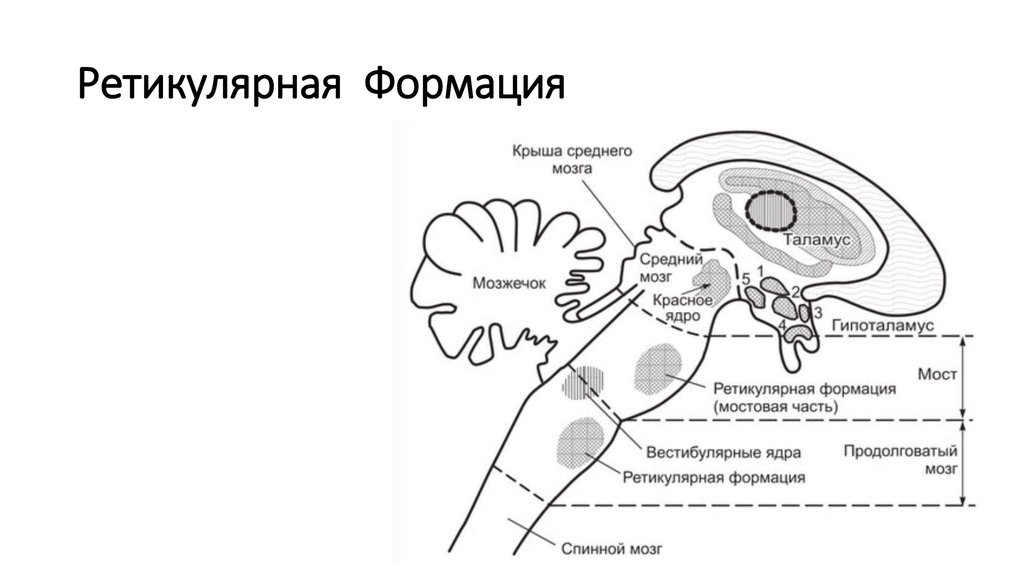 Чтобы избежать возможных искажений в электрофизиологических экспериментах, как правило, используют специальные слабополяризующиеся электроды, например хлорсеребряные или каломельные, имеющие незначительный поляризационный потенциал.
Чтобы избежать возможных искажений в электрофизиологических экспериментах, как правило, используют специальные слабополяризующиеся электроды, например хлорсеребряные или каломельные, имеющие незначительный поляризационный потенциал.
 Қажырлы еңбекті қажет ететін, келешегі кемел Нұрлы Жолда бірлігімізді бекемдеп, аянбай тер төгуіміз керек
Қажырлы еңбекті қажет ететін, келешегі кемел Нұрлы Жолда бірлігімізді бекемдеп, аянбай тер төгуіміз керек 9
9 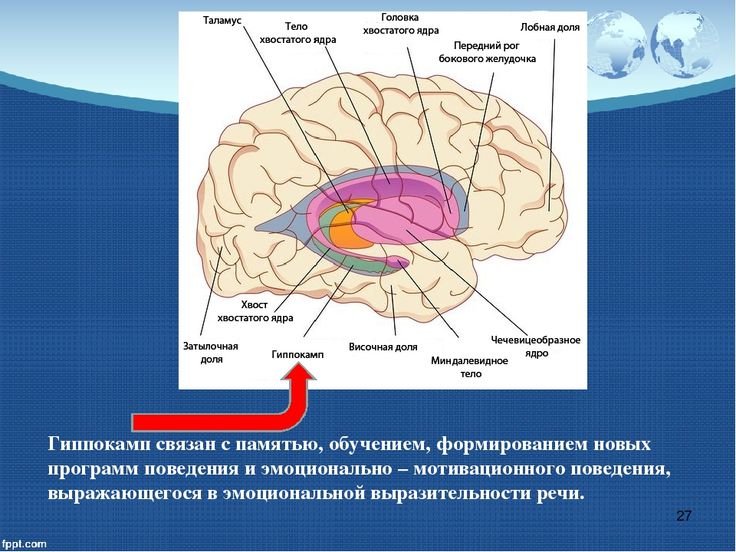 Часто наследственное заболевание.
Часто наследственное заболевание. N Engl J Med 345:956-63, 2001
N Engl J Med 345:956-63, 2001 ядра таламуса, а затем обратно в кору
ядра таламуса, а затем обратно в кору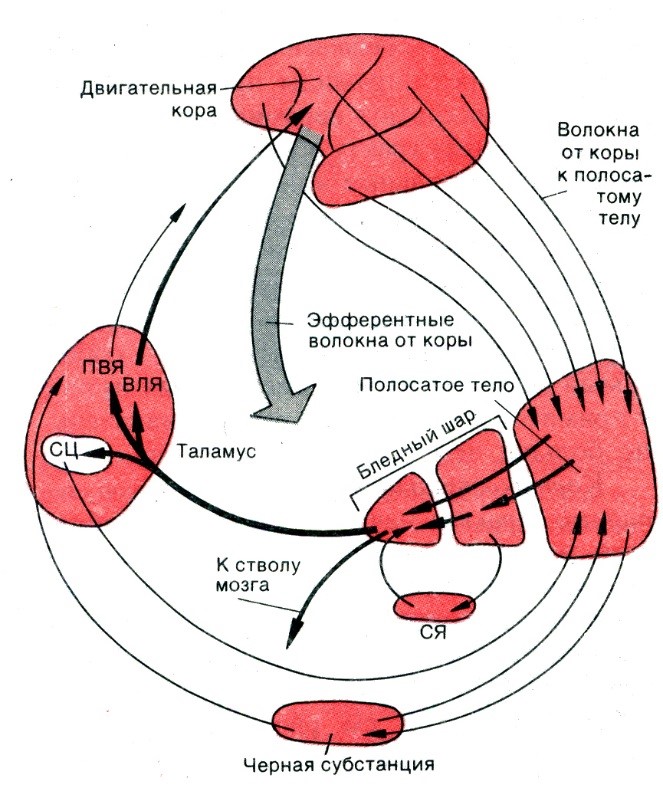 или во время произвольного движения
или во время произвольного движения