Слизистые оболочки – важный участок защитного барьера организма
Авторы: А.Г. Никоненко, к.б.н.; НИИ физиологии АН Украины им. А.А. Богомольца, г. Киев
27.03.2015
Нормальная жизнедеятельность человеческого организма предполагает поддержание условий внутренней среды, которые в значительной степени отличаются от условий среды внешней. Область контакта этих двух сред имеет важнейшее значение для целостности всего организма, поэтому структура и функция поверхностных тканей во многом подчинена формированию барьера между клетками организма и внешней средой. Снаружи тело покрыто кожей, а функцию барьера внутри тела выполняют слизистые оболочки, которые выстилают различные трубчатые и полые органы. Наиболее важное значение имеют органы желудочно-кишечного, респираторного и урогенитального трактов. Менее значимы слизистые оболочки других органов, например конъюнктива.
Менее значимы слизистые оболочки других органов, например конъюнктива.
Несмотря на разнообразие функций различных слизистых, они имеют общие черты строения. Их наружный слой сформирован эпителием, а подлежащий слой соединительной ткани обильно снабжен кровеносными и лимфатическими сосудами. Еще ниже может располагаться тонкий слой гладкомышечной ткани. Кожа и слизистые оболочки формируют физический и экологический барьер, который препятствует проникновению патологических агентов внутрь организма [3]. Механизмы защиты, однако, у них кардинально отличны.
Наружный слой кожи представлен прочным многослойным ороговевающим епителием, эпидермисом. На поверхности кожи, как правило, мало влаги, а секреты желез кожи препятствуют размножению микроорганизмов. Эпидермис непроницаем для влаги, противодействует повреждающему действию механических факторов и препятствует проникновению бактерий внутрь организма. Задача поддержания защитных свойств слизистыми значительно более сложна по целому ряду причин.
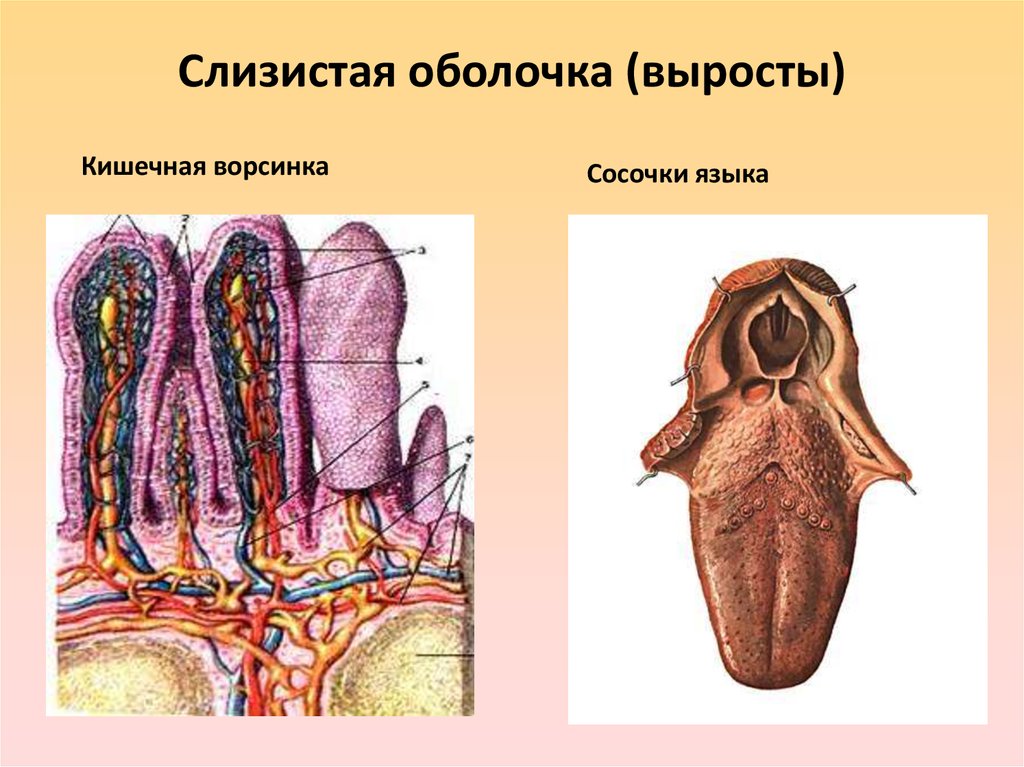
Еще одна специфика слизистых оболочек как защитного барьера – увлажненность их поверхности. Наличие влаги создает условия, способствующие размножению микроорганизмов и диффузии токсинов внутрь организма. Существенным фактором является и то, что совокупная площадь поверхности слизистых оболочек организма намного превосходит поверхность кожи. В одном лишь тонком кишечнике за счет многочисленных пальцеобразных выростов стенки кишки, а также микроворсинок плазматической мембраны эпителиоцитов площадь поверхности слизистой достигает 300 м
Микроорганизмы заселяют почти все участки слизистых оболочек, хотя их распределение и численность весьма неоднородны и определяются анатомическими и физиологическими особенностями слизистых. Наибольшее видовое разнообразие микроорганизмов отмечено в желудочно-кишечном тракте (ЖКТ), здесь выявляется около 500 видов. Число микробных клеток в кишечнике может достигать 1015, что значительно превышает число собственных клеток организма-хозяина. Напротив, на слизистых мочевого пузыря и почек, а также нижних отделов дыхательного тракта микроорганизмы в норме отсутствуют [30].
В зависимости от условий, которые могут сильно отличаться, в различных слизистых доминируют те или иные микроорганизмы. Например, в ротовой полости ряд микроорганизмов специально адаптирован к анаэробным условиям десневых карманов, другие же обладают способностью удерживаться на поверхности зубов. В ротовой полости выявляются бактерии родов Streptococcus, Neisseria, Veillonella, Staphylococcus, Fusobacterium, Corynebacterium, Actinomyces, Haemophilus, Lactobacillus и Bacteroides.
 Здесь также встречаются грибы (Candida albicans) и простейшие (Entamoeba gingivalis) [26].
Здесь также встречаются грибы (Candida albicans) и простейшие (Entamoeba gingivalis) [26]. Микроорганизмы, присутствующие в верхних дыхательных путях, сходны с таковыми в ротовой полости. В носовой полости и глотке присутствуют резидентные популяции микробов. В хоанах могут встречаться бактерии рода Neisseria, причем возбудитель менингита N. meningitidis выявляется здесь примерно у 5% здоровых индивидуумов. Ротовая область глотки содержит бактерии многих видов, однако в количественном отношении здесь доминируют стрептококки.
 , а также могут присутствовать грамотрицательные палочки Escherichia coli. Плотность и многообразие микрофлоры увеличивается по мере продвижения вдоль ЖКТ, достигая максимума в толстом кишечнике. В ободочной кишке бактерии составляют около 55% твердого содержимого. Здесь постоянно присутствуют бактерии 40 видов, хотя выявить можно представителей, по меньшей мере, 400 видов. Численность анаэробных микроорганизмов в толстом кишечнике превосходит аэробов в 100-1000 раз [30].
, а также могут присутствовать грамотрицательные палочки Escherichia coli. Плотность и многообразие микрофлоры увеличивается по мере продвижения вдоль ЖКТ, достигая максимума в толстом кишечнике. В ободочной кишке бактерии составляют около 55% твердого содержимого. Здесь постоянно присутствуют бактерии 40 видов, хотя выявить можно представителей, по меньшей мере, 400 видов. Численность анаэробных микроорганизмов в толстом кишечнике превосходит аэробов в 100-1000 раз [30].Состав микрофлоры вагины здоровой женщины включает более 50 видов анаэробных и аэробных бактерий и может меняться в зависимости от гормонального статуса. Здесь находятся Streptococcus spp., Сorynebacterium, Mycobacterium, Candida spp., а доминируют бактерии рода Lactobacillus [24]. Микробные клетки часто обнаруживаются в дистальных отделах урогенитального тракта. Микрофлора уретры напоминает таковую кожи (Staphylococcus spp., Streptococcus spp.) и может время от времени содержать Escherichia coli. Колонизацию более высоких отделов тракта предотвращает смывание микроорганизмов мочой.
 Мочевой пузырь и почки, как правило, являются стерильными.
Мочевой пузырь и почки, как правило, являются стерильными. Отношения организма хозяина и микроорганизмов могут относиться к симбиозу, когда оба, и микроб и хозяин, получают выгоду от совместного существования. Примером таких микроорганизмов могут быть представители нормальной микрофлоры кожи. Организм хозяина обеспечивает им питательные вещества и тепло, в то время как бактерии продуцируют кислоты, понижающие рН кожи, и предотвращают колонизацию ее более опасными микробами (например, Staphylococcus epidermidis). Бактерии также могут сосуществовать с макроорганизмом на условиях комменсализма, когда микроб получает выгоду, а организм хозяина, не получая выгоды, в то же время не страдает от контакта с бактерией. Таким образом взаимодействуют с организмом человека большинство представителей нормальной микрофлоры. И, наконец, организм хозяина может страдать от бактерий, вызывающих болезнь (паразитизм). Следует, однако, отметить, что многие микроорганизмы-комменсалы способны при определенных обстоятельствах вызывать болезни.

Нормальная микрофлора слизистых оболочек находится в состоянии симбиоза с организмом и выполняет целый ряд важных функций. Ее становление происходило на протяжении миллионов лет, а поэтому эволюцию слизистых оболочек корректнее рассматривать как совместную эволюцию их симбиоза с микроорганизмами [2]. Одной из важных функций микрофлоры является трофическая. Например, анаэробная кишечная микрофлора разлагает полисахариды, не гидролизуемые собственными пищеварительными ферментами организма [6]. При брожении моносахаридов с участием сахаролитических анаэробов ЖКТ образуются короткоцепочечные жирные кислоты [9, 10], которые в значительной мере восполняют энергетические потребности эпителиоцитов толстой кишки и других клеток организма. Нарушение обеспечения эпителиоцитов этими кислотами является одним из звеньев патогенеза язвенного колита [9] и таких функциональных болезней, как синдром раздраженной толстой кишки [33].
Важной ролью кишечной микрофлоры является детоксикация организма.

Следует также упомянуть образование микрофлорой активных метаболитов, которые могут использоваться организмом человека – γ-аминомасляной кислоты, путресцина и других соединений [21, 34]. Микрофлора кишечника поставляет хозяину витамины группы В, витамин К, участвует в обмене железа, цинка и кобальта [10]. Например, источником 20% незаменимой аминокислоты – лизина, попадающей в организм человека, является микрофлора кишечника [19]. Еще одной важной функцией бактериальной микрофлоры является стимуляция моторной активности кишки [35], а также поддержание водного и ионного гомеостаза организма [8].
Благотворные эффекты нормальной микрофлоры включают предотвращение колонизации и инфекции благодаря конкуренции с патогенными микроорганизмами за пространство и питательные вещества.
 Нормальная резидентная микрофлора посредством низкомолекулярных метаболитов, а также специальных антимикробных веществ подавляет жизнедеятельность ряда патогенных микроорганизмов [15].
Нормальная резидентная микрофлора посредством низкомолекулярных метаболитов, а также специальных антимикробных веществ подавляет жизнедеятельность ряда патогенных микроорганизмов [15]. Одним из главных защитных механизмов слизистой оболочки является увлажнение ее поверхности слизью, которая вырабатывается либо отдельными клетками, либо специализированными многоклеточными железами. Слизь играет важную роль в предотвращении проникновения патогенов внутрь организма, формируя вязкий слой, который связывает патогены. Активное перемещение слизи вдоль поверхности слизистой способствует дальнейшему удалению микроорганизмов. Например, в дыхательном тракте слизь перемещается за счет деятельности ресничек многорядного эпителия, а в кишечнике – за счет перистальтической активности последнего. В некоторых местах, в конъюнктиве, ротовой и носовой полостях, урогенитальном тракте микробы удаляются с поверхности слизистых с помощью смывания соответствующими секретами. Слизистая оболочка полости носа вырабатывает в течение дня около полулитра жидкости.
Важным фактором поддержания баланса в экосистеме микрофлора – макроорганизм является адгезия, посредством которой организм контролирует численность бактерий. Механизмы адгезии весьма разнообразны и включают как неспецифические, так и специфические взаимодействия с участием специальных молекул – адгезинов. Для установления адгезионного контакта бактериальная клетка и клетка-мишень должны преодолеть электростатическое отталкивание, так как их поверхностные молекулы в норме несут отрицательный заряд. Сахаролитические бактерии обладают необходимым ферментным аппаратом для отщепления отрицательно заряженных фрагментов. Возможны и гидрофобные адгезивные контакты между бактериями и эпителиоцитами слизистых [7, 13]. Адгезия микроорганизмов к поверхности эпителия слизистой может также осуществляться при помощи фимбрий, упорядоченно расположенных нитевидных выростов на поверхности бактериальных клеток.
 Однако наиболее важную роль играют взаимодействия между адгезинами и рецепторами эпителиоцитов слизистых, некоторые из которых являются видоспецифичными [12, 22].
Однако наиболее важную роль играют взаимодействия между адгезинами и рецепторами эпителиоцитов слизистых, некоторые из которых являются видоспецифичными [12, 22]. Несмотря на защитную функцию эпителия и бактерицидное действие секретов, некоторые патогены все же попадают внутрь организма. На этом этапе защита реализуется за счет клеток иммунной системы, которыми богата соединительнотканная составляющая слизистой. Здесь много фагоцитов, тучных клеток и лимфоцитов, часть из которых рассеяна в тканевом матриксе, а другая часть формирует агрегаты, что наиболее ярко проявляется в миндалинах и аппендиксе. Агрегаты лимфоцитов многочисленны в подвздошной кишке, где они носят название пейеровых бляшек. Антигены из просвета кишки могут проникать в пейеровы бляшки через специализированные эпителиальные М-клетки. Эти клетки находятся непосредственно над лимфатическими фолликулами в слизистой кишечника и респираторного тракта [16]. Процесс представления антигенов при посредничестве М-клеток приобретает особо важное значение во время лактации, когда антигенпродуцирующие клетки из пейеровых бляшек мигрируют в молочную железу и секретируют антитела в молоко, таким образом обеспечивая новорожденного пассивным иммунитетом против патогенов, с которыми контактировала мать.

В пейеровых бляшках кишечника преобладают В-лимфоциты, ответственные за развитие гуморального иммунитета, они составляют здесь до 70% клеток. Большинство плазматических клеток в слизистых продуцируют Ig А, в то время как клетки, секретирующие Ig G и Ig М, преимущественно локализованы в тканях, не содержащих слизистых поверхностей.
Ig A – это основной класс антител в секретах дыхательных путей и кишечного тракта. Молекулы Ig A в составе секретов представляют собой димеры, соединенные в «хвостовой» части белком, известным как J-цепь, а также содержат дополнительный полипептидный компонент, называемый секреторным. Димеры Ig A приобретают секреторный компонент на поверхности эпителиоцитов. Он синтезируется самими эпителиальными клетками и экспонируется вначале на их базальной поверхности, где служит рецептором для связывания Ig A из крови. Образующиеся комплексы Ig A с секреторным компонентом поглощаются путем эндоцитоза, проходят через цитоплазму эпителиоцита и выводятся на поверхность слизистой.
 В дополнение к транспортной роли секреторный компонент, возможно, защищает молекулы Ig A от протеолиза пищеварительными ферментами [1].
В дополнение к транспортной роли секреторный компонент, возможно, защищает молекулы Ig A от протеолиза пищеварительными ферментами [1]. Секреторный Ig A в слизи действует как первая линия иммунной защиты слизистых, нейтрализующая патогены. Исследования показали, что присутствие секреторного Ig A коррелирует с устойчивостью к инфицированию различными патогенами бактериальной, вирусной и грибковой природы [18, 25]. Другим важным компонентом иммунной защиты слизистых являются Т-лимфоциты. Т-клетки одной из популяций контактируют с эпителиоцитами и оказывают защитный эффект, убивая инфицированные клетки и привлекая другие иммунные клетки к борьбе с патогеном [11]. Интересно, что источником этих лимфоцитов у мыши являются кластеры клеток, находящиеся непосредственно под эпителиальной выстилкой кишечника [27]. Т-клетки способны перемещаться в тканях слизистой благодаря специальным «homing»-рецепторам на их мембранах [22, 31]. Если иммунный ответ развивается в слизистой ЖКТ, Т-клетки могут перемещаться в другие слизистые, например легких или носовой полости, обеспечивая защиту организма на системном уровне [18, 32].
Важное значение имеет взаимодействие между ответом слизистой оболочки и иммунным ответом в масштабах всего организма. Показано, что системное стимулирование иммунной системы (например, путем инъекции или через дыхательные пути) приводит к выработке антител в организме, но может не вызывать ответа слизистых. С другой стороны, стимуляция иммунного ответа слизистых может приводить к мобилизации иммунных клеток как в слизистой, так и в масштабах всего организма [18].
Низкомолекулярные токсины попадают во внутреннюю среду организма лишь при нарушении нормальных соотношений микрофлоры и организма хозяина. Однако организм может использовать небольшие количества некоторых токсинов для активации соответствующих механизмов собственной защиты. Интегральный компонент наружной мембраны грамотрицательных бактерий, эндотоксин, попадая в кровоток в значительных количествах, вызывает целый ряд системных эффектов, которые могут привести к некрозам тканей, внутрисосудистому свертыванию крови и тяжелой интоксикации.
 В норме большая часть эндотоксина элиминируется фагоцитами печени [17], однако малая часть его все же проникает в системный кровоток. Выявлено активирующее влияние эндотоксина на клетки иммунной системы, например макрофаги в ответ на эндотоксин вырабатывают цитокины –
β- и
γ-интерфероны [14].
В норме большая часть эндотоксина элиминируется фагоцитами печени [17], однако малая часть его все же проникает в системный кровоток. Выявлено активирующее влияние эндотоксина на клетки иммунной системы, например макрофаги в ответ на эндотоксин вырабатывают цитокины –
β- и
γ-интерфероны [14]. Нормальная микрофлора слабо иммуногенна для хозяина из-за того, что клетки слизистых характеризуются низкой или поляризованной экспрессией так называемых toll-like рецепторов. Экспрессия этих рецепторов может усиливаться в ответ на медиаторы воспаления [5]. Молекулярная эволюция эпителия слизистых проходила под давлением отбора, который способствовал уменьшению ответа организма на бактерии-комменсалы, при поддержании способности ответа на патогенные микроорганизмы. Иными словами, взаимоотношения между нормальной микрофлорой и слизистыми можно обьяснить как результат конвергентной эволюции рецепторов и поверхностных молекул микроорганизмов и эпителиоцитов.
С другой стороны, болезнетворные микроорганизмы для преодоления защитного барьера слизистых часто используют механизмы, объединенные под названием молекулярной мимикрии [29].
 Типичным примером мимикрии может являться наличие на внешней мембране стрептококков группы А так называемых М-белков, по своей структуре напоминающих миозин [4]. Очевидно, что у этих микроорганизмов в ходе эволюции сложилась система, позволяющая избегать направленного противомикробного действия защитных сил человеческого организма.
Типичным примером мимикрии может являться наличие на внешней мембране стрептококков группы А так называемых М-белков, по своей структуре напоминающих миозин [4]. Очевидно, что у этих микроорганизмов в ходе эволюции сложилась система, позволяющая избегать направленного противомикробного действия защитных сил человеческого организма. Можно сделать заключение, что защитные механизмы слизистой оболочки включают в себя много факторов и являются продуктом совместной деятельности макроорганизма и микрофлоры. Здесь действуют как неспецифические защитные факторы (рН, редокс-потенциал, вязкость, низкомолекулярные метаболиты микрофлоры), так и специфические – секреторный Ig А, фагоциты и иммунные клетки. В совокупности формируется «колонизационная резистентность» – способность микрофлоры и макроорганизма в кооперации защищать экосистему слизистых от патогенных микроорганизмов.
Нарушение экологического баланса в слизистой оболочке, которое может происходить как в ходе заболевания, так и быть результатом аллопатического лечения, приводит к нарушениям в составе и численности микрофлоры.
 Например, при лечении с помощью антибиотиков численность некоторых представителей нормальной анаэробной микрофлоры кишечника может резко возрастать, а сами они – вызывать заболевание. Так происходит, например, с бактерией Clostridium difficile, которая может сохранять жизнеспособность при антимикробной терапии и вызывать впоследствии псевдомембранный колит [28].
Например, при лечении с помощью антибиотиков численность некоторых представителей нормальной анаэробной микрофлоры кишечника может резко возрастать, а сами они – вызывать заболевание. Так происходит, например, с бактерией Clostridium difficile, которая может сохранять жизнеспособность при антимикробной терапии и вызывать впоследствии псевдомембранный колит [28]. Изменение состава и численности нормальной микрофлоры может сделать слизистую оболочку более уязвимой по отношению к болезнетворным микроорганизмам. В экспериментах на животных было показано, что угнетение нормальной микрофлоры ЖКТ под влиянием стрептомицина позволяло легче инфицировать животных устойчивыми к стрептомицину штаммами сальмонеллы. Интересно, что если у нормальных животных для инфицирования было необходимо 106 микроорганизмов, то было достаточно лишь десяти возбудителей у животных, которым вводили стрептомицин [20].
При выборе стратегии лечения следует учитывать тот факт, что становление защитных механизмов слизистых оболочек организма человека происходило в течение миллионов лет и их нормальное функционирование зависит от поддержания тонкого баланса в экосистеме микрофлора – макроорганизм.
 Стимулирование собственных защитных сил организма, созвучное основным парадигмам биологической медицины, позволяет добиваться терапевтических целей, не разрушая в тоже время сложных и совершенных механизмов защиты, созданных самой природой.
Стимулирование собственных защитных сил организма, созвучное основным парадигмам биологической медицины, позволяет добиваться терапевтических целей, не разрушая в тоже время сложных и совершенных механизмов защиты, созданных самой природой.Литература
1. Альбертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. Молекулярная биология клетки. М., «Мир», 1987, т. 5, 231 с.
2. Бабин В.Н., Домарадский И.В., Дубинин А.В., Кондракова О.А. Биохимические и молекулярные аспекты симбиоза человека и его микрофлоры. Рос. хим. журнал, 1994, т. 28, №6, с. 66-78.
3. Хэм А., Кормак Д. Гистология, М., «Мир», т. 4, 344 с.
4. Фишетти В.А. М – белки стрептококков. В мире науки, 1991, №8, с. 24-32.
5. Abreu M.T. Immunologic regulation of toll-like receptors in gut epithelium.Curr. Opin. Gastroenterol., 2003, 19: 559-564.
6. Blaut M. Relationship of prebiotics and food to intestinal microflora. Eur.J.Nutr., 2002, 41 Suppl 1: I11-16.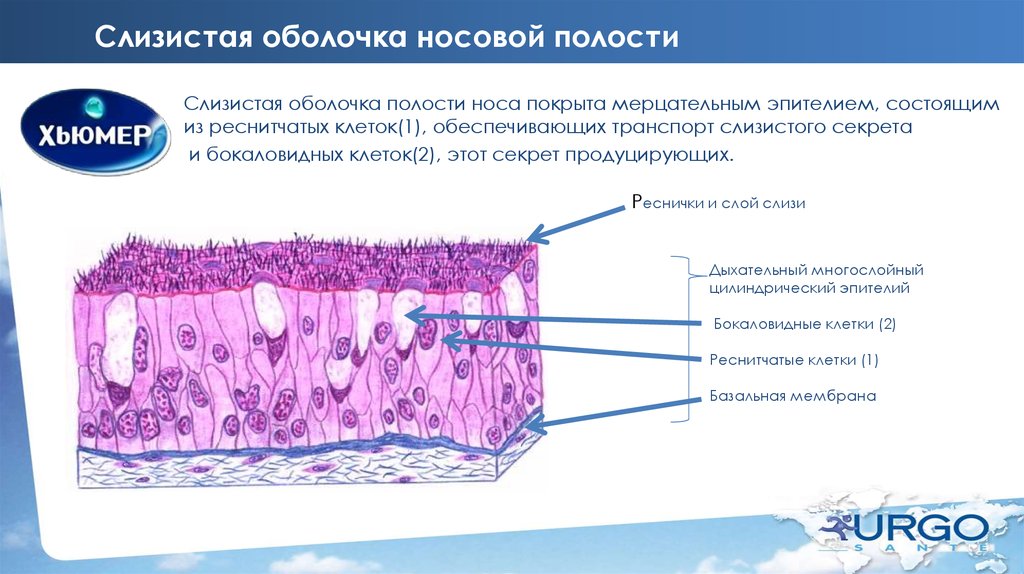
7. Burke D.A, Axon A.T. Hydrophobic adhesin of E coli in ulcerative colitis.Gut, 1988, 29: 41-43.
8. Caprilli R., Frieri G., Marchetti G., Giambartolomei S. Gli scambi ionici del colon. Minerva Gastroenterologica e Dietologica, 1995, 41: 289-301.
9. Cook S.I, Sellin J.H. Short chain fatty acids in health and disease. Aliment.Pharmacol. Ther., 1998, 12: 499-507.
10. Cummings J.H., Macfarlane G.T. Role of intestinal bacteria in nutrient metabolism. J.Parenter. Enteral.Nutr., 1997, 21:357-365.
11. Isolauri E., Sutas Y., Kankaanpaa P., Arvilommi H., Salminen S. Probiotics: effects on immunity. Am.J.Clin.Nutr., 2001, 73(Suppl): 444S-450S.
12. Jenkinson H.F. Cell surface protein receptors in oral streptococci. FEMS Microbiol. Lett., 1994, 121:133-140.
13. Kennedy M.J. Role of motility, chemotaxis, and adhesion in microbial ecology. Ann.N. Y.Acad.Sci., 1987, 506: 260-273.
14. Klocker U., Schultz U., Schaller H.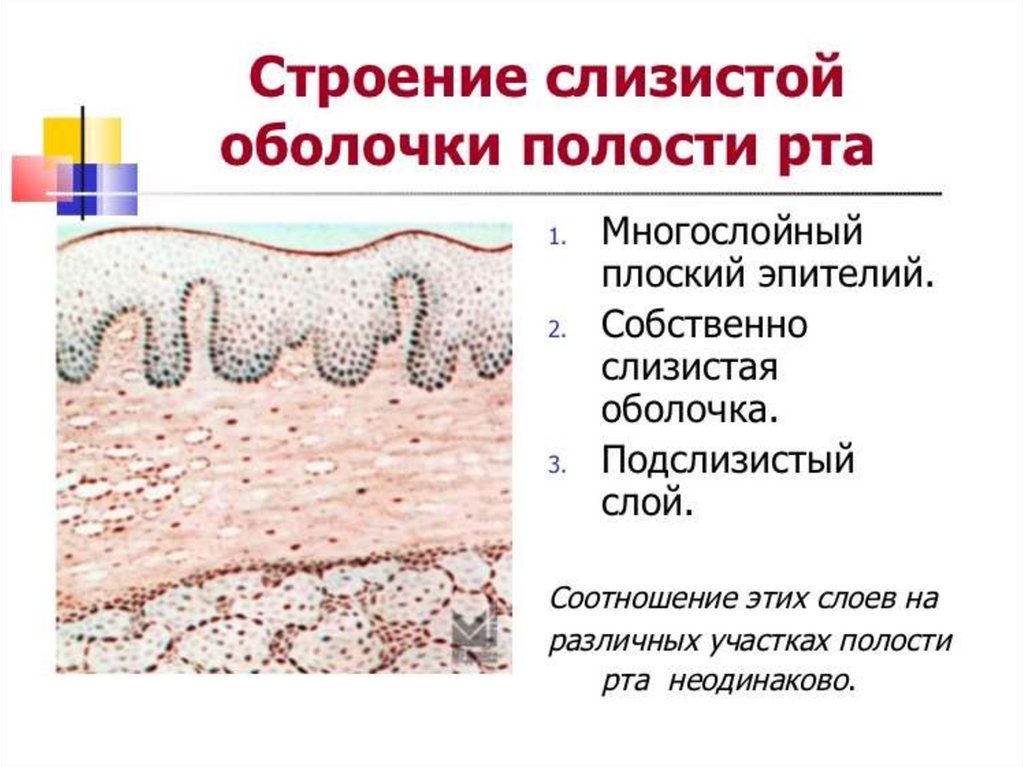 , Protzer U. Endotoxin stimulates liver macrophages to release mediators that inhibit an early step in hepadnavirus replication. J. Virol., 2000, 74: 5525-5533.
, Protzer U. Endotoxin stimulates liver macrophages to release mediators that inhibit an early step in hepadnavirus replication. J. Virol., 2000, 74: 5525-5533.
15. Lu L., Walker W.A. Pathologic and physiologic interactions of bacteria with the gastrointestinal epithelium. Am.J.Clin.Nutr., 2001, 73 (Suppl): 1124S-30S.
16. Man A.L., Prieto-Garcia M.E., Nicoletti C. Improving M cell mediated transport across mucosal barriers: do certain bacteria hold the keys? Immunology, 2004, 113): 15-22.
17. Mathison J.C., Ulevitch R.J. The clearance, tissue distribution, and cellular localization of intravenously injected lipopolysaccharide in rabbits. J.Immunol., 1979, 123: 2133-2143.
18. McCluskie M.J., Davis H.L. Mucosal immunization with DNA vaccines. Microbes Infect., 199l, 1: 685-698.
19. Metges C.C. Contribution of microbial amino acids to amino acid homeostasis of the host. J. Nutr., 2000, 130: 1857S-1864S.
20. Miller C.P., Bonhoff M.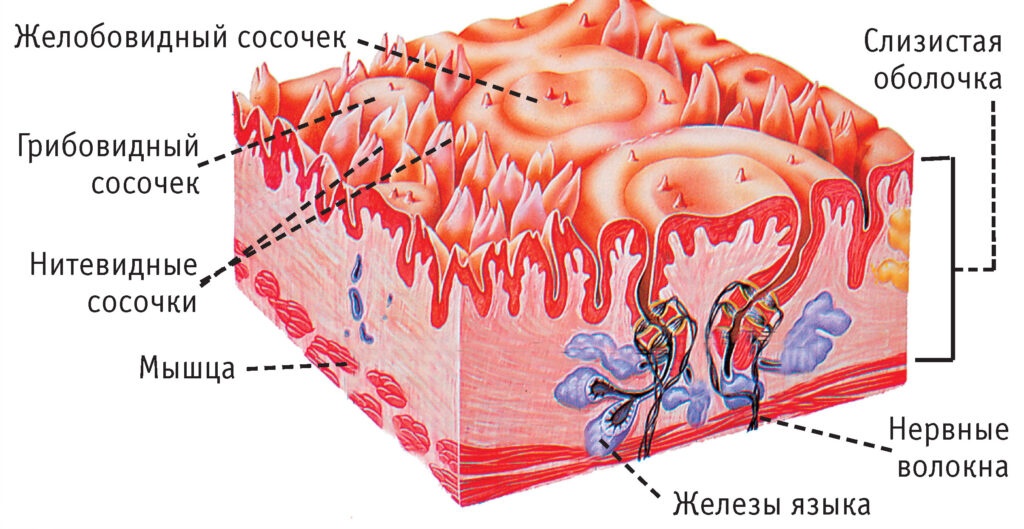 Changes in the mouse’s enteric microflora associated with enhanced susceptibility to Salmonella infection following streptomycin treatment. J.Infect.Dis., 1963, 113: 59-66.
Changes in the mouse’s enteric microflora associated with enhanced susceptibility to Salmonella infection following streptomycin treatment. J.Infect.Dis., 1963, 113: 59-66.
21. Noack J., Dongowski G., Hartmann L., Blaut M. The human gut bacteria Bacteroides thetaiotaomicron and Fusobacterium varium produce putrescine and spermidine in cecum of pectin-fed gnotobiotic rats. J. Nutr., 2000, 130: 1225-1231.
22. Ogra P.L., Faden H., Welliver R.C.Vaccination strategies for mucosal immune responses. Clin.Microbiol.Rev., 2001, 14: 430-445.
23. Piatti G. Bacterial adhesion to respiratory mucosa and its modulation by antibiotics at sub-inhibitory concentrations. Pharmacol.Res., 1994, 30: 289-299
24. Redondo-Lopez V., Cook R.L., Sobel J.D. Emerging role of lactobacilli in the control and maintenance of the vaginal bacterial microflora. Rev.Infect.Dis., 1990, 12: 856-872.
25. Rosenthal K.L., Gallichan W.S. Challenges for vaccination against sexually-transmitted diseases: induction and long-term maintenance of mucosal immune responses in the female genital tract. Semin.Immunol., 1997, 9: 303-314.
Semin.Immunol., 1997, 9: 303-314.
26. Savage D.C. Microbial ecology of the gastrointestinal tract. Annu.Rev.Microbiol., 1977, 31: 107-120.
27. Saito H, Kanamori Y, Takemori T, Nariuchi H, Kubota E, Takahashi-Iwanaga H., Iwanaga T., Ishikawa H. Generation of intestinal T cells from progenitors residing in gut cryptopatches. Science, 1998, 280: 275-278.
28. Settle C.D., Wilcox M.H. Antibiotic-induced Clostridium difficile infection. Aliment. Pharmacol. Ther., 1996, 10: 835-841.
29. Stebbins C.E., Galan J.E. Structural mimicry in bacterial virulence. Nature, 2001, 412: 701-705.
30. Tannock G.W. Normal Microflora. Chapman and Hall, NY, 1995.
31. Uhlig H.H., Mottet C., Powrie F. Homing of intestinal immune cells. Novartis Found. Symp., 2004, 263:179-188.
32. van Ginkel F.W., Nguyen H.H., McGhee J.R. Vaccines for mucosal immunity to combat emerging infectious diseases. Emerg. Infect. Dis., 2000, 6: 123-132.ы
33. van Nuenen M.H., Venema K., van der Woude J.C., Kuipers E.J. The metabolic activity of fecal microbiota from healthy individuals and patients with inflammatory bowel disease. Dig. Dis.Sci., 2004, 49: 485-491.
van Nuenen M.H., Venema K., van der Woude J.C., Kuipers E.J. The metabolic activity of fecal microbiota from healthy individuals and patients with inflammatory bowel disease. Dig. Dis.Sci., 2004, 49: 485-491.
34. van Berlo C.L., de Jonge H.R., van den Bogaard A.E., van Eijk H.M., Janssen M.A., Soeters P.B. gamma-Aminobutyric acid production in small and large intestine of normal and germ-free Wistar rats. Influence of food intake and intestinal flora. Gastroenterology, 1987, 93: 472-479.
35. Verdu E.F., Collins S.M. Microbial-gut interactions in health and disease. Irritable bowel syndrome. Best. Pract. Res. Clin. Gastroenterol., 2004, 18: 315-321.
- Номер:
- № 114 март — Общетерапевтический номер
09. 12.2022
Терапія та сімейна медицинаELOM‑080 (Респеро Миртол / Респеро Миртол форте): які переваги забезпечує фітопрепарат у лікуванні риносинуситу?
12.2022
Терапія та сімейна медицинаELOM‑080 (Респеро Миртол / Респеро Миртол форте): які переваги забезпечує фітопрепарат у лікуванні риносинуситу?
10 вересня у м. Гамбург (Німеччина) відбувся міжнародний симпозіум «Покращення мукоциліарного кліренсу: уроки від інфекцій верхніх дихальних шляхів до COVID‑19», організований німецькою фармацевтичною компанією G. Pohl-Boskamp GmbH & Co. KG.
Її досвід розробки інноваційних рішень для лікування патології дихальної системи сягає 50 років. За цей час створено і впроваджено в практику багато дієвих лікарських засобів, серед яких ELOM‑080 – стандартизований миртол, який представлений компанією Berlin-Chemie Menarini під торговою назвою Геломиртол у Європі та Респеро Миртол / Респеро Миртол форте в Україні. Одна зі сфер застосування ELOM‑080, а саме лікування риносинуситу, активно висвітлювалося в рамках заходу як із позиції лікарів-клініцистів,
так і з точки зору наукових досліджень. …
…
09.12.2022 Терапія та сімейна медицинаАмтолметин гуацил – нестероїдний протизапальний препарат з гастропротекторними властивостями
Несприятливий вплив нестероїдних протизапальних препаратів (НПЗП) на шлунково-кишковий тракт (ШКТ) є одним із айпоширеніших побічних ефектів ліків у популяції. Гастротоксичність НПЗП не лише знижує прихильність пацієнтів до лікування, а й може спричиняти фатальні шлунково-кишкові кровотечі [1]. Амтолметин гуацил (АМГ) – некислотний естеровий прекурсор толметину, який чинить протизапальну, болезаспокійливу та жарознижувальну дію як представник класу НПЗП, але на відміну від неселективних молекул цієї групи має гастропротекторні властивості. Механізми та клінічні ефекти АМГ розглянуто в цьому огляді….
09. 12.2022
Терапія та сімейна медицинаСучасні нутрицевтичні комплекси в офтальмології
12.2022
Терапія та сімейна медицинаСучасні нутрицевтичні комплекси в офтальмології
Провідна роль у патогенезі низки очних захворювань належить окисному стресу. Як відомо, окисний стрес виникає у результаті порушення рівноваги між активними формами кисню (пероксидами та вільними радикалами) й антиоксидантною системою захисту клітини. Порушення окисно-відновних процесів спричиняє підвищення рівня активних форм кисню, наслідком чого є окиснення білків, ліпідів і ДНК клітини. Виражений окисний стрес може викликати загибель клітини. Основа порушення балансу між активними формами кисню та антиоксидантною системою захисту клітини – порушення антиоксидантної системи захисту внаслідок виникнення дефіциту її складових….
09.12.2022 Акушерство/гінекологіяДиференційована профілактика природжених вад розвитку плода в жінок репродуктивного віку з урахуванням поліморфізму гена метилентетрагідрофолатредуктази
Фолієва кислота (ФК), також відома як вітамін B9, є життєво важливим мікроелементом, який відіграє значну роль у процесах синтезу пуринових і піримідинових попередників нуклеїнових кислот, метаболізмі метіоніну, серину, гліцину та гістидину й утворенні метилювальних агентів, потрібних для забезпечення нормального обміну речовин і регуляції генів. Є наукові дані й про роль ФК у профілактиці онкологічних, неврологічних і психіатричних захворювань [1]….
Є наукові дані й про роль ФК у профілактиці онкологічних, неврологічних і психіатричних захворювань [1]….
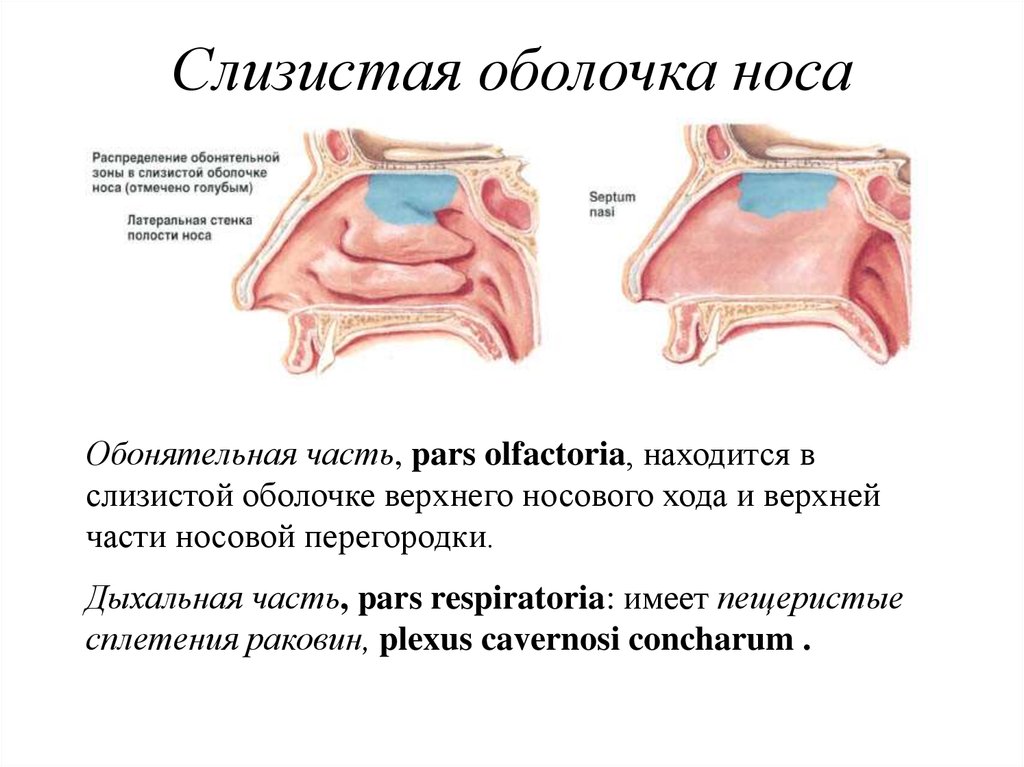
Механизмы местной защиты слизистой оболочки полости носа и околоносовых пазух
Полость носа вместе с околоносовыми пазухами (ОНП) в структурно-функциональном отношении представляют собой единую систему воздухоносных полостей. Являясь начальным отделом дыхательных путей, эта система обеспечивает кондиционирование вдыхаемого воздуха, которое заключается в его очистке, обезвреживании, терморегуляции и увлажнении. Этот сложнейший биокондиционер способен задерживать более 90% микроорганизмов и инородных частиц, попадающих во время вдоха [1—4].
Ключевая роль в выполнении указанных функций полости носа и околоносовых пазух принадлежит слизистой оболочке. Последняя является сложно организованной системой, состоящей из эпителия, стромы, желез, сосудистых элементов, а также нервного аппарата, и функционирует в результате их сложнейших межтканевых интегративных взаимодействий. Имея в общих чертах однотипное строение, слизистая оболочка в различных отделах полости носа и ОНП в структурно-функциональном отношении несколько отличается [5, 6].
Имея в общих чертах однотипное строение, слизистая оболочка в различных отделах полости носа и ОНП в структурно-функциональном отношении несколько отличается [5, 6].
В современной литературе существует множество интересных работ, посвященных структуре и функции слизистых оболочек верхних дыхательных путей. Вместе с тем вопрос о механизмах местной защиты слизистой оболочки полости носа и ОНП практически не изучен. Поэтому исследование в данном направлении является актуальным и перспективным и в дальнейшем позволит разработать схемы патогенетического лечения в зависимости от глубины поражения слизистой оболочки.
Цель данного исследования — изучение механизмов местной защиты слизистой оболочки полости носа и ОНП.
Объект и методы
Материалом для исследования стали слизистая оболочка полости носа и ОНП, которые получили во время вскрытия лиц, умерших от заболеваний, не связанных с оториноларингологической патологией. Из полученного материала, согласно общепринятой методике, изготавливали препараты, которые окрашивали гематоксилином и эозином, фуксилином по Харту с подкрашиванием пикрофуксином по ван Гизону, окраской по способу Маллори, ШИК-реакцией — альциановым синим с подкрашиванием по способу Бергмана. В процессе иммуногистохимических исследований использованы моноклональные антитела к специфическому маркеру макрофагов — CD68, к маркеру T-лимфоцитов — CD6 и к маркеру В-лимфоцитов — CD20. Изучение окрашенных препаратов проводилось на цифровом светооптическом микроскопе Olympus BX41 с использованием объективов ×10, ×20, ×40, а их фотосъемка — на цифровую фотокамеру Olympus C 4040 («Olympus Medical Systems Corporation», Япония).
В процессе иммуногистохимических исследований использованы моноклональные антитела к специфическому маркеру макрофагов — CD68, к маркеру T-лимфоцитов — CD6 и к маркеру В-лимфоцитов — CD20. Изучение окрашенных препаратов проводилось на цифровом светооптическом микроскопе Olympus BX41 с использованием объективов ×10, ×20, ×40, а их фотосъемка — на цифровую фотокамеру Olympus C 4040 («Olympus Medical Systems Corporation», Япония).
Результаты и обсуждение
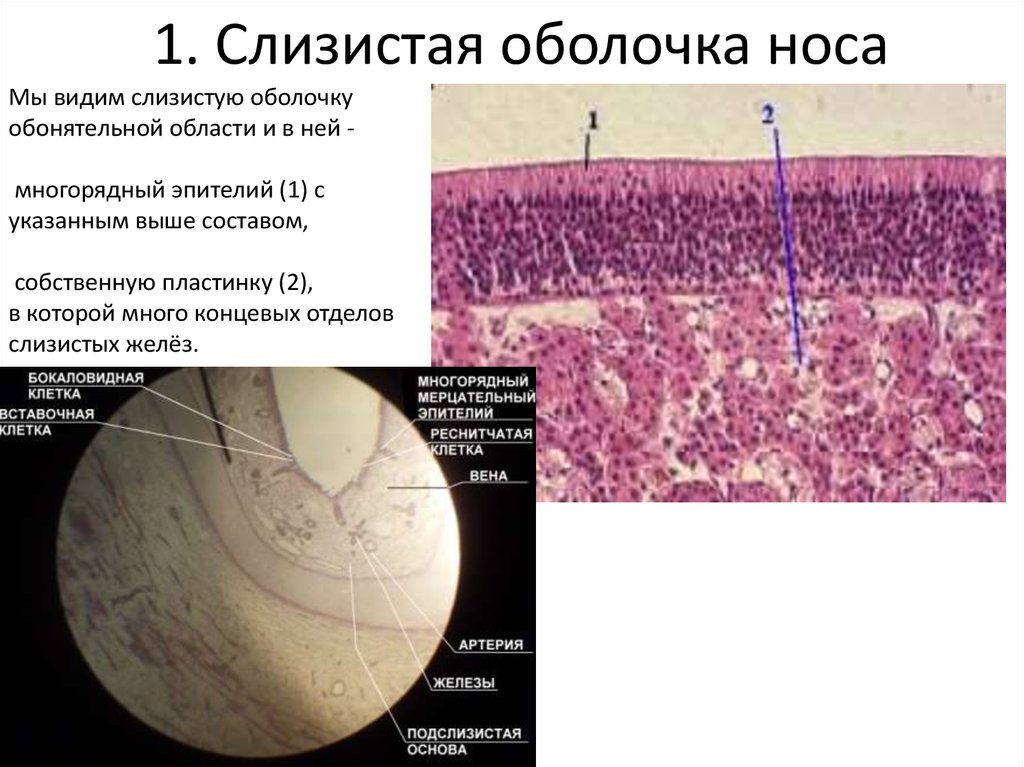
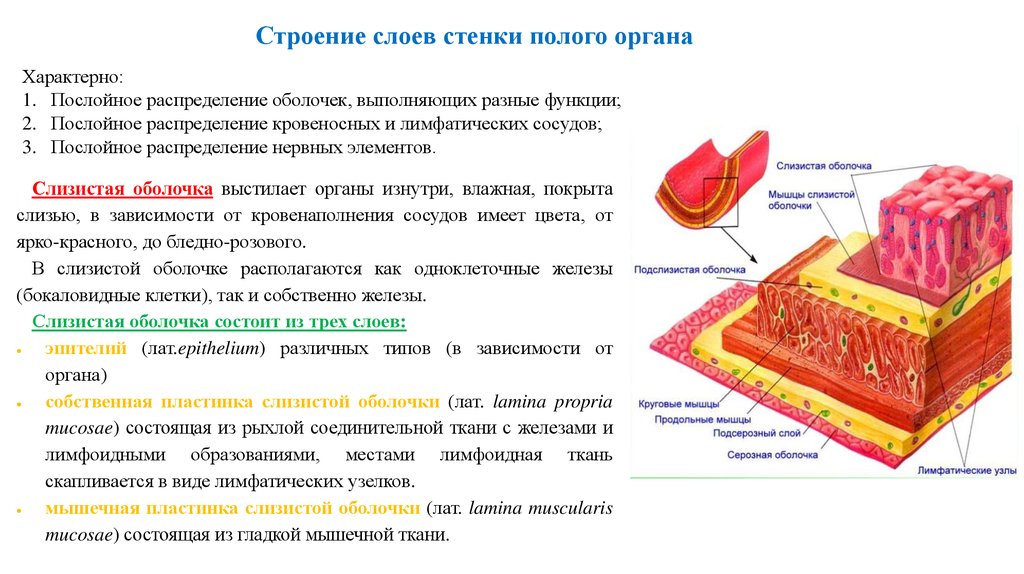
Проведенное исследование свидетельствует, что слизистая оболочка полости носа и ОНП покрыты многорядным мерцательным эпителием. Под эпителием расположен собственный слой, представленный в поверхностных отделах рыхлой, а в более глубоких — плотной соединительной тканью. В нем определяются микрососуды (артериолы, венулы и капилляры), фибробласты и фиброциты с вытянутыми ядрами, а также ацинусы и выводные протоки слизистых и серозных желез.
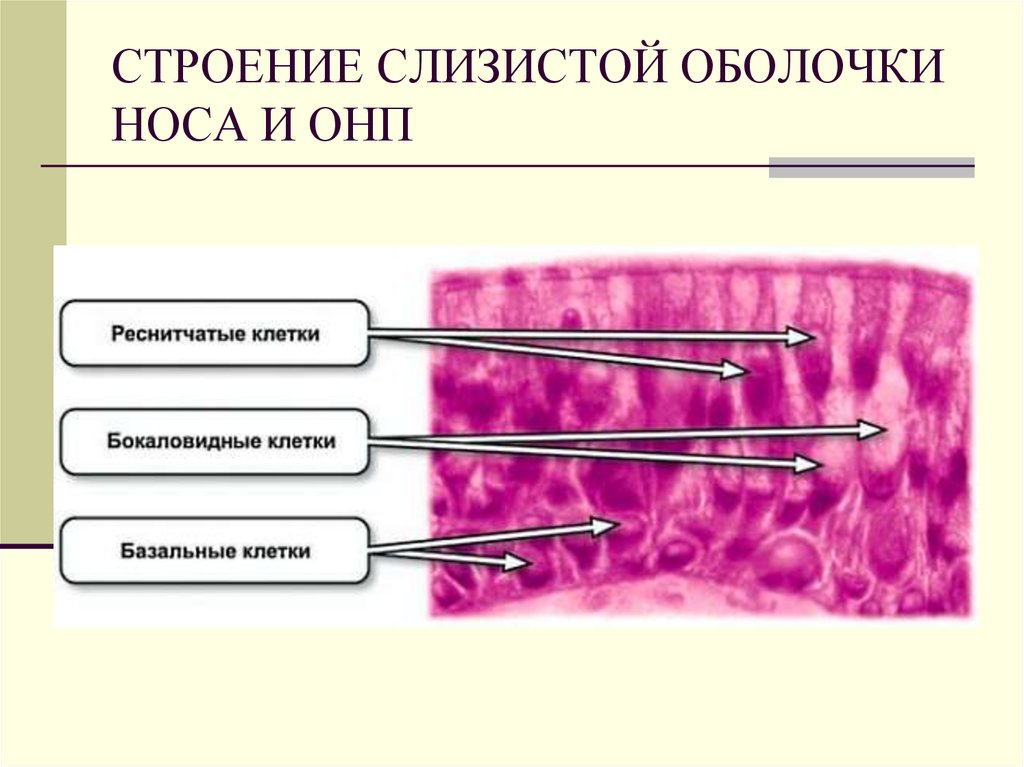
Многорядный мерцательный эпителий состоит из мерцательных, бокаловидных, коротких и длинных вставочных, а также микроворсинчатых клеток. Ядра мерцательных клеток расположены в апикальной части их цитоплазмы. Ядра микроворсинчатых эпителиоцитов образуют второй ряд и определяются в центральной части цитоплазмы. Расположение ядер бокаловидных клеток напрямую зависит от фазы секреторного цикла. Ядра коротких и длинных вставочных клеток расположены непосредственно возле базальной мембраны. Таким образом, многорядность мерцательного эпителия обусловлена выраженной структурно-функциональной разнородностью его клеточного состава.
Ядра мерцательных клеток расположены в апикальной части их цитоплазмы. Ядра микроворсинчатых эпителиоцитов образуют второй ряд и определяются в центральной части цитоплазмы. Расположение ядер бокаловидных клеток напрямую зависит от фазы секреторного цикла. Ядра коротких и длинных вставочных клеток расположены непосредственно возле базальной мембраны. Таким образом, многорядность мерцательного эпителия обусловлена выраженной структурно-функциональной разнородностью его клеточного состава.
Собственные гистохимические исследования позволили идентифицировать клеточные элементы многорядного мерцательного эпителия. Так, на препаратах, окрашенных комбинированным методом ШИК-реакция — альциановый синий с подкрашиванием по способу Бергмана, четко визуализируются бокаловидные клетки, альциан-положительная цитоплазма которых интенсивно окрашивается в голубой цвет. В то же время цитоплазма других эпителиоцитов имеет розовый цвет. В собственном слое определяются микрососуды и волокнистые структуры, а в более глубоких отделах — ацинусы и протоки желез. При этом отдельные дольки, а также междольковые протоки интенсивно окрашиваются в красный цвет. Это свидетельствует, что в данных структурах синтезируется, а также выделяется ШИК-положительный секрет, представленный нейтральными мукопротеидами (рис. 1 на цв. вклейке).Рисунок 1. Структурная организация слизистой оболочки полости носа. 1 — бокаловидные клетки; 2 — мерцательные клетки; 3 — базальная мембрана; 4 – волокнистые структуры собственного слоя; 5 — ацинусы и протоки желез. Окраска ШИК-реакция — альциановым синим с подкрашиванием по Бергману. Ув. 200.
При этом отдельные дольки, а также междольковые протоки интенсивно окрашиваются в красный цвет. Это свидетельствует, что в данных структурах синтезируется, а также выделяется ШИК-положительный секрет, представленный нейтральными мукопротеидами (рис. 1 на цв. вклейке).Рисунок 1. Структурная организация слизистой оболочки полости носа. 1 — бокаловидные клетки; 2 — мерцательные клетки; 3 — базальная мембрана; 4 – волокнистые структуры собственного слоя; 5 — ацинусы и протоки желез. Окраска ШИК-реакция — альциановым синим с подкрашиванием по Бергману. Ув. 200.
Поскольку в состав ресничек входит гидрофобный протеин тубулин, то с целью идентификации мерцательных клеток нами предложено использовать гистохимическую окраску препаратов по способу Маллори. При этом на апикальной поверхности мерцательных клеток четко визуализируются многочисленные реснички, которые образуют волнообразную поверхность. Ножки ресничек расположены в апикальной части цитоплазмы и формируют Маллори-положительные диски. Ядра мерцательных эпителиоцитов имеют вытянутую или овальную форму и базофильную окраску (рис. 2 на цв.вклейке).Рисунок 2. Строение многорядного мерцательного эпителия слизистой оболочки полости носа. 1 — мерцательная клетка; 2 — бокаловидная клетка; 3 — базальная мембрана. Окраска по Маллори. Ув. 400.
Ядра мерцательных эпителиоцитов имеют вытянутую или овальную форму и базофильную окраску (рис. 2 на цв.вклейке).Рисунок 2. Строение многорядного мерцательного эпителия слизистой оболочки полости носа. 1 — мерцательная клетка; 2 — бокаловидная клетка; 3 — базальная мембрана. Окраска по Маллори. Ув. 400.
В зонах роста — криптах многорядный мерцательный эпителий имеет несколько иную структурно-функциональную организацию. Зоны роста представляют собой неглубокие инвагинации эпителия в подлежащую рыхлую соединительную ткань собственного слоя. В этих участках определяются бокаловидные клетки, которые находятся на разных фазах секреторного цикла, а также единичные мерцательные эпителиоциты. Среди них расположены микроворсинчатые клетки, которые содержат ядра различной формы. На нечетко контурированной базальной мембране определяются короткие и длинные вставочные клетки. Рыхлая соединительная ткань собственного слоя васкуляризирована более интенсивно. В ней определяются многочисленные мелкие периваскулярные лимфоидно-клеточные инфильтраты.
Проведенные иммуногистохимические исследования свидетельствуют, что среди коротких и длинных вставочных клеток в многорядном мерцательном эпителии определяются клеточные элементы с экспрессией специфического маркера макрофагов — CD68. В подлежащей под базальной мембраной соединительной ткани также экспрессируются единичные CD68-положительные макрофаги. Таким образом, в норме в многорядном мерцательном эпителии определяются внутриэпителиальные макрофаги, которые репрезентируют отдельные разновидности антигенов, участвуя в формировании локального гомеостаза (рис. 3 на цв. вклейке).Рисунок 3. Экспрессия CD68-положительных макрофагов в слизистой оболочке полости носа. 1 — экспрессия в эпителии; 2 — экспрессия в собственном слое. ИГХ-метод, дополнительная окраска гематоксилином Майера. Ув. 400.
В эпителии определяются также клеточные элементы с экспрессией специфического маркера T-лимфоцитов — CD6. Одни из них располагаются возле базальной мембраны среди коротких вставочных клеток, а другие — среди мерцательных и бокаловидных эпителиоцитов. В собственном слое определяются периваскулярные лимфоидно-клеточные инфильтраты, состоящие из CD6-положительных T-лимфоцитов.
В собственном слое определяются периваскулярные лимфоидно-клеточные инфильтраты, состоящие из CD6-положительных T-лимфоцитов.
Таким образом, в многорядном мерцательном эпителии слизистой оболочки полости носа и ОНП можно выделить две популяции клеточных элементов. Одна представлена дифференцированными мерцательными и бокаловидными эпителиоцитами. Цилиарный аппарат мерцательных клеток вместе с мукозным секретом, который выделяют бокаловидные клетки, а также слизистые и серозные железы собственного слоя на поверхности слизистой оболочки образуют мукоцилиарную транспортную систему или мукоцилиарный барьер. Мукоцилиарная активность эпителия зависит от частоты биения ресничек, а также от вязкости и эластичности слизистого секрета.
В связи с этим оптимальные количественные и качественные (вязкость и эластичность) параметры мукозного секрета, а также нормальная двигательная активность цилиарного аппарата в физиологических условиях предотвращают адгезию и колонизацию попадающей во время вдоха микрофлоры. Кроме этого, мукоцилиарный транспорт препятствует контакту микроорганизмов с внутриэпителиальными макрофагами, а также дальнейшей передаче их антигенной информации на Т-лимфоциты.
Кроме этого, мукоцилиарный транспорт препятствует контакту микроорганизмов с внутриэпителиальными макрофагами, а также дальнейшей передаче их антигенной информации на Т-лимфоциты.
При дисфункции мукоцилиарного барьера микроорганизмы проходят апикальные отделы многорядного мерцательного эпителия. В последующем они контактируют с внутриэпителиальными макрофагами, которые их фагоцитируют и разрушают. В случае, если процесс фагоцитоза незавершен, в реакцию вступают Т-лимфоциты. Их функция заключается в распознавании антигенных детерминантов, элиминации антигенов и регуляции иммунного ответа. Таким образом, сенсибилизированные лимфоциты — «Т-киллеры» узнают антигенные детерминанты и, секретируя цитотоксические лимфокины, осуществляют иммунный цитолиз.
Дифференцированные эпителиоциты обновляются каждые 4—8 нед. Мерцательные клетки теряют реснички, а в бокаловидных клетках возникает слизистая дистрофия, которая приводит к разрушению их ядер.
Другая популяция клеточных элементов многорядного мерцательного эпителия представлена микроворсинчатыми эпителиоцитами. Их апикальная поверхность содержит микроворсинки. Они осуществляют и регулируют продукцию перицилиарной жидкости — зо`ля. Кроме того, микроворсинчатые эпителиоциты могут дифференцироваться как в мерцательные, так и в бокаловидные клетки. В зонах роста — криптах определяется значительно большее их количество по сравнению с другими отделами эпителия. При воспалении микроворсинчатые клетки дифференцируются в бокаловидные, что приводит к бокаловидной трансформации эпителия. Вместе с тем, дифференцируясь в том или ином направлении, они способствуют регенерации эпителиального покрова слизистой оболочки, в результате чего в нем возобновляется нормальное соотношение мерцательных и бокаловидных клеток.
Их апикальная поверхность содержит микроворсинки. Они осуществляют и регулируют продукцию перицилиарной жидкости — зо`ля. Кроме того, микроворсинчатые эпителиоциты могут дифференцироваться как в мерцательные, так и в бокаловидные клетки. В зонах роста — криптах определяется значительно большее их количество по сравнению с другими отделами эпителия. При воспалении микроворсинчатые клетки дифференцируются в бокаловидные, что приводит к бокаловидной трансформации эпителия. Вместе с тем, дифференцируясь в том или ином направлении, они способствуют регенерации эпителиального покрова слизистой оболочки, в результате чего в нем возобновляется нормальное соотношение мерцательных и бокаловидных клеток.
Таким образом, две разные популяции клеточных элементов многорядного мерцательного эпителия обусловливают его физиологический тканевый гомеостаз.
С одной стороны, в эпителии постоянно происходит частичное или полное разрушение дифференцированных клеток, а с другой — пролиферация и специализация микроворсинчатых эпителиоцитов. Образующиеся в результате деструктивных процессов в эпителии антигены сначала фагоцитируются внутриэпителиальными макрофагами. В дальнейшем образованные вследствие фагоцитоза детерминанты передаются на систему Т-лимфоцитов, которая обеспечивает лизис отмерших эпителиоцитов.
Образующиеся в результате деструктивных процессов в эпителии антигены сначала фагоцитируются внутриэпителиальными макрофагами. В дальнейшем образованные вследствие фагоцитоза детерминанты передаются на систему Т-лимфоцитов, которая обеспечивает лизис отмерших эпителиоцитов.
Выводные протоки слизистых и серозных желез собственного слоя слизистой оболочки покрыты цилиндрическим мерцательно-микроворсинчатым эпителием.
В нем отсутствуют короткие и длинные вставочные клетки, а двигательная активность цилиарного аппарата мерцательных клеток обеспечивает транспорт секрета, который образуется в ацинусах. В то же время микроворсинчатые клетки обладают способностью к его частичной реабсорбции. Под эпителием выводных протоков желез располагаются очаговые или диффузные лимфоидно-клеточные скопления (рис. 4 на цв. вклейке).Рисунок 4. Выводные протоки желез собственного слоя слизистой оболочки полости носа. 1 — цилиндрический мерцательный эпителий, выстилающий протоки; 2 — ацинусы желез; 3 — рыхлая соединительная ткань между протоками; 4 — лимфоидно-клеточные инфильтраты; 5 — микрососуды. Окраска гематоксилином и эозином. Ув. 200.
Окраска гематоксилином и эозином. Ув. 200.
Такие лимфоидно-клеточные инфильтраты в слизистой оболочке верхних дыхательных путей известны как MALT (mucosa associated lymphoid tissue) [7—9].
Собственные иммуногистохимические исследования свидетельствуют, что эти лимфоидно-клеточные скопления представлены в основном CD20-положительными В-лимфоцитами. Последние трансформируются в плазмоцитарные клетки, которые синтезируют неактивную форму IgA (рис. 5 на цв.вклейке).Рисунок 5. Экспрессия CD20-положительных клеточных элементов в периваскулярной соединительной ткани собственного слоя. 1 — В-лимфоцит; 2 — плазмоцит; 3 — эндотелий сосуда. ИГХ-метод, дополнительная окраска гематоксилином Майера. Ув. 400.
Молекула неактивной формы IgA имеет дисульфидные (S-S) группы. Процесс ее активации происходит во время выведение IgA на поверхность эпителия выводных протоков. При прохождении по межклеточным пространствам между эпителиоцитами в молекуле IgA дисульфидные группы расщепляются и образуются сульфгидрильные (S-H). Этому способствует гликопротеин, называемый секреторным компонентом, который продуцируют эпителиальные клетки. В результате на свободной поверхности мерцательно-микроворсинчатого эпителия выводных протоков желез возникает активная форма неспецифического IgA, который преципитирует или агглютинирует антигены микроорганизмов, а также нейтрализует их токсины. Таким образом, секреторный IgA в мукозном слое создает защитный барьер, предохраняющий слизистую от проникновения микробных и вирусных антигенов. В связи с этим в слизистой оболочке полости носа и околоносовых пазух, помимо мукоцилиарной транспортной системы, можно выделить несколько иной в структурно-функциональном отношении механизм защиты — лимфоэпителиальный барьер.
Этому способствует гликопротеин, называемый секреторным компонентом, который продуцируют эпителиальные клетки. В результате на свободной поверхности мерцательно-микроворсинчатого эпителия выводных протоков желез возникает активная форма неспецифического IgA, который преципитирует или агглютинирует антигены микроорганизмов, а также нейтрализует их токсины. Таким образом, секреторный IgA в мукозном слое создает защитный барьер, предохраняющий слизистую от проникновения микробных и вирусных антигенов. В связи с этим в слизистой оболочке полости носа и околоносовых пазух, помимо мукоцилиарной транспортной системы, можно выделить несколько иной в структурно-функциональном отношении механизм защиты — лимфоэпителиальный барьер.
В собственном слое слизистой оболочки расположены ацинусы желез, а также их выводные протоки. По сравнению с бокаловидными клетками, слизистые железы продуцируют более густой мукозный секрет. Серозные железы выделяют секрет с высоким содержанием белка, в котором содержатся лизоцим, лактоферрин, а также бактериолитические ферменты. Кроме этого, иногда определяются смешанные серозно-слизистые железы.
Кроме этого, иногда определяются смешанные серозно-слизистые железы.
В ацинусах желез ядра секреторных клеток смещены к базальной мембране, а в их просвете определяется гомогенный секрет (рис. 6 на цв. вклейке).Рисунок 6. Ацинусы и выводные протоки слизистой железы. 1 — секреторные клетки; 2 — гомогенная слизь в просвете ацинуса; 3 — базальная мембрана; 4 — миоэпителиальные клетки; 5 — выводной проток. Окраска гематоксилином и эозином. Ув. 200.
Между базальной мембраной ацинуса и секреторными клетками располагаются миоэпителиальные клеточные элементы. Именно их сократительная деятельность определяет степень выделения секрета. Конфигурация миоэпителиальных клеток четко определяется при окраске по способу Маллори. Они содержат ядро вытянутой формы и темно-коричневую цитоплазму, отростки которой располагаются между секреторными клетками (рис. 7 на цв. вклейке).Рисунок 7. Ацинус слизистой железы. 1 — секреторные клетки; 2 — миоэпителиальные клетки; 3 — отростки миоэпителиальных клеток; 4 — базальная мембрана. Окраска по Маллори. Ув. 400.
Окраска по Маллори. Ув. 400.
Несомненно, что секрет бокаловидных клеток, а также слизистых и серозных желез отличается по реологическим свойствам. В связи с этим мукозный секрет на поверхности слизистой состоит из двух слоев: перицилиарной жидкости — зо`ля и вязкого поверхностного слоя — геля. По нашему мнению, золь является продуктом секреции бокаловидных клеток и слизистых желез, а гель — продуктом секреции серозных желез. В связи с этим такие различия в секреторной деятельности позволяют выделить в слизистой оболочке особый мукогландулярный барьер.
В рыхлой соединительной ткани собственного слоя располагаются микрососуды, проходящие параллельно по отношению к базальной мембране, а также пенетрирующие сосуды, которые отходят от предыдущих. Между микрососудами определяются клеточные элементы лимфоидного и фибробластического ряда.
Собственные иммуногистохимические исследования свидетельствуют, что эти лимфоидно-клеточные скопления представлены в основном CD20-положительными В-лимфоцитами, их производными — плазмоцитами, а также единичными лаброцитами. Плазмоциты содержат эксцентрично расположенное ядро, а их цитоплазма — светло-коричневые гранулы. Лаброциты имеют большие размеры. В их цитоплазме также определяются гранулы темно-коричневого цвета. Одни лаброциты имеют сохраненные контуры цитоплазмы, а в других она разрушается, что сопровождается выходом гранул в интерстиций (рис. 8 на цв. вклейке).Рисунок 8. Экспрессия CD20-положительных клеточных элементов, составляющих лимфоидно-клеточные инфильтраты в собственном слое. 1 — В-лимфоцит; 2 — плазмоцит; 3 — лаброцит. ИГХ-метод, дополнительная окраска гематоксилином Майера. Ув. 400.
Плазмоциты содержат эксцентрично расположенное ядро, а их цитоплазма — светло-коричневые гранулы. Лаброциты имеют большие размеры. В их цитоплазме также определяются гранулы темно-коричневого цвета. Одни лаброциты имеют сохраненные контуры цитоплазмы, а в других она разрушается, что сопровождается выходом гранул в интерстиций (рис. 8 на цв. вклейке).Рисунок 8. Экспрессия CD20-положительных клеточных элементов, составляющих лимфоидно-клеточные инфильтраты в собственном слое. 1 — В-лимфоцит; 2 — плазмоцит; 3 — лаброцит. ИГХ-метод, дополнительная окраска гематоксилином Майера. Ув. 400.
Благодаря синтезу и секреции биологически активных веществ, лаброциты поддерживают гомеостаз соединительной ткани. Согласно данным литературы [10—12], они имеют три стуктурно-функциональных состояния. Лаброциты с апокриновым типом секреции выделяют гиалуроновую кислоту, которая увеличивает проницаемость сосудистой стенки, соединительной ткани, а также базальной мембраны эпителия. Лаброциты с мерокриновым типом секреции продуцируют и выделяют серотонин или гистамин. Гистамин обладает нейротрансмиттерным действием как на нервные окончания, так и на сосудистую стенку и вызывает расширение кровеносных сосудов. Таким образом, эти разновидности лаброцитов влияют на состояние микроциркуляторного русла слизистой оболочки, обеспечивая ее реакцию на влияние экзогенных факторов. Лаброциты с голокриновым типом секреции и практически полностью разрушенной цитоплазмой располагаются, как правило, в плотной соединительной ткани, которая характерна для более глубоких отделов собственного слоя. Они синтезируют и соответственно выделяют ФАТ — фактор, активирующий тромбоциты. Эта биологически активная субстанция усиливает сосудистую проницаемость, вызывает отек и стимулирует лимфоидно-клеточную инфильтрацию слизистой оболочки.
Гистамин обладает нейротрансмиттерным действием как на нервные окончания, так и на сосудистую стенку и вызывает расширение кровеносных сосудов. Таким образом, эти разновидности лаброцитов влияют на состояние микроциркуляторного русла слизистой оболочки, обеспечивая ее реакцию на влияние экзогенных факторов. Лаброциты с голокриновым типом секреции и практически полностью разрушенной цитоплазмой располагаются, как правило, в плотной соединительной ткани, которая характерна для более глубоких отделов собственного слоя. Они синтезируют и соответственно выделяют ФАТ — фактор, активирующий тромбоциты. Эта биологически активная субстанция усиливает сосудистую проницаемость, вызывает отек и стимулирует лимфоидно-клеточную инфильтрацию слизистой оболочки.
В связи с этим в слизистой оболочке можно выделить еще один механизм местной защиты — стромально-сосудистый или интерстициальный барьер, который в норме поддерживает гомеостаз соединительной ткани собственного слоя.
Таким образом, в слизистой оболочке полости носа и ОНП существуют абсолютно разные в структурно-функциональном отношении барьеры, а именно: мукоцилиарный, лимфоэпителиальный, мукогландулярный и стромально-сосудистый (интерстициальный). Эти барьеры обеспечивают защиту слизистой оболочки на разных уровнях. Нарушение функции или повреждение одного, более поверхностно расположенного механизма местной защиты, автоматически вызывает активацию другого.
Эти барьеры обеспечивают защиту слизистой оболочки на разных уровнях. Нарушение функции или повреждение одного, более поверхностно расположенного механизма местной защиты, автоматически вызывает активацию другого.
Безусловно, что функциональное значение того или иного механизма местной защиты в различных отделах полости носа и ОНП неодинаково. В связи с этим дальнейшее изучение структурно-функциональной организации слизистой оболочки полости носа и ОНП, а также механизмов защиты последней является актуальным и перспективным направлением научно-практических исследований.
Выводы
1. Цилиарный аппарат мерцательных клеток вместе с мукозным секретом, который выделяют бокаловидные клетки, а также слизистые и серозные железы на поверхности слизистой оболочки образуют мукоцилиарную транспортную систему, или мукоцилиарный барьер.
2. Очаговые и диффузные скопления В-лимфоцитов и их производных вместе с мерцательно-микроворсинчатым эпителием выводных протоков желез образуют лимфоэпителиальный барьер слизистой оболочки. Синтезированный плазмоцитами и активированный в эпителии неспецифический секреторный IgA в муциновом слое преципитирует и агглютинирует антигены микроорганизмов, а также нейтрализует их токсины.
Синтезированный плазмоцитами и активированный в эпителии неспецифический секреторный IgA в муциновом слое преципитирует и агглютинирует антигены микроорганизмов, а также нейтрализует их токсины.
3. Мукогландулярный барьер представлен ацинусами слизистых и серозных желез, а также их выводными протоками, которые продуцируют и выделяют более густой по сравнению с бокаловидными клетками секрет. В связи с этим мукозный секрет на поверхности слизистой состоит из двух слоев: зо`ля — продукта секреции бокаловидных клеток и слизистых желез и более вязкого геля — продукта секреции серозных желез.
4. Стромально-сосудистый или интерстициальный барьер расположен в собственном слое слизистой оболочки и представлен рыхлой или плотной соединительной тканью, гомеостаз которой благодаря синтезу и секреции биологически активных веществ поддерживают лаброциты.
Слизистая оболочка (слизистая оболочка) – определение, функции и примеры
Слизистая оболочка Определение
Слизистая оболочка, также известная как слизистая оболочка (множественное число: mucosae), представляет собой слой клеток, который окружает органы тела и отверстия тела. Состоит из эктодермальной ткани. Слизистые оболочки могут содержать или выделять слизь, представляющую собой густую жидкость, которая защищает внутреннюю часть тела от грязи и патогенов, таких как вирусы и бактерии. Существует множество различных слизистых оболочек, таких как слизистые оболочки дыхательной, пищеварительной и репродуктивной систем.
Состоит из эктодермальной ткани. Слизистые оболочки могут содержать или выделять слизь, представляющую собой густую жидкость, которая защищает внутреннюю часть тела от грязи и патогенов, таких как вирусы и бактерии. Существует множество различных слизистых оболочек, таких как слизистые оболочки дыхательной, пищеварительной и репродуктивной систем.
Разница между словами «слизистая» и «слизь»
«Слизистая оболочка» пишется иначе, чем «слизь». Какая разница? Слизь — существительное; это слово, описывающее секрецию жидкости из слизистой оболочки. Слизь получила свое название от латинского слова mucus, означающего сопли или слизь. Слизистый, с другой стороны, является прилагательным; это слово, описывающее мембрану, которая производит или содержит слизь.
Функции слизистых оболочек
В общем, функции слизистых оболочек заключаются в защите организма от заражения вирусами и бактериями и в поддержании адекватной влажности тканей организма. Определенные слизистые оболочки выполняют специализированные функции. Например, слизистая оболочка желудка и кишечника участвует в переваривании и всасывании пищи. Слизистые оболочки носа и обоняния помогают запахам расщепляться в носу, чтобы можно было обнаружить их частицы и почувствовать запах вещества. Слизистые оболочки также встречаются в репродуктивных органах, таких как влагалище; естественные выделения из влагалища производятся слизистой оболочкой влагалища для самоочищения и сохранения влаги во влагалище.
Например, слизистая оболочка желудка и кишечника участвует в переваривании и всасывании пищи. Слизистые оболочки носа и обоняния помогают запахам расщепляться в носу, чтобы можно было обнаружить их частицы и почувствовать запах вещества. Слизистые оболочки также встречаются в репродуктивных органах, таких как влагалище; естественные выделения из влагалища производятся слизистой оболочкой влагалища для самоочищения и сохранения влаги во влагалище.
Образцы слизистых оболочек
Слизистые оболочки пищеварительной системы
Рот, язык, пищевод, желудок и кишечник покрыты слизистой оболочкой. Эти оболочки называют слизистой оболочкой полости рта, слизистой оболочкой пищевода, слизистой оболочкой желудка и слизистой оболочкой кишечника. Слизистая оболочка полости рта обнаруживается во рту, и изменения ее состояния могут быть признаками авитаминоза, сахарного диабета или в результате длительного употребления табака или алкоголя. Различают три типа слизистой оболочки полости рта: выстилающую, жевательную и специализированную. Слизистая оболочка выстилает такие поверхности, как мягкое небо и дно полости рта. Жевательная слизистая обеспечивает более твердую поверхность для жевания, в то время как специализированная слизистая находится на языке и содержит вкусовые сосочки. Слизистая оболочка пищевода выделяет слизь, которая защищает пищевод от стирания пищей. Слизистая оболочка желудка, находящаяся в желудке, вырабатывает слизь, пищеварительные ферменты и клетки, которые стимулируют выработку кислоты для расщепления пищи. Кишечник выстлан слизистой оболочкой кишечника, которая поглощает питательные вещества из пищи, а также поглощает воду.
Слизистая оболочка выстилает такие поверхности, как мягкое небо и дно полости рта. Жевательная слизистая обеспечивает более твердую поверхность для жевания, в то время как специализированная слизистая находится на языке и содержит вкусовые сосочки. Слизистая оболочка пищевода выделяет слизь, которая защищает пищевод от стирания пищей. Слизистая оболочка желудка, находящаяся в желудке, вырабатывает слизь, пищеварительные ферменты и клетки, которые стимулируют выработку кислоты для расщепления пищи. Кишечник выстлан слизистой оболочкой кишечника, которая поглощает питательные вещества из пищи, а также поглощает воду.
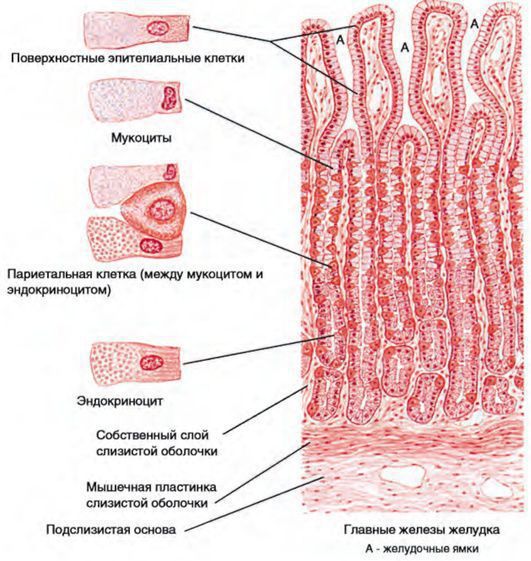
Это микроскопическое изображение слизистой оболочки желудка.
Слизистые оболочки дыхательной системы
Слизистая оболочка носа представляет собой выстилку полости носа. Он увлажняет воздух, поступающий в организм при вдохе. Он обычно поражается во время простуды, и во время простуды выделяется больше слизи, чем обычно; это создает симптомы заложенного, насморка. Обонятельная слизистая расположена в верхней части носовой полости и помогает нам чувствовать запах. Слизистые оболочки также выстилают бронхи легких, где происходит газообмен. Если у кого-то астма, слизистая оболочка бронхов может воспаляться, что повышает вероятность спазма бронхов. Это вызывает временное снижение функции легких.
Обонятельная слизистая расположена в верхней части носовой полости и помогает нам чувствовать запах. Слизистые оболочки также выстилают бронхи легких, где происходит газообмен. Если у кого-то астма, слизистая оболочка бронхов может воспаляться, что повышает вероятность спазма бронхов. Это вызывает временное снижение функции легких.
Слизистые оболочки репродуктивной системы
Слизистые оболочки также встречаются в органах репродуктивной системы. Слизистая оболочка влагалища выстилает влагалище и выделяет жидкость, которая помогает поддерживать влажность влагалища. Матка также содержит слизистую оболочку, которая называется эндометрием. Эндометрий имеет слой, который утолщается, так что оплодотворенная яйцеклетка может имплантироваться в него; если оплодотворения не происходит, эта оболочка сбрасывается во время менструального цикла.
Половой член также имеет слизистую оболочку, которая называется слизистой оболочкой полового члена или препуциальной слизистой оболочкой. Слизистая оболочка препуция конкретно относится к слизистой оболочке на внутренней стороне препуция (крайняя плоть). Функция слизистой оболочки препуция заключается в поддержании уровня влажности. Эта слизистая оболочка в значительной степени удаляется во время обрезания, поэтому у мужчин, подвергшихся обрезанию, эта влага теряется, и головка полового члена становится более сухой.
Слизистая оболочка препуция конкретно относится к слизистой оболочке на внутренней стороне препуция (крайняя плоть). Функция слизистой оболочки препуция заключается в поддержании уровня влажности. Эта слизистая оболочка в значительной степени удаляется во время обрезания, поэтому у мужчин, подвергшихся обрезанию, эта влага теряется, и головка полового члена становится более сухой.
- Отверстие – Отверстие в теле, такое как рот; часто выстлан слизистой оболочкой.
- Эктодерма – Внешний слой клеток в развивающемся эмбрионе, из которого формируются такие структуры, как кожа, нервы и слизистые оболочки.
- Жевание – Разрушение пищи зубами, т. е. пережевывание.
- Эндометрий – Слизистая оболочка матки.
Тест
1. В чем разница между слизью и слизью?
A. Слизистая — прилагательное, описывающее слизистую оболочку, а слизь — существительное.
B. Слизь — прилагательное, описывающее слизистую оболочку, а слизь — существительное.
C. Слизь обнаруживается только в носу, тогда как слизь обнаруживается на других участках тела.
D. Слизь обнаруживается только в носу, тогда как слизь обнаруживается на других участках тела.
Ответ на вопрос № 1
Правильно . Слизистый — прилагательное; он описывает мембраны, которые производят слизь. Слизь — это существительное, относящееся к защитной жидкости. Слизь находится не только в полости носа, но и в других областях тела, выстланных слизистыми оболочками.
2. Какая слизистая оболочка не является частью пищеварительной системы?
A. Слизистая оральная слизистая оболочка
B. Слизистая оболочка желудка
C. Подготовленная слизистая оболочка
D. Subsa
. Слизистые оболочки полости рта, желудка и пищевода находятся во рту, желудке и пищеводе соответственно. Все они являются частью пищеварительной системы. Слизистая оболочка препуция расположена на крайней плоти полового члена, поэтому является частью половой системы.
Слизистые оболочки полости рта, желудка и пищевода находятся во рту, желудке и пищеводе соответственно. Все они являются частью пищеварительной системы. Слизистая оболочка препуция расположена на крайней плоти полового члена, поэтому является частью половой системы.
3. Какая функция не является функцией слизистой оболочки?
A. Для смазывания влагалища
B. Для поглощения питательных веществ из пищи
C. Для поддержания тела в сухости
D. Для устранения запахов, чтобы их можно было обнаружить и почувствовать по запаху
1
1
Ответ на вопрос №3
C верно. Варианты A, B и D зависят от разных слизистых оболочек. Вариант A описывает слизистую оболочку влагалища, вариант B описывает слизистую оболочку кишечника, а вариант D описывает слизистую оболочку носа и обоняния. Вариант C не зависит от какой-либо слизистой оболочки; на самом деле, это противоположно общей функции слизистой оболочки. Поскольку слизистые оболочки производят или содержат слизь, их работа заключается в том, чтобы поддерживать влажность различных частей тела, а не сухость.
Поскольку слизистые оболочки производят или содержат слизь, их работа заключается в том, чтобы поддерживать влажность различных частей тела, а не сухость.
Серия «Городские легенды»: пемфигоид слизистых оболочек
Обзор
. 2014 янв; 20(1):35-54.
дои: 10.1111/odi.12193.
Epub 2013 6 ноября.
Г Ди Зензо 1 , М. Карроццо, Л. С. Чан
принадлежность
- 1 Лаборатория молекулярной и клеточной биологии, Istituto Dermopatico dell’Immacolata, IDI-IRCCS, Рим, Италия.
- PMID: 24320968
- DOI:
10.
 1111/оди.12193
1111/оди.12193
Обзор
G Di Zenzo et al.
Оральный Дис.
2014 Январь
. 2014 янв; 20(1):35-54.
дои: 10.1111/odi.12193.
Epub 2013 6 ноября.
Авторы
Г Ди Зензо 1 , М. Карроццо, Л. С. Чан
принадлежность
- 1 Лаборатория молекулярной и клеточной биологии, Istituto Dermopatico dell’Immacolata, IDI-IRCCS, Рим, Италия.
- PMID: 24320968
- DOI:
10.
 1111/оди.12193
1111/оди.12193
Абстрактный
Пемфигоид слизистых оболочек (ПМС) представляет собой гетерогенную группу аутоиммунных субэпителиально-пузырчатых заболеваний, поражающих преимущественно слизистые оболочки и проявляющих выраженную клиническую и иммунологическую изменчивость. Мы исследовали четыре спорные темы: (i) Существует ли оральный пемфигоид (ОП) как отдельная сущность? (ii) Излечим ли пемфигоид слизистых оболочек? (iii) Каков наилучший вариант лечения ММР? (iv) Существует ли эксклюзивный оральный IgA-дерматит как отдельное состояние от MMP? Результаты обширного литературного поиска показали, что (i) до сих пор неясно, можно ли рассматривать пациентов с ОП как отдельную подгруппу ММП со специфическими клиническими и иммунологическими особенностями; (ii) неясно, можно ли отказаться от схем лечения, позволяющих контролировать ММР, чтобы позволить пациентам достичь ремиссии без лекарств, или их следует постоянно вводить в некоторых количествах; (iii) существует тревожная нехватка качественных исследований MMP, а имеющиеся рекомендации основаны исключительно на, как правило, небольших когортах пациентов или сериях случаев. Возможно, следует обновить некоторые из консенсусных мнений экспертов 2002 г., особенно в отношении безопасности сульфаниламидных препаратов; (iv) мы не нашли каких-либо веских доказательств в поддержку исключительной пероральной (и, возможно, также слизистой) формы LAD как отдельной сущности.
Возможно, следует обновить некоторые из консенсусных мнений экспертов 2002 г., особенно в отношении безопасности сульфаниламидных препаратов; (iv) мы не нашли каких-либо веских доказательств в поддержку исключительной пероральной (и, возможно, также слизистой) формы LAD как отдельной сущности.
Ключевые слова: линейный IgA-дерматит слизистых оболочек; пемфигоид слизистых оболочек; оральный пемфигоид; лечение.
© 2013 John Wiley & Sons A/S. Опубликовано John Wiley & Sons Ltd.
Похожие статьи
[Пемфигоид слизистых оболочек. Клинические, гистопатологические и иммунологические аспекты и современные терапевтические концепции.
Карроццо М., Брокколетти Р., Карбоне М., Гарзино-Демо П., Гандольфо С.
Карроццо М. и др.
Минерва Стоматол. 1996 окт; 45 (10): 455-63. Минерва Стоматол. 1996.
PMID: 9026690
Обзор.
итальянский.
Минерва Стоматол. 1996.
PMID: 9026690
Обзор.
итальянский.
Успешное лечение пемфигоида слизистых оболочек этанерцептом у 3 пациентов.
Канисарес М.Дж., Смит Д.И., Коннерс М.С., Маверик К.Дж., Хеффернан М.П.
Канисарес М.Дж. и соавт.
Арка Дерматол. 2006 ноябрь; 142(11):1457-61. doi: 10.1001/archderm.142.11.1457.
Арка Дерматол. 2006.
PMID: 17116836
Лечение пемфигоида слизистых оболочек: обзор литературы и обновление.
Альрашдан М.С., Камагучи М.
Альрашдан М.С. и др.
Евр Дж Дерматол. 2022 1 мая; 32(3):312-321. doi: 10.1684/ejd.2021.4132.
Евр Дж Дерматол. 2022.
PMID: 36065531
Обзор.
Английский.
Пемфигоид слизистых оболочек.
Sollecito TP, Parisi E.
Соллецито Т.П. и др.
Дент Клин Норт Ам. 2005 г., янв.; 49(1):91–106, viii. doi: 10.1016/j.cden.2004.07.004.
Дент Клин Норт Ам. 2005.
PMID: 15567363
Обзор.
Обнаружение линейных отложений IgE при буллезном пемфигоиде и пемфигоиде слизистых оболочек: полезный ключ к диагностике.
Яйли С., Пеливани Н., Белтраминелли Х., Виртмюллер У., Белезнай З., Хорн М., Боррадори Л.
Яйли С. и др.
Бр Дж Дерматол. 2011 ноябрь; 165(5):1133-7. doi: 10.1111/j.1365-2133.2011.10481.x.
Бр Дж Дерматол. 2011.
PMID: 21711326
Посмотреть все похожие статьи
Цитируется
Пемфигоид слизистых оболочек у пациента с хронической вирусной инфекцией гепатита В: клинический случай.
 Поскольку слизистые оболочки производят или содержат слизь, их работа заключается в том, чтобы поддерживать влажность различных частей тела, а не сухость.
Поскольку слизистые оболочки производят или содержат слизь, их работа заключается в том, чтобы поддерживать влажность различных частей тела, а не сухость. 1111/оди.12193
1111/оди.12193 1111/оди.12193
1111/оди.12193 Возможно, следует обновить некоторые из консенсусных мнений экспертов 2002 г., особенно в отношении безопасности сульфаниламидных препаратов; (iv) мы не нашли каких-либо веских доказательств в поддержку исключительной пероральной (и, возможно, также слизистой) формы LAD как отдельной сущности.
Возможно, следует обновить некоторые из консенсусных мнений экспертов 2002 г., особенно в отношении безопасности сульфаниламидных препаратов; (iv) мы не нашли каких-либо веских доказательств в поддержку исключительной пероральной (и, возможно, также слизистой) формы LAD как отдельной сущности.[Пемфигоид слизистых оболочек. Клинические, гистопатологические и иммунологические аспекты и современные терапевтические концепции.
Карроццо М., Брокколетти Р., Карбоне М., Гарзино-Демо П., Гандольфо С.
Карроццо М. и др.
Минерва Стоматол. 1996 окт; 45 (10): 455-63. Минерва Стоматол. 1996.
PMID: 9026690
Обзор.
итальянский.
Минерва Стоматол. 1996.
PMID: 9026690
Обзор.
итальянский.
Успешное лечение пемфигоида слизистых оболочек этанерцептом у 3 пациентов.
Канисарес М.Дж., Смит Д.И., Коннерс М.С., Маверик К.Дж., Хеффернан М.П. Канисарес М.Дж. и соавт. Арка Дерматол. 2006 ноябрь; 142(11):1457-61. doi: 10.1001/archderm.142.11.1457. Арка Дерматол. 2006. PMID: 17116836
Лечение пемфигоида слизистых оболочек: обзор литературы и обновление.
Альрашдан М.С., Камагучи М. Альрашдан М.С. и др. Евр Дж Дерматол. 2022 1 мая; 32(3):312-321. doi: 10.1684/ejd.2021.4132. Евр Дж Дерматол. 2022. PMID: 36065531 Обзор. Английский.
Пемфигоид слизистых оболочек.
Sollecito TP, Parisi E. Соллецито Т.П. и др. Дент Клин Норт Ам. 2005 г., янв.; 49(1):91–106, viii. doi: 10.1016/j.cden.2004.07.004. Дент Клин Норт Ам. 2005. PMID: 15567363 Обзор.
Обнаружение линейных отложений IgE при буллезном пемфигоиде и пемфигоиде слизистых оболочек: полезный ключ к диагностике.
Яйли С., Пеливани Н., Белтраминелли Х., Виртмюллер У., Белезнай З., Хорн М., Боррадори Л. Яйли С. и др. Бр Дж Дерматол. 2011 ноябрь; 165(5):1133-7. doi: 10.1111/j.1365-2133.2011.10481.x. Бр Дж Дерматол. 2011. PMID: 21711326
Пемфигоид слизистых оболочек у пациента с хронической вирусной инфекцией гепатита В: клинический случай.
