Ветряная оспа («ветрянка»)
Эта инфекция была названа « ветрянкой» в связи со своей заразностью. Ее распространение происходит словно со скоростью ветра. Ребенок может заразиться ветряной оспой, зайдя в лифт после больного человека. После появления больного ребенка в школе или детском саду, через некоторое время заболевает большинство детей.
Ветряная оспа относится к числу наиболее распространенных заболеваний детского возраста. За последние годы заболеваемость ветрянкой в России увеличилась почти в 2 раза. Преимущественно болеют дети в возрасте от 1 до 10 лет, максимальная заболеваемость отмечается среди детей в возрасте 3-4 лет. Дети до 6 месяцев практически не болеют ветряной оспой, т.к. мать передает им собственный иммунитет через плаценту и во время грудного вскармливания. Пик заболеваемости отмечается в осенне-зимний период.
Что такое ветряная оспа?
Ветряная оспа – острая вирусная инфекция с воздушно-капельным путем передачи, характеризующаяся появлением на коже и слизистых оболочках сыпи в виде мелких пузырьков.
Возбудителем ветряной оспы является вирус Varicella zoster, относящийся к семейству герпетических вирусов. Во внешней среде вирус неустойчив и быстро погибает.
Единственным источником инфекции является человек. Восприимчивость к ветряной оспе очень высокая.
Больные становятся заразными в конце инкубационного периода (за 48 часов до появления сыпи) и до 5-го дня с момента появления последнего элемента сыпи.
Путь передачи инфекции –воздушно-капельный.
Вирусы в огромном количестве выделяются при чихании, кашле, разговоре. Также возможна передача вируса от матери плоду во время беременности. Через третьих лиц передача инфекции невозможна. На обуви и одежде принести вирус домой тоже нет шансов.
В связи с большой летучестью вируса, его распространение возможно с этажа на этаж, на расстояние до 20 метров.
Ветряная оспа у взрослых протекает намного тяжелее, чем у детей, и способна вызвать серьезные осложнения.
Клиническая картина.
Инкубационный период продолжается от 10 до 21 дня (чаще 14-17 дней).
У детей заболевание начинается с подъема температуры до 38,5 – 39оС, отмечается слабость, снижение аппетита, головная боль. Ребенок становится капризным, отказывается от еды. Одновременно с подъемом температуры появляется сыпь. Выраженность лихорадки соответствует обилию сыпи. Продолжительность лихорадки 3-5 дней. Каждое новое высыпание сопровождается подъемом температуры тела. Сыпь сначала имеет вид красных пятнышек, которые в течение нескольких часов превращаются в папулы, далее в пузырьки, а через 1-2 дня на месте сыпи остается корочка. Размеры пузырьков сопоставимы с размером булавочной головки. После отпадения корочки остается красное пятно, иногда – рубец. Первые элементы сыпи обычно появляются на коже лица, волосистой части головы, спине, животе, груди, плечах, бедрах. На ладонях и подошвах сыпь, как правило, отсутствует.
Выздоровление наступает не ранее 10 дня с момента высыпаний.
Осложнения заболевания.
Ветряная оспа считается доброкачественным заболеванием, однако, в ряде случаев могут развиться тяжелые осложнения. Среди осложнений ветряной оспы наиболее частыми являются гнойные поражения кожи – фурункулы, абсцессы и др. тяжело протекает специфическая пневмония, а самым грозным осложнением этой инфекции является поражение центральной нервной системы в форме энцефалита или менингита.
Среди взрослого населения наиболее частым осложнением является пневмония, а у новорожденных «синдром врожденной ветряной оспы», когда беременная женщина перенесла заболевание на ранних сроках беременности.
Сложности в протекании заболевания наблюдаются у людей с иммунодефицитом, в том числе и ВИЧ-инфекцией.
Для предотвращения присоединения вторичной инфекции необходимо следить за частотой рук, одежды, постельного белья больного. В период высыпаний и лихорадки больной должен соблюдать постельный режим.
Элементы сыпи рекомендуется смазывать раствором бриллиантового зеленого. В период высыпаний разрешается мытье с использованием щадящего мыла, мочалку использовать нельзя, так как существует опасность повреждения корочек.
Родители должны своевременно отреагировать на изменения сыпи и вызвать врача для предупреждения развития осложнений:
· Если сыпь увеличивается в размерах, похожа на начало «простуды на губах», покрывается многочисленными пузырьками, синеет, наливается кровью, новые высыпания появляются спустя 10 дней с момента появления первых признаков заболевания «ветрянки».
· если более недели держится температура выше 37 или температура с каждым днем растет,
· если сыпь распространяется на слизистые оболочки: глаза, ротовою полость, или на половые органы, т.
· при появлении кашля или насморка, т.к. герпетические высыпания могут находиться в носоглотке
· при появлении поноса и частой рвоты,
т.е. во всех случаях, когда ветрянка протекает атипично.
В любом случае, как только вы заметили первые признаки недомогания ребенка и сыпь, сразу вызовите врача. Только он точно определит, ветряная оспа у ребенка или другое заболевание (не опытному взгляду отличить симптомы ветряной оспы от аллергии или других заболеваний с сыпью довольно сложно), и будет контролировать течение болезни.
Ветряная оспа у взрослых
Ветряная оспа во взрослом возрасте протекает намного тяжелее. Отличительной особенностью ветряной оспы у взрослых являются выраженные симптомы интоксикации и частое развития осложнений, вплоть до летального исхода.
Ветряная оспа у беременных.
Беременная женщина, заболевшая ветряной оспой, нуждается в тщательном наблюдении врача. Инфекция опасна как для самой женщины, так и для плода. Ветряная оспа может вызвать патологию зрения, а также задержку умственного и физического развития плода.
Профилактика.
Общая профилактика ветряной оспы заключается в своевременной диагностике заболевания, изоляции больного с последующим проветриванием и влажной уборкой помещения с целью предотвращения распространения инфекции. Больного ветряной оспой изолируют до 5-го дня от момента появления последних элементов сыпи. В детских коллективах карантин накладывается с 11 по 21 день от момента контакта.
На сегодняшний день разработана специфическая профилактика ветряной оспы. Вакцинация проводится детям, не болевшим ранее этой инфекцией. Вакцина вводится подкожно: детям, в возрасте от 1 года до 13 лет — однократно; детям старше 13 лет и взрослым необходимо двукратное введение вакцины с интервалами между введениями 6-10 недель.
Вакцинация показана лицам, относящимся к группе высокого риска: лицам, страдающим тяжелыми хроническими заболеваниями, больным острым лейкозом, лицам, получающим иммунодепрессанты, лучевую терапию, пациентам, которым планируется провести трансплантацию органа.
Среди привитых лиц случаи заражения ветряной оспой крайне редки. Если заражение произошло, то заболевание протекает в легкой или скрытой форме. После проведенной вакцинации у ребенка в этот же день начинает формироваться иммунитет, который заканчивает свое формирование через 6 недель. Именно с этого момента при контакте с больным ребенком не стоит опасаться заболевания.
Хроническое воспаление и инфекции
- Помощь пациентам
- Новости
- Мероприятия
- Премия
- Конгресс
- Вебинары
- Фото
- Видеолекции
- youtube канал
- COVID-19
-
Об ассоциации
-
Руководство ассоциации
- Президент ассоциации
- Учредители
- Правление ассоциации
- Заседания правления
- Попечительский совет
- Попечительский совет
- Региональные отделения
-
Уставные документы
- Цели и задачи ассоциации
- Права и обязанности членов ассоциации
- Отзывы об ассоциации
- Контакты
- Взносы в ассоциацию
- Партнёры ассоциации
- Сотрудничество
- СМИ об ассоциации
- Аккредитация СМИ
-
Руководство ассоциации
-
Проекты
- Горячая линия
- Конкурс «Жизнь продолжается!»
-
Конкурс журналистских работ
- Положение о конкурсе
- Конкурс 2020 год
- Конкурс 2019 год
- История моей победы
- Онкопатруль
- Группа взаимопомощи
-
Проект «Силы есть»
- Часть 1
- Часть 2
- ОчУмелые ручки
-
Центр О.
 П.Р.А.
П.Р.А.
- Жизнь после диагноза
- Танцетерапия
- #СпастиЖизнь
- Онконет
- Проект Важно услышать
- Пациентоориентированный цифровой онкоцентр
- Волонтерское движение
- Занятия по скандинавской ходьбе
- Пациентам
Воспаление – нормальный физиологический процесс, в ходе которого организм пытается устранить причину, вызвавшую повреждение тканей и устранить полученные повреждения. В норме после этого процесс воспаления останавливается, но в некоторых случаях развивается хроническое воспаление.
В норме после этого процесс воспаления останавливается, но в некоторых случаях развивается хроническое воспаление.
Хроническое воспаление
В случае хронического воспаления процесс воспаления может начаться даже без явного воздействия внешнего повреждающего фактора и может продолжаться в течение длительного времени. Это может происходить под влиянием некоторых микроорганизмов (вирусов, бактерий, грибов и т.д.) или, например, как следствие ненормальной реакции организма на собственные ткани, что приводит к развитию различных аутоиммунных реакций (болезнь Крона, язвенный колит, атрофический гастрит и т.д.).
Под длительным воздействием воспалительных факторов происходит постоянное повреждение тканей на фоне которого возможно появление злокачественных клеток. Некоторые микроорганизмы-возбудители инфекционных болезней могут повышать риск развития рака. Ниже перечислены наиболее изученные из них.
Вирус папилломы человека (ВПЧ, HPV)
ВПЧ — причина развития практически всех случаев рака шейки матки (РШМ). Кроме того, у носителей данной инфекции значимо повышается риск развития других опухолей наружных половых органов, а также рака головы и шеи. Эта инфекция очень широко распространена в человеческой популяции, так, в США ВПЧ ежегодно поражает около 79 млн. человек. В настоящий момент известно более 150 штаммов этого вируса, при этом только около 15 из них являются онкогенными, т.е. способными приводить к развитию злокачественных новообразований.
Кроме того, у носителей данной инфекции значимо повышается риск развития других опухолей наружных половых органов, а также рака головы и шеи. Эта инфекция очень широко распространена в человеческой популяции, так, в США ВПЧ ежегодно поражает около 79 млн. человек. В настоящий момент известно более 150 штаммов этого вируса, при этом только около 15 из них являются онкогенными, т.е. способными приводить к развитию злокачественных новообразований.
В мире РШМ является второй по частоте встречаемости опухолью у женщин. Внедрение повсеместного обследования (скрининга), включающего в себя регулярные осмотры гинекологом со взятием цитологических мазков из шейки матки (цервикального канала), а также определение наличия ДНК ВПЧ в крови позволило резко снизить заболеваемость и смертность от РШМ в развитых странах. На сегодняшний день 9 из 10 случаев смерти от РШМ приходится на бедные регионы и страны.
На сегодняшний день не существует способов лечения ВПЧ, однако в клиническую практику уже внедрены вакцины, которые позволяют резко снизить вероятность развития РШМ, защищая человека от наиболее распространенных штаммов HPV. Очень важно, чтобы вакцинация проводилась до момента первого контакта человека с возбудителем этой инфекции, рекомендуется прививать детей в возрасте от 11 до 12 лет.
Очень важно, чтобы вакцинация проводилась до момента первого контакта человека с возбудителем этой инфекции, рекомендуется прививать детей в возрасте от 11 до 12 лет.
Кроме того, РШМ не развивается моментально. Его развитию предшествуют предопухолевые изменения эпителия – дисплазия, затем – т.н. «цервикальная неоплазия in situ», которая представляет собой самую раннюю стадию РШМ. Своевременная диагностика и лечение таких процессов позволяет предотвратить развитие РШМ.
Вирусные гепатиты С и В (HCV и HBV)
Хроническая инфекция, вызванная этими возбудителями, может приводить к развитию цирроза и рака печени, кроме этого доказана их связь с развитие некоторых лимфом. В настоящее время широко применяются вакцины против вирусного гепатита B, они позволяют эффективно предотвращать заражение и развитие хронической HBV инфекции, снижая тем самым вероятность развития рака печени.
К сожалению, не существует профилактических вакцин против вируса гепатита С. Это обусловлено высокой мутационной изменчивостью этого вируса, что резко затрудняет разработку и создание таких препаратов. Тем не менее, в настоящее время разработаны весьма эффективные противовирусные лекарственные препараты, которые могут подавить размножение или полностью уничтожить вирус в организме.
Это обусловлено высокой мутационной изменчивостью этого вируса, что резко затрудняет разработку и создание таких препаратов. Тем не менее, в настоящее время разработаны весьма эффективные противовирусные лекарственные препараты, которые могут подавить размножение или полностью уничтожить вирус в организме.
Вирус иммунодефицита человека (ВИЧ, HIV)
Этот широко известный вирус вызывает развитие СПИД – синдрома приобретенного иммунодефицита. ВИЧ ослабляет иммунную систему организма, делая её неспособной сопротивляться воздействиям различных микроорганизмов (например тех, что перечислены в этом разделе). Люди, инфицированные ВИЧ, характеризируются повышенным риском развития саркомы Капоши, лимфом, РШМ, печени, легких и других опухолей. Вакцины от ВИЧ не существует, но разработаны специальные препараты для противовирусной терапии, которые позволяют подавить размножение этого вируса и значительно продлить жизнь пациентам.
На фоне подавления иммунитета другого происхождения, например у пациентов, получающих длительное лечение иммуносупрессивными препаратами после трансплантации органов или высокими доза глюкокортикостероидов (например, преднизолон, дексаметазон и т.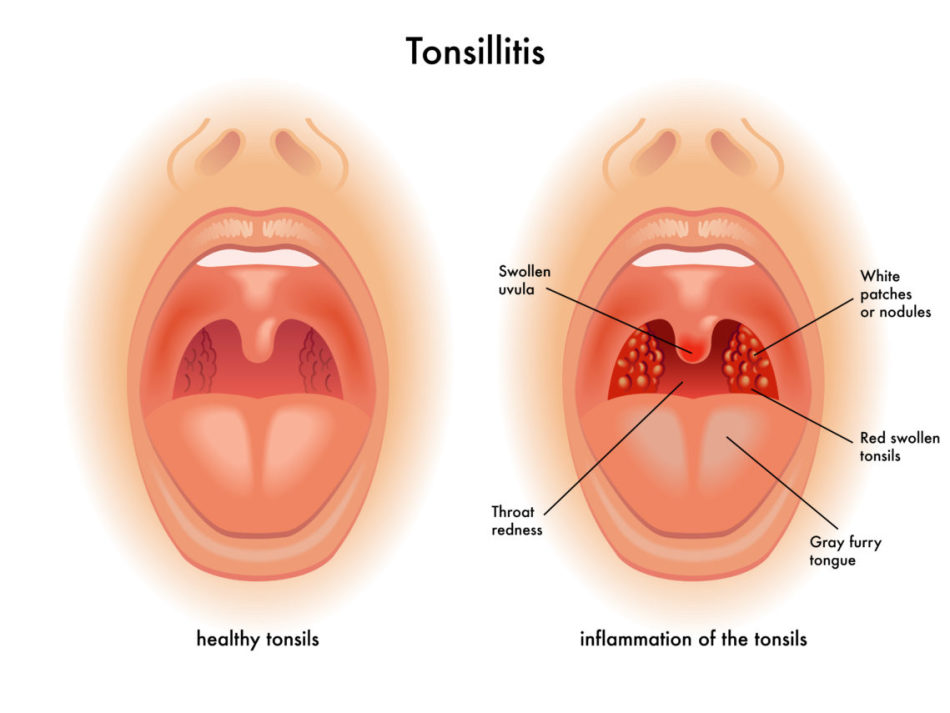 д.) также повышается риск развития множества опухолей.
д.) также повышается риск развития множества опухолей.
Вирусы герпеса
К наиболее онкогенным видам этих вирусов относят вирус Эпштейн-Барр (EBV), который повышает риск развития лимфомы и рака желудка, а также носоглотки. Штамм 8 вируса герпеса ассоциирован с развитием саркомы Капоши.
Бактерии и грибы
Helicobacter pylori (HP) – бактерия, которая может колонизировать слизистую оболочку желудка. На фоне вызванной ей инфекции повышается риск развития язвенной болезни желудка и двенадцатиперстной кишки, а также рака желудка. HP инфекция хорошо поддается лечению антибактериальными препаратами.
Кроме того, некоторые грибки (например, Aspergillus flavus и Aspergillus parasiticus) в процессе своей жизнедеятельности вырабатывают афлатоксины – вредные ещества, которые могут загрязнять сельскохозяйственную продукцию. Распространенность этих грибков велика в жарких и влажных странах, афлатоксины могут попадать в пищу в поле, в процессе сбора урожая и во время её хранения. Употребление в пищу афлатоксинов повышает риск развития рака печени.
Употребление в пищу афлатоксинов повышает риск развития рака печени.
Паразиты
К наиболее онкогенным паразитам относят Schistosoma hematobium (возбудитель шистосомоза), который может вызывать рак мочевого пузыря и Opisthorchis viverrini (возбудитель описторхоза), на фоне которого повышается риск развития рака желчевыводящих путей (холингиокарциномы).
Следует помнить, что отсутствие симптомов инфекции не означает отсутствия самой инфекции.
ЗППП, половые инфекции. Или чем опасен оральный и незащищенный секс?
В этой статье:
«Когда почувствуешь себя одиноким, вспомни,
внутри тебя живут виды бактерий, не выполняющих
никаких функций. Ты просто им нравишься»
А.Доброкотов
Все не так просто при незащищенном и оральном сексе. Иллюзия безопасности присуствует только в нашем сознаии. На самом деле все много сложнее.
Батерии с рук могут оказаться везде – во рту, в гениталиях, в глазах
Рот, как ни странно, одно из наиболее нечистоплотных мест в организме. Рот – это та область, в которую попадает очень много постронних бактерий. Даже, если вы моете руки и соблюдате гигиену полости рта (чистите зубы и полощите рот), все-равно избежать попадания чужой флоры не удается. Она вокруг нас везде. В пище, на руках, под ногтями, на вашей зубной щетке…
Рот – это та область, в которую попадает очень много постронних бактерий. Даже, если вы моете руки и соблюдате гигиену полости рта (чистите зубы и полощите рот), все-равно избежать попадания чужой флоры не удается. Она вокруг нас везде. В пище, на руках, под ногтями, на вашей зубной щетке…
На фото то,что высевается только с ваших рук.
Не верите? Можете сами взять и проверить. Инструкция – здесь.
А тут мама попросила пришедшего с прогулки ребенка приложить свою немытую ладошку к чашке Петри*
*Чашка Петри – это та лабораторная посудина, на которой выращивают бактерии.
И вот, что получилось.
Источник: pikabu.ru
Эти разноцветные пятна – колонии разросшихся бактерий. О чем это говорит? О том, что немытые руки очень грязные. Человек трогает этими руками все. И гениталии в том числе. Бактерии с рук могут переходить в рот, глаза, гениталии. Равно, как в обратном порядке из гениталий в рот, в глаза и т. д.
д.
Теперь о содержимом рта
То, что на руках, то нередко и во рту.
Будете неприятно удивлены! Изо рта высевается бактерий больше в разы (!!!). И много более разнообразных, в том числе и патогенных.
Предвижу вопрос: «Слюна содержит бактерицидный фермент лизоцим, который все обезвредит?».
Да, лизоцим есть. Но его активности не хватает для умерщвления большого количества бактерий во рту, в том числе патогенных. Полезная флора (т.н. сапорофиты*), которая постоянно проживает во рту, адаптирована к лизоциму.
*сапорофиты – живущие в симбиозе с организмом человека
Активности лизоцима не хватит на обезвреживание всех поступающих в рот извне бактерий.
Ниже – бакпосев из зева.
Полезные бактерии и бактерии сожители (комменсалы)
Во рту могут быть выявлены много разновидностей бактерий: стафилококки-комменсалы*, некоторые вирусы, простейшие микроорганизмы и др.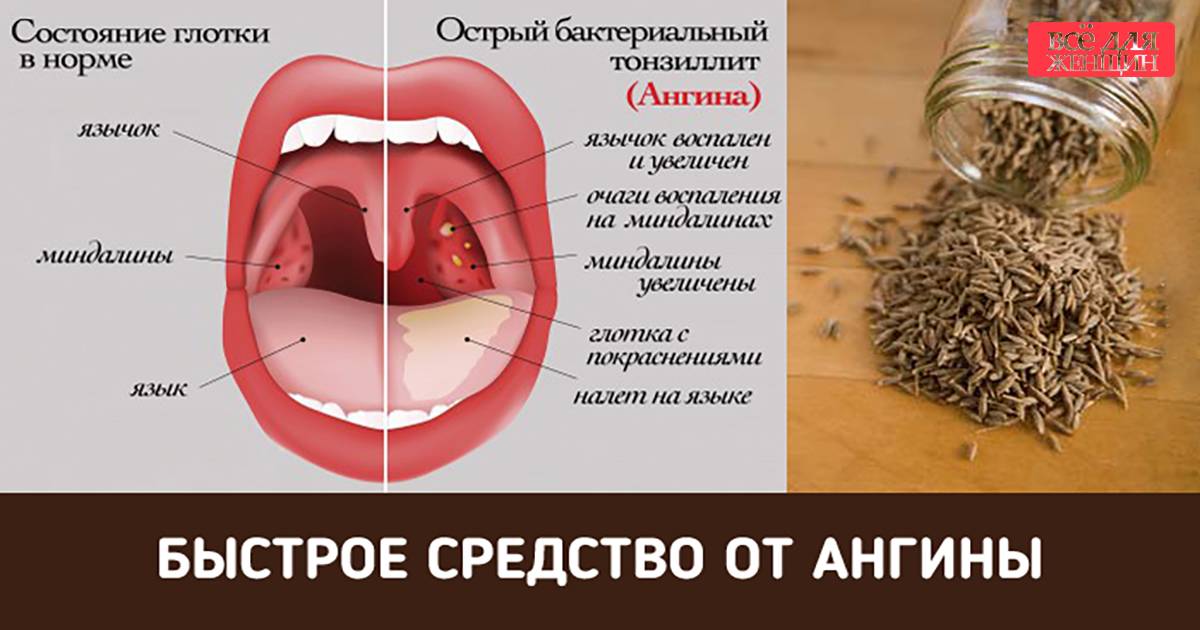 Чаще это постоянные обитатели ротовой полости, от которых, как правило никакого вреда нет. Это те бактерии, «которым ты просто нравишься»
Чаще это постоянные обитатели ротовой полости, от которых, как правило никакого вреда нет. Это те бактерии, «которым ты просто нравишься»
*Комменсалы – сожители, которые не приносят вреда
Понятие «нормальная микрофлора» объединяет в себе микроорганизмы, наличие которых является нормой для здорового человека.
Вместе с тем, достаточно часто встречаются и патогенные бактерии. Грань между здоровой флорой и патогенами провести сложно. Более того, случаются ситуации, когда происходит «обвал» иммунитета и своя «родная и безобидная» флора «покажет зубы» — станет патогенной.
Теперь о сексе с оральным уклоном. Доказанный состав флоры ротовой полости человека
Состав флоры ротовой полости человека постоянно обновляется. В рот микроорганизмы попадают с пищей, воздухом, водой… Во рту есть места, где могут задержаться бактерии. Это межзубные промежутки, карманы десен, складки слизистых полости рта и др. Именно там остатки пищи и др. превращаются в среду для роста бактерий.
Во рту преобладают анаэтобные типы бактерий (те, которым для жизни не нужен кислород).
На щеках, в их эпителии живет стрептококк — Streptococcus mitior.
На проверхности зубов — Streptococcus mutans и Streptococcus sangius.
Кончик языка украшает Streptococcus salivarius.
Во рту обитают спирохеты родов Treponema Leptospiria, Borrelia.
Есть там и микоплазмы (M. Salivarium, M. orale) – ничего не напоминает? Много простейших микроорганизмов — Trichomonas buccalis, Entamoeba buccalis, Entamoeba dentalis, аэробактерии, Клебсиелла (палочка Фридлендера).
Естественная флора – это барьер для внешней флоры. Своя флора конкурирует с пришельцами. И в этом, в том числе, ее польза. Эта флора полезна.
Но, как себя поведет естественная флора при попадании в иную среду?
Например, во влагалище или в уретру партнера?
Патогенные бактерии рта. Что находят во рту при исследованиях
В рот неизбежно попадают и патогенные бактерии. Именно они в состоянии нанести вред.
Тем более, что нередки такие заболевания полости рта, как кандидоз, стоматит, глоссит, лейкоплакия, пародонтит, пародонтоз, гингивит и др. Все они вызваны инородными бактериями и вирусами, которые попали в рот. Все эти заболевания вызваны патогенной флорой.
Что характерно: выраженность проявлений этой патологии может быть смазанной. Поэтому человек может на них и не обратить внимания.
Доминирующие обитатели полости рта – это стрептококки. Более 100 стрептококков содержится в 1 миллилитре слюны.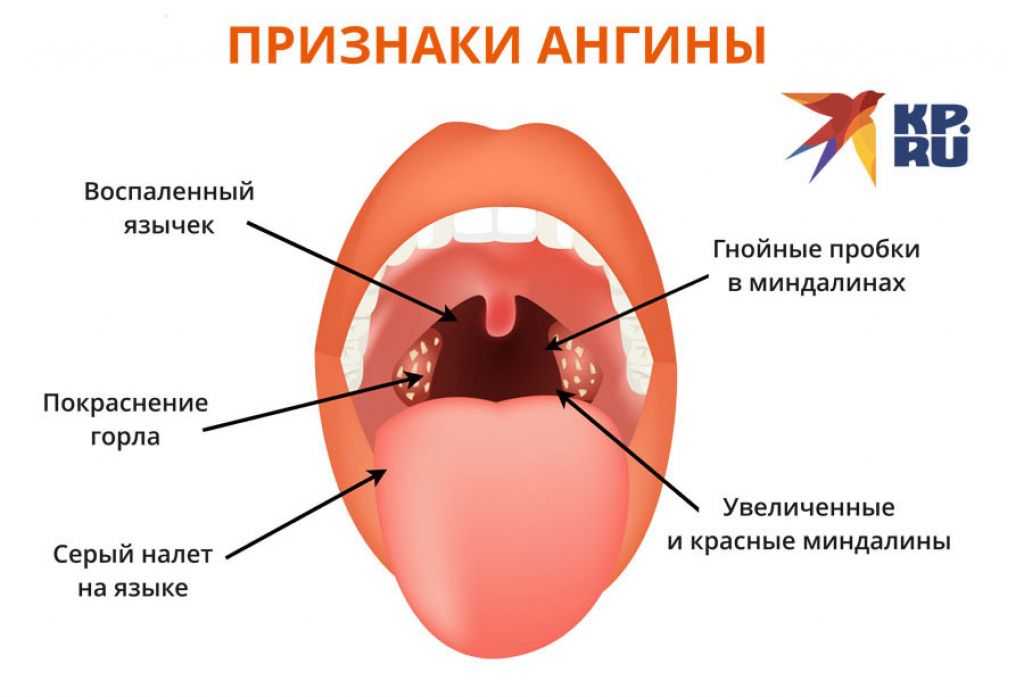 При этом в зубном налете неизменно присутствует эпидермальный стафилококк Staph. epidermidis. Последние исследования показали, что эпидермальный стафилококк, попадая, например, в гениталии (не свойственное для него место) становится патогеном (вредным).
При этом в зубном налете неизменно присутствует эпидермальный стафилококк Staph. epidermidis. Последние исследования показали, что эпидермальный стафилококк, попадая, например, в гениталии (не свойственное для него место) становится патогеном (вредным).
Такой же патогенной флорой является золотистый стафилококк (Staph. aureus) – очень агрессивная внутрибольничная инфекция. Ее вывести из больничного помещения невозможно. Ремонты и дезинфекция не помогают. Из-за золотистого стафилококка в Америке целые больницы не ремонтируют, а просто сносят.
Доказано, что золотистый и эпидермальные стафилококки абсолютные патогены, способные вызвать воспалительные заболевания мочеполовой системы.
Во рту выявляются грибы Candida , Aspergillia niger, Pseudomonae aeruginosa, род бактерий Staphylococcus , Streptococcus , кишечная палочка Esherichia coli , Klebsiella , рода Neisseria , Энтерококки Enterococcus , Коринобактерии (Corynobacter). Грибы: C. albicans, C. tropikalis,
Грибы: C. albicans, C. tropikalis,
Другие виды стафилококков, что находят во рту: Staph. Viri, Staph. Albic, Staph. Aureus, Staph. haeruelibicus,
Стрепотококки: Streptococcus. Viridans, — абсолютно патогенная для мочеполовой системы флора, как и эпидермальный стафилококк Str. Epidermidis.
и другие стрептококки: Str. Faecabis, Str. Aureus, Str. Hominis, Str. Vissei, Str. Flaeris, Str. Salivarum, Str. Agalactika, Str. Milis, Str. Sanguis, Str. Pyogenes, Str. Anginosus, Str. Mutans, Str. Cremoris,
Salivarum, Str. Agalactika, Str. Milis, Str. Sanguis, Str. Pyogenes, Str. Anginosus, Str. Mutans, Str. Cremoris,
Род Neisseria: N. sicca, N. subfeava, N. feava,
Клебсиеллы: K. pneumoniae, — флора, которая вызывает пневмонию и прогрессировать до абсцесса легкого, вызывает цистит, пиелит, бактериемии, сепсис и др.
Кишечная палочка Esherichia coli, — нередкий обитатель как рта, так и половых органов.
Энтерококки — Enterococcus faeceum (энтерококк фекалис)— агрессивная патогенная флора. Ее находят как во рту, так и в гениталиях.
Ее находят как во рту, так и в гениталиях.
Синегнойная палочка — Pseudomonae aeruginosa,
Плесневые грибки Aspergillia niger,
Дифтероид Corynobacter pseudodiphteriae.
Источник natural-sciences.ru
Перечисленное выше – это далеко не все, что можно высеять во рту.
Ротовую полость могут заселить возбудители заболеваний, передающихся половым путем (ЗППП)
Заболевания, передающиеся половым путем (ЗППП), передаются от партнера к партнеру через биологические жидкости (в том числе и через слюну). При попадании слюны от зараженного человека на гениталии (половые органы) партнера вызывает инфицирование, что ведет к местному воспалению.
Внизу частично приведен список возбудителей ЗППП, которые поражают ротовую полость.
Герпес
Хламидиоз — характерные хламидийные включения в клетке
Как оказалось, хламидии очень живучие бактерии. Они живут в условиях совершенно несовместимых с жизнью. Ученые нашли хламидии в Северном Ледовитом океане на глубине 3000 метров. Они выживают без кислорода и в условиях очень высокого давления. Неудивительно, что хламидии так сложно лечатся. Этот паразит приспособиться к любым условиям.
Источник: ferra.ru
Уреоплазмоз
Гарднереллез
Представление о о том, что гарднарелла является естественной флорой в организме, не очень соответствует действительности. Гарднарелла легко становится патогенным микроорганизмом, вызывая воспалительные изменения в половых органах такие, как жжение во влагалище (вагинит) и другие воспаления. Гарднереллез является одним из наиболее частых причин бектериального вагиноза. Последние исследования показали, что гарднереллез может провоцировать боль в суставах (артрит)
Последние исследования показали, что гарднереллез может провоцировать боль в суставах (артрит)
Гонорея (диплококк)
Сифилис
Вот такой устрашающий вид имеет бледная спирохета — возбудитель известного столетиями заболевания «сифилис».
При этом можно заразиться, например, гепатитом С, который передается через биологические жидкости, в том числе через слюну и половым путем
Гепатит C
Инфекции, имеющие отношение к желудочно-кишечному тракту. Например – кишечная палочка и энтерококки и др.
Энтерококк фекалис
Эти и многие другие инфекции являются абсолютными патогенами для мочеполовой системы. Они могут передаваться как естественным путем, так и при оральном сексе.
Они могут передаваться как естественным путем, так и при оральном сексе.
Так насколько опасен оральный секс?
Опасен! И вариантов бактерий, находящихся во рту множество.
С высокой степенью вероятности возможен переход бактериального содержимого рта на мочеполовые органы как у женщин, так и у мужчин.
Причем это касается не только строго патогенной флоры, а и любых, даже сапрофитных* бактерий, которые могут находиться во рту.
*Сапрофитные бактерии – бактерии – сожители.
Относительно патогенная и даже непатогенная флора рта может быть частично нейтрализована условиями, где она прижилась. Попадая изо рта в половые органы, бактерия сталкивается с совершенно другой средой. Иная кислотность, другая слизистая, другая концентрация гормонов …, которые могут сделать ее абсолютным патогеном. В половых органах эти бактерии способны вызвать воспалительные заболевания.
Достаточно одного единственного сексуального контакта для того, что бы существенно нарушить бактериальную чистоту половых органов и вызвать воспление: бектериальный вагинит, уретрит, цервицит, эндомтреит, сальпингит, воспаление яичников — аднексит.
Если возник вопрос, откуда у женщины пульсирующая боль справа внизу живота, то с высокой степенью вероятности можно предположить, что это, например, правосторонний аднексит воспалительного характера. Наиболее вероятная причина воспаления – чужеродная флора. Которую, кстати, не сложно выявить и ликвидироать. Решив все проблемы с воспалением.
Так же и с вопросами «боль внизу живота при мочеиспускании», «зуда в промежности», «жжение в промежности», «почему болезненные месячные?» или «болезненные месячные, что делать?». Перед тем, как перебирать большой перечень возможных причин, сделайте банальное исследование на беаткериальную чистоту половых органов. И вопрос может быстро и легко решиться.
Некоторые выводы:
- Руки нужно мыть
- Оральный секс далеко не безопасен.

- Патогенная флора при оральном сексе переходит из полости рта в мочеполовые органы и с высокой степенью вероятности может вызвать воспаление (цистит, уретрит, простатит, цервицит, эндометрит, аднексит и др.). Все зависит от состава флоры и от персонального иммунитета.
- Воспаление может быть выраженным, с бурными проявлениями, как, например, при гонорее: боль, жжение, гнойные выделения, тяжесть внизу живота.
- Воспаление может протекать без каких-либо ощущений и внешних проявлений. Пациент может об инфекции не догадываться. Как, например, при хламидиозе, уреаплазмозе, микоплазмозе. Эти микроорганизмы имеют специальную ферментную систему, которая препятствует развитию воспаления. В этом нередко и проблема, когда пациент считает, что он полностью здоров поскольку «его ничего не беспокоит». В одной лаборатории нашли, а во второй – нет??? NB! Ошибка в диагностике у мужчин достигает 60%, а у женщин – 12% (официальные данные, связанные с техническими моментами забора материала и самих исследований.
 На сегодня независимо от рейтинга лаборатории и страны исполнения!). Но существуют технические решения, способные в разы уменьшить ошибку диагностики.
На сегодня независимо от рейтинга лаборатории и страны исполнения!). Но существуют технические решения, способные в разы уменьшить ошибку диагностики. - Проявления могут быть минимально выраженными при стафилококковой и энтерокковой инфкекции, но вызывать при этом реактивные изменения, например, в суставах и сосудах (например, эндоваскулит).
- Неважно, в каком направлении двигается инфекция: из рта в гениталии или в обратном направлении. Незащищенные и оральный секс может заразить как ротовую полость, так и мочеполовую систему.
Что делать при воспалении?
- Опрос может что-либо показать при наличии жалоб.
- На глаз и при ручном гинекологическом или урологическом осмотре найти причину воспаления не выйдет. Нужно более глубокое обследование.
- УЗИ трансвагинальное и УЗИ простаты показывают воспаления в 80% случаев. Но только при соблюдении определенных стандартов.
Если приведенные выше пункты 1, 2 и 3 дополнить профессиональным лабораторным обследованием (с соблюдением всех стандартов), то, как правило, удается получить абсолютно точные данные по бактериальной чистоте мочеполовых органов.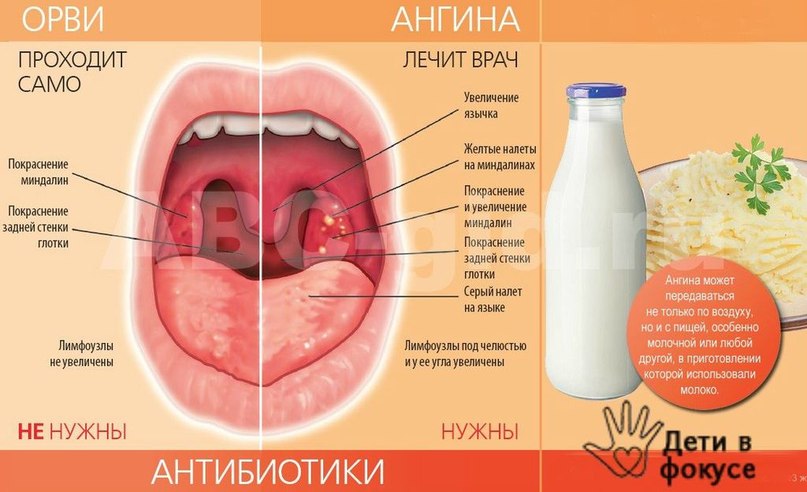 Это самый короткий путь в решении лечения воспаления, особенно – хронических воспалений женских и мужских половых органов.
Это самый короткий путь в решении лечения воспаления, особенно – хронических воспалений женских и мужских половых органов.
Диагностика и лечение заболеваний, передающихся половым путем и других инфекций мочеполовой системы проводится в Киеве, на левом берегу, 250 метров от ст. метро Дарница, пер. Строителей, дом. 4. Центр «Меддиагностика»
.
Гинеколог и уролог в Киеве.
Записаться к гинекологу в Киеве
можно по телефонам, указанным на сайте.
Записаться на приём Как проехать
11 заболеваний, которыми можно заразиться от домашних питомцев
Многие владельцы часто делят со своими питомцами постель, еду и даже технические гаджеты, но при этом животные могут стать для человека источником патогенных бактерий и вирусов. По данным Центров по контролю и профилактике заболеваний (Centers for Disease Control and Prevention — CDC), США, несмотря на большое разнообразие инфекций, передающихся от животных к человеку, владельцы редко заражаются ими от своих домашних питомцев. Ниже представлены 11 заболеваний и патогенов, источником которых для человека может стать его четырехлапый друг.
Ниже представлены 11 заболеваний и патогенов, источником которых для человека может стать его четырехлапый друг.
Кошки могут заражаться различными штаммами гриппа, включая птичий грипп. В редких случаях это заболевание передается человеку. В 2016 г. в приюте для животных в Нью-Йорке среди кошек произошла вспышка птичьего гриппа, вызванного штаммом H7N2. После продолжительного незащищенного контакта с больными животными у одного из сотрудников приюта диагностировали это заболевание. По данным CDC, в целом для человека риск заражения вирусом гриппа от кошек довольно низкий.
У собак и кошек может развиваться чума. Кошки более восприимчивы к инфекции, чем собаки, утверждают ученые. Человек может заразиться чумой через царапины или укус инфицированного животного, а в некоторых случаях — респираторно-капельным путем. Существует также косвенный путь передачи заболевания: бактерии от животного к человеку попадают через укусы блох.
Некоторые популярные домашние животные могут передавать человеку сальмонеллу, но особенно часто это происходит в случае с черепахами./8-1m.jpg) Эти животные могут быть инфицированы сальмонеллой, и человек заражается, контактируя с животными или их аквариумами и клетками. Основной симптом сальмонеллеза — диарея, которая длится около 1 нед. В тяжелом случае требуется госпитализация.
Эти животные могут быть инфицированы сальмонеллой, и человек заражается, контактируя с животными или их аквариумами и клетками. Основной симптом сальмонеллеза — диарея, которая длится около 1 нед. В тяжелом случае требуется госпитализация.
Бешенство — смертельная вирусная инфекция, поражающая центральную нервную систему и распространяющаяся через укусы больных животных. После разработки вакцины против бешенства домашние собаки перестали быть основным источником вируса для человека. Инфицирование домашних питомцев в основном происходит после укуса больных диких животных.
Хантавирусы — семейство вирусов, которыми обычно инфицируются грызуны. Вирус попадает в мочу, помет и слюну больных животных, а человек может вдыхать его с капельками жидкости в воздухе. В 2017 г. зарегистрировано 8 случаев заражения от домашних крыс вирусом Сеул, вызывающим геморрагическую лихорадку с почечным синдромом.
Бактерия Campylobacter, обитающая в кишечнике теплокровных животных, вызывает кампилобактериоз — заболевание желудочно-кишечного тракта.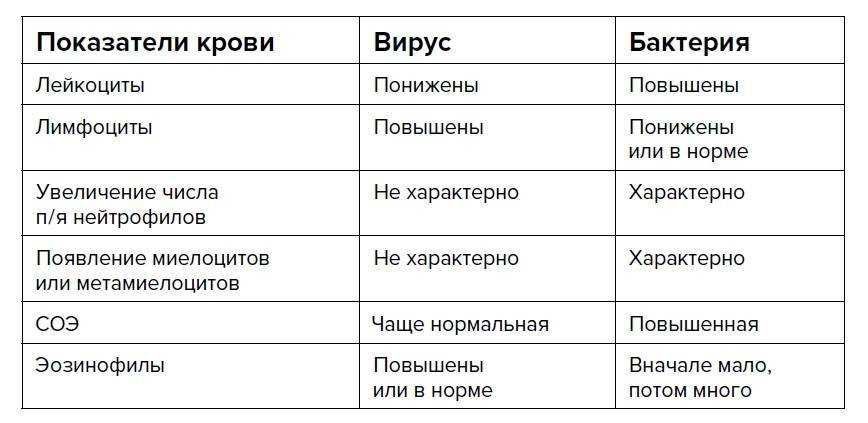 Человек может заразиться патогеном при поедании сырой или недоваренной домашней птицы. Но Campylobacter также может инфицировать собак и кошек, от которых передается человеку во время контакта с экскрементами больных питомцев.
Человек может заразиться патогеном при поедании сырой или недоваренной домашней птицы. Но Campylobacter также может инфицировать собак и кошек, от которых передается человеку во время контакта с экскрементами больных питомцев.
Кошки являются носителями токсоплазмоза, который может передаваться человеку при уборке кошачьих туалетов. Зачастую инфекция не вызывает симптомов, но в тяжелом случае паразит может повредить мозг, глаза и другие органы, отметили ученые. Инфекция может передаваться от матери к ребенку, поэтому беременным рекомендуют избегать контактов с экскрементами домашних питомцев.
Capnocytophaga — бактерия, обитающая в ротовой полости собак и кошек — в редких случаях может передаваться человеку через укусы, царапины и слюну животного. Особенно подвержены инфекции лица с ослабленной иммунной системой. Основные симптомы заболевания: диарея, лихорадка, рвота, головная и мышечная боль, в тяжелых случаях развивается сепсис и может наступить летальный исход.
Около 40% кошек переносят бактерию Bartonella henselae, вызывающую у человека фелиноз (болезнь кошачьих царапин). Заражение происходит через укусы, царапины и при облизывании кошкой открытой раны на теле человека. Заболевание сопровождается воспалением в области раны, высокой температурой тела, головной болью, потерей аппетита, истощением и отеком лимфатических узлов. Лицам с ослабленной иммунной системой рекомендуют избегать контакта с молодыми кошками (до 1 года), поскольку они чаще всего являются носителями патогена.
Домашние питомцы могут заразиться лептоспирозом через воду или от больного дикого животного, а человек — через контакт с инфицированной мочой. Вакцинация является основным методом профилактики этого заболевания.
По данным ученых, метициллин — устойчивый золотистый стафилококк может передаваться от животных к человеку. Эта бактерия вызывает заболевания кожи, дыхательных и мочевыводящих путей. Не существует специфических методов лечения домашних питомцев с этой инфекцией, а их владельцам следует часто мыть руки и выделить для животных отдельное спальное место.
Для профилактики инфекционных заболеваний специалисты рекомендуют тщательно соблюдать правила гигиены при уходе за домашними питомцами, контакте с их едой или экскрементами. А надлежащий ветеринарный уход поможет сохранить здоровье животных.
По материалам www.livescience.com
Стрептодермия | «Кожно-венерологический диспансер №6»
Стрептодермия (пиодермия стрептококковая) – представляет собой инфекционно–аллергическое заболевание.
Болезнь возникает при попадании в толщу кожи стрептококка и продуктов его жизнедеятельности.
Основным проявлением заболевания, независимо от возраста пациента, становится образование на поверхности кожи гнойных элементов, имеющих характерную округлую форму и шелушащуюся поверхность. Различают клинические формы заболевания, в зависимости от размеров патологического очага, их количества и зоны распространения.
Причины возникновения стрептодермии
Возбудители заболевания – микроорганизмы семейства стрептококков, являются типичными представителями условно-патогенной микробной флоры организма – при достаточно напряженном местном иммунитете, целостности кожных покровов и слизистой, нормальном функционировании иммунной системы организма в целом, активное развитие и распространение этого организма ограничивается, и заболевание не развивается.
Возникновение стрептодермии всегда сопряжено с нарушением целостности кожного покрова (для проникновения инфекции достаточно микротравмы или потертости), изменением местного иммунитета и нарушением активности иммунной системы организма в целом.
Причины и факторы риска развития стрептодермии
При этом заболевании, как и при любой стрептококковой инфекции, существует инкубационный период. При попадании в организм стрептококка типичная клиническая картина стрептодермии развивается только через 7 дней после инфицирования.
После завершения инкубационного периода на коже появляются фликтены. Эти специфические высыпания на коже являются отличительным признаком стрептодермии.
Предраспологающими факторами, наличие которых увеличивает вероятность развития заболевания, становятся:
- пренебрежительное отношение к правилам личной гигиены;
- острое и хроническое переутомление;
- стрессовые ситуации;
- любые состояния, которые могут вызвать снижение иммунитета;
- недостаточное количество витаминов в пище пациента и его организме;
- травмы кожи (даже самые незначительные).

В организм человека микроорганизм может попасть контактно-бытовом путем – инфекция передается через посуду, одежду, при бытовых контактах, через игрушки, а также через пыль, в которой содержатся стрептококки.
В жаркое время года инфекция может передаваться насекомыми, которые на своих лапках переносят возбудители.
В холодное время года очень часто отмечается сезонный рост заболеваемости стрептодермией, совпадающий по времени с ростом заболеваемости скарлатиной и ангинами – такая ситуация объясняется тем, что причиной всех заболеваний становится один и тот же микроорганизм.
Кинические симптомы и локализация стрептодермии
Основными проявлениями заболевания становятся:
- Появление на поверхности кожи небольших пузырьков, наполненных прозрачной, но быстро мутнеющей жидкостью.
- Чаще всего высыпания локализуются на лице, спине, конечностях, нижней части туловища.
- Кожный зуд (часто возникает нестерпимое жжение).

- Пигментация кожи на месте «старых» очагов заболевания.
- Общее недомогание – нарушение самочувствия, вялость, слабость, отсутствие аппетита.
В зависимости от расположения высыпаний, различают несколько клинических форм стрептодермии:
- стрептококковое импетиго – проявляется одиночными разрозненными высыпаниями (фликтенами), которые локализуются на коже лица, туловища, конечностей, имеют тенденцию к слиянию. Поражения не проникают глубже базального слоя кожи, после вскрытия фликтены на поверхности кожи образуются тонкие корки серого цвета, оставляющие после отпадения пятна синевато-розового цвета;
- буллезное импетиго – проявляется фликтенами большого размера, после вскрытия которых на коже открываются поверхностные эрозии, склонные к увеличению поверхности поражения. Такие элементы чаще всего образуются на кистях, стопах и голенях;
- стрептококковая заеда (ангулярный стоматит, щелевидное импетиго) – проявляется фликтенами, расположенными в углах рта.
 Первичный элемент сыпи очень быстро превращается в линейные трещины, покрытые корочками желто-медового цвета, отпадающими без следа, но склонными к повторному появлению. Кроме того, щелевидное импетиго может появиться у крыльев носа или возле наружного края глазной щели. Заболевание может сопровождаться выраженным зудом и слюнотечением, которые провоцируют распространение инфекционного процесса по коже лица, отказом от пищи из-за невозможности открыть рот;
Первичный элемент сыпи очень быстро превращается в линейные трещины, покрытые корочками желто-медового цвета, отпадающими без следа, но склонными к повторному появлению. Кроме того, щелевидное импетиго может появиться у крыльев носа или возле наружного края глазной щели. Заболевание может сопровождаться выраженным зудом и слюнотечением, которые провоцируют распространение инфекционного процесса по коже лица, отказом от пищи из-за невозможности открыть рот; - стрептококковый лишай у детей – возникает чаще всего на коже лица. Появляются шелушащиеся очаги розового или белого цвета, имеющие округлую форму и четко очерченные границы. Элементы сыпи могут уменьшаться под действием солнечных лучей, но ранее пораженные участки кожи не могут нормально загорать;
- турниоль (стрептодермия ногтевых валиков) – часто возникает у детей, которые привыкли грызть ногти. В этом случае вокруг ногтевых пластинок возникают фликтены, которые вскрываются с образованием подковообразной эрозии;
- стрептококковая опрелость – возникает поражение кожных складок, на которых формируются мелкие фликтены, склонные к слиянию.
 После вскрытия на коже образуются мокнущие поверхности ярко-розового цвета.
После вскрытия на коже образуются мокнущие поверхности ярко-розового цвета.
Профилактика стрептодермии
Профилактика стрептодермии заключается:
- в соблюдении личной гигиены,
- ограничении контактов со страдающими любой стрептококковой инфекцией,
- своевременное лечение инфекционных заболеваний.
Очень важно своевременно и правильно обрабатывать любые мелкие травмы и повреждения кожи. При пораженных участках кожи нельзя допускать попадание на них влаги, так как это может способствовать распространению заболевания.
Приглашаем Вас на обследование и консультацию в «КВД № 6».
Наши врачи готовы оказать квалифицированную медицинскую помощь и дать консультацию по всем волнующим Вас вопросам.
Наш адрес: СПб, ул. Летчика Пилютова, д. 41
Режим работы:
• по рабочим дням 9.00–20.00
• суббота (неотложная помощь) 9.00-15.00
Телефон регистратуры: 744-2715 ✆
симптомы, лечение у детей, взрослых, беременных
4 декабря 2020
Фарингит — это воспалительное заболевание слизистой оболочки и лимфоидных элементов глотки.
МКБ — фарингит:
- J02 — острый фарингит
- J02.0 — стрептококковый фарингит
- J02.8 — острый фарингит, вызванный другими уточненными возбудителями
- J02.9 — острый фарингит неуточненный
- J31.2 — хронический фарингит
- J31.1 — хронический назофарингит
Фарингит редко выделяют как отдельное заболевание, обычно ставят диагноз острое респираторное вирусное заболевание (ОРВИ).
ОРВИ — это общее название, врач обычно уточняет, как именно проявляется ОРВИ.
Это может быть ринит (насморк), фарингит (красное горло), ринофарингит (воспаление носа и горла) и др.1,2
Важно не путать фарингит с тонзиллитом.
Для этого давайте разберемся в строении глотки и ротовой полости.
Строение глотки
Глотка делится на 3 отдела:
- верхний (носоглотка)
- средний (ротоглотка)
- нижний (гортаноглотка)
Это разделение является весьма условным, т.к. между отделами нет четких границ. При возникновении воспаления редко бывает так, чтобы воспалительный процесс локализовался в одном отделе, обычно инфекционные процессы распространяются и перемещаются по всем отделам глотки.5,7
При возникновении воспаления редко бывает так, чтобы воспалительный процесс локализовался в одном отделе, обычно инфекционные процессы распространяются и перемещаются по всем отделам глотки.5,7
Как видно на картинке ниже, ротоглотка представлена небно-глоточными дужками, небным язычком и мягким небом.
При фарингите обычно поражаются:
- дужки
- язычок
- мягкое небо
- задняя стенка глотки
Для полного осмотра глотки врач использует шпатель. Он нужен, чтобы улучшить обзор задней стенки глотки.
Небные миндалины при фарингите также воспаляются, т.к. ограничить процесс воспаления невозможно. Такой распространенный характер воспаления при фарингите отличает его от тонзиллита, где происходит поражение преимущественно небных миндалин.
Как часто встречается фарингит
Фарингит, как и обычное ОРВИ (вирусная инфекция), встречается довольно часто. Частота заболеваемости увеличивается в сезон с сентября по май, а пик приходится на февраль-март. Спад заболеваемости фарингитом в 3-5 раз отмечается в летние месяцы.10,11
Спад заболеваемости фарингитом в 3-5 раз отмечается в летние месяцы.10,11
В детском возрасте острый фарингит встречается чаще, чем во взрослом. Дети до 5 лет переносят вирусную инфекцию, в том числе с фарингитом, по 6-8 раз за год.8,9
Дети, которые ходят в детский сад, болеют на 10-15% чаще в течение первого года посещения организации. К сожалению, “домашние” дети впоследствии чаще болеют в школьном возрасте.
Причины возникновения фарингита и тонзиллита
Этиология (происхождение, причина) фарингита. В 70-90% случаев фарингит вызывают вирусы. Также фарингит могут вызывать бактерии, грибки, аллергия, травмы, воздействие раздражающих факторов.
Из вирусов чаще всего встречаются риновирусы, аденовирусы, грипп, парагрипп, энтеровирусы, Коксаки А, коронавирусы, группа герпесвирусов (вирус Эпштейна-Барр, цитомегаловирус, ВПГ).12
Существуют фарингиты, которые выделяют в отдельный диагноз в зависимости от возбудителя, например стрептококковый фарингит МКБ J02. 0
0
Факторы риска развития острого фарингита
- Воздействие химических раздражителей на слизистую глотки
- Воздействие низких температур на слизистую глотки
- Длительное пребывание в закрытых, плохо проветриваемых помещениях
- Сниженный иммунитет
- Детский и пожилой возраст
- Заболевания ЖКТ (гастроэзофагеальная рефлюксная болезнь — ГЭРБ)
- Инфекция в ротовой полости (кариозные зубы, гингивиты)
- Частый и длительный контакт с табачным дымом
Классификация фарингитов
Фарингит бывает острым и хроническим. Острым называется воспаление, которое возникло внезапно. Хроническим называют заболевание, которое сохраняется длительное время, при этом оно может не беспокоить человека, но при определенных обстоятельствах вызывать жалобы и беспокойство.3
КЛАССИФИКАЦИЯ | КОММЕНТАРИЙ | ||
| классификация: | Классификация фарингитов по причине возникновения: | комментарий: | вирусный |
| классификация: | Фарингиты, связанные со специфическими возбудителями: | комментарий: | вирус Эпштейна-Барр при инфекционном мононуклеозе |
| классификация: | Виды хронического фарингита: | комментарий: | гипертрофический (увеличение слизистой) |
Симптомы острого фарингита (тонзиллофарингита)
Самые частые жалобы при фарингите:
- боль в горле
- першение
- сухость
- боль при глотании
- отказ от еды
- заложенность в ушах
- ощущение недомогания
- подъем температуры
Как было сказано ранее, фарингит редко бывает самостоятельным заболеванием, поэтому и проявления могут быть связаны не только с горлом. Может появиться заложенность носа, насморк, покраснение глаз, сухой кашель.
Может появиться заложенность носа, насморк, покраснение глаз, сухой кашель.
Симптомы хронического фарингита
В период ремиссии (когда вы вылечили острый фарингит или вылечили обострение хронического фарингита) может беспокоить ощущение сухости в горле, легкое першение. В период обострения появляются жалобы, как при остром фарингите.3
Диагностика фарингита
Определить острый фарингит можно по жалобам пациента и при осмотре ротоглотки (фарингоскопии).
Объективные симптомы фарингита, которые оценивает врач при осмотре горла:
- отек и гиперемия (покраснение) слизистой глотки
- гнойный или слизисто-гнойный налет на стенках слизистой глотки
- наличие воспаления в дужках, миндалинах, устьях слуховых труб
- наличие ярко-красных бугорков на задней поверхности глотки и на боковой — гипертрофированные (увеличенные) лимфоидные фолликулы
- истончение слизистой с участками отслаивающегося эпителия, корок и вязкой слизи (атрофический фарингит)
На основании этих симптомов врач может поставить не только диагноз фарингит, но и предположить его причину (вирусное воспаление, грибковая инфекция и т. д.).
д.).
Несмотря на то, что острый фарингит в 70% является вирусным заболеванием, иногда требуется исключить бактериальную причину. Это очень важно для определения дальнейшей тактики лечения и профилактики осложнений. Для этого следует провести экспресс-тест для исключения стрептококковой природы фарингита.
В некоторых случаях при длительно сохраняющихся жалобах, повышенной температуре, сохраняющейся более 3-х дней, также необходимо сдать общий анализ крови для понимания причины острого фарингита.
Лечение фарингита
Фарингит обычно протекает не тяжело, хотя некоторым пациентам боль может доставлять очень много дискомфорта.
Наиболее распространен вирусный фарингит, для терапии которого обычно достаточно местного лечения. Рекомендуется применять комбинированные препараты, которые способны не только уменьшить боль, но и воздействовать на ее причину.
Тантум
® Верде для лечения фарингитаПрепаратом, способным воздействовать на причину воспаления и боли при фарингите, является Тантум® Верде. В его состав входит бензидамин — это нестероидный противовоспалительный препарат, который обладает обезболивающим и противовоспалительным действием.13 Также бензидамин оказывает антисептическое действие на бактерии и грибы.14,15 Он работает на местном уровне, снимая воспаление и ускоряя процессы регенерации (восстановления) и не оказывает системного действия на весь организм, что немаловажно при лечении фарингита.16
В его состав входит бензидамин — это нестероидный противовоспалительный препарат, который обладает обезболивающим и противовоспалительным действием.13 Также бензидамин оказывает антисептическое действие на бактерии и грибы.14,15 Он работает на местном уровне, снимая воспаление и ускоряя процессы регенерации (восстановления) и не оказывает системного действия на весь организм, что немаловажно при лечении фарингита.16
Для лечения бактериального фарингита (если стрептатест положительный) помимо симптоматической терапии (обезболивание и снятие воспаления в глотке), врач может назначить антибактериальные препараты.1,6,12
Спрей Тантум® Верде
подробнее
Раствор Тантум® Верде
подробнее
Таблетки Тантум® Верде
подробнее
Для лечения фарингита можно использовать спрей, таблетки для рассасывания, раствор для полоскания Тантум® Верде.
В детском возрасте разрешено применение спрея (формы подачи лекарства) с 3 лет, а пастилки для рассасывания с 6 лет.17
Правильное лечение заболеваний горла
Хронический фарингит в стадии ремиссии не требует лечения. При обострении хронического фарингита также целесообразно использовать местную терапию для снятия воспаления и улучшения регенерации тканей глотки. Тантум® Верде обладает этими свойствами и оказывает обезболивающее действие.
Диета при остром фарингите
Важным аспектом в лечении фарингита является обильное питье – жидкость необходима, чтобы снять интоксикацию и улучшить самочувствие.
Не рекомендуется употреблять кислые морсы и компоты, а также горячие напитки. Кислота может дополнительно травмировать стенки горла, а горячее может нанести ожог.
Из рациона следует исключить острые, копченые, консервированные продукты, чтобы дополнительно не травмировать слизистую глотки.
Осложнения фарингита
Обычно острый фарингит хорошо поддается лечению. Прогноз вирусного фарингита — выздоровление.
Прогноз вирусного фарингита — выздоровление.
Бактериальный (стрептококковый фарингит) может осложниться образованием заглоточного абсцесса, а в последующем оказать негативное влияние на сердце и почки, вызывая эндокардит и гломерулонефрит.
Симптомы фарингита могут сохраняться и при правильном лечении, если не устранена истинная причина заболевания. Например, если не лечить гастроэзофагеальную рефлюксную болезнь (поражение ЖКТ), то фарингит будет постоянно о себе напоминать.
Острый фарингит может перейти в хроническую форму.
Профилактика фарингита
Для профилактики фарингита рекомендуется:
- избегать переохлаждений и одеваться по погоде
- избегать контакта с табаком и химическими раздражителями
- проводить частые проветривания рабочих и жилых помещений
- чаще гулять на свежем воздухе. Прогулки помогут укрепить защитные свойства организма в борьбе с фарингитом
- не пить ледяную воду
- не делиться едой и столовыми приборами, чашками
- избегать мест массового скопления людей, при возможности находиться в них как можно меньше времени
- использовать дезинфицирующие средства, в том числе в местах общественного пользования, транспорте и т.
 д.
д. - часто мыть руки
Фарингит у беременных
В период беременности у женщины снижаются защитные свойства организма. В связи с этим сильно увеличивается риск заражения инфекционными заболеваниями, а также обострения хронических заболеваний.
Беременным женщинам необходимо тщательно следить за своим здоровьем и проводить профилактику заболеваний: избегать контакта с людьми, болеющими респираторными заболеваниями, избегать мест массового скопления людей, мыть руки, регулярно и правильно питаться. При заболевании острым фарингитом или обострении хронического требуется лечение. Не рекомендуется применять препараты, способные оказывать действие на весь организм. Они могут пройти через плаценту к ребенку и причинить ему вред. Для лечения фарингита беременным женщинам рекомендуется обратиться к врачу и использовать полоскание полости рта солевыми растворами.
Часто задаваемые вопросы
1. Можно ли фарингит лечить дома?
Обычно фарингит не требует госпитализации (лечения в больнице). Вы можете лечить фарингит в домашних условиях самостоятельно, используя местные средства для снятия боли и воспаления в горле. Если при самостоятельном лечении в течение 3-х дней боль в горле не проходит или если помимо боли в горле появилась высокая температура, необходимо обратиться к врачу.
Вы можете лечить фарингит в домашних условиях самостоятельно, используя местные средства для снятия боли и воспаления в горле. Если при самостоятельном лечении в течение 3-х дней боль в горле не проходит или если помимо боли в горле появилась высокая температура, необходимо обратиться к врачу.
2. К какому врачу обратиться при боли в горле?
С болью в горле, першением, трудностями при глотании сначала надо обратиться к терапевту или педиатру, если это ребенок. Если будут показания, то врач назначит консультацию ЛОР врача.
3. Очень сильная боль в горле. У меня точно не ангина?
При фарингите болевой синдром может быть более выраженным, чем при тонзиллите (ангине). Для лечения фарингита рекомендуется использовать спреи с обезболивающим эффектом, например Тантум® Верде Форте. Для исключения ангины (стрептококкового тонзиллита) или стрептококкового фарингита рекомендуется провести экспресс-тест (стрептатест).
4. Нужен ли антибиотик при фарингите?
Антибиотик показан ТОЛЬКО при бактериальном фарингите.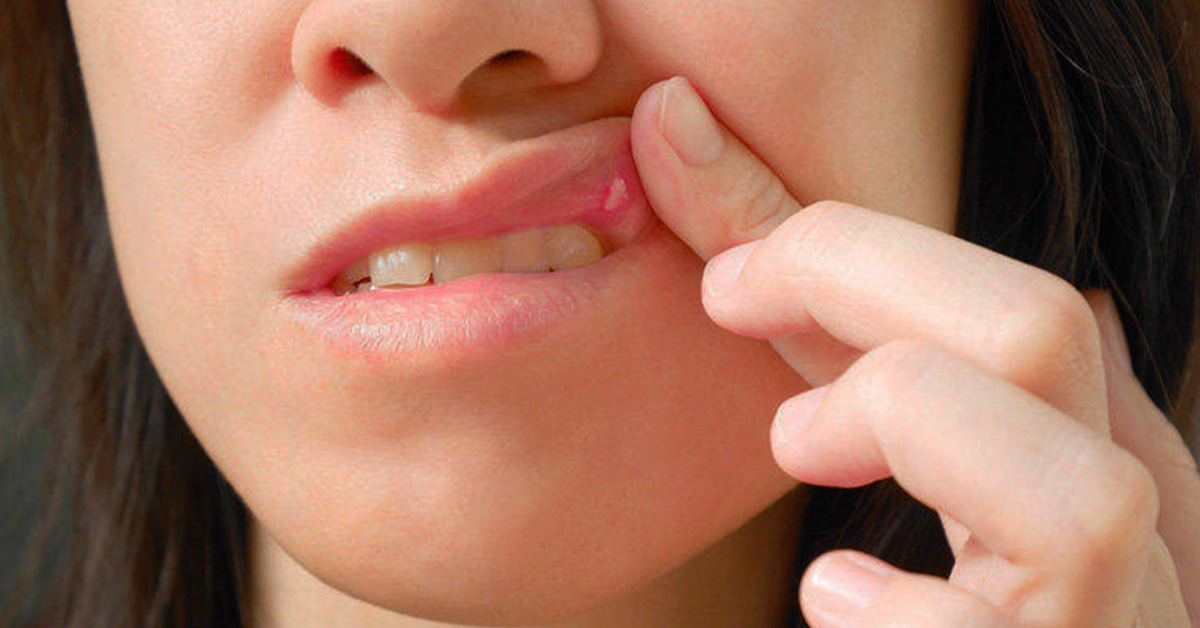 Для быстрой диагностики проведите экспресс-тест на стрептококк. Он позволит исключить или подтвердить бактериальную природу фарингита. При выявлении стрептококка врач назначит антибиотики.
Для быстрой диагностики проведите экспресс-тест на стрептококк. Он позволит исключить или подтвердить бактериальную природу фарингита. При выявлении стрептококка врач назначит антибиотики.
5. Заразен ли острый фарингит?
Чаще всего причиной возникновения острого фарингита является вирус. Больной может быть заразен. При появлении симптомов фарингита следует соблюдать домашний режим до полного выздоровления.
6. Что будет, если не лечить фарингит?
Могут возникнуть осложнения. При отсутствии лечения фарингита жалобы сохраняются значительно дольше, воспаление не проходит и начинает приобретать хронический характер.
7. Можно ли вакцинироваться при фарингите и когда?
На фоне острого заболевания или обострения хронического фарингита вакцинация противопоказана. Дождитесь полного выздоровления, после этого можете делать вакцинацию. Исключение составляет вакцинация против гриппа. Ее можно делать при нормализации температуры, т.е. не нужно дожидаться исчезновения всех симптомов.
8. Можно ли есть холодное при боли в горле?
При фарингите не рекомендуется есть очень холодную пищу, в том числе мороженое. Это может усилить воспалительный процесс и замедлить восстановление.
9. Можно ли делать ингаляции при фарингите?
Ингаляции не эффективны для лечения фарингита, но фарингит редко бывает изолированным заболеванием. Он может сочетаться с бронхитом, ларингитом и стенозом (у детей). Для их лечения врач назначает ингаляции, в том числе с лекарственными средствами.
Тайная социальная жизнь вирусов
Генетик Ротем Сорек увидел, что его бактерии больны — пока все хорошо. Он намеренно заразил их вирусом, чтобы проверить, будет ли каждый больной микроб сражаться в одиночку или общаться со своими союзниками для отражения атаки.
Но когда он и его команда из Научного института Вейцмана в Реховоте, Израиль, заглянули в содержимое своих колб, они увидели нечто совершенно неожиданное: бактерии молчали, а вирусы болтали, передавая записки. друг другу на молекулярном языке, понятном только им. Они вместе решали, когда затаиться в клетке-хозяине, а когда размножиться и вырваться наружу в поисках новых жертв.
друг другу на молекулярном языке, понятном только им. Они вместе решали, когда затаиться в клетке-хозяине, а когда размножиться и вырваться наружу в поисках новых жертв.
Это было случайное открытие, которое коренным образом изменило представление ученых о том, как ведут себя вирусы.
Вирусы, заражающие бактерии — шипастые существа, похожие на леденцы, известные как бактериофаги (или фаги), — имеют механизмы наблюдения, которые дают им информацию о том, оставаться ли в спящем состоянии или атаковать, в зависимости от наличия новых жертв. Но исследователи долгое время считали эти процессы пассивными; фаги, казалось, просто сидели и слушали, ожидая, когда бактериальные сигналы бедствия достигнут апогея, прежде чем действовать.
Сорек и его коллеги обнаружили, что фаги активно обсуждают свой выбор. Они поняли, что когда фаг заражает клетку, он высвобождает крошечный белок — пептид длиной всего шесть аминокислот, — который служит сообщением своим собратьям: «Я взял жертву». По мере того как фаги заражают все больше клеток, сигнал становится все громче, сигнализируя о том, что неинфицированных хозяев становится все меньше. Затем фаги останавливают лизис — процесс репликации и выхода из своих хозяев — вместо этого остаются скрытыми в вялотекущем состоянии, называемом лизогенией 9.0011 1 .
По мере того как фаги заражают все больше клеток, сигнал становится все громче, сигнализируя о том, что неинфицированных хозяев становится все меньше. Затем фаги останавливают лизис — процесс репликации и выхода из своих хозяев — вместо этого остаются скрытыми в вялотекущем состоянии, называемом лизогенией 9.0011 1 .
Вирусы, как оказалось, не зависели от бактериальных сигналов при принятии решений. Они управляли своей судьбой. «Это открытие стало большой, важной, революционной концепцией в вирусологии», — говорит Вэй Ченг, структурный микробиолог из Сычуаньского университета в Чэнду, Китай.
Сорек назвал этот вирусный пептид «арбитриумом» в честь латинского слова «решение». Похоже, это работало так же, как коммуникационная система, используемая бактериями — определение кворума — для обмена информацией о плотности клеток и соответствующей корректировки популяции. Тем не менее, это был первый случай, когда кто-либо продемонстрировал молекулярную передачу сообщений такого рода у вирусов. И это соответствовало формирующейся картине вирусов как гораздо более сложных социальных агентов, чем считали ученые.
И это соответствовало формирующейся картине вирусов как гораздо более сложных социальных агентов, чем считали ученые.
Вирусологи долгое время изучали своих субъектов изолированно, нацеливаясь на клетки всего с одной вирусной частицей. Но становится все более очевидным, что многие вирусы кооперируются, объединяясь, чтобы совместно заражать хозяев и разрушать противовирусную иммунную защиту.
Подразумевается, что исследователи, возможно, неправильно проводили свои эксперименты. «Это потрясло один из столпов вирусологии», — говорит Сэм Диас-Муньос, биолог-эволюционист из Калифорнийского университета в Дэвисе.
Изучение языка, лежащего в основе этих вирусных взаимодействий, может помочь в разработке новых методов лечения рака и неприятных суперинфекций. Социальные пристрастия вирусов даже помогают объяснить, как они уклоняются от бактериальной иммунной системы, известной как CRISPR. «Концептуально это действительно мощно», — говорит Диас-Муньос.
Социальные исследования
Ученые впервые обнаружили смешение вирусов в 1940-х годах, когда отдельные эксперименты биофизика Макса Дельбрюка и бактериолога Альфреда Херши показали, что две вирусные частицы могут одновременно проникать в одну и ту же клетку и обмениваться генами. Но, по словам Дейла Кайзера, молекулярного генетика из Стэнфордского университета в Калифорнии и протеже Дельбрюка, эти ранние наблюдения были действительно интересны ученым только как экспериментальный метод — они позволили исследователям создать помесь двух вирусных штаммов. Актуальность для фундаментальной биологии была упущена.
Но, по словам Дейла Кайзера, молекулярного генетика из Стэнфордского университета в Калифорнии и протеже Дельбрюка, эти ранние наблюдения были действительно интересны ученым только как экспериментальный метод — они позволили исследователям создать помесь двух вирусных штаммов. Актуальность для фундаментальной биологии была упущена.
Только в 1999 году кто-либо обратил внимание на то, чего удалось добиться благодаря сотрудничеству с самими вирусами. В том же году биологи-эволюционисты Пол Тернер, ныне работающий в Йельском университете в Нью-Хейвене, штат Коннектикут, и Лин Чао, ныне работающий в Калифорнийском университете в Сан-Диего, показали, что фаги играют в свою собственную версию стратегической игры «дилемма заключенного», работая в партнерстве под руководством определенных обстоятельствах и действовать в собственных интересах в отношении других 2 .
Вирусы, известные как фаги (зеленые), могут лучше заражать клетки, такие как эта бактерия (оранжевые), когда они взаимодействуют и взаимодействуют друг с другом. Фото: AMI Images/Science Photo Library
Фото: AMI Images/Science Photo Library
Далее последовали другие примеры полезных вирусных взаимодействий, в том числе те, в которых участвовали патогены, ответственные за такие заболевания, как гепатит, полиомиелит, корь и грипп. Они часто происходили между различными вирусными штаммами, которые были заинтересованы в повышении своих репродуктивных шансов. Но молекулярная основа этих кооперативных черт — метод общения — в значительной степени оставалась неуловимой. И как отмечает Рафаэль Санхуан, генетик-эволюционист из Университета Валенсии в Испании: «Здесь действительно важно то, как».
Вот почему открытие арбитража стало таким большим шагом вперед в этой области.
Почти сразу после того, как Сорек впервые описал это явление, в 2017 году, четыре независимые группы, в том числе группа Ченга и одна под руководством структурного биолога Альберто Марины из Биомедицинского института Валенсии в Испании, приступили к работе, пытаясь выявить молекулярную основу, с помощью которой пептиды арбитрия производятся, ощущаются и действуют фагами.
Технические подробности, изложенные в пяти статьях 3 – 7 за последние девять месяцев помогли точно объяснить, как открытые Сореком короткие пептиды влияют на принятие вирусных решений. Однако для Марины это только начало истории: он подозревает, что система связи, вероятно, выполняет гораздо больше функций.
Подозрение Марины основано на находке в одной из этих бумаг 6 . Работая с Хосе Пенадесом, микробиологом из Университета Глазго, Великобритания, Марина показала, что рецептор арбитрия в фаге может взаимодействовать не только с генами бактерии, которые помогают вирусу размножаться, но и с другими, неродственными участками ДНК. . Это означает, что его активность может не ограничиваться решением вируса остаться или уйти. В настоящее время исследователи изучают, влияет ли пептидный язык фага на активность ключевых генов его жертвы. «Если это правда, — говорит Марина, — это сделало бы картину намного больше и интереснее».
Развивая свое первоначальное открытие, Сорек обнаружил, что повсюду появляются пептиды арбитрия. Его команда обнаружила как минимум 15 различных типов фагов, каждый из которых может инфицировать почвенные микробы и использовать какой-то короткий пептид для передачи 8 . Примечательно, что, по словам Сорека, «каждый фаг говорит на своем языке и понимает только свой». Таким образом, вирусная болтовня, по-видимому, эволюционировала, чтобы позволить общение только между близкими родственниками.
Фаги могут говорить только с представителями своего вида, но они также могут слушать и на других языках. Молекулярный биолог Бонни Басслер и ее аспирант Джастин Сильпе обнаружили, что вирусы могут использовать химические вещества, определяющие кворум, выделяемые бактериями, чтобы определить, когда лучше начать размножаться — и убивать 9 . «Фаги подслушивают и захватывают информацию о хосте в своих целях — в данном случае, чтобы убить хоста», — объясняет Басслер.
Это молекулярное отслеживание происходит естественным образом в фагах, инфицирующих бактерию, вызывающую холеру, Vibrio cholerae . Но в своей лаборатории в Принстонском университете в Нью-Джерси Басслер и Сильпе разработали «шпионские» фаги, которые могут воспринимать сигналы, уникальные для других микробов, включая Escherichia coli и 9.0061 Salmonella typhimurium и уничтожить их. По сути, вирусы стали программируемыми убийцами, которых можно было заставить убивать любую бактерию — по желанию и по требованию.
Ради общего блага
Некоторое вирусное сотрудничество, кажется, граничит с альтруизмом. Две независимые группы сообщили в прошлом году, что некоторые фаги действуют самоотверженно, преодолевая вирусные контрмеры бактерий Pseudomonas 10 , 11 .
Команды — одну возглавлял фаговый биолог Джо Бонди-Деноми из Калифорнийского университета в Сан-Франциско, другую — эксперт CRISPR Эдзе Вестра и вирусолог Стинеке ван Хаут из Эксетерского университета, Великобритания, — наблюдали, как вирусы бомбардируют бактерии специализированными белки, предназначенные для разрушения иммунной защиты клеток на основе CRISPR.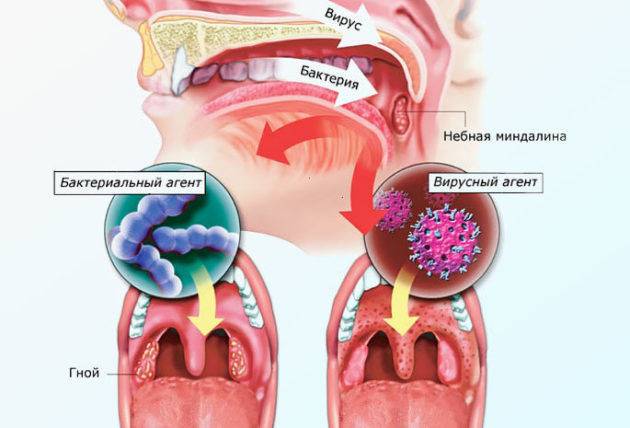 Первая волна вирусов атаковала клетки, убивая себя, но также ослабляя бактерии. Первоначальная бомбардировка проложила путь другим, чтобы победить микробного врага. «Эти фаги должны были быть там, и умереть, и произвести анти-CRISPR, прежде чем другой фаг мог прийти и добиться успеха», — говорит Бонди-Деноми.
Первая волна вирусов атаковала клетки, убивая себя, но также ослабляя бактерии. Первоначальная бомбардировка проложила путь другим, чтобы победить микробного врага. «Эти фаги должны были быть там, и умереть, и произвести анти-CRISPR, прежде чем другой фаг мог прийти и добиться успеха», — говорит Бонди-Деноми.
В последующей работе Вестра и его постдоктор Энн Шеваллеро продемонстрировали, как фаги, лишенные этих анти-CRISPR-белков, могут использовать совместные предложения других фагов, которые делают 12 . Для Вестры это показывает потенциально далеко идущие последствия альтруистического поведения среди вирусов. «На популяционном уровне существует множество возникающих свойств, — говорит он. «Очень важно помнить об экологии этих фагов».
Эти примеры общения и сотрудничества в фагах, вероятно, являются лишь верхушкой социального копья, говорит Ланьинг Цзэн, биофизик из Центра фаговых технологий Техасского университета A&M в Колледж-Стейшн. «Это целая неизведанная область». То же самое касается вирусов, поражающих другие типы клеток, включая клетки животных и человека, которые используют свои собственные социальные трюки.
То же самое касается вирусов, поражающих другие типы клеток, включая клетки животных и человека, которые используют свои собственные социальные трюки.
Возьмем вирус везикулярного стоматита (VSV), который в основном поражает сельскохозяйственных животных, но может вызывать гриппоподобное заболевание и у людей. Частицы этого вирусного патогена подавляют иммунитет хозяина за личный ущерб, но приносят пользу группе, как показали Санхуан и его коллеги 13 . Пока никто не уверен, как происходит это совместное уклонение, но работа подчеркивает, насколько решающим может быть альтруизм для успеха VSV. Это могло бы помочь ученым победить вирус у сельскохозяйственных животных и оптимизировать его для использования в вакцинах и терапевтических средствах.
Другие случаи коллективного действия широко распространены среди болезнетворных вирусов. В полиовирусе, например, несколько генетически различных вирусных штаммов могут слипаться вместе, чтобы обмениваться генными продуктами и усиливать свой потенциал уничтожения человеческих клеток 14 . А два штамма вируса гриппа — один превосходит другие при проникновении в клетку, а другой — при выходе из нее, — растут лучше, когда их содержат в клеточной культуре вместе, чем при раздельном содержании 15 .
А два штамма вируса гриппа — один превосходит другие при проникновении в клетку, а другой — при выходе из нее, — растут лучше, когда их содержат в клеточной культуре вместе, чем при раздельном содержании 15 .
Но в реальных условиях, в мазках из носа людей, больных гриппом, два вирусных штамма, похоже, не сосуществовали 16 . Джесси Блум из Онкологического исследовательского центра Фреда Хатчинсона в Сиэтле, штат Вашингтон, который руководил исследованием, считает, что это связано с некоторыми особенностями жизни вируса гриппа — размер его популяции колеблется настолько сильно, что кооперативные частицы имеют небольшой шанс слипнуться. . По его словам, для вирусов, которые не сталкиваются с такими узкими местами при передаче, «в реальных условиях сотрудничество может с большей вероятностью поддерживаться».
Именно это обнаружила микроскопист Нихал Алтан-Боннет, изучая передачу ротавируса между детёнышами мышей. Частицы ротавируса могут вместе перемещаться между клетками в пузыревидных везикулах, разделяя ресурсы и скрываясь от иммунной системы хозяина. И, как показали Алтан-Боннет и ее коллеги, частицы становятся более заразными для мышей, когда они находятся внутри этих кооперативных кластеров, чем когда они действуют поодиночке 9.0011 17 .
И, как показали Алтан-Боннет и ее коллеги, частицы становятся более заразными для мышей, когда они находятся внутри этих кооперативных кластеров, чем когда они действуют поодиночке 9.0011 17 .
В настоящее время известно, что многие другие патогенные вирусы, в том числе ответственные за вирус Зика, гепатит, ветряную оспу, норовирус и простуду, также передаются через эти везикулы.
«Эти вирусы очень коварны, — говорит Алтан-Бонне, руководитель Лаборатории динамики хозяин-патоген в Национальном институте сердца, легких и крови США в Бетесде, штат Мэриленд. «И мы должны думать о стратегиях, которые разрушают эту кооперативность и кластеризацию вирусов».
То есть, если разрушительная сила вирусов не может быть использована во благо. Несколько групп тестируют фаги в качестве средства для лечения бактериальных инфекций, и знание того, как они взаимодействуют друг с другом, может помочь усовершенствовать такие методы лечения, которые имеют долгую историю в медицине, но только начинают использоваться для терапевтического эффекта.
Задействовать фаг
Например, в прошлом месяце исследователи описали первое успешное клиническое применение генетически модифицированных фагов для борьбы с лекарственно-устойчивой бактериальной инфекцией 18 . Конечно, для таких инфекций идеальным решением является использование вируса для полного уничтожения бактерий. Но для состояний, которые отмечены микробным дисбалансом, таких как акне, некоторые виды рака и воспалительные заболевания кишечника, может быть лучше использовать фаг, который может помочь восстановить баланс без тотальной атаки.
А для более тонких приложений точное знание того, как взаимодействуют вирусы, «может быть очень полезным для помощи нам в разработке фагов, которые можно использовать для лечения болезней», — говорит Карен Максвелл, фаговый биолог из Университета Торонто в Канаде. Таким образом, подключение к системе арбитража может привести к более податливым или даже обратимым методам лечения.
Научиться говорить с вирусом может принести и другую терапевтическую пользу. «Это может быть дополнением к набору инструментов синтетической биологии, чтобы помочь точно настроить экспрессию генов бактерий», — говорит Кристофер Альтери, микробиолог из Мичиганского университета в Дирборне.
«Это может быть дополнением к набору инструментов синтетической биологии, чтобы помочь точно настроить экспрессию генов бактерий», — говорит Кристофер Альтери, микробиолог из Мичиганского университета в Дирборне.
Сорек, например, взял пептиды arbitrium из их естественной среды обитания в фаге и вставил их в другие организмы, где они действуют как диммеры, которые включают или ослабляют активность генов. В неопубликованной работе он и его аспирант Зоар Эрез вставили механизм арбитража в бактерию 9.0061 Bacillus subtilis , что позволяет им по желанию манипулировать несколькими его генами. Сконструированные микробы однажды можно будет использовать, например, для доставки лекарств в точных дозах или в определенные места.
Более того, отмечает Сорек, если арбитриум-подобные системы окажутся консервативными в человеческих вирусах — таких патогенах, как ВИЧ и вирус простого герпеса, которые, подобно фагам, проводят часть своей жизни, прячась в клетках, — то любая коммуникационная молекула, которая вызывает спячку вируса, которая «немедленно становится лекарством».
Каждый продолжающийся научный проект получает «-ологию», и изучение общительных вирусов не исключение. Два года назад Диас-Муньос, Санхуан и биолог-эволюционист Стю Уэст из Оксфордского университета, Великобритания, придумали 19 новый термин — социовирусология — чтобы обеспечить основу для своего направления исследований. Американское общество микробиологии проведет первый в истории семинар, посвященный этой теме, на своем ежегодном собрании в этом месяце в Сан-Франциско. «Это идея, время которой пришло, — говорит Диас-Муньос.
В социовирусологии он видит много параллелей с постепенным принятием сходного группового поведения среди бактерий в прошлые годы: только когда исследователи определили химические вещества, участвующие в ощущении кворума, и дали название этому процессу, большинство микробиологов не обращали на это явление никакого внимания. внимание.
«Это не в сознании», — говорит Диас-Муньос. Но, как и во всех социальных и вирусных вещах, сообщение распространяется.
Ссылки
-
Эрез, З. и др. Природа 541 , 488–493 (2017).
ПабМед Статья Google ученый
-
Тернер, П. Е. и Чао, Л. Природа 398 , 441–443 (1999).
ПабМед Статья Google ученый
-
Ван, К. и др. Природа Микробиолог. 3 , 1266–1273 (2018).
ПабМед Статья Google ученый
-
Доу, К. и др. Природа Микробиолог. 3 , 1285–1294 (2018).
ПабМед Статья Google ученый
-
Чжэнь, X. и др. Protein Cell 10 , 131–136 (2019).
ПабМед Статья Google ученый
- «>
Гальего Дель Соль, Ф., Пенадес, Дж. Р. и Марина, А. Мол. Cell 74 , 59–72.e3 (2019).
ПабМед Статья Google ученый
-
Гуан З. и др. Сотовый Дисков. 5 , 29 (2019).
ПабМед Статья Google ученый
-
Стокар-Авихаил А., Таль Н., Эрез З., Лопатина А. и Сорек Р. Микроб-хозяин клетки 25 , 746–755.e5 (2019).
ПабМед Статья Google ученый
-
Силпе, Дж. Э. и Басслер, Б. Л. Cell 176 , 268–280.e13 (2019).
ПабМед Статья Google ученый
-
Ландсбергер, М. и др. Ячейка 174 , 908–916.e12 (2018).
ПабМед Статья Google ученый
- «>
Borges, A. L. et al. Ячейка 174 , 917–925.e10 (2018).
ПабМед Статья Google ученый
-
Шевальеро, А. и др. . препринт на сайте bioRxiv https://doi.org/10.1101/574418 (2019 г.).
-
Доминго-Калап П., Сегредо-Отеро Э., Дуран-Морено М. и Санхуан Р. Nature Microbiol . 4 , 1006–1013 (2019).
ПабМед Статья Google ученый
-
Агилера, Э. Р., Эриксон, А. К., Джесудхасан, П. Р., Робинсон, К. М. и Пфайффер, Дж. К. mBio 8 , e02020-16 (2017).
ПабМед Статья Google ученый
-
Сюэ, К. С., Хупер, К. А., Оллодарт, А. Р., Дингенс, А. С. и Блум, Д. Д. eLife 5 , e13974 (2016).
ПабМед Статья Google ученый
- «>
Сюэ, К. С., Гренингер, А. Л., Перес-Осорио, А. и Блум, Дж. Д. mSphere 3 , e00552-17 (2018).
ПабМед Google ученый
-
Сантиана, М. и др. Микроб-хозяин клетки 24 , 208–220.e8 (2018).
ПабМед Статья Google ученый
-
Дедрик, Р. М. и др. Природа Мед. 25 , 730–733 (2019).
ПабМед Статья Google ученый
-
Диас-Муньос, С. Л., Санхуан, Р. и Уэст, С. Клеточный микроб-хозяин 22 , 437–441 (2017).
ПабМед Статья Google ученый
Загрузить ссылки
Мультиантигенная противотуберкулезная вакцина с вектором вируса везикулярного стоматита ограничивает бактериальную пролиферацию у мышей после однократного интраназального введения
Введение
Туберкулез (ТБ) остается серьезной проблемой здравоохранения во всем мире. Одна треть населения была инфицирована Mycobacterium tuberculosis (M.tb), и у людей, инфицированных латентной формой M.tb, диагностируется неклинический ТБ или латентная инфекция ТБ, причем примерно 5–10% этих людей случаев заболевания ТБ в их жизни (ВОЗ, 2004 г.). Кроме того, у латентно инфицированных лиц риск развития активной формы туберкулеза у ВИЧ-инфицированных составляет примерно 10% в год, если они не получают антиретровирусную терапию (Cohn, 2000). Следовательно, необходимы успешные вакцины против инфекции M.tb.
Одна треть населения была инфицирована Mycobacterium tuberculosis (M.tb), и у людей, инфицированных латентной формой M.tb, диагностируется неклинический ТБ или латентная инфекция ТБ, причем примерно 5–10% этих людей случаев заболевания ТБ в их жизни (ВОЗ, 2004 г.). Кроме того, у латентно инфицированных лиц риск развития активной формы туберкулеза у ВИЧ-инфицированных составляет примерно 10% в год, если они не получают антиретровирусную терапию (Cohn, 2000). Следовательно, необходимы успешные вакцины против инфекции M.tb.
Mycobacterium bovis бацилла Кальметта-Герена (БЦЖ), единственная доступная вакцина против ТБ, не смогла контролировать ТБ взрослых и установление латентной персистирующей (ТБ) инфекции (Brewer, 2000; Glyn Hewinson, 2005). Согласно предыдущим исследованиям, Т-клеточный иммунитет, характеризующийся секрецией IFN-γ и других цитокинов, играет важную роль в защите от инфекции M.tb (Cooper, 2009). Память Т-клеток, специфичная для вакцины, также может обеспечивать защиту при вторичном заражении за счет качественно иного и количественно усиленного ответа (Henao-Tamayo et al.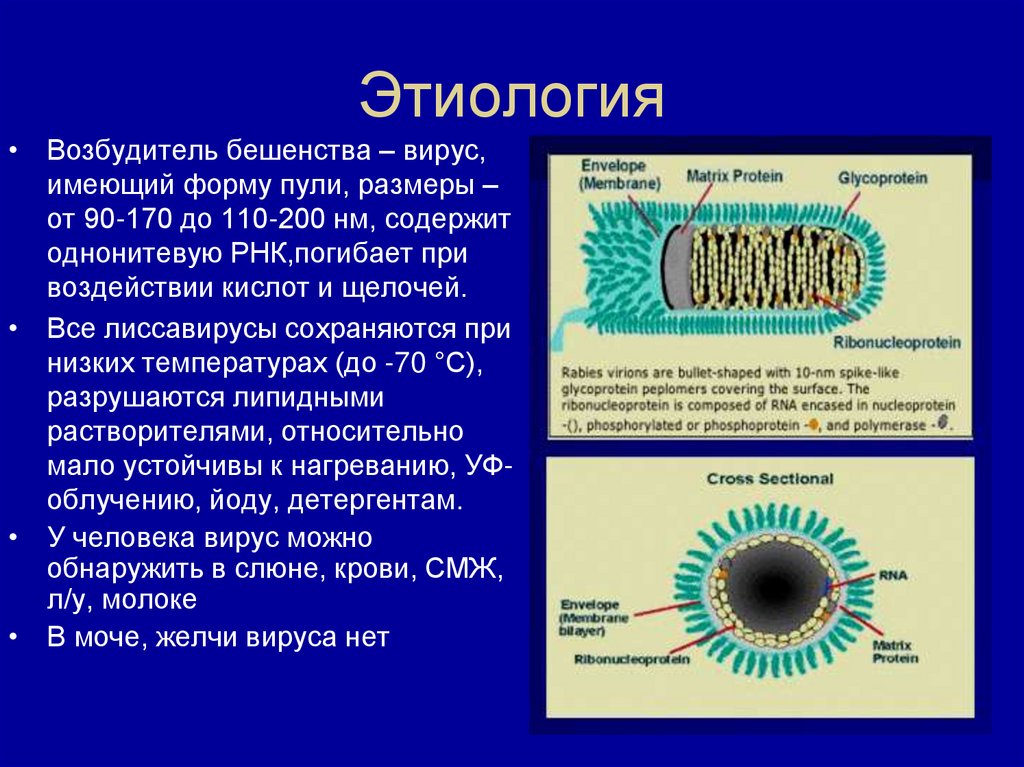 , 2014).
, 2014).
Ранее мы показали, что новая ДНК-вакцина p846 с тройным антигеном слита с тремя четко определенными микобактериальными антигенами [Rv3615c (Millington et al., 2011), Mtb10.4 (Hogarth et al., 2006) и Rv2660c ( Betts et al., 2002)], индуцировал устойчивые Т-клеточно-опосредованные иммунные ответы после четырех иммунизаций (Kong et al., 2014). Учитывая, что в некоторых районах существует множество проблем, в которых отсутствует медицинская инфраструктура для проведения многократных инъекций (Fachado et al., 2003), вакцинацию однократной безыгольной дозой следует рассматривать как важную цель разработки вакцины. Было доказано, что вирус везикулярного стоматита (VSV), РНК-вирус с отрицательной цепью, является предпочтительным вирусным вектором для доставки чужеродных вакцинных антигенов (Rose et al., 2001; Haglund et al., 2002; Clarke et al., 2007). ; Бракстон и др., 2010). VSV имеет три основных преимущества как потенциальная платформа доставки против туберкулеза. Во-первых, мы и другие группы продемонстрировали, что ВВС можно вакцинировать через слизистую оболочку (Tan et al. , 2005; Wu et al., 2014). Считается, что он лучше вызывает защитные иммунные реакции против инфекционных заболеваний в месте заражения (Davis, 2001). Во-вторых, с помощью обратной генетической системы VSV дополнительные гены могут быть легко вставлены в вирусный геном, а рекомбинантный VSV (rVSV), экспрессирующий чужеродные антигены, может быть выращен до высоких титров в клеточных линиях млекопитающих (Goonetilleke et al., 2003). ). В-третьих, rVSV может стимулировать мощный гуморальный и клеточно-опосредованный иммунный ответ при безыгольном однократном введении в моделях на животных (Johnson et al., 19).97; Фабер и др., 2005; Кобли и др., 2010). Кроме того, распространенность антител к VSV в общей популяции чрезвычайно низка. Поэтому лишь немногие люди являются носителями ранее существовавших антител для противодействия вакцинам на основе VSV (Lichty et al., 2004). Ранее было показано, что противотуберкулезная вакцина на основе VSV VSVAg85A, экспрессирующая высокоиммуногенный антиген Ag85A, обладает защитным действием при заражении легких M.
, 2005; Wu et al., 2014). Считается, что он лучше вызывает защитные иммунные реакции против инфекционных заболеваний в месте заражения (Davis, 2001). Во-вторых, с помощью обратной генетической системы VSV дополнительные гены могут быть легко вставлены в вирусный геном, а рекомбинантный VSV (rVSV), экспрессирующий чужеродные антигены, может быть выращен до высоких титров в клеточных линиях млекопитающих (Goonetilleke et al., 2003). ). В-третьих, rVSV может стимулировать мощный гуморальный и клеточно-опосредованный иммунный ответ при безыгольном однократном введении в моделях на животных (Johnson et al., 19).97; Фабер и др., 2005; Кобли и др., 2010). Кроме того, распространенность антител к VSV в общей популяции чрезвычайно низка. Поэтому лишь немногие люди являются носителями ранее существовавших антител для противодействия вакцинам на основе VSV (Lichty et al., 2004). Ранее было показано, что противотуберкулезная вакцина на основе VSV VSVAg85A, экспрессирующая высокоиммуногенный антиген Ag85A, обладает защитным действием при заражении легких M. tb при интраназальном введении мышам (Roediger et al., 2008). Однако эта защита проявилась в ранний момент времени, обнаруженная через 2 недели после иммунизации, и не была устойчивой.
tb при интраназальном введении мышам (Roediger et al., 2008). Однако эта защита проявилась в ранний момент времени, обнаруженная через 2 недели после иммунизации, и не была устойчивой.
Здесь мы разработали вакцину на основе VSV VSV-846, экспрессирующую четко определенный слитый ген тройного антигена, который был эффективен против микобактериальной инфекции, описанной в нашем предыдущем отчете (Kong et al., 2014). Наши результаты показали, что вакцинация VSV-846 вызывала значительный иммунный ответ, опосредованный Т-клетками, и обеспечивает эффективную долговременную защиту после введения БЦЖ в однократной безыгольной дозе. Эти результаты могут также дать представление о дальнейшей разработке вакцины M.tb.
Материалы и методы.
Протоколы иммунизации. Все эксперименты на животных проводились в соответствии с рекомендациями по лабораторным животным Комиссии по этике лабораторных животных Университета Сучжоу (SYXK2014-0030).
Перед всеми иммунизациями мышей слегка анестезировали 30% изофлураном (Baxter), разведенным в пропиленгликоле. Однократные интраназальные прививки 10 6 БОЕ вводили в объеме 25 мкл для VSV-846. Для иммунизации БЦЖ мышам вводили однократно 1×10 7 колониеобразующих единиц (КОЕ) БЦЖ подкожно. Для плазмидной иммунизации мышам внутримышечно вводили 50 мкг p846 4 раза в две недели. (1) Для обнаружения индуцированного VSV-846 иммунного ответа и защиты каждая группа состояла из двенадцати мышей. Шесть мышей на группу умерщвляли через 2 недели после заключительной вакцинации ДНК для анализа высвобождения IFN-γ, анализа пролиферации лимфоцитов и измерения цитотоксических Т-лимфоцитов. Других шести мышей в каждой группе заражали БЦЖ через 6 недель после последней вакцинации ДНК и умерщвляли через 6 недель после заражения для обнаружения бактериальной нагрузки. (2) Для обнаружения долгосрочной защиты, индуцированной VSV-846, каждая группа состояла из восемнадцати мышей. Шесть мышей на группу умерщвляли через 6, 12 или 24 недели после заражения БЦЖ для обнаружения бактериальной нагрузки и оценки патологии.
Однократные интраназальные прививки 10 6 БОЕ вводили в объеме 25 мкл для VSV-846. Для иммунизации БЦЖ мышам вводили однократно 1×10 7 колониеобразующих единиц (КОЕ) БЦЖ подкожно. Для плазмидной иммунизации мышам внутримышечно вводили 50 мкг p846 4 раза в две недели. (1) Для обнаружения индуцированного VSV-846 иммунного ответа и защиты каждая группа состояла из двенадцати мышей. Шесть мышей на группу умерщвляли через 2 недели после заключительной вакцинации ДНК для анализа высвобождения IFN-γ, анализа пролиферации лимфоцитов и измерения цитотоксических Т-лимфоцитов. Других шести мышей в каждой группе заражали БЦЖ через 6 недель после последней вакцинации ДНК и умерщвляли через 6 недель после заражения для обнаружения бактериальной нагрузки. (2) Для обнаружения долгосрочной защиты, индуцированной VSV-846, каждая группа состояла из восемнадцати мышей. Шесть мышей на группу умерщвляли через 6, 12 или 24 недели после заражения БЦЖ для обнаружения бактериальной нагрузки и оценки патологии. (3) Для обнаружения Т-клеток памяти, индуцированных VSV-846, каждая группа состояла из шести мышей. Этих мышей умерщвляли через 24 недели после последней вакцинации ДНК для обнаружения Т-клеток памяти.
(3) Для обнаружения Т-клеток памяти, индуцированных VSV-846, каждая группа состояла из шести мышей. Этих мышей умерщвляли через 24 недели после последней вакцинации ДНК для обнаружения Т-клеток памяти.
Бактериальные штаммы и условия культивирования
Штамм Escherichia coli DH5α выращивали в среде Луриа-Бертани для клонирования. M. bovis BCG (датский штамм 1331) был предоставлен Центром контроля заболеваний Сучжоу и культивирован в среде Миддлбрука 7H9 или подсчитан на агаре 7h21 с добавлением 10% олеиновой кислоты-альбумин-декстрозы-каталазы, 0,5% глицерина. и 0,05% Tween 80. Инактивированный штамм M.tb h47Rv был предоставлен Пятой народной больницей Сучжоу.
Поколение вакцины на основе VSV, VSV-846
Гибридный ген, кодирующий Rv3615c, Mtb10.4 и Rv2660c, амплифицировали с помощью ПЦР, как описано ранее (Kong et al., 2014). Продукт ПЦР расщепляли XhoI и NheI и клонировали в пятое положение плазмиды pVSV-XN2 (Cobleigh et al., 2010), получая pVSV-XN 2 -846. Рекомбинантный вирус VSV-846 был получен с помощью следующей процедуры. Вкратце, клетки почек детенышей хомячка BHK-21 (номер ATCC: CCL-10), выращенные до 60% слияния, инфицировали рекомбинантным вирусом осповакцины, экспрессирующим РНК-полимеразу T7 (Fuerst et al. ., 1986) и инкубировали в течение 1 ч в бессывороточной среде Игла, модифицированной Дульбекко (DMEM). Затем инфицированные вирусом коровьей оспы клетки котрансфицировали плазмидами pVSV-XN 2 -846 и другими плазмидами для экспрессии VSV N, P и L (Ritz et al., 2012). Супернатанты собирали через 48 ч после трансфекции, фильтровали через фильтр с порами 0,2 мкм для удаления вируса осповакцины и пассировали на свежие клетки BHK-21. Среду собирали немедленно и фильтровали через фильтр с порами 0,2 мкм после того, как через 2 дня наблюдали цитопатические эффекты. Затем рекомбинантный VSV очищали от бляшек и размножали. Определяли титр и хранили VSV-846 при -80°C до использования.
Рекомбинантный вирус VSV-846 был получен с помощью следующей процедуры. Вкратце, клетки почек детенышей хомячка BHK-21 (номер ATCC: CCL-10), выращенные до 60% слияния, инфицировали рекомбинантным вирусом осповакцины, экспрессирующим РНК-полимеразу T7 (Fuerst et al. ., 1986) и инкубировали в течение 1 ч в бессывороточной среде Игла, модифицированной Дульбекко (DMEM). Затем инфицированные вирусом коровьей оспы клетки котрансфицировали плазмидами pVSV-XN 2 -846 и другими плазмидами для экспрессии VSV N, P и L (Ritz et al., 2012). Супернатанты собирали через 48 ч после трансфекции, фильтровали через фильтр с порами 0,2 мкм для удаления вируса осповакцины и пассировали на свежие клетки BHK-21. Среду собирали немедленно и фильтровали через фильтр с порами 0,2 мкм после того, как через 2 дня наблюдали цитопатические эффекты. Затем рекомбинантный VSV очищали от бляшек и размножали. Определяли титр и хранили VSV-846 при -80°C до использования.
Вестерн-блоттинг
Клетки BHK-21 инфицировали VSV-846 и собирали через 6 часов после инфицирования. Клетки промывали фосфатно-солевым буфером (PBS) и лизировали 2 × буфером для образцов SDS. Белки разделяли на 10% SDS-геле, переносили на нитроцеллюлозную мембрану, зондировали антителом против флага (Sigma 1:2000) и детектировали вторичным антителом (Southern Biotech 1:5000) с использованием хемилюминесценции.
Клетки промывали фосфатно-солевым буфером (PBS) и лизировали 2 × буфером для образцов SDS. Белки разделяли на 10% SDS-геле, переносили на нитроцеллюлозную мембрану, зондировали антителом против флага (Sigma 1:2000) и детектировали вторичным антителом (Southern Biotech 1:5000) с использованием хемилюминесценции.
Анализ высвобождения IFN-γ
Через две недели после последней иммунизации клетки селезенки, выделенные от мышей, иммунизированных вакциной, высевали при 5 × 10 6 клеток/лунку в 24-луночных планшетах. Эти клетки стимулировали белком TFP846 (10 мкг/мл), как описано ранее (Kong et al., 2014), при 37°C в течение 72 часов. Концентрации IFN-γ в культуральном супернатанте измеряли с помощью набора ELISA (eBioscience) в соответствии с процедурой производителя.
Анализ пролиферации лимфоцитов
Пролиферацию спленоцитов у иммунизированных мышей измеряли через 2 недели после последней иммунизации. Жизнеспособные спленоциты доводили до концентрации 5 × 10 6 клеток/мл и добавляли в 96-луночные планшеты с плоским дном в количестве 5 × 10 5 клеток/лунку с 10 мкг/мл белка TFP846. В каждую лунку добавляли реагент для мечения BrdU (Roche) в соотношении 1:1000. Планшеты с культурами выдерживали в тех же условиях еще 24 ч, а затем инкубировали с анти-BrdU-пероксидазой. Измеряли величину поглощения при 370 нм. Каждый образец анализировали в трех повторностях.
В каждую лунку добавляли реагент для мечения BrdU (Roche) в соотношении 1:1000. Планшеты с культурами выдерживали в тех же условиях еще 24 ч, а затем инкубировали с анти-BrdU-пероксидазой. Измеряли величину поглощения при 370 нм. Каждый образец анализировали в трех повторностях.
Измерение цитотоксических Т-лимфоцитов
Через две недели после последней ДНК-иммунизации выделяли и стимулировали спленоциты in vitro с 10 мкг/мл рекомбинантных белков TFP846 у вакцинированных мышей при 37°C, 5% CO 2 . Клетки мышиной миеломной линии SP2/0 из банка клеток Китайской академии наук обрабатывали инактивированным M. tb h47Rv в течение 24 ч в качестве клеток-мишеней. Анализ нерадиоактивных цитотоксических Т-лимфоцитов (ЦТЛ) проводили с помощью набора для определения цитотоксичности лактатдегидрогеназы (ЛДГ) (Roche). Эффекторные клетки титровали в 96-луночных планшетах с U-образным дном при соотношениях эффектор-клетки-мишени 50:1, 25:1 и 12,5:1; 1 × 10 9Затем добавляли 0011 4 клеток-мишеней. После инкубации при 37°С в течение 72 ч отбирали по 100 мкл клеточного супернатанта на лунку и переносили в соответствующие лунки 96-луночного планшета. В каждую лунку добавляли реакционную смесь (100 мкл) и инкубировали при комнатной температуре в течение 30 мин. Измеряли значение поглощения при 492 нм. Процент цитотоксичности CTL рассчитывали следующим образом:
После инкубации при 37°С в течение 72 ч отбирали по 100 мкл клеточного супернатанта на лунку и переносили в соответствующие лунки 96-луночного планшета. В каждую лунку добавляли реакционную смесь (100 мкл) и инкубировали при комнатной температуре в течение 30 мин. Измеряли значение поглощения при 492 нм. Процент цитотоксичности CTL рассчитывали следующим образом:
Цитотоксичность (%) = [(эффекторная и целевая клеточная смеси — контроль клеток -клеток) -low]/(контроль высокого контроля) × 100%;
В соответствии с протоколом высоким контролем была максимальная высвобождаемая активность ЛДГ в клетках (50 мкл среды для культивирования клеток, 50 мкл необработанных клеток и 5 мкл буфера для лизиса). Низким контролем была спонтанная активность ЛДГ, высвобождаемая из необработанных нормальных клеток (50 мкл среды для культивирования клеток, 50 мкл необработанных клеток).
Заражение мышей и анализ колониеобразующих единиц
Через шесть недель после заключительной вакцинации ДНК иммунизированным мышам интраназально вводили 1 × 10 7 КОЕ БЦЖ, как описано ранее (Kong et al. , 2014; Song et al. , 2015). Бактериальную нагрузку в селезенке и легких в указанные моменты времени после заражения подсчитывали в соответствии с колониеобразующими единицами серийных разведений гомогенатов тканей на среде Миддлбрука 7 ч 21 в трех повторностях.
, 2014; Song et al. , 2015). Бактериальную нагрузку в селезенке и легких в указанные моменты времени после заражения подсчитывали в соответствии с колониеобразующими единицами серийных разведений гомогенатов тканей на среде Миддлбрука 7 ч 21 в трех повторностях.
Гистопатологический анализ и оценка тяжести воспаления
Для гистопатологического анализа легкие иммунизированных мышей ( n = 6 на группу) собирали через 24 недели после заражения БЦЖ. Ткани разрезали и окрашивали гематоксилином и эозином. В одном эксперименте от каждой мыши делали пять срезов. Затем случайным образом отбирали два среза от каждой мыши, и в общей сложности двенадцать срезов каждой группы оценивали на предмет воспаления двумя независимыми исследователями в одном эксперименте. Показатель воспаления оценивали как процент площади воспаления по сравнению с общим размером среза ткани с помощью сетки окуляра микроскопа, как сообщалось ранее (Fairweather et al., 2005; Liu et al., 2014).
Проточная цитометрия
Через двадцать четыре недели после заключительной иммунизации ДНК из иммунизированных мышей выделяли спленоциты ( n = 6 на группу). Клетки памяти CD4 + окрашивали PerCP-Cy5.5-анти-мышиный CD4 (Biolegend), FITC-анти-мышиный CD44 (Biolegend), PE-анти-мышиный CD62L (Biolegend) и APC-Cy7-анти-мышиный CD44 (Biolegend). мышиный CD25 (Биолегенда). Клетки памяти CD8 + окрашивали антителами PerCP-антимышиный CD8 (Biolegend), PE-антимышиный CD62L (Biolegend) и Pacific blue-антимышиный CD45R (Biolegend). Окрашенные клетки фиксировали с помощью Cytofix/Cytoperm Buffer™ (Becton Dickson) и затем анализировали с помощью проточного цитометра FACS Canto II с программным обеспечением FACSDiva.
Клетки памяти CD4 + окрашивали PerCP-Cy5.5-анти-мышиный CD4 (Biolegend), FITC-анти-мышиный CD44 (Biolegend), PE-анти-мышиный CD62L (Biolegend) и APC-Cy7-анти-мышиный CD44 (Biolegend). мышиный CD25 (Биолегенда). Клетки памяти CD8 + окрашивали антителами PerCP-антимышиный CD8 (Biolegend), PE-антимышиный CD62L (Biolegend) и Pacific blue-антимышиный CD45R (Biolegend). Окрашенные клетки фиксировали с помощью Cytofix/Cytoperm Buffer™ (Becton Dickson) и затем анализировали с помощью проточного цитометра FACS Canto II с программным обеспечением FACSDiva.
Статистический анализ
Статистический анализ выполнялся с помощью GraphPad Prism. Данные были получены из трех отдельных экспериментов и представлены как среднее значение и стандартное отклонение. Данные были подвергнуты статистическому анализу с помощью двустороннего независимого теста Стьюдента t с помощью SPSS 12.0. Уровень статистической значимости был установлен на уровне P < 0,05.
Результаты
Получение и идентификация VSV-846, несущего слияние тройного антигена микобактерий
Для создания вакцины на основе VSV был амплифицирован ген тройного антигена TFP846 (Rv3615c-Mtb10.4-Rv2660c) в плазмиде p846 (Kong et al., 2014), а затем клонирован в геном VSV в пятой позиции. антигенома VSV (рис. 1А). Супернатант rVSV в клеточной культуре собирали через 48 ч после трансфекции для очистки. Клетки BHK-21, инфицированные rVSV, проявляли цитопатическую активность через 6 ч после заражения (рис. 1В). Экспрессия гена тройного антигена была подтверждена антителом против флага (рис. 1С). Эти результаты свидетельствовали об успешном создании вакцины VSV-846 на основе VSV, экспрессирующей слитый тройной антиген M.tb TFP846.
Рисунок 1. Получение и идентификация вакцины VSV-846. (A) Схема плазмиды pVSV-XN2-846. Слитый тройной антиген TFP846 (Rv3615c-Mtb10.4-Rv2660c) амплифицировали из плазмиды p846, а затем ген слитого тройного антигена клонировали в пятое положение плазмиды pVSV-XN2 после расщепления XhoI и NheI. (B) Изображения под микроскопом клеток BHK-21, инфицированных VSV-846, или неинфицированных контрольных образцов через 6 ч после заражения (200×). (C) Слитый тройной антиген TFP846 был экспрессирован в клетках, инфицированных VSV-846. Блот исследовали антителом против флага. Контроль: Нормальные клетки без инфекции.
(B) Изображения под микроскопом клеток BHK-21, инфицированных VSV-846, или неинфицированных контрольных образцов через 6 ч после заражения (200×). (C) Слитый тройной антиген TFP846 был экспрессирован в клетках, инфицированных VSV-846. Блот исследовали антителом против флага. Контроль: Нормальные клетки без инфекции.
Оценка клеточных ответов и защиты, индуцированных VSV-846
Учитывая важную роль клеточных ответов против микобактериальной инфекции, мы оценили клеточные ответы, индуцированные VSV-846, через 2 недели после заключительной иммунизации ДНК (рис. 2). Был проведен анализ высвобождения IFN-γ, чтобы определить, способна ли вакцина VSV-846 индуцировать высокие уровни антигенспецифического IFN-γ 9.0011 + Т-клеток. Наши результаты показали, что уровень IFN-γ, секретируемый клетками селезенки мыши, иммунизированной VSV-846, был выше по сравнению с таковым из клеток селезенки мыши, иммунизированной p846, после инкубации с белком TFP846 (рис. 3A, * P <0,05) и был сходным. до уровня IFN-γ, секретируемого клетками селезенки мыши, иммунизированной БЦЖ. Значительно повышенная пролиферация антиген-специфических Т-клеток также наблюдалась у мышей, иммунизированных VSV-846, в ответ на белок TFP846 по сравнению с мышами, иммунизированными p846 (рис. 3B, * 9).0061 р < 0,05). Специфическую активность цитотоксических Т-лимфоцитов (ЦТЛ) оценивали, используя клетки SP2/0 в качестве клеток-мишеней. Самый сильный ответ антиген-специфической цитотоксичности был обнаружен у VSV-846, иммунизированного при соотношении E:T 50:1 (фиг. 3C, * p <0,05).
3A, * P <0,05) и был сходным. до уровня IFN-γ, секретируемого клетками селезенки мыши, иммунизированной БЦЖ. Значительно повышенная пролиферация антиген-специфических Т-клеток также наблюдалась у мышей, иммунизированных VSV-846, в ответ на белок TFP846 по сравнению с мышами, иммунизированными p846 (рис. 3B, * 9).0061 р < 0,05). Специфическую активность цитотоксических Т-лимфоцитов (ЦТЛ) оценивали, используя клетки SP2/0 в качестве клеток-мишеней. Самый сильный ответ антиген-специфической цитотоксичности был обнаружен у VSV-846, иммунизированного при соотношении E:T 50:1 (фиг. 3C, * p <0,05).
Рисунок 2. Хронология вакцинации животных, заражения и обнаружения . Группе мышей BALB/c вводили в объеме 25 мкл VSV-846 (однократные интраназальные инокуляции 10 6 БОЕ). Отдельно мышей иммунизировали 50 мкг плазмидной ДНК р846, вводимой внутримышечно или 10 6 КОЕ БЦЖ, введенная подкожно, служила контрольной группой. Выявление иммунного ответа, провокацию БЦЖ, бактериальную нагрузку и оценку патологии применяли, как указано в моментах времени.
Рис. 3. Клеточные реакции и защита, индуцированные VSV-846. (A) Антиген-специфический IFN-γ высвобождается из спленоцитов, очищенных от мышей BALB/c, иммунизированных VSV-846, после стимуляции in vitro рекомбинантным TFP846 через 2 недели после иммунизации. (Б) Специфическая пролиферация Т-клеток в селезенке, измеренная с помощью анализа BrdU через 2 недели после иммунизации. (C) Специфический цитотоксический ответ был обнаружен в ткани селезенки, полученной от мышей, иммунизированных VSV-846 при соотношении E:T 50:1~12,5:1. Для одного эксперимента каждая группа состояла из шести мышей. Результаты представлены как среднее ± стандартное отклонение трех отдельных экспериментов. Планка погрешности представляет собой стандартное отклонение трех средних в повторных экспериментах. * р < 0,05, ** р < 0,01. (D) Количество бактерий в одном эксперименте ( n = 6 на группу) в легких мышей BALB/c, подвергшихся различным вакцинациям, зараженным Mycobacterium bovis BCG через 6 недель после вакцинации. * р < 0,05, *** р < 0,001.
* р < 0,05, *** р < 0,001.
Для изучения степени защиты иммунизированных мышей интраназально заражали 10 7 колониеобразующими единицами (КОЕ) БЦЖ и через 6 недель после заражения определяли бактериальную нагрузку в легких. Мы наблюдали, что вакцинация против VSV-846 эффективно контролировала рост бактерий до уровней — примерно в 10 раз ниже, чем наблюдаемые в группе с имитацией, и в 2,2 раза ниже, чем в группе, получавшей p846 (рис. 3D, * 9).0061 р < 0,05 и *** р < 0,001). Однако бактериальная нагрузка у мышей, иммунизированных VSV-846, существенно не отличалась от наблюдаемой у мышей, иммунизированных БЦЖ. Эти результаты показали, что вакцинация VSV-846 индуцировала сильный специфический Т-клеточный иммунный ответ и защищала мышей от микобактериальной инфекции через 12 недель после вакцинации.
Иммунизация против VSV-846 вызывала долговременную защиту
Чтобы определить, вызывает ли вакцинация против VSV-846 долговременный иммунный ответ, группы мышей BALB/c иммунизировали и заражали. Бактериальную нагрузку в легких мышей оценивали с течением времени. В соответствии с результатами, показанными на фиг. 3, через 6 недель после бактериального заражения мыши были защищены вакцинацией VSV-846. Этот метод привел к снижению легочных КОЕ на 1,47 log по сравнению с таковыми, наблюдаемыми в контрольной группе, хотя этот результат существенно не отличался от такового в группе БЦЖ. Интересно, что исследование временных точек через 12 и 24 недели после заражения показало, что бактериальная нагрузка в группе, иммунизированной VSV-846, была значительно ниже, чем в группе БЦЖ (рис. 4А, ** 9).0061 p < 0,01 и *** p < 0,001), что свидетельствует о том, что вакцинация против VSV-846 может вызывать лучшую долговременную защиту от бактериальной инфекции. Через двадцать четыре недели после заражения анализировали патологию легочных тканей. Были исследованы срезы здоровых мышей, выявившие тяжелую интерстициальную пневмонию, воспаление и диффузные гранулемоподобные реакции после инфицирования БЦЖ.
Бактериальную нагрузку в легких мышей оценивали с течением времени. В соответствии с результатами, показанными на фиг. 3, через 6 недель после бактериального заражения мыши были защищены вакцинацией VSV-846. Этот метод привел к снижению легочных КОЕ на 1,47 log по сравнению с таковыми, наблюдаемыми в контрольной группе, хотя этот результат существенно не отличался от такового в группе БЦЖ. Интересно, что исследование временных точек через 12 и 24 недели после заражения показало, что бактериальная нагрузка в группе, иммунизированной VSV-846, была значительно ниже, чем в группе БЦЖ (рис. 4А, ** 9).0061 p < 0,01 и *** p < 0,001), что свидетельствует о том, что вакцинация против VSV-846 может вызывать лучшую долговременную защиту от бактериальной инфекции. Через двадцать четыре недели после заражения анализировали патологию легочных тканей. Были исследованы срезы здоровых мышей, выявившие тяжелую интерстициальную пневмонию, воспаление и диффузные гранулемоподобные реакции после инфицирования БЦЖ. Однако у мышей, иммунизированных VSV-846, наблюдалось гораздо меньшее воспаление и неповрежденная альвеолярная морфология по сравнению с мышами, вакцинированными p846 или БЦЖ, что указывает на то, что вакцинация VSV-846 облегчала повреждение легких после заражения БЦЖ (рис. 4B).
Однако у мышей, иммунизированных VSV-846, наблюдалось гораздо меньшее воспаление и неповрежденная альвеолярная морфология по сравнению с мышами, вакцинированными p846 или БЦЖ, что указывает на то, что вакцинация VSV-846 облегчала повреждение легких после заражения БЦЖ (рис. 4B).
Рисунок 4. Длительный иммунитет и защитная эффективность VSV-846. (A) Группы мышей иммунизировали и заражали Mycobacterium bovis BCG. Бактериальную нагрузку в легких мышей определяли в течение 24 недель после заражения. Для одного эксперимента каждая группа состояла из шести мышей. Результаты представлены как среднее ± стандартное отклонение трех отдельных экспериментов. Планка погрешности представляет собой стандартное отклонение трех средних в повторных экспериментах. ** р < 0,01, *** р < 0,001. (B) Патология легочных тканей, окрашенных H&E (левая панель, шкала: 100 мкм). и представлена оценка воспаления (правая панель) через 24 недели после заражения. Показанные изображения являются репрезентативными изображениями одного эксперимента. Данные оценки воспаления представлены как среднее ± стандартное отклонение трех отдельных экспериментов. Планка погрешности представляет собой стандартное отклонение трех средних в повторных экспериментах. ** р < 0,01.
Показанные изображения являются репрезентативными изображениями одного эксперимента. Данные оценки воспаления представлены как среднее ± стандартное отклонение трех отдельных экспериментов. Планка погрешности представляет собой стандартное отклонение трех средних в повторных экспериментах. ** р < 0,01.
VSV-846 Увеличение объема памяти CD4
+ и CD8 + Т-клетки Т-клетки памяти способны быстрее реагировать и обеспечивать более быстрое удаление вируса при повторном контакте с антигеном. A long-term immune response based on the presence of memory (CD44 + CD62L Low CD25 − ) CD4 + T and (CD44 + CD62L Low CD45R − ) CD8 + Т-клетки исследуют для определения защиты от микобактериальной инфекции (Sondel et al., 2003). Мышей иммунизировали VSV-846, и через 24 недели после заключительной ДНК-вакцинации выделяли спленоциты для количественной оценки ответа Т-клеток памяти. CD25 — Т-клетки или CD45R — Т-клетки были изолированы от CD4 + или CD8 + Т-клеток с помощью проточной цитометрии соответственно. Затем Т-клетки долговременной памяти характеризовали CD44 + и CD62L Low . Как показано на рисунке 5, процент как CD4 + (15,85%), так и CD8 + (8,69%) Т-клеток памяти был выше в группе VSV-846 по сравнению с наблюдаемым в группе БЦЖ (рис. 4A). ,В, * р < 0,05 и *** p <0,001), что указывает на то, что иммунизация VSV-846 способна обеспечить устойчивый клеточный иммунитет.
CD25 — Т-клетки или CD45R — Т-клетки были изолированы от CD4 + или CD8 + Т-клеток с помощью проточной цитометрии соответственно. Затем Т-клетки долговременной памяти характеризовали CD44 + и CD62L Low . Как показано на рисунке 5, процент как CD4 + (15,85%), так и CD8 + (8,69%) Т-клеток памяти был выше в группе VSV-846 по сравнению с наблюдаемым в группе БЦЖ (рис. 4A). ,В, * р < 0,05 и *** p <0,001), что указывает на то, что иммунизация VSV-846 способна обеспечить устойчивый клеточный иммунитет.
Рис. 5. Иммунные ответы Т-клеток памяти, индуцированные VSV-846 Через 24 недели после заключительной иммунизации ДНК были выделены спленоциты иммунизированных мышей ( n = 6 на группу), а Т-клетки памяти были проанализированы потоком цитометрия . Иммунизация VSV-846 особенно повышала частоту памяти (A) CD4 + и (B) CD8 + Т-клетки по сравнению с иммунизацией p846 или БЦЖ, что позволяет предположить, что иммунизация VSV-846 может обеспечить более эффективную защиту путем индукции этих Т-клеток на поздних стадиях инфекции. Графики рассеяния показаны для спленоцитов одной мыши. Для одного эксперимента каждая группа состояла из шести мышей. Результаты представлены как среднее ± стандартное отклонение трех отдельных экспериментов. Планка погрешности представляет собой стандартное отклонение трех средних в повторных экспериментах. * р < 0,05, *** р < 0,001.
Графики рассеяния показаны для спленоцитов одной мыши. Для одного эксперимента каждая группа состояла из шести мышей. Результаты представлены как среднее ± стандартное отклонение трех отдельных экспериментов. Планка погрешности представляет собой стандартное отклонение трех средних в повторных экспериментах. * р < 0,05, *** р < 0,001.
Обсуждение
В последние годы было показано, что иммунизация живыми способными к репликации вакцинами против VSV является эффективным методом разработки вакцин (Rose et al., 2001; Haglund et al., 2002; Clarke et al., 2007; Брэкстон и др., 2010). Векторы VSV имеют определенные преимущества для использования в доставке вакцин. В частности, они могут индуцировать стойкий гуморальный и клеточно-опосредованный иммунитет Th2 после однократной дозы в отсутствие дополнительного адъюванта (Publicover et al., 2005). До сих пор традиционные вакцинации требуют повторных доз для индукции длительного иммунитета, и часто требуется специфический адъювант. Например, двухдозовая вакцина HeVsG требует действия двух адъювантов, все гидрогели, и олигодезоксинуклеотида CpG (Bossart et al., 2012) для создания иммунного ответа Th2. Однако гидрогели сами по себе обычно вызывают ответ Th3, который не подходит для вирусных инфекций (Coffman et al., 2010; Steinhagen et al., 2011).
Например, двухдозовая вакцина HeVsG требует действия двух адъювантов, все гидрогели, и олигодезоксинуклеотида CpG (Bossart et al., 2012) для создания иммунного ответа Th2. Однако гидрогели сами по себе обычно вызывают ответ Th3, который не подходит для вирусных инфекций (Coffman et al., 2010; Steinhagen et al., 2011).
Ранее мы сообщали, что четырехкратная инокуляция голой плазмиды ДНК, кодирующей белок TFP846, вызывала сильный Т-клеточно-опосредованный иммунный ответ (Kong et al., 2014). В этом исследовании мы показали, что защита вместе с долгосрочным иммунным ответом против микобактериальной инфекции у мышей была эффективно достигнута путем интраназальной иммунизации однократной дозой вакцины на основе VSV, VSV-846.
Индуцированные вакциной CD4 + Т-клетки, как известно, секретируют активирующие фагоциты цитокины типа 1, такие как IFN-γ и TNF-α, которые способствуют внутриклеточной противомикробной защите путем активации макрофагов (Kerksiek and Pamer, 1999; Шредер и др.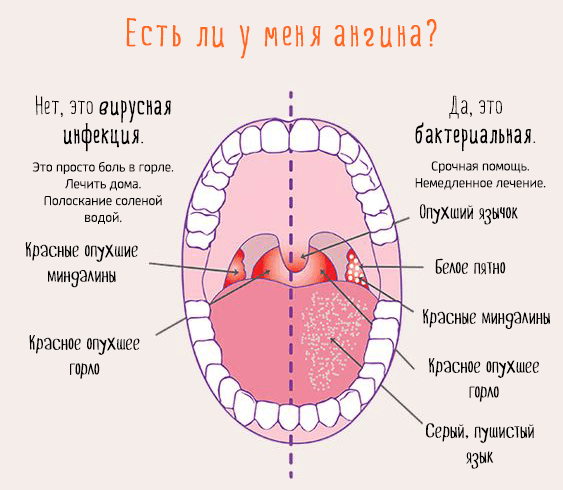 , 2004). Недавние исследования показывают, что как Т-клетки CD4 + , так и IFN-γ играют решающую роль в борьбе с бактериальными инфекциями (Malley et al., 2005; Pilione and Harvill, 2006). Слитый тройной антиген TFP846 содержит три антигена M.tb: Rv3615c (Boesen et al., 1995), M.tb10.4 (Skjøt et al., 2000) и Rv2660c (Betts et al., 2002). И Rv3615c, и M.tb10.4 охватывают высокую плотность эпитопов Т-клеток, которые способствуют сильному иммунному ответу Т-клеток, включая функциональные субпопуляции Т-клеток, секретирующие как IFN-γ, так и IL-2 (Millington et al., 2011). Rv2660c стабильно экспрессируется на ранних и поздних стадиях инфекции M.tb и значительно усиливает защитный иммунитет, характеризующийся высокой долей многофункциональных CD4+ Т-клеток, против инфекции M.tb у мышей и яванских макак (Aagaard et al., 2011; Lin и др., 2012). Здесь сильный клеточный иммунный ответ был вызван однократной дозой VSV-846, о чем свидетельствует повышенное высвобождение IFN-γ, пролиферация лимфоцитов и цитотоксичность Т-клеток (рис.
, 2004). Недавние исследования показывают, что как Т-клетки CD4 + , так и IFN-γ играют решающую роль в борьбе с бактериальными инфекциями (Malley et al., 2005; Pilione and Harvill, 2006). Слитый тройной антиген TFP846 содержит три антигена M.tb: Rv3615c (Boesen et al., 1995), M.tb10.4 (Skjøt et al., 2000) и Rv2660c (Betts et al., 2002). И Rv3615c, и M.tb10.4 охватывают высокую плотность эпитопов Т-клеток, которые способствуют сильному иммунному ответу Т-клеток, включая функциональные субпопуляции Т-клеток, секретирующие как IFN-γ, так и IL-2 (Millington et al., 2011). Rv2660c стабильно экспрессируется на ранних и поздних стадиях инфекции M.tb и значительно усиливает защитный иммунитет, характеризующийся высокой долей многофункциональных CD4+ Т-клеток, против инфекции M.tb у мышей и яванских макак (Aagaard et al., 2011; Lin и др., 2012). Здесь сильный клеточный иммунный ответ был вызван однократной дозой VSV-846, о чем свидетельствует повышенное высвобождение IFN-γ, пролиферация лимфоцитов и цитотоксичность Т-клеток (рис. 3A-C).
3A-C).
Хотя аналогичные бактериальные нагрузки были измерены у мышей, иммунизированных VSV-846 и БЦЖ, через 6 недель после заражения, они значительно различались при длительных интервалах, включая 12 и 24 недели после заражения. Этот результат отличался от результата, о котором сообщил Roediger (Roediger et al., 2008), где VSVAg85A обеспечивал только временную защиту от легочного заражения M.tb после однократной иммунизации слизистой оболочки дыхательных путей. Учитывая, что использовалась одна и та же вирусная векторная система, возможное объяснение состоит в том, что слитый тройной антиген TFP846 более устойчив к индуцированию противотуберкулезных иммунных ответов по сравнению с использованием отдельных антигенов M.tb.
Т-клетки памяти способствуют защите хозяина при широком спектре вирусных и внутриклеточных бактериальных инфекций (Harty et al., 2000). Как эффекторные Т-клетки памяти, так и устойчивая высокая пролиферативная способность центральных Т-клеток памяти важны для потенциально успешной противотуберкулезной вакцины (Andersen and Woodworth, 2014; Nunes-Alves et al. , 2014). CD62L представляет собой рецептор самонаведения в лимфатических узлах, который подавляется при активации ЦТЛ (Ottenhoff and Kaufmann, 2012). CD44 является поверхностным белком, необходимым для экстравазации лимфоцитов в места воспаления, и его активация представляет собой маркер для Т-клеток памяти (Harty et al., 2000). В этом исследовании мы наблюдали, что большая популяция CD44 + и CD62L Низкие Т-клетки памяти из изолированных спленоцитов через 24 недели после вакцинации. Хотя мы наблюдали гораздо более высокий процент Т-клеток памяти CD44 + и CD62L Low после иммунизации VSV-846 по сравнению с таковым у мышей, иммунизированных БЦЖ, мы не смогли определить, были ли эти Т-клетки памяти получены в результате индукции VSV-846. без окрашивания антиген-специфическим тетрамером. Ранее сообщалось, что вакцина на основе VSV индуцировала пролиферацию полифункциональных Т-клеток, которые секретируют активирующие цитокины, такие как IL-2, IFN-γ и TNF-α, и способствуют противовирусной защите (Wu et al.
, 2014). CD62L представляет собой рецептор самонаведения в лимфатических узлах, который подавляется при активации ЦТЛ (Ottenhoff and Kaufmann, 2012). CD44 является поверхностным белком, необходимым для экстравазации лимфоцитов в места воспаления, и его активация представляет собой маркер для Т-клеток памяти (Harty et al., 2000). В этом исследовании мы наблюдали, что большая популяция CD44 + и CD62L Низкие Т-клетки памяти из изолированных спленоцитов через 24 недели после вакцинации. Хотя мы наблюдали гораздо более высокий процент Т-клеток памяти CD44 + и CD62L Low после иммунизации VSV-846 по сравнению с таковым у мышей, иммунизированных БЦЖ, мы не смогли определить, были ли эти Т-клетки памяти получены в результате индукции VSV-846. без окрашивания антиген-специфическим тетрамером. Ранее сообщалось, что вакцина на основе VSV индуцировала пролиферацию полифункциональных Т-клеток, которые секретируют активирующие цитокины, такие как IL-2, IFN-γ и TNF-α, и способствуют противовирусной защите (Wu et al. , 2014). Однако ни одно исследование не показало способность вызванных вакциной клеток, секретирующих множество цитокинов во время инфекции, превращаться в долгоживущие Т-клетки памяти, демонстрирующие повышенную способность контролировать инфекцию, о чем свидетельствует клиническая неудача MVA85A (Ottenhoff and Kaufmann, 2012).
, 2014). Однако ни одно исследование не показало способность вызванных вакциной клеток, секретирующих множество цитокинов во время инфекции, превращаться в долгоживущие Т-клетки памяти, демонстрирующие повышенную способность контролировать инфекцию, о чем свидетельствует клиническая неудача MVA85A (Ottenhoff and Kaufmann, 2012).
В заключение, наши результаты показывают, что противотуберкулезная вакцина VSV-846 на основе VSV вызывает сильные клеточные иммунные ответы, а также ответы Т-клеток памяти и защищает вакцинированных мышей от инфекции БЦЖ в течение длительного периода времени после введения иглы. -бесплатная разовая доза. Эти результаты показали, что использование VSV в качестве вектора доставки антигена является потенциально успешным вариантом для разработки противотуберкулезной вакцины.
Вклад авторов
CD и SX разработали исследование. МЗ проводил эксперименты. MZ, CD и SX интерпретировали данные. MZ, CD и SX написали рукопись. Все авторы одобрили окончательный вариант статьи.
Финансирование
Эта работа была поддержана Крупной государственной программой развития фундаментальных исследований Китая (2013CB530501, 2013CB531502), грантами Национального научно-технического проекта в течение периода двадцатипятилетнего плана Китая (2013ZX10003007), Национальным природным Научный фонд Китая (31470839, 81072428, 31270977), Приоритетная академическая программа развития высших учебных заведений Цзянсу (PAPD), Инновационная исследовательская группа провинции Цзянсу.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Авторы хотели бы поблагодарить профессора Джона К. Роуза из Йельского университета за предоставление обратной генетической системы VSV. Авторы также благодарят доктора Бернарда Мосса из NIH за предоставленный вирус коровьей оспы vTF7-3, экспрессирующий РНК-полимеразу T7.
Ссылки
Aagaard, C., Hoang, T., Dietrich, J., Cardona, P.J., Izzo, A., Dolganov, G., et al. (2011). Многоступенчатая противотуберкулезная вакцина, обеспечивающая эффективную защиту до и после заражения. Нац. Мед. 17, 189–194. doi: 10.1038/nm.2285
Полный текст CrossRef | Google Scholar
Андерсен П. и Вудворт Дж. С. (2014). Противотуберкулезные вакцины – переосмысление современной парадигмы. Тренды Иммунол. 35, 387–395. doi: 10.1016/j.it.2014.04.006
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Беттс Дж. К., Люки П. Т., Робб Л. К., МакАдам Р. А. и Дункан К. (2002). Оценка модели питательного голодания Mycobacterium tuberculosis персистентность по профилю экспрессии генов и белков. Мол. микробиол. 43, 717–731. doi: 10.1046/j.1365-2958.2002.02779.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Boesen, H., Jensen, B.N., Wilcke, T. и Andersen, P. (1995). Т-клеточные ответы человека на секретируемые антигенные фракции Mycobacterium tuberculosis . Заразить. Иммун. 63, 1491–1497.
(1995). Т-клеточные ответы человека на секретируемые антигенные фракции Mycobacterium tuberculosis . Заразить. Иммун. 63, 1491–1497.
Реферат PubMed | Google Scholar
Боссарт К. Н., Роккс Б., Фельдманн Ф., Брининг Д., Скотт Д., Лакасс Р. и др. (2012). Вакцина на основе субъединицы гликопротеина G вируса Хендра защищает африканских зеленых мартышек от заражения вирусом Нипах. Науч. Перевод Мед. 4, 146ra107. doi: 10.1126/scitranslmed.3004241
PubMed Abstract | Полный текст CrossRef
Брэкстон, К.Л., Пакетт, С.Х., Мизель, С.Б., и Лайлс, Д.С. (2010). Защита от заражения летальным вирусом коровьей оспы с использованием вакцинного вектора вируса везикулярного стоматита с мутантным аттенуированным белком матрикса, экспрессирующего антигены поксвируса. Дж. Вирол. 84, 3552–3561. doi: 10.1128/ОВИ.01572-09
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Брюэр, Т. Ф. (2000). Профилактика туберкулеза с помощью вакцины бациллы Кальметта-Герена: метаанализ литературы. клин. Заразить. Дис. 31(Прил. 3), S64–S67. doi: 10.1086/314072
клин. Заразить. Дис. 31(Прил. 3), S64–S67. doi: 10.1086/314072
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Кларк, Д. К., Насар, Ф., Ли, М., Джонсон, Дж. Э., Райт, К., Кальдерон, П., и др. (2007). Синергетическая аттенуация вируса везикулярного стоматита за счет комбинации специфических усечений гена G и транслокаций гена N. Дж. Вирол. 81, 2056–2064. doi: 10.1128/ОВИ.01911-06
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Кобли М. А., Буонокор Л., Апричард С. Л., Роуз Дж. К. и Робек М. Д. (2010). Вакцинный вектор вируса гепатита В на основе вируса везикулярного стоматита обеспечивает защиту от заражения в виде однократной дозы. Дж. Вирол. 84, 7513–7522. doi: 10.1128/ОВИ.00200-10
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Коффман Р.Л., Шер А. и Седер Р.А. (2010). Вакцинные адъюванты: задействуем врожденный иммунитет. Иммунитет 33, 492–503. doi: 10.1016/j.immuni.2010.10.002
doi: 10.1016/j.immuni.2010.10.002
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Кон, Д.Л. (2000). Лечение латентной туберкулезной инфекции: новые возможности для борьбы с туберкулезом. клин. Заразить. Дис. 31, 120–124. doi: 10.1086/313891
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Купер, А. М. (2009). Клеточные иммунные реакции при туберкулезе. Год. Преподобный Иммунол. 27, 393–422. doi: 10.1146/annurev.immunol.021908.132703
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Дэвис С.С. (2001). Назальные вакцины. Доп. Наркотик Делив. Ред. 51, 21–42. doi: 10.1016/S0169-409X(01)00162-4
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Faber, M., Lamirande, E.W., Roberts, A., Rice, A.B., Koprowski, H., Dietzschold, B., et al. (2005). Однократная иммунизация вектором на основе рабдовируса, экспрессирующим S-белок коронавируса тяжелого острого респираторного синдрома (SARS-CoV), приводит к выработке высоких уровней антител, нейтрализующих SARS-CoV. Дж. Генерал Вирол. 86, 1435–1440. doi: 10.1099/vir.0.80844-0
Дж. Генерал Вирол. 86, 1435–1440. doi: 10.1099/vir.0.80844-0
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Фачадо А., Родригес А., Молина Дж., Сильверио Дж. К., Марино А. П., Пинто Л. М. и др. (2003). Долгосрочный защитный иммунный ответ, вызванный вакцинацией экспрессионной геномной библиотекой Toxoplasma gondii. Заразить. Иммун. 71, 5407–5411. doi: 10.1128/IAI.71.9.5407-5411.2003
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Fairweather, D., Frisancho-Kiss, S., Yusung, S.A., Barrett, M.A., Davis, S.E., Steele, R.A., et al. (2005). IL-12 защищает от миокардита, вызванного вирусом Коксаки B3, путем увеличения IFN-гамма и популяций макрофагов и нейтрофилов в сердце. Дж. Иммунол. 174, 261–269. doi: 10.4049/jimmunol.174.1.261
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Fuerst, T.R., Niles, E.G., Studier, F.W., and Moss, B. (1986). Эукариотическая система временной экспрессии на основе рекомбинантного вируса осповакцины, синтезирующего РНК-полимеразу бактериофага Т7.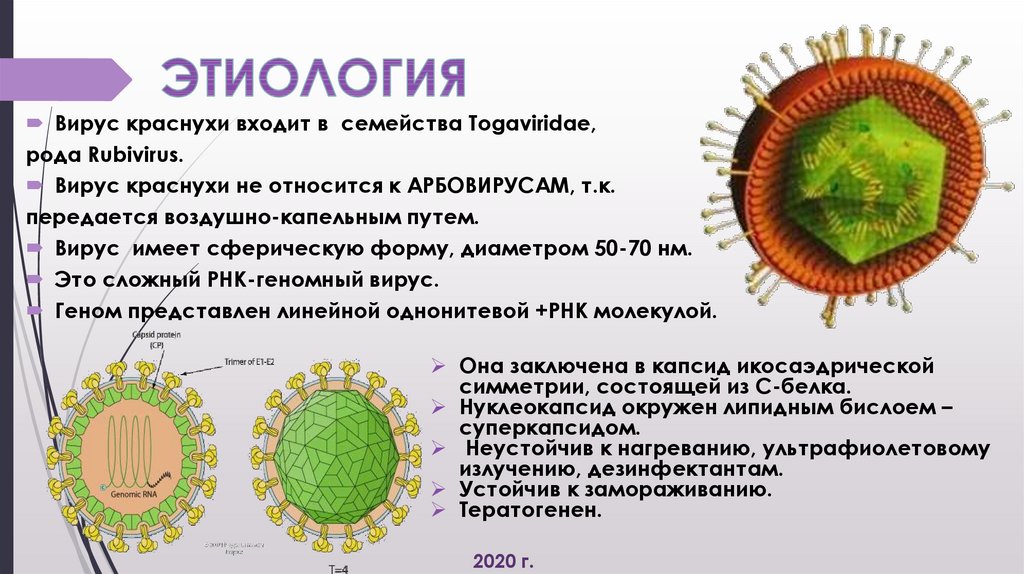 Проц. Натл. акад. науч. США 83, 8122–8126. doi: 10.1073/pnas.83.21.8122
Проц. Натл. акад. науч. США 83, 8122–8126. doi: 10.1073/pnas.83.21.8122
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Глин Хьюинсон, Р. (2005). Противотуберкулезные вакцины для всего мира. Туберкулез (Эдинб). 85, 1–6. doi: 10.1016/j.tube.2004.10.002
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Гунетиллеке, Н. П., МакШейн, Х., Ханнан, К. М., Андерсон, Р. Дж., Брукс, Р. Х., и Хилл, А. В. (2003). Повышенная иммуногенность и защитная эффективность против Mycobacterium tuberculosis вакцины против бациллы Кальметта-Герена с введением через слизистую оболочку и рекомбинантным модифицированным вирусом осповакцины Анкара. Дж. Иммунол. 171, 1602–1609. doi: 10.4049/jimmunol.171.3.1602
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Хаглунд К., Лейнер И., Керксик К., Буонокор Л., Памер Э. и Роуз Дж. К. (2002). Первичный CD8(+) Т-клеточный ответ высокого уровня на gag и env вируса иммунодефицита человека типа 1, вызванный вакцинацией рекомбинантными вирусами везикулярного стоматита.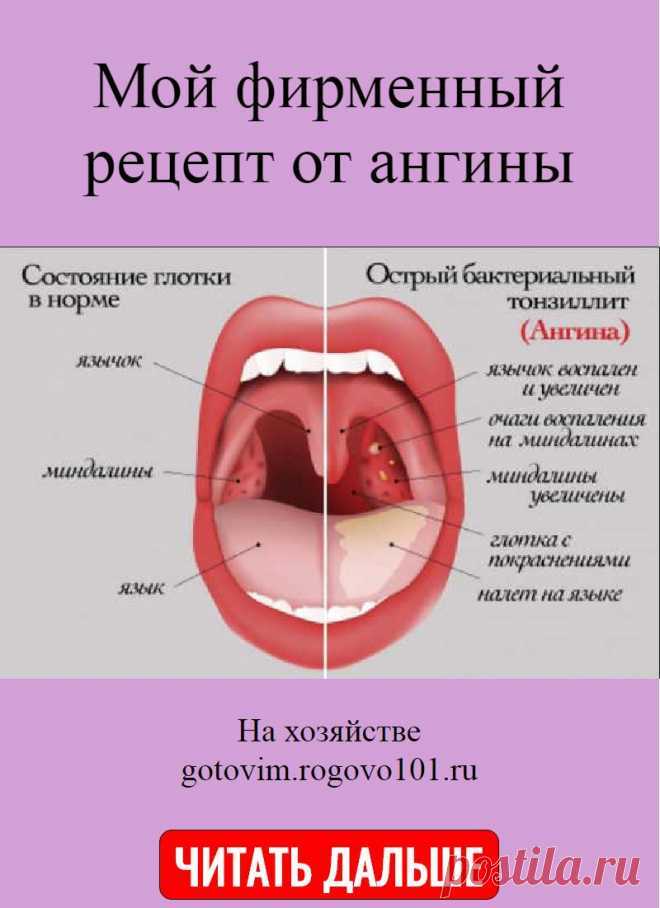 Дж. Вирол. 76, 2730–2738. doi: 10.1128/ОВИ.76.6.2730-2738.2002
Дж. Вирол. 76, 2730–2738. doi: 10.1128/ОВИ.76.6.2730-2738.2002
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Харти, Дж. Т., Твиннерейм, А. Р., и Уайт, Д. В. (2000). Эффекторные механизмы CD8+ Т-клеток в устойчивости к инфекциям. Год. Преподобный Иммунол. 18, 275–308. doi: 10.1146/annurev.immunol.18.1.275
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Энао-Тамайо, М., Ордуэй, Д. Дж., и Орм, И. М. (2014). Субпопуляции Т-клеток памяти при туберкулезе: на что мы должны ориентироваться? Туберкулез (Эдинб). 94, 455–461. doi: 10.1016/j.tube.2014.05.001
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Hogarth, P.J., Logan, K.E., Ferraz, JC, Hewinson, R.G., and Chambers, MA (2006). Защитная эффективность, индуцированная Mycobacterium bovis бациллой Кальметта-Герена, может быть усилена независимым от антигена образом за счет использования некодирующей плазмидной ДНК. Вакцина 24, 95–101. doi: 10.1016/j.vaccine.2005.07.115
Вакцина 24, 95–101. doi: 10.1016/j.vaccine.2005.07.115
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Джонсон, Дж. Э., Шнелл, М. Дж., Буонокор, Л., и Роуз, Дж. К. (1997). Специфическое нацеливание на CD4+ клетки рекомбинантных вирусов везикулярного стоматита, кодирующих белки оболочки вируса иммунодефицита человека. Дж. Вирол. 71, 5060–5068.
Реферат PubMed | Google Scholar
Керксиек К.М. и Памер Э.Г. (1999). Реакции Т-клеток на бактериальную инфекцию. Курс. мнение Иммунол. 11, 400–405. doi: 10.1016/S0952-7915(99)80067-3
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Конг, Х., Донг, К., и Сюн, С. (2014). Новая вакцина p846, кодирующая Rv3615c, Mtb10.4 и Rv2660c, вызывает сильный иммунный ответ и облегчает повреждение легких, вызванное микобактериальной инфекцией. Гул. Вакцина. Иммунотер. 10, 378–390. doi: 10.4161/hv.27121
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Лихти, Б. Д., Пауэр, А. Т., Стойдл, Д. Ф., и Белл, Дж. К. (2004). Вирус везикулярного стоматита: новое изобретение пули. Тенденции Мол. Мед. 10, 210–216. doi: 10.1016/j.molmed.2004.03.003
Д., Пауэр, А. Т., Стойдл, Д. Ф., и Белл, Дж. К. (2004). Вирус везикулярного стоматита: новое изобретение пули. Тенденции Мол. Мед. 10, 210–216. doi: 10.1016/j.molmed.2004.03.003
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Лин П. Л., Дитрих Дж., Тан Э., Абалос Р. М., Бургос Дж., Бигби К. и др. (2012). Многоэтапная вакцина Н56 усиливает действие БЦЖ для защиты яванских макак от активного туберкулеза и реактивации латентной инфекции Mycobacterium tuberculosis . Дж. Клин. Инвестировать. 122, 303–314. doi: 10.1172/JCI46252
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Лю Л., Юэ Ю. и Сюн С. (2014). Интерферон-гамма/ИЛ-4, происходящий из NK, запускает несопоставимую по половому признаку поляризацию макрофагов при миокардите, индуцированном CVB3. Дж. Мол. Клетка. Кардиол. 76, 15–25. doi: 10.1016/j.yjmcc.2014.07.021
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Малли Р. , Трзински К., Сривастава А., Томпсон К. М., Андерсон П. В. и Липсич М. (2005). CD4 + Т-клетки опосредуют антитело-независимый приобретенный иммунитет к пневмококковой колонизации. Проц. Натл. акад. науч. США 102, 4848–4853. doi: 10.1073/pnas.0501254102
, Трзински К., Сривастава А., Томпсон К. М., Андерсон П. В. и Липсич М. (2005). CD4 + Т-клетки опосредуют антитело-независимый приобретенный иммунитет к пневмококковой колонизации. Проц. Натл. акад. науч. США 102, 4848–4853. doi: 10.1073/pnas.0501254102
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Миллингтон К. А., Форчун С. М., Лоу Дж., Гарсес А., Хингли-Уилсон С. М., Викремасингх М. и др. (2011). Rv3615c представляет собой сильно иммунодоминантный RD1 (область различий 1)-зависимый секретируемый антиген, специфичный для инфекции Mycobacterium tuberculosis . Проц. Натл. акад. науч. США 108, 5730–5735. doi: 10.1073/pnas.1015153108
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
Nunes-Alves, C., Booty, M.G., Carpenter, S.M., Jayaraman, P., Rothchild, A.C., and Behar, S.M. (2014). В поисках новой парадигмы защитного иммунитета к туберкулезу. Нац. Преподобный Микробиолог.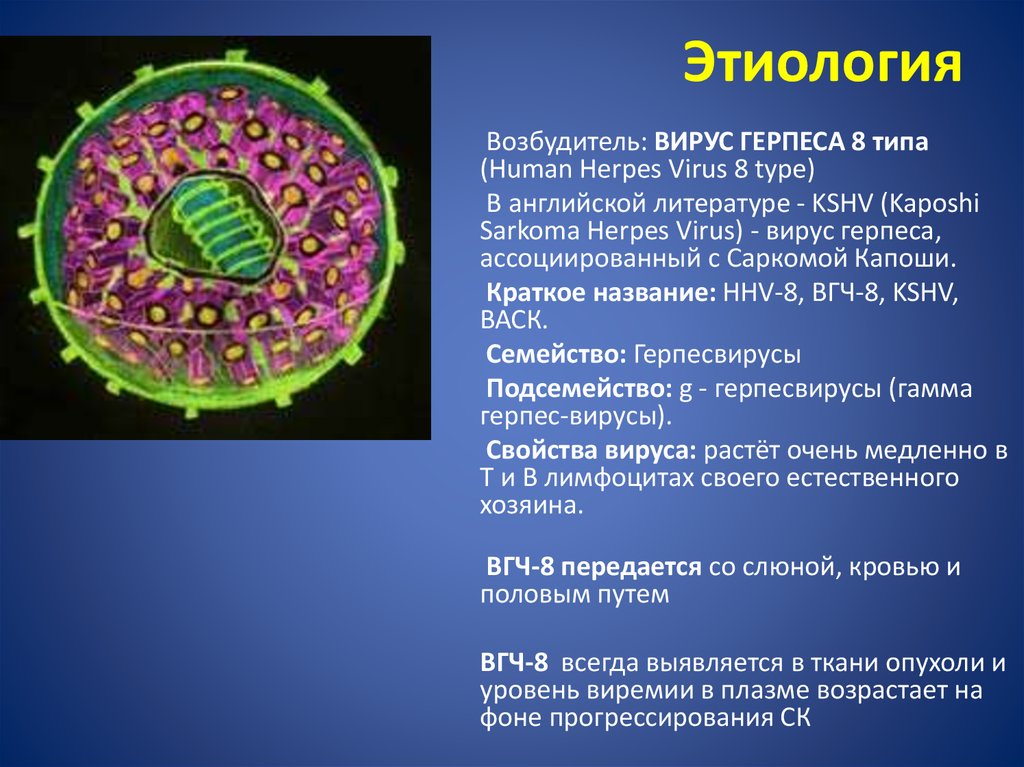 12, 289–299. doi: 10.1038/nrmicro3230
12, 289–299. doi: 10.1038/nrmicro3230
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Оттенхофф, Т. Х., и Кауфманн, С. Х. (2012). Вакцины против туберкулеза: где мы и куда нам нужно идти? PLoS Патог. 8:e1002607. doi: 10.1371/journal.ppat.1002607
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Пилионе, М. Р., и Харвилл, Э. Т. (2006). Система секреции Bordetella bronchiseptica III типа ингибирует выработку гамма-интерферона, необходимого для эффективного бактериального клиренса, опосредованного антителами. Заразить. Иммун. 74, 1043–1049. doi: 10.1128/IAI.74.2.1043-1049.2006
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Publicover, J., Ramsburg, E., и Rose, JK (2005). Вакцинный вектор однократного цикла на основе вируса везикулярного стоматита может индуцировать иммунные ответы, сравнимые с реакциями, генерируемыми вектором, способным к репликации. Дж. Вирол. 79, 13231–13238. doi: 10.1128/ОВИ.79.21.13231-13238.2005
Вирол. 79, 13231–13238. doi: 10.1128/ОВИ.79.21.13231-13238.2005
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Ритц Н., Страх М., Яу К., Датта Б., Тебрюгге М., Коннелл Т. Г. и др. (2012). Сравнительный анализ полифункциональных Т-клеток и секретируемых цитокинов, индуцированных иммунизацией бациллой Кальметта-Герена у детей и взрослых. ПЛОС ОДИН 7:e37535. doi: 10.1371/journal.pone.0037535
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Редигер, Э. К., Кугатасан, К., Чжан, X., Личти, Б. Д., и Син, З. (2008). Гетерологическое усиление рекомбинантной аденовирусной первичной иммунизации новой противотуберкулезной вакциной на основе вируса везикулярного стоматита. Мол. тер. 16, 1161–1169. doi: 10.1038/mt.2008.59
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Роуз Н.Ф., Маркс П.А., Луккей А., Никсон Д.Ф., Моретто В.Дж., Донахью С.М. и др. (2001). Эффективная вакцина против СПИДа на основе живых аттенуированных рекомбинантов вируса везикулярного стоматита. Сотовый 106, 539–549. doi: 10.1016/S0092-8674(01)00482-2
Сотовый 106, 539–549. doi: 10.1016/S0092-8674(01)00482-2
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Шредер К., Герцог П. Дж., Раваси Т. и Хьюм Д. А. (2004). Интерферон-гамма: обзор сигналов, механизмов и функций. Дж. Лейкок. биол. 75, 163–189. doi: 10.1189/jlb.0603252
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Скьёт Р. Л., Эттингер Т., Розенкрандс И., Равн П., Брок И., Якобсен С. и др. (2000). Сравнительная оценка белков с низкой молекулярной массой из Mycobacterium tuberculosis идентифицирует членов семейства ESAT-6 как иммунодоминантные Т-клеточные антигены. Заразить. Иммун. 68, 214–220. doi: 10.1128/IAI.68.1.214-220.2000
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Сондел, П.М., Бухтояров, И.Н., и ДеСантес, К. (2003). Приятные воспоминания: помнить об иммунной защите и забывать о реакции «трансплантат против хозяина». Дж. Клин. Инвестировать. 112, 25–27. doi: 10.1172/JCI19095
Клин. Инвестировать. 112, 25–27. doi: 10.1172/JCI19095
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Сонг Т., Донг С. и Сюн С. (2015). Сигнальная молекула активации лимфоцитов SLAMF1 усиливает микобактериальную БЦЖ-индуцированную воспалительную реакцию и способствует клиренсу бактерий. Междунар. Дж. Мед. микробиол. 305, 572–580. doi: 10.1016/j.ijmm.2015.07.006
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Стейнхаген Ф., Кинджо Т., Боде К. и Клинман Д. М. (2011). Иммунные адъюванты на основе TLR. Вакцина 29, 3341–3355. doi: 10.1016/j.vaccine.2010.08.002
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Тан, Г. С., Маккенна, П. М., Козер, М. Л., Маклинден, Р., Ким, Дж. Х., МакГеттиган, Дж. П., и др. (2005). Сильный клеточный и гуморальный иммунный ответ против ВИЧ Env, индуцированный гетерологичным рабдовирусным подходом прайм-буст. Вирусология 331, 82–93. doi: 10.1016/j.virol.2004.10.018
doi: 10.1016/j.virol.2004.10.018
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
ВОЗ (2004 г.). ВОЗ Заболевания, предупреждаемые с помощью вакцин: Система мониторинга, 2004 г. Глобальный обзор . Женева: ВОЗ.
Ву, Ф., Фань, X., Юэ, Ю., Сюн, С., и Донг, К. (2014). Вакцина для слизистых оболочек на основе вируса везикулярного стоматита способствует созреванию дендритных клеток и вызывает предпочтительный иммунный ответ против вирусного миокардита, вызванного вирусом Коксаки В3. Вакцина 32, 3917–3926. doi: 10.1016/j.vaccine.2014.05.052
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
типов вакцин | HHS.gov
Существует несколько различных типов вакцин. Каждый тип предназначен для того, чтобы научить вашу иммунную систему бороться с определенными видами микробов и серьезными заболеваниями, которые они вызывают.
Когда ученые создают вакцины, они учитывают:
- Как ваша иммунная система реагирует на микроб
- Кто нуждается в прививке от микроба
- Лучшая технология или подход к созданию вакцины
На основе ряда этих факторов ученые решают, какой тип вакцины они будут производить. Существует несколько типов вакцин, в том числе:
Существует несколько типов вакцин, в том числе:
- Инактивированные вакцины
- Живые аттенуированные вакцины
- Вакцины с матричной РНК (мРНК)
- Субъединичные, рекомбинантные, полисахаридные и конъюгированные вакцины
- Токсоидные вакцины
- Вакцины против вирусных векторов
Инактивированные вакцины
В инактивированных вакцинах используется убитая версия микроорганизма, вызывающего заболевание.
Инактивированные вакцины обычно не обеспечивают такой сильный иммунитет (защиту), как живые вакцины. Таким образом, вам может понадобиться несколько доз с течением времени (бустерные прививки), чтобы получить постоянный иммунитет против болезней.
Инактивированные вакцины используются для защиты от:
- Гепатита А
- Грипп (только прививка)
- Полиомиелит (только инъекция)
- Бешенство
Живые аттенуированные вакцины
В живых вакцинах используется ослабленная (или аттенуированная) форма микроорганизма, вызывающего заболевание.
Поскольку эти вакцины настолько похожи на естественную инфекцию, что помогают ее предотвратить, они создают сильный и продолжительный иммунный ответ. Всего 1 или 2 дозы большинства живых вакцин могут обеспечить пожизненную защиту от микробов и болезней, которые они вызывают.
Но у живых вакцин есть и некоторые ограничения. Например:
- Поскольку они содержат небольшое количество ослабленного живого вируса, некоторым людям следует поговорить со своим лечащим врачом перед их получением, например людям с ослабленной иммунной системой, хроническими проблемами со здоровьем или людям, у которых был орган. пересадка.
- Их нужно держать в прохладе, поэтому они плохо путешествуют. Это означает, что их нельзя использовать в странах с ограниченным доступом к холодильникам.
Живые вакцины используются для защиты от:
- Корь, эпидемический паротит, краснуха (комбинированная вакцина MMR)
- Ротавирус
- Оспа
- Ветряная оспа
- Желтая лихорадка
Вакцины с матричной РНК, также называемые мРНК-вакцинами
Исследователи изучают и работают с мРНК-вакцинами на протяжении десятилетий, и эта технология использовалась для создания некоторых вакцин против COVID-19. Вакцины с мРНК производят белки, чтобы вызвать иммунный ответ. мРНК-вакцины имеют несколько преимуществ по сравнению с другими типами вакцин, в том числе более короткое время производства и, поскольку они не содержат живого вируса, отсутствие риска заболевания у вакцинированного человека.
Вакцины с мРНК производят белки, чтобы вызвать иммунный ответ. мРНК-вакцины имеют несколько преимуществ по сравнению с другими типами вакцин, в том числе более короткое время производства и, поскольку они не содержат живого вируса, отсутствие риска заболевания у вакцинированного человека.
мРНК-вакцины используются для защиты от:
- COVID-19
Субъединичные, рекомбинантные, полисахаридные и конъюгированные вакцины
Субъединичные, рекомбинантные, полисахаридные и конъюгированные вакцины используют определенные фрагменты зародыша, такие как его белок, сахар или капсид (оболочка вокруг зародыша).
Поскольку в этих вакцинах используются только определенные части микроба, они вызывают очень сильный иммунный ответ, нацеленный на ключевые части микроба. Их также можно использовать практически для всех, кто в них нуждается, включая людей с ослабленной иммунной системой и хроническими проблемами со здоровьем.
Одним из недостатков этих вакцин является то, что вам могут потребоваться повторные прививки для постоянной защиты от болезней.
Эти вакцины используются для защиты от:
- Hib ( Haemophilus influenzae тип b) болезни
- Гепатит В
- ВПЧ (вирус папилломы человека)
- Коклюш (часть комбинированной вакцины DTaP)
- Пневмококковая инфекция
- Менингококковая инфекция
- Черепица
Токсоидные вакцины
Токсоидные вакцины используют токсин (вредный продукт), вырабатываемый микробом, вызывающим заболевание. Они создают иммунитет к частям зародыша, вызывающим заболевание, а не к самому зародышу. Это означает, что иммунный ответ нацелен на токсин, а не на весь микроб.
Как и некоторые другие типы вакцин, вам могут понадобиться повторные прививки, чтобы обеспечить постоянную защиту от болезней.
Токсоидные вакцины используются для защиты от:
- Дифтерии
- Столбняк
Вакцины против вирусных векторов
На протяжении десятилетий ученые изучали вакцины против вирусных векторов. В некоторых вакцинах, которые недавно применялись при вспышках лихорадки Эбола, использовалась технология вирусных векторов, и ряд исследований был сосредоточен на вакцинах вирусных векторов против других инфекционных заболеваний, таких как вирус Зика, грипп и ВИЧ. Ученые использовали эту технологию и для создания вакцин против COVID-19.
В некоторых вакцинах, которые недавно применялись при вспышках лихорадки Эбола, использовалась технология вирусных векторов, и ряд исследований был сосредоточен на вакцинах вирусных векторов против других инфекционных заболеваний, таких как вирус Зика, грипп и ВИЧ. Ученые использовали эту технологию и для создания вакцин против COVID-19.
Вакцины с вирусным вектором используют модифицированную версию другого вируса в качестве вектора для обеспечения защиты. В качестве переносчиков использовались несколько различных вирусов, включая грипп, вирус везикулярного стоматита (VSV), вирус кори и аденовирус, вызывающий простуду. Аденовирус является одним из вирусных векторов, используемых в некоторых случаях COVID-19.вакцины проходят клинические испытания. Вакцины против вирусных векторов используются для защиты от:
- COVID-19
Заболевания, передающиеся от лошади к человеку
Передовой опыт биобезопасности включает:
- Часто мойте руки водой с мылом или используйте дезинфицирующее средство для рук.
- Соблюдайте правила гигиены и санитарии.
- Не ешьте и не пейте в сараях, конюшнях и других местах, где содержатся лошади.
- Изолируйте больных лошадей, используйте специальные приспособления и оборудование для ухода за ними и по возможности обрабатывайте этих лошадей каждый день в последний раз.
- Вакцинируйте лошадей с учетом факторов риска для вашего района и учреждения и в соответствии с рекомендациями вашего ветеринара.
- Учтите, что совместное смешивание лошадей и домашнего скота может привести к распространению инфекции.
- Изолируйте и проверяйте новых лошадей, прежде чем позволить им вступить в контакт с местным стадом.
- Борьба с грызунами и дикими животными в местах содержания лошадей.
- Используйте антибиотики в соответствии с указаниями вашего ветеринара и убедитесь, что вы следуете полному курсу лечения, чтобы свести к минимуму распространение устойчивых к антибиотикам бактерий.
*Узнайте больше о биозащите лошадей в нашем отчете о лошадях осенью 2020 года.
Можно ли заразиться от лошади? Да, но хорошая новость заключается в том, что прямая передача болезни от лошади к человеку встречается редко. Вот краткий обзор некоторых бактериальных, грибковых, паразитарных и вирусных заболеваний, которые потенциально могут передаваться нам непосредственно от лошадей в нашей жизни. В этот список не входят такие заболевания, как Западный Нил, которые могут передаваться от лошадей к человеку косвенно, например, через укус насекомого.
Все, кто проводит время рядом с лошадьми, должны принимать меры предосторожности против следующих заболеваний, которые обычно передаются от лошадей человеку: открытая рана, такая как ссадина кожи, рваная рана или место укуса насекомого.
Лошади: Дерматофилоз часто встречается у лошадей и часто известен как «дождевая гниль», «дождевой ожог», «грязевая сыпь» или «грязевая лихорадка». Чаще всего это связано с длительным воздействием влаги в виде дождя или пота под одеялами или прихватками. Болезнь может привести к болезненным поражениям и отекам на спине, морде и конечностях, которые обычно образуют сухие, «благородные» корки.
Болезнь может привести к болезненным поражениям и отекам на спине, морде и конечностях, которые обычно образуют сухие, «благородные» корки.
Передача: Бактерии могут передаваться от лошадей к человеку при прямом контакте с инфицированными животными.
Люди: У людей поражения обычно возникают на кистях и предплечьях.
Лечение и профилактика: Местные и системные антибиотики используются для лечения дерматофилеза. Для лошадей также важно учитывать изменения в управлении, чтобы держать животных сухими. Хотя дерматофилоз не опасен для жизни, он может привести к вторичным инфекциям, если его не лечить.
- Стригущий лишай — Стригущий лишай или дерматофития вызывается инфекцией кожи или волос, вызываемой в основном грибками Trichophyton equinum и Trichophyton mentagrophytes .
Лошади: Эти грибы живут в почве, и лошади могут подвергаться воздействию, когда копают, катаются или ложатся в грязь.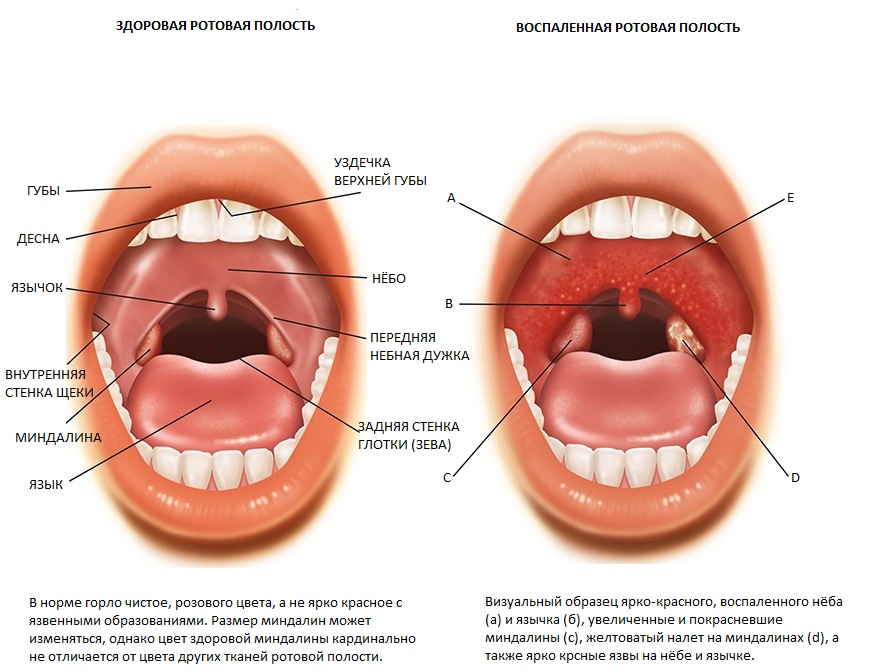 Грибы могут передаваться между лошадьми при контакте с инфицированными людьми и зараженными предметами, такими как оборудование для ухода за лошадьми и снаряжение. Клинические признаки стригущего лишая у лошадей обычно состоят из участков с корками, сухой кожи с выпадением волос и круговых зудящих поражений.
Грибы могут передаваться между лошадьми при контакте с инфицированными людьми и зараженными предметами, такими как оборудование для ухода за лошадьми и снаряжение. Клинические признаки стригущего лишая у лошадей обычно состоят из участков с корками, сухой кожи с выпадением волос и круговых зудящих поражений.
Передача: Грибок может передаваться от лошадей к человеку при непосредственном контакте с кожей или шерстью зараженного животного или при прикосновении к зараженным предметам.
Люди: Подобно лошадям, у людей часто появляется чешуйчатая, покрасневшая, круговая сыпь.
Лечение и профилактика: Инфекции часто проходят без лечения, но в некоторых случаях эффективны лечебные шампуни.
- Сальмонеллез — Сальмонеллез вызывается бактериями Salmonella enterica и вызывает диарею у лошадей и людей.
Лошади: У лошадей бактерии передаются через зараженный корм или воду. Передача также может происходить при прямом контакте с инфицированными людьми или поверхностями, загрязненными навозом инфицированного человека. Некоторые лошади являются носителями, которые не проявляют никаких признаков болезни, но могут активно передавать микроорганизмы. Носители могут заболеть в состоянии стресса, вызванного операцией, транспортировкой, сменой корма и т. д. Тяжелые случаи могут привести к летальному исходу, если их не лечить.
Некоторые лошади являются носителями, которые не проявляют никаких признаков болезни, но могут активно передавать микроорганизмы. Носители могут заболеть в состоянии стресса, вызванного операцией, транспортировкой, сменой корма и т. д. Тяжелые случаи могут привести к летальному исходу, если их не лечить.
Передача: Люди, работающие рядом с лошадьми, могут заразиться сальмонеллой, прикоснувшись к загрязненным поверхностям и случайно перенеся бактерии с рук в рот.
Люди: Многие люди не проявляют симптомов сальмонеллезной инфекции. У других может развиться лихорадка, дискомфорт в животе и диарея. Клиническая форма заболевания может быть легкой или тяжелой, а тяжелые случаи могут привести к летальному исходу, если не лечить.
Лечение и профилактика: У людей в большинстве случаев заболевание проходит даже без лечения. У лошадей можно использовать нестероидные противовоспалительные препараты (НПВП) для облегчения боли, а средства защиты желудочно-кишечного тракта, такие как биогубка или активированный уголь, могут связывать бактериальный токсин. В тяжелых случаях может потребоваться лечение внутривенными жидкостями и электролитами. Поскольку микроорганизм широко распространен в окружающей среде, профилактика сальмонеллеза затруднена. Идентификация зараженных лошадей и строгие протоколы биобезопасности — лучший подход к предотвращению распространения болезни.
В тяжелых случаях может потребоваться лечение внутривенными жидкостями и электролитами. Поскольку микроорганизм широко распространен в окружающей среде, профилактика сальмонеллеза затруднена. Идентификация зараженных лошадей и строгие протоколы биобезопасности — лучший подход к предотвращению распространения болезни.
Заболевания, которые реже передаются от лошадей к человеку, но все же требуют соответствующих мер биологической безопасности:
- Кампилобактериоз — Бактериальные виды рода Кампилобактерии могут вызывать раздражение и воспаление желудка и кишечника (гастроэнтерит ) у животных и человека. Фактически, это самая распространенная бактериальная причина гастроэнтерита во всем мире.
Лошади: Инфекции у лошадей вызывают воспаление тонкой кишки (энтерит), которое приводит к диарее.
Передача: Бактерии обычно передаются через фекальное загрязнение окружающей среды и последующее проглатывание через пищу или воду. Люди могут заразиться в результате деятельности, связанной с лошадьми, включая уборку денников и уход за лошадьми. Однако вы, скорее всего, подвергнетесь воздействию Campylobacter через сырую или недоваренную курицу или непастеризованное молоко.
Люди могут заразиться в результате деятельности, связанной с лошадьми, включая уборку денников и уход за лошадьми. Однако вы, скорее всего, подвергнетесь воздействию Campylobacter через сырую или недоваренную курицу или непастеризованное молоко.
Люди: Симптомы у человека включают боль в животе, диарею, тошноту, лихорадку и рвоту.
Лечение и профилактика: Антибиотики могут использоваться для лечения инфицированных людей. Инфекция Campylobacter редко опасна для жизни.
- Криптоспоридиоз — Паразиты рода Cryptosporidium являются важным источником желудочно-кишечных заболеваний у людей и животных во всем мире. Эти очень заразные паразиты поражают кишечник и вызывают диарею и потерю веса.
Лошади: Криптоспоридиоз чаще всего наблюдается у жеребят, особенно у жеребят с ослабленным иммунитетом или в состоянии стресса. Лошади заражаются при проглатывании паразита с зараженной пищей или водой.
Передача: Паразит может передаваться от лошадей человеку через загрязненную воду, почву или поверхности и может сохраняться в окружающей среде в течение длительного времени.
Люди: У людей проглатывание паразита может вызвать водянистую диарею, рвоту, спазмы желудка и потерю веса. Симптомы могут длиться до двух недель.
Лечение и профилактика: Симптомы часто исчезают без лечения у людей со здоровой иммунной системой. Людям с ослабленной иммунной системой или тяжелыми инфекциями противопаразитарные препараты (например, нитазоксанид) и средства, препятствующие моторике (например, лоперамид), могут облегчить диарею.
- Лямблиоз — Одноклеточные организмы рода Giardia , чаще всего Giardia duodenalis , прикрепляются к кишечнику, вызывая проблемы с всасыванием витаминов и других питательных веществ, что часто приводит к диарее. Загрязненная вода и почва являются основными источниками инфекции.

Лошади: Giardia может вызывать перемежающуюся диарею у некоторых инфицированных лошадей, а также плохой шерстяной покров и потерю веса. Жеребята часто заражаются, но часто не проявляют клинических признаков.
Передача: Зараженные лошади могут передавать паразита людям непрямым путем через загрязнение воды фекалиями или непосредственно при контакте с зараженными поверхностями.
Люди: Симптомы у человека включают диарею, спазмы в животе, вздутие живота и потерю веса.
Лечение и профилактика: Антибиотик метронидазол обычно используется для лечения лямблиоза у обоих видов.
Лептоспироз может быть связан с рецидивирующим увеитом лошадей (лунной слепотой).
- Лептоспироз — В США лептоспироз лошадей часто возникает в результате заражения бактериями Leptospira interrogans при контакте с инфицированной мочой, часто с зараженным кормом или водой. Бактерии быстро распространяются по тканям по всему телу через кровоток.

Лептоспироз может быть связан с рецидивирующим увеитом лошадей (лунной слепотой).
Лошади: У лошадей заболевание связано с абортами, мертворождением, заболеванием почек и рецидивирующим увеитом лошадей (также известным как лунная слепота), хотя у некоторых инфицированных лошадей клинические признаки отсутствуют.
Передача: Люди могут заразиться при контакте зараженной воды с поврежденной кожей или слизистыми оболочками (глазами, носом или ртом).
Люди: У людей лептоспироз вызывает симптомы гриппа, включая боль в животе, высокую температуру, озноб, рвоту и желтуху, но могут возникать неврологические, респираторные, сердечные и глазные проблемы.
Лечение и профилактика: Антибиотики и противовоспалительные средства используются для лечения лептоспироза. В настоящее время нет вакцины против лептоспироза для человека, но есть вакцина для лошадей.
- Бешенство — Бешенство, смертельно опасное заболевание, распространенное во всем мире, вызывается вирусом бешенства.
 Все млекопитающие восприимчивы к бешенству, но у лошадей оно относительно редкое: ежегодно регистрируется менее 100 случаев.
Все млекопитающие восприимчивы к бешенству, но у лошадей оно относительно редкое: ежегодно регистрируется менее 100 случаев.
Лошади: Клинические признаки у лошадей включают некоординированные движения (атаксия), частичный паралич (парез) задних конечностей, желание лечь, хромоту, затрудненное дыхание, колики, повышенную чувствительность к свету и звуку и лихорадку. Большинство лошадей умирают от сердечно-дыхательной недостаточности в течение 2-5 дней, но в некоторых случаях это может занять до 2 недель.
Передача: Вирус обнаруживается в слюне животных. Бешенство может передаваться от лошадей к человеку через укус или контакт инфицированной слюны с глазами, носом или ртом или через поврежденную кожу.
Люди: Симптомы у людей включают лихорадку, головную боль, зуд в месте заражения и боль. Инфицированные люди могут стать гипервозбудимыми или страдать генерализованным параличом, а смерть наступает в течение 2-10 дней. В редких случаях у выживших могут возникнуть тяжелые неврологические расстройства.
Лечение и профилактика: От бешенства у лошадей лечения не существует. Людям, которые думают, что их могло укусить бешеное животное, делают серию прививок, чтобы предотвратить заражение. Эффективного лечения после установления инфекции не существует. Вакцины против бешенства доступны для лошадей и людей. Бешенство является зарегистрированным заболеванием в Соединенных Штатах; о подозрительных случаях следует сообщать немедленно.
Кроме того, те, кто импортирует лошадей и/или выезжает в другие страны для работы и деятельности, связанной с лошадьми, должны принимать меры предосторожности в отношении:
- Сибирская язва — Сибирская язва вызывается бактерией Bacillus anthracis , которая может сохраняться в почве десятилетиями. Бактерии производят токсин, который разрушает клетки инфицированных тканей. Бактериальные споры исторически использовались в качестве оружия (в аэрозольной форме) и считаются возможными агентами биологической атаки или биотерроризма.

Лошади: Клинические признаки сибирской язвы у лошадей различаются в зависимости от того, проглотила ли лошадь бактерии или заразилась через укус насекомого. Лихорадка, потеря аппетита, воспаление тонкого кишечника (энтерит), колики и кровавый понос могут возникнуть, если лошадь проглотит бактерии. Смерть обычно наступает через 2-4 дня. В случаях, когда сибирская язва заносится через укус насекомого, клинические признаки включают опухоль в месте укуса, а также на шее, груди, животе и половых органах.
Передача: Болезнь может передаваться от лошадей к человеку при обращении с инфицированными животными.
Люди: У людей сибирская язва может быть кожной, ингаляционной или желудочно-кишечной. Кожная форма является наиболее распространенной (и такой тип может передаваться от лошадей). Эта форма возникает, когда бактерии попадают в организм через порезы или ссадины на коже. На коже рук, кистей, лица и шеи в течение 2-3 дней появляются очаги с черным центром. Смерть наступает редко при соответствующем лечении антибиотиками.
Смерть наступает редко при соответствующем лечении антибиотиками.
Лечение и профилактика: Своевременное лечение антибиотиками необходимо для успешного исхода у обоих видов. Хотя вакцина для человека доступна, вакцинация не рекомендуется для обычного человека, поскольку вакцина недоступна, а риск заражения в Соединенных Штатах считается низким. Вакцина доступна для лошадей, но, как правило, рекомендуется только для лошадей в районах, о которых известно, что они заражены. Сибирская язва является регистрируемым заболеванием в Соединенных Штатах; необходимо немедленно связаться с соответствующим агентством.
- Сап — Бактерии Burkholderia mallei вызывают сап, и для большинства видов инфекция приводит к летальному исходу.
Лошади: Инфекция у лошадей может привести к гнойным поражениям кожи и респираторным инфекциям. Источником инфекции являются выделения из носа и кожи инфицированных непарнокопытных. Считается, что основным путем заражения является употребление пищи или воды, зараженных B. mallei , хотя возможны вдыхание и попадание на кожу. Зараженное оборудование, снаряжение и одежда также могут передавать бактерии. Некоторые инфицированные лошади не проявляют никаких симптомов, но могут служить источником инфекции, выделяя B. mallei периодически или постоянно.
mallei , хотя возможны вдыхание и попадание на кожу. Зараженное оборудование, снаряжение и одежда также могут передавать бактерии. Некоторые инфицированные лошади не проявляют никаких симптомов, но могут служить источником инфекции, выделяя B. mallei периодически или постоянно.
Передача: Люди могут заразиться при прямом контакте с инфицированными животными.
Люди: Симптомы у человека включают лихорадку, мышечную боль, боль в груди, чувствительность к свету и головную боль. Если бактерии попадают в кровоток, инфекция без лечения может привести к летальному исходу.
Лечение и профилактика: Антибиотики используются для лечения сапа у людей. Случаи болезни лошадей не лечат в Соединенных Штатах. Поскольку она заразна и может привести к летальному исходу для человека, эта бактерия считается потенциальным агентом биотерроризма (биологический агент уровня 1). Сап считается чужеродным заболеванием животных, которого в настоящее время нет в Соединенных Штатах.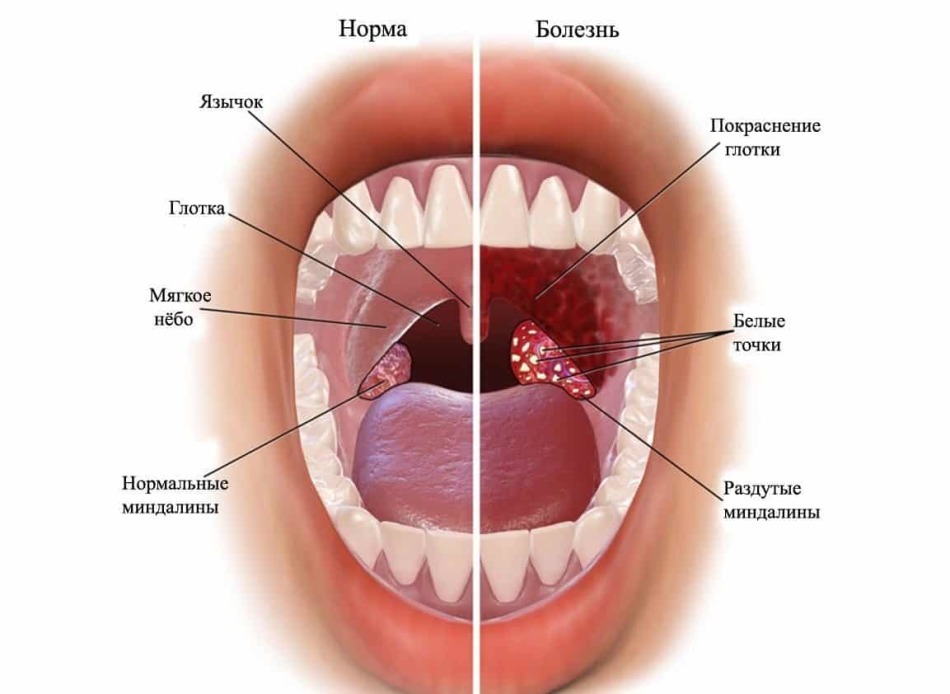 Все лошади, ввозимые в США, проверяются на наличие сапа, чтобы предотвратить занесение болезни. Сап — это регистрируемое заболевание в Соединенных Штатах; о подозрительных случаях следует сообщать немедленно.
Все лошади, ввозимые в США, проверяются на наличие сапа, чтобы предотвратить занесение болезни. Сап — это регистрируемое заболевание в Соединенных Штатах; о подозрительных случаях следует сообщать немедленно.
- Везикулярный стоматит — Это заболевание вызывается вирусом везикулярного стоматита.
Лошади: Везикулярный стоматит вызывает поражения и волдыри на языке, рту, носу и губах у лошадей. Другие клинические признаки включают слюнотечение или пену изо рта, вялость, лихорадку и потерю аппетита. Смертность редка. Лошади обычно выздоравливают в течение двух недель, но вспышки могут иметь серьезные финансовые последствия для коневодческой отрасли. Везикулярный стоматит зарегистрирован во всем мире, при этом большинство вспышек у лошадей в США ограничивается западными штатами.
Передача: Передача человеку может происходить при прямом контакте с пятнами или слюной инфицированных лошадей.
Люди: Симптомы у людей напоминают грипп и включают лихорадку, озноб, тошноту, рвоту и головную боль. Во рту и горле у взрослых могут образовываться поражения, а у детей может развиться энцефалит, хотя это бывает редко.
Во рту и горле у взрослых могут образовываться поражения, а у детей может развиться энцефалит, хотя это бывает редко.
Лечение и профилактика: У лошадей лечение ограничивается поддерживающей терапией и противовоспалительными препаратами. Хотя вакцины доступны для некоторых видов домашнего скота в некоторых странах, в настоящее время нет вакцин против везикулярного стоматита лошадей или человека. Везикулярный стоматит является регистрируемым заболеванием в Соединенных Штатах; о подозрительных случаях следует сообщать немедленно.
Объекты, в которых размещаются лошади с домашним скотом, должны также принимать соответствующие меры предосторожности, чтобы избежать:
- Бруцеллез — Большинство случаев бруцеллеза у лошадей вызывается бактериями Brucella abortus , которые также являются причиной заболевания у лошадей. крупный рогатый скот. Возможно, неудивительно, что случаи бруцеллеза у лошадей обычно возникают у лошадей, содержащихся вместе с крупным рогатым скотом.

Лошади: Лошади заражаются бактериями при проглатывании, вдыхании или контакте с ссадинами на коже. У лошадей бруцеллез, называемый «затылочной болезнью» или «свищевой холкой», вызывает болезненные отеки у основания шеи и по бокам холки, что может привести к абсцессам. Суставы также могут опухать, и сообщалось о репродуктивных проблемах, включая аборты.
Передача: B. abortus может передаваться от лошадей человеку при контакте с зараженными биологическими жидкостями, тканями или трупами, хотя задокументированные случаи передачи редки.
Люди: У людей заболевание может имитировать многие другие инфекционные и неинфекционные заболевания. Симптомы включают лихорадку, анорексию, головную боль, боль в спине, боль в суставах и потерю веса. Даже без лечения большинство пациентов выздоравливают в течение 3 недель.
Лечение и профилактика: Лечение лошадей состоит из антибиотиков широкого спектра действия и дренирования абсцессов. В тяжелых случаях может потребоваться хирургическое вмешательство. Несмотря на то, что бруцеллез зарегистрирован во всем мире, он был ликвидирован во многих странах, поэтому инфекции встречаются редко. Бруцеллез является регистрируемым заболеванием в Соединенных Штатах; о подозрительных случаях необходимо сообщать в течение 48 часов.
В тяжелых случаях может потребоваться хирургическое вмешательство. Несмотря на то, что бруцеллез зарегистрирован во всем мире, он был ликвидирован во многих странах, поэтому инфекции встречаются редко. Бруцеллез является регистрируемым заболеванием в Соединенных Штатах; о подозрительных случаях необходимо сообщать в течение 48 часов.
Ветеринары, ветеринарные техники, менеджеры по разведению и другие лица, которые с большей вероятностью вступят в контакт с инфицированными животными, должны принять меры предосторожности, чтобы защитить себя от:
- MRSA (метициллин-резистентные штаммы Staphylococcus aureus ) — Хотя Staphylococcus aureus часто не вызывает проблем у людей или животных, устойчивые к антибиотикам формы трудно поддаются лечению. Метициллин-резистентные штаммы Staphylococcus aureus устойчивы к антибиотикам, которые часто используются для лечения инфекций Staphylococcus .
Лошади: У лошадей могут возникать инфекции кожи, мягких тканей, суставов и области хирургического вмешательства. Клинические признаки могут включать раны или участки хирургического вмешательства, которые выделяют гной и не заживают. Некоторые лошади являются переносчиками MRSA без каких-либо клинических признаков, но они все же могут передавать бактерии людям и другим лошадям.
Клинические признаки могут включать раны или участки хирургического вмешательства, которые выделяют гной и не заживают. Некоторые лошади являются переносчиками MRSA без каких-либо клинических признаков, но они все же могут передавать бактерии людям и другим лошадям.
Передача: Люди могут заразиться MRSA от лошадей при прямом контакте с инфицированными животными, особенно при прямом контакте руки-к-носу.
Люди: Инфекции MRSA у людей часто проявляются в виде красной сыпи или кожных фурункулов. Симптомы могут также включать лихорадку.
Лечение и профилактика: Большинство инфекций MRSA можно эффективно лечить антибиотиками при ранней диагностике. Здоровые лошади могут быть переносчиками MRSA, и известно, что это часто встречается у людей, работающих с лошадьми, таких как ветеринары. Это означает, что практически невозможно устранить воздействие MRSA на людей или лошадей.
- Rhodococcus equi инфекции — Rhodococcus equi – это бактерия, живущая в почве и вызывающая пневмонию у молодых (в возрасте от 1 до 6 месяцев) жеребят.
 В редких случаях могут заразиться взрослые лошади и люди с иммунодефицитом. Распространенность заболевания варьируется, но R. equi можно обнаружить на большинстве конных ферм по всему миру.
В редких случаях могут заразиться взрослые лошади и люди с иммунодефицитом. Распространенность заболевания варьируется, но R. equi можно обнаружить на большинстве конных ферм по всему миру.
Жеребята могут вдыхать R. equi или проглатывать зараженную почву.
Лошади: Жеребенок может вдыхать переносимые по воздуху бактерии в дыхательные пути или проглатывать зараженную почву. К сожалению, жеребята часто не проявляют признаков до тех пор, пока болезнь не станет тяжелой. Клинические признаки могут включать лихорадку, затрудненное дыхание, кашель и депрессию.
Передача: Поскольку R. equi обитает в почве, его можно вдыхать с пылью на фермах или попадать в организм через поврежденную кожу. Бактерии также могут передаваться при контакте с инфицированными жеребятами.
Люди: У людей с ослабленным иммунитетом R. equi может вызывать инфекцию легких, которая приводит к образованию абсцессов. Смертность может достигать 50%. У людей со здоровой иммунной системой инфекции могут поражать лишь небольшую часть тела и обычно связаны с ранами.
У людей со здоровой иммунной системой инфекции могут поражать лишь небольшую часть тела и обычно связаны с ранами.
Лечение и профилактика: Антибиотики можно использовать для лечения инфекции у лошадей, но они также могут привести к потенциально серьезным побочным эффектам. Доступных вакцин нет. Раннее выявление у жеребят с помощью анализа крови, ультразвукового скрининга и лечения антибиотиками по мере необходимости в настоящее время является лучшим подходом для обеспечения успешного результата. У людей для лечения инфекции может использоваться комбинация антибиотиков с хирургическим вмешательством для дренирования больших абсцессов в некоторых случаях.
3 Наиболее распространенные стоматологические заболевания у кошек
Home / Gaia Toast / 3 наиболее распространенных стоматологических заболевания у кошек
Стоматологические заболевания, скрытые на виду, подобны бомбам замедленного действия, которые могут причинить вашей кошке сильную боль и значительную вмятину на вашем кошельке, если их не лечить.
 Так что действительно стоит знать симптомы и как предотвратить их развитие.
Так что действительно стоит знать симптомы и как предотвратить их развитие. Вот три наиболее распространенных стоматологических заболевания у кошек:
-
Пародонтит (инфекция десен)
-
Стоматит (воспаление и изъязвление тканей полости рта, например, десен, щек и языка)
-
Резорбция зубов (Спонтанное разрушение тканей зуба)
На диаграмме показаны области, где обычно начинается и развивается каждая стоматологическая инфекция. В частности, периодонтит начинается на линии десны, но распространяется глубже, в то время как резорбция зуба обычно происходит ниже линии десны, то есть в области корня.
Вот краткое описание каждого заболевания и того, на что следует обратить внимание:
1) Пародонтит
(также известный как серьезная инфекция десен)
Что его вызывает?
Частицы пищи, оставшиеся после еды, и бактерии накапливаются, образуя зубной налет вдоль линии десен.
 Зубной налет превращается в зубной камень, который раздражает десны, вызывая воспаление (или гингивит). Со временем зубной камень накапливается и начинает отделять десны от зубов, создавая пространства под зубами, где могут размножаться бактерии. Эти бактерии в конечном итоге разрушаются и разъедают структуры зуба.
Зубной налет превращается в зубной камень, который раздражает десны, вызывая воспаление (или гингивит). Со временем зубной камень накапливается и начинает отделять десны от зубов, создавая пространства под зубами, где могут размножаться бактерии. Эти бактерии в конечном итоге разрушаются и разъедают структуры зуба. Что за знаки?
*Примечание. Для полной диагностики, чтобы проверить, насколько далеко зашла инфекция, ветеринару потребуется ввести кошке анестезию и сделать рентген ротовой полости.
Что самое худшее может случиться?
Если не лечить, тяжелый периодонтит может привести к потере зубов, десен и кости, что очень болезненно. Вашей кошке может потребоваться операция по удалению гнилых зубов и пораженных тканей. Пародонтит также может вызвать развитие стоматита (см. ниже).
Как это предотвратить?
Регулярная чистка зубов и десен после еды и ежегодные профилактические осмотры.
 Другими словами, вы не можете оставить свою кошку на произвол судьбы, когда дело доходит до ее зубов.
Другими словами, вы не можете оставить свою кошку на произвол судьбы, когда дело доходит до ее зубов. «Вы не можете полагаться на зубные лакомства для чистки зубов вашей кошки. Регулярная и правильная чистка зубов по-прежнему остается самой эффективной профилактической мерой». — Доктор Клэр Тан, главный ветеринарный врач, Gaia Vets
Знаете ли вы, что пародонтит настолько распространен, что к 3 годам у большинства кошек в той или иной степени проявляется эта инфекция? Симптомы также довольно незаметны для раннего обнаружения, и если вы дождетесь некоторых из упомянутых выше признаков, инфекция может быть уже довольно запущенной и дорогостоящей для лечения.
2) Стоматит
(также известный как воспаление и изъязвление тканей)
Чем это вызвано?
Причины еще полностью не выяснены, но предполагается, что это вызвано тем, что собственная иммунная система кошки атакует собственные ткани полости рта в результате ненормальной реакции на бактерии во рту.
 Многие кошки, у которых развивается стоматит, также инфицированы определенными вирусами или бактериями, такими как вирус кошачьего иммунодефицита (FIV), кошачий каливирус, вирус кошачьего герпеса и т. д. Пародонтит также может вызывать развитие стоматита.
Многие кошки, у которых развивается стоматит, также инфицированы определенными вирусами или бактериями, такими как вирус кошачьего иммунодефицита (FIV), кошачий каливирус, вирус кошачьего герпеса и т. д. Пародонтит также может вызывать развитие стоматита. Что за знаки?
*Примечание. Ваш ветеринар может провести анализ крови, чтобы проверить наличие инфекций, которые могут вызвать стоматит.
Что самое худшее может случиться?
Стоматит очень болезненный, и ваша кошка не может нормально есть. Подобно пародонтиту, вашей кошке может потребоваться анестезия и удаление зубов в тяжелых случаях.
Как это предотвратить?
Поскольку пародонтит может вызвать стоматит, регулярная чистка зубов и десен после еды предотвратит его развитие. Также поможет соблюдение графика вакцинации вашей кошки, чтобы защитить ее от вирусов, которые могут вызвать стоматит.
3) Резорбция зуба
(также известная как разрушение структуры зуба)
Чем это вызвано?
Точные причины этого заболевания неизвестны, но тело кошки, по-видимому, резорбирует дентин, ключевую структуру зуба.
 Он начинается как полость, то есть отверстие в зубной эмали, которое увеличивается до тех пор, пока не будет разрушен весь зуб. Это приводит к расшатыванию зуба и обнажению корня (где находятся все кровеносные сосуды и нервы).
Он начинается как полость, то есть отверстие в зубной эмали, которое увеличивается до тех пор, пока не будет разрушен весь зуб. Это приводит к расшатыванию зуба и обнажению корня (где находятся все кровеносные сосуды и нервы).
Породы кошек, такие как персидские, подвержены более высокому риску резорбции зубов.
Все кошки могут страдать от резорбции зубов, но риск увеличивается с возрастом кошек и у некоторых пород, таких как персы и сиамы.
Какие знаки?
-
Нежелание касаться области рта из-за боли
-
Нежелание жевать
-
Обильное слюнотечение, иногда с примесью крови
- 0364 Зубы стучат во время еды или питья
*Примечание. Чтобы выяснить, какие зубы поражены резорбцией, ветеринару потребуется ввести кошке анестезию и сделать рентген рта.
Что самое худшее может случиться?
Необходимо удалить сильные боли из-за обнаженных корней и пораженных зубов вашей кошки.

 д)
д)