Строение слизистой оболочки полости рта. Понятие о податливости и подвижности слизистой оболочки.
Слизистая оболочка рта в отличие от других слизистых оболочек организма человека имеет ряд особенностей. Она устойчива к воздействию физических, химических раздражителей, а также к внедрению инфекций. Регенераторная способность повышена. Эти свойства в определенной степени обусловлены ее строением.
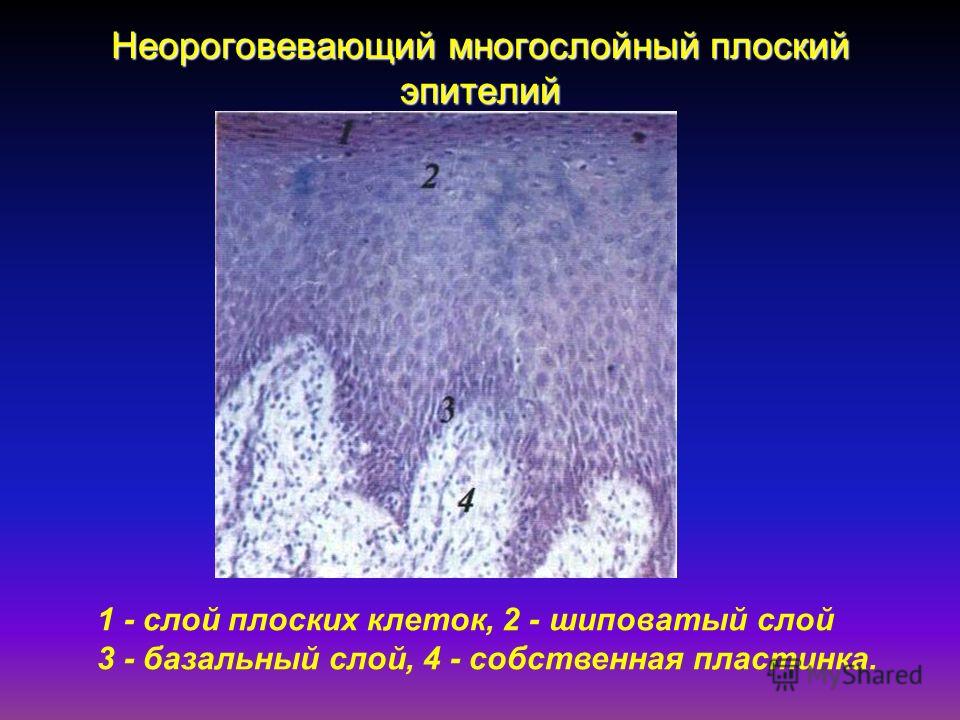
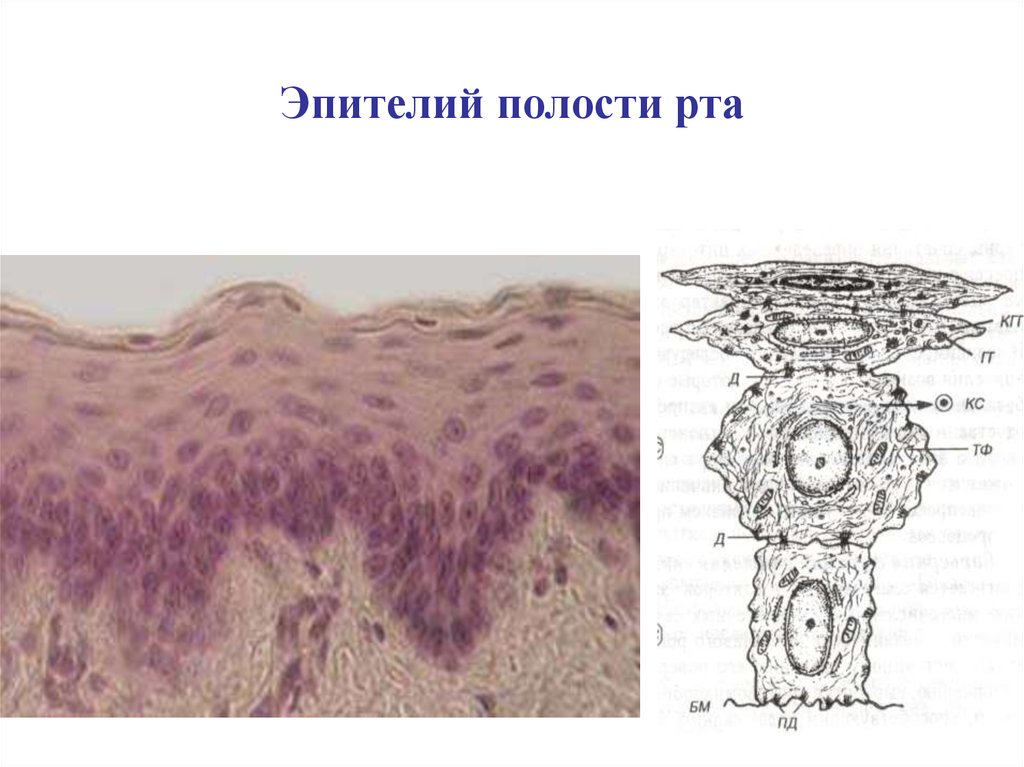
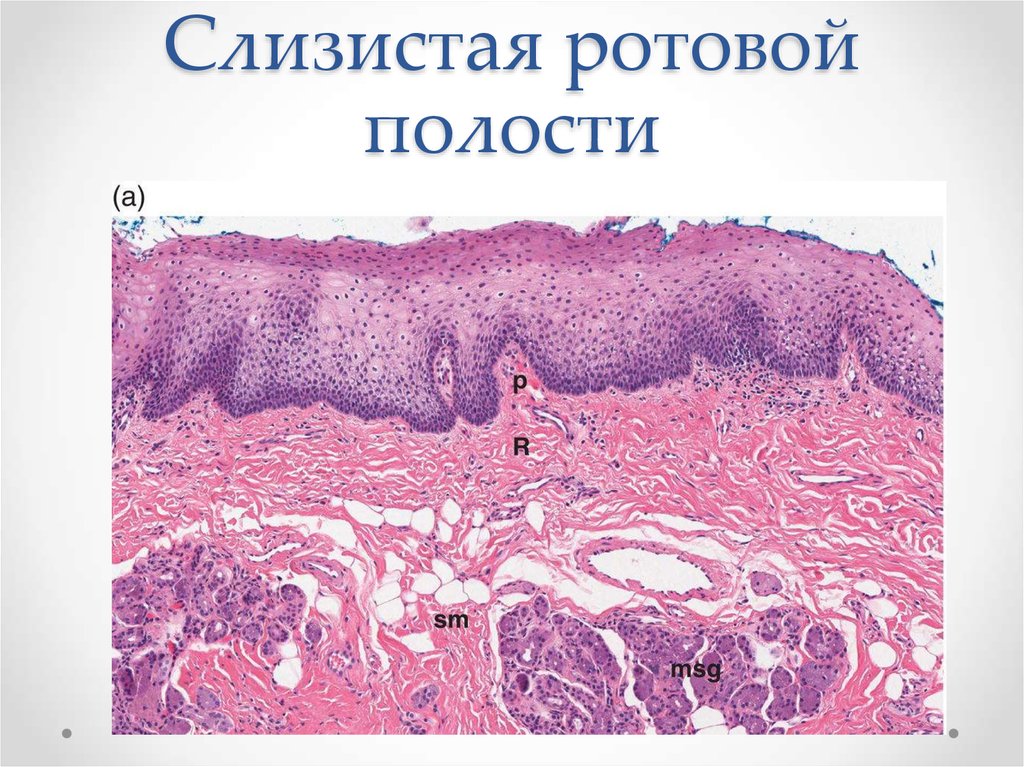
На всем протяжении слизистая оболочка полости рта выстлана многослойным плоским эпителием, состоящим из нескольких слоев клеток. Под ним располагаются базальная мембрана, собственно слизистая оболочка и подслизистый слой. Соотношение этих слоев на различных участках полости рта неодинаково. Твердое нёбо, язык, десна, которые подвергаются наиболее сильному давлению во время приема пищи, имеют более мощный эпителий. Губы, щеки обладают хорошо выраженной собственной пластинкой; а дно полости рта и переходные складки — преимущественно развитой подслизистой основой. Эпителий непосредственно обращен в полость рта и вследствие слущивания верхнего слоя подвергается постоянному обновлению. В некоторых участках эпителий способен ороговевать в результате механических, физических и химических воздействий. Наиболее сильно процесс ороговения выраженна твердом нёбе, языке и деснах и представлен несколькими рядами безъядерных клеток. К нему примыкает зернистый слой. Клетки этого слоя вытянуты и содержат в своей цитоплазме зерна кератогиалина. Этот слой бывает только там, где выражен процесс ороговения. В области щек, губ, дна полости рта, переходных складок, в десневой борозде и нижней поверхности языка в норме ороговения не наблюдается. Здесь поверхность образована уплощенными клетками. К ним примыкают несколько рядов шиповидных клеток полигональной формы, плотно соединенных друг с другом.
В некоторых участках эпителий способен ороговевать в результате механических, физических и химических воздействий. Наиболее сильно процесс ороговения выраженна твердом нёбе, языке и деснах и представлен несколькими рядами безъядерных клеток. К нему примыкает зернистый слой. Клетки этого слоя вытянуты и содержат в своей цитоплазме зерна кератогиалина. Этот слой бывает только там, где выражен процесс ороговения. В области щек, губ, дна полости рта, переходных складок, в десневой борозде и нижней поверхности языка в норме ороговения не наблюдается. Здесь поверхность образована уплощенными клетками. К ним примыкают несколько рядов шиповидных клеток полигональной формы, плотно соединенных друг с другом.
Самым глубоким слоем эпителия является ростковый, образованный клетками цилиндрической формы. Они располагаются в один ряд на базальной мембране, поэтому называются базальным слоем. Базальные клетки содержат округлое ядро с ядрышком и цитоплазму с многочисленными митохондриями. Кроме цилиндрических клеток в базальном слое встречаются клетки звездчатой формы с длинными отростками — клетки Лангерганса.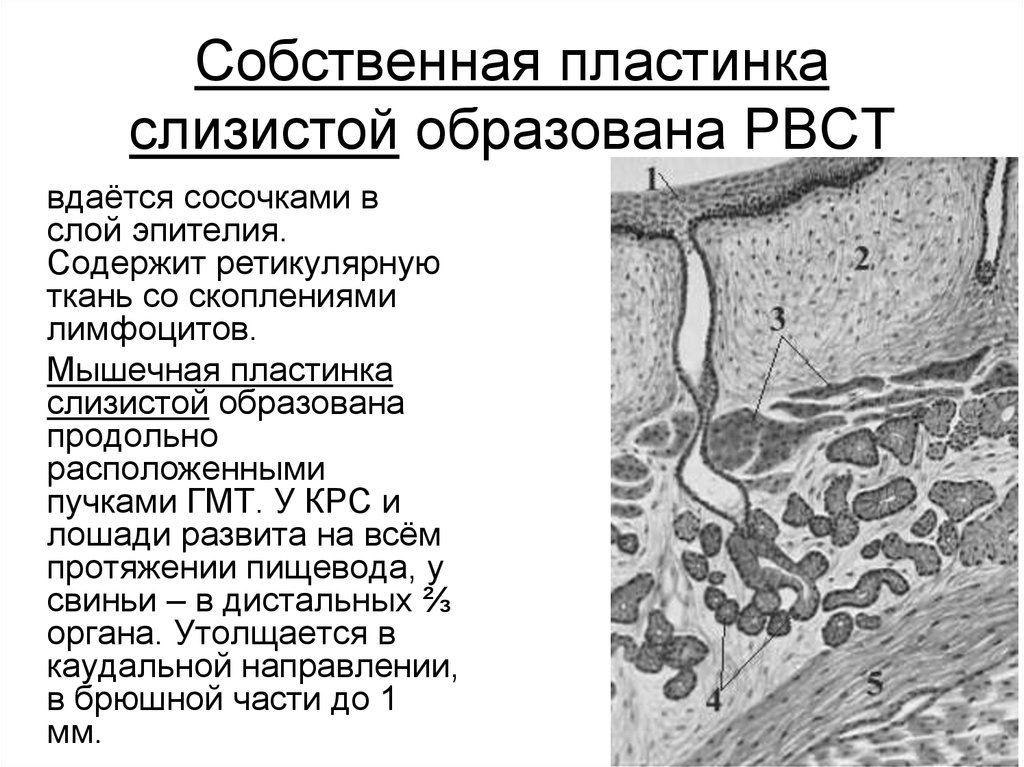 Они выявляются только с помощью импрегнации серебром. Регенерация эпителия происходит за счет росткового слоя. Базальная мембрана образована густым сплетением тонких аргирофильных волокон и является связующим звеном между эпителием и собственной пластинкой слизистой оболочки.
Они выявляются только с помощью импрегнации серебром. Регенерация эпителия происходит за счет росткового слоя. Базальная мембрана образована густым сплетением тонких аргирофильных волокон и является связующим звеном между эпителием и собственной пластинкой слизистой оболочки.
Собственно слизистая оболочка состоит из соединительной ткани, представленной основным веществом, волокнистыми структурами и клеточными элементами. Этот слой в виде сосочков волнообразно вдается в эпителиальный слой. Здесь располагаются капиллярная сеть, нервные сплетения и лимфатические сосуды. Защитная функция соединительной ткани заключается в создании механического барьера. В этой связи для нормального состояния соединительной ткани важное значение имеет субстратферментная система: гиалуроновая кислота основного вещества — гиалуронидаза. При увеличении количества тканевой или микробной гиалуронидазы происходит деполимеризация гиалуроновой кислоты, в результате чего увеличивается проницаемость соединительной ткани.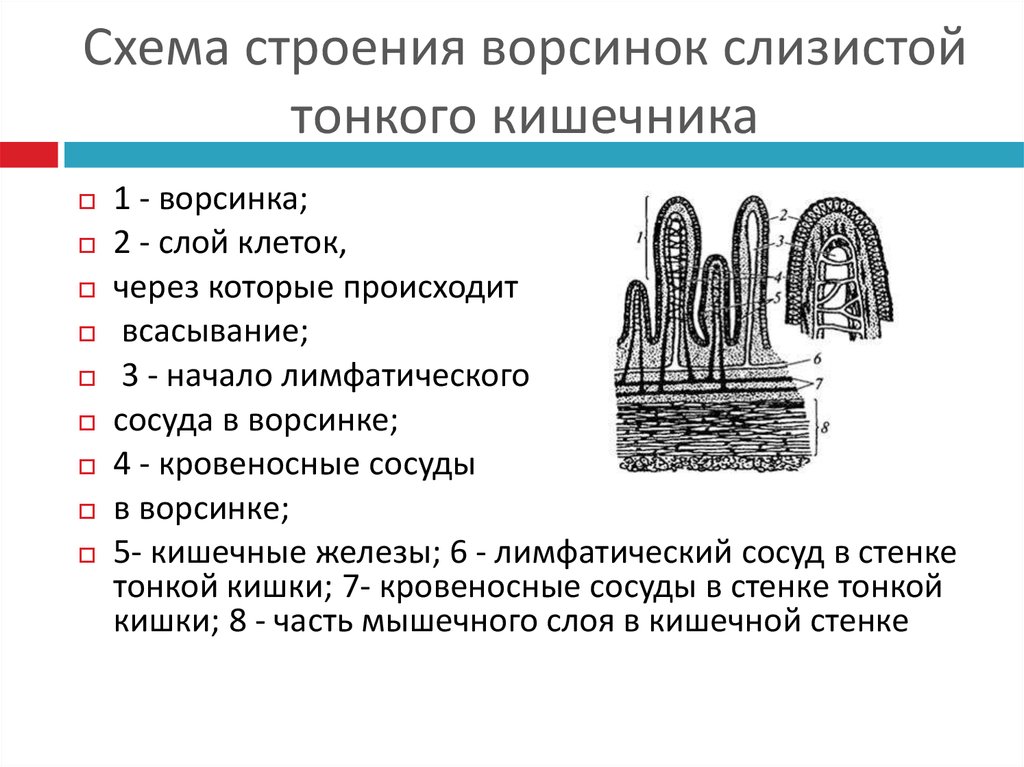
Волокнистые структуры представлены коллагеновыми и аргирофильными волокнами. Наибольшее количество коллагеновых волокон располагается в слизистой оболочке десны и твердого нёба.
Клеточные элементы собственной пластинки слизистой представлены в основном фибробластами, макрофагами, тучными клетками, плазматическими, гистиоцитами (оседлые макрофаги).
Фибробласты — главная клеточная форма соединительной ткани. Они выделяют преколлаген, проэлластин и др.
Макрофаги выполняют защитную функцию. Они фагоцитируют инородные частицы бактерий, погибшие клетки, активно участвуют в воспалительных и иммунных реакциях. При воспалении гистиоциты превращаются в макрофаги, а после воспаления вновь в покоящиеся клеточные формы.
Тучные клетки — функциональные клетки соединительной ткани — характеризуются наличием в протоплазме гранул. Чаще они локализуются вдоль сосудов. Этих клеток больше в области слизистой губ и щек, меньше — в области языка, твердого нёба, десен, т.е. их меньше там, где эпителий ороговевает. Тучные клетки служат носителями биологически активных веществ, являющихся пусковыми механизмами при воспалении: гепарина и гистамина. Они регулируют проницаемость сосудов, участвуют в процессе аллергических реакций. Плазматические клетки осуществляют защитные, иммунологические процессы слизистой оболочки, содержат в большом количестве РНК. Образуются под действием антигена из Р-лимфоцитов. Вырабатывают иммуноглобулины.
Тучные клетки служат носителями биологически активных веществ, являющихся пусковыми механизмами при воспалении: гепарина и гистамина. Они регулируют проницаемость сосудов, участвуют в процессе аллергических реакций. Плазматические клетки осуществляют защитные, иммунологические процессы слизистой оболочки, содержат в большом количестве РНК. Образуются под действием антигена из Р-лимфоцитов. Вырабатывают иммуноглобулины.
При возникновении патологических процессов в слизистой оболочке полости рта появляются сегментоядерные лейкоциты, лимфоциты.Гистиоциты могут трансформироваться в эпителиоидные клетки, которые, в свою очередь, могут образовывать гигантские клетки. Эпителиоидные клетки выявляются при специфических заболеваниях слизистой оболочки и кандидозе.
Подслизистый слой представлен рыхлой соединительной тканью. В слизистой оболочке языка, десен и частично твердого нёба подслизистая основа отсутствует, а в области дна полости рта, переходных складок губ, щек — хорошо выражена.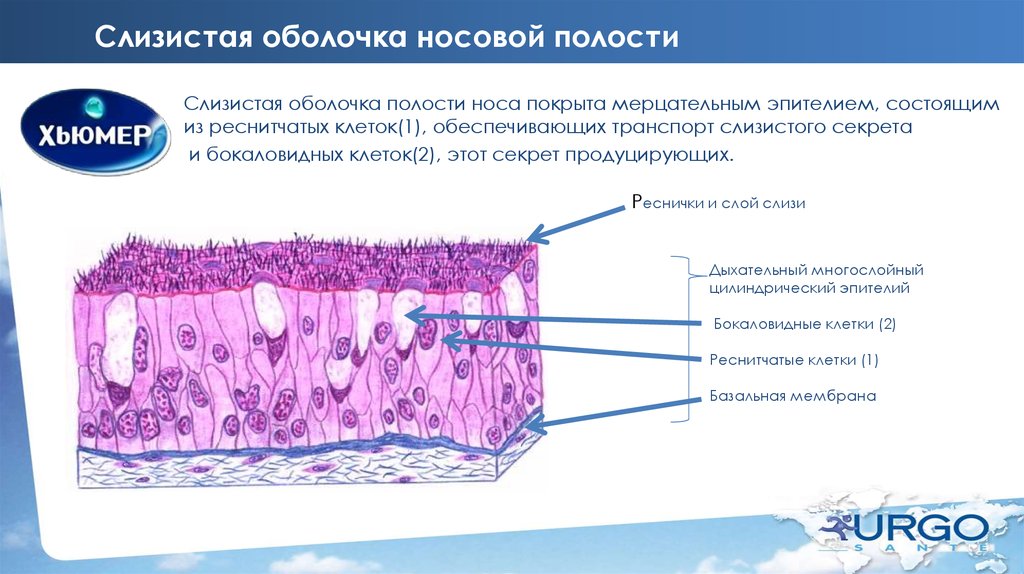 В этом слое располагается большое количество мелких сосудов, малые слюнные железы и сальные железы Фордайса. От степени выраженности подслизистого слоя зависит подвижность слизистой оболочки полости рта (кроме языка, где подвижность обусловлена мышцами).
В этом слое располагается большое количество мелких сосудов, малые слюнные железы и сальные железы Фордайса. От степени выраженности подслизистого слоя зависит подвижность слизистой оболочки полости рта (кроме языка, где подвижность обусловлена мышцами).
Ткани полости рта, губ, зубов и передних 2/3 языка иннервирует тройничный нерв (периферические отростки нервных клеток Гассерова узла). С передних 2/3 языка вкусовую чувствительность воспринимает лицевой нерв (7-я пара).
Чувствительным нервом задней 1/3 языка является языкоглоточный нерв (9-я пара). Симпатические волокна проникают вдоль артерий из верхнего шейного узла. Они влияют на кровоснабжение слизистой оболочки и на секрецию слюнных желез.
Особенности строения слизистой оболочки рта Губа ограничена с одной стороны слизистой оболочкой, а снаружи — кожей.
Красная кайма является переходной зоной между ними. Место перехода красной каймы губы в слизистую полости рта называют зоной Клейна.
Щека со стороны полости рта выстлана неороговевающим эпителием. По линии смыкания зубов эпителий иногда проявляет тенденцию к ороговению. Собственно слизистая оболочка содержит большое количество эластичных волокон.
По линии смыкания зубов эпителий иногда проявляет тенденцию к ороговению. Собственно слизистая оболочка содержит большое количество эластичных волокон.
Десна выстлана эпителием, склонным к ороговению, за исключением эпителия десневой борозды, где он более тонкий и в норме никогда не ороговевает. Эпителий десневой борозды называется бороздковым или сулькулярным. Место прикрепления эпителия к кристаллам апатита эмали называется эпителиальным прикреплением, а эпителий в этом участке — соединительным. Эпителий десневой борозды продолжается в соединительный эпителий. Дно полости рта и переходные складки щек и губ выстланы неороговевающим эпителием. Хорошо
выражена подслизистая основа. Слизистая оболочка легко собирается в складки. В ее толще заложено большое количество мелких слюнных желез.
Мягкое нёбо представляет собой мышечное образование с поперечно-полосатыми волокнами. Оральный, или передний, отдел выстлан многослойным плоским неороговевающим эпителием. Твердое нёбо покрыто многослойным плоским эпителием, проявляющим тенденцию к ороговению.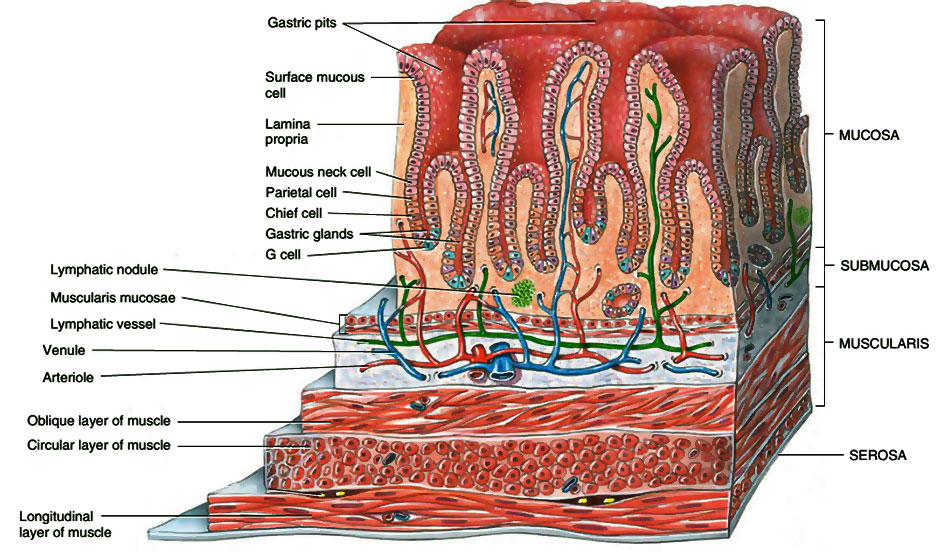 Язык представляет собой мышечный орган. Он покрыт многослойным плоским ороговевающим эпителием. Подслизистый слой отсутствует.
Язык представляет собой мышечный орган. Он покрыт многослойным плоским ороговевающим эпителием. Подслизистый слой отсутствует.
Нитевидные сосочки покрывают всю поверхность спинки языка. Они вытянутой формы, не содержат вкусовых луковиц.
Листовидные сосочки располагаются по боковым поверхностям языка в задних отделах в виде складок в количестве 8—15. В покровном эпителии заложены вкусовые луковицы.
Грибовидные сосочки располагаются среди нитевидных в области кончика языка в виде красных точек. Они покрыты тонким слоем неороговевающего эпителия, в котором находятся вкусовые луковицы.
Желобоватые сосочки — самые крупные сосочки языка — располагаются в виде римской цифры V ближе к корню и окружены валиком и бороздкой. В стенках желобоватых сосочков имеется большое количество вкусовых луковиц.
Рыхлая, податливая слизистая.Встречается у гиперстеников, у больных с общими соматическими заболеваниями (сахарный диабет, заболевания ССС и др.). 4. Подвижная слизистая оболочка. Встречается у больных с заболеваниями пародонта, наблюдается при атрофии альвеолярного отростка и подлежащей кости в результате повышенного давления съемного протеза, т.е. у пациентов, которые ранее были протезированы съемными протезами с давлением на слизистую оболочку.
Встречается у больных с заболеваниями пародонта, наблюдается при атрофии альвеолярного отростка и подлежащей кости в результате повышенного давления съемного протеза, т.е. у пациентов, которые ранее были протезированы съемными протезами с давлением на слизистую оболочку.
Различают подвижную и неподвижную слизистую оболочку. Подвижная слизистая оболочка покрывает щеки, губы, дно полости рта. Она имеет рыхлый подслизистый слой соединительной ткани и легко собирается в складку. При сокращении окружающей мускулатуры такая слизистая оболочка смещается. Степень подвижности ее колеблется в значительных пределах (от большой до незначительной).
Неподвижная слизистая оболочка лишена подслизистого слоя и лежит на надкостнице, отделенная от нее тонкой прослойкой фиброзной соединительной ткани. Типичными местами расположения ее являются альвеолярные отростки, область сагиттального шва и небного валика. Лишь под давлением протеза выявляется податливость неподвижной слизистой оболочки в направлении к кости.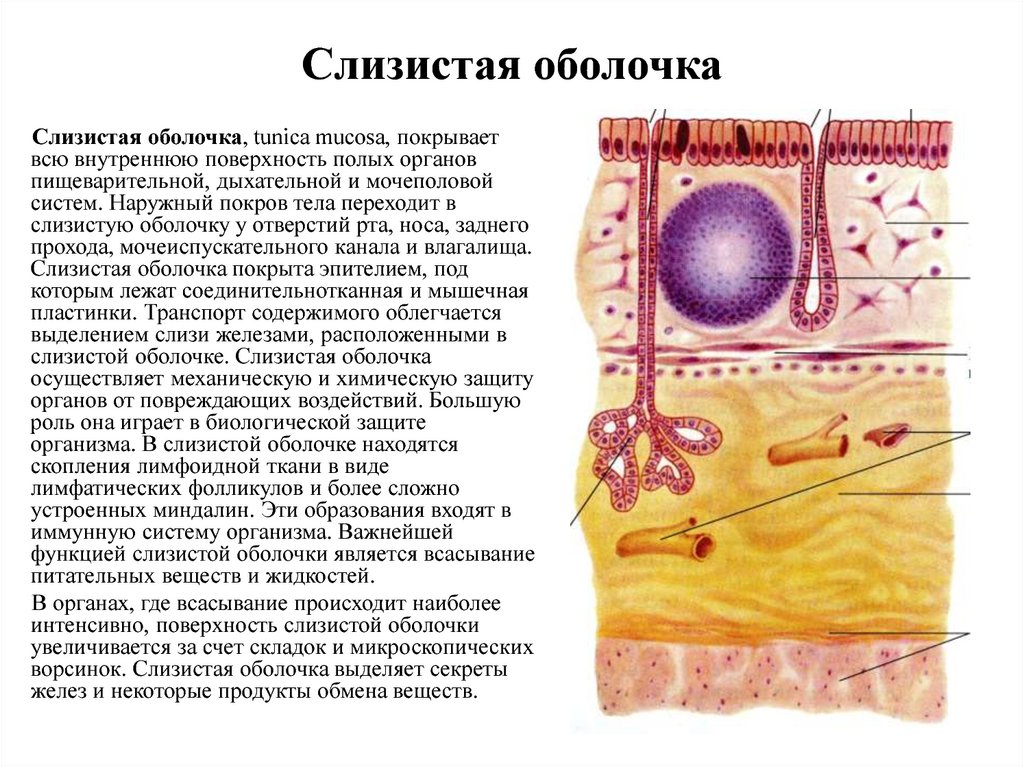 Эта податливость определяется наличием сосудов в толще соединительной прослойки.
Эта податливость определяется наличием сосудов в толще соединительной прослойки.
Височно-нижнечелюстной сустав – это парное сочленение, образованное нижнечелюстной и височной костями. Правое и левое сочленение физиологически образуют единую систему, движения в них совершаются одновременно. Височнонижнечелюстной сустав состоит из следующих элементов: головка нижней челюсти, нижнечелюстная ямка, суставной бугорок, суставной диск, капсула и связки.
Суставная головка – костное образование эллипсоидной формы на конце мыщелковых отростков нижней челюсти. Состоит из тонкого слоя компактной кости, сбоку покрытой волокнистым хрящом, а снизу губчатой костью. Головка удлинена в поперечном направлении, сужена в сагиттальном.
Нижнечелюстная ямка височной кости спереди отграничивается суставным бугорком, сзади проходит по переднему краю каменистобарабанной щели височной кости, латерально – ограничена скуловым отростком. Каменистобарабанная щель делит ямку на две примерно равные части: переднюю (интракапсулярную) и заднюю (экстракапсулярную).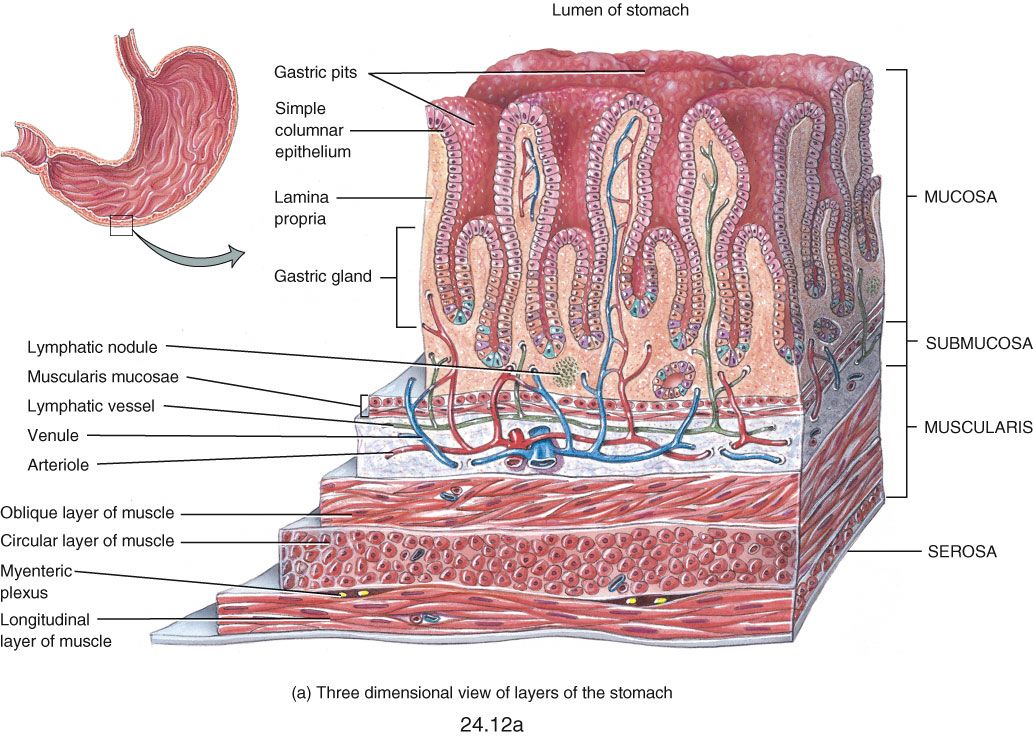 Передняя часть ямки представлена плотной костной тканью, покрытой хрящом. Задняя часть – лишь тонкой костью, отделяющей суставную ямку от среднего и внутреннего уха, что способствует переходу воспалительных процессов уха на элементы височнонижнечелюстного сустава. Размеры нижнечелюстной ямки височной кости больше суставной головки, что относит височно-нижнечелюстной сустав к инконгруэнтным суставам, последняя выравнивается за счет того, что суставная капсула прикрепляется не вне ямки, а внутри ее у переднего края каменисто-барабанной щели и за счет двояковогнутого суставного диска.
Передняя часть ямки представлена плотной костной тканью, покрытой хрящом. Задняя часть – лишь тонкой костью, отделяющей суставную ямку от среднего и внутреннего уха, что способствует переходу воспалительных процессов уха на элементы височнонижнечелюстного сустава. Размеры нижнечелюстной ямки височной кости больше суставной головки, что относит височно-нижнечелюстной сустав к инконгруэнтным суставам, последняя выравнивается за счет того, что суставная капсула прикрепляется не вне ямки, а внутри ее у переднего края каменисто-барабанной щели и за счет двояковогнутого суставного диска.
Суставной бугорок – костное утолщение заднего отдела скулового отростка височной кости. У новорожденных он отсутствует, а появляется к 7–8 месяцам жизни и полностью оформляется к 6–7 годам (к началу прорезывания постоянных зубов). При вертикальных движениях нижней челюсти головка скользит по заднему его скату, а при максимальном открытии рта – останавливается у его вершины. Высота суставного бугорка изменяется в зависимости от возраста и зубной окклюзии. Наибольшая его высота отмечается у людей среднего возраста с нормальным прикусом. В пожилом возрасте и при отсутствии зубов высота бугорка уменьшается.
Наибольшая его высота отмечается у людей среднего возраста с нормальным прикусом. В пожилом возрасте и при отсутствии зубов высота бугорка уменьшается.
Суставной диск – двояковогнутая пластинка, состоящая из грубоволокнистой соединительной ткани. Имеет овальную форму. Расположен между суставными поверхностями, изолирует суставную головку от нижнечелюстной ямки, разделяя полость сустава на два этажа (верхний и нижний), диск сращен по краям с капсулой сустава. Объем верхнего этажа – 1,5 мл, а нижнего – 0,5 мл. Диск расположен так, что суставная головка скользит по задней поверхности бугорка, поэтому в момент жевательного акта наибольшее давление приходится не на заднюю часть свода суставной ямки, а на суставной бугорок. С возрастом происходят дистрофические процессы в суставном диске, что может приводить к его склерозированию и истончению.
Суставная капсула – эластичная соединительнотканная оболочка. Состоит из наружного – фиброзного и внутреннего – эндотелиального слоя.
Внутренний слой представлен клетками, которые выделяют синовиальную жидкость, уменьшающую трение суставных поверхностей, и является биологической защитой сустава от внедрения микробов.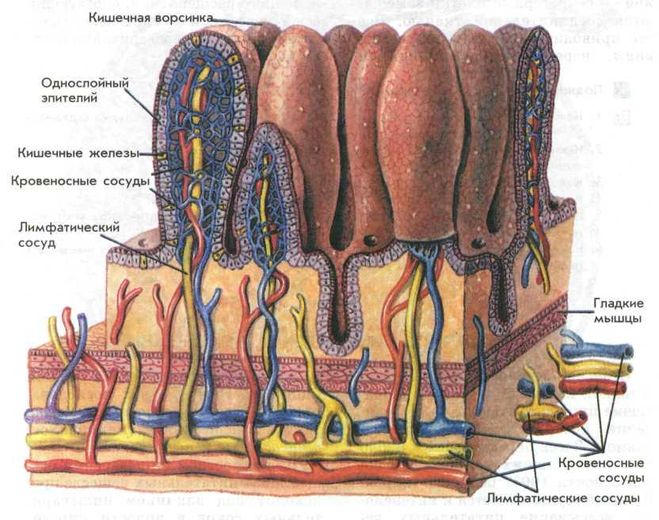 Капсула очень прочна (не разрывается при вывихах). Передняя часть капсулы прикрепляется впереди бугорка, а задняя – к каменисто-барабанной щели.
Капсула очень прочна (не разрывается при вывихах). Передняя часть капсулы прикрепляется впереди бугорка, а задняя – к каменисто-барабанной щели.
Связочный аппарат представлен интра– и экстракапсулярными связками,
которые регулируют боковые движения или выдвижения челюсти вперед. При старении организма в капсуле и связочном аппарате также наблюдаются склеротические изменения.
При заболевании височно-нижнечелюстного сустава связки теряют свою эластичность и ограничивают движение в суставе, а при их оссификации движение в суставе крайне затруднено.
По мнению В.А. Хватовой (1982), инконгруэнтность суставных поверхностей создает неустойчивость внутрисуставных взаимоотношений, а также полную зависимость этих взаимоотношений от смыкания зубных рядов и состояния жевательных мышц.
Ввисочно-нижнечелюстном суставе возможна комбинация разных видов движения: вертикального (открывание и закрывание рта), сагиттального (вперед и назад) и трансверзального (боковое). В норме при максимальном открывании рта расстояние между режущими краями верхних и нижних резцов (резцовое расстояние) равно приблизительно 40–50 мм. Изменение расстояния между режущими краями резцов при открывании рта в сторону его уменьшения или увеличения указывает на патологию в суставе или окружающих его тканях. При артритах, артрозах, болевой дисфункции, анкилозе и т. д. наблюдается уменьшение этого расстояния, а при подвывихах сустава – увеличение.
Изменение расстояния между режущими краями резцов при открывании рта в сторону его уменьшения или увеличения указывает на патологию в суставе или окружающих его тканях. При артритах, артрозах, болевой дисфункции, анкилозе и т. д. наблюдается уменьшение этого расстояния, а при подвывихах сустава – увеличение.
Внорме, в зависимости от вида прикуса, различают три типа височнонижнечелюстного сустава:
– при ортогнатическом прикусе – умеренно выпукло-вогнутый;
– для прямого прикуса характерен уплощенный сустав;
– для глубокого – подчеркнуто выпукло-вогнутый. Все это необходимо учитывать при обследовании больных и установлении
диагноза.
Височно-нижнечелюстной сустав, articulatio temporomandibularis, парный,
образуется головкой нижней челюсти, caput mandibulae, нижнечелюстной ямкой, fossa mandibularis, и суставным бугорком, tuberculum articulare, чешуйчатой части височной кости.
Суставные поверхности покрыты соединительнотканным хрящом. В полости сустава залегает двояковогнутая овальной формы волокнистая хрящевая пластинка — суставной диск discus articularis. Располагаясь в горизонтальной плоскости, диск своей верхней поверхностью прилежит к tuberculum arti-culare, а нижней — к caput mandibulae. Он срастается по окружности с суставной капсулой и делит полость сустава на два не сообщающихся между собой отдела: верхний и нижний. К внутреннему краю диска прикрепляется часть сухожильных пучков латеральной крыловидной мышцы, m. pterygoideus lateralis.
Располагаясь в горизонтальной плоскости, диск своей верхней поверхностью прилежит к tuberculum arti-culare, а нижней — к caput mandibulae. Он срастается по окружности с суставной капсулой и делит полость сустава на два не сообщающихся между собой отдела: верхний и нижний. К внутреннему краю диска прикрепляется часть сухожильных пучков латеральной крыловидной мышцы, m. pterygoideus lateralis.
Суставная капсула, capsula articularis, прикрепляется по краю суставного хряща; на височной кости она фиксирована впереди — по переднему скату tuberculum articulare, сзади — по переднему краю fissura petrotympanica, латерально — у основания processus zygomaticus; медиально достигает spina ossis sphenoidalis; на нижней челюсти суставная капсула охватывает ее шейку, прикрепляясь к ней сзади несколько ниже, чем спереди.
Строение слизистой оболочки полости рта
Похожие презентации:
Эндокринная система
Анатомо — физиологические особенности сердечно — сосудистой системы детей
Хронический панкреатит
Топографическая анатомия верхних конечностей
Анатомия и физиология сердца
Мышцы головы и шеи
Эхинококкоз человека
Черепно-мозговые нервы
Анатомия и физиология печени
Топографическая анатомия и оперативная хирургия таза и промежности
1.
 Строение слизистой оболочки полости ртаСОПР имеет четкое строение. Она состоит из эпителия,
Строение слизистой оболочки полости ртаСОПР имеет четкое строение. Она состоит из эпителия,собственной пластинки и подслизистой основы. Соотношение
толщины этих слоев на различных участках полости рта
неодинаково. В СО твердого неба, языка, десны эпителиальный слой
наиболее толстый. Собственная пластинка хорошо выражена в СО
губы, щеки. Подслизистая основа наиболее развита в области дна
полости рта и переходных складок. Такое строение обусловлено
особенностями функций различных участков СОПР.
Эпителий многослойный плоский, обращен в ротовую полость и
вследствие слущивания поверхностных слоев клеток подвергается
постоянному обновлению. В некоторых участках поверхностные
эпителиальные клетки ороговевают. Степень ороговения на разных
участках слизистой не одинакова. Наиболее выражено ороговение
эпителия на тех участках слизистой, которые подвергаются
наибольшему механическому, химическому и термическому
воздействию, что является подтверждением защитноприспособительного характера процесса ороговения эпителия СОПР,
который особенно ярко выражен на твердом небе, спинке языка и
деснах.
1- эпителий
2- собственная
пластинка
3- подслизистая основа
5. Типы слизистой:
6. Жевательная
Выстилает твердое небо и десны и принимает участие преимущественно вмеханической обработке пищи. Она покрыта ороговевающим эпителием, плотно
прилежит и прочно прикреплена к подлежащей кости, практически неподвижна,
обладает высокой механической прочностью и низкой проницаемостью.
Десна представляет собой часть СОПР, непосредственно окружающую зубы.
Собственная пластинка десны состоит из соединительной ткани и содержит
коллагеновые и эластичные волокна, большое количество кровеносных сосудов,
нервных окончаний. Железы и подслизистая основа отсутствуют. Десна
подразделяется на 3 части:
а) прикрепленная;
б) свободная;
в) десневые межзубные сосочки.
7. Выстилающая
Типичная слизистая оболочка, выстланная толстым (500-600 мкм)многослойным плоским неороговевающим эпителием. В наружных
частях промежуточного слоя и поверхностном слое эпителиоциты
содержат значительное количество гликогена.
 Собственная пластинка
Собственная пластинкасостоит из волокнистой соединительной ткани с высоким содержанием
коллагеновых
и
эластических
волокон
и
многочисленными
анастомозирующими капиллярными петлями. Собственная пластинка
переходит в подслизистую основу, примыкающую к мышцам, и
содержащую большое количество сосудов, жировую ткань.
8. Специализированная
Верхняя и боковые поверхности языка покрытыслизистой оболочкой, в состав которой входят
многослойный плоский частично ороговевающий
эпителий и собственная пластинка, прочно
сращенная с подлежащей мышечной тканью.
Собственно слизистая оболочка языка вместе с
покрывающим эпителием образует выступы –
сосочки языка. Существует 4 вида сосочков:
нитевидные, грибовидные, листовидные и
желобовидные.
9. Нитевидные сосочки языка
Нитевидныесосочки
самые
многочисленные и располагаются по
всей поверхности спинки языка.
Вкусовые луковицы в них отсутствуют.
Вершины
нитевидных
сосочков
ороговевают.
При
нарушении
нормального отторжения ороговевших
чешуек, что бывает при заболевании
желудочно-кишечного тракта и др., на
языке образуется белый налет –
«обложенный язык». Возможно и
интенсивное отторжение наружного
слоя эпителия нитевидных сосочков
на ограниченном участке. Такое
явление
получило
название
десквамации.
10. Грибовидные сосочки языка
Грибовидные сосочки в большом количествеобнаруживаются на кончике языка, в меньшей – на
спинке. Эпителий, покрывающий сосочки, неороговевает,
поэтому макроскопически они имеют вид красных точек,
слегка возвышающихся над уровнем нитевидных
сосочков. В грибовидных сосочках заложены вкусовые
луковицы, имеющие хорошее кровоснабжение.
11. Листовидные и Желобовидные
Листовидныесосочки располагаются по краям
языка в задних отделах (впереди
желобоватых сосочков) группами по
15-20, образуя небольшие выступы.
Иногда эти образования принимают
за патологию. В листовидных
сосочках располагаются вкусовые
луковицы.
Желобовидные сосочки самые
крупные сосочки языка.
Располагаются по линии границы
корня и тела языка. Их локализация
напоминает римскую цифру V. Число
их непарное (9 –11). Каждый сосочек
окружен бороздкой, в которую
открываются выводные протоки
мелких слюнных желез. В стенках
желобоватых сосочков имеется
большое количество вкусовых
рецепторов (до 150 луковиц).
3- Листовидные
6- Желобовидные
12. Функции слизистой:
Защитнаяслизистая
оболочка защищает подлежащие
ткани
от
возможного
повреждающего
действия
содержимого, находящегося в
полости рта. В СОПР как
эпителий, так и соединительная
ткань
адаптированы
к
противодействию
различных
нагрузок. Эпителий слизистой
оболочки
полости
рта
относительно
устойчив
к
воздействию
не
только
механических, но и химических
факторов.
счет постоянной десквамации
(слущивания)
и
активной
регенерации эпителия СОПР в
физиологических условиях.
Сенсорная
осуществляется
благодаря
присутствию
рецепторов, воспринимающих температурные, тактильные и
болевые
сигналы.
В
полости
рта
имеются
также
специализированные вкусовые рецепторы.
Вкусовые сосочки языка
Секреторная — поверхность СОПР смачивается слюной, которая
вырабатывается крупными и мелкими слюнными железами. Слюна,
размягчая пищу, препятствует механическому повреждению СОПР,
удаляет различные микроорганизмы с поверхности СОПР. Она также
содержит неспецифические противомикробные вещества и антитела,
препятствующие прикреплению микробов к поверхности эпителия.
Иммунная — слизистая оболочка полости рта принимает участие в
обеспечении местного иммунитета. Она содержит клеточные элементы,
участвующие как в афферентном, так и эфферентном звеньях иммунных
реакций (клетки Лангерганса, макрофаги, лимфоциты, плазматические
клетки).
 В слюне, омывающей поверхность слизистой оболочки,
В слюне, омывающей поверхность слизистой оболочки,присутствуют антитела.
Всасывательная — некоторые участки
слизистой проницаемы для ряда веществ
(йода, калия, натрия, отдельных аминокислот).
Важное клиническое значение имеет ее
проницаемость для некоторых лекарственных
веществ.
Например,
нитроглицерин,
применяемый
для
снятия
приступа
стенокардии, помещается под язык откуда
быстро всасывается.
English Русский Правила
Медсовет для врачей | Remedium.ru
29.09.2022
Как лечить синусит у взрослых?
 ..
..Подробнее
28.09.2022
Симптомы перфорации барабанной перепонки
Нарушение целостности барабанной перепонки – различные варианты её перфорации – может происходить при остром среднем отите, тупой или проникающей травме уха (с инородным телом или без), а также при баротравме. Клинические проявления при этом в целом сходные, однако тактика ведения может различаться…
Подробнее
27.09.2022
Атрезия хоан
Атрезия хоан — это врожденное заболевание, при котором задние хоаны в полости носа закупориваются костью, мягкими тканями или и тем, и другим. Полная заложенность носа у новорожденного может привести к смерти от асфиксии. При попытке вдоха язык подтягивается к небу, что приводит к обструкции ротовых…
При попытке вдоха язык подтягивается к небу, что приводит к обструкции ротовых…
Подробнее
26.09.2022
Как лечить ОРВИ?
Острые респираторные вирусные инфекции (ОРВИ) – группа доброкачественных самокупирующихся заболеваний вирусной природы. ОРВИ – самое частое острое инфекционное заболевание в мире. Иногда применяются термины «простуда» и ОРЗ, которые могут подразумевать и другие возбудители, кроме вирусов. Точное…
Подробнее
22.09.2022
Как защититься от гриппа?
Грипп (инфлюэнца – устар.) – сезонное респираторное заболевание, вызываемое вирусами гриппа, которое обладает пандемическим потенциалом и сопровождается смертью 350–650 тысяч человек во всем мире ежегодно.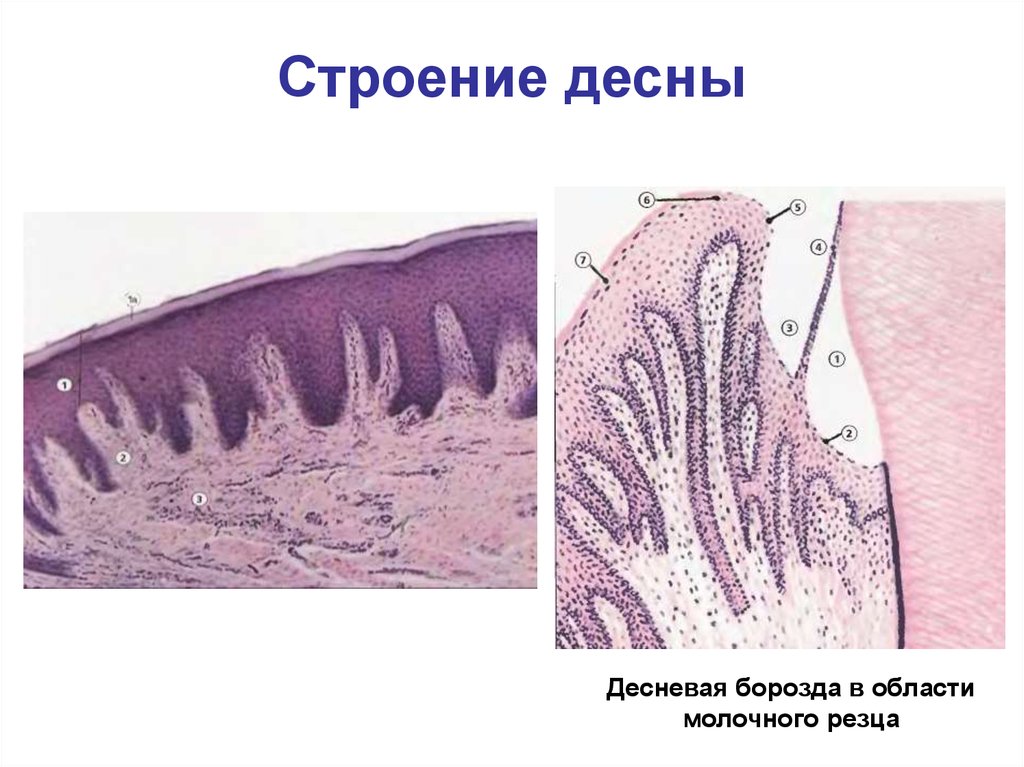 Грипп вызывал в XX веке самую крупную пандемию, известную как «испанка» (1918–1920 год), число…
Грипп вызывал в XX веке самую крупную пандемию, известную как «испанка» (1918–1920 год), число…
Подробнее
21.09.2022
Психиатрическая коморбидность и психоэмоциональный статус больных с акне
Е.В. Дворянкова1,2*, Н.А. Шевченко3, О.В. Жукова4,5 ; 1 Центр теоретических проблем физико-химической фармакологии Российской академии наук, 2 Медицинский семейный центр «Пангея», 3 Центр комплексной реабилитации инвалидов «Бутово», 4 Российский…
Подробнее
19.09.2022
Что влияет на выявляемость ишемического инсульта при нейровизуализации?
З.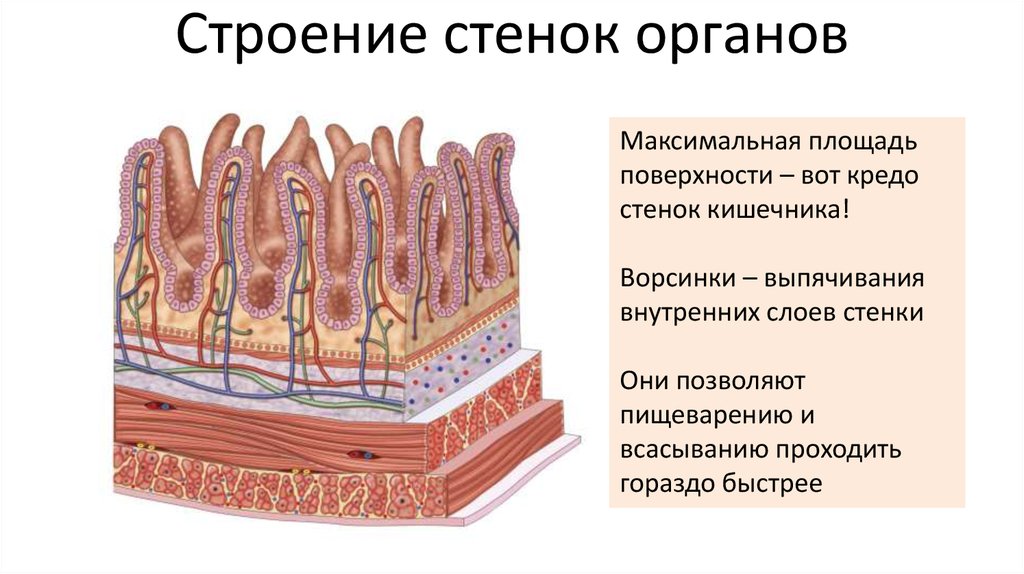 А. Ахатова, Р.С. Мусин, П.Н. Власов, Ю.И. Макарова, С.А. Труханов;
А. Ахатова, Р.С. Мусин, П.Н. Власов, Ю.И. Макарова, С.А. Труханов;
Введение. Заболеваемость инсультом составляет 2,5–3 случая на 1 тыс. населения в год, смертность – 1 случай на 1 тыс. населения в год. По разным данным, до 20% компьютерных томографий (КТ), проведенных в …
Подробнее
15.09.2022
Клинические особенности и тактика терапии коморбидных дерматозов
Е.Е. Жильцова1,2, С.A. Политов1,2, О.В. Баковецкая1; 1 РязГМУ им. ак. И.П. Павлова, 2 РО «ОККВД»
В статье представлен случай возможной коморбидности в дерматологической практике. Известно, что инфекции кожи являются распространенными у пациентов с хронической экземой, причем они могут иметь бактериальную,…
Подробнее
13. 09.2022
09.2022
Альтернативные виды терапии рецидивирующего цистита у женщин в менопаузе
Е.В. Кульчавеня1,2,3, Л.С. Трейвиш3, Е.В. Телина3; 1 Новосибирский научно-исследовательский институт туберкулеза, 2 Новосибирский государственный медицинский университет, 3 Медицинский центр «Авиценна»
Инфекции мочевыводящих путей (ИМП)…
Подробнее
09.09.2022
Сравнительная оценка результатов терапии акне легкой степени
И.М. Хисматулина, Е.В. Файзуллина, Е.С. Гусарова, Р.Р. Набиева; Казанский государственный медицинский университет
Введение.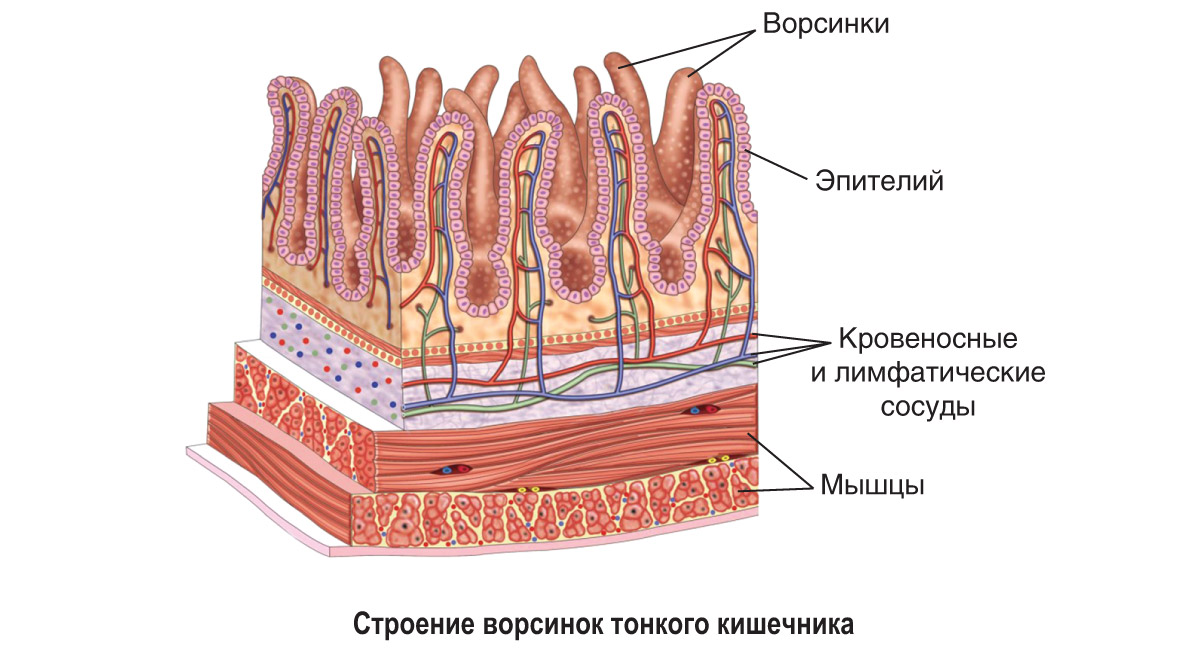 Акне легкой степени является самой недооцененной формой заболевания.
Акне легкой степени является самой недооцененной формой заболевания.
Цель исследования – сравнить результаты наружной комбинированной терапии…
Подробнее
Загрузить еще
Строение слизистой оболочки полости рта презентация, доклад
Строение слизистой оболочки полости рта
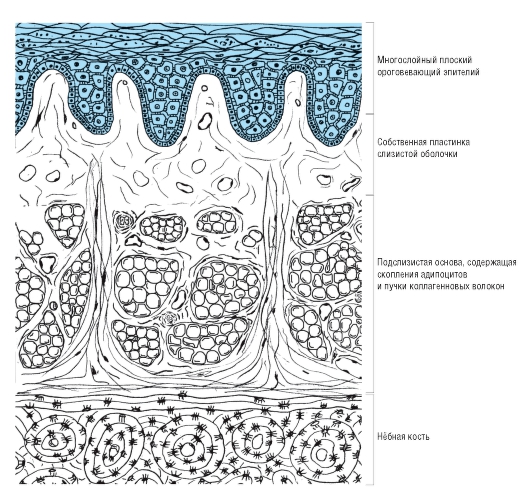
СОПР имеет четкое строение. Она состоит из эпителия, собственной пластинки и подслизистой основы. Соотношение толщины этих слоев на различных участках полости рта неодинаково. В СО твердого неба, языка, десны эпителиальный слой наиболее толстый. Собственная пластинка хорошо выражена в СО губы, щеки. Подслизистая основа наиболее развита в области дна полости рта и переходных складок. Такое строение обусловлено особенностями функций различных участков СОПР.
Такое строение обусловлено особенностями функций различных участков СОПР.
Эпителий многослойный плоский, обращен в ротовую полость и вследствие слущивания поверхностных слоев клеток подвергается постоянному обновлению. В некоторых участках поверхностные эпителиальные клетки ороговевают. Степень ороговения на разных участках слизистой не одинакова. Наиболее выражено ороговение эпителия на тех участках слизистой, которые подвергаются наибольшему механическому, химическому и термическому воздействию, что является подтверждением защитно-приспособительного характера процесса ороговения эпителия СОПР, который особенно ярко выражен на твердом небе, спинке языка и деснах.
1- эпителий
2- собственная пластинка
3- подслизистая основа
Типы слизистой:
Жевательная
Выстилает твердое небо и десны и принимает участие преимущественно в механической обработке пищи. Она покрыта ороговевающим эпителием, плотно прилежит и прочно прикреплена к подлежащей кости, практически неподвижна, обладает высокой механической прочностью и низкой проницаемостью.
Она покрыта ороговевающим эпителием, плотно прилежит и прочно прикреплена к подлежащей кости, практически неподвижна, обладает высокой механической прочностью и низкой проницаемостью.
Десна представляет собой часть СОПР, непосредственно окружающую зубы. Собственная пластинка десны состоит из соединительной ткани и содержит коллагеновые и эластичные волокна, большое количество кровеносных сосудов, нервных окончаний. Железы и подслизистая основа отсутствуют. Десна подразделяется на 3 части:
а) прикрепленная;
б) свободная;
в) десневые межзубные сосочки.
Выстилающая
Типичная слизистая оболочка, выстланная толстым (500-600 мкм) многослойным плоским неороговевающим эпителием. В наружных частях промежуточного слоя и поверхностном слое эпителиоциты содержат значительное количество гликогена. Собственная пластинка состоит из волокнистой соединительной ткани с высоким содержанием коллагеновых и эластических волокон и многочисленными анастомозирующими капиллярными петлями.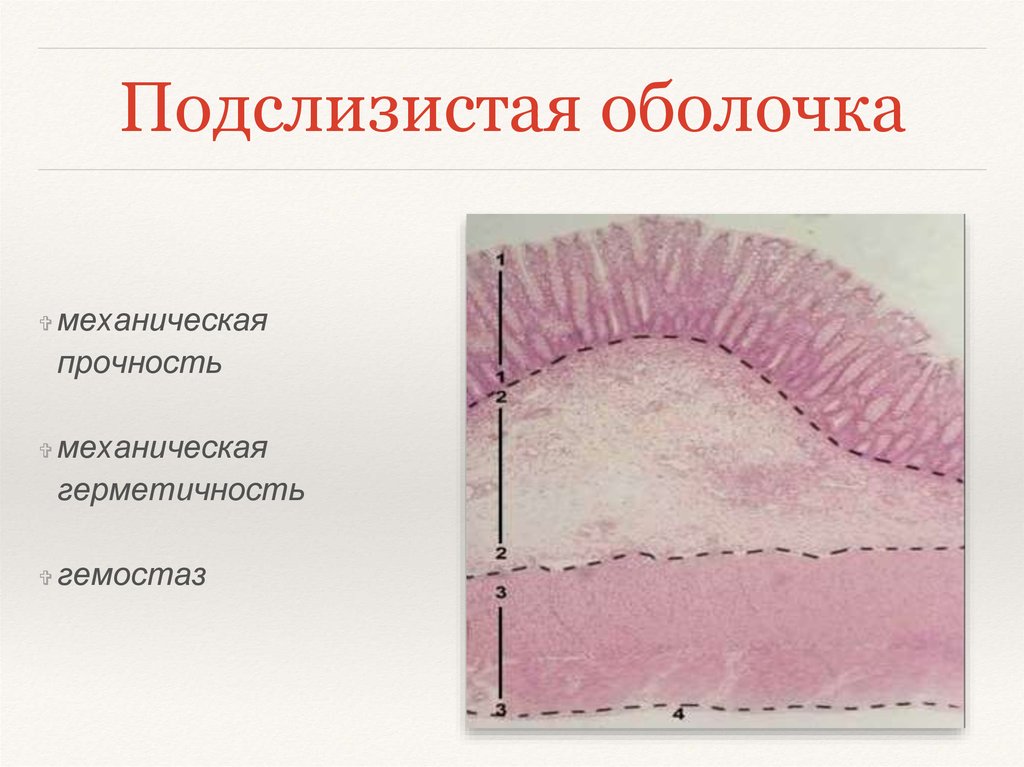 Собственная пластинка переходит в подслизистую основу, примыкающую к мышцам, и содержащую большое количество сосудов, жировую ткань.
Собственная пластинка переходит в подслизистую основу, примыкающую к мышцам, и содержащую большое количество сосудов, жировую ткань.
Специализированная
Верхняя и боковые поверхности языка покрыты слизистой оболочкой, в состав которой входят многослойный плоский частично ороговевающий эпителий и собственная пластинка, прочно сращенная с подлежащей мышечной тканью. Собственно слизистая оболочка языка вместе с покрывающим эпителием образует выступы – сосочки языка. Существует 4 вида сосочков: нитевидные, грибовидные, листовидные и желобовидные.
Нитевидные сосочки языка
Нитевидные сосочки самые многочисленные и располагаются по всей поверхности спинки языка. Вкусовые луковицы в них отсутствуют. Вершины нитевидных сосочков ороговевают. При нарушении нормального отторжения ороговевших чешуек, что бывает при заболевании желудочно-кишечного тракта и др. , на языке образуется белый налет – «обложенный язык». Возможно и интенсивное отторжение наружного слоя эпителия нитевидных сосочков на ограниченном участке. Такое явление получило название десквамации.
, на языке образуется белый налет – «обложенный язык». Возможно и интенсивное отторжение наружного слоя эпителия нитевидных сосочков на ограниченном участке. Такое явление получило название десквамации.
Грибовидные сосочки языка
Грибовидные сосочки в большом количестве обнаруживаются на кончике языка, в меньшей – на спинке. Эпителий, покрывающий сосочки, неороговевает, поэтому макроскопически они имеют вид красных точек, слегка возвышающихся над уровнем нитевидных сосочков. В грибовидных сосочках заложены вкусовые луковицы, имеющие хорошее кровоснабжение.
Листовидные и Желобовидные
Листовидные сосочки располагаются по краям языка в задних отделах (впереди желобоватых сосочков) группами по 15-20, образуя небольшие выступы. Иногда эти образования принимают за патологию. В листовидных сосочках располагаются вкусовые луковицы.
Желобовидные сосочки самые крупные сосочки языка.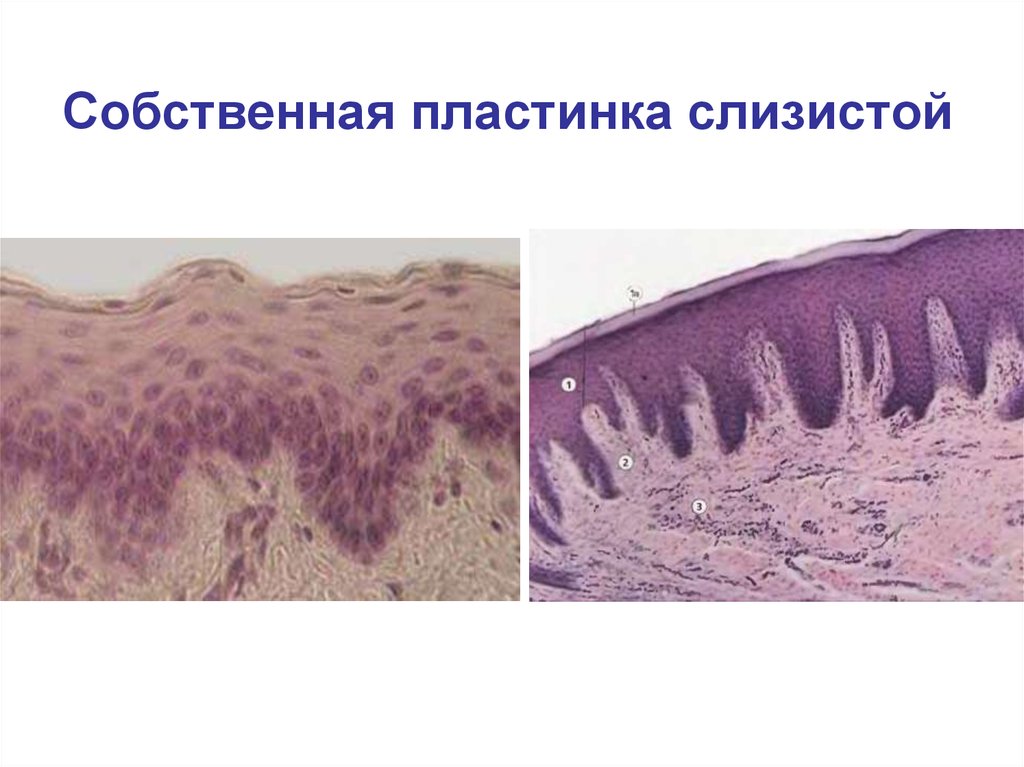 Располагаются по линии границы корня и тела языка. Их локализация напоминает римскую цифру V. Число их непарное (9 –11). Каждый сосочек окружен бороздкой, в которую открываются выводные протоки мелких слюнных желез. В стенках желобоватых сосочков имеется большое количество вкусовых рецепторов (до 150 луковиц).
Располагаются по линии границы корня и тела языка. Их локализация напоминает римскую цифру V. Число их непарное (9 –11). Каждый сосочек окружен бороздкой, в которую открываются выводные протоки мелких слюнных желез. В стенках желобоватых сосочков имеется большое количество вкусовых рецепторов (до 150 луковиц).
3- Листовидные
6- Желобовидные
Функции слизистой:
Защитная — слизистая оболочка защищает подлежащие ткани от возможного повреждающего действия содержимого, находящегося в полости рта. В СОПР как эпителий, так и соединительная ткань адаптированы к противодействию различных нагрузок. Эпителий слизистой оболочки полости рта относительно устойчив к воздействию не только механических, но и химических факторов. Это происходит за счет постоянной десквамации (слущивания) и активной регенерации эпителия СОПР в физиологических условиях.
Сенсорная — осуществляется благодаря присутствию рецепторов, воспринимающих температурные, тактильные и болевые сигналы. В полости рта имеются также специализированные вкусовые рецепторы.
В полости рта имеются также специализированные вкусовые рецепторы.
Вкусовые сосочки языка
Секреторная — поверхность СОПР смачивается слюной, которая вырабатывается крупными и мелкими слюнными железами. Слюна, размягчая пищу, препятствует механическому повреждению СОПР, удаляет различные микроорганизмы с поверхности СОПР. Она также содержит неспецифические противомикробные вещества и антитела, препятствующие прикреплению микробов к поверхности эпителия.
Иммунная — слизистая оболочка полости рта принимает участие в обеспечении местного иммунитета. Она содержит клеточные элементы, участвующие как в афферентном, так и эфферентном звеньях иммунных реакций (клетки Лангерганса, макрофаги, лимфоциты, плазматические клетки). В слюне, омывающей поверхность слизистой оболочки, присутствуют антитела.
Всасывательная — некоторые участки слизистой проницаемы для ряда веществ (йода, калия, натрия, отдельных аминокислот).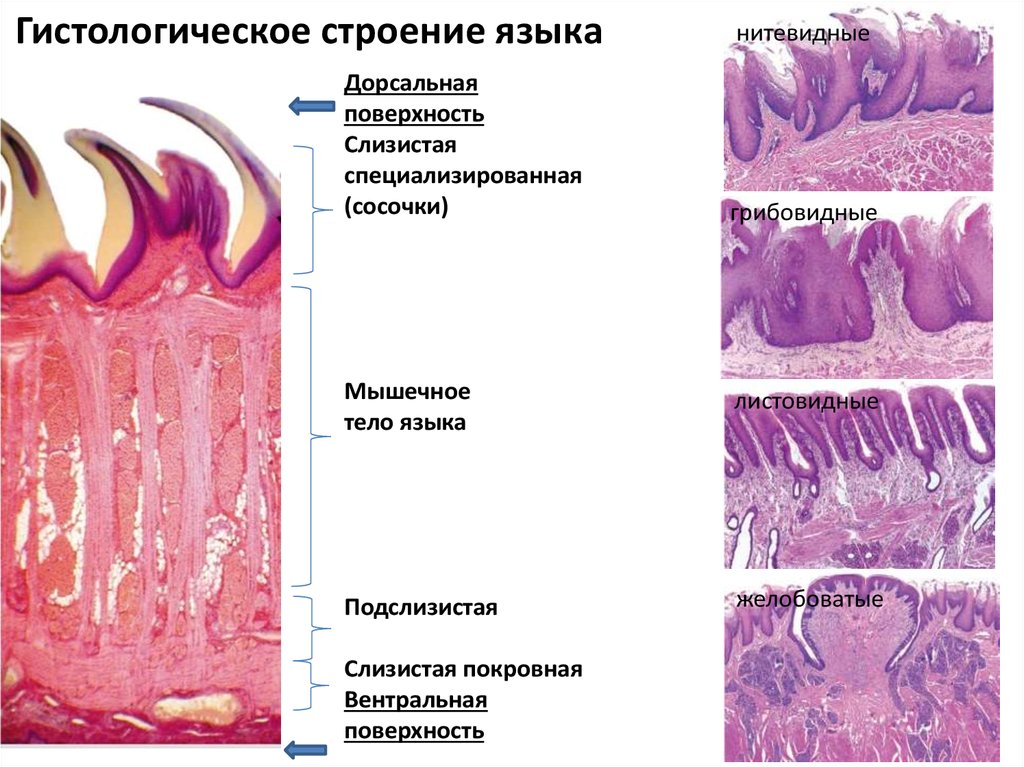 Важное клиническое значение имеет ее проницаемость для некоторых лекарственных веществ. Например, нитроглицерин, применяемый для снятия приступа стенокардии, помещается под язык откуда быстро всасывается.
Важное клиническое значение имеет ее проницаемость для некоторых лекарственных веществ. Например, нитроглицерин, применяемый для снятия приступа стенокардии, помещается под язык откуда быстро всасывается.
Скачать презентацию
Строение шейки матки: описание, кольпофотограмма
Строение шейки матки
Шейка матки – это часть матки, которая одним концом частично располагается во влагалище, а другим через внутренний зев переходит в полость тела матки.
Она имеет форму цилиндра с каналом внутри. Через наружное отверстие, т.н. наружный зев, цервикальный канал открывается во влагалище. Через внутреннее отверстие, т.н. внутренний зев, цервикальный канал открывается и соединяется с полостью матки. Общие размеры шейки матки могут варьировать от 2-3 см до 4-6 см как в длину, так в диаметре.
Рис.1. Схематическое изображение внутренних гениталий
Шейка матки — мышечно-соединительнотканный орган, который покрыт эпителиальной тканью.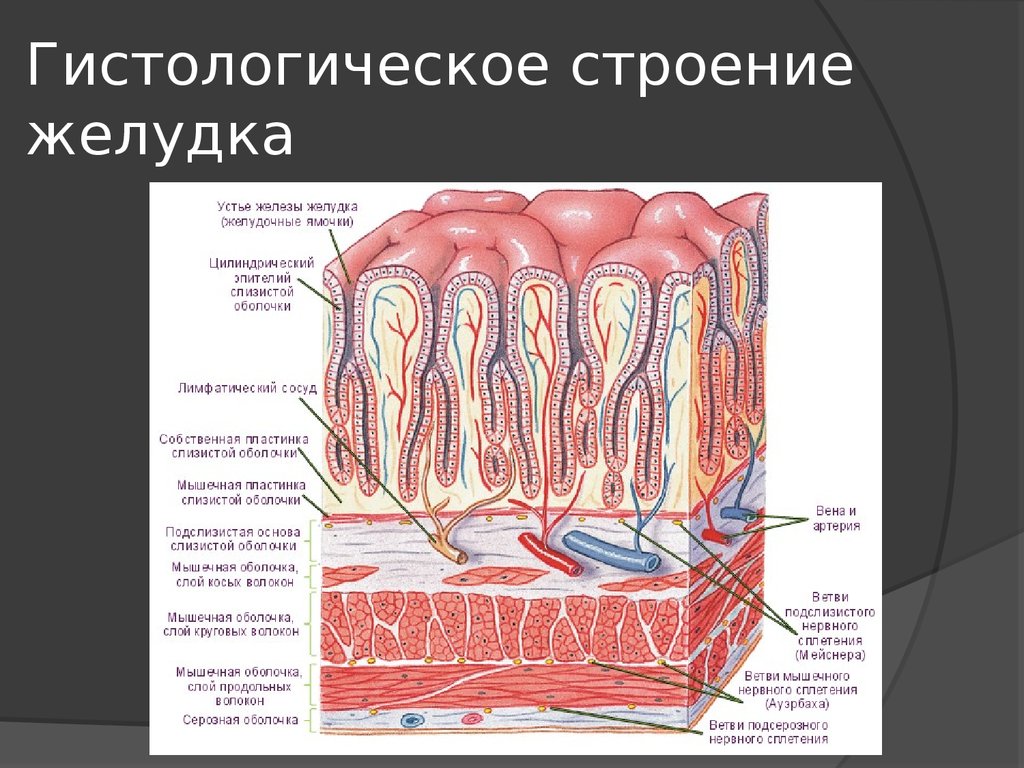 В соединительной ткани проходят кровеносные и лимфатические сосуды, мышечная ткань представлена гладкими мышцами. Основная часть мышечной ткани находится в верхней части шейки матки в виде кольца и выполняет запирательную функцию. Ближе к влагалищной части шейка матки содержит большей частью соединительнотканные волокна. Эпителиальная ткань покрывает шейку матки с влагалищной части и внутри цервикального канала.
В соединительной ткани проходят кровеносные и лимфатические сосуды, мышечная ткань представлена гладкими мышцами. Основная часть мышечной ткани находится в верхней части шейки матки в виде кольца и выполняет запирательную функцию. Ближе к влагалищной части шейка матки содержит большей частью соединительнотканные волокна. Эпителиальная ткань покрывает шейку матки с влагалищной части и внутри цервикального канала.
Часть шейки матки, которая размещается во влагалище и видна врачу при осмотре называется эктоцервикс. Эта часть шейки матки имеет гладкую поверхность, покрыта многослойным плоским неороговевающим эпителием, таким же, как и влагалище, и слизистая малых половых губ.
Рис.2. Микрофотограмма многослойного плоского эпителия нормального строения. Микрофотограмма любезно предоставлена к.мед.н, заведующим отделением патанатомии Национального института рака Михаилом Кротевичем
Этот эпителий гладкий, розовый, устойчивый к механическим нагрузкам и кислой среде влагалища. Многослойный плоский эпителий выполняет защитную функцию. Он достаточно быстро обновляется и восстанавливается при механических травмах. Полное обновление эпителиального пласта происходит за 4-5 дней.
Многослойный плоский эпителий выполняет защитную функцию. Он достаточно быстро обновляется и восстанавливается при механических травмах. Полное обновление эпителиального пласта происходит за 4-5 дней.
Рис.3. На кольпофотограмме шейка матки покрыта нормальным многослойным плоским эпителием.
В цервикальном канале слизистая оболочка имеет складчатую форму, представлена множественными изгибами соединительной ткани, которые напоминают железы, покрыта однослойным нежным эпителием- цилиндрическим эпителием. Этот эпителий продуцирует прозрачную слизь. Слизь в цервикальном канале образует слизистую пробку. Характер и вид цервикальной слизи изменяется с фазами менструального цикла. В первую фазу цикла слизи несколько больше, во время овуляции она становиться прозрачной и тягучей.
Многослойный плоский эпителий и цилиндрический эпителий встречаются друг с другом в области наружного зева и образуют линию стыка.
Рис.4. На кольпофотограмме представлена шейка матки в период овуляции. В цервикальном канале прозрачная слизь, видна слизистая цервикального канала, линия стыка двух видов эпителия на уровне наружного зева.
На кольпофотограмме представлена шейка матки в период овуляции. В цервикальном канале прозрачная слизь, видна слизистая цервикального канала, линия стыка двух видов эпителия на уровне наружного зева.
Место стыка необходимо и желательно визуализировать при выполнении кольпоскопии, и оно обязательно должно попасть в область взятия цитологического мазка (Пап-теста).
Почему это важно?
Известно, что основной причиной возникновения дисплазии и рака шейки матки является вирус папилломы человека. Этот вирус может размножаться только в активно делящихся клетках. Такие клетки имеются в многослойном плоском эпителии в самых нижних его слоях – базальные клетки. Однако при сохраненной целостности эпителия они надежно защищены верхними слоями. Единственное «слабое» место на шейке матки, где вирус может «добраться» до таких клеток – это место стыка.
Рис. 5. Схематическое изображение места стыка многослойного плоского эпителия и цилиндрического. Хорошо видно, что базальные клетки в месте стыка располагаются близко к поверхности – это «слабое звено».
Хорошо видно, что базальные клетки в месте стыка располагаются близко к поверхности – это «слабое звено».
Там нижние (базальные) клетки поднимаются на поверхность и остаются уязвимыми для вируса. Как правило все патологические процессы в эпителии шейки матки начинают возникать в области зоны стыка, поэтому важным является обязательное кольпоскопическое и цитологическое исследование этой зоны шейки матки.
Третьим нормальным видом эпителия шейки матки является метаплазированный эпителий. Слово «метаплазия» несколько пугает пациентов, поскольку несколько созвучно со словом «метастаз», однако к нему не имеет никакого отношения.
Рис. 6. На кольпофоограмме представлена шейка матки с небольшой эктопией цилиндрического эпителия и зоной трансформации 1 типа шейки матки (метаплазированный эпителий и множественные открытые железы), четко видно место стыка, которое располагается на внешней части шейки матки — эктоцервиксе.
Метаплазированный эпителий возникает из резервных клеток, т. н. бипотентных клеток, или другими словами – клеток, имеющих две возможности к развитию. Эти клетки способны в зависимости от условий превращаться либо в клетки цилиндрического, либо в клетки многослойного плоского неороговевающего эпителия путем процесса метаплазии. Процесс метаплазии ступенчатый. Метаплазия бывает ранней, незрелой и зрелой. По свойствам и виду клетки ранней метаплазии похожи на клетки цилиндрического эпителия, очень ранняя метаплазия иногда для неопытного морфолога (гистолога или цитолога) может имитировать злокачественный процесс. По степени созревания метаплазия приобретает свойства многослойного плоского эпителия. Если процессу метаплазии ничего не мешает (травмы, воспаления, инфицирование ВПЧ), то он заканчивается образованием многослойного плоского неороговевающего эпителия. Процесс метаплазии происходит на шейке матки при наличии на ней эктопии цилиндрического эпителия, а также в процессе заживления эпителиальных дефектов – эрозий и ссадин, травм.
н. бипотентных клеток, или другими словами – клеток, имеющих две возможности к развитию. Эти клетки способны в зависимости от условий превращаться либо в клетки цилиндрического, либо в клетки многослойного плоского неороговевающего эпителия путем процесса метаплазии. Процесс метаплазии ступенчатый. Метаплазия бывает ранней, незрелой и зрелой. По свойствам и виду клетки ранней метаплазии похожи на клетки цилиндрического эпителия, очень ранняя метаплазия иногда для неопытного морфолога (гистолога или цитолога) может имитировать злокачественный процесс. По степени созревания метаплазия приобретает свойства многослойного плоского эпителия. Если процессу метаплазии ничего не мешает (травмы, воспаления, инфицирование ВПЧ), то он заканчивается образованием многослойного плоского неороговевающего эпителия. Процесс метаплазии происходит на шейке матки при наличии на ней эктопии цилиндрического эпителия, а также в процессе заживления эпителиальных дефектов – эрозий и ссадин, травм.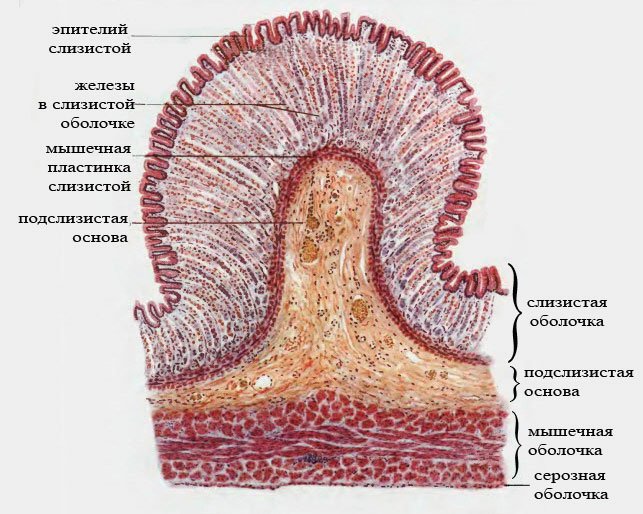
Вся площадь поверхности шейки матки, на которой происходит метаплазия, называется — зона трансформации шейки матки (зона перестройки, рис. 6, 7). Это то место, на котором происходят активно процессы преобразования эпителия, и эти участки шейки матки очень чувствительны для негативного воздействия вируса папилломы человека.
Рис.7. Микрофотограмма. Зона трансформации шейки матки под микроскопом: многослойный плоский эпителий, цилиндрический эителий, метаплазированный эпителий, линия стыка. Микрофотограмма любезно предоставлена к.мед.н, заведующим отделением патанатомии Национального института рака Михаилом Кротевичем.
Очень важно исследовать эту зону кольпоскопически и цитологически, поскольку риск развития предрака и рака шейки матки на ней во много сот раз выше, чем на многослойном плоском эпителии вне такой зоны.
Зоны трансформации шейки матки делятся на три типа:
Рис. 8. Зона трансформации 1 типа располагается на внешней части шейки матки и полностью видима при кольпоскопии;
Рис.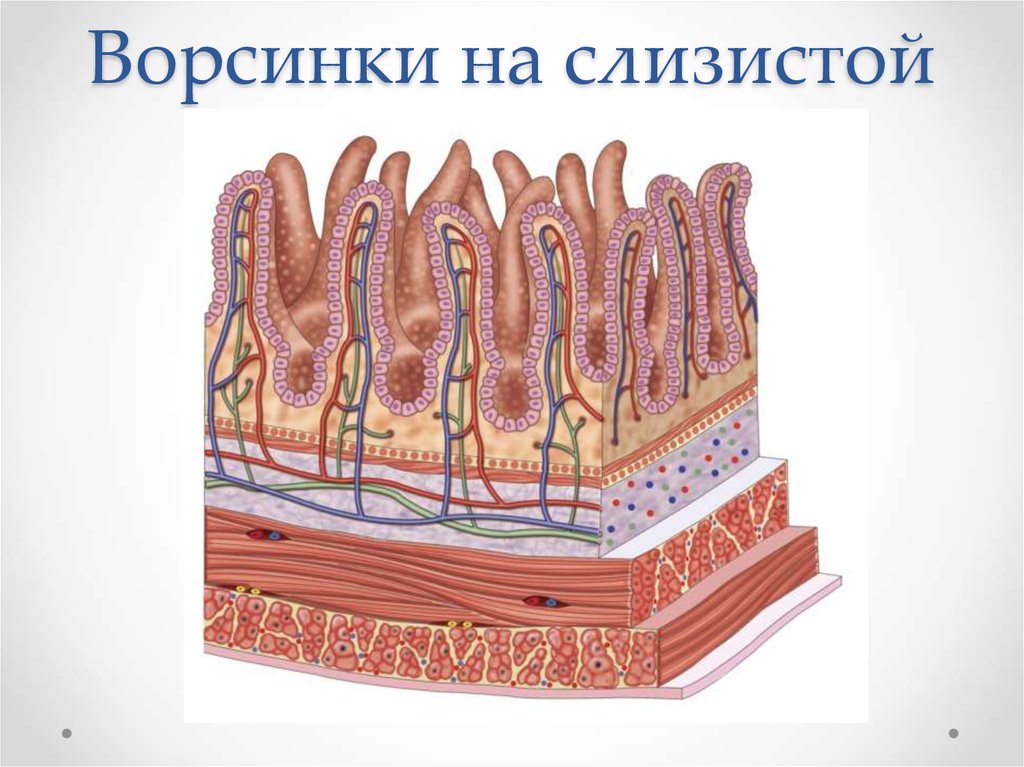 9. Зона трансформации 2 типа располагается на внешней части шейки матки, но имеет и компонент расположенный в цервикальном канале, однако полностью видима;
9. Зона трансформации 2 типа располагается на внешней части шейки матки, но имеет и компонент расположенный в цервикальном канале, однако полностью видима;
Рис. 10. Зона трансформации 3 типа имеет внутрицервикальный компонент, полностью не видима.
Подслизистые новообразования желудочно-кишечного тракта в эндоскопической практике
Подслизистые новообразования желудочно-кишечного тракта — собирательное понятие, включающее изменения, общим признаком которых является локализация патологического очага подслизистой стенки полого органа. Они составляют до 5% всех новообразований данной локализации и могут быть бессимптомными, являясь случайной находкой при эндоскопическом исследовании (0,4% наблюдений) [50]. По сообщениям некоторых авторов, при патологоанатомических исследованиях умерших в возрасте старше 50 лет подслизистые опухоли пищевода впервые выявляются в 5%, подслизистые опухоли желудка — в 50% случаев [59]. Прижизненно подслизистые новообразования верхних отделов желудочно-кишечного тракта обнаруживаются с различной частотой.
Длительное время подслизистые новообразования трактовались хирургами и эндоскопистами как доброкачественные и в большинстве подлежащие динамическому наблюдению. Исключение составляли новообразования больших размеров, которые имели клинические проявления и вынуждали хирургов к оперативному вмешательству. Подслизистые новообразования наиболее часто выявляются при эндоскопическом или при рентгенологическом исследовании желудочно-кишечного тракта. При рентгенологическом исследовании данные образования выглядят как пристеночно расположенные дефекты наполнения округлой или овоидной формы. Однако данное исследование не позволяет провести дифференциальную диагностику между образованием стенки полого органа и экстраорганно расположенным патологическим очагом. Наиболее эффективным методом диагностики подслизистых опухолей до последнего времени оставалось эндоскопическое исследование, при котором визуализируются округлой или овоидной формы образования, деформирующие просвет органа и покрытые в большинстве наблюдений неизмененной слизистой. По косвенным эндоскопическим признакам можно предположить, что данное образование исходит из стенки полого органа, однако четкие критерии, позволяющие провести дифференциальную диагностику между подслизистым образованием и экстраорганной компрессией, отсутствуют. По данным литературы, чувствительность и специфичность рутинного эндоскопического исследования в дифференциальной диагностике между подслизистыми образованиями и экстраорганной компрессией составляют 87 и 29% соответственно [51]. Также визуальное эндоскопическое исследование не дает ответа на вопрос о структуре образования и не позволяет определить, из какого именно слоя стенки полого органа оно происходит.
Однако данное исследование не позволяет провести дифференциальную диагностику между образованием стенки полого органа и экстраорганно расположенным патологическим очагом. Наиболее эффективным методом диагностики подслизистых опухолей до последнего времени оставалось эндоскопическое исследование, при котором визуализируются округлой или овоидной формы образования, деформирующие просвет органа и покрытые в большинстве наблюдений неизмененной слизистой. По косвенным эндоскопическим признакам можно предположить, что данное образование исходит из стенки полого органа, однако четкие критерии, позволяющие провести дифференциальную диагностику между подслизистым образованием и экстраорганной компрессией, отсутствуют. По данным литературы, чувствительность и специфичность рутинного эндоскопического исследования в дифференциальной диагностике между подслизистыми образованиями и экстраорганной компрессией составляют 87 и 29% соответственно [51]. Также визуальное эндоскопическое исследование не дает ответа на вопрос о структуре образования и не позволяет определить, из какого именно слоя стенки полого органа оно происходит.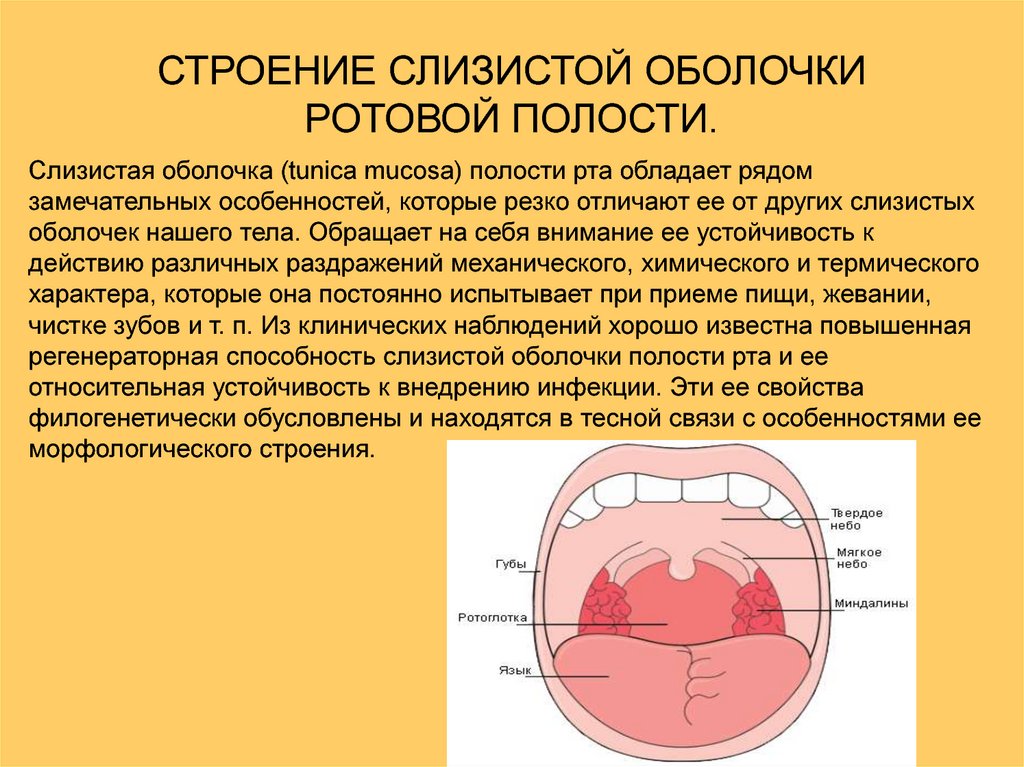 С учетом локализации биопсия по стандартной методике при эндоскопическом исследовании также не дает возможности установить гистологическую природу этих новообразований [8]. Другие неинвазивные лучевые методы диагностики (КТ, УЗИ, МРТ) еще менее чувствительны [40], так как в большинстве наблюдений небольшие подслизистые образования этими методами не выявляются. Возможности диагностики и дифференциальной диагностики неэпителиальных опухолей и неопухолевых образований стенки желудочно-кишечного тракта значительно расширяет эндоскопическая ультрасонография. Этот метод позволяет не только достоверно различать образования стенки и экстраорганные структуры, но и определять слой, из которого происходит новообразование, а оценивая его эхогенную характеристику, четко дифференцировать неэпителиальные опухоли и неопухолевые образования желудочно-кишечного тракта. При морфологическом исследовании становится ясно, что подслизистые образования включают кисты, дистопию ткани поджелудочной железы и целую группу неэпителиальных опухолей мышечного, неврогенного и сосудистого происхождения [48].
С учетом локализации биопсия по стандартной методике при эндоскопическом исследовании также не дает возможности установить гистологическую природу этих новообразований [8]. Другие неинвазивные лучевые методы диагностики (КТ, УЗИ, МРТ) еще менее чувствительны [40], так как в большинстве наблюдений небольшие подслизистые образования этими методами не выявляются. Возможности диагностики и дифференциальной диагностики неэпителиальных опухолей и неопухолевых образований стенки желудочно-кишечного тракта значительно расширяет эндоскопическая ультрасонография. Этот метод позволяет не только достоверно различать образования стенки и экстраорганные структуры, но и определять слой, из которого происходит новообразование, а оценивая его эхогенную характеристику, четко дифференцировать неэпителиальные опухоли и неопухолевые образования желудочно-кишечного тракта. При морфологическом исследовании становится ясно, что подслизистые образования включают кисты, дистопию ткани поджелудочной железы и целую группу неэпителиальных опухолей мышечного, неврогенного и сосудистого происхождения [48].
В последние годы интерес к неэпителиальным опухолям желудочно-кишечного тракта значительно возрос, активно изучаются визуальные и лучевые характеристики этих новообразований, их гистологическое строение, проводятся исследования результатов хирургического и химиотерапевтического лечения пациентов с различными подслизистыми новообразованиями желудочно-кишечного тракта. Своей задачей в данном обзоре мы видим необходимость дать информацию для эндоскопистов и врачей других специальностей о том, каковы могут быть возможные варианты безобидных с виду подслизистых новообразований, так как только своевременная дифференциальная диагностика служит основой решения тактических вопросов.
Гастроинтестинальные стромальные опухоли являются наиболее распространенными среди неэпителиальных опухолей желудочно-кишечного тракта и составляют до 1% всех злокачественных опухолей этой локализации [7, 12, 18, 38, 51, 53]. Эти новообразования ранее расценивались как лейомиомы, лейомиобластомы и лейомиосаркомы, однако иммуногистохимические исследования показали их особую природу [27].
Еще в 1960 г. J. Martin и соавт. [33] опубликовали сообщение о 6 наблюдениях «интрамуральных мышечных опухолей» желудка и предположили мышечное происхождение этих «странных» опухолей [27]. Двумя годами позже A. Stout [55] ввел термин «лейомиобластома» для описания группы «причудливых» миогенных опухолей желудка. В течение двух десятков лет авторы использовали различные названия для удобства описания веретеноклеточных и эпителиоидных опухолей, встречающихся во всех отделах желудочно-кишечного тракта. Первыми термин «гастроинтестинальная стромальная опухоль» (ГИСО) ввели M. Mazur и H. Clark в 1983 г. как компромиссный для описания опухолей с не вполне понятной дифференцировкой [35]. Для этих опухолей характерной была двойственность их фенотипа: гладкомышечный и нейрогенный.
Большой шаг в выяснении морфогенеза ГИСО был сделан в работах S. Hirota [27], который выявил С-kit-позитивные клетки в мышечной оболочке желудочно-кишечного тракта у мышей. Эти клетки располагаются в области интрамуральных сплетений и по локализации совпадают с интерстициальными клетками Кахля, обладающими пейсмекерной активностью. Эти клетки, как и клетки ГИСО, имеют положительную реакцию на С-kit (CD117) в 90% наблюдений. CD117 является трансмембранным белком, внешний фрагмент которого функционирует как рецептор к фактору роста стволовых клеток, а внутренний — как протеинкиназа, регулирующая фосфорилирование сигнальных внутриклеточных молекул, влияющих на деление клетки. Таким образом, мутация протоонкогена С-kit приводит к постоянной стимуляции рецептора CD117 и активации сложного комплекса внутриклеточных сигналов, результатом которых является стимуляция митотической активности и пролиферации клеток [36]. Из молекулярно-генетических нарушений наиболее частой является мутация в экзоне 11 гена С-kit, выявляемая в 60-70% наблюдений. Эти опухоли чувствительны к лекарственной терапии иматинибом. Второй по частоте является мутация в экзоне 9 (5-15%), при данном варианте чаще наблюдается первичная лекарственная резистентность. Редки мутации в экзонах 13 и 17. В некоторых случаях ГИСО не выявляются мутации С-kit, однако имеются мутации других генов.
Эти клетки, как и клетки ГИСО, имеют положительную реакцию на С-kit (CD117) в 90% наблюдений. CD117 является трансмембранным белком, внешний фрагмент которого функционирует как рецептор к фактору роста стволовых клеток, а внутренний — как протеинкиназа, регулирующая фосфорилирование сигнальных внутриклеточных молекул, влияющих на деление клетки. Таким образом, мутация протоонкогена С-kit приводит к постоянной стимуляции рецептора CD117 и активации сложного комплекса внутриклеточных сигналов, результатом которых является стимуляция митотической активности и пролиферации клеток [36]. Из молекулярно-генетических нарушений наиболее частой является мутация в экзоне 11 гена С-kit, выявляемая в 60-70% наблюдений. Эти опухоли чувствительны к лекарственной терапии иматинибом. Второй по частоте является мутация в экзоне 9 (5-15%), при данном варианте чаще наблюдается первичная лекарственная резистентность. Редки мутации в экзонах 13 и 17. В некоторых случаях ГИСО не выявляются мутации С-kit, однако имеются мутации других генов. Значимы также мутации, связанные с рецептором тромбоцитарного фактора роста альфа (PDGFRa), в этих случаях диагноз опухоли устанавливается по совокупности других признаков или требует молекулярно-генетического анализа [26]. Положительная реакция клеток ГИСО на СD34 выявляется в 46-100% наблюдений и зависит от локализации опухоли: наиболее редко эта реакция выявляется при локализации опухоли в тонкой кишке [23]. В настоящее время доказано, что гастроинтестинальные стромальные опухоли — это наиболее частая разновидность мезенхимальных опухолей желудочно-кишечного тракта и большинство опухолей, ранее расценивавшихся как лейомиома, лейомиобластома и лейомиосаркома, трактуются клиницистами и патоморфологами как ГИСО [12].
Значимы также мутации, связанные с рецептором тромбоцитарного фактора роста альфа (PDGFRa), в этих случаях диагноз опухоли устанавливается по совокупности других признаков или требует молекулярно-генетического анализа [26]. Положительная реакция клеток ГИСО на СD34 выявляется в 46-100% наблюдений и зависит от локализации опухоли: наиболее редко эта реакция выявляется при локализации опухоли в тонкой кишке [23]. В настоящее время доказано, что гастроинтестинальные стромальные опухоли — это наиболее частая разновидность мезенхимальных опухолей желудочно-кишечного тракта и большинство опухолей, ранее расценивавшихся как лейомиома, лейомиобластома и лейомиосаркома, трактуются клиницистами и патоморфологами как ГИСО [12].
Наиболее часто встречаются веретеноклеточный (62%), эпителиоидный (17%) и смешанный (21%) гистологические варианты строения ГИСО [1]. Несмотря на различные варианты гистологического строения, все ГИСО считаются потенциально злокачественными [1, 12, 26]. Даже после радикального удаления опухоли (макро- и микроскопически в пределах здоровых тканей) частота рецидивов достигает 30-50%, проявляясь либо метастазами в печень, либо местным рецидивом (метастазы по брюшине). Особенно неблагоприятен прогноз при опухолях тонкой кишки, когда средний уровень выживаемости составляет около 20 мес [41]. Основными путями генерализации гастроинтестинальной стромальной опухоли является метастазирование в печень и распространение по брюшине. Лимфогенное метастазирование для опухоли не характерно [12, 23]. В настоящее время для определения степени злокачественности ГИСО пользуются критериями, предложенными C. Fletcher и соавт. [18] и M. Miettinen и соавт. [38], по которым высокий риск определяется размером опухоли более 5 см, количеством митозов более 5 в 50 полях зрения при увеличении 400 и инвазией опухолью слизистой. Иммуногистохимическим маркером степени злокачественности опухоли является также индекс экспрессии Ki-67, который достоверно возрастает выше 10% в опухолях высокого риска [68].
Особенно неблагоприятен прогноз при опухолях тонкой кишки, когда средний уровень выживаемости составляет около 20 мес [41]. Основными путями генерализации гастроинтестинальной стромальной опухоли является метастазирование в печень и распространение по брюшине. Лимфогенное метастазирование для опухоли не характерно [12, 23]. В настоящее время для определения степени злокачественности ГИСО пользуются критериями, предложенными C. Fletcher и соавт. [18] и M. Miettinen и соавт. [38], по которым высокий риск определяется размером опухоли более 5 см, количеством митозов более 5 в 50 полях зрения при увеличении 400 и инвазией опухолью слизистой. Иммуногистохимическим маркером степени злокачественности опухоли является также индекс экспрессии Ki-67, который достоверно возрастает выше 10% в опухолях высокого риска [68].
Многие авторы отмечают различия в строении и развитии ГИСО в разных отделах желудочно-кишечного тракта.Рисунок 1. Cхема алгоритма лечения гастроинтестинальных стромальных опухолей. Наиболее часто гастроинтестинальные стромальные опухоли встречаются в желудке — до 60-70%. Несмотря на то что, по мнению некоторых авторов, опухоли этой локализации в большинстве наблюдений по гистологическому строению и митотической активности относятся к низкому и среднему риску малигнизации, нередки наблюдения, в которых гистологически благоприятные опухоли рано метастазируют в печень, в то время как опухоли с высоким риском малигнизации остаются клинически более благоприятными [23]. Опухоли тонкой кишки, включая и двенадцатиперстную, встречаются в 20-30% наблюдений и характеризуются более агрессивным течением, более половины из них злокачественные [22]. Гистологически неблагоприятными факторами при опухолях тонкой кишки являются количество митозов и прорастание слизистой. ГИСО с локализацией в пищеводе встречаются крайне редко, составляя 1-2% ГИСО других локализаций, в большинстве же наблюдений в пищеводе выявляются истинные миогенные опухоли. По гистологическому строению ГИСО пищевода сходны с опухолями желудка, однако для пищеводной локализации характерно более агрессивное течение заболевания — злокачественными оказываются более половины опухолей [37].
Наиболее часто гастроинтестинальные стромальные опухоли встречаются в желудке — до 60-70%. Несмотря на то что, по мнению некоторых авторов, опухоли этой локализации в большинстве наблюдений по гистологическому строению и митотической активности относятся к низкому и среднему риску малигнизации, нередки наблюдения, в которых гистологически благоприятные опухоли рано метастазируют в печень, в то время как опухоли с высоким риском малигнизации остаются клинически более благоприятными [23]. Опухоли тонкой кишки, включая и двенадцатиперстную, встречаются в 20-30% наблюдений и характеризуются более агрессивным течением, более половины из них злокачественные [22]. Гистологически неблагоприятными факторами при опухолях тонкой кишки являются количество митозов и прорастание слизистой. ГИСО с локализацией в пищеводе встречаются крайне редко, составляя 1-2% ГИСО других локализаций, в большинстве же наблюдений в пищеводе выявляются истинные миогенные опухоли. По гистологическому строению ГИСО пищевода сходны с опухолями желудка, однако для пищеводной локализации характерно более агрессивное течение заболевания — злокачественными оказываются более половины опухолей [37]. Независимо от локализации большинство гастроинтестинальных стромальных опухолей чувствительны к ингибиторам тирозинкиназы, например к иматиниба мезилату (гливек). Применение этого препарата при ГИСО позволяет стабилизировать течение опухолевого процесса. Однако лечение этим препаратом имеет строгие показания, включающие в основном первично диссеминированные и рецидивные опухоли [5, 10]. Основным же методом лечения локальных форм ГИСО остается хирургический. В настоящее время предложен и используется алгоритм для лечения первично выявленных гастроинтестинальных стромальных опухолей, представленный на схеме [12].
Независимо от локализации большинство гастроинтестинальных стромальных опухолей чувствительны к ингибиторам тирозинкиназы, например к иматиниба мезилату (гливек). Применение этого препарата при ГИСО позволяет стабилизировать течение опухолевого процесса. Однако лечение этим препаратом имеет строгие показания, включающие в основном первично диссеминированные и рецидивные опухоли [5, 10]. Основным же методом лечения локальных форм ГИСО остается хирургический. В настоящее время предложен и используется алгоритм для лечения первично выявленных гастроинтестинальных стромальных опухолей, представленный на схеме [12].
В рекомендациях конференции по тактике лечения ГИСО (март 2004 г.) указывается, что лапароскопическая и лапароскопически ассистированная резекция может использоваться только при небольших (менее 2 см) опухолях, при более крупных образованиях показана лапаротомия с широкой резекцией полого органа, несущего опухоль, и при инвазии — резекция окружающих органов [10]. В то же время многими авторами доказывается эффективность и онкологическая безопасность удаления крупных опухолей лапароскопическим способом [41].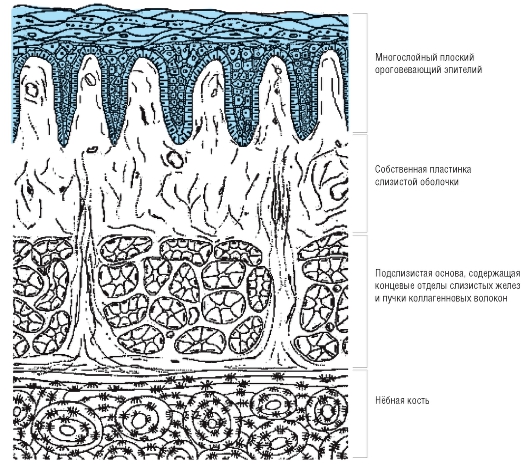 Однако число наблюдений для оценки результатов лапароскопических операций в настоящее время явно недостаточно. В последние годы в связи с развитием внутрипросветной — эндолюминальной хирургии стали возможными эндоскопические вмешательства в виде подслизистой диссекции при небольших ГИСО c низким риском злокачественности и без инвазии в мышечный слой стенки полого органа [28], хотя большинство авторов относятся сдержанно к такому способу лечения.
Однако число наблюдений для оценки результатов лапароскопических операций в настоящее время явно недостаточно. В последние годы в связи с развитием внутрипросветной — эндолюминальной хирургии стали возможными эндоскопические вмешательства в виде подслизистой диссекции при небольших ГИСО c низким риском злокачественности и без инвазии в мышечный слой стенки полого органа [28], хотя большинство авторов относятся сдержанно к такому способу лечения.
При эндоскопическом исследовании опухоли могут выявляться в виде образований округлой или овоидной формы; небольшие образования покрыты неизмененной слизистой, однако нередко можно выявить ее изъязвление над опухолью, что служит прогностически неблагоприятным фактором относительно злокачественности образования и может стать источником желудочно-кишечных кровотечений с развитием анемии, в 50% наблюдений это является поводом для обращения пациентов к врачу и причиной выявления ГИСО [21]. При эндосонографическом исследовании ГИСО визуализируется как гипоэхогенное образование, которое в зависимости от степени злокачественности может иметь как гомогенную, так и гетерогенную структуру и исходить из мышечной пластинки слизистой или мышечного слоя стенки органа [25].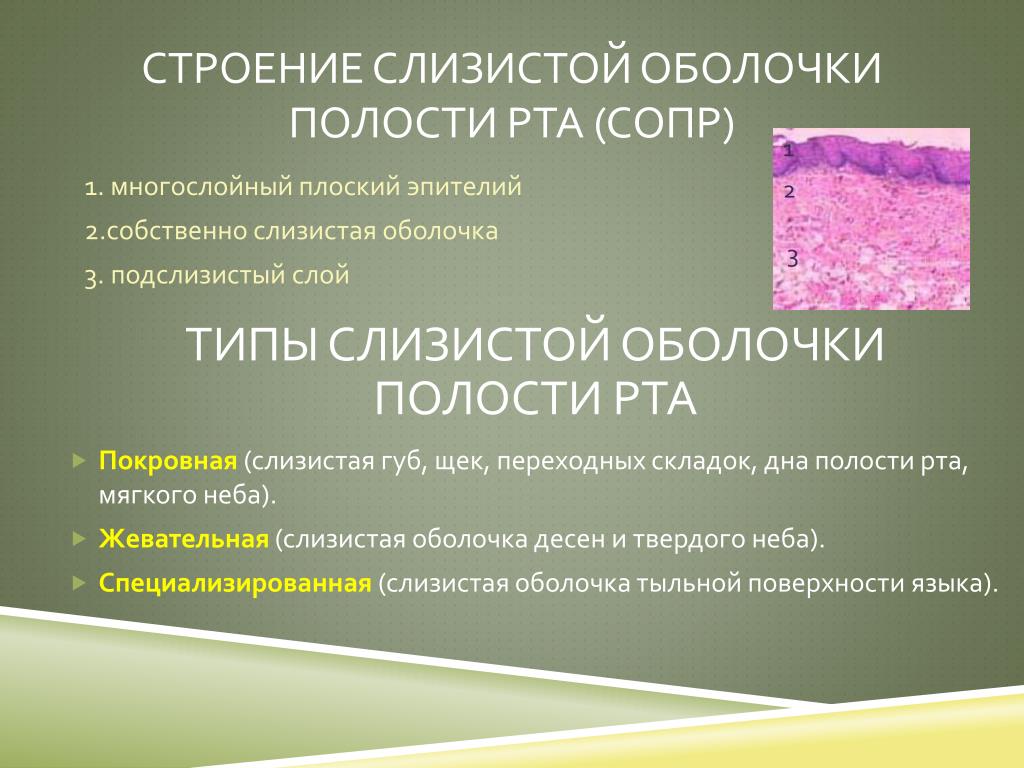
В дифференциально-диагностическом ряду с гастроинтестинальными опухолями находятся мезенхимальные опухоли и другие новообразования, локализующиеся в стенке пищеварительной трубки и покрытые неизмененной слизистой. Наиболее часто гастроинтестинальную опухоль приходится дифференцировать с истинными гладкомышечными опухолями, липомой, шванномой, нейроэндокринной опухолью, эктопированной поджелудочной железой. Такие образования, как воспалительная миофибробластическая опухоль, воспалительный фиброзный полип, гранулярно-клеточные опухоли, нейрофиброма, сосудистые опухоли и метастазы в стенке желудочно-кишечного тракта, встречаются крайне редко и имеют небольшое практическое значение в дифференциальной диагностике.
Истинные мышечные опухоли лейомиома и лейомиосаркома также встречаются в желудочно-кишечном тракте, однако гораздо реже ГИСО. Опухоль может локализоваться в любом отделе пищеварительной трубки, однако наиболее часто — в пищеводе, где составляет до 75% доброкачественных опухолей, в желудке лейомиома в настоящее время встречается в 0,1% всех опухолей этого органа. По гистологическому строению опухоли сходны с ГИСО, но в отличие от нее истинные мышечные опухоли чаще обнаруживаются у молодых пациентов, при иммуногистохимическом исследовании дают отрицательную реакцию на CD117 и CD34 и положительную на десмин и мышечный актин [37]. Образования имеют округлую или овоидную форму, покрыты неизмененной слизистой, при эндосонографии гипоэхогенные, с ровным, четким контуром, гомогенной структуры, исходящие из II (мышечной пластинки слизистой) или IV (мышечного) эхо-слоя [25]. Лейомиома — доброкачественная опухоль, нередко не имеет клинических симптомов, однако при изъязвлении покрывающей слизистой может быть источником кровотечения, приводя к анемии и обусловливая соответствующую клиническую картину [58]. Лейомиосаркома — злокачественная гладкомышечная опухоль, часто приводящая к изъязвлению слизистой и кровотечению. Опухоль радио- и химиoрезистентна, поэтому подлежит обязательному хирургическому лечению [23].
По гистологическому строению опухоли сходны с ГИСО, но в отличие от нее истинные мышечные опухоли чаще обнаруживаются у молодых пациентов, при иммуногистохимическом исследовании дают отрицательную реакцию на CD117 и CD34 и положительную на десмин и мышечный актин [37]. Образования имеют округлую или овоидную форму, покрыты неизмененной слизистой, при эндосонографии гипоэхогенные, с ровным, четким контуром, гомогенной структуры, исходящие из II (мышечной пластинки слизистой) или IV (мышечного) эхо-слоя [25]. Лейомиома — доброкачественная опухоль, нередко не имеет клинических симптомов, однако при изъязвлении покрывающей слизистой может быть источником кровотечения, приводя к анемии и обусловливая соответствующую клиническую картину [58]. Лейомиосаркома — злокачественная гладкомышечная опухоль, часто приводящая к изъязвлению слизистой и кровотечению. Опухоль радио- и химиoрезистентна, поэтому подлежит обязательному хирургическому лечению [23].
Шваннома — доброкачественная нейрогенная опухоль, встречается в желудке, в толстой кишке, реже в пищеводе. При иммуногистохимическом исследовании дает положительную реакцию на S-100, иногда может быть положительной по CD34, но всегда отрицательна по CD117 [49]. По эндоскопической и эндосонографической картине сходна с лейомиомой и гастроинтестинальной стромальной опухолью, дифференциальная диагностика возможна только на основании гистологического и иммуногистохимического исследований [25]. Опухоль доброкачественная и при отсутствии клинических проявлений не требует хирургического лечения.
При иммуногистохимическом исследовании дает положительную реакцию на S-100, иногда может быть положительной по CD34, но всегда отрицательна по CD117 [49]. По эндоскопической и эндосонографической картине сходна с лейомиомой и гастроинтестинальной стромальной опухолью, дифференциальная диагностика возможна только на основании гистологического и иммуногистохимического исследований [25]. Опухоль доброкачественная и при отсутствии клинических проявлений не требует хирургического лечения.
Липома — доброкачественная опухоль из жировой ткани, составляет от 1 до 3% всех доброкачественных неэпителиальных опухолей желудка [6]. Наиболее часто встречается в толстой кишке, но может локализоваться в любом отделе пищеварительной трубки. Опухоль обычно исходит из подслизистого слоя, гистологически имеет типичное строение (жировая ткань). При больших размерах может вызывать непроходимость и кровотечение [53]. При клинических проявлениях и тенденции к росту необходимо удаление опухоли. В последнее время в литературе появляются сообщения об успешном удалении даже больших опухолей эндоскопически без каких-либо осложнений. Авторы отмечают отсутствие рецидива опухоли в сроки наблюдения до 8 лет [63].
В последнее время в литературе появляются сообщения об успешном удалении даже больших опухолей эндоскопически без каких-либо осложнений. Авторы отмечают отсутствие рецидива опухоли в сроки наблюдения до 8 лет [63].
Нейроэндокринные опухоли желудочно-кишечного тракта развиваются в органах, производных от передней кишки эмбриона (пищевод, желудок и двенадцатиперстная кишка), и составляют до 5-8% всех нейроэндокринных опухолей. При локализации в верхних отделах желудочно-кишечного тракта обычно гормонально не активны и выявляются случайно при эндоскопическом исследовании или при оперативных вмешательствах по поводу других заболеваний [19]. Гистологически опухоль представлена в виде гнездных скоплений мелких клеток с круглыми ядрами или в виде тяжей опухолевых клеток, соединенных трабекулами. Образование обычно локализуется во II (мышечной пластинке слизистой) или III (подслизистом) эхо-слое, покрыто неизмененной слизистой, однако иногда покрывающая слизистая может изъязвляться, что также является причиной кровотечений [39]. Нейроэндокринные опухоли обладают определенным злокачественным потенциалом, и чем больше размер опухоли, тем выше риск метастазирования, поэтому при образованиях размером более 2 см рекомендуется их удаление [34].
Нейроэндокринные опухоли обладают определенным злокачественным потенциалом, и чем больше размер опухоли, тем выше риск метастазирования, поэтому при образованиях размером более 2 см рекомендуется их удаление [34].
Воспалительная миофибробластическая опухоль (воспалительная псевдоопухоль или воспалительная фибросаркома) — общее название редких мезенхимальных опухолей, состоящих из веретеновидных клеток (миофибробластов), лимфоцитов и плазматических клеток. Хотя эти опухоли развиваются как реакция на инфекционный процесс, некоторые из них способны к пролиферативному росту и очень редко озлокачествляются [15, 23]. Чаще встречаются в детском возрасте, иммуногистохимически дают положительную реакцию на десмин и актин, в то же время CD117 и CD34 отрицательны [15].
Воспалительный фиброзный полип — подслизистое образование, наиболее часто встречающееся в желудке и терминальном отделе подвздошной кишки. При эндосонографии выявляется гипоэхогенное образование однородной эхо-структуры, локализующееся во II или III эхо-слое, мышечный слой полого органа при этих образованиях интактен. В отличие от лейомиомы или нейроэндокринной опухоли этой локализации воспалительный фиброзный полип имеет нечеткий наружный контур [25]. Опухоль состоит из веретеновидных клеток, мелких сосудов и воспалительных клеток (обычно преобладают эозинофилы, но встречаются и плазматические клетки, и лимфоциты). Большинство этих опухолей дает положительную реакцию на CD34, однако стромальный компонент опухоли отрицателен по CD117 [19, 23].
В отличие от лейомиомы или нейроэндокринной опухоли этой локализации воспалительный фиброзный полип имеет нечеткий наружный контур [25]. Опухоль состоит из веретеновидных клеток, мелких сосудов и воспалительных клеток (обычно преобладают эозинофилы, но встречаются и плазматические клетки, и лимфоциты). Большинство этих опухолей дает положительную реакцию на CD34, однако стромальный компонент опухоли отрицателен по CD117 [19, 23].
Гранулярно-клеточные опухоли — редкие образования желудочно-кишечного тракта. Гистологически они представлены в виде опухоли преимущественного солидного строения, с веретеновидными или овальными клетками, особенностью которых является наличие в цитоплазме эозинофильных гранул. Опухоль, вероятно, смешанного происхождения, так как иммуногистохимически имеет признаки как нейроэктодермального, так и миогенного ростка. Опухоль обычно позитивна по S-100 и дает отрицательную реакцию на десмин, CD117 и CD34 [40]. Проявляется в виде единичных подслизистых узлов или полипов, при эхографии визуализируется как однородное гипоэхогенное образование, с ровным контуром, исходящее из подслизистого или мышечного слоя стенки желудка [25]. Опухоль доброкачественная, редко достигает больших размеров, не метастазирует, не рецидивирует и обычно не требует хирургического лечения [46].
Опухоль доброкачественная, редко достигает больших размеров, не метастазирует, не рецидивирует и обычно не требует хирургического лечения [46].
Нейрофиброма — нейрогенная опухоль, обычно исходящая из ауэрбаховского сплетения и локализующаяся в желудке, тонкой и ободочной кишке, чаще всего в подвздошной кишке. Обычно является признаком нейрофиброматоза типа I (болезнь Реклингхаузена) и часто сопровождается типичными проявлениями на коже (мелкие опухоли на ножке и пятна цвета кофе с молоком). Нейрофиброма может локализоваться в любом отделе желудка, при эндоскопии визуализируется как округлый очаг плотноэластической консистенции, при эндосонографии — как гипоэхогенное образование, локализующееся в IV слое, без гистологического исследования неотличимо от других образований, исходящих из мышечной стенки желудка. Опухоль доброкачественная, однако может малигнизироваться и склонна к рецидивам после удаления [31].
Гемангиома — зрелая доброкачественная опухоль из сосудов. Капиллярная гемангиома — это истинное новообразование с пролиферацией эндотелиальных клеток и формированием атипичных капилляров. Макроскопически представлена красным или синюшным узлом с гладкой или бугристой поверхностью, на разрезе имеет ячеистое строение. Микроскопически опухоль состоит из ветвящихся сосудов капиллярного типа с узким просветом, который не всегда заполнен кровью. Кавернозная гемангиома — новообразование, состоящее из причудливых полостей типа синусоидов различной величины, сообщающихся между собой. Макроскопически имеет вид четко отграниченного от окружающих тканей багрово-синюшного узла, на разрезе напоминающего губку. Микроскопически состоит из тонкостенных каверн, выстланных одним слоем эндотелиальных клеток и заполненных кровью. Венозная гемангиома микроскопически представлена преимущественно сосудами венозного типа [4]. Гемангиомы нередко являются причиной кровотечений и требуют удаления хирургическим или эндоскопическим способом, однако при множественном поражении удаление опухолей затруднено.
Капиллярная гемангиома — это истинное новообразование с пролиферацией эндотелиальных клеток и формированием атипичных капилляров. Макроскопически представлена красным или синюшным узлом с гладкой или бугристой поверхностью, на разрезе имеет ячеистое строение. Микроскопически опухоль состоит из ветвящихся сосудов капиллярного типа с узким просветом, который не всегда заполнен кровью. Кавернозная гемангиома — новообразование, состоящее из причудливых полостей типа синусоидов различной величины, сообщающихся между собой. Макроскопически имеет вид четко отграниченного от окружающих тканей багрово-синюшного узла, на разрезе напоминающего губку. Микроскопически состоит из тонкостенных каверн, выстланных одним слоем эндотелиальных клеток и заполненных кровью. Венозная гемангиома микроскопически представлена преимущественно сосудами венозного типа [4]. Гемангиомы нередко являются причиной кровотечений и требуют удаления хирургическим или эндоскопическим способом, однако при множественном поражении удаление опухолей затруднено. Альтернативным методом лечения при небольших размерах новообразования может являться аргоно-плазменная или электрокоагуляция [16].
Альтернативным методом лечения при небольших размерах новообразования может являться аргоно-плазменная или электрокоагуляция [16].
Другие сосудистые опухоли: гломусная опухоль (гломус-ангиома) состоит из щелевидных сосудов, выстланных эндотелием и окруженных муфтами из эпителиоидных (гломусных) клеток; лимфангиома развивается из лимфатических сосудов, разрастающихся в разных направлениях и образующих узел или диффузное утолщение стенки органа. На разрезе опухоль состоит из полостей разной величины, заполненных лимфой. Эти опухоли имеют доброкачественное течение и при наличии клинической симптоматики могут быть удалены эндоскопически [53].
Эктопированная поджелудочная железа обычно выявляется случайно при эндоскопии, оперативных вмешательствах или на аутопсии. По данным литературы, она встречается у 1 из 500 больных, оперированных по поводу заболеваний верхних отделов желудочно-кишечного тракта. На аутопсии эктопированная поджелудочная железа выявляется в 6-14% случаев [25]. Новообразование имеет строение, характерное для поджелудочной железы, нередко на слизистой, покрывающей образование, можно визуализировать устье выводного протока. В большинстве наблюдений клиническая симптоматика отсутствует, однако возможно развитие осложнений в виде воспаления, кистозной трансформации, изъязвления, кровотечения, обтурации просвета кишки и малигнизации, что оправдывает ее удаление [48].
Новообразование имеет строение, характерное для поджелудочной железы, нередко на слизистой, покрывающей образование, можно визуализировать устье выводного протока. В большинстве наблюдений клиническая симптоматика отсутствует, однако возможно развитие осложнений в виде воспаления, кистозной трансформации, изъязвления, кровотечения, обтурации просвета кишки и малигнизации, что оправдывает ее удаление [48].
Дупликационные кисты — врожденное заболевание, связанное с удвоением любого отдела желудочно-кишечного тракта, встречается крайне редко (примерно 1 на 4500 родившихся) [11]. Клинические проявления чаще бывают у детей. Кисты представляют собой шаровидные жидкостные образования, связанные с мышечным слоем стенки полого органа, имеют эпителиальную выстилку и локализуются в любом отделе от языка до прямой кишки. Обычно это единичные образования, которые могут иметь и не иметь связи с просветом желудочно-кишечного тракта. Клинически они чаще бессимптомны, однако иногда пациенты предъявляют жалобы на дискомфорт в животе, диспепсию, анемию и похудание, иногда может развиваться перитонит вследствие перфорации стенки кисты [42]. При эндоскопии обычно выявляется деформация стенки желудка, и только эндосонография позволяет установить правильный диагноз [56, 57]. С учетом сообщения в литературе о развитии злокачественных опухолей в дупликационных кистах динамическое наблюдение за такими пациентами нецелесообразно, поэтому наиболее адекватным лечением признается хирургическое удаление кисты [30], однако возможность малигнизации дупликационных кист достоверно не доказана. Эндоскопическое и транскутанное пункционное лечение дупликационных кист возможно, но может сопровождаться развитием таких осложнений, как кровотечение и формирование свища [17].
При эндоскопии обычно выявляется деформация стенки желудка, и только эндосонография позволяет установить правильный диагноз [56, 57]. С учетом сообщения в литературе о развитии злокачественных опухолей в дупликационных кистах динамическое наблюдение за такими пациентами нецелесообразно, поэтому наиболее адекватным лечением признается хирургическое удаление кисты [30], однако возможность малигнизации дупликационных кист достоверно не доказана. Эндоскопическое и транскутанное пункционное лечение дупликационных кист возможно, но может сопровождаться развитием таких осложнений, как кровотечение и формирование свища [17].
Обобщая изложенное выше, можно сделать заключение, что современные тенденции в лечении подслизистых новообразований желудочно-кишечного тракта сводятся к следующему алгоритму: при небольших доброкачественных бессимптомных опухолях, таких как лейомиома, шваннома, липома, гранулярно-клеточная опухоль и сосудистые опухоли, проводится динамическое наблюдение, условно доброкачественные и симптоматические доброкачественные опухоли подлежат удалению преимущественно из малоинвазивного эндолюминального доступа [16, 48, 53, 63]. При злокачественных опухолях, к которым относят и солитарные ГИСО, большинство авторов склоняются к необходимости резекции органа из лапаротомного, лапароскопического или лапароскопического трансгастрального доступа [10, 12, 23, 32, 41].
При злокачественных опухолях, к которым относят и солитарные ГИСО, большинство авторов склоняются к необходимости резекции органа из лапаротомного, лапароскопического или лапароскопического трансгастрального доступа [10, 12, 23, 32, 41].
Такой дифференцированный подход к лечебной тактике при подслизистых образованиях предъявляет высокие требования к дооперационной диагностике. Эндосонография открывает новые возможности точной диагностики подслизистых образований. Первым рубежом диагностики является разграничение образований стенки и экстраорганных опухолей, деформирующих просвет полого органа [62]. Наибольшие трудности встречаются при дупликационных кистах, которые часто, особенно при расположении на задней стенке желудка, трактуются диагностами как кистозные опухоли поджелудочной железы [56]. Помимо доказательства связи образования со стенкой органа перед эндосонографией ставится задача установить предположительный диагноз, характер образования и его локализацию относительно слоев стенки полого органа, на основании чего можно косвенно судить о характере поражения (табл. 2) [25].
2) [25].
Совокупность этих данных играет немаловажную роль в определении лечебной тактики и метода удаления опухоли в каждом конкретном наблюдении. Основными характеристиками опухоли, определяемыми при эндосонографии, являются размер образования, эхогенность, внутреннее строение, четкость контура и слой, из которого она исходит [43, 61].
Эхогенность патологического очага — немаловажная характеристика, так как позволяет однозначно дифференцировать из всей группы образований кисты и липомы. Если при эндосонографии визуализируется анэхогенное четко очерченное образование, можно с большой вероятностью предполагать диагноз дупликационной кисты [56, 57]. Однако нередко отмечается негомогенное содержимое кисты, что свидетельствует о неоднородности ее содержимого и может вызывать неоднозначную трактовку характера подслизистого образования [56]. Напротив, липома визуализируется как гиперэхогенное однородное образование, исходящее из подслизистого слоя [39, 63]. Наибольшие трудности возникают при трактовке гипоэхогенных подслизистых опухолей, так как практически все подслизистые образования, за исключением кист и липом, являются гипоэхогенными. Большинство авторов сходятся во мнении, что на основании одной только ультразвуковой картины невозможно достоверно судить о гистологическом варианте той или иной мезенхимальной опухоли [9]. Значимыми критериями в этом случае являются структура, размер и контур образования, на основании анализа которых можно составить представление о степени злокачественности опухоли [54]. L. Palazzo и соавт., E. Shen и соавт. предложены ультразвуковые признаки, говорящие о возможном злокачественном характере опухоли [45, 52, 54]: размер опухоли более 3-4 см, неровный контур образования, наличие внутренних фокусов повышенной эхогенности или кист, стремительный рост при динамическом наблюдении.
Большинство авторов сходятся во мнении, что на основании одной только ультразвуковой картины невозможно достоверно судить о гистологическом варианте той или иной мезенхимальной опухоли [9]. Значимыми критериями в этом случае являются структура, размер и контур образования, на основании анализа которых можно составить представление о степени злокачественности опухоли [54]. L. Palazzo и соавт., E. Shen и соавт. предложены ультразвуковые признаки, говорящие о возможном злокачественном характере опухоли [45, 52, 54]: размер опухоли более 3-4 см, неровный контур образования, наличие внутренних фокусов повышенной эхогенности или кист, стремительный рост при динамическом наблюдении.
M. Miettinen и соавт. [38] на большом клиническом материале показали, что мелкие, до 2 см, ГИСО не имели метастазов, что позволяет отнести небольшой размер опухоли к прогностически благоприятным факторам. Для удобства оценки риска злокачественности опухоли L. Palazzo и соавт. [45] выделили 3 основных критерия: неровность контура опухоли, наличие в ней анэхогенных зон и увеличение регионарных лимфоузлов (последний критерий не актуален для ГИСО). Авторы отмечают, что чувствительность и специфичность каждого из этих признаков составляет 91 и 88% соответственно, достигая 100% при наличии двух признаков из трех.
Авторы отмечают, что чувствительность и специфичность каждого из этих признаков составляет 91 и 88% соответственно, достигая 100% при наличии двух признаков из трех.
В большинстве наблюдений для окончательного определения гистологического характера опухоли необходимо получение ткани опухоли для проведения гистологического и иммуногистохимического исследований. Возможности щипцовой биопсии при подслизистых образованиях значительно ограничены, а выполнение резекции части опухоли для ее гистологического исследования чревато такими осложнениями, как кровотечение из опухоли и диссеминация процесса. Транскутанная биопсия сложна при образованиях небольшого размера и может привести к диссеминации процесса, поэтому ее следует использовать только при крупных, нерезектабельных опухолях для подбора химиотерапии [14]. Тонкоигольная пункция и аспирационная биопсия под контролем эндосонографии открыли новые возможности для морфологического и иммуногистохимического анализа подслизистых новообразований. По мнению P. Chatzipantelis и соавт. [13] и M. Gu и соавт. [24], с внедрением этого метода ГИСО стали диагностировать значительно чаще. Метод позволяет получить материал для гистологического и иммуногистохимического исследований в 60-80% наблюдений [20, 60]. Многие исследователи предпочитают проведение микроскопического исследования непосредственно в операционной для первичной оценки результативности биопсии и при недостаточном количестве материала прибегают к повторной пункции и аспирационной биопсии, что позволяет достигать 100% эффективности манипуляции [8]. По данным P. Chatzipantelis и соавт. [13], гистологическая верификация диагноза при анализе мазка в операционной достигала 82,4%, в 17,6% наблюдений потребовалось проведение иммуногистохимического исследования фиксированного материала. По данным разных авторов, диагностическая точность аспирационной биопсии под контролем эндоскопического УЗИ составляет от 91 до 100% [7, 8, 30].
По мнению P. Chatzipantelis и соавт. [13] и M. Gu и соавт. [24], с внедрением этого метода ГИСО стали диагностировать значительно чаще. Метод позволяет получить материал для гистологического и иммуногистохимического исследований в 60-80% наблюдений [20, 60]. Многие исследователи предпочитают проведение микроскопического исследования непосредственно в операционной для первичной оценки результативности биопсии и при недостаточном количестве материала прибегают к повторной пункции и аспирационной биопсии, что позволяет достигать 100% эффективности манипуляции [8]. По данным P. Chatzipantelis и соавт. [13], гистологическая верификация диагноза при анализе мазка в операционной достигала 82,4%, в 17,6% наблюдений потребовалось проведение иммуногистохимического исследования фиксированного материала. По данным разных авторов, диагностическая точность аспирационной биопсии под контролем эндоскопического УЗИ составляет от 91 до 100% [7, 8, 30].
Учитывая сложности дооперационной диагностики и сохранение даже малого процента вероятности ошибки, в том числе при исследовании биоптата, мы считаем, что любые подслизистые образования подлежат хирургическому лечению. Эндосонография при подслизистых образованиях позволяет, во-первых, дифференцировать подслизистые образования с опухолями окружающих органов. Во-вторых, метод незаменим при выборе лечебной тактики. При выявлении крупных, выходящих за пределы органа опухолей, которые по данным эндосонографии имеют признаки злокачественности, необходимо решать вопрос о выполнении лапаротомии для широкой резекции органа. При опухолях меньшего размера с пограничными признаками злокачественности, что наиболее часто встречается в повседневной практике, эндосонография является решающим методом, определяющим способ удаления новообразования. Способ удаления следует выбирать исходя из локализации опухоли по отношению к слоям стенки желудка. Если опухоль исходит из мышечного (IV) эхо-слоя, ее удаление эндоскопическим способом с высокой вероятностью может привести к перфорации органа, кроме того, наиболее частой неэпителиальной опухолью, исходящей из мышечного слоя, является ГИСО. В таких ситуациях оптимальной и онкологически оправданной следует считать полнослойную резекцию органа, несущего опухоль, что на сегодняшний день возможно выполнить адекватно и безопасно из лапароскопического доступа.
Эндосонография при подслизистых образованиях позволяет, во-первых, дифференцировать подслизистые образования с опухолями окружающих органов. Во-вторых, метод незаменим при выборе лечебной тактики. При выявлении крупных, выходящих за пределы органа опухолей, которые по данным эндосонографии имеют признаки злокачественности, необходимо решать вопрос о выполнении лапаротомии для широкой резекции органа. При опухолях меньшего размера с пограничными признаками злокачественности, что наиболее часто встречается в повседневной практике, эндосонография является решающим методом, определяющим способ удаления новообразования. Способ удаления следует выбирать исходя из локализации опухоли по отношению к слоям стенки желудка. Если опухоль исходит из мышечного (IV) эхо-слоя, ее удаление эндоскопическим способом с высокой вероятностью может привести к перфорации органа, кроме того, наиболее частой неэпителиальной опухолью, исходящей из мышечного слоя, является ГИСО. В таких ситуациях оптимальной и онкологически оправданной следует считать полнослойную резекцию органа, несущего опухоль, что на сегодняшний день возможно выполнить адекватно и безопасно из лапароскопического доступа. Образование небольших размеров, исходящее из мышечной пластинки слизистой (особенно в пищеводе), с отсутствием признаков злокачественности может быть удалено эндоскопически — эндолюминально методами подслизистой диссекции. Аналогичный способ удаления можно предложить для образований, локализующихся в III слое, где вероятность злокачественных опухолей минимальна. Таким образом, эндосонография является важнейшим методом в диагностике неэпителиальных опухолей желудочно-кишечного тракта, позволяющим проводить их дифференциальную диагностику, и играет немалую роль в определении тактики и способа лечения пациентов с подслизистыми образованиями.
Образование небольших размеров, исходящее из мышечной пластинки слизистой (особенно в пищеводе), с отсутствием признаков злокачественности может быть удалено эндоскопически — эндолюминально методами подслизистой диссекции. Аналогичный способ удаления можно предложить для образований, локализующихся в III слое, где вероятность злокачественных опухолей минимальна. Таким образом, эндосонография является важнейшим методом в диагностике неэпителиальных опухолей желудочно-кишечного тракта, позволяющим проводить их дифференциальную диагностику, и играет немалую роль в определении тактики и способа лечения пациентов с подслизистыми образованиями.
Подводя итог изложенному, хотелось бы еще раз подчеркнуть, что подслизистые новообразования являются широкой группой заболеваний, которая требует серьезного обследования, дифференциальной диагностики и лечения с использованием современных эндоскопических методов. В связи с выделением потенциально злокачественных гастроинтестинальных стромальных опухолей, которые считаются самыми распространенными неэпителиальными опухолями желудочно-кишечного тракта, и трудностью проведения дифференциальной диагностики их с другими неэпителиальными опухолями подход к ведению и лечению таких пациентов на сегодняшний день изменился. При выявлении во время эндоскопического исследования подслизистых новообразований необходимо дифференцировать их от сдавления органа извне с помощью других уточняющих методов исследования, таких как УЗИ, КТ, МРТ. Однако самым точным методом диагностики, позволяющим определить органную принадлежность опухоли и слой стенки полого органа, из которого она исходит, является эндосонография, данные которой определяют выбор метода лечения подслизистых новообразований желудочно-кишечного тракта.
При выявлении во время эндоскопического исследования подслизистых новообразований необходимо дифференцировать их от сдавления органа извне с помощью других уточняющих методов исследования, таких как УЗИ, КТ, МРТ. Однако самым точным методом диагностики, позволяющим определить органную принадлежность опухоли и слой стенки полого органа, из которого она исходит, является эндосонография, данные которой определяют выбор метода лечения подслизистых новообразований желудочно-кишечного тракта.
Мы считаем, что выявленные подслизистые образования необходимо удалять с последующими гистологическим и иммуногистохимическим исследованиями. Исключения составляют диссеминированные формы ГИСО, при которых необходимо проведение комплексного лечения в специализированных стационарах. Вместе с тем при наличии мелких бессимптомных образований, не имеющих признаков злокачественности, особенно исходящих из мышечной оболочки пищевода, возможно динамическое наблюдение. При этом мы руководствуемся тем, что ГИСО для пищевода наименее характерны, а радикальное удаление опухоли, исходящей из мышечного слоя, требует резекции стенки органа, т. е. торакоскопии или торакотомии. Таким образом, имеется несоответствие риска оперативного вмешательства и риска прогрессирования заболевания. При выборе хирургического доступа необходимо руководствоваться размером опухоли, ее распространенностью за пределы органа и наличием признаков злокачественности. Пограничные опухоли или вызывающие те или иные жалобы у пациентов подлежат удалению по возможности из малоинвазивного доступа. Способ удаления следует выбирать, принимая во внимание слой стенки органа, из которой исходит опухоль. При локализации опухоли в мышечной пластинке слизистой или в подслизистом слое предпочтение следует отдавать эндоскопическим методам лечения. Если опухоль исходит из мышечного слоя, необходимо выполнять лапароскопическую резекцию. При наличии признаков злокачественности, выявляемых при эндосонографии, следует производить операцию лапаротомным способом, используя широкую резекцию с лимфаденэктомией.
е. торакоскопии или торакотомии. Таким образом, имеется несоответствие риска оперативного вмешательства и риска прогрессирования заболевания. При выборе хирургического доступа необходимо руководствоваться размером опухоли, ее распространенностью за пределы органа и наличием признаков злокачественности. Пограничные опухоли или вызывающие те или иные жалобы у пациентов подлежат удалению по возможности из малоинвазивного доступа. Способ удаления следует выбирать, принимая во внимание слой стенки органа, из которой исходит опухоль. При локализации опухоли в мышечной пластинке слизистой или в подслизистом слое предпочтение следует отдавать эндоскопическим методам лечения. Если опухоль исходит из мышечного слоя, необходимо выполнять лапароскопическую резекцию. При наличии признаков злокачественности, выявляемых при эндосонографии, следует производить операцию лапаротомным способом, используя широкую резекцию с лимфаденэктомией.
В заключение хотелось бы сказать, что благодаря появлению такого метода эндоскопического исследования, как эндосонография, подход к диагностике и лечению пациентов с подслизистыми образованиями желудочно-кишечного тракта претерпел значительные изменения. Точность в постановке верного диагноза увеличилась в разы, что обусловливает улучшение исходов лечения данной группы пациентов.
Точность в постановке верного диагноза увеличилась в разы, что обусловливает улучшение исходов лечения данной группы пациентов.
Гистология слизистой оболочки полости рта — StatPearls
Введение
Слизистая оболочка, выстилающая структуры в пределах полости рта, известна как слизистая оболочка полости рта . Это влажная оболочка мягких тканей, простирающаяся от места соединения красной каймы губ и слизистой оболочки губ спереди до небно-глоточных складок сзади.
Гистологически слизистая оболочка полости рта состоит из трех слоев: поверхностного плоского многослойного эпителия, известного как эпителия полости рта , толщина и степень ороговения которого зависят от локализации и функциональных требований [1]. Ниже находится подлежащая соединительная ткань, известная как lamina propria, и плотная соединительная ткань неправильной формы, подслизистая оболочка, которая находится на самом глубоком уровне. Последний отсутствует в некоторых отделах ротовой полости, где собственная пластинка непосредственно связана с костью или мышцей.
Слизистую оболочку полости рта можно разделить на выстилающую слизистую оболочку, жевательную слизистую оболочку и специализированную слизистую оболочку с характерными гистологическими, клиническими и функциональными особенностями. Разнообразие функций, которые развивает слизистая оболочка полости рта, в основном включает защиту подлежащих тканей от механических, химических и биологических раздражителей, секрецию основных веществ и сенсорную функцию, которая позволяет воспринимать температуру, прикосновение, боль и вкус [2]. [3][4][2].
Структура
Эпителий полости рта
Вся поверхность слизистой оболочки полости рта покрыта многослойным плоским эпителием. Это высокоорганизованная бессосудистая и полупроницаемая ткань, толщина и степень ороговения которой варьируются в зависимости от расположения в ротовой полости и функциональных и механических требований этой области. Межпальцевый интерфейс соединяет эпителий и собственную пластинку. Волнообразные выступы более глубокого слоя эпителия, известные как сетчатые штифты , прикрепляются к нижележащим папиллярным отросткам собственной пластинки. Между этими двумя тканями находится неклеточная базальная мембрана, с которой плотно связан эпителий. Базальная мембрана обеспечивает поддержку эпителия и соединяет его с соединительной тканью. При световой микроскопии она видна как демаркационная линия между эпителием и соединительной тканью собственной пластинки. Однако это лучше видно с помощью электронной микроскопии, которая четко показывает базальную пластинку, которая далее подразделяется на прозрачную пластинку и плотную пластинку.
Волнообразные выступы более глубокого слоя эпителия, известные как сетчатые штифты , прикрепляются к нижележащим папиллярным отросткам собственной пластинки. Между этими двумя тканями находится неклеточная базальная мембрана, с которой плотно связан эпителий. Базальная мембрана обеспечивает поддержку эпителия и соединяет его с соединительной тканью. При световой микроскопии она видна как демаркационная линия между эпителием и соединительной тканью собственной пластинки. Однако это лучше видно с помощью электронной микроскопии, которая четко показывает базальную пластинку, которая далее подразделяется на прозрачную пластинку и плотную пластинку.
Слизистую оболочку полости рта можно разделить на три типа, которые различаются гистологически, клинически и функционально. Слизистая оболочка, которая выстилает подвижные структуры рта, получила название выстилки, или подвижной слизистой оболочки , которая находится на мягком небе, щеках, губах, слизистой оболочке альвеол, дне рта и вестибулярном своде. Тип эпителия, покрывающего слизистую оболочку, представляет собой неороговевающих многослойных плоскоклеточных эпителий [1]. Жесткая слизистая оболочка, плотно связанная с подлежащей костью в прикрепленной десне и твердом небе, известна как 9.0005 жевательная слизистая оболочка . Тип эпителия, покрывающего эти поверхности, представляет собой ороговевший или паракератинизированный многослойный плоский эпителий, который обеспечивает способность жевательной слизистой оболочки лучше выдерживать нагрузку, которой она подвергается во время жевания. Наконец, на спинке языка есть специализированная слизистая оболочка, на которой виден многослойный плоский эпителий, который может быть либо кератинизированным , либо некератинизированным . Он получил это название из-за своей уникальной особенности наличия различных типов языковых сосочков и вкусовых рецепторов, которые позволяют воспринимать вкус. Поскольку спинка языка активно участвует в жевании, эту слизистую оболочку иногда также классифицируют как жевательную слизистую оболочку.
Тип эпителия, покрывающего слизистую оболочку, представляет собой неороговевающих многослойных плоскоклеточных эпителий [1]. Жесткая слизистая оболочка, плотно связанная с подлежащей костью в прикрепленной десне и твердом небе, известна как 9.0005 жевательная слизистая оболочка . Тип эпителия, покрывающего эти поверхности, представляет собой ороговевший или паракератинизированный многослойный плоский эпителий, который обеспечивает способность жевательной слизистой оболочки лучше выдерживать нагрузку, которой она подвергается во время жевания. Наконец, на спинке языка есть специализированная слизистая оболочка, на которой виден многослойный плоский эпителий, который может быть либо кератинизированным , либо некератинизированным . Он получил это название из-за своей уникальной особенности наличия различных типов языковых сосочков и вкусовых рецепторов, которые позволяют воспринимать вкус. Поскольку спинка языка активно участвует в жевании, эту слизистую оболочку иногда также классифицируют как жевательную слизистую оболочку.
Четыре слоя образуют эпителий ротовой полости в ороговевшей слизистой оболочке полости рта, что характерно для жевательной слизистой оболочки. Начиная с более глубокого слоя, мы обнаружили базальный слой, за которым следовали шиповатый, зернистый и роговой слои. Когда эпителий неороговевает, например, в слизистой оболочке, над базальным слоем есть нитевидный и растянутый слои [1]. Кроме того, в неороговевающем эпителии, видимом на слизистой оболочке, отсутствует зернистый слой, а шиповатый слой, как известно, обычно тоньше [5]. Клетки, образующие эпителий, прикреплены друг к другу десмосомами и постепенно уплощаются от базального слоя вверх к роговому слою, где они приобретают чешуйчатый или чешуйчатый вид. Клетки плоского эпителия известны как кератиноциты, поскольку они в основном состоят из цитокератинов.
Базальный слой представляет собой слой кубовидных или столбчатых клеток, которые находятся над базальной мембраной, к которой их прикрепляют полудесмосомы. Эти клетки известны своей митотической способностью. Непосредственно над базальным слоем несколько слоев более крупных клеток, называемых шиповатыми клетками, из-за их формы образуют шиповатый слой. Наступает зернистый слой; затем эти клетки содержат мелкие цитоплазматические гранулы кератогиалина, которые сильно окрашиваются гематоксилином. Наконец, более поверхностный слой, stratum superficiale или stratum corneum, представляет собой ороговевший слой, состоящий из очень плоских клеток, на которые указывает отсутствие ядра и окрашивание эозином в розовый цвет [6].
Непосредственно над базальным слоем несколько слоев более крупных клеток, называемых шиповатыми клетками, из-за их формы образуют шиповатый слой. Наступает зернистый слой; затем эти клетки содержат мелкие цитоплазматические гранулы кератогиалина, которые сильно окрашиваются гематоксилином. Наконец, более поверхностный слой, stratum superficiale или stratum corneum, представляет собой ороговевший слой, состоящий из очень плоских клеток, на которые указывает отсутствие ядра и окрашивание эозином в розовый цвет [6].
Восполнение эпителия полости рта
Эпителиальные клетки ротовой полости часто заменяются клеточным делением примерно каждые 14–21 день. Это связано с тем, что ротовая полость постоянно подвергается высоким функциональным требованиям, что обуславливает необходимость частого оборота. Процесс пополнения начинается в базальном слое, в основном образованном митотичными клетками, которые сначала подвергаются пролиферации, а затем процессам дифференцировки и миграции [2]. Известно, что оборот подвижной слизистой оболочки происходит быстрее, чем жевательной (см. табл. 1). Для поддержания гомеостаза эпителия необходима дифференцировка и десквамация на поверхности, которая уравновешивает деление клеток. Когда гомеостаз изменяется под воздействием таких факторов, как старение или патологические состояния, это может привести к гиперпластическому или атрофическому эпителию [7].
Известно, что оборот подвижной слизистой оболочки происходит быстрее, чем жевательной (см. табл. 1). Для поддержания гомеостаза эпителия необходима дифференцировка и десквамация на поверхности, которая уравновешивает деление клеток. Когда гомеостаз изменяется под воздействием таких факторов, как старение или патологические состояния, это может привести к гиперпластическому или атрофическому эпителию [7].
Таблица 1: Время оборота эпителиальных клеток в выбранных тканях[7]
Популяция клеток, не содержащих кератиноцитов
Помимо кератиноцитов, в эпителии ротовой полости постоянно находятся другие специализированные клетки, называемые некератиноцитарными клетками, включая меланоциты, клетки Лангергана и клетки Меркеля. Более того, другие различные воспалительные клетки могут временно мигрировать в эпителий ротовой полости.
Меланоциты
Меланоциты представляют собой продуцирующие меланин удлиненные дендритные клетки, расположенные в базальном слое ротового эпителия, которые происходят из нервного гребня, а затем мигрируют в кожу и слизистую оболочку полости рта, где они и находятся [8]. Эти клетки содержат белки, необходимые для синтеза меланина и процесса созревания меланосом. Меланоциты синтезируют меланин в виде структур, известных как меланосомы, которые затем переносятся в цитоплазму соседних эпителиальных клеток благодаря своим длинным дендритным отросткам, простирающимся между кератиноцитами. Соотношение меланоцитов к кератиноцитам в базальном слое эпителия полости рта колеблется от 1:10 до 1:15 [9].][10][11]. Стволовые клетки меланоцитов, чья ниша в ротовой полости до сих пор неизвестна, поддерживают популяцию зрелых меланоцитов благодаря своей способности к регенерации и дифференцировке [10].
Эти клетки содержат белки, необходимые для синтеза меланина и процесса созревания меланосом. Меланоциты синтезируют меланин в виде структур, известных как меланосомы, которые затем переносятся в цитоплазму соседних эпителиальных клеток благодаря своим длинным дендритным отросткам, простирающимся между кератиноцитами. Соотношение меланоцитов к кератиноцитам в базальном слое эпителия полости рта колеблется от 1:10 до 1:15 [9].][10][11]. Стволовые клетки меланоцитов, чья ниша в ротовой полости до сих пор неизвестна, поддерживают популяцию зрелых меланоцитов благодаря своей способности к регенерации и дифференцировке [10].
Все люди имеют одинаковое количество меланоцитов в слизистой оболочке полости рта и коже. Различные цвета кожи и пигментация слизистой оболочки полости рта определяются размером и количеством меланосом и типом синтезируемого меланина, эумеланина или феомеланина. Гранулы меланина, представляющие собой группы меланосом, можно наблюдать под микроскопом в сильно пигментированной ткани, окрашенной гематоксилином и эозином.
Известно, что функция, которую меланоциты выполняют в организме человека, хотя и не совсем понятна, заключается в производстве меланина, который способствует определению цвета кожи, слизистых оболочек, волос и глаз. В то же время меланин защищает эти ткани от вредного воздействия ультрафиолетового света, активных форм кислорода и свободных радикалов, присутствующих в окружающей среде [10]. Стоит отметить, что с возрастом количество ротовых меланоцитов увеличивается, и, следовательно, увеличивается степень и интенсивность пигментации полости рта, которые считаются физиологическими [12][13][14]. Предполагается, что это увеличение может быть результатом кумулятивных возможных меланогенных стимулов, таких как воспалительные состояния, лекарства, повторяющиеся и легкие функциональные травмы или табачный дым [15].
Клетки Лангерганса
Клетки Лангерганса представляют собой дендритные клетки, происходящие из костного мозга, которые мигрируют в эпителий ротовой полости, где они располагаются в шиповидном слое. Они необходимы для иммунного надзора за тканью, поскольку они функционируют как антигенпрезентирующие клетки, фагоцитируя антигены в эпителии и мигрируя в нижележащую собственную пластинку, откуда они могут достигать регионарных лимфатических узлов. Здесь они превращают антигенные белки в антигенные пептиды, которые впоследствии представляются Т-клеткам [16]. Таким образом, клетки Лангерганса являются связующим звеном между слизистой оболочкой полости рта и иммунной системой. Ультраструктурной отличительной особенностью этих клеток являются палочковидные органеллы, иногда описываемые как «теннисные ракетки», находящиеся исключительно в цитоплазме клеток Лангерганса, называемые гранулами или тельцами Бирбека. Клетки Лангерганса можно наблюдать с помощью специфических иммуногистохимических реакций, таких как иммуногистохимия S-100.
Они необходимы для иммунного надзора за тканью, поскольку они функционируют как антигенпрезентирующие клетки, фагоцитируя антигены в эпителии и мигрируя в нижележащую собственную пластинку, откуда они могут достигать регионарных лимфатических узлов. Здесь они превращают антигенные белки в антигенные пептиды, которые впоследствии представляются Т-клеткам [16]. Таким образом, клетки Лангерганса являются связующим звеном между слизистой оболочкой полости рта и иммунной системой. Ультраструктурной отличительной особенностью этих клеток являются палочковидные органеллы, иногда описываемые как «теннисные ракетки», находящиеся исключительно в цитоплазме клеток Лангерганса, называемые гранулами или тельцами Бирбека. Клетки Лангерганса можно наблюдать с помощью специфических иммуногистохимических реакций, таких как иммуногистохимия S-100.
Ячейки Меркель
Клетки Меркеля представляют собой медленно адаптирующиеся сенсорные сенсорные рецепторы, связанные с нервным чувствительным окончанием, расположенным преимущественно в эпидермисе; однако они также обнаруживаются на слизистой оболочке полости рта в базальном слое [17][18]. Они имеют цитоплазматические пузырьки, обычно расположенные рядом со сцепленными с ними нервными волокнами. Было высказано предположение, что эти структуры высвобождают молекулы медиатора в синапсоподобное соединение, расположенное между нервным волокном и клеткой Меркеля, которое генерирует нервный импульс.
Они имеют цитоплазматические пузырьки, обычно расположенные рядом со сцепленными с ними нервными волокнами. Было высказано предположение, что эти структуры высвобождают молекулы медиатора в синапсоподобное соединение, расположенное между нервным волокном и клеткой Меркеля, которое генерирует нервный импульс.
В полости рта они в основном локализуются в ороговевших эпителиях десен верхней и нижней челюсти и твердом небе. Однако эти комплексы клеток Меркеля и нейритов расположены в большем количестве в слизистой оболочке язычных десен. Поэтому считается, что они действуют как медленно адаптирующиеся механорецепторы и дают соматосенсорную информацию о положении языка [18].
Известно, что у пациентов, которые носят полные съемные протезы, снижается оральная чувствительность из-за потери периодонтальной связки. Недавние исследования показали возможность того, что увеличение количества клеток Меркеля может помочь частично компенсировать потерю механорецепции из-за потери периодонтальной связки у таких пациентов. Несмотря на это, оральная чувствительность пациентов с полной адентией останется нарушенной [19].].
Несмотря на это, оральная чувствительность пациентов с полной адентией останется нарушенной [19].].
Lamina Propria
Под эпителием находится слой соединительной ткани, называемый lamina propria , состоящий из кровеносных сосудов, нервов, фибробластов, макрофагов, тучных клеток и волокон воспалительных клеток, погруженных в аморфное вещество, образованное протеогликанами и гликопротеинами. Собственная пластинка подразделяется на два слоя: поверхностный сосочковый слой и более глубокий сетчатый слой. Сосочковый слой образован тонкими беспорядочно ориентированными коллагеновыми волокнами, образующими волнообразные гребни сосочков, которые соединяются с эпителием; эта поверхность обеспечивает более широкую область для транспорта питательных веществ [20]. В сосочковом слое обнаруживается множество капиллярных петель. Ретикулярный слой расположен между сосочковым слоем и нижележащей структурой (подслизистой оболочкой или надкостницей в зависимости от региона) и образован более толстыми коллагеновыми волокнами, которые ориентированы параллельно поверхности, хотя базальные волокна постепенно располагаются так, чтобы перпендикулярно соединяться с надкостницей [21]. ]. Эти волокнистые прикрепления называются слизисто-надкостничными, что обеспечивает способность сопротивляться сжатию и сдвигу слизистой оболочки полости рта благодаря прочному соединению с костью [22].
]. Эти волокнистые прикрепления называются слизисто-надкостничными, что обеспечивает способность сопротивляться сжатию и сдвигу слизистой оболочки полости рта благодаря прочному соединению с костью [22].
Основной клеткой собственной пластинки пластинки является фибробласт, выполняющий основные функции. Он участвует в синтезе и восполнении соединительных волокон и аморфного вещества, а также в заживлении ран, где увеличивается количество фибробластов. При некоторых состояниях, таких как разрастание десен, вызванное лекарствами, индуцирующие препараты вызывают активацию и пролиферацию фибробластов тканей десны, что приводит к повышенной секреции гликозаминогликанов аморфного вещества [23]. Макрофаги в основном участвуют в фагоцитарной активности, а также стимулируют пролиферацию фибробластов во время заживления ран. Наконец, тучные клетки также обнаруживаются в соединительной ткани собственной пластинки. Отличительной их особенностью являются цитоплазматические гранулы, содержащие гепарин и гистамин, последний известен тем, что инициирует сосудистые изменения при воспалительном процессе. Двумя основными волокнами, обнаруженными в соединительной ткани собственной пластинки, являются коллаген и эластин, где основными являются коллагеновые волокна типа I и III.
Двумя основными волокнами, обнаруженными в соединительной ткани собственной пластинки, являются коллаген и эластин, где основными являются коллагеновые волокна типа I и III.
Подслизистая основа
Под собственной пластинкой находится слой фиброколлагеновой и эластичной ткани, содержащий кровеносные сосуды и нервы, известный как подслизистая оболочка. В зависимости от локализации подслизистая оболочка может содержать жировую ткань, малые слюнные железы, лимфоидную ткань и мышечную ткань. Подслизистая оболочка обнаруживается во всех отделах щечной полости, кроме прикрепленной десны и твердого неба, покрытого жевательной слизистой оболочкой, где подслизистый слой отсутствует, а собственная пластинка непосредственно прикреплена к подлежащей кости, образуя слизисто-надкостничную оболочку.
Эктопические сальные железы, известные как гранулы Фордайса, могут быть обнаружены в подслизистом слое слизистой оболочки полости рта в некоторых местах. Несмотря на то, что они всегда считались нормальным вариантом, недавние исследования показали, что у людей с повышенным липидным профилем количество гранул Фордайса больше. Таким образом, этот клинический признак не следует игнорировать. Чаще всего они локализуются на слизистой оболочке щек и губ. Возраст и курение уменьшают их плотность [24].
Таким образом, этот клинический признак не следует игнорировать. Чаще всего они локализуются на слизистой оболочке щек и губ. Возраст и курение уменьшают их плотность [24].
Функция
Защитная функция
Полость рта представляет собой среду, постоянно подвергающуюся воздействию механических, химических и биологических раздражителей нашей повседневной деятельности. Слизистая оболочка полости рта играет важную роль в защите подлежащих тканей от механических сил, связанных с нормальной функцией жевания (растяжение, сжатие и истирание из-за жесткой диеты), внешних антигенов и вредных молекул из пищи. Кроме того, слизистая оболочка полости рта также подвергается воздействию канцерогенных веществ, содержащихся в алкоголе, табаке и бетеле, потребляемых в некоторых регионах. Эпителий полости рта действует как барьер против этих физиологических и патогенных стрессов. Он действует как физический и иммунный барьер для внешней агрессии и предотвращает проникновение нормальной бактериальной флоры полости рта, которая может вызвать инфекцию. Эпителий полости рта достигает этого за счет того, что состоит из многослойных эпителиальных клеток и межклеточных соединений и поддерживает иммунный ответ на антигены благодаря наличию дендритных клеток (DC) и Т-хелперных клеток 17 (Th27) [2].
Эпителий полости рта достигает этого за счет того, что состоит из многослойных эпителиальных клеток и межклеточных соединений и поддерживает иммунный ответ на антигены благодаря наличию дендритных клеток (DC) и Т-хелперных клеток 17 (Th27) [2].
Секрет
Основным веществом, выделяемым слизистой оболочкой полости рта, является слюна, которая выделяется протоками больших и малых слюнных желез. В состав подслизистой оболочки входят широко распространенные в полости рта малые слюнные железы. Тем не менее основные слюнные железы, являющиеся основным источником слюны, располагаются за пределами слизистой оболочки полости рта. Однако их выводные протоки открываются в ротовую полость, способствуя поддержанию влажности тканей. Слизистая оболочка полости рта имеет меньшее количество сальных желез, зарегистрированных на губах, слизистой оболочке губ и щек у большинства взрослого населения и могут быть обнаружены спорадически в альвеолярной слизистой оболочке. Эти железы выделяют жировое вещество, известное как кожное сало, функции которого еще не определены. Однако недавние исследования кожного сала показывают, что он может играть роль в иммунитете [25].
Однако недавние исследования кожного сала показывают, что он может играть роль в иммунитете [25].
Сенсорная функция
Полость рта получает сенсорную иннервацию от трех ветвей тройничного нерва. В слизистой оболочке полости рта в основном присутствуют три типа сенсорных окончаний, состоящие из дисков Меркеля, тельцов Мейснера и свободных нервных окончаний, которые позволяют слизистой оболочке полости рта воспринимать и реагировать на раздражители температуры, прикосновения и боли. Кроме того, он воспринимает вкусовые ощущения соленого, сладкого, кислого, горького и умами, хотя недавно было высказано предположение, что также может быть вкусовое ощущение жира [3][4]. Рецепторные клетки вкуса локализуются на спинке языка и мягком небе. Слизистые оболочки гортани, глотки и верхних отделов пищевода также содержат эти рецепторы. Сенсорная функция полости рта необходима для опознавания предметов, влияния на действия, совершаемые при жевании, и инициации глотательного рефлекса. Осязание позволяет координировать движения языка, губ и мягкого неба, чтобы правильно издавать звуки при разговоре [26].
Осязание позволяет координировать движения языка, губ и мягкого неба, чтобы правильно издавать звуки при разговоре [26].
Подготовка ткани
Образец биопсии слизистой оболочки полости рта можно исследовать под микроскопом после соответствующей обработки. Этапы подготовки образцов могут включать правильную консервацию тканей, обезвоживание, очистку, инфильтрацию парафином, создание срезов и окрашивание, чаще всего гематоксилином и эозином (H&E). Метод H&E точно дифференцирует различные клеточные компоненты, окрашивая ядро и цитоплазму контрастными цветами [27].
Гистохимия и цитохимия
Некоторые компоненты слизистой оболочки полости рта идентифицируются методами иммуногистохимии. Например, клетки Лангергана требуют специфических иммуногистохимических реакций, таких как иммуногистохимия S-100. Клетки Меркеля нелегко обнаружить в образцах, окрашенных гематоксилином и эозином, и обычно их идентифицируют методами иммуногистохимии. Они экспрессируют простые цитокератиновые промежуточные филаменты CK 7, 8, 18, 19 и 20. Более того, CK20 обнаружен только во вкусовых сосочках и клетках Меркеля в многослойном плоском эпителии [18].
Более того, CK20 обнаружен только во вкусовых сосочках и клетках Меркеля в многослойном плоском эпителии [18].
Световая микроскопия
Световая микроскопия (LM) используется для визуализации различных структур окрашенного образца слизистой оболочки полости рта. Зная нормальный вид слизистой оболочки полости рта, можно выявить патологические изменения в ткани.
Микроскопия Электрон
Электронная микроскопия (ЭМ) использует пучок электронов для получения изображения образца вместо света, создавая изображения с более высоким разрешением, которые лучше идентифицируют гистологические структуры. При ЭМ можно идентифицировать ультраструктурные особенности эпителия, такие как слипчивые соединения, плотные соединения, щелевые соединения, десмосомы, полудесмосомы и базальную пластинку, которая отделяет эпителий от соединительной ткани [28].
Клиническое значение
Слизистая оболочка полости рта выполняет большое количество функций , имеющих клиническое значение. Он действует как защитный физический и иммунный барьер от внешних раздражителей и содержит малые слюнные железы, которые выделяют слюну, сохраняя влажность тканей, а также воспринимают и реагируют на раздражители температуры, прикосновения и боли. Множественные заболевания могут поражать слизистую оболочку полости рта и нарушать ее способность выполнять эти задачи. Чтобы упомянуть некоторые примеры, разрушение эпителия полости рта может вызвать различные поражения слизистой оболочки полости рта, такие как красный плоский лишай и лейкоплакия полости рта. Карциномы полости рта, такие как плоскоклеточная карцинома (OSCC), развиваются, когда эпителиальный барьер слизистой оболочки полости рта разрушается и кератиноциты подвергаются дефектной дифференцировке [2]. Кроме того, разрушение десневого барьера, вызванное дисбактериозом микробиоты полости рта в сочетании с воспалением, приводит к заболеваниям пародонта [2].
Он действует как защитный физический и иммунный барьер от внешних раздражителей и содержит малые слюнные железы, которые выделяют слюну, сохраняя влажность тканей, а также воспринимают и реагируют на раздражители температуры, прикосновения и боли. Множественные заболевания могут поражать слизистую оболочку полости рта и нарушать ее способность выполнять эти задачи. Чтобы упомянуть некоторые примеры, разрушение эпителия полости рта может вызвать различные поражения слизистой оболочки полости рта, такие как красный плоский лишай и лейкоплакия полости рта. Карциномы полости рта, такие как плоскоклеточная карцинома (OSCC), развиваются, когда эпителиальный барьер слизистой оболочки полости рта разрушается и кератиноциты подвергаются дефектной дифференцировке [2]. Кроме того, разрушение десневого барьера, вызванное дисбактериозом микробиоты полости рта в сочетании с воспалением, приводит к заболеваниям пародонта [2].
Распространенные поверхностные поражения слизистой оболочки полости рта включают рецидивирующий лабиальный герпес, кандидоз, рецидивирующий афтозный стоматит, мигрирующую эритему, волосатый язык и красный плоский лишай [29]. Кроме того, стоит отметить, что аномалии слизистой оболочки полости рта могут быть симптомом заболеваний слизистых оболочек или кожи и многих системных состояний. Поэтому знание гистологических особенностей слизистой оболочки полости рта необходимо для распознавания и точной диагностики патологических доброкачественных состояний и злокачественных новообразований.
Кроме того, стоит отметить, что аномалии слизистой оболочки полости рта могут быть симптомом заболеваний слизистых оболочек или кожи и многих системных состояний. Поэтому знание гистологических особенностей слизистой оболочки полости рта необходимо для распознавания и точной диагностики патологических доброкачественных состояний и злокачественных новообразований.
Контрольные вопросы
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Рисунок
Слизистая оболочка полости рта, эпителий, собственная пластинка, подслизистая оболочка, надкостница, кость, сосочковый слой, ретикулярный слой. Предоставлено StatPearls Publishing. Иллюстрация Эммы Грегори. Фронт Иммунол. 2019;10:208. [Бесплатная статья PMC: PMC6383680] [PubMed: 30837987]
Ван С.С., Тан Ю.Л., Пан С., Чжэн М., Тан Ю.Дж., Лян Х.Х. Поддержание орального эпителиального барьера. Жизнь наук. 2019 15 июня; 227: 129-136. [PubMed: 31002922]
Жизнь наук. 2019 15 июня; 227: 129-136. [PubMed: 31002922]
AlJulaih GH, Lasrado S. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 11 августа 2021 г. Анатомия, голова и шея, вкусовые рецепторы языка. [PubMed: 30969518]
Ложеретт Ф., Гайяр Д., Пассилли-Деграс П., Ниот И., Беснар П. Есть ли у нас вкус жира? Биохимия. 2007 г., февраль 89 г.(2): 265-9. [PubMed: 17126471]
Otsuka-Tanaka Y, Oommen S, Kawasaki M, Kawasaki K, Imam N, Jalani-Ghazani F, Hindges R, Sharpe PT, Ohazama A. Развитие слизистой оболочки полости рта зависит от мезенхимальные микроРНК. Джей Дент Рез. 2013 март; 92(3):229-34. [PubMed: 23242232]
Адамс Д. Кератинизация эпителия полости рта. Энн Р. Колл Surg Engl. 1976 г., сен; 58 (5): 351–358. [Бесплатная статья PMC: PMC24] [PubMed: 788618]
Squier CA, Кремер MJ. Биология слизистой оболочки полости рта и пищевода. J Natl Cancer Inst Monogr. 2001;(29):7-15. [PubMed: 11694559]
J Natl Cancer Inst Monogr. 2001;(29):7-15. [PubMed: 11694559]
Томас А.Дж., Эриксон, Калифорния. Изготовление меланоцита: спецификация меланобластов из нервного гребня. Пигментно-клеточная меланома Res. 2008 Декабрь; 21 (6): 598-610. [PubMed: 1
69]Барретт А.В., Скалли С. Меланоциты слизистой оболочки полости рта человека: обзор. Дж Орал Патол Мед. 1994 март; 23 (3): 97-103. [PubMed: 8021847]
Феллер Л., Масилана А., Хаммисса Р.А., Алтини М., Джадват Ю., Леммер Дж. Меланин: биофизиология меланоцитов полости рта и физиологическая пигментация полости рта. Голова Лицо Мед. 2014 24 марта; 10:8. [Бесплатная статья PMC: PMC3994327] [PubMed: 24661309]
Yamaguchi Y, Brenner M, Hearing VJ. Регуляция пигментации кожи. Дж. Биол. Хим. 2007 г., 21 сентября; 282(38):27557-61. [PubMed: 17635904]
BROWN T. ПИГМЕНТАЦИЯ РТА У АБОРИГЕНОВ КАЛУМБУРУ, СЕВЕРО-ЗАПАДНАЯ АВСТРАЛИЯ. Arch Oral Biol. 1964 сен-октябрь; 9:555-64. [PubMed: 14205457]
Arch Oral Biol. 1964 сен-октябрь; 9:555-64. [PubMed: 14205457]
Dummett CO, Barens G. Пигментация слизистой оболочки рта: обновленный литературный обзор. J Пародонтол. 1971 ноябрь; 42 (11): 726-36. [PubMed: 4944004]
Эйзен Д. Нарушения пигментации в полости рта. Клин Дерматол. 2000 сен-октябрь;18(5):579-87. [PubMed: 11134853]
Meleti M, Vescovi P, Mooi WJ, van der Waal I. Пигментные поражения слизистой оболочки полости рта и периоральных тканей: схема диагностики и некоторые рекомендации по лечению. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2008 май; 105(5):606-16. [PubMed: 18206403]
Wang YP, Chen IC, Wu YH, Wu YC, Chen HM, Yu-Fong Chang J. Количество клеток Лангерганса при дисплазии эпителия полости рта и их корреляция с клинико-патологическими параметрами. J Formos Med Assoc. 2017 июнь; 116 (6): 457-463. [В паблике: 282
]

García-Caballero L, Caneiro J, Gándara M, González-Ortega N, Cepeda-Emiliani A, Gude F, Collado M, Beiras A, Gallego R. Клетки Меркеля слизистой оболочки полости рта человека экспрессируют плюрипотентный фактор транскрипции стволовых клеток Sox2. Гистол Гистопатол. 2020 сен;35(9):1007-1012. [PubMed: 32495847]
Кингсмилл В.Дж., Берковиц Б.К., Барретт А.В. Иммуногистохимический анализ плотности клеток Меркеля человека в эпителии десны у зубчатых и беззубых субъектов. Arch Oral Biol. 2005 г., октябрь; 50 (10): 883-7. [В паблике: 16137497]
Righi A, Betts CM, Marchetti C, Marucci G, Montebugnoli L, Prati C, Eusebi LH, Muzzi L, Ragazzini T, Foschini MP. Клетки Меркеля в слизистой оболочке полости рта. Международный Дж. Сург Патол. 2006 июль; 14 (3): 206-11. [PubMed: 16959700]
Kydd WL, Daly CH. Биологическое и механическое воздействие стресса на слизистую оболочку полости рта. Джей Простет Дент. 1982 март; 47(3):317-29. [PubMed: 7038105]
Джей Простет Дент. 1982 март; 47(3):317-29. [PubMed: 7038105]
Chen J, Ahmad R, Li W, Swain M, Li Q. Биомеханика слизистой оболочки полости рта. Интерфейс JR Soc. 2015 Авг 06;12(109)):20150325. [Бесплатная статья PMC: PMC4535403] [PubMed: 26224566]
Fleisch L, Austin JC. Гистологическое исследование реакции жевательной и выстилающей слизистой оболочки на механическую нагрузку у зеленых мартышек. Джей Простет Дент. 1978 г., февраль; 39(2):211-6. [PubMed: 413909]
Тунгаре С., Паранджпе АГ. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 25 сентября 2021 г. Разрастание десен, вызванное лекарствами. [В паблике: 30860753]
Габалла К.Ю., Рахими И. Может ли присутствие пероральных гранул Фордайса служить маркером гиперлипидемии? Дент Рес Дж. (Исфахан). 2014 сен; 11 (5): 553-8. [Бесплатная статья PMC: PMC4241607] [PubMed: 25426145]

Wertz PW. Липиды и проницаемость и антимикробный барьер кожи. J Липиды. 2018;2018:5954034. [Бесплатная статья PMC: PMC6139190] [PubMed: 30245886]
Bearelly S, Cheung SW. Сенсорная топография структур полости рта. JAMA Otolaryngol Head Neck Surg. 2017 01 января; 143 (1): 73-80. [В паблике: 27684535]
Фельдман А.Т., Вулф Д. Обработка тканей и окрашивание гематоксилином и эозином. Методы Мол Биол. 2014;1180:31-43. [PubMed: 25015141]
Kurn H, Daly DT. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 19 ноября 2021 г. Гистология, эпителиальная клетка. [PubMed: 32644489]
Gonsalves WC, Chi AC, Neville BW. Общие поражения полости рта: Часть I. Поверхностные поражения слизистой оболочки. Ам семейный врач. 2007 15 февраля; 75 (4): 501-7. [В паблике: 17323710]
Гистология слизистой оболочки полости рта — StatPearls
Введение
Слизистая оболочка, выстилающая структуры в пределах полости рта, известна как слизистая оболочка полости рта . Это влажная оболочка мягких тканей, простирающаяся от места соединения красной каймы губ и слизистой оболочки губ спереди до небно-глоточных складок сзади.
Это влажная оболочка мягких тканей, простирающаяся от места соединения красной каймы губ и слизистой оболочки губ спереди до небно-глоточных складок сзади.
Гистологически слизистая оболочка полости рта состоит из трех слоев: поверхностного плоского многослойного эпителия, известного как эпителия полости рта , толщина и степень ороговения которого зависят от локализации и функциональных требований [1]. Ниже находится подлежащая соединительная ткань, известная как lamina propria, и плотная соединительная ткань неправильной формы, подслизистая оболочка, которая находится на самом глубоком уровне. Последний отсутствует в некоторых отделах ротовой полости, где собственная пластинка непосредственно связана с костью или мышцей.
Слизистую оболочку полости рта можно разделить на выстилающую слизистую оболочку, жевательную слизистую оболочку и специализированную слизистую оболочку с характерными гистологическими, клиническими и функциональными особенностями. Разнообразие функций, которые развивает слизистая оболочка полости рта, в основном включает защиту подлежащих тканей от механических, химических и биологических раздражителей, секрецию основных веществ и сенсорную функцию, которая позволяет воспринимать температуру, прикосновение, боль и вкус [2]. [3][4][2].
[3][4][2].
Структура
Эпителий полости рта
Вся поверхность слизистой оболочки полости рта покрыта многослойным плоским эпителием. Это высокоорганизованная бессосудистая и полупроницаемая ткань, толщина и степень ороговения которой варьируются в зависимости от расположения в ротовой полости и функциональных и механических требований этой области. Межпальцевый интерфейс соединяет эпителий и собственную пластинку. Волнообразные выступы более глубокого слоя эпителия, известные как сетчатые штифты , прикрепляются к нижележащим папиллярным отросткам собственной пластинки. Между этими двумя тканями находится неклеточная базальная мембрана, с которой плотно связан эпителий. Базальная мембрана обеспечивает поддержку эпителия и соединяет его с соединительной тканью. При световой микроскопии она видна как демаркационная линия между эпителием и соединительной тканью собственной пластинки. Однако это лучше видно с помощью электронной микроскопии, которая четко показывает базальную пластинку, которая далее подразделяется на прозрачную пластинку и плотную пластинку.
Слизистую оболочку полости рта можно разделить на три типа, которые различаются гистологически, клинически и функционально. Слизистая оболочка, которая выстилает подвижные структуры рта, получила название выстилки, или подвижной слизистой оболочки , которая находится на мягком небе, щеках, губах, слизистой оболочке альвеол, дне рта и вестибулярном своде. Тип эпителия, покрывающего слизистую оболочку, представляет собой неороговевающих многослойных плоскоклеточных эпителий [1]. Жесткая слизистая оболочка, плотно связанная с подлежащей костью в прикрепленной десне и твердом небе, известна как 9.0005 жевательная слизистая оболочка . Тип эпителия, покрывающего эти поверхности, представляет собой ороговевший или паракератинизированный многослойный плоский эпителий, который обеспечивает способность жевательной слизистой оболочки лучше выдерживать нагрузку, которой она подвергается во время жевания. Наконец, на спинке языка есть специализированная слизистая оболочка, на которой виден многослойный плоский эпителий, который может быть либо кератинизированным , либо некератинизированным . Он получил это название из-за своей уникальной особенности наличия различных типов языковых сосочков и вкусовых рецепторов, которые позволяют воспринимать вкус. Поскольку спинка языка активно участвует в жевании, эту слизистую оболочку иногда также классифицируют как жевательную слизистую оболочку.
Он получил это название из-за своей уникальной особенности наличия различных типов языковых сосочков и вкусовых рецепторов, которые позволяют воспринимать вкус. Поскольку спинка языка активно участвует в жевании, эту слизистую оболочку иногда также классифицируют как жевательную слизистую оболочку.
Четыре слоя образуют эпителий ротовой полости в ороговевшей слизистой оболочке полости рта, что характерно для жевательной слизистой оболочки. Начиная с более глубокого слоя, мы обнаружили базальный слой, за которым следовали шиповатый, зернистый и роговой слои. Когда эпителий неороговевает, например, в слизистой оболочке, над базальным слоем есть нитевидный и растянутый слои [1]. Кроме того, в неороговевающем эпителии, видимом на слизистой оболочке, отсутствует зернистый слой, а шиповатый слой, как известно, обычно тоньше [5]. Клетки, образующие эпителий, прикреплены друг к другу десмосомами и постепенно уплощаются от базального слоя вверх к роговому слою, где они приобретают чешуйчатый или чешуйчатый вид. Клетки плоского эпителия известны как кератиноциты, поскольку они в основном состоят из цитокератинов.
Клетки плоского эпителия известны как кератиноциты, поскольку они в основном состоят из цитокератинов.
Базальный слой представляет собой слой кубовидных или столбчатых клеток, которые находятся над базальной мембраной, к которой их прикрепляют полудесмосомы. Эти клетки известны своей митотической способностью. Непосредственно над базальным слоем несколько слоев более крупных клеток, называемых шиповатыми клетками, из-за их формы образуют шиповатый слой. Наступает зернистый слой; затем эти клетки содержат мелкие цитоплазматические гранулы кератогиалина, которые сильно окрашиваются гематоксилином. Наконец, более поверхностный слой, stratum superficiale или stratum corneum, представляет собой ороговевший слой, состоящий из очень плоских клеток, на которые указывает отсутствие ядра и окрашивание эозином в розовый цвет [6].
Восполнение эпителия полости рта
Эпителиальные клетки ротовой полости часто заменяются клеточным делением примерно каждые 14–21 день. Это связано с тем, что ротовая полость постоянно подвергается высоким функциональным требованиям, что обуславливает необходимость частого оборота. Процесс пополнения начинается в базальном слое, в основном образованном митотичными клетками, которые сначала подвергаются пролиферации, а затем процессам дифференцировки и миграции [2]. Известно, что оборот подвижной слизистой оболочки происходит быстрее, чем жевательной (см. табл. 1). Для поддержания гомеостаза эпителия необходима дифференцировка и десквамация на поверхности, которая уравновешивает деление клеток. Когда гомеостаз изменяется под воздействием таких факторов, как старение или патологические состояния, это может привести к гиперпластическому или атрофическому эпителию [7].
Это связано с тем, что ротовая полость постоянно подвергается высоким функциональным требованиям, что обуславливает необходимость частого оборота. Процесс пополнения начинается в базальном слое, в основном образованном митотичными клетками, которые сначала подвергаются пролиферации, а затем процессам дифференцировки и миграции [2]. Известно, что оборот подвижной слизистой оболочки происходит быстрее, чем жевательной (см. табл. 1). Для поддержания гомеостаза эпителия необходима дифференцировка и десквамация на поверхности, которая уравновешивает деление клеток. Когда гомеостаз изменяется под воздействием таких факторов, как старение или патологические состояния, это может привести к гиперпластическому или атрофическому эпителию [7].
Таблица 1: Время оборота эпителиальных клеток в выбранных тканях[7]
Популяция клеток, не содержащих кератиноцитов
Помимо кератиноцитов, в эпителии ротовой полости постоянно находятся другие специализированные клетки, называемые некератиноцитарными клетками, включая меланоциты, клетки Лангергана и клетки Меркеля. Более того, другие различные воспалительные клетки могут временно мигрировать в эпителий ротовой полости.
Более того, другие различные воспалительные клетки могут временно мигрировать в эпителий ротовой полости.
Меланоциты
Меланоциты представляют собой продуцирующие меланин удлиненные дендритные клетки, расположенные в базальном слое ротового эпителия, которые происходят из нервного гребня, а затем мигрируют в кожу и слизистую оболочку полости рта, где они и находятся [8]. Эти клетки содержат белки, необходимые для синтеза меланина и процесса созревания меланосом. Меланоциты синтезируют меланин в виде структур, известных как меланосомы, которые затем переносятся в цитоплазму соседних эпителиальных клеток благодаря своим длинным дендритным отросткам, простирающимся между кератиноцитами. Соотношение меланоцитов к кератиноцитам в базальном слое эпителия полости рта колеблется от 1:10 до 1:15 [9].][10][11]. Стволовые клетки меланоцитов, чья ниша в ротовой полости до сих пор неизвестна, поддерживают популяцию зрелых меланоцитов благодаря своей способности к регенерации и дифференцировке [10].
Все люди имеют одинаковое количество меланоцитов в слизистой оболочке полости рта и коже. Различные цвета кожи и пигментация слизистой оболочки полости рта определяются размером и количеством меланосом и типом синтезируемого меланина, эумеланина или феомеланина. Гранулы меланина, представляющие собой группы меланосом, можно наблюдать под микроскопом в сильно пигментированной ткани, окрашенной гематоксилином и эозином.
Известно, что функция, которую меланоциты выполняют в организме человека, хотя и не совсем понятна, заключается в производстве меланина, который способствует определению цвета кожи, слизистых оболочек, волос и глаз. В то же время меланин защищает эти ткани от вредного воздействия ультрафиолетового света, активных форм кислорода и свободных радикалов, присутствующих в окружающей среде [10]. Стоит отметить, что с возрастом количество ротовых меланоцитов увеличивается, и, следовательно, увеличивается степень и интенсивность пигментации полости рта, которые считаются физиологическими [12][13][14]. Предполагается, что это увеличение может быть результатом кумулятивных возможных меланогенных стимулов, таких как воспалительные состояния, лекарства, повторяющиеся и легкие функциональные травмы или табачный дым [15].
Предполагается, что это увеличение может быть результатом кумулятивных возможных меланогенных стимулов, таких как воспалительные состояния, лекарства, повторяющиеся и легкие функциональные травмы или табачный дым [15].
Клетки Лангерганса
Клетки Лангерганса представляют собой дендритные клетки, происходящие из костного мозга, которые мигрируют в эпителий ротовой полости, где они располагаются в шиповидном слое. Они необходимы для иммунного надзора за тканью, поскольку они функционируют как антигенпрезентирующие клетки, фагоцитируя антигены в эпителии и мигрируя в нижележащую собственную пластинку, откуда они могут достигать регионарных лимфатических узлов. Здесь они превращают антигенные белки в антигенные пептиды, которые впоследствии представляются Т-клеткам [16]. Таким образом, клетки Лангерганса являются связующим звеном между слизистой оболочкой полости рта и иммунной системой. Ультраструктурной отличительной особенностью этих клеток являются палочковидные органеллы, иногда описываемые как «теннисные ракетки», находящиеся исключительно в цитоплазме клеток Лангерганса, называемые гранулами или тельцами Бирбека. Клетки Лангерганса можно наблюдать с помощью специфических иммуногистохимических реакций, таких как иммуногистохимия S-100.
Клетки Лангерганса можно наблюдать с помощью специфических иммуногистохимических реакций, таких как иммуногистохимия S-100.
Ячейки Меркель
Клетки Меркеля представляют собой медленно адаптирующиеся сенсорные сенсорные рецепторы, связанные с нервным чувствительным окончанием, расположенным преимущественно в эпидермисе; однако они также обнаруживаются на слизистой оболочке полости рта в базальном слое [17][18]. Они имеют цитоплазматические пузырьки, обычно расположенные рядом со сцепленными с ними нервными волокнами. Было высказано предположение, что эти структуры высвобождают молекулы медиатора в синапсоподобное соединение, расположенное между нервным волокном и клеткой Меркеля, которое генерирует нервный импульс.
В полости рта они в основном локализуются в ороговевших эпителиях десен верхней и нижней челюсти и твердом небе. Однако эти комплексы клеток Меркеля и нейритов расположены в большем количестве в слизистой оболочке язычных десен. Поэтому считается, что они действуют как медленно адаптирующиеся механорецепторы и дают соматосенсорную информацию о положении языка [18].
Известно, что у пациентов, которые носят полные съемные протезы, снижается оральная чувствительность из-за потери периодонтальной связки. Недавние исследования показали возможность того, что увеличение количества клеток Меркеля может помочь частично компенсировать потерю механорецепции из-за потери периодонтальной связки у таких пациентов. Несмотря на это, оральная чувствительность пациентов с полной адентией останется нарушенной [19].].
Lamina Propria
Под эпителием находится слой соединительной ткани, называемый lamina propria , состоящий из кровеносных сосудов, нервов, фибробластов, макрофагов, тучных клеток и волокон воспалительных клеток, погруженных в аморфное вещество, образованное протеогликанами и гликопротеинами. Собственная пластинка подразделяется на два слоя: поверхностный сосочковый слой и более глубокий сетчатый слой. Сосочковый слой образован тонкими беспорядочно ориентированными коллагеновыми волокнами, образующими волнообразные гребни сосочков, которые соединяются с эпителием; эта поверхность обеспечивает более широкую область для транспорта питательных веществ [20]. В сосочковом слое обнаруживается множество капиллярных петель. Ретикулярный слой расположен между сосочковым слоем и нижележащей структурой (подслизистой оболочкой или надкостницей в зависимости от региона) и образован более толстыми коллагеновыми волокнами, которые ориентированы параллельно поверхности, хотя базальные волокна постепенно располагаются так, чтобы перпендикулярно соединяться с надкостницей [21]. ]. Эти волокнистые прикрепления называются слизисто-надкостничными, что обеспечивает способность сопротивляться сжатию и сдвигу слизистой оболочки полости рта благодаря прочному соединению с костью [22].
В сосочковом слое обнаруживается множество капиллярных петель. Ретикулярный слой расположен между сосочковым слоем и нижележащей структурой (подслизистой оболочкой или надкостницей в зависимости от региона) и образован более толстыми коллагеновыми волокнами, которые ориентированы параллельно поверхности, хотя базальные волокна постепенно располагаются так, чтобы перпендикулярно соединяться с надкостницей [21]. ]. Эти волокнистые прикрепления называются слизисто-надкостничными, что обеспечивает способность сопротивляться сжатию и сдвигу слизистой оболочки полости рта благодаря прочному соединению с костью [22].
Основной клеткой собственной пластинки пластинки является фибробласт, выполняющий основные функции. Он участвует в синтезе и восполнении соединительных волокон и аморфного вещества, а также в заживлении ран, где увеличивается количество фибробластов. При некоторых состояниях, таких как разрастание десен, вызванное лекарствами, индуцирующие препараты вызывают активацию и пролиферацию фибробластов тканей десны, что приводит к повышенной секреции гликозаминогликанов аморфного вещества [23]. Макрофаги в основном участвуют в фагоцитарной активности, а также стимулируют пролиферацию фибробластов во время заживления ран. Наконец, тучные клетки также обнаруживаются в соединительной ткани собственной пластинки. Отличительной их особенностью являются цитоплазматические гранулы, содержащие гепарин и гистамин, последний известен тем, что инициирует сосудистые изменения при воспалительном процессе. Двумя основными волокнами, обнаруженными в соединительной ткани собственной пластинки, являются коллаген и эластин, где основными являются коллагеновые волокна типа I и III.
Макрофаги в основном участвуют в фагоцитарной активности, а также стимулируют пролиферацию фибробластов во время заживления ран. Наконец, тучные клетки также обнаруживаются в соединительной ткани собственной пластинки. Отличительной их особенностью являются цитоплазматические гранулы, содержащие гепарин и гистамин, последний известен тем, что инициирует сосудистые изменения при воспалительном процессе. Двумя основными волокнами, обнаруженными в соединительной ткани собственной пластинки, являются коллаген и эластин, где основными являются коллагеновые волокна типа I и III.
Подслизистая основа
Под собственной пластинкой находится слой фиброколлагеновой и эластичной ткани, содержащий кровеносные сосуды и нервы, известный как подслизистая оболочка. В зависимости от локализации подслизистая оболочка может содержать жировую ткань, малые слюнные железы, лимфоидную ткань и мышечную ткань. Подслизистая оболочка обнаруживается во всех отделах щечной полости, кроме прикрепленной десны и твердого неба, покрытого жевательной слизистой оболочкой, где подслизистый слой отсутствует, а собственная пластинка непосредственно прикреплена к подлежащей кости, образуя слизисто-надкостничную оболочку.
Эктопические сальные железы, известные как гранулы Фордайса, могут быть обнаружены в подслизистом слое слизистой оболочки полости рта в некоторых местах. Несмотря на то, что они всегда считались нормальным вариантом, недавние исследования показали, что у людей с повышенным липидным профилем количество гранул Фордайса больше. Таким образом, этот клинический признак не следует игнорировать. Чаще всего они локализуются на слизистой оболочке щек и губ. Возраст и курение уменьшают их плотность [24].
Функция
Защитная функция
Полость рта представляет собой среду, постоянно подвергающуюся воздействию механических, химических и биологических раздражителей нашей повседневной деятельности. Слизистая оболочка полости рта играет важную роль в защите подлежащих тканей от механических сил, связанных с нормальной функцией жевания (растяжение, сжатие и истирание из-за жесткой диеты), внешних антигенов и вредных молекул из пищи. Кроме того, слизистая оболочка полости рта также подвергается воздействию канцерогенных веществ, содержащихся в алкоголе, табаке и бетеле, потребляемых в некоторых регионах. Эпителий полости рта действует как барьер против этих физиологических и патогенных стрессов. Он действует как физический и иммунный барьер для внешней агрессии и предотвращает проникновение нормальной бактериальной флоры полости рта, которая может вызвать инфекцию. Эпителий полости рта достигает этого за счет того, что состоит из многослойных эпителиальных клеток и межклеточных соединений и поддерживает иммунный ответ на антигены благодаря наличию дендритных клеток (DC) и Т-хелперных клеток 17 (Th27) [2].
Эпителий полости рта действует как барьер против этих физиологических и патогенных стрессов. Он действует как физический и иммунный барьер для внешней агрессии и предотвращает проникновение нормальной бактериальной флоры полости рта, которая может вызвать инфекцию. Эпителий полости рта достигает этого за счет того, что состоит из многослойных эпителиальных клеток и межклеточных соединений и поддерживает иммунный ответ на антигены благодаря наличию дендритных клеток (DC) и Т-хелперных клеток 17 (Th27) [2].
Секрет
Основным веществом, выделяемым слизистой оболочкой полости рта, является слюна, которая выделяется протоками больших и малых слюнных желез. В состав подслизистой оболочки входят широко распространенные в полости рта малые слюнные железы. Тем не менее основные слюнные железы, являющиеся основным источником слюны, располагаются за пределами слизистой оболочки полости рта. Однако их выводные протоки открываются в ротовую полость, способствуя поддержанию влажности тканей. Слизистая оболочка полости рта имеет меньшее количество сальных желез, зарегистрированных на губах, слизистой оболочке губ и щек у большинства взрослого населения и могут быть обнаружены спорадически в альвеолярной слизистой оболочке. Эти железы выделяют жировое вещество, известное как кожное сало, функции которого еще не определены. Однако недавние исследования кожного сала показывают, что он может играть роль в иммунитете [25].
Слизистая оболочка полости рта имеет меньшее количество сальных желез, зарегистрированных на губах, слизистой оболочке губ и щек у большинства взрослого населения и могут быть обнаружены спорадически в альвеолярной слизистой оболочке. Эти железы выделяют жировое вещество, известное как кожное сало, функции которого еще не определены. Однако недавние исследования кожного сала показывают, что он может играть роль в иммунитете [25].
Сенсорная функция
Полость рта получает сенсорную иннервацию от трех ветвей тройничного нерва. В слизистой оболочке полости рта в основном присутствуют три типа сенсорных окончаний, состоящие из дисков Меркеля, тельцов Мейснера и свободных нервных окончаний, которые позволяют слизистой оболочке полости рта воспринимать и реагировать на раздражители температуры, прикосновения и боли. Кроме того, он воспринимает вкусовые ощущения соленого, сладкого, кислого, горького и умами, хотя недавно было высказано предположение, что также может быть вкусовое ощущение жира [3][4]. Рецепторные клетки вкуса локализуются на спинке языка и мягком небе. Слизистые оболочки гортани, глотки и верхних отделов пищевода также содержат эти рецепторы. Сенсорная функция полости рта необходима для опознавания предметов, влияния на действия, совершаемые при жевании, и инициации глотательного рефлекса. Осязание позволяет координировать движения языка, губ и мягкого неба, чтобы правильно издавать звуки при разговоре [26].
Рецепторные клетки вкуса локализуются на спинке языка и мягком небе. Слизистые оболочки гортани, глотки и верхних отделов пищевода также содержат эти рецепторы. Сенсорная функция полости рта необходима для опознавания предметов, влияния на действия, совершаемые при жевании, и инициации глотательного рефлекса. Осязание позволяет координировать движения языка, губ и мягкого неба, чтобы правильно издавать звуки при разговоре [26].
Подготовка ткани
Образец биопсии слизистой оболочки полости рта можно исследовать под микроскопом после соответствующей обработки. Этапы подготовки образцов могут включать правильную консервацию тканей, обезвоживание, очистку, инфильтрацию парафином, создание срезов и окрашивание, чаще всего гематоксилином и эозином (H&E). Метод H&E точно дифференцирует различные клеточные компоненты, окрашивая ядро и цитоплазму контрастными цветами [27].
Гистохимия и цитохимия
Некоторые компоненты слизистой оболочки полости рта идентифицируются методами иммуногистохимии. Например, клетки Лангергана требуют специфических иммуногистохимических реакций, таких как иммуногистохимия S-100. Клетки Меркеля нелегко обнаружить в образцах, окрашенных гематоксилином и эозином, и обычно их идентифицируют методами иммуногистохимии. Они экспрессируют простые цитокератиновые промежуточные филаменты CK 7, 8, 18, 19 и 20. Более того, CK20 обнаружен только во вкусовых сосочках и клетках Меркеля в многослойном плоском эпителии [18].
Например, клетки Лангергана требуют специфических иммуногистохимических реакций, таких как иммуногистохимия S-100. Клетки Меркеля нелегко обнаружить в образцах, окрашенных гематоксилином и эозином, и обычно их идентифицируют методами иммуногистохимии. Они экспрессируют простые цитокератиновые промежуточные филаменты CK 7, 8, 18, 19 и 20. Более того, CK20 обнаружен только во вкусовых сосочках и клетках Меркеля в многослойном плоском эпителии [18].
Световая микроскопия
Световая микроскопия (LM) используется для визуализации различных структур окрашенного образца слизистой оболочки полости рта. Зная нормальный вид слизистой оболочки полости рта, можно выявить патологические изменения в ткани.
Микроскопия Электрон
Электронная микроскопия (ЭМ) использует пучок электронов для получения изображения образца вместо света, создавая изображения с более высоким разрешением, которые лучше идентифицируют гистологические структуры. При ЭМ можно идентифицировать ультраструктурные особенности эпителия, такие как слипчивые соединения, плотные соединения, щелевые соединения, десмосомы, полудесмосомы и базальную пластинку, которая отделяет эпителий от соединительной ткани [28].
Клиническое значение
Слизистая оболочка полости рта выполняет большое количество функций , имеющих клиническое значение. Он действует как защитный физический и иммунный барьер от внешних раздражителей и содержит малые слюнные железы, которые выделяют слюну, сохраняя влажность тканей, а также воспринимают и реагируют на раздражители температуры, прикосновения и боли. Множественные заболевания могут поражать слизистую оболочку полости рта и нарушать ее способность выполнять эти задачи. Чтобы упомянуть некоторые примеры, разрушение эпителия полости рта может вызвать различные поражения слизистой оболочки полости рта, такие как красный плоский лишай и лейкоплакия полости рта. Карциномы полости рта, такие как плоскоклеточная карцинома (OSCC), развиваются, когда эпителиальный барьер слизистой оболочки полости рта разрушается и кератиноциты подвергаются дефектной дифференцировке [2]. Кроме того, разрушение десневого барьера, вызванное дисбактериозом микробиоты полости рта в сочетании с воспалением, приводит к заболеваниям пародонта [2].
Распространенные поверхностные поражения слизистой оболочки полости рта включают рецидивирующий лабиальный герпес, кандидоз, рецидивирующий афтозный стоматит, мигрирующую эритему, волосатый язык и красный плоский лишай [29]. Кроме того, стоит отметить, что аномалии слизистой оболочки полости рта могут быть симптомом заболеваний слизистых оболочек или кожи и многих системных состояний. Поэтому знание гистологических особенностей слизистой оболочки полости рта необходимо для распознавания и точной диагностики патологических доброкачественных состояний и злокачественных новообразований.
Контрольные вопросы
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Рисунок
Слизистая оболочка полости рта, эпителий, собственная пластинка, подслизистая оболочка, надкостница, кость, сосочковый слой, ретикулярный слой. Предоставлено StatPearls Publishing. Иллюстрация Эммы Грегори. Фронт Иммунол. 2019;10:208. [Бесплатная статья PMC: PMC6383680] [PubMed: 30837987]
Иллюстрация Эммы Грегори. Фронт Иммунол. 2019;10:208. [Бесплатная статья PMC: PMC6383680] [PubMed: 30837987]
Ван С.С., Тан Ю.Л., Пан С., Чжэн М., Тан Ю.Дж., Лян Х.Х. Поддержание орального эпителиального барьера. Жизнь наук. 2019 15 июня; 227: 129-136. [PubMed: 31002922]
AlJulaih GH, Lasrado S. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 11 августа 2021 г. Анатомия, голова и шея, вкусовые рецепторы языка. [PubMed: 30969518]
Ложеретт Ф., Гайяр Д., Пассилли-Деграс П., Ниот И., Беснар П. Есть ли у нас вкус жира? Биохимия. 2007 г., февраль 89 г.(2): 265-9. [PubMed: 17126471]
Otsuka-Tanaka Y, Oommen S, Kawasaki M, Kawasaki K, Imam N, Jalani-Ghazani F, Hindges R, Sharpe PT, Ohazama A. Развитие слизистой оболочки полости рта зависит от мезенхимальные микроРНК. Джей Дент Рез. 2013 март; 92(3):229-34. [PubMed: 23242232]

Адамс Д. Кератинизация эпителия полости рта. Энн Р. Колл Surg Engl. 1976 г., сен; 58 (5): 351–358. [Бесплатная статья PMC: PMC24] [PubMed: 788618]
Squier CA, Кремер MJ. Биология слизистой оболочки полости рта и пищевода. J Natl Cancer Inst Monogr. 2001;(29):7-15. [PubMed: 11694559]
Томас А.Дж., Эриксон, Калифорния. Изготовление меланоцита: спецификация меланобластов из нервного гребня. Пигментно-клеточная меланома Res. 2008 Декабрь; 21 (6): 598-610. [PubMed: 1
69]Барретт А.В., Скалли С. Меланоциты слизистой оболочки полости рта человека: обзор. Дж Орал Патол Мед. 1994 март; 23 (3): 97-103. [PubMed: 8021847]
Феллер Л., Масилана А., Хаммисса Р.А., Алтини М., Джадват Ю., Леммер Дж. Меланин: биофизиология меланоцитов полости рта и физиологическая пигментация полости рта. Голова Лицо Мед. 2014 24 марта; 10:8. [Бесплатная статья PMC: PMC3994327] [PubMed: 24661309]

Yamaguchi Y, Brenner M, Hearing VJ. Регуляция пигментации кожи. Дж. Биол. Хим. 2007 г., 21 сентября; 282(38):27557-61. [PubMed: 17635904]
BROWN T. ПИГМЕНТАЦИЯ РТА У АБОРИГЕНОВ КАЛУМБУРУ, СЕВЕРО-ЗАПАДНАЯ АВСТРАЛИЯ. Arch Oral Biol. 1964 сен-октябрь; 9:555-64. [PubMed: 14205457]
Dummett CO, Barens G. Пигментация слизистой оболочки рта: обновленный литературный обзор. J Пародонтол. 1971 ноябрь; 42 (11): 726-36. [PubMed: 4944004]
Эйзен Д. Нарушения пигментации в полости рта. Клин Дерматол. 2000 сен-октябрь;18(5):579-87. [PubMed: 11134853]
Meleti M, Vescovi P, Mooi WJ, van der Waal I. Пигментные поражения слизистой оболочки полости рта и периоральных тканей: схема диагностики и некоторые рекомендации по лечению. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2008 май; 105(5):606-16. [PubMed: 18206403]
Wang YP, Chen IC, Wu YH, Wu YC, Chen HM, Yu-Fong Chang J. Количество клеток Лангерганса при дисплазии эпителия полости рта и их корреляция с клинико-патологическими параметрами. J Formos Med Assoc. 2017 июнь; 116 (6): 457-463. [В паблике: 282
Количество клеток Лангерганса при дисплазии эпителия полости рта и их корреляция с клинико-патологическими параметрами. J Formos Med Assoc. 2017 июнь; 116 (6): 457-463. [В паблике: 282
]
García-Caballero L, Caneiro J, Gándara M, González-Ortega N, Cepeda-Emiliani A, Gude F, Collado M, Beiras A, Gallego R. Клетки Меркеля слизистой оболочки полости рта человека экспрессируют плюрипотентный фактор транскрипции стволовых клеток Sox2. Гистол Гистопатол. 2020 сен;35(9):1007-1012. [PubMed: 32495847]
Кингсмилл В.Дж., Берковиц Б.К., Барретт А.В. Иммуногистохимический анализ плотности клеток Меркеля человека в эпителии десны у зубчатых и беззубых субъектов. Arch Oral Biol. 2005 г., октябрь; 50 (10): 883-7. [В паблике: 16137497]
Righi A, Betts CM, Marchetti C, Marucci G, Montebugnoli L, Prati C, Eusebi LH, Muzzi L, Ragazzini T, Foschini MP. Клетки Меркеля в слизистой оболочке полости рта. Международный Дж. Сург Патол. 2006 июль; 14 (3): 206-11. [PubMed: 16959700]
Сург Патол. 2006 июль; 14 (3): 206-11. [PubMed: 16959700]
Kydd WL, Daly CH. Биологическое и механическое воздействие стресса на слизистую оболочку полости рта. Джей Простет Дент. 1982 март; 47(3):317-29. [PubMed: 7038105]
Chen J, Ahmad R, Li W, Swain M, Li Q. Биомеханика слизистой оболочки полости рта. Интерфейс JR Soc. 2015 Авг 06;12(109)):20150325. [Бесплатная статья PMC: PMC4535403] [PubMed: 26224566]
Fleisch L, Austin JC. Гистологическое исследование реакции жевательной и выстилающей слизистой оболочки на механическую нагрузку у зеленых мартышек. Джей Простет Дент. 1978 г., февраль; 39(2):211-6. [PubMed: 413909]
Тунгаре С., Паранджпе АГ. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 25 сентября 2021 г. Разрастание десен, вызванное лекарствами. [В паблике: 30860753]
Габалла К.Ю., Рахими И. Может ли присутствие пероральных гранул Фордайса служить маркером гиперлипидемии? Дент Рес Дж. (Исфахан). 2014 сен; 11 (5): 553-8. [Бесплатная статья PMC: PMC4241607] [PubMed: 25426145]
Может ли присутствие пероральных гранул Фордайса служить маркером гиперлипидемии? Дент Рес Дж. (Исфахан). 2014 сен; 11 (5): 553-8. [Бесплатная статья PMC: PMC4241607] [PubMed: 25426145]
Wertz PW. Липиды и проницаемость и антимикробный барьер кожи. J Липиды. 2018;2018:5954034. [Бесплатная статья PMC: PMC6139190] [PubMed: 30245886]
Bearelly S, Cheung SW. Сенсорная топография структур полости рта. JAMA Otolaryngol Head Neck Surg. 2017 01 января; 143 (1): 73-80. [В паблике: 27684535]
Фельдман А.Т., Вулф Д. Обработка тканей и окрашивание гематоксилином и эозином. Методы Мол Биол. 2014;1180:31-43. [PubMed: 25015141]
Kurn H, Daly DT. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 19 ноября 2021 г. Гистология, эпителиальная клетка. [PubMed: 32644489]
Gonsalves WC, Chi AC, Neville BW. Общие поражения полости рта: Часть I. Поверхностные поражения слизистой оболочки. Ам семейный врач. 2007 15 февраля; 75 (4): 501-7. [В паблике: 17323710]
Поверхностные поражения слизистой оболочки. Ам семейный врач. 2007 15 февраля; 75 (4): 501-7. [В паблике: 17323710]
Гистология слизистой оболочки полости рта — StatPearls
Введение
Слизистая оболочка, выстилающая структуры в пределах полости рта, известна как слизистая оболочка полости рта . Это влажная оболочка мягких тканей, простирающаяся от места соединения красной каймы губ и слизистой оболочки губ спереди до небно-глоточных складок сзади.
Гистологически слизистая оболочка полости рта состоит из трех слоев: поверхностного плоского многослойного эпителия, известного как эпителия полости рта , толщина и степень ороговения которого зависят от локализации и функциональных требований [1]. Ниже находится подлежащая соединительная ткань, известная как lamina propria, и плотная соединительная ткань неправильной формы, подслизистая оболочка, которая находится на самом глубоком уровне. Последний отсутствует в некоторых отделах ротовой полости, где собственная пластинка непосредственно связана с костью или мышцей.
Слизистую оболочку полости рта можно разделить на выстилающую слизистую оболочку, жевательную слизистую оболочку и специализированную слизистую оболочку с характерными гистологическими, клиническими и функциональными особенностями. Разнообразие функций, которые развивает слизистая оболочка полости рта, в основном включает защиту подлежащих тканей от механических, химических и биологических раздражителей, секрецию основных веществ и сенсорную функцию, которая позволяет воспринимать температуру, прикосновение, боль и вкус [2]. [3][4][2].
Структура
Эпителий полости рта
Вся поверхность слизистой оболочки полости рта покрыта многослойным плоским эпителием. Это высокоорганизованная бессосудистая и полупроницаемая ткань, толщина и степень ороговения которой варьируются в зависимости от расположения в ротовой полости и функциональных и механических требований этой области. Межпальцевый интерфейс соединяет эпителий и собственную пластинку. Волнообразные выступы более глубокого слоя эпителия, известные как сетчатые штифты , прикрепляются к нижележащим папиллярным отросткам собственной пластинки. Между этими двумя тканями находится неклеточная базальная мембрана, с которой плотно связан эпителий. Базальная мембрана обеспечивает поддержку эпителия и соединяет его с соединительной тканью. При световой микроскопии она видна как демаркационная линия между эпителием и соединительной тканью собственной пластинки. Однако это лучше видно с помощью электронной микроскопии, которая четко показывает базальную пластинку, которая далее подразделяется на прозрачную пластинку и плотную пластинку.
Волнообразные выступы более глубокого слоя эпителия, известные как сетчатые штифты , прикрепляются к нижележащим папиллярным отросткам собственной пластинки. Между этими двумя тканями находится неклеточная базальная мембрана, с которой плотно связан эпителий. Базальная мембрана обеспечивает поддержку эпителия и соединяет его с соединительной тканью. При световой микроскопии она видна как демаркационная линия между эпителием и соединительной тканью собственной пластинки. Однако это лучше видно с помощью электронной микроскопии, которая четко показывает базальную пластинку, которая далее подразделяется на прозрачную пластинку и плотную пластинку.
Слизистую оболочку полости рта можно разделить на три типа, которые различаются гистологически, клинически и функционально. Слизистая оболочка, которая выстилает подвижные структуры рта, получила название выстилки, или подвижной слизистой оболочки , которая находится на мягком небе, щеках, губах, слизистой оболочке альвеол, дне рта и вестибулярном своде. Тип эпителия, покрывающего слизистую оболочку, представляет собой неороговевающих многослойных плоскоклеточных эпителий [1]. Жесткая слизистая оболочка, плотно связанная с подлежащей костью в прикрепленной десне и твердом небе, известна как 9.0005 жевательная слизистая оболочка . Тип эпителия, покрывающего эти поверхности, представляет собой ороговевший или паракератинизированный многослойный плоский эпителий, который обеспечивает способность жевательной слизистой оболочки лучше выдерживать нагрузку, которой она подвергается во время жевания. Наконец, на спинке языка есть специализированная слизистая оболочка, на которой виден многослойный плоский эпителий, который может быть либо кератинизированным , либо некератинизированным . Он получил это название из-за своей уникальной особенности наличия различных типов языковых сосочков и вкусовых рецепторов, которые позволяют воспринимать вкус. Поскольку спинка языка активно участвует в жевании, эту слизистую оболочку иногда также классифицируют как жевательную слизистую оболочку.
Тип эпителия, покрывающего слизистую оболочку, представляет собой неороговевающих многослойных плоскоклеточных эпителий [1]. Жесткая слизистая оболочка, плотно связанная с подлежащей костью в прикрепленной десне и твердом небе, известна как 9.0005 жевательная слизистая оболочка . Тип эпителия, покрывающего эти поверхности, представляет собой ороговевший или паракератинизированный многослойный плоский эпителий, который обеспечивает способность жевательной слизистой оболочки лучше выдерживать нагрузку, которой она подвергается во время жевания. Наконец, на спинке языка есть специализированная слизистая оболочка, на которой виден многослойный плоский эпителий, который может быть либо кератинизированным , либо некератинизированным . Он получил это название из-за своей уникальной особенности наличия различных типов языковых сосочков и вкусовых рецепторов, которые позволяют воспринимать вкус. Поскольку спинка языка активно участвует в жевании, эту слизистую оболочку иногда также классифицируют как жевательную слизистую оболочку.
Четыре слоя образуют эпителий ротовой полости в ороговевшей слизистой оболочке полости рта, что характерно для жевательной слизистой оболочки. Начиная с более глубокого слоя, мы обнаружили базальный слой, за которым следовали шиповатый, зернистый и роговой слои. Когда эпителий неороговевает, например, в слизистой оболочке, над базальным слоем есть нитевидный и растянутый слои [1]. Кроме того, в неороговевающем эпителии, видимом на слизистой оболочке, отсутствует зернистый слой, а шиповатый слой, как известно, обычно тоньше [5]. Клетки, образующие эпителий, прикреплены друг к другу десмосомами и постепенно уплощаются от базального слоя вверх к роговому слою, где они приобретают чешуйчатый или чешуйчатый вид. Клетки плоского эпителия известны как кератиноциты, поскольку они в основном состоят из цитокератинов.
Базальный слой представляет собой слой кубовидных или столбчатых клеток, которые находятся над базальной мембраной, к которой их прикрепляют полудесмосомы. Эти клетки известны своей митотической способностью. Непосредственно над базальным слоем несколько слоев более крупных клеток, называемых шиповатыми клетками, из-за их формы образуют шиповатый слой. Наступает зернистый слой; затем эти клетки содержат мелкие цитоплазматические гранулы кератогиалина, которые сильно окрашиваются гематоксилином. Наконец, более поверхностный слой, stratum superficiale или stratum corneum, представляет собой ороговевший слой, состоящий из очень плоских клеток, на которые указывает отсутствие ядра и окрашивание эозином в розовый цвет [6].
Непосредственно над базальным слоем несколько слоев более крупных клеток, называемых шиповатыми клетками, из-за их формы образуют шиповатый слой. Наступает зернистый слой; затем эти клетки содержат мелкие цитоплазматические гранулы кератогиалина, которые сильно окрашиваются гематоксилином. Наконец, более поверхностный слой, stratum superficiale или stratum corneum, представляет собой ороговевший слой, состоящий из очень плоских клеток, на которые указывает отсутствие ядра и окрашивание эозином в розовый цвет [6].
Восполнение эпителия полости рта
Эпителиальные клетки ротовой полости часто заменяются клеточным делением примерно каждые 14–21 день. Это связано с тем, что ротовая полость постоянно подвергается высоким функциональным требованиям, что обуславливает необходимость частого оборота. Процесс пополнения начинается в базальном слое, в основном образованном митотичными клетками, которые сначала подвергаются пролиферации, а затем процессам дифференцировки и миграции [2]. Известно, что оборот подвижной слизистой оболочки происходит быстрее, чем жевательной (см. табл. 1). Для поддержания гомеостаза эпителия необходима дифференцировка и десквамация на поверхности, которая уравновешивает деление клеток. Когда гомеостаз изменяется под воздействием таких факторов, как старение или патологические состояния, это может привести к гиперпластическому или атрофическому эпителию [7].
Известно, что оборот подвижной слизистой оболочки происходит быстрее, чем жевательной (см. табл. 1). Для поддержания гомеостаза эпителия необходима дифференцировка и десквамация на поверхности, которая уравновешивает деление клеток. Когда гомеостаз изменяется под воздействием таких факторов, как старение или патологические состояния, это может привести к гиперпластическому или атрофическому эпителию [7].
Таблица 1: Время оборота эпителиальных клеток в выбранных тканях[7]
Популяция клеток, не содержащих кератиноцитов
Помимо кератиноцитов, в эпителии ротовой полости постоянно находятся другие специализированные клетки, называемые некератиноцитарными клетками, включая меланоциты, клетки Лангергана и клетки Меркеля. Более того, другие различные воспалительные клетки могут временно мигрировать в эпителий ротовой полости.
Меланоциты
Меланоциты представляют собой продуцирующие меланин удлиненные дендритные клетки, расположенные в базальном слое ротового эпителия, которые происходят из нервного гребня, а затем мигрируют в кожу и слизистую оболочку полости рта, где они и находятся [8]. Эти клетки содержат белки, необходимые для синтеза меланина и процесса созревания меланосом. Меланоциты синтезируют меланин в виде структур, известных как меланосомы, которые затем переносятся в цитоплазму соседних эпителиальных клеток благодаря своим длинным дендритным отросткам, простирающимся между кератиноцитами. Соотношение меланоцитов к кератиноцитам в базальном слое эпителия полости рта колеблется от 1:10 до 1:15 [9].][10][11]. Стволовые клетки меланоцитов, чья ниша в ротовой полости до сих пор неизвестна, поддерживают популяцию зрелых меланоцитов благодаря своей способности к регенерации и дифференцировке [10].
Эти клетки содержат белки, необходимые для синтеза меланина и процесса созревания меланосом. Меланоциты синтезируют меланин в виде структур, известных как меланосомы, которые затем переносятся в цитоплазму соседних эпителиальных клеток благодаря своим длинным дендритным отросткам, простирающимся между кератиноцитами. Соотношение меланоцитов к кератиноцитам в базальном слое эпителия полости рта колеблется от 1:10 до 1:15 [9].][10][11]. Стволовые клетки меланоцитов, чья ниша в ротовой полости до сих пор неизвестна, поддерживают популяцию зрелых меланоцитов благодаря своей способности к регенерации и дифференцировке [10].
Все люди имеют одинаковое количество меланоцитов в слизистой оболочке полости рта и коже. Различные цвета кожи и пигментация слизистой оболочки полости рта определяются размером и количеством меланосом и типом синтезируемого меланина, эумеланина или феомеланина. Гранулы меланина, представляющие собой группы меланосом, можно наблюдать под микроскопом в сильно пигментированной ткани, окрашенной гематоксилином и эозином.
Известно, что функция, которую меланоциты выполняют в организме человека, хотя и не совсем понятна, заключается в производстве меланина, который способствует определению цвета кожи, слизистых оболочек, волос и глаз. В то же время меланин защищает эти ткани от вредного воздействия ультрафиолетового света, активных форм кислорода и свободных радикалов, присутствующих в окружающей среде [10]. Стоит отметить, что с возрастом количество ротовых меланоцитов увеличивается, и, следовательно, увеличивается степень и интенсивность пигментации полости рта, которые считаются физиологическими [12][13][14]. Предполагается, что это увеличение может быть результатом кумулятивных возможных меланогенных стимулов, таких как воспалительные состояния, лекарства, повторяющиеся и легкие функциональные травмы или табачный дым [15].
Клетки Лангерганса
Клетки Лангерганса представляют собой дендритные клетки, происходящие из костного мозга, которые мигрируют в эпителий ротовой полости, где они располагаются в шиповидном слое. Они необходимы для иммунного надзора за тканью, поскольку они функционируют как антигенпрезентирующие клетки, фагоцитируя антигены в эпителии и мигрируя в нижележащую собственную пластинку, откуда они могут достигать регионарных лимфатических узлов. Здесь они превращают антигенные белки в антигенные пептиды, которые впоследствии представляются Т-клеткам [16]. Таким образом, клетки Лангерганса являются связующим звеном между слизистой оболочкой полости рта и иммунной системой. Ультраструктурной отличительной особенностью этих клеток являются палочковидные органеллы, иногда описываемые как «теннисные ракетки», находящиеся исключительно в цитоплазме клеток Лангерганса, называемые гранулами или тельцами Бирбека. Клетки Лангерганса можно наблюдать с помощью специфических иммуногистохимических реакций, таких как иммуногистохимия S-100.
Они необходимы для иммунного надзора за тканью, поскольку они функционируют как антигенпрезентирующие клетки, фагоцитируя антигены в эпителии и мигрируя в нижележащую собственную пластинку, откуда они могут достигать регионарных лимфатических узлов. Здесь они превращают антигенные белки в антигенные пептиды, которые впоследствии представляются Т-клеткам [16]. Таким образом, клетки Лангерганса являются связующим звеном между слизистой оболочкой полости рта и иммунной системой. Ультраструктурной отличительной особенностью этих клеток являются палочковидные органеллы, иногда описываемые как «теннисные ракетки», находящиеся исключительно в цитоплазме клеток Лангерганса, называемые гранулами или тельцами Бирбека. Клетки Лангерганса можно наблюдать с помощью специфических иммуногистохимических реакций, таких как иммуногистохимия S-100.
Ячейки Меркель
Клетки Меркеля представляют собой медленно адаптирующиеся сенсорные сенсорные рецепторы, связанные с нервным чувствительным окончанием, расположенным преимущественно в эпидермисе; однако они также обнаруживаются на слизистой оболочке полости рта в базальном слое [17][18]. Они имеют цитоплазматические пузырьки, обычно расположенные рядом со сцепленными с ними нервными волокнами. Было высказано предположение, что эти структуры высвобождают молекулы медиатора в синапсоподобное соединение, расположенное между нервным волокном и клеткой Меркеля, которое генерирует нервный импульс.
Они имеют цитоплазматические пузырьки, обычно расположенные рядом со сцепленными с ними нервными волокнами. Было высказано предположение, что эти структуры высвобождают молекулы медиатора в синапсоподобное соединение, расположенное между нервным волокном и клеткой Меркеля, которое генерирует нервный импульс.
В полости рта они в основном локализуются в ороговевших эпителиях десен верхней и нижней челюсти и твердом небе. Однако эти комплексы клеток Меркеля и нейритов расположены в большем количестве в слизистой оболочке язычных десен. Поэтому считается, что они действуют как медленно адаптирующиеся механорецепторы и дают соматосенсорную информацию о положении языка [18].
Известно, что у пациентов, которые носят полные съемные протезы, снижается оральная чувствительность из-за потери периодонтальной связки. Недавние исследования показали возможность того, что увеличение количества клеток Меркеля может помочь частично компенсировать потерю механорецепции из-за потери периодонтальной связки у таких пациентов. Несмотря на это, оральная чувствительность пациентов с полной адентией останется нарушенной [19].].
Несмотря на это, оральная чувствительность пациентов с полной адентией останется нарушенной [19].].
Lamina Propria
Под эпителием находится слой соединительной ткани, называемый lamina propria , состоящий из кровеносных сосудов, нервов, фибробластов, макрофагов, тучных клеток и волокон воспалительных клеток, погруженных в аморфное вещество, образованное протеогликанами и гликопротеинами. Собственная пластинка подразделяется на два слоя: поверхностный сосочковый слой и более глубокий сетчатый слой. Сосочковый слой образован тонкими беспорядочно ориентированными коллагеновыми волокнами, образующими волнообразные гребни сосочков, которые соединяются с эпителием; эта поверхность обеспечивает более широкую область для транспорта питательных веществ [20]. В сосочковом слое обнаруживается множество капиллярных петель. Ретикулярный слой расположен между сосочковым слоем и нижележащей структурой (подслизистой оболочкой или надкостницей в зависимости от региона) и образован более толстыми коллагеновыми волокнами, которые ориентированы параллельно поверхности, хотя базальные волокна постепенно располагаются так, чтобы перпендикулярно соединяться с надкостницей [21]. ]. Эти волокнистые прикрепления называются слизисто-надкостничными, что обеспечивает способность сопротивляться сжатию и сдвигу слизистой оболочки полости рта благодаря прочному соединению с костью [22].
]. Эти волокнистые прикрепления называются слизисто-надкостничными, что обеспечивает способность сопротивляться сжатию и сдвигу слизистой оболочки полости рта благодаря прочному соединению с костью [22].
Основной клеткой собственной пластинки пластинки является фибробласт, выполняющий основные функции. Он участвует в синтезе и восполнении соединительных волокон и аморфного вещества, а также в заживлении ран, где увеличивается количество фибробластов. При некоторых состояниях, таких как разрастание десен, вызванное лекарствами, индуцирующие препараты вызывают активацию и пролиферацию фибробластов тканей десны, что приводит к повышенной секреции гликозаминогликанов аморфного вещества [23]. Макрофаги в основном участвуют в фагоцитарной активности, а также стимулируют пролиферацию фибробластов во время заживления ран. Наконец, тучные клетки также обнаруживаются в соединительной ткани собственной пластинки. Отличительной их особенностью являются цитоплазматические гранулы, содержащие гепарин и гистамин, последний известен тем, что инициирует сосудистые изменения при воспалительном процессе. Двумя основными волокнами, обнаруженными в соединительной ткани собственной пластинки, являются коллаген и эластин, где основными являются коллагеновые волокна типа I и III.
Двумя основными волокнами, обнаруженными в соединительной ткани собственной пластинки, являются коллаген и эластин, где основными являются коллагеновые волокна типа I и III.
Подслизистая основа
Под собственной пластинкой находится слой фиброколлагеновой и эластичной ткани, содержащий кровеносные сосуды и нервы, известный как подслизистая оболочка. В зависимости от локализации подслизистая оболочка может содержать жировую ткань, малые слюнные железы, лимфоидную ткань и мышечную ткань. Подслизистая оболочка обнаруживается во всех отделах щечной полости, кроме прикрепленной десны и твердого неба, покрытого жевательной слизистой оболочкой, где подслизистый слой отсутствует, а собственная пластинка непосредственно прикреплена к подлежащей кости, образуя слизисто-надкостничную оболочку.
Эктопические сальные железы, известные как гранулы Фордайса, могут быть обнаружены в подслизистом слое слизистой оболочки полости рта в некоторых местах. Несмотря на то, что они всегда считались нормальным вариантом, недавние исследования показали, что у людей с повышенным липидным профилем количество гранул Фордайса больше. Таким образом, этот клинический признак не следует игнорировать. Чаще всего они локализуются на слизистой оболочке щек и губ. Возраст и курение уменьшают их плотность [24].
Таким образом, этот клинический признак не следует игнорировать. Чаще всего они локализуются на слизистой оболочке щек и губ. Возраст и курение уменьшают их плотность [24].
Функция
Защитная функция
Полость рта представляет собой среду, постоянно подвергающуюся воздействию механических, химических и биологических раздражителей нашей повседневной деятельности. Слизистая оболочка полости рта играет важную роль в защите подлежащих тканей от механических сил, связанных с нормальной функцией жевания (растяжение, сжатие и истирание из-за жесткой диеты), внешних антигенов и вредных молекул из пищи. Кроме того, слизистая оболочка полости рта также подвергается воздействию канцерогенных веществ, содержащихся в алкоголе, табаке и бетеле, потребляемых в некоторых регионах. Эпителий полости рта действует как барьер против этих физиологических и патогенных стрессов. Он действует как физический и иммунный барьер для внешней агрессии и предотвращает проникновение нормальной бактериальной флоры полости рта, которая может вызвать инфекцию. Эпителий полости рта достигает этого за счет того, что состоит из многослойных эпителиальных клеток и межклеточных соединений и поддерживает иммунный ответ на антигены благодаря наличию дендритных клеток (DC) и Т-хелперных клеток 17 (Th27) [2].
Эпителий полости рта достигает этого за счет того, что состоит из многослойных эпителиальных клеток и межклеточных соединений и поддерживает иммунный ответ на антигены благодаря наличию дендритных клеток (DC) и Т-хелперных клеток 17 (Th27) [2].
Секрет
Основным веществом, выделяемым слизистой оболочкой полости рта, является слюна, которая выделяется протоками больших и малых слюнных желез. В состав подслизистой оболочки входят широко распространенные в полости рта малые слюнные железы. Тем не менее основные слюнные железы, являющиеся основным источником слюны, располагаются за пределами слизистой оболочки полости рта. Однако их выводные протоки открываются в ротовую полость, способствуя поддержанию влажности тканей. Слизистая оболочка полости рта имеет меньшее количество сальных желез, зарегистрированных на губах, слизистой оболочке губ и щек у большинства взрослого населения и могут быть обнаружены спорадически в альвеолярной слизистой оболочке. Эти железы выделяют жировое вещество, известное как кожное сало, функции которого еще не определены. Однако недавние исследования кожного сала показывают, что он может играть роль в иммунитете [25].
Однако недавние исследования кожного сала показывают, что он может играть роль в иммунитете [25].
Сенсорная функция
Полость рта получает сенсорную иннервацию от трех ветвей тройничного нерва. В слизистой оболочке полости рта в основном присутствуют три типа сенсорных окончаний, состоящие из дисков Меркеля, тельцов Мейснера и свободных нервных окончаний, которые позволяют слизистой оболочке полости рта воспринимать и реагировать на раздражители температуры, прикосновения и боли. Кроме того, он воспринимает вкусовые ощущения соленого, сладкого, кислого, горького и умами, хотя недавно было высказано предположение, что также может быть вкусовое ощущение жира [3][4]. Рецепторные клетки вкуса локализуются на спинке языка и мягком небе. Слизистые оболочки гортани, глотки и верхних отделов пищевода также содержат эти рецепторы. Сенсорная функция полости рта необходима для опознавания предметов, влияния на действия, совершаемые при жевании, и инициации глотательного рефлекса. Осязание позволяет координировать движения языка, губ и мягкого неба, чтобы правильно издавать звуки при разговоре [26].
Осязание позволяет координировать движения языка, губ и мягкого неба, чтобы правильно издавать звуки при разговоре [26].
Подготовка ткани
Образец биопсии слизистой оболочки полости рта можно исследовать под микроскопом после соответствующей обработки. Этапы подготовки образцов могут включать правильную консервацию тканей, обезвоживание, очистку, инфильтрацию парафином, создание срезов и окрашивание, чаще всего гематоксилином и эозином (H&E). Метод H&E точно дифференцирует различные клеточные компоненты, окрашивая ядро и цитоплазму контрастными цветами [27].
Гистохимия и цитохимия
Некоторые компоненты слизистой оболочки полости рта идентифицируются методами иммуногистохимии. Например, клетки Лангергана требуют специфических иммуногистохимических реакций, таких как иммуногистохимия S-100. Клетки Меркеля нелегко обнаружить в образцах, окрашенных гематоксилином и эозином, и обычно их идентифицируют методами иммуногистохимии. Они экспрессируют простые цитокератиновые промежуточные филаменты CK 7, 8, 18, 19 и 20. Более того, CK20 обнаружен только во вкусовых сосочках и клетках Меркеля в многослойном плоском эпителии [18].
Более того, CK20 обнаружен только во вкусовых сосочках и клетках Меркеля в многослойном плоском эпителии [18].
Световая микроскопия
Световая микроскопия (LM) используется для визуализации различных структур окрашенного образца слизистой оболочки полости рта. Зная нормальный вид слизистой оболочки полости рта, можно выявить патологические изменения в ткани.
Микроскопия Электрон
Электронная микроскопия (ЭМ) использует пучок электронов для получения изображения образца вместо света, создавая изображения с более высоким разрешением, которые лучше идентифицируют гистологические структуры. При ЭМ можно идентифицировать ультраструктурные особенности эпителия, такие как слипчивые соединения, плотные соединения, щелевые соединения, десмосомы, полудесмосомы и базальную пластинку, которая отделяет эпителий от соединительной ткани [28].
Клиническое значение
Слизистая оболочка полости рта выполняет большое количество функций , имеющих клиническое значение. Он действует как защитный физический и иммунный барьер от внешних раздражителей и содержит малые слюнные железы, которые выделяют слюну, сохраняя влажность тканей, а также воспринимают и реагируют на раздражители температуры, прикосновения и боли. Множественные заболевания могут поражать слизистую оболочку полости рта и нарушать ее способность выполнять эти задачи. Чтобы упомянуть некоторые примеры, разрушение эпителия полости рта может вызвать различные поражения слизистой оболочки полости рта, такие как красный плоский лишай и лейкоплакия полости рта. Карциномы полости рта, такие как плоскоклеточная карцинома (OSCC), развиваются, когда эпителиальный барьер слизистой оболочки полости рта разрушается и кератиноциты подвергаются дефектной дифференцировке [2]. Кроме того, разрушение десневого барьера, вызванное дисбактериозом микробиоты полости рта в сочетании с воспалением, приводит к заболеваниям пародонта [2].
Он действует как защитный физический и иммунный барьер от внешних раздражителей и содержит малые слюнные железы, которые выделяют слюну, сохраняя влажность тканей, а также воспринимают и реагируют на раздражители температуры, прикосновения и боли. Множественные заболевания могут поражать слизистую оболочку полости рта и нарушать ее способность выполнять эти задачи. Чтобы упомянуть некоторые примеры, разрушение эпителия полости рта может вызвать различные поражения слизистой оболочки полости рта, такие как красный плоский лишай и лейкоплакия полости рта. Карциномы полости рта, такие как плоскоклеточная карцинома (OSCC), развиваются, когда эпителиальный барьер слизистой оболочки полости рта разрушается и кератиноциты подвергаются дефектной дифференцировке [2]. Кроме того, разрушение десневого барьера, вызванное дисбактериозом микробиоты полости рта в сочетании с воспалением, приводит к заболеваниям пародонта [2].
Распространенные поверхностные поражения слизистой оболочки полости рта включают рецидивирующий лабиальный герпес, кандидоз, рецидивирующий афтозный стоматит, мигрирующую эритему, волосатый язык и красный плоский лишай [29]. Кроме того, стоит отметить, что аномалии слизистой оболочки полости рта могут быть симптомом заболеваний слизистых оболочек или кожи и многих системных состояний. Поэтому знание гистологических особенностей слизистой оболочки полости рта необходимо для распознавания и точной диагностики патологических доброкачественных состояний и злокачественных новообразований.
Кроме того, стоит отметить, что аномалии слизистой оболочки полости рта могут быть симптомом заболеваний слизистых оболочек или кожи и многих системных состояний. Поэтому знание гистологических особенностей слизистой оболочки полости рта необходимо для распознавания и точной диагностики патологических доброкачественных состояний и злокачественных новообразований.
Контрольные вопросы
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Рисунок
Слизистая оболочка полости рта, эпителий, собственная пластинка, подслизистая оболочка, надкостница, кость, сосочковый слой, ретикулярный слой. Предоставлено StatPearls Publishing. Иллюстрация Эммы Грегори. Фронт Иммунол. 2019;10:208. [Бесплатная статья PMC: PMC6383680] [PubMed: 30837987]
Ван С.С., Тан Ю.Л., Пан С., Чжэн М., Тан Ю.Дж., Лян Х.Х. Поддержание орального эпителиального барьера. Жизнь наук. 2019 15 июня; 227: 129-136. [PubMed: 31002922]
Жизнь наук. 2019 15 июня; 227: 129-136. [PubMed: 31002922]
AlJulaih GH, Lasrado S. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 11 августа 2021 г. Анатомия, голова и шея, вкусовые рецепторы языка. [PubMed: 30969518]
Ложеретт Ф., Гайяр Д., Пассилли-Деграс П., Ниот И., Беснар П. Есть ли у нас вкус жира? Биохимия. 2007 г., февраль 89 г.(2): 265-9. [PubMed: 17126471]
Otsuka-Tanaka Y, Oommen S, Kawasaki M, Kawasaki K, Imam N, Jalani-Ghazani F, Hindges R, Sharpe PT, Ohazama A. Развитие слизистой оболочки полости рта зависит от мезенхимальные микроРНК. Джей Дент Рез. 2013 март; 92(3):229-34. [PubMed: 23242232]
Адамс Д. Кератинизация эпителия полости рта. Энн Р. Колл Surg Engl. 1976 г., сен; 58 (5): 351–358. [Бесплатная статья PMC: PMC24] [PubMed: 788618]
Squier CA, Кремер MJ. Биология слизистой оболочки полости рта и пищевода. J Natl Cancer Inst Monogr. 2001;(29):7-15. [PubMed: 11694559]
J Natl Cancer Inst Monogr. 2001;(29):7-15. [PubMed: 11694559]
Томас А.Дж., Эриксон, Калифорния. Изготовление меланоцита: спецификация меланобластов из нервного гребня. Пигментно-клеточная меланома Res. 2008 Декабрь; 21 (6): 598-610. [PubMed: 1
69]Барретт А.В., Скалли С. Меланоциты слизистой оболочки полости рта человека: обзор. Дж Орал Патол Мед. 1994 март; 23 (3): 97-103. [PubMed: 8021847]
Феллер Л., Масилана А., Хаммисса Р.А., Алтини М., Джадват Ю., Леммер Дж. Меланин: биофизиология меланоцитов полости рта и физиологическая пигментация полости рта. Голова Лицо Мед. 2014 24 марта; 10:8. [Бесплатная статья PMC: PMC3994327] [PubMed: 24661309]
Yamaguchi Y, Brenner M, Hearing VJ. Регуляция пигментации кожи. Дж. Биол. Хим. 2007 г., 21 сентября; 282(38):27557-61. [PubMed: 17635904]
BROWN T. ПИГМЕНТАЦИЯ РТА У АБОРИГЕНОВ КАЛУМБУРУ, СЕВЕРО-ЗАПАДНАЯ АВСТРАЛИЯ. Arch Oral Biol. 1964 сен-октябрь; 9:555-64. [PubMed: 14205457]
Arch Oral Biol. 1964 сен-октябрь; 9:555-64. [PubMed: 14205457]
Dummett CO, Barens G. Пигментация слизистой оболочки рта: обновленный литературный обзор. J Пародонтол. 1971 ноябрь; 42 (11): 726-36. [PubMed: 4944004]
Эйзен Д. Нарушения пигментации в полости рта. Клин Дерматол. 2000 сен-октябрь;18(5):579-87. [PubMed: 11134853]
Meleti M, Vescovi P, Mooi WJ, van der Waal I. Пигментные поражения слизистой оболочки полости рта и периоральных тканей: схема диагностики и некоторые рекомендации по лечению. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2008 май; 105(5):606-16. [PubMed: 18206403]
Wang YP, Chen IC, Wu YH, Wu YC, Chen HM, Yu-Fong Chang J. Количество клеток Лангерганса при дисплазии эпителия полости рта и их корреляция с клинико-патологическими параметрами. J Formos Med Assoc. 2017 июнь; 116 (6): 457-463. [В паблике: 282
]

García-Caballero L, Caneiro J, Gándara M, González-Ortega N, Cepeda-Emiliani A, Gude F, Collado M, Beiras A, Gallego R. Клетки Меркеля слизистой оболочки полости рта человека экспрессируют плюрипотентный фактор транскрипции стволовых клеток Sox2. Гистол Гистопатол. 2020 сен;35(9):1007-1012. [PubMed: 32495847]
Кингсмилл В.Дж., Берковиц Б.К., Барретт А.В. Иммуногистохимический анализ плотности клеток Меркеля человека в эпителии десны у зубчатых и беззубых субъектов. Arch Oral Biol. 2005 г., октябрь; 50 (10): 883-7. [В паблике: 16137497]
Righi A, Betts CM, Marchetti C, Marucci G, Montebugnoli L, Prati C, Eusebi LH, Muzzi L, Ragazzini T, Foschini MP. Клетки Меркеля в слизистой оболочке полости рта. Международный Дж. Сург Патол. 2006 июль; 14 (3): 206-11. [PubMed: 16959700]
Kydd WL, Daly CH. Биологическое и механическое воздействие стресса на слизистую оболочку полости рта. Джей Простет Дент. 1982 март; 47(3):317-29. [PubMed: 7038105]
Джей Простет Дент. 1982 март; 47(3):317-29. [PubMed: 7038105]
Chen J, Ahmad R, Li W, Swain M, Li Q. Биомеханика слизистой оболочки полости рта. Интерфейс JR Soc. 2015 Авг 06;12(109)):20150325. [Бесплатная статья PMC: PMC4535403] [PubMed: 26224566]
Fleisch L, Austin JC. Гистологическое исследование реакции жевательной и выстилающей слизистой оболочки на механическую нагрузку у зеленых мартышек. Джей Простет Дент. 1978 г., февраль; 39(2):211-6. [PubMed: 413909]
Тунгаре С., Паранджпе АГ. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 25 сентября 2021 г. Разрастание десен, вызванное лекарствами. [В паблике: 30860753]
Габалла К.Ю., Рахими И. Может ли присутствие пероральных гранул Фордайса служить маркером гиперлипидемии? Дент Рес Дж. (Исфахан). 2014 сен; 11 (5): 553-8. [Бесплатная статья PMC: PMC4241607] [PubMed: 25426145]

Wertz PW. Липиды и проницаемость и антимикробный барьер кожи. J Липиды. 2018;2018:5954034. [Бесплатная статья PMC: PMC6139190] [PubMed: 30245886]
Bearelly S, Cheung SW. Сенсорная топография структур полости рта. JAMA Otolaryngol Head Neck Surg. 2017 01 января; 143 (1): 73-80. [В паблике: 27684535]
Фельдман А.Т., Вулф Д. Обработка тканей и окрашивание гематоксилином и эозином. Методы Мол Биол. 2014;1180:31-43. [PubMed: 25015141]
Kurn H, Daly DT. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 19 ноября 2021 г. Гистология, эпителиальная клетка. [PubMed: 32644489]
Gonsalves WC, Chi AC, Neville BW. Общие поражения полости рта: Часть I. Поверхностные поражения слизистой оболочки. Ам семейный врач. 2007 15 февраля; 75 (4): 501-7. [В паблике: 17323710]
Гистология слизистой оболочки полости рта — StatPearls
Введение
Слизистая оболочка, выстилающая структуры в пределах полости рта, известна как слизистая оболочка полости рта . Это влажная оболочка мягких тканей, простирающаяся от места соединения красной каймы губ и слизистой оболочки губ спереди до небно-глоточных складок сзади.
Это влажная оболочка мягких тканей, простирающаяся от места соединения красной каймы губ и слизистой оболочки губ спереди до небно-глоточных складок сзади.
Гистологически слизистая оболочка полости рта состоит из трех слоев: поверхностного плоского многослойного эпителия, известного как эпителия полости рта , толщина и степень ороговения которого зависят от локализации и функциональных требований [1]. Ниже находится подлежащая соединительная ткань, известная как lamina propria, и плотная соединительная ткань неправильной формы, подслизистая оболочка, которая находится на самом глубоком уровне. Последний отсутствует в некоторых отделах ротовой полости, где собственная пластинка непосредственно связана с костью или мышцей.
Слизистую оболочку полости рта можно разделить на выстилающую слизистую оболочку, жевательную слизистую оболочку и специализированную слизистую оболочку с характерными гистологическими, клиническими и функциональными особенностями. Разнообразие функций, которые развивает слизистая оболочка полости рта, в основном включает защиту подлежащих тканей от механических, химических и биологических раздражителей, секрецию основных веществ и сенсорную функцию, которая позволяет воспринимать температуру, прикосновение, боль и вкус [2]. [3][4][2].
[3][4][2].
Структура
Эпителий полости рта
Вся поверхность слизистой оболочки полости рта покрыта многослойным плоским эпителием. Это высокоорганизованная бессосудистая и полупроницаемая ткань, толщина и степень ороговения которой варьируются в зависимости от расположения в ротовой полости и функциональных и механических требований этой области. Межпальцевый интерфейс соединяет эпителий и собственную пластинку. Волнообразные выступы более глубокого слоя эпителия, известные как сетчатые штифты , прикрепляются к нижележащим папиллярным отросткам собственной пластинки. Между этими двумя тканями находится неклеточная базальная мембрана, с которой плотно связан эпителий. Базальная мембрана обеспечивает поддержку эпителия и соединяет его с соединительной тканью. При световой микроскопии она видна как демаркационная линия между эпителием и соединительной тканью собственной пластинки. Однако это лучше видно с помощью электронной микроскопии, которая четко показывает базальную пластинку, которая далее подразделяется на прозрачную пластинку и плотную пластинку.
Слизистую оболочку полости рта можно разделить на три типа, которые различаются гистологически, клинически и функционально. Слизистая оболочка, которая выстилает подвижные структуры рта, получила название выстилки, или подвижной слизистой оболочки , которая находится на мягком небе, щеках, губах, слизистой оболочке альвеол, дне рта и вестибулярном своде. Тип эпителия, покрывающего слизистую оболочку, представляет собой неороговевающих многослойных плоскоклеточных эпителий [1]. Жесткая слизистая оболочка, плотно связанная с подлежащей костью в прикрепленной десне и твердом небе, известна как 9.0005 жевательная слизистая оболочка . Тип эпителия, покрывающего эти поверхности, представляет собой ороговевший или паракератинизированный многослойный плоский эпителий, который обеспечивает способность жевательной слизистой оболочки лучше выдерживать нагрузку, которой она подвергается во время жевания. Наконец, на спинке языка есть специализированная слизистая оболочка, на которой виден многослойный плоский эпителий, который может быть либо кератинизированным , либо некератинизированным . Он получил это название из-за своей уникальной особенности наличия различных типов языковых сосочков и вкусовых рецепторов, которые позволяют воспринимать вкус. Поскольку спинка языка активно участвует в жевании, эту слизистую оболочку иногда также классифицируют как жевательную слизистую оболочку.
Он получил это название из-за своей уникальной особенности наличия различных типов языковых сосочков и вкусовых рецепторов, которые позволяют воспринимать вкус. Поскольку спинка языка активно участвует в жевании, эту слизистую оболочку иногда также классифицируют как жевательную слизистую оболочку.
Четыре слоя образуют эпителий ротовой полости в ороговевшей слизистой оболочке полости рта, что характерно для жевательной слизистой оболочки. Начиная с более глубокого слоя, мы обнаружили базальный слой, за которым следовали шиповатый, зернистый и роговой слои. Когда эпителий неороговевает, например, в слизистой оболочке, над базальным слоем есть нитевидный и растянутый слои [1]. Кроме того, в неороговевающем эпителии, видимом на слизистой оболочке, отсутствует зернистый слой, а шиповатый слой, как известно, обычно тоньше [5]. Клетки, образующие эпителий, прикреплены друг к другу десмосомами и постепенно уплощаются от базального слоя вверх к роговому слою, где они приобретают чешуйчатый или чешуйчатый вид. Клетки плоского эпителия известны как кератиноциты, поскольку они в основном состоят из цитокератинов.
Клетки плоского эпителия известны как кератиноциты, поскольку они в основном состоят из цитокератинов.
Базальный слой представляет собой слой кубовидных или столбчатых клеток, которые находятся над базальной мембраной, к которой их прикрепляют полудесмосомы. Эти клетки известны своей митотической способностью. Непосредственно над базальным слоем несколько слоев более крупных клеток, называемых шиповатыми клетками, из-за их формы образуют шиповатый слой. Наступает зернистый слой; затем эти клетки содержат мелкие цитоплазматические гранулы кератогиалина, которые сильно окрашиваются гематоксилином. Наконец, более поверхностный слой, stratum superficiale или stratum corneum, представляет собой ороговевший слой, состоящий из очень плоских клеток, на которые указывает отсутствие ядра и окрашивание эозином в розовый цвет [6].
Восполнение эпителия полости рта
Эпителиальные клетки ротовой полости часто заменяются клеточным делением примерно каждые 14–21 день. Это связано с тем, что ротовая полость постоянно подвергается высоким функциональным требованиям, что обуславливает необходимость частого оборота. Процесс пополнения начинается в базальном слое, в основном образованном митотичными клетками, которые сначала подвергаются пролиферации, а затем процессам дифференцировки и миграции [2]. Известно, что оборот подвижной слизистой оболочки происходит быстрее, чем жевательной (см. табл. 1). Для поддержания гомеостаза эпителия необходима дифференцировка и десквамация на поверхности, которая уравновешивает деление клеток. Когда гомеостаз изменяется под воздействием таких факторов, как старение или патологические состояния, это может привести к гиперпластическому или атрофическому эпителию [7].
Это связано с тем, что ротовая полость постоянно подвергается высоким функциональным требованиям, что обуславливает необходимость частого оборота. Процесс пополнения начинается в базальном слое, в основном образованном митотичными клетками, которые сначала подвергаются пролиферации, а затем процессам дифференцировки и миграции [2]. Известно, что оборот подвижной слизистой оболочки происходит быстрее, чем жевательной (см. табл. 1). Для поддержания гомеостаза эпителия необходима дифференцировка и десквамация на поверхности, которая уравновешивает деление клеток. Когда гомеостаз изменяется под воздействием таких факторов, как старение или патологические состояния, это может привести к гиперпластическому или атрофическому эпителию [7].
Таблица 1: Время оборота эпителиальных клеток в выбранных тканях[7]
Популяция клеток, не содержащих кератиноцитов
Помимо кератиноцитов, в эпителии ротовой полости постоянно находятся другие специализированные клетки, называемые некератиноцитарными клетками, включая меланоциты, клетки Лангергана и клетки Меркеля. Более того, другие различные воспалительные клетки могут временно мигрировать в эпителий ротовой полости.
Более того, другие различные воспалительные клетки могут временно мигрировать в эпителий ротовой полости.
Меланоциты
Меланоциты представляют собой продуцирующие меланин удлиненные дендритные клетки, расположенные в базальном слое ротового эпителия, которые происходят из нервного гребня, а затем мигрируют в кожу и слизистую оболочку полости рта, где они и находятся [8]. Эти клетки содержат белки, необходимые для синтеза меланина и процесса созревания меланосом. Меланоциты синтезируют меланин в виде структур, известных как меланосомы, которые затем переносятся в цитоплазму соседних эпителиальных клеток благодаря своим длинным дендритным отросткам, простирающимся между кератиноцитами. Соотношение меланоцитов к кератиноцитам в базальном слое эпителия полости рта колеблется от 1:10 до 1:15 [9].][10][11]. Стволовые клетки меланоцитов, чья ниша в ротовой полости до сих пор неизвестна, поддерживают популяцию зрелых меланоцитов благодаря своей способности к регенерации и дифференцировке [10].
Все люди имеют одинаковое количество меланоцитов в слизистой оболочке полости рта и коже. Различные цвета кожи и пигментация слизистой оболочки полости рта определяются размером и количеством меланосом и типом синтезируемого меланина, эумеланина или феомеланина. Гранулы меланина, представляющие собой группы меланосом, можно наблюдать под микроскопом в сильно пигментированной ткани, окрашенной гематоксилином и эозином.
Известно, что функция, которую меланоциты выполняют в организме человека, хотя и не совсем понятна, заключается в производстве меланина, который способствует определению цвета кожи, слизистых оболочек, волос и глаз. В то же время меланин защищает эти ткани от вредного воздействия ультрафиолетового света, активных форм кислорода и свободных радикалов, присутствующих в окружающей среде [10]. Стоит отметить, что с возрастом количество ротовых меланоцитов увеличивается, и, следовательно, увеличивается степень и интенсивность пигментации полости рта, которые считаются физиологическими [12][13][14]. Предполагается, что это увеличение может быть результатом кумулятивных возможных меланогенных стимулов, таких как воспалительные состояния, лекарства, повторяющиеся и легкие функциональные травмы или табачный дым [15].
Предполагается, что это увеличение может быть результатом кумулятивных возможных меланогенных стимулов, таких как воспалительные состояния, лекарства, повторяющиеся и легкие функциональные травмы или табачный дым [15].
Клетки Лангерганса
Клетки Лангерганса представляют собой дендритные клетки, происходящие из костного мозга, которые мигрируют в эпителий ротовой полости, где они располагаются в шиповидном слое. Они необходимы для иммунного надзора за тканью, поскольку они функционируют как антигенпрезентирующие клетки, фагоцитируя антигены в эпителии и мигрируя в нижележащую собственную пластинку, откуда они могут достигать регионарных лимфатических узлов. Здесь они превращают антигенные белки в антигенные пептиды, которые впоследствии представляются Т-клеткам [16]. Таким образом, клетки Лангерганса являются связующим звеном между слизистой оболочкой полости рта и иммунной системой. Ультраструктурной отличительной особенностью этих клеток являются палочковидные органеллы, иногда описываемые как «теннисные ракетки», находящиеся исключительно в цитоплазме клеток Лангерганса, называемые гранулами или тельцами Бирбека. Клетки Лангерганса можно наблюдать с помощью специфических иммуногистохимических реакций, таких как иммуногистохимия S-100.
Клетки Лангерганса можно наблюдать с помощью специфических иммуногистохимических реакций, таких как иммуногистохимия S-100.
Ячейки Меркель
Клетки Меркеля представляют собой медленно адаптирующиеся сенсорные сенсорные рецепторы, связанные с нервным чувствительным окончанием, расположенным преимущественно в эпидермисе; однако они также обнаруживаются на слизистой оболочке полости рта в базальном слое [17][18]. Они имеют цитоплазматические пузырьки, обычно расположенные рядом со сцепленными с ними нервными волокнами. Было высказано предположение, что эти структуры высвобождают молекулы медиатора в синапсоподобное соединение, расположенное между нервным волокном и клеткой Меркеля, которое генерирует нервный импульс.
В полости рта они в основном локализуются в ороговевших эпителиях десен верхней и нижней челюсти и твердом небе. Однако эти комплексы клеток Меркеля и нейритов расположены в большем количестве в слизистой оболочке язычных десен. Поэтому считается, что они действуют как медленно адаптирующиеся механорецепторы и дают соматосенсорную информацию о положении языка [18].
Известно, что у пациентов, которые носят полные съемные протезы, снижается оральная чувствительность из-за потери периодонтальной связки. Недавние исследования показали возможность того, что увеличение количества клеток Меркеля может помочь частично компенсировать потерю механорецепции из-за потери периодонтальной связки у таких пациентов. Несмотря на это, оральная чувствительность пациентов с полной адентией останется нарушенной [19].].
Lamina Propria
Под эпителием находится слой соединительной ткани, называемый lamina propria , состоящий из кровеносных сосудов, нервов, фибробластов, макрофагов, тучных клеток и волокон воспалительных клеток, погруженных в аморфное вещество, образованное протеогликанами и гликопротеинами. Собственная пластинка подразделяется на два слоя: поверхностный сосочковый слой и более глубокий сетчатый слой. Сосочковый слой образован тонкими беспорядочно ориентированными коллагеновыми волокнами, образующими волнообразные гребни сосочков, которые соединяются с эпителием; эта поверхность обеспечивает более широкую область для транспорта питательных веществ [20]. В сосочковом слое обнаруживается множество капиллярных петель. Ретикулярный слой расположен между сосочковым слоем и нижележащей структурой (подслизистой оболочкой или надкостницей в зависимости от региона) и образован более толстыми коллагеновыми волокнами, которые ориентированы параллельно поверхности, хотя базальные волокна постепенно располагаются так, чтобы перпендикулярно соединяться с надкостницей [21]. ]. Эти волокнистые прикрепления называются слизисто-надкостничными, что обеспечивает способность сопротивляться сжатию и сдвигу слизистой оболочки полости рта благодаря прочному соединению с костью [22].
В сосочковом слое обнаруживается множество капиллярных петель. Ретикулярный слой расположен между сосочковым слоем и нижележащей структурой (подслизистой оболочкой или надкостницей в зависимости от региона) и образован более толстыми коллагеновыми волокнами, которые ориентированы параллельно поверхности, хотя базальные волокна постепенно располагаются так, чтобы перпендикулярно соединяться с надкостницей [21]. ]. Эти волокнистые прикрепления называются слизисто-надкостничными, что обеспечивает способность сопротивляться сжатию и сдвигу слизистой оболочки полости рта благодаря прочному соединению с костью [22].
Основной клеткой собственной пластинки пластинки является фибробласт, выполняющий основные функции. Он участвует в синтезе и восполнении соединительных волокон и аморфного вещества, а также в заживлении ран, где увеличивается количество фибробластов. При некоторых состояниях, таких как разрастание десен, вызванное лекарствами, индуцирующие препараты вызывают активацию и пролиферацию фибробластов тканей десны, что приводит к повышенной секреции гликозаминогликанов аморфного вещества [23]. Макрофаги в основном участвуют в фагоцитарной активности, а также стимулируют пролиферацию фибробластов во время заживления ран. Наконец, тучные клетки также обнаруживаются в соединительной ткани собственной пластинки. Отличительной их особенностью являются цитоплазматические гранулы, содержащие гепарин и гистамин, последний известен тем, что инициирует сосудистые изменения при воспалительном процессе. Двумя основными волокнами, обнаруженными в соединительной ткани собственной пластинки, являются коллаген и эластин, где основными являются коллагеновые волокна типа I и III.
Макрофаги в основном участвуют в фагоцитарной активности, а также стимулируют пролиферацию фибробластов во время заживления ран. Наконец, тучные клетки также обнаруживаются в соединительной ткани собственной пластинки. Отличительной их особенностью являются цитоплазматические гранулы, содержащие гепарин и гистамин, последний известен тем, что инициирует сосудистые изменения при воспалительном процессе. Двумя основными волокнами, обнаруженными в соединительной ткани собственной пластинки, являются коллаген и эластин, где основными являются коллагеновые волокна типа I и III.
Подслизистая основа
Под собственной пластинкой находится слой фиброколлагеновой и эластичной ткани, содержащий кровеносные сосуды и нервы, известный как подслизистая оболочка. В зависимости от локализации подслизистая оболочка может содержать жировую ткань, малые слюнные железы, лимфоидную ткань и мышечную ткань. Подслизистая оболочка обнаруживается во всех отделах щечной полости, кроме прикрепленной десны и твердого неба, покрытого жевательной слизистой оболочкой, где подслизистый слой отсутствует, а собственная пластинка непосредственно прикреплена к подлежащей кости, образуя слизисто-надкостничную оболочку.
Эктопические сальные железы, известные как гранулы Фордайса, могут быть обнаружены в подслизистом слое слизистой оболочки полости рта в некоторых местах. Несмотря на то, что они всегда считались нормальным вариантом, недавние исследования показали, что у людей с повышенным липидным профилем количество гранул Фордайса больше. Таким образом, этот клинический признак не следует игнорировать. Чаще всего они локализуются на слизистой оболочке щек и губ. Возраст и курение уменьшают их плотность [24].
Функция
Защитная функция
Полость рта представляет собой среду, постоянно подвергающуюся воздействию механических, химических и биологических раздражителей нашей повседневной деятельности. Слизистая оболочка полости рта играет важную роль в защите подлежащих тканей от механических сил, связанных с нормальной функцией жевания (растяжение, сжатие и истирание из-за жесткой диеты), внешних антигенов и вредных молекул из пищи. Кроме того, слизистая оболочка полости рта также подвергается воздействию канцерогенных веществ, содержащихся в алкоголе, табаке и бетеле, потребляемых в некоторых регионах. Эпителий полости рта действует как барьер против этих физиологических и патогенных стрессов. Он действует как физический и иммунный барьер для внешней агрессии и предотвращает проникновение нормальной бактериальной флоры полости рта, которая может вызвать инфекцию. Эпителий полости рта достигает этого за счет того, что состоит из многослойных эпителиальных клеток и межклеточных соединений и поддерживает иммунный ответ на антигены благодаря наличию дендритных клеток (DC) и Т-хелперных клеток 17 (Th27) [2].
Эпителий полости рта действует как барьер против этих физиологических и патогенных стрессов. Он действует как физический и иммунный барьер для внешней агрессии и предотвращает проникновение нормальной бактериальной флоры полости рта, которая может вызвать инфекцию. Эпителий полости рта достигает этого за счет того, что состоит из многослойных эпителиальных клеток и межклеточных соединений и поддерживает иммунный ответ на антигены благодаря наличию дендритных клеток (DC) и Т-хелперных клеток 17 (Th27) [2].
Секрет
Основным веществом, выделяемым слизистой оболочкой полости рта, является слюна, которая выделяется протоками больших и малых слюнных желез. В состав подслизистой оболочки входят широко распространенные в полости рта малые слюнные железы. Тем не менее основные слюнные железы, являющиеся основным источником слюны, располагаются за пределами слизистой оболочки полости рта. Однако их выводные протоки открываются в ротовую полость, способствуя поддержанию влажности тканей. Слизистая оболочка полости рта имеет меньшее количество сальных желез, зарегистрированных на губах, слизистой оболочке губ и щек у большинства взрослого населения и могут быть обнаружены спорадически в альвеолярной слизистой оболочке. Эти железы выделяют жировое вещество, известное как кожное сало, функции которого еще не определены. Однако недавние исследования кожного сала показывают, что он может играть роль в иммунитете [25].
Слизистая оболочка полости рта имеет меньшее количество сальных желез, зарегистрированных на губах, слизистой оболочке губ и щек у большинства взрослого населения и могут быть обнаружены спорадически в альвеолярной слизистой оболочке. Эти железы выделяют жировое вещество, известное как кожное сало, функции которого еще не определены. Однако недавние исследования кожного сала показывают, что он может играть роль в иммунитете [25].
Сенсорная функция
Полость рта получает сенсорную иннервацию от трех ветвей тройничного нерва. В слизистой оболочке полости рта в основном присутствуют три типа сенсорных окончаний, состоящие из дисков Меркеля, тельцов Мейснера и свободных нервных окончаний, которые позволяют слизистой оболочке полости рта воспринимать и реагировать на раздражители температуры, прикосновения и боли. Кроме того, он воспринимает вкусовые ощущения соленого, сладкого, кислого, горького и умами, хотя недавно было высказано предположение, что также может быть вкусовое ощущение жира [3][4]. Рецепторные клетки вкуса локализуются на спинке языка и мягком небе. Слизистые оболочки гортани, глотки и верхних отделов пищевода также содержат эти рецепторы. Сенсорная функция полости рта необходима для опознавания предметов, влияния на действия, совершаемые при жевании, и инициации глотательного рефлекса. Осязание позволяет координировать движения языка, губ и мягкого неба, чтобы правильно издавать звуки при разговоре [26].
Рецепторные клетки вкуса локализуются на спинке языка и мягком небе. Слизистые оболочки гортани, глотки и верхних отделов пищевода также содержат эти рецепторы. Сенсорная функция полости рта необходима для опознавания предметов, влияния на действия, совершаемые при жевании, и инициации глотательного рефлекса. Осязание позволяет координировать движения языка, губ и мягкого неба, чтобы правильно издавать звуки при разговоре [26].
Подготовка ткани
Образец биопсии слизистой оболочки полости рта можно исследовать под микроскопом после соответствующей обработки. Этапы подготовки образцов могут включать правильную консервацию тканей, обезвоживание, очистку, инфильтрацию парафином, создание срезов и окрашивание, чаще всего гематоксилином и эозином (H&E). Метод H&E точно дифференцирует различные клеточные компоненты, окрашивая ядро и цитоплазму контрастными цветами [27].
Гистохимия и цитохимия
Некоторые компоненты слизистой оболочки полости рта идентифицируются методами иммуногистохимии. Например, клетки Лангергана требуют специфических иммуногистохимических реакций, таких как иммуногистохимия S-100. Клетки Меркеля нелегко обнаружить в образцах, окрашенных гематоксилином и эозином, и обычно их идентифицируют методами иммуногистохимии. Они экспрессируют простые цитокератиновые промежуточные филаменты CK 7, 8, 18, 19 и 20. Более того, CK20 обнаружен только во вкусовых сосочках и клетках Меркеля в многослойном плоском эпителии [18].
Например, клетки Лангергана требуют специфических иммуногистохимических реакций, таких как иммуногистохимия S-100. Клетки Меркеля нелегко обнаружить в образцах, окрашенных гематоксилином и эозином, и обычно их идентифицируют методами иммуногистохимии. Они экспрессируют простые цитокератиновые промежуточные филаменты CK 7, 8, 18, 19 и 20. Более того, CK20 обнаружен только во вкусовых сосочках и клетках Меркеля в многослойном плоском эпителии [18].
Световая микроскопия
Световая микроскопия (LM) используется для визуализации различных структур окрашенного образца слизистой оболочки полости рта. Зная нормальный вид слизистой оболочки полости рта, можно выявить патологические изменения в ткани.
Микроскопия Электрон
Электронная микроскопия (ЭМ) использует пучок электронов для получения изображения образца вместо света, создавая изображения с более высоким разрешением, которые лучше идентифицируют гистологические структуры. При ЭМ можно идентифицировать ультраструктурные особенности эпителия, такие как слипчивые соединения, плотные соединения, щелевые соединения, десмосомы, полудесмосомы и базальную пластинку, которая отделяет эпителий от соединительной ткани [28].
Клиническое значение
Слизистая оболочка полости рта выполняет большое количество функций , имеющих клиническое значение. Он действует как защитный физический и иммунный барьер от внешних раздражителей и содержит малые слюнные железы, которые выделяют слюну, сохраняя влажность тканей, а также воспринимают и реагируют на раздражители температуры, прикосновения и боли. Множественные заболевания могут поражать слизистую оболочку полости рта и нарушать ее способность выполнять эти задачи. Чтобы упомянуть некоторые примеры, разрушение эпителия полости рта может вызвать различные поражения слизистой оболочки полости рта, такие как красный плоский лишай и лейкоплакия полости рта. Карциномы полости рта, такие как плоскоклеточная карцинома (OSCC), развиваются, когда эпителиальный барьер слизистой оболочки полости рта разрушается и кератиноциты подвергаются дефектной дифференцировке [2]. Кроме того, разрушение десневого барьера, вызванное дисбактериозом микробиоты полости рта в сочетании с воспалением, приводит к заболеваниям пародонта [2].
Распространенные поверхностные поражения слизистой оболочки полости рта включают рецидивирующий лабиальный герпес, кандидоз, рецидивирующий афтозный стоматит, мигрирующую эритему, волосатый язык и красный плоский лишай [29]. Кроме того, стоит отметить, что аномалии слизистой оболочки полости рта могут быть симптомом заболеваний слизистых оболочек или кожи и многих системных состояний. Поэтому знание гистологических особенностей слизистой оболочки полости рта необходимо для распознавания и точной диагностики патологических доброкачественных состояний и злокачественных новообразований.
Контрольные вопросы
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Рисунок
Слизистая оболочка полости рта, эпителий, собственная пластинка, подслизистая оболочка, надкостница, кость, сосочковый слой, ретикулярный слой. Предоставлено StatPearls Publishing. Иллюстрация Эммы Грегори. Фронт Иммунол. 2019;10:208. [Бесплатная статья PMC: PMC6383680] [PubMed: 30837987]
Иллюстрация Эммы Грегори. Фронт Иммунол. 2019;10:208. [Бесплатная статья PMC: PMC6383680] [PubMed: 30837987]
Ван С.С., Тан Ю.Л., Пан С., Чжэн М., Тан Ю.Дж., Лян Х.Х. Поддержание орального эпителиального барьера. Жизнь наук. 2019 15 июня; 227: 129-136. [PubMed: 31002922]
AlJulaih GH, Lasrado S. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 11 августа 2021 г. Анатомия, голова и шея, вкусовые рецепторы языка. [PubMed: 30969518]
Ложеретт Ф., Гайяр Д., Пассилли-Деграс П., Ниот И., Беснар П. Есть ли у нас вкус жира? Биохимия. 2007 г., февраль 89 г.(2): 265-9. [PubMed: 17126471]
Otsuka-Tanaka Y, Oommen S, Kawasaki M, Kawasaki K, Imam N, Jalani-Ghazani F, Hindges R, Sharpe PT, Ohazama A. Развитие слизистой оболочки полости рта зависит от мезенхимальные микроРНК. Джей Дент Рез. 2013 март; 92(3):229-34. [PubMed: 23242232]

Адамс Д. Кератинизация эпителия полости рта. Энн Р. Колл Surg Engl. 1976 г., сен; 58 (5): 351–358. [Бесплатная статья PMC: PMC24] [PubMed: 788618]
Squier CA, Кремер MJ. Биология слизистой оболочки полости рта и пищевода. J Natl Cancer Inst Monogr. 2001;(29):7-15. [PubMed: 11694559]
Томас А.Дж., Эриксон, Калифорния. Изготовление меланоцита: спецификация меланобластов из нервного гребня. Пигментно-клеточная меланома Res. 2008 Декабрь; 21 (6): 598-610. [PubMed: 1
69]Барретт А.В., Скалли С. Меланоциты слизистой оболочки полости рта человека: обзор. Дж Орал Патол Мед. 1994 март; 23 (3): 97-103. [PubMed: 8021847]
Феллер Л., Масилана А., Хаммисса Р.А., Алтини М., Джадват Ю., Леммер Дж. Меланин: биофизиология меланоцитов полости рта и физиологическая пигментация полости рта. Голова Лицо Мед. 2014 24 марта; 10:8. [Бесплатная статья PMC: PMC3994327] [PubMed: 24661309]

Yamaguchi Y, Brenner M, Hearing VJ. Регуляция пигментации кожи. Дж. Биол. Хим. 2007 г., 21 сентября; 282(38):27557-61. [PubMed: 17635904]
BROWN T. ПИГМЕНТАЦИЯ РТА У АБОРИГЕНОВ КАЛУМБУРУ, СЕВЕРО-ЗАПАДНАЯ АВСТРАЛИЯ. Arch Oral Biol. 1964 сен-октябрь; 9:555-64. [PubMed: 14205457]
Dummett CO, Barens G. Пигментация слизистой оболочки рта: обновленный литературный обзор. J Пародонтол. 1971 ноябрь; 42 (11): 726-36. [PubMed: 4944004]
Эйзен Д. Нарушения пигментации в полости рта. Клин Дерматол. 2000 сен-октябрь;18(5):579-87. [PubMed: 11134853]
Meleti M, Vescovi P, Mooi WJ, van der Waal I. Пигментные поражения слизистой оболочки полости рта и периоральных тканей: схема диагностики и некоторые рекомендации по лечению. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2008 май; 105(5):606-16. [PubMed: 18206403]
Wang YP, Chen IC, Wu YH, Wu YC, Chen HM, Yu-Fong Chang J. Количество клеток Лангерганса при дисплазии эпителия полости рта и их корреляция с клинико-патологическими параметрами. J Formos Med Assoc. 2017 июнь; 116 (6): 457-463. [В паблике: 282
Количество клеток Лангерганса при дисплазии эпителия полости рта и их корреляция с клинико-патологическими параметрами. J Formos Med Assoc. 2017 июнь; 116 (6): 457-463. [В паблике: 282
]
García-Caballero L, Caneiro J, Gándara M, González-Ortega N, Cepeda-Emiliani A, Gude F, Collado M, Beiras A, Gallego R. Клетки Меркеля слизистой оболочки полости рта человека экспрессируют плюрипотентный фактор транскрипции стволовых клеток Sox2. Гистол Гистопатол. 2020 сен;35(9):1007-1012. [PubMed: 32495847]
Кингсмилл В.Дж., Берковиц Б.К., Барретт А.В. Иммуногистохимический анализ плотности клеток Меркеля человека в эпителии десны у зубчатых и беззубых субъектов. Arch Oral Biol. 2005 г., октябрь; 50 (10): 883-7. [В паблике: 16137497]
Righi A, Betts CM, Marchetti C, Marucci G, Montebugnoli L, Prati C, Eusebi LH, Muzzi L, Ragazzini T, Foschini MP. Клетки Меркеля в слизистой оболочке полости рта. Международный Дж. Сург Патол. 2006 июль; 14 (3): 206-11. [PubMed: 16959700]
Сург Патол. 2006 июль; 14 (3): 206-11. [PubMed: 16959700]
Kydd WL, Daly CH. Биологическое и механическое воздействие стресса на слизистую оболочку полости рта. Джей Простет Дент. 1982 март; 47(3):317-29. [PubMed: 7038105]
Chen J, Ahmad R, Li W, Swain M, Li Q. Биомеханика слизистой оболочки полости рта. Интерфейс JR Soc. 2015 Авг 06;12(109)):20150325. [Бесплатная статья PMC: PMC4535403] [PubMed: 26224566]
Fleisch L, Austin JC. Гистологическое исследование реакции жевательной и выстилающей слизистой оболочки на механическую нагрузку у зеленых мартышек. Джей Простет Дент. 1978 г., февраль; 39(2):211-6. [PubMed: 413909]
Тунгаре С., Паранджпе АГ. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 25 сентября 2021 г. Разрастание десен, вызванное лекарствами. [В паблике: 30860753]
Габалла К.Ю., Рахими И. Может ли присутствие пероральных гранул Фордайса служить маркером гиперлипидемии? Дент Рес Дж. (Исфахан). 2014 сен; 11 (5): 553-8. [Бесплатная статья PMC: PMC4241607] [PubMed: 25426145]
Может ли присутствие пероральных гранул Фордайса служить маркером гиперлипидемии? Дент Рес Дж. (Исфахан). 2014 сен; 11 (5): 553-8. [Бесплатная статья PMC: PMC4241607] [PubMed: 25426145]
Wertz PW. Липиды и проницаемость и антимикробный барьер кожи. J Липиды. 2018;2018:5954034. [Бесплатная статья PMC: PMC6139190] [PubMed: 30245886]
Bearelly S, Cheung SW. Сенсорная топография структур полости рта. JAMA Otolaryngol Head Neck Surg. 2017 01 января; 143 (1): 73-80. [В паблике: 27684535]
Фельдман А.Т., Вулф Д. Обработка тканей и окрашивание гематоксилином и эозином. Методы Мол Биол. 2014;1180:31-43. [PubMed: 25015141]
Kurn H, Daly DT. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 19 ноября 2021 г. Гистология, эпителиальная клетка. [PubMed: 32644489]
Gonsalves WC, Chi AC, Neville BW. Общие поражения полости рта: Часть I. Поверхностные поражения слизистой оболочки. Ам семейный врач. 2007 15 февраля; 75 (4): 501-7. [В паблике: 17323710]
Поверхностные поражения слизистой оболочки. Ам семейный врач. 2007 15 февраля; 75 (4): 501-7. [В паблике: 17323710]
Гистология слизистой оболочки полости рта — StatPearls
Введение
Слизистая оболочка, выстилающая структуры в пределах полости рта, известна как слизистая оболочка полости рта . Это влажная оболочка мягких тканей, простирающаяся от места соединения красной каймы губ и слизистой оболочки губ спереди до небно-глоточных складок сзади.
Гистологически слизистая оболочка полости рта состоит из трех слоев: поверхностного плоского многослойного эпителия, известного как эпителия полости рта , толщина и степень ороговения которого зависят от локализации и функциональных требований [1]. Ниже находится подлежащая соединительная ткань, известная как lamina propria, и плотная соединительная ткань неправильной формы, подслизистая оболочка, которая находится на самом глубоком уровне. Последний отсутствует в некоторых отделах ротовой полости, где собственная пластинка непосредственно связана с костью или мышцей.
Слизистую оболочку полости рта можно разделить на выстилающую слизистую оболочку, жевательную слизистую оболочку и специализированную слизистую оболочку с характерными гистологическими, клиническими и функциональными особенностями. Разнообразие функций, которые развивает слизистая оболочка полости рта, в основном включает защиту подлежащих тканей от механических, химических и биологических раздражителей, секрецию основных веществ и сенсорную функцию, которая позволяет воспринимать температуру, прикосновение, боль и вкус [2]. [3][4][2].
Структура
Эпителий полости рта
Вся поверхность слизистой оболочки полости рта покрыта многослойным плоским эпителием. Это высокоорганизованная бессосудистая и полупроницаемая ткань, толщина и степень ороговения которой варьируются в зависимости от расположения в ротовой полости и функциональных и механических требований этой области. Межпальцевый интерфейс соединяет эпителий и собственную пластинку. Волнообразные выступы более глубокого слоя эпителия, известные как сетчатые штифты , прикрепляются к нижележащим папиллярным отросткам собственной пластинки. Между этими двумя тканями находится неклеточная базальная мембрана, с которой плотно связан эпителий. Базальная мембрана обеспечивает поддержку эпителия и соединяет его с соединительной тканью. При световой микроскопии она видна как демаркационная линия между эпителием и соединительной тканью собственной пластинки. Однако это лучше видно с помощью электронной микроскопии, которая четко показывает базальную пластинку, которая далее подразделяется на прозрачную пластинку и плотную пластинку.
Волнообразные выступы более глубокого слоя эпителия, известные как сетчатые штифты , прикрепляются к нижележащим папиллярным отросткам собственной пластинки. Между этими двумя тканями находится неклеточная базальная мембрана, с которой плотно связан эпителий. Базальная мембрана обеспечивает поддержку эпителия и соединяет его с соединительной тканью. При световой микроскопии она видна как демаркационная линия между эпителием и соединительной тканью собственной пластинки. Однако это лучше видно с помощью электронной микроскопии, которая четко показывает базальную пластинку, которая далее подразделяется на прозрачную пластинку и плотную пластинку.
Слизистую оболочку полости рта можно разделить на три типа, которые различаются гистологически, клинически и функционально. Слизистая оболочка, которая выстилает подвижные структуры рта, получила название выстилки, или подвижной слизистой оболочки , которая находится на мягком небе, щеках, губах, слизистой оболочке альвеол, дне рта и вестибулярном своде. Тип эпителия, покрывающего слизистую оболочку, представляет собой неороговевающих многослойных плоскоклеточных эпителий [1]. Жесткая слизистая оболочка, плотно связанная с подлежащей костью в прикрепленной десне и твердом небе, известна как 9.0005 жевательная слизистая оболочка . Тип эпителия, покрывающего эти поверхности, представляет собой ороговевший или паракератинизированный многослойный плоский эпителий, который обеспечивает способность жевательной слизистой оболочки лучше выдерживать нагрузку, которой она подвергается во время жевания. Наконец, на спинке языка есть специализированная слизистая оболочка, на которой виден многослойный плоский эпителий, который может быть либо кератинизированным , либо некератинизированным . Он получил это название из-за своей уникальной особенности наличия различных типов языковых сосочков и вкусовых рецепторов, которые позволяют воспринимать вкус. Поскольку спинка языка активно участвует в жевании, эту слизистую оболочку иногда также классифицируют как жевательную слизистую оболочку.
Тип эпителия, покрывающего слизистую оболочку, представляет собой неороговевающих многослойных плоскоклеточных эпителий [1]. Жесткая слизистая оболочка, плотно связанная с подлежащей костью в прикрепленной десне и твердом небе, известна как 9.0005 жевательная слизистая оболочка . Тип эпителия, покрывающего эти поверхности, представляет собой ороговевший или паракератинизированный многослойный плоский эпителий, который обеспечивает способность жевательной слизистой оболочки лучше выдерживать нагрузку, которой она подвергается во время жевания. Наконец, на спинке языка есть специализированная слизистая оболочка, на которой виден многослойный плоский эпителий, который может быть либо кератинизированным , либо некератинизированным . Он получил это название из-за своей уникальной особенности наличия различных типов языковых сосочков и вкусовых рецепторов, которые позволяют воспринимать вкус. Поскольку спинка языка активно участвует в жевании, эту слизистую оболочку иногда также классифицируют как жевательную слизистую оболочку.
Четыре слоя образуют эпителий ротовой полости в ороговевшей слизистой оболочке полости рта, что характерно для жевательной слизистой оболочки. Начиная с более глубокого слоя, мы обнаружили базальный слой, за которым следовали шиповатый, зернистый и роговой слои. Когда эпителий неороговевает, например, в слизистой оболочке, над базальным слоем есть нитевидный и растянутый слои [1]. Кроме того, в неороговевающем эпителии, видимом на слизистой оболочке, отсутствует зернистый слой, а шиповатый слой, как известно, обычно тоньше [5]. Клетки, образующие эпителий, прикреплены друг к другу десмосомами и постепенно уплощаются от базального слоя вверх к роговому слою, где они приобретают чешуйчатый или чешуйчатый вид. Клетки плоского эпителия известны как кератиноциты, поскольку они в основном состоят из цитокератинов.
Базальный слой представляет собой слой кубовидных или столбчатых клеток, которые находятся над базальной мембраной, к которой их прикрепляют полудесмосомы. Эти клетки известны своей митотической способностью. Непосредственно над базальным слоем несколько слоев более крупных клеток, называемых шиповатыми клетками, из-за их формы образуют шиповатый слой. Наступает зернистый слой; затем эти клетки содержат мелкие цитоплазматические гранулы кератогиалина, которые сильно окрашиваются гематоксилином. Наконец, более поверхностный слой, stratum superficiale или stratum corneum, представляет собой ороговевший слой, состоящий из очень плоских клеток, на которые указывает отсутствие ядра и окрашивание эозином в розовый цвет [6].
Непосредственно над базальным слоем несколько слоев более крупных клеток, называемых шиповатыми клетками, из-за их формы образуют шиповатый слой. Наступает зернистый слой; затем эти клетки содержат мелкие цитоплазматические гранулы кератогиалина, которые сильно окрашиваются гематоксилином. Наконец, более поверхностный слой, stratum superficiale или stratum corneum, представляет собой ороговевший слой, состоящий из очень плоских клеток, на которые указывает отсутствие ядра и окрашивание эозином в розовый цвет [6].
Восполнение эпителия полости рта
Эпителиальные клетки ротовой полости часто заменяются клеточным делением примерно каждые 14–21 день. Это связано с тем, что ротовая полость постоянно подвергается высоким функциональным требованиям, что обуславливает необходимость частого оборота. Процесс пополнения начинается в базальном слое, в основном образованном митотичными клетками, которые сначала подвергаются пролиферации, а затем процессам дифференцировки и миграции [2]. Известно, что оборот подвижной слизистой оболочки происходит быстрее, чем жевательной (см. табл. 1). Для поддержания гомеостаза эпителия необходима дифференцировка и десквамация на поверхности, которая уравновешивает деление клеток. Когда гомеостаз изменяется под воздействием таких факторов, как старение или патологические состояния, это может привести к гиперпластическому или атрофическому эпителию [7].
Известно, что оборот подвижной слизистой оболочки происходит быстрее, чем жевательной (см. табл. 1). Для поддержания гомеостаза эпителия необходима дифференцировка и десквамация на поверхности, которая уравновешивает деление клеток. Когда гомеостаз изменяется под воздействием таких факторов, как старение или патологические состояния, это может привести к гиперпластическому или атрофическому эпителию [7].
Таблица 1: Время оборота эпителиальных клеток в выбранных тканях[7]
Популяция клеток, не содержащих кератиноцитов
Помимо кератиноцитов, в эпителии ротовой полости постоянно находятся другие специализированные клетки, называемые некератиноцитарными клетками, включая меланоциты, клетки Лангергана и клетки Меркеля. Более того, другие различные воспалительные клетки могут временно мигрировать в эпителий ротовой полости.
Меланоциты
Меланоциты представляют собой продуцирующие меланин удлиненные дендритные клетки, расположенные в базальном слое ротового эпителия, которые происходят из нервного гребня, а затем мигрируют в кожу и слизистую оболочку полости рта, где они и находятся [8]. Эти клетки содержат белки, необходимые для синтеза меланина и процесса созревания меланосом. Меланоциты синтезируют меланин в виде структур, известных как меланосомы, которые затем переносятся в цитоплазму соседних эпителиальных клеток благодаря своим длинным дендритным отросткам, простирающимся между кератиноцитами. Соотношение меланоцитов к кератиноцитам в базальном слое эпителия полости рта колеблется от 1:10 до 1:15 [9].][10][11]. Стволовые клетки меланоцитов, чья ниша в ротовой полости до сих пор неизвестна, поддерживают популяцию зрелых меланоцитов благодаря своей способности к регенерации и дифференцировке [10].
Эти клетки содержат белки, необходимые для синтеза меланина и процесса созревания меланосом. Меланоциты синтезируют меланин в виде структур, известных как меланосомы, которые затем переносятся в цитоплазму соседних эпителиальных клеток благодаря своим длинным дендритным отросткам, простирающимся между кератиноцитами. Соотношение меланоцитов к кератиноцитам в базальном слое эпителия полости рта колеблется от 1:10 до 1:15 [9].][10][11]. Стволовые клетки меланоцитов, чья ниша в ротовой полости до сих пор неизвестна, поддерживают популяцию зрелых меланоцитов благодаря своей способности к регенерации и дифференцировке [10].
Все люди имеют одинаковое количество меланоцитов в слизистой оболочке полости рта и коже. Различные цвета кожи и пигментация слизистой оболочки полости рта определяются размером и количеством меланосом и типом синтезируемого меланина, эумеланина или феомеланина. Гранулы меланина, представляющие собой группы меланосом, можно наблюдать под микроскопом в сильно пигментированной ткани, окрашенной гематоксилином и эозином.
Известно, что функция, которую меланоциты выполняют в организме человека, хотя и не совсем понятна, заключается в производстве меланина, который способствует определению цвета кожи, слизистых оболочек, волос и глаз. В то же время меланин защищает эти ткани от вредного воздействия ультрафиолетового света, активных форм кислорода и свободных радикалов, присутствующих в окружающей среде [10]. Стоит отметить, что с возрастом количество ротовых меланоцитов увеличивается, и, следовательно, увеличивается степень и интенсивность пигментации полости рта, которые считаются физиологическими [12][13][14]. Предполагается, что это увеличение может быть результатом кумулятивных возможных меланогенных стимулов, таких как воспалительные состояния, лекарства, повторяющиеся и легкие функциональные травмы или табачный дым [15].
Клетки Лангерганса
Клетки Лангерганса представляют собой дендритные клетки, происходящие из костного мозга, которые мигрируют в эпителий ротовой полости, где они располагаются в шиповидном слое. Они необходимы для иммунного надзора за тканью, поскольку они функционируют как антигенпрезентирующие клетки, фагоцитируя антигены в эпителии и мигрируя в нижележащую собственную пластинку, откуда они могут достигать регионарных лимфатических узлов. Здесь они превращают антигенные белки в антигенные пептиды, которые впоследствии представляются Т-клеткам [16]. Таким образом, клетки Лангерганса являются связующим звеном между слизистой оболочкой полости рта и иммунной системой. Ультраструктурной отличительной особенностью этих клеток являются палочковидные органеллы, иногда описываемые как «теннисные ракетки», находящиеся исключительно в цитоплазме клеток Лангерганса, называемые гранулами или тельцами Бирбека. Клетки Лангерганса можно наблюдать с помощью специфических иммуногистохимических реакций, таких как иммуногистохимия S-100.
Они необходимы для иммунного надзора за тканью, поскольку они функционируют как антигенпрезентирующие клетки, фагоцитируя антигены в эпителии и мигрируя в нижележащую собственную пластинку, откуда они могут достигать регионарных лимфатических узлов. Здесь они превращают антигенные белки в антигенные пептиды, которые впоследствии представляются Т-клеткам [16]. Таким образом, клетки Лангерганса являются связующим звеном между слизистой оболочкой полости рта и иммунной системой. Ультраструктурной отличительной особенностью этих клеток являются палочковидные органеллы, иногда описываемые как «теннисные ракетки», находящиеся исключительно в цитоплазме клеток Лангерганса, называемые гранулами или тельцами Бирбека. Клетки Лангерганса можно наблюдать с помощью специфических иммуногистохимических реакций, таких как иммуногистохимия S-100.
Ячейки Меркель
Клетки Меркеля представляют собой медленно адаптирующиеся сенсорные сенсорные рецепторы, связанные с нервным чувствительным окончанием, расположенным преимущественно в эпидермисе; однако они также обнаруживаются на слизистой оболочке полости рта в базальном слое [17][18]. Они имеют цитоплазматические пузырьки, обычно расположенные рядом со сцепленными с ними нервными волокнами. Было высказано предположение, что эти структуры высвобождают молекулы медиатора в синапсоподобное соединение, расположенное между нервным волокном и клеткой Меркеля, которое генерирует нервный импульс.
Они имеют цитоплазматические пузырьки, обычно расположенные рядом со сцепленными с ними нервными волокнами. Было высказано предположение, что эти структуры высвобождают молекулы медиатора в синапсоподобное соединение, расположенное между нервным волокном и клеткой Меркеля, которое генерирует нервный импульс.
В полости рта они в основном локализуются в ороговевших эпителиях десен верхней и нижней челюсти и твердом небе. Однако эти комплексы клеток Меркеля и нейритов расположены в большем количестве в слизистой оболочке язычных десен. Поэтому считается, что они действуют как медленно адаптирующиеся механорецепторы и дают соматосенсорную информацию о положении языка [18].
Известно, что у пациентов, которые носят полные съемные протезы, снижается оральная чувствительность из-за потери периодонтальной связки. Недавние исследования показали возможность того, что увеличение количества клеток Меркеля может помочь частично компенсировать потерю механорецепции из-за потери периодонтальной связки у таких пациентов. Несмотря на это, оральная чувствительность пациентов с полной адентией останется нарушенной [19].].
Несмотря на это, оральная чувствительность пациентов с полной адентией останется нарушенной [19].].
Lamina Propria
Под эпителием находится слой соединительной ткани, называемый lamina propria , состоящий из кровеносных сосудов, нервов, фибробластов, макрофагов, тучных клеток и волокон воспалительных клеток, погруженных в аморфное вещество, образованное протеогликанами и гликопротеинами. Собственная пластинка подразделяется на два слоя: поверхностный сосочковый слой и более глубокий сетчатый слой. Сосочковый слой образован тонкими беспорядочно ориентированными коллагеновыми волокнами, образующими волнообразные гребни сосочков, которые соединяются с эпителием; эта поверхность обеспечивает более широкую область для транспорта питательных веществ [20]. В сосочковом слое обнаруживается множество капиллярных петель. Ретикулярный слой расположен между сосочковым слоем и нижележащей структурой (подслизистой оболочкой или надкостницей в зависимости от региона) и образован более толстыми коллагеновыми волокнами, которые ориентированы параллельно поверхности, хотя базальные волокна постепенно располагаются так, чтобы перпендикулярно соединяться с надкостницей [21]. ]. Эти волокнистые прикрепления называются слизисто-надкостничными, что обеспечивает способность сопротивляться сжатию и сдвигу слизистой оболочки полости рта благодаря прочному соединению с костью [22].
]. Эти волокнистые прикрепления называются слизисто-надкостничными, что обеспечивает способность сопротивляться сжатию и сдвигу слизистой оболочки полости рта благодаря прочному соединению с костью [22].
Основной клеткой собственной пластинки пластинки является фибробласт, выполняющий основные функции. Он участвует в синтезе и восполнении соединительных волокон и аморфного вещества, а также в заживлении ран, где увеличивается количество фибробластов. При некоторых состояниях, таких как разрастание десен, вызванное лекарствами, индуцирующие препараты вызывают активацию и пролиферацию фибробластов тканей десны, что приводит к повышенной секреции гликозаминогликанов аморфного вещества [23]. Макрофаги в основном участвуют в фагоцитарной активности, а также стимулируют пролиферацию фибробластов во время заживления ран. Наконец, тучные клетки также обнаруживаются в соединительной ткани собственной пластинки. Отличительной их особенностью являются цитоплазматические гранулы, содержащие гепарин и гистамин, последний известен тем, что инициирует сосудистые изменения при воспалительном процессе. Двумя основными волокнами, обнаруженными в соединительной ткани собственной пластинки, являются коллаген и эластин, где основными являются коллагеновые волокна типа I и III.
Двумя основными волокнами, обнаруженными в соединительной ткани собственной пластинки, являются коллаген и эластин, где основными являются коллагеновые волокна типа I и III.
Подслизистая основа
Под собственной пластинкой находится слой фиброколлагеновой и эластичной ткани, содержащий кровеносные сосуды и нервы, известный как подслизистая оболочка. В зависимости от локализации подслизистая оболочка может содержать жировую ткань, малые слюнные железы, лимфоидную ткань и мышечную ткань. Подслизистая оболочка обнаруживается во всех отделах щечной полости, кроме прикрепленной десны и твердого неба, покрытого жевательной слизистой оболочкой, где подслизистый слой отсутствует, а собственная пластинка непосредственно прикреплена к подлежащей кости, образуя слизисто-надкостничную оболочку.
Эктопические сальные железы, известные как гранулы Фордайса, могут быть обнаружены в подслизистом слое слизистой оболочки полости рта в некоторых местах. Несмотря на то, что они всегда считались нормальным вариантом, недавние исследования показали, что у людей с повышенным липидным профилем количество гранул Фордайса больше. Таким образом, этот клинический признак не следует игнорировать. Чаще всего они локализуются на слизистой оболочке щек и губ. Возраст и курение уменьшают их плотность [24].
Таким образом, этот клинический признак не следует игнорировать. Чаще всего они локализуются на слизистой оболочке щек и губ. Возраст и курение уменьшают их плотность [24].
Функция
Защитная функция
Полость рта представляет собой среду, постоянно подвергающуюся воздействию механических, химических и биологических раздражителей нашей повседневной деятельности. Слизистая оболочка полости рта играет важную роль в защите подлежащих тканей от механических сил, связанных с нормальной функцией жевания (растяжение, сжатие и истирание из-за жесткой диеты), внешних антигенов и вредных молекул из пищи. Кроме того, слизистая оболочка полости рта также подвергается воздействию канцерогенных веществ, содержащихся в алкоголе, табаке и бетеле, потребляемых в некоторых регионах. Эпителий полости рта действует как барьер против этих физиологических и патогенных стрессов. Он действует как физический и иммунный барьер для внешней агрессии и предотвращает проникновение нормальной бактериальной флоры полости рта, которая может вызвать инфекцию. Эпителий полости рта достигает этого за счет того, что состоит из многослойных эпителиальных клеток и межклеточных соединений и поддерживает иммунный ответ на антигены благодаря наличию дендритных клеток (DC) и Т-хелперных клеток 17 (Th27) [2].
Эпителий полости рта достигает этого за счет того, что состоит из многослойных эпителиальных клеток и межклеточных соединений и поддерживает иммунный ответ на антигены благодаря наличию дендритных клеток (DC) и Т-хелперных клеток 17 (Th27) [2].
Секрет
Основным веществом, выделяемым слизистой оболочкой полости рта, является слюна, которая выделяется протоками больших и малых слюнных желез. В состав подслизистой оболочки входят широко распространенные в полости рта малые слюнные железы. Тем не менее основные слюнные железы, являющиеся основным источником слюны, располагаются за пределами слизистой оболочки полости рта. Однако их выводные протоки открываются в ротовую полость, способствуя поддержанию влажности тканей. Слизистая оболочка полости рта имеет меньшее количество сальных желез, зарегистрированных на губах, слизистой оболочке губ и щек у большинства взрослого населения и могут быть обнаружены спорадически в альвеолярной слизистой оболочке. Эти железы выделяют жировое вещество, известное как кожное сало, функции которого еще не определены. Однако недавние исследования кожного сала показывают, что он может играть роль в иммунитете [25].
Однако недавние исследования кожного сала показывают, что он может играть роль в иммунитете [25].
Сенсорная функция
Полость рта получает сенсорную иннервацию от трех ветвей тройничного нерва. В слизистой оболочке полости рта в основном присутствуют три типа сенсорных окончаний, состоящие из дисков Меркеля, тельцов Мейснера и свободных нервных окончаний, которые позволяют слизистой оболочке полости рта воспринимать и реагировать на раздражители температуры, прикосновения и боли. Кроме того, он воспринимает вкусовые ощущения соленого, сладкого, кислого, горького и умами, хотя недавно было высказано предположение, что также может быть вкусовое ощущение жира [3][4]. Рецепторные клетки вкуса локализуются на спинке языка и мягком небе. Слизистые оболочки гортани, глотки и верхних отделов пищевода также содержат эти рецепторы. Сенсорная функция полости рта необходима для опознавания предметов, влияния на действия, совершаемые при жевании, и инициации глотательного рефлекса. Осязание позволяет координировать движения языка, губ и мягкого неба, чтобы правильно издавать звуки при разговоре [26].
Осязание позволяет координировать движения языка, губ и мягкого неба, чтобы правильно издавать звуки при разговоре [26].
Подготовка ткани
Образец биопсии слизистой оболочки полости рта можно исследовать под микроскопом после соответствующей обработки. Этапы подготовки образцов могут включать правильную консервацию тканей, обезвоживание, очистку, инфильтрацию парафином, создание срезов и окрашивание, чаще всего гематоксилином и эозином (H&E). Метод H&E точно дифференцирует различные клеточные компоненты, окрашивая ядро и цитоплазму контрастными цветами [27].
Гистохимия и цитохимия
Некоторые компоненты слизистой оболочки полости рта идентифицируются методами иммуногистохимии. Например, клетки Лангергана требуют специфических иммуногистохимических реакций, таких как иммуногистохимия S-100. Клетки Меркеля нелегко обнаружить в образцах, окрашенных гематоксилином и эозином, и обычно их идентифицируют методами иммуногистохимии. Они экспрессируют простые цитокератиновые промежуточные филаменты CK 7, 8, 18, 19 и 20. Более того, CK20 обнаружен только во вкусовых сосочках и клетках Меркеля в многослойном плоском эпителии [18].
Более того, CK20 обнаружен только во вкусовых сосочках и клетках Меркеля в многослойном плоском эпителии [18].
Световая микроскопия
Световая микроскопия (LM) используется для визуализации различных структур окрашенного образца слизистой оболочки полости рта. Зная нормальный вид слизистой оболочки полости рта, можно выявить патологические изменения в ткани.
Микроскопия Электрон
Электронная микроскопия (ЭМ) использует пучок электронов для получения изображения образца вместо света, создавая изображения с более высоким разрешением, которые лучше идентифицируют гистологические структуры. При ЭМ можно идентифицировать ультраструктурные особенности эпителия, такие как слипчивые соединения, плотные соединения, щелевые соединения, десмосомы, полудесмосомы и базальную пластинку, которая отделяет эпителий от соединительной ткани [28].
Клиническое значение
Слизистая оболочка полости рта выполняет большое количество функций , имеющих клиническое значение. Он действует как защитный физический и иммунный барьер от внешних раздражителей и содержит малые слюнные железы, которые выделяют слюну, сохраняя влажность тканей, а также воспринимают и реагируют на раздражители температуры, прикосновения и боли. Множественные заболевания могут поражать слизистую оболочку полости рта и нарушать ее способность выполнять эти задачи. Чтобы упомянуть некоторые примеры, разрушение эпителия полости рта может вызвать различные поражения слизистой оболочки полости рта, такие как красный плоский лишай и лейкоплакия полости рта. Карциномы полости рта, такие как плоскоклеточная карцинома (OSCC), развиваются, когда эпителиальный барьер слизистой оболочки полости рта разрушается и кератиноциты подвергаются дефектной дифференцировке [2]. Кроме того, разрушение десневого барьера, вызванное дисбактериозом микробиоты полости рта в сочетании с воспалением, приводит к заболеваниям пародонта [2].
Он действует как защитный физический и иммунный барьер от внешних раздражителей и содержит малые слюнные железы, которые выделяют слюну, сохраняя влажность тканей, а также воспринимают и реагируют на раздражители температуры, прикосновения и боли. Множественные заболевания могут поражать слизистую оболочку полости рта и нарушать ее способность выполнять эти задачи. Чтобы упомянуть некоторые примеры, разрушение эпителия полости рта может вызвать различные поражения слизистой оболочки полости рта, такие как красный плоский лишай и лейкоплакия полости рта. Карциномы полости рта, такие как плоскоклеточная карцинома (OSCC), развиваются, когда эпителиальный барьер слизистой оболочки полости рта разрушается и кератиноциты подвергаются дефектной дифференцировке [2]. Кроме того, разрушение десневого барьера, вызванное дисбактериозом микробиоты полости рта в сочетании с воспалением, приводит к заболеваниям пародонта [2].
Распространенные поверхностные поражения слизистой оболочки полости рта включают рецидивирующий лабиальный герпес, кандидоз, рецидивирующий афтозный стоматит, мигрирующую эритему, волосатый язык и красный плоский лишай [29]. Кроме того, стоит отметить, что аномалии слизистой оболочки полости рта могут быть симптомом заболеваний слизистых оболочек или кожи и многих системных состояний. Поэтому знание гистологических особенностей слизистой оболочки полости рта необходимо для распознавания и точной диагностики патологических доброкачественных состояний и злокачественных новообразований.
Кроме того, стоит отметить, что аномалии слизистой оболочки полости рта могут быть симптомом заболеваний слизистых оболочек или кожи и многих системных состояний. Поэтому знание гистологических особенностей слизистой оболочки полости рта необходимо для распознавания и точной диагностики патологических доброкачественных состояний и злокачественных новообразований.
Контрольные вопросы
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Рисунок
Слизистая оболочка полости рта, эпителий, собственная пластинка, подслизистая оболочка, надкостница, кость, сосочковый слой, ретикулярный слой. Предоставлено StatPearls Publishing. Иллюстрация Эммы Грегори. Фронт Иммунол. 2019;10:208. [Бесплатная статья PMC: PMC6383680] [PubMed: 30837987]
Ван С.С., Тан Ю.Л., Пан С., Чжэн М., Тан Ю.Дж., Лян Х.Х. Поддержание орального эпителиального барьера. Жизнь наук. 2019 15 июня; 227: 129-136. [PubMed: 31002922]
Жизнь наук. 2019 15 июня; 227: 129-136. [PubMed: 31002922]
AlJulaih GH, Lasrado S. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 11 августа 2021 г. Анатомия, голова и шея, вкусовые рецепторы языка. [PubMed: 30969518]
Ложеретт Ф., Гайяр Д., Пассилли-Деграс П., Ниот И., Беснар П. Есть ли у нас вкус жира? Биохимия. 2007 г., февраль 89 г.(2): 265-9. [PubMed: 17126471]
Otsuka-Tanaka Y, Oommen S, Kawasaki M, Kawasaki K, Imam N, Jalani-Ghazani F, Hindges R, Sharpe PT, Ohazama A. Развитие слизистой оболочки полости рта зависит от мезенхимальные микроРНК. Джей Дент Рез. 2013 март; 92(3):229-34. [PubMed: 23242232]
Адамс Д. Кератинизация эпителия полости рта. Энн Р. Колл Surg Engl. 1976 г., сен; 58 (5): 351–358. [Бесплатная статья PMC: PMC24] [PubMed: 788618]
Squier CA, Кремер MJ. Биология слизистой оболочки полости рта и пищевода. J Natl Cancer Inst Monogr. 2001;(29):7-15. [PubMed: 11694559]
J Natl Cancer Inst Monogr. 2001;(29):7-15. [PubMed: 11694559]
Томас А.Дж., Эриксон, Калифорния. Изготовление меланоцита: спецификация меланобластов из нервного гребня. Пигментно-клеточная меланома Res. 2008 Декабрь; 21 (6): 598-610. [PubMed: 1
69]Барретт А.В., Скалли С. Меланоциты слизистой оболочки полости рта человека: обзор. Дж Орал Патол Мед. 1994 март; 23 (3): 97-103. [PubMed: 8021847]
Феллер Л., Масилана А., Хаммисса Р.А., Алтини М., Джадват Ю., Леммер Дж. Меланин: биофизиология меланоцитов полости рта и физиологическая пигментация полости рта. Голова Лицо Мед. 2014 24 марта; 10:8. [Бесплатная статья PMC: PMC3994327] [PubMed: 24661309]
Yamaguchi Y, Brenner M, Hearing VJ. Регуляция пигментации кожи. Дж. Биол. Хим. 2007 г., 21 сентября; 282(38):27557-61. [PubMed: 17635904]
BROWN T. ПИГМЕНТАЦИЯ РТА У АБОРИГЕНОВ КАЛУМБУРУ, СЕВЕРО-ЗАПАДНАЯ АВСТРАЛИЯ. Arch Oral Biol. 1964 сен-октябрь; 9:555-64. [PubMed: 14205457]
Arch Oral Biol. 1964 сен-октябрь; 9:555-64. [PubMed: 14205457]
Dummett CO, Barens G. Пигментация слизистой оболочки рта: обновленный литературный обзор. J Пародонтол. 1971 ноябрь; 42 (11): 726-36. [PubMed: 4944004]
Эйзен Д. Нарушения пигментации в полости рта. Клин Дерматол. 2000 сен-октябрь;18(5):579-87. [PubMed: 11134853]
Meleti M, Vescovi P, Mooi WJ, van der Waal I. Пигментные поражения слизистой оболочки полости рта и периоральных тканей: схема диагностики и некоторые рекомендации по лечению. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2008 май; 105(5):606-16. [PubMed: 18206403]
Wang YP, Chen IC, Wu YH, Wu YC, Chen HM, Yu-Fong Chang J. Количество клеток Лангерганса при дисплазии эпителия полости рта и их корреляция с клинико-патологическими параметрами. J Formos Med Assoc. 2017 июнь; 116 (6): 457-463. [В паблике: 282
]

García-Caballero L, Caneiro J, Gándara M, González-Ortega N, Cepeda-Emiliani A, Gude F, Collado M, Beiras A, Gallego R. Клетки Меркеля слизистой оболочки полости рта человека экспрессируют плюрипотентный фактор транскрипции стволовых клеток Sox2. Гистол Гистопатол. 2020 сен;35(9):1007-1012. [PubMed: 32495847]
Кингсмилл В.Дж., Берковиц Б.К., Барретт А.В. Иммуногистохимический анализ плотности клеток Меркеля человека в эпителии десны у зубчатых и беззубых субъектов. Arch Oral Biol. 2005 г., октябрь; 50 (10): 883-7. [В паблике: 16137497]
Righi A, Betts CM, Marchetti C, Marucci G, Montebugnoli L, Prati C, Eusebi LH, Muzzi L, Ragazzini T, Foschini MP. Клетки Меркеля в слизистой оболочке полости рта. Международный Дж. Сург Патол. 2006 июль; 14 (3): 206-11. [PubMed: 16959700]
Kydd WL, Daly CH. Биологическое и механическое воздействие стресса на слизистую оболочку полости рта. Джей Простет Дент. 1982 март; 47(3):317-29. [PubMed: 7038105]
Джей Простет Дент. 1982 март; 47(3):317-29. [PubMed: 7038105]
Chen J, Ahmad R, Li W, Swain M, Li Q. Биомеханика слизистой оболочки полости рта. Интерфейс JR Soc. 2015 Авг 06;12(109)):20150325. [Бесплатная статья PMC: PMC4535403] [PubMed: 26224566]
Fleisch L, Austin JC. Гистологическое исследование реакции жевательной и выстилающей слизистой оболочки на механическую нагрузку у зеленых мартышек. Джей Простет Дент. 1978 г., февраль; 39(2):211-6. [PubMed: 413909]
Тунгаре С., Паранджпе АГ. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 25 сентября 2021 г. Разрастание десен, вызванное лекарствами. [В паблике: 30860753]
Габалла К.Ю., Рахими И. Может ли присутствие пероральных гранул Фордайса служить маркером гиперлипидемии? Дент Рес Дж. (Исфахан). 2014 сен; 11 (5): 553-8. [Бесплатная статья PMC: PMC4241607] [PubMed: 25426145]

Wertz PW. Липиды и проницаемость и антимикробный барьер кожи. J Липиды. 2018;2018:5954034. [Бесплатная статья PMC: PMC6139190] [PubMed: 30245886]
Bearelly S, Cheung SW. Сенсорная топография структур полости рта. JAMA Otolaryngol Head Neck Surg. 2017 01 января; 143 (1): 73-80. [В паблике: 27684535]
Фельдман А.Т., Вулф Д. Обработка тканей и окрашивание гематоксилином и эозином. Методы Мол Биол. 2014;1180:31-43. [PubMed: 25015141]
Kurn H, Daly DT. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 19 ноября 2021 г. Гистология, эпителиальная клетка. [PubMed: 32644489]
Gonsalves WC, Chi AC, Neville BW. Общие поражения полости рта: Часть I. Поверхностные поражения слизистой оболочки. Ам семейный врач. 2007 15 февраля; 75 (4): 501-7. [В паблике: 17323710]
Границы | Эпителиальные клетки слизистой оболочки полости рта
Введение
Эпителий слизистой оболочки полости рта представляет собой барьер, отделяющий подлежащие ткани от окружающей среды. Он состоит из двух слоев: поверхностного многослойного плоского эпителия и более глубокого слоя собственной пластинки. В кератинизированной слизистой оболочке полости рта эпителий состоит из четырех слоев базального, шиповатого, зернистого и рогового слоев. В неороговевающем эпителии за базальным слоем следуют нитевидный и растянутый слои. В слизистой оболочке полости рта дифференцируются различные фенотипы: выстилающая слизистая оболочка, жевательная слизистая оболочка и специализированная слизистая оболочка (1). Слизистая оболочка локализуется над подвижными структурами, такими как мягкое небо, щеки, губы, слизистая альвеол, вестибулярный свод и дно рта, растяжима и слабо связана с соседними структурами богатой эластином соединительной тканью и имеет неороговевающий плоский эпителий. Жевательная слизистая оболочка представляет собой жесткий и прочный защитный покров десны и твердого неба, плотно связанный плотной соединительной тканью с подлежащей костью. Этот эпителий ороговевает. Специализированная слизистая оболочка расположена на спинке языка, имеет ороговевший эпителий и включает язычные сосочки и вкусовые почки в качестве специализированных структур (2).
Он состоит из двух слоев: поверхностного многослойного плоского эпителия и более глубокого слоя собственной пластинки. В кератинизированной слизистой оболочке полости рта эпителий состоит из четырех слоев базального, шиповатого, зернистого и рогового слоев. В неороговевающем эпителии за базальным слоем следуют нитевидный и растянутый слои. В слизистой оболочке полости рта дифференцируются различные фенотипы: выстилающая слизистая оболочка, жевательная слизистая оболочка и специализированная слизистая оболочка (1). Слизистая оболочка локализуется над подвижными структурами, такими как мягкое небо, щеки, губы, слизистая альвеол, вестибулярный свод и дно рта, растяжима и слабо связана с соседними структурами богатой эластином соединительной тканью и имеет неороговевающий плоский эпителий. Жевательная слизистая оболочка представляет собой жесткий и прочный защитный покров десны и твердого неба, плотно связанный плотной соединительной тканью с подлежащей костью. Этот эпителий ороговевает. Специализированная слизистая оболочка расположена на спинке языка, имеет ороговевший эпителий и включает язычные сосочки и вкусовые почки в качестве специализированных структур (2).
Соединительный эпителий (JE) обеспечивает прямое прикрепление к поверхности зуба. Базальные клетки ЯЭ прикрепляются к соединительной ткани внешней базальной пластинкой, в то время как супрабазальные клетки прикрепляются к поверхности зуба внутренней базальной пластинкой, продуцируемой ЮЭ. JE содержит меньше клеточных соединений, чем эпителий десны полости рта, но могут быть обнаружены хорошо развитые щелевые соединения и некоторые небольшие спаечные соединения (2). ЯЭ имеет широкие межклеточные пространства, обладает высокой проницаемостью для водорастворимых веществ и служит основным путем трансмиграции полиморфноядерных лейкоцитов (3, 4). ЯЭ не проявляет фенотипической стратификации, но самые внешние клетки кажутся удлиненными и выровнены своей длинной осью параллельно поверхности зуба (3).
Эпителиальный барьер полости рта является результатом многочисленных структурных и функциональных белковых взаимодействий, приводящих к способности реагировать на различные экзогенные, возможно, токсические воздействия. Плоский эпителий обладает структурными свойствами, такими как расслоение и ороговение кератиноцитов, а также специфическими межклеточными взаимодействиями для поддержания своей барьерной функции. В настоящее время признано, что эпителиальные клетки не являются пассивными наблюдателями, а метаболически активны и способны реагировать на внешние стимулы путем синтеза ряда цитокинов, молекул адгезии, факторов роста, хемокинов и матриксных металлопротеаз (5). Ткани десны обеспечивают защиту от сил трения при жевании, а также защищают мягкие ткани от химического или микробного воздействия (3).
Плоский эпителий обладает структурными свойствами, такими как расслоение и ороговение кератиноцитов, а также специфическими межклеточными взаимодействиями для поддержания своей барьерной функции. В настоящее время признано, что эпителиальные клетки не являются пассивными наблюдателями, а метаболически активны и способны реагировать на внешние стимулы путем синтеза ряда цитокинов, молекул адгезии, факторов роста, хемокинов и матриксных металлопротеаз (5). Ткани десны обеспечивают защиту от сил трения при жевании, а также защищают мягкие ткани от химического или микробного воздействия (3).
Клеточный фенотип и апоптоз эпителиальных клеток полости рта
Многослойный эпителий слизистой оболочки полости рта вместе с эпителием кожи относится к наиболее защитным и резистентным эпителиям. Он состоит из двух слоев: первого слоя эпителиальных клеток с базальной мембраной и второго слоя подлежащей соединительной ткани, собственной пластинки (4). Десна состоит из эпителиальной и соединительной тканей, образующих жевательную слизистую оболочку, прикрепленную к зубам и альвеолярному отростку. Десневой эпителий состоит из многослойного плоского ороговевшего эпителия, в то время как эпителий ротовой борозды кажется многослойным и неороговевающим (рис. 1).
Десневой эпителий состоит из многослойного плоского ороговевшего эпителия, в то время как эпителий ротовой борозды кажется многослойным и неороговевающим (рис. 1).
Рисунок 1 . Закономерности распределения цитокератина. Паттерны распределения цитокератина (ЦК) в эпителии полости рта. Модифицировано согласно Pöllänen et al. (6).
Некератинизированный ЯЭ не показывает истинной фенотипической стратификации (3). В отличие от орто-кератинизированного эпидермиса кожи, эпителий полости рта в норме экспрессирует все три основных паттерна дифференцировки кератиноцитов. Как анатомическая и функциональная единица, картина кератинизации десны демонстрирует вариации, частично происходящие от адаптационных процессов ткани к особому участку вокруг полностью прорезавшихся зубов. Ороговевающий эпителий, похожий на эпидермис, выявляется в областях, подвергающихся жевательным и другим механическим воздействиям. Слизисто-десневой переход обозначает границу десны от подвижной слизистой оболочки альвеолярного отростка и слизистой дна полости рта. Дно рта и щечная часть должны быть гибкими для речи, глотания или жевания и покрыты слизистой оболочкой, которая не ороговевает. Специализированная слизистая оболочка спинки языка включает ряд сосочков и покрыта эпителием, который может быть как ороговевшим, так и неороговевающим. В физиологических условиях барьер поляризованного эпителия позволяет регулировать парацеллюлярные потоки растворенных веществ и питательных веществ, а также сбор антигенов и наблюдение иммунными клетками слизистой оболочки. Во время воспаления этот защитный механизм может быть нарушен различными раздражителями, исходящими с обеих сторон эпителиального барьера.
Дно рта и щечная часть должны быть гибкими для речи, глотания или жевания и покрыты слизистой оболочкой, которая не ороговевает. Специализированная слизистая оболочка спинки языка включает ряд сосочков и покрыта эпителием, который может быть как ороговевшим, так и неороговевающим. В физиологических условиях барьер поляризованного эпителия позволяет регулировать парацеллюлярные потоки растворенных веществ и питательных веществ, а также сбор антигенов и наблюдение иммунными клетками слизистой оболочки. Во время воспаления этот защитный механизм может быть нарушен различными раздражителями, исходящими с обеих сторон эпителиального барьера.
Цитокератины
Кератины являются одним из основных компонентов эпителиального цитоскелета. Они принадлежат к группе промежуточных филаментов белков цитоскелета. Семейство генов примерно из 30 членов кодирует кератины. Они имеют общую структуру, состоящую примерно из 310-аминокислотного центрального о-спирального стержневого домена, окруженного неспиральными концевыми доменами, которые сильно различаются по последовательности и структуре (7). На основании аминокислотной последовательности и заряда кератиновые белки делятся на две группы: кислые кератины I типа, включая кератины K9.-K20 и основные или нейтральные кератины II типа, включая K1–K8. Два кератиновых белка, один типа I и один типа II, всегда коэкспрессируются и строят гетерополимеры с образованием 10-нм кератиновых промежуточных филаментов (IFs), которые являются частью цитоскелета. В базальном пролиферативном слое кератиновая пара К5/К14 экспрессируется в многослойном эпителии. Кератин 19 обнаруживается в простом эпителии и базальных клетках неороговевающего эпителия (8, 9). Пара кератинов, которая экспрессируется в постмитотических слоях дифференцирующихся супрабазальных клеток, различается в зависимости от локализации. Распределение цитокератина является высокоспецифичным и зависит от типа эпителия, локализации, степени дифференцировки, поэтому экспрессия кератина является чувствительным и специфичным маркером дифференцировки в эпителиальных клетках (10). В тканях десны и эпидермисе, например, для ороговевающего эпителия присутствуют кератины K1 и K10, в то время как в эпителии слизистой оболочки щеки или пищевода K4 и K13 в основном экспрессируются кератины (11).
На основании аминокислотной последовательности и заряда кератиновые белки делятся на две группы: кислые кератины I типа, включая кератины K9.-K20 и основные или нейтральные кератины II типа, включая K1–K8. Два кератиновых белка, один типа I и один типа II, всегда коэкспрессируются и строят гетерополимеры с образованием 10-нм кератиновых промежуточных филаментов (IFs), которые являются частью цитоскелета. В базальном пролиферативном слое кератиновая пара К5/К14 экспрессируется в многослойном эпителии. Кератин 19 обнаруживается в простом эпителии и базальных клетках неороговевающего эпителия (8, 9). Пара кератинов, которая экспрессируется в постмитотических слоях дифференцирующихся супрабазальных клеток, различается в зависимости от локализации. Распределение цитокератина является высокоспецифичным и зависит от типа эпителия, локализации, степени дифференцировки, поэтому экспрессия кератина является чувствительным и специфичным маркером дифференцировки в эпителиальных клетках (10). В тканях десны и эпидермисе, например, для ороговевающего эпителия присутствуют кератины K1 и K10, в то время как в эпителии слизистой оболочки щеки или пищевода K4 и K13 в основном экспрессируются кератины (11). Кроме того, супрабазальные эпителиальные клетки твердого неба и десны экспрессируют K2, обозначенный как K2p, в отличие от эпидермального K2e. Гены K2p и K2e родственны, но разделены (12). Помимо кератинового рисунка, выраженного прикрепленной десной, некоторые специализированные эпителиальные клетки в десне демонстрируют отчетливый кератиновый рисунок. Эпителий борозды и клетки края десны экспрессируют K4 и K13. Напротив, соединительный эпителий, прилегающий к поверхности зуба, синтезирует К8, К13, К16, К18 и К19.(11, 13). На рис. 1 показано региональное распределение цитокератина в десне. Эпителий полости рта может демонстрировать один из двух типов эпителиального созревания: (1) они ороговевают, таким образом, слизистая оболочка созревает за счет образования поверхностного слоя кератина. Это включает ортокератинизацию, которая относится к отсутствию ядер в поверхностном слое чешуек при созревании, и паракератинизацию, которая обозначает сохранение пикнотических ядер в поверхностном слое чешуек во время созревания (14).
Кроме того, супрабазальные эпителиальные клетки твердого неба и десны экспрессируют K2, обозначенный как K2p, в отличие от эпидермального K2e. Гены K2p и K2e родственны, но разделены (12). Помимо кератинового рисунка, выраженного прикрепленной десной, некоторые специализированные эпителиальные клетки в десне демонстрируют отчетливый кератиновый рисунок. Эпителий борозды и клетки края десны экспрессируют K4 и K13. Напротив, соединительный эпителий, прилегающий к поверхности зуба, синтезирует К8, К13, К16, К18 и К19.(11, 13). На рис. 1 показано региональное распределение цитокератина в десне. Эпителий полости рта может демонстрировать один из двух типов эпителиального созревания: (1) они ороговевают, таким образом, слизистая оболочка созревает за счет образования поверхностного слоя кератина. Это включает ортокератинизацию, которая относится к отсутствию ядер в поверхностном слое чешуек при созревании, и паракератинизацию, которая обозначает сохранение пикнотических ядер в поверхностном слое чешуек во время созревания (14). Некератинизация – это вторая возможность, которая означает созревание без кератинового слоя, что означает, что ядра с редкими кератиновыми нитями остаются в цитоплазме самых поверхностных клеток (15). В зависимости от функциональных требований в тканях десны присутствуют различные типы ороговения. Эпителий десны полости рта ороговевает, в то время как эпителий борозд и соединений (JE), а также слизистая оболочка не ороговевают (14).
Некератинизация – это вторая возможность, которая означает созревание без кератинового слоя, что означает, что ядра с редкими кератиновыми нитями остаются в цитоплазме самых поверхностных клеток (15). В зависимости от функциональных требований в тканях десны присутствуют различные типы ороговения. Эпителий десны полости рта ороговевает, в то время как эпителий борозд и соединений (JE), а также слизистая оболочка не ороговевают (14).
Сборка кератиновых нитей начинается параллельной ассоциацией. Одна цепь типа I образует парный димер со своим аналогом типа II, два димера антипараллельно связываются с тетрамером. Два тетрамера соединяются латерально, образуя протофиламент, восемь из которых скручиваются в веревку, образуя кератиновую нить. Таким образом, каждая кератиновая нить имеет в поперечном сечении 32 отдельных α-спиральных спирали. Полипептидные цепи дополнительно стабилизируются за счет сильных латеральных гидрофобных взаимодействий. Пучки кератиновых филаментов связаны с макромолекулярными сетями, ориентированными радиально в цитоплазме (2, 16). Региональная специфичность экспрессии кератина может быть связана с внутренней специализацией региональных стволовых клеток кератиноцитов. Нарушения в кератине могут быть генетическими или приобретенными. Многочисленные мутации кератина были идентифицированы как причина нескольких заболеваний кожи и слизистых оболочек. Аномальное ороговение является частью нескольких заболеваний полости рта. Эта тема рассмотрена Rao et al. (17).
Региональная специфичность экспрессии кератина может быть связана с внутренней специализацией региональных стволовых клеток кератиноцитов. Нарушения в кератине могут быть генетическими или приобретенными. Многочисленные мутации кератина были идентифицированы как причина нескольких заболеваний кожи и слизистых оболочек. Аномальное ороговение является частью нескольких заболеваний полости рта. Эта тема рассмотрена Rao et al. (17).
Десневой эпителиальный барьер
Биопленки по-разному модулируют эпителиальный клеточный иммунный ответ в зависимости от их свойств и состава. Бактериальная биопленка, расположенная на поверхности зуба и в десневой щели, считается основным возбудителем, участвующим в патогенезе гингивита и периодонтита, и включает полимикробную синергию и дисбиоз (18). Дисбактериоз основан на относительном обилии различных видов бактерий по сравнению с их низким присутствием в норме, вызывая модификацию взаимодействия между хозяином и микробами, что может опосредовать деструктивное воспаление и потерю костной массы (19). , 20).
, 20).
Патогены Keystone, такие как Porphyromonas gingivalis ( P. gingivalis ), способны подавлять реакцию хозяина и способствовать нарушению гомеостатического состояния, в то время как другие виды бактерий проявляют свойства патобионтов, которые могут вызывать деструктивное воспаление, включая как врожденное, так и адаптивный иммунный ответ (21, 22). Кроме того, для возникновения гингивита и пародонтита требуется восприимчивый хозяин, управляющий сложными воспалительными взаимодействиями.
Кератиноциты эпителия десны образуют барьер против бактериальной инфекции и инвазии (23). Они связаны между собой рядом специализированных трансмембранных молекулярных комплексов, среди которых межклеточные соединения, включающие плотные соединения, слипчивые соединения и щелевые соединения (рис. 2).
Рисунок 2 . Строение эпителиальных межклеточных контактов. Модель клеточных соединений, модифицированная по Мете и Малику (24). Расположение соединений, включающее плотные соединения, слипчивые соединения, щелевые соединения и интегрин. Окклюдин, клаудины и соединительные молекулы адгезии (JAM) необходимы для плотных соединений, тогда как сосудистый эндотелий (VE)-кадгерин образует слипчивые соединения. Коннексины входят в состав щелевых контактов. Внеклеточные домены окклюдина, клаудина и VE-кадгерина поддерживают межклеточные контакты. Внутриклеточные домены обеспечивают стабильность соединений, связываясь с актиновым цитоскелетом через катенины (β,β-катенин, α,α-катенин; γ,γ-катенин; p120, p120-катенин) или белок zonula occludens-1 (ZO-1). Щелевые контакты отвечают за быстрый обмен информацией с низкомолекулярными вторичными мессенджерами, такими как Ca 9.1763 2+ и IP 3 между соседними ячейками. Рецепторы интегрина связывают эндотелиальные клетки с внеклеточным матриксом (ECM) через белки матрикса, такие как фибронектин (FN) или витронектин (VN). Цитозольные домены интегринов связаны с актиновым цитоскелетом через белки talin и vinculin (Vin), участвующие в интегрин-опосредованной передаче сигналов.
Окклюдин, клаудины и соединительные молекулы адгезии (JAM) необходимы для плотных соединений, тогда как сосудистый эндотелий (VE)-кадгерин образует слипчивые соединения. Коннексины входят в состав щелевых контактов. Внеклеточные домены окклюдина, клаудина и VE-кадгерина поддерживают межклеточные контакты. Внутриклеточные домены обеспечивают стабильность соединений, связываясь с актиновым цитоскелетом через катенины (β,β-катенин, α,α-катенин; γ,γ-катенин; p120, p120-катенин) или белок zonula occludens-1 (ZO-1). Щелевые контакты отвечают за быстрый обмен информацией с низкомолекулярными вторичными мессенджерами, такими как Ca 9.1763 2+ и IP 3 между соседними ячейками. Рецепторы интегрина связывают эндотелиальные клетки с внеклеточным матриксом (ECM) через белки матрикса, такие как фибронектин (FN) или витронектин (VN). Цитозольные домены интегринов связаны с актиновым цитоскелетом через белки talin и vinculin (Vin), участвующие в интегрин-опосредованной передаче сигналов.
Нормальная экспрессия этих молекулярных комплексов в тканях десны необходима для поддержания целостности эпителия. Как только целостность биопленки нарушена вредными воздействиями, ассоциированные бактерии могут проникнуть в более глубокие ткани пародонта, вызывая воспалительную реакцию. Таким образом, эти межклеточные связи являются важной частью врожденного иммунного ответа, направленного на сопротивление микробным и токсическим воздействиям.
Структура и функция плотных контактов (TJ)
Плотные контакты представляют собой сложные белковые структуры, образующие ленточный рисунок среди соседних клеток, окружающих клетки на апикальной стороне латеральной мембраны (25). Одной из основных функций комплекса TJ является формирование барьера для регуляции прохождения через парацеллюлярный путь воды, ионов, растворенных веществ и других малых молекул (26–28). Структура ТК представляет собой цепочку непрерывных частиц, вложенных в мембрану, образуя тяжи ТК. Нить представляет собой фибриллоподобную структуру, построенную путем сборки клаудина и белков MARVEL, связанных с плотными соединениями (TAMP). TAMPS состоят из MAL = миелинового и лимфоцитарного домена, ассоциированного с плотными соединениями, и MARVEL = родственных белков для переноса везикул и домена связи с мембраной. Собранная структура представляет собой функциональную единицу ТБ, образованную соседними плазматическими мембранами (29, 30).
TAMPS состоят из MAL = миелинового и лимфоцитарного домена, ассоциированного с плотными соединениями, и MARVEL = родственных белков для переноса везикул и домена связи с мембраной. Собранная структура представляет собой функциональную единицу ТБ, образованную соседними плазматическими мембранами (29, 30).
Ряд различных сигнальных и транспортных молекул, которые регулируют дифференцировку, пролиферацию и полярность клеток, координируются TJs (31, 32). Топология TJ состоит из трех белковых доменов, спирального трансмембранного домена, цитозольного каркасного домена и цитозольного хвоста, характеризующегося клеточной передачей сигналов. Нити TJ образованы трансмембранными белками, классом, который состоит из множества интегральных мембранных белков, включая группы ткане- и клеточно-специфических клаудинов (29)., 33) семейство TAMP и соединительные молекулы адгезии (JAM). В состав клаудина входят четыре трансмембранных домена, два внеклеточных домена, образующих две петли, у которых N-конец и С-конец расположены внутриклеточно. Claudins обладают барьерными свойствами (30, 34, 35) и способны регулировать функцию ворот как парацеллюлярные каналы плотных соединений (PTJC). Их биологические и физические свойства сопоставимы с традиционными ионными каналами (36). Они также включают окклюдин в соединения (29). В соседних клетках печени мыши было показано, что различные члены семейства клаудинов образуют гомофильные или гетерофильные полимеры. Кроме того, claudins могут образовывать парные нити на мембране соседних клеток (37). Различия в барьерных свойствах между типами клеток, вероятно, вызваны различными комбинациями клаудинов (38).
Claudins обладают барьерными свойствами (30, 34, 35) и способны регулировать функцию ворот как парацеллюлярные каналы плотных соединений (PTJC). Их биологические и физические свойства сопоставимы с традиционными ионными каналами (36). Они также включают окклюдин в соединения (29). В соседних клетках печени мыши было показано, что различные члены семейства клаудинов образуют гомофильные или гетерофильные полимеры. Кроме того, claudins могут образовывать парные нити на мембране соседних клеток (37). Различия в барьерных свойствах между типами клеток, вероятно, вызваны различными комбинациями клаудинов (38).
Семейство TAMP включает белок MARVEL D1, также называемый окклюдином, MARVEL D2 (трицеллулин) и белок MARVEL D3. Эти молекулы обладают четырьмя трансмембранными доменами и двумя внеклеточными петлями, подобно клаудину (39)., 40). Неясно, выполняют ли нити, состоящие из окклюдина, те же функции, что и нити, образованные клаудинами, но исследования in vitro и in vivo показали, что окклюдин играет важную роль в барьерной функции TJ и межклеточных адгезивных взаимодействиях (39, 41-43). Claudin 1 и occludin были обнаружены в десне, но не в бороздчатом и соединительном эпителии. Более того, было обнаружено, что белки слипчивых соединений P-cadherin и α-catenin обнаруживаются во всех трех эпителиях, тогда как E-cadherin не присутствует в соединительном эпителии (44). Экспрессия клаудина-4 была обнаружена в эпителиальной клеточной линии плоскоклеточного рака ротовой полости человека h513 (45) и в иммортализованных кератиноцитах десны человека (46). Генетические исследования белков адгезии в культурах стратифицированных многослойных эпителиальных клеток десны показали сильную экспрессию клаудина-4, клаудина-1, JAM-1, клаудина-25, клаудина-17, окклюдина и клаудина-12 (47). Окклюдин способен связываться с различными сигнальными молекулами, такими как нерецепторная тирозинкиназа c-Yes, атипичная протеинкиназа C (aPKC) и фосфоинозитид-3-киназа (PI3K), а также с протеинфосфатазами 2A и 1, и, по-видимому, обладает сигнальным функции передатчика (48, 49).
Claudin 1 и occludin были обнаружены в десне, но не в бороздчатом и соединительном эпителии. Более того, было обнаружено, что белки слипчивых соединений P-cadherin и α-catenin обнаруживаются во всех трех эпителиях, тогда как E-cadherin не присутствует в соединительном эпителии (44). Экспрессия клаудина-4 была обнаружена в эпителиальной клеточной линии плоскоклеточного рака ротовой полости человека h513 (45) и в иммортализованных кератиноцитах десны человека (46). Генетические исследования белков адгезии в культурах стратифицированных многослойных эпителиальных клеток десны показали сильную экспрессию клаудина-4, клаудина-1, JAM-1, клаудина-25, клаудина-17, окклюдина и клаудина-12 (47). Окклюдин способен связываться с различными сигнальными молекулами, такими как нерецепторная тирозинкиназа c-Yes, атипичная протеинкиназа C (aPKC) и фосфоинозитид-3-киназа (PI3K), а также с протеинфосфатазами 2A и 1, и, по-видимому, обладает сигнальным функции передатчика (48, 49).
MARVEL D2 (также называемый трицеллюлином) обнаруживается в местах контакта трехклеточных клеток. Он собран в пряди, образующие трубчатую структуру, расположенную вертикально по отношению к двухклеточному ремню TJ (50). Вероятно, он контролирует поток макромолекул, но также необходим для организации ЩЖ. В линии эпителиальных клеток млекопитающих мышей нокаут трицеллюлина Eph5 приводит к нарушению структуры биклеточных и трехклеточных контактов (51). Третий TAMP, MARVEL D3, экспрессируется во многих эпителиальных клетках, и было обнаружено, что его функция не является существенной для образования TJ (52).
Он собран в пряди, образующие трубчатую структуру, расположенную вертикально по отношению к двухклеточному ремню TJ (50). Вероятно, он контролирует поток макромолекул, но также необходим для организации ЩЖ. В линии эпителиальных клеток млекопитающих мышей нокаут трицеллюлина Eph5 приводит к нарушению структуры биклеточных и трехклеточных контактов (51). Третий TAMP, MARVEL D3, экспрессируется во многих эпителиальных клетках, и было обнаружено, что его функция не является существенной для образования TJ (52).
Члены семейства соединительных молекул адгезии (JAM), JAM-A, JAM-B, JAM-4, JAM-L, а также рецептор Коксаки и аденовируса (CAR) принадлежат к надсемейству иммуноглобулинов. JAM, по-видимому, менее важны для регуляции соединительной структуры, но скорее способствуют адгезии и передаче сигналов. Исследования в основном были сосредоточены на соединительной роли JAM-A, которая, как было показано, локализована в фибриллах плотного соединения на основе клаудина в эпителиальных клетках (53). Белок JAM-A содержит две внеклеточные иммуноглобулиноподобные петли, один трансмембранный и цитоплазматический домены, оканчивающиеся PDZ-связывающим мотивом, который, как сообщалось, взаимодействует с AF-6/афадином и белком zonula occludens (ZO)-1 (54) и ЗО-2 (55). CAR, по-видимому, представляет собой молекулу клеточной адгезии, которая способствует образованию межклеточных контактов. В культивируемых эпителиальных клетках молекулы CAR на соседних клетках образуют гомотипические взаимодействия (56). CAR локально концентрируется в TJ на самых апикальных участках латеральных поверхностей поляризованных эпителиальных клеток, и его сверхэкспрессия в культивируемых поляризованных клетках увеличивает TER (57), в то время как растворимые CAR и анти-CAR антитела разрушают TJ (56), что свидетельствует о что CAR участвует в барьерной функции TJ.
Белок JAM-A содержит две внеклеточные иммуноглобулиноподобные петли, один трансмембранный и цитоплазматический домены, оканчивающиеся PDZ-связывающим мотивом, который, как сообщалось, взаимодействует с AF-6/афадином и белком zonula occludens (ZO)-1 (54) и ЗО-2 (55). CAR, по-видимому, представляет собой молекулу клеточной адгезии, которая способствует образованию межклеточных контактов. В культивируемых эпителиальных клетках молекулы CAR на соседних клетках образуют гомотипические взаимодействия (56). CAR локально концентрируется в TJ на самых апикальных участках латеральных поверхностей поляризованных эпителиальных клеток, и его сверхэкспрессия в культивируемых поляризованных клетках увеличивает TER (57), в то время как растворимые CAR и анти-CAR антитела разрушают TJ (56), что свидетельствует о что CAR участвует в барьерной функции TJ.
Все члены цитозольных каркасных белков имеют один или несколько белков постсинаптической плотности (PSD95), домены супрессора больших опухолей диска дрозофилы (Dlg1) и домены белка zonula occludens-1 (PDZ). Они способны связываться с различными интегральными мембранными белками, такими как клаудины, окклюдины или JAM, а также могут связываться с актиновыми филаментами. Таким образом они соединяют TJ с актиновыми филаментами и стабилизируют белковые комплексы. Известно растущее число белков, содержащих PDZ, включая белки, подобные мембраносвязанной гуанилаткиназе (MAGUK), белок, связанный с Lin7 (Pals1), AF-6/афадин, атипичную протеинкиназу C (aPKC), изотип-специфический взаимодействующий белок (ASIP). ), дефектный по разделению белок 3 (PAR-3), мульти-PDZ белок 1 (MUPP1) и белок, связанный с плотными соединениями (PATJ) (58). Эти каркасные белки, по-видимому, важны для организации и локализации TJ, поскольку блокада доменов PDZ приводит к плохо организованным TJ, которые, как следствие, распространяются в другие области (59).). Белки Zonula occludens (ZO) принадлежат к семейству MAGUK и включают три члена ZO-1 (60), ZO-2 (61) и ZO-3 (62). Через свои три домена PDZ белки ZO взаимодействуют с несколькими белками, такими как клаудины, MARVEL D1 или JAM и F-актин.
Они способны связываться с различными интегральными мембранными белками, такими как клаудины, окклюдины или JAM, а также могут связываться с актиновыми филаментами. Таким образом они соединяют TJ с актиновыми филаментами и стабилизируют белковые комплексы. Известно растущее число белков, содержащих PDZ, включая белки, подобные мембраносвязанной гуанилаткиназе (MAGUK), белок, связанный с Lin7 (Pals1), AF-6/афадин, атипичную протеинкиназу C (aPKC), изотип-специфический взаимодействующий белок (ASIP). ), дефектный по разделению белок 3 (PAR-3), мульти-PDZ белок 1 (MUPP1) и белок, связанный с плотными соединениями (PATJ) (58). Эти каркасные белки, по-видимому, важны для организации и локализации TJ, поскольку блокада доменов PDZ приводит к плохо организованным TJ, которые, как следствие, распространяются в другие области (59).). Белки Zonula occludens (ZO) принадлежат к семейству MAGUK и включают три члена ZO-1 (60), ZO-2 (61) и ZO-3 (62). Через свои три домена PDZ белки ZO взаимодействуют с несколькими белками, такими как клаудины, MARVEL D1 или JAM и F-актин. Эта ассоциация с несколькими белками делает возможным образование больших комплексов, которые связывают цитоскелет с тяжами TJ (58).
Эта ассоциация с несколькими белками делает возможным образование больших комплексов, которые связывают цитоскелет с тяжами TJ (58).
Барьерная функция и структура TJs регулируются внутриклеточными сигнальными белками, которые включают протеинкиназу A, протеинкиназу C, Rho-киназу, киназу легкой цепи миозина, GTPase Rab13, тирозинкиназу и митоген-активируемую протеинкиназу. Все эти белки не являются специфическими для TJ, но необходимы для их образования и функционирования. Передача сигнала TJs рассмотрена в Takano et al. (63). Имеются дополнительные обзоры, посвященные физиологии и функции TJ (64), регуляции (65) и специфическим компонентам, таким как трехклеточные плотные соединения (66). В ткани десны ТК наблюдались только в зернистом и ороговевом слое, если они не образовывали сложных тяжей, в отличие от культивируемых кератиноцитов десны in vitro , который показал сильно расширенный каркас нитей TJ (67).
Измерение трансэпителиального электрического сопротивления (TER) представляет собой метод исследования проницаемости слизистых барьеров in vitro , и изменения значений TER напрямую связаны с целостностью и функцией парацеллюлярного окклюзионного барьера (68, 69). Измерения TER являются полезным инструментом для оценки целостности плотных соединений. Сила трансмукозального сопротивления тесно связана с количеством соединительных тяжей и плотностью соединения (70). Эта корреляция была продемонстрирована в первичных кератиноцитах десны человека (рис. 3) (67). Развитие ТЭР зависит от внутриклеточного содержания Са 2+ концентрации (72).
Измерения TER являются полезным инструментом для оценки целостности плотных соединений. Сила трансмукозального сопротивления тесно связана с количеством соединительных тяжей и плотностью соединения (70). Эта корреляция была продемонстрирована в первичных кератиноцитах десны человека (рис. 3) (67). Развитие ТЭР зависит от внутриклеточного содержания Са 2+ концентрации (72).
Рисунок 3 . Белки плотных контактов первичных кератиноцитов после инфицирования P. gingivalis . Иммуноокрашивание белков плотного соединения в первичных кератиноцитах десны человека, клаудин 1 (a, d) , клаудин 2 (b, e) и окклюдин (c, f) ; (а–в) клеток в культуральной среде; (d–f) клеток, инфицированных апикально плюс базолатерально Pophyromonas gingivalis ( P. gingivalis ) W83 (MOI 10 4 ) на 4 часа. Стрелки (e,f) показывают изогнутые штаммы окклюдина в стенках неинфицированных клеток, в инфицированных клетках стрелки указывают на скопления окклюдина, масштабная линейка = 20 мкм (71).
Иммортализованные кератиноциты десны человека (IHGK) (73, 74), использованные в трехмерной культуральной модели, были инфицированы штаммами P. gingivalis , продуцирующими гингипаин, и мутантным дефектом RGP/KGP (75). Это вызывало значительное снижение TER через 24 часа у штаммов, продуцирующих гингипаин, но не у дефектного мутанта. Исследования белков плотных контактов в тех же экспериментальных условиях с использованием иммунного окрашивания выявили вызванные инфекцией изменения экспрессии клаудина-1, клаудина-2 и окклюдина. После инфицирования типичная проволочная структура клаудина-1 и клаудина-2 (рис. 3а, б) исчезла, и белки образовали конгломераты (рис. 3г, д). Изогнутые нити окклюдина, присутствующие в контрольных анализах (рис. 3с), также подверглись деградации (рис. 3f). Растворимые факторы вирулентности, такие как гингипаины, разрушают эпителиальный барьер in vitro , что коррелирует с распадом соединительных межклеточных комплексов. Инвазия и повреждение эпителиального слоя инфекционными агентами является важным этапом и может привести к бактериальной инвазии и разрушению подлежащей соединительной ткани.
Результаты этого исследования дают некоторое представление о начальных стадиях бактериальных инфекций полости рта, ведущих к гингивиту и пародонтиту.
Еще одним механизмом помимо повреждения может быть активная интернализация комплексов эпителиальной адгезии. В эпителиальных клетках кишечника (клетки T84) IFN-γ индуцирует процесс интернализации белка TJ (клаудин-1, окклюдин, JAM-A) путем микропиноцитоза, что приводит к утечке эпителиального слоя (76). Гуо и др. (77) определил влияние P. gingivalis, P. gingivalis ЛПС и eATP на белках TJ в модели культуры эпителиальных клеток ротовой полости. Количественная полимеразная цепная реакция в реальном времени (RT-PCR), иммуноокрашивание и иммуноблоты экспрессии генов и белков в TJ показали, что инфекция P. gingivalis приводила к временной активизации генов, кодирующих окклюдин, клаудин-1 и клаудин-4, но не JAM-A, клаудин-15 или ZO-1, в то время как P. gingivalis LPS увеличивали клаудин-1, клаудин-15 и ZO-1 и снижали окклюдин, JAM-A и клаудин-4. Значительная активация белков плотных контактов была продемонстрирована, когда клетки были предварительно обработаны eATP. Эти результаты показывают, что P. gingivalis индуцировал ранние защитные механизмы хозяина. P. gingivalis LPS стимулирует разрушение эпителиального барьера сильнее, чем P. gingivalis . Стимуляция АТФ дополнительно увеличивала влияние на белки TJ после инфекции P. gingivalis и индуцированного LPS нарушения целостности эпителия (77).
Значительная активация белков плотных контактов была продемонстрирована, когда клетки были предварительно обработаны eATP. Эти результаты показывают, что P. gingivalis индуцировал ранние защитные механизмы хозяина. P. gingivalis LPS стимулирует разрушение эпителиального барьера сильнее, чем P. gingivalis . Стимуляция АТФ дополнительно увеличивала влияние на белки TJ после инфекции P. gingivalis и индуцированного LPS нарушения целостности эпителия (77).
Структура и функция спаек (AJ)
Спаечные контакты (AJ) или спайки zonula, промежуточные соединения, или «поясные десмосомы», являются определяющей чертой всех эпителиев, образуя апикальные локализованные структуры спаек, близко расположенные к эпителию. мембран соседних эпителиальных клеток, играющих существенную роль в регуляции соединительного комплекса. AJ представляют собой белковые комплексы, которые появляются на межклеточных соединениях в эпителиальных и эндотелиальных тканях. Их локализация более базальная, чем плотные контакты. AJs похожи на полосы, которые окружают клетку (адгезивные зоны) или появляются как точки прикрепления к внеклеточному матриксу (адгезионные бляшки). Сайты межклеточной адгезии состоят из кадгеринов, которые связаны с актиновым цитоскелетом катенинами и другими компонентами, такими как актинин и винкулин (78). AJ образуются путем гомофильного связывания внеклеточных доменов кадгерина кальций-зависимым образом. Сближение клеток с клетками поддерживается и усиливается за счет гомофильных взаимодействий однопроходных трансмембранных молекул E-Cadherin (E-Cad). Этот процесс стабилизируется за счет накопления плотной сети актиновых филаментов и связывания молекул, фиксирующих кластеры E-Cad на внутреннем цитоскелете (79).). Цитоплазматический домен E-Cad состоит из β-катенина (β-Cat), взаимодействующего с p120-катенином (p120-Ctn). β-Cat связывается с α-катенином (α-Cad), сохраняя связь с актиновым цитоскелетом. Кадгерин непосредственно связывается с β-катенином или плакоглобином, после чего следует связывание с α-катенином, который впоследствии связывается с винкулином, α-актинином, ZO-1 и актином (80).
Их локализация более базальная, чем плотные контакты. AJs похожи на полосы, которые окружают клетку (адгезивные зоны) или появляются как точки прикрепления к внеклеточному матриксу (адгезионные бляшки). Сайты межклеточной адгезии состоят из кадгеринов, которые связаны с актиновым цитоскелетом катенинами и другими компонентами, такими как актинин и винкулин (78). AJ образуются путем гомофильного связывания внеклеточных доменов кадгерина кальций-зависимым образом. Сближение клеток с клетками поддерживается и усиливается за счет гомофильных взаимодействий однопроходных трансмембранных молекул E-Cadherin (E-Cad). Этот процесс стабилизируется за счет накопления плотной сети актиновых филаментов и связывания молекул, фиксирующих кластеры E-Cad на внутреннем цитоскелете (79).). Цитоплазматический домен E-Cad состоит из β-катенина (β-Cat), взаимодействующего с p120-катенином (p120-Ctn). β-Cat связывается с α-катенином (α-Cad), сохраняя связь с актиновым цитоскелетом. Кадгерин непосредственно связывается с β-катенином или плакоглобином, после чего следует связывание с α-катенином, который впоследствии связывается с винкулином, α-актинином, ZO-1 и актином (80). Также α-Cat способен взаимодействовать с другими актин-связывающими белками, такими как формин, AF6/afadin или EPLIN (81). Нектин и связанный с ним белок AF6/afadin L-afadin сконцентрирован в AJs (82). Трансмембранный белок vezatin локализуется в местах основанной на кадгерине межклеточной адгезии в культивируемых клетках и прикрепляет миозин VIIa к комплексу кадгерин-катенин (83). Благодаря своей динамической структуре слипчивые соединения физически соединяют соседние эпителиальные клетки, соединяют межклеточные адгезивные контакты с цитоскелетом и участвуют в определении апикально-базальной оси каждой клетки. E-Cads, так же как и катенины, являются субстратами фосфатаз и киназ, которые являются ключевыми регуляторами AJ и модифицируют взаимодействия между белками, позволяя им регулировать степень взаимодействия между E-Cad и катениновым комплексом, а также их концентрации в мембране, т.е. необходим для модуляции силы адгезии и ремоделирования AJ [рассмотрено в (84)].
Также α-Cat способен взаимодействовать с другими актин-связывающими белками, такими как формин, AF6/afadin или EPLIN (81). Нектин и связанный с ним белок AF6/afadin L-afadin сконцентрирован в AJs (82). Трансмембранный белок vezatin локализуется в местах основанной на кадгерине межклеточной адгезии в культивируемых клетках и прикрепляет миозин VIIa к комплексу кадгерин-катенин (83). Благодаря своей динамической структуре слипчивые соединения физически соединяют соседние эпителиальные клетки, соединяют межклеточные адгезивные контакты с цитоскелетом и участвуют в определении апикально-базальной оси каждой клетки. E-Cads, так же как и катенины, являются субстратами фосфатаз и киназ, которые являются ключевыми регуляторами AJ и модифицируют взаимодействия между белками, позволяя им регулировать степень взаимодействия между E-Cad и катениновым комплексом, а также их концентрации в мембране, т.е. необходим для модуляции силы адгезии и ремоделирования AJ [рассмотрено в (84)].
В результате протеолитического разрушения предполагаемыми пародонтальными патогенами, такими как P. gingivalis , E-Cads поражаются при пародонтите (85, 86). P. gingivalis способен продуцировать различные протеолитические ферменты, в том числе восемь эндопептидаз и многочисленные экзопептидазы (87). Гингипаины представляют собой внеклеточные цистеиновые протеиназы, которые могут нарушать адгезию эндотелиальных клеток (88, 89). Гингипаины также способны усиливать коллагенолиз, индуцируя матриксные металлопротеиназы хозяина. Шитс и др. (90) также продемонстрировали расщепление клеточных рецепторов. Расщепление белков соединения адгезии (показано в клетках HOK-16) влияет на N-кадгерин, VE-кадгерин, β-интегрин и снижает адгезию клеток к белкам внеклеточного матрикса (91). Это может привести к отслоению эндотелиальных клеток.
gingivalis , E-Cads поражаются при пародонтите (85, 86). P. gingivalis способен продуцировать различные протеолитические ферменты, в том числе восемь эндопептидаз и многочисленные экзопептидазы (87). Гингипаины представляют собой внеклеточные цистеиновые протеиназы, которые могут нарушать адгезию эндотелиальных клеток (88, 89). Гингипаины также способны усиливать коллагенолиз, индуцируя матриксные металлопротеиназы хозяина. Шитс и др. (90) также продемонстрировали расщепление клеточных рецепторов. Расщепление белков соединения адгезии (показано в клетках HOK-16) влияет на N-кадгерин, VE-кадгерин, β-интегрин и снижает адгезию клеток к белкам внеклеточного матрикса (91). Это может привести к отслоению эндотелиальных клеток.
Бактериальная адгезия и инвазия в эпителиальные клетки являются патологическими процессами, которые также способны нарушать эпителиальный барьер при пародонтите
Было показано, что 9Фимбрии 0005 P. gingivalis связываются с клеточным α5β1-интегрином, который обеспечивает прикрепление бактерий к клеткам-хозяевам (92–94). Клеточные интегрины представляют собой гетеродимерные рецепторы белков внеклеточного матрикса и по существу участвуют в клеточных физиологических процессах, связанных с метаболизмом, активацией, дифференцировкой, подвижностью и пролиферацией (95). Эти функции зависят от связывания α5β1-интегрина с его лигандом фибронектином (96).
Клеточные интегрины представляют собой гетеродимерные рецепторы белков внеклеточного матрикса и по существу участвуют в клеточных физиологических процессах, связанных с метаболизмом, активацией, дифференцировкой, подвижностью и пролиферацией (95). Эти функции зависят от связывания α5β1-интегрина с его лигандом фибронектином (96).
P. gingivalis может разрушать клеточные сигнальные молекулы и инактивировать различные клеточные функции, которые важны для заживления и регенерации, а также гомеостатических свойств тканей пародонта (91, 97–99).
Инвазия эпителиальных клеток разрушает эпителиальный барьер, и внутриклеточные патогены влияют на клеточные функции за счет использования динамина, актиновых волокон, микротрубочек, PI3K и липидных рафтов клеток-хозяев.
Внутриклеточная локализация позволяет патогенам проникать глубоко в ткани, распространяясь от клетки к клетке, процесс, который, по-видимому, опосредован выпячиванием мембран, основанным на полимеризации актина. Это позволяет избежать выброса бактерий во внеклеточное пространство, т. е. пародонтальных патогенов, таких как P. gingivalis распространяется между клетками, не попадая во внеклеточное пространство, что может способствовать колонизации тканей полости рта, избегая проявления гуморального иммунного ответа (86).
Это позволяет избежать выброса бактерий во внеклеточное пространство, т. е. пародонтальных патогенов, таких как P. gingivalis распространяется между клетками, не попадая во внеклеточное пространство, что может способствовать колонизации тканей полости рта, избегая проявления гуморального иммунного ответа (86).
Важность соединительных белков в иммунном ответе на бактериальные биопленки была продемонстрирована Belibasakis et al. (47). Группа исследовала влияние модели поддесневой биопленки из 10 видов на экспрессию генов всех известных клеточных контактов (плотные соединения, десмосомы, щелевые соединения и слипчивые соединения) и оценила участие 3 видов «красного комплекса» [9].0005 P. gingivalis, Treponema denticola ( T. denticola ) и Tannerella forsythia ( T. forsythia )] в многослойной культуре эпителиальных клеток десны. Результаты этого исследования показали различное влияние на соединительную экспрессию двух моделей биопленок (BF) (одна с «красным комплексом» и одна без него). Установлено, что БФ, включающий «красный комплекс», не влиял на экспрессию ни одного из исследованных генов плотных контактов. Отсутствие «красного комплекса» (РК) в биопленке приводило к значительно более высокой экспрессии клаудина-4 по сравнению с контролем через 3 и 24 часа. Оценка экспрессии генов десмосом, слипчивых контактов и белков щелевых контактов в ответ на биопленки без «красного комплекса» приводила к увеличению экспрессии десмоколлина-2 через 3 ч, в то время как «красный комплекс», включающий биопленку, не вызывал этого эффекта. Через 24 часа эта экспрессия была значительно снижена обоими вариантами биопленки. Через 3 часа воздействия биопленки экспрессия гена ни одного из исследованных соединительных адапторных белков не регулировалась, в то время как через 24 часа экспрессия десмоплакина и плакоглобина снижалась в ответ на обе биопленки (47).
Установлено, что БФ, включающий «красный комплекс», не влиял на экспрессию ни одного из исследованных генов плотных контактов. Отсутствие «красного комплекса» (РК) в биопленке приводило к значительно более высокой экспрессии клаудина-4 по сравнению с контролем через 3 и 24 часа. Оценка экспрессии генов десмосом, слипчивых контактов и белков щелевых контактов в ответ на биопленки без «красного комплекса» приводила к увеличению экспрессии десмоколлина-2 через 3 ч, в то время как «красный комплекс», включающий биопленку, не вызывал этого эффекта. Через 24 часа эта экспрессия была значительно снижена обоими вариантами биопленки. Через 3 часа воздействия биопленки экспрессия гена ни одного из исследованных соединительных адапторных белков не регулировалась, в то время как через 24 часа экспрессия десмоплакина и плакоглобина снижалась в ответ на обе биопленки (47).
Клеточные рецепторы
Толл-подобные рецепторы (TLR)
Толл-подобные рецепторы (TLR) (рис. 4, 5) принадлежат к наиболее охарактеризованному семейству клеточных эффекторов для обнаружения патогенов (101). TLR широко экспрессируются в эукариотических клетках. Это трансмембранные белки, которые распознают молекулярные структуры, классифицируемые как «ассоциированные с патогенами молекулярные паттерны» (PAMP), и, таким образом, относятся к рецепторам распознавания паттернов (PRR). Эти закономерности присутствуют почти у всех типов микроорганизмов (102). Толл-подобные рецепторы содержат подковообразный внеклеточный богатый лейцином повтор (LRR) и внутрицитоплазматический домен toll/IL-1R (TIR), которые связаны одним трансмембранным доменом. Домен LRR отвечает за распознавание лиганда, а передача внутриклеточного сигнала поддерживается доменом TIR. TLR представляют собой не только наиболее важные, но и одни из первых механизмов иммунной защиты от грибковых, бактериальных и вирусных патогенов. После связывания TLR активируется нижестоящий сигнальный путь, играющий важную роль во врожденных и адаптивных иммунных реакциях. В полости рта постоянно присутствует большое количество микроорганизмов, поэтому экспрессия и функция TLR необходимы для поддержания гомеостаза тканей полости рта.
TLR широко экспрессируются в эукариотических клетках. Это трансмембранные белки, которые распознают молекулярные структуры, классифицируемые как «ассоциированные с патогенами молекулярные паттерны» (PAMP), и, таким образом, относятся к рецепторам распознавания паттернов (PRR). Эти закономерности присутствуют почти у всех типов микроорганизмов (102). Толл-подобные рецепторы содержат подковообразный внеклеточный богатый лейцином повтор (LRR) и внутрицитоплазматический домен toll/IL-1R (TIR), которые связаны одним трансмембранным доменом. Домен LRR отвечает за распознавание лиганда, а передача внутриклеточного сигнала поддерживается доменом TIR. TLR представляют собой не только наиболее важные, но и одни из первых механизмов иммунной защиты от грибковых, бактериальных и вирусных патогенов. После связывания TLR активируется нижестоящий сигнальный путь, играющий важную роль во врожденных и адаптивных иммунных реакциях. В полости рта постоянно присутствует большое количество микроорганизмов, поэтому экспрессия и функция TLR необходимы для поддержания гомеостаза тканей полости рта. У человека в настоящее время идентифицировано 10 TLR, включая как внеклеточные, так и внутриклеточные рецепторы. Все они обнаруживают ряд специфических лигандов, за исключением орфанного рецептора TLR10, для которого специфический лиганд еще не обнаружен (101, 103). TLR1, TLR2, TLR4, TLR5, TLR6 и TLR10 экспрессируются на клеточной поверхности для распознавания внеклеточных микроорганизмов и лигандов. TLR3, TLR7, TLR8 и TLR9внутриклеточно локализуются в цитозольном эндосомальном компартменте, связывая микроорганизмы и лиганды, прошедшие через мембрану клетки-хозяина (104). На рис. 4 показано расположение TLR и идентичность их лигандов/агонистов. TLR11 идентифицирован в геноме человека, но не транслируется в белок, поскольку его открытая рамка считывания содержит стоп-кодон (105). TLR2 образует гетеродимеры с TLR1 или TLR6 и распознает пептидогликан, липопептид и липопротеины, в то время как липополисахарид грамотрицательных бактерий является специфическим лигандом TLR4 (106, 107). TLR3 распознает двухцепочечную РНК (дцРНК), TLR5 может обнаруживать бактериальный флагеллин, было показано, что TLR7 и TLR8 распознают имидазохинилины и одноцепочечную РНК и TLR9.
У человека в настоящее время идентифицировано 10 TLR, включая как внеклеточные, так и внутриклеточные рецепторы. Все они обнаруживают ряд специфических лигандов, за исключением орфанного рецептора TLR10, для которого специфический лиганд еще не обнаружен (101, 103). TLR1, TLR2, TLR4, TLR5, TLR6 и TLR10 экспрессируются на клеточной поверхности для распознавания внеклеточных микроорганизмов и лигандов. TLR3, TLR7, TLR8 и TLR9внутриклеточно локализуются в цитозольном эндосомальном компартменте, связывая микроорганизмы и лиганды, прошедшие через мембрану клетки-хозяина (104). На рис. 4 показано расположение TLR и идентичность их лигандов/агонистов. TLR11 идентифицирован в геноме человека, но не транслируется в белок, поскольку его открытая рамка считывания содержит стоп-кодон (105). TLR2 образует гетеродимеры с TLR1 или TLR6 и распознает пептидогликан, липопептид и липопротеины, в то время как липополисахарид грамотрицательных бактерий является специфическим лигандом TLR4 (106, 107). TLR3 распознает двухцепочечную РНК (дцРНК), TLR5 может обнаруживать бактериальный флагеллин, было показано, что TLR7 и TLR8 распознают имидазохинилины и одноцепочечную РНК и TLR9. обнаруживает бактериальную и вирусную ДНК по их цитозиновым и гуаниновым парам оснований (108–113). Связывание LRR лигандами индуцирует конформационные изменения TIR, приводящие к взаимодействиям между доменами TIR соседних TLR и связыванию дополнительных адапторных белков, необходимых для инициации внутриклеточного сигнального каскада. Наиболее важными адапторными молекулами являются миелоидный фактор дифференцировки 88 (MyD88), адаптор-подобный MyD88 (Mal) (адапторный белок, содержащий домен TIR, TIRAP), адапторный белок, содержащий домен TIR, индуцирующий интерферон-β (TRIF) (TIR). -содержащая адаптерная молекула, синоним TICAM) и связанная с TRIF молекула адаптера (TRAM) (114–119). Передача сигналов TLR может негативно регулироваться различными ингибирующими молекулами, в том числе белком, взаимодействующим с toll (Tollip), протеинкиназой, ассоциированной с рецептором интерлейкина-1 (IL-1R) (IRAK)-M, стерильными a- и HEAT-Armadillo- белок, содержащий мотив (SARM), и адаптер В-клеток или PI3K (BCAP), которые ингибируют нижележащие фазы в TLR-зависимых сигнальных каскадах.
обнаруживает бактериальную и вирусную ДНК по их цитозиновым и гуаниновым парам оснований (108–113). Связывание LRR лигандами индуцирует конформационные изменения TIR, приводящие к взаимодействиям между доменами TIR соседних TLR и связыванию дополнительных адапторных белков, необходимых для инициации внутриклеточного сигнального каскада. Наиболее важными адапторными молекулами являются миелоидный фактор дифференцировки 88 (MyD88), адаптор-подобный MyD88 (Mal) (адапторный белок, содержащий домен TIR, TIRAP), адапторный белок, содержащий домен TIR, индуцирующий интерферон-β (TRIF) (TIR). -содержащая адаптерная молекула, синоним TICAM) и связанная с TRIF молекула адаптера (TRAM) (114–119). Передача сигналов TLR может негативно регулироваться различными ингибирующими молекулами, в том числе белком, взаимодействующим с toll (Tollip), протеинкиназой, ассоциированной с рецептором интерлейкина-1 (IL-1R) (IRAK)-M, стерильными a- и HEAT-Armadillo- белок, содержащий мотив (SARM), и адаптер В-клеток или PI3K (BCAP), которые ингибируют нижележащие фазы в TLR-зависимых сигнальных каскадах. Ассоциированные с IL-1R протеинкиназы (IRAK) IRAK4, IRAK1 и IRAK2 активируются MyD88 с последующей активацией фактора 6, ассоциированного с рецептором фактора некроза опухоли (TRAF6), и RIP, что происходит путем активации трансформирующего фактора роста (TGF)-β. комплекс активированной киназы 1 (TAK1) и TAK1-связывающего белка (TAB1, TAB2 и TAB3) (120–123). Впоследствии регуляторные факторы экспрессии генов семейства митогенактивируемых протеинкиназ (MAPK) (ERK, JNK, p38) и NF-kB активируются, регулируя выживаемость и пролиферацию клеток, и индуцируют активацию иммунных клеток, продукцию про-/противовоспалительных медиаторы (цитокины и хемокины), интерфероны и антимикробные препараты. Активация внутриклеточно расположенных TLR7, TLR8 и TLR9также передается через MyD88, но также может инициировать TRAF6, IRAK4 и TRAF3-зависимую активацию IRF7, которая перемещается в ядро и индуцирует продукцию интерферона типа I (114, 124).
Ассоциированные с IL-1R протеинкиназы (IRAK) IRAK4, IRAK1 и IRAK2 активируются MyD88 с последующей активацией фактора 6, ассоциированного с рецептором фактора некроза опухоли (TRAF6), и RIP, что происходит путем активации трансформирующего фактора роста (TGF)-β. комплекс активированной киназы 1 (TAK1) и TAK1-связывающего белка (TAB1, TAB2 и TAB3) (120–123). Впоследствии регуляторные факторы экспрессии генов семейства митогенактивируемых протеинкиназ (MAPK) (ERK, JNK, p38) и NF-kB активируются, регулируя выживаемость и пролиферацию клеток, и индуцируют активацию иммунных клеток, продукцию про-/противовоспалительных медиаторы (цитокины и хемокины), интерфероны и антимикробные препараты. Активация внутриклеточно расположенных TLR7, TLR8 и TLR9также передается через MyD88, но также может инициировать TRAF6, IRAK4 и TRAF3-зависимую активацию IRF7, которая перемещается в ядро и индуцирует продукцию интерферона типа I (114, 124).
Рисунок 4 . Клеточное расположение толл-подобных рецепторов (TLR) и идентификация их лигандов/агонистов. Стимуляция поверхностных TLR (TLR-2, TLR-4 и TLR-5) соответствующими лигандами приводит к активации ядерного фактора (NF)-κB. Последующее увеличение уровней провоспалительных цитокинов и приток воспалительных клеток создает среду, защищающую как от вирусов, так и от бактерий. Активация внутриклеточных TLR (TLR-3, TLR-7, TLR-8 и TLR-9).) приводит к активации фактора, регулирующего интерферон (IRF), и выработке интерферонов 1-го типа (IFN) и провоспалительных цитокинов, снова создавая среду, неблагоприятную для патогенов (100).
Стимуляция поверхностных TLR (TLR-2, TLR-4 и TLR-5) соответствующими лигандами приводит к активации ядерного фактора (NF)-κB. Последующее увеличение уровней провоспалительных цитокинов и приток воспалительных клеток создает среду, защищающую как от вирусов, так и от бактерий. Активация внутриклеточных TLR (TLR-3, TLR-7, TLR-8 и TLR-9).) приводит к активации фактора, регулирующего интерферон (IRF), и выработке интерферонов 1-го типа (IFN) и провоспалительных цитокинов, снова создавая среду, неблагоприятную для патогенов (100).
Рисунок 5 . Сигнальные пути толл-подобного рецептора (TLR). TLR-4, TLR-5 и гетеродимеры TLR-1/TLR-2 и TLR-2/TLR-6 расположены на клеточной поверхности, где они активируются соответствующим лигандом. И наоборот, TLR-3, TLR-7, TLR-8 и TLR-9 расположены в эндосомальных компартментах клетки и распознают микробные и вирусные нуклеиновые кислоты. Стимуляция TLR-1/TLR-2, TLR-2/TLR-6, TLR-4 и TLR-5 приводит к взаимодействию белка первичного ответа миелоидной дифференцировки (MyD88) и белка, подобного адаптеру MYD88 (MAL), с адаптерные белки, содержащие домен толл/интерлейкина-1 (TIR). Это стимулирует нижестоящие сигнальные пути, которые включают взаимодействия между IL-1R-ассоциированными киназами (IRAK) и адаптерными молекулами фактора некроза опухоли (TNF), рецептор-ассоциированными факторами (TRAF) и активирует митоген-активируемые протеинкиназы (MAPK) JUN N-концевой киназы (JNK) и p38. Активация этих киназ приводит к активации факторов транскрипции, таких как ядерный фактор-κB (NF-κB), циклический аденозинмонофосфат (AMP)-чувствительный элемент, связывающий белок (CREB) и белок-активатор-1 (AP-1). Основным последствием активации поверхностных TLRs является индукция провоспалительных цитокинов. Активация TLR-7, TLR-8 и TLR-9также приводит к вовлечению MyD88, MAL, IRAKs и киназы-ингибитора NF-kB (IKK)α, однако активируются интерферон-регуляторные факторы (IRF), что приводит к продукции интерферонов типа 1 (IFN). Стимуляция TLR-3 приводит к ассоциации адаптерного белка, содержащего домен TIR, индуцирующего IFNβ (TRIF). Это приводит к передаче сигналов факторов, ассоциированных с рецептором TNF (TRAF), и IKK, что приводит к активации IRF3 и продукции IFN 1 типа (100).
Это стимулирует нижестоящие сигнальные пути, которые включают взаимодействия между IL-1R-ассоциированными киназами (IRAK) и адаптерными молекулами фактора некроза опухоли (TNF), рецептор-ассоциированными факторами (TRAF) и активирует митоген-активируемые протеинкиназы (MAPK) JUN N-концевой киназы (JNK) и p38. Активация этих киназ приводит к активации факторов транскрипции, таких как ядерный фактор-κB (NF-κB), циклический аденозинмонофосфат (AMP)-чувствительный элемент, связывающий белок (CREB) и белок-активатор-1 (AP-1). Основным последствием активации поверхностных TLRs является индукция провоспалительных цитокинов. Активация TLR-7, TLR-8 и TLR-9также приводит к вовлечению MyD88, MAL, IRAKs и киназы-ингибитора NF-kB (IKK)α, однако активируются интерферон-регуляторные факторы (IRF), что приводит к продукции интерферонов типа 1 (IFN). Стимуляция TLR-3 приводит к ассоциации адаптерного белка, содержащего домен TIR, индуцирующего IFNβ (TRIF). Это приводит к передаче сигналов факторов, ассоциированных с рецептором TNF (TRAF), и IKK, что приводит к активации IRF3 и продукции IFN 1 типа (100).
На рис. 5 показаны сигнальные пути TLR. мРНК всех 10 TLR были обнаружены в эпителиальных клетках полости рта, но фактическая экспрессия и клеточная локализация белков TLR различаются и индуцируемы. TLR2 высоко экспрессирован в базальном слое эпителия десны, уровни ниже в поверхностных слоях, которые более подвержены воздействию микроорганизмов и влиянию окружающей среды. Помимо выявления колонизирующих микроорганизмов в поверхностной части эпителия, это можно рассматривать как механизм, облегчающий TLR-зависимую воспалительную реакцию только тогда, когда возбудители распознаются в базальном слое. Для TLR1, TLR3, TLR4, TLR5 и TLR9был продемонстрирован аналогичный паттерн экспрессии (125, 126). Экспрессия TLR7 и TLR8 показывает одинаковую картину в здоровой и воспаленной ткани. Экспрессия TLR2 и TLR4 увеличивается при остром и персистирующем воспалении десен, хотя стимуляция агонистами TLR не индуцирует выработку провоспалительных цитокинов, а вызывает образование β-дефенсина-2 в эпителиальных клетках и, таким образом, способствует локальному нисходящему иммунному ответу (127).
При хронических воспалительных состояниях, таких как пародонтит, в отличие от повышающей регуляции TLR2, экспрессия TLR4 снижается, что может предотвратить обострение воспаления, т. е. разрушение тканей и костей за счет сдерживания воспалительной реакции (128). Было продемонстрировано, что здоровые и воспаленные ткани полости рта человека экспрессируют молекулы TLR2, TLR4, NOD1 и NOD2, причем локализация TLR2 и TLR4 на клеточной поверхности может быть более четко обнаружена в воспаленной, чем в здоровой десне. Кроме того, было продемонстрировано, что линии эпителиальных клеток ротовой полости человека HSC-2, HO-1-u-1 и клетки KB, а также первично культивированные эпителиальные клетки ротовой полости конститутивно экспрессируют TLR2, TLR4, NOD1 и NOD2. Стимуляция этих клеток агонистами TLR и NOD вызывала активацию противомикробного пептида β-дефенсина (129). Эпителиальные клетки ротовой полости, в отличие от эпителиальных клеток толстой кишки, не секретировали цитокины, такие как IL-8, моноцитарный хемоаттрактантный белок-1 (MCP-1), гранулоцитарный колониестимулирующий фактор (G-CSF), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM -CSF) и фактор роста эндотелия сосудов (VEGF) после стимуляции бактериальными компонентами, но повышали экспрессию белков распознавания пептидогликана (PGRPs), еще одного семейства молекул распознавания образов (130, 131). Эти результаты свидетельствуют о том, что часть клеток десенсибилизирована, чтобы предотвратить разрушение тканей из-за чрезмерного врожденного иммунного ответа на бактериальные стимулы, поскольку клетки и бактерии взаимодействуют конститутивно (130, 131).
Эти результаты свидетельствуют о том, что часть клеток десенсибилизирована, чтобы предотвратить разрушение тканей из-за чрезмерного врожденного иммунного ответа на бактериальные стимулы, поскольку клетки и бактерии взаимодействуют конститутивно (130, 131).
При пародонтите аномальный иммунный ответ, известный как «гиперреактивный» фенотип, был продемонстрирован при исследовании лейкоцитов периферической крови, стимулированных агонистами TLR2 и TLR4. Стимуляция привела к повышению уровня провоспалительных цитокинов, продуцируемых лейкоцитами, полученными от пациентов с локализованным агрессивным пародонтитом. Этот измененный иммунный ответ может привести к быстрой потере соединительной ткани и пародонтального прикрепления, а также альвеолярной кости, что может привести к ранней потере зубов уже у молодых людей (132). В перекрестном исследовании изучалась роль эпигенетической регуляции, в частности статуса метилирования ДНК, генов в пути TLR у пациентов с локализованным агрессивным пародонтитом (LAP). Периферическую кровь стимулировали Escherichia coli ( E. coli ) ЛПС анализировали на метилирование ДНК семи сигнальных генов TLR. При определенных позициях CpG у пациентов с ЛАП по сравнению со здоровым контролем наблюдались различия в статусе метилирования, а также между тяжелой и умеренной ЛАП. У людей с умеренной ЛАП наблюдается гиперметилирование как повышающих, так и подавляющих генов, в то время как с тяжелой ЛАП наблюдается гипометилирование этих генов. Статус метилирования коррелировал с повышенным профилем провоспалительных цитокинов у пациентов с ЛАП, что позволяет предположить, что эпигенетические модификации в передаче сигналов TLR могут модулировать прогрессирование заболевания и разрушение тканей (133).
Периферическую кровь стимулировали Escherichia coli ( E. coli ) ЛПС анализировали на метилирование ДНК семи сигнальных генов TLR. При определенных позициях CpG у пациентов с ЛАП по сравнению со здоровым контролем наблюдались различия в статусе метилирования, а также между тяжелой и умеренной ЛАП. У людей с умеренной ЛАП наблюдается гиперметилирование как повышающих, так и подавляющих генов, в то время как с тяжелой ЛАП наблюдается гипометилирование этих генов. Статус метилирования коррелировал с повышенным профилем провоспалительных цитокинов у пациентов с ЛАП, что позволяет предположить, что эпигенетические модификации в передаче сигналов TLR могут модулировать прогрессирование заболевания и разрушение тканей (133).
Мета-анализ, оценивающий связь между полиморфизмами TLR4 и хроническим пародонтитом (ХП), выявил связь между аллелем TLR4C > G (rs7873784) и ХП у азиатов (134). Связь между полиморфизмами TLR4 и раком желудка была исследована в метаанализе Jin et al. (134). Эта группа выявила повышенный риск рака желудка при полиморфизме TLR4 + 896A/G и TLR4 + 1196C/T в европеоидной популяции (135).
(134). Эта группа выявила повышенный риск рака желудка при полиморфизме TLR4 + 896A/G и TLR4 + 1196C/T в европеоидной популяции (135).
Рецепторы домена олигомеризации, связывающие нуклеотиды (NOD)
Рецепторы домена олигомеризации, связывающие нуклеотиды (NOD) (рис. 6), представляют собой цитозольные молекулы распознавания образов, которые связываются с пептидогликаном (PGN), компонентом клеточных стенок бактерий. Они принадлежат к семейству NOD-подобных рецепторов (NLR), включая также NACHT-LRR (богатые лейцином повторы) и белки, содержащие пириновый домен (NALP), факторы ингибиторов апоптоза нейронов (NAIP) и фактор активации протеазы ICE (IPAF). ) (137–139). Лиганд NOD1 представляет собой производную от PGN γ-D-глутамилмезодиаминопимелиновую кислоту (iE-DAP), тогда как мурамилдипептид (MDP) представляет собой лиганд NOD2 (140, 141). MDP обнаруживается в грамотрицательных, а также в грамположительных бактериальных PGN, в то время как iE-DAP присутствует в грамотрицательных бактериальных PGN и в PGN определенных грамположительных бактерий, таких как 9. 0005 Bacillus subtilis и Listeria monocytogenes (142). Следовательно, NOD1 особенно вовлечен в распознавание компонентов клеточных стенок грамотрицательных бактерий, в то время как NOD2 может распознавать и то, и другое (143, 144). Ряд различных типов клеток, включая эпителиальные клетки полости рта, экспрессируют NOD1, который играет важную роль во врожденных иммунных реакциях (127, 129, 145). Связывание NOD1 и последующая передача сигналов вызывают воспалительную реакцию, индуцируя продукцию цитокинов, хемокинов и антимикробных пептидов. Среди этих продуктов некоторые являются провоспалительными, например, интерлейкин (ИЛ)-6, ИЛ-8, фактор некроза опухоли (ФНО)-α и бета-дефенсин человека (hBD)-2, в то время как другие обладают иммунорегуляторными или антимикробными свойствами. , такие как интерферон (IFN)-γ и человеческий β-дефенсин-1 (hBD-1). Влияние iE-DAP на продукцию цитокинов также было исследовано с противоречивыми результатами: хотя сообщалось, что iE-DAP стимулировал различные человеческие эпителиальные клетки продуцируют противомикробные пептиды, но не провоспалительные цитокины, такие как IL-6 и IL-8 (127, 129).
0005 Bacillus subtilis и Listeria monocytogenes (142). Следовательно, NOD1 особенно вовлечен в распознавание компонентов клеточных стенок грамотрицательных бактерий, в то время как NOD2 может распознавать и то, и другое (143, 144). Ряд различных типов клеток, включая эпителиальные клетки полости рта, экспрессируют NOD1, который играет важную роль во врожденных иммунных реакциях (127, 129, 145). Связывание NOD1 и последующая передача сигналов вызывают воспалительную реакцию, индуцируя продукцию цитокинов, хемокинов и антимикробных пептидов. Среди этих продуктов некоторые являются провоспалительными, например, интерлейкин (ИЛ)-6, ИЛ-8, фактор некроза опухоли (ФНО)-α и бета-дефенсин человека (hBD)-2, в то время как другие обладают иммунорегуляторными или антимикробными свойствами. , такие как интерферон (IFN)-γ и человеческий β-дефенсин-1 (hBD-1). Влияние iE-DAP на продукцию цитокинов также было исследовано с противоречивыми результатами: хотя сообщалось, что iE-DAP стимулировал различные человеческие эпителиальные клетки продуцируют противомикробные пептиды, но не провоспалительные цитокины, такие как IL-6 и IL-8 (127, 129). , 131, 145), на эпителиальных клетках кишечника человека и фибробластах пульпы зуба также было показано, что активация NOD1 индуцирует продукцию провоспалительных цитокинов (127, 142, 146–148).
, 131, 145), на эпителиальных клетках кишечника человека и фибробластах пульпы зуба также было показано, что активация NOD1 индуцирует продукцию провоспалительных цитокинов (127, 142, 146–148).
Рисунок 6 . Модель сигнальных каскадов белка (NOD)1 и NOD2, содержащего домен олигомеризации, связывающий нуклеотиды. NOD1 и NOD2 распознают бактериальные пептидогликаны (PGN), (iE-DAP) и мурамилдипептид (MDP) соответственно. После восприятия лиганда NODs рекрутируют свою общую серин/треонин-протеинкиназу (RIP)2, взаимодействующую с адаптерным рецептором, за счет активации каспаз и доменов рекрутирования (CARD)-CARD взаимодействий и индуцируют RIP2 для фосфорилирования. Члены семейства факторов, ассоциированных с рецептором фактора некроза опухоли (TRAF) (TRAF2, TRAF5 и TRAF6), семейства ингибиторов апоптоза (IAP) (XIAP, cIAP1 и cIAP2) и В-клеточной лимфомы (BCL) 2 (BID) связываются с RIP2 и облегчают его убиквитинирование, позволяя рекрутировать трансформирующий фактор роста-β-активируемую киназу (TAK)1 и убиквитинированный ядерный фактор (NF-kB) основной модулятор (NEMO) в нодосому. С одной стороны, NEMO вызывает активацию канонического пути NF-κB путем фосфорилирования киназы ингибитора NF-κB (IKK)α и IKKβ, путем индукции ядерного фактора энхансера гена каппа-легкого полипептида в В-клетках фосфорилирование ингибитора альфа (IκBα) и протеасомного деградации и высвобождения субъединиц p50 и p65 NF-κB. С другой стороны, трансформирующий фактор роста-β-активируемая киназа 1 (TAK1) рекрутирует, трансформирующий фактор роста-β-активируемая киназа, связывающий белок (TAB) 1 и TAB2/3, индуцирует оба (p38, внеклеточно-сигнальные регулируемые киназы = ERK, и JUN N-концевые киназы = JNK) митоген-активируемые протеинкиназы (MAPK) и активация NF-κB. Стимуляция обоих плеч завершается индукцией антимикробных пептидов (АМП), цитокинов и хемокинов. Формирование нодосомы способствует аутофагии, и, наоборот, полностью функциональный механизм аутофагии помогает в передаче сигнала через нодосому. Связанный с аутофагией белок (ATG) 16L1 вместе с ATG5 и ATG12 необходим для образования аутофагосом, однако, независимо от его функций аутофагии, ATG16L1 негативно регулирует передачу сигналов NOD/RIP2 (136).
С одной стороны, NEMO вызывает активацию канонического пути NF-κB путем фосфорилирования киназы ингибитора NF-κB (IKK)α и IKKβ, путем индукции ядерного фактора энхансера гена каппа-легкого полипептида в В-клетках фосфорилирование ингибитора альфа (IκBα) и протеасомного деградации и высвобождения субъединиц p50 и p65 NF-κB. С другой стороны, трансформирующий фактор роста-β-активируемая киназа 1 (TAK1) рекрутирует, трансформирующий фактор роста-β-активируемая киназа, связывающий белок (TAB) 1 и TAB2/3, индуцирует оба (p38, внеклеточно-сигнальные регулируемые киназы = ERK, и JUN N-концевые киназы = JNK) митоген-активируемые протеинкиназы (MAPK) и активация NF-κB. Стимуляция обоих плеч завершается индукцией антимикробных пептидов (АМП), цитокинов и хемокинов. Формирование нодосомы способствует аутофагии, и, наоборот, полностью функциональный механизм аутофагии помогает в передаче сигнала через нодосому. Связанный с аутофагией белок (ATG) 16L1 вместе с ATG5 и ATG12 необходим для образования аутофагосом, однако, независимо от его функций аутофагии, ATG16L1 негативно регулирует передачу сигналов NOD/RIP2 (136).
В линии эпителиальных клеток слизистой оболочки полости рта человека (Leuk-1) при стимуляции была продемонстрирована активация NOD1, рецептор-взаимодействующей серин/треонин-протеинкиназы 2 (RIP2) и P-NF-κB, которая значительно ингибировалась предварительной обработкой ячейки с экстрактом сигаретного дыма (ЭПС). Супрессивный эффект CSE на экспрессию NOD1 был обратным после лечения iE-DAP. Комбинация стимуляции CSE с обработкой iE-DAP предотвращала дальнейшее повышение уровней RIP2 и P-NF-kB, т. е. iE-DAP обращала ингибирующее действие CSE на экспрессию NOD1 и предотвращала чрезмерную активацию RIP2 и P-NF-kB. κB из-за воздействия CSE. Кроме того, CSE повышал уровни IL-6, IL-8 и TNF-α и снижал уровень IFN-γ, в то время как iE-DAP повышал уровни IL-6, TNF-α и IFN-γ, указывая на то, что iE-DAP усиливал экспрессия генов и высвобождение IL-6, TNF-α и IFN-γ в клетках Leuk-1, но снижал уровень мРНК IL-8, не влияя на продукцию IL-8 на уровне белка. Эти результаты показывают, что iE-DAP способен в определенной степени противодействовать CSE-опосредованным эффектам экспрессии NOD1 и нижестоящей передаче сигналов (149). ). На рисунке 6 изображена модель сигнальных каскадов NOD1 и NOD2.
). На рисунке 6 изображена модель сигнальных каскадов NOD1 и NOD2.
Протеазоактивируемые рецепторы (PAR)
Протеазоактивируемые рецепторы (PAR) представляют собой семейство рецепторов, связанных с G-белком (GPCR), которое включает четыре члена: PAR-1, PAR-2, PAR-3 и PAR -4, которые играют важную роль в заживлении ран, воспалении, гемостазе, тромбозе, прогрессировании рака и эмбриональном развитии (150). PAR активируются протеолитическим расщеплением N-концевой внеклеточной последовательности рецепторов протеиназой. Это расщепление обнажает новую N-концевую последовательность, действующую как связанный лиганд, который после связывания с рецептором инициирует множественные сигнальные каскады (151-153). Хотя все PAR демонстрируют одинаковый механизм действия, было продемонстрировано, что разные PAR могут активироваться разными протеиназами и проявлять различное распределение и биологическую активность (154). Одним из основных активаторов PAR-1, PAR-2 и PAR-3 является тромбин, другие важные активаторы PAR-1 включают активированный протеин C (APC) и матриксную металлопротеиназу-1 (MMP-1). Трипсин и триптаза тучных клеток человека активируют PAR-2, тогда как трипсин и катепсин G активируют PAR-4. Анализ нижестоящих сигнальных ответов после активации PAR показал, что PAR-1, PAR-2 и PAR-4 могут передавать сигналы автономно, в то время как PAR-3 скорее является корецептором для PAR-1 и PAR-4 (155). –158). PAR экспрессируются в ряде различных типов клеток, и было высказано предположение, что они влияют на физиологические процессы, такие как рост, развитие, воспаление, восстановление тканей и боль. В эпителиальных клетках десны (GEC) можно было продемонстрировать присутствие мРНК PAR-1,-2 и 3 и экспрессию белка, в то время как PAR-4 не был обнаружен. Предварительная инкубация клеток с Супернатант P. gingivalis , содержащий протеолитическую активность, индуцировал активацию мРНК PAR-2. Напротив, PAR-1 и -3 подавлялись. На основании этих результатов авторы пришли к выводу, что GEC распознают P. gingivalis с помощью PAR и опосредуют ответы клеток врожденного иммунитета (159).
Трипсин и триптаза тучных клеток человека активируют PAR-2, тогда как трипсин и катепсин G активируют PAR-4. Анализ нижестоящих сигнальных ответов после активации PAR показал, что PAR-1, PAR-2 и PAR-4 могут передавать сигналы автономно, в то время как PAR-3 скорее является корецептором для PAR-1 и PAR-4 (155). –158). PAR экспрессируются в ряде различных типов клеток, и было высказано предположение, что они влияют на физиологические процессы, такие как рост, развитие, воспаление, восстановление тканей и боль. В эпителиальных клетках десны (GEC) можно было продемонстрировать присутствие мРНК PAR-1,-2 и 3 и экспрессию белка, в то время как PAR-4 не был обнаружен. Предварительная инкубация клеток с Супернатант P. gingivalis , содержащий протеолитическую активность, индуцировал активацию мРНК PAR-2. Напротив, PAR-1 и -3 подавлялись. На основании этих результатов авторы пришли к выводу, что GEC распознают P. gingivalis с помощью PAR и опосредуют ответы клеток врожденного иммунитета (159). Было обнаружено, что PAR, NOD и TLR демонстрируют сложное взаимодействие. В экспериментах по сайленсингу было показано, что нокаут одного типа рецепторов может влиять на другие. GEC с молчащими PAR-1 и -2 реагировали с повышенной экспрессией NOD1 и NOD2 при стимуляции P. gingivalis или Fusobacterium nucleatum ( F. nucleatum ). Экспрессия TLR2 снижалась после заражения P. gingivalis , когда PAR2 был нокдаун, но не изменялся после стимуляции F. nucleatum , в то время как экспрессия TLR4 увеличивалась после подавления PAR2 и последующей стимуляции F. nucleatum . F. nucleatum активирует TLR4, в то время как P. gingivalis благодаря своей уникальной структуре LPS способен использовать TLR2 и отключать TLR4. Эти данные свидетельствуют о том, что если рецепторы PAR отсутствуют, экспрессия TLR модифицируется в ответ на воздействие бактерий в зависимости от уровня их активации. PRR могут функционировать как заменители эпителиального иммунного ответа на бактериальную провокацию.
Было обнаружено, что PAR, NOD и TLR демонстрируют сложное взаимодействие. В экспериментах по сайленсингу было показано, что нокаут одного типа рецепторов может влиять на другие. GEC с молчащими PAR-1 и -2 реагировали с повышенной экспрессией NOD1 и NOD2 при стимуляции P. gingivalis или Fusobacterium nucleatum ( F. nucleatum ). Экспрессия TLR2 снижалась после заражения P. gingivalis , когда PAR2 был нокдаун, но не изменялся после стимуляции F. nucleatum , в то время как экспрессия TLR4 увеличивалась после подавления PAR2 и последующей стимуляции F. nucleatum . F. nucleatum активирует TLR4, в то время как P. gingivalis благодаря своей уникальной структуре LPS способен использовать TLR2 и отключать TLR4. Эти данные свидетельствуют о том, что если рецепторы PAR отсутствуют, экспрессия TLR модифицируется в ответ на воздействие бактерий в зависимости от уровня их активации. PRR могут функционировать как заменители эпителиального иммунного ответа на бактериальную провокацию. Эти ответы показывают вариации в зависимости от свойств бактериальных стимулов (160).
Эти ответы показывают вариации в зависимости от свойств бактериальных стимулов (160).
Инфламмасомы
Еще одним механизмом иммунной системы для инициации провоспалительного ответа является так называемая инфламмасома (рис. 7, 8), белковый комплекс, состоящий из мультимера, который развивается в цитоплазме и участвует в иммунном ответе на патогенные микробы. или сигналы опасности. Инфламмасома индуцирует продукцию и секрецию зрелых провоспалительных цитокинов, IL-1β и IL-18, что в конечном итоге приводит к пироптозу, особому типу гибели клеток (162–165). Инфламмасомы можно разделить на канонические и неканонические пути (162, 164–167). Как правило, функциональный канонический инфламмасомный комплекс состоит из нуклеотидсвязывающего домена белка, богатого лейцином (NLR), спек-подобного белка, ассоциированного с апоптозом, адапторной молекулы, содержащего домен CARD (ASC), и каспазы-1 (167). Состав вышестоящих регуляторов и специфических молекул инфламмасомы зависит от типа сигналов опасности и микробных индукторов (164). Наиболее охарактеризованный NLR, пириновый домен, содержащий инфламмасому 3 (NLRP3) (рис. 8), например, активируется внеклеточным аденозинтрифосфатом (eATP), сигнализирующим об опасности пуриновым рецептором 2X7 (P2X7) и активными формами кислорода (АФК). Инфицирование бактериальными патогенами может индуцировать инфламмасому NLRP3. Специфическая активация инфламмасомы, отсутствующей при меланоме (AIM)2, запускается путем восприятия двухцепочечной ДНК в цитозоле, в то время как инфламмасома, превращающая IL-1β-превращающий фермент (ICE), протеазу-активирующий фактор (IPAF), активируется грамотрицательными бактериями. например, Salmonella typhimurium, Shigella flexneri, Legionella pneumophila и Pseudomonas aeruginosa ), которые имеют системы секреции III или IV типа (164). В эпителиальных клетках десны F. nucleatum также активирует инфламмасому NLRP3, которая, в свою очередь, активирует каспазу-1 и стимулирует секрецию зрелого IL-1β (168).
Наиболее охарактеризованный NLR, пириновый домен, содержащий инфламмасому 3 (NLRP3) (рис. 8), например, активируется внеклеточным аденозинтрифосфатом (eATP), сигнализирующим об опасности пуриновым рецептором 2X7 (P2X7) и активными формами кислорода (АФК). Инфицирование бактериальными патогенами может индуцировать инфламмасому NLRP3. Специфическая активация инфламмасомы, отсутствующей при меланоме (AIM)2, запускается путем восприятия двухцепочечной ДНК в цитозоле, в то время как инфламмасома, превращающая IL-1β-превращающий фермент (ICE), протеазу-активирующий фактор (IPAF), активируется грамотрицательными бактериями. например, Salmonella typhimurium, Shigella flexneri, Legionella pneumophila и Pseudomonas aeruginosa ), которые имеют системы секреции III или IV типа (164). В эпителиальных клетках десны F. nucleatum также активирует инфламмасому NLRP3, которая, в свою очередь, активирует каспазу-1 и стимулирует секрецию зрелого IL-1β (168).
Рисунок 7 . Микробная активация инфламмасом. Патогенные микроорганизмы активируют инфламмасомы через множество агонистов и путей. Salmonells typhimurium (S. typhimurium ) , Legionells pneumophila (L. pneumophila ) и Mycobacterium tuberculosis ( M. tuberculosis ) находятся в фагосоме клетки-хозяина и способны активировать инфламмасомы посредством секретируемых флагеллинов, эффекторов. или неопределенные домены NACHT, LRR и PYD, содержащие белок (NLRP)3. NACHT = NAIP, белок-ингибитор апоптоза нейронов; C2TA, активатор транскрипции класса 2 MHC; HET-E, гетерокарионная несовместимость; TP1, белок 1, ассоциированный с теломеразой; LRR, богатый лейцином повтор; PYD, домен PYRIN. Francisella tularensis ( F. tularensis ) и Listeria monocytogenes ( L. monocytogenes) , которые избегают активации фагосомы, отсутствующей в меланоме (AIM)2, которая воспринимает цитозольную дезоксирибонуклеиновую кислоту (ДНК). Летальный токсин Bacillus anthracis ( B.
Микробная активация инфламмасом. Патогенные микроорганизмы активируют инфламмасомы через множество агонистов и путей. Salmonells typhimurium (S. typhimurium ) , Legionells pneumophila (L. pneumophila ) и Mycobacterium tuberculosis ( M. tuberculosis ) находятся в фагосоме клетки-хозяина и способны активировать инфламмасомы посредством секретируемых флагеллинов, эффекторов. или неопределенные домены NACHT, LRR и PYD, содержащие белок (NLRP)3. NACHT = NAIP, белок-ингибитор апоптоза нейронов; C2TA, активатор транскрипции класса 2 MHC; HET-E, гетерокарионная несовместимость; TP1, белок 1, ассоциированный с теломеразой; LRR, богатый лейцином повтор; PYD, домен PYRIN. Francisella tularensis ( F. tularensis ) и Listeria monocytogenes ( L. monocytogenes) , которые избегают активации фагосомы, отсутствующей в меланоме (AIM)2, которая воспринимает цитозольную дезоксирибонуклеиновую кислоту (ДНК). Летальный токсин Bacillus anthracis ( B. anthracis ) активирует инфламмасому NLRP1. Кандида. albicans ( C. albicans ) и гемозоин активируют NLRP3 посредством передачи сигналов тирозинкиназы селезенки (SYK). Опосредованная вирусом активация воспаления сильно зависит от обнаружения нуклеиновых кислот с помощью NLRP3, AIM2 и гена, индуцируемого ретиноевой кислотой (RIG)-I. Пунктирные линии указывают на передачу сигналов через неизвестный механизм (161).
anthracis ) активирует инфламмасому NLRP1. Кандида. albicans ( C. albicans ) и гемозоин активируют NLRP3 посредством передачи сигналов тирозинкиназы селезенки (SYK). Опосредованная вирусом активация воспаления сильно зависит от обнаружения нуклеиновых кислот с помощью NLRP3, AIM2 и гена, индуцируемого ретиноевой кислотой (RIG)-I. Пунктирные линии указывают на передачу сигналов через неизвестный механизм (161).
Рисунок 8 . Механизм активации канонического белка, содержащего домены NACHT, LRR и PYD (NLRP)3-инфламмасомы. NACHT = NAIP, белок-ингибитор апоптоза нейронов; C2TA, активатор транскрипции класса 2 MHC; HET-E, гетерокарионная несовместимость; TP1, белок 1, ассоциированный с теломеразой; LRR, богатый лейцином повтор; PYD, домен PYRIN. Различные молекулярные паттерны, ассоциированные с патогенами (PAMP) и молекулярные паттерны, связанные с повреждением (DAMP), обеспечивают сигнал 2, необходимый для сборки и активации инфламмасомы NLRP3, состоящей из NLRP3, пятнистоподобного белка, ассоциированного с апоптозом (ASC), и каспазы-1. Хотя точный механизм, ведущий к активации NLRP3, все еще остается спорным, предполагается, что ион калия K 9Отток 1763 + может быть обычным клеточным ответом, который запускает активацию воспаления. Однако это представление не было полностью проверено, и возможно, что для передачи сигналов между оттоком K + и инфламмасомой NLRP3 может потребоваться неидентифицированный или промежуточный адаптер. Кристаллы и частицы DAMP проникают в клетку посредством эндоцитоза, непосредственно вызывая отток K + и образование NLRP3-инфламмасомы. Кроме того, эндолизосомы, несущие эти DAMP, претерпевают разрыв лизосом и высвобождают катепсин B, который действует как внутриклеточный DAMP и может индуцировать K + отток. Однако противоречивые исследования показывают, что разрыв лизосом может вызывать отток K + и активацию воспаления даже в отсутствие катепсина B. Аденозинтрифосфат (АТФ) связывается с рецептором P2X Purinoceptor 7 (P2X7) на клеточной мембране и вызывает открытие каналы аннексина 1 (PANX1), обеспечивающие отток и приток K + любых PAMP и DAMP, присутствующих во внеклеточном пространстве.
Хотя точный механизм, ведущий к активации NLRP3, все еще остается спорным, предполагается, что ион калия K 9Отток 1763 + может быть обычным клеточным ответом, который запускает активацию воспаления. Однако это представление не было полностью проверено, и возможно, что для передачи сигналов между оттоком K + и инфламмасомой NLRP3 может потребоваться неидентифицированный или промежуточный адаптер. Кристаллы и частицы DAMP проникают в клетку посредством эндоцитоза, непосредственно вызывая отток K + и образование NLRP3-инфламмасомы. Кроме того, эндолизосомы, несущие эти DAMP, претерпевают разрыв лизосом и высвобождают катепсин B, который действует как внутриклеточный DAMP и может индуцировать K + отток. Однако противоречивые исследования показывают, что разрыв лизосом может вызывать отток K + и активацию воспаления даже в отсутствие катепсина B. Аденозинтрифосфат (АТФ) связывается с рецептором P2X Purinoceptor 7 (P2X7) на клеточной мембране и вызывает открытие каналы аннексина 1 (PANX1), обеспечивающие отток и приток K + любых PAMP и DAMP, присутствующих во внеклеточном пространстве. PAMP, такие как порообразующие токсины, активируют инфламмасому NLRP3 и облегчают K + отток. Липосомы вызывают приток Ca 2+ через открытие каналов (TRPM2). Накопление избыточного Ca 2+ в цитозоле вызывает митохондриальную дисфункцию и высвобождение митохондриальных активных форм кислорода (mtROS) и окисленной митохондриальной дезоксирибонуклеиновой кислоты (мтДНК), которые могут активировать инфламмасому NLRP3 либо непосредственно, либо путем индукции оттока K + . Удаление проблемных митохондрий с помощью митофагии помогает избежать такой активации воспаления. Митохондриальный кардиолипин связывается с NLRP3 и необходим для активации NLRP3-инфламмасомы. После сборки NLRP3-инфламмасомы каспаза-1 подвергается протеолитическому расщеплению, управляемому близостью, и дополнительно превращает про-интерлейкин (IL)-18 и про-IL-1β в их зрелые активные формы. Активация оси NLRP3-каспаза-1 приводит к воспалению и пироптозной гибели клеток (136).
PAMP, такие как порообразующие токсины, активируют инфламмасому NLRP3 и облегчают K + отток. Липосомы вызывают приток Ca 2+ через открытие каналов (TRPM2). Накопление избыточного Ca 2+ в цитозоле вызывает митохондриальную дисфункцию и высвобождение митохондриальных активных форм кислорода (mtROS) и окисленной митохондриальной дезоксирибонуклеиновой кислоты (мтДНК), которые могут активировать инфламмасому NLRP3 либо непосредственно, либо путем индукции оттока K + . Удаление проблемных митохондрий с помощью митофагии помогает избежать такой активации воспаления. Митохондриальный кардиолипин связывается с NLRP3 и необходим для активации NLRP3-инфламмасомы. После сборки NLRP3-инфламмасомы каспаза-1 подвергается протеолитическому расщеплению, управляемому близостью, и дополнительно превращает про-интерлейкин (IL)-18 и про-IL-1β в их зрелые активные формы. Активация оси NLRP3-каспаза-1 приводит к воспалению и пироптозной гибели клеток (136).
P. gingivalis способен ингибировать врожденный иммунный ответ с помощью нуклеозид-дифосфаткиназы (NDK) после стимуляции внеклеточной (е)АТФ. Сигнал опасности eATP связывается с рецепторами P2X7, что приводит к активации инфламмасомы и каспазы-1. Таким образом, воздействие P. gingivalis дикого типа на эпителиальные клетки десны (GEC) приводило к блокаде АТФ-индуцированной активации каспазы-1, в то время как P. gingivalis с дефицитом NDK проявлял меньшие эффекты.
P. gingivalis Было показано, что NDK модифицирует высвобождение белка группы высокой подвижности B1 (HMGB1), еще одного провоспалительного сигнала опасности, который в неинфицированных клетках остается связанным с хроматином. Инфекция P. gingivalis дикого типа или с дефицитом NDK индуцировала высвобождение HMGB1 из ядра в цитозоль. HMGB1 доставлялся во внеклеточное пространство при стимуляции неинфицированных GEC АТФ. HMGB1 высвобождался в большей степени, когда клетки, обработанные АТФ, были инфицированы мутантами с дефицитом NDK вместо 9 дикого типа. 0005 P. gingivalis . Эти результаты свидетельствуют о том, что NDK в значительной степени участвуют в ингибировании P2X7-зависимой активации инфламмасом и высвобождении HMGB1 из бактериально инфицированных GEC (169).
0005 P. gingivalis . Эти результаты свидетельствуют о том, что NDK в значительной степени участвуют в ингибировании P2X7-зависимой активации инфламмасом и высвобождении HMGB1 из бактериально инфицированных GEC (169).
Существует множество инфламмасом, которые могут активироваться различными механизмами, что приводит к созреванию и секреции провоспалительных цитокинов (170, 171). Внеклеточный АТФ, один из первых активаторов, который, как было обнаружено, индуцирует образование воспаления NLRP3, считается принадлежащим к группе эндогенных молекулярных паттернов, связанных с повреждением (DAMP), высвобождаемых умирающими или поврежденными клетками (172, 173). Он незначительно присутствует в здоровых тканях, но может увеличиваться до высоких микромолярных концентраций в воспаленных участках после повреждения ткани (174). Исследования показали, что eATP вызывает активацию каспазы-1, за которой следует высвобождение IL-1β (175, 176). Йилмаз и др. (177) показали, что обработанные ЛПС или инфицированные эпителиальные клетки десны (GEC) не секретировали IL-1β, если они не были стимулированы eATP, и что eATP не изменял экспрессию NLRP3 или апоптоз-ассоциированного спек-подобного белка (ASC) в P. gingivalis инфицированных эпителиальных клеток десны. NLRP10 — самый маленький белок NLR человека. Он отличается от других белков NLR из-за отсутствия богатого лейцином повторяющегося домена, который участвует в восприятии или связывании лиганда. При инфицировании двумя пародонтальными патогенами, T. forsythia и F. nucleatum , линия эпителиальных клеток ротовой полости человека HOK-16B реагировала с повышенной экспрессией мРНК и белка NLRP10 при заражении Streptococcus oralis ( S. oralis ) не вызывал этого эффекта. Эти результаты показывают, что активация NLRP10 в клетках HOK-16B является патоген-специфичной (178). Рисунок 7 демонстрирует микробную активацию инфламмасом.
gingivalis инфицированных эпителиальных клеток десны. NLRP10 — самый маленький белок NLR человека. Он отличается от других белков NLR из-за отсутствия богатого лейцином повторяющегося домена, который участвует в восприятии или связывании лиганда. При инфицировании двумя пародонтальными патогенами, T. forsythia и F. nucleatum , линия эпителиальных клеток ротовой полости человека HOK-16B реагировала с повышенной экспрессией мРНК и белка NLRP10 при заражении Streptococcus oralis ( S. oralis ) не вызывал этого эффекта. Эти результаты показывают, что активация NLRP10 в клетках HOK-16B является патоген-специфичной (178). Рисунок 7 демонстрирует микробную активацию инфламмасом.
Производство и высвобождение цитокинов
Реакция интерлейкина (IL)-8 эпителиальных клеток десны после воздействия различных мультивидовых биопленок регулировалась по-разному (179). Характеристика всего секретома после заражения биопленки видами красного комплекса показала, что больше белков подвергалось подавлению, чем повышению (180).
Кератиноциты способны продуцировать различные цитокины, такие как IL-1, IL-6, IL-8 и фактор некроза опухоли (TNF)-α. Они поддерживают нормальные гомеостатические механизмы и могут вызывать пролиферативный эффект при повреждении. Цитокины слизистой оболочки могут иметь как провоспалительные, так и противовоспалительные функции. Дисбаланс в уровнях цитокинов может поддерживать воспалительные заболевания. Цитокины обеспечивают паракринную (между соседними клетками), эндокринную (клетки в удаленных участках) и аутокринную (межклеточную) систему связи между клетками. Цитокины, исходя из различных функций, происхождения и химической структуры, подразделяются на следующие группы: IL, TNF, хемокины, колониестимулирующие факторы (CSF), интерфероны (IFN) и факторы роста (GF). Цитокины обладают множеством активностей и функций (плейотропных и избыточных), поэтому их можно отнести более чем к одной группе. IL-3, например, также может быть отнесен к группе CSF (181). Цитокины IL-1 (IL-1α, IL-1β и IL-1Ra) важны для регуляции иммунного ответа и воспаления, поскольку они индуцируют экспрессию многих эффекторных белков, например, цитокинов/хемокинов, синтетазы оксида азота и ММП. (182).
(182).
Иммортализованная линия эпителиальных клеток ротовой полости человека OKF6-TERT2 реагирует на совместную инкубацию с in vitro культивируемых биопленок одно- и смешанных видов бактерий, состоящих из P. gingivalis, F. nucleatum, Aggregatibacter actinomycetemcomitans ( A. actinomycetemcomitans ) и Streptococcus mitis ( S. mitis ) с повышенной экспрессией мРНК IL-8, хемокинового лиганда 3 с мотивом C-X-C (CXCL3), CXCL1, IL-1, IL-6, CSF-2 и TNF -α. Реакция была наибольшей после стимуляции биопленками смешанных видов (183).
Хемокин IL-8 имеет решающее значение для здоровья полости рта, поскольку он поддерживает переход активированных иммунных клеток в ткани десны и через них, а также способствует адгезии иммунных клеток, ремоделированию тканей и ангиогенезу (184). IL-8 повышен в слюне пациентов с карциномой полости рта. Вероятно, это может быть биомаркером для выявления плоскоклеточного рака полости рта и ротоглотки (185). У пациентов с тяжелым периодонтитом IL-8 также был обнаружен в больших количествах в десневой жидкости на здоровых участках (186). Шуллер и др. исследовали базальные уровни высвобождения IL-8 и связали его с бактериальным сообществом, личной гигиеной полости рта и питанием у людей со здоровым состоянием десен (187). Показано, что базальный выброс ИЛ-8 находится в пределах 90,9 и 98,2 пг/мл, а бактериальные биопленки характерны для здоровой микробиоты полости рта. Была обнаружена связь между базальным уровнем IL-8 и микробиотой полости рта, что свидетельствует о связи между бактериями полости рта и воспалительным состоянием. Также сообщалось о связи между питанием, личной гигиеной полости рта, микробиотой полости рта и уровнями ИЛ-8. Идентификация индикаторных бактерий у здоровых людей с высоким уровнем высвобождения IL-8 считалась важной, поскольку они, возможно, являются многообещающими индикаторами возникновения заболеваний полости рта (187). Фуджимура и др. (188) сообщили, что рецептор гемофорического гемоглобина (HbR), который связывает гемоглобин и захватывает порфирин и гем ( P. gingivalis нуждается в железе для роста), при взаимодействии с клетками-хозяевами нарушается передача клеточного сигнала этими клетками с последующим ингибированием дифференцировки остеокластов из макрофагов костного мозга (188).
Шуллер и др. исследовали базальные уровни высвобождения IL-8 и связали его с бактериальным сообществом, личной гигиеной полости рта и питанием у людей со здоровым состоянием десен (187). Показано, что базальный выброс ИЛ-8 находится в пределах 90,9 и 98,2 пг/мл, а бактериальные биопленки характерны для здоровой микробиоты полости рта. Была обнаружена связь между базальным уровнем IL-8 и микробиотой полости рта, что свидетельствует о связи между бактериями полости рта и воспалительным состоянием. Также сообщалось о связи между питанием, личной гигиеной полости рта, микробиотой полости рта и уровнями ИЛ-8. Идентификация индикаторных бактерий у здоровых людей с высоким уровнем высвобождения IL-8 считалась важной, поскольку они, возможно, являются многообещающими индикаторами возникновения заболеваний полости рта (187). Фуджимура и др. (188) сообщили, что рецептор гемофорического гемоглобина (HbR), который связывает гемоглобин и захватывает порфирин и гем ( P. gingivalis нуждается в железе для роста), при взаимодействии с клетками-хозяевами нарушается передача клеточного сигнала этими клетками с последующим ингибированием дифференцировки остеокластов из макрофагов костного мозга (188). Было показано, что функция HbR, индуцирующая IL-8, из эпителиальных клеток хозяина поддерживается за счет активации передачи клеточного сигнала. Повышенная экспрессия IL-8 эпителиальными клетками десны индуцировалась HbR дозозависимым образом. Этот процесс связан с активацией p38 MAPK и Erk1/2 с помощью сайленсинговых (si)РНК и ингибиторов (189).).
Было показано, что функция HbR, индуцирующая IL-8, из эпителиальных клеток хозяина поддерживается за счет активации передачи клеточного сигнала. Повышенная экспрессия IL-8 эпителиальными клетками десны индуцировалась HbR дозозависимым образом. Этот процесс связан с активацией p38 MAPK и Erk1/2 с помощью сайленсинговых (si)РНК и ингибиторов (189).).
IL-33 принадлежит к семейству цитокинов IL-1 и конститутивно экспрессируется в ядрах эпителиальных и эндотелиальных клеток (190). IL-33, полученный из эпителиальных клеток, усиливает опосредованный цитокинами T-хелперов (Th)2 воспалительный иммунный ответ при бактериальном заражении (191). IL-33 был обнаружен в воспаленном эпителии десен у пациентов с хроническим пародонтитом. Повышенная экспрессия IL-33, индуцированная P . gingivalis обнаружен в цитоплазме эпителиальных клеток десны человека in vitro . Напротив, P . gingivalis fimbriae, липополисахарид или липопептид не вызывали этого эффекта. Ингибирование P . Протеазы gingivalis (гингипаины) блокировали индукцию мРНК IL-33. Также P . gingivalis gingipain-нулевой мутант KDP136 не повышал экспрессию IL-33. Замалчивание PAR-2 и ингибирование фосфолипазы C, p38 и NF-κB ограничивали P . gingivalis индуцировал экспрессию IL-33. Эти результаты указывают на активацию оси PAR-2/IL-33 в эпителиальных клетках десны человека на Р . gingivalis через гингипин-зависимый механизм (192).
Ингибирование P . Протеазы gingivalis (гингипаины) блокировали индукцию мРНК IL-33. Также P . gingivalis gingipain-нулевой мутант KDP136 не повышал экспрессию IL-33. Замалчивание PAR-2 и ингибирование фосфолипазы C, p38 и NF-κB ограничивали P . gingivalis индуцировал экспрессию IL-33. Эти результаты указывают на активацию оси PAR-2/IL-33 в эпителиальных клетках десны человека на Р . gingivalis через гингипин-зависимый механизм (192).
Ангиопоэтиноподобный белок (ANGPTL) принадлежит к семейству из восьми секретируемых гликопротеинов, но не связывается с тирозинкиназой с иммуноглобулиноподобными и EGF-подобными доменами (Tie)2, рецептором ангиопоэтина или с родственным белком Tie1 , и, классифицируемый как орфанный лиганд, по-видимому, проявляет биологические функции, отличные от ангиопоэтинов (193–195). ANGPTL2 управляет тканевым гомеостазом путем индукции воспаления и ангиогенеза (19).4, 196). Повышенные концентрации ANGPTL2 присутствуют в жидкости десневой борозды (GCF) у пациентов с хроническим периодонтитом, а стимуляция P. gingivalis LPS повышала уровень мРНК ANGPTL2 и уровни белка в клетках плоскоклеточной карциномы десны Ca9-22. Рекомбинантный человеческий ANGPTL2 вызывал повышенные уровни мРНК IL-1β, IL-8, TNF-α и белка в клетках Ca9-22. Подавление ANGPTL2 и блокирование антител против интегрина рецептора ANGPTL α5β1 ингибировали активацию мРНК и белка IL-1β, IL-8 и TNF-α, что свидетельствует о том, что секреция ANGPTL индуцирует воспалительные цитокины в эпителиальных клетках десны через аутокринную петлю. Таким образом, новый каскад индукции воспалительных цитокинов включает последовательные Р . gingivalis Выявлена активация LPS-ANGPTL2-интегрина α5β1, которая может быть ответственна за деструктивные процессы пародонта, индуцируемые эпителиальными клетками десны. Таким образом, ANGPTL2 участвует в патогенезе пародонтита и может способствовать развитию продолжительного хронического воспаления (197).
gingivalis LPS повышала уровень мРНК ANGPTL2 и уровни белка в клетках плоскоклеточной карциномы десны Ca9-22. Рекомбинантный человеческий ANGPTL2 вызывал повышенные уровни мРНК IL-1β, IL-8, TNF-α и белка в клетках Ca9-22. Подавление ANGPTL2 и блокирование антител против интегрина рецептора ANGPTL α5β1 ингибировали активацию мРНК и белка IL-1β, IL-8 и TNF-α, что свидетельствует о том, что секреция ANGPTL индуцирует воспалительные цитокины в эпителиальных клетках десны через аутокринную петлю. Таким образом, новый каскад индукции воспалительных цитокинов включает последовательные Р . gingivalis Выявлена активация LPS-ANGPTL2-интегрина α5β1, которая может быть ответственна за деструктивные процессы пародонта, индуцируемые эпителиальными клетками десны. Таким образом, ANGPTL2 участвует в патогенезе пародонтита и может способствовать развитию продолжительного хронического воспаления (197).
Иммортализованная линия клеток десны человека реагировала с повышенными концентрациями мРНК IL-8 и IL-6 и поддерживала фосфорилирование киназы ERK и p38 MAP при заражении A. actinomycetemcomitans (198).
actinomycetemcomitans (198).
A. actinomycetemcomitans , член таксономического семейства Pasteurellaceae , связан с развитием агрессивного пародонтита и может также способствовать развитию хронического пародонтита (199–201). Среди других патогенных членов пародонтальной биопленки A. actinomycetemcomitans продуцирует различные вещества, способные прямо или косвенно повреждать клетки и ткани. Как член биопленки ротовой полости, эта бактерия, как известно, экспрессирует сложные опероны для двух цитотоксинов, лейкотоксина (Lkt) и цитолетального токсина растяжения (Cdt) (202, 203). Эти токсины способны нарушать иммунный ответ хозяина и, таким образом, способствовать патогенезу пародонтита (204). Эпителиальные клетки десны человека (HGEC) стимулировали 50 клиническими штаммами и 7 эталонными штаммами из A. actinomycetemcomitans , включая различные серотипы и несеротипируемые штаммы, штаммы из глубоких или неглубоких очагов и эталонные серотипные штаммы, исследованные на экспрессию мРНК IL-1β, IL-6, IL-8 и TNF-α . Результаты показали, что уровень мРНК IL-8 сильно повышался после стимуляции клинически полученным штаммом A. actinomycetemcomitans , а также эталонными штаммами. Серотип f индуцировал самую высокую экспрессию по сравнению с другими серотипами. Промоторный ген JP2-подобного лейкотоксина и несеротипируемые (NS) 1 и NS2 вызывали меньшую индукцию IL-8 по сравнению с серотипируемыми штаммами, и активация IL-8 после стимуляции клиническими штаммами из глубоких карманов также показала значительно более низкие уровни, чем изолированы от неглубоких карманов. Эти результаты показывают, что JP2-подобные лейкотоксины NS1 и NS2 из клинических изолятов A. actinomycetemcomitans , полученные из глубоких карманов, способны влиять на функцию нейтрофилов, снижая реакцию IL-8, что приводит к иммуносупрессии, которая может поддерживать вирулентность и выживаемость этих бактерий (205).
Результаты показали, что уровень мРНК IL-8 сильно повышался после стимуляции клинически полученным штаммом A. actinomycetemcomitans , а также эталонными штаммами. Серотип f индуцировал самую высокую экспрессию по сравнению с другими серотипами. Промоторный ген JP2-подобного лейкотоксина и несеротипируемые (NS) 1 и NS2 вызывали меньшую индукцию IL-8 по сравнению с серотипируемыми штаммами, и активация IL-8 после стимуляции клиническими штаммами из глубоких карманов также показала значительно более низкие уровни, чем изолированы от неглубоких карманов. Эти результаты показывают, что JP2-подобные лейкотоксины NS1 и NS2 из клинических изолятов A. actinomycetemcomitans , полученные из глубоких карманов, способны влиять на функцию нейтрофилов, снижая реакцию IL-8, что приводит к иммуносупрессии, которая может поддерживать вирулентность и выживаемость этих бактерий (205).
Влияние
Treponema denticola T. denticola представляет собой грамотрицательную анаэробную оральную спирохету, которая известна как представитель пародонтальных патогенов и связана с хроническим пародонтитом (206, 207). Он обладает множеством факторов вирулентности, включая дентилизин, активную протеазу, расположенную на поверхности клетки, которая расщепляет связи фенилаланил/аланил и пролил/аланил, активность трипсиноподобной протеазы и способность к подвижности и хемотаксису через периплазматические жгутики [обзор см. в Dashper и другие. (208)].
Он обладает множеством факторов вирулентности, включая дентилизин, активную протеазу, расположенную на поверхности клетки, которая расщепляет связи фенилаланил/аланил и пролил/аланил, активность трипсиноподобной протеазы и способность к подвижности и хемотаксису через периплазматические жгутики [обзор см. в Dashper и другие. (208)].
На первичных эпителиальных клетках десны было продемонстрировано, что T. denticola не индуцирует продукцию IL-8, что не может быть объяснено деградацией IL-8, поскольку мутантная протеаза, которая не расщепляет IL-8, также не индуцирует t индуцировать продукцию ИЛ-8. Кроме того, T. denticola не способствовал транскрипции мРНК IL-8 и hβD-2. Этот нарушенный ответ эпителиальных клеток на T. denticola предполагает участие в патогенезе пародонтита недостаточной инициации хемотаксиса нейтрофилами в пародонтальном кармане (209).). Механизм подавления IL-8 T. denticola исследовали с использованием иммортализованных эпителиальных клеток десны человека (HOK-16B). Дентисилин разрушал TNF-α, цитокин, индуцирующий IL-8, что свидетельствует о модуляции IL-8 (210). В моноцитах, полученных из мононуклеарных клеток периферической крови человека, исследовали роль T. denticola периплазматических жгутиков (ПФ). Стимуляция врожденного иммунного ответа с помощью PAMPs показала, что экспонирующие жгутики T. denticola 9 дикого типа 0006 индуцировал продукцию цитокинов TNF-α, IL-1, IL-6, IL-10 и IL-12 при активации ядерного фактора (NF)-κB через толл-подобный рецептор (TLR)2. Эти результаты позволяют предположить, что T. denticola активирует врожденный иммунный ответ TLR2-зависимым образом и что жгутики участвуют в качестве ключевых бактериальных компонентов (211).
Дентисилин разрушал TNF-α, цитокин, индуцирующий IL-8, что свидетельствует о модуляции IL-8 (210). В моноцитах, полученных из мононуклеарных клеток периферической крови человека, исследовали роль T. denticola периплазматических жгутиков (ПФ). Стимуляция врожденного иммунного ответа с помощью PAMPs показала, что экспонирующие жгутики T. denticola 9 дикого типа 0006 индуцировал продукцию цитокинов TNF-α, IL-1, IL-6, IL-10 и IL-12 при активации ядерного фактора (NF)-κB через толл-подобный рецептор (TLR)2. Эти результаты позволяют предположить, что T. denticola активирует врожденный иммунный ответ TLR2-зависимым образом и что жгутики участвуют в качестве ключевых бактериальных компонентов (211).
Семейство IL-17, состоящее из IL-17A–IL-17F, играет важную роль в защите хозяина от микробного заражения, а также было показано, что оно имеет решающее значение в патогенезе периодонтита (212). Первоначально IL-17A считался цитокином, экспрессируемым исключительно клетками Th27 (213), но последующие исследования показали, что другие клеточные источники способны экспрессировать IL-17A, включая γδ Т-клетки, естественные клетки-киллеры, нейтрофилы, эозинофилы, тучные клетки и макрофаги. (212). В тканях десны у пациентов с пародонтитом (214–217) присутствие клеток, продуцирующих IL-17, коррелирует с тяжестью воспаления в очагах пародонтита (218). Кроме того, повышенные уровни IL-17A были обнаружены в GCF пациентов с пародонтитом. Уровни IL-17A снижаются после нехирургической терапии (219, 220). Аванг и др. (221) проанализировали клиническую связь между цитокинами семейства IL-17 и периодонтитом, а также биологический эффект IL-17A и IL-17E с использованием модельных систем in vitro . Согласно их исследованиям, уровни IL-17A в сыворотке, слюне и GCF повышены у пациентов с пародонтитом и коррелируют с клиническими параметрами потери прикрепления, глубины кармана и кровотечения при зондировании. Пациенты с пародонтитом демонстрируют более низкие уровни IL-17E в сыворотке, и соотношение IL-17A-IL-17E в сыворотке также положительно коррелирует с клиническими параметрами. In vitro , IL-17E подавлял IL-17A, а P. gingivalis индуцировал экспрессию хемокинов путем ингибирования фосфорилирования субъединицы p65 NF-kB, что указывало на то, что в патогенезе периодонтита сывороточный IL-17A-IL-17E соотношение может быть маркером тяжести заболевания, в то время как IL-17E противостоит IL-17A.
(212). В тканях десны у пациентов с пародонтитом (214–217) присутствие клеток, продуцирующих IL-17, коррелирует с тяжестью воспаления в очагах пародонтита (218). Кроме того, повышенные уровни IL-17A были обнаружены в GCF пациентов с пародонтитом. Уровни IL-17A снижаются после нехирургической терапии (219, 220). Аванг и др. (221) проанализировали клиническую связь между цитокинами семейства IL-17 и периодонтитом, а также биологический эффект IL-17A и IL-17E с использованием модельных систем in vitro . Согласно их исследованиям, уровни IL-17A в сыворотке, слюне и GCF повышены у пациентов с пародонтитом и коррелируют с клиническими параметрами потери прикрепления, глубины кармана и кровотечения при зондировании. Пациенты с пародонтитом демонстрируют более низкие уровни IL-17E в сыворотке, и соотношение IL-17A-IL-17E в сыворотке также положительно коррелирует с клиническими параметрами. In vitro , IL-17E подавлял IL-17A, а P. gingivalis индуцировал экспрессию хемокинов путем ингибирования фосфорилирования субъединицы p65 NF-kB, что указывало на то, что в патогенезе периодонтита сывороточный IL-17A-IL-17E соотношение может быть маркером тяжести заболевания, в то время как IL-17E противостоит IL-17A. IL-17E, продуцируемый оральными кератиноцитами, может подавлять IL-17A в периодонте (221).
IL-17E, продуцируемый оральными кератиноцитами, может подавлять IL-17A в периодонте (221).
Иммуномодуляция, бактериальная инфекция и раковые клетки
Роль специфичной для задержки роста 6 (GAS6)
Специфический для остановки роста 6 (GAS6) и белок S (PROS1) являются лигандами тирозинкиназного рецептора тирозинкиназы (TYRO)3, AXL и протоонкогенного (MERTK или TAM) рецептора (222), которые участвуют в ряде биологических процессов, включая иммунную регуляцию (223). GAS6 конститутивно экспрессируется в эпителиальных клетках полости рта, и было показано, что он подавляет активацию эпителия в равновесном состоянии для поддержания гомеостаза (224). В слизистой оболочке полости рта поверхностные слои эпителия экспрессируют GAS6 вместе с его преобладающим рецептором AXL. После рождения экспрессия GAS6 индуцируется MYD88-зависимым образом развивающейся микробиотой. Было показано, что GAS6, экспрессируемый дендритными клетками (DC), ингибирует продукцию IL-6, поддерживая развитие регуляторных Т-клеток (Treg) и уменьшая образование клеток Th27. Это обеспечивает более толерогенную иммунологическую среду для микробиоты полости рта (224). Передача сигналов GAS6/AXL, по-видимому, играет решающую роль в регуляции гомеостаза слизистой оболочки полости рта. Таким образом, патогены, воздействующие на ось GAS6/AXL, могут вызывать дисбиотическое состояние и последующую патологию полости рта. Индукция пероральных адаптивных иммунных ответов специфическими патогенами прекращается в Gas6 -/- мыши и GAS6 способны одновременно индуцировать про- и противовоспалительные регуляторные пути после того, как мышей заразили P. gingivalis . GAS6 не только повышает экспрессию молекул адгезии в кровеносных сосудах, что поддерживает экстравазацию иммунных клеток, принадлежащих к врожденному иммунному ответу, но также увеличивает экспрессию хемокинов CCL19 и CCL21 и, таким образом, способствует миграции пероральных ДК в лимфатические узлы. Кроме того, GAS6 подавляет экспрессию провоспалительных молекул Р-селектина, молекулы межклеточной адгезии 1 (ICAM-1) и молекулы адгезии 1 сосудистых клеток (VCAM-1) в слизистой оболочке полости рта.
Это обеспечивает более толерогенную иммунологическую среду для микробиоты полости рта (224). Передача сигналов GAS6/AXL, по-видимому, играет решающую роль в регуляции гомеостаза слизистой оболочки полости рта. Таким образом, патогены, воздействующие на ось GAS6/AXL, могут вызывать дисбиотическое состояние и последующую патологию полости рта. Индукция пероральных адаптивных иммунных ответов специфическими патогенами прекращается в Gas6 -/- мыши и GAS6 способны одновременно индуцировать про- и противовоспалительные регуляторные пути после того, как мышей заразили P. gingivalis . GAS6 не только повышает экспрессию молекул адгезии в кровеносных сосудах, что поддерживает экстравазацию иммунных клеток, принадлежащих к врожденному иммунному ответу, но также увеличивает экспрессию хемокинов CCL19 и CCL21 и, таким образом, способствует миграции пероральных ДК в лимфатические узлы. Кроме того, GAS6 подавляет экспрессию провоспалительных молекул Р-селектина, молекулы межклеточной адгезии 1 (ICAM-1) и молекулы адгезии 1 сосудистых клеток (VCAM-1) в слизистой оболочке полости рта. Кроме того, GAS6 блокирует созревание ДК и снижает презентацию антигена ДК Т-клеткам. Авторы пришли к выводу, что GAS6 облегчает миграцию воспалительных клеток и ДК через эндотелий в обоих направлениях, в то время как стимуляция Т-клеток и активация слизистой подавляется. Эта строго регулируемая активность GAS6 поддерживает быстрый, но все еще умеренный иммунитет слизистой оболочки к оральным патогенам (225).
Кроме того, GAS6 блокирует созревание ДК и снижает презентацию антигена ДК Т-клеткам. Авторы пришли к выводу, что GAS6 облегчает миграцию воспалительных клеток и ДК через эндотелий в обоих направлениях, в то время как стимуляция Т-клеток и активация слизистой подавляется. Эта строго регулируемая активность GAS6 поддерживает быстрый, но все еще умеренный иммунитет слизистой оболочки к оральным патогенам (225).
Бактериальные инфекции и раковые клетки
Данные свидетельствуют о повышенном риске развития рака при хронических инфекциях и воспалениях. Бактериальные инфекции и канцерогенез, по-видимому, связаны (226). Пародонтит, одно из наиболее распространенных хронических воспалительных заболеваний человека, вызывается микроорганизмами в биопленке ротовой полости, которые вызывают локальное воспаление. Пародонтит вызывает эпителиальную пролиферацию и апикальную миграцию вдоль поверхности корня зуба и приводит к постоянному высвобождению воспалительных цитокинов, факторов роста, простагландинов и ферментов, которые тесно связаны с развитием рака (226). В предыдущих исследованиях Tezal et al. (226, 227) сообщалось, что предполагаемая связь между пародонтитом и новообразованиями полости рта является значимой. Высокая экспрессия PD-L1 была связана с различными типами злокачественных новообразований человека, такими как рак легких, рак поджелудочной железы, рак ротовой полости, рак почек, рак груди и желудка (228, 229).). Рак головы и шеи относится к 10 наиболее распространенным видам рака в мире (230). Около 95% случаев относятся к типу плоскоклеточной карциномы (SCC). Опухоли могут расти только в том случае, если их тканевая среда обеспечивает им среду, которая поддерживает их рост и распространение. Изменения тканевого гомеостаза в результате инфекции или воспаления могут нарушить структурную целостность стромы и способствовать онкогенезу (231).
В предыдущих исследованиях Tezal et al. (226, 227) сообщалось, что предполагаемая связь между пародонтитом и новообразованиями полости рта является значимой. Высокая экспрессия PD-L1 была связана с различными типами злокачественных новообразований человека, такими как рак легких, рак поджелудочной железы, рак ротовой полости, рак почек, рак груди и желудка (228, 229).). Рак головы и шеи относится к 10 наиболее распространенным видам рака в мире (230). Около 95% случаев относятся к типу плоскоклеточной карциномы (SCC). Опухоли могут расти только в том случае, если их тканевая среда обеспечивает им среду, которая поддерживает их рост и распространение. Изменения тканевого гомеостаза в результате инфекции или воспаления могут нарушить структурную целостность стромы и способствовать онкогенезу (231).
Лиганд программируемой гибели 1 (PD-L1, также называемый B7-h2) принадлежит к семейству B7 и играет важную роль в регуляции клеточно-опосредованного иммунного ответа (232, 233). Сигналы, опосредованные PD-L1, важны для совместной передачи сигналов активации и толерантности Т-клеток (234). Сигналы PD-L1 также способны подавлять функции и выживаемость Т-клеток (228, 235). Модификация иммунных реакций в очагах рака является важным механизмом, связанным с ускользанием опухолей от иммунитета. В микроокружении опухоли PD-L1 и рецептор запрограммированной смерти 1 (PD-1) могут взаимодействовать и индуцировать противоопухолевые механизмы путем активации множества специфических путей, включая лигирование PD-1 с помощью PD-L1 на антиген-специфических Т-клетках. Это, в свою очередь, может привести к функциональной анергии и/или апоптозу этих эффекторных Т-клеток. Лигирование PD-1 с помощью PD-L1, возможно, способствует толерантности и напрямую защищает опухоль от апоптоза путем обратной передачи сигналов через PD-L1 (228, 236, 237). Было показано, что Р . gingivalis W83 активирует PD-L1 в раковых клетках полости рта и в первичных, а также в иммортализованных кератиноцитах десны человека (238). Высокие уровни PD-L1 были продемонстрированы в клетках инвазивной плоскоклеточной карциномы полости рта (239).
Сигналы PD-L1 также способны подавлять функции и выживаемость Т-клеток (228, 235). Модификация иммунных реакций в очагах рака является важным механизмом, связанным с ускользанием опухолей от иммунитета. В микроокружении опухоли PD-L1 и рецептор запрограммированной смерти 1 (PD-1) могут взаимодействовать и индуцировать противоопухолевые механизмы путем активации множества специфических путей, включая лигирование PD-1 с помощью PD-L1 на антиген-специфических Т-клетках. Это, в свою очередь, может привести к функциональной анергии и/или апоптозу этих эффекторных Т-клеток. Лигирование PD-1 с помощью PD-L1, возможно, способствует толерантности и напрямую защищает опухоль от апоптоза путем обратной передачи сигналов через PD-L1 (228, 236, 237). Было показано, что Р . gingivalis W83 активирует PD-L1 в раковых клетках полости рта и в первичных, а также в иммортализованных кератиноцитах десны человека (238). Высокие уровни PD-L1 были продемонстрированы в клетках инвазивной плоскоклеточной карциномы полости рта (239). Кроме того, положительная экспрессия PD-L1 была обнаружена в образцах тканей плоскоклеточного рака полости рта ex vivo (240). Мембранные белки P . gingivalis ответственны за активацию, в то время как цитозольные белки не индуцируют PD-L1 (241). Первичные кератиноциты десны человека (PHGK) и клетки плоскоклеточной карциномы полости рта (SCC-25) активировали ряд генов, связанных с воспалением, при заражении Мембраны P. gingivalis , среди которых члены нижележащего сигнального пути NF-κB, сигнального пути TLR и путей MAPK. Эти данные не только предполагают, что мембрана P. gingivalis индуцирует провоспалительный ответ в злокачественных и незлокачественных эпителиальных клетках полости рта, но также указывают на возможную связь между инфекцией и карциномами полости рта, поскольку сигнальные пути p38 MAPK и MEK4-JNK1 были нарушены. показано, что он участвует в контексте микроокружения опухоли и контроля роста рака (242).
Кроме того, положительная экспрессия PD-L1 была обнаружена в образцах тканей плоскоклеточного рака полости рта ex vivo (240). Мембранные белки P . gingivalis ответственны за активацию, в то время как цитозольные белки не индуцируют PD-L1 (241). Первичные кератиноциты десны человека (PHGK) и клетки плоскоклеточной карциномы полости рта (SCC-25) активировали ряд генов, связанных с воспалением, при заражении Мембраны P. gingivalis , среди которых члены нижележащего сигнального пути NF-κB, сигнального пути TLR и путей MAPK. Эти данные не только предполагают, что мембрана P. gingivalis индуцирует провоспалительный ответ в злокачественных и незлокачественных эпителиальных клетках полости рта, но также указывают на возможную связь между инфекцией и карциномами полости рта, поскольку сигнальные пути p38 MAPK и MEK4-JNK1 были нарушены. показано, что он участвует в контексте микроокружения опухоли и контроля роста рака (242).
В китайской популяции был продемонстрирован повышенный риск карциномы головы и шеи у лиц с подслизистым фиброзом полости рта, лейкоплакией полости рта и повторяющимися зубными язвами, что свидетельствует о тесной связи между этими заболеваниями и раком (243). Также больные колоректальным раком носят штаммы F. nucleatum в раковых очагах. F. nucleatum является одним из видов бактерий с наиболее высокой плотностью колонизации в ротовой полости и, как известно, вызывает пародонтит (244). Влияние оральных патогенов на развитие опухолей полости рта исследовали Hoppe et al. (245). Стимуляция опухолевых клеток ротовой полости с помощью P. gingivalis приводил к увеличению пролиферации клеток, в то время как A. actinomycetemcomitans , напротив, способствовал гибели клеток. Бактерии, а также антимикробные пептиды индуцировали разнообразные эффекты на уровни транскрипции генов онкогенных дефензинов и передачу сигналов рецептора эпидермального фактора роста (EGFR). Первичное воздействие двух оральных патогенов было противоположным по характеру пролиферации опухолевых клеток полости рта. Напротив, оба индуцировали сходные вторичные эффекты на скорость пролиферации, модулируя степень экспрессии важного онкогенного гена α-дефензина.
Также больные колоректальным раком носят штаммы F. nucleatum в раковых очагах. F. nucleatum является одним из видов бактерий с наиболее высокой плотностью колонизации в ротовой полости и, как известно, вызывает пародонтит (244). Влияние оральных патогенов на развитие опухолей полости рта исследовали Hoppe et al. (245). Стимуляция опухолевых клеток ротовой полости с помощью P. gingivalis приводил к увеличению пролиферации клеток, в то время как A. actinomycetemcomitans , напротив, способствовал гибели клеток. Бактерии, а также антимикробные пептиды индуцировали разнообразные эффекты на уровни транскрипции генов онкогенных дефензинов и передачу сигналов рецептора эпидермального фактора роста (EGFR). Первичное воздействие двух оральных патогенов было противоположным по характеру пролиферации опухолевых клеток полости рта. Напротив, оба индуцировали сходные вторичные эффекты на скорость пролиферации, модулируя степень экспрессии важного онкогенного гена α-дефензина. Дефенсины человека по-разному модифицируют передачу сигналов рецептора эпидермального фактора роста, подтверждая предположение, что эти антимикробные пептиды являются возможными лигандами EGFR. Взаимодействие этих двух молекул может вызвать модификацию пролиферативного поведения опухолевых клеток полости рта (245). Недавно созданная модель долговременной инфекции путем стимуляции человеческих иммортализованных эпителиальных клеток полости рта (HIOEC) с помощью P. gingivalis при низкой множественности инфекции (MOI) в течение 5–23 недель использовали для исследования возможных изменений в опухолях. Постоянная инфекция P. gingivalis вызывала изменения в морфологии клеток, повышала пролиферативную способность и повышала миграционные и инвазивные свойства клеток. Кроме того, гены, связанные с опухолями, включая GAS6 и PD-L1, которые, возможно, действуют как ключевые регуляторы трансформации нераковых клеток в опухолевые, активировались в ответ на длительное воздействие P.
Дефенсины человека по-разному модифицируют передачу сигналов рецептора эпидермального фактора роста, подтверждая предположение, что эти антимикробные пептиды являются возможными лигандами EGFR. Взаимодействие этих двух молекул может вызвать модификацию пролиферативного поведения опухолевых клеток полости рта (245). Недавно созданная модель долговременной инфекции путем стимуляции человеческих иммортализованных эпителиальных клеток полости рта (HIOEC) с помощью P. gingivalis при низкой множественности инфекции (MOI) в течение 5–23 недель использовали для исследования возможных изменений в опухолях. Постоянная инфекция P. gingivalis вызывала изменения в морфологии клеток, повышала пролиферативную способность и повышала миграционные и инвазивные свойства клеток. Кроме того, гены, связанные с опухолями, включая GAS6 и PD-L1, которые, возможно, действуют как ключевые регуляторы трансформации нераковых клеток в опухолевые, активировались в ответ на длительное воздействие P. gingivalis . Авторы пришли к выводу, что P. gingivalis способен поддерживать туморогенные характеристики HIOEC, предполагая, что хроническая инфекция P. gingivalis , возможно, представляет собой фактор риска развития рака полости рта (246). Используя недавно созданную модель онкогенеза ротовой полости мышей, связанную с пародонтитом, было сообщено, что хроническая бактериальная инфекция поддерживает развитие OSCC, индуцируя усиленную передачу сигналов IL-6-сигнального преобразователя и активатора транскрипции 3 (STAT3) путь. Результаты показывают, что пародонтальные патогены, такие как P. gingivalis и F. nucleatum способствуют онкогенезу, взаимодействуя непосредственно с эпителиальными клетками полости рта через TLR2. Кроме того, эти патогены стимулируют пролиферацию OSCC человека и индуцируют экспрессию ключевых молекулярных факторов, которые принимают участие в онкогенезе, таких как STAT3, который активируется в ответ на интерфероны, EGF, IL-5, IL-6 и циклин D1, которые необходим для прохождения через фазу G1 клеточного цикла и вызывает миграцию клеток.
gingivalis . Авторы пришли к выводу, что P. gingivalis способен поддерживать туморогенные характеристики HIOEC, предполагая, что хроническая инфекция P. gingivalis , возможно, представляет собой фактор риска развития рака полости рта (246). Используя недавно созданную модель онкогенеза ротовой полости мышей, связанную с пародонтитом, было сообщено, что хроническая бактериальная инфекция поддерживает развитие OSCC, индуцируя усиленную передачу сигналов IL-6-сигнального преобразователя и активатора транскрипции 3 (STAT3) путь. Результаты показывают, что пародонтальные патогены, такие как P. gingivalis и F. nucleatum способствуют онкогенезу, взаимодействуя непосредственно с эпителиальными клетками полости рта через TLR2. Кроме того, эти патогены стимулируют пролиферацию OSCC человека и индуцируют экспрессию ключевых молекулярных факторов, которые принимают участие в онкогенезе, таких как STAT3, который активируется в ответ на интерфероны, EGF, IL-5, IL-6 и циклин D1, которые необходим для прохождения через фазу G1 клеточного цикла и вызывает миграцию клеток. Эти находки отражают роль бактерий полости рта в механизме химически индуцированного онкогенеза OSCC (247).
Эти находки отражают роль бактерий полости рта в механизме химически индуцированного онкогенеза OSCC (247).
Эпителиально-мезенхимальный переход (ЭМП) имеет решающее значение для превращения нормальных эпителиальных клеток в клетки карциномы во время канцерогенеза. Понижение уровня E-кадгерина и повышение уровня N-кадгерина и факторов транскрипции белка цинковых пальцев SNAI1 (= улитка), SNAI2 (= слизняк) и гомеобокса, связывающего e-бокс с цинковыми пальцами (Zeb)1, являются типичными маркерами этого преобразования. (248). В недавно установленной длительной инфекции in vitro модель Lee et al. (249) продемонстрировали, что первичные эпителиальные клетки ротовой полости после 120 ч инфицирования P. gingivalis развивают фенотип ЕМТ, включающий снижение E-кадгерина и увеличение экспрессии Slug, Snail и Zeb1. Заражение первичных культур эпителиальных клеток крыс пародонтальными патогенами в течение 8 дней вызывало повышенный процент виментин-позитивных клеток, 20% после стимуляции P. gingivalis и 30% после заражения F. nucleatum . Кроме того, пародонтальные патогены индуцировали повышенную активацию Snail, а электрический импеданс по сравнению с необлученными контрольными культурами был снижен. Способность клеток мигрировать увеличивалась в ответ на бактериальную стимуляцию, о чем свидетельствовало количество мигрирующих клеток и скорость закрытия расчесов. В заключение, постоянная стимуляция первичных культур оральных кератиноцитов крыс пародонтальными патогенами вызывала ЭМП-подобные свойства, что указывает на то, что этот процесс может способствовать потере целостности эпителия (250).
gingivalis и 30% после заражения F. nucleatum . Кроме того, пародонтальные патогены индуцировали повышенную активацию Snail, а электрический импеданс по сравнению с необлученными контрольными культурами был снижен. Способность клеток мигрировать увеличивалась в ответ на бактериальную стимуляцию, о чем свидетельствовало количество мигрирующих клеток и скорость закрытия расчесов. В заключение, постоянная стимуляция первичных культур оральных кератиноцитов крыс пародонтальными патогенами вызывала ЭМП-подобные свойства, что указывает на то, что этот процесс может способствовать потере целостности эпителия (250).
Выводы
Состав десневого эпителиального барьера достаточно сложен, так как в его структуру входит огромное количество различных молекул. Кератины являются основным компонентом ороговевающего многослойного эпителиального цитоскелета. В зависимости от локализации и функции разные эпителии экспрессируют отчетливый цитокератиновый паттерн. Чтобы поддерживать свою функцию, многослойный эпителий, включая слизистую оболочку полости рта, должен поддерживать плотную межклеточную адгезию в жизнеспособных клетках, которая включает межклеточные плотные и адгезивные соединения, которые соединяются с актиновым цитоскелетом. Иммунный ответ тканей полости рта способен распознавать микробную инфекцию и колонизацию и способен справляться с ней. Эпителиальные клетки экспрессируют ряд рецепторов распознавания образов, включая TLR, NOD1, NOD2 и PAR, и способны собирать различные виды инфламмасом и экспрессировать различные провоспалительные цитокины и хемокины. Резидентные бактерии полости рта постоянно влияют на эпителиальные клетки-хозяева. В зависимости от своего состава биопленки по-разному модифицируют клеточные иммунные реакции эпителия. Основные пародонтальные патогены, такие как P. gingivalis обладает рядом различных стратегий для выхода из-под действия врожденного иммунитета и выживания в тканях, которые воздействуют на эпителиальный барьер, изменяя экспрессию и целостность различных межклеточных соединений.
Иммунный ответ тканей полости рта способен распознавать микробную инфекцию и колонизацию и способен справляться с ней. Эпителиальные клетки экспрессируют ряд рецепторов распознавания образов, включая TLR, NOD1, NOD2 и PAR, и способны собирать различные виды инфламмасом и экспрессировать различные провоспалительные цитокины и хемокины. Резидентные бактерии полости рта постоянно влияют на эпителиальные клетки-хозяева. В зависимости от своего состава биопленки по-разному модифицируют клеточные иммунные реакции эпителия. Основные пародонтальные патогены, такие как P. gingivalis обладает рядом различных стратегий для выхода из-под действия врожденного иммунитета и выживания в тканях, которые воздействуют на эпителиальный барьер, изменяя экспрессию и целостность различных межклеточных соединений.
Сбалансированное иммунно-воспалительное состояние хозяина с его биопленкой в здоровом состоянии может быть нарушено отдельными видами, такими как P. gingivalis и F. nucleatum , которые способны нарушить это равновесие, вызывая дисбиотическую микробиоту (251 ). Хронические инфекции и стойкое воспаление связаны с повышенным риском развития рака. Стойкие бактериальные агенты могут индуцировать активацию иммуноингибирующих рецепторов, что, в свою очередь, облегчает способность раковых клеток уклоняться от противоопухолевого иммунного ответа хозяина. Кроме того, длительная инфекция, возможно, поддерживает канцерогенез, регулируя экспрессию генов инфицированных эпителиальных клеток таким образом, что это приводит к развитию фенотипа, указывающего на трансформацию клеток из нормальных в раковые.
Хронические инфекции и стойкое воспаление связаны с повышенным риском развития рака. Стойкие бактериальные агенты могут индуцировать активацию иммуноингибирующих рецепторов, что, в свою очередь, облегчает способность раковых клеток уклоняться от противоопухолевого иммунного ответа хозяина. Кроме того, длительная инфекция, возможно, поддерживает канцерогенез, регулируя экспрессию генов инфицированных эпителиальных клеток таким образом, что это приводит к развитию фенотипа, указывающего на трансформацию клеток из нормальных в раковые.
Вклад автора
SG написала рукопись. JM исправил рукопись и помог в написании.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Ссылки
1. Gartner LP. Анатомия полости рта и типы тканей. Семин Дерматол. (1994) 13:68–73.
Реферат PubMed | Академия Google
2. Гарант ПР. Клетки и ткани полости рта . Иллинойс, Иллинойс: Quintessence Publishing Co., Inc. (2003).
Гарант ПР. Клетки и ткани полости рта . Иллинойс, Иллинойс: Quintessence Publishing Co., Inc. (2003).
Google Scholar
3. Schroeder HE, Listgarten MA. Ткани десны: архитектура защиты пародонта. Пародонтология (1997) 13:91–120.
Реферат PubMed | Google Scholar
4. Squier CA, Кремер MJ. Биология слизистой оболочки полости рта и пищевода. J Natl Cancer Inst Monogr. (2001) 29:7–15.
Google Scholar
5. Groeger SE, Meyle J. Эпителиальный барьер и бактериальная инфекция полости рта. Пародонтология (2015) 69:46–67. doi: 10.1111/prd.12094
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
6. Полланен М.Т., Салонен Дж.И., Уитто В.Дж. Структура и функция зубоэпителиального интерфейса в норме и при патологии. Пародонтология (2003) 31:12–31. doi: 10.1034/j.1600-0757.2003.03102.x
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
7. Steinert PM, Roop DR. Молекулярная и клеточная биология промежуточных филаментов. Annu Rev Biochem. (1988) 57: 593–625.
Молекулярная и клеточная биология промежуточных филаментов. Annu Rev Biochem. (1988) 57: 593–625.
Реферат PubMed | Google Scholar
8. Moll R, Franke WW, Schiller DL, Geiger B, Krepler R. Каталог цитокератинов человека: паттерны экспрессии в нормальном эпителии, опухолях и культивируемых клетках. Cell (1982) 31:11–24. doi: 10.1016/0092-8674(82)-7
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
9. Су Л., Морган П.Р., Лейн Э.Б. Экспрессия белков и мРНК простых эпителиальных кератинов в нормальном, диспластическом и злокачественном эпителии полости рта. Ам Дж. Патол. (1994) 145:1349–57.
Реферат PubMed | Google Scholar
10. Молл Р., Диво М., Лангбейн Л. Кератины человека: биология и патология. Histochem Cell Biol. (2008) 129:705–33. doi: 10.1007/s00418-008-0435-6
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
11. Дейл Б.А., Салонен Дж., Джонс А. Х. Новые подходы и концепции в изучении дифференцировки эпителия полости рта. Crit Rev Oral Biol Med. (1990) 1:167–90. doi: 10.1177/10454411 0030201
Х. Новые подходы и концепции в изучении дифференцировки эпителия полости рта. Crit Rev Oral Biol Med. (1990) 1:167–90. doi: 10.1177/10454411 0030201
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
12. Collin C, Ouhayoun JP, Grund C, Franke WW. Супрабазальные маркерные белки, отличающие ороговевающий плоский эпителий: полипептиды цитокератина 2 ротового жевательного эпителия и эпидермиса различаются. Дифференциация (1992) 51:137–48. doi: 10.1111/j.1432-0436.1992.tb00690.x
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
13. Mackenzie IC, Rittman G, Gao Z, Leigh I, Lane EB. Паттерны экспрессии цитокератина в эпителии десен человека. J Пародонтальные рес. (1991) 26:468–78. doi: 10.1111/j.1600-0765.1991.tb01797.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
14. Berkovitz BKB HG, Moxham BJ. Оральная анатомия, гистология и эмбриология . Эдинберг: Elsevier limited. (2009).
(2009).
Google Scholar
15. Nanci A. Ten Гистология полости рта Кейт, развитие, структура и функция . Мосби, Миссури: Эльзевир Мосби (2008).
Google Scholar
16. Альбертс Б. Дж. А., Льюис Дж., Рафф М., Робертс К., Уолтер П. Молекулярная биология клетки . Нью-Йорк, штат Нью-Йорк: Garland Science (2002).
Google Scholar
17. Рао Р.С., Патил С., Ганави Б.С. Пероральные цитокератины в норме и при патологии. J Contemp Dent Pract. (2014) 15:127–36. doi: 10.5005/jp-journals-10024-1502
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
18. Хаджишенгаллис Г., Ламонт Р.Дж. За пределами красного комплекса и в более сложной: модель полимикробной синергии и дисбиоза (PSD) этиологии заболеваний пародонта. моль Оральный микробиол. (2012) 27:409–19. doi: 10.1111/j.2041-1014.2012.00663.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
19. Abusleme L, Dupuy AK, Dutzan N, Silva N, Burleson JA, Strausbaugh LD, et al. Поддесневой микробиом в норме и при пародонтите и его связь с биомассой сообщества и воспалением. ISME J. (2013) 7:1016–25. doi: 10.1038/ismej.2012.174
Поддесневой микробиом в норме и при пародонтите и его связь с биомассой сообщества и воспалением. ISME J. (2013) 7:1016–25. doi: 10.1038/ismej.2012.174
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
20. Hajishengallis G, Darveau RP, Curtis MA. Гипотеза краеугольного камня-возбудителя. Nat Rev Microbiol. (2012) 10:717–25. doi: 10.1038/nrmicro2873
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
21. Hajishengallis G. Иммуномикробный патогенез пародонтита: краеугольные камни, патобионты и ответ хозяина. Тренды Иммунол. (2014) 35:3–11. doi: 10.1016/j.it.2013.09.001
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
22. Hajishengallis G. Инфламмофильный характер микробиоты, ассоциированной с пародонтитом. моль Оральный микробиол. (2014) 29: 248–57. doi: 10.1111/omi.12065
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
23. Пресланд Р.Б., Юревич Р.Дж. Осмысление эпителиального барьера: что молекулярная биология и генетика говорят нам о функциях слизистой оболочки полости рта и эпидермальных тканей. J Dent Educ. (2002) 66:564–74.
Пресланд Р.Б., Юревич Р.Дж. Осмысление эпителиального барьера: что молекулярная биология и генетика говорят нам о функциях слизистой оболочки полости рта и эпидермальных тканей. J Dent Educ. (2002) 66:564–74.
Реферат PubMed | Google Scholar
24. Мехта Д., Малик А.Б. Сигнальные механизмы, регулирующие проницаемость эндотелия. Physiol Rev. (2006) 86:279–367. doi: 10.1152/physrev.00012.2005
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
25. Ниссен CM. Плотные соединения/спаечные соединения: основная структура и функция. J Инвест Дерматол. (2007) 127:2525–32. doi: 10.1038/sj.jid.5700865
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
26. Андерсон Дж.М. Молекулярная структура плотных контактов и их роль в эпителиальном транспорте. Новости физиол. наук. (2001) 16:126–30.
Реферат PubMed | Google Scholar
27. Цукита С., Фурусе М., Ито М. Многофункциональные нити в плотных соединениях. Nat Rev Mol Cell Biol. (2001) 2:285–93. doi: 10.1038/35067088
Nat Rev Mol Cell Biol. (2001) 2:285–93. doi: 10.1038/35067088
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
28. Dejana E. Эндотелиальные межклеточные соединения: счастливы вместе. Nat Rev Mol Cell Biol. (2004) 5: 261–70. doi: 10.1038/nrm1357
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
29. Furuse M, Fujita K, Hiiragi T, Fujimoto K, Tsukita S. Claudin-1 и -2: новые интегральные мембранные белки, локализующиеся в плотных соединениях без сходства последовательностей с окклюдином. J Cell Biol. (1998) 141:1539–50. doi: 10.1083/jcb.141.7.1539
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
30. Furuse M, Sasaki H, Fujimoto K, Tsukita S. Продукт одного гена, клаудин-1 или-2, восстанавливает нити с плотным соединением и рекрутирует окклюдин в фибробласты. J Cell Biol. (1998) 143:391–401. doi: 10.1083/jcb.143.2.391
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
31. Маттер К., Айжаз С., Цапара А., Балда М.С. Плотные контакты млекопитающих в регуляции дифференцировки и пролиферации эпителия. Curr Opin Cell Biol. (2005) 17:453–8. doi: 10.1016/j.ceb.2005.08.003
Маттер К., Айжаз С., Цапара А., Балда М.С. Плотные контакты млекопитающих в регуляции дифференцировки и пролиферации эпителия. Curr Opin Cell Biol. (2005) 17:453–8. doi: 10.1016/j.ceb.2005.08.003
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
32. Колер К., Захрауи А. Плотные соединения: координатор клеточной сигнализации и мембранного транспорта. Biol Cell (2005) 97:659–65. doi: 10.1042/BC20040147
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
33. Цукита С., Фурусе М. Преодоление барьеров в изучении функций плотных контактов: от окклюдина к клаудину. Genes Cells (1998) 3:569–73. дои: 10.1046/j.1365-2443.1998.00212.x
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
34. Furuse M, Hata M, Furuse K, Yoshida Y, Haratake A, Sugitani Y, et al. Плотные соединения на основе клаудина имеют решающее значение для эпидермального барьера млекопитающих: урок мышей с дефицитом клаудина-1. J Cell Biol. (2002) 156:1099–111. doi: 10.1083/jcb.200110122
J Cell Biol. (2002) 156:1099–111. doi: 10.1083/jcb.200110122
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
35. Цукита С., Фурусе М. Барьер на основе Клодина в простых и слоистых ячеистых листах. Curr Opin Cell Biol. (2002) 14:531–6. doi: 10.1016/S0955-0674(02)00362-9
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
36. Тан Фольксваген, Гуденаф Д.А. Парацеллюлярный ионный канал в области плотного соединения. Biophys J. (2003) 84:1660–73. doi: 10.1016/S0006-3495(03)74975-3
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
37. Furuse M, Sasaki H, Tsukita S. Способ взаимодействия гетерогенных видов клаудина внутри и между нитями плотного соединения. J Cell Biol. (1999) 147:891–903. doi: 10.1083/jcb.147.4.891
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
38. Фурусе М. Нокаутные животные и естественные мутации как экспериментальный и диагностический инструмент для изучения функций плотных контактов in vivo . Биохим Биофиз Акта (2009) 1788:813–9. doi: 10.1016/j.bbamem.2008.07.017
Биохим Биофиз Акта (2009) 1788:813–9. doi: 10.1016/j.bbamem.2008.07.017
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
39. Furuse M, Hirase T, Itoh M, Nagafuchi A, Yonemura S, Tsukita S, et al. Окклюдин: новый интегральный мембранный белок, локализующийся в плотных контактах. J Cell Biol. (1993) 123 (6 часть 2): 1777–88. doi: 10.1083/jcb.123.6.1777
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
40. Муресан З., Пол Д.Л., Гуденаф Д.А. Окклюдин 1B, вариант белка плотных контактов окклюдина. Mol Biol Cell (2000) 11:627–34. doi: 10.1091/mbc.11.2.627
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
41. Шен Л., Тернер Дж. Р. Деполимеризация актина разрушает плотные контакты посредством эндоцитоза, опосредованного кавеолами. Mol Biol Cell (2005) 16:3919–36. doi: 10.1091/mbc.e04-12-1089
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
42. Утеч М., Менниген Р., Брювер М. Эндоцитоз и рециркуляция белков плотного соединения при воспалении. J Биомед Биотехнолог. (2010) 2010:484987. doi: 10.1155/2010/484987
Утеч М., Менниген Р., Брювер М. Эндоцитоз и рециркуляция белков плотного соединения при воспалении. J Биомед Биотехнолог. (2010) 2010:484987. doi: 10.1155/2010/484987
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
43. Yu AS, McCarthy KM, Francis SA, McCormack JM, Lai J, Rogers RA, et al. Нокдаун экспрессии окклюдина приводит к разнообразным фенотипическим изменениям в эпителиальных клетках. Am J Physiol Cell Physiol. (2005) 288:C1231–41. doi: 10.1152/ajpcell.00581.2004
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
44. Hatakeyama S, Yaegashi T, Oikawa Y, Fujiwara H, Mikami T, Takeda Y, et al. Паттерн экспрессии молекул адгезии в соединительном эпителии отличается от такового в другом эпителии десны. J Пародонтальные рес. (2006) 41:322–8. doi: 10.1111/j.1600-0765.2006.00875.x
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
45. Ye P, Yu H, Simonian M, Hunter N. Паттерны экспрессии компонентов плотного соединения, индуцированные CD24, в модели клеточной культуры эпителия полости рта коррелируют с пораженными тканями пародонта. J Пародонтальные рес. (2014) 49: 253–9. doi: 10.1111/jre.12102
Паттерны экспрессии компонентов плотного соединения, индуцированные CD24, в модели клеточной культуры эпителия полости рта коррелируют с пораженными тканями пародонта. J Пародонтальные рес. (2014) 49: 253–9. doi: 10.1111/jre.12102
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
46. Groeger S, Jarzina F, Windhorst A, Meyle J. Влияние ретиноевой кислоты на эпителиальные барьеры десен человека. J Пародонтальные рес. (2016) 51:748–57. doi: 10.1111/jre.12351
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
47. Belibasakis GN, Kast JI, Thurnheer T, Akdis CA, Bostanci N. Экспрессия десневых эпителиальных соединений в ответ на поддесневые биопленки. Вирулентность (2015) 6:704–9. doi: 10.1080/21505594.2015.1081731
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
48. Chen YH, Lu Q, Goodenough DA, Jeansonne B. Нерецепторная тирозинкиназа c-Yes взаимодействует с окклюдином во время образования плотных контактов в эпителиальных клетках почек собак. Mol Biol Cell (2002) 13:1227–37. doi: 10.1091/mbc.01-08-0423
Mol Biol Cell (2002) 13:1227–37. doi: 10.1091/mbc.01-08-0423
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
49. Seth A, Sheth P, Elias BC, Rao R. Протеиновые фосфатазы 2A и 1 взаимодействуют с окклюдином и отрицательно регулируют сборку плотных контактов в клеточном монослое CACO-2. J Biol Chem. (2007) 282:11487–98. doi: 10.1074/jbc.M610597200
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
50. Ikenouchi J, Furuse M, Furuse K, Sasaki H, Tsukita S. Трицеллюлин представляет собой новый барьер на трехклеточных контактах эпителиальных клеток. J Cell Biol. (2005) 171:939–45. doi: 10.1083/jcb.200510043
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
51. Krug SM, Amasheh S, Richter JF, Milatz S, Gunzel D, Westphal JK, et al. Трицеллюлин образует барьер для макромолекул в трехклеточных плотных контактах, не влияя на ионную проницаемость. Mol Biol Cell (2009) 20:3713–24. doi: 10.1091/mbc.e09-01-0080
doi: 10.1091/mbc.e09-01-0080
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
52. Raleigh DR, Marchiando AM, Zhang Y, Shen L, Sasaki H, Wang Y, et al. Белки MARVEL, связанные с плотными контактами, marveld3, tricellulin и occludin имеют разные, но перекрывающиеся функции. Mol Biol Cell (2010) 21:1200–13. doi: 10.1091/mbc.e09-08-0734
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
53. Itoh M, Sasaki H, Furuse M, Ozaki H, Kita T, Tsukita S. Молекула соединительной адгезии (JAM) связывается с PAR-3: возможный механизм привлечения PAR-3 к плотным контактам. J Cell Biol. (2001) 154:491–7. doi: 10.1083/jcb.200103047
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
54. Ebnet K, Schulz CU, Meyer Zu, Brickwedde MK, Pendl GG, Vestweber D. Молекула соединительной адгезии взаимодействует с белками AF-6 и ZO-1, содержащими домен PDZ. J Biol Chem. (2000) 275:27979–88. doi: 10.1074/jbc.M002363200
doi: 10.1074/jbc.M002363200
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
55. Monteiro AC, Sumagin R, Rankin CR, Leoni G, Mina MJ, Reiter DM, et al. JAM-A связывается с ZO-2, афадином и PDZ-GEF1, чтобы активировать Rap2c и регулировать функцию эпителиального барьера. Mol Biol Cell (2013) 24:2849–60. doi: 10.1091/mbc.e13-06-0298
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
56. Cohen CJ, Shieh JT, Pickles RJ, Okegawa T, Hsieh JT, Bergelson JM. Рецептор вируса Коксаки и аденовируса является трансмембранным компонентом плотного контакта. Proc Natl Acad Sci USA. (2001) 98:15191–6. doi: 10.1073/pnas.261452898
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
57. Уолтерс Р.В., Фреймут П., Монингер Т.О., Ганске И., Забнер Дж., Уэлш М.Дж. Аденовирусное волокно разрушает CAR-опосредованную межклеточную адгезию, позволяя вирусу ускользнуть. Cell (2002) 110:789–99. doi: 10.1016/S0092-8674(02)00912-1
doi: 10.1016/S0092-8674(02)00912-1
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
58. Zhang GH, Wu LL, Yu GY. Плотные соединения и парацеллюлярная жидкость и транспорт ионов в слюнных железах. Чин Дж. Дент Рез. (2013) 16:13–46.
Реферат PubMed | Google Scholar
59. McCarthy KM, Francis SA, McCormack JM, Lai J, Rogers RA, Skare IB, et al. Индуцируемая экспрессия claudin-1-myc, но не occludin-VSV-G, приводит к образованию аберрантной цепи плотного соединения в клетках MDCK. J Cell Sci. (2000) 113 (Pt 19): 3387–98.
Google Scholar
60. Стивенсон Б.Р., Силициано Д.Д., Мусекер М.С., Гуденаф Д.А. Идентификация ZO-1: высокомолекулярный полипептид, связанный с плотным соединением (zonula occludens) в различных эпителиях. J Cell Biol. (1986) 103:755–66. doi: 10.1083/jcb.103.3.755
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
61. Gumbiner B, Lowenkopf T, Apatira D. Идентификация полипептида массой 160 кДа, который связывается с белком плотных контактов ZO-1. Proc Natl Acad Sci USA. (1991) 88:3460–4. doi: 10.1073/pnas.88.8.3460
Идентификация полипептида массой 160 кДа, который связывается с белком плотных контактов ZO-1. Proc Natl Acad Sci USA. (1991) 88:3460–4. doi: 10.1073/pnas.88.8.3460
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
62. Хаскинс Дж., Гу Л., Виттхен Э.С., Хиббард Дж., Стивенсон Б.Р. ZO-3, новый член семейства белков MAGUK, обнаруженный в области плотных контактов, взаимодействует с ZO-1 и окклюдином. J Cell Biol. (1998) 141:199–208. doi: 10.1083/jcb.141.1.199
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
63. Такано К., Кодзима Т., Савада Н., Хими Т. Роль плотных контактов в передаче сигнала: обновление. EXCLI J. (2014) 13:1145–62.
Реферат PubMed | Google Scholar
64. Андерсон Дж.М., Ван Итали К.М. Физиология и функция плотного соединения. Колд Спринг Харб Перспект Биол. (2009) 1: а002584. doi: 10.1101/cshperspect.a002584
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
65. Turner JR, Buschmann MM, Romero-Calvo I, Sailer A, Shen L. Роль молекулярного ремоделирования в дифференциальной регуляции проницаемости плотных контактов. Semin Cell Dev Biol. (2014) 36:204–12. doi: 10.1016/j.semcdb.2014.09.022
Turner JR, Buschmann MM, Romero-Calvo I, Sailer A, Shen L. Роль молекулярного ремоделирования в дифференциальной регуляции проницаемости плотных контактов. Semin Cell Dev Biol. (2014) 36:204–12. doi: 10.1016/j.semcdb.2014.09.022
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
66. Furuse M, Izumi Y, Oda Y, Higashi T, Iwamoto N. Молекулярная организация трехклеточных плотных соединений. Tissue Barriers (2014) 2:e28960. doi: 10.4161/tisb.28960
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
67. Meyle J, Gultig K, Rascher G, Wolburg H. Трансэпителиальное электрическое сопротивление и плотные соединения кератиноцитов десны человека. J Пародонтальные рес. (1999) 34:214–22. doi: 10.1111/j.1600-0765.1999.tb02244.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
68. Gumbiner B, Simons K. Функциональный анализ белков, участвующих в создании эпителиального окклюзионного барьера: идентификация увоморулин-подобного полипептида. J Cell Biol. (1986) 102:457–68. doi: 10.1083/jcb.102.2.457
J Cell Biol. (1986) 102:457–68. doi: 10.1083/jcb.102.2.457
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
69. Staddon JM, Herrenknecht K, Smales C, Rubin LL. Доказательства того, что фосфорилирование тирозина может увеличить проницаемость плотных контактов. J Cell Sci. (1995) 108 (часть 2): 609–19.
Реферат PubMed | Google Scholar
70. Клод П. Морфологические факторы, влияющие на трансэпителиальную проницаемость: модель сопротивления zonula ocludens. J Membr Biol. (1978) 39: 219–32. doi: 10.1007/BF01870332
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
71. Groeger S, Doman E, Chakraborty T, Meyle J. Влияние инфекции Porphyromonas gingivalis на функцию эпителиального барьера десны человека in vitro . Eur J Oral Sci. (2010) 118:582–9. doi: 10.1111/j.1600-0722.2010.00782.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
72. Палант С.Э., Даффи М.Э., Мукерджи Б.К., Хо С., Бенцель С.Дж. Регуляция Ca2+ проницаемости и структуры плотных контактов в желчном пузыре Necturus. Am J Physiol. (1983) 245:C203–12. doi: 10.1152/ajpcell.1983.245.3.C203
Палант С.Э., Даффи М.Э., Мукерджи Б.К., Хо С., Бенцель С.Дж. Регуляция Ca2+ проницаемости и структуры плотных контактов в желчном пузыре Necturus. Am J Physiol. (1983) 245:C203–12. doi: 10.1152/ajpcell.1983.245.3.C203
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
73. Huibregtse JM, Beaudenon SL. Механизм белков Е6 ВПЧ в клеточной трансформации. Семин Рак Биол. (1996) 7:317–26.
Реферат PubMed | Google Scholar
74. Groeger S, Michel J, Meyle J. Создание и характеристика иммортализованных клеточных линий кератиноцитов десны человека. J Пародонтальные рес. (2008) 43:604–14. doi: 10.1111/j.1600-0765.2007.01019.x
CrossRef Full Text | Google Scholar
75. Ши Ю., Ратнаяке Д.Б., Окамото К., Абэ Н., Ямамото К., Накаяма К. Генетический анализ протеолиза, связывания гемоглобина и гемагглютинации Porphyromonas gingivalis . Конструирование мутантов с комбинацией rgpA, rgpB, kgp и hagA. J Biol Chem. (1999) 274:17955–60.
(1999) 274:17955–60.
Реферат PubMed | Google Scholar
76. Брювер М., Утеч М., Иванов А.И., Хопкинс А.М., Паркос К.А., Нусрат А. Интерферон-гамма индуцирует интернализацию эпителиальных белков плотного соединения посредством процесса, подобного макропиноцитозу. FASEB J. (2005) 19:923–33. doi: 10.1096/fj.04-3260com
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
77. Guo W, Wang P, Liu ZH, Ye P. Анализ дифференциальной экспрессии белков плотных контактов в культивируемых эпителиальных клетках полости рта, измененных липополисахаридом Porphyromonas gingivalis, Porphyromonas gingivalis и внеклеточным аденозинтрифосфатом. Int J Oral Sci. (2018) 10:e8. doi: 10.1038/ijos.2017.51
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
78. Провост Э., Римм Д.Л. Споры на цитоплазматической стороне комплекса адгезии на основе кадгерина. Curr Opin Cell Biol. (1999) 11:567–72. doi: 10.1016/S0955-0674(99)00015-0
doi: 10.1016/S0955-0674(99)00015-0
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
79. Баум Б., Джорджиу М. Динамика слипчивых соединений при формировании, поддержании и ремоделировании эпителия. J Cell Biol. (2011) 192:907–17. doi: 10.1083/jcb.201009141
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
80. Imamura Y, Itoh M, Maeno Y, Tsukita S, Nagafuchi A. Функциональные домены альфа-катенина, необходимые для сильного состояния клеточной адгезии на основе кадгерина. J Cell Biol. (1999) 144:1311–22. doi: 10.1083/jcb.144.6.1311
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
81. Abe K, Takeichi M. EPLIN опосредует связывание кадгерин-катенинового комплекса с F-актином и стабилизирует кольцевой актиновый пояс. Proc Natl Acad Sci USA. (2008) 105: 13–9. doi: 10.1073/pnas.0710504105
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
82. Mandai K, Nakanishi H, Satoh A, Obaishi H, Wada M, Nishioka H, et al. Новый белок, связывающий актиновые филаменты, с одним доменом PDZ, локализованным в межклеточных соединениях на основе кадгерина. J Cell Biol. (1997) 139:517–28. doi: 10.1083/jcb.139.2.517
Mandai K, Nakanishi H, Satoh A, Obaishi H, Wada M, Nishioka H, et al. Новый белок, связывающий актиновые филаменты, с одним доменом PDZ, локализованным в межклеточных соединениях на основе кадгерина. J Cell Biol. (1997) 139:517–28. doi: 10.1083/jcb.139.2.517
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
83. Kussel-Andermann P, El-Amraoui A, Safieddine S, Nouaille S, Perfettini I, Lecuit M, et al. Везатин, новый трансмембранный белок, связывает миозин VIIA с комплексом кадгерин-катенины. EMBO J. (2000) 19:6020–9. doi: 10.1093/emboj/19.22.6020
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
84. Coopman P, Djiane A. Регуляция адгезионных соединений и комплекса E-кадгерина эпителиальной полярностью. Cell Mol Life Sci. (2016) 73:3535–53. doi: 10.1007/s00018-016-2260-8
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
85. Накагава И., Инаба Х., Ямамура Т. , Като Т., Каваи С., Оошима Т. и др. Инвазия эпителиальных клеток и протеолиз компонентов клеточной фокальной адгезии различными типами Porphyromonas gingivalis бахромок. Заразить иммунн. (2006) 74:3773–82. doi: 10.1128/IAI.01902-05
, Като Т., Каваи С., Оошима Т. и др. Инвазия эпителиальных клеток и протеолиз компонентов клеточной фокальной адгезии различными типами Porphyromonas gingivalis бахромок. Заразить иммунн. (2006) 74:3773–82. doi: 10.1128/IAI.01902-05
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
86. Йилмаз О., Вербеке П., Ламонт Р.Дж., Ойциус Д.М. Межклеточное распространение инфекции Porphyromonas gingivalis в первичных эпителиальных клетках десны. Заразить иммунн. (2006) 74:703–10. doi: 10.1128/IAI.74.1.703-710.2006
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
87. Потемпа Дж., Банбула А., Трэвис Дж. Роль бактериальных протеиназ в разрушении матрикса и модуляции ответов хозяина. Пародонтология (2000) 24:153–92. doi: 10.1034/j.1600-0757.2000.2240108.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
88. Беди Г.С., Уильямс Т. Очистка и характеристика протеазы, разрушающей коллаген, из Porphyromonas gingivalis . J Biol Chem. (1994) 269: 599–606.
J Biol Chem. (1994) 269: 599–606.
Реферат PubMed | Академия Google
89. Chen Z, Casiano CA, Fletcher HM. Протеазоактивные препараты внеклеточного белка из Porphyromonas gingivalis W83 индуцируют протеолиз N-кадгерина, потерю клеточной адгезии и апоптоз в эпителиальных клетках человека. J Пародонтология. (2001) 72:641–50. doi: 10.1902/jop.2001.72.5.641
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
90. Sheets SM, Potempa J, Travis J, Fletcher HM, Casiano CA. Гингипаины из Porphyromonas gingivalis W83 синергически разрушает адгезию эндотелиальных клеток и может индуцировать каспазо-независимый апоптоз. Заразить иммунн. (2006) 74:5667–78. doi: 10.1128/IAI.01140-05
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
91. Хинтерманн Э., Хааке С.К., Кристен У., Шараби А., Куаранта В. Дискретный протеолиз компонентов фокального контакта и соединения адгезивов в кератиноцитах, инфицированных Porphyromonas gingivalis : стратегия клеточной адгезии и отключения миграции. Заразить иммунн. (2002) 70:5846–56. doi: 10.1128/IAI.70.10.5846-5856.2002
Заразить иммунн. (2002) 70:5846–56. doi: 10.1128/IAI.70.10.5846-5856.2002
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
92. Амано А. Молекулярное взаимодействие Porphyromonas gingivalis с клетками-хозяевами: значение для микробного патогенеза заболеваний пародонта. J Пародонтология. (2003) 74:90–6. doi: 10.1902/jop.2003.74.1.90
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
93. Накагава И., Амано А., Кубонива М., Накамура Т., Кавабата С., Хамада С. Функциональные различия между вариантами FimA из Porphyromonas gingivalis и их влияние на адгезию и инвазию эпителиальных клеток человека. Заразить иммунн. (2002) 70: 277–85. doi: 10.1128/IAI.70.1.277-285.2002
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
94. Цуда К., Амано А., Умебаяши К., Инаба Х., Накагава И., Наканиши Ю. и др. Молекулярная диссекция интернализации Porphyromonas gingivalis клетками с использованием флуоресцентных шариков, покрытых бактериальными мембранными пузырьками. Функция клеточной структуры (2005) 30:81–91. doi: 10.1247/csf.30.81
Функция клеточной структуры (2005) 30:81–91. doi: 10.1247/csf.30.81
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
95. Huttenlocher A, Ginsberg MH, Horwitz AF. Модуляция клеточной миграции с помощью интегрин-опосредованных цитоскелетных связей и сродства к связыванию лигандов. J Cell Biol. (1996) 134:1551–62. doi: 10.1083/jcb.134.6.1551
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
96. Cox EA, Sastry SK, Huttenlocher A. Адгезия, опосредованная интегрином, регулирует полярность клеток и выпячивание мембран через семейство Rho ГТФаз. Mol Biol Cell (2001) 12:265–77. doi: 10.1091/mbc.12.2.265
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
97. Като Т., Каваи С., Накано К., Инаба Х., Кубонива М., Накагава И. и др. Вирулентность Porphyromonas gingivalis изменяется путем замены гена fimbria другим генотипом. Клеточная микробиология. (2007) 9: 753–65. doi: 10.1111/j.1462-5822.2006.00825.x
doi: 10.1111/j.1462-5822.2006.00825.x
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
98. Lamont RJ, Yilmaz O. Внутри или снаружи: инвазивность бактерий полости рта. Пародонтология (2002) 30:61–9. doi: 10.1034/j.1600-0757.2002.03006.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
99. Амано А. Нарушение эпителиального барьера и нарушение клеточной функции с помощью Porphyromonas gingivalis . Front Biosci. (2007) 12:3965–74. doi: 10.2741/2363
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
100. Mifsud EJ, Tan AC, Jackson DC. Агонисты TLR как модуляторы врожденного иммунного ответа и их потенциал в качестве агентов против инфекционных заболеваний. Фронт Иммунол. (2014) 5:79. doi: 10.3389/fimmu.2014.00079
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
101. Сасаи М., Ямамото М. Рецепторы распознавания патогенов: лиганды и сигнальные пути с помощью толл-подобных рецепторов. Int Rev Immunol. (2013) 32:116–33. дои: 10.3109/08830185.2013.774391
Int Rev Immunol. (2013) 32:116–33. дои: 10.3109/08830185.2013.774391
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
102. Акира С., Сато С. Толл-подобные рецепторы и их сигнальные механизмы. Scand J Infect Dis. (2003) 35:555–62. doi: 10.1080/00365540310015683
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
103. Каваи Т., Акира С. Передача сигналов TLR. Семин Иммунол. (2007) 19:24–32. doi: 10.1016/j.smim.2006.12.004
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
104. Карио Э., Браун Д., Макки М., Линч-Девани К., Геркен Г., Подольский Д.К. Связанные с комменсалами молекулярные паттерны индуцируют селективный транспорт toll-подобных рецепторов от апикальной мембраны к цитоплазматическим компартментам в поляризованном кишечном эпителии. Ам Дж. Патол. (2002) 160:165–73. doi: 10.1016/S0002-9440(10)64360-X
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
105. Zhang D, Zhang G, Hayden MS, Greenblatt MB, Bussey C, Flavell RA, et al. Толл-подобный рецептор, предотвращающий заражение уропатогенными бактериями. Science (2004) 303:1522–6. doi: 10.1126/science.1094351
Zhang D, Zhang G, Hayden MS, Greenblatt MB, Bussey C, Flavell RA, et al. Толл-подобный рецептор, предотвращающий заражение уропатогенными бактериями. Science (2004) 303:1522–6. doi: 10.1126/science.1094351
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
106. Poltorak A, He X, Smirnova I, Liu MY, Van Huffel C, Du X, et al. Дефектная передача сигналов LPS у мышей C3H/HeJ и C57BL/10ScCr: мутации в гене Tlr4. Science (1998) 282:2085–8. doi: 10.1126/science.282.5396.2085
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
107. Takeuchi O, Sato S, Horiuchi T, Hoshino K, Takeda K, Dong Z, et al. Передний край: роль толл-подобного рецептора 1 в опосредовании иммунного ответа на микробные липопротеины. J Иммунол. (2002) 169:10–4. doi: 10.4049/jimmunol.169.1.10
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
108. Алексопулу Л., Холт А.С., Меджитов Р., Флавелл Р. А. Распознавание двухцепочечной РНК и активация NF-kappaB Toll-подобным рецептором 3. Nature (2001) 413:732–8. doi: 10.1038/35099560
А. Распознавание двухцепочечной РНК и активация NF-kappaB Toll-подобным рецептором 3. Nature (2001) 413:732–8. doi: 10.1038/35099560
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
109. Bauer S, Kirschning CJ, Hacker H, Redecke V, Hausmann S, Akira S, et al. TLR9 человекапридает чувствительность к бактериальной ДНК посредством распознавания видоспецифического мотива CpG. Proc Natl Acad Sci USA. (2001) 98:9237–42. doi: 10.1073/pnas.1612
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
110. Hayashi F, Smith KD, Ozinsky A, Hawn TR, Yi EC, Goodlett DR, et al. Врожденный иммунный ответ на бактериальный флагеллин опосредуется Toll-подобным рецептором 5. Nature (2001) 410:1099–103. doi: 10.1038/35074106
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
111. Hemmi H, Kaisho T, Takeuchi O, Sato S, Sanjo H, Hoshino K, et al. Небольшие противовирусные соединения активируют иммунные клетки через TLR7 MyD88-зависимый сигнальный путь. Нат Иммунол. (2002) 3:196–200. doi: 10.1038/ni758
Нат Иммунол. (2002) 3:196–200. doi: 10.1038/ni758
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
112. Hemmi H, Takeuchi O, Kawai T, Kaisho T, Sato S, Sanjo H, et al. Toll-подобный рецептор распознает бактериальную ДНК. Природа (2000) 408:740–5. дои: 10.1038/35047123
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
113. Jurk M, Heil F, Vollmer J, Schetter C, Krieg AM, Wagner H, et al. TLR7 или TLR8 человека независимо друг от друга придают ответ на противовирусное соединение R-848. Нат Иммунол. (2002) 3:499. doi: 10.1038/ni0602-499
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
114. Fitzgerald KA, Palsson-McDermott EM, Bowie AG, Jefferies CA, Mansell AS, Brady G, et al. Mal (подобный адаптеру MyD88) необходим для передачи сигнала Toll-подобного рецептора-4. Природа (2001) 413:78–83. doi: 10.1038/350
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
115. Fitzgerald KA, Rowe DC, Barnes BJ, Caffrey DR, Visintin A, Latz E, et al. Передача сигналов LPS-TLR4 на IRF-3/7 и NF-kappaB включает адаптеры междугородной связи TRAM и TRIF. J Exp Med. (2003) 198:1043–55. doi: 10.1084/jem.20031023
Fitzgerald KA, Rowe DC, Barnes BJ, Caffrey DR, Visintin A, Latz E, et al. Передача сигналов LPS-TLR4 на IRF-3/7 и NF-kappaB включает адаптеры междугородной связи TRAM и TRIF. J Exp Med. (2003) 198:1043–55. doi: 10.1084/jem.20031023
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
116. Хорнг Т., Бартон Г.М., Меджитов Р. TIRAP: молекула-адаптер в сигнальном пути Toll. Нат Иммунол. (2001) 2:835–41. doi: 10.1038/ni0901-835
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
117. Меджитов Р., Престон-Херлбурт П., Копп Э., Стадлен А., Чен С., Гош С. и др. MyD88 представляет собой адапторный белок в сигнальных путях семейства рецепторов hToll/IL-1. Mol Cell (1998) 2:253–8. doi: 10.1016/S1097-2765(00)80136-7
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
118. Oshiumi H, Matsumoto M, Funami K, Akazawa T. Seya T. TICAM-1, адаптерная молекула, которая участвует в опосредованной Toll-подобным рецептором 3 индукции бета-интерферона. Нат Иммунол. (2003) 4:161–7. doi: 10.1038/ni886
Нат Иммунол. (2003) 4:161–7. doi: 10.1038/ni886
CrossRef Full Text
119. Yamamoto M, Sato S, Hemmi H, Hoshino K, Kaisho T, Sanjo H, et al. Роль адаптера TRIF в MyD88-независимом сигнальном пути толл-подобного рецептора. Наука (2003) 301:640–3. doi: 10.1126/science.1087262
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
120. Акира С., Ямамото М., Такеда К. Роль адаптеров в передаче сигналов Toll-подобных рецепторов. Biochem Soc Trans. (2003) 31 (часть 3): 637–42. doi: 10.1042/bst0310637
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
121. Года Дж., Мацумура Т., Иноуэ Дж. Передний край: фактор, ассоциированный с TNFR (TRAF) 6, необходим для MyD88-зависимого пути, но не для рецепторного домена toll/IL-1, содержащего адаптер, индуцирующий IFN-бета. (TRIF)-зависимый путь передачи сигналов TLR. Дж Иммунол. (2004) 173:2913–7. doi: 10.4049/jimmunol.173.5.2913
CrossRef Полный текст | Академия Google
122. Кондо Т., Каваи Т., Акира С. Анализ негативной регуляции передачи сигналов Toll-подобных рецепторов. Тренды Иммунол. (2012) 33:449–58. doi: 10.1016/j.it.2012.05.002
Кондо Т., Каваи Т., Акира С. Анализ негативной регуляции передачи сигналов Toll-подобных рецепторов. Тренды Иммунол. (2012) 33:449–58. doi: 10.1016/j.it.2012.05.002
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
123. Meylan E, Burns K, Hofmann K, Blancheteau V, Martinon F, Kelliher M, et al. RIP1 является важным медиатором активации NF-каппа B, индуцированной Toll-подобным рецептором 3. Нат Иммунол. (2004) 5:503–7. doi: 10.1038/ni1061
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
124. Chen HC, Zhan X, Tran KK, Shen H. Избирательное нацеливание на сигнальный путь толл-подобного рецептора 9 (TLR9)–IRF 7 с помощью частиц полимерной смеси. Биоматериалы (2013) 34:6464–72. doi: 10.1016/j.biomaterials.2013.05.016
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
125. Беклен А., Хукканен М., Ричардсон Р., Конттинен Ю.Т. Иммуногистохимическая локализация Toll-подобных рецепторов 1–10 при пародонтите. Пероральный микробиол иммунол. (2008) 23:425–31. дои: 10.1111/j.1399-302X.2008.00448.x
Пероральный микробиол иммунол. (2008) 23:425–31. дои: 10.1111/j.1399-302X.2008.00448.x
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
126. Semlali A, Witoled C, Alanazi M, Rouabhia M. Дым цельной сигареты увеличивал экспрессию TLR, HBD и провоспалительных цитокинов эпителиальными клетками десны человека посредством различных сигнальных путей. PLoS ONE (2012) 7:e52614. doi: 10.1371/journal.pone.0052614
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
127. Uehara A, Fujimoto Y, Fukase K, Takada H. Различные эпителиальные клетки человека экспрессируют функциональные Toll-подобные рецепторы NOD1 и NOD2 для производства антимикробных пептидов, но не провоспалительных цитокинов. Мол Иммунол. (2007) 44:3100–11. doi: 10.1016/j.molimm.2007.02.007
CrossRef Full Text | Google Scholar
128. Promsudthi A, Poomsawat S, Limsricharoen W. Роль Toll-подобных рецепторов 2 и 4 в тканях десен при хроническом пародонтите у пациентов с диабетом 2 типа. J Пародонтальные рес. (2014) 49:346–54. doi: 10.1111/jre.12112
J Пародонтальные рес. (2014) 49:346–54. doi: 10.1111/jre.12112
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
129. Сугавара Ю., Уэхара А., Фуджимото Ю., Кусумото С., Фукасе К., Сибата К. и др. Толл-подобные рецепторы, NOD1 и NOD2 в эпителиальных клетках полости рта. Дж Дент Рез. (2006) 85:524–9. doi: 10.1177/154405
8500609
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
130. Уэхара А., Сугавара С., Тамаи Р., Такада Х. Контрастные реакции эпителиальных клеток десны и толстой кишки человека на липополисахариды, липотейхоевые кислоты и пептидогликаны в присутствии растворимого CD14. Мед микробиол иммунол. (2001) 189:185–92. doi: 10.1007/s004300100063
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
131. Уэхара А., Сугавара Ю., Курата С., Фудзимото Ю., Фукасе К., Кусумото С. и др. Химически синтезированные патоген-ассоциированные молекулярные паттерны увеличивают экспрессию белков распознавания пептидогликана через толл-подобные рецепторы NOD1 и NOD2 в эпителиальных клетках ротовой полости человека. Клеточная микробиология. (2005) 7: 675–86. doi: 10.1111/j.1462-5822.2004.00500.x
Клеточная микробиология. (2005) 7: 675–86. doi: 10.1111/j.1462-5822.2004.00500.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
132. Shaddox L, Wiedey J, Bimstein E, Magnuson I, Clare-Salzler M, Aukhil I, et al. Гиперреактивный фенотип при локализованном агрессивном пародонтите. Дж Дент Рез. (2010) 89:143–8. doi: 10.1177/00220345097
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
133. Shaddox LM, Mullersman AF, Huang H, Wallet SM, Langaee T, Aukhil I. Эпигенетическая регуляция воспаления при локализованном агрессивном пародонтите. Клин Эпигенетика (2017) 9:94. doi: 10.1186/s13148-017-0385-8
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
134. Jin SH, Guan XY, Liang WH, Bai GH, Liu JG. Полиморфизм TLR4 и предрасположенность к пародонтиту: метаанализ. Медицина (2016) 95:e4845. doi: 10.1097/MD.0000000000004845
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
135. Zhou Q, Wang C, Wang X, Wu X, Zhu Z, Liu B, et al. Связь между полиморфизмами TLR4 (+896A/G и +1196C/T) и риском рака желудка: обновленный метаанализ. PLoS ONE (2014) 9:e109605. doi: 10.1371/journal.pone.0109605
Zhou Q, Wang C, Wang X, Wu X, Zhu Z, Liu B, et al. Связь между полиморфизмами TLR4 (+896A/G и +1196C/T) и риском рака желудка: обновленный метаанализ. PLoS ONE (2014) 9:e109605. doi: 10.1371/journal.pone.0109605
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
136. Саксена М., Ерецян Г. NOD-подобные рецепторы: основные регуляторы воспаления и рака. Фронт Иммунол. (2014) 5:327. doi: 10.3389/fimmu.2014.00327
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
137. Becker CE, O’Neill LA. Инфламмасомы при воспалительных заболеваниях: роль TLR и их взаимодействие с NLR. Семин Иммунопатол. (2007) 29: 239–48. doi: 10.1007/s00281-007-0081-4
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
138. Martinon F, Tschopp J. NLR присоединяются к TLR как врожденные датчики патогенов. Тенденции Иммунол. (2005) 26:447–54. doi: 10.1016/j.it.2005.06.004
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
139. Тинг Дж.П., Кастнер Д.Л., Хоффман Х.М. CATERPILLERS, пирин и наследственные иммунологические нарушения. Nat Rev Immunol. (2006) 6:183–95. doi: 10.1038/nri1788
Тинг Дж.П., Кастнер Д.Л., Хоффман Х.М. CATERPILLERS, пирин и наследственные иммунологические нарушения. Nat Rev Immunol. (2006) 6:183–95. doi: 10.1038/nri1788
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
140. Girardin SE, Boneca IG, Carneiro LA, Antignac A, Jehanno M, Viala J, et al. Nod1 обнаруживает уникальный муропептид из пептидогликана грамотрицательных бактерий. Наука (2003) 300:1584–7. doi: 10.1126/science.1084677
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
141. Инохара Н., Огура Ю., Фонтальба А., Гутьеррес О., Понс Ф., Креспо Дж. и др. Распознавание хозяином бактериального мурамилдипептида опосредовано NOD2. Последствия болезни Крона. J Biol Chem. (2003) 278:5509–12. doi: 10.1074/jbc.C200673200
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
142. Chamaillard M, Hashimoto M, Horie Y, Masumoto J, Qiu S, Saab L, et al. Существенная роль NOD1 в распознавании хозяином бактериального пептидогликана, содержащего диаминопимелиновую кислоту. Нат Иммунол. (2003) 4:702–7. doi: 10.1038/ni945
Нат Иммунол. (2003) 4:702–7. doi: 10.1038/ni945
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
143. Инохара С., Макдональд С., Нуньес Г. Белки NOD-LRR: роль во взаимодействиях хозяин-микроб и воспалительных заболеваниях. Annu Rev Biochem. (2005) 74:355–83. doi: 10.1146/annurev.biochem.74.082803.133347
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
144. Стробер В., Мюррей П.Дж., Китани А., Ватанабе Т. Сигнальные пути и молекулярные взаимодействия NOD1 и NOD2. Nat Rev Immunol. (2006) 6:9–20. doi: 10.1038/nri1747
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
145. Уэхара А., Такада Х. Синергизм между TLR и NOD1/2 в эпителиальных клетках полости рта. Дж Дент Рез. (2008) 87:682–6. doi: 10.1177/154405
8700709
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
146. Hirao K, Yumoto H, Takahashi K, Mukai K, Nakanishi T, Matsuo T. Роль TLR2, TLR4, NOD2 и NOD1 в фибробластах пульпы. Дж Дент Рез. (2009) 88:762–7. doi: 10.1177/00220345079
Роль TLR2, TLR4, NOD2 и NOD1 в фибробластах пульпы. Дж Дент Рез. (2009) 88:762–7. doi: 10.1177/00220345079
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
147. Lee YY, Chan CH, Hung SL, Chen YC, Lee YH, Yang SF. Активация нуклеотид-связывающего домена олигомеризации 1 в воспаленной пульпе зуба человека. Дж Эндод. (2011) 37:1370–5. doi: 10.1016/j.joen.2011.06.008
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
148. Zhou S, Yu P, Guan L, Xing A, Liu S, Xiong Q, et al. Экспрессия NOD1, вызванная iE-DAP в клетках трофобласта человека в первом триместре, и ее потенциальная роль в воспалении, связанном с инфекцией. Eur J Obstet Gynecol Reprod Biol. (2013) 170:318–23. doi: 10.1016/j.ejogrb.2013.04.011
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
149. Gao Y, Jiang W, Qian Y, Zhou Q, Jiang H, Wang X и др. Агонист NOD1 iE-DAP нейтрализует действие экстракта сигаретного дыма на сигнальный путь NOD1 в эпителиальных клетках слизистой оболочки полости рта человека. Int J Clin Exp Med. (2015) 8:12519–28.
Int J Clin Exp Med. (2015) 8:12519–28.
Реферат PubMed | Google Scholar
150. Гизелер Ф., Унгефрорен Х., Сеттмахер У., Холленберг М.Д., Кауфманн Р. Протеиназоактивируемые рецепторы (PAR) – основное внимание уделяется взаимодействиям между рецепторами и их физиологическому и патофизиологическому воздействию. Сигнал сотовой связи. (2013) 11:86. doi: 10.1186/1478-811X-11-86
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
151. Баннетт Н.В. Рецепторы, активируемые протеазами: как протеазы сигнализируют клеткам, вызывая воспаление и боль. Семин Тромб Гемост. (2006) 32 (Приложение 1): 39–48. doi: 10.1055/s-2006-3
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
152. Knecht W, Cottrell GS, Amadesi S, Mohlin J, Skaregarde A, Gedda K, et al. Трипсин IV или мезотрипсин и p23 расщепляют активируемые протеазой рецепторы 1 и 2, вызывая воспаление и гипералгезию. J Biol Chem. (2007) 282:26089–100. doi: 10.1074/jbc.M703840200
doi: 10.1074/jbc.M703840200
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
153. Лурбакос А., Чинни С., Томпсон П., Потемпа Дж., Трэвис Дж., Маки Э.Дж. и др. Расщепление и активация активируемого протеиназой рецептора-2 на нейтрофилах человека с помощью гингипаина-R из Porphyromonas gingivalis . ФЭБС Письмо. (1998) 435:45–8. doi: 10.1016/S0014-5793(98)01036-9
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
154. Coughlin SR, Camerer E. Участие в воспалении. Дж Клин Инвест. (2003) 111:25–7. doi: 10.1172/JCI17564
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
155. Камерер Э., Хуанг В., Кафлин С.Р. Зависимая от тканевого фактора и фактора X активация активируемого протеазой рецептора 2 фактором VIIa. Proc Natl Acad Sci USA. (2000) 97:5255–60. doi: 10.1073/pnas.97.10.5255
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
156. Коттрелл Г.С., Амадези С., Грейди Э.Ф., Баннетт Н.В. Трипсин IV, новый агонист рецепторов 2 и 4, активируемых протеазами. J Biol Chem. (2004) 279:13532–9. doi: 10.1074/jbc.M3120
Коттрелл Г.С., Амадези С., Грейди Э.Ф., Баннетт Н.В. Трипсин IV, новый агонист рецепторов 2 и 4, активируемых протеазами. J Biol Chem. (2004) 279:13532–9. doi: 10.1074/jbc.M3120
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
157. Ishihara H, Connolly AJ, Zeng D, Kahn ML, Zheng YW, Timmons C, et al. Активируемый протеазой рецептор 3 является вторым рецептором тромбина у человека. Природа (1997) 386:502–6. дои: 10.1038/386502a0
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
158. Sambrano GR, Huang W, Faruqi T, Mahrus S, Craik C, Coughlin SR. Катепсин G активирует активируемый протеазой рецептор-4 в тромбоцитах человека. J Biol Chem. (2000) 275:6819–23. doi: 10.1074/jbc.275.10.6819
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
159. Zhang D, Li S, Hu L, Sheng L, Chen L. Модуляция экспрессии рецептора, активируемого протеазой, с помощью Porphyromonas gingivalis в эпителиальных клетках десны человека. BMC Oral Health (2015) 15:128. doi: 10.1186/s12903-015-0105-8
BMC Oral Health (2015) 15:128. doi: 10.1186/s12903-015-0105-8
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
160. Chung WO, An JY, Yin L, Hacker BM, Rohani MG, Dommisch H, et al. Взаимодействие рецепторов, активируемых протеазой, и рецепторов распознавания образов NOD в эпителиальных врожденных иммунных реакциях на бактерии. Иммунол Летт. (2010) 131:113–9. doi: 10.1016/j.imlet.2010.02.006
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
161. Скелдон А., Салех М. Инфламмасомы: молекулярные эффекторы устойчивости хозяина к бактериальным, вирусным, паразитарным и грибковым инфекциям. Фронт микробиол. (2011) 2:15. doi: 10.3389/fmicb.2011.00015
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
162. Мартинон Ф., Бернс К., Чопп Дж. Инфламмасома: молекулярная платформа, запускающая активацию воспалительных каспаз и процессинг proIL-бета. Mol Cell (2002) 10:417–26. дои: 10.1016/S1097-2765(02)00599-3
дои: 10.1016/S1097-2765(02)00599-3
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
163. Саид-Садьер Н., Ойциус Д.М. Алармины, инфламмасомы и иммунитет. Biomed J. (2012) 35:437–49. doi: 10.4103/2319-4170.104408
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
164. Шредер К., Чопп Дж. Инфламмасомы. Cell (2010) 140:821–32. doi: 10.1016/j.cell.2010.01.040
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
165. Йылмаз О, Ли К.Л. Инфламмасома и сигнализация молекулы опасности: на перекрестке воспаления и персистенции возбудителя в полости рта. Пародонтология (2015) 69:83–95. doi: 10.1111/prd.12084
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
166. Akhter A, Caution K, Abu Khweek A, Tazi M, Abdulrahman BA, Abdelaziz DH, et al. Каспаза-11 способствует слиянию фагосом, содержащих патогенные бактерии, с лизосомами путем модулирования полимеризации актина. Иммунитет (2012) 37:35–47. doi: 10.1016/j.immuni.2012.05.001
Иммунитет (2012) 37:35–47. doi: 10.1016/j.immuni.2012.05.001
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
167. Ван де Вердонк Ф.Л., Нетеа М.Г., Динарелло К.А., Йостен Л.А. Активация воспаления и процессинг IL-1beta и IL-18 во время инфекции. Тренды Иммунол. (2011) 32:110–6. doi: 10.1016/j.it.2011.01.003
CrossRef Полный текст | Google Scholar
168. Bui FQ, Johnson L, Roberts J, Hung SC, Lee J, Atanasova KR, et al. 9Инфицирование эпителиальных клеток десны 0005 Fusobacterium nucleatum приводит к NLRP3-инфламмасомозависимой секреции IL-1бета и сигналам опасности ASC и HMGB1. Клеточная микробиология. (2016) 18:970–81. doi: 10.1111/cmi.12560
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
169. Johnson L, Atanasova KR, Bui PQ, Lee J, Hung SC, Yilmaz O, et al. Porphyromonas gingivalis ослабляет АТФ-опосредованную активацию воспаления и высвобождение HMGB1 посредством экспрессии нуклеозид-дифосфаткиназы. Заражение микробами. (2015) 17:369–77. doi: 10.1016/j.micinf.2015.03.010
Заражение микробами. (2015) 17:369–77. doi: 10.1016/j.micinf.2015.03.010
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
170. Кри Э.М. Каспазные перекрестные помехи: интеграция сигнальных путей апоптоза и врожденного иммунитета. Тренды Иммунол. (2014) 35:631–40. doi: 10.1016/j.it.2014.10.004
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
171. Элдридж М.Дж., Шеной А.Р. Антимикробные инфламмасомы: единая передача сигналов против различных бактериальных патогенов. Curr Opin Microbiol. (2015) 23:32–41. doi: 10.1016/j.mib.2014.10.008
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
172. Bauernfeind F, Ablasser A, Bartok E, Kim S, Schmid-Burgk J, Cavlar T, et al. Инфламмасомы: текущее понимание и открытые вопросы. Cell Mol Life Sci. (2011) 68:765–83. doi: 10.1007/s00018-010-0567-4
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
173. Ferrari D, Pizzirani C, Adinolfi E, Lemoli RM, Curti A, Idzko M, et al. Рецептор P2X7: ключевой игрок в процессинге и высвобождении IL-1. J Иммунол. (2006) 176:3877–83. doi: 10.4049/jimmunol.176.7.3877
Ferrari D, Pizzirani C, Adinolfi E, Lemoli RM, Curti A, Idzko M, et al. Рецептор P2X7: ключевой игрок в процессинге и высвобождении IL-1. J Иммунол. (2006) 176:3877–83. doi: 10.4049/jimmunol.176.7.3877
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
174. Michaud M, Martins I, Sukkurwala AQ, Adjemian S, Ma Y, Pellegatti P, et al. Зависимые от аутофагии противораковые иммунные ответы, индуцированные химиотерапевтическими агентами у мышей. Наука (2011) 334:1573–7. doi: 10.1126/science.1208347
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
175. Perregaux DG, McNiff P, Laliberte R, Conklyn M, Gabel CA. АТФ действует как агонист, стимулирующий индуцированную стимулом секрецию IL-1 бета и IL-18 в крови человека. J Иммунол. (2000) 165:4615–23. doi: 10.4049/jimmunol.165.8.4615
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
176. Sanz JM, Di Virgilio F. Кинетика и механизм АТФ-зависимого высвобождения IL-1 бета из клеток микроглии. Дж Иммунол. (2000) 164:4893–8.
Дж Иммунол. (2000) 164:4893–8.
Реферат PubMed | Google Scholar
177. Йилмаз О., Сатер А.А., Яо Л., Кутузис Т., Петтенгилл М., Ойциус Д.М. АТФ-зависимая активация инфламмасомы в первичных эпителиальных клетках десны, инфицированных Порфиромонас десневой . Клеточная микробиология. (2010) 12:188–98. doi: 10.1111/j.1462-5822.2009.01390.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
178. Lee SJ, Choi BK. Участие NLRP10 в индукции IL-1альфа клеток эпителия полости рта пародонтальными патогенами. Врожденный иммунитет. (2017) 23:569–77. doi: 10.1177/1753425
2610
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
179. Belibasakis GN, Thurnheer T, Bostanci N. Интерлейкин-8 ответы многослойного десневого эпителия на поддесневые биопленки: роль видов «красного комплекса». PLoS ONE (2013) 8:e81581. doi: 10.1371/journal.pone.0081581
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
180. Bostanci N, Bao K, Wahlander A, Grossmann J, Thurnheer T, Belibasakis GN. Секретом десневого эпителия в ответ на поддесневые биопленки. моль Оральный микробиол. (2015) 30:323–35. doi: 10.1111/omi.12096
Bostanci N, Bao K, Wahlander A, Grossmann J, Thurnheer T, Belibasakis GN. Секретом десневого эпителия в ответ на поддесневые биопленки. моль Оральный микробиол. (2015) 30:323–35. doi: 10.1111/omi.12096
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
181. Feliciani C, Gupta AK, Sauder DN. Кератиноциты и цитокины/факторы роста. Crit Rev Oral Biol Med. (1996) 7:300–18. doi: 10.1177/10454411960070040101
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
182. Динарелло, Калифорния. Семейство IL-1 и воспалительные заболевания. Clin Exp Ревматол. (2002) 20 (5 Приложение 27): S1–13.
Реферат PubMed | Google Scholar
183. Ramage G, Lappin DF, Millhouse E, Malcolm J, Jose A, Yang J, et al. Реакция эпителиальных клеток на модели ротовой биопленки, связанные со здоровьем и болезнями. J Периодонтальная рез. (2017) 52:325–33. doi: 10.1111/jre.12395
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
184. Кэмпбелл Л.М., Максвелл П.Дж., Во Д.Дж. Обоснование и средства для нацеливания на передачу сигналов провоспалительного интерлейкина-8 (CXCL8) при раке. Pharmaceuticals (2013) 6:929–59. doi: 10.3390/ph6080929
Кэмпбелл Л.М., Максвелл П.Дж., Во Д.Дж. Обоснование и средства для нацеливания на передачу сигналов провоспалительного интерлейкина-8 (CXCL8) при раке. Pharmaceuticals (2013) 6:929–59. doi: 10.3390/ph6080929
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
185. St John MA, Li Y, Zhou X, Denny P, Ho CM, Montemagno C, et al. Интерлейкин 6 и интерлейкин 8 как потенциальные биомаркеры плоскоклеточного рака полости рта и ротоглотки. Арка Отоларингол Голова Шеи Хирург. (2004) 130:929–35. doi: 10.1001/archotol.130.8.929
CrossRef Полный текст | Google Scholar
186. Goutoudi P, Diza E, Arvanitidou M. Влияние периодонтальной терапии на уровни интерлейкина-6 и интерлейкина-8 в десневой жидкости при хроническом пародонтите. Int J Dent. (2012) 2012:362905. doi: 10.1155/2012/362905
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
187. Schueller K, Riva A, Pfeiffer S, Berry D, Somoza V. Члены микробиоты полости рта связаны с высвобождением IL-8 эпителиальными клетками десен у здоровых людей. Фронт микробиол. (2017) 8:416. doi: 10.3389/fmicb.2017.00416
Члены микробиоты полости рта связаны с высвобождением IL-8 эпителиальными клетками десен у здоровых людей. Фронт микробиол. (2017) 8:416. doi: 10.3389/fmicb.2017.00416
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
188. Fujimura Y, Hotokezaka H, Ohara N, Naito M, Sakai E, Yoshimura M, et al. Белок рецептора гемоглобина porphyromonas gingivalis ингибирует индуцируемый лигандом рецептора NF-kappaB остеокластогенез из макрофагов костного мозга. Заразить иммунн. (2006) 74:2544–51. doi: 10.1128/IAI.74.5.2544-2551.2006
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
189. Fujita Y, Nakayama M, Naito M, Yamachika E, Inoue T, Nakayama K, et al. Белок рецептора гемоглобина из Porphyromonas gingivalis индуцирует выработку интерлейкина-8 в эпителиальных клетках десны человека посредством стимуляции путей передачи сигнала митоген-активируемой протеинкиназы и NF-kappaB. Заразить иммунн. (2014) 82:202–11. doi: 10.1128/IAI.01140-12
doi: 10.1128/IAI.01140-12
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
190. Moussion C, Ortega N, Girard JP. IL-1-подобный цитокин IL-33 конститутивно экспрессируется в ядрах эндотелиальных и эпителиальных клеток in vivo : роман «Алармин»? PLoS ONE (2008) 3:e3331. doi: 10.1371/journal.pone.0003331
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
191. Paul WE, Zhu J. Как инициируются и усиливаются иммунные реакции типа T(H)2? Nat Rev Immunol. (2010) 10: 225–35. doi: 10.1038/nri2735
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
192. Tada H, Matsuyama T, Nishioka T, Hagiwara M, Kiyoura Y, Shimauchi H, et al. Porphyromonas gingivalis гингипаин зависимо увеличивает продукцию IL-33 в эпителиальных клетках десны человека. PLoS ONE (2016) 11:e0152794. doi: 10.1371/journal.pone.0152794
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
193. Kadomatsu T, Endo M, Miyata K, Oike Y. Различные роли ANGPTL2 в физиологии и патофизиологии. Тренды Эндокринол Метаб. (2014) 25:245–54. doi: 10.1016/j.tem.2014.03.012
Kadomatsu T, Endo M, Miyata K, Oike Y. Различные роли ANGPTL2 в физиологии и патофизиологии. Тренды Эндокринол Метаб. (2014) 25:245–54. doi: 10.1016/j.tem.2014.03.012
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
194. Kim I, Moon SO, Koh KN, Kim H, Uhm CS, Kwak HJ, et al. Молекулярное клонирование, экспрессия и характеристика родственного ангиопоэтину белка. родственный ангиопоэтину белок индуцирует прорастание эндотелиальных клеток. J Biol Chem. (1999) 274:26523–8. doi: 10.1074/jbc.274.37.26523
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
195. Сантулли Г. Ангиопоэтиноподобные белки: всесторонний взгляд. Передний эндокринол. (2014) 5:4. дои: 10.3389/fendo.2014.00004
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
196. Kubota Y, Oike Y, Satoh S, Tabata Y, Niikura Y, Morisada T, et al. Кооперативное взаимодействие ангиопоэтиноподобных белков 1 и 2 в развитии сосудов рыбок данио. Proc Natl Acad Sci USA. (2005) 102:13502–7. doi: 10.1073/pnas.05012
Proc Natl Acad Sci USA. (2005) 102:13502–7. doi: 10.1073/pnas.05012
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
197. Оно Т., Ямамото Г., Хаяши Д.И., Нисида Э., Гото Х., Сасаки Ю. и др. Ангиопоэтиноподобный белок 2 регулирует Porphyromonas gingivalis Липополисахарид-индуцированная воспалительная реакция в эпителиальных клетках десны человека. PLoS ONE (2017) 12:e0184825. doi: 10.1371/journal.pone.0184825
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
198. Imai H, Fujita T, Kajiya M, Ouhara K, Yoshimoto T, Matsuda S, et al. Мобилизация TLR4 в липидные рафты с помощью aggregatibacter actinomycetemcomitans в эпителиальных клетках десны. Cell Physiol Biochem. (2016) 39: 1777–86. doi: 10.1159/000447877
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
199. Armitage GC. Сравнение микробиологических особенностей хронического и агрессивного пародонтита. Пародонтология (2010) 53:70–88. doi: 10.1111/j.1600-0757.2010.00357.x
Пародонтология (2010) 53:70–88. doi: 10.1111/j.1600-0757.2010.00357.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
200. Darveau RP. Пародонтит: полимикробное нарушение гомеостаза хозяина. Nat Rev Microbiol. (2010) 8: 481–90. doi: 10.1038/nrmicro2337
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
201. Таубман М.А., Вальверде П., Хан Х., Каваи Т. Иммунный ответ: ключ к резорбции кости при заболеваниях пародонта. J Пародонтология. (2005) 76 (11 Приложение): 2033–41. doi: 10.1902/jop.2005.76.11-S.2033
CrossRef Full Text | Google Scholar
202. Lally ET, Golub EE, Kieba IR, Taichman NS, Rosenbloom J, Rosenbloom JC, et al. Анализ Actinobacillus actinomycetemcomitans ген лейкотоксина. Описание уникальных особенностей и сравнение с гомологичными токсинами. J Biol Chem. (1989) 264:15451–6.
Реферат PubMed | Google Scholar
203. Mayer MP, Bueno LC, Hansen EJ, DiRienzo JM. Идентификация локуса гена цитолетального растягивающего токсина и особенностей области, ассоциированной с вирулентностью, в Actinobacillus actinomycetemcomitans . Заразить иммунн. (1999) 67:1227–37.
Идентификация локуса гена цитолетального растягивающего токсина и особенностей области, ассоциированной с вирулентностью, в Actinobacillus actinomycetemcomitans . Заразить иммунн. (1999) 67:1227–37.
Реферат PubMed | Академия Google
204. Feng Z, Weinberg A. Роль бактерий в здоровье и заболеваниях тканей пародонта. Пародонтология (2006) 40:50–76. doi: 10.1111/j.1600-0757.2005.00148.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
205. Pahumunto N, Chotjumlong P, Makeudom A, Krisanaprakornkit S, Dahlen G, Teanpaisan R. Провоспалительные цитокиновые ответы в эпителиальных клетках десны человека после стимуляции экстрактом клеточной стенки Aggregatibacter actinomycetemcomitans подтипов. Анаэробы (2017) 48:103–9. doi: 10.1016/j.anaerobe.2017.08.001
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
206. Саймонсон Л.Г., Гудман Ч., Биал Дж.Дж., Мортон Х.Э. Количественная взаимосвязь Treponema denticola с тяжестью пародонтита. Заразить иммунн. (1988) 56:726–8.
Заразить иммунн. (1988) 56:726–8.
Реферат PubMed | Google Scholar
207. Сокрански С.С., Хаффаджи А.Д., Куджини М.А., Смит С., Кент Р.Л. Младший. Микробные комплексы в поддесневом налете. J Clin Пародонтология. (1998) 25:134–44.
Реферат PubMed | Google Scholar
208. Dashper SG, Seers CA, Tan KH, Reynolds EC. Факторы вирулентности оральной спирохеты Treponema denticola . Дж Дент Рез. (2011) 90:691–703. doi: 10.1177/0022034510385242
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
209. Brissette CA, Pham TT, Coats SR, Darveau RP, Lukehart SA. Treponema denticola не индуцирует продукцию общих медиаторов врожденного иммунитета из первичных эпителиальных клеток десны. Оральный микробиол иммунол. (2008) 23:474–81. doi: 10.1111/j.1399-302X.2008.00452.x
Полный текст CrossRef | Google Scholar
210. Jo AR, Baek KJ, Shin JE, Choi Y. Механизмы подавления IL-8 Treponema denticola в эпителиальных клетках десны. Immunol Cell Biol. (2014) 92:139–47. doi: 10.1038/icb.2013.80
Immunol Cell Biol. (2014) 92:139–47. doi: 10.1038/icb.2013.80
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
211. Ruby J, Martin M, Passineau MJ, Godovikova V, Fenno JC, Wu H. Активация врожденной иммунной системы с помощью Treponema denticola периплазматические жгутики через толл-подобный рецептор 2. Infect Immun. (2018) 86: e00573–17. doi: 10.1128/IAI.00251-18
CrossRef Full Text | Google Scholar
212. Gu C, Wu L, Li X. Семейство IL-17: цитокины, рецепторы и передача сигналов. Цитокин (2013) 64:477–85. doi: 10.1016/j.cyto.2013.07.022
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
213. Yao Z, Painter SL, Fanslow WC, Ulrich D, Macduff BM, Spriggs MK, et al. IL-17 человека: новый цитокин, полученный из Т-клеток. J Иммунол. (1995) 155:5483–6.
Реферат PubMed | Google Scholar
214. Adibrad M, Deyhimi P, Ganjalikhani Hakemi M, Behfarnia P, Shahabuei M, Rafie L. Признаки присутствия клеток Th27 при хроническом заболевании пародонта. J Пародонтальные рес. (2012) 47:525–31. doi: 10.1111/j.1600-0765.2011.01464.x
Признаки присутствия клеток Th27 при хроническом заболевании пародонта. J Пародонтальные рес. (2012) 47:525–31. doi: 10.1111/j.1600-0765.2011.01464.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
215. Беклен А., Айнола М., Хукканен М., Гурган С., Сорса Т., Конттинен Ю.Т. ММП, ИЛ-1 и ФНО регулируются ИЛ-17 при пародонтите. Дж Дент Рез. (2007) 86:347–51. doi: 10.1177/1544058600409
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
216. Cardoso CR, Garlet GP, Crippa GE, Rosa AL, Junior WM, Rossi MA, et al. Доказательства наличия клеток Т-хелперов 17 типа при хронических поражениях пародонтоза человека. Пероральный микробиол иммунол. (2009) 24:1–6. doi: 10.1111/j.1399-302X.2008.00463.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
217. Konermann A, Beyer M, Deschner J, Allam JP, Novak N, Winter J, et al. Клетки периодонтальной связки человека облегчают рекрутирование лейкоцитов, и на их иммуномодулирующую функцию влияет высвобождение цитокина Th27. Клеточный иммунол. (2012) 272:137–43. doi: 10.1016/j.cellimm.2011.10.020
Клеточный иммунол. (2012) 272:137–43. doi: 10.1016/j.cellimm.2011.10.020
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
218. Allam JP, Duan Y, Heinemann F, Winter J, Gotz W, Deschner J, et al. IL-23-продуцирующие CD68(+) макрофагоподобные клетки преобладают в IL-17-поляризованном инфильтрате при поражениях хронического периодонтита. J Клиника пародонтологии. (2011) 38:879–86. doi: 10.1111/j.1600-051X.2011.01752.x
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
219. Buduneli N, Buduneli E, Kutukculer N. Уровни интерлейкина-17, RANKL и остеопротегерина в жидкости десневой борозды у курящих и некурящих пациентов с хроническим пародонтитом во время начального пародонтологического лечения. J Пародонтология. (2009) 80:1274–80. doi: 10.1902/jop.2009.0
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
220. Vernal R, Dutzan N, Chaparro A, Puente J, Antonieta Valenzuela M, Gamonal J. Уровни интерлейкина-17 в жидкости десневой борозды и в супернатантах клеточных культур ткани десны у пациентов с хроническим пародонтитом. J Clin Пародонтология. (2005) 32:383–9. doi: 10.1111/j.1600-051X.2005.00684.x
Уровни интерлейкина-17 в жидкости десневой борозды и в супернатантах клеточных культур ткани десны у пациентов с хроническим пародонтитом. J Clin Пародонтология. (2005) 32:383–9. doi: 10.1111/j.1600-051X.2005.00684.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
221. Awang RA, Lappin DF, MacPherson A, Riggio M, Robertson D, Hodge P, et al. Клинические ассоциации между цитокинами семейства IL-17 и пародонтитом и потенциальные дифференциальные роли IL-17A и IL-17E в пародонтальном иммунитете. Воспаление Res. (2014) 63:1001–12. doi: 10.1007/s00011-014-0776-7
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
222. Лемке Г., Ротлин К.В. Иммунобиология рецепторов ТАМ. Nat Rev Immunol. (2008) 8:327–36. doi: 10.1038/nri2303
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
223. Лемке Г., Берстин-Коэн Т. Рецепторы ТАМ и клиренс апоптотических клеток. Ann NY Acad Sci. (2010) 1209:23–9. doi: 10.1111/j.1749-6632.2010.05744.x
(2010) 1209:23–9. doi: 10.1111/j.1749-6632.2010.05744.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
224. Nassar M, Tabib Y, Capucha T, Mizraji G, Nir T, Pevsner-Fischer M, et al. GAS6 является ключевым гомеостатическим иммунологическим регулятором взаимодействий хозяина и комменсала в слизистой оболочке полости рта. Proc Natl Acad Sci USA. (2017) 114:E337–46. doi: 10.1073/pnas.16144
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
225. Nassar M, Tabib Y, Capucha T, Mizraji G, Nir T, Saba F, et al. Множественные регуляторные уровни специфичного для остановки роста 6 в иммунитете слизистых оболочек против орального патогена. Фронт Иммунол. (2018) 9:1374. doi: 10.3389/fimmu.2018.01374
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
226. Tezal M, Sullivan MA, Reid ME, Marshall JR, Hyland A, Loree T, et al. Хронический пародонтит и риск рака языка. Арка Отоларингол Голова Шеи Хирург. (2007) 133:450–4. doi: 10.1001/archotol.133.5.450
(2007) 133:450–4. doi: 10.1001/archotol.133.5.450
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
227. Тезал М., Гросси С.Г., Дженко Р.Дж. Связан ли пародонтит с новообразованиями полости рта? J Пародонтология. (2005) 76:406–10. doi: 10.1902/jop.2005.76.3.406
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
228. Dong H, Strome SE, Salomao DR, Tamura H, Hirano F, Flies DB, et al. Связанный с опухолью B7-h2 способствует апоптозу Т-клеток: потенциальный механизм уклонения от иммунитета. Нац. мед. (2002) 8:793–800. doi: 10.1038/nm730
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
229. Wu P, Wu D, Li L, Chai Y, Huang J. PD-L1 и выживаемость при солидных опухолях: метаанализ. PLoS ONE (2015) 10:e0131403. doi: 10.1371/journal.pone.0131403
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
230. Siegel R, Naishadham D, Jemal A. Статистика рака, 2013. CA Cancer J Clin. (2013) 63:11–30. doi: 10.3322/caac.21166
Статистика рака, 2013. CA Cancer J Clin. (2013) 63:11–30. doi: 10.3322/caac.21166
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
231. Гривенников С.И., Гретен Ф.Р., Карин М. Иммунитет, воспаление и рак. Cell (2010) 140:883–99. doi: 10.1016/j.cell.2010.01.025
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
232. Dong H, Zhu G, Tamada K, Chen L. B7-h2, третий представитель семейства B7, ко-стимулирует пролиферацию Т-клеток и секрецию интерлейкина-10. Нац. мед. (1999) 5:1365–9. дои: 10.1038/70932
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
233. Freeman GJ, Long AJ, Iwai Y, Bourque K, Chernova T, Nishimura H, et al. Взаимодействие с иммуноингибиторным рецептором PD-1 новым членом семейства B7 приводит к негативной регуляции активации лимфоцитов. J Exp Med. (2000) 192:1027–34. doi: 10.1084/jem.192.7.1027
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
234. Ван С., Чен Л. Ко-сигнальные пути Т-лимфоцитов семейства B7-CD28. Cell Mol Immunol. (2004) 1:37–42.
Ван С., Чен Л. Ко-сигнальные пути Т-лимфоцитов семейства B7-CD28. Cell Mol Immunol. (2004) 1:37–42.
Реферат PubMed | Google Scholar
235. Subudhi SK, Zhou P, Yerian LM, Chin RK, Lo JC, Anders RA, et al. Локальная экспрессия B7-h2 способствует органоспецифическому аутоиммунитету и отторжению трансплантата. Дж Клин Инвест. (2004) 113: 694–700. doi: 10.1172/JCI19210
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
236. Azuma T, Yao S, Zhu G, Flies AS, Flies SJ, Chen L. B7-h2 является вездесущим антиапоптотическим рецептором раковых клеток. Кровь (2008) 111:3635–43. doi: 10.1182/blood-2007-11-123141
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
237. Duraiswamy J, Kaluza KM, Freeman GJ, Coukos G. Двойная блокада PD-1 и CTLA-4 в сочетании с противоопухолевой вакциной эффективно восстанавливает функцию отторжения Т-клеток в опухолях. Рак Рез. (2013) 73:3591–603. doi: 10. 1158/0008-5472.CAN-12-4100
1158/0008-5472.CAN-12-4100
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
238. Groeger S, Domann E, Gonzales JR, Chakraborty T, Meyle J. Рецепторы B7-h2 и B7-DC клеток плоскоклеточной карциномы полости рта активируются Порфиромонас десневой . Иммунобиология (2011) 216:1302–10. doi: 10.1016/j.imbio.2011.05.005
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
239. Hirai M, Kitahara H, Kobayashi Y, Kato K, Bou-Gharios G, Nakamura H, et al. Регуляция экспрессии PD-L1 в микроокружении высокозлокачественной инвазивной плоскоклеточной карциномы полости рта человека. Int J Oncol. (2017) 50:41–8. doi: 10.3892/ijo.2016.3785
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
240. Groeger S, Howaldt HP, Raifer H, Gattenloehner S, Chakraborty T, Meyle J. Клетки плоскоклеточной карциномы полости рта экспрессируют рецепторы B7-h2 и B7-DC in vivo . Патол Онкол Рез. (2017) 23:99–110. doi: 10.1007/s12253-016-0100-7
(2017) 23:99–110. doi: 10.1007/s12253-016-0100-7
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
241. Groeger S, Jarzina F, Mamat U, Meyle J. Индукция рецептора B7-h2 фракциями бактериальных клеток Porphyromonas gingivalis на эпителиальных клетках ротовой полости человека. Иммунобиология (2017) 222:137–147. doi: 10.1016/j.imbio.2016.10.011
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
242. Groeger S, Jarzina F, Domann E, Meyle J. Porphyromonas gingivalis активирует пути NFkappaB и MAPK в эпителиальных клетках полости рта человека. ВМС Иммунол. (2017) 18:1. doi: 10.1186/s12865-016-0185-5
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
243. Li S, Lee YC, Li Q, Chen CJ, Hsu WL, Lou PJ и другие. Поражения полости рта, хронические заболевания и риск рака головы и шеи. Оральная онкология. (2015) 51:1082–7. doi: 10.1016/j.oraloncology.2015. 10.014
10.014
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
244. Komiya Y, Shimomura Y, Higurashi T, Sugi Y, Arimoto J, Umezawa S, et al. Пациенты с колоректальным раком имеют идентичные штаммы Fusobacterium nucleatum при колоректальном раке и полости рта. Гут (2018). doi: 10.1136/gutjnl-2018-316661. [Epub перед печатью].
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
245. Hoppe T, Kraus D, Novak N, Probstmeier R, Frentzen M, Wenghoefer M, et al. Оральные патогены изменяют свойства пролиферации опухолевых клеток полости рта, влияя на экспрессию генов дефенсинов человека. Тумор Биол. (2016) 37:13789–98. doi: 10.1007/s13277-016-5281-x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
246. Geng F, Liu J, Guo Y, Li C, Wang H, Wang H, et al. Постоянное воздействие Porphyromonas gingivalis способствует пролиферативным и инвазионным способностям, а также туморогенным свойствам иммортализованных эпителиальных клеток ротовой полости человека. Front Cell Infect Microbiol. (2017) 7:57. doi: 10.3389/fcimb.2017.00057
Front Cell Infect Microbiol. (2017) 7:57. doi: 10.3389/fcimb.2017.00057
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
247. Биндер Галлимиди А., Фишман С., Ревач Б., Бульвик Р., Малютина А., Рубинштейн А.М. и др. Пародонтальные патогены Porphyromonas gingivalis и Fusobacterium nucleatum способствуют прогрессированию опухоли в модели химического канцерогенеза, специфичного для ротовой полости. Oncotarget (2015) 6:22613–23. doi: 10.18632/oncotarget.4209
Полнотекстовая перекрестная ссылка | Google Scholar
248. Bolos V, Peinado H, Perez-Moreno MA, Fraga MF, Esteller M, Cano A. Фактор транскрипции Slug подавляет экспрессию E-кадгерина и индуцирует эпителиально-мезенхимальные переходы: сравнение с репрессорами Snail и E47. J Cell Sci. (2003) 116 (часть 3): 499–511. doi: 10.1242/jcs.00224
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
249. Ли Дж., Робертс Дж. С., Атанасова К.Р., Чоудхури Н., Хан К., Йилмаз О. Первичные эпителиальные клетки человека приобретают фенотип эпителиально-мезенхимального перехода во время длительного инфицирования условно-патогенным микроорганизмом полости рта, Порфиромонас десневой . Front Cell Infect Microbiol. (2017) 7:493. doi: 10.3389/fcimb.2017.00493
С., Атанасова К.Р., Чоудхури Н., Хан К., Йилмаз О. Первичные эпителиальные клетки человека приобретают фенотип эпителиально-мезенхимального перехода во время длительного инфицирования условно-патогенным микроорганизмом полости рта, Порфиромонас десневой . Front Cell Infect Microbiol. (2017) 7:493. doi: 10.3389/fcimb.2017.00493
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
250. Абдулкарим А.А., Шелтон Р.М., Ландини Г., Купер П.Р., Милворд М.Р. Потенциальная роль пародонтальных патогенов в нарушении функции эпителиального барьера путем индукции эпителиально-мезенхимального перехода. J Пародонтальные рес. (2018) 53:565–74. doi: 10.1111/jre.12546
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
251. Meyle J, Chapple I. Молекулярные аспекты патогенеза периодонтита. Пародонтология (2015) 69:7–17. doi: 10.1111/prd.12104
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
252. Paster BJ, Boches SK, Galvin JL, Ericson RE, Lau CN, Levanos VA, et al. Бактериальное разнообразие поддесневого налета человека. Дж Бактериол. (2001) 183:3770–83. doi: 10.1128/JB.183.12.3770-3783.2001
Paster BJ, Boches SK, Galvin JL, Ericson RE, Lau CN, Levanos VA, et al. Бактериальное разнообразие поддесневого налета человека. Дж Бактериол. (2001) 183:3770–83. doi: 10.1128/JB.183.12.3770-3783.2001
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
253. van Winkelhoff AJ, Loos BG, van der Reijden WA, van der Velden U. Porphyromonas gingivalis, Bacteroides forsythus и другие предполагаемые пародонтальные патогены у субъектов с деструкцией пародонта и без нее. J Клиника пародонтологии. (2002) 29:1023–8. doi: 10.1034/j.1600-051X.2002.2.x
Полный текст CrossRef | Google Scholar
254. Татакис Д.Н., Кумар П.С. Этиология и патогенез заболеваний пародонта. Дент Клин Норт Ам. (2005) 49: 491–516. doi: 10.1016/j.cden.2005.03.001
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
255. Ji S, Kim Y, Min BM, Han SH, Choi Y. Врожденные иммунные ответы эпителиальных клеток десны на непериодонтопатические и пародонтопатические бактерии. J Пародонтальные рес. (2007) 42:503–10. doi: 10.1111/j.1600-0765.2007.00974.x
J Пародонтальные рес. (2007) 42:503–10. doi: 10.1111/j.1600-0765.2007.00974.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
256. Guo W, Wang P, Liu Z, Yang P, Ye P. Активация инфламмасомы, содержащей пириновый домен-3, зависит от липополисахарида из Porphyromonas gingivalis и внеклеточный аденозинтрифосфат в культивируемых эпителиальных клетках полости рта. BMC Oral Health (2015) 15:133. doi: 10.1186/s12903-015-0115-6
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
257. Мур В.Е., Мур Л.В. Бактерии заболеваний пародонта. Пародонтология (1994) 5:66–77. doi: 10.1111/j.1600-0757.1994.tb00019.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
258. Kumagai Y, Yagishita H, Yajima A, Okamoto T, Konishi K. Молекулярный механизм разрушения соединительной ткани дипептидиламинопептидазой IV, продуцируемой пародонтальным патогеном Порфиромонас десневой . Заразить иммунн. (2005) 73:2655–64. doi: 10.1128/IAI.73.5.2655-2664.2005
Заразить иммунн. (2005) 73:2655–64. doi: 10.1128/IAI.73.5.2655-2664.2005
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
259. Холт С.К., Кесавалу Л., Уокер С., Дженко, Калифорния. Факторы вирулентности Porphyromonas gingivalis . Пародонтология (1999) 20:168–238. doi: 10.1111/j.1600-0757.1999.tb00162.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
260. Биркедал-Хансен Х., Тейлор Р.Э., Замбон Дж.Дж., Барва П.К., Нейдерс М.Э. Характеристика коллагенолитической активности штаммов Bacteroides gingivalis. J Периодонтальная рез. (1988) 23:258–64. doi: 10.1111/j.1600-0765.1988.tb01369.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
261. Soolari AS, Champagne C, Punzi JS, Amar S, Van Dyke TE. Модуляция сывороточной реакции нейтрофилов на Porphyromonas gingivalis LPS при заболеваниях пародонта. J Int Acad Periodontol. (1999) 1:101–9.
Реферат PubMed | Google Scholar
262. Кесавалу Л., Эберсоле Дж.Л., Мачен Р.Л., Холт С.К. Porphyromonas gingivalis вирулентность у мышей: индукция иммунитета к бактериальным компонентам. Заразить иммунн. (1992) 60:1455–64.
Реферат PubMed | Google Scholar
263. Амано А., Накагава И., Окахаши Н., Хамада Н. Вариации фимбрий Porphyromonas gingivalis в отношении микробного патогенеза. J Пародонтальные рес. (2004) 39:136–42. doi: 10.1111/j.1600-0765.2004.00719.x
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
264. Джотвани Р., Катлер CW. Фимбриированный Porphyromonas gingivalis более эффективен, чем P. gingivalis с дефицитом фимбрий, при проникновении в дендритные клетки человека in vitro и индуцирует воспалительный эффекторный ответ Th2. Заразить иммунн. (2004) 72:1725–32.
Реферат PubMed | Google Scholar
265. Preshaw PM, Schifferle RE, Walters JD. Porphyromonas gingivalis липополисахарид задерживает апоптоз полиморфноядерных лейкоцитов человека in vitro . J Пародонтальные рес. (1999) 34:197–202. doi: 10.1111/j.1600-0765.1999.tb02242.x
Porphyromonas gingivalis липополисахарид задерживает апоптоз полиморфноядерных лейкоцитов человека in vitro . J Пародонтальные рес. (1999) 34:197–202. doi: 10.1111/j.1600-0765.1999.tb02242.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
266. Хамада Н., Ватанабэ К., Сасакава С., Йошикава М., Йошимура Ф., Умемото Т. Создание и характеристика мутанта fimA Porphyromonas gingivalis . Заразить иммунн. (1994) 62:1696–704.
Реферат PubMed | Google Scholar
267. Гренье Д. Инактивация бактерицидной активности сыворотки человека трипсиноподобной протеазой, выделенной из Порфиромонас десневой . Заразить иммунн. (1992) 60:1854–7.
Реферат PubMed | Google Scholar
268. Njoroge T, Genco RJ, Sojar HT, Hamada N, Genco CA. Роль фимбрий в инвазии Porphyromonas gingivalis эпителиальных клеток полости рта. Заразить иммунн. (1997) 65:1980–4.
Реферат PubMed | Google Scholar
269. Lamont RJ, Chan A, Belton CM, Izutsu KT, Vasel D, Weinberg A. Porphyromonas gingivalis инвазия эпителиальных клеток десны. Заразить иммунн. (1995) 63:3878–85.
Lamont RJ, Chan A, Belton CM, Izutsu KT, Vasel D, Weinberg A. Porphyromonas gingivalis инвазия эпителиальных клеток десны. Заразить иммунн. (1995) 63:3878–85.
Реферат PubMed | Google Scholar
270. Йилмаз О., Ватанабэ К., Ламонт Р.Дж. Участие интегринов в опосредованном фимбриями связывании и инвазии Porphyromonas gingivalis . Клеточная микробиология. (2002) 4:305–14. doi: 10.1046/j.1462-5822.2002.00192.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
271. Ватанабэ К., Ямаджи Ю., Умемото Т. Корреляция между адгезионной активностью клеток и структурой поверхности в Порфиромонас десневой . Пероральный микробиол иммунол. (1992) 7:357–63. doi: 10.1111/j.1399-302X.1992.tb00636.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
272. Shah HN, Gharbia SE, Kowlessur D, Wilkie E, Brocklehurst K. Выделение и характеристика гингивина, цистеиновой протеиназы из штамма W83 Porphyromonas gingivalis .
