Периодонтальная связка: что это такое?
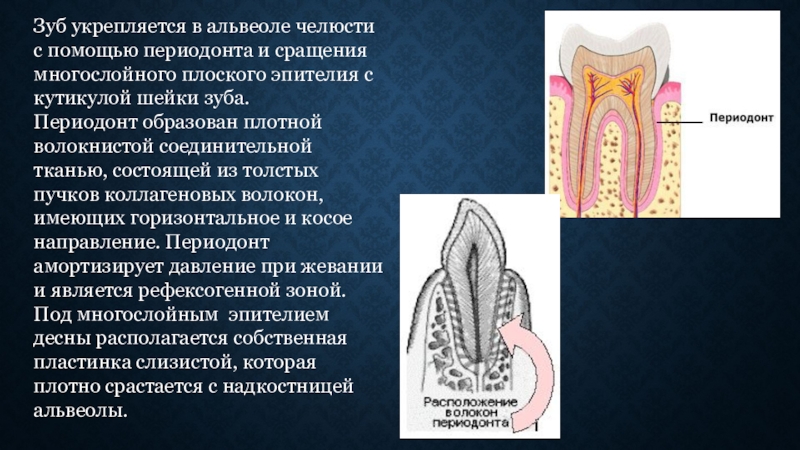
Многие люди полагают, что зубы удерживаются на своих местах только благодаря костной ткани челюсти и деснам. На самом деле зуб и кость соединяет мягкая ткань, которая называется периодонтальной связкой. Она состоит из коллагеновых волокон разного типа и пронизана нервами и сосудами. Периодонтальная связка очень тонка и при этом чрезвычайно сложно устроена. Как объясняют стоматологи, с одной стороны она прикреплена к окружающей зуб кости, а с другой — к покрывающему корень зуба цементу. Хотя эта ткань и называется связкой, не следует путать ее со связками суставов. Периодонтальная связка выполняет очень важные функции.
Каковы функции периодонтальной связки?
Поддержку внешних тканей десны эта связка не обеспечивает; она располагается в периодонтальной щели, строго между корнем и костью. Периодонтальная связка позволяет зубу выдерживать жевательные нагрузки и поглощает избыточное давление при стискивании зубов.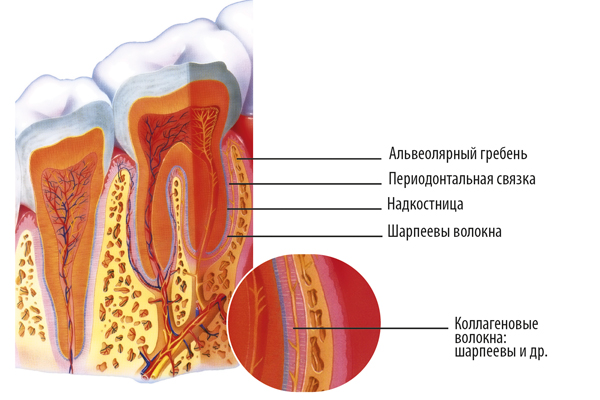
Периодонтальная связка способствует обновлению и ремоделированию окружающей зуб кости. Сращивание корня зуба с костью называется анкилозом и приводит к нарушению амортизации и подвижности зуба. Такая ситуация может возникнуть при повреждении какого-либо участка связки.
Периодонтальная связка помогает зубу адаптироваться к нагрузкам, возникающим из-за привычки скрежетать зубами (бруксизма) или других парафункциональных привычек. Если зуб начинает демонстрировать подвижность или шататься, эта связка утолщается. При уменьшении избыточных нагрузок на зуб связка возвращается в нормальное состояние, что способствует усилению фиксации зуба.
Периодонтальная связка и общее стоматологическое здоровье
Тяжелая форма пародонтита может привести к разрушению кости и утрате периодонтальной связки. В результате этого зуб лишается связи с костью и, следовательно, опоры. Периодонтальная связка восприимчива к воспалению и плохо регенерирует, если же ее не восстановить, то нет никаких гарантий, что даже трансплантация кости позволит пациенту с пародонтитом сохранить зубы.
Чтобы ваши зубы и десны оставались здоровыми, за ними нужно правильно ухаживать. Чистите зубы дважды в день фторидсодержащей зубной пастой, а также регулярно используйте зубную нить и ополаскиватель для полости рта, обеспечивающий дополнительную защиту и укрепление десен.
12. Фиксация зубов. Строение периодонта, его связочный аппарат. Понятие о пародонте.
 Совокупность 3 элементов
(костная зубная альвеола, периодонт и
цемент) называют поддерживающим аппаратом
зуба.
Совокупность 3 элементов
(костная зубная альвеола, периодонт и
цемент) называют поддерживающим аппаратом
зуба.Периодонт представляет собой комплекс соединительнотканных пучков, расположенных между костной альвеолой и цементом. Ширина периодонтальной щели зубов человека составляет возле устья альвеолы 0,15-0,35 мм, в средней трети корня 0,1-0,3 мм, у верхушки корня 0,3-0,55 мм. В средней трети корня периодонтальная щель имеет перетяжку, поэтому условно ее можно сравнить по форме с песочными часами, что связано с микродвижениями зуба в альвеоле. После 55-60 лет периодонтальная щель суживается (в 72% случаев).
Множество
пучков коллагеновых волокон идет от
стенки зубной альвеолы к цементу. В
промежутках между пучками фиброзной
ткани находятся прослойки рыхлой
соединительной ткани, в которой лежат
клеточные элементы (гистиоциты,
фибробласты, остеобласты и др.), сосуды
и нервы. Направление пучков коллагеновых
волокон периодонта неодинаково в
различных отделах.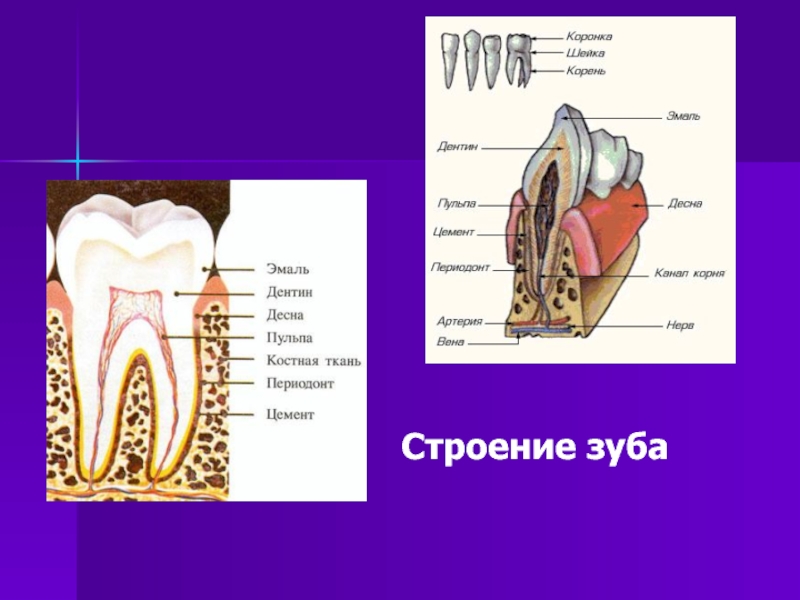
Зубодесневые волокна, fibraedentogingivales, начинаются от цемента корня у дна десневого кармана и распространяются веерообразно кнаружи в соединительную дань десны.
Пучки хорошо выражены на вестибулярной и оральной поверхностях и сравнительно слабо на контактных поверхностях зубов. Толщина пучков волокон не превышает 0,1 мм.
Межзубные волокна, fibraeinterdentaliae, образуют мощные пучки шириной 1,0-1,5 мм. Они простираются от цемента контактной поверхности одного зуба через межзубную перегородку к цементу соседнего зуба. Эта группа пучков выполняет особую роль: сохраняет непрерывность зубного ряда и участвует в распределении жевательного давления в пределах зубной дуги.
Зубоальвеолярные
волокна, fibraedentoalveolares, начинаются от
Цемента корня на всем протяжении и идут
к стенке зубной альвеолы. Пучки волокон
начинаются на верхушке корня,
распространяются почти вертикально, в
приверхушечной части — горизонтально,
в средней и верхней трети корня они идут
косо снизу вверх. На многокорневых зубах
пучки идут менее косо, в местах разделения
корня следуют сверху вниз, от одного
корня к другому, перекрещиваясь друг с
другом. При отсутствии зуба-антагониста
направление пучков становится
горизонтальным.
Пучки волокон
начинаются на верхушке корня,
распространяются почти вертикально, в
приверхушечной части — горизонтально,
в средней и верхней трети корня они идут
косо снизу вверх. На многокорневых зубах
пучки идут менее косо, в местах разделения
корня следуют сверху вниз, от одного
корня к другому, перекрещиваясь друг с
другом. При отсутствии зуба-антагониста
направление пучков становится
горизонтальным.
Рис. 1. Строение периодонта. 1 — зубоальвеолярные волокна; 2 — межзубные (межкорневые) волокна; 3 — зубодесневые волокна.
Ориентировка пучков коллагеновых волокон периодонта, а также структура губчатого вещества челюстей формируются под влиянием функциональной нагрузки. В зубах, лишенных антагонистов, со временем направление пучков периодонта из косого становится горизонтальным и даже косым в противоположном направлении. Периодонт нефункционирующих зубов более рыхлый.
Пародонт —
это комплекс тканей, включающий в себя
цемент корня, периодонтальную связку
и альвеолярную кость.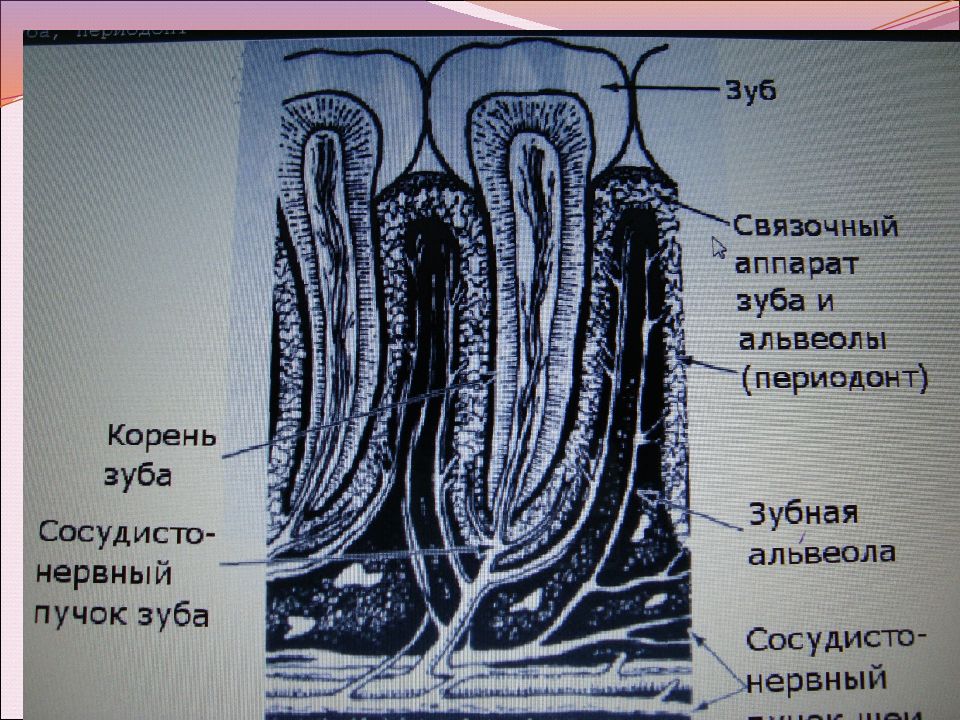 Ткани
пародонта выполняют опорную (сопротивление
физиологическим нагрузкам) и удерживающую
функции (фиксация зуба в лунке). Пародонт
представляет собой единую анатомическую
II функциональную систему (см. рис. 1.9).
Апикальный пародонт является частью
пародонта, локализующегося в области
верхушки корня.
Ткани
пародонта выполняют опорную (сопротивление
физиологическим нагрузкам) и удерживающую
функции (фиксация зуба в лунке). Пародонт
представляет собой единую анатомическую
II функциональную систему (см. рис. 1.9).
Апикальный пародонт является частью
пародонта, локализующегося в области
верхушки корня.
 Альвеолярная кость образует лунку зуба.
На рентгенограмме она выглядит как
узкая рентгеноконтрастная зона —
кортикальная пластина. Альвеолярную
часть пронизывают многочисленные
сосуды. В лакунах располагаются клетки
остеоциты. Со стороны периодонтальной
щели кость содержит неминерализованные
остеомы и костеобразующие клетки
остеобласты.
Периодонтальная
связка представлена плотной
неминерализованной соединительной
тканью, заполняющей пространство между
цементом корня зуба и альвеолярной
костью. Она содержит многочисленные
коллагеновые волокна, расположенные
под углом между цементом корня и
альвеолярной костью.
В
области верхушки зуба волокна расходятся
радиально от поверхности корня и
вплетаются в окружающую костную
ткань. Клетки,
волокна и межклеточное вещество Верхушечный
пародонт содержит клеточные элементы
нескольких типов. Цементобласты являются
специализированными цемент-продуцирующими
клетками, характерными только для
периодонтальной связки. Ультраструктура
цементобластов близка к ультраструктуре
остеобластов и фибробластов пульпы и
периодонта.
Альвеолярная кость образует лунку зуба.
На рентгенограмме она выглядит как
узкая рентгеноконтрастная зона —
кортикальная пластина. Альвеолярную
часть пронизывают многочисленные
сосуды. В лакунах располагаются клетки
остеоциты. Со стороны периодонтальной
щели кость содержит неминерализованные
остеомы и костеобразующие клетки
остеобласты.
Периодонтальная
связка представлена плотной
неминерализованной соединительной
тканью, заполняющей пространство между
цементом корня зуба и альвеолярной
костью. Она содержит многочисленные
коллагеновые волокна, расположенные
под углом между цементом корня и
альвеолярной костью.
В
области верхушки зуба волокна расходятся
радиально от поверхности корня и
вплетаются в окружающую костную
ткань. Клетки,
волокна и межклеточное вещество Верхушечный
пародонт содержит клеточные элементы
нескольких типов. Цементобласты являются
специализированными цемент-продуцирующими
клетками, характерными только для
периодонтальной связки. Ультраструктура
цементобластов близка к ультраструктуре
остеобластов и фибробластов пульпы и
периодонта.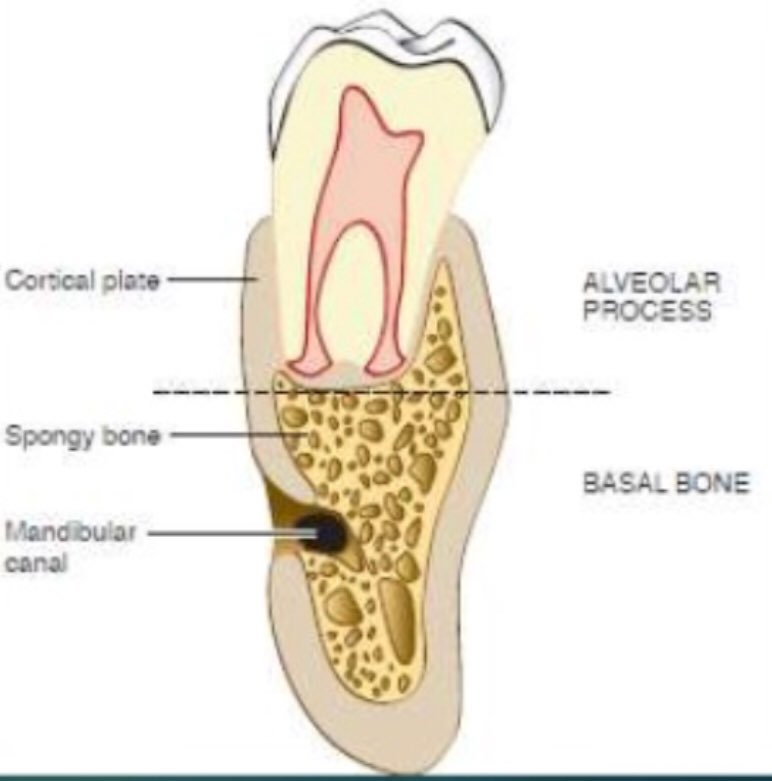 Функциональная специфичность
этих клеток определяется в первую
очередь их локализацией.
Основными
клеточными элементами периодонтальной
связки являются фибробласты. Они
участвуют в формировании периодонтальных
волокон и межклеточного вещества. Кроме
того, коллагеновые волокна претерпевают
постоянную перестройку, а именно
формирование и деградацию. Оба эти
процесса идут с участием фибробластов,
причем нередко расщепление и образование
волокон может происходить одновременно.
Подобно пульпарной ткани, периодонтальная
связка содержит малодифференцированные
клетки, обладающие свойством
мультипотенциальности. При определенных
условиях эти клетки могут дифференцироваться
в любые клетки периодонта, что играет
немаловажную роль при репаративных
процессах. Тучные клетки, составляющие
до 6% всей клеточной популяции пародонта,
также образуются из малодифференцированных
мезенхимальных клеток.
Макрофаги
встречаются в невоспаленных структурах
пародонта крайне редко. Они участвуют
в синтезе различных клеточно-активных
белков.
Функциональная специфичность
этих клеток определяется в первую
очередь их локализацией.
Основными
клеточными элементами периодонтальной
связки являются фибробласты. Они
участвуют в формировании периодонтальных
волокон и межклеточного вещества. Кроме
того, коллагеновые волокна претерпевают
постоянную перестройку, а именно
формирование и деградацию. Оба эти
процесса идут с участием фибробластов,
причем нередко расщепление и образование
волокон может происходить одновременно.
Подобно пульпарной ткани, периодонтальная
связка содержит малодифференцированные
клетки, обладающие свойством
мультипотенциальности. При определенных
условиях эти клетки могут дифференцироваться
в любые клетки периодонта, что играет
немаловажную роль при репаративных
процессах. Тучные клетки, составляющие
до 6% всей клеточной популяции пародонта,
также образуются из малодифференцированных
мезенхимальных клеток.
Макрофаги
встречаются в невоспаленных структурах
пародонта крайне редко. Они участвуют
в синтезе различных клеточно-активных
белков.

 Таким образом, в отличие от
пульпы зуба пародонт имеет богатое
коллатеральное кровообращение.
Капиллярная сеть также хорошо развита.
Она более выражена в области костной
ткани, нежели у поверхности корня. Вблизи
сосудов находятся лимфатические
капилляры, несущие лимфу к регионарным
лимфатическим узлам.
Нервные
стволы в пародонте располагаются по
ходу кровеносных сосудов. Среди нервных
окончаний встречаются как миелиновые,
так и безмиелиновые. Чувствительные
окончания относятся к системе тройничного
нерва. Нервные окончания являются
проприоцепторами и болевыми рецепторами,
реагирующими на самые незначительные
изменения тканевого давления.
Таким образом, в отличие от
пульпы зуба пародонт имеет богатое
коллатеральное кровообращение.
Капиллярная сеть также хорошо развита.
Она более выражена в области костной
ткани, нежели у поверхности корня. Вблизи
сосудов находятся лимфатические
капилляры, несущие лимфу к регионарным
лимфатическим узлам.
Нервные
стволы в пародонте располагаются по
ходу кровеносных сосудов. Среди нервных
окончаний встречаются как миелиновые,
так и безмиелиновые. Чувствительные
окончания относятся к системе тройничного
нерва. Нервные окончания являются
проприоцепторами и болевыми рецепторами,
реагирующими на самые незначительные
изменения тканевого давления. Морфологические особенности периодонта первых премоляров и моляров Текст научной статьи по специальности «Клиническая медицина»
Морфологические особенности периодонта первых премоляров и моляров*
Хертек М.В.
Morphological features of periodontal first premolars and molars Khertek M.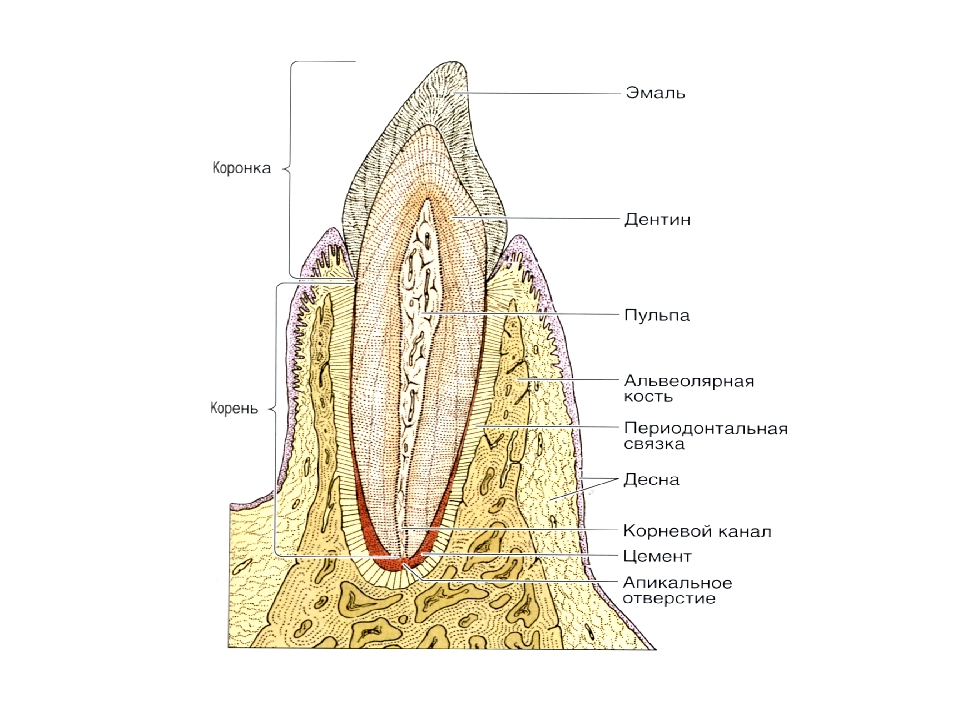 V.
V.
Сибирский государственный медицинский университет, г. Томск
© Хертек М.В.
Проведен расчет и анализ данных о морфофункциональной организации периодонтальной связки с разных поверхностей (медиальной, дистальной, щечной и небной) на различных уровнях корней первых моляров и первых премоляров. Показано, что при биомеханической нагрузке на жевательные зубы морфология периодонта меняется на всем протяжении корня в зависимости от локализации зон сжатия и растяжения.
Ключевые слова: биомеханика, зуб, морфология, периодонтальная связка.
The calculation and analysis of data on the morphofunctional organization of periodontal ligament with different surfaces (medial, distal, buccal and palatal) at various levels of the roots of the first molars and first premolars. Shown that the biomechanical load on teeth morphology of periodontal changes throughout the root, depending on the localization of zones of compression and tension.
Shown that the biomechanical load on teeth morphology of periodontal changes throughout the root, depending on the localization of zones of compression and tension.
Key words: biomechanics, tooth morphology, periodontal ligament.
УДК 611.314-018:616.314.5/.314.6-091.8
Введение
ности
зуба. Существует теория о подвешивании корня зуба, согласно которой жевательное давление передается через корень на периодонт и от него на лунку [3, 4, 9]. При потере зубов-антагонистов расположение пучков волокон периодонта нарушается, и они истончаются. При повышенной нагрузке на зуб, наоборот, отмечается утолщение периодонтальной связки, особенно на тех участках, которые испытывают наибольшее давление
[7].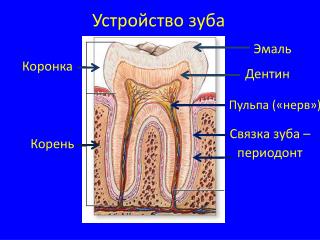
Если рассматривать зубочелюстную систему в целом как механизм, который обеспечивает измельчение пищи, то зубной ряд представляет собой жесткую рабочую поверхность. При любых функциональных нагрузках значительная часть волокон периодонта работает на растяжение, что обеспечивает устойчивость зуба, корень которого практически всегда остается в упругофиксированном состоянии, не касаясь стенок альвеолы [2, 11].
Ряд авторов [11, 13] считают, что зубы под воздей-
ствием приложенных сил совершают колебательные
* Работа выполнена под руководством д-ра мед. наук, профессора С. В. Логвинова.
Периодонт (периоцемент, периодонтальная связка) — это уникальная структура организма, основной функцией которой является равномерное распределение нагрузки на костную ткань альвеолы, возникающей при жевании [16].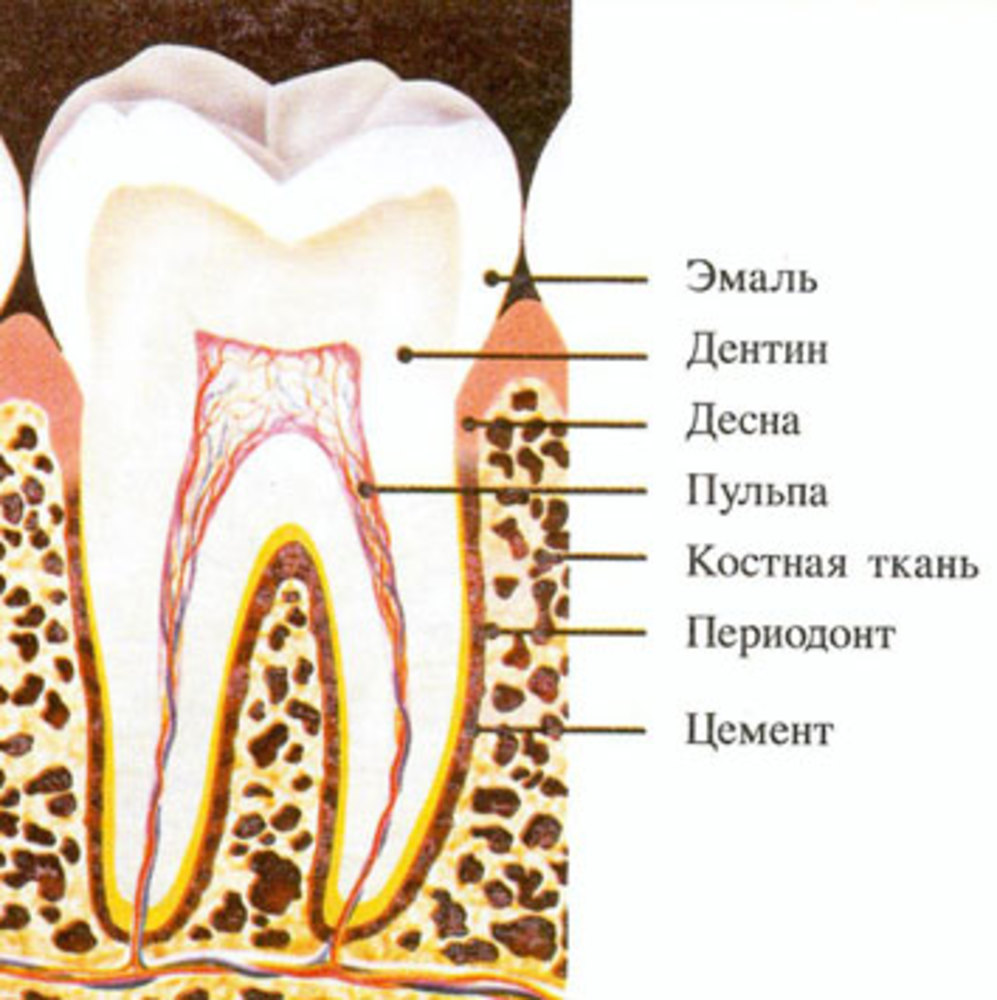 Ширина периодонтальной щели, занимаемой связкой, неодинакова на различных уровнях. Наибольшая в области края альвеолы, где она составляет 0,23—0,27 мм (минимальное и максимальное значение), далее в цервикальной области постепенно сужается до 0,17—0,19 мм и в средней трети становится наименьшей — до 0,08—0,14 мм. Затем в апикальной трети периодонтальная щель вновь увеличивается до 0,16—0,19 мм и в области дна альвеолы составляет 0,23—0,28 мм [2]. Из этого можно сделать вывод, что в средней части лунки периодонтальная щель имеет сужение, и это дает право некоторым авторам сравнивать ее конфигурацию с песочными часами. Сужение периодонтальной щели в средней трети объясняется характером физиологической подвиж-
Ширина периодонтальной щели, занимаемой связкой, неодинакова на различных уровнях. Наибольшая в области края альвеолы, где она составляет 0,23—0,27 мм (минимальное и максимальное значение), далее в цервикальной области постепенно сужается до 0,17—0,19 мм и в средней трети становится наименьшей — до 0,08—0,14 мм. Затем в апикальной трети периодонтальная щель вновь увеличивается до 0,16—0,19 мм и в области дна альвеолы составляет 0,23—0,28 мм [2]. Из этого можно сделать вывод, что в средней части лунки периодонтальная щель имеет сужение, и это дает право некоторым авторам сравнивать ее конфигурацию с песочными часами. Сужение периодонтальной щели в средней трети объясняется характером физиологической подвиж-
движения в альвеолах, главным образом в вестибулярном и оральном направлениях. Однако нужно учесть,
что зубы совершают микродвижения в своих лунках в покое. Сила, соответствующая жевательной нагрузке, действует под некоторым углом по отношению к оси зуба, и точка ее приложения не совпадает с осью. Такое приложение силы характерно в первую очередь для премоляров, у которых жевательная площадка смещена орально в более значительной степени, чем у передних зубов и моляров [10]. Современные возможности биомеханики, которые применяются в стоматологии, с каждым годом значительно расширяются. Морфология периодонта жевательных групп зубов изучена далеко не полно. Мало сведений об особенностях периодонтальной связки на различных поверхностях зубов. Для врачей-стоматологов данный вопрос имеет важное практическое значение. Это прежде всего связано с тем, что при ортопедических и ортодон-тических нагрузках на периодонт возникают неадекватные изменения в его структуре и функции [2, 3]. Таким образом, актуальность проблемы морфологии периодонта и биомеханических особенностей зуба с каждым годом возрастает.
Такое приложение силы характерно в первую очередь для премоляров, у которых жевательная площадка смещена орально в более значительной степени, чем у передних зубов и моляров [10]. Современные возможности биомеханики, которые применяются в стоматологии, с каждым годом значительно расширяются. Морфология периодонта жевательных групп зубов изучена далеко не полно. Мало сведений об особенностях периодонтальной связки на различных поверхностях зубов. Для врачей-стоматологов данный вопрос имеет важное практическое значение. Это прежде всего связано с тем, что при ортопедических и ортодон-тических нагрузках на периодонт возникают неадекватные изменения в его структуре и функции [2, 3]. Таким образом, актуальность проблемы морфологии периодонта и биомеханических особенностей зуба с каждым годом возрастает.
Цель исследования — изучить морфологические особенности периодонтальной связки на различных уровнях корня с разных поверхностей (медиальной, дистальной, небной, оральной и щечной) первых пре-моляров и первых моляров.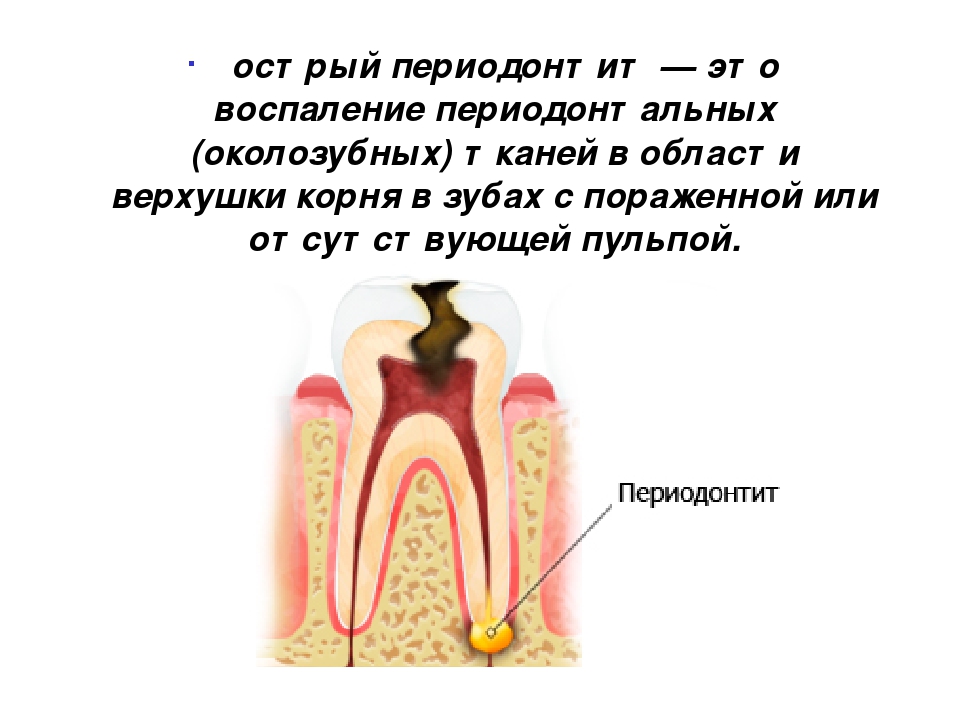 Определить связь между биомеханикой и морфологией периодонта первых моляров и первых премоляров.
Определить связь между биомеханикой и морфологией периодонта первых моляров и первых премоляров.
Материал и методы
Материалом для морфологических исследований служили фрагменты верхних челюстей с зубами, взятые у трупов людей возрастной группы от 45 до 65 лет. Всего изучено 10 зубоальвеолярных комплексов первых моляров и первых премоляров. Материал забирали на 2-е сут после смерти и фиксировали в 10%-м формалине. После фиксации материала производили его декальцинацию в 15%-м растворе азотной кислоты и заливали в парафин. Срезы готовили в горизонтальной плоскости на уровне апикальной, средней части корня (промежуточном отделе) и на уровне десны, окрашивали гематоксилином и эозином, по ван Гизону. С помощью сетки Автандилова, вставленной в окуляр микроскопа, определяли удельную площадь кровеносных и лимфатиче-
ских сосудов, удельный объем рыхлой и плотной соединительной ткани с различных поверхностей (медиальной, дистальной, небной или оральной и щечной) периодонта. Статистическую обработку данных проводили с использованием критерия Манна—Уитни. Статистически значимыми различия считались при р < 0,05. Результаты представляли в виде Х± т, где Х — выборочное среднее, т — ошибка среднего.
Статистическую обработку данных проводили с использованием критерия Манна—Уитни. Статистически значимыми различия считались при р < 0,05. Результаты представляли в виде Х± т, где Х — выборочное среднее, т — ошибка среднего.
Результаты
На гистологических препаратах хорошо виден пе-риодонт, граничащий с одной стороны с цементом зуба, а с другой стороны — с тонкой пластинкой костной ткани. Последняя имеет единичные остеоны и образует выросты в сторону периодонта. Периодон-тальная связка содержит толстые пучки коллагеновых волокон, имеющих преимущественно радиальное направление, как правило, от указанных выростов альвеолярной кости и с противоположной стороны вплетающихся в цемент (рис. 1). От пластинки костной ткани также отходят пучки коллагеновых волокон, имеющих тангенциальное направление. Между пучками коллагеновых волокон хорошо выражена рыхлая волокнистая соединительная ткань (рис. 2,а). По объему она, как правило, уступает плотной соединительной ткани связки. В ней довольно много различных клеточных элементов, но преобладающими являются клетки фибробластического ряда. Среди клеток пе-риодонта можно отметить лимфоциты различной степени зрелости, которые превалируют в десневой части корня, а также в небольшом количестве обнаруживаются макрофаги. В периодонтальной связке встречаются эпителиальные остатки (островки) Малассе, преимущественно они сосредоточены в области шейки и верхушки корня.
2,а). По объему она, как правило, уступает плотной соединительной ткани связки. В ней довольно много различных клеточных элементов, но преобладающими являются клетки фибробластического ряда. Среди клеток пе-риодонта можно отметить лимфоциты различной степени зрелости, которые превалируют в десневой части корня, а также в небольшом количестве обнаруживаются макрофаги. В периодонтальной связке встречаются эпителиальные остатки (островки) Малассе, преимущественно они сосредоточены в области шейки и верхушки корня.
В периодонте располагаются многочисленные кровеносные сосуды различного калибра и типа, начиная от мелких артерий, артериол и гемокапилляров и заканчивая венами (рис. 2). Весьма характерным является наличие лимфатических сосудов, они имеют очень тонкую стенку, в составе которой обнаружены лишь единичные ядра эндотелиальных клеток, их просвет не содержит форменных элементов крови. Эти сосуды чаще всего обнаруживаются вблизи цемента, а также около костной ткани. В средней части корня они чаще имеют продольное расположение, а в области десны и апекса периодонта — циркулярное. Надо
В средней части корня они чаще имеют продольное расположение, а в области десны и апекса периодонта — циркулярное. Надо
отметить, что в рыхлой соединительной ткани, вблизи связок часто определяются значительные пространства между волокнами, не имеющие выраженной собственной стенки. Чаще всего они занимают существенную объемную долю в тканях связки и, будучи заполненными тканевой жидкостью, могут играть значительную роль в амортизации при нагрузке с той или иной поверхности корня зубов.
б
Рис. 1. Периодонтальная связка первых моляров, верхней челюсти: а — плотная волокнистая соединительная ткань; б — соединения плотной волокнистой соединительной ткани с цементом. Окраска гематоксилином и эозином. Ув. а — 200, б — 800
При количественном анализе структурных элементов периодонта первых моляров и первых премоляров наблюдаются особенности с поверхностей кор-
ня на разных его уровнях (табл. 1). Удельные объемы плотной волокнистой соединительной ткани (ПВСТ) на разных уровнях корней премоляров и моляров превалируют над таковыми рыхлой волокнистой соединительной ткани (РВСТ). Однако их соотношения на разных поверхностях варьируют. Так, удельный объем ПВСТ в десневой части первых моляров на дисталь-ной поверхности ((64,2 ± 7,3)%) значимо больше, чем на медиальной ((47,7 ± 6,2)%). Соответственно, обратная зависимость отмечается в отношении РВСТ — в десневой области ее доля больше на медиальной поверхности, чем на дистальной. Аналогичные тенденции в соотношении плотной и рыхлой соединительных тканей отмечены для небной и щечной поверхностей десневой части первых моляров, однако в этом случае цифровые значения для разных поверхностей не имеют достоверных отличий. Здесь же отметим, что с позиций биомеханической модели [7, 11] первых моляров в десневой зоне медиальная и щечная поверхности считаются зонами сжатия периодонта, а дистальная и небная — зонами растяжения.
1). Удельные объемы плотной волокнистой соединительной ткани (ПВСТ) на разных уровнях корней премоляров и моляров превалируют над таковыми рыхлой волокнистой соединительной ткани (РВСТ). Однако их соотношения на разных поверхностях варьируют. Так, удельный объем ПВСТ в десневой части первых моляров на дисталь-ной поверхности ((64,2 ± 7,3)%) значимо больше, чем на медиальной ((47,7 ± 6,2)%). Соответственно, обратная зависимость отмечается в отношении РВСТ — в десневой области ее доля больше на медиальной поверхности, чем на дистальной. Аналогичные тенденции в соотношении плотной и рыхлой соединительных тканей отмечены для небной и щечной поверхностей десневой части первых моляров, однако в этом случае цифровые значения для разных поверхностей не имеют достоверных отличий. Здесь же отметим, что с позиций биомеханической модели [7, 11] первых моляров в десневой зоне медиальная и щечная поверхности считаются зонами сжатия периодонта, а дистальная и небная — зонами растяжения.
б
Рис. 2. Периодонтальная связка первых премоляров: а — прослойка рыхлой волокнистой соединительной ткани; б — кровеносные и лимфатические сосуды. Окраска гематоксилином и эозином. Ув. а — 800, б — 200
2. Периодонтальная связка первых премоляров: а — прослойка рыхлой волокнистой соединительной ткани; б — кровеносные и лимфатические сосуды. Окраска гематоксилином и эозином. Ув. а — 800, б — 200
Таблица 1
Удельные объемы (%) структурных элементов периодонта первых моляров на разных уровнях корня с различных сторон (п = 10)
(Х ± т)
Струк- Поверхность
тура медиальная дистальная небная щечная
Десневая часть
КС 6,6 ± 0,4 5 5,3 ± 0,4 6,4 ± 0,4 8,40 ± 0,50 2 5
ЛС 4,2 ± 0,5 4,7 ± 0,4 5,6 ± 0,4 6,48 ± 0,4
РВСТ 42,6 ± 6,1 24,6 ± 5,8 1 28,7 ± 5,7 1 35,78 ± 5,3 2, 3, 5
ПВСТ 47,7 ± 6,2 5 64,2 ± 7,3 1 5 59,4 ± 6,5 50,26 ± 5,5 1 2
Средняя часть
КС 5,4 ± 0,4 4 3,3 ± 0,4 1 3,7 ± 0,4 1А5 5,5 ± 0,4 3, 4
ЛС 4,9 ± 0,4 4,5 ± 0,4 3,6 ± 0,4 3,4 ± 0,4
РВСТ 27,7 ± 5,3 4 5 22,8 ± 5,1 1 12,6 ± 3,7 1 4 5 31,2 ± 6,1 4
ПВСТ 61,3 ± 5,7 4, 5 68,3 ± 5,2 4 80,0 ± 4,3 1 2, 4, 5 60,9 ± 5,8 3, 4
Апикальная часть
КС 3,7 ± 0,4 4 4,6 ± 0,4 7,3 ± 0,8 1 2 6,1 ± 0,6 4
ЛС 4,5 ± 0,5 5,2 ± 0,4 8,9 ± 0,8 5,1 ± 0,4
РВСТ 22,6 ± 4,7 20,2 ± 1,7 25,2 ± 5,1 26,1 ± 5,2 2
ПВСТ 70,2 ± 6,2 4 69,9 ± 5,5 64,9 ± 5,5 64,1 ± 5,4 4
Примечание. п — количество структурных элементов. Значимые отличия (р < 0,05) здесь и в табл. 2 обозначены: 1 — при сравнении дистальной, небной или щечной поверхности с медиальной поверхностью в десневой, средней или апикальной частях зуба соответственно; 2 — при сравнении медиальной, небной или щечной поверхности с дистальной поверхностью в десневой, средней или апикальной частях зуба соответственно; 3 — при сравнении медиальной, дистальной или щечной поверхности с небной поверхностью в десневой, средней или апикальной частях зуба соответственно;
п — количество структурных элементов. Значимые отличия (р < 0,05) здесь и в табл. 2 обозначены: 1 — при сравнении дистальной, небной или щечной поверхности с медиальной поверхностью в десневой, средней или апикальной частях зуба соответственно; 2 — при сравнении медиальной, небной или щечной поверхности с дистальной поверхностью в десневой, средней или апикальной частях зуба соответственно; 3 — при сравнении медиальной, дистальной или щечной поверхности с небной поверхностью в десневой, средней или апикальной частях зуба соответственно;
4 — при сравнении одинаковых поверхностей в десневой и средней частях зуба соответственно; 5 — при сравнении одинаковых поверхностей в средней и апикальной частях зуба соответственно.
В средней части корня первых моляров наибольший объем ПВСТ ((80,0 ± 4,3)%) и наименьший объем РВСТ ((12,2 ± 3,7)%) зарегистрированы на небной поверхности. Как известно, эта область корня является зоной наибольшего сопротивления, в которой силы тяжести при нагрузке располагаются в средней трети, вблизи разветвления корней.
В апикальной части удельные объемы ПВСТ на разных поверхностях значимо не отличаются, то же относится и к РВСТ. Но при сравнении значений ПВСТ медиальных поверхностей верхушечной части ((70,2 ± 6,2)%) и десневой части ((47,7 ± 6,2)%) различия достоверны. Обратная зависимость наблюдается применительно РВСТ дистальных областей. Отметим, что с позиций биомеханики первых моляров медиаль-
ная поверхность верхушечной части является зоной растяжения периодонта, а в десневой части — зоной сжатия.
Удельный объем кровеносных (КС) и лимфатических сосудов (ЛС) значительно отличается с разных сторон корня моляров. Максимальные удельные объемы КС отмечаются на щечной поверхности ((8,4 ± 0,5)%) в десневой части и с небной стороны на апикальном уровне ((7,3 ± 0,8)%) корня, что соответствует зонам сжатия периодонта при биомеханических нагрузках.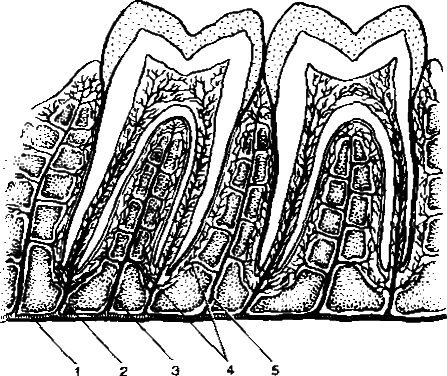 Изменения удельных объемов ЛС на всех поверхностях соответствуют количественным показателям КС. Цифровые значения ЛС на всех поверхностях и уровнях корня значимых отличий не имеют.
Изменения удельных объемов ЛС на всех поверхностях соответствуют количественным показателям КС. Цифровые значения ЛС на всех поверхностях и уровнях корня значимых отличий не имеют.
На различных уровнях корня первых премоляров соотношения ПВСТ и РВСТ существенно отличаются (табл. 2). На десневой части корня отмечается наименьший объем ПВСТ по сравнению с верхушечной и средней частями периодонта, особенно на медиальной и дистальной поверхностях. Наблюдаются обратные пропорции по отношению к РВСТ. С медиальной стороны на среднем участке корня удельный объем ПВСТ составил (74,2 ± 6,3)%, а объем РВСТ (9,6 ± 0,5)%. Такие численные показатели соответствуют центру сопротивления, расположенному приблизительно на расстоянии 0,4 длины корней данной группы зубов [11].
Таблица 2
Удельные объемы (%) структурных элементов периодонта первых премоляров на разных уровнях корня с различных сторон (n = 10) (Х ± m)
Струк Поверхность
тура медиальная дистальная небная щечная
Десневая часть
КС 8,2 ± 0,5 8,8 ± 0,4 7,4 ± 0,5 6,7 ± 0,4
ЛС 8,1 ± 0,5 4,4 ± 0,4 1 6,2 ± 0,5 5,5 ± 0,4
РВСТ 25,7 ± 5,3 20,6 ± 5,4 25,1 ± 5,3 24,3 ± 4,9
ПВСТ 57,4 ± 6,4 66,0 ± 5,8 61,3 ± 5,2 63,6 ± 5,7
Средняя часть
КС 6,7 ± 0,5 4 5,9 ± 0,5 4 4,5 ± 0,5 4 5,7 ± 0,4 1
ЛС 9,1 ± 0,6 5 7,9 ± 0,6 4 8,9 ± 0,6 11,6 ± 0,7 4, 5
РВСТ 9,6 ± 0,5 3, 4 5 14,8 ± 0,4 4 5 18,4 ± 1,5 4 14,8 ± 0,5 14 5
ПВСТ 74,2 ± 6,3 4 5 74,0 ± 5,1 3 4 67,5 ± 5,5 5 68,5 ± 5,2 1, 2
Апикальная часть
КС 4,5 ± 0,4 4 6,0 ± 0,5 4 5,2 ± 0,5 5,3 ± 0,5
ЛС 6,9 ± 0,6 6,8 ± 0,7 11,2 ± 0,7 1 2 6,5 ± 0,5
РВСТ 19,2 ± 1,2 18,1 ± 0,5 18,6 ± 0,4 24,2 ± 1,1 3
ПВСТ 72,4 ± 4,7 3, 4 69,5 ± 5,2 63,2 ± 4,9 2 63,8 ± 4,9 1 2
В области десневой зоны периодонта удельный объем ПВСТ ((66,0 ± 5,8)%) с дистальной стороны
больше, чем с противоположной — медиальной поверхности ((57,4 ± 6,4)%).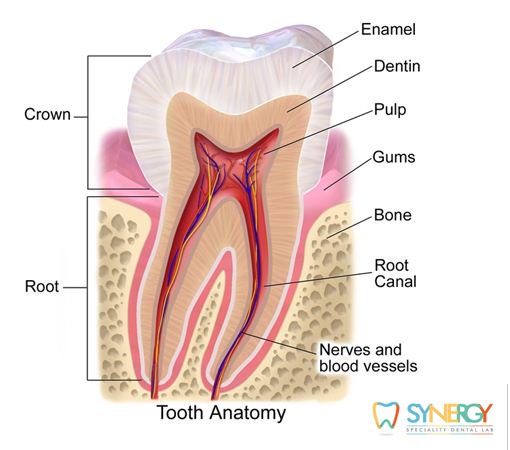 В верхушечной части корня отмечается обратная тенденция. Эти данные соответствуют зонам давления и натяжения периодонтальной связки, которые возникают при жевательных нагрузках, воздействующих на зубы.
В верхушечной части корня отмечается обратная тенденция. Эти данные соответствуют зонам давления и натяжения периодонтальной связки, которые возникают при жевательных нагрузках, воздействующих на зубы.
В десневой части корня на дистальной поверхности премоляров, которая соответствует зоне сжатия периодонта, наибольший удельный объем КС ((8,8 ± 0,4)%). С щечной стороны располагается зона растяжения периодонтальной связки, там объем КС значимо меньше. Удельный объем ЛС в средней части (щечная поверхность) и апикальной части (небная поверхность) значимо больше, чем в десневой части.
Обсуждение
Одной из актуальных проблем в стоматологии является сохранение функциональной ценности каждого зуба. Функция жевательной группы зубов в большей степени заключается в перетирании ими пищевого комка. По данным Ю.И. Савченкова и соавт. (2007), разжевывание пищи требует наряду с вертикальными нагрузками достаточно больших горизонтальных усилий.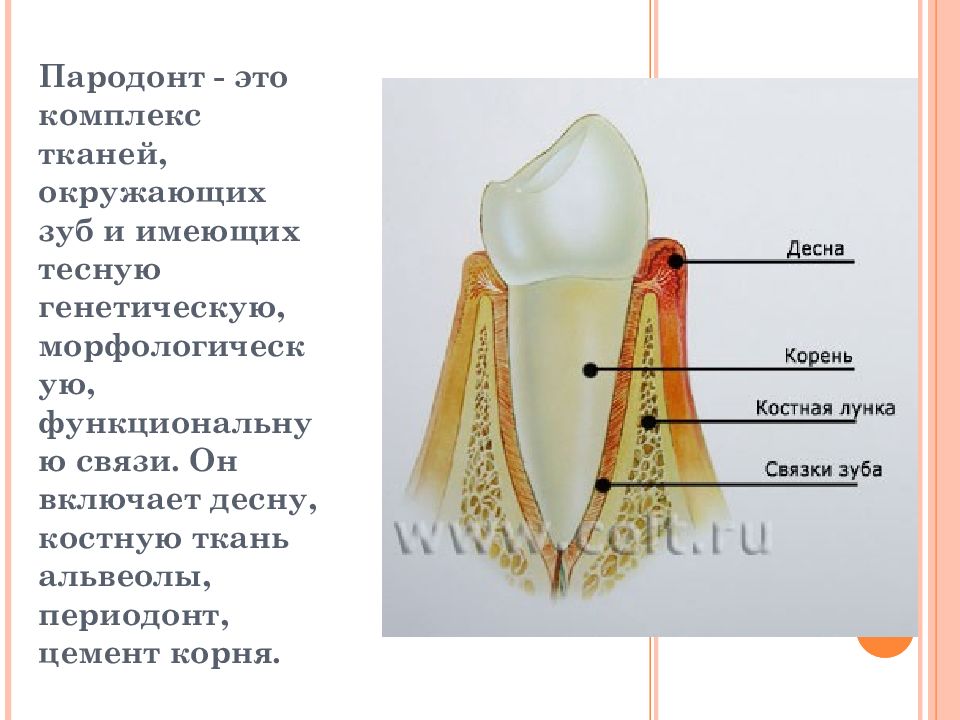 Они необходимы не только для раздавливания, но и для растирания пищи, подготовки ее к перевариванию. Давление, падающее на какой-либо зуб, распространяется не только по его корням на альвеолярные отростки, но и по межзубным контактам на соседние зубы. Анатомическая форма первых премоляров и первых моляров отличается. Первые премоляры напоминают с вестибулярной поверхности коронку клыка и имеют сферическую форму. Эти зубы имеют один или два корня. Первые моляры играют большую роль при жевании (molaris — жернов). Жевательная поверхность этих зубов большая, форма ее ромбовидная. Первые верхние моляры имеют три корня [5]. Они самые крупные по форме и ранние зубы, прорезывающиеся первыми из всех постоянных зубов. Эта группа подвергается жевательной нагрузке раньше всех остальных зубов, и она же первой разрушается. Соответственно, первые моляры принимают максимальную силу при жевательной нагрузке. Согласно исследованиям, произведенным с помощью электрических приборов, во время пережевывания твердой пищи на моляры действует сила, равная 200—300 Н, при этом 1 Н равен 1 кг [11].
Они необходимы не только для раздавливания, но и для растирания пищи, подготовки ее к перевариванию. Давление, падающее на какой-либо зуб, распространяется не только по его корням на альвеолярные отростки, но и по межзубным контактам на соседние зубы. Анатомическая форма первых премоляров и первых моляров отличается. Первые премоляры напоминают с вестибулярной поверхности коронку клыка и имеют сферическую форму. Эти зубы имеют один или два корня. Первые моляры играют большую роль при жевании (molaris — жернов). Жевательная поверхность этих зубов большая, форма ее ромбовидная. Первые верхние моляры имеют три корня [5]. Они самые крупные по форме и ранние зубы, прорезывающиеся первыми из всех постоянных зубов. Эта группа подвергается жевательной нагрузке раньше всех остальных зубов, и она же первой разрушается. Соответственно, первые моляры принимают максимальную силу при жевательной нагрузке. Согласно исследованиям, произведенным с помощью электрических приборов, во время пережевывания твердой пищи на моляры действует сила, равная 200—300 Н, при этом 1 Н равен 1 кг [11]. Эта группа зубов имеет наклон коронки в медиальном направлении, таким
Эта группа зубов имеет наклон коронки в медиальном направлении, таким
образом, жевательная сила, действующая на них, переносится на премоляры. Характерный волнистый ход пучков коллагеновых фибрилл периодонта приводит к незначительному смещению зубов при нагрузке, действующей на зубы. Волокна натягиваются либо сжимаются. Независимо от возникающей нагрузки или силы, действующей на зубы, выделяются две зоны сжатия и две зоны растяжения периодонтальной связки на различном уровне корня с разных поверхностей. Из полученных данных следует, что максимальный удельный объем плотной соединительной ткани соответствует зоне растяжения периодонта, с противоположной стороны в зоне сдавления периодонтальной связки отмечается наименьший ее объем.
Сила, давящая на зубы, распределяется по всему периметру периодонта и соответствует распределению кровеносных и лимфатических сосудов в данной группе зубов. С морфологической точки зрения при увеличении нагрузки отмечается выраженное полнокровие не только сосудов периодонтальной связки, но и костной ткани альвеолы, преобладание венозного компонента, гипертрофия сосудистой стенки [1]. При изучении гистологических срезов данной группы отмечается обильное кровоснабжение в зонах сжатия периодонта.
С морфологической точки зрения при увеличении нагрузки отмечается выраженное полнокровие не только сосудов периодонтальной связки, но и костной ткани альвеолы, преобладание венозного компонента, гипертрофия сосудистой стенки [1]. При изучении гистологических срезов данной группы отмечается обильное кровоснабжение в зонах сжатия периодонта.
Относительно первых премоляров верхней челюсти известно, что сила, действующая со стороны пережевывания твердой пищи, меньше, чем у моляров, и составляет 130—180 Н [11]. Сила, соответствующая жевательной нагрузке, действует под некоторым углом по отношению к оси зуба, и точка ее приложения не совпадает с осью на величину корня. Такое приложение силы характерно в первую очередь для премо-ляров, у которых жевательная площадка смещена орально в более значительной степени, чем у передних зубов и моляров. Первые премоляры отличаются по форме и анатомическому строению корней от ранее рассмотренных зубов. Эта группа зубов имеет два отдельно стоящих корня или один с раздвоенными верхушками. При изучении периодонта первых премо-ляров имеются отличительные признаки от первых моляров. В зависимости от точки сопротивления, прикладываемой при жевательной силе, нагрузка будет распределяться в средней части периодонта. Удельный объем плотной соединительной ткани варьирует на разных участках корня соответственно жевательной нагрузке.
Эта группа зубов имеет два отдельно стоящих корня или один с раздвоенными верхушками. При изучении периодонта первых премо-ляров имеются отличительные признаки от первых моляров. В зависимости от точки сопротивления, прикладываемой при жевательной силе, нагрузка будет распределяться в средней части периодонта. Удельный объем плотной соединительной ткани варьирует на разных участках корня соответственно жевательной нагрузке.
Наибольшая часть лимфатических сосудов сосредоточена в верхушечной зоне периодонта. В средней и десневой частях корня их количество меньше [14]. При ортодонтическом перемещении зубов наблюдается повышенное количество лимфатических сосудов в области сжатия периодонтальной связки. Их численный показатель увеличивается за счет повышенного выделения эндотелиального фактора роста, в месте сдавливания периодонта [15]. При анализе количественных данных удельных объемов кровеносных и лимфатических сосудов отмечается, что в зонах давления периодонта наибольший их объем, и аналогичная картина наблюдается в зоне растяжения перио-донтальной связки, где КС и ЛС меньше.
Выводы
1. Удельный объем плотной ткани преобладает в областях растяжения периодонта при жевательной нагрузке.
2. Удельный объем рыхлой волокнистой соединительной ткани преобладает в областях сжатия перио-донта.
3. Удельный объем кровеносных и лимфатических сосудов превалирует в зонах сжатия периодонтальной связки.
Литература
1. Антонова И.Н. Роль нарушений адаптации в патогенезе воспалительных заболеваний пародонта у спортсменов: автореф. дис. … д-ра мед. наук. СПб., 2008. 38 с.
2. Артюшкевич А.С., Трофимова Е.К., Латышева С.В. Клиническая периодонтология. Минск: Ураджай, 2002. 300 с.
3. Ашмарин А.Н. Состояние периодонта опорных зубов под несъемными протезами. дис. … канд. мед. наук. 2007. 104 с.
Ашмарин А.Н. Состояние периодонта опорных зубов под несъемными протезами. дис. … канд. мед. наук. 2007. 104 с.
4. Быков В. Л. Гистология и эмбриология органов полости рта человека. СПб.: Спец. литература, 1996. 246 с.
5. Гайвороновский И.В., Петрова Т.Б. Анатомия зубов человека. СПб.: ЭЛБИ-СПб., 2005. 54 с.
6. Гемонов В.В. Нервный аппарат периодонта и его место в системе рефлексогенных зон организма // Стоматология. 2001. № 4. С. 4—7.
7. Иванов В.С., Овруцкий Г.Д., Гемонов В.В. Практическая эндодонтия. М.: Медицина, 1984. 224 с.
8. Копейкин В.Н. Ортопедическое лечение заболеваний пародонта. М.: Триада Х, 1998. 176 с.
9. Сивоволов С.И. Клинические аспекты пародонтологии. М.: Триада Х, 2001. 165 с.
М.: Триада Х, 2001. 165 с.
10. Чуйко А.Н., Вовк В.Е. Особенности биомеханики в стоматологии. Харьков: Прапор, 2006. 304 с
11. Шварц А.Д. Биомеханика и окклюзия зубов. М.: Изд-во «АМЛ ЗАО», 1994. 204 с.
12. Шилько С.В. Биомеханический анализ периодонтальной связки // Рос. журн. биомеханики. 2003. № 3. С. 29—34.
13. Bolcato-Belleminl A.L., Elkaim R., Abehseral A. et al. Expression of mRNAs encoding for a and B integrin subunits, MMPs, and TIMPs in stretched human periodontal ligament and gingival fibroblasts // J. Dental Research. 2000. V. 79 (9). P. 1712—1716,
14. Berggreen E., Sivakami R. Haug, Lilian E. Mkonyi, Athanasia Bletsa. Characterization of the dental lymphatic system and identification of cells immunopositive to specific lymphatic markers // J. of Oral Sciences. 2009. V. 117, № 1. P. 34—42.
of Oral Sciences. 2009. V. 117, № 1. P. 34—42.
15. Miyagawa A., Chiba M., Hayashi H. et al. Compressive force induces VEGF production in periodontal tissues // J. Dental Research. 2009. V. 88 (8). P. 752—756.
16. Nakao K., Goto T., Gunjigake K.K. et al. Intermittent force induces high RANKL expression in human periodontal ligament cells // J. of Dental Research. 2007. V. 86, № 7. P. 623—628.
Поступила в редакцию 26.04.2010 г. Утверждена к печати 13.05.2010 г.
Сведения об авторах
М.В. Хертек — аспирантка кафедры гистологии эмбриологии и цитологии СибГМУ (г. Томск). Для корреспонденции
Хертек Марина Васильевна, тел. 8-923-405-08-61, @шаП: [email protected]
Периодонтит
Классическими признаками периодонтита являются наличие резкой локализованной боли постоянного характера. Вначале при остром периодонтите отмечается нерезко выраженная ноющая боль, которая локализована и соответствует области поражённого зуба.
Вначале при остром периодонтите отмечается нерезко выраженная ноющая боль, которая локализована и соответствует области поражённого зуба.
Позднее боль становится более интенсивной, рвущей и пульсирующей, иногда боль отдает в область глаза, виска, уха, что свидетельствует о переходе в гнойное воспаление. Появляется ощущение выдвижения больного зуба из зубной дуги (симптом выросшего зуба), при жевании резкая боль, он становится подвижным.
Общее состояние также ухудшается: отмечаются недомогание, головная боль, температура тела (из-за боли зубов) повышается до 37-38 °С.
При появлении хоть одного симптома данного заболевания вам необходимо обратиться за консультацией к специалисту. В нашей клинике в консультацию врача войдет составление плана лечения хоть для одного зуба, хоть для всей полости рта, а так же, при необходимости, в консультацию уже включено рентгеновское обследование на радиовизиографе. На консультации врач объяснит вам все этапы лечения вашего зуба, а также подробно распишет стоимость каждого этапа.
Периодонтит
Периодонтит – воспалительное заболевание периодонта, возникающее у верхушки корня зуба. Периодонтом называют связки зуба, которые находятся в узкой щели между костью и зубами. Периодонтиты являются более тяжелыми заболеваниями, чем кариес и пульпит. Воспалительный процесс возникает в результате поступления инфекции и токсинов через корневой канал в связки зуба.
Стадии развития периодонтита
Выделяют две основные группы периодонтитов: хронический и острый. Как правило, острый периодонтит встречается чуть реже. Данный факт специалисты объясняют тем, что при развитии воспаления в тканях периодонта существует отток экссудата и больной может вовсе и не замечать, на протяжении нескольких лет наличия у него такого заболевания.
Симптомы периодонтита
Острый периодонтит имеет следующие симптомы: постоянные резкие давящие или рвущие боли в области причинного зуба, которые обязательно усиливаются от прикосновения, нажатия или постукивания по нему. Возникает чувство выросшего зуба. Присутствует отек мягких тканей губы, десны или щеки в области больного зуба, сам зуб имеет некоторую степень подвижности. Довольно часто, на десне в проекции верхушки корня образуется свищ, из которого вытекает гной. Свищи чаще всего образуются при периодонтите у детей, но и у взрослых тоже бывают. Свищ представляет собой канал, который предназначен для оттока гнойного экссудата из воспалительного очага. Также увеличены лимфатические узлы.
Возникает чувство выросшего зуба. Присутствует отек мягких тканей губы, десны или щеки в области больного зуба, сам зуб имеет некоторую степень подвижности. Довольно часто, на десне в проекции верхушки корня образуется свищ, из которого вытекает гной. Свищи чаще всего образуются при периодонтите у детей, но и у взрослых тоже бывают. Свищ представляет собой канал, который предназначен для оттока гнойного экссудата из воспалительного очага. Также увеличены лимфатические узлы.
Хронический периодонтит может не проявляться долгое время и вообще протекать без всяких симптомов. Единственно что пациент помнит это то, что этот зуб, когда то давно, у него болел. При осмотре зуб сильно разрушен и его коронка изменена в цвете до серого, особенно в области шейки. Слизистая пастозная и отечная.
Хронический периодонтит
Обострение хронического периодонтита протекает с теми же симптомами что и острый, единственное отличие будет выявлено на рентген снимке. Любой хронический периодонтит разрушает костную ткань и это будет видно на рентгене.
Причины периодонтита
Стоматологи выделяют несколько основных причин возникновения данного заболевания: острое или хроническое воспаление пульпы зуба, не вылеченные вовремя кариозные процессы, травмы зубов. Чаще всего же периодонтит возникает из-за инфекции. Попадание инфекции в периодонт может быть также обусловлено такими заболеваниями как периостит и остеомиелит.
Диагностика периодонтита
Врач ставит диагноз на основании опроса, клинической картины и дополнительных методом исследования пациента. Дополнительные методы: рентген и ЭОД. Если сказать простыми словами ЭОД это реакция пульпы на электрический ток, не бойтесь, процедура абсолютно безболезненная. Периодонтит выдает показатели ЭОД больше 100 микроампер. На рентгене, как правило, видна полость около верхушки зуба в виде темной тени различного диаметра.
Лечение периодонтита
Если вы обнаружили у себя симптомы данного заболевания, вам немедленно следует обратиться к врачу. Строго запрещается греть какими-либо способами область воспаления. Согревание только ухудшает состояние и повышает скорость развития воспалительного процесса. Затягивание процесса лечения в лучшем случае ведет к хроническим процессам, в худшем — к тяжелым осложнениям.
Строго запрещается греть какими-либо способами область воспаления. Согревание только ухудшает состояние и повышает скорость развития воспалительного процесса. Затягивание процесса лечения в лучшем случае ведет к хроническим процессам, в худшем — к тяжелым осложнениям.
Этапы лечения периодонтита
Выделяют несколько типов периодонтитов, тактика лечения зависит от множества факторов: длительность болей, характер рентгенологических изменений, жалобы пациента, результаты дополнительных исследований. Лечат периодонтит как правило за 2-3 посещения.
В первое посещение проводится:
Для точности врач делает диагностический рентген снимок
-Обезболивание
-Удаление пораженных кариесом твердых тканей зуба.
-Удаление мертвой пульпы или распломбировка каналов зуба, если зуб был ранее лечен по причине пульпита.
-Инструментальная и медикаментозная обработка всех корневых каналов.
-Пломбирование каналов различными лекарственными пастами
-Постановка временной пломбы.
На повторное посещение пациент обязательно приходит через время, обозначенное врачом (от нескольких дней, то 2-3 месяцев). Временную пломбу удаляют, лекарственные препаратов также убирают из корневых каналов. Вновь промывают каналы антисептическими препаратами (хлоргексидин, гипохлорид натрия). В случае отсутствия жалоб, клинических признаков периодонтита, каналы пломбируют постоянными пломбировочными материалами (гуттаперчивые штифтики и специальный цемент для корневых каналов). Делают Рентгеновский снимок для контроля качества пломбировки каналов.
В большинстве случаев зуб сразу же можно восстановить пломбой после пломбировки каналов, если из-за объема разрешения зуб не восстановить даже с использованием стекловолоконных и анкерных штифтов, то необходимо ортопедическое восстановление (металлокерамическая либо циркониевая коронка). При направлении к ортопеду дополнительная консультация не оплачивается, ортопед восстановит вам зубик за 2-3 посещения.
На картинке ниже хорошо отображены все этапы лечения:
Профилактика и осложнения
К профилактике периодонтита относится своевременное лечение у стоматолога кариеса, пульпита и болезней десен.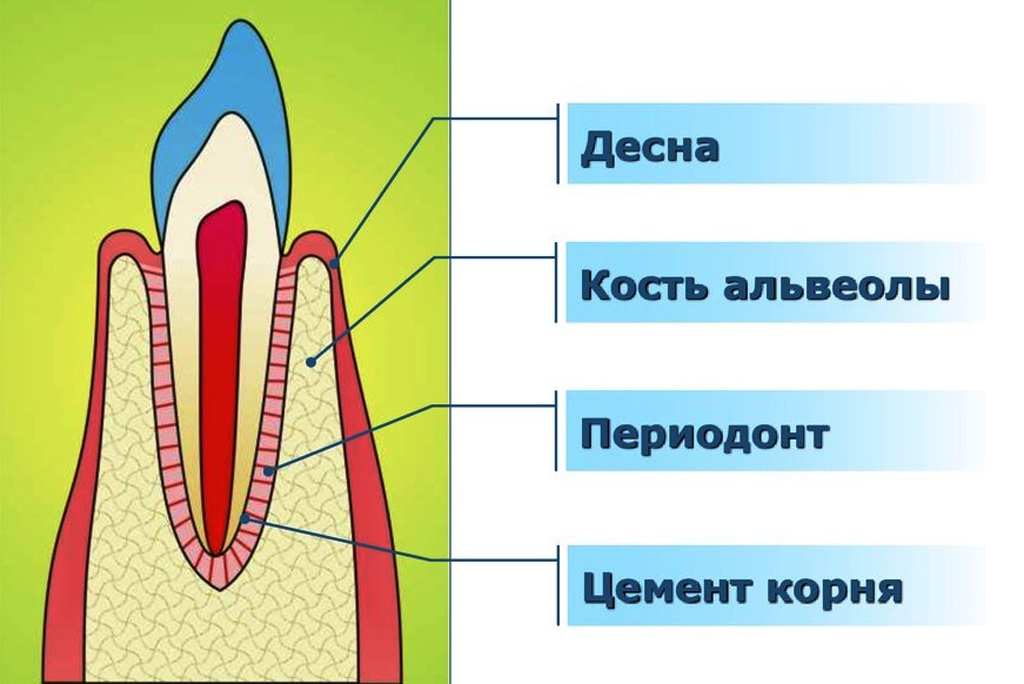 А также надо не забывать дважды в год проходить профилактический осмотр. Периодонтит обязательно нужно лечить. При отсутствии процесса лечения инфекция распространяется дальше на соседние ткани, при этом возникают более опасные заболевания: флегмоны, абсцессы, гайморит и другие.
А также надо не забывать дважды в год проходить профилактический осмотр. Периодонтит обязательно нужно лечить. При отсутствии процесса лечения инфекция распространяется дальше на соседние ткани, при этом возникают более опасные заболевания: флегмоны, абсцессы, гайморит и другие.
Ознакомиться с нашим прейскурантом на лечение вы можете по ссылке — «Цены».
Для записи на прием звоните по телефону 8 (812) 570-19-19 либо заполните форму «Электронной записи на прием» и мы Вам обязательно перезвоним для подтверждения.
Реакция тканей пародонта на чрезмерные нагрузки – STOMWEB.RU
Автор: Fermin A. Carranza
Адаптационный потенциал тканей пародонта к окклюзионным нагрузкам
Ткани пародонта стремятся приспособиться к силам, действующим на коронку. Этот адаптационный потенциал различается у разных людей и у одного и того же человека в разное время. Влияние окклюзионных нагрузок на ткани пародонта зависит от их величины, направления, продолжительности и частоты.
При увеличении величины окклюзионных нагрузок происходит расширение периодонтальной щели, увеличение числа и ширины волокон периодонта и увеличение плотности альвеолярной кости.
Изменение направления окклюзионных нагрузок вызывает переориентацию напряжений и деформаций в периодонте (рис. 15-1).
Рисунок 15-1 Картина распределения напряжений вокруг корней изменяется в результате изменения направления окклюзионных сил (экспериментальная модель с использованием фотоупругого анализа). A, Буккальный вид моляра, подвергнутого действию осевой силы. Затемненные участки показывают, что внутренние напряжения присутствуют на верхушках корней. B, Буккальный вид моляра, подвергнутого действию медиальной силы. Затемненные участки указывают на то, что внутренние напряжения присутствуют вдоль медиальной поверхности и на верхушке медиального корня.
Основные волокна периодонтальной связки расположены таким образом, что они наилучшим образом приспосабливаются к окклюзионным силам, действующим вдоль длинной оси зуба. Латеральные (горизонтальные) и вращающие (ротационные) нагрузки наиболее часто приводят к повреждению тканей пародонта.
Реакция альвеолярной кости также зависит от продолжительности и частоты воздействия окклюзионных сил. Постоянное давление на кость более губительно, чем периодическое. Чем чаще применяются периодические силы, тем нагрузка более разрушительна для пародонта.
Окклюзионная травма
Свойственный организму «запас прочности», общий для всех тканей, позволяет приспосабливаться к некоторым изменениям окклюзии без неблагоприятного воздействия на ткани пародонта. Однако когда окклюзионные нагрузки превышают адаптивную способность тканей, происходит их повреждение. Полученная травма называется травмой от окклюзии, также известной как травматизм или окклюзионная травма.
Таким образом, травма от окклюзии относится к повреждению ткани, а не к окклюзионной силе. Окклюзия, которая вызывает такое повреждение, называется травматической окклюзией. Чрезмерные окклюзионные нагрузки могут также нарушать функцию жевательной мускулатуры и вызывать болезненные спазмы, повреждать височно-нижнечелюстные суставы или способствовать повышенной стираемости зубов. Тем не менее, термин травма от окклюзии обычно используется в отношении поражения тканей пародонта.
Острая и хроническая травма
Окклюзионная травма может быть острой или хронической. Острая травма происходит в результате резкого удара при смыкании зубных рядов, такого как при надкусывании твердых предметов (например, оливковой косточки). Реставрации или протезы, которые создают препятствия или изменяют направление окклюзионных сил на зубы также могут вызвать острую травму.
Острая травма приводит к появлению боли в зубах, болезненности при перкуссии и увеличению подвижности зубов. Если действие фактора прекращается путем изменения положения зуба или путем истирания или коррекции реставрации, травма исчезает и симптомы стихают. В противном случае, травма может прогрессировать и привести к некрозу тканей пародонта с образованием пародонтальных абсцессов, или может сохраняться как бессимптомное, хроническое состояние. Острая травма может также стимулировать образование цементиклей (рис 15-2).
Рисунок 15-2 В образце аутоптата человека отмечается образование цементиклей, вероятно вызванных острой окклюзионной травмой. Обратите внимание на процесс репарации кости в области смещения, разрыв цемента и восстановление периодонтальной связки.
Хроническая окклюзионная травма встречается чаще, чем острая и имеет большее клиническое значение. Она чаще всего развивается в результате постепенных изменений окклюзионных взаимоотношений вследствие стираемости, смещения и экструзии зубов в сочетании с парафункциями, такими как бруксизм и сжатие, а не как продолжение острой травмы пародонта. Далее обсуждаются особенности хронической травмы от окклюзии и их значение.
Критерием, определяющим будет ли окклюзия травматической, является наличие повреждения тканей пародонта, а не характер смыкания зубов. Любая окклюзия, приводящая к травме пародонта, является травмирующей. Нарушение окклюзии не обязательно приводит к травме пародонта; она может произойти даже, когда окклюзия кажется нормальной. Зубочелюстная система может быть анатомически и эстетически приемлемой, но функционально разрушительной. Аналогичным образом не всякая патологическая окклюзия травмирует ткани пародонта. Травматические окклюзионные отношения называются такими терминами, как окклюзионная дисгармония, функциональный дисбаланс и окклюзионная дистрофия. Эти термины относятся к влиянию окклюзии на ткани пародонта, а не к положению зубов. Так как травма от окклюзии относится к повреждению ткани, а не к окклюзии, повышенная окклюзионная нагрузка не является травмирующей, если ткани пародонта могут к ней приспособиться.
Первичная и вторичная окклюзионная травма
Окклюзионная травма может быть возникнуть при изменении окклюзионных сил, снижении способности тканей пародонта противостоять окклюзионным нагрузкам или при наличии обоих факторов. Когда травма от окклюзии является результатом изменений окклюзионных сил, ее называют первичной окклюзионной травмой. Когда же она является результатом снижения способности тканей противостоять окклюзионным нагрузкам, ее называют вторичной окклюзионной травмой.
Первичная окклюзионная травма возникает, если травматическая окклюзия считается первичным этиологическим фактором в деструкции тканей пародонта и, если имеются только местные изменения, которым подвергается зуб. Примерами являются травма пародонта, произошедшая вокруг зубов со здоровым пародонтом после (1) установки “завышающей пломбы”, (2) использования протеза, создающего избыточные силы, действующие на опорные зубы и зубы-антагонисты (3), перемещения или экструзии зубов в пространства, созданные отсутствующими зубами, или (4) ортодонтического перемещения зубов в функционально неприемлемые позиции. Большинство исследований окклюзионной травмы на животных изучали первичный тип травмы. Изменения, произошедшие в результате первичной травмы, не изменяют уровень прикрепления и не инициируют формирование кармана. Это, вероятно, потому, что не затрагиваются супраальвеолярные волокна и, следовательно, предотвращается апикальная миграция соединительного эпителия.
Вторичная окклюзионная травма возникает, когда нарушается адаптивная способность тканей противостоять окклюзионным нагрузкам вследствие резорбции костной ткани или маргинального воспаления. Это приводит к разрушению периодонтальной связки и изменению функции остальных тканей. Пародонт становится более восприимчивым к травмам, и ранее хорошо переносимые окклюзионные нагрузки становятся травмирующими.
На рисунке 15-3 изображены три различные ситуации воздействия чрезмерных окклюзионных нагрузок:
- Зубы с нормальным пародонтом и нормальным уровнем кости
- Зубы с нормальным пародонтом и снижением высоты кости
- Зубы с маргинальным пародонтитом и снижением высоты кости
Рисунок 15-3 Травматические нагрузки могут оказывать действие на А, зубы с нормальным пародонтом и нормальной высотой кости; B, зубы с нормальным пародонтом и сниженной высотой кости; или С, зубы с маргинальным пародонтитом с сниженной высотой кости.
Первый случай является примером первичной окклюзионной травмы, тогда как последние два представляют собой примеры вторичной окклюзионной травмы. Последствия травмы от окклюзии в этих различных ситуациях анализируются далее.
В экспериментальных исследованиях на животных было обнаружено, что системные нарушения могут снизить резистентность тканей, и ранее переносимые нагрузки могут стать избыточными. Теоретически может быть представлен другой механизм, с помощью которого устойчивость тканей к чрезмерному действию нагрузок снижается, приводя к возникновению вторичной окклюзионной травмы.
Стадии ответной реакции ткани на чрезмерную окклюзионную нагрузку
Ответная реакция ткани проходит в три этапа: повреждение, репарация и адаптивное ремоделирование пародонта.
I этап: Повреждение
Повреждение ткани происходит вследствие чрезмерных окклюзионных нагрузок. Затем организм пытается устранить повреждение и восстановить ткани пародонта. Это происходит, если действие нагрузок ослабляется или если зуб сдвигается, что приводит к прекращению их действия на него. Если эти нагрузки носят хронический характер, пародонт ремоделируется, чтобы амортизировать их воздействие. Периодонтальная связка расширяется за счет кости, приводя к образованию угловых костных дефектов без пародонтальных карманов и ослаблению зуба.
Под действием окклюзионных сил зуб поворачивается вокруг точки опоры или оси вращения, которая в однокорневых зубах находится на границе между средней и апикальной третью корня, а в многокорневых зубах в середине интеррадикулярной кости (рис 15-4).
Рисунок 15-4 Очаги натяжения и сдавления на противоположных участках периодонтальной связки, экспериментально вызванные ортодонтическим перемещением моляра крысы.
Это создает области сдавления и натяжения на противоположных сторонах точки опоры. Различные повреждения производятся различной степенью сдавления и натяжения. Если воздействуют смещающие силы, то в одной области могут сосуществовать различные повреждения.
Участками пародонта, наиболее восприимчивыми к повреждениям от чрезмерных окклюзионных нагрузок, являются области фуркации.
Повреждение пародонта приводит к временному снижению митотической активности и скорости пролиферации и дифференцировки фибробластов, образования коллагена и формирования костной ткани. Они возвращаются к нормальному уровню после прекращения воздействия нагрузок.
II этап: Репарация
В нормальном пародонте постоянно происходит репарация, а окклюзионная травма стимулирует повышение репаративной активности.
Поврежденные ткани удаляются, и образуются новые клетки и волокна соединительной, костной ткани и цемента для восстановления поврежденного пародонта (рис 15-5).
Рисунок 15-5 Экспериментальная окклюзионная травма у крыс. Участок некроза маргинального пародонта, резорбция и ремоделирование более апикальных участков.
Нагрузки остаются травматическими только до тех пор, пока повреждение превышает репаративную способность тканей.
III Стадия: Адаптивное ремоделирование пародонта
Если процесс восстановления отстает от процесса разрушения, вызванного окклюзионной нагрузкой, пародонт ремоделируется, стремясь создать структурные отношения, при которых эти силы не оказывают повреждающего действия на ткани. Это приводит к расширению периодонтальной связки, которая принимает форму воронки, и образованию угловых костных дефектов без формирования кармана. Вовлеченные зубы становятся ослабленными. Также сообщается об усилении васкуляризации.
Три этапа развития травматических повреждений различаются гистометрически относительным количеством костной ткани, подвергающейся резорбции или формированию (рисунок 15-8).
Рисунок 15-8 Эволюция травматических повреждений, экспериментально представленных на крысах путем вариации относительных величин областей образования и резорбции костной ткани пародонта. Горизонтальная ось — количество дней после начала действия травматического фактора. Вертикальная ось — процент резорбируемой или формирующейся костной ткани. Этапы эволюции поражений представлены на верхних рисунках, которые показывают среднее количество костной активности для каждой группы.
Фаза повреждения показывает увеличение участков резорбции и ослабление образования костной ткани, в то время как фаза репарации демонстрирует уменьшение участков резорбции и усиление образования костной ткани. После адаптивного ремоделирования пародонта, резорбция и формирование возвращаются к норме.
Когда кость резорбируется под действием чрезмерных окклюзионных сил, организм старается укрепить истонченные костные трабекулы новой костью. (Рисунок 15-6).
Рисунок 15-6 Апикальная область премоляра собаки, подвергнутая экспериментальной окклюзионной травме, вызывающая интрузию зуба и участки некроза периодонтальной связки. Обратите внимание на активное формирование кости на внешней стороне и резорбцию на периферии некротического участка.
Эти попытки компенсировать потерю кости приводят к формированию экзостозов и являются главной особенностью ремоделирования из-за окклюзионной травмы. Это также происходит, когда кость разрушается воспалительным процессом или остеолитическими опухолями.
Экзостозы могут формироваться как в теле челюсти (центральные экзостозы), так и на поверхности кости (периферические экзостозы). В центральном экзостозе эндостелиальные клетки образуют новую кость, которая восстанавливает костные трабекулы и снижает размер костномозгового пространства. Периферический экзостоз возникает на вестибулярной или лингвальной поверхностях альвеолярной пластинки. В зависимости от тяжести периферический экзостоз может образовывать полкообразное утолщение на маргинальном крае альвеолы (Рисунок 15-7), или выраженную выпуклость в вестибулярной и лингвальной кости.
Рисунок 15-7 А, Расширение периодонтальной щели в пришеечной области зуба и изменение формы маргинальной альвеолярной кости в результате хронической длительной окклюзионной травмы у крыс. B, Аналогичные изменения маргинальной кости, обнаруженные в аутоптате человека.
Влияние недостаточной окклюзионной нагрузки
Недостаточная окклюзионная нагрузка также может оказывать повреждающее действие на ткани пародонта. Недостаточная стимуляция вызывает истончение периодонтальной связки, атрофию волокон, остеопороз альвеолярной кости, а также уменьшение высоты костной ткани. Гипофункция может возникнуть в результате открытого прикуса, отсутствия антагониста или односторонних жевательных привычек, которые способствуют запущенности одной стороны полости рта.
Восстановление травматических поражений
Окклюзионная травма является обратимой. Когда травма индуцируется искусственно у экспериментальных животных, зубы отодвигаются или внедряются в челюсть. Когда действие искусственно созданной силы ослабевает, ткани подвергаются восстановлению. Несмотря на то, что при таких условиях травма от окклюзии обратима, она не всегда проходит сама собой, и поэтому не всегда является временной или имеет незначительное клиническое значение. Для процесса репарации должно уменьшиться действие повреждающего фактора. Если условия в организме человека не позволяют зубам избежать или адаптироваться к чрезмерной окклюзионной нагрузке, повреждение пародонта сохраняется и усугубляется.
Наличие воспалительного процесса в пародонте в результате накопления зубных отложений может привести к снижению потенциала восстановления травматических повреждений.
Влияние чрезмерных окклюзионных нагрузок на пульпу зуба
Воздействие чрезмерных окклюзионных нагрузок на пульпу зуба не установлено. Некоторые врачи сообщают об исчезновении пульпарных симптомов после коррекции чрезмерных окклюзионных нагрузок. Реакция пульпы была отмечена у животных, подвергающихся повышенным окклюзионным нагрузкам, но отсутствовала, когда силы были минимальными и происходили в течение короткого промежутка времени.
Влияние окклюзионной травмы на развитие маргинального пародонтита
Ранние клинические наблюдения исследователей и клиницистов в этиологии заболеваний пародонта отводят важную роль окклюзионной травме. С тех пор многочисленные исследования пытались определить механизмы, с помощью которых травма от окклюзии может оказывать влияние на заболевания пародонта.
Первые исследования включали фиксацию высоких коронок или реставраций на зубах собак или обезьян, что приводило к действию непрерывной или периодической силы в одном направлении. Эти исследования обеспечили ортодонтический тип нагрузки и дали четкое описание изменений, происходящих в зонах высокого сдавления и натяжения. Такие процедуры, как правило, приводят к перемещению зубов и консолидации в новом, не оказывающем травматического действия положении.
Окклюзионная травма в организме человека, тем не менее, является результатом сил, которые действуют в противоположных направлениях. Они были проанализированы на экспериментальных животных с использованием «смещающих сил», производимых высокой коронкой, в сочетании с ортодонтическим устройством, который приводил травмированный зуб обратно в исходное положение, когда воздействие силы было ослаблено путем разделения зубов. В другом случае зубы были разделены деревянными или эластичными клиньями для их смещения к противоположной стороне. Через 48 часов клин удаляли, и процедура повторялась на противоположной стороне.
Эти исследования продемонстрировали комбинацию изменений, вызванных сдавлением и натяжением на обеих сторонах зуба, с увеличением ширины периодонтальной связки и увеличением подвижности зубов. Ни один из этих методов не вызывает воспаления или образования пародонтального кармана, а результаты представили различные степени функциональной адаптации к повышенным нагрузкам.
Для того, чтобы более точно имитировать проблемы, возникающие в организме человека, исследования были затем проведены с одновременным наличием индуцированного бляшкой воспаления десен и влиянием смещающей силы.
Накопление бактериального налета, который инициирует гингивит и приводит к образованию пародонтального кармана, влияет на маргинальную десну, а окклюзионная травма происходит в опорных тканях и не оказывает на нее влияния (рис 15-9).
Рисунок 15-9. Взаимодействие между зубной бляшкой и организмом хозяина осуществляется в области десневой борозды. Окклюзионная травма наблюдается в опорных тканях зуба.
Маргинальная десна не подается действию травмы от окклюзии, потому что ее кровоснабжение не снижается, даже тогда, когда сосуды периодонтальной связки облитерированы вследствие чрезмерных окклюзионных нагрузок. Неоднократно продемонстрировано, что окклюзионная травма не вызывает формирования карманов или гингивита и не увеличивает количества десневой жидкости. † Кроме того, экспериментальная травма у собак не влияет на бактериальную репопуляцию карманов после скейлинга и сглаживания корня. Однако подвижные зубы у человека содержат значительно большее количество Campylobacter rectus и Peptostreptococcus micros, чем неподвижные.
До тех пор пока воспаление ограничивается десной, воспалительный процесс не зависит от окклюзионных сил. Когда воспаление распространяется на опорные ткани пародонта (то есть, когда развивается пародонтит), индуцированное бляшкой воспаление располагается в зоне влияния окклюзии, которую Glickman назвал зоной совместного поражения.
Две группы, экспериментально изучая эту тему, получили противоречивые результаты, вероятно, из-за различия используемых методов. Группа The Eastman Dental Center group in Rochester, NY, использовали беличьих обезьян, получающих травму от повторяющихся межзубных вклиниваний и имеющих воспаление десен от легкой до умеренной степени; экспериментальное время составляло до 10 недель. Они сообщили, что наличие травмы не привело к увеличению потери прикрепления, индуцированного пародонтитом. University of Gothenburg group in Sweden использовали собак породы бигль, получающих травму вследствие размещения колпачковой назубной шины и ортодонтических приспособлений и имеющих воспаление десен тяжелой степени; экспериментальное время составило до 1 года. Эта группа обнаружила, что окклюзионные напряжения увеличивают деструкцию тканей пародонта, вызванной пародонтитом.
При устранении окклюзионной травмы происходит существенное изменение резорбции костной ткани, за исключением пародонтита. Это свидетельствует о том, что воспаление ингибирует регенерацию костной ткани. Таким образом, в случаях окклюзионной травмы важно ликвидировать маргинальный воспалительный компонент, так как после удаления травмирующих контактов наличие воспаления влияет на регенерацию костной ткани. Кроме того, в экспериментах на животных было показано, что травма от окклюзии не вызывает прогрессирующую деструкцию тканей пародонта в здоровых областях после ликвидации ранее существовавшего пародонтита.
Окклюзионная травма также приводит к изменению формы альвеолярного гребня. Оно представлено расширением маргинальной периодонтальной щели, сужением интерпроксимальной альвеолярной кости и выступообразным утолщением альвеолярного края. Поэтому, хотя травма от окклюзии не изменяет воспалительного процесса, она изменяет архитектуру области вокруг воспаленного участка. Таким образом, при отсутствии воспаления ответная реакция на окклюзионную травму ограничивается адаптацией к повышенным нагрузкам. При наличии воспаления, однако, изменения формы альвеолярного гребня могут способствовать ангулярной резорбции костной ткани, а также образованию внутрикостных карманов.
Другие теории, объясняющие взаимосвязь травмы и воспаления, включают в себя следующее:
- Окклюзионная травма может изменять направление распространения десневого воспаления в подлежащие ткани. Это может способствовать снижению плотности коллагена и увеличению количества лейкоцитов, остеокластов и кровеносных сосудов в коронковой части подвижных зубов. Воспаление может затем перейти на периодонтальную связку, а не на кость. В результате резорбция костной ткани становится ангулярной, а карманы могут стать внутрикостными.
- Посттравматические участки резорбции корня, незакрытые апикальным перемещением воспаленного десневого прикрепления, могут создать благоприятные условия для формирования и прикрепления зубного налета и камней и, следовательно, способствовать развитию более глубоких поражений.
- Наддесневая бляшка может стать поддесневой, если зуб повернут oртодонтически или смещается в беззубый участок, что приводит к трансформации надкостного кармана во внутрикостный.
- Увеличение подвижности травматически ослабленных зубов может оказывать насосный эффект на метаболиты бляшки, увеличивая их проникновение.
Клинические и рентгенологические признаки окклюзионной травмы
Наиболее распространенным клиническим признаком травмы пародонта является увеличение подвижности зуба. На стадии повреждения травм от окклюзии происходит разрушение волокон периодонта, что увеличивает подвижность зубов. На заключительном этапе адаптация пародонта к повышенным нагрузкам влечет за собой расширение периодонтальной связки, что также приводит к увеличению подвижности зуба. Хотя эта подвижность зуба больше так называемой физиологической подвижности, ее нельзя считать патологической, так как она является приспособительной. Если же она прогрессирует, приводя к ухудшению, то ее можно считать патологической.
Другими причинами увеличения подвижности зубов являются прогессирующая резорбция костной ткани, воспаление периодонтальной связки, а также некоторые системные факторы (например, беременность). Деструкция окружающей альвеолярной кости, например, как при остеомиелите или опухолях челюстей, также может способствовать увеличению подвижности зубов.
Рентгенографические признаки окклюзионной травмы могут включать в себя следующее:
- Увеличение ширины периодонтальной щели, часто с утолщением кортикальной пластинки вдоль латеральной поверхности корня в апикальной области, а также в областях бифуркаций. Эти изменения не обязательно указывают на деструктивные изменения, потому что они могут возникнуть в результате утолщения и укрепления периодонтальной связки и альвеолярной кости, представляя собой благоприятную ответную реакцию на повышенные окклюзионные нагрузки.
- «Вертикальная», а не «горизонтальная» деструкция межзубной перегородки.
- Разрежение и уплотнение альвеолярной кости.
- Резорбция корня.
Таким образом, окклюзионная травма не инициирует гингивит или образование пародонтальных карманов, но может стать дополнительным фактором риска прогрессирования и тяжести заболевания. Понимание влияния травмы от окклюзии на ткани пародонта является полезным при лечении заболеваний пародонта.
Патологическое перемещение зубов
Патологическое перемещение говорит о сдвиге зуба, которое возникает при нарушении баланса среди факторов, поддерживающих физиологическое положение зуба, вследствие заболеваний пародонта. Патологическое смещение является довольно распространенным явлением и может быть ранним признаком заболевания, или может развиваться в связи с воспалением десны и формированием кармана при прогрессировании заболевания.
Патологическое перемещение происходит чаще всего в области передних зубов, однако также могут быть затронуты задние зубы. Зубы могут двигаться в любом направлении, смещение обычно сопровождается подвижностью и ротацией. Патологическое смещение в окклюзионном или резцовом направлении называется экструзией. Встречаются все степени патологического перемещения, и могут быть вовлечены один или несколько зубов (рисунок 15-10).
Рисунок 15-10. Лабиальное перемещение центральных резцов верхней челюсти, особенно правого. A, вид спереди B, вид сбоку.
Важно обнаружить смещение на ранних стадиях и предотвратить более серьезное поражение путем устранения причинных факторов. Даже на ранней стадии происходит определенная степень резорбции костной ткани.
Патогенез
В обеспечении нормального положения зубов определенную роль играют два основных фактора: здоровое состояние и нормальная высота поддерживающего аппарата зуба и силы, воздействующие на зубы. Последнее включает в себя окклюзионные силы, давление со стороны губ, щек и языка. Факторы, которые важны в отношении окклюзионных нагрузок, включают в себя морфологические признаки зуба и бугорковую инклинацию; наличие полного комплекта зубов; физиологическую тенденцию к медиальному смещению; характер и расположение контактных точек; проксимальную, инцизальную и окклюзионную стираемость; и осевую инклинацию зубов. Изменение любого из этих факторов способствует развитию взаимосвязанной последовательности изменений в области одного зуба или группы зубов, что может привести к патологическому смещению. Таким образом, патологическое смещение происходит при условиях, которые ослабляют опорные ткани пародонта, увеличивают или модифицируют силы, воздействующие на зубы.
Ослабление опорных тканей пародонта
Воспалительная деструкция тканей пародонта при пародонтите создает дисбаланс между силами, поддерживающими зуб в нормальном положении, и окклюзионными и мышечными силами, обычно выдерживаемых зубом. Зуб с ослабленными опорными тканями не в состоянии сохранять свое нормальное положение в дуге и потому удаляется от противостоящей силы, если не сдерживается проксимальным контактом. Сила, которая перемещает слабо поддерживаемый зуб, может быть создана с помощью таких факторов, как окклюзионные контакты или давление со стороны языка.
Важно понимать, что патологическое перемещение происходит из-за ослабленных тканей пародонта; сама сила не обязательно аномальна. Силы, которые являются приемлемыми для интактного пародонта, становятся губительными при ослаблении опорных тканей пародонта, как и в зубах с аномальными проксимальными контактами. Аномально расположенные проксимальные контакты преобразовывают обычный передний компонент нагрузки в расклинивающую силу, которая перемещает зуб окклюзионно или инцизиально. Расклинивающая сила, которая может быть выдержана интактным пародонтом, приводит к экструзии зуба при ослаблении опорных тканей пародонта вследствие заболевания. При изменении положения зуб подвергается аномальным окклюзионных силам, которые усугубляют деструкцию тканей пародонта и смещение зубов.
Патологическое смещение может продолжаться после того, как зуб больше не контактирует с антагонистами. Нагрузку обеспечивает давление со стороны языка, пищевого комка во время жевания и пролиферирующей грануляционной ткани.
Патологическое смещение также является ранним признаком локализованного агрессивного пародонтита. Резцы верхней и нижней челюстей с ослабленным пародонтом смещаются лабиально и выталкиваются, образовывая диастему между зубами.
Изменения сил, воздействующих на зубы
Изменения величины, направления или частоты сил, действующих на зубы, могут вызвать патологическое перемещение зуба или группы зубов. При достаточном ослаблении тканей пародонта эти силы не обязательно должны быть аномальными, чтобы вызвать смещение зубов. Изменения сил могут возникнуть в результате наличия незамещенных отсутствующих зубов или других причин.
Отсутствие замещения недостающих зубов
Часто смещение зубов происходит в участки, созданные отсутствующими зубами. Оно отличается от патологического смещения тем, что не является результатом деструкции тканей пародонта. Тем не менее, создает условия, которые приводят к заболеваниям пародонта, и, таким образом, первоначальное движение зубов усугубляется разрушением поддерживающих тканей пародонта (рис 15-11).
Рисунок 15-11 Зубные камни и резорбция костной ткани на мезиальной поверхности клыка, смещенного в дистальном направлении.
Перемещение обычно происходит в медиальном направлении, в сочетании с наклоном или экструзией за пределы окклюзионной плоскости. Премоляры часто смещаются дистально (рис 15-12).
Рисунок 15-12. Моляр верхней челюсти наклонен и выдвинут в пространство, образованное вследствие отсутствия зуба нижней челюсти.
Хотя перемещение является общим осложнением при отсутствии замещения недостающих зубов, оно происходит не всегда (Рисунок 15-13).
Figure 15-13 Отсутствие перемещения или экструзии зубов, несмотря на отсутствие в течение 4 лет зубов нижней челюсти.
Отсутствие замещения первого моляра
Наблюдаются характерные изменения, которые могут привести к невозможности замещения отсутствующих первых моляров. В крайних случаях они включают следующие компоненты:
- Второй и третий моляры наклоняются мезиально, что приводит к уменьшению вертикального размера (рис 15-14).
- Премоляры перемещаются дистально, нижние резцы наклоняются или смещаются лингвально. При этом смещенные дистально премоляры нижней челюсти теряют межбугорковый контакт с зубами верхней челюсти и могут наклоняться дистально.
- Глубокий прикус в переднем отделе увеличивается. Нижние резцы контактируют с резцами верхней челюсти около десны или травмируют десну.
- Резцы верхней челюсти смещаются лабиально и латерально (рис 15-15).
- Наблюдается экструзия передних зубов, так как в значительной степени исчезает инцизальный контакт.
- Образование диастемы (рис 15-14).
Рисунок 15-14 Примеры нарушения окклюзии, связанного с отсутствием замещения недостающих зубов. Обратите внимание на выраженное патологическое смещение, нарушенные проксимальные контакты и функциональные взаимоотношения.
Рисунок 15-15. Резцы верхней челюсти наклонены лабиально у пациента с двусторонними не замещенными дефектами нижней челюсти. Обратите внимание на экструзию верхних моляров.
Нарушенные проксимальные контакты способствуют застреванию пищи, накоплению зубного налета, приводя к воспалению десен, а также формированию кармана, а затем резорбции костной ткани и подвижности зубов. Нарушение окклюзии, образованное изменением положения зубов, травмирует опорные ткани пародонта и усугубляет деструкцию, вызванную воспалением. Ослабление опорных тканей пародонта приводит к дальнейшему смещению зубов и нарушению окклюзии.
Другие причины
Причиной изменения положения зуба может стать либо сама окклюзионная травма, либо окклюзионная травма в сочетании с воспалительными заболеваниями пародонта. Направление движения зависит от окклюзионной нагрузки.
Давление со стороны языка может вызвать сдвиг зубов при отсутствии заболеваний пародонта или может способствовать патологическому смещению зубов с ослабленным поддерживающим аппарратом (рис 15-16).
Рисунок 15-16. Патологическое смещение, связанное с давлением языка. A, вид спереди. B, вид со стороны неба.
В зубах с ослабленным пародонтом вследствие деструкции патологическому смещению зубов способствует давление со стороны грануляционной ткани пародонтальных карманов. Зубы могут возвращаться в исходное положение после устранения карманов, но если, деструкция больше с одной стороны зуба, чем с другой, заживление ткани, как правило, будет в направлении меньшего разрушения.
Незначительное избыточное давление стимулирует резорбцию альвеолярной кости с расширением периодонтальной щели. Слегка избыточное давление вызывает элонгацию волокон периодонтальной связки и аппозицию альвеолярной кости. В зонах повышенного давления увеличено количество кровеносных сосудов, и они сужены; в участках повышенного напряжения наблюдается их расширение.
Большее давление производит градацию изменений в периодонтальной связке, начиная с компрессии волокон, продуцирующих участки гиалинизации. Последующее повреждение фибробластов и других клеток соединительной ткани приводит к некрозу участков связки. Также наблюдаются сосудистые изменения: в течение 30 минут происходят расстройство и стаз кровотока; в течение от 2-х до 3-х часов кровеносные сосуды наполнены эритроцитами, которые начинают дробиться; и в течение от 1 до 7 дней происходят дезинтеграция стенок кровеносных сосудов и высвобождение содержимого в окружающие ткани. Кроме того, наблюдается увеличение резорбции альвеолярной кости и резорбция поверхности зуба.
Сильное натяжение вызывает расширение волокон периодонтальной связки, тромбоз, кровоизлияние, разрыв периодонтальной связки и резорбцию альвеолярной кости.
Давление, способное сместить корень, вызывает некроз периодонтальной связки и костной ткани. Кость резорбируется в области жизнеспособной периодонтальной связки, прилегающей к некротическим областям, и участков костного мозга, этот процесс называется подрывающая резорбция.
Наука на практике
Ткани пародонта передают нагрузку на окружающую кость и вызывают костные изменения, такие как резорбция в области компрессии и образование кости в области напряжения. Периодонтальная связка обеспечивает вязко-эластичную гелеобразную среду, которая защищает зубочелюстную систему от избыточных сил путем амортизации или сдерживающего эффекта.
Окклюзионная травма сначала приводит к вазодилатации в сочетании с экструзией и болью при накусывании. Эти симптомы можно быстро предотвратить путем коррекции окклюзионных контактов. Такие изменения могут быть также связаны с повышенной чувствительностью и болью пульпарного происхождения от горячего и холодного вследствие развития сосудистых осложнений в тканях пародонта, приводящих к расширению кровеносных сосудов пульпы. У таких пациентов боль можно немедленно устранить с помощью коррекции окклюзионных контактов.
Травма от окклюзии не является первичной причиной образования индуцированных бляшкой пародонтальных карманов и резорбции костной ткани, но пациенты с пародонтитом и окклюзионной травмой могут иметь акцентированную потерю кости. Состояние многих пациентов улучшается, когда окклюзионная терапия является частью протокола лечения заболеваний пародонта.
Первичное поражение эндодонта со вторичным заболеванием периодонта
(Эндодонтально-периодонтральное поражение, I-класс поражения)
Описание и причины
Первичное поражение эндодонта со вторичным заболеванием периодонта – заболевание эндодонта, которое распространяется через верхушку корня зуба вдоль периодонтальной связки для установления связи с периодонтальной бороздой.
Хроническое поражение эндодонта находит место дренирования по пути наименьшего сопротивления. Выход может сформироваться вдоль слизистой и выходить на слизисто-десневой линии, может проникать в носовую полость или экстраорально, через кожу. Иногда, свищ может идти вдоль пеиодонтальной связки позади зуба, в оконцовке достигая периодонтальной борозды. При закрытии дефекта камнем и бляшками, эпителиальное присоединение мигрирует апикально.
Клинические признаки
Причины поражения эндодонта обычно легко определяются при осмотре, например, перелом коронки, обнажение пульпы от предшествующей травмы. Периоодонтальная связка здоровая по всей поверхности, за исключением зоны формирования свища. (зуб неподвижен). Исследование периодонтальных карманов выявляет его значительную глубину и внезапное окончание.
Диагностика
Дентальная радиография показывает радиопрозрачный тракт, от верхушки корня зуба до альвеолярного края. Отсутствует горизонтальная потеря кости или радиографические признаки периодонального заболевания, кроме как линейная прозрачность вдоль корня (обычно именуется как J-поражение). Окружная диагностика пробником обычно выявляет единственный, очень глубокий периодонтальный карман с узким и внезапно бороздчатым отверстием, что говорит о том, что зуб имеет нормальную глубину периодонтальной связки.
При дифференциальной диагностике учитывают первичное периодонтальное заболевание со вторичным вовлечением эндодонта («перио-эндо» поражение).
Лечение
Лечение канала корня и соответствующее периодонтальное лечение дает хорошие прогнозы
Валерий Шубин, ветеринарный врач, г. Балаково
Услуги. Лечение периодонтита. Дента Комфорт — Стоматологическая клиника на Тимирязевской (Москва)
Периодонтит — это воспаление круговой связки зуба (периодонта) окружающие корень зуба.
Причинами возникновения периодонтита могут быть механические травмы, такой периодонтит называется травматическим, возникающий при ударе в лицо тяжелых предметов, удар после пломбирования каналов, раскалывания орехов. Хронические травмы — завышенная пломба, перекусывание ниток и проволок при отсутствии рядом стоящих зубов, надавливанием на зуб ручкой. При таких травмах процесс протекает, как обычно, остро.
Инфекционный периодонтит развивается, как осложнение нелеченного кариеса, причиной которого является инфекция поступающая за пределы корневого канала в кость.
Медикаментозный периодонтит развивается при неправильном лечении пульпита путем попадания на периодонт сильнодействующих веществ таких, как паста содержащая мышьяк, формалин, также периодонтит возникающий вследствие аллергических реакций.
При хроническом периодонтите — все выражено слабее, может протекать бессимптомно, возможен отек и покраснение десны и повышение температуры.
Симптомы острого периодонтита — боль интенсивная, рвущая, пульсирующая, что свидетельствует о переходе в гнойное состояние.
Лечение периодонтита в каждом конкретном случае индивидуально и способствует сложному иногда долгому профессиональному лечению. Для устранения воспаления нужно дать хирургически широкий отход гною из очага воспаления через канал зуба наружу. Иначе гной проложит сам себе путь через десну и кость, образуя долго не заживающие свищевые ходы. Для снятия воспаления применяются специальные пасты для восстановления костной ткани и рассасыванию кисты (гранулемы). В корень зуба закладываются лекарства на неделю или больше.
После купирования воспаления в периодонте каналы тщательно пломбируют. Во многих случаях комплексное лечение является эффективным.
Что такое киста зуба (гранулема)?
Это патологическое образование на верхушке корня зуба, возникающее в результате инфицирования корневых каналов и представляющее из себя полостное образование, ограниченное капсулой, внутри которой находтися инфицированная жидкость.
Причины образования кисты зуба:
- развивается из-за невылеченного кариеса;
- из-за некачественно пролеченных корневых каналов;
- вследствие травмы(ожог пульпы, механическая травма).
Как распознать кисту?
Часто заболевание протекает бессимптомно. Увидеть кисту можно только, сделав рентген зуба.
Иногда при снижении иммунитета, стрессе, тяжелой физической и умственной нагрузке заболевание дает обострение и сопровождается сильной болью, припухлостью десны, накусывание на этот зуб болезненно, возможно вытекание гноя из десны.
Анатомия пародонта — Пародонтальная связка
Распространено ошибочное мнение, что ткань и кость десны удерживают зубы на месте. На самом деле пародонтальная связка (PDL) служит соединением мягких тканей между зубом и костью. PDL вставляется в кость, окружающую зуб, а также во внешний поверхностный слой корня (цемент). Состоящая из различных типов коллагена и имеющая сосудисто-нервный компонент, периодонтальная связка очень узкая и сложная. Несмотря на то, что она называется связкой, PDL не функционирует подобно окружающим суставной сустав, но играет важную роль в общем здоровье полости рта человека.
PDL Назначение
Периодонтальная связка находится только между корнем зуба и прилегающей костью и не поддерживает внешние ткани десны. Сложная природа ткани PDL позволяет зубу правильно функционировать во время жевания и выдерживать давление от скрежета или сжатия. Позволяя зубу адаптироваться к силам от таких привычек, как бруксизм (скрежетание зубами), PDL увеличивается, когда зуб начинает двигаться или расшатываться. После того, как силы, действующие на зуб, уменьшатся, периодонтальная связка заживет и уменьшит подвижность зуба.
Поскольку PDL помогает при прорезывании зубов и перемещении зубов, ортодонтическое перемещение зубов возможно. Зуб был бы неподвижным и функционировал бы подобно имплантату, если бы он был соединен непосредственно с костью. Когда зуб напрямую соединен с костью (известный как анкилоз), он не может перемещаться и может возникнуть в результате разрушения области периодонтальной связки. Поскольку периодонтальная связка удерживает зуб в лунке, а не соединение кости с зубом, зуб обычно можно удалить без удаления челюстной кости.
Пародонтальная связка выполняет четыре функции:
Опора : периодонтальная связка — это компонент пародонта, который позволяет зубам прикрепляться к окружающей альвеолярной кости через цемент. Волокна PDL также передают и поглощают силы между зубами и альвеолярной костью.
Nutritive : Сильно анастомозированный PDL обеспечивает жизнеспособность окружающих клеток. Питательные вещества передаются через три типа кровеносных сосудов: десневые сосуды, перфорирующие сосуды и апикальные сосуды.
Сенсорная : Сильно иннервируемая PDL включает ноцицепцию, механорецепцию и рефлексы.
Ремоделирование : PDL содержит клетки-предшественники, которые могут дифференцироваться в остеобласты. Считается, что эти клетки используются для физиологического обслуживания и восстановления альвеолярной кости.
Периодонтальная связка: последствия для здоровья полости рта
Одной из основных причин разрушения костей и потери пародонтальной связки является прогрессирующее заболевание десен (пародонтит).Когда у пациента развивается пародонтит, ткань десен отступает от зубов, образуя карманы. Бактерии, вызывающие заболевание, накапливаются в карманах, что приводит к инфекции, которая, если ее не лечить, разрушает кости, связки и ткани во рту и в конечном итоге может привести к потере зубов. После потери PDL соседняя кость не прикрепляется к зубу и, следовательно, не может служить опорой.
Периодонтальная связка не восстанавливается легко в тех областях, где она была потеряна, и склонна к воспалению пародонта.Если у пациента на поздней стадии заболевания десен повреждена челюстная кость, установка костного трансплантата может быть неудачной, если одновременно не восстанавливается пародонтальная связка.
Пародонтальная связка — обзор
Стволовые клетки пародонтальной связки (PDLSC)
Пародонтальная связка (PDL) может быть определена как фиброзный сустав, который прикрепляет корень зуба к альвеолярной кости. Сделанный из волокнистой соединительной ткани, он удерживает зуб в пружинной подвеске, позволяя зубу выдерживать механическое давление во время работы.
Периодонтальная связка была предложена как ниша стволовых клеток нервного гребня (Coura et al., 2008). В 2004 году Сео и его коллеги успешно изолировали мультипотентные стволовые клетки из периодонтальной связки третьих моляров человека и доказали, что они обладают способностью к многолинейной дифференцировке. С тех пор были проведены многочисленные исследования для характеристики PDLSC, которые можно резюмировать следующим образом: PDLSC экспрессируют маркеры общих мезенхимальных стволовых клеток (MSC) и некоторые маркеры перицитов, такие как STRO-1, STRO-4, CD29, CD73, CD90 ( Thy1), CD106 (VCAM-1) и CD146 (MUC18), но отрицательны по экспрессии эндотелиальных (CD31), гемопоэтических (CD14, CD34, CD45, CD79a) и вспомогательных иммунных антигенов (CD11b, CD19, HLA-DR , CD40, CD54, CD80, CD86) (Чжу и Лян, 2015; Бартольд и Гронтос, 2017).Культивируемые PDLSC человека также положительны в отношении маркеров перицитов, таких как CD146, нейральный / глиальный антиген 2 (NG2) и CD140b (Iwasaki et al., 2013).
Было высказано предположение, что клетки PDL человека имеют периваскулярное происхождение, поскольку совместное культивирование изолированных hPDLSC с эндотелиальными клетками пупочной вены человека (HUVEC) последовательно показало доказательства взаимодействия hPDLSC с HUVECS, как и ожидалось от перицитов (Iwasaki et al., 2013). Несмотря на большое количество исследований, проведенных на PDLSCs in vitro, мало что известно о локализации и идентичности PDLSCs in vivo.
В PDL принято считать, что PDLSC расположены периваскулярно или параваскулярно. В 1980-х McCulloch идентифицировал расположение клеток, сохраняющих метку, в PDL путем импульсной инъекции 3 H-тимидина, предположив, что эти клетки располагаются в пределах 10 мкм от кровеносных сосудов (McCulloch, 1985). Позже, с использованием нескольких маркеров PDLSC, идентифицированных in vitro, таких как STRO-1, CD146 и CD44, предполагаемые PDLSC человека были идентифицированы в основном в параваскулярных областях, в диапазоне кровеносных сосудов 0–20 мкм (Chen et al., 2006; Питару и др., 2013). Ограничением этих исследований было то, что способность мезенхимальных стволовых клеток дифференцироваться в определенные типы клеток не проверялась и, что более важно, судьбы этих клеток in vivo не отслеживались.
Несколько исследований обнаружили источник терминированных дифференцированных клеток в PDL. Как уникальная структура PDL, образование цемента привлекает наибольшее внимание. В 2009 году было высказано предположение, что эпителиальные клетки корневого влагалища (HERS) участвуют в формировании клеточного цемента (Huang et al., 2009), однако, как эти эпителиальные клетки становятся мезенхимальными клетками, не было продемонстрировано. Что наиболее важно, также было указано, что большинство цементоцитов и цементобластов не происходят из HERS, указывая на то, что по крайней мере еще одна субпопуляция PDLSCs вносит вклад в цемент (Huang et al., 2009). В 2012 году было показано, что Osterix (OSX) -позитивные клетки-предшественники влияют на формирование цементобластов и цементоцитов с помощью методологии усиления и потери функции с системой Cre-loxP (Cao et al., 2012). OSX экспрессируется не в HERS, а в клетках фолликулов, что позволяет предположить еще один источник цементобластов и цементоцитов. Тем не менее, ни HERS, ни OSX-экспрессирующие клетки не локализуются в периваскулярных или параваскулярных областях, что поднимает вопрос об их идентичности стволовых клетках. Возможно, что эти клетки являются коммитированными клетками-предшественниками, которые при внедрении в цемент дают начало цементобластам или цементоцитам. В таких обстоятельствах отслеживание генетических клонов необходимо, чтобы показать как предков, так и их потомков (Kretzschmar and Watt, 2012).Путем отслеживания клонов Roguljic утверждал, что αSMA-положительные клетки являются предшественниками, которые могут давать начало остеобластам, цементобластам и фибробластам (Roguljic et al., 2013). Примечательно, что распространение αSMA-положительных клеток ограничивается шейными и апикальными областями, что указывает на гетерогенность популяций стволовых клеток. Недавно была идентифицирована другая субпопуляция, клетки, экспрессирующие Axin2, как участвующие как в клеточном, так и в бесклеточном цементе (Xie et al., 2019). Таким образом, клетки, экспрессирующие αSMA, и клетки, экспрессирующие Axin2, являются единственными известными клетками in vivo, которые участвуют в формировании клеток цемента.
Пародонтологическая анатомия — Пародонтальная связка
Периодонтальная связка, которую часто называют PDL, представляет собой группу специализированных волокон соединительной ткани, которые прикрепляют зуб к альвеолярной кости. PDL вставляется в цемент корня с одной стороны и в альвеолярную кость с другой.
Ткани пародонта объединяются, образуя динамичную и активную группу тканей. Альвеолярная кость (C) в основном окружена субэпителиальной соединительной тканью десны.Он покрыт разнообразным характерным эпителием десен. Цемент, покрывающий корень зуба, прикрепляется к прилегающей кортикальной поверхности альвеолярной кости за счет альвеолярного гребня (I), горизонтального (J) и косого (K) волокон периодонтальной связки.
Структура
PDL состоит из основных волокон, рыхлой соединительной ткани, бластных и обломочных клеток, волокон окситалана и остатка клеток Малассеза.
Альвеолодентальная связка
Первичная основная группа волокон — это альвеолодентальная связка, которая состоит из пяти различных подгрупп волокон.Эти подгруппы волокон включают следующие: альвеолярный гребень, горизонтальный, косой, апикальный и межкорневой на многокорневых зубах.
Эти волокна помогают зубу противостоять естественным силам сжатия, возникающим при жевании, и остаются в кости. Концы основных волокон, которые находятся внутри цемента или собственно альвеолярной кости, называются волокнами Шарпея.
Транссептальные волокна
Транссептальные волокна (H) проходят над гребнем альвеолярной кости и внедряются в цемент соседних зубов, где образуют межзубную связку.Эти волокна служат для выравнивания зубов. Эти волокна можно рассматривать как принадлежащие десневой ткани, поскольку они не имеют костного прикрепления.
Рыхлая соединительная ткань
Рыхлая соединительная ткань содержит волокна, внеклеточный матрикс, клетки, нервы и кровеносные сосуды. Внеклеточный компартмент состоит из пучков коллагеновых волокон 1-го, 3-го и 5-го типов, встроенных в межклеточное вещество. Коллагеновые волокна PDL классифицируются в зависимости от того, как они ориентированы и расположены вдоль зуба.Клетки включают следующее: фибробласты, защитные клетки и недифференцированные мезенхимальные клетки.
Остаток ячейки Malassez
Эти группы эпителиальных клеток локализуются в зрелой PDL после распада эпителиальной оболочки корня Гертвига при формировании корня. Они образуют сплетение, окружающее весь зуб. Клеточные остатки Malassez могут быть причиной образования кист в более позднем возрасте.
Волокна окситалана
Волокна окситалана уникальны для PDL и обладают естественной эластичностью.Он вставляется в цемент и движется в двух разных направлениях; параллельно поверхности корня и наклонно к поверхности корня.
Состав
По оценкам, вещество PDL содержит до 70% воды. Считается, что он оказывает значительное влияние на прочность зуба и его способность противостоять нагрузкам. Полнота и жизнеспособность PDL имеют решающее значение для функционирования зуба.
Ширина PDL обычно составляет от 0,15 до 0,38 мм в самой тонкой части, которая расположена в средней трети корня.Ширина постепенно уменьшается с возрастом. PDL — это часть периодонта, которая действует как прикрепление зубов к окружающей альвеолярной кости через цемент.
Пародонтологическая анатомия: пародонтальная связка
Пародонтальная связка (PDL) — это группа специализированных динамических волокон соединительной ткани, которые прикрепляют зуб к альвеолярной кости. PDL вводится в цемент корня с одной стороны, а с другой — в альвеолярную кость.
Структура
PDL состоит из следующих компонентов: основные волокна, бластные и обломочные клетки, рыхлая соединительная ткань, окситалановые волокна и остаток клеток Малассеза.
Альвеолодентальная связка
Альвеолодентальная связка является основной основной группой волокон. Альвеолодентальная связка состоит из пяти различных подгрупп волокон, которые включают: альвеолярный гребень, горизонтальный, косой, апикальный и межкорневой на многокорневых зубах. Другими основными волокнами, которые не включают альвеолодентальную связку, являются транссептальные волокна.
Эти волокна помогают зубу противостоять естественным силам сжатия, которые возникают во время повседневного использования, такого как жевание, и они остаются в кости.Концы основных волокон, которые находятся внутри цемента или собственно альвеолярной кости, являются волокнами Шарпея.
Транссептальные волокна
Транссептальные волокна — это волокна, которые проходят над гребнем альвеолярной кости межпроксимально. Эти волокна встраиваются в цемент соседних зубов. В этом месте они образуют межзубную связку. Эти волокна работают вместе, чтобы зубы были правильно выровнены. Поскольку эти волокна не содержат костных прикреплений, они считаются принадлежащими десневой ткани.
Свободная соединительная ткань
Рыхлая соединительная ткань состоит из волокон, клеток, внеклеточного матрикса, нервов и кровеносных сосудов. Внеклеточный компартмент содержит пучки коллагеновых волокон 1-го, 3-го и 5-го типов, которые встроены в межклеточное вещество. Коллагеновые волокна PDL классифицируются в зависимости от их ориентации и расположения на зубе. Эти клетки включают фибробласты, защитные клетки и недифференцированные мезенхимальные клетки.
Остаток ячеек Малассеса
Эти группы эпителиальных клеток локализуются в зрелой PDL после распада эпителиальной оболочки корня Гертвига во время образования корня.Они образуют сеть нервов, окружающих зуб. На более поздних этапах жизни клеточные остатки Малассеза могут размножаться с воспалением, которое может привести к образованию корешковых кист.
Окситалановые волокна
Волокна окситалана уникальны для PDL и обладают естественной эластичностью. Пятерки вставляются в цемент и движутся в двух разных направлениях. Волокна проходят как параллельно поверхности корня, так и под углом к поверхности корня. Идея заключается в том, что функция поддерживает проходимость кровеносных сосудов во время окклюзионной нагрузки.Однако необходимы дополнительные исследования, чтобы полностью определить функцию и способность волокон окситалана.
Состав
По оценкам, PDL почти на 70% состоит из воды. Также считается, что он оказывает значительное влияние на прочность зуба и его способность выдерживать высокие нагрузки. Полнота и жизнеспособность PDL являются важными компонентами функционального зуба.
В большинстве случаев ширина PDL составляет от 0,15 до 0,38 мм. Самая тонкая часть PDL находится в средней трети корня.Ширина PDL со временем уменьшается с возрастом пациента.
Развитие
КлеткиPDL являются одними из множества клеток, происходящих из зубного фолликула. Это происходит после формирования кроны и после того, как корни начинают развиваться. Эти клетки реконструируют зубной фолликул, чтобы сформировать PDL. Формирование PDL начинается на стыке цементно-эмали и продолжается в апикальном направлении.
Энтезы пародонтальных связок и их адаптивная роль в контексте функции зубочелюстного сустава
Зубной прикрепление млекопитающих является неотъемлемой частью орального и черепно-лицевого жевательного комплекса, обладает уникальными характеристиками коротких движений по сравнению с дальнодействующими движениями, наблюдаемыми в диартродиальных мышцах. суставы опорно-двигательного аппарата.Такое короткое движение обеспечивается мягкой волокнистой PDL, которая прикрепляет цемент к альвеолярной кости и действует как амортизатор для распределения окклюзионных нагрузок во время жевания (11, 32, 40). Поглощение функциональных нагрузок уменьшает удар твердого зуба о зуб и износ эмали, снижает концентрацию напряжений / деформаций в PDL-цементе, местах прикрепления PDL-кости и поверхностях контакта и позволяет в течение десятилетий циклической нагрузки (40, 41). Движение зубов из-за жевания в физиологических пределах стимулирует функцию суставов за счет поддержания функционального PDL-пространства с помощью механобиологических процессов (42).Цель этого раздела — выяснить движение зубов в альвеолярной лунке и получить представление о вкладе и адаптивной способности конститутивных свойств мягких / твердых тканей и поверхностей раздела для поддержания биомеханики суставов. Экспериментальные подходы включали валидированный целостный метод с использованием неинвазивной техники визуализации с помощью микрорентгеновской компьютерной томографии (μ-XCT) в сочетании с устройством механической нагрузки (6, 8). Ex vivo эксперименты позволили визуализировать и оценить эффект физических сдвигов в интактном комплексе нагруженного фиброзного сустава (6, 8).
1.1. Entheses, Entheses Органы и интерфейсы: перспективы материаловедения, биомеханики и механобиологии () (8, 32, 43)
Несущее пространство периодонтальной связки (PDL-пространство), места прикрепления PDL-кости и PDL-цемента, а также PDL -вставки(a) Периодонтальная связка (PDL) -пространство, представленное на поверхности корня премоляра человека на 0 N (в основном однородное PDL-пространство) и на 100 N (сконцентрировано, как указано красной стрелкой). Осевые и сагиттальные виртуальные сечения в двумерном (2D) пространстве (b) экстраполируются из трехмерного (3D) пространства (a).Белые стрелки указывают на эквивалентные ориентиры как в 3D (a), так и в 2D (b) пространствах. Области со значительно суженным PDL-пространством, особенно в условиях нагрузки, обведены красной кривой (a), а соответствующие области в 2D-пространстве обозначены стрелками (b). Присоединение PDL к альвеолярной кости (PDL-кость) и цементу (PDL-цемент), визуализированное с помощью методов сканирующей электронной и атомно-силовой микроскопии (SEM, AFM), показано на панели c (PDL-кость) и d (PDL- цемент) соответственно. Обратите внимание на изменение ориентации радиального PDL (rad-PDL) на окружное PDL (cir-PDL), поскольку он «огибает» альвеолярную кость и цемент перед тем, как он вставляется (вставки PDL) в соответствующие минерализованные ткани внутри несущего комплекса.В обоих случаях эти вставки гигроскопичны, что обозначено их увеличенным профилем высоты при изображении в гидратированных условиях (белые области коррелируют с топографическими пиками 2000–3000 нм по сравнению с более темными областями, которые соответствуют 0 нм).
Подобно другим диартродиальным суставам в организме, несущий нагрузку фиброзный сустав кость-PDL-зуб обладает способностью реагировать и выдерживать циклическую нагрузку посредством саморегулируемых биологических процессов. В условиях нагрузки механические напряжения могут стимулировать клетки в различных участках комплекса (и) и способствовать адаптивным к деформации свойствам в тканях пародонта и их границах раздела (и).С точки зрения материалов свойства адаптации к деформации называются физико-химическими свойствами.
Функциональные аспекты, связанные с интерфейсами в контексте биомеханики и механобиологии, были красноречиво изложены Дарси Томпсон и были адаптированы для соответствия содержанию рукописи. Томпсон писал: «… и красота и сила механической конструкции (сустава) заключаются не в одной части или в другой (ткани как таковые), а в гармоничном соединении (стыках), в котором все части, мягкие и твердые, жесткие и гибкие. , опора растяжения и опора давления составляют вместе (44).Интерфейс — это «конкатенация» разнородных материалов. Различные аналитические методы, подобные урокам материаловедения, полученным на природе, научили, что интерфейс можно преобразовать в омофон; межфазная фаза в том смысле, что это область, которая инкапсулирует изменения физических и химических характеристик, которые позволяют переход одного материала в другой (от мягкого к твердому (наоборот), от твердого к твердому, от мягкого к мягкому — все это разные ткани) в бесшовной мода. Это означает, что интерфаза является переходной зоной и требует идентификации конца и начала двух разнородных тканей.
В биологии термин, аналогичный интерфейсу, — это орган энтезиса. Этот термин впервые был использован в опорно-двигательной системе для определения границ раздела разнородных тканей, таких как кость и сухожилие (костно-сухожильные) или кость и связка (костно-связочная) (45, 46). Есть еще один термин, известный как «стык». Однако, как он используется в контексте интерфейса, он имеет ограниченное значение, поскольку он намекает на физическое разграничение между двумя разными материалами / тканями, видимыми невооруженным глазом, или ограничивается световым микроскопом с низким разрешением.Также наблюдались несколько таких переходов, известных как дентин-эмаль, цемент-дентин и цемент-эмаль (47–52). С точки зрения механики и материаловедения, тема, представляющая особый интерес для исследователей, — это «вязкость разрушения» кажущейся прерывистой системы, то есть то, что можно определить как резкий переход от одного материала к другому. Однако междисциплинарные подходы, включая различные аналитические методы и гистологические анализы, показали, что естественные границы раздела фаз состоят из градиентов из-за постепенных изменений в структуре, элементном и молекулярном составе и модуле упругости в пределах конечной ширины между разнородными тканями, включая цемент-дентин, цемент- эмаль, эмаль-дентин (47–53).Подобным образом фиброзно-хрящевые суставы показали, что, когда сухожилия вставлены в кость, они переходят через зоны, содержащие градиенты органических и неорганических концентраций, перемежающихся с гигроскопическими областями (2). Следовательно, считается, что эти постепенные переходы в элементном и биохимическом составе обеспечивают устойчивость к функциональным требованиям, включая перелом (48). Важность постепенного перехода, допускаемого несколькими зонами, особенно подчеркивается, когда он противопоставляется одной зоне, на что указывает резкое увеличение или уменьшение соотношения органических и неорганических веществ (54, 55).Эти единичные зоны наблюдаются как упругие неоднородности в несущих системах с нарушенной функцией () (43).
Физические характеристики нормальной и нарушенной PDL и комплекса кость-PDL-цемент с использованием различных методов визуализации с высоким разрешением и наноиндентирования на основе АСМЦифровые сегментированные блоки из моляров человека иллюстрируют PDL в кажущихся нормальными (а) и скомпрометированных условиях ( б). Нормальное состояние определяется как PDL-пространство 150–380 мкм (a), а суженное PDL-пространство составляет 5-50 мкм (b).Подобно трехмерным цифровым реконструкциям, виртуальные сечения иллюстрируют сосудистые пучки (кровеносные сосуды: BV) в пределах нормальной PDL, и аналогичные структуры видны в суженной PDL (d). Кроме того, вставки PDL можно наблюдать в областях с меньшим ослаблением рентгеновского излучения в трехмерных реконструированных объемах и двумерных виртуальных сечениях (белые стрелки на b и d). Аналогичным образом идентифицируются остеоцитарные лакуны (звездочки в a-d). Сканирующие электронные микрофотографии нормального (e) и суженного (f) состояния иллюстрируют PDL между альвеолярной костью (AB) и цементом (C).Картирование модуля упругости во влажных условиях с использованием наноиндентора иллюстрирует нарушение сплошности в суженном комплексе кость-PDL-цемент (g).
а. Структурная интеграция в тандеме с постепенным изменением физических и химических характеристик на границах раздела PDL-кость и PDL-цемент существует в комплексе кость-PDL-цемент (32)
Интерфейсы продолжают характеризоваться как биоинженерные шаблоны, на которых ткани могут быть регенерированы для замещения поврежденных и / или хронически воспаленных участков, нарушающих передвижение.Внутри суставов интерфейсы представляют собой локализованные области и действуют как «функциональные машины» из-за перекрестных помех между множеством клеток и структурными компонентами клеточного внеклеточного матрикса, которые работают согласованно, чтобы приспособиться к функциональным силам и разрешить движение суставов (56). В костно-мышечной, оральной и черепно-лицевой системах эти интерфейсы грубо классифицируются как 1) непрямые фиброзно-хрящевые, при которых связки сухожилий вставляются в кость через промежуточный тип ткани, такой как хрящ, и 2) прямые волокнистые энтезы, в которых сухожилия / связки вставляются в кость без идентифицируемой хрящевой ткани (57).Исследования, основанные на принципах биомеханики и механобиологии, проиллюстрировали границы раздела PDL-кость и PDL-цемент фиброзного сустава кость-зуб, чтобы выразить характеристики, аналогичные прямым фиброзным энтезисам. Несмотря на это, применение принципов механики материалов, усиление деформаций внутри клеток на границах раздела мягких и твердых тканей по сравнению с соседними объемными тканями само по себе делает привязанные концы более мягких тканей восприимчивыми к увеличению моментов сдвига и изгиба, которые обычно идентифицируются. в несущих соединениях с короткими и дальними движениями.Однако с точки зрения механики, чтобы предотвратить катастрофическое разрушение сустава из-за усталости, клетки с вкраплениями повышенных концентраций молекул матрикса, включая адгезивные протеогликаны (PG) на этих связанных концах (58), могут способствовать миграции клеток и обеспечивать их адгезию и необходимые взаимодействия с матрицей. для регенерации и ремоделирования тканей (2).
PG представляют собой гидрофильные макромолекулы, которые несут ответственность за сопротивление сжимающим силам благодаря своим характеристикам удержания воды и выдерживают функциональные нагрузки в пародонте (35).PG секретируются различными клетками в PDL, чтобы изолировать биомолекулы и прямо или косвенно модулировать образование внеклеточного матрикса. PGs имеют различную функцию в том, что их концентрация и расположение в области 5-10 мкм, прилегающей к цементу и альвеолярной кости, отчетливо отличаются от участков прикрепления PDL-цемента и PDL-кости (). К ним относятся регулирование адгезии фибробластов, цементобластов и остеобластов к прилегающим тканям для восстановления как деградированных тканей, так и механизма прикрепления, а также действия в качестве потенциальных модуляторов биоминералов (3, 17, 18).Следовательно, можно предположить, что присущие PG-декорированные границы раздела PDL-цемент и PDL-кость и частичное набухание в прилегающих гипоминерализованных областях, состоящих из гигроскопических вставок PDL, имеют жизненно важное значение для прикрепления зубов и регулирования физиологических нагрузок (31-33, 35, 40) (и). Эти идентифицируемые постепенные переходы от более мягких тканей к более твердым (и наоборот) используются в качестве стандартного «чертежа» для разработки функционально градуированных интерфейсов (FGI). Руководящий принцип FGI состоит в том, чтобы уменьшить механические деформации, распределяя их по более широкой границе раздела, тем самым уменьшая подверженность разрушению из-за разрывов и разрывов (32, 59–61), тем самым повышая сопротивление разрушению.Эта подпись природы FGI постоянно демонстрировалась у различных видов, включая клюв кальмара, бамбуковый стебель и сосудистый пучок пальмы Washingtonia robusta (62–64) и многих других. Внутри каждого из этих видов градиенты механической жесткости развились как адаптивная реакция в попытке укрепить нижележащую структуру органа, чтобы противостоять внешнему раздражителю. Таким образом, интерфейсы могут быть затем определены как совокупность связанных тканей в месте прикрепления (энтезе) и рядом с ним, и они развиваются в ответ на сигналы окружающей среды, такие как сдвиги в механических напряжениях.Следовательно, стимулированные клетки пытаются укрепить области, поскольку они реагируют на биомеханические сигналы (механические напряжения, связанные с растяжением, сжатием и сдвигом), которые действуют как функция для любого организма. Армирование может быть идентифицировано как многозонный интерфейс, демонстрирующий постепенный переход, или как однозонный интерфейс, демонстрирующий резкий переход от мягких тканей к твердым и наоборот. Эти отдельные зоны идентифицируются как упругие неоднородности внутри несущих систем с нарушенной функцией ().
г. Отклонение от измеренного нормального PDL-пространства (150–380 мкм) к адаптированным участкам (5–50 мкм) в исходной связке-кости и связке-цементном соединении должно противостоять функциональным требованиям () (33)
Когда внешние раздражители, которые модулировать функциональный гомеостаз изменяются и включают аномальные режимы, происходит необратимое моделирование и изменяются физико-химические свойства до тех пор, пока не будет достигнут новый функциональный гомеостаз в суставе (31, 33). В этих условиях вопрос: Каково функциональное значение этих локально измеренных сдвигов в физико-химических градиентах, особенно в комплексе PDL-кость, PDL-цемент и кость-PDL-цемент? То есть, как это изменение градиента жесткости влияет на общую функцию сустава?
В нормальных условиях градация жесткости от PDL к кости и от PDL к цементу может изменяться из-за естественного физиологического движения зубов с возрастом, известного как активное прорезывание, а также из-за биомеханических функций, таких как; жевательные силы из-за нормального и неправильного прикуса.Эта нормальная адаптивная роль интерфейсов PDL-кость и PDL-цемент усиливается с добавлением внешних возмущений, таких как терапевтическая нагрузка, вызванная ортодонтическими силами или заболеванием, как в случае с пародонтитом. В поддержку принципа механики материалов, более высокая частота воспаления и разрушения в виде разрывов на границе раздела мягких и твердых тканей обычно наблюдается, когда границы раздела PDL с костью и PDL с цементом подвергаются нефизиологической нагрузке. Из-за присутствия клеток все более напряженные интерфейсы становятся локальными регуляторами и образуют самоуправляющиеся зоны, и в конечном итоге наблюдаются как участки хронического воспаления.Эти травмы обычно возникают при повторных оскорблениях / нефизиологических стимулах или при занятиях спортом с высокой нагрузкой, примером которых является развитие инсерционной тендинопатии в локте, ахилловом сухожилии и колене (65–67). Такие травмы также известны как энтезопатии, постепенно формирующиеся в мягких и твердых тканях, охватывающих органы / интерфейсы, с непрерывными нефизиологическими циклическими нагрузками, которые со временем могут препятствовать подвижности суставов и вызывать поражение суставов (68).
Было обнаружено, что в фиброзном соединении костной ткани человека, зуба PDL и зуба эти градиенты эластичности в области энтезов вызваны постепенным увеличением соотношения неорганических и органических веществ по мере перехода более мягкого PDL в более жесткую кость и цемент (32, 40, 49, 69 , 70) ().Частичное набухание в гипоминерализованных областях в местах прикрепления между PDL и костью или цементом может определять ширину границы раздела, по которой механические свойства варьируются от более низких значений PDL (10-50 МПа) до более высоких значений, наблюдаемых в альвеолярной кости (0,2-9,6 ГПа). и цемент (1,1–8,3 ГПа). В результате при нормальном функционировании такие интерфейсы могут защищать от чрезмерных поперечных, скручивающих, изгибающих, вращательных, растягивающих и сжимающих сил, сопровождаемых совместным перемещением (59, 71), обеспечивая оптимальное распределение нагрузки и передачу циклических нагрузок (т.е. жевательные силы), которые предотвращают износ из-за усталости. Однако возникают следующие вопросы; что произойдет, если это постепенное изменение жесткости резко изменится, как показано на рисунке? Что бы означало это изменение деформационно-адаптивных свойств (в данном случае свойство — пониженный модуль упругости) в контексте совместной функции? И при каких внешних стимулах, включая клинические сценарии, могло бы возникнуть такое изменение градуированных свойств? Эти вопросы будут рассмотрены в следующих разделах.
Считается, что адаптивная природа PDL и его интерфейсов обусловлена сосудистыми элементами (кровеносные сосуды — BV,) и нервами (33), которые являются продолжением внеклеточного матрикса PDL, состоящего из волокнистых белков, включая доминирующий коллаген I типа и следовые количества коллагенов III и V типов, эластиновые и окситалановые волокна и глобулярные белки, включая протеогликаны и другие неколлагеновые белки (72–74). Клетки-предшественники и их дифференцированные клоны остеобластов, фибробластов и цементобластов находятся внутри матрикса, но локализованы в штамм-специфичных областях комплекса (2).Поверхностный слой альвеолярной кости, прилегающий к PDL, состоит из подлежащего остеоидного матрикса с созревающими неорганическими минералами в преобладающих формах гидроксиапатита и карбоксиапатита (75, 76). Обычно общая структура альвеолярной кости состоит из внешней плотной оболочки компактной кости, известной как твердая оболочка, к которой прикреплена губчатая губчатая кость с сильными васкуляризациями. Толщина компактной кости, а также размер и количество трабекул в губчатой кости могут увеличиваться и / или уменьшаться в плотности в ответ на гиперфункцию и гипофункцию соответственно (77–79) и контролируются величиной и продолжительностью нагрузки.Эти аспекты ремоделирования кости происходят за счет согласованных усилий остеобластов мезенхимальных и остеокластов гематопоэтического происхождения, создавая обратные линии, вызываемые активностями отложения и резорбции, соответственно (80–82). Следовательно, с функциональной точки зрения, можно спросить, вызывают ли эти выступы в кости () с более высоким модулем упругости эластичность кости, несмотря на преобладание гигроскопических вставок из PDL? И сдвигает ли этот разрыв в ткани и суставе биомеханику сустава с физиологической на патологическую или неадаптированную функцию?
Альвеолярная кость вместе с выступом связки кости работает во взаимодействии с другой минерализованной тканью, цементом в фиброзном соединении кость-PDL-зуб.Напротив места прикрепления PDL-кости в комплексе, минерализующий матрикс, известный как цементоид, также существует на границе PDL-цемент (2, 5, 32, 83). Считается, что цемент похож по структуре на кость; тем не менее, он обладает бесклеточной зоной в анатомической коронковой части от половины до двух третей корня зуба (5, 83). Отложение и резорбция минералов также происходит в цементе, как и в кости; однако эти изменения обычно имеют форму моделирования, а не ремоделирования (5, 84).Чаще всего думают, что цемент пластинчатый, не адаптируется и имеет минимальную адаптивную реакцию. Хотя это может быть правдой по сравнению с васкуляризованной костью, результаты нашей лаборатории показали, что цемент может иметь отсроченный ответ. Если да, то может ли это быть причиной того, что кость прорастает в пространство PDL (, и), а цемент впоследствии может уступить место росту кости? Оба эти события не обязательно должны быть видны в одной и той же двумерной (2D) плоскости, они действительно происходят в трехмерных (3D) объемах комплекса кость-PDL-цемент (37).И может ли это быть причиной того, что могут возникать вторичные явления, такие как соответствующие или несоответствующие формы между костной альвеолярной лункой и цементом зуба?
1.2. Усиление физиологического и патологического напряжения на стыках PDL-кость и PDL-цемент: соответствующие и несоответствующие поверхности альвеолярной кости и зуба (и) (31, 33)
В скелетно-мышечной и стоматологической ортопедии конформные и несоответствующие поверхности могут определять форму-функцию поведение / адаптация сустава и дает представление о локальном поведении на уровне ткани и результирующих клеточных ответах и последующей генетической и молекулярной экспрессии.Эти иерархические масштабные события обеспечивают непрерывный эффект функционального гомеостаза сустава. Основываясь на фундаментальной основополагающей концепции Юлиуса Вольфа, долгосрочное воздействие функциональных аберраций на макроуровне может привести к патологическим деформациям для поддержания функции. Со временем патологические деформации минерализованных тканей изменяют внутреннюю архитектуру, поскольку сустав продолжает функционировать. Если распространить это на фиброзное соединение кость-PDL-зуб, относительные движения между элементами через комбинацию мягких и твердых тканей и их интерфейсов будут продолжать адаптировать ткани локально.Эта адаптация основана на принципах биомеханики суставов, переплетенных с механобиологией тканей. Адаптация определяется пространственно-временными изменениями физических и химических свойств мягких и минерализованных тканей, включая их границы раздела, что, в свою очередь, может привести к общему изменению во взаимосвязи формы и функции, обычно называемой функциональной или биомеханической адаптацией.
В этом разделе будет разъяснено влияние эксцентрических нагрузок, нагрузок, которые не совпадают с анатомической осью сустава, в отличие от концентрических нагрузок.Эксцентрические нагрузки — это нагрузки, налагаемые парафункциональными привычками с различной величиной и частотой, при которых главный вектор преобразуется в момент и может усугубить функциональную адаптацию между двумя несоответствующими поверхностями в движении, особенно на привязанных концах PDL-кости и PDL-цемента сайты вложения. Эти адаптации с течением времени можно наблюдать как физические особенности, известные как сужения, и при исследовании в контексте функции они могут привести к концентрации стресса и надвигающемуся отказу некогда биомеханически эффективного сустава.К другим значительным нарушениям, вызванным нагрузкой, относятся травматические и терапевтические нагрузки от ортодонтических скоб, все из которых могут изменить соотношение формы и функции и снизить функциональную эффективность фиброзного сустава кость-PDL-зуб, что будет обсуждаться в разделе 2.
c. Эти участки сужения в пространстве PDL со временем становятся новыми участками, несущими нагрузку, и могут в конечном итоге нарушить функцию сустава () (31)
Форма модулирует биомеханический ответ отдельных структурных компонентов фиброзного сустава, включая его интерфейсы, для облегчения оптимального движения зубов 31) в физиологических и нефизиологических условиях, в том числе при терапевтических нагрузках.Контекстуальная информация о межфазной биомеханике лучше всего выделяется при проведении экспериментов in situ и посредством визуализации интерфейсов без нагрузки и в условиях нагрузки. После регистрации / анализа изображений была нанесена на карту деформация внутри PDL в результате концентрической нагрузки (вертикальная нагрузка, выровненная с анатомической осью фиброзного сустава кость-PDL-зуб), как показано на. Нормальное пространство PDL размером 150–380 мкм, как наблюдается, механически деформируется в условиях равномерной нагрузки.Тем не менее, in situ эксцентрическая (смещенная от центра) нагрузка сустава продемонстрировала, что может происходить наклон корня в костной лунке и вызывать адаптацию тканей не только на границах раздела, но и внутри тканей пародонта как таковых путем преобразования деформации, вызванной деформацией. в соответствующих матрицах (механическая энергия) в биологические процессы (химическая энергия). Это преобразование происходит преимущественно внутриклеточно и обеспечивается взаимодействиями матрикс-клетка и клетка-клетка (32, 33, 85–88).В частности, механические деформации могут быть локализованы в областях, где ценится несоответствие между поверхностями зуба и альвеолярной впадины (- красные пятна, –– стрелки –блоки и белые стрелки). В этих областях вполне вероятно, что деформации энтезов сухожилий / связок-костей могут в четыре раза превышать деформацию, испытываемую основной тканью сухожилий / связок, с микротрещинами и / или микротрещинами, происходящими в основном на границе раздела (89, 90). В результате клетки в тканях рядом с энтезами подвергаются частому усилению деформации, что впоследствии вызывает износ на тканевом уровне и вызывает дегенеративные заболевания, называемые энтезопатиями (57, 89).
Энтезопатии могут возникать в результате болезней и / или вызванных нагрузкой возмущений более высоких частот и величин циклических механических сил. Сдвиг деформации в пространстве PDL просто из-за нагрузки (и) и других аберрантных факторов, таких как бактериальный инсульт, изменения твердости пищи и терапевтические нагрузки, может, в свою очередь, изменить общее смещение зуба относительно лунки в лунке. реакция на нагрузку, тем самым изменяя саморегулирующийся биомеханический цикл сустава и вызывая его адаптивный характер на неограниченный срок (-).В других случаях было показано, что экспрессия провоспалительных факторов, рекрутирование клеток и метаплазия в местах энтезов в ответ на чрезмерные посторонние нагрузки и / или длительные воспалительные состояния способствуют развитию костных шпор, препятствующих подвижности суставов (56, 57). Следовательно, длительные нарушения в виде чрезмерных внешних нагрузок часто вызывают хронические воспалительные заболевания, которые могут изменять или разрушать ткани, участвующие в построении органов, снижающих концентрацию стресса.Наблюдаемые костные выпячивания могут возникать из-за нефизиологических функциональных требований на привязанных концах участков прикрепления PDL-кости и PDL-цемента и укреплять область для соответствия функциональным требованиям. Это скомпрометированное пространство PDL будет продолжаться при дальнейшей нагрузке, поскольку места сужения станут новыми «местами, несущими нагрузку», что в конечном итоге вызовет прямое местное сращение кости с цементом. Точно так же предполагается, что изменение функции фиброзного сустава, то есть движение зубов, генерирует адаптацию тканевого состава к изменениям в биомеханике (- различия между нормальным и нарушенным человеческим комплексом кость-PDL-зуб).Клинически, хотя суженное PDL-пространство может считаться бессимптомным при наложении других аберрантных нагрузок и клинических вмешательств, оно может вызвать разрушение фиброзного сустава.
Клинический сценарий, в котором используется манипулирование PDL для стимулирования ортодонтического движения зубов, и модель на животных, чтобы связать физические возмущения на коронке с биологическими процессами в фиброзном суставе, несущем нагрузку на костно-PDL-зубОртодонтическое вмешательство — это клинический сценарий, который может стимулируют правдоподобные нарушения целостности физических характеристик комплекса кость-PDL-зуб.Проиллюстрировано общее смещение зубов путем сравнения реконструированных томографов с коническим лучом, полученных до и после одного года ортодонтического вмешательства. Обратите внимание, что наблюдаемое максимальное смещение зубов составляет 4 мм и значительно больше, чем 150–380 мкм пространства PDL, обычно идентифицируемого у людей. Физические изменения из-за механической стимуляции в результате биологических процессов для быстрой трансляции зубов запрограммированы у грызунов, особенно у мышей между молярами 1 и 2 (M1 и M2, наконечник красной стрелки) с эластичной лентой известной жесткости (XN / m) ( e) сначала выполнить сравнительный анализ изменений PDL-пространства (h) в центрических (f) и эксцентрических (g) условиях.Обратите внимание, что в проиллюстрированном сценарии корни эксцентрично нагруженного первого моляра были смещены в дистальном направлении (h), особенно при сравнении концентрических условий (g).
Обзор распространенных состояний, связанных с расширением пародонтальной связки
Abstract
Цель
Целью данной статьи является обзор группы поражений, связанных с расширением пародонтальной связки (PDL).
Материалы и методы
Был проведен электронный поиск с использованием специализированных баз данных, таких как Google Scholar, PubMed, PubMed Central, Science Direct и Scopus, для поиска соответствующих исследований с использованием таких ключевых слов, как «пародонт», «периодонтальная связка», «пародонт. связочное пространство »,« расширенная периодонтальная связка »и« расширение пародонтальной связки ».
Результаты
Из почти 200 статей около 60 имели общее отношение к теме. В итоге было рассмотрено 47 статей, тесно связанных с интересующей темой. Когда были собраны соответствующие данные, были идентифицированы следующие 10 субъектов: окклюзионная / ортодонтическая травма, пародонтоз / периодонтит, пульпо-периапикальные поражения, остеосаркома, хондросаркома, неходжкинская лимфома, прогрессирующий системный склероз, радиационно-индуцированный костный дефект, бисфосфонат- сопутствующий остеонекроз и остеомиелит.
Заключение
Хотя с расширением PDL могут столкнуться многие стоматологи во время рутинных ежедневных процедур, клиницист должен также учитывать некоторые серьезные связанные с этим состояния.
Ключевые слова: Пародонтальная связка, Периапикальный периодонтит, Остеосаркома, Прогрессирующий системный склероз, Лучевая терапия
Введение
Пародонтальная связка, обычно известная как PDL, представляет собой мягкую соединительную ткань между внутренней стенкой альвеолярной впадины и корнями. зубов.Он состоит из коллагеновых лент (в основном коллагена I типа), соединяющих цемент зубов с деснами и альвеолярной костью. Фибробласты являются основными клетками в PDL, которые формируют, поддерживают и восстанавливают альвеолярную кость и цемент. Кроме того, датчики в PDL обеспечивают проприоцептивный ввод и определяют давление, прикладываемое к зубам.1,2,3 Морфология PDL варьируется в зависимости от анатомии зубов и даже поверхности зубов. Например, он тоньше в середине корня и немного шире около верхушки корня и альвеолярного гребня, что позволяет предположить, что точка опоры физиологического движения зуба расположена в самой тонкой области PDL.2,4 Рентгенологически PDL представляет собой рентгенопрозрачное пространство между твердой оболочкой и корнем зуба. Нормальная ширина PDL колеблется от 0,15 мм до 0,21 мм, которая может уменьшаться с возрастом.1,4 Расширение PDL является одним из наиболее важных изменений околозубных структур и может быть связано с различными аномалиями. чтобы определить, имеет ли расширение правильную или неправильную форму, а также присутствует ли твердая пластинка твердой оболочки. Например, ортодонтическое перемещение зубов приводит к расширению PDL, но твердая пластинка остается нетронутой.Напротив, злокачественные или локально агрессивные поражения могут быстро разрастаться вниз в пространство связок, что приводит к нерегулярному расширению и разрушению твердой оболочки.4,5,6 Рентгенография остается основным методом исследования для оценки поражений челюсти в повседневной стоматологической практике. 7 Хотя с расширением PDL могут столкнуться многие стоматологи во время повседневных процедур, некоторые случаи могут быть связаны с серьезными поражениями или заболеваниями. Таким образом, цель данной статьи состояла в том, чтобы рассмотреть 10 наиболее важных клинических сущностей, связанных с расширением PDL, чтобы привлечь внимание практикующих стоматологов к этим результатам визуализации и помочь практикующим стоматологам ставить более точные диагнозы и улучшать планы лечения на основе данных пациентов. рентгенограммы.
Материалы и методы
В этом обзоре общие поисковые системы и специализированные базы данных, включая Google Scholar, PubMed, PubMed Central, Science Direct и Scopus, использовались для поиска соответствующих исследований с использованием ключевых слов «периодонт», «периодонтальная связка», «Пространство периодонтальной связки», «расширенная периодонтальная связка» и «расширение пародонтальной связки». Было найдено около 200 статей, около 60 из которых имеют непосредственное отношение к теме. Около 140 статей были исключены из процесса проверки по следующим причинам: они были написаны на языках, отличных от английского, их полный текст был недоступен, они были в форме отчетов о случаях с небольшим количеством случаев, которые указывали только на наличие тема без демонстрации частоты, или они в основном были сосредоточены на изменениях в челюстных костях, а не в PDL.Из 60 отобранных статей были изучены недавно опубликованные статьи с неповторяющейся тематикой, а 15 были опущены. В итоге мы включили 47 статей, которые были тесно связаны с интересующей темой. Когда были собраны соответствующие данные, было выявлено 10 организаций.
Результаты
Из обзора литературы было идентифицировано 10 сущностей, связанных с расширением PDL, как подробно описано ниже.
Окклюзионная / ортодонтическая травма
Травматическая окклюзия или окклюзионная травма определяется как чрезмерное усилие или давление на 1 зуб или на зубы, приводящее либо к усилению альвеолярной опоры, либо к разрушению поддерживающих тканей.8 Травматическая окклюзия может вызвать дегенеративные изменения в ответ на давление, превышающее физиологическую переносимость поддерживающих зуб тканей. Помимо клинических признаков и симптомов, таких как подвижность зубов, фасеточный износ, боль, необычная реакция на перкуссию и парафункции в анамнезе, есть некоторые рентгенологические признаки, в том числе расширение PDL, утолщение твердой мозговой оболочки, потеря костной массы и увеличенное количество и размер трабекулы. 4,9 PDL, которая находится между цементом и альвеолярной костью, действует как амортизатор, чтобы противостоять механическим силам, приложенным к зубам, и реагирует ремоделированием.Когда к коронке зуба прилагается постоянная сила, это вызывает движение зуба, которое первоначально отмечается сужением периодонтальной мембраны. Однако во вторичном периоде движения зубов происходит прямая резорбция кости, и ПДП значительно расширяется (). Было показано, что клетки PDL при механическом стрессе могут индуцировать секрецию остеокластов посредством синтеза PGE2 во время ортодонтического перемещения зубов.10
Расширение периодонтальной связки вокруг правого второго моляра нижней челюсти очевидно при потере соседних зубов, подвергая ее воздействию тяжелая окклюзионная травма.
Kundapur et al., 11 в исследовании с участием 300 пациентов с травматической окклюзией, обратившихся за консультацией к пародонту, обнаружили, что расширение PDL только наблюдалось у 8,7%, расширение PDL с потерей костной массы наблюдалось в 2,7%, а расширение PDL, сопровождающееся костным. выпадение и утолщение твердой пластинки отмечено в 0,7% случаев.
Другие последствия травматической окклюзии — гиперцементоз и перелом корня. Сама по себе травматическая окклюзия не приводит к заболеванию пародонта, но потеря костной массы может ускориться при наличии ранее существовавшего пародонтита.Поскольку клиническое обследование может быть недостаточным для диагностики этого заболевания, настоятельно рекомендуется рентгенографическая оценка.4 Ортодонтические силы могут вызвать расширение PDL, но при этом щадят твердую пластинку оболочки () .4,5,6
Панорамная рентгенограмма демонстрирует общее расширение пародонтальной связки. из-за травмы, вызванной ортодонтическими силами.
Заболевания пародонта / пародонтит
Заболевания пародонта, включая гингивит и пародонтит, представляют собой хронический иммунный воспалительный ответ, связанный с генетическими факторами и факторами окружающей среды.12 Пародонтит характеризуется воспалительным разрушением поддерживающего аппарата зуба (периодонтальной связки, цемента и альвеолярной кости), что приводит к постепенному расшатыванию зубов.13 Рентгенография играет ключевую роль в оценке этого состояния. Подобно всем воспалительным поражениям челюстной кости, пародонтоз / пародонтит обычно представляет собой сочетание потери костной массы (в основном в ранней острой фазе) и образования кости или даже склероза (в основном в хронической фазе). Ранний периодонтит вызывает притупление альвеолярного гребня и уменьшение высоты альвеолярной кости в передних отделах челюстей.Потеря обычно острого угла между твердой оболочкой твердой оболочки и альвеолярным гребнем также может быть замечена в задних областях.4 В хронических случаях наблюдается горизонтальная и вертикальная потеря костной ткани. Вертикальный костный дефект развивается, когда потеря костной массы распространяется вниз по корню зубов в сочетании с глубоким пародонтальным карманом. На ранней стадии это явление проявляется как аномальное расширение PDL (). В устойчивых случаях может произойти потеря костной массы щечных или язычных кортикальных пластин и костные деформации в области разветвления многокорневых зубов.Расширение PDL на верхушке или межкорневой области является важным свидетельством заболевания пародонта.4 Раннее выявление заболеваний пародонта и правильное лечение костных дефектов имеют важное значение для лучшей диагностики, лечения и прогноза этого заболевания.13
Периапикальные рентгенограммы показывают расширение пародонтальной связки вокруг резцов верхней и нижней челюсти из-за пародонтита.
Пульпо-периапикальные поражения
Эти группы поражений считаются наиболее частыми образованиями, связанными с пульпитом или неправильной терапией корневых каналов.14 Marmary и Kutiner15 продемонстрировали, что периапикальные дефекты можно увидеть в 34% случаев глубокого кариеса и что существует связь между кариозными поражениями и периапикальными костными изменениями. В другом исследовании сообщалось, что распространенность апикальных поражений в сочетании с зубами с пломбированными корнями достигает 64%, а расширение PDL было первым признаком рентгенограмм.13 В исследовании Dayal et al. 16 54,2% зубов с пульпитом имели рентгенологические изменения в основном в виде хронического пульпита и полипа пульпы.Кроме того, расширение PDL было наиболее частой находкой в большинстве случаев (46,1%) (), за которым следовало нарушение сплошности твердой пластинки (20,2%), утолщение твердой оболочки (18%) и конденсирующийся остит (12,3%). . Также сообщалось о расширении PDL в зубах с подострым пульпитом, острым пульпитом и гиперемией пульпы. Было отмечено, что расширение PDL в верхушках корней обычно было характерным признаком воспалительных поражений эндодонтического происхождения.17
Расширение пародонтальной связки в результате пульпо-периапикального поражения наблюдается во втором моляре левой нижней челюсти.
Остеомиелит
Остеомиелит — это инфекция костей. Это состояние имеет 2 фазы: острую или хроническую. Острая фаза болезни может поражать пациентов любого возраста с сильной мужской склонностью.4 Она гораздо чаще встречается в нижней челюсти, чем в верхней челюсти, возможно, из-за плохого кровоснабжения нижней челюсти18, 19. длительный и, как правило, менее тяжелый. У пациентов с обширными поражениями заболевание может распространиться на мыщелок нижней челюсти и суставы, что приводит к септическому артриту.Также может развиться дренирующий свищ, который может проявляться в виде четко выраженного разрыва в наружной коре или в новой надкостнице (4). Рентгенография играет ключевую роль в диагностике и последующем наблюдении за заболеванием. Может отмечаться небольшое снижение плотности пораженной кости. Однако острый остеомиелит может стимулировать резорбцию или костеобразование. Секвестры служат рентгенологическим признаком поздней стадии острого заболевания18, 19, 20. Хронический остеомиелит обычно стимулирует формирование новой надкостницы по образцу «луковой кожицы».Между тем, зубы могут подвергаться резорбции наружного корня, твердая оболочка твердой оболочки сливается с периферической зернистой склеротической костью и становится менее заметной, а пространство PDL расширяется в апикальной области. твёрдая пластинка может быть начальным рентгенологическим индикатором остеомиелита. Первоначально разрушение кости происходило внутри губчатого вещества кости. Кортикальная пластинка была вторично вовлечена в результате прогрессирующей резорбции кости и увеличения давления, оказываемого воспалением.18,19,20
Панорамное реконструированное компьютерное рентгенологическое изображение с коническим лучом показывает хронический склерозирующий остеомиелит с расширением периодонтальной связки вокруг правого нижнечелюстного клыка, а также подбородочный свищ.
Остеосаркома
После множественной миеломы остеосаркома является наиболее частой первичной злокачественной опухолью кости с оценочной частотой 2 или 3 случая на 100 000 человек.21 Однако остеосаркома челюстей встречается редко и составляет от 5% до 13% случаев заболевания. все случаи остеосаркомы.22 Более 80% случаев произошли в возрасте от 5 до 25 лет, но второй, более низкий пик заболеваемости был зарегистрирован в пятом и шестом десятилетии. Пристрастия к полу или расе не наблюдалось, и нижняя челюсть поражается чаще, чем верхняя челюсть.21 Остеосаркома клинически проявляется как твердое опухание, увеличивающееся в размерах в течение нескольких месяцев. Оно может сопровождаться парестезией, болью, деформацией лицевых костей, подвижностью зубов и зубной болью, что приводит к необдуманному удалению. 21 Раннее обнаружение является наиболее важным фактором для улучшения прогноза.В большинстве случаев среднее время между начальными симптомами и окончательным диагнозом составляет от 3 до 5 месяцев.21,23 Диагноз остеосаркомы обычно подозревается на основании рентгенологических изменений пораженной кости. Согласно Garrington et al., При ранней остеосаркоме челюстей на периапикальной рентгенограмме зубов была обнаружена симметрично расширенная PDL 1 или более зубов, очевидно, до того, как были обнаружены какие-либо другие рентгенологические особенности. Кроме того, было упомянуто, что расширение PDL могло происходить асимметрично ().21 В серии случаев, проведенных Givol et al. 23, расширение PDL было обнаружено в 28% остеосарком челюстной кости, и было указано, что симметричное расширение PDL было характерной особенностью остеосаркомы. Другими рентгенологическими находками были смешанные рентгенопрозрачные / рентгеноконтрастные образования, рентгеноконтрастные образования с изъеденным молью, треугольник Кодмана и появление солнечных лучей21. Пациент с остеосаркомой.Обратите внимание на появление солнечных лучей в восходящей ветви и под углом нижней челюсти.
Хондросаркома
После множественной миеломы и остеосаркомы хондросаркома является третьей по распространенности первичной злокачественной опухолью челюстной кости.25 Только от 5% до 10% хондросарком возникают в области головы и шеи. Он может появиться в любом возрасте; тем не менее, большинство случаев обнаруживается между третьим и шестым десятилетиями жизни.26,27 Мужчины поражаются чаще, чем женщины, и верхняя челюсть поражается больше, чем нижняя челюсть.25 Клинически опухоль проявляется в виде безболезненного отека или образования, связанного с расшатыванием пораженного зуба. 26 Боль может быть поздним симптомом, а региональная лимфаденопатия встречается редко. 27 Хотя она может имитировать появление остеосаркомы на рентгенограммах, 25 нет патогномоничного изображения. находка была найдена для этого поражения. Иногда могут присутствовать единичные или множественные просветы с нечеткими границами, деструкция кости, связанная с кальцификациями, матовое стекло или появление солнечных лучей / солнечных вспышек, а также равномерное расширение PDL.27 В областях, несущих зубы, расширенный PDL (признак Гаррингтона) может быть замечен как ранний признак хондросаркомы.28 Если поражение происходит рядом с зубами, также может наблюдаться смещение зуба и резорбция корня. лимфома
Лимфома — это злокачественное лимфопролиферативное заболевание, разделенное на 2 типа: лимфома Ходжкина (HL) и неходжкинская лимфома (NHL) .29 Первичная NHL обнаруживается за пределами узловых тканей в 24–45% случаев, причем чаще всего поражаются желудочно-кишечный тракт и кожа.Поражение костей встречается редко и составляет лишь 5% всех экстраузловых лимфом. НХЛ челюстей поражает взрослых в четвертом и пятом десятилетиях жизни с преобладанием мужчин (соотношение мужчин и женщин 3: 2) .30 При возникновении в зубных областях НХЛ обычно проявляется как стоматологическая патология, что делает ее сложно установить своевременный диагноз. В среднем, проходит более 2 месяцев между первичным представлением и окончательным диагнозом НХЛ.31 Клинически это проявляется в виде опухоли кости, подвижности зубов, образования в лунке после удаления, боли, патологического перелома и анестезии или парестезии на пути нижний альвеолярный нерв.30 Что касается визуализации, патогномоничных признаков для НХЛ не обнаружено; однако он обычно проявляется как плохо определяемая рентгенопрозрачность, похожая на многие распространенные одонтогенные патологии, такие как хронический апикальный пародонтит. 30,32 Япес и др. 33 сообщили о случае НХЛ, которая была ошибочно диагностирована как пародонтальный абсцесс. Другие рентгенографические признаки НХЛ включают потерю кортикального слоя, расширение нижнечелюстного канала, расширение подбородочного отверстия, потерю твердой пластинки и расширение PDL.30 Нерегулярное и диффузное расширение PDL было зарегистрировано как рентгенологическое обнаружение NHL. вовлечение верхней челюсти по Buchanan et al.32 О тех же результатах сообщили Imaizumi et al. 34 в отношении нижней челюсти.
Прогрессирующий системный склероз
Прогрессирующий системный склероз — это генерализованное заболевание соединительной ткани, которое приводит к чрезмерному отложению коллагена и укреплению кожи и других тканей. Это заболевание среднего возраста (от 30 до 50 лет), которое в 3 раза чаще встречается у женщин, чем у мужчин.4 Устные проявления прогрессирующего системного склероза включают ограничение открывания рта, ксеростомию, заболевания пародонта, увеличение ширины PDL. , резорбция кости нижней челюсти.35 Наиболее частым признаком прогрессирующего системного склероза на рентгенограммах полости рта является увеличение ширины PDL примерно у двух третей пациентов. Пораженное пространство PDL обычно как минимум в два раза толще, чем нормальное, и в него вовлечены как передние, так и задние зубы.4 Частота расширения PDL у пациентов с прогрессирующим системным склерозом варьировала от 7% по Stafne до 100% по Marmary et al.36 , 37 В недавнем исследовании Anbiaee и Tafakhori35 утверждали, что прогрессирующий системный склероз следует учитывать при дифференциальной диагностике у пациентов с расширением PDL и интактной твердой пластинкой, особенно в задних неподвижных зубах, когда расширенный PDL обнаруживается более чем в 1 квадранте ().Более того, у двух третей пациентов с прогрессирующим системным склерозом наблюдается расширение PDL.38 В серии случаев, проведенных Baron et al., 1 эрозия нижней челюсти и расширение PDL были упомянуты как основные рентгенологические признаки, которые позволяют дифференцировать прогрессирующую болезнь. системный склероз от нормального состояния. Baron et al.1 также продемонстрировали, что тяжесть заболевания в значительной степени связана с количеством зубов с расширенной PDL. Основные причины расширения PDL до конца не изучены. Auluk39 предположил, что это изменение вызвано вовлечением жевательной мышцы, которая становится более объемной и оказывает повышенную окклюзионную силу, что приводит к первичной травме из-за окклюзии.Однако этот механизм был отвергнут Мехрой.40 Учитывая высокое содержание фибробластов и коллагена в PDL, неудивительно, что расширение PDL у этих пациентов вызвано избыточным отложением волокон коллагена и окситалана с последующей резорбцией альвеолярного отростка. гребень, окружающий корень. 1,41
Панорамное реконструированное компьютерно-томографическое изображение с коническим лучом показывает расширенную пародонтальную связку в основном в задних областях челюстей у пациента с прогрессирующим системным склерозом.
Лучевой дефект кости
Лучевая травма челюстей является одним из серьезных осложнений после лучевой терапии злокачественных образований ротовой полости42. Тип и зрелость кости, а также доза облучения являются решающими факторами, определяющими реакцию костей на это. травма, повреждение. При облучении незрелой кости происходит задержка роста. Радиационное повреждение зрелой кости, вероятно, зависит от дозы и может повлиять на остеобласты (уменьшение образования матрикса) и остеокласты (увеличение резорбции кости).Чаще всего лучевая терапия затрагивает заднюю часть нижней челюсти, за которой следует задняя часть верхней челюсти. Чтобы свести к минимуму побочные эффекты лучевой терапии, важно раннее выявление травм костей. В целом, рентгенологические изменения мало полезны в ранней диагностике лучевых дефектов кости.4,42 Однако в альвеолярном отростке челюстей нерегулярное расширение PDL вокруг пораженных зубов является наиболее частым рентгенологическим признаком после облучения ( ).4 В исследовании Fujita et al., 42 расширение PDL было упомянуто как раннее рентгенологическое изменение, наблюдаемое при орофациальной лучевой терапии. О тех же результатах сообщили и другие исследователи в двух исследованиях на животных.43,44 Недавно было продемонстрировано, что более чем у 50% пациентов, получающих терапевтическую лучевую терапию, наблюдалось расширение PDL, и большинство случаев не было обнаружено в течение 2 лет после облучения. Расширение PDL также было более серьезным, когда доза на нижнюю челюсть превышала 45 Гр.4 В качестве возможного патогенеза было высказано предположение, что уменьшенная васкуляризация мембраны PDL и отек увеличивают объем периодонтальной связки, что приводит к резорбции лунки зуба. стенка, которая может быть ускорена внутри омертвевшей облученной кости.4,45 Другие рентгенографические изменения были аналогичны потере костной массы при пародонтозе. 4
Панорамное реконструированное компьютерное томографическое изображение с коническим лучом показывает расширение пародонтальной связки в правом нижнечелюстных премолярах у пациента с раком головы и шеи, вызванное лучевой терапией.
Остеонекроз, связанный с бисфосфонатами
Бисфосфонаты — это лекарства, используемые для лечения или лечения остеопороза, костных метастазов, несовершенного остеогенеза, ревматоидного артериита, большой талассемии, множественной миеломы и гиперкальциемии, связанной с злокачественными новообразованиями.46 В 2003 году была впервые описана взаимосвязь между остеонекрозом челюстей и бисфосфонатами.47 Клинические признаки варьируются: у одних пациентов симптомы могут отсутствовать, а у других — болезненное обнажение костей, подвижные зубы, воспаление мягких тканей, отсутствие симптомов. исцеление экстракционной лунки, а также заболевания пазух и нейросенсорные расстройства.46,48 Диагноз может быть отложен, поскольку он не имеет специфических рентгенографических характеристик. Обычными рентгенологическими находками являются склероз альвеолярного края и утолщение твердой оболочки, сужение нижнего альвеолярного канала, периостальная реакция, секвестры, расширение PDL и периапикальная рентгенопрозрачность.46,48,49 В исследовании Fleisher et al. 48 расширение PDL было наиболее частой находкой у пациентов с остеонекрозом, связанным с бисфосфонатами. Он был обнаружен в 83% случаев, когда бисфосфонаты применялись внутривенно или перорально, и в 88% случаев, когда бисфосфонаты употреблялись только парентерально. Также было продемонстрировано, что наличие расширения PDL может быть более чувствительным индикатором, чем тестирование CTX (карбоксиконцевой телопептид коллагена I типа) при прогнозировании риска некроза кости. В другом исследовании Moeini et al., 46 утолщение твердой оболочки, плохо заживающие или незаживающие лунки, расширение PDL и склеротические изменения нижнечелюстного канала были обнаружены у 58%, 41,6%, 33,3% и 25% детей, принимавших бисфосфонаты.
Обсуждение
Этот обзор показал, что расширение PDL может быть связано с 10 относительно распространенными объектами, которые можно разделить на 4 группы: травматические, инфекционные, неопластические или системные причины.
Травматическими причинами расширения PDL являются окклюзионные / ортодонтические травмы и радиационный дефект кости.Травматическая окклюзия вызвана аномалиями развития челюстей или несоответствующими реставрационными, протезными или даже ортодонтическими процедурами, которые в конечном итоге приводят к расширению PDL в 1 зубе или нескольких зубах.8,9,10 Из-за воздействия на костные ткани лучевая терапия может быть рассмотрена. как травматическая причина расширения PDL. 4,42,43
Пародонтоз / пародонтит, пульпо-периапикальные поражения и остеомиелит являются одними из инфекционных причин расширения PDL. Возбудители пародонта или распространение зубного абсцесса способствуют расширению пародонтальной связки.4,13 Некоторые отчеты показали, что пульпит, пульпо-периапикальные патологии или даже витальная пульпа с минимальным гиперемическим поражением приводили к расширению PDL через инфекционный путь. 14,16,17 С другой стороны, боль, лихорадка, отек прилегающих мягких тканей. ткани, лимфаденопатия и лейкоцитоз должны побуждать клинициста к остеомиелиту.4,18
Расширение PDL также может быть вызвано неопластическими поражениями костей челюсти, такими как остеосаркома, хондросаркома и NHL. Расширение PDL, особенно при асимметричном распределении, сопровождающемся образованием костной массы в челюстях с прогрессирующим характером роста, должно побудить стоматолога учитывать остеосаркому и хондросаркому при дифференциальной диагностике и проводить более сложные диагностические процедуры.23,26,28 С другой стороны, первым проявлением НХЛ может быть расширение PDL или поражения челюсти, имитирующие пародонтоз. 32,33
Между тем, периапикальные поражения, резистентные к терапии корневых каналов, могут быть диагностированы как лимфома, согласно исследованию. некоторые сообщения.29 Общепризнано, что большинство новообразований имеют лучший прогноз, если обнаруживаются на более ранних стадиях; однако расширение PDL является менее заметным признаком оральной лимфомы в академических стоматологических курсах.
Прогрессирующий системный склероз и остеонекроз, связанный с бисфосфонатами, — это два системных состояния, ведущих к расширению PDL.До 100% пациентов с прогрессирующим системным склерозом демонстрируют этот признак.36,37 Расширение PDL является ранним признаком прогрессирующего системного склероза, который может помочь практикующим стоматологам установить своевременный диагноз с помощью соответствующих лабораторных тестов35. У пациентов, принимающих бисфосфонаты, PDL Расширение может быть хорошим индикатором для прогнозирования развития остеонекроза.48
В этом обзоре основное внимание уделялось связи между стоматологическими и медицинскими дисциплинами и роли практикующих стоматологов как пионеров диагностического процесса в некоторых случаях.Между тем, были предприняты особые усилия для введения узкого дифференциального диагноза, помогающего стоматологам принимать более логичные решения при столкновении с такими поражениями. Очевидно, что обе стратегии приводят к выбору лучших протоколов лечения для пациентов.
Адаптивная природа комплекса кость-пародонтальная связка-цемент в периодонтите, вызванном лигатурой, крыса Модель
Новый аспект этого исследования включает в себя иллюстрацию значительной адаптации функционально загруженного комплекса кость-PDL-цемент при пародонтите, вызванном лигатурой модель крысы.После 4, 8 и 15 дней лигирования провоспалительные цитокины (TNF- α и RANKL), индикатор минеральной резорбции (TRAP) и молекула миграции и адгезии клеток для регенерации ткани (фибронектин) в комплексе были локализованы и коррелирует с изменениями в PDL-пространстве (функциональном пространстве). Через 4 дня лигирования функциональное пространство дистального комплекса было расширено по сравнению с контролем и положительно коррелировало с повышенной экспрессией TNF- α . Через 8 и 15 дней количество клеток RANKL (+) уменьшилось около мезиального гребня альвеолярной кости (ABC), но увеличилось в дистальном отделе ABC.Клетки TRAP (+) на обеих сторонах комплекса значительно увеличились через 8 дней. Постепенное изменение экспрессии фибронектина от дистальных поверхностей раздела PDL-вторичный цемент через слои прецедента наблюдалось по сравнению с увеличенными и резкими изменениями на мезиальных границах раздела PDL-цемент и PDL-кость в лигированной и контрольной группах. Основываясь на наших результатах, мы предполагаем, что в пораженном пародонте могут быть созданы скомпрометированные поля деформации, которые в ответ на длительную функцию могут значительно изменить исходные образования кости и апикального цемента.
1. Введение
Механические нагрузки в результате жевания или укуса способствуют гомеостазу пародонтальной связки (PDL) и комплекса кость-PDL-цемент после развития фиброзного сустава кость-PDL-зуб [1, 2 ]. Гомеостаз сустава поддерживается PDL, который содержит гетерогенную популяцию клеток, таких как фибробласты, остеобласты, цементобласты и недифференцированные мезенхимальные клетки, а также их энтезы (места прикрепления) с костью и цементом.Эти клетки чувствительны к механическим нагрузкам, которые проявляются в деформациях, и в результате могут способствовать образованию или рассасыванию минералов. Взаимодействия клетка-матрикс и клетка-клетка регулируют непрерывный оборот PDL, моделирование и ремоделирование кости и последующую адаптацию первичного и вторичного цемента, включая интерфейсы PDL-кость и PDL-цемент на протяжении всей их физиологической функции [2-5]. Аккомодация функциональных нагрузок в пределах физиологического диапазона продолжается до тех пор, пока комплекс кость-PDL-цемент защищен от ротовой полости эпителием десен и подлежащими соединительными тканями.Однако комплекс является мишенью для бактериальной инфекции из-за комменсальных микроорганизмов в ротовой полости и уникальных анатомических особенностей этой среды [6]. В результате ткани пародонта подвержены бактериальной инвазии.
Считается, что взаимосвязь между микробными взаимодействиями хозяина и прогрессированием пародонтита зависит от сочетания экологического сдвига в составе поддесневой биопленки, генетических факторов и других посторонних влияний [7]. Несмотря на множество посторонних факторов, модель «критического пути» патогенеза пародонта, разработанная Оффенбахером [8], не учитывает механические нагрузки, то есть влияние функциональной механики на прогрессирование заболевания в несущем нагрузку суставе человека.Биомеханика и другие функциональные аспекты пораженных суставов являются важными областями изучения, поскольку измененный гомеостаз из-за бактериальной инвазии может привести к патологической адаптации непораженных тканей. Следовательно, комбинаторное влияние заболевания и функциональных (механических) нагрузок на прогрессирование заболевания и совместную адаптацию является важной областью исследований. Тем не менее, проблема, которая возникает при проведении таких исследований, заключается в ограниченном доступе к образцам, взятым у людей. Следовательно, модели на животных в целом и модели на крысах в частности продолжают широко использоваться в качестве экспериментальной системы для выяснения влияния различных факторов на патогенез и прогрессирование пародонта [9, 10].Несмотря на обширную литературу, касающуюся характеристик прогрессирования пародонта на различных моделях животных, лишь несколько исследований описали эффекты заболевания с биомеханической точки зрения.
Многочисленные исследования на людях и животных подтвердили инфекционную этиологию воспаления десен [11–13], апикальную миграцию прикрепления десневого эпителия и возможную потерю опоры подлежащей кости и соединительной ткани [14, 15], что приводит к клиническим проявлениям. пародонтит.В этом исследовании мы использовали пропитанную липополисахаридом модель лигатуры крысы, чтобы инициировать клинические признаки пародонтита, а именно воспаление и потерю прикрепления PDL и альвеолярной кости [16]. Эта модель является аналогом, который стимулирует естественное возникновение пародонтита у людей — задержку пищи с течением времени, за которой следует острая и хроническая воспалительная реакция хозяина [17–19]. Как только заболевание инициировано, комплекс продолжает функционировать, и изменения клинических характеристик могут быть коррелированы с распределением биохимических маркеров.В этом исследовании оценивали наличие и распределение следующих биохимических маркеров в срезах, взятых из гемимаксилл, собранных на 4, 8 и 15 дни лигирования, и соответствующих контролей: активатор рецептора ядерного фактора κ лиганд B (RANKL: мембрана -связанный белок, обычно обнаруживаемый на клетках PDL, остеобластах и Т-клетках, который индуцирует экспрессию RANK на поверхности остеокластов) [20, 21]; тартрат-резистентная кислая фосфатаза (TRAP: фермент, высоко экспрессируемый остеокластами) [22]; фактор некроза опухоли-альфа (TNF- α : маркер системного воспаления) [23] и фибронектин (FN: молекула адгезии гликопротеина для фибробластов, которая способствует продукции внеклеточного матрикса) [24].Более того, изменения в биохимических проявлениях и локализации коррелировали с морфологическими изменениями комплекса. Основываясь на предыдущих исследованиях, проведенных другими исследователями, морфологические изменения кости и цемента из-за воспаления были связаны с повышенной экспрессией провоспалительных медиаторов [25–28], включая различные цитокины, такие как TNF- α , которые участвуют в воспалительном процессе кости. резорбция [29]. RANKL, который, как известно, управляет остеокластогенезом синергетически с TNF- α [30], был картирован по всему комплексу кость-PDL-цемент, и ожидалось, что он будет увеличиваться в воспаленной ткани пародонта.Кроме того, были идентифицированы активные остеокласты и соответствующие изменения в биохимическом распределении и резорбции альвеолярной кости. Наконец, адаптивные изменения во вторичном цементе, отмеченные экспрессией FN [31], обсуждались в контексте функции суставов. Наша общая гипотеза заключалась в том, что деградация коронки из-за периодонтита может вызвать значительное изменение биомеханики комплекса и что результирующие адаптивные эффекты могут быть разными для кости и вторичного цемента. Цель состояла в том, чтобы определить адаптацию этого несущего сустава, то есть комплекса кость-PDL-зуб, с началом периодонтита путем картирования и сопоставления морфологических изменений зуба и альвеолярной лунки с ключевыми биомолекулярными экспрессиями в комплексе. .
2. Материалы и методы
Чтобы свести к минимуму последствия пародонтита, вызванного окружающей средой [32–34], 6-недельных самцов крыс Sprague-Dawley содержали в стерильном помещении (здание Parnassus Services Building) и кормили твердой пищей. гранулированный рацион на время исследования. Все животные, включенные в это исследование, содержались в условиях, свободных от патогенов, в соответствии с руководящими принципами Институционального комитета по уходу и использованию животных (IACUC) UCSF и Национального института здоровья (NIH).
2.1. Вызвание пародонтита с использованием лигатуры
In vivo Крысиная лигатура Модель4–0 шелковых шовных нитей, пропитанных 1 мг липополисахарида (ЛПС) из Escherichia coli серотипа 055: B5 (Sigma-Aldrich, США) на 1 мл 1x Трис-буфер использовался для индукции пародонтита (в определенный момент времени). Нити были помещены между первым и вторым молярами, а также вторым и третьим молярами обеих верхних челюстей (рис. 1 (а)). Моляры повторно восстанавливали каждые 2-3 дня для обеспечения ретенции.Контрольных крыс (на определенный момент времени) чистили зубной нитью каждые 2-3 дня 4–0 шелковыми лигатурами без LPS. Крыс умерщвляли через 4, 8 и 15 дней лигирования. Верхнечелюстные кости собирали и разрезали пополам. Правые гемимаксиллы хранили в 70% этаноле для анализа микро-XCT. Левые гемимаксиллы фиксировали в 4% параформальдегиде (PFA) при комнатной температуре в течение ночи для гистологии.
2.2. Гистологический анализ экспрессии цитокинов с помощью иммуногистологии, идентификация резорбции кости через TRAP (+) остеокласты и наблюдение изменений двулучепреломления коллагена
После фиксации интактные гемимаксиллы () декальцинировались в 0.5 М раствор этилендиаминтетрауксусной кислоты (ЭДТА) в течение 3 недель. Раствор ЭДТА меняли каждые 3 дня. Затем образцы обезвоживали с помощью 80%, 95% и 100% спирта Flex (Richard-Allan Scientific, Kalamazoo, MI USA) перед заливкой в парафин (Tissue Prep-II, Fisher Scientific, Fair Lawn, NJ USA). Встроенные образцы делали сагиттально на роторном микротоме (Reichert-Jung Biocut, Вена, Австрия) с использованием одноразового стального лезвия (TBF Inc., Shur / Sharp, Fisher Scientific, Fair Lawn, NJ USA).Серийные срезы парафина помещали на предметные стекла Superfrost Plus (Fisher Scientific, Fair Lawn, NJ). Срезы депарафинизировали ксилолом и регидратировали с помощью нисходящей серии этанола из 100%, 95% и 80% этанола перед дальнейшим использованием.
2.2.1. Иммуноокрашивание для RANKL, FN и TNF-альфа
Протокол иммунофлуоресцентного окрашивания, используемый для RANKL и FN, был основан на ранее описанном протоколе [35]. Вкратце, депарафинизированные срезы переваривали трипсином (Sigma-Aldrich, St.Луис, Миссури, США) при 37 ° C. После промывания образцы инкубировали в блокирующем буфере (3% козьей сыворотки, 0,1% BSA в 1x PBS), а затем с первичными антителами поликлонального кроличьего анти-RANKL (Santa Cruz Biotechnology Inc., sc-9073, Санта-Крус, Калифорния, США). США) и моноклональные мышиные анти-FN (Santa Cruz Biotechnology Inc., sc-8422, Санта-Крус, Калифорния, США), разведенные до 1:50 в блокирующем буфере. Срезы хранили при 4 ° C с последующей промывкой 0,1% Tween-20 в PBS (PBST) и инкубировали со вторичными антителами.Козьи анти-кроличьи антитела AlexaFluor 594 (Invitrogen, A-11012, Карлсбад, Калифорния, США) и козьи антимышиные антитела AlexaFluor 488 (Invitrogen, A-11029, Карлсбад, Калифорния, США) использовали для маркировки поликлональных кроличьих анти-RANKL и моноклональных антител. мышиные антитела против FN в концентрации 1: 300 (разбавленные в блокирующем буфере) соответственно. Срезы промывали PBST и затем окрашивали тригидратом тригидрохлорида 1: 10 000 (Invitrogen, Carlsbad, CA, USA) в течение десяти минут в отсутствие света. Предметные стекла дважды промывали PBS и закрепляли с помощью Fluoro-Gel (Electron Microscopy Sciences, Hatfield, PA, USA).Окрашенные срезы визуализировали с помощью флуоресцентного микроскопа Eclipse E800 (Nikon Inc., Мелвилл, Нью-Йорк). Фильтр TRITC (540–565 нм) использовался для возбуждения AlexaFluor 594 (абс. 590 нм, излучение 617 нм), фильтр FITC (465–495 нм) для возбуждения AlexaFluor488 (абс. 495 нм, излучение 519 нм) и Фильтр DAPI (340–380 нм) для возбуждения тригидрата тригидрохлорида (абс. 358 нм, излучение 461 нм). Изображения были сшиты с помощью Microsoft Research Image Composite Editor (Microsoft Corporation, Редмонд, Вашингтон, США).
Для количественного анализа RANKL количество клеток RANKL (+) в двух квадратных областях размером 125 мкм м вокруг поверхности гребня альвеолярной кости было подсчитано с использованием изображения J (v1.44p, Национальный институт здоровья, США). Были рассчитаны средние по группе (± стандартное отклонение). Двусторонний дисперсионный анализ (ANOVA) был использован для анализа влияния времени и условий эксперимента. Последующий апостериорный тест был использован для анализа различий между группами. был взят для обозначения значимости. Для сравнительной оценки FN для иммунофлуоресцентных микрофотографий каждой группы был создан линейный график размером 300 мкм м, охватывающий дентин, вторичный цемент, PDL и альвеолярную кость, и с помощью Image J.
Окрашивание 3,3′-диаминобензидином (DAB) для обнаружения TNF- α проводили на серийных срезах. Эндогенные пероксидазы дезактивировали 80% метанолом и 0,6% H 2 O 2 . После извлечения антигена срезы инкубировали с нормальной сывороткой в течение 30 минут для предотвращения неспецифического связывания. Для обнаружения цитокинов на срезы наносили первичное антитело (козье поликлональное антитело против TNF- α крысы, sc-1350 Santa Cruz Biotechnology, Inc., Санта-Крус, Калифорния, США) в разведении 1: 100 в PBS. и инкубировали в течение ночи при комнатной температуре.Срезы инкубировали в течение 15 мин при комнатной температуре со вторичным антителом (биотинилированное кроличье антитело против козьего IgG, PK-6105, Vector Labs, Burlingame, CA, USA). Комплексы антиген-антитело визуализировали с помощью раствора тетрахлорида DAB (Sigma, D3939, Сент-Луис, Миссури, США), промывали в дистиллированной воде, контрастировали гематоксилином Gill (3X) (Fisher Scientific, Каламазу, Мичиган, США) и промывали в проточная вода. Наконец, срезы обезвоживали в возрастающей концентрации спирта, очищали ксилолом и монтировали.Отрицательный контроль получали заменой первичных антител нормальной козьей сывороткой. Ткани легких, взятые у тех же животных, использовали в качестве положительного контроля. Срезы оценивал один исследователь, который не знал назначения лечения с помощью светового микроскопа (BX 51, Olympus America Inc., Сан-Диего, Калифорния, США).
2.2.2. Резорбция путем картирования TRAP (+) остеокластических клеток
Окрашивание тартрат-устойчивой кислой фосфатазой (TRAP) на остеокласты проводили путем обработки регидратированных образцов 0.2 М ацетатный буфер, раствор 0,2 М ацетата натрия и 50 мМ L — (+) — винной кислоты (Sigma-Aldrich, Сент-Луис, Миссури, США). После 20 минут инкубации при комнатной температуре добавляли нафтол AS-MX фосфат и быструю красную соль TR с последующей инкубацией при 37 ° C в течение 1 часа с тщательным мониторингом под микроскопом через первые полчаса для отслеживания развития яркого красное окрашивание для остеокластической активности. Окрашенные срезы промывали деионизированной водой, контрастировали гематоксилином и устанавливали с помощью Immu-Mount (ThermoScientific, Fremont, CA, USA) для последующего исследования под световой микроскопией.Области, окрашенные TRAP (+), были классифицированы в зависимости от местоположения: сегмент от альвеолярного гребня (определяемый как изогнутая поверхность, соединяющая мезиальную и дистальную поверхности собственно альвеолярной кости) до начальной точки вторичного цемента в качестве коронального сегмента и от вторичного цемента. цемент к вершине как апикальный сегмент. Критериями идентификации остеокластов было окрашивание TRAP (+) более чем с тремя ядрами [36]. Количество остеокластов в каждой области подсчитывали вручную по периметру PDL-кости с помощью Image-Pro Plus v6.0 (Media Cybernetics, Inc., Bethesda, MD, США) и были рассчитаны отношения количества остеокластов к периметру в мезиальном и дистальном направлении [37]. Эти соотношения проверяли на предмет статистических различий между контрольной и лигатурной группами и по временным точкам с использованием двустороннего дисперсионного анализа с последующими апостериорными тестами для анализа разницы между группами. Различия с считались значительными.
2.2.3. Двулучепреломление коллагена с использованием красителя Picrosirius Red (PSR)
Депарафинизированные срезы окрашивали Sirius red F3B (C.I. 35782) и пикриновую кислоту (American MasterTech Scientific Co., Лоди, Калифорния, США). Окрашенные срезы анализировали с помощью светового микроскопа и Image-Pro Plus. Поляризованный свет использовался для усиления двойного лучепреломления коллагена, чтобы проиллюстрировать изменения в ориентации коллагеновых волокон и интенсивности двойного лучепреломления во всем комплексе [38, 39].
2.3. Изменения морфометрии комплекса кость-PDL-цемент с помощью компьютерной микрорентгенографии (
μ -XCT)Макромасштабный структурный анализ интактных правых верхнечелюстных суставов (каждая группа) был выполнен с использованием микрорентгенографической томографии ( μ -XCT, Micro XCT-200, Xradia, Inc., Плезантон, Калифорния, США) при 2-кратном увеличении. Рентгеновское изображение было выполнено на образцах с использованием вольфрамового анода с настройкой 75 кВп при 6 Вт в бункере 2 и кварцевого кремнеземного (SiO 2 ) фильтра, разработанного специально для биологических образцов. Образцы сканировали при погружении в 70% этанол, при этом второй моляр находился в центре поля зрения. Было собрано 2000 прогнозов при времени экспозиции 9–14 с для каждого прогноза.
Томограммы реконструированы (XMReconstructor v8.1.6599, Xradia Inc., Плезантон, Калифорния, США) и были созданы виртуальные 2D-срезы (Xradia 3D viewer v1.1.6, Xradia Inc., Плезантон, США) для выполнения следующих измерений с использованием изображения J. Для анализа прогрессирования пародонтита по временным точкам три Через каждый образец были сделаны сагиттальные срезы, содержащие апикальное отверстие: в мезиодистальном направлении через (1) оба буккальных корня, (2) оба язычных корня и (3) межкорневую область (рис. 1 (c)). Резорбцию гребня альвеолярной кости (ABC) определяли путем измерения расстояния от цементно-эмалевого соединения (CEJ) до соседнего ABC второго моляра верхней челюсти вдоль мезиального и дистального корней (рис. 1 (c)).Ширина PDL-пространства вокруг второго моляра верхней челюсти определялась с использованием вышеупомянутых буккальных и язычных сагиттальных срезов (каждая группа). Мезиальный и дистальный корни были разделены на четверти от CEJ до верхушки корня (рис. 1 (d)). От трех апикальных четвертей пять измерений PDL-пространства от альвеолярной кости до корневого цемента на четверть среза были измерены с использованием изображения J. Межкорневые пространства PDL (или межкорневые расстояния), измеренные с использованием срединно-сагиттального сечения как расстояния от гребня межкорневого среза. кость к развилке корня моляра (рис. 1 (г)).Все статистические анализы значимых различий в морфометрии по временным точкам и внутри них были выполнены с использованием двустороннего дисперсионного анализа в сочетании с апостериорными тестами. Различия с считались значительными.
3. Результаты
Естественно возникающие поля растяжения и сжатия в комплексе «кость-PDL-зуб крысы» [35]. Следует отметить, что у крысы дистальная сторона более склонна к резорбции минералов, тогда как мезиальная сторона более склонна к минералообразованию. С биомеханической точки зрения это происходит из-за деформаций растяжения на мезиальной стороне по сравнению с реакционными деформациями сжатия на дистальной стороне.В результате минерал образуется на мезиальной стороне альвеолярной лунки, в то время как минерал резорбируется на дистальной стороне той же альвеолярной лунки, таким образом поддерживая однородное функциональное пространство в фиброзном соединении кость-PDL-зуб.
3.1. Изменения экспрессии биохимических маркеров в периодонтите, индуцированном пропиткой лигатурой LPS Модель
3.1.1. Экспрессия RANKL в комплексе
Интенсивная экспрессия RANKL в эндостальных пространствах альвеолярной кости и сосудистой сети в PDL была обнаружена (фигура 2 (а)) в лигированной группе.Кроме того, остеокласты в резорбционных ямках как в местах прикрепления PDL-кости, так и PDL-цемента сильно экспрессируют RANKL (Рисунок 2 (b)).
Чтобы коррелировать экспрессию RANKL с остеокластической активностью, подсчитывали количество клеток RANKL (+) в субэпителиальной соединительной ткани (СТ) около альвеолярного гребня (Рисунки 2 (c) –2 (e)). Подсчет клеток RANKL (+) показал интересную тенденцию к окрашиванию TRAP (+). На мезиальной стороне (рис. 2 (d)) количество клеток RANKL (+) в лигированной группе было больше, чем в контрольной группе.Однако количество клеток RANKL (+) со временем уменьшалось в обеих группах, показывая значительное снижение в лигированной группе с 4 дней до 15 дней (). На дистальной стороне (рис. 2 (е)) наблюдалось значительное увеличение количества клеток RANKL (+) в лигированной группе по сравнению с контрольной группой () через 4 дня, но снижение наблюдалось через 8 дней. На дистальной стороне было выявлено большее количество клеток RANKL (+) по сравнению с мезиальной стороной лигированной группы и дистальной и мезиальной сторонами контрольной группы (Фигуры 2 (d) и 2 (e)).
3.1.2. Остеокластическая активность в комплексе
Морфологические изменения также оценивали в окрашенных мезиодистальных срезах, и наблюдали повышенную резорбцию альвеолярной кости со временем (рис. 3 (а)). В соответствии с морфометрическим анализом μ -XCT, расстояние CEJ-ABC было выше в лигированных группах (рисунки 3 (а) и 5 (а) (i)). Многоядерные TRAP (+) клетки наблюдались в эндостальном и костномозговом пространствах, независимо от экспериментальных условий или временных точек (рис. 3 (b) (i – ix)).Активные остеокласты на границе PDL-кости также были обнаружены на альвеолярном гребне в группе с 8-дневным лигированием (рис. 3 (b) (ii)). Количественная оценка клеток TRAP (+) показала преимущественную дистальную локализацию независимо от условий эксперимента или момента времени (Фигуры 3 (b) (x) и 3 (b) (xi)).
Данные для 4-дневной лигированной группы были отброшены из-за неадекватных образцов. Клетки TRAP (+) показали преимущественную дистальную локализацию независимо от условий эксперимента или момента времени (Рисунки 3 (b) (x) и 3 (b) (xi)) и достигли пика через 8 дней, за исключением апикальных сегментов на дистальной стороне.На мезиальной стороне остеокластическая активность через 8 дней была значительно выше, чем активность, наблюдаемая через 4 дня в корональных сегментах и у 15-дневной группы с лигированием в апикальных сегментах (Рисунок 3 (b) (x)). В контрольных группах не наблюдалось значительного увеличения или уменьшения как в коронарном, так и в апикальном сегментах. Однако мезиальная остеокластическая активность лигированных групп значительно увеличилась через 8 дней в апикальных сегментах по сравнению с соответствующими контрольными группами, прежде чем снизилась через 15 дней (рис. 3 (b) (x)).На дистальной стороне остеокластическая активность как через 8 дней, так и через 15 дней была значительно выше, чем у 4-дневной контрольной группы в коронарных сегментах, когда 4-дневная контрольная группа использовалась в качестве эталона (данные не показаны). Как на 8-й, так и на 15-й дни лигированные группы показали увеличение остеокластической активности в коронарных сегментах по сравнению с соответствующими контрольными группами, тогда как остеокластическая активность в лигированных группах снизилась в апикальных сегментах (рис. 3 (b) (xi)). Между 8 и 15 днями дистальная остеокластическая активность лигированных групп снизилась как в коронковом, так и в апикальном сегментах (рис. 3 (b) (xi)).
3.1.3. Иммуногистохимическая локализация TNF-
αTNF- α был идентифицирован в эпителии десен, субэпителиальной КТ, эндостальных пространствах, предентине и вторичном цементе (рис. 4 (а)). В частности, экспрессия TNF- α в лигированных группах была более интенсивной, чем у контрольных групп, как на мезиальной, так и на дистальной границе раздела PDL-цемент, межкорневого комплекса и в эндостальных пространствах (рис. 4 (b)). При большем увеличении остеокластоподобные клетки были обнаружены на границах раздела PDL-кость в лигированных группах (рис. 4 (b), стрелки).
3.2. Модель периодонтита, вызванного пропиткой LPS, на крысах стимулировала значительные изменения резорбции альвеолярной кости, ширины PDL-пространства, двулучепреломления коллагена и экспрессии фибронектина
3.2.1. Резорбция альвеолярной кости
Морфометрический анализ с использованием μ -XCT показал, что во все временные точки расстояние от CEJ до ABC (CEJ-ABC) было больше в лигированных группах по сравнению с контрольными группами как в мезиальной, так и в дистальной областях (Рисунок 5 (а) (i)). В то время как через 4 дня как мезиальные, так и дистальные области лигированных групп показали значительное увеличение CEJ-ABC по сравнению с контролем, только дистальные области показали значительное увеличение в соответствующих сравнениях.В мезиальных областях как контрольных, так и лигированных комплексов CEJ-ABC демонстрировал тенденцию к снижению от 4 до 8 дней и к увеличению с 8 до 15 дней; однако только лигированная мезиальная область показала значительное увеличение между 8 и 15 днями (). В дистальных областях CEJ-ABC демонстрирует тенденцию к увеличению как в контрольных, так и в лигированных комплексах со временем, значительно увеличиваясь через 8 и 15 дней по сравнению с 4 днями (). Межкорневое расстояние в контрольном комплексе со временем уменьшалось (рис. 5 (а) (ii)).Напротив, межкорневое расстояние в лигированном комплексе значительно уменьшилось между 4 и 8 днями лигирования (), а затем немного увеличилось после 15 дней лигирования. Сравнение средних значений в лигированных и контрольных межкорневых PDL-пространствах в каждый момент времени показало, что лигированный комплекс имел значительно большее межкорневое PDL-пространство через 4 дня (). Это значительное увеличение не сохранялось через 8 дней, но возобновилось через 15 дней.
3.2.2. PDL-Space
Измерения PDL-пространства показали различия во времени между контрольными (рис. 5 (а) (iii)) и лигированными комплексами (рис. 5 (а) (iv)) как в коронарной, так и в апикальной областях.Во всех лигированных областях с течением времени было обнаружено уменьшение с последующей тенденцией к увеличению в PDL-пространстве со значительным уменьшением в дистальной апикальной области (). Напротив, контрольные комплексы не демонстрировали этой тенденции, за исключением дистальной корональной области. Вместо этого между 8 и 15 днями PDL-пространство как мезиальной, так и дистальной сторон показало тенденцию к уменьшению со временем в контрольном комплексе со значительным уменьшением между 4 и 15 днями в мезиальной апикальной области (). При сравнении PDL-пространства между контрольными и лигированными комплексами было интересно отметить, что все наблюдаемые существенные различия в мезиальных областях произошли в более ранние временные точки — 4 и 8 дней ().Значительные различия в дистальных областях произошли в основном в более поздние временные точки — 8 и 15 дней ().
Чтобы отделить эффект лечения от эффекта развития, среднее контрольное PDL-пространство вычитали из среднего обработанного PDL-пространства для каждой области (рис. 5 (b)). Мезиальные апикальные и все дистальные PDL-пространства лигированного комплекса увеличились через 4 дня, в то время как мезиальные корональные и средние медиальные PDL-пространства уменьшились по сравнению с контролем. В мезиальной коронковой, мезиальной средней и дистальной апикальной областях наблюдались значительные различия в PDL-пространстве между лигированной и контрольной группами.Независимо от анатомического расположения через 8 дней разница между лигированными и контрольными мезиальными PDL-пространствами увеличивалась отрицательно, а разница между лигированными и контрольными дистальными PDL-пространствами увеличивалась положительно со временем по сравнению с соответствующими контрольными областями (). Таким образом, наблюдалась значительная разница в PDL-пространстве между лигированными и контрольными группами во всех регионах. Через 15 дней дистальные PDL-пространства лигированных коронарных областей оставались больше, чем соответствующие контрольные области, но уменьшались в различиях, в то время как дистальные PDL-пространства лигированных средних и апикальных областей увеличивались в отличие от соответствующих контрольных областей.Точно так же мезиальные лигированные области все еще оставались меньше, чем PDL-пространства в контроле; однако они уменьшились по сравнению с соответствующими контрольными регионами. Интересно, что только дистальные области показали значительные различия между лигированными и контрольными измерениями PDL-пространства через 15 дней.
3.2.3. Коллагеновое двулучепреломление
Изменения двулучепреломления PSR наблюдались на дистальной стороне в зависимости от продолжительности повреждения (рис. 5 (c), см. Рис. S1 и дополнительные видеоролики в дополнительных материалах, доступных онлайн по адресу http: // dx.doi.org/10.1155/2013/876316). В коронарных областях лигированный комплекс показал нарушенную целостность транссептальных волокон с уменьшенным двойным лучепреломлением, в отличие от наблюдаемого высокого двойного лучепреломления с прямыми коллагеновыми волокнами в контрольном комплексе. В апикальных областях ширина повышенного двойного лучепреломления в дистальном PDL-вторичном цементе лигированного комплекса увеличивалась через 4, 8 и 15 дней (Рисунок 5 (c)). Следует отметить, что двойное лучепреломление зависит от угла между образцом, окрашенным PSR, и поляризованным светом.Для полного представления вышеупомянутого наблюдения включены дополнительные фильмы.
3.2.4. Экспрессия FN на границах раздела PDL-кость и PDL-цемент
На мезиальной стороне экспрессия FN была проиллюстрирована как острые пики на границах раздела PDL-кость и PDL-цемент, независимо от условий эксперимента и момента времени. Однако ширина высокой интенсивности ФН была шире в лигированной группе по сравнению с контрольной (Рисунки 6 (a1), 6 (a3), 6 (b1), 6 (b3), 6 (c1) и 6 (c3)). . На дистальной стороне наблюдалось отображение FN на большей ширине цемента от места прикрепления PDL-цемента.С другой стороны, было показано только внезапное падение интенсивности без пика в месте прикрепления PDL-кости (Рисунки 6 (a2), 6 (a4), 6 (b2), 6 (b4), 6 (c2), 6 (c4) и рисунок S2).
4. Обсуждение
Результаты этого исследования взяты из широко используемой экспериментальной модели пародонтита на крысах [40–44]. Толчком к выбору модели лигатуры является то, что она продвигает сценарии, похожие на столкновение пищи между зубами у людей. Предполагается, что лигатуры между 1-м и 2-м молярами и 2-м и 3-м молярами (рис. 1 (а)) способствуют равным и противоположным силам, сводя на нет или сводя к минимуму эффекты, связанные с самой лигатурой.Кроме того, LPS использовался в качестве катализатора для ускорения дегенерации коронковой ткани, вызывая признаки периодонтита, такие как резорбция альвеолярного гребня и дегенерация PDL, тем самым способствуя потере прикрепления коронковых зубов. Следует отметить, что морфометрия, то есть PDL-пространство, может увеличиваться или уменьшаться. В результате функциональное пространство либо расширяется, либо сужается, что, в свою очередь, может изменить общую биомеханику органа.
На основании наблюдений в этом исследовании можно сделать вывод, что изменения в биохимической экспрессии и / или коронально-апикальные градиенты, возникающие в результате воспаления, могут объяснить деградацию ткани и последующую адаптивную реакцию, обусловленную механобиологией.Тем не менее, необходимы дальнейшие исследования для изучения потенциальных эффектов костеобразования и резорбции во время болезни. Это может быть выполнено путем временного картирования событий, связанных с минералообразованием и резорбцией, для выявления границ раздела PDL-цемент и PDL-кость при растяжении и / или сжатии с использованием динамической гистоморфометрии с использованием флуорохромной техники. Кроме того, наше исследование ограничено ранней стадией пародонтита, поэтому модель хронического периодонтита должна быть разработана на основе наблюдений, проводимых в более длительные моменты времени с использованием предложенной модели эндотоксин-лигатуры.Более длительное время перевязки позволит прояснить связанные со временем механобиологические эффекты на общую морфологию суставов и микроструктуру мягких твердых тканей, включая нарушение функции суставов — тема, которая в настоящее время исследуется.
Результаты этого исследования обсуждаются на том основании, что и заболевание, и функция (продолжающееся жевание твердых гранул крысами) имеют сопутствующий эффект на биохимические и последующие морфологические изменения в органе. Комбинированный эффект может привести к положительной или отрицательной обратной связи, что приведет к нарушению функции органа.Несмотря на то, что всесторонние исследования постулируют причинно-следственную связь между бактериями и / или воспалительными цитокинами и деструкцией ткани [44–51], они пространственно ограничены и описывают только деструкцию альвеолярной кости. В результате необходимы исследования, чтобы проиллюстрировать влияние на весь комплекс кость-PDL-цемент, в котором ни одна ткань не играет особой роли, когда она функционирует.
Таким образом, два сопутствующих эффекта, которые будут обсуждаться, будут включать: (1) вызванную воспалением коронарную дегенерацию в результате пропитки нитей LPS и (2) потенциальные механобиологические эффекты, особенно в апикальных областях аппарата крепления зубов из-за корональная дегенерация с течением времени.Чтобы идентифицировать воспалительную реакцию хозяина, мы картировали экспрессию RANKL, резорбции остеокластов и TNF- α . Результирующая адаптация была детализирована через изменение морфологии из-за повышенной резорбции альвеолярной кости и чистых изменений в PDL-пространстве, корональных потерь, апикального увеличения двойного лучепреломления коллагена в комплексе и увеличения экспрессии FN, особенно в апикальных областях, то есть внутри вторичного цемента и кости. Эти наблюдаемые закономерности суммированы на рисунках S2 и S3.
4.1. Связанные с воспалением биомолекулярные экспрессии в комплексе
Воспаление, вызванное лигатурой, является ответом хозяина на устранение вредных стимулов из-за инородного тела и бактериальной колонизации. Ответ запускает рекрутирование иммунных клеток из крови в различные васкуляризированные соединительные ткани, преимущественно подверженные воздействию LPS и лигатуры [27]. Рекрутируемые воспалительные клетки, в свою очередь, способствуют биохимическому каскаду, вызывая индуцированный протеиназой фибринолиз, остеокластогенез и активацию латентных остеокластов [16].Образование и активность остеокластов in vivo зависят от экспрессии RANKL остеобластами или стромальными клетками костного мозга [52, 53]. В результате мы наблюдали экспрессию RANKL в эндостальных пространствах и сосудистой сети PDL. В этом исследовании корональная часть альвеолярной кости больше всего страдает от LPS из-за его близости к лигатуре, и поэтому экспрессия клеток RANKL (+) возле альвеолярного гребня была определена количественно (рисунки 2 (d) и 2 (e) )). Интересно, что наблюдаемая тенденция RANKL (+) противоречит тенденции активности остеокластов TRAP (+) (Рисунки 3 (b) (x) и 3 (b) (xi)).Другими словами, количество клеток RANKL (+) увеличивалось за 4 дня до того, как уменьшилось, а затем восстановилось через 15 дней на дистальных сторонах лигированных групп. Хорошо известно, что остеокластогенез включает сложную серию последовательных стадий, включая передачу сигналов RANKL-RANK [54]. Это могло бы объяснить наблюдаемую тенденцию задержки остеокластической активности, то есть TRAP (+) клеток.
Наряду с RANKL, TNF- α также играет роль в воспалительной резорбции кости, поскольку TNF- α действует синергетически с RANKL, усиливая остеокластогенез [52, 55, 56].Известный механизм, с помощью которого TNF- α модулирует деструкцию кости, связан со стимуляцией RANKL дифференцировки остеокластов посредством аутокринной передачи сигналов [57]. Большинство исследований in vivo показывают, что TNF- α в основном продуцируется активированными макрофагами и действует как агонист или антагонист, ускоряя или сдерживая резорбцию альвеолярной кости, соответственно [47, 58–60]. По нашим наблюдениям, TNF- α был распределен по пародонту (рис. 4 (а)).Это может быть связано с иммунными клетками, источником TNF- α , который рекрутируется вдоль кровотока в сильно васкуляризованных PDL. Общая экспрессия TNF- α была повышена в лигированных группах, особенно на границах раздела PDL-первичный цемент, межкорневого комплекса и эндостальных пространств. Это означает, что коронарные лигатуры вызывают воспаление всего комплекса кость-PDL-цемент, а не ограничиваются только корональной областью. Анатомически TNF- α -положительные остеокласты преобладали на границе PDL-кости на дистальной стороне в лигированных группах.Это наблюдение было положительно коррелировано с повышенной иммунофлуоресценцией RANKL в сочетании с предыдущими исследованиями, которые показали, что TNF- α разделяет механизм, с помощью которого RANKL проявляет свой остеокластогенный эффект [26, 57]. Кроме того, TNF- α был локализован в соединительном эпителии. Вероятно, что TNF- α , высвобожденный внеклеточно, дрейфовал в эпителиальный слой, поскольку межклеточное пространство в соединительном эпителии сравнительно шире и содержит пропорционально меньше десмосом, чем в оральном эпителии [61], что позволяет цитокинам проникать в эпителий.
4.2. Изменения морфометрии комплекса, общие признаки пародонтита
Лигированные группы показали повышенную АВС и межкорневую резорбцию по сравнению с контролем через 4 дня. Это наблюдение, скорее всего, вызвано воспалительными явлениями хозяина на ранней стадии из-за LPS в качестве основного стимула. Аргумент может быть дополнительно подтвержден наблюдением за уменьшением расстояния CEJ-ABC в мезиальных областях и уменьшением межкорневого PDL-пространства через 8 дней. Однако снижение резорбции кости, несмотря на усиление воспаления, могло быть вызвано возрастными процессами моделирования кости [42, 62] между 4 и 8 днями, поскольку костная ткань имеет высокую скорость обновления.Предполагается, что к 15 дню резорбтивные эффекты воспаления преодолевают связанные с ростом процессы в лигированных комплексах, что приводит к возобновлению увеличения как мезиального, так и дистального CEJ-ABC, а также межкорневого PDL-пространства. Следует отметить, что в пределах этого наблюдаемого эффекта находится влияние остеокластов в контроле за счет естественной дистальной резорбции у крыс [31, 62, 63]. Однако лигированный комплекс включал активные остеокласты на альвеолярном гребне в дополнение к дистальному интерфейсу PDL-кость.Кроме того, остеокластическая активность достигла пика через 8 дней после лигирования. Этот феномен можно объяснить с точки зрения характеристик воспаления, вызванного наложением лигатуры, острого и кратковременного воспаления, которое привело к начальному смещению равновесия с бактериального эндотоксина, то есть ЛПС, на реакцию хозяина. Однако остеокластическая активность не сохранялась через 8 дней, что позволяет предположить, что эффект воспаления, вызванного перевязкой, не был устойчивым, потому что (1) расположение лигатуры было относительно корональным, и (2) реакция хозяина, которая могла уменьшиться как локальная концентрация ЛПС была диффузной [64].Этот результат согласуется с предыдущими исследованиями [65–69] и может быть идентифицирован как ремиссия моделирования кости после острой фазы воспаления.
4.3. Результат ранних механобиологических эффектов пораженного фиброзного сустава
Основываясь на наблюдаемых морфологических различиях (рисунки 5 (a) и 5 (b)), мы прогнозируем, что корональная дегенерация могла сместиться с физиологической на нефизиологическую, то есть патологическую функцию. Предполагается, что этот переход от физиологической нагрузки к аберрантной нагрузке на комплекс является значительным отклонением от оптимальной функции.Это связано с тем, что повышенная подвижность суставов из-за дегенерации PDL и опоры коронковой альвеолярной кости может вызвать усиленное движение зубов с альвеолярной впадиной. Такой аргумент может быть дополнительно подкреплен тем фактом, что лигатуру приходилось повторно вводить крысам каждые два-три дня. Основываясь на нашей предыдущей работе, регионы, которые, по прогнозам, будут испытывать повышенное напряжение на начальных стадиях заболевания, включают места прикрепления коронки, области с преобладанием апикальной компрессии и преимущественно межкорневые области [70] (пространство PDL в межкорневой области более узкое по сравнению с к PDL-пространству вокруг зуба (рис. 5 (а)).Таким образом, можно предположить, что в лигированных группах здоровые PDL в межкорневых областях и апикально к пораженным областям могут испытывать усиленные напряжения во время жевания по сравнению с их контрольными аналогами. Кроме того, штаммы могут быть изменены на границах раздела PDL-кость и PDL-цемент [71] в лигированных группах. Эти измененные трехмерные профили деформации представляют особый интерес, поскольку отклонения от нормального физиологического напряжения могут привести к патологической функции (аберрантная нагрузка / функция) и нарушению механотрансдукции с течением времени [5, 72, 73], включая границы раздела мягких и твердых тканей, где несколько типы клеток проживают.
Лигированные группы демонстрировали различные паттерны морфологической адаптации с течением времени по сравнению с контрольными группами, на что указывают изменения в PDL-пространстве. Дополнительное увеличение экспрессии RANKL и активности остеокластов, увеличение межкорневого PDL-пространства (15 дней, рис. 5 (a) (ii)) может указывать на чрезмерное напряжение в межкорневом комплексе в более позднее время, что приводит к резорбции и смещению адаптивных эффектов. нашей модели к наблюдаемым в модели гиперокклюзии [74, 75]. Таким образом, возможно, что в нашем исследовании межкорневая кость, обычно известная как точка опоры для вращения зуба [70], сместилась, таким образом изменив поле деформации во всем комплексе кость-PDL-цемент.
Сдвиг в сторону отклоняющейся функции может способствовать чистому изменению локализации и интенсивности RANKL. RANKL — это механочувствительная молекула, экспрессия которой снижается с натяжением в остеобластах [76]. При сравнении альвеолярных гребней внутри лигированных комплексов было замечено, что экспрессия RANKL увеличивалась между 8 и 15 днями на дистальной стороне, но снижалась со временем на мезиальной стороне (Рисунки 2 (d) и 2 (e)). Хотя экспрессия RANKL увеличивается в каждый момент времени между лигированием и контролем как мезиально, так и дистально из-за воспалительной реакции хозяина, предполагаемое возрастное мезиальное напряжение из-за роста могло противодействовать этому увеличению во время длительной механической нагрузки.Таким образом, хотя увеличение экспрессии RANKL наблюдалось в 4-дневных лигированных комплексах по сравнению с контролями, аналогичное количество клеток RANKL (+) наблюдалось между лигированными и контрольными комплексами через 15 дней. Напротив, прогрессирующее увеличение количества клеток RANKL (+) с 8 до 15 дней на дистальной стороне, скорее всего, было вызвано комбинированным эффектом экспрессии, индуцированной компрессией из-за дистального дрейфа и воспалительной реакции хозяина [77, 78]. Хотя мы коррелируем увеличение экспрессии RANKL с активацией остеокластов, важно отметить, что соотношение RANKL / остеопротегерин (OPG) должно использоваться в качестве стандартного показателя для формирующейся и резорбтивной кости [16].Вместе эти данные предполагают, что ранняя воспалительная реакция хозяина вызывает усиление биохимических экспрессий в коронарной артерии. Однако более поздние изменения в экспрессии соответствующих биомолекул из-за противоположных механобиологических эффектов на мезиальной и дистальной сторонах индуцируются аберрантной функцией лигированного сустава. Во вторичном цементе наблюдались эффекты, связанные с аберрантной функцией. В этом исследовании дополнительные данные о двойном лучепреломлении коллагена и экспрессии FN, наблюдаемые в дистальном вторичном цементе, предлагаются в качестве компенсаторной адаптации из-за чистого увеличения резорбции дистальной кости и поддержания возрастной нормальной физиологической активности в мезиальном комплексе (рис. (в)).Однако двойное лучепреломление, на которое указывает PSR, является лишь дополнительным маркером к более подтверждающей экспрессии FN. Это связано с тем, что двулучепреломление коллагена, идентифицированное с помощью окрашивания PSR, также является функцией толщины среза и сильно зависит от ориентации волокон относительно поляризаторов (были включены видеоролики, чтобы подчеркнуть специфичность наших результатов — рисунок S1 и дополнительные видеоролики) и уровня деминерализации тканей. и целостность коллагена.
Предполагается, что вторичный цемент приспосабливается к окклюзии во время постоперационной фазы развития зуба и, как было показано, реагирует на нагрузку [35, 79].Таким образом, вполне вероятно, что вторичная адаптация цемента будет следовать за резорбцией коронковой кости как механизм компенсации разрушения из-за воспаления. В этом исследовании мы использовали два идентификатора, чтобы детализировать адаптацию вторичного цемента. К ним относятся двойное лучепреломление коллагена и экспрессия FN [24, 80, 81]. Запуск локальных биохимических эффектов вызвал увеличение организации апикального коллагенового матрикса со временем (Рисунок 5 (c)). В результате измененное двойное лучепреломление наблюдалось на мезиальной части, но больше на границе раздела между PDL и вторичным цементом в лигированных группах (дополнительные видеоролики на рис. S1).Это означает, что вызванная воспалением механобиология дистанционно стимулировала органический матрикс в апикальном цементе (Рисунки 5 (c), 6, S1 и S2). Хотя повышенный уровень двойного лучепреломления, эквивалентный таковому у контролей, наблюдался через 4 дня, с увеличением времени увеличивались как ширина, так и интенсивность двойного лучепреломления на дистальной вторичной поверхности цемента. Вероятно, что комплекс адаптировался к изменениям, возникающим в результате лигатурно-индуцированного коронарного воспаления в мезиальной области с преобладанием натяжения и дистальной области с преобладанием компрессии.Однако адаптация проявлялась в апикальных областях в виде образования новой кости, которая преобладала на мезиальной стороне, и образования нового цемента на дистальной стороне (рисунки 5 (c) и 6) в соответствующих группах.
Вышеупомянутая вторичная адаптация цемента, детализированная через двойное лучепреломление коллагена, может быть дополнительно усилена экспрессией FN. Нефизиологические напряжения в мезиальном комплексе лигированных крыс из-за корональной дегенерации транссептальных и периодонтальных волокон могли изменить экспрессию мРНК FN и содержание белка апикально (Рисунок 6) [82, 83].Паттерн локализации широкой полосы экспрессии FN апикально может быть результатом повышенной организации вокруг периферии клеток остео- или цементобластов и повышенной плотности по мере образования коллагенового матрикса [84].
FN является важным хемотаксическим белком для хранения факторов роста, наряду с его плодовитыми взаимодействиями с молекулами клеточной поверхности для облегчения клеточной адгезии, миграции и регулирования клеточной дифференцировки и пролиферации [24]. Хотя FN не является прямым маркером образования твердых тканей с использованием иммуногистохимии, он предоставляет доказательства того, что этот многоцелевой белок может усиливать ответ предшественников остеобластов, чтобы изменять регенеративный или репаративный потенциал органических матриц во время механобиологической адаптации [83].То же самое может относиться к предшественникам цементобластов на стороне зуба, что приводит к мезиальному отложению вторичного цемента. Хотя было показано, что сжимающие нагрузки вызывают снижение экспрессии FN в клетках PDL [82, 83], по сравнению с контролем, дистальные области лигированных моляров интересно проиллюстрировали повышенную экспрессию FN в местах прикрепления PDL к цементу и через дистальные слои прецедента. комплекса (рисунок 6).
Мы суммируем результаты, представляя биомеханическую модель, репрезентативную для измеренных нижестоящих изменений локализации и уровня экспрессии механочувствительных белков и чистых пространственно-временных изменений в PDL-пространстве (Рисунок S3).На дистальной коронковой стороне временные тенденции PDL-пространства напрямую коррелировали с тенденциями остеокластической активности. Таким образом, чистое увеличение PDL-пространства на дистальной коронковой стороне в лигированных группах может быть объяснено повышенной остеокластической активностью из-за увеличения деформации сжатия внутри PDL. Повышенная компрессия может возникнуть в результате увеличения дистального вращения зуба во всем теле (рис. S3A.3) в сочетании с воспалением коронки. Как в контрольной, так и в лигированной группах активность остеокластов значительно увеличилась через 8 дней и оставалась значительно выше через 15 дней по сравнению с 4-дневными контролями.В то время как остеокластическая активность в лигированных группах была выше через 8 дней по сравнению с контрольной группой, отсутствие значимой разницы между контрольной и лигированной группами в оба момента времени можно объяснить (1) изменениями, связанными с развитием в ранние моменты времени, что замаскировали эффект воспаления и механобиологический ответ и / или (2) необходимость в большем размере выборки. Однако интересно отметить, что наблюдалась сниженная, но устойчивая остеокластическая активность через 15 дней, что могло повлиять на наблюдаемое PDL-пространство.
В апикальном сегменте дистального комплекса тенденция, наблюдаемая в PDL-пространстве, не соответствовала изменению остеокластической активности. В частности, при сопоставлении тенденций остеокластической активности и PDL-пространства с течением времени повышенная остеокластическая активность не соответствовала уменьшению PDL-пространства в 8-дневных лигированных суставах. Кроме того, измеренное увеличение ширины экспрессии FN рядом с дистальным вторичным цементом, что указывает на новое прилегание цемента, вызывает предположение, что пространство PDL в этой области испытывало повышенные деформации растяжения во время увеличенного дистального вращения и вертикального смещения (Рисунок S3A.3). Следовательно, ожидается, что со временем пространство PDL станет уже, чем у контрольных групп (рисунок S3A.4). Однако наблюдались противоположные морфологические изменения. Увеличение PDL-пространства в лигированных суставах через 15 дней по сравнению с контролем и 8-дневными лигированными суставами свидетельствует о задержке наблюдаемых морфологических эффектов (резорбция кости) после увеличения активности остеокластов [69]. А именно, можно предположить, что 8 дней лигирования были ближе к началу увеличения остеокластической активности, которое перешло в 15 дней лигирования, что привело к увеличению PDL-пространства.Таким образом, новое наложение цемента, помеченное FN, могло быть пропущено при измерениях микро-XCT, поскольку полоса с FN-меткой указывает на преобладание органического матрикса. Следовательно, PDL-пространство может быть сужено при длительном наблюдении, поскольку цементному слою дается время для минерализации. Необходимы дальнейшие исследования, идентифицирующие рост цемента с использованием флуорохромного метода или маркеров, специфичных для цемента, и их можно использовать для подтверждения этого явления. Точно так же тенденции остеокластической активности на мезиальной стороне отражали противоположные морфологические изменения в PDL-пространстве в соответствующие моменты времени.
С морфологической точки зрения, значительно уменьшенное пространство PDL в более апикальных, непораженных областях лигированных фиброзных суставов можно отнести к увеличению деформации растяжения в этой области из-за корональной деградации [70]. Хотя хорошо известно, что экспериментально индуцированный пародонтит стимулирует вызванную воспалением остеокластическую активность, такая активность ограничивается корональными областями [85]. Следовательно, остеокластическая активность, наблюдаемая в более апикальных областях лигированных комплексов, может быть проявлением связи резорбции / образования с физиологическим обновлением кости [86].Однако усиленные штаммы могли ускорить адаптацию комплекса с увеличением скорости обновления костной ткани. С точки зрения локализации деформации предполагается, что эти области с преобладанием сжатия будут перемещаться в области с преобладанием растяжения. Это происходит из-за апикально мигрирующей точки опоры вращения зуба, которая возникает из-за повышенной подвижности зуба в результате потери коронкового прикрепления и резорбции межкорневой кости (Рисунок S3A.3). Наша модель также подтверждается увеличенной шириной полосы экспрессии FN, наблюдаемой в месте прикрепления PDL к кости в апикальной области на мезиальной стороне (Рисунки 6 (a3), 6 (b3), 6 (c3) и S3A.4).
На основании этих результатов мы предполагаем, что изменения, связанные с заболеванием, способствуют адаптации кости и апикального цемента, что преимущественно наблюдалось на мезиально-корональной и дистально-апикальной сторонах зуба. Важно отметить, что предполагается, что механические деформации в комплексе одного корня аналогичны деформациям во всем комплексе зуба, несмотря на лигатуру. Следовательно, мезиодистальные эффекты, обсуждаемые в комплексе кость-PDL-зуб, должны быть аналогичны тем, которые наблюдаются в соответствующих комплексах мезиальных и дистальных корней того же зуба.
5. Выводы
В данном исследовании мы прояснили изменение, вызванное заболеванием, путем отделения эффектов, вызванных заболеванием, от физиологически обусловленных явлений с непарными контрольными группами. В заключение, наши результаты показали, что корональная индукция воспалительного нарушения влияет на общее распределение биохимических молекул во всем комплексе. Более того, сопутствующая функция, наложенная на скомпрометированный комплекс, могла бы ускорить адаптацию ткани для удовлетворения функциональных требований (Рисунки S2 и S3).Чтобы быть конкретным, чистое уменьшение функционального пространства было идентифицировано в мезиальном комплексе, тогда как чистое увеличение функционального пространства было идентифицировано в дистальном комплексе. Кроме того, адаптивная реакция вторичного цемента, то есть преимущественное образование цемента, была более очевидной в дистальном направлении. Измененное выражение в более поздние моменты времени предполагает, что продолжительная функция может проявляться в чрезмерных нагрузках на пораженный фиброзный сустав, смещая физиологическую функцию в нарушенную функцию по сравнению с контрольной группой.Совершенно необходимо, чтобы будущие исследования измеряли биомеханическую реакцию суставов, которые претерпели краткосрочные и долгосрочные изменения в воспаленных и деградированных фиброзных суставах. При измерении биомеханические результаты подтвердят предложенную модель, согласно которой ранние морфологические изменения, вызванные заболеванием, могут нарушать функцию, в конечном итоге вызывая наблюдаемые вторичные адаптации фиброзного сустава.
Вклад авторов
Джи-Хён Ли и Джереми Д. Линь внесли одинаковый вклад.
Благодарности
Авторы благодарят Центр биоматериалов и биоинженерии MicroCT Imaging Facility, UCSF за использование Micro XCT.Поддержку оказали NIH / NIDCR R00DE018212, NIH / NIDCR R01DE022032, NIH / NIDCR T32 DE07306-14, NIH / NCRR S10RR026645, а также отделы профилактических и восстановительных стоматологических и орофациальных наук, UCSF. Авторы признают, что у них нет конфликта интересов, и они были полностью вовлечены в изучение и подготовку статьи.
Дополнительные материалы
Дополнительные материалы включают набор дополнительных фильмов и 3 дополнительных рисунка. Дополнительные видеоролики включают образцы, повернутые относительно скрещенного поляризатора и анализатора, чтобы проиллюстрировать различное двулучепреломление в коллагене PDL из контрольных и лигированных групп.Дополнительный рисунок 1 включает единственную микрофотографию, показывающую двойное лучепреломление PDL, взятого из контрольных и лигированных образцов в разные моменты времени, соответственно. Дополнительный рисунок 2 иллюстрирует объединенное флуоресцентное изображение различных иммуномеченых биомолекул, исследованных в этом исследовании. Дополнительный рисунок 3 суммирует наблюдаемые изменения в биомолекулярных выражениях в зависимости от анатомического расположения в комплексе. На дополнительном рисунке 4 представлена гипотеза, иллюстрирующая адаптацию костей и цемента, вызванную механобиологией, и, как следствие, общее изменение биомеханики на уровне органов.Подробную информацию о фильмах и рисунках можно найти в соответствующих подписях.
Дополнительные фильмы. Фильмы, показывающие вращение окрашенного PSR контроля и лигированных комплексов относительно скрещенных поляризатора и анализатора. Вращение на 360 градусов каждого дистального и мезиального комплекса показано с шагом в пять градусов. (A) 4-дневный контрольный дистальный комплекс, (B) 4-дневный контрольный мезиальный комплекс, (C) 4-дневный лигированный дистальный комплекс, (D) 4-дневный лигированный мезиальный комплекс, (E) 8-дневный контрольный дистальный комплекс, (F) 8 день контрольный мезиальный комплекс, (G) лигированный 8-дневный комплекс, (H) 15-дневный контрольный дистальный комплекс, (I) 15-дневный контрольный мезиальный комплекс, (J) 15-дневный лигированный дистальный комплекс, (K) 15-дневный лигированный мезиальный комплекс.
Дополнительный рисунок 1. Микрофотографии, иллюстрирующие различия в двойном лучепреломлении коллагена между контрольными и лигированными комплексами кость-PDL-цемент. Дистальный (красный) и мезиальный (зеленый) комплексы очерчены для каждого контрольного и лигированного срезов, окрашенных PSR, через 4, 8 и 15 дней. Эти изображения при 4-кратном увеличении служат анатомическими ориентирами для дополнительных фильмов. Альвеолярная кость (AB), дентин (Den), периодонтальная связка (PDL), вторичный цемент (SC), транссептальные волокна (TF).
Дополнительный рисунок 2.Объединенное изображение сигналов иммунофлуоресценции RANKL, FN и DAPI. Наложение панелей, представляющих иммунофлуоресценцию для RANKL (красный), FBN (зеленый) и DAPI (синий). (A1) 4-дневный контрольный мезиальный комплекс, (A2) 4-дневный контрольный дистальный комплекс, (B1) 8-дневный лигированный мезиальный комплекс, (B2) 8-дневный лигированный дистальный комплекс, (C1) 15-дневный лигированный мезиальный комплекс, (C2) 15 день лигированный дистальный комплекс. Белые стрелки указывают на остеокластоподобные клетки в резорбционных ямках на границе PDL-кости и гребне альвеолярной кости. Альвеолярная кость (AB), дентин (D), вторичный цемент (SC), новый цемент (N) и сосудистая сеть (V).
Дополнительный рисунок 3. Модели, аннотирующие (3A) фундаментальные изменения в биомеханике на уровне органов, и (3B) коррелируют между наблюдаемыми морфологическими изменениями и пространственными биохимическими выражениями, подчеркивая морфологические адаптации. (3A) ВЕРХНЯЯ ПАНЕЛЬ: (1) Здоровый фиброзный сустав демонстрирует высоту гребня альвеолярной кости (ABC) и структуру PDL для нормальной поддержки прикрепления. Таким образом, это подвергается ограниченному, но контролируемому вертикальному смещению, кручению и ротации дистального отдела зуба во время окклюзионной нагрузки.Это вызывает компрессию коронки в дистальном комплексе фиброзного сустава. (2) Резорбция минерализованных тканей в коронарных областях сустава, вызванная компрессией, показана оранжевыми стрелками. В физиологических пределах функциональное пространство PDL поддерживается за счет напряжения, вызванного нагрузкой, и последующей механобиологической активности на границах раздела мягких и твердых тканей и объемного PDL. Это не приводит к чистому изменению функционального пространства PDL. НИЖНЯЯ ПАНЕЛЬ: (3) Выделена потеря коронарного прикрепления из-за вызванной воспалением резорбции ABC и деградации PDL.Отсутствие опоры аттачмента приводит к увеличению вертикального смещения зуба и вращению всего тела. Резорбция межзубного и межкорневого AB снижает точку опоры, изменяя вращение всего тела зуба. Биомеханика на уровне органов вызывает повышенные сжимающие нагрузки на дистальный корональный комплекс, наряду с повышенными растягивающими нагрузками на мезиально-корональное и мезиальное апикальное пространство PDL и дистальную границу раздела PDL-вторичный цемент. (4) Сохраняющаяся функция (жевание) вызывает сдвиг деформации на границах раздела мягких и твердых тканей, способствуя образованию чистых минерализованных тканей (синие стрелки, зеленая линия) в областях, испытывающих деформации растяжения и чистую резорбцию минерализованной ткани (красные стрелки) в областях, испытывающих сжатие.
