полезная информация от Медицинского центра №1
Этот вид обезболивания наносится как аппликация на ткани полости рта, чаще-на десну и не подразумевает под собой инъекций, поэтому этот тип анестезии называют еще поверхностной.Это предельно простой вид анестезии, не требующий дополнительного оборудования и квалификации, и что немаловажно — абсолютно безболезненный.
Также, если некоторые стоматологические процедуры предполагают обширное или болезненное вмешательство, то также используется терминальная анестезия. Но следует помнить, что поверхностная анестезия применяется только как вспомогательное средство и не заменяет собой основной анестетик.

Для этого вида обезболивания используют специальные лекарственные препараты, но могут быть применены как физические виды обезболивания, так и химические. К примеру, — охлаждение.
В стоматологии для поверхностного обезболивания применяют такие медикаменты, как лидокаин, дикаин или промекаин. Это могут быть мазь, гель, порошок, аэрозоль, раствор и другие виды. В препарате может присутствовать антисептик, ароматические компоненты или добавлен краситель, что будет приятно для детей.
Нанесение очень простое – препарат прикладывается или намазывается на ткань (как правило, это десна), глубина проникновения анестетика составляет примерно 1-3 мм, и действует он на протяжение 10 — 20 минут.
Препарат дикаин не рекомендован детям до десяти лет.
Аллергическая реакция или повышенная чувствительность к используемым препаратам.
Ее недостаток заключается в возможном токсическом воздействии при всасывании в кровь, поэтому необходимо контролировать ее концентрацию, поэтому анестетик в форме аэрозоля не рекомендован.

Услуга: Анестезия
Анестезия
Почти в каждой второй семье проживает, какое либо животное — будь то кошка, собака, мышка, попугай, черепашка или кролик. Мы ухаживаем за ними, балуем, любим и лелеем, как детей. Если наш друг попал в беду, мы стараемся ему помочь. Животные, как и люди, болеют и получают травмы. Очень хорошо, что сейчас имеются клиники, лаборатории, УЗИ и рентген для животных. При заболевании внутренних органов и травмах, возникает необходимость в оперативном лечении животных с применением анестезии. Что такое анестезия?
Анестезия — это уменьшение или полная потеря чувствительности тела или его части под воздействием анестезирующих препаратов. Анестезия бывает местная и общая.
Ингаляционный наркоз (общая анестезия).
Введение анестезирующего средства в дыхательные пути в виде газа при помощи вдыхания через маску и выдоха в атмосферу. Вызывает у пациента состояние глубокого сна, при котором отсутствуют все виды чувствительности. В отличие от других анестезий, ингаляционный наркоз управляем, его можно быстро уменьшить, добавить, либо прекратить. Применяемый препарат изофлуран проникая в альвеолы при вдыхании быстро поступает в кровь и разносится по всему организму. Специфически действуя на нервную систему. Изофлуран обладает малой токсичностью и быстро выводится из организма через легкие. В данное время широко используется новый препарат для общей анестезии у кошек — севофлюран. Он с успехом используется для общей анестезии у людей. Характеризуется следующими качествами: быстро действует, слабо влияет на функции внутренних органов, минимальное возбуждение, не раздражает слизистую дыхательных путей, быстрое пробуждение после наркоза, может применяться для всех видов животных. Поэтому севофлюрановая анестезия нашла широкое применение при проведении оперативных вмешательств повышенной сложности. Местная анестезия — это временная потеря чувствительности на определенном участке тканей тела животного. Достигается при помощи введения специальных медицинских препаратов.
В отличие от других анестезий, ингаляционный наркоз управляем, его можно быстро уменьшить, добавить, либо прекратить. Применяемый препарат изофлуран проникая в альвеолы при вдыхании быстро поступает в кровь и разносится по всему организму. Специфически действуя на нервную систему. Изофлуран обладает малой токсичностью и быстро выводится из организма через легкие. В данное время широко используется новый препарат для общей анестезии у кошек — севофлюран. Он с успехом используется для общей анестезии у людей. Характеризуется следующими качествами: быстро действует, слабо влияет на функции внутренних органов, минимальное возбуждение, не раздражает слизистую дыхательных путей, быстрое пробуждение после наркоза, может применяться для всех видов животных. Поэтому севофлюрановая анестезия нашла широкое применение при проведении оперативных вмешательств повышенной сложности. Местная анестезия — это временная потеря чувствительности на определенном участке тканей тела животного. Достигается при помощи введения специальных медицинских препаратов.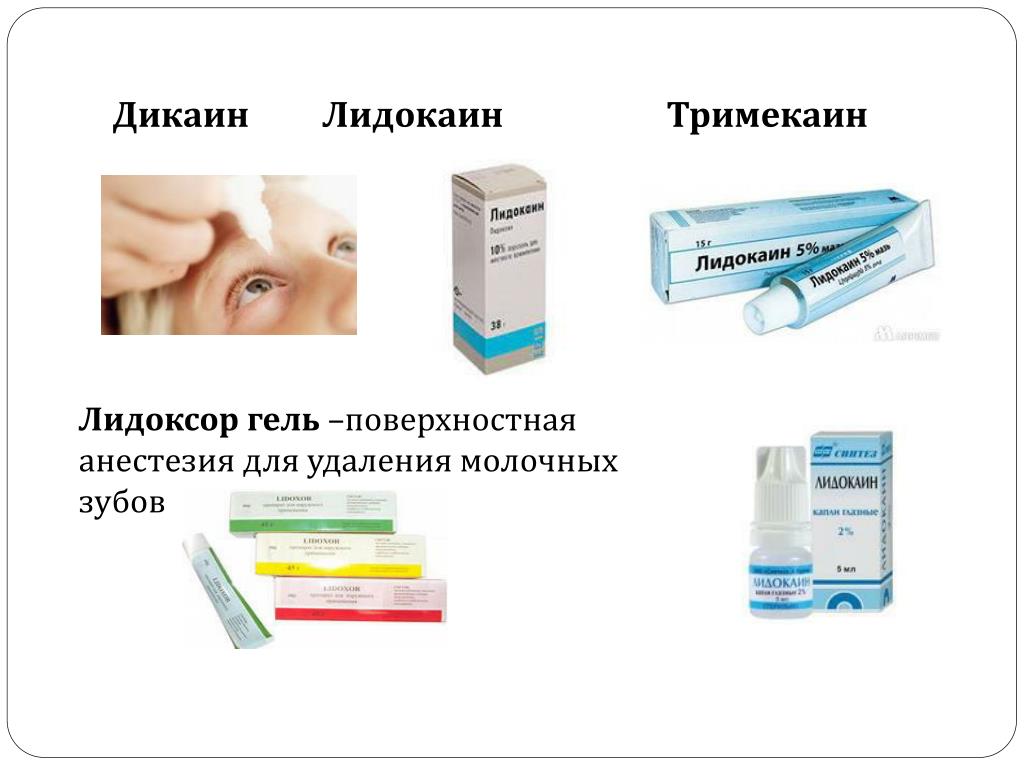
Инфильтрационная анестезия проводится в основном 0.25% — 0.5% раствором новокаина. Препарат вводится внутрикожно в виде обкалывания с постепенным углублением в ткани. Это позволяет производить более глубокие операци. После разреза можно продолжить послойное обкалывание вокруг оперируемого органа; — Спинномозговая или субарахноидальная анестезия, это введение анестезирующих препаратов после прокола твердой мозговой оболочки в поясничном и хвостовом отделе. Данный вид анестезии применяется при проведении операции на внутренних органах брюшной полости, таза и нижних конечностях; — Перидуральная (эпидуральная) анестезия очень эффективна и может проводиться на любом отделе позвоночника. Однако проведение ее очень сложно, нужны хорошие знания особенностей строения позвоночника у животных и опыт. Этот вид анестезии предпочтителен для оперирования кошек. При проведении эпидуральной анестезии кошка находится в сознании, но совершенно не ощущает боли, это позволяет проводить операции на области задних конечностей, органах брюшной и тазовой полости. — Внутрикостная анестезия проводится перед операцией на костях, для этого конечности придают возвышенное положение и накладывают жгут у основания, до исчезновения пульса, затем после послойного обезболивания прокалывают кость и вводят анестезирующие препараты; — Внутривенная регионарная анестезия применяется при операции на бедре или конечности до верхней трети плеча. На конечность накладывается жгут, чтобы остановить циркуляцию крови и производится внутриартериальное или внутривенное введение анестезирующего препарата;
Данный вид анестезии применяется при проведении операции на внутренних органах брюшной полости, таза и нижних конечностях; — Перидуральная (эпидуральная) анестезия очень эффективна и может проводиться на любом отделе позвоночника. Однако проведение ее очень сложно, нужны хорошие знания особенностей строения позвоночника у животных и опыт. Этот вид анестезии предпочтителен для оперирования кошек. При проведении эпидуральной анестезии кошка находится в сознании, но совершенно не ощущает боли, это позволяет проводить операции на области задних конечностей, органах брюшной и тазовой полости. — Внутрикостная анестезия проводится перед операцией на костях, для этого конечности придают возвышенное положение и накладывают жгут у основания, до исчезновения пульса, затем после послойного обезболивания прокалывают кость и вводят анестезирующие препараты; — Внутривенная регионарная анестезия применяется при операции на бедре или конечности до верхней трети плеча. На конечность накладывается жгут, чтобы остановить циркуляцию крови и производится внутриартериальное или внутривенное введение анестезирующего препарата;
— Анестезия поперечного сечения, это, блокада, которая проводится при переломах костей.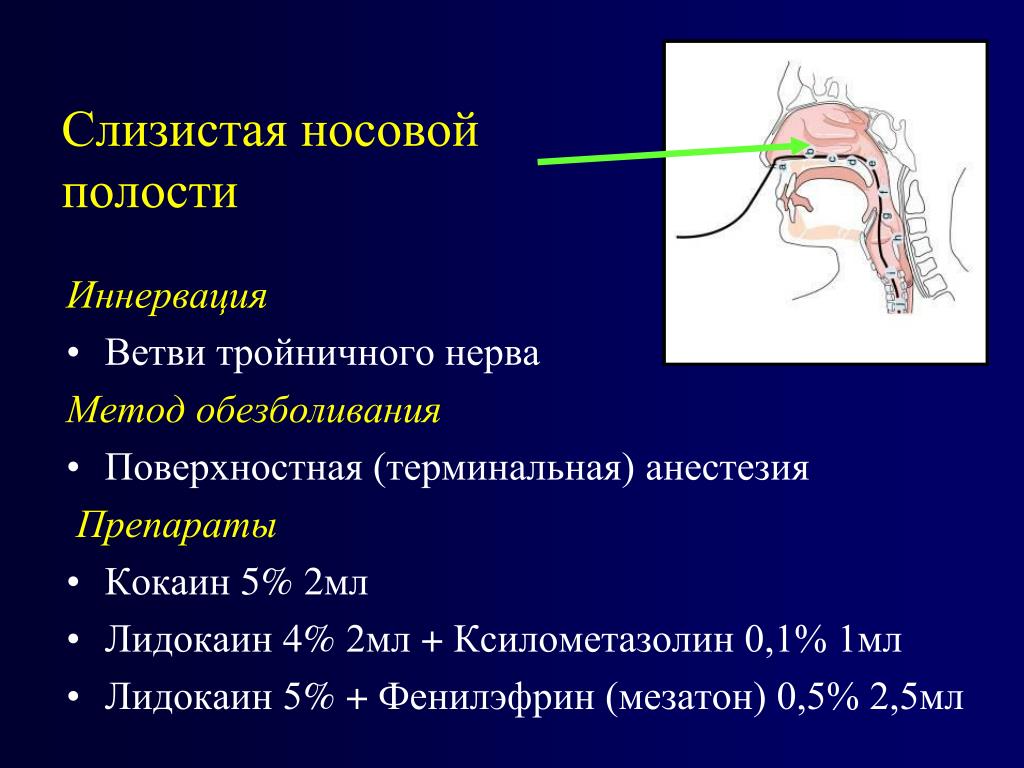 Во время транспортировки животного, чтобы снять боль и предотвратить болевой шок. Выше места перелома прокалывают переднюю и заднюю группу мышц до кости, затем игла оттягивается на 1см и вводится новокаин; — Проводниковая анестезия у животных или регионарная, к ней относятся (паравертебральная, межреберная, стволовая, сакральная и анестезия челюстной области). Все эти анестезии достигаются путем введения анестезирующих препаратов в область нервных сплетениий или корешков спинного мозга. Это приводит к снижению болевой чувствительности в месте, вызывающем беспокойство животного. Применяются часто при радикулитах, ушибах, переломах ребер, конечностей и позвоночника. В акушерской практике, при кесаревом сечении и удалении матки.
Во время транспортировки животного, чтобы снять боль и предотвратить болевой шок. Выше места перелома прокалывают переднюю и заднюю группу мышц до кости, затем игла оттягивается на 1см и вводится новокаин; — Проводниковая анестезия у животных или регионарная, к ней относятся (паравертебральная, межреберная, стволовая, сакральная и анестезия челюстной области). Все эти анестезии достигаются путем введения анестезирующих препаратов в область нервных сплетениий или корешков спинного мозга. Это приводит к снижению болевой чувствительности в месте, вызывающем беспокойство животного. Применяются часто при радикулитах, ушибах, переломах ребер, конечностей и позвоночника. В акушерской практике, при кесаревом сечении и удалении матки.
Методы и виды анестезии
25.06.2020Виды анестезии
- Местная
- Общая
- Комбинированная
Анестезия в стоматологии всегда разделяется на три вида:
Местная анестезия проводится в ограниченной области, где необходимо «отключить» болевую чувствительность нервных окончаний.
Второй вид — общий наркоз, применяется очень редко. Только тогда, когда необходима нечувствительность к боли всего организма, с полной потерей сознания.
А вот комбинированная анестезия сочетает в себе местное обезболивание и предварительную премедикацию, которая проводится путем расслабления и успокоения без отключения сознания.
У каждого вида наркоза, существуют свои разделения. К примеру, у местной анестезии тоже имеются подвиды.
Сюда относится Аппликационная анестезия – это поверхностное обезболивание с помощью спрея — Лидокаина, которое применяется при снятии зубных отложений, удалении подвижных зубов, а также перед проведением более глубокого вида анестезии, чтобы снять неприятные ощущения от укола. Он используется довольно редко и способен лишать боли лишь при неглубоких вмешательствах. В этом случае применяются различные мази и спреи, которые наносятся на нужный участок стерильным ватным тампоном или марлей.
Также есть такой подвид, как Инфильтрационная анестезия – обезболивание, чаще других применяемое в стоматологии, другими словами — «заморозка». Такая анестезия представляет собой инъекцию анестетика, которая вводится под слизистую оболочку, надкостницу или внутри костно.
Этот вид обезболивания применяется при самых различных стоматологических операциях: при лечении зубов и зубных каналов, операциях на пульпе зуба. Продолжительность и воздействие обезболивания достаточны для любого стоматологического вмешательства продолжительностью не менее 60 минут.
Тут вводят анестетик с помощью тонкой иглы под слизистую оболочку рядом с проблемным зубом или внутрь кости, который начинает действовать 10 минут спустя. Полученный эффект сохраняется на 2–3 часа, в зависимости от используемого препарата, глубины его введения и количества. Не стоит забывать и о Проводниковой анестезии. При этом виде обезболивания, препарат подводят к ветвям тройничного нерва, при этом обезболивающий эффект наблюдается в заданной области иннервации.
Проводниковая анестезия применяется при оперативных вмешательствах в области больших коренных зубов, при операциях на деснах и больших по объему вмешательствах. Здесь подразумевается отключение не мелких веточек, а крупных нервных скоплений, стволов, каналов. Зато проводниковая анестезия позволяет «выключить разом пол челюсти». Так что она нашла своё применение при хирургических операциях, удалении зубов, воспалительных процессах. Избавление от болезненных ощущений происходит 2–3 часа.
Техника выполнения такой анестезии несколько сложнее, чем других. Ее рекомендуют в основном при лечении и удалении молярах (больших коренных зубов) или вмешательстве в десну. И последний подвид — Стволовая анестезия.
Этот вид анестезии проводится у основания черепа для блокады ветвей тройничного нерва и используется в стационаре при оперативных вмешательствах, при тяжелом болевом синдроме, невралгии, травмах. Ее суть заключается во введении с помощью тонкой иглы у основания черепа специальных препаратов, блокирующих верхне- и нижнечелюстной нервы. Такое обезболивание проводится чаще всего при проведении серьезных операций в условиях стационара и в случае четко выраженного болевого синдрома.
Такое обезболивание проводится чаще всего при проведении серьезных операций в условиях стационара и в случае четко выраженного болевого синдрома.
Современные местные анестетики представлены препаратами на основе артикаина и мепивакаина. Артикаин – превосходит все препараты по своим свойствам. Он выпускается в виде капсул под такими названиями как «Ультракаин», «Убестизин», «Септанест». Мепивакаин применяется в препарате «Скандонест». Вид анестезии, препарат и дозировка подбираются индивидуально в зависимости от клинической ситуации, сопутствующей патологии у пациента. Не посещать стоматолога нельзя. Не санированная ротовая полость чревата различными осложнениями. Поэтому стоит отбросить в сторону все предрассудки и без страха лечить зубы!
Еще один важный момент, о котором нужно знать, это лекарственная непереносимость. Если у вас были аллергические реакции на анестетики нужно обязательно сообщить об этом врачу, чтобы изменить тактику проведения анестезии на надежную и безопасную.
Пациенты с заболеваниями сердечно-сосудистой системы (инфаркт миокарда, инсульт после которых не прошло 6 месяцев). Стоматологическая помощь оказывается в условиях стационара! Стоит внимательно отнестись к декомпенсированным формам эндокринной патологии (сахарный диабет, тиреотоксикоз и др.). Стоматологическая помощь оказывается в условиях стационара! Так же имеет место случаи аллергии на местные анестетики или на компоненты, входящие в них. Пациенту проводят пробы в аллергологическом центре! Чтобы избежать осложнения при анестезии, Вам необходимо сообщить врачу об имеющихся хронических заболеваниях, состоянии артериального давления, аллергических реакциях на медикаменты, продукты питания, постоянно принимаемых лекарственных препаратах. Вспомните, как проходили удаление или лечение зубов раньше, делал ли доктор Вам анестезию. Как вы при этом чувствовали себя.
Общий наркоз и его противопоказанияЧастичное обезболивание неактуально при серьезных операциях, травмах костей челюстно-лицевой области и аллергии на используемые препараты. Общая анестезия применяется крайне редко в основном только тогда, когда пациент испытывает сильнейший страх и стресс. И также ее могут рекомендовать при психосоматических заболеваниях, аллергической реакции на местные анестетики и обширных хирургических вмешательствах, например, протезировании на имплантах. Как и у любой другой процедуры, связанной с применением анестетика, здесь аналогично присутствует ряд противопоказаний: бронхиальная астма или другие заболевания дыхательной системы. Гормональные заболевания или долгий прием гормональных средств, также нарушение сердечного ритма. Недавно перенесенный инфаркт миокарда или обширные хирургические вмешательства и алкогольное или наркотическое опьянение. Или при нарушении работы почек и печени. Перед процедурой категорически запрещается принимать пищу, перестать пить следует за 4 часа до начала сеанса.
Общая анестезия применяется крайне редко в основном только тогда, когда пациент испытывает сильнейший страх и стресс. И также ее могут рекомендовать при психосоматических заболеваниях, аллергической реакции на местные анестетики и обширных хирургических вмешательствах, например, протезировании на имплантах. Как и у любой другой процедуры, связанной с применением анестетика, здесь аналогично присутствует ряд противопоказаний: бронхиальная астма или другие заболевания дыхательной системы. Гормональные заболевания или долгий прием гормональных средств, также нарушение сердечного ритма. Недавно перенесенный инфаркт миокарда или обширные хирургические вмешательства и алкогольное или наркотическое опьянение. Или при нарушении работы почек и печени. Перед процедурой категорически запрещается принимать пищу, перестать пить следует за 4 часа до начала сеанса.
К преимуществам данной анестезии можно отнести абсолютную безболезненность даже самой сложной процедуры. У пациента нет стресса, и следующее посещение стоматолога уже не вызывает страха. Качество лечения значительно возрастает, ведь врач может спокойно работать. Риск воспалительных осложнений в этом случае практически равен нулю. Во время процедуры обязательно присутствует анестезиолог, который контролирует состояние пациента, следит за его давлением, дыханием и пульсом.
Качество лечения значительно возрастает, ведь врач может спокойно работать. Риск воспалительных осложнений в этом случае практически равен нулю. Во время процедуры обязательно присутствует анестезиолог, который контролирует состояние пациента, следит за его давлением, дыханием и пульсом.
Новейшие препараты для анестезии абсолютно безвредны и нетоксичны. Они не вызывают привыкания, не воздействуют на работу внутренних органов или ЦНС. После наркоза пациент чувствует лишь легкую слабость, которая проходит через несколько часов. Наша клиника гордится своей репутацией и дорожит каждым клиентом. Специалисты крайне внимательно относятся к использованию наркоза, предотвращая все возможные нарушения.
Мы с Вами рассмотрели основные виды анестезии в стоматологии, позволяющие заботиться о здоровье зубов относительно безболезненно и без особого дискомфорта. И поэтому, настоятельно рекомендуем выбирать только хорошие и проверенные временем стоматологические клиники, где вы сможете доверить свое здоровье настоящим профессионалам. И тогда вы с уверенностью скажете – «Восьмерку удалять совсем не больно!». Будьте здоровы, и улыбайтесь каждому новому дню!
И тогда вы с уверенностью скажете – «Восьмерку удалять совсем не больно!». Будьте здоровы, и улыбайтесь каждому новому дню!
Полезные ссылки
НаркозМестная анестезия в ветеринарной практике (спектр применения, показания и противопоказания, техника, дозировки)
Автор: Каменева А. В., ветеринарный врач-анестезиолог, Областной ветеринарный центр «Квина», Ветеринарный центр МедВет.Актуальность темы
Применение местной анестезии в первую очередь направлено на уменьшение негативного воздействия общей анестезии, снижение доз в/в анестетиков, уменьшение боли в послеоперационном периоде. К противопоказаниям относят только индивидуальную непереносимость и повреждения кожи в месте введения. Анестезия местная (anaesthesia localis) – искусственно вызванное, обратимое угнетение чувствительности (прежде всего болевой) на ограниченных участках тела, которое обеспечивается блокадой периферической нервной системы на разных уровнях. При этом сначала исчезает чувство боли, затем нарушается температурная чувствительность и в последнюю очередь – тактильная чувствительность, а также чувство давления.
Цель
Осветить простоту и необходимость применения местной анестезии, исходя из литературных данных, а также собственных результатов.Методы
Местная анестезия подразделяется на:
– терминальную (анестезию поверхности органа);
– инфильтрационную (пропитывание анестетиком тканей);
– регионарную: паравертебральную, межреберную, стволовую, сакральную, анестезию челюстной области;
– спинномозговую (субарахноидальную);
– перидуральную (эпидуральную);
– внутрикостную;
– внутривенную регионарную;
– анестезию поперечного сечения.
Материалы
Для проведения местной анестезии в первую очередь требуются анестетик, инъекционные иглы (для мелких животных), спинальные иглы (для крупных животных), эпидуральные катетеры.
Используемые в настоящее время анестетики являются химическими производными кокаина, растительного алкалоида. Уже к 1960 г. был изобретен аналог лидокаина. При выборе анестетика необходимо ориентироваться на его свойства. Не меньшее значение имеет и цена (лидокаин в десятки раз дешевле бупивакаина и ропивакаина). Зная особенности действующего вещества, можно сделать правильный выбор или подобрать верную комбинацию и сочетать препараты.
Уже к 1960 г. был изобретен аналог лидокаина. При выборе анестетика необходимо ориентироваться на его свойства. Не меньшее значение имеет и цена (лидокаин в десятки раз дешевле бупивакаина и ропивакаина). Зная особенности действующего вещества, можно сделать правильный выбор или подобрать верную комбинацию и сочетать препараты.
Свойства местных анестетиков
Местом действия анестетика является липидная оболочка нервных клеток, поэтому важной характеристикой является растворимость в жирах, которая определяет активность вещества. Другой интересный показатель – рКа, чем ближе эта цифра к физиологическому рН, тем быстрее начинает действовать местный анестетик. В щелочной среде адреналин нестабилен, поэтому содержащие его анестетики (ультракаин, убистезин) имеют рН около 4-5, следовательно, они начинают работать медленнее, чем анестетики, в которые адреналин добавляют непосредственно перед работой. Аналогичная проблема возникает при обезболивании воспаленных участков (где величина рН низкая), там для развития эффекта требуется больше времени. Подщелачивание раствора (0,2 мл 5%-ного натрия бикарбоната на 2 мл 1%-ного лидокаина) ускоряет начало действия, удлиняет его продолжительность и уменьшает боль при подкожном введении.
Подщелачивание раствора (0,2 мл 5%-ного натрия бикарбоната на 2 мл 1%-ного лидокаина) ускоряет начало действия, удлиняет его продолжительность и уменьшает боль при подкожном введении.Добавление адреналина усиливает вазоконстрикцию, абсорбция анестетика уменьшается, а длительность его действия увеличивается, но это актуально только для анестетиков короткого действия (лидокаин), в отношении бупивакаина и ропивакаина это малоэффективно. Закономерно, что для кошек дозы анестетика обычно ниже, т. к. токсический эффект достигается раньше, а период действия меньше.
Токсичность и влияние на организм
Сердечно-сосудистая система: передозировка лидокаином вызывает аритмии и депрессию кровообращения; попадание ропивакаина в кровяное русло приводит к АВ-блокаде, желудочковым аритмиям и судорогам. Дыхательная система: лидокаин устраняет рефлекторный бронхоспазм, к апноэ может привести блокада межреберных нервов. ЦНС: токсичность слабо выражена из-за предварительной седации. Иногда могут быть мышечные подергивания (особенно во время введения).
Иногда могут быть мышечные подергивания (особенно во время введения).
Техника выполнения
Эпидуральная анестезияПоказания (операции на тазовых конечностях, хвосте, тазовой и брюшной полостях). Препарат: лидокаин 2%-ный в дозе 2-4 мг/кг в зависимости от области проведения вмешательства. Если операции на хвосте или тазовых конечностях, достаточно 2-3 мг/кг, если проводится овариогистерэктомия или диагностическая лапаротомия, дозы увеличивают до 4 мг/кг. Бупивакаин/ропивакаин из расчета 2-3 мг/кг. Общий объем препарата не должен превышать 1,5 мл для кошки и 10 мл для собаки. Для введения анестетика возможно применение обычных игл (для мелких животных) или спинальных. Размер иглы выбирают в зависимости от размера и упитанности животного. Лучший тест на проникновение в эпидуральное пространство – это характерное потрескивание при прохождении желтой связки и потеря сопротивления при введении раствора. Отсутствие болевой чувствительности тазовых конечностей и зияние ануса через 5-10 мин после введения препарата свидетельствуют об успешном проведении анестезии.
 При выполнении кесарева сечения эффективно добавлять к анестетику налбуфин из расчета 0,25 мг/кг. Применение эпидурального катетера необходимо при операции длительностью более 3-4 часов или при высокой степени болевого синдрома в послеоперационный период. Также благодаря катетеру возможно проведение высокой эпидуральной анестезии при операции на органах грудной клетки.
При выполнении кесарева сечения эффективно добавлять к анестетику налбуфин из расчета 0,25 мг/кг. Применение эпидурального катетера необходимо при операции длительностью более 3-4 часов или при высокой степени болевого синдрома в послеоперационный период. Также благодаря катетеру возможно проведение высокой эпидуральной анестезии при операции на органах грудной клетки.Пример анестезиологического протокола:
1) Кошка (унилатеральная мастэктомия + овариогистерэктомия) вес 4 кг, 7 лет. Анестезиологический риск 2-й степени.
Ожидаемая степень боли: от умеренной до тяжелой.
Премедикация: антибиотик, НПВП.
Седация: пропофол 6 мг/кг.
Эпидуральная анестезия: налбуфин 1 мг + лидокаин 3,5 мг/кг (0,7 мл 2%-ный лидокаин).
Дополнительно: золетил из расчета 1-2 мг/кг.
Послеоперационный период: опиоиды каждые 8 часов из расчета 0,4 мг/кг.
2) Собака (ампутация тазовой конечности) вес 25 кг, 3 года.
Анестезиологический риск 2-3-й степени.
Ожидаемая степень боли: от умеренной до
тяжелой.
Премедикация: антибиотики, ранняя анальгезия опиатами.
Седация: опиаты + медетомидин 10-30 мкг/кг + пропофол 6 мг/кг.
Эпидуральная анестезия: катетер L7-S1 до L5, бупивакаин 1,5 мг/кг (7,5 мл 0,5%-ного
раствора)
Дополнительно: если катетер установлен верно – ничего, если анестезия неадекватная – газ
или золетил.
Послеоперационный период: опиоиды каждые 8 часов из расчета 0,4 мг/кг.
Блокада плечевого сплетения
Показания: операции на грудной конечности ниже уровня локтя
Препарат выбора: лидокаин или бупивакаин
Перед проведением блокады животное должно быть хорошо седировано. Для введения анестетика используют спинальные иглы размером от 21G до 18G, иглу вводят медиальнее плечевого сустава на 2-3 см, но латеральнее ребра параллельно позвоночнику. Некоторые авторы рекомендуют после введения иглы на ½ изменить угол более дорсально.
 Необходимо убедиться, что не повреждены сосуды, после чего вводится анестетик, дозу которого лучше распределять на нескольких уровнях. В связи с тем что плечевое сплетение и связанные с ним нервы занимают обширное пространство, дозу анестетика разводят NaCl на 50% для увеличения объема раствора. Потеря чувствительности происходит в течение 10-20 мин идлится около 2-4 часов. Полное восстановление наступает через 6 часов. Блокада плечевого сплетения – достаточно эффективный и безопасный метод, но могут возникнуть проблемы с длительным периодом ожидания эффекта особенно у собак с ожирением.
Необходимо убедиться, что не повреждены сосуды, после чего вводится анестетик, дозу которого лучше распределять на нескольких уровнях. В связи с тем что плечевое сплетение и связанные с ним нервы занимают обширное пространство, дозу анестетика разводят NaCl на 50% для увеличения объема раствора. Потеря чувствительности происходит в течение 10-20 мин идлится около 2-4 часов. Полное восстановление наступает через 6 часов. Блокада плечевого сплетения – достаточно эффективный и безопасный метод, но могут возникнуть проблемы с длительным периодом ожидания эффекта особенно у собак с ожирением.Анестезиологический протокол: собака (ампутация запястья) вес 15 кг, возраст 10 мес.
Ожидаемая степень боли: от умеренной до тяжелой.
Анестезиологический риск 2-й степени.
Премедикация: антибиотики, НПВП.
Седация: опиаты + медетомидин 10-30 мкг/кг + пропофол 6 мг/кг.
Блокада плечевого сплетения: бупивакаин 0,5%-ный 2 мг/кг (30 мг = 6 мл, развести до 12 мл NaCl).

Дополнительно: если катетер установлен верно – ничего, если анестезия неадекватная – газ или золетил.
Послеоперационная анальгезия: опиоиды при необходимости.
Блокада межреберных нервов
Показания: снятие боли во время и после торакотомии, наличие плеврального дренажа, переломы ребер. Блокада позволяет минимизировать количество системных анальгетиков, которые способны угнетать дыхание. Инъекция позволяет обезболить участок в два межреберных промежутка. Суммарная доза от всех инъекций анестетика не должна превышать общей дозы на вес животного.
Препарат выбора: лидокаин, бупивакаин, ропивакаин.
Целесообразно применять данную блокаду после торакотомии или до операции в случае длительного ожидания. Обычно выраженной седации не требуется и достаточно обезболивания. Анестетик вводят в два промежутка каудальнее и в два промежутка дорсальнее области разреза. Препарат быстро всасывается в кровь, поэтому не стоит превышать дозу 1,5 мг/кг в сумме на всю блокаду.
 При введении может возникнуть чувство жжения, для уменьшения неприятных ощущений анестетик можно разводить NaCl. Еще один способ снизить боль и улучшить экскурсию грудной клетки – интраплевральная анестезия. Анестетик вводится по дренажным трубкам в дозе 1,5 мг/кг в течение 1-2 мин, после чего лучше положить животное на бок, где располагается разрез. Вероятно, эффект достигается из-за ретроградной блокады межреберных нервов. Перед введением раствора необходимо провести аспирацию жидкости и воздуха.
При введении может возникнуть чувство жжения, для уменьшения неприятных ощущений анестетик можно разводить NaCl. Еще один способ снизить боль и улучшить экскурсию грудной клетки – интраплевральная анестезия. Анестетик вводится по дренажным трубкам в дозе 1,5 мг/кг в течение 1-2 мин, после чего лучше положить животное на бок, где располагается разрез. Вероятно, эффект достигается из-за ретроградной блокады межреберных нервов. Перед введением раствора необходимо провести аспирацию жидкости и воздуха.Анестезиологический протокол: собака доберман, торакотомия по поводу резекции доли легкого (абсцесс), возраст 3 г, вес 37 кг.
Ожидаемая степень боли: от умеренной до тяжелой.
Премедикация: атропин, опиаты.
Седация: миорелаксанты (если доступны).
Анестезия: кетамин (или золетил), пропофол, высокая эпидуральная анестезия.
Послеоперационный период: блокада межреберных нервов – ропивакаин 1,5 мг/кг (5,5 мл 1%-ного раствора) по 1,1 мл в каждый из 5 межреберных промежутков.

Интраплевральная блокада: (после того как животное проснется) 5,5 мл ропивакаина до 10 мл NaCl каждые 8 часов в течение 24-36 часов + опиаты.
Ретробульбарная блокада
Применение: операция на глазном яблоке, удаление глазного яблока.
Препарат выбора: лидокаин (+ адреналин, новокаин 0,5%-ный).
Данную блокаду часто комбинируют с инфильтрационной анестезией верхнего и нижнеговека. Примечательна эта анестезия тем, что к раствору лидокаина очень удобно добавлять адреналин, это значительно снижает кровотечение в месте разреза и продлевает блокаду. При выполнении ретробульбарной блокады есть риск повредить глазное яблоко и попасть в субарахноидальное пространство, что может привести к брадикардии и остановке дыхания. Лидокаин вводится из расчета 4 мг/кг, некоторые авторы разбавляют его 0,5%-ным новокаином + адреналин. В ретробульбарное пространство вводят порядка 1-2 мл раствора, остальное используют для инфильтрационной анестезии.
 Иглу вводят параллельно глазному яблоку, а потом меняют угол медиально к центру. Существует также методика четырех точек, когда препарат вводят в равных четвертях. Вкол осуществляют через кожу, а раствор вводят в заглазничное пространство. Если развивается мидриаз – это признак успешного блока.
Иглу вводят параллельно глазному яблоку, а потом меняют угол медиально к центру. Существует также методика четырех точек, когда препарат вводят в равных четвертях. Вкол осуществляют через кожу, а раствор вводят в заглазничное пространство. Если развивается мидриаз – это признак успешного блока.Анестезиологический протокол: собака кокер-спаниель, 3 мес., вес 4 кг.
Ретробульбарная блокада: лидокаин 4 мг/кг (0,8 мл лидокаина, до 4 мл новокаином 0,5%-ным + адреналин 0,1 мл)
Выводы
Таким образом, при качественном выполнении местного обезболивания возможно снизить дозы общего анестетика, а порой и ограничиться только гипнотическими средствами, улучшить состояние животного после операции, а значит, сократить реабилитацию. Применение местных анестетиков несущественно удорожает стоимость операции, зато поднимает имидж клиники и позволяет выполнять больший спектр операций. Выражаю благодарность всей операционной бригаде и отделению реабилитации, без этих людей совершенствовать свою работу невозможно, мы одна команда!(Вилковыский И.
 Ф., Чернявская А. В., Плярпа И. А., Масалов В. В., Гекова Н., Смирнова Ю.)
Список использованной литературы:
Ф., Чернявская А. В., Плярпа И. А., Масалов В. В., Гекова Н., Смирнова Ю.)
Список использованной литературы:- Lumb & Jones’ Veterinary Anesthesia and Analgesia
- Small Animal Anesthesia Rotation Handout April 2011© Michigan State University Veterinary Teaching Hospital.
- Veterinary pain management. Second edition. James S. Gaynor; William W. Muir.
- Клиническая анестезиология. Дж. Эдвард Морган-мл.; Мэгид С. Михаил.
- Anesthesia and Analgesia proceedings 378, 16 may 2009.
- Анестезиология и анальгезия мелких домашних животных. Г. Л. Кэрролл.
- Местная анестезия. Майкл Малрой, 2-е издание 2005 г.
Терминальная анестезия и острая токсичность вновь синтезированных производных пиперидина Текст научной статьи по специальности «Фундаментальная медицина»
Примечания: р — коэффициент корреляции по сравнению с тримекаином; р — по сравнению с лидокаином; р — по сравнению с новокаином.
Заключение. испытанные вещества, а также препараты сравнения, по
Таким образом можно заключить, что МАВ-175 является токсичности сопоставим с лидокаином и тримекаином
наиболее активным из всех изученных соединений. МАВ- (предыдущие исследования) и может быть рекомендован
175 превосходит как по длительности полной анестезии, для углубленного изучения.
так и по общей продолжительности действия все
СПИСОК ЛИТЕРАТУРЫ
1 Rathmell J.P., Neal J.M., Viscomi C.M. Регионарная анестезия: Самое необходимое в анестезиологии /Пер. с англ.; Под общ.ред. А.П.Зильбера, В.В.Мальцева. — М.: МЕДпресс-информ, 2007. — 272 с.
2 Cateral W. A., Mackie К Местные анестетики //Клиническая фармакология по Гудману и Гилману /Под общей ред. А.Г.Гилмана. -Пер. с англ. — М.: Практика, 2006. — С. 291 — 306.
A., Mackie К Местные анестетики //Клиническая фармакология по Гудману и Гилману /Под общей ред. А.Г.Гилмана. -Пер. с англ. — М.: Практика, 2006. — С. 291 — 306.
3 Ми1гоуМкЬйе1 F. Местная анестезия. Иллюстрированное практическое руководство / Пер. с англ. — М.: БИНОМ. Лаборатория знаний, 2003. — 301 с.
4 С.Р. Насырова Изыскание новых местно анестетических средств среди вновь синтезированных производных пиперидинов: автореф. … канд. мед. наук. — Алматы, 2009. — 49 с.
5 5. Кузденбаева Р.С., Рахимов К.Д., Шин С.Н. Доклиническое изучение местноанестезирующей активности новых биологических веществ. (Методическое пособие для фармакологов).Гос. Фарм. Комитет РК. — Алматы: 2000. — 28 с.
6 Игнатов Ю.Д., Чернякова И.В., Васильев Ю.Н. и др. Методические рекомендации по экспериментальному изучению местноанестезирующих средств. мыста лабораторлык шифрлер1 ЖЖЗ-161, ЖЖЗ -162, ЖЖЗ -163, ЖЖЗ -171, ЖЖЗ-173 жэне ЖЖЗ-175 жацадан синтезделген пиперидин туындыларыныц жерпшкп жансыздандыратын белсендштн зерттеу нэтижелер1 усынылган. Жогарыда зерттелген заттардыц ¡шшен ЖЖЗ-175 косылысы етгазпштш анестезияны зерттеу барысында эталонды препараттармен салыстырганда жогары белсендШк керсеткеш аныкталынды.
мыста лабораторлык шифрлер1 ЖЖЗ-161, ЖЖЗ -162, ЖЖЗ -163, ЖЖЗ -171, ЖЖЗ-173 жэне ЖЖЗ-175 жацадан синтезделген пиперидин туындыларыныц жерпшкп жансыздандыратын белсендштн зерттеу нэтижелер1 усынылган. Жогарыда зерттелген заттардыц ¡шшен ЖЖЗ-175 косылысы етгазпштш анестезияны зерттеу барысында эталонды препараттармен салыстырганда жогары белсендШк керсеткеш аныкталынды.
ТYЙiндi сездер: пиперидин туындылары, етгазпштш анестезия, жерплшт анестетиктер
G.M. PICHKHADZE, D.M. KADUROVA, G.S. SMAGULOVA, K.D. PRALIEV, K.B. RAIMKULOVA
Kazakh National Medical University named after S.D.Asfendiyarov Department of pharmacology
THE SEARCH COMPOUNDS WITH LOCAL ANESTHETIC ACTIVITY AT A CONDUCTIVE ANESTHESIA
Resume: The paper presents the study of the local anesthetic activity of newly synthesized derivatives piperidine under laboratory codes LAS-161, LAS — 162, LAS — 163, LAS — 171, LAS — 173 and LAS — 175. Found that the study of the above substances, the connection of the LAS — 175 in series experiments on conduction anesthesia proved to be a potent anesthetic, greater activity than standard drugs. Keywords: piperidine derivatives, conducting anaesthesia, local anesthetics
Found that the study of the above substances, the connection of the LAS — 175 in series experiments on conduction anesthesia proved to be a potent anesthetic, greater activity than standard drugs. Keywords: piperidine derivatives, conducting anaesthesia, local anesthetics
УДК: 616-089. 5-031. 84: 547. 298.4
Г.М. ПИЧХАДЗЕ, Г.С. СМАГУЛОВА, И.И. КИМ, К.Б. РАИМКУЛОВА
Казахский Национальный медицинский Университет им. С.Д.Асфендиярова Кафедра фармакологии
ТЕРМИНАЛЬНАЯ АНЕСТЕЗИЯ И ОСТРАЯ ТОКСИЧНОСТЬ ВНОВЬ СИНТЕЗИРОВАННЫХ ПРОИЗВОДНЫХ ПИПЕРИДИНА
В работе представлено изучение острой токсичности и местноанестезирующей активности вновь синтезированных производных пиперидина под лабораторными шифрами: МАВ-161, МАВ-162, МАВ-163, МАВ-171, МАВ-173 и МАВ-175. при терминальной анестезии. Установлено, что все испытанные вещества не проявили активности при терминальной анестезии. Острая токсичность соединении, кроме МАВ-175, ниже, чем у препаратов сравнения. МАВ-175 по токсичности сопоставим с тримекаином и лидокаином. Ключевые слова:. производные пиперидина, терминальная анестезия, местные анестетики, острая токсичность
при терминальной анестезии. Установлено, что все испытанные вещества не проявили активности при терминальной анестезии. Острая токсичность соединении, кроме МАВ-175, ниже, чем у препаратов сравнения. МАВ-175 по токсичности сопоставим с тримекаином и лидокаином. Ключевые слова:. производные пиперидина, терминальная анестезия, местные анестетики, острая токсичность
Актуальность проблемы не вызывает сомнения, так как при огромном практическом применении местных анестетиков в медицинской практике трудности заключаются в отсутствии препаратов, соответствующим всем требованиям клиники[1].
Удельный вес местной анестезии на сегодняшнем этапе устранения и профилактики болевого синдрома является достаточно большим, так как при общем обезболивании возможны серьезные нарушения различных функции ССС, ЦНС, ЖКТ и отдельных органов.
Поэтому большой интерес представляют производные пиперидина, которые по данным многочисленных исследовании способны проявлять выраженную местноанестезирующую активность при низкой токсичности [2,3].
Цель: изучение местноанестезирующей активности при терминальной анестезии и острой токсичности вновь синтезированных производных пиперидина. Материал и методы исследования.
Для экспериментального изучения специфической местноанестезирующей активности и острой токсичности 6 вновь синтезированных производных пиперидина под лабораторными шифрами: МАВ- 161, МАВ- 162, МАВ- 163, МАВ- 171, МАВ- 173 и МАВ- 175, были использованы методы первичного скрининга, рекомендованные
Фармакологическим комитетом РК [4]. Терминальная анестезия.
В опытах были использованы ненаркотизированные кролики-самцы массой 2,0- 2,5 кгвеса. Определялся порог чувствительности роговицы глаза кролика к тактильному воздействию. Определялось максимальное количество ритмических раздражений, наносимых на роговицу глаза с помощью капроновой нити с одним закругленным концом, со скоростью 100 в минуту, не вызывавшие роговичного рефлекса. Исходную чувствительность роговицы глаза кролика определяли дважды с интервалом в 5 минут. Раствор исследуемого вещества в объеме 0,2 мл (4 капли) инстиллировали в конъюнктивальный мешок глаза кролика в 2 раза с интервалом в 1 минуту.
Исходную чувствительность роговицы глаза кролика определяли дважды с интервалом в 5 минут. Раствор исследуемого вещества в объеме 0,2 мл (4 капли) инстиллировали в конъюнктивальный мешок глаза кролика в 2 раза с интервалом в 1 минуту.
Первое определение поверхностной анестезии проводили на 3 минуте и повторяли через определенные промежутки
времени (всего 13 определений). Каждый раз отмечали минимальное число прикосновений одинаковой силы и ритма, вызывающее смыкание век.
Каждую концентрацию вещества проверяли 8 раз. Определялась сила анестезии — глубина анестезии, выраженная в индексах Ренье (максимальный индекс -1300), длительность полной анестезии и общая продолжительность анестезирующего эффекта. Активность испытуемых соединений сравнивалась с эталонным анестетиком дикаином. Полученные данные обработаны статистически. Одновременно с выявлением местноанестезирующих свойств определялось
раздражающее действие исследуемых соединений на ткани глаза кролика. Острая токсичность
Острая токсичность определялась при однократном подкожном введении соединений и эталонных препаратов мышам. В эксперимент брали белых беспородных мышей массой 17,0 — 22,0 г. Вещества дозировались в мг на кг веса животного. Животных, получавших одну и ту же дозу, составляло 6.Фиксировался характер внешних симптомов отравления, скорость их наступления, выраженность скорости регрессии и смертность. За животными, не погибшими в первые 24 часа, устанавливалось наблюдение до полного восстановления поведения и аппетита. Степень токсичности соединений и эталонных препаратов определяли по показателю (ЛД50). Результаты исследований статистически обработаны по общеизвестной методике. Летальная доза (ЛД50) рассчитывалась по методу Беренса. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ. Терминальная анестезия
Анестезирующая активность большинства соединений изучалась в 1% растворах. По данной методике было поставлено 48 опытов на 5 кроликах.
Для каждого соединения и препаратов сравнения вычислены индексы Ренье, длительность полной анестезии и общая продолжительность действия. Результаты опытов представлены в таблице 1.
Соединение, препарат 1% растворы
Индекс анестезии М±м Длительность полной анестезии (мин.) Общая продолжительность действия (мин.)
МАВ-161 13,0±0 — —
МАВ-162 13,0±0 — —
МАВ-163 13,0±0 — —
МАВ-171 13,0±0 — —
МАВ-173 13,0±0 — —
МАВ-175 13,0±0 — —
Дикаин 1300±0 50,0 ± 0 более 60 минут
Из результатов таблицы видно, что 6 представленных соединений в 1% растворах оказались не эффективными при данном виде анестезии.
В указанной концентрации все соединения значительно уступает дикаину, по всем параметрам 1% раствору дикаина. Индекс Ренье их равен 13. Все испытанные вещества не вызывают полной анестезии, общая продолжительность действия их равна 0. В этой концентрации все соединения оказывают умеренное раздражающее действие на ткани глаза кролика. 1 % растворы дикаина проявляют более сильное и длительное раздражающее действие на ткани глаза: гиперемию коньюнктивы век, мигательной перепонки, краев век, склеры, инфильтрацию тканей век.
Острая токсичность.
Токсичность соединений при подкожном введении беспородным белым мышам
Острая токсичность всех представленных соединений и препаратов сравнения изучалась при подкожном введении 300 мышам. Всего поставлено 300 опытов. Все соединения вводились в1-2 % растворах. В связи с тем что предельно допустимый вводимый обьем жидкости мышам составляет 1 мл., концентрация растворов малотоксичных веществ была увеличена до 4%. Картина отравления при ведении токсических доз соединений была однотипной и отличалась быстротой нарастания токсических проявлений с увеличением дозы. Явления интоксикации начинали развиваться через 7-20 минут. Отравление проявлялось общим угнетением животных: у мышей развивалась заторможенность, полностью отсутствовали ответные реакции на внешние раздражения (перемещение животных из одной клетки в другую). Одновременно развивалась одышка. Повышение дозы вело к появлению сначала мышечных подергиваний, а затем клонических, или клонико-тонических судорог. Мыши принимали боковое положение, дыхание становилось
редким, аритмичным, поверхностным. Смерть наступала от первичной остановки дыхания через 15-50 минут от момента введения соединения. Выжившие мыши уже через 1,5-2 часа (при введении доз, близких к максимально переносимым) или к концу первых суток выходили из
заторможенного состояния, принимали обычное положение, вели себя активно и не отличались от интактных животных. Результаты исследований и вычисленные из опытов данные средней смертельной дозы — ЛД50 со стандартной средней арифметической ошибкой представлены в таблице 2.
Таблица 2 — Острая токсичность вновь синтезированных производных пиперидина и эталонных препаратов
Соединения, препараты ЛД50 Стандартная средняя арифметическая ошибка
МАВ 161 >1000 Р1<0.001 P2>0.001 P3<0.001
МАВ 162 1225 Р1<0.001 P2>0.001 P3<0.001 27,2
МАВ 163 1125 Р1<0.001 P2>0.001 P3<0.001 27,2
МАВ 171 1525 Р1<0.001 P2>0.001 P3<0.001 24,03
МАВ 173 1725 Р1<0.001 P2>0.001 P3<0.001 25,14
МАВ 175 245 Р1>0.>0.05), и токсичнее, чем новокаин.
Токсичность МАВ-175 статистически достоверно меньше, чем у лидокаина.
Заключение.
Следовательно, все изученные соединения не проявили эффекта при терминальной анестезии, оказывая умеренное раздражающее действие на ткани глаза кролика. Испытанные соединения, кроме МАВ-175, менее токсичны в сравнениии с эталонными препаратами, МАВ-175 сопоставимый по токсичности с тримекаином и лидокаином, и менее токсичный, чем дикаин, могут быть рекомендованы для дальнейшего изучения специфической активности (при инфильтрационной и проводниковой анестезии).
СПИСОК ЛИТЕРАТУРЫ
1 Mukhamedtzhanova G.S., Kadurova D.M., Nasurova S.R. Local anaesthetic activity of the new amidoxime derivatives//Pharmaceutical Chemistry Journal, Springer: 2011. — N8. — Volume 45. — P.468-471.
2 Имашова Ш.О., Насырова С.Р., Пичхадзе Г.М. и др. Влияние наноструктурных биополимеров на биофармацевтические свойства активных местноанестезирующих веществ // Вестник КазНМУ. — №5. — 2010. — С.217-219.
3 Harvey K., Adair J., Isho M. Can intravenous lidocaine decrease postsurgical ileus and shorten hospital stay in elective bowel surgery. A pilot study and literature review. Am.J.Surg. — 2009. — №198. — Р. 231-236
4 Хабриев Р.У. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ (издание второе, переработанное и дополненное)// Медицина. — М.: 2005. — С.364-392.
Г.М. ПИЧХАДЗЕ, Г.С. СМАГУЛОВА, И.И. КИМ, К.Б. РАИМКУЛОВА
С.Ж. Асфендияров атындагы Цазац ¥лттыщ медицина университетI Фармакология кафедрасы
ЖАЦАДАН СИНТЕЗДЕЛГЕН ПИПЕРИДИН ТУЫНДЫЛАРЫНЫЦ БЕТКЕЙЛ1К АНЕСТЕЗИЯСЫ МЕН ЖЕДЕЛ УЫТТЫЛЫГЫ
Тушн: Ж^мыста лабораторлык шифрлер1 ЖЖЗ-161, ЖЖЗ -162, ЖЖЗ -163, ЖЖЗ -171, ЖЖЗ-173 жэне ЖЖЗ-175 жацадан синтезделген пиперидин туындыларыныц жедел уыттылыгы мен жергшшт жансыздандыратын белсендшшн терминалды анестезияда зерттеу нэтижелер1 усынылган. Барлык зерттелген заттар териналды анестезияда белсендшш керсетпегеш аныкталынды. ЖЖЗ-175 косылысынан баскалардыц жедел уыттылыгы салыстыру препараттарынан темен болды. ЖЖЗ-175 уыттылыгы бойынша тримекаин мен лидокаинге сэйкес болды.
Туйщд сездер: пиперидин туындылары, терминалды! анестезия, жергшшт анестетиктер, жедел уыттылык
G.M. PICHKHADZE, G.S. SMAGULOVA, I.I. KIM, K.B. RAIMKULOVA
Kazakh National Medical University named after S.D.Asfendiyarov Department of pharmacology
TERMINAL ANESTHESIA AND ACUTE TOXICITY OF NEWLY SYNTHESIZED THE PIPERIDINE DERIVATIVES
Resume: The paper presents the study of acute toxicity and local anesthetic activity of newly synthesized derivatives of piperidine under laboratory code: LAS-161, LAS -162, LAS -163, LAS- 171, LAS- 173 and LAS -175 at terminal anesthesia.
It is found that all tested substances have not shown activity at the terminal anesthesia. Acute toxicity of the compound except LAS-175 below than the comparator drugs. LAS -175 toxicity comparable to trimekain and lidocaine. Кeywoгds: piperidine derivatives, terminal anesthesia, local anesthetics, acute toxicity
УДК 616.348-002-08: 615.243
Ф.К.СМАИЛОВА, Р.Х.КАРАЕВ, Р.А.ДУЛАЗОВ, Х.В.БАКИРОВ, Б.А.САЖАНОВ
Казахский Национальный медицинский университет им. С.ДАсфендиярова
ОПЫТ ПРИМЕНЕНИЯ ПРЕПАРАТА ИНФЛИКСИМАБ ПРИ НЕСПЕЦИФИЧЕСКОМ ЯЗВЕННОМ КОЛИТЕ:
КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ
В статье приводится собственное наблюдение врачей интернов-терапевтов по применению препарата Инфликсимаб в лечении больного с тяжелым течением неспецифического язвенного колита. Так же проведена обработка статистических данных по заболеваемости неспецифическим язвенным колитом в Западно-Казахстанской области. На примере данного клинического случая внеочередной раз была доказана эффективность препарата Инфликсимаб.
Ключевые слова: неспецифический язвенный колит, активность, лечение, инфликсимаб, эффективность.
Актуальность проблемы неспецифического язвенного колита (НЯК) на сегодня не подлежит сомнению, учитывая многообразие механизмов развития заболевания, а также недостаточную эффективность используемых средств медикаментозной коррекции. По распространенности НЯК занимает одно из ведущих мест среди заболеваний органов пищеварения, имеет рецидивирующее течение и неблагоприятный медико-социальный прогноз. Введение. Неспецифический язвенный колит — хроническое заболевание воспалительной природы с язвенно-деструктивными изменениями слизистой оболочки прямой и ободочной кишок, характеризующееся прогрессирующим течением и развитием тяжелых кишечных и внекишечных осложнений, таких как кровотечение, токсическая дилатация толстой кишки, перфорация, перитонит, абсцессы, стриктуры, рак, сепсис [1].
В десятой редакции Международной классификации болезней данное заболевание обозначено как язвенный колит-ЯК (неспецифический), шифр К51 — «некротизирующее воспаление слизистой оболочки толстой и прямой кишки, характеризующееся обострениями». Распространенность НЯК колеблется в зависимости от этнической принадлежности и географической зоны. По данным Абдулхакова А.С., частота НЯК по Московкому региону России составляет 22,3 случая на 100 тыс. населения, распространенность в мире достигает 50-230 случаев на 100 тыс.населения, ежегодный прирост НЯК в мире -5-20 случаев на 100 тыс. населения [2]. Эпидемиология НЯК в целом по Казахстану неизвестна. Заболевание встречается во всех возрастных групах, но основной пик заболеваемости приходится на наиболее трудоспособный возраст 20-40 лет. Второй пик отмечается в
возрастной группе после 55 лет. Мужчины и женщины болеют с одинаковой частотой. Чаще заболевают лица европеоидной популяции, нежели негроидной. Частота НЯК в больших городах примерно в 1,5-4 раза выше, чем в сельских районах.
Эиология НЯК до конца не изучена. В патогенезе предпочтение отдается иммуногенетической теории происхождения заболевания. В пользу данной теории говорит тот факт, что имеются семейные случаи заболевания, а среди ближайших родственников ЯК встречается в 15 раз чаще, чем в общей популяции. Примерно у 10% больных родственники первой ступени страдают тем же заболеванием. Например, среди евреев заболевание встречается в 3,5 раза чаще, чем у лиц нееврейской национальности. Кроме того, выявлена связь заболевания с антигенами комплекса гистосовместимости HLA.
Основным механизмом в развитии заболевания является избыточная продукция противовоспалительных цитокинов, которые начинают вырабатываться под воздействием своеобразных триггеров, в роли которых могут выступать вирусы, бактерии и бактериальные продукты (эндотоксин, пептидогликан клеточной стенки), пища (белки сои и молока) в сочетании с нервно-психическими, информационными и физическими перегрузками, часто на фоне неблагоприятных экологических влияний. Клинические проявления болезни могут быть от легких до тяжелых, вплоть до молниеносных форм. В соответствии с Консенсусом ЕССО и Монреальской классификацией, течение язвенного колита делится на ремиссию и активную фазу заболевания.
Таблица 1 — Монреальская классификация активности язвенного колита
Ремиссия Активный ЯК
S0 S1 S2 S3
Частота стула/день Нет симптомов <4 >4 >6 и
Примесь крови в стуле Может присутствовать Присутствует Присутствует
Пульс, уд/мин Норма Возможны признаки системной интоксикации >90 или
Температура0 С > 37,5 или
Гемоглобин, г/л <105 или
СОЭ, мм/час >30
Страница не найдена |
Страница не найдена |404. Страница не найдена
Архив за месяц
ПнВтСрЧтПтСбВс
14151617181920
21222324252627
282930
12
12
1
3031
12
15161718192021
25262728293031
123
45678910
12
17181920212223
31
2728293031
1
1234
567891011
12
891011121314
11121314151617
28293031
1234
12
12345
6789101112
567891011
12131415161718
19202122232425
3456789
17181920212223
24252627282930
12345
13141516171819
20212223242526
2728293031
15161718192021
22232425262728
2930
Архивы
Июл
Авг
Сен
Окт
Ноя
Дек
Метки
Настройки
для слабовидящих
Лидокаин | Биохимик
Взаимодействие с другими лекарственными средствами
При одновременном применении лидокаина и бета-адреноблокаторов возможно усиление токсических эффектов лидокаина.Нерационально назначать лидокаин вместе с аймалином, амиодароном, верапамилом или хинидином в связи с усилением кардиодепрессивного действия.
Совместное применение лидокаина и прокаинамида может вызвать возбуждение центральной нервной системы, галлюцинации.
При внутривенном введении гексобарбитала или тиопентала натрия на фоне действия лидокаина возможно угнетение дыхания.
Сочетанное применение лидокаина и фенитоина следует применять с осторожностью, так как это приводит к усилению кардиодепрессивного эффекта.
Под влиянием ингибиторов моноаминооксидазы вероятно усиление местноанестезирующего действия лидокаина. Больным, принимающим ингибиторы моноаминооксидазы, не следует назначать лидокаин парентерально.
При одновременном применении лидокаина и полимиксина В возможно усиление угнетающего влияния на нервно- мышечную передачу, используемого в качестве антиаритмического средства, поэтому в этом случае необходимо следить за функцией дыхания больного.
При сочетанном применении лидокаина со снотворными или седативными средствами возможно усиление угнетающего действия на центральную нервную систему.
Под влиянием циметидина внутривенное введение лидокаина вызывает нежелательные эффекты (оглушение, сонливость, брадикардия и др.). В случае необходимости комбинированной терапии следует уменьшить дозу лидокаина.
Барбитураты, фенитоин, рифампицин (индукторы микросомальных ферментов печени) снижают эффективность (может потребоваться увеличение дозы).
Снижает эффект антимиастенических препаратов. При назначении с аймалином, фенитоином, хинидином, амиодароном возможно усиление отрицательного инотропного эффекта. Сердечные гликозиды ослабляют кардиотонический эффект, курареподобные препараты усиливают мышечную релаксацию.
Прокаинамид повышает риск развития возбуждения центральной нервной системы, галлюцинаций.
При внутривенном введении гексобарбитала или тиопентал натрия на фоне действия лидокаина возможно угнетение дыхания.
Антикоагулянты (в т.ч. гепарин, варфарин и др.) увеличивают риск возникновения кровотечений. Не снижает противомикроб- ную активность сульфаниламидов (при метаболизме не происходит образования ПАБК (парааминобензойная кислота)).
Основы фармакологии местных анестетиков
Anesth Prog. 2006 Fall; 53 (3): 98–109.
Дэниел Э. Беккер
* Профессор смежных медицинских наук, Общественный колледж Синклера, и заместитель директора по образованию, Госпиталь Майами Вэлли, Дейтон, Огайо
Kenneth L Reed
† Частная практика, ограниченная анестезией для стоматологии, Аризона, и клинический доцент стоматологической школы Орегонского университета здравоохранения и наук, Портленд, Орегон, и клинический доцент кафедры челюстно-лицевой хирургии, секция анестезии и медицины, Школа стоматологии, Университет Южной Калифорнии, Лос-Анджелес, Калифорния
* Профессор смежных медицинских наук, Общественный колледж Синклера, и заместитель директора по образованию, Госпиталь Майами Вэлли, Дейтон, Огайо
† Частная практика, ограниченная анестезией для стоматологии, Аризона, и клинический адъюнкт-профессор Школы стоматологии Орегонского университета здравоохранения и наук, Портленд, Орегон, и клинический адъюнкт-профессор кафедры челюстно-лицевой хирургии, Секция анестезии и медицины, Школа стоматологии, Университет Южной Калифорнии, Лос-Анджелес, Калифорния
Адресная переписка Дэниелу Э.Becker, DDS, 444 West 3rd Street, Dayton, OH 45402.
Получено 22 января 2006 г .; Принято 22 января 2006 г.
Copyright © 2006 Американское стоматологическое общество анестезиологов. Эта статья цитируется в других статьях PMC.Abstract
Невозможно оказать эффективную стоматологическую помощь без применения местных анестетиков. Этот класс препаратов имеет впечатляющую историю безопасности и эффективности, но все местные анестетики могут вызвать значительную токсичность при неосторожном использовании.Целью этого обзора является информирование практикующего врача по вопросам, касающимся базовой фармакологии и клинического использования составов местных анестетиков.
Ключевые слова: Фармакология местных анестетиков
ОБЩИЕ СВОЙСТВА МЕСТНЫХ АНЕСТЕТИКОВ
Местные анестетики прерывают нервную проводимость, подавляя приток ионов натрия. В большинстве случаев это следует за их диффузией через нервную мембрану в аксоплазму, где они попадают в натриевые каналы и не позволяют им перейти в активное или «открытое» состояние.Молекула местного анестетика состоит из 3 компонентов: (а) липофильное ароматическое кольцо, (б) промежуточная сложноэфирная или амидная цепь и (в) концевой амин. Каждый из них вносит свой вклад в молекулу ().
Состав местного анестетика. Все местные анестетики состоят из 3 основных компонентов, каждый из которых обладает определенным свойством.
Ароматическое кольцо улучшает растворимость соединения в липидах, которая может быть дополнительно улучшена алифатическими заменами в местах, обозначенных (R).Повышенная растворимость липидов увеличивает диффузию через нервные оболочки, а также через нервные мембраны отдельных аксонов, составляющих нервный ствол. Это свойство коррелирует с активностью , потому что большая часть введенной дозы может попасть в нейроны. Поскольку бупивакаин более растворим в липидах, чем лидокаин, он более эффективен и готовится в концентрации 0,5% (5 мг / мл), а не в концентрации 2% (20 мг / мл).
Конечный амин может существовать в третичной форме (3 связи), которая является жирорастворимой, или в виде четвертичной формы (4 связи), которая имеет положительный заряд и делает молекулу водорастворимой.Как объяснено выше, ароматическое кольцо определяет фактическую степень растворимости липидов, но терминальный амин действует как «переключатель включения-выключения», позволяя местному анестетику существовать либо в жирорастворимой, либо в водорастворимой конформации. Каждая из третичных и четвертичных форм играет ключевую роль в последовательности событий, ведущих к блокаде проводимости.
Чтобы основа местного анестетика оставалась стабильной в растворе, ее формулируют в виде гидрохлоридной соли. Таким образом, молекулы существуют в четвертичном водорастворимом состоянии во время инъекции.Однако эта форма не проникает в нейрон. Таким образом, время начала местной анестезии зависит от пропорции молекул, которые превращаются в третичную липидорастворимую структуру при воздействии физиологического pH (7,4). Константа ионизации (pKa) анестетика предсказывает долю молекул, которые существуют в каждом из этих состояний. По определению, pKa молекулы представляет собой pH, при котором 50% молекул существуют в жирорастворимой третичной форме и 50% в четвертичной, водорастворимой форме.PKa всех местных анестетиков составляет> 7,4 (физиологический pH), и, следовательно, большая часть молекул существует в четвертичной водорастворимой форме при введении в ткань, имеющую нормальный pH 7,4. Кроме того, кислая среда, связанная с воспаленными тканями, еще больше способствует четвертичной водорастворимой конфигурации. По-видимому, этим объясняются трудности при попытке обезболить воспаленные или инфицированные ткани; меньше молекул существует в виде третичных жирорастворимых форм, которые могут проникать через нервы.В этих ситуациях бупивакаин (pKa 8,1) будет наименее эффективным, а мепивакаин (pKa 7,6), скорее всего, обеспечит эффективную анестезию ().
Местное обезболивающее. Введенный местный анестетик находится в равновесии в виде четвертичной соли (BH + ) и третичного основания (B). Доля каждого из них определяется pKa анестетика и pH ткани. Жирорастворимые вещества (B) необходимы для проникновения как в эпиневрий, так и в нейрональную мембрану.Как только молекула достигает аксоплазмы нейрона, амин получает ион водорода, и эта ионизированная четвертичная форма (BH + ) отвечает за фактическую блокаду натриевого канала. Предположительно, он связывается внутри натриевого канала около внутренней поверхности нейрональной мембраны.
Промежуточная цепь или связь обеспечивает удобную основу для классификации, а также определяет характер биотрансформации. Сложные эфиры гидролизуются эстеразами плазмы, а амиды биотрансформируются в печени.Сложные эфиры больше не упаковываются в стоматологические картриджи и используются нечасто, за исключением бензокаина, который содержится в некоторых местных анестетиках.
Как и другие препараты, местные анестетики различаются по своей способности связываться с белками плазмы. При циркуляции в кровотоке они связываются с альфа-1-кислотным гликопротеином (кислые препараты, скорее всего, связываются с альбумином). Это свойство связывания белков коррелирует с их сродством к белку в натриевых каналах и предсказывает продолжительность нервной блокады.Бупивакаин имеет наибольший процент связывания с белками и является местным анестетиком самого длительного действия, доступным в стоматологических картриджах. Клиническая эффективность местных анестетиков коррелирует с 4 основными характеристиками или свойствами, которые суммированы в.
Таблица 1
Характеристики и клинические корреляты
СИСТЕМНАЯ ТОКСИЧНОСТЬ
Местные анестетики подавляют центральную нервную систему в зависимости от дозы (см.). Низкие сывороточные концентрации используются в клинических условиях для подавления сердечных аритмий и статусных судорог, но более высокие концентрации вызывают судорожную активность.Судорожные припадки являются основным опасным для жизни последствием передозировки местного анестетика. Предположительно, это происходит из-за избирательного угнетения центральных тормозных путей, что позволяет возбуждающим трактам работать безумно. Признаки токсичности лидокаина могут проявляться при концентрациях> 5 мкг / мл, но для судорожных припадков обычно требуются концентрации> 8 мкг / мл.
Системное влияние лидокаина.
Помимо нервной блокады, периферическое действие большинства местных анестетиков включает в себя вазодилатацию различной степени, что способствует развитию гипотонии, наблюдаемой после приема больших доз.Важно, чтобы местные анестетики считались депрессантами центральной нервной системы, и они усиливали любое угнетение дыхания, связанное с седативными средствами и опиоидами. Кроме того, сывороточные концентрации, необходимые для возникновения судорог, ниже, если присутствует гиперкарбия (повышенный уровень углекислого газа). Это тот случай, когда угнетение дыхания вызывается одновременным приемом седативных средств и опиоидов. Goodson and Moore –1 задокументировали катастрофические последствия взаимодействия этого лекарственного средства у педиатрических пациентов, получавших предоперационную седацию вместе с чрезмерными дозами местных анестетиков.
Прежде чем мы обратимся к переменным, которые влияют на системные концентрации в сыворотке крови, рассмотрим следующее предложение для расчета доз. Процентные растворы отражают граммы растворенного вещества (лекарственного средства), растворенного в 100 мл растворителя. 3% раствор мепивакаина содержит 3 г мепивакаина, растворенных в каждых 100 мл растворителя. Переводить это количество в миллиграммы на миллилитр или миллиграммы на картридж — утомительно. Для удобства воспользуйтесь следующими советами. Прежде всего, считайте, что картриджи с анестетиком содержат 2 мл, а не 1.8 мл. Эта ошибка приведет к завышению дозы и, следовательно, является безопасной практикой. Для данного процентного решения переместите десятичную запятую на 1 вправо; полученное число будет отражать миллиграммы на миллилитр. Например, 3,0% мепивакаин составляет 30 мг / мл. Стоматологический картридж содержит 2 мл и, следовательно, содержит ~ 60 мг мепивакаина. Бупивакаин 0,5% содержит 5 мг / мл и, следовательно, ~ 10 мг на картридж. После инъекции 2½ картриджей с 2% лидокаином удобно считать это ~ 5 мл при 20 мг / мл или 100 мг всего.
В 1972 году Скотт и др. 2 опубликовали исследование из серии клинических исследований, оценивающих переменные, которые определяют последующие концентрации местных анестетиков в сыворотке. Было обнаружено, что концентрация в сыворотке крови варьируется в зависимости от пути введения анестетика. При использовании лидокаина в дозе 400 мг самые высокие уровни в сыворотке наблюдались при последующей инфильтрации слизистой оболочки влагалища, а самые низкие — при подкожной инфильтрации брюшной полости. Однако в каждом случае пиковый уровень в сыворотке крови наблюдался через 20–30 минут после инъекции только лидокаина.Независимо от способа введения пиковые уровни были снижены, а скорость абсорбции замедлена за счет добавления вазопрессоров, таких как адреналин, к раствору местного анестетика. Разумно предположить, что системные концентрации после инъекции в подслизистую оболочку в полости рта будут приближаться к концентрациям после инъекции в слизистую оболочку влагалища из-за аналогичной васкулярности.
Концентрации в сыворотке после 3 способов введения.
Дополнительные переменные также были рассмотрены в ходе этих знаковых исследований.Как и ожидалось, доза и скорость инъекции напрямую связаны с конечной системной концентрацией в сыворотке. Концентрация раствора (например, 2% против 3%) не имеет значения; системная концентрация зависит от общей дозы (например, 20 мл 3% или 30 мл 2% каждая составляет 600 мг и дает такую же концентрацию в сыворотке). При использовании лидокаина или других анестетиков в концентрациях> 2% необходимо учитывать введенную дозу (миллиграммы), а не объем (миллилитры или картриджи).
Вопреки общепринятому мнению, возраст или вес пациента не позволяют предсказать системную концентрацию в сыворотке после доз, рассчитанных как мг / год, возраст или мг / кг.При ведении педиатрических пациентов максимальные дозы обычно выражаются в мг / кг, и это следует соблюдать в качестве меры предосторожности. Однако это не имеет большого значения для взрослых, и следует следовать рекомендациям, выраженным в максимальной дозе в миллиграммах, независимо от веса и возраста. Очевидно, это максимальное количество не должно превышаться при расчете доз для больших детей.
При рассмотрении токсичности любого класса наркотиков следует помнить о метаболитах, а также о исходном лекарстве.Местные анестетики — не исключение. Лидокаин биотрансформируется в печени в моноэтилглицинексилидид и глицинексилидид. Эти метаболиты обладают значительной активностью и участвуют в случаях токсичности лидокаина после повторных доз и непрерывных внутривенных инфузий.
Метаболит прилокаина, 0 -толуидин, может окислять железо в гемоглобине от двухвалентного (Fe 2+ ) до трехвалентного (Fe 3+ ). Измененные таким образом гемы не связывают кислород, а нормальные гемы на той же самой молекуле гемоглобина с трудом выделяют свой кислород.Эта форма гемоглобина называется метгемоглобином, и когда таким образом изменяется> 1% общего гемоглобина, состояние называется метгемоглобинемией. Пациенты выглядят синюшными и становятся симптоматичными, когда доля метгемоглобина превышает 10-15%. 3 Состояние редко опасно для жизни и реагирует на внутривенное введение метиленового синего, который восстанавливает геммы до нормального состояния. Маловероятно, что метгемоглобинемия, связанная с прилокаином, возникнет после приема рекомендуемых доз. Редко можно встретить пациента с наследственной метгемоглобинемией, что противопоказано к применению прилокаина.
АЛЛЕРГИЯ НА МЕСТНЫЕ АНЕСТЕТИКИ
Пациенты часто заявляют, что у них аллергия на местные анестетики. Однако после тщательного опроса обычно выясняется, что то, что они испытали, было либо обмороком, связанным с инъекцией, либо учащенным сердцебиением, связанным с адреналином, который либо содержится в растворе, либо высвобождается эндогенно. В научной литературе появлялись сообщения об аллергических реакциях на местные анестетики, хотя и редко, но ни один из них не подтвердил реакцию гиперчувствительности, опосредованную IgE.Тем не менее, у пациентов иногда наблюдались симптомы, соответствующие аллергической реакции на амидные местные анестетики. 4 , 5 В некоторых случаях причиной этих эпизодов были консерванты (метилпарабен) или антиоксиданты (бисульфиты), содержащиеся в растворе. 6 Метилпарабен включен в многодозовые флаконы для предотвращения роста микробов. Его больше нет во флаконах с одной дозой или стоматологических картриджах. Метабисульфиты предотвращают окисление вазопрессоров и входят только в стоматологические картриджи, содержащие адреналин или левонордефрин.Чтобы прояснить несколько заблуждений относительно аллергических реакций, следует краткий обзор их патогенеза, представленный Адкинсоном. 7
Чтобы лекарства были иммуногенными, они должны иметь большую молекулярную массу и обладать множественными валентностями, чтобы их могли распознать иммунные клетки. Большие белки, такие как инсулин, удовлетворяют этим требованиям и хорошо известны как иммуногенные. Большинство других молекул слишком малы и должны соединяться с другими молекулами, которые действуют как носители, и в этом случае лекарство описывается как гаптен.Этот комплекс носителя и гаптена может вызывать и вызывать аллергическую реакцию (). Часто метаболит лекарства — это фактическая молекула, которая функционирует как гаптен. Это верно для бета-лактамных и сульфаниламидных антибиотиков. В случае сульфонамидов фенильное кольцо, содержащее аминное замещение, представляет собой фрагмент, участвующий в образовании иммуногенного комплекса (). Этот фрагмент является общим для других производных парааминобензойной кислоты (ПАБК), таких как метилпарабен и некоторых, но не всех, сложноэфирных местных анестетиков.В этих случаях может существовать возможность перекрестной аллергенности среди подобных соединений из-за общей составляющей (например, сульфаниламидных антибиотиков, метилпарабена и сложных эфиров ПАБК).
Носитель + гаптен = иммуноген.
Бессмысленно называть «сложные эфиры» более аллергенными, чем амидные местные анестетики. Сложный эфир представляет собой просто химическую связь и не придает соединению иммуногенности. Скорее всего, виноват молекулярный компонент, соединенный этой связью. Это заблуждение привело к тому, что некоторые агенты были ошибочно названы «перекрестно аллергенными» с сульфаниламидами.Артикаин классифицируется как амидный местный анестетик из-за связи между его жирорастворимым кольцом и концевым амином. Его тиофеновое кольцо содержит атом серы, который не обладает иммуногенными свойствами, и боковую цепь сложного эфира, которая делает соединение неактивным после гидролиза. Однако артикаин не высвобождает метаболит, напоминающий ПАБК, и не вызывает опасений относительно иммуногенности. Напротив, прокаин является представителем сложных эфиров, полученных из ПАБК, и гидролиз высвобождает фрагмент, который является потенциально иммуногенным ().
Сложные эфирные связи новокаина и артикаина.
Последнее заблуждение относится к сульфитам. Их включают в растворы местных анестетиков, содержащие вазопрессоры, чтобы предотвратить их окисление. Это неорганические соединения (-SO 3 ), которые участвуют в аллергических реакциях, но они не имеют никакого отношения к иммуногенности, приписываемой соединениям, родственным PABA. Эти агенты также используются в качестве антиоксидантов в свежих фруктах и овощах, чтобы сохранить их цвет и внешний вид.Пациенты, заявляющие об аллергии на такие продукты, могут испытывать перекрестные реакции с растворами местных анестетиков, содержащих вазопрессоры.
Лекарственные реакции с клиническими проявлениями, указывающими на иммунологические механизмы, но заведомо лишенными иммунной основы, обычно считаются «псевдоаллергическими» реакциями. Такие реакции являются идиосинкразическими по механизму, и их следует отличать от истинной аллергии. Когда эти реакции имитируют более тяжелые IgE-независимые синдромы, их описывают как «анафилактоидные», а не как анафилактические.Анафилактоидные реакции включают тот же конечный общий путь, что и настоящая аллергия, но механизм высвобождения вазоактивных медиаторов не является иммуноопосредованным.
Если пациент описывает реакцию, которая клинически согласуется с аллергией, стоматолог должен избегать использования вызывающего раздражение агента до тех пор, пока он не будет оценен аллергологом. В случае, если до получения медицинского разрешения требуется обезболивающее, самым разумным выбором будет либо мепивакаин, либо прилокаин без вазопрессоров.Согласно общепринятому мнению, если местные анестетики действительно вызывают аллергию, сложные эфиры ПАБК будут способны к перекрестной реакции, но это маловероятно среди амидных местных анестетиков. Кроме того, избегая растворов, содержащих вазопрессоры, можно избежать бисульфитов, которые входят в состав антиоксидантов. Возможна чувствительность к бисульфитам, особенно у пациентов с астмой или атопией. Эти принципы являются основой блок-схемы, представленной в. Никогда нельзя отказывать пациенту в пользе местной анестезии из-за ошибочных предположений относительно аллергии.
Ведение пациентов с аллергией на местные анестетики. Исключите частые реакции, ошибочно принимаемые за аллергию (например, обморок и тахикардию). Затем установите, что характер их реакции хотя бы напоминал реакцию гиперчувствительности (например, сыпь, кожный зуд, крапивница, одышка). Если препарат известен, выберите другой амид, не содержащий вазопрессоров, чтобы не было бисульфитов. В противном случае обратитесь к аллергологу, сообщив при необходимости эту цифру. По материалам deShazo RD, Kemp SF. JAMA. 1997; 278: 1903.
СРАВНЕНИЯ МЕСТНЫХ АНЕСТЕТИКОВ
Кокаин был первым местным анестетиком, открытым в 1860 году. Он уникален среди местных анестетиков, потому что, помимо блокирования проведения импульса по аксонам, он ингибирует обратный захват нейротрансмиттеров адренергическими окончаниями нейронов. Периферически это приводит к накоплению норадреналина в симпатических синапсах, что приводит к сужению сосудов и стимуляции сердца. В основном, накопление норадреналина приводит к генерализованной стимуляции центральной нервной системы.Однако в центральной нервной системе обнаруживаются дополнительные адренергические нейротрансмиттеры, и их обратный захват также подавляется. В частности, подавление кокаином обратного захвата дофамина выражено и отвечает за его эйфорический эффект и возможность злоупотребления. По всем этим причинам, а также из-за того, что он не обладает большей анестезирующей эффективностью, кокаин мало используется в медицине, за исключением местного применения во время некоторых офтальмологических процедур и процедур. Из-за возможности дополнительных симпатомиметических эффектов следует избегать применения адреналина при назначении местных анестетиков пациентам, подозреваемым в недавнем употреблении кокаина.
Прокаин (новокаин) был представлен в 1905 году и стал первым местным анестетиком, получившим широкое распространение в США. Однако его популярность снизилась после появления лидокаина в 1948 году. Сегодня лидокаин является наиболее широко используемым средством, но все местные анестетики имеют сопоставимую эффективность. Они различаются по эффективности и нескольким фармакокинетическим параметрам, которые объясняют различия в начале и продолжительности анестезии. При выборе конкретного агента необходимо учитывать продолжительность запланированной процедуры и проблемы, связанные с концентрацией вазопрессоров.Для длительных процедур логичным выбором является бупивакаин, но, согласно исследованиям, в которых сравнивались различные анестетики, он считается одним из наиболее болезненных агентов во время инъекции. 8–10 Одна из стратегий — обеспечить первые 60–90 минут анестезии менее раздражающим агентом (лидокаином или прилокаином), а затем повторно ввести в анестезированные ткани бупивакаин для обеспечения обезболивания в послеоперационном периоде. Такая стратегия наиболее эффективна после нервной блокады; следует ожидать более короткую продолжительность после инфильтрации мягких тканей.См. Продолжительность и максимальные дозы.
Таблица 2
Местные анестетики в картриджах 11
Несмотря на отдельные заявления о превосходстве артикаина (септокаина, ультракаина), двойные слепые исследования подтвердили, что эффективность сравнима с лидокаином. 12 , 13 Тем не менее, артикаин имеет определенные особенности, которые делают его привлекательным выбором для отдельных случаев. В отличие от других анестетиков, содержащих бензол в качестве ароматического кольца, артикаин имеет тиофеновое кольцо, которое обеспечивает большую липидорастворимость, чем лидокаин.Это свойство должно было позволить более низкую концентрацию, но на самом деле это был 4% раствор. Заявления об успешной анестезии после инфильтрации нижней челюсти, вероятно, связаны с высокой растворимостью липидов и большим количеством молекул на миллилитр введенного препарата по сравнению с лидокаином. На сегодняшний день не было опубликованных исследований, сравнивающих артикаин с 4% растворами лидокаина при инфильтрации нижней челюсти. Кроме того, такие концентрации лидокаина представляют неприемлемый риск системной токсичности, и эта проблема вводит еще одно привлекательное свойство артикаина, а именно характер клиренса.
Хотя артикаин классифицируется как амид из-за связи его промежуточной цепи, тиофеновое кольцо также содержит боковую цепь сложного эфира. Эта цепь гидролизуется эстеразами плазмы, что делает молекулу неактивной. В результате период полувыведения артикаина составляет всего 20 минут по сравнению с ~ 90 минутами для лидокаина и других амидов, требующих очистки печени. По этой причине артикаин представляет меньший риск системной токсичности при равных дозах (например, 1 картридж 4% артикаина против 2 картриджей 2% лидокаина).Предположительно, этот принцип также обеспечит большую безопасность при длительных приемах, когда необходимо вводить дополнительные дозы анестетика. Следует уточнить, что артикаин на молекулярном уровне классифицируется как амид, а не сложный эфир ПАБК, и не вызывает никаких опасений по поводу перекрестной аллергии на производные ПАБК.
Преимущества артикаина несколько смягчаются сообщениями о парестезии после его использования при блокаде нижних альвеол. Haas and Lennon 14 сообщили о повышении частоты парестезий в Канаде после введения артикаина в середине 1980-х годов.Только в 1993 г. было зарегистрировано 14 случаев парестезии, и все они были связаны с применением артикаина или прилокаина (см.). Хотя общая частота парестезии низка, нельзя сбрасывать со счетов повышенный риск, который, по-видимому, связан с более высокими концентрациями местных анестетиков при использовании для блокады нервов.
Таблица 3
Заболеваемость парестезией в Канаде в 1993 г. 14
В рамках процесса утверждения нового лекарственного препарата в США определенные данные должны быть представлены в Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США.Когда артикаин подавался на утверждение, следующие данные были частью процесса подачи заявки и согласуются с данными Хааса и Леннона. 14 Полный текст документа можно найти, выполнив поиск на веб-сайте Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США в поисках Статистического обзора заявки № 20-971. Глядя на исследование № 96001.02US на странице 12 документа, оно гласит: «И снова группа, принимавшая артикаин, имеет значительно более высокий риск парестезии (10 из 569, vs.1 из 284 в группе лидокаина) ». Таким образом, похоже, что при использовании 4% растворов местных анестетиков возникает беспокойство по поводу парестезии. Как и в случае со всеми лекарствами, каждый практикующий врач должен провести анализ «риск-польза» перед применением лекарства. Только в том случае, если польза от использования артикаина превышает риск для этого практикующего врача, его следует рассматривать для использования. Было бы разумно ограничить использование этих агентов для проникновения и зарезервировать их использование в нервных блоках на случай неудачных попыток с другими агентами.
МАКСИМАЛЬНЫЕ ДОЗЫ ДЛЯ МЕСТНЫХ АНЕСТЕТИКОВ
Последний вопрос, который необходимо рассмотреть, — это максимальное количество анестетика, которое можно использовать для данного пациента. Согласно данным, первоначально представленным Скоттом и соавторами, 2 лидокаин, вводимый подслизистым путем, вызывает системные концентрации в сыворотке крови значительно ниже токсичных уровней. Это примерно количество, содержащееся в 10 картриджах с анестетиком, и это количество принято считать пределом на один прием у стоматолога. Резюме этих и других исследований, касающихся дополнительных местных анестетиков, являются основой для максимальных рекомендуемых доз, перечисленных в.Но текущая информация не затрагивает вопросы, касающиеся длительных стоматологических процедур, которые могут значительно продлиться дольше, чем анестезия, проводимая обычными средствами. В таких случаях решения относительно дополнительных доз должны основываться на эмпирическом суждении.
Период полувыведения из сыворотки (T 1/2 ) различных местных анестетиков составляет от 90 минут для обычных агентов, таких как лидокаин, до почти 300 минут для таких агентов, как бупивакаин. Это снижение начинается после достижения максимальной концентрации и уменьшается примерно через 20–30 минут с применением одних только анестетиков.(Время достижения максимальной концентрации в сочетании с вазопрессорами не подтверждено документально, но добавление дополнительных 10–15 минут было бы разумной оценкой.) Как только максимальная концентрация будет достигнута, дополнительные дозы будут поглощены, поскольку исходные дозы уменьшаются. Это опасное время, потому что невозможно точно предсказать концентрацию в сыворотке в любой период. Кроме того, индивидуальные значения пациентов не могут быть известны полностью из-за колоколообразной формы распределения ответов пациентов, что делает эти теоретические расчеты еще более проблематичными.Однако, учитывая тот факт, что растворы, содержащие вазопрессоры, всасываются медленно и их пиковые концентрации снижаются, кажется разумным предположить, что дозы, не превышающие одной четвертой максимальной допустимой дозы, указанной в таблице, можно вводить в течение каждого последующего часа лечения. Это предположение предполагает, что у пациента адекватная перфузия и функция печени, и он не получает лекарств, замедляющих печеночный клиренс. Однако во время длительных процедур следует провести анестезию и завершить лечение в одной области, прежде чем проводить анестезию в другой.Следуя этому принципу, редко бывает необходимо превышать максимальные рекомендуемые пределы. При использовании комбинации агентов рекомендации по максимальным дозам следует рассматривать как дополнительные. Например, если была введена половина максимальной дозы лидокаина, было бы безопасно вводить до половины максимальной дозы мепивакаина.
ВАЗОПРЕССОРЫ
Вазопрессоры в сочетании с местными анестетиками обеспечивают локальный гемостаз в операционном поле и задерживают их всасывание.Задержка всасывания местных анестетиков не только снижает риск системной токсичности, но и увеличивает продолжительность анестезии. Адреналин является наиболее распространенным агентом, используемым для этой цели, несмотря на то, что он проявляет значительную сердечную стимуляцию из-за его агонистического действия бета-1 в дополнение к его желаемой сосудосуживающей активности (агонистическое действие альфа-1).
Несмотря на популярность адреналина 1: 100 000, его концентрации> 1: 200 000 (5 мкг / мл) не дают никаких преимуществ с точки зрения продления анестезии или снижения концентрации местной анестезии в сыворотке.Более высокие концентрации не обеспечивают лучшего начала или продолжительности блокады нижнего альвеолярного нерва 15 , 16 и не снижают концентрации местного анестетика в сыворотке. 2 Однако более высокие концентрации (например, 1: 100 000 [10 мкг / мл] и 1: 50 000 [20 мкг / мл]) могут обеспечить лучший гемостаз в области хирургического вмешательства, когда это влияние желательно.
Чтобы правильно решить вопросы безопасности вазопрессоров, нужно прежде всего понять принципы расчета доз.Растворы, выраженные в виде соотношений, представляют собой граммы растворенного вещества (лекарственного средства), растворенного в миллилитрах растворителя. Адреналин в концентрации 1: 100 000 содержит 1 г адреналина, растворенного в 100 000 мл растворителя. Преобразование этого количества в миллиграммы или микрограммы на миллилитр занимает много времени. Эта концентрация чаще всего встречается в растворах местных анестетиков и лучше всего запоминается как 10 мкг / мл. Если принять ранее высказанное предположение о том, что картриджи содержат 2 мл, из этого следует, что картридж местного анестетика в сочетании с адреналином 1: 100 000 содержит ~ 20 мкг адреналина.Просто удвойте это количество при использовании растворов, содержащих адреналин 1: 50 000, и уменьшите вдвое те, которые содержат адреналин в концентрации 1: 200 000.
Продолжаются дискуссии о вредном влиянии вазопрессоров на пациентов с сердечно-сосудистыми заболеваниями. Клинические испытания однозначно подтвердили, что даже небольшие дозы адреналина в растворах местных анестетиков влияют на сердечно-сосудистую функцию (см.). Dionne et al. 17 изучали влияние 3 картриджей 2% лидокаина с адреналином 1: 100 000 (~ 60 мкг или точно 54 мкг адреналина).Подслизистая инъекция этой дозы увеличивала сердечный выброс, частоту сердечных сокращений и ударный объем. Периферическое сопротивление снизилось, а среднее артериальное давление практически не изменилось. Этот результат согласуется с данными об инфузиях адреналина 10 мкг / мин, представленными в стандартных текстах. 18 Вопрос, который мы должны решить, заключается в том, представляют ли эти влияния значительный риск для пациентов с сердечно-сосудистыми заболеваниями. Предполагаемые стандарты и руководства продолжают предлагаться, но на самом деле все они анекдотичны.В конечном итоге для принятия решения стоматолог должен вынести здравое клиническое суждение, основанное на тщательном анализе каждого рассматриваемого пациента. Если показана консультация с врачом пациента, обсудите ожидаемый диапазон доз в микрограммах, а не в концентрациях или картриджах. Например, если планируется 2–4 картриджа с местным анестетиком, объясните, что вы будете использовать 40–80 мкг адреналина, инфильтрованного под слизистую оболочку, а не 2–4 картриджа с адреналином 1: 100 000. Врач не знаком с дозой, выраженной в картриджах или концентрациях.Для справки: обычная доза адреналина при аллергических реакциях составляет 0,3 мг или 300 мкг.
Сердечно-сосудистые влияния адреналина. Пациенты получили подслизистую инфильтрацию 3 картриджей (5,4 мл) 2% лидокаина и 2% лидокаина с адреналином 1: 100 000. Изменения сердечно-сосудистых параметров регистрировались как процентное изменение. Частота сердечных сокращений (ЧСС), ударный объем (УО) и сердечный выброс (СО) определяют систолическое артериальное давление. Периферическое сопротивление (PR) определяет диастолическое артериальное давление.Среднее артериальное давление (САД) рассчитывается как (САД + 2 × ДАД) / 3. По материалам Dionne et al. 17
Левонордефрин (НеоКобефрин) — вазопрессор в сочетании с 2% растворами мепивакаина в США. Он больше похож на норадреналин, чем на адреналин, и не обладает активностью в отношении рецепторов бета 2 . Адреналин увеличивает частоту сердечных сокращений и систолическое давление, но снижает диастолическое давление. Напротив, системное введение норадреналина увеличивает систолическое, диастолическое и среднее артериальное давление, что вызывает рефлекторное замедление сердечного ритма. 18 (Это проиллюстрировано и объяснено в.) Левонордефрин был предложен в качестве альтернативы местным анестетикам, содержащим адреналин, при лечении пациентов с сердечно-сосудистыми заболеваниями сердца, поскольку он не увеличивает частоту сердечных сокращений. Однако защитники не принимают во внимание его нежелательное влияние на артериальное давление. Концентрация левонордефрина 1: 20 000, обнаруженная в мепивакаине, считается эквивалентной стандартной концентрации адреналина 1: 100 000 с точки зрения активности альфа-рецепторов (сужение сосудов).После инфильтрации они обладают эквивалентной эффективностью для сужения подслизистых сосудов, и их влияние на местное кровотечение и абсорбцию анестетика одинаково.
Сердечно-сосудистые влияния норадреналина (и левонордефрина) по сравнению с адреналином. 18 A. Оба препарата стимулируют рецепторы бета 1 в сердечной мышце, что увеличивает сократимость миокарда. Это приводит к повышению систолического давления. Б. Оба препарата стимулируют альфа-рецепторы сосудов, что приводит к их сужению.Подслизистые сосуды содержат только альфа-рецепторы, поэтому оба препарата вызывают локальное сужение сосудов при подслизистом введении. Но подслизистые сосуды здесь не показаны; они не влияют на диастолическое давление. Системные артерии влияют на диастолическое давление и содержат рецепторы бета 2 , которые расширяют сосуды, и их гораздо больше, чем рецепторов альфа. Норэпинефрин не имеет сродства к рецепторам бета 2 и сужает системные артерии за счет активации альфа-рецепторов, хотя их меньше.Это увеличивает диастолическое давление. Адреналин, который имеет бета 2 , а также активность альфа-рецепторов, вызывает расширение сосудов и снижение диастолического давления. C. Оба препарата стимулируют рецепторы бета--1 в сино-предсердном узле, что увеличивает частоту сердечных сокращений. Но этот потенциальный эффект от норэпинефрина перекрывается рефлексом, который объясняется следующим образом. Обратите внимание, что адреналин не влияет на среднее артериальное давление; систолическое давление увеличивается, но диастолическое уменьшается и сводит на нет какое-либо влияние на среднее артериальное давление.Норэпинефрин увеличивает систолическое, диастолическое и среднее артериальное давление. Повышение среднего артериального давления стимулирует барорецепторы в каротидном синусе, которые вызывают вагусное замедление сердечного ритма.
Заблуждения относительно неблагоприятных взаимодействий между вазопрессорами и антидепрессантами сохраняются, несмотря на литературу, которая развеивает эту озабоченность. Большинство из этих опасений связано с фармакокинетическими взаимодействиями, обусловленными клиренсом катехоламинов. Хотя нейрональное поглощение является основным методом прекращения действия эндогенных адренергических нейромедиаторов, биотрансформация в печени является основным путем прекращения приема экзогенно вводимых адренергических препаратов. 18 Большинство некатехоламинов метаболизируются в печени моноаминоксидазой, но те, которые имеют структуру катехоламинов, в первую очередь инактивируются катехол-о-метилтрансферазой. Адреналин и левонордефрин являются катехоламинами и метаболизируются в основном катехол-о-метилтрансферазой, а не моноаминоксидазой или нейрональным захватом. 18 , 19 Пациентам, получавшим ингибиторы моноаминоксидазы, ничто не мешает избавиться от любого из этих вазопрессоров. 11 Новые антидепрессанты (например, флуоксетин [прозак]) избирательно подавляют обратный захват серотонина и также не вызывают беспокойства. Хотя они не противопоказаны полностью, вазопрессоры, тем не менее, следует применять с осторожностью у пациентов, получающих трициклические антидепрессанты. Этот конкретный класс антидепрессантов обладает способностью вызывать сердечную аритмию, которая может быть усилена аналогичной тенденцией, присущей всем симпатомиметическим агентам. У этих пациентов следует постоянно контролировать жизненные показатели, если используется более 1 или 2 картриджей, содержащих какой-либо вазопрессор.
Пациенты, принимающие неселективные бета-блокаторы, имеют повышенную чувствительность к системным эффектам вазопрессоров. 20 Бета-блокаторы используются из-за их способности блокировать симпатические влияния на сердечные бета-рецепторы 1 . К сожалению, старые агенты неселективны и также блокируют рецепторы бета 2 на системных артериях. Это компенсирует тенденцию адреналина к расширению и вместо этого увеличивает системное сосудистое сопротивление. Артериальное давление резко повышается и сопровождается рефлекторным замедлением сердечного ритма.Механизм этого взаимодействия подробно описан в и. В медицинской литературе сообщалось о многочисленных сообщениях об инсульте и остановке сердца, предупреждающих об этом потенциальном взаимодействии. 21 , 22 Сообщалось о гипертонических реакциях после низких доз адреналина и левонордефрина. 23 Существенно, что это взаимодействие не будет происходить у пациентов, получающих селективные бета-антагонисты 1 , потому что при обычных дозах они имеют небольшое сродство к сосудистым бета-рецепторам 2 или совсем не имеют его.Тем не менее, следует проявлять осторожность, поскольку предполагаемая селективность в отношении рецепторов бета--1 не может быть абсолютной, особенно у пациентов, принимающих лекарства в высоких дозах. Ниже приведены 2 рекомендации, которые следует учитывать при использовании вазопрессоров у пациентов, принимающих бета-адреноблокаторы:
-
По возможности избегайте использования вазопрессоров.
-
Если будет использоваться вазопрессор, запишите артериальное давление и частоту сердечных сокращений, а затем действуйте следующим образом: (a) после инъекции каждого картриджа сделайте паузу в 5 минут и повторно оцените жизненно важные функции перед введением любого дополнительного местного анестетика; или (b) инфильтрируют всю область, подлежащую лечению, с помощью картриджа, чтобы обеспечить сужение местных сосудов, затем повторно вводят в область местный анестетик, не содержащий вазопрессора.
Механизм взаимодействия адреналина и бета-адреноблокаторов. Сердечно-сосудистые влияния адреналина опосредуются рецепторами альфа, бета-1 и бета-2 и изменяются у пациентов, принимающих неселективные бета-блокаторы. На этих графиках различаются типичные сердечно-сосудистые реакции на тестовую дозу адреналина от 10 до 20 мкг у нормального пациента по сравнению с пациентом с бета-блокировкой (см. Дополнительные пояснения). Обратите внимание, что ключевой механизм включает влияние адреналина на системное сосудистое сопротивление и последующее диастолическое артериальное давление (ДАД).
Таблица 4
Механизм взаимодействия адреналина и неселективных бета-блокаторов (см. Иллюстрацию)
Наконец, следует уделить внимание максимально допустимым дозам вазопрессоров. Выражать ограничения в виде назначений нецелесообразно; Время лечения может составлять от 30 минут до 3-4 часов. Влияние данной дозы адреналина на пациентов сильно различается. Пиковые уровни адреналина в сыворотке после подслизистой инъекции обычно достигаются в течение 5 минут и быстро снижаются из-за инактивации катехол-о-метилтрансферазой.Как правило, гемодинамическое влияние адреналина наблюдается в течение нескольких минут после инъекции и полностью исчезает через 20 минут. Доза 40 мкг (примерно 2 картриджа, содержащие адреналин 1: 100 000) является наиболее консервативным и часто упоминаемым ограничением дозы адреналина у пациентов со значительными сердечно-сосудистыми заболеваниями. Следует уточнить, что это руководство более точно отражает 30-минутные периоды времени, а не встречи. Более разумное предложение должно основываться на оценке пациента, а не на максимальной дозе.Если по какой-либо причине медицинский статус пациента вызывает сомнение, повторно оцените показатели жизненно важных функций в течение 5 минут после введения каждого картриджа. Если состояние пациента стабильно, могут быть введены дополнительные дозы с последующей аналогичной переоценкой.
ВОПРОСЫ ДЛЯ ПРОДОЛЖЕНИЯ ОБРАЗОВАНИЯ
-
Beckercaine — недавно выпущенный местный анестетик, классифицируемый как сложный эфир и смешанный с адреналином 1: 200 000. Он имеет вдвое большую растворимость в липидах, чем лидокаин, и другие данные являются следующими, с соответствующими данными для лидокаина в скобках: pKa = 7.5 (7,9) Связывание с белками 92% (65%). В отношении этого нового чудо-лекарства все следующее является правильным, ЗА ИСКЛЮЧЕНИЕМ:
-
Вероятно, это 1% раствор.
-
Начинается быстрее, чем лидокаин.
-
Метаболизируется в плазме.
-
Он имеет более короткую продолжительность действия, чем лидокаин.
-
-
Что из следующего отражает точные дозы, содержащиеся в 5 мл (~ 2,5 картриджа) 4% прилокаина с 1: 200 000 адреналина?
-
Прилокаин 20 мг; адреналин 50 мкг.
-
Прилокаин 200 мг; адреналин 25 мкг.
-
Прилокаин 20 мг; адреналин 25 мкг.
-
Прилокаин 200 мг; адреналин 10 мкг.
-
-
Гипертензивные события, связанные с взаимодействием лекарств, произошли после введения местных анестетиков, содержащих адреналин, у пациентов, получавших лекарственные препараты с помощью какого из следующего?
-
Неселективные бета-блокаторы.
-
Антидепрессанты MAOI.
-
Антидепрессанты СИОЗС.
-
a и b верны.
-
a, b и c верны.
-
-
Максимальная рекомендуемая доза составляет 500 мг для лидокаина с адреналином и 400 мг для мепивакаина. Анестезию получить сложно, и вы ввели 6 картриджей 2% лидокаина с адреналином, чтобы удалить 4 третьих моляра. Два участка остаются чувствительными, и вы выбираете повторную инъекцию 3% мепивакаина, чтобы избежать большего количества адреналина.Какое из следующего количества картриджей было бы максимальным количеством, которое вы можете безопасно использовать? (Предположим, 2 мл на картридж.)
-
1
-
3
-
5
-
7
-
ССЫЛКИ
- Goodson JM, Moore PA. Опасные для жизни реакции после педодонтической седации: оценка взаимодействия наркотиков, местных анестетиков и противорвотных препаратов. J Am Dent Assoc. 1983; 107: 239–245.[PubMed] [Google Scholar]
- Скотт Д. Б., Джебсон П. Дж. Р., Брейд Д. П. и др. Факторы, влияющие на уровни лигнокаина и прилокаина в плазме. Br J Anaesth. 1972; 44: 1040–1049. [PubMed] [Google Scholar]
- Прчал Дж. Т., Грегг X. Гемоглобинопатии: метгемоблобинемии, полицитемии и нестабильные гемоглобины. В: Гольдман Л., Аузиелло Д., редакторы. Сесил Учебник медицины. 22-е изд. Филадельфия, Пенсильвания: WB Saunders Co; 2004. [Google Scholar]
- Gall H, Kaufmann R, Kalveram CM. Побочные реакции на местные анестетики: проанализировано 197 случаев.J Allergy Clin Immunol. 1996; 97: 933–937. [PubMed] [Google Scholar]
- Беркун Ю., Бен-Цви А., Леви Ю., Галили Д., Шалит М. Оценка побочных реакций на местные анестетики: опыт с 236 пациентами. Ann Allergy Asthma Immunol. 2003. 91: 342–345. [PubMed] [Google Scholar]
- Шац М. Побочные реакции на местные анестетики. Immunol Allergy Clin North Am. 1992; 12: 585–609. [Google Scholar]
- Адкинсон Н.Ф., мл. Лекарственная аллергия. В: Адкинсон Н. Ф. младший, Юнгингер Дж. В., Бусс В. В., редакторы.Аллергия Миддлтона: принципы и практика. 6-е изд. Филадельфия, Пенсильвания: Мосби Инк; 2003. et al, eds. [Google Scholar]
- Моррис Р., Маккей В., Мушлин П. Сравнение боли, связанной с внутрикожной и подкожной инфильтрацией с помощью различных растворов местных анестетиков. Anesth Analg. 1987; 66: 1180–1182. [PubMed] [Google Scholar]
- Вал М.Дж., Овертон Д., Хауэлл Дж., Сигель Э., Шмитт М.М., Малдун М. Боль при инъекции простого прилокаина по сравнению с лидокаином с эпинефрином. Проспективное двойное слепое исследование.J Am Dent Assoc. 2001; 132: 1396–1401. [PubMed] [Google Scholar]
- Валь М.Дж., Шмитт М.М., Овертон Д.А., Гордон М.К. Боль при инъекции бупивакаина с адреналином по сравнению с простым прилокаином. J Am Dent Assoc. 2002; 133: 1652–1656. [PubMed] [Google Scholar]
- Yagiela JA. Местные анестетики. В: Dionne RA, Phero JP, Becker DE, редакторы. Управление болью и тревогой в стоматологическом кабинете. Сент-Луис, Миссури: WB Saunders / Elsevier Science; 2002. [Google Scholar]
- Маламед С.Ф., Ганьон С., Леблан Д.Эффективность артикаина: новый амидный местный анестетик. J Am Dent Assoc. 2000; 131: 635–642. [PubMed] [Google Scholar]
- Mikesell P, Nusstein J, Reader A, Beck M, Weaver J. Сравнение артикаина и лидокаина при блокаде нижних альвеолярных нервов. Дж. Эндод. 2005; 31: 265–270. [PubMed] [Google Scholar]
- Хаас Д.А., Леннон Д. 21-летнее ретроспективное исследование сообщений о парестезии после местного анестетика. J Can Dent Assoc. 1995; 61: 319–330. [PubMed] [Google Scholar]
- Дагер Ф. Б., Яред Г. М., Махту П.Оценка 2% -ного лидокаина с различными концентрациями адреналина для блокады нижнего альвеолярного нерва. Дж. Эндод. 1997; 23: 178–180. [PubMed] [Google Scholar]
- Тофоли Г. Р., Рамачато Дж. К., де Оливейра ПК. Сравнение эффективности 4% артикаина в сочетании с адреналином 1: 100 000 или 1: 200 000 при блокаде нижнего альвеолярного нерва. Anesth Prog. 2003. 50: 164–168. и другие. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Дионн Р.А., Гольдштейн Д.С., Вирдзек PR. Влияние премедикации диазепамом и местного анестетика, содержащего адреналин, на сердечно-сосудистую систему и реакцию катехоламинов на оральную хирургию.Anesth Analg. 1984. 63: 640–646. [PubMed] [Google Scholar]
- Хоффман BB. Катехоламины, симпатомиметические препараты и антагонисты адренергических рецепторов. В: Hardman JG, Limbird LE, Gilman AG, редакторы. Гудман и Гилман «Фармакологические основы терапии». 10-е изд. Нью-Йорк, штат Нью-Йорк: Макгроу-Хилл; 2001. [Google Scholar]
- Lawson NW, Meyer DJ. Физиология и фармакология вегетативной нервной системы. В: Бараш П.Г., Каллен Б.Ф., Стултинг Р.К., редакторы. Клиническая анестезия. 3-е изд. Филадельфия, Пенсильвания: JB Lippincott Co; 1997 г.[Google Scholar]
- Becker DE. Клинические последствия вегетативной фармакологии. J Oral Maxillofac Surg. 1992; 50: 734–740. [PubMed] [Google Scholar]
- Foster CA, Aston SJ. Взаимодействие пропранолола и адреналина: потенциальная катастрофа. Plast Reconstr Surg. 1983; 72: 74–78. [PubMed] [Google Scholar]
- Gandy W. Тяжелое взаимодействие адреналина и пропранолола. Ann Emerg Med. 1989; 18: 98–99. [PubMed] [Google Scholar]
- Mito RS, Yagiela JA. Гипертоническая реакция на левонордефрин у пациента, получающего пропранолол: отчет о случае.J Am Dent Assoc. 1988. 116: 55–57. [PubMed] [Google Scholar]
Местные анестетики: обзор фармакологических соображений
Abstract
Местные анестетики обладают впечатляющей историей эффективности и безопасности в медицинской и стоматологической практике. Их использование настолько рутинно, а побочные эффекты настолько редки, что медицинские работники могут по понятным причинам упустить из виду многие из своих фармакотерапевтических принципов. Цель этой статьи для повышения квалификации — предоставить обзор и обновить основную фармакологию для различных местных анестетиков, используемых в настоящее время.Технические соображения будут рассмотрены в следующей статье.
Ключевые слова: Местные анестетики, Фармакология, Лекарственная токсичность, Стоматология
Местные анестетики прерывают нервную проводимость, подавляя приток ионов натрия через каналы или ионофоры в мембранах нейронов. Обычно эти каналы существуют в состоянии покоя, во время которого ионам натрия запрещен доступ. Когда нейрон стимулируется, канал принимает активированное или открытое состояние, в котором ионы натрия диффундируют в клетку, инициируя деполяризацию.После этого внезапного изменения мембранного напряжения натриевой канал переходит в неактивное состояние, во время которого дальнейший приток запрещается, в то время как активные транспортные механизмы возвращают ионы натрия наружу. После этой реполяризации канал принимает нормальное состояние покоя. Понимание этих состояний натриевых каналов помогает объяснить предпочтительную чувствительность местных анестетиков к различным классам нейронных волокон.
Местные анестетики обладают большим сродством к рецепторам внутри натриевых каналов во время их активированного и инактивированного состояний, чем когда они находятся в состоянии покоя. 1 , 2 Следовательно, нервные волокна с более высокой скоростью возбуждения наиболее восприимчивы к действию местного анестетика. Кроме того, волокна меньшего размера обычно более восприимчивы, потому что данный объем раствора местного анестетика может более легко блокировать необходимое количество натриевых каналов для полного прерывания передачи импульса. По этим причинам наиболее чувствительными являются крошечные, быстрорастущие вегетативные волокна, за ними следуют сенсорные волокна и, наконец, соматические двигательные волокна. 1 , 2 Анестезиолог, блокирующий смешанные спинномозговые нервы, хорошо осведомлен об этой разной чувствительности. По мере того, как пациенты оправляются от спинномозговой анестезии, они сначала восстанавливают произвольную двигательную функцию, затем возвращаются ощущения и, наконец, они могут мочиться (вегетативный контроль). Дантисту обычно не приходится уделять этому внимание, потому что ветви тройничного нерва, анестезируемые при стоматологических процедурах, состоят только из небольших, быстро возбуждающихся сенсорных волокон. Однако многие классы сенсорных волокон также различаются по диаметру и скорости возбуждения.Например, болевые волокна более чувствительны, чем волокна, несущие давление и проприоцепцию. Пациента может по-прежнему беспокоить чувство давления, несмотря на полную анестезию болевых волокон.
ОБЩИЕ СВОЙСТВА МЕСТНЫХ АНЕСТЕТИКОВ
Молекулярная структура всех местных анестетиков состоит из 3 компонентов: (а) липофильное ароматическое кольцо, (б) промежуточная сложноэфирная или амидная связь и (в) третичный амин. Каждый из этих компонентов придает молекуле различные клинические свойства.(См.)
Местноанестезирующий состав.
Эффективность анестетика
Местные анестетики различаются по своей эффективности, что позволяет использовать их в концентрациях от 0,5 до 4%. Это во многом является результатом различий в растворимости липидов, что увеличивает диффузию через нервные оболочки и нервные мембраны. Это свойство определяется ароматическим кольцом и его замещениями, а также замещениями, добавленными к третичному амину. Например, бупивакаин более растворим в липидах и более эффективен, чем артикаин, что позволяет формулировать его как 0.5% концентрация (5 мг / мл), а не 4% концентрация (40 мг / мл).
Время начала действия
Повышенная растворимость лекарства в липидах не только увеличивает эффективность, но и способствует более быстрой диффузии через клеточные мембраны. Для местных анестетиков это ускоряет начало анестезии изолированных волокон во время исследований in vitro, но следует понимать, что клинически играют роль и другие факторы. Например, присущие сосудорасширяющие свойства могут способствовать системной абсорбции до того, как анестетик достигнет нервной оболочки.Высокая растворимость липидов может препятствовать диспергированию в тканевых жидкостях, а также способствовать секвестрации в соседних жировых тканях или миелиновых оболочках. В любом случае меньшее количество молекул достигает нейрональной мембраны, и начало реакции задерживается. Следовательно, в отличие от исследований изолированных волокон in vitro, большая растворимость липидов обычно замедляет наступление анестезии в клинических условиях. Введение более высоких концентраций, которые позволяют большему количеству молекул достигать мембраны и ускоряют наступление, может компенсировать это влияние.Хотя бупивакаин и артикаин хорошо растворимы в липидах, 4% концентрация артикаина обеспечивает гораздо более быстрое начало.
Несмотря на множество факторов, влияющих на количество местного анестетика, достигающего нервных волокон, наиболее важным фактором, определяющим начало анестезии, является пропорция этих молекул, которые находятся в жирорастворимом, а не в водорастворимом состоянии. Конечный амин, проиллюстрированный на, может существовать в третичной форме (3 связи), которая растворима в липидах, или в виде четвертичной формы (4 связи), которая имеет положительный заряд и делает молекулу растворимой в воде.Чтобы основа местного анестетика была стабильной в растворе, ее формулируют в виде гидрохлоридной соли. Таким образом, молекулы существуют в четвертичном, водорастворимом состоянии во время инъекции и не могут проникать в нейрон. Следовательно, время начала местной анестезии напрямую связано с долей молекул, которые превращаются в третичную липидорастворимую структуру при воздействии физиологического pH (7,4). Эта пропорция определяется константой ионизации (pKa) анестетика и рассчитывается с использованием уравнения Хендерсона-Хассельбаха:
Проще говоря, если местный анестетик должен иметь pKa 7.4, и для введения в ткани, имеющие физиологический pH 7,4, 50% молекул будут существовать в четвертичной (катионной) форме и 50% будут существовать в третичной (незаряженной) форме; только половина молекул будет жирорастворимой и сможет проникать в нейрон. К сожалению, pKa для всех местных анестетиков превышает 7,4 (физиологический pH), и поэтому большая часть молекул существует в четвертичной водорастворимой форме при введении в нормальную ткань. Клиническая оговорка заключается в том, что чем выше pKa для местного анестетика, тем меньше молекул доступно в их жирорастворимой форме.Это задержит наступление. Кроме того, кислая среда, связанная с воспаленными тканями, снижает их pH значительно ниже 7,4 и еще больше способствует четвертичной водорастворимой конфигурации. Это было предложено как одно из объяснений трудностей при попытке обезболить воспаленные или инфицированные ткани. 1 , 2 В этих ситуациях, например, бупивакаин (pKa 8,1) менее желателен, чем мепивакаин (pKa 7,6).
Следует уточнить, однако, что как только третичные молекулы попадают в нейрон, они реионизируются в четвертичную форму, что считается фактической блокадой натриевого канала.Последовательность событий, которая приводит к нервной блокаде, проиллюстрирована на рисунке.
Местное обезболивающее. Введенный местный анестетик находится в равновесии в виде четвертичной соли (BH + ) и третичного основания (B). Доля каждого из них определяется pKa анестетика и pH ткани. Жирорастворимое основание (B) необходимо для проникновения как в эпиневрий, так и в нейрональную мембрану. Как только молекула достигает аксоплазмы нейрона, амин получает ион водорода, и эта ионизированная четвертичная форма (BH + ) отвечает за фактическую блокаду натриевого канала.Равновесие между (BH + ) и (B) определяется pH тканей и pKa анестетика (pH / pKa).
Метаболизм и выведение
Промежуточная цепочка или звено обеспечивает удобную основу для классификации местных анестетиков, а также определяет характер их выведения. Амиды биотрансформируются в печени, но сложные эфиры гидролизуются в кровотоке эстеразами плазмы. Местные анестетики на основе сложного эфира больше не упаковываются в стоматологические картриджи и используются нечасто, за исключением бензокаина, который содержится в некоторых местных анестетических препаратах.Артикаин в этом отношении уникален. Он классифицируется как амид в соответствии с его промежуточной связью, но также содержит боковую цепь сложного эфира на своем ароматическом кольце. Гидролиз этой боковой цепи делает молекулу неактивной, и поэтому она удаляется аналогично сложноэфирным анестетикам.
Продолжительность действия
Местные анестетики различаются по продолжительности действия в основном из-за различий в их сродстве к белку. Как и большинство лекарств, местные анестетики обратимо связываются с белками плазмы, циркулируя в кровотоке.Это свойство выражается в процентах циркулирующего лекарственного средства, связанного с белком, и было обнаружено, что оно также коррелирует со сродством анестетика к белку в натриевых каналах. Чем выше тенденция к связыванию белков, тем дольше анестетик будет выдерживать нервную блокаду. Например, бупивакаин демонстрирует 95% связывания с белками по сравнению с 55% для мепивакаина, и это объясняется разницей в продолжительности их нервной блокады.
Продолжительность анестезии также зависит от времени, в течение которого местный анестетик остается в непосредственной близости от нервных волокон.Локальная секвестрация высоколипидорастворимых анестетиков может обеспечить постоянное высвобождение к мембранам нейронов, увеличивая продолжительность действия, но сужение соседней сосудистой сети более значимо в этом отношении. По этой причине во многие препараты добавляют вазопрессоры, чтобы замедлить абсорбцию и продлить анестезию. Это особенно важно, потому что сами местные анестетики различаются по своей способности вызывать расширение сосудов. Например, при использовании без вазопрессоров лидокаин сокращает свою продолжительность за счет расширения местной сосудистой сети, в то время как мепивакаин и бупивакаин этого не делают.Составы простого лидокаина могут быть полезны для кратковременных процедур после инфильтрации, но их эффективность при блокаде нерва невысока.
ТОКСИЧНОСТЬ МЕСТНЫХ АНЕСТЕТИКОВ
Системная токсичность, приписываемая местным анестетикам, зависит от дозы, но понимание этих доз не всегда является простым делом. К сожалению, использование картриджей с анестетиком в стоматологии привело к небрежности в оценке фактического количества анестетика, которое мы вводим нашим пациентам. К сожалению, эту практику продолжают развивать во время бакалавриата и во многих уважаемых стоматологических публикациях.Стоматологический картридж представляет собой объем, а не дозу, которую более правильно выражать в миллиграммах или микрограммах. Кроме того, стоматологические картриджи часто содержат 2 препарата: местный анестетик и вазопрессор, каждый из которых имеет отдельную дозу. Еще больше усложняет ситуацию то, что стоматологические картриджи содержат особые объемы, такие как 1,7 или 1,8 мл. Сумма этих проблем делает попытки вычислений реальных дозировок и позволяет запоминать количества на картридж, а не фактическую оценку правильных доз. Эта практика еще больше усложняется, когда картриджи содержат различные концентрации местных анестетиков и вазопрессоров.Чтобы упростить расчет дозировки, разумно отказаться от концепции картриджей и считать, что каждый из них содержит 2 мл объема. Это приведет к завышению количества, вводимого пациенту, что является безопасной практикой. Например, когда было введено 4½ картриджа, оцените его как 9 мл. Эту единицу объема легче преобразовать в приблизительную дозу каждого лекарства в миллиграммах или микрограммах, как показано на.
Таблица 1.
Приблизительные дозы *
По мере всасывания местных анестетиков из места инъекции их концентрация в кровотоке повышается, а периферическая нервная система и центральная нервная система (ЦНС) подавляются в зависимости от дозы. манера.(См.) Низкие сывороточные концентрации используются клинически для подавления сердечных аритмий и статусных судорог, но, по иронии судьбы, более высокие концентрации вызывают судорожную активность. Судорожные припадки являются первоначальным опасным для жизни последствием передозировки местного анестетика. Предположительно, это происходит из-за избирательного угнетения центральных тормозных путей, которые позволяют возбуждающим трактам работать безумно. По мере того, как концентрации в сыворотке продолжают расти, все метаболические пути ингибируются, что приводит к коме, остановке дыхания и, в конечном итоге, сердечно-сосудистому коллапсу.Признаки токсичности лидокаина могут проявляться при концентрациях> 5 мкг / мл, но для судорожных припадков обычно требуются концентрации> 10 мкг / мл.
Приблизительные концентрации лидокаина в сыворотке и системные эффекты.
Важно, чтобы местные анестетики считались депрессантами ЦНС, и они потенцируют любое угнетение дыхания, связанное с седативными средствами и опиоидами. Кроме того, сывороточные концентрации, необходимые для возникновения судорог, ниже, если присутствует гиперкарбия (повышенный уровень углекислого газа).Это тот случай, когда угнетение дыхания вызывается одновременным приемом седативных средств и опиоидов. Гудсон и Мур задокументировали катастрофические последствия взаимодействия этого лекарственного средства у педиатрических пациентов, получающих процедурную седацию, наряду с чрезмерными дозами местных анестетиков. 3
Хотя все местные анестетики несут сравнимый риск токсичности для ЦНС, следует отметить, что бупивакаин проявляет больший потенциал прямой сердечной токсичности, чем другие агенты. 1 , 2 Объяснение не полностью установлено, но считается, что оно связано с тем фактом, что бупивакаин имеет большее сродство к неактивным и покоящимся конфигурациям натриевых каналов и медленнее диссоциирует от этих каналов. Это задерживает восстановление от потенциалов действия, делая сердечные ткани восприимчивыми к аритмиям. Это беспокойство актуально при определенных медицинских процедурах, во время которых бупивакаин вводят в очень высоких дозах. Никогда не было обнаружено, что это происходит при дозах до максимальных, рекомендованных для стоматологической анестезии.
Возникает очевидный вопрос: какая системная концентрация в сыворотке крови следует за введением определенной дозы местного анестетика. В 1972 году Скотт и др. Опубликовали одно из серии знаковых клинических исследований, оценивающих переменные, которые определяют последующие концентрации лидокаина и прилокаина в сыворотке. 4 Неудивительно, что концентрации в сыворотке крови менялись в зависимости от относительной васкулярности тканей, в которые вводили анестетик. При использовании лидокаина в дозе 400 мг самые высокие уровни в сыворотке наблюдались при последующей инфильтрации слизистой оболочки влагалища, а самые низкие — при подкожной инфильтрации брюшной полости.Однако в каждом случае пиковый уровень в сыворотке крови наблюдался через 20–30 минут после инъекции только лидокаина. Независимо от способа введения пиковые уровни были снижены, а скорость абсорбции замедлена путем добавления 1 200 000 эпинефрина к раствору местного анестетика. Разумно предположить, что системные концентрации после подслизистой инъекции в ротовую полость будут приближаться к таковым после инъекции в слизистую оболочку влагалища из-за аналогичной васкулярности. К сожалению, очень мало стоматологических исследований, посвященных более высоким дозам местных анестетиков.Однако Hersh et al. 5 опубликовали впечатляющее исследование, в котором были получены сопоставимые результаты после нескольких внутриротовых инъекций в общей сложности 7 картриджей (1,7 мл каждый = ∼480 мг) артикаина, содержащего адреналин 1 ∶ 200 000. (См.) Можно разумно заключить, что соблюдение опубликованных максимальных рекомендуемых доз для местных анестетиков не приведет к системным уровням в сыворотке крови, приближающимся к уровням, связанным с токсичностью.
Концентрации местного анестетика в сыворотке крови. (См. Текст для объяснения.По материалам Scott et al. 4 и Hersh et al. 5 )
Дополнительные переменные также рассматривались Скоттом и др. 4 Как и ожидалось, дозировка и скорость инъекции были напрямую связаны с концентрацией в сыворотке. Концентрация раствора, например, 2% против 4%, не имела значения; концентрации в сыворотке были связаны с общей дозировкой. Введение 20 мл 2% или 10 мл 4% (400 мг) привело к такой же концентрации в сыворотке. При использовании лидокаина или других анестетиков, независимо от их концентрации, необходимо учитывать введенную дозу (миллиграммы), а не объем (миллилитры или картриджи).
Вопреки общепринятому мнению, возраст или вес пациента не позволяют предсказать системную концентрацию в сыворотке после доз, рассчитанных в миллиграммах на возраст (годы) или миллиграммах на килограмм. Однако при ведении педиатрических пациентов максимальные дозировки обычно выражаются в мг / кг, и это следует соблюдать в качестве меры предосторожности. Однако это не имеет большого значения для взрослых, и следует придерживаться рекомендаций, выраженных в максимальной дозе в миллиграммах, независимо от веса и возраста.Очевидно, это максимальное количество не должно превышаться при расчете доз в мг / кг для больших детей.
При рассмотрении токсичности любого класса наркотиков следует помнить о метаболитах, а также о исходном лекарстве. Метаболит прилокаина, или -толуидин, может окислять железо в гемоглобине от двухвалентного (Fe 2+ ) до трехвалентного (Fe 3+ ). Измененные таким образом гемы не связывают кислород, а нормальные гемы на одной и той же молекуле гемоглобина с трудом выделяют свой кислород.Эта форма гемоглобина называется метгемоглобином, и когда таким образом изменяется> 1% общего гемоглобина, состояние называется метгемоглобинемией. Пациенты выглядят синюшными и становятся симптоматичными, когда доля метгемоглобина превышает 15%. 6 Насыщение гемоглобина по данным пульсоксиметрии (SpO 2 ) будет снижаться, несмотря на клинические доказательства эффективной оксигенации и вентиляции. Например, показания пульсоксиметра могут быть <90%, но фактическое давление кислорода в артериальной крови (PaO 2 ) может находиться в пределах нормы (> 80 мм рт.Состояние становится опасным для жизни, когда уровень метгемоглобина превышает 50–60%, и лечится с помощью внутривенного введения метиленового синего, который восстанавливает гем до нормального состояния. Маловероятно, что метгемоглобинемия, связанная с прилокаином, возникнет после приема рекомендуемых доз. Редко можно встретить пациента с наследственной метгемоглобинемией, что противопоказано к применению прилокаина.
Аллергия на местные анестетики
Пациенты часто заявляют, что у них аллергия на местные анестетики.Однако после тщательного опроса обычно выясняется, что они испытали либо обморок, связанный с инъекцией, либо учащенное сердцебиение, связанное с адреналином, содержащимся в растворе или высвобожденным эндогенно. Аллергические реакции после инъекций местного анестетика, скорее всего, связаны с консервантами (метилпарабен) или антиоксидантами (сульфиты), содержащимися в растворе. 7 Метилпарабен включен в многодозовые флаконы для предотвращения роста микробов.Его больше нет во флаконах с одной дозой или стоматологических картриджах. Сульфиты предотвращают окисление вазопрессоров и входят только в те стоматологические картриджи, содержащие адреналин или левонордефрин.
Аллергические реакции вызываются иммунными механизмами, посредством которых лимфоциты сенсибилизируются к антигену и при последующем воздействии опосредуют ряд патофизиологических изменений. Гелл и Кумбс сначала отнесли реакции гиперчувствительности (аллергические) к типам от I до IV, основываясь на различных иммунологических механизмах. 8 Реакции типа I возникают в течение нескольких минут после провокации и опосредуются антителами или иммуноглобулином Е (IgE), продуцируемым В-лимфоцитами. Это тип, который чаще всего провоцируется компонентами местных анестетиков. Реакции типа 4 задерживаются на несколько дней после провокации и опосредуются сенсибилизированными Т-лимфоцитами. Этот тип реакции на местные анестетики бывает очень редко.
Чтобы лекарства были иммуногенными, они должны иметь большую молекулярную массу и обладать множественными валентностями, чтобы их могли распознать иммунные клетки. 9 Крупные белки, такие как инсулин животного происхождения, удовлетворяют этим требованиям и хорошо зарекомендовали себя как иммуногенные. Большинство молекул лекарств слишком малы и фактически объединяются с другими молекулами, которые действуют как носители, вызывая аллергическую реакцию. В случае сульфонамидных антибиотиков, например, фенильное кольцо, содержащее аминное замещение, является виновником образования иммуногенного комплекса. Этот фрагмент является общим для других производных парааминобензойной кислоты (ПАБК), таких как метилпарабен и некоторых, но не всех, сложноэфирных местных анестетиков.В этих случаях может существовать потенциал перекрестной аллергенности, поскольку они имеют общую молекулярную структуру, например сульфамидные антибиотики, метилпарабен и сложные эфиры ПАБК.
Говоря о местных анестетиках, неразумно называть сложные эфиры более аллергенными, чем амиды. Сложный эфир представляет собой просто химическую связь и не придает соединению иммуногенности. Скорее всего, виноват молекулярный компонент, соединенный этой связью. Это заблуждение привело к тому, что некоторые агенты были ошибочно названы перекрестно аллергенными с сульфонамидными антибиотиками.Артикаин классифицируется как амидный местный анестетик из-за связи между его жирорастворимым кольцом и концевым амином. Его тиофеновое кольцо содержит атом серы, который не обладает иммуногенными свойствами, и боковую цепь сложного эфира, которая делает соединение неактивным после гидролиза. Однако артикаин не высвобождает метаболит, напоминающий ПАБК, и не вызывает опасений относительно перекрестной иммуногенности с сульфаниламидами. Напротив, прокаин является представителем сложных эфиров, полученных из ПАБК, и гидролиз высвобождает фрагмент, который является потенциально иммуногенным ().
Молекулярные структуры и аллергенность. Иммуногенность объясняется лекарствами, имеющими фенильное кольцо с пара-аминным замещением. Он содержится в сульфонамидных антибиотиках и соединениях, содержащих парааминобензойную кислоту (ПАБК), таких как некоторые солнцезащитные кремы и косметика. Он также содержится в консервантах на основе метилпарабена и местных анестетиках на основе сложных эфиров, таких как прокаин. Сложноэфирные связи (прокаин) или боковые цепи (артикаин) не являются иммуногенными, как и атом серы тиофенового кольца (артикаин).* указывает на иммуногенный фрагмент.
Последнее заблуждение относится к сульфитам. Их включают в растворы местных анестетиков, содержащие вазопрессоры, чтобы предотвратить их окисление. Это неорганические соединения (-SO 3 ), которые участвуют в аллергических реакциях, но они не имеют никакого отношения к иммуногенности, приписываемой соединениям, родственным PABA. Эти агенты также используются в качестве антиоксидантов в свежих фруктах и овощах, чтобы сохранить их цвет и внешний вид. Важно отметить, что пациенты с аллергией на такие продукты могут испытывать перекрестные реакции с растворами местных анестетиков, содержащих вазопрессоры, поскольку они содержат те же самые сульфиты.
Сообщения об аллергических реакциях на местные анестетики появлялись в научной литературе с некоторой частотой. 10 , 11 Однако трудно понять точность или фактическую частоту из-за несоответствия в методах подтверждения, которые включают кожные уколы, внутрикожные инъекции и провокационные препараты. Во многих случаях не было подтверждения фактического виновника, консерванта или местного анестетика. Более того, лишь очень немногие из них действительно подтвердили присутствие IgE к лекарственному средству с помощью иммуноблоттинга.Обширный анализ этой литературы недавно был проведен Speca et al. 12
Практически во всех описаниях случаев у пациентов действительно наблюдались признаки и симптомы, соответствующие аллергической реакции. Был ли реальный патогенез действительно иммуноопосредованным (аллергия), вероятно, скорее академический, чем прагматический. Конечное событие в этих реакциях приписывается синтезу и высвобождению медиаторов, вместе называемых аутакоидами, из которых гистамин и лейкотриены являются наиболее важными.Эти аутакоиды не только оказывают прямое воздействие на ткани, но также могут привлекать различные воспалительные клетки, которые способствуют так называемой реакции поздней фазы, которая может не проявляться в течение нескольких дней после провокации. В самом деле, лекарства нередко генерируют эти аутакоиды за счет действий, которые не являются иммуноопосредованными и поэтому неправильно классифицируются как аллергия. Меперидин стимулирует высвобождение гистамина из тучных клеток, а нестероидные противовоспалительные препараты могут способствовать синтезу лейкотриенов.В таких случаях реакция пациента обычно обозначается как псевдоаллергическая, чтобы отличить ее от истинной аллергии, которая является иммунной.
Если пациент описывает реакцию, которая, по крайней мере, клинически соответствует аллергии, стоматолог должен избегать использования вызывающего заболевания агента до тех пор, пока его не осмотрит аллерголог. В случае, если до получения медицинского разрешения требуется обезболивающее, самым разумным выбором будет либо мепивакаин, либо прилокаин без вазопрессоров. Согласно общепринятому мнению, если местные анестетики действительно вызывают аллергию, эфиры ПАБК будут более вероятными, чем амидные местные анестетики.Кроме того, избегая растворов, содержащих вазопрессоры, можно избежать любых бисульфитов, которые входят в состав антиоксидантов. Возможна чувствительность к различным сульфитам, особенно у пациентов с астмой или атопией. Эти принципы являются основой блок-схемы, представленной в. Пациенту никогда нельзя отказывать в преимуществах местной анестезии на основании ошибочных предположений относительно аллергии.
Ведение пациентов с аллергией на местные анестетики. Исключите частые реакции, ошибочно принимаемые за аллергию, например обмороки и тахикардию.Затем установите, что характер их реакции, по крайней мере, напоминал реакцию гиперчувствительности, например, сыпь, зуд, крапивницу или одышку. Если препарат известен, выберите другой амид, не содержащий вазопрессоров, чтобы не было сульфитов. В противном случае направьте пациента к аллергологу для тестирования сульфитов и типичных местных анестетиков, таких как лидокаин, мепивакаин и прилокаин. (Адаптировано из deShazo и Kemp. 13 )
Местная токсичность
Ишемический некроз тканей может возникнуть после инъекций местных анестетиков.Это может быть связано с раздражающим действием раствора, давлением больших объемов или сужением сосудистой сети из-за вазопрессоров. Это особенно опасно при инъекции в прикрепленную слизистую оболочку, например твердое небо. Также растет беспокойство по поводу прямой нейротоксичности, связанной с составами, содержащими высокие концентрации, такие как 4% артикаин и прилокаин.
Хаас и Леннон сообщили о повышении частоты парестезий в Канаде после введения артикаина в середине 1980-х годов. 14 Только в 1993 году было зарегистрировано 14 случаев парестезии, и все они были связаны с применением артикаина или прилокаина. Когда артикаин впервые был подан на одобрение Управления по контролю за продуктами и лекарствами США, было установлено, что он имеет более высокий риск парестезии, чем лидокаин.
Совсем недавно Гаристо и др. 15 рассмотрели заявления о парестезии в Соединенных Штатах в период с ноября 1997 года по август 2008 года и обнаружили 248 случаев парестезии после стоматологических процедур.В большинстве случаев (~ 95%) была задействована блокада нижнечелюстного нерва, и в 89% из них был поражен язычный нерв. По сравнению с другими местными анестетиками, парестезия была в 7,3 раза более вероятна при использовании 4% артикаина и в 3,6 раза более вероятна при применении 4% прилокаина. Подобные результаты из отчетов о парестезии в Дании были опубликованы Hillerup et al. 16 Эти данные могут быть еще более значимыми, если учесть количество случаев, которые вполне могут остаться незарегистрированными.
Хотя стоматологическое сообщество не спешило прийти к консенсусу по этому вопросу, следует понимать, что в литературе по медицинской анестезии категорически утверждается, что более высокая концентрация растворов местных анестетиков увеличивает риск прямой нейротоксичности для нервных стволов: «Все клинически используемые местные анестетики могут оказывать прямое токсическое воздействие на нервы, если они достигают достаточно высоких интраневральных концентраций.Клиницисты должны знать, что концентрации приготовленных растворов местных анестетиков сами по себе нейротоксичны и что их разбавление in situ или в тканях необходимо для безопасного использования ». 1
Этот факт дополнительно подтверждается Hillerup et al, которые продемонстрировали большую нервную токсичность 4 по сравнению с 2% артикаином в препаратах седалищного нерва. 17 Как и в случае со всеми лекарствами, каждый практикующий врач должен провести анализ соотношения риска и пользы перед применением лекарства. Только в том случае, если польза от использования артикаина превышает риск для этого практикующего врача, его следует рассматривать для использования.Было бы разумно ограничить использование 4% концентраций для инфильтрации и избегать их использования для нервной блокады, отдав предпочтение агентам, сформулированным в более низких концентрациях. 15 , 16
СРАВНЕНИЯ С МЕСТНЫМИ АНЕСТЕТИКАМИ
Лидокаин продолжает оставаться наиболее широко используемым местным анестетиком в Соединенных Штатах, но все эти агенты имеют сопоставимую эффективность. Они различаются по эффективности и нескольким фармакокинетическим параметрам, которые объясняют различия в начале и продолжительности анестезии.При выборе конкретного агента необходимо учитывать продолжительность запланированной процедуры и проблемы, связанные с концентрацией вазопрессоров. Для длительных процедур логичным выбором является бупивакаин, но, согласно исследованиям, в которых сравнивались различные анестетики, он считается одним из наиболее болезненных агентов во время инъекции. 18 — , 20 Одна из стратегий — обеспечить первые 60–90 минут анестезии с использованием менее раздражающего агента (лидокаин или прилокаин), а затем повторно ввести анестезируемую ткань с бупивакаином, чтобы обеспечить хорошее обезболивание в послеоперационном периоде. период.Такая стратегия наиболее эффективна после нервных блокад; следует ожидать более короткую продолжительность пульпарной анестезии после инфильтрации. (См.)
Таблица 2.
Местные анестетики, доступные в картриджах 21 , 22
Несмотря на неофициальные заявления о превосходстве артикаина над лидокаином при блокаде нижних альвеол, опубликованные исследования практически не обнаружили разницы. , особенно при наличии симптомов зубов. 22 — , 24 Любое небольшое преимущество артикаина компенсируется его повышенным риском парестезии, о чем говорилось выше.Тем не менее, для инфильтрации нижней челюсти артикаин явно лучше и не несет риска нервной токсичности, если не вводится рядом с подбородочным нервом. 22 , 25 , 26 Превосходство артикаина можно объяснить его высокой растворимостью в липидах и концентрацией его препаратов. В отличие от других анестетиков, содержащих бензол в качестве ароматического кольца, артикаин имеет тиофеновое кольцо и замены, которые придают большую растворимость липидов, чем другие местные анестетики, за исключением бупивакаина.Это свойство должно было позволить использовать его в более низкой концентрации, но на самом деле он был составлен в виде 4% раствора. Артикаин не только более растворим в липидах, но и содержит большее количество молекул, чем, например, 2% лидокаин в равном объеме. На сегодняшний день не было опубликованных исследований, сравнивающих артикаин с 4% растворами лидокаина при инфильтрации нижней челюсти. Лидокаин в этой концентрации представляет неприемлемый риск системной токсичности, что дает еще одно привлекательное свойство артикаина: характер клиренса.
Хотя артикаин классифицируется как амид, из-за связи его промежуточной цепи тиофеновое кольцо также содержит боковую цепь сложного эфира. Эта цепь гидролизуется эстеразами плазмы, что делает молекулу неактивной. В результате период полувыведения артикаина составляет всего 20-40 минут по сравнению с> 90 минутами для лидокаина и других амидов, требующих печеночного клиренса. По этой причине артикаин представляет меньший риск системной токсичности при длительных приемах, когда вводятся дополнительные дозы анестетика.Однако следует помнить, что артикаин с концентрацией 4% содержит удвоенную дозу 2% лидокаина на введенный объем, и их максимальные рекомендуемые дозы идентичны.
ВАЗОПРЕССОРЫ
Вазопрессоры — это препараты, которые обеспечивают сужение кровеносных сосудов путем активации альфа-1-адренорецепторов. Их сочетают с местными анестетиками для обеспечения гемостаза в операционном поле и задержки абсорбции анестетика. Задержка всасывания местных анестетиков не только снижает риск системной токсичности, но и увеличивает продолжительность анестезии.Адреналин является наиболее распространенным агентом, используемым для этой цели, несмотря на то, что он проявляет значительную сердечную стимуляцию из-за его дополнительного действия в качестве агониста бета-1-адренорецепторов.
Несмотря на популярность адреналина 1 100 000, его концентрации выше 1 ∶ 200 000 (5 мкг / мл) практически не дают никаких преимуществ. Более высокие концентрации не обеспечивают лучшего начала или продолжительности блокады нижнего альвеолярного нерва. 29 , 30 Более высокие концентрации также не снижают концентрации местного анестетика в сыворотке. 4 , 5 Однако более высокие концентрации, например, 1 ∶ 100 000 (10 мкг / мл) и 1 ∶ 50 000 (20 мкг / мл), могут обеспечить лучший гемостаз при инфильтрации в операционном поле, когда это влияние желанный.
Влияния на сердечно-сосудистую систему
Чтобы должным образом решить вопросы безопасности, нужно сначала понять принципы расчета дозировки, представленные в этой статье. Продолжаются дискуссии о пагубном влиянии адреналина на пациентов с сердечно-сосудистыми заболеваниями.Часто этот спор продолжается без полного понимания фактического действия и эффектов этого широко используемого препарата. Адреналин действует как агонист рецепторов альфа, бета-1 и бета-2. Эти действия объясняют его влияние на сердечно-сосудистую систему, как показано на рис. Прежде чем анализировать этот показатель, важно прояснить распространенное заблуждение. Стоматолог рассматривает адреналин как сосудосуживающее средство на основании его эффектов при введении в подслизистые ткани. Это потому, что крошечные сосуды в этом месте содержат только альфа-рецепторы.Более крупные системные артерии, которые определяют артериальное сопротивление и диастолическое артериальное давление, содержат гораздо больше бета-2, чем альфа-рецепторов, и после абсорбции низкие дозы адреналина вызывают расширение этих сосудов.
Сердечно-сосудистые эффекты адреналина. 31 Следующий график иллюстрирует типичную сердечно-сосудистую реакцию на адреналин, вводимый в виде непрерывной внутривенной инфузии 10 мкг / мин. (Это количество содержится в 1 мл концентрации 1 ∶ 100 000.) Адреналин увеличивает частоту сердечных сокращений (ЧСС) за счет активации рецепторов бета-1 в синоатриальном узле, нормальном кардиостимуляторе сердца. Он также активирует рецепторы бета-1 на клетках миокарда, увеличивая их сократимость и повышая систолическое артериальное давление (САД). Однако он активирует бета-2 рецепторы на системных артериях, вызывая расширение сосудов. Это снижение артериального сопротивления вызывает снижение диастолического давления (ДАД). Эти эффекты приводят к небольшому изменению среднего артериального давления (САД).
Клинические испытания однозначно подтвердили, что даже небольшие дозы адреналина в растворах местных анестетиков влияют на сердечно-сосудистую функцию.Dionne et al. 32 изучали влияние 3 картриджей 2% лидокаина с эпинефрином 1 100 000 (~ 60 мкг адреналина). Подслизистая инъекция этой дозировки увеличивала сердечный выброс, частоту сердечных сокращений и ударный объем. Системное артериальное сопротивление было снижено, а среднее артериальное давление практически не изменилось. Аналогичным образом, Hersh et al. 5 наблюдали аналогичные результаты после введения артикаина, содержащего 1 100 000 (∼120 мкг) и 1 ∶ 200 000 (∼60 мкг) адреналина, с большей реакцией на более высокую дозировку.Эти результаты согласуются с общепризнанными влияниями, как показано на рис.
Результаты исследований, подобных только что упомянутым, следует рассматривать в перспективе. Например, влияние ~ 120 мкг адреналина, опубликованное Hersh et al. 5 , было незначительным: увеличение частоты сердечных сокращений на ~ 8-10 ударов в минуту и изменения артериального давления в среднем на ~ 5 мм рт. Тем не менее, 14 участников были в отличном состоянии, их показатели жизнедеятельности в состоянии покоя составляли в среднем 68 для частоты сердечных сокращений, 125 мм рт. Ст. Для систолического давления и 73 мм рт. Ст. Для диастолического давления.Кроме того, они не принимали никаких серьезных лекарств. Очевидно, что такие люди могут легко переносить введенные дозы, но следует отметить, что двое из этих здоровых участников действительно сообщили о сердцебиении.
Даже небольшие дозы адреналина вызывают сердечно-сосудистые эффекты; это однозначно. Вопрос заключается в том, представляют ли сердечно-сосудистые воздействия адреналина значительный риск для пациентов с различной степенью компрометации. Стандарты и руководства продолжают продвигаться, но на самом деле все они анекдотичны.Наивно предлагать ввести ограничение «2 картриджа» для пациентов с сердечно-сосудистыми заболеваниями. В конечном итоге для принятия решения стоматолог должен вынести здравое клиническое суждение, основанное на тщательном анализе каждого рассматриваемого пациента. Если показана консультация с врачом пациента, обсудите ожидаемый диапазон доз в микрограммах, а не в концентрациях или картриджах. Например, если планируется 2–4 картриджа с местным анестетиком, объясните, что вы будете использовать 40–80 мкг адреналина, инфильтрованного под слизистую оболочку, а не 2–4 картриджа с адреналином 1 ∶ 100 000.Врач не знаком с дозировкой, выраженной в картриджах или концентрациях. Для справки рассмотрите стандартную дозу адреналина для лечения аллергической реакции: 0,3 мг или 300 мкг. Врач, как правило, будет интересоваться дозами 100 мкг или больше.
Левонордефрин (Неокобефрин) — вазопрессор в сочетании с 2% препаратами мепивакаина в США. Он больше похож на норадреналин, чем на адреналин, поскольку не обладает активностью в отношении бета-2-рецепторов. По этой причине он повышает не только систолическое артериальное давление, как адреналин, но также диастолическое и среднее артериальное давление.У некоторых пациентов это может вызвать рефлекторное блуждающее влияние на частоту сердечных сокращений, которое может частично компенсировать прямую стимуляцию сердечного ритма рецепторами бета-1. Однако исследования, оценивающие влияние сердечно-сосудистой системы после внутрикостных инъекций, обнаружили небольшую разницу между адреналином и левонордефрином. 33 , 34 Это, вероятно, объясняется быстрым всасыванием, которое позволяет проводить прямую стимуляцию бета-1 до вмешательства рефлекторных реакций на среднее артериальное давление.Сравнение адреналина и левонордефрина представлено в.
Таблица 3.
Действия адреналина по сравнению с левонордефрином
Максимально допустимые дозы вазопрессоров не установлены. Выражать ограничения в виде назначений нецелесообразно; Время лечения может составлять от 30 минут до 3-4 часов. Кроме того, влияние данной дозы вазопрессора на пациентов сильно различается. Пиковое влияние адреналина обычно наблюдается в течение 5–10 минут после инъекции 5 и быстро снижается; Адреналин и левонордефрин являются катехоламинами и быстро метаболизируются катехол-о-метилтрансферазой.Фактически, период полувыведения большинства катехоламинов составляет всего 1-3 минуты. Как правило, гемодинамические влияния наблюдаются в течение нескольких минут после инъекции и полностью исчезают через 10-15 минут. Доза адреналина 40 мкг (примерно 2 картриджа с содержанием адреналина 1 100 000) является наиболее консервативным и часто упоминаемым ограничением дозы для пациентов с серьезными сердечно-сосудистыми заболеваниями. Следует уточнить, что это руководство более точно отражает 30-минутные периоды времени, а не встречи.Более рациональное предложение — основывать дозировку на оценке пациента, а не на максимальных количествах. Например, если по какой-либо причине медицинский статус пациента ставится под сомнение, разумный протокол состоит в том, чтобы записывать исходную частоту сердечных сокращений и артериальное давление до операции и снова после каждых введенных 20–40 мкг. Это соответствует 1-2 картриджам с концентрацией адреналина 1 ∶ 100 000. Практически любой пациент может выдержать такое количество сердечно-сосудистых воздействий. Если состояние пациента остается стабильным, могут быть введены дополнительные дозы, после чего следует аналогичная схема повторной оценки показателей жизнедеятельности.
Лекарственные взаимодействия
Возможные лекарственные взаимодействия были подробно рассмотрены в предыдущей статье для повышения квалификации в этом журнале. 35 Наиболее важные из них относятся к возможной усиленной стимуляции сердечно-сосудистой системы. Вазопрессоры, обнаруженные в формах местного анестетика, обладают кардиотоническим действием, и это может стать более значительным, когда пациенты принимают лекарственные препараты с аналогичным действием. К ним относятся трициклические антидепрессанты и ингибиторы моноаминоксидазы, дигоксин, гормон щитовидной железы или любые симпатомиметики, используемые для контроля веса или нарушений внимания.Вазопрессоры не противопоказаны этим пациентам, но их следует назначать с осторожностью, как описано выше для пациентов с ограниченными возможностями здоровья. Пациентам, у которых есть подозрение на злоупотребление стимуляторами, например кокаином, может быть разумным вообще избегать вазопрессоров.
Осторожное использование вазопрессоров также рекомендуется пациентам, принимающим неселективные бета-блокаторы. В отличие от селективных агентов, которые блокируют только рецепторы бета-1 в сердце, неселективные агенты также блокируют сосудистые рецепторы бета-2.В этом случае альфа-агонистическое действие вазопрессоров становится более выраженным, и как диастолическое, так и среднее артериальное давление могут стать опасно повышенными. Обычно это сопровождается внезапным рефлекторным замедлением сердечного ритма. Существенные последствия этого взаимодействия хорошо задокументированы. 36 — , 38 Взаимодействие с бета-блокаторами происходит во времени, идентичном наблюдаемому для нормальных сердечно-сосудистых реакций на адреналин. Он начинается после абсорбции из места инъекции, которая обычно достигает пика в течение 5 минут и снижается в течение последующих 10–15 минут.Вазопрессоры не противопоказаны пациентам, принимающим неселективные бета-блокаторы, но дозы должны быть консервативными, а артериальное давление периодически контролировать во время приема, как описано выше. Следует избегать использования ретракционных шнуров, пропитанных рацемическим адреналином. Эти продукты содержат адреналин в количествах, намного превышающих те, которые содержатся в составах местных анестетиков.
Анестезия (Рекомендации) | Исследования позвоночных животных
Руководства: IACUC предоставил набор руководящих документов (Политики, Руководства и Информационные листы) для использования при планировании процедур с животными в Университете Айовы.Исключение из Руководства должно быть описано и обосновано в Протоколе о животных и утверждено в ходе обычного процесса проверки.
Цель: Целью данного руководства является предоставление рекомендаций по обычно используемым ингаляционным и инъекционным анестетикам для использования в исследованиях на животных в Университете Айовы. Все анестетики, используемые для животных, должны быть указаны в утвержденном протоколе для животных. Все анестезиологические процедуры должны выполняться специально обученным персоналом.
Учет анестезии / седации
- Относится ко всем процедурам выживания и невыживания, выполняемым под анестезией
- Мыши и крысы (а также рыбы, земноводные, рептилии и птицы)
- Краткие процедуры с использованием ингаляционных / абсорбированных анестетиков
- Запись не требуется
- Кратковременные процедуры — это те процедуры, которые вызывают не более чем кратковременную боль (например,грамм. сбор крови, инъекция в хвостовую вену, ножницы из хвоста / плавника для генотипирования или интраназальных посевов)
- Для всех других процедур, не описанных выше
- Требуется запись
- Животные должны находиться под наблюдением до полного выздоровления в случае выживания или эвтаназии в случае невыживания
- Документируйте следующее:
- Дата
- Главный следователь
- Протокол животных №
- ID животного
- Виды
- Вес
- Процедура
- Используемое (ые) средство (а), дозировка, способ применения
- Время индукции наркоза
- Время выхода из наркоза или время эвтаназии
- Краткие процедуры с использованием ингаляционных / абсорбированных анестетиков
- USDA Covered Species (все млекопитающие, кроме мышей из рода Mus и крыс из рода Rattus )
- Любое анестезиологическое вмешательство
- Требуется индивидуальная запись для каждого животного
- Документ следующий:
- Дата
- Главный следователь
- Протокол животных №
- ID животного
- Виды
- Вес
- Процедура
- Используемое (ые) средство (а), дозировка, способ применения
- Время индукции наркоза
- Время выхода из наркоза или время эвтаназии
- Мониторинг (каждые 15 минут до выздоровления или эвтаназии)
- Любое анестезиологическое вмешательство
- Информацию о хирургической карте см. В руководстве по хирургии
- Щелкните здесь для просмотра шаблонов анестезиологических отчетов
Поддерживающий уход за животными во время анестезии
- Нанесите офтальмологическую мазь на оба глаза для предотвращения высыхания при любой анестезии более 5 минут
- Поддерживайте нормальную температуру тела, используя теплое одеяло с циркулирующей водой, термопрокладки и / или подогретые жидкости для внутривенного вливания.
- НЕ используйте продаваемые без рецепта электрические грелки, так как они склонны к перегреву
- Обеспечьте жидкостями (например,g., IV, IP, SQ) животным во время длительной анестезии для поддержания адекватной гидратации, как описано в утвержденном протоколе для животных
Мониторинг и оценка анестезии
- USDA Covered Species (все млекопитающие, кроме мышей из рода Mus и крыс из рода Rattus )
- Монитор пульса, частоты дыхания и температуры
- Документируйте эти параметры по крайней мере каждые 15 минут во время анестезии
- Для грызунов может быть достаточно качественного мониторинга нормальной сердечно-сосудистой и респираторной функции, поскольку количественно оценить эти параметры сложно.
- Для всех других видов ожидается количественный мониторинг (числовая частота сердечных сокращений и дыхания).
- При использовании аппарата ИВЛ отметьте скорость вентиляции и дыхательный объем в записях
- Монитор гемодинамических параметров для обеспечения адекватного газообмена
- Слизистые оболочки должны быть розовыми и влажными
- Время наполнения капилляров должно быть менее 2 секунд
- Мониторинг хотя бы одного показателя распознавания глубокой боли (рефлекс педали, рефлекс ушной раковины и т. Д.) следует проводить регулярно, чтобы обеспечить адекватную анестезию.
- Отрегулируйте глубину анестезии в соответствии с изменениями контролируемых параметров, чтобы обеспечить продолжение хирургической плоскости анестезии
- Мыши и крысы
- Контролировать частоту дыхания и усилие, цвет слизистых оболочек и отраженный цвет глаз (у животных-альбиносов) через равные промежутки времени (не более 15 минут)
- Оценить уровень анестезии по рефлексу педали (сильное защемление пальца ноги) и отрегулировать подачу анестетика, чтобы сохранить операционную плоскость
Восстановление после анестезии
- Крупные животные
- Миски с едой и водой должны быть извлечены из корзины для утилизации
- Наблюдайте за каждым животным до полного выздоровления (нормальные значения для следующего):
- ЧСС и частота дыхания
- Сохранение грудного положения лежа (лежа на груди)
- Частота сердечных сокращений и дыхания
- Температура тела
- Рекомендуется использовать грелку с циркулирующей теплой водой
- Гидратация оценивается по тургору кожи или «липкости» слизистой оболочки
- Выпустите воздух из интубационной трубки и извлеките ее, когда животное сможет проглотить.
- Не оставляйте животное без присмотра, пока на месте интубационная трубка
- Время от времени перемещайте лежачих животных, чтобы ускорить выздоровление.
- Животные не должны оставаться одной стороной вниз более четырех (4) часов
- Опустите голову животного немного ниже уровня груди, чтобы предотвратить аспирацию в случае рвоты
- Мыши и крысы
- Поместите грызунов в теплую, чистую, сухую и тихую среду вдали от других животных
- Накройте или замените подстилку полотенцем
- Постельные принадлежности могут прилипать к глазам или их можно вдохнуть, пока животные восстанавливаются после наркоза
- Обеспечьте тепло во время выздоровления:
- Имеющаяся в продаже хирургическая грелка (НЕ «продаваемая без рецепта» грелка для человека)
- Лампа накаливания (50-75 Вт) на расстоянии 12-14 дюймов от грызунов
- Габаритный фонарь, чтобы грызуны могли убежать от источников света при желании
- Необходимо проводить внимательный контроль, чтобы не допустить перегрева грызунов
- Использование клетки / инкубатора с регулируемой температурой
- Если указано в утвержденном протоколе для животных, можно вводить теплый стерильный физиологический раствор для восполнения потерь биологических жидкостей во время операции
- Грызуны должны находиться под постоянным наблюдением до тех пор, пока они не сохранят вертикальное положение и не смогут нормально ходить по клетке, прежде чем вернуться в помещение для животных
- Все животные должны находиться под постоянным наблюдением до тех пор, пока они не сохранят прямую позу и не смогут нормально ходить по клетке, прежде чем завершить наблюдение и вернуться в помещение для животных.
Анестетики
Ниже приводится список обычно используемых анестетиков. Этот список не является исчерпывающим; другие анестетики могут быть перечислены и использованы в протоколе для животных.
Другие принятые ресурсы для соответствующих анальгетиков включают следующие формуляры:
- Plumb’s Veterinary Drug Handbook (Plumb)
- Анестезия и обезболивание лабораторных животных (ACLAM)
- Формуляр для лабораторных животных (Hawk)
- Справочник экзотических животных (Карпентер и Марион)
- Справочник по ветеринарной анестезии (Muir & Hubbell)
- Свинья в лаборатории (мошенничество)
Соответствующие анестезирующие препараты и дозировку следует определять после консультации с ветеринаром OAR или IACUC.
Ингаляционные анестетики
ИЗОФЛУРАН / СЕВОФЛУРАН — ИСПАРИТЕЛЬ
- Изофлуран / севофлуран необходимо вводить с помощью правильно откалиброванного испарителя при использовании в качестве анестетика в хирургии
- Анестезирующие газы должны удаляться должным образом
- Прямой выхлоп
- Канистра с активированным углем (например, канистра F / Air)
- Следует взвешивать перед каждым использованием и выбрасывать по достижении максимального веса
- Необходимо вести учет веса
- Испарители необходимо калибровать не реже одного раза в год.
- Необходимо вести протоколы калибровки для каждого испарителя
ИЗОФЛУРАН — МЕТОД КАПЕЛЬНОЙ СТАКАНИ
- НЕ для использования севофлурана ; концентрацию севофлурана невозможно точно контролировать методом капельной банки
- Изофлуран можно вводить в капле для анестезии за одну короткую процедуру.
- Не может использоваться для каких-либо хирургических вмешательств (включая операции по выживанию и выживанию)
- Анестезирующие газы должны удаляться должным образом
- Вытяжной шкаф
- Герметичный шкаф биобезопасности
- Животные не должны напрямую контактировать с жидким изофлураном
- Капельная банка должна быть очищена (т.е. удаление мочи / кала) между животными
- Использование этого метода с конической пробиркой на 50 мл не рекомендуется
Капельное дозирование изофлурана: внутренний объем камеры (л) и требуемая изофлурановая жидкость (мл)
| Достигнутая концентрация изофлурана | 1 л | 2 л | 3 л | 4 л | 5 л |
|---|---|---|---|---|---|
| 1% | 0.05 мл | 0,10 мл | 0,15 мл | 0,20 мл | 0,26 мл |
| 2% | 0,10 мл | 0,20 мл | 0,31 мл | 0,41 мл | 0,51 мл |
| 3% | 0,15 мл | 0,31 мл | 0,46 мл | 0,61 мл | 0,77 мл |
| 4% | 0,20 мл | 0,41 мл | 0.61 мл | 0,82 мл | 1,02 мл |
| 5% | 0,26 мл | 0,51 мл | 0,77 мл | 1,02 мл | 1,28 мл |
75% CO2 / 25% O2
- 75% CO2 / 25% O2 можно использовать для однократных коротких процедур
- Не может использоваться для каких-либо хирургических вмешательств (включая операции без выживания и выживания).
- Доступно предварительно смешанное от поставщиков
- Соблюдайте меры предосторожности; животные легко подвержены передозировке
- Не предназначен для эвтаназии
- Свяжитесь с членом ветеринарного персонала Управления животных ресурсов, если вы не знакомы с правильным использованием CO. 2 / O 2
Абсорбированные анестетики
- Метансульфонат трикаина (MS-222)
- Лягушки:
- 0.05-0,2% (500-2000 мг / л) раствор
- Раствор необходимо забуферить бикарбонатом натрия до pH 7,0-7,5
- Погрузить лягушку в раствор на 10-20 минут
- Об уровне анестезии судят по потере рефлексов выпрямления, потере рефлекса глотания и потере реакции отдергивания при защемлении пальца ноги
- Рыба:
- 0,0025-0,01% (25-100 мг / л) раствор
- Раствор должен быть забуферен бикарбонатом натрия до pH 7.0-7,5
- Погрузите рыбу в раствор до достижения необходимой глубины анестезии
- Об уровне анестезии судят по потере равновесия, потере реакции на вредные раздражители (защемление основания хвоста), скорости движения глазных яблок и цвету жабр
- Хранилище
- Трикаин (жидкий раствор) можно хранить при комнатной температуре в течение 3-5 дней, если он защищен от воздействия света.
- Трикаин (жидкий раствор) можно хранить при 4 ° C (т.е.е. — холодильник) в течение 1 месяца при хранении в защищенном от света месте.
- Трикаин (жидкий раствор) можно хранить при -20 ° C (т. Е. В морозильной камере) в течение 1 года, если он защищен от света.
- Трикаин (порошок) можно хранить при комнатной температуре до 5 лет в темном контейнере.
- Лягушки:
Инъекционные анестетики
ОБЫЧНО ИСПОЛЬЗУЕМЫЕ ИНЪЕКЦИОННЫЕ АНЕСТЕТИЧЕСКИЕ СРЕДСТВА
МЫШЬ
|
Агент |
Дозировка |
Продолжительность наркоза |
|
Кетамин / ксилазин * |
кетамин 80-100 мг / кг IP ксилазин 10-12.5 мг / кг IP |
20-30 минут |
|
Кетамин / ксилазиновый коктейль * |
KX mouse cocktail 0,1 мл / 20 г мыши вес. IP Содержит: 87,5 мг / кг Кетамин 12,5 мг / кг Ксилазин |
20-30 минут |
|
Кетамин / ксилазин / ацепромазин |
кетамин 60-100 мг / кг IP ксилазин 10-15 мг / кг IP ацепромазин 2-5 мг / кг IP |
60-90 минут |
|
Пентобарбитал |
50 мг / кг IP |
20-40 минут |
|
Авертин ǂ См. Предупреждение ниже |
240 мг / кг IP |
30 минут |
* Кетамин / ксилазин без комбинации с анальгетиком (опиоидом или НПВП) может быть недостаточным для проведения хирургической плоскости анестезии.Введение соответствующих анальгетиков перед операцией и / или добавление ацепромазина усилит анестезирующий эффект кетамина / ксилазина.
** Инструкции по приготовлению коктейля кетамин / ксилазин можно найти ниже.
ǂ ПРЕДУПРЕЖДЕНИЕ : NIH и европейские директивы не рекомендуют использовать авертин. Требования к приготовлению и хранению авертина приведены ниже.
* РЕКОМЕНДАЦИИ — ПРИГОТОВЛЕНИЕ КОКТЕЙЛЯ КЕТАМИНА / КСИЛАЗИНА ДЛЯ МЫШЕЙ
- Требуется использование стерильного флакона для инъекций (например,грамм. пробирка для забора крови redtop; коммерческий флакон для инъекций)
- Инструкции по смешиванию:
- Перед смешиванием проверьте концентрацию лекарств
- Для флакона на 10 мл с использованием 100 мг / мл кетамина и 100 мг / мл ксилазина добавить:
- 1,75 мл кетамина (100 мг / мл)
- 0,25 мл ксилазина (100 мг / мл)
- 8 мл физиологического раствора или стерильной воды для инъекций
- Рекомендуется использовать следующий шаблон для этикетки:
- Смесь для анестезии для мышей: кетамин / ксилазин
- Дозировка: 0.1 мл / 20 г IP
- Доставляет: 87,5 мг / кг кетамина / 12,5 мг / кг ксилазина
- Концентрация: 17,5 мг / мл кетамина / 2,5 мг / мл ксилазина
Срок действия истекает: ____________
- Срок годности коктейля определяется либо шестью месяцами с даты смешивания, либо в зависимости от того, какой из компонентов истекает раньше (если менее 6 месяцев)
- Например: разбавленный 13.08.2011, кетамин истекает 10.12.2012, ксилазин истекает 10.10.11, а стерильная вода для инъекций истекает 01.12.2013; срок годности коктейля 10.10.11
RAT
|
Агент |
Дозировка |
Продолжительность наркоза |
|
Кетамин / ксилазин |
кетамин 40-100 мг / кг IP ксилазин 5-13 мг / кг IP |
60-80 минут |
|
Кетамин / ксилазиновый коктейль *
|
Крысиный коктейль KX 0.1 мл / 100 г вес. IP Содержит: 91 мг / кг Кетамин 9,1 мг / кг Ксилазин |
60-80 минут |
|
Кетамин / ксилазин / ацепромазин |
кетамин 20-50 мг / кг IP ксилазин 2-10 мг / кг IP ацепромазин 0,5-1,5 мг / кг IP |
60-120 минут |
|
Пентобарбитал |
30-50 мг / кг IP |
90-120 минут |
* Кетамин / ксилазин без комбинации с анальгетиком (опиоидом или НПВП) может быть недостаточным для проведения хирургической плоскости анестезии.Введение соответствующих анальгетиков перед операцией и / или добавление ацепромазина усилит анестезирующий эффект кетамина / ксилазина.
** Инструкции по приготовлению коктейля кетамин / ксилазин можно найти ниже.
РЕКОМЕНДАЦИИ — ПРИГОТОВЛЕНИЕ КЕТАМИНА / КСИЛАЗИНА КОКТЕЙЛЯ ДЛЯ КРЫС
- Требуется использование стерильного флакона для инъекций (например, пробирка для забора крови Redtop; коммерческий флакон для инъекций)
- Инструкции по смешиванию:
- Перед смешиванием проверьте концентрацию лекарств
- Для флакона на 10 мл с использованием 100 мг / мл кетамина и 100 мг / мл ксилазина добавить:
- 10 мл кетамина (100 мг / мл)
- 1 мл ксилазина (100 мг / мл)
- Рекомендуется использовать следующий шаблон для этикетки:
- Смесь анестетиков для крыс: Кетамин / ксилазин
- Дозировка: 0.1 мл / 100 г IP
- Доставляет: 91 мг / кг кетамина, 9,1 мг / кг ксилазина
- Концентрация: 91 мг / мл кетамина, 9,1 мг / мл ксилазина
- Срок действия истекает: ____________
- Срок годности коктейля определяется либо шестью месяцами с даты смешивания, либо в зависимости от того, какой из компонентов истекает раньше (если менее 6 месяцев)
- Например: разбавленный 13.08.2011, срок годности кетамина истекает 10.10.2012, ксилазина истекает 10.10.11, стерильная вода для инъекций истекает 01.01.2013, срок годности коктейля 10.10 / 11
КРОЛИК
| Агент | Дозировка |
|---|---|
| Кетамин / ксилазин |
кетамин 22-50 мг / кг в / м ксилазин 2.5-10 мг / кг в / м |
| Пентобарбитал | 20-60 мг / кг в / в |
СВИНЬЯ
| Агент | Дозировка |
|---|---|
| кетамин / ксилазин |
кетамин 20 мг / кг в / м ксилазин 2 мг / кг в / м |
| Телазол / кетамин |
телазол 4,4 мг / кг кетамин 2.2 мг / кг |
| Пентобарбитал | 20-40 мг / кг в / в |
ОВЦА
| Агент | Дозировка |
|---|---|
| Кетамин / ксилазин |
5-15 мг / кг в / м кетамин 0,05-0,2 мг / кг в / м ксилазин |
| Тиопентал | 10-16 мг / кг в / в |
FERRET
| Агент | Дозировка |
|---|---|
| Кетамин / ксилазин |
10-25 мг / кг в / м кетамин 0.25-0,5 мг / кг в / м ксилазин |
Другие виды или анестетики:
Обратитесь за консультацией к ветеринарному врачу Университета Айовы
ИНСТРУКЦИИ ПО ПРИГОТОВЛЕНИЮ И ХРАНЕНИЮ АВЕРТИНА (ТРИБРОМОЭТАНОЛА)
- Авертин — это быстродействующий анестетик нефармацевтического класса *, который используется при краткосрочных хирургических вмешательствах на мышах.
- ПРИМЕЧАНИЕ: В соответствии с 8-м изданием Руководства по уходу и использованию лабораторных животных, использование химикатов или веществ нефармацевтического назначения должно быть описано и научно обосновано в Протоколе о животных.
- Меры предосторожности:
- Не вводите Авертин, если у вас есть:
- Нестерильные растворы
- Устаревшие решения
- Более концентрированные растворы
- Дозы выше рекомендуемых
- Авертин следует вводить только один раз (без повторного приема) из-за раздражения желудочно-кишечного тракта
- Не вводите Авертин, если у вас есть:
- Недостатки применения Авертина:
- Раздражение тканей, особенно при высоких дозах, высоких концентрациях или повторных дозах
- Разлагается в присутствии тепла или света с образованием токсичных побочных продуктов, которые могут быть как нефротоксичными, так и гепатотоксичными
- Может вызвать кишечную непроходимость через несколько недель после инъекции
- Непредсказуемые эффекты у мышей в возрасте до 16 дней или у мышей с измененным углеводным обменом (например,g., линии мышей, использованные в качестве моделей диабета или ожирения)
- Некоторые европейские журналы отклоняют рукописи исследований, когда авертин используется в качестве анестетика
- Состав:
- 2,5 грамма 2,2,2 Трибромэтанол
- 5 мл 2-метил-2-бутанола (амиленгидрат, третичный амиловый спирт)
- 200 мл дистиллированной воды — нейтральный pH (стерильный)
- Препарат (раствор 12,5 мг / мл):
- Растворите 2,5 грамма трибромэтанола в 5 мл амиленгидрата.
- Нагрейте растворенный раствор до 40 ° C при интенсивном перемешивании.
- Добавьте дистиллированную воду, непрерывно помешивая, до конечного объема 200 мл.
- Стерилизовать через фильтр Millipore (0,5 микрон)
- Хранение:
- Отфильтровать конечный раствор в пробирки для забора крови с красной крышкой или стерильные стеклянные контейнеры янтарного (коричневого) цвета
- Емкость с раствором необходимо обернуть алюминиевой фольгой для защиты раствора от света
- Контейнер с раствором должен быть маркирован содержимым и датой приготовления
- Хранить в холодильнике или морозильной камере
- Истечение срока наступило, если выполнено одно из следующих условий:
- Срок годности две недели при хранении в холодильнике
- Срок годности один год при хранении в морозильной камере
- Кристаллизация раствора
- Раствор пожелтел
Последний раз редактировал IACUC 12.02.2020
Фармакология анестетиков I: анестетики для внутривенного введения | BJA Education
-
Точный механизм действия i.v. анестетики остаются неуловимыми, но большинство агентов проявляют свое действие через усиление активности рецептора GABA A .
-
Усиление рецепторов GABA A увеличивает проводимость хлорид-ионов, что приводит к подавлению постсинаптических токов и, в конечном итоге, к подавлению активности нейронов.
-
И.В. анестетики обладают широким спектром воздействия не только на центральную нервную систему, но также на сердечно-сосудистую, дыхательную и другие системы основных органов.
-
Новее i.v. Разрабатываются анестетики, структурно родственные пропофолу и этомидату. Эти новые агенты могут преодолеть некоторые нежелательные побочные эффекты, связанные с их исходными аналогами.
Этот обзор посвящен пересмотру ключевых фармакодинамических и фармакокинетических принципов, лежащих в основе наиболее часто используемых внутривенных инъекций. анестетиков и кратко описывает некоторые новые в / в. агенты, в том числе аналоги пропофола и этамидата.
Введение тиопентала в клиническую практику в 1934 г. ознаменовало появление современных в / в. анестезия. Пропофол и этомидат были разработаны совсем недавно. Несмотря на отличные показатели безопасности, идеальный i.v. анестетика еще не существует, потому что все эти агенты вызывают нежелательное угнетение сердечно-сосудистой системы. Идеальный i.v. анестетик вызывает гипноз (бессознательное состояние), анальгезию и амнезию без каких-либо побочных эффектов. Потому что ни один i.v. анестетик идеален, многие препараты используются в комбинации для достижения желаемых клинических эффектов.
Механизмы действия
Исторически сложилось так, что в размышлениях о механизме действия общих анестетиков доминировали две идеи: наблюдение Мейера – Овертона и унитарная гипотеза. Мейер-Овертон независимо сообщил, что эффективность анестетиков коррелирует с их липидной растворимостью, тогда как единая гипотеза утверждала, что, хотя известные общие анестетики являются химически разными агентами, они производят анестезирующие эффекты схожим (неизвестным) механизмом.Эти идеи лежали в основе доктрины, согласно которой анестетики неспецифично воздействуют на липидный компонент клеточной стенки нейронов. Однако в 1984 году Фрэнкс и Либ продемонстрировали, что большинство общих анестетиков ингибируют не содержащий липидов фермент люциферазу светлячка, указывая на то, что они действуют непосредственно с белком, то есть на определенные рецепторные участки, а не с липидными мембранами. Самый современный i.v. (и ингаляционные) анестетики, как было показано, оказывают значительное влияние на лиганд-управляемые ионные каналы, в частности рецепторы GABA A , а также на другие белки, ответственные за нейронную активность, такие как каналы двухпорового домена K + . 1
Новейшие мутагенные молекулярные методы «нокаута», посредством которых мутировавшие нативные гены вводятся («вбивают») экспериментальным животным, позволяют избежать проблем удаления субъединиц рецептора, обычно связанных с моделью «нокаутирующей» мутации. Модели с постукиванием показали, что мутация β3-субъединицы рецептора GABA A снижает чувствительность мышей к i.v. анестетик этомидат, но не к ингаляционным анестетикам Напротив, данные свидетельствуют о том, что мыши с генетическими изменениями в α-субъединицах рецептора GABA A демонстрируют дифференциальную чувствительность к анестетикам по сравнению с «нормальными» мышами, что позволяет предположить, что ни одна объединяющая цель не может объяснить действие всех современных общих анестетиков. 2
Однако только модуляция рецепторов GABA A не полностью объясняет механизм действия всех анестетиков. Клинические концентрации N 2 O и ксенона, например, обеспечивают свои эффекты за счет ингибирования рецепторов N -метил-d-аспартата (NMDA) на возбуждающих глутаминергических нейронах, что предполагает дальнейшее разнообразие общего анестезирующего действия. В настоящее время появляются данные о ряде дополнительных механизмов общей анестезии, которые можно резюмировать следующим образом: Многие я.v. анестетики опосредуют свое действие, усиливая активность ГАМК (γ-аминомасляной кислоты) в отношении ингибирующих рецепторов ГАМК A . GABA A рецепторы представляют собой лиганд-зависимые ионные каналы, состоящие из пяти субъединиц, расположенных вокруг центральной поры. Существует ряд изоформ рецептора GABA A , которые определяют его агонистическое сродство, вероятность открытия ионного канала и проводимость (а также расположение и экспрессию на постсинаптической мембране). Существует шесть подтипов α-субъединиц, три подтипа β- и γ-субъединиц, а также δ-, ɛ- и θ-субъединицы.Большинство ионных каналов, управляемых GABA A , включают как α-, так и β-субъединицы, наиболее распространенной комбинацией в мозге млекопитающих является пентамер, содержащий две α-, две β- и субъединицу γ- (α 2 β 2 γ). Эти пентамерные комплексы GABA A образуют каналы хлорид-аниона и являются молекулярными мишенями для бензодиазепинов, барбитуратов, внутривенно. анестетики (пропофол и этомидат) и ингаляционные ингаляционные ингаляционные ингаляционные анестетики. Активация рецептора GABA A приводит к постсинаптической гиперполяризации клеточной мембраны, подавлению постсинаптических токов и, в конечном итоге, к подавлению нейрональной активности.
-
Двухпористые доменные каналы K + : это семейство из 15 ионных каналов K + , определяемых двумя P-доменами в тандеме в их первичной последовательности и характеризующихся независимостью от напряжения и отсутствием инактивации потенциал действия. Эти специальные каналы K + отвечают за токи утечки, определяющие мембранный потенциал покоя. Стандартные АТФ-зависимые каналы K + последовательно активируются и деактивируются каждым потенциалом действия.Они широко распространены в центральной нервной системе и регулируются большинством ингаляционных общих анестетиков. Текущие исследования, включающие сайт-направленный мутагенез, показали, что эти каналы K + присутствуют пре- и постсинаптически, и что некоторое обезболивающее действие объясняется пресинаптическим ингибированием высвобождения возбуждающего нейротрансмиттера, в дополнение к конкурентному ингибированию после сайты рецепторов синаптического ионного канала. 3,4
-
Внесинаптические рецепторы: к ним относятся α5- и δ-субъединицы, содержащие рецепторы GABA A , экспрессируемые в основном в гиппокампе, где их активация подавляет долгосрочное потенцирование и, следовательно, память и обучение.Хотя было показано, что эти рецепторы α5 не участвуют в возникновении седативного эффекта или неподвижности, некоторые внесинаптические рецепторы предпочтительно усиливаются внутривенным введением. анестетики.
-
Интегрированные нейронные сетевые модели анестезиологического эффекта: Связать действие анестетика на определенных участках ионных каналов с его реальными поведенческими эффектами сопряжено с трудностями. Большое внимание было уделено нейронным сетям, участвующим в сне и возбуждении, включая вентролатеральную преоптическую область гипоталамуса, туберомамиллярное ядро и восходящую ретикулярную активирующую систему. 5
Значительная часть снотворного действия пропофола опосредуется связыванием с β-субъединицами рецепторов GABA A . Благодаря своему действию на рецепторы GABA A в гиппокампе и префронтальной коре пропофол подавляет высвобождение ацетилхолина. Это действие, по-видимому, важно для седативного эффекта пропофола. Пропофол также вызывает ингибирование рецепторов NMDA, что может способствовать его центральным эффектам. Этомидат был первым i.v. обнаружено, что агент обладает избирательностью к субъединице ГАМК А . Он очень похож на пропофол по своему действию на рецепторы GABA A , но кажется, что β2- и β 3 -субъединицы более важны для его снотворного действия.
Барбитураты связываются с рецептором GABA A в β-субъединице. Подобно пропофолу и этомидату, этот сайт связывания отличается от сайта связывания для самой ГАМК и отличается от сайта связывания бензодиазепина, который расположен на границе между α- и γ-субъединицами рецепторов GABA A .
Кетамин ингибирует возбуждающий нейротрансмиттер глутамат на рецепторах NMDA. Он функционирует в таламусе (который передает сенсорные импульсы от ретикулярной активирующей системы к коре головного мозга) и лимбической коре (которая участвует в осознании ощущений). 6
Фармакокинетика обычно используемых в / в. анестетики
Пропофол
Фармакокинетика
Пропофол представляет собой 2,6-диизопропилфенол и представляет собой слабую липофильную кислоту (p K a = 11) (Таблица 1).Он очень нерастворим в воде, поэтому его формулируют в виде 1% -ного водного раствора (10 мг / мл -1 ) в эмульсии масло-в-воде, содержащей соевое масло, глицерин и яичный лецитин. Это может способствовать росту бактерий, но добавление хелатирующего агента динатрия эдетата уменьшило это. Пропофол может вызывать боль во время инъекции, которая может быть ослаблена совместным введением лидокаина или препаратом со средней длиной цепи, а не с длинноцепочечными триглицеридами. Он имеет короткий период полураспада при начальном распределении (2-8 мин).Пропофол быстро метаболизируется в печени путем конъюгации с глюкуронидом и сульфатом, образуя водорастворимые соединения, которые выводятся в основном почками. Клиренс пропофола чрезвычайно высок (больше, чем кровоток в печени), что свидетельствует о дополнительном внепеченочном метаболизме.
Таблица 1 Фармакокинетикав / в. обезболивающие .
| . | пропофол . | Тиопентал . | Кетамин . | Этомидат . | |||
|---|---|---|---|---|---|---|---|
| Водорастворимый | Нет | Да | Да | Нет | |||
| Период полураспада (начальный) (мин) | 2 | 8,5 | 16 | Период полураспада (конечный) (ч)4–7 | 12 | 3 | 5,4 |
| Объем распределения (литр кг −1 ) | 4.6 | 2,4 | 3 | 5,4 | |||
| Клиренс (мл мин -1 кг -1 ) | 25 | 11 | 19 | 18 | |||
| 98 | 80 | 12 | 75 |
| . | пропофол . | Тиопентал . | Кетамин . | Этомидат . | |||
|---|---|---|---|---|---|---|---|
| Водорастворимый | Нет | Да | Да | Нет | |||
| Период полураспада (начальный) (мин) | 2 | 8,5 | 16 | Период полураспада (конечный) (ч)4–7 | 12 | 3 | 5,4 |
| Объем распределения (литр кг −1 ) | 4.6 | 2,4 | 3 | 5,4 | |||
| Клиренс (мл мин. −1 кг −1 ) | 25 | 11 | 19 | 18 | |||
| 98 | 80 | 12 | 75 |
Фармакокинетика в / в обезболивающие .
| . | пропофол . | Тиопентал . | Кетамин . | Этомидат . | |||
|---|---|---|---|---|---|---|---|
| Водорастворимый | Нет | Да | Да | Нет | |||
| Период полураспада (начальный) (мин) | 2 | 8,5 | 16 | Период полураспада (конечный) (ч)4–7 | 12 | 3 | 5,4 |
| Объем распределения (литр кг −1 ) | 4.6 | 2,4 | 3 | 5,4 | |||
| Клиренс (мл мин -1 кг -1 ) | 25 | 11 | 19 | 18 | |||
| 98 | 80 | 12 | 75 |
| . | пропофол . | Тиопентал . | Кетамин . | Этомидат . | |||
|---|---|---|---|---|---|---|---|
| Водорастворимый | Нет | Да | Да | Нет | |||
| Период полураспада (начальный) (мин) | 2 | 8,5 | 16 | Период полураспада (конечный) (ч)4–7 | 12 | 3 | 5,4 |
| Объем распределения (литр кг −1 ) | 4.6 | 2,4 | 3 | 5,4 | |||
| Клиренс (мл мин -1 кг -1 ) | 25 | 11 | 19 | 18 | |||
| 98 | 80 | 12 | 75 |
После однократной болюсной инъекции уровни пропофола в крови быстро снижаются в результате перераспределения и выведения. Период полувыведения из первоначального распределения составляет 2-8 минут, а период полувыведения составляет 4-7 часов.Более длительный период полувыведения свидетельствует о распределении по жировым тканям с низкой перфузией, что приводит к медленному возвращению пропофола в центральный компартмент. Из-за этой медленной скорости возврата в компартмент плазмы концентрации пропофола в крови резко не увеличиваются. Контекстно-зависимый период полураспада для инфузии пропофола продолжительностью до 8 часов составляет <40 минут. Следовательно, выход из наркоза или седативных средств пропофолом остается относительно быстрым даже после длительной инфузии.
Фармакодинамические эффекты
Фармакодинамические эффекты ряда в / в. общие анестетики для основных систем органов показаны в таблице 2.
Таблица 2Системные эффекты в / в. агенты. SVR — системное сосудистое сопротивление; САД — среднее артериальное давление; CBF, мозговой кровоток
| Функция . | пропофол . | Тиопентал . | Кетамин . | Этомидат . | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Частота сердечных сокращений | Минимальный эффект | Повышенный | Повышенный | Нет эффекта | ||||||||||||||||
| Сократимость | Пониженная | Пониженная | Пониженная 9124 | Сниженная 9114 | Сниженный | Повышенный | Минимальный эффект | |||||||||||||
| MAP | Сниженный | Сниженный | Повышенный | Минимальный эффект | ||||||||||||||||
| Дыхательный | Депрессия | 9124Дыхание | Депрессия | 91249124 9124 9123 9124 | Снижение | Снижение | Повышение | Снижение | ||||||||||||
| Кора надпочечников | — | — | — | Функциональное торможение |
Системная таблица эффекты я.v. агенты. SVR — системное сосудистое сопротивление; САД — среднее артериальное давление; CBF, мозговой кровоток
| Функция . | пропофол . | Тиопентал . | Кетамин . | Этомидат . | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Частота сердечных сокращений | Минимальный эффект | Повышенный | Повышенный | Нет эффекта | ||||||||||||||||
| Сократимость | Пониженная | Пониженная | Пониженная 9124 | Сниженная 9114 | Сниженный | Повышенный | Минимальный эффект | |||||||||||||
| MAP | Сниженный | Сниженный | Повышенный | Минимальный эффект | ||||||||||||||||
| Дыхательный | Депрессия | 9124Дыхание | Депрессия | 91249124 9124 9123 9124 | Снижение | Снижение | Повышение | Снижение | ||||||||||||
| Кора надпочечников | — | — | — | Функциональное торможение |
Пропофол снижает системное сопротивление сосудов, сердечную сократимость и преднагрузку.Пациенты с нарушением функции желудочков плохо переносят значительное снижение сердечного выброса в результате снижения давления наполнения желудочков и сократимости. Частота сердечных сокращений увеличивается вследствие активации компенсаторных механизмов, опосредованных барорецепторами, в ответ на снижение сердечного выброса и системного сосудистого сопротивления.
Респираторный
Как и тиопентал, пропофол вызывает глубокое угнетение дыхания. Снижение рефлексов верхних дыхательных путей полезно во время интубации или надевания ларингеальной маски при отсутствии паралича, вызванного нервно-мышечными блокаторами.
Церебральный
Пропофол снижает потребность мозга в кислороде, мозговой кровоток и внутричерепное давление. Он также обладает полезным противорвотным действием. Хотя во время индукции он может вызывать спонтанные движения, подергивание мышц или икоту, он обладает преимущественно противосудорожными свойствами при высоких дозах инфузии и вызывает подавление вспышек на ЭЭГ. Его успешно использовали для купирования эпилептического статуса.
Потенциальная токсичность
Длительные инфузии высоких доз пропофола вызывают «синдром инфузии пропофола», характеризующийся тяжелым метаболическим ацидозом, рабдомиолизом, почечной недостаточностью, липемией и сердечной недостаточностью в сочетании с тяжелым заболеванием.В настоящее время существуют руководящие принципы, рекомендующие максимальную скорость инфузии пропофола 4,8 мг / кг -1 ч -1 для долгосрочной седации у пациентов интенсивной терапии. 6
Тиопентал
Фармакокинетика
Тиопентал — это наиболее часто используемый барбитурат, производный от барбитуровой кислоты, продукта конденсации мочевины и малоновой кислоты. Он нерастворим в воде и готовится в карбонатной соли для поддержания щелочного pH.Хотя он сильно связан с белками (80%), его высокая растворимость в липидах и высокая неионизированная фракция (60%) обеспечивают быстрое поглощение мозгом в течение 30 секунд. У пациентов с истощением внутрисосудистого объема, низким уровнем сывороточного альбумина или при увеличении неионизированной фракции (например, метаболический ацидоз) для данной дозы будут достигнуты более высокие концентрации в мозге и сердце, что увеличивает риск сердечно-сосудистых заболеваний. После однократного болюсного введения тиопентал быстро распределяется по тканям с низким объемом перфузии (например,грамм. головной и спинной мозг), а затем медленнее перераспределяется в мышечную ткань, что прекращает первоначальный эффект индукционной дозы. Поглощение тиопентала жировой тканью является незначительным фактором прекращения действия индукционной дозы из-за минимальной перфузии в жировую ткань и медленного удаления тиопентала из нее. Однако после продолжительной инфузии прекращение действия тиопентала становится все более зависимым от этих более медленных процессов поглощения жировой тканью и выведения посредством метаболизма в печени.
Фармакодинамика
Сердечно-сосудистые
Тиопентал вызывает прямую депрессию миокарда со снижением среднего артериального давления (САД) из-за угнетения мозгового вазомоторного центра и снижения симпатического оттока, что приводит к расширению емкостных сосудов. Это приводит к увеличению частоты сердечных сокращений из-за опосредованной барорецепторами симпатической рефлекторной стимуляции сердца в ответ на снижение сердечного выброса и артериального давления.Эффект более выражен при гиповолемии, β-блокаде, тампонаде перикарда и пороках сердца.
Респираторный
Тиопентал вызывает угнетение сердечно-сосудистого вентиляционного центра и снижает реакцию на гиперкапноэ и гипоксию. Он не полностью подавляет вредные рефлексы дыхательных путей и может предрасполагать к ларингоспазму и бронхоспазму. Обладает также анальгетическим действием.
Церебральный
Тиопентал снижает скорость метаболического потребления кислорода головным мозгом (CMRO 2 ), мозговой кровоток и внутричерепное давление.Большие дозы вызывают электрическую тишину (подавление вспышек) на ЭЭГ, что может защитить мозг от эпизодов очаговой ишемии.
Потенциальная токсичность
Из-за медленного метаболизма и продолжительной кинетики выведения тиопентал редко используется в виде непрерывной инфузии. С ним не было связано никакой специфической токсичности, кроме увеличения его известных побочных эффектов.
Этомидат
Этамидат — производное имидазола, впервые введенное в клиническую практику в 1973 году.Он сильно связывается с белками, имеет быстрое начало действия из-за его высокой растворимости в липидах и большой неионизированной фракции при физиологическом pH. Перераспределение отвечает за снижение его концентрации в плазме. Он подвергается быстрому гидролизу эстеразами плазмы и микросомальными ферментами печени.
Фармакодинамика
Сердечно-сосудистые
Этомидат известен своей сердечно-сосудистой стабильностью по сравнению с пропофолом и тиопенталом.При индукционной дозе 0,3 мг / кг -1 , этомидат не влияет на системное сосудистое сопротивление, сократимость миокарда и частоту сердечных сокращений.
Респираторный
Этомидат оказывает минимальное влияние на вентиляцию легких и не вызывает апноэ в соответствующих клинических дозах.
Церебральный
Этомидат снижает скорость мозгового метаболизма, кровоток и внутричерепное давление в той же степени, что и тиопентал. Из-за минимальных сердечно-сосудистых эффектов давление церебральной перфузии поддерживается.
Потенциальная токсичность
Этомидат связывается с ферментом 11-β-гидроксилазы P450, который важен для стероидогенеза. Этот эффект обусловлен связыванием атома азота в имидазольном кольце этамидата с Fe 2+ внутри гемового кольца фермента 11-β-гидроксилазы, что приводит к ингибированию образования стероидов.
Длительные инфузии этогоидата вызывают подавление коры надпочечников. Это привело к отказу от использования этогоидата в качестве седативного средства в отделениях интенсивной терапии.В последнее время он потерял популярность в качестве индукционного агента по тем же причинам, хотя важность подавления надпочечников после однократного болюсного введения неясна.
Кетамин
Кетамин, производное фенциклидина, впервые был введен в клиническую анестезию в 1966 году. Кетамин более растворим в липидах и меньше связан с белками, чем тиопентал, и ионизируется при физиологическом pH, что приводит к быстрому началу действия. Опять же, его немедленное обращение происходит из-за перераспределения в периферический отсек.Он метаболизируется в печени до норкетамина, который клинически активен, но в меньшей степени, чем его исходное соединение.
Фармакодинамика
Сердечно-сосудистые
Кетамин, в отличие от других в / в. анестетики, повышают артериальное давление, частоту сердечных сокращений и сердечный выброс за счет центральной стимуляции симпатической нервной системы. Повышает легочное артериальное давление и работу миокарда. Он относительно противопоказан пациентам с ишемической болезнью сердца и плохо контролируемой артериальной гипертензией.Его часто используют как в / в. анестетик у больных с острым гиповолемическим шоком.
Респираторный
Кетамин оказывает минимальное влияние на вентиляцию легких. Это мощный бронходилататор, который сохраняет рефлексы верхних дыхательных путей, но пациентам с повышенным риском аспирации может потребоваться защита дыхательных путей.
Церебральный
Кетамин увеличивает церебральный кровоток, внутричерепное давление и потребность мозга в кислороде. Он вызывает состояние диссоциативной анестезии , в результате чего пациент выглядит сознательным (например,грамм. открытие глаз, глотание, сокращение мышц), но не реагирует на боль. Неприятные сны, галлюцинации и делирий могут сопровождать его использование, но эти побочные эффекты можно свести к минимуму путем совместного приема с бензодиазепинами. Обладает обезболивающими и сберегающими опиоиды свойствами.
Потенциальная токсичность
Многочисленные исследования на грызунах показывают, что антагонисты рецепторов NMDA, включая кетамин, вызывают нейродегенерацию в развивающемся мозге. Также имеются данные о том, что другие общие анестетики, такие как изофлуран, могут вызывать гибель нейрональных клеток (апоптоз) в моделях новорожденных животных во время ключевых периодов развития нервной системы, что может усугубляться одновременным введением мидазолама или закиси азота.В последнее время возникла озабоченность по поводу безопасности анестезии у младенцев и детей. Недостаточно данных о людях, чтобы подтвердить или опровергнуть клиническую применимость этих результатов. В настоящее время проводятся проспективные рандомизированные клинические испытания для выяснения клинической значимости этих результатов. 7
Роман в.в. анестетики
Производные пропофола
PFO713
Аналогичен пропофолу, но содержит более крупные боковые цепи в положениях 2, 6 фенольного кольца (рис.1). Он содержит два определенных хиральных центра, а также является мощным модулятором рецептора GABA A , обеспечивающим надежную анестезию после болюсной инъекции без боли и улучшенный профиль побочных эффектов со стороны сердечно-сосудистой системы по сравнению с пропофолом. Эта молекула имеет пониженную концентрацию водной фазы по сравнению с пропофолом, что может объяснить отсутствие боли при инъекции. Однако его эффективность после непрерывной инфузии еще предстоит оценить в клинических испытаниях.
Рис. 1
PF0713 представляет собой ( R , R ) -2,6-ди- сек -бутилфенол, соединение, очень похожее на пропофол.И две, и шесть групп в фенольном кольце оптически активны, и именно форма R , R была оценена на человеке.
Рис. 1
PF0713 представляет собой ( R , R ) -2,6-ди- сек -бутилфенол, соединение, очень похожее на пропофол. И две, и шесть групп в фенольном кольце оптически активны, и именно форма R , R была оценена на человеке.
Фоспропофол
Фоспропфол — фосфатный пролекарство пропофола, которое превращается в пропофол в течение нескольких минут после i.v. инъекция. Введение анестезии задерживается, и, соответственно, восстановление происходит медленно. Не вызывает боли при инъекции. Однако это может вызвать боль в промежности или парестезию. Будет ли он полезен в клинической практике, будет зависеть от его эффективности в сравнительных клинических испытаниях и от того, смогут ли анестезиологи определить, как лучше всего использовать этот агент, эффект которого откладывается после введения. 8
Производные этамидата
Метоксикарбонилэтомидат (MOC etomidate)
Этот быстро метаболизирующийся аналог этогоидата вызывает только временное (минимальное) подавление надпочечников.После однократной болюсной инъекции в экспериментальных моделях на животных он проявляет высокую сердечно-сосудистую стабильность. Однако, как и у более новых производных пропофола, его безопасность при непрерывной инфузии еще предстоит оценить. МОС-томидат менее эффективен, чем этомидат и пропофол, и, учитывая его короткую продолжительность действия, поддержание анестезии с помощью инфузии потребует относительно больших доз. Однако подавление надпочечников вероятно во время любой инфузии, что потенциально ограничивает ее клиническую применимость.Он быстро метаболизируется до карбоновых кислот и метанола. Безопасность этих метаболитов в настоящее время неясна (рис. 2).
Рис. 2
Этомидат, МОС-этомидат и его неактивный метаболит МОС-этомидат карбоновой кислоты.
Рис. 2
Этомидат, МОС-этомидат и его неактивный метаболит МОС-этомидат карбоновой кислоты.
Карбоэтомидат
Карбоэтомидат — аналог этогоидата с альтернативным механизмом минимизации подавления надпочечников.Этомидат подавляет стероидогенез, ингибируя фермент цитохрома P450, 11 β-гидроксилазу. Карбоэтомидат модифицирован тем, что в нем отсутствует атом азота в имидазольном кольце этомидата, что значительно снижает его способность ингибировать стероидогенез, тем самым сводя к минимуму адренокортикальное подавление (рис. 3). Он вызывал минимальные изменения артериального давления у экспериментальных животных. Он может оказаться подходящим для поддержания анестезии или седации, когда особенно показана сердечно-сосудистая стабильность, но опять же требует исследования в сравнительных клинических испытаниях. 8
Рис. 3
Карбоэтомидат (обратите внимание, что атом азота был заменен внутри атома углерода в имидазольном кольце).
Рис. 3
Карбоэтомидат (обратите внимание, что атом азота был заменен внутри атома углерода в имидазольном кольце).
Декларация интересов
Не объявлено.
Список литературы
1.,.Общие анестетики: механизмы действия
,Основы анестезии
,2006
2nd EdnPhiladelphia
Mosby Elsevier
(стр.287
—94
) 2,. ,.Внутривенные анестетики
,Foundations of Anesthesia
,2006
2nd EdnPhiladelphia
Mosby Elsevier
(стр.295
—310
) 3,,.Механизмы действия ингаляционных анестетиков
,N Engl J Med
,2003
, vol.348
(стр.2110
—24
) 4,.Подавление памяти и обучения под действием общих анестетиков
,Can J Anaesth
,2011
, vol.58
(стр.167
—77
) 5,.Молекулярные и нейрональные субстраты для общей анестезии
,Nat Rev Neurosci
,2004
, vol.5
(стр.709
—20
) 6,,, et al.Клинические рекомендации по длительному применению седативных и анальгетических средств у взрослых в критическом состоянии
,Crit Care Med
,2002
, vol.30
(стр.119
—41
) 7,.Токсичны ли анестетики для мозга?
,Br J Анаэст
,2011
, т.107
(стр.30
—7
) 8,.Новые лекарства и технологии, внутривенная анестезия снова в движении
,Br J Anaesth
,2010
, vol.105
(стр.246
—54
)© Автор [2013]. Опубликовано Oxford University Press от имени Британского журнала анестезии.Все права защищены. Для получения разрешений обращайтесь по электронной почте: [email protected]
Внутривенное анестезирующее средство — обзор
Послеоперационные причины
Подтверждение адекватной оксигенации и вентиляции является первым шагом в исследовании отсроченного возникновения. Послеоперационная дыхательная недостаточность может вызвать гипоксемию, гиперкапнию или и то, и другое. Причины дыхательной недостаточности могут быть неврологическими, легочными и мышечными. Центральное дыхательное движение может быть потеряно из-за передозировки лекарствами, внутричерепной патологии, хронической обструктивной болезни легких или апноэ во сне.Вентиляция нарушается из-за первичных мышечных проблем, метаболического дисбаланса, ожирения и остаточной нервно-мышечной блокады. Гипоксемия приводит к гипоксии головного мозга и угнетает функцию коры головного мозга. Гиперкапния, воспринимаемая центральными хеморецепторами, первоначально стимулирует дыхание, но с прогрессированием угнетает регулирующие дыхательные центры мозга, вызывая дальнейшую гиповентиляцию. Гиперкапния приводит к расширению церебральных сосудов, что приводит к увеличению объема церебральной крови, а у пациента с травмой головы и нарушением внутричерепной податливости наблюдается повышение ВЧД, что может привести к вторичному повреждению нейронов. 15
Внимание к гемодинамике, особенно артериальному давлению, также важно во время выпадения. Патофизиология возникновения АГ сложна. Системная АГ является серьезной проблемой, связанной с ранним возникновением АГ, поскольку острая АГ у нейрохирургического пациента может привести к гиперемии мозга и прорывному кровотечению. Сообщается, что частота послеоперационной АГ у нейрохирургических пациентов достигает 70–90%. 18 , 19 Это может быть следствием повышенной симпатической стимуляции, о чем свидетельствует увеличение циркулирующих катехоламинов. 20 Боль во время хирургического закрытия может способствовать симпатической стимуляции, ведущей к возникновению АГ. 21
Взаимосвязь между сердечным выбросом или артериальным давлением и церебральным кровотоком во время выхода не ясна, но, по-видимому, существует связь между выходным симпатическим выбросом и церебральной гиперемией. Bruder et al. обнаружили линейную зависимость между потреблением кислорода и скоростью церебрального кровотока (с помощью транскраниального допплера) при экстубации. 22
Возникшая АГ (систолическое артериальное давление> 200 мм рт. Ст.) Может быть фактором риска ВЧГ после внутричерепной хирургии.В рандомизированном проспективном исследовании низких доз анестетиков у нейрохирургических пациентов Bhagat et al. сообщили о возникновении АГ у 38% пациентов. 21 Такие же результаты наблюдались Bilotta et al., Где использование ремифентанила / суфентанила вместе с пропофолом приводило к АГ после трепанации черепа у 37% пациентов. 23 Talke et al. сообщили об эпизодах гипертонии у 50% пациентов, тогда как Magni et al. наблюдали АГ во время восстановления после внутричерепной хирургии у 29% своих пациентов. 24 , 25 В ретроспективном исследовании случай-контроль Basali et al. 26 сообщили, что у нейрохирургических пациентов в 3,6 раза выше вероятность развития послеоперационной АГ, чем у их контрольной группы. Они обнаружили, что 62% пациентов с ICH имели АГ во время операции по сравнению с только 34% пациентов из контрольной группы (P <0,001). Снова 62% процентов группы ICH имели гипертонию перед кровотечением в первые 12 послеоперационных часов по сравнению с 25% контрольной группы (P <0,001, отношение шансов 4,6) для послеоперационной ICH.Пребывание в стационаре (медиана, 24,5 против 11,0 дней) и смертность (18,2 против 1,6%) были значительно выше в ICH, чем в контрольных группах. Это особенно важно для нейрохирурга, который может достичь гемостаза при низком или нормальном кровяном давлении, но столкнуться с кровотечением при более высоком давлении.
Поскольку системная АГ является обычным явлением при возникновении болезни, можно рассмотреть возможность профилактического вливания эсмолола (или других симпатолитических препаратов). Дозы от 200 до 300 мг / кг / мин использовались для контроля системной гипертензии. 18 Бета-адреноблокаторы могут притуплять гиперемию головного мозга во время появления гипертонии. Различные внутривенные гипотензивные агенты (лабеталол, урапидил или никардипин) доступны для контроля немедленного повышения системной гипертензии во время ее появления. Сравнительное исследование лабеталола и никардипина для контроля возникновения артериальной гипертензии после краниотомии показало, что в группе, получавшей никардипин, наблюдалась более высокая частота гипотензии и тахикардии. 27 Комбинация дилтиазема и никардипина может быть эффективной, с тем преимуществом, что она вызывает меньшую тахикардию, чем один никардипин.Использование низких доз фентанила во время закрытия трепанации черепа также может быть эффективным для предотвращения ранней послеоперационной гипертензии. 21
Включение измерения электролитов и глюкозы в крови в анализ газов крови также может помочь в исключении метаболических причин отсроченного возникновения. У пациента с церебральной солевой недостаточностью или несахарным диабетом могут наблюдаться резкие изменения уровня натрия в крови, приводящие к изменениям психического статуса и даже к судорогам. Легкая гипонатриемия обычно протекает бессимптомно, но концентрация натрия в сыворотке <120 ммоль / л вызывает спутанность сознания и раздражительность.Дальнейшее снижение до <110 ммоль / л может вызвать судороги и кому. Синдром неадекватной секреции антидиуретического гормона вызывает гипонатриемию и может быть результатом травмы головного мозга, субарахноидального кровоизлияния и применения различных лекарств (например, опиоидов, галоперидола и вазопрессина). Синдром церебральной солевой недостаточности с аналогичными последствиями также может возникать у пациента с травмой головного мозга.
Крайняя гипернатриемия (Na> 160 ммоль / л) может редко возникать в послеоперационном периоде. Избыток натрия обезвоживает клетки мозга, что может привести к разрыву сосудов и ICH.Клинические эффекты уремии разнообразны, но в тяжелых случаях внутримозговые изменения могут вызывать сонливость, спутанность сознания и кому. 15 Также важно уделять внимание другим электролитам; внутривенное введение магния во время операции для предотвращения судорог также может вызывать мышечную слабость или усиливать нервно-мышечную блокаду.
Поскольку мозг полностью зависит от глюкозы как источника энергии, нейрогликопения может вызвать спутанность сознания, ненормальное поведение, судороги и кому. Это может произойти у маленьких детей, а также при плохо контролируемом диабете, голодании и употреблении алкоголя. 14 Тяжелая гипергликемия также может продлить бессознательное состояние после наркоза. У нелеченного пациента он вызывает осмотический диурез и обезвоживание, что приводит к сонливости и ацидозу. В тяжелых случаях гиперосмоляльность и повышенная вязкость крови предрасполагают к развитию церебрального синуса или венозного тромбоза и отека мозга. Интраоперационная окклюзия сосудов у диабетиков с микрососудистыми и макрососудистыми заболеваниями может привести к ишемическому инсульту. 15
Внутривенные анестетики, используемые для подавления вспышки и защиты мозга во время временного клипирования артерии, могут продлить возникновение.Время появления зависит от введенной дозы и фармакокинетики применяемого средства.
Clinical Pearl
В зависимости от характера нейрохирургической процедуры вероятность послеоперационных припадков может быть высокой и может быть потенциальным источником отсроченного возникновения. Приступы могут быть незначительными у появляющегося пациента и могут быть несудорожными или включать продолжающийся нистагм, легкие движения пальцев рук и ног или подергивания в уголках рта.
Еще одно важное требование для своевременного появления на свет — нормотермия.Если во время нейрохирургии используется индуцированная гипотермия или температура тела падает из-за неадекватных методов согревания, температура будет низкой во время появления. Последствия переохлаждения многочисленны и широко распространены. При понижении температуры могут возникнуть спутанность сознания (<35 ° C), потеря сознания (<30 ° C), апноэ (<24 ° C) и отсутствие церебральной активности (<18 ° C). При значительном снижении температуры снижается сердечный выброс и могут возникать аритмии. Низкий сердечный выброс влияет на кровообращение и перфузию тканей, а также на фармакокинетику лекарств. 15
Clinical Pearl
Гипотермия часто встречается у нейрохирургических пациентов, поскольку во время операции могут быть затронуты структуры гипоталамуса, что затрудняет терморегуляцию.
Дрожь, вызванная гипотермией при появлении, может увеличить потребление кислорода и привести к ацидозу. Гипотермия может вызвать другие осложнения, такие как замедленное заживление ран, ишемия миокарда и коагулопатия. 28 Дрожь увеличивает потребности мозга в метаболизме и в некоторых случаях может быть неверно интерпретирована как судорожная активность, особенно в контексте неполного снятия нервно-мышечной блокады.Лучший способ контролировать послеоперационную дрожь — поддерживать нормотермию, чего можно добиться с помощью принудительного подогрева воздуха во время нейрохирургии. Потребление кислорода и повышение уровня катехоламинов в крови меньше во время выздоровления сразу после операции у нормотермных пациентов. 20 Фармакологические методы могут использоваться для предотвращения послеоперационной дрожи, учитывая, что эти фармакологические агенты сами по себе могут вызывать седативный эффект. 29 Также важно понимать, что гипертермия нежелательна во время нейрохирургических процедур. 30
Хирургические причины
Несмотря на то, что существует длинный список причин отсроченного появления анестетиков, не следует откладывать рассмотрение возможных хирургических осложнений. Алгоритмический подход, как упоминалось ранее, для определения причины и лечения — лучший курс действий. Связь между анестезиологом и нейрохирургом в момент возникновения болезни должна быть постоянной и своевременной. Если есть какая-либо вероятность того, что задержка появления не является результатом действия анестезии, следует немедленно уведомить хирурга.Внутричерепное кровоизлияние, возникающее в послеоперационном периоде из источника кровотечения, вызванного недостаточным гемостазом, может быстро расшириться. Хотя некоторые анестезирующие и реверсивные агенты могут влиять на размер зрачка и реактивность, неравный размер зрачка должен вызывать опасения по поводу ICH. Интраоперационная травма и повреждение жизненно важных областей головного мозга также могут отсрочить появление, что оправдывает использование препаратов короткого действия для ускоренного неврологического обследования.
Судороги после нейрохирургии могут быть особенно проблематичными.Хотя нет никаких доказательств того, что профилактика судорог с помощью противоэпилептических препаратов должна использоваться для всех внутричерепных процедур, 31 эти препараты обычно используются в клинической практике. Как упоминалось ранее, эти агенты могут вызывать длительное прекращение седативного действия.
Вакуумная система, подключенная к системе экстрадурального дренажа, может быть источником послеоперационного кровотечения. Его следует внимательно проверить на предмет более сильного, чем ожидалось, кровотечения, которое может привести к тяжелой гипотензии, если не будет обнаружено вовремя.Причиной кровоизлияния в мозг, которую часто не замечают, является отрицательное давление дренажа. 32 , 33 Преходящая брадикардия после подключения вакуумного устройства является предупреждающим признаком этого осложнения.
Причины остаточного действия анестетика
Ранняя послеоперационная диагностика неврологических осложнений является важным шагом в ограничении церебральных осложнений и улучшении результатов. Однако некоторые послеоперационные анестетики могут имитировать очаговый неврологический дефицит.Низкие дозы мидазолама или фентанила могут обострять или демонстрировать очаговые неврологические нарушения у более чем 60% пациентов с предшествующей компенсированной неврологической дисфункцией. Также может произойти временное повторное появление очаговых симптомов у пациентов с отдаленным (хроническим) инсультом. 34 Это наблюдение может объяснить некоторые сообщения о резком исчезновении послеоперационного неврологического дефицита с помощью налоксона 35 и наблюдение временных неврологических нарушений в период восстановления после нейрохирургии.Использование анестетиков короткого действия во время нейрохирургической анестезии позволяет избежать ненужных сканирований с помощью компьютерной томографии черепа или экстренного повторного открытия черепа.
Системные и основные причины отсроченного появления яиц приведены в Таблице 45.1.
Внутривенный анестетик — обзор
Внутривенный анестетик
Внутривенный анестетик можно условно разделить на три класса: седативно-снотворные средства, миорелаксанты и опиоиды. Другие агенты включают антихолинэстеразы, холинолитики и антагонисты опиоидов (см. Таблицу 26-5).Внутривенные анестетики, такие как ингаляционные анестетики, обладают седативно-снотворным эффектом, который отражает концентрацию агента в ЦНС. Агенты, вводимые внутривенно, быстро распределяются в богатых сосудами областях, таких как ЦНС, сердце и почки. Прекращение действия определяется, прежде всего, повторным перераспределением лекарств в группы мышц и в менее перфузионные области тела, такие как жир и кости. Фармакокинетика для каждого пациента варьируется в зависимости от состава тела, распределения сердечного выброса, уровня белков плазмы, метаболизма и экскреции.Различия между пациентами не позволяют точно предвидеть эффект от внутривенных анестетиков и требуют от анестезиолога тщательного титрования анестетиков в соответствии с ответом каждого пациента. Хорошо задокументировано, что новорожденные гораздо более подвержены кардиореспираторным эффектам внутривенных анестетиков, чем взрослые 192 ; поэтому единичная дозировка анестетиков не только неэффективна, но и небезопасна.
Несмотря на растущую популярность и использование в анестезии у взрослых, большинство внутривенных препаратов у младенцев недостаточно изучены.Наиболее доступная фармакокинетическая информация об анальгетиках и седативных средствах у незрелых субъектов получена на животных моделях. 193–195 Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США решило эту проблему, и в настоящее время разрабатываются стимулы для фармацевтических компаний к изучению новых лекарств у детей. 196, 197 Наиболее часто используемыми внутривенными седативными снотворными средствами являются пропофол, тиопентал и кетамин. Пропофол, в частности, получил признание, потому что он имеет более быстрое начало и прекращение, чем тиопентал или кетамин. 198–200 Пропофол проявляет меньшую раздражительность дыхательных путей, послеоперационный седативный эффект и тошноту или рвоту. 201, 202 Недостатком пропофола является боль при внутривенном введении. 203 К счастью, дети, которым требуется частая анестезия, имеют доступ к центральным венам, что позволяет избежать трудностей с периферическим введением. Вдыхание 50% N 2 O значительно уменьшает боль из-за введения пропофола. 204 Дополнительная проблема пропофола связана с молниеносным метаболическим ацидозом, связанным с длительными инфузиями в отделениях интенсивной терапии.Это может быть связано с нарушением окисления жирных кислот. 205 Долгосрочные инфузии пропофола, когда-то использовавшиеся в условиях интенсивной терапии, больше не рекомендуются для детей. 206, 207
Барбитураты тиопентал и метогекситал по-прежнему часто используются, хотя в значительной степени они были заменены пропофолом. Индукция тиопенталом безболезненна и является разумной заменой пропофола, когда быстрое появление не является важным фактором. Прекращение действия происходит из-за перераспределения, но более длительный период полувыведения у новорожденных может быть связан с уменьшением клиренса. 208, 209 Тиопентал является миокардиальным депрессантом и сосудорасширяющим средством, поэтому при назначении его младенцу с гиповолемией необходимо соблюдать особую осторожность. 210 Метогекситал, вводимый ректально в дозе 25–30 мг / кг, обеспечивает седативный эффект на 60–80 минут, позволяя провести краткие диагностические процедуры, или действует как предоперационная седация у детей старшего возраста. 211–214
Кетамин, производное фенциклидина, первоначально разработанный для использования в ветеринарии, представляет собой адъювант для внутривенной анестезии, который оказывает сильное обезболивающее и седативное действие.Вскоре после введения кетамин был рекомендован для педиатрической анестезии, поскольку он обеспечивал большую сердечно-сосудистую стабильность, меньшее угнетение дыхания и лучшее поддержание защитных рефлексов дыхательных путей. 215 Кетамин действительно обеспечивает большую стабильность сердечно-сосудистой системы у младенцев, страдающих от шока и сердечной недостаточности, но он также вызывает длительный седативный эффект, увеличение секреции ротоглотки и большее угнетение дыхания и нарушение дыхательных путей, чем предполагалось изначально. 215 Кетамин оказался наиболее полезным в качестве анестетика у самых больных младенцев с цианотическим врожденным пороком сердца, которым требуется длительная послеоперационная вентиляция. 215 Кетамин не является хорошим выбором анестетика для новорожденных, которых отлучат от ИВЛ в ближайшем послеоперационном периоде. По показаниям, внутривенное введение кетамина, титруемого до достижения эффекта, дает значительно более короткое время восстановления, чем большие внутримышечные болюсы препарата. 215
Морфин — наиболее часто используемый опиоид в педиатрической анестезии.Для младенцев, перенесших серьезную операцию, морфин обеспечивает надежную анальгезию длительного действия. Его можно вводить перорально, внутримышечно или внутривенно. Клиренс морфина у новорожденных составляет всего 9,2 мл / кг / мин по сравнению с клиренсом у взрослых 49 мл / кг / мин. 216 Уменьшение клиренса подвергает новорожденных риску быстрого накопления и угнетения дыхания. Кроме того, незрелый гематоэнцефалический барьер новорожденного в исследованиях на животных приводит к тому, что концентрация морфина в ЦНС у новорожденных в два-три раза выше, чем у взрослых. 195
Фентанил — более мощный опиоид короткого действия, чем морфин. Он часто используется в качестве анестетика в дополнение к общей анестезии. Это особенно полезно при сердечной анестезии, где высокие дозы от 50 до 100 мкг / кг очень эффективны для блокирования стрессовой реакции на операцию с минимальными гемодинамическими последствиями. 217, 218 Как и морфин, фентанил имеет более длительный период полувыведения и меньший клиренс у младенцев по сравнению с детьми более старшего возраста. 219
Ремифентанил — новейший синтетический опиоид.Он имеет чрезвычайно короткий период полувыведения, не накапливается во время инфузий и метаболизируется неспецифическими эстеразами. 220 Период полураспада от 3 до 5 минут и быстрое выведение могут избежать послеоперационных респираторных эффектов других наркотиков. Два основных недостатка ремифентанила заключаются в том, что его необходимо постоянно вводить внутривенно и что необходимо вводить дополнительные анальгетики для послеоперационного контроля боли. Как и в случае других синтетических опиоидов, брадикардия 221 и ригидность грудной клетки 222 могут быть серьезными, поэтому следует ожидать лечения ваголитиками и миорелаксантами.
Таким образом, все внутривенные анестетики могут вызывать непредсказуемые эффекты у новорожденных, и их следует тщательно титровать в уменьшенных дозах при индукции анестезии, чтобы избежать послеоперационного апноэ и седации. Обратимые агенты, такие как наркотики и недеполяризующие миорелаксанты, могут предложить большую универсальность и меньший риск послеоперационного апноэ, чем необратимые агенты длительного действия, такие как барбитураты, основные транквилизаторы и кетамин.
Ресурсы лабораторных животных — Ресурсы лабораторных животных
Университет Монтаны признает необходимость разумного и этичного использования животных для достижения своей цели как образовательного и исследовательского центра.Сотрудники LAR сертифицированы Американской ассоциацией лабораторных животных и имеют многолетний опыт ухода за лабораторными животными.
Программа по уходу и использованию животных Университета Монтаны была аккредитована Американской ассоциацией по аккредитации Международной организации по уходу за лабораторными животными (AAALAC) с 1967 года. UM гордится тем, что является одним из первых участников этой программы добровольной аккредитации, которая фокусируется на все аспекты использования и ухода за животными.
Институциональный комитет по уходу и использованию животных (IACUC) играет ключевую роль в обеспечении строгого соблюдения Университетом соответствующих законов и руководящих принципов, касающихся использования живых животных в исследованиях и образовании.IACUC, посредством процесса обзора протокола, изложенного в Политике службы общественного здравоохранения в отношении гуманного ухода и использования лабораторных животных, поддерживает самые строгие законы, касающиеся использования животных.
Протокол использования животных (AUP) должен быть одобрен IACUC до начала любого исследовательского проекта с использованием живых животных. Копия этой утвержденной формы должна храниться в офисе координатора IACUC по телефону (406) 243-6395 до начала любого такого исследования. Для исследовательских и / или учебных программ, нуждающихся в внешней поддержке (например,g., NSF, NIH, частные фонды), эта форма должна быть отправлена не позднее отправки Контрольного списка ORSP для утверждения спонсируемых программ через E-Prop.
Ключевой персонал
Келли Каррик, rLATG, ILAM
Заведующий отделением, Департамент ресурсов лабораторных животных
(406) 243-4892
Кэтрин Хейвилин, BS, CPIA, RBP
Менеджер и заместитель председателя IACUC; Специалист по биобезопасности
(406) 243-6395
Пэм Бруссард, DVM
Ветеринарный врач
(406) 552-9599
