Оптимизация послеоперационного ведения пациентов с кистовидными образованиями челюстей больших размеров
Оптимизация послеоперационного ведения пациентов с кистовидными образованиями челюстей больших размеров
Сайт издательства «Медиа Сфера»
содержит материалы, предназначенные исключительно для работников здравоохранения. Закрывая это сообщение, Вы подтверждаете, что являетесь дипломированным медицинским работником или студентом медицинского образовательного учреждения.
Просычева О.О.
ГБОУ ВПО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России, Россия
Оптимизация послеоперационного ведения пациентов с кистовидными образованиями челюстей больших размеров
Авторы:
Просычева О.О.
Подробнее об авторах
Журнал:
Российская стоматология. 2016;9(2): 65‑65
2016;9(2): 65‑65
Как цитировать:
Просычева О.О. Оптимизация послеоперационного ведения пациентов с кистовидными образованиями челюстей больших размеров. Российская стоматология.
2016;9(2):65‑65.
Prosycheva OO. . Russian Stomatology. 2016;9(2):65‑65. (In Russ.)
Читать метаданные
Авторы:
Просычева О.О.
ГБОУ ВПО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России, Россия
Закрыть метаданные
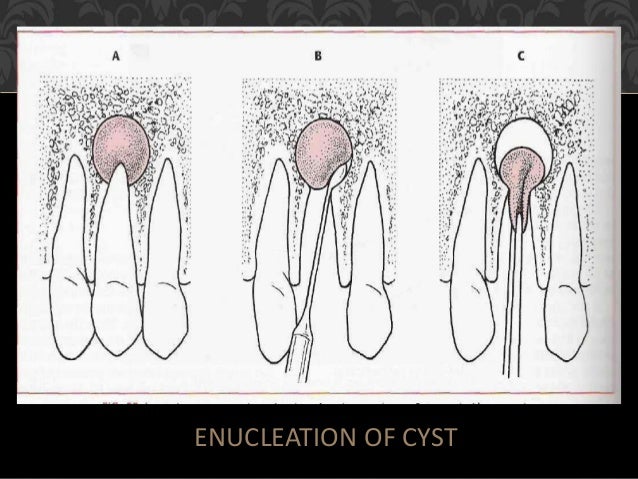
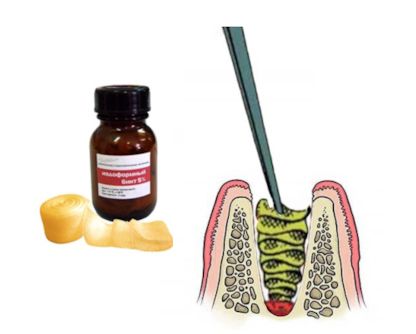
Одонтогенные кисты челюстей составляют от 8 до 12% всех заболеваний челюстно-лицевой области и достигают 80—85% среди опухолей и опухолеподобных образований. До настоящего времени часто выявляются кистовидные образования челюстей больших размеров с разрушением окружающих костных стенок, проникающие в соседние анатомические образования: полость носа, верхнечелюстной синус и др.

Материал и методы. В наших совместных исследованиях на базе клиники центра стоматологии и челюстно-лицевой хирургии МГМСУ и ЦНИИ швейной промышленности РФ разработаны и исследованы турунды из нетканых материалов. На лабораторном этапе исследования проведено сравнение технических показателей нетканых материалов с медицинской марлей. Разработаны: неперфорированный гидроструйный нетканый материал (НГНМ), с содержанием вискозы и полиэстера в соотношении 70/30 и плотностью 45 г/м2 и перфорированный гидроструйный нетканый материал (ПГНМ), с содержанием вискозы и полиэстера 50/50 и плотностью 55 г/м2. Разработанные материалы соответствуют техническим условиям, прошли токсикологическую экспертизу и разрешены к применению в качестве перевязочных материалов (патент № 2012150117 от 23.11.12). Нами обследованы и прооперированы 34 пациента с одонтогенными кистами верхней челюсти больших размеров, локализующихся преимущественно во фронтальном отделе и проникающими в полость носа, верхнечелюстной синус и вызывающих деструкцию твердого неба.

Результаты. В экспериментальной части проведено сравнительное исследование степени адгезии медицинской марли — 5,7 Н/см; йодоформной турунды (официнальной) — 3,7 Н/см; НГНМ — 1,6 Н/см; ПГНМ — 1,2 Н/см. Выявлена высокая степень адгезии марлевого носителя к прилежащей поверхности, что не соответствует требованиям ГОСТ к перевязочным материалам (максимум 3,0 Н/см).
При предоперационном обследовании зубов, проецирующихся в кистозную полость, выявлено, что в большинстве случаев клинически интактные зубы не были вовлечены в процесс деструкции костной ткани и имели значения ЭОД до 10—17 мкА.
Выявлены значительные различия у пациентов сравниваемых групп по характеру и продолжительности болевого синдрома в зависимости от используемого перевязочного материала. Интенсивность болевого синдрома при первой перевязке на 7-е сутки послеоперационного периода не выявила статистически достоверных отличий и составила максимальные 10 баллов, что соответствует интенсивной боли. Однако на 2-й и 3-й перевязках выявлены статистически достоверные отличия у пациентов 2-й и 3-й групп относительно 1-й группы, где применялась йодоформная турунда. Показатели интенсивности болевого синдрома составили на второй перевязке (14-е сутки послеоперационного периода): 1-я группа — 8,6 балла, 2-я — 4,3 и 3-я — 4,7 соответственно; на третьей перевязке (21-е сутки): 1-я группа — 4,8; 2-я — 3,2; 3-я — 3,5 балла.
При перевязках выявлено отличие в сроках эпителизации раневой поверхности в зависимости от применяемого при лечении материала. Применение НГНМ и ПГНМ в группах сравнения статистически достоверно уменьшает срок эпителизации раневой поверхности по сравнению с контрольной группой. Так, в 1-й группе (контрольной) эпителизация раневой поверхности происходила в среднем на 32-е сутки лечения, во 2-й группе (НГНМ) — на 24-е сутки, в 3-й группе (ПГНМ) — на 22-е сутки.
Также при клиническом применении выявлена значительная травматизация грануляционной ткани, выражающейся кровоточивостью раневой поверхности при перевязках с применением йодоформной турунды вплоть до 28 сут послеоперационного лечения. При применении нетканых материалов кровоточивость при перевязках сохранялась до 20 сут. Вместе с тем выявлены явления деструкции по линии перфорации материала при перевязках с применением ПГНМ на 7-е сутки нахождения в ране.
Вывод. Применение нетканых материалов повышает эффективность лечения пациентов с одонтогенными кистами челюстей больших размеров в раннем послеоперационном периоде после проведения операции цистотомии за счет снижения болевого синдрома и уменьшения периода эпителизации раневой поверхности.
Профилактика воспалительных осложнений после удаления третьих моляров нижней челюсти
Профилактика воспалительных осложнений после удаления третьих моляров нижней челюсти
Сайт издательства «Медиа Сфера»
содержит материалы, предназначенные исключительно для работников здравоохранения. Закрывая это сообщение, Вы подтверждаете, что являетесь дипломированным медицинским работником или студентом медицинского образовательного учреждения.
ФГБУ «Центральный научный исследовательский институт стоматологии и челюстно-лицевой хирургии» Минздрава России
Гурин А.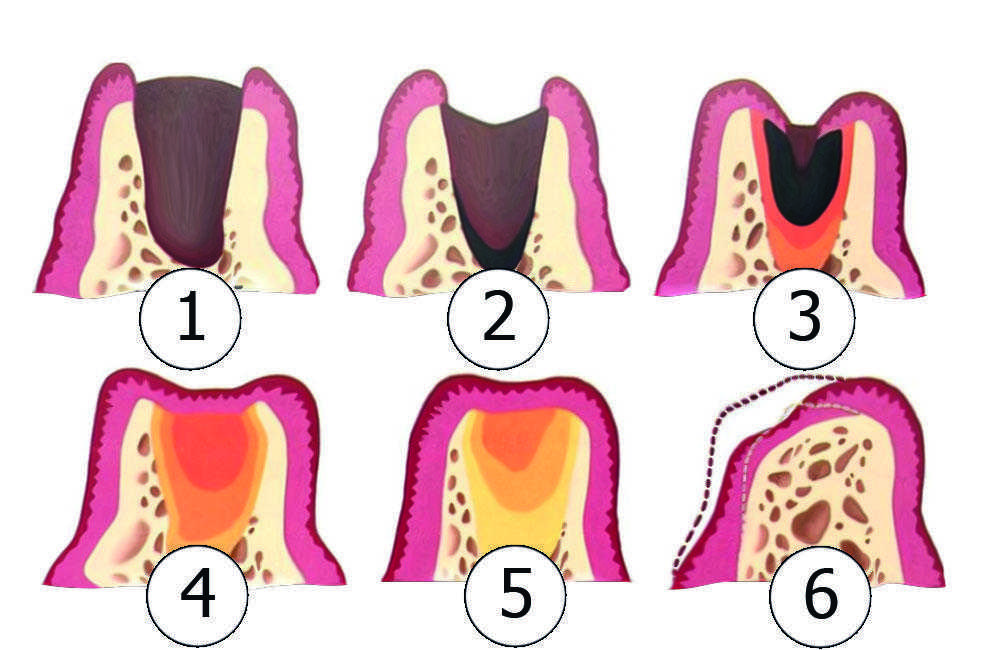 Н.
Н.
ФГБУ НМИЦ «Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии» Минздрава России
Витренко Д.В.
ФГБУ НМИЦ «Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии» Минздрава России
Левченко Д.Д.
ФГБУ НМИЦ «Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии» Минздрава России
Профилактика воспалительных осложнений после удаления третьих моляров нижней челюсти
Авторы:
Семкин В.А., Гурин А.Н., Витренко Д.В., Левченко Д.Д.
Подробнее об авторах
Журнал: Стоматология. 2022;101(3): 38‑43
DOI: 10.17116/stomat202210103138
Как цитировать:
Семкин В.А., Гурин А.Н., Витренко Д.В., Левченко Д. Д. Профилактика воспалительных осложнений после удаления третьих моляров нижней челюсти. Стоматология.
2022;101(3):38‑43.
Д. Профилактика воспалительных осложнений после удаления третьих моляров нижней челюсти. Стоматология.
2022;101(3):38‑43.
Syomkin VA, Gurin AN, Vitrenko DV, Levchenko DD. Prevention of inflammatory complications after surgical extraction of mandibular third molars. Stomatologiya. 2022;101(3):38‑43. (In Russ.)
https://doi.org/10.17116/stomat202210103138
Закрыть метаданные
ОБОСНОВАНИЕ
Наиболее распространенными осложнениями после удаления ретенированных третьих моляров нижней челюсти являются воспалительные осложнения. К основным вариантам профилактики относятся назначение антибиотиков до операции и/или в послеоперационном периоде; способ послеоперационного ведения лунки зуба, подразумевающий заживление первичным либо вторичным натяжением. Каждый из вариантов послеоперационного ведения обладает преимуществами и недостатками.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Сравнение глухого ушивания и тампонады лунки йодоформной турундой после удаления ретенированных третьих моляров нижней челюсти для профилактики воспалительных осложнений.
МАТЕРИАЛ И МЕТОДЫ
Выполнено рестроспективное когортное исследование. Проанализированы медицинские карты 273 пациентов, которым было выполнено удаление ретенированных нижних третьих моляров по ортодонтическим показаниям. В исследование включена медицинская документация 100 пациентов, в 50 случаях послеоперационное ведение осуществлялось с использованием йодоформной турунды, в 50 случаях проведено только глухое ушивание лунки. В зависимости от типа данных и их распределения использовались тест хи-квадрат, точный критерий Фишера двусторонний, критерий t Стьюдента, критерий U Манна—Уитни. Статистически значимыми считали различия при p<0,05.
РЕЗУЛЬТАТЫ
У пациентов, у которых в послеоперационном периоде использовали йодоформную турунду, альвеолит развивался в 8 %, при глухом ушивании лунки — в 34% (p=0,003). Общий период реабилитации у пациентов без альвеолита с использованием турунды составил 8 [7; 31] сут., при глухом ушивании — 7 [7; 8] сут. (p=0,003).
(p=0,003).
ЗАКЛЮЧЕНИЕ
Оптимальным вариантом профилактики альвеолита после удаления третьих моляров нижней челюсти является заживление вторичным натяжением с использованием йодоформной турунды. Однако при глухом ушивании заживление происходило значительно быстрее в случае, если в послеоперационном периоде не возникал альвеолит, что обосновывает разработку альтернативного способа ведения лунки зуба.
Ключевые слова:
альвеолит
третий моляр нижней челюсти
реабилитация
когортное исследование
Авторы:
Семкин В.А.
ФГБУ «Центральный научный исследовательский институт стоматологии и челюстно-лицевой хирургии» Минздрава России
Гурин А.Н.
ФГБУ НМИЦ «Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии» Минздрава России
Витренко Д.В.
ФГБУ НМИЦ «Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии» Минздрава России
Левченко Д. Д.
Д.
ФГБУ НМИЦ «Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии» Минздрава России
Список литературы:
- Bouloux GF, Steed MB, Perciaccante VJ. Complications of Third Molar Surgery. Oral Maxillofac Surg Clin North Am. 2007;19(1):117-128. https://doi.org/10.1016/j.coms.2006.11.013
- Brauer HU. Unusual complications associated with third molar surgery: a systematic review. Quintessence Int. 2009;40(7):565-572.
- Bouloux GF, Steed MB, Perciaccante VJ. Complications of third molar surgery. Oral Maxillofac Surg Clin North Am. 2007;19(1):117-vii. https://doi.org/10.1016/j.coms.2006.11.013
- Зорина О.А., Петрухина Н.Б., Борискина О.А. Медикаментозное сопровождение альвеолита челюсти препаратом Холисал. Стоматология. 2019;98(6):58-64. https://doi.org/10.17116/stomat20199806158
- Daly B, Sharif MO, Newton T, Jones K, Worthington H V. Local interventions for the management of alveolar osteitis (dry socket). Cochrane Database Syst Rev.
 Published online December 2012. https://doi.org/10.1002/14651858.CD006968.pub2
Published online December 2012. https://doi.org/10.1002/14651858.CD006968.pub2 - Хирургическая стоматология: национальное руководство. Под ред. Кулакова А.А. М.: ГЭОТАР-Медиа; 2021;107-108. https://doi.org/10.33029/9704-6001-6-SUR-2020-1-408
- Shen LH, Xiao E, Wang EB, Zheng H, Zhang Y. High-Throughput Sequencing Analysis of Microbial Profiles in the Dry Socket. J Oral Maxillofac Surg. 2019;77(8):1548-1556. https://doi.org/10.1016/j.joms.2019.02.041
- Balamurugan R, Zachariah T. Comparison of primary and secondary closure with a buccal mucosal-advancement flap on postoperative course after mandibular impacted third molar surgery. Oral Maxillofac Surg. 2020;24(1): 37-43. https://doi.org/10.1007/s10006-019-00814-w
- Brunello G, De Biagi M, Crepaldi G, Rodrigues FI, Sivolella S. An Observational Cohort Study on Delayed-Onset Infections after Mandibular Third-Molar Extractions. Int J Dent. 2017;2017:1435348. https://doi.org/10.1155/2017/1435348
- Figueiredo R, Valmaseda-Castellón E, Formoso-Senande MF, Berini-Aytés L, Gay-Escoda C.
 Delayed-onset infections after impacted lower third molar extraction: involved bacteria and sensitivity profiles to commonly used antibiotics. Oral Surg Oral Med Oral Pathol Oral Radiol. 2012;114(1):43-48. https://doi.org/10.1016/j.tripleo.2011.06.022
Delayed-onset infections after impacted lower third molar extraction: involved bacteria and sensitivity profiles to commonly used antibiotics. Oral Surg Oral Med Oral Pathol Oral Radiol. 2012;114(1):43-48. https://doi.org/10.1016/j.tripleo.2011.06.022 - Blum IR. Contemporary views on dry socket (alveolar osteitis): A clinical appraisal of standardization, aetiopathogenesis and management: A critical review. Int J Oral Maxillofac Surg. 2002;31(3):309-317. https://doi.org/10.1054/ijom.2002.0263
- Øyri H, Jensen JL, Barkvoll P, Jonsdottir OH, Reseland J, Bjørnland T. Incidence of alveolar osteitis after mandibular third molar surgery. Can inflammatory cytokines be identified locally? Acta Odontol Scand. 2021;79(3):205-211. https://doi.org/10.1080/00016357.2020.1817546
- Гржибовский А.М., Горбатова М.А., Наркевич А.Н., Виноградов К.А. Необходимый объем выборки для сравнений долей в двух независимых группах. Морская медицина. 2020;6(3):76-83. https://doi.org/10.22328/2413-5747-2020-6-3-76-83
Закрыть метаданные
Никифоров вадим станиславовичПатенты | ПатентГуру
Назад
- Фильтр
- История поиска
Дата подачи
—
Дата публикации
—
Изобретатель
МПК (секция)
МПК (класс)
МПК (подкласс)
МПК (группа)
МПК (подгруппа)
Агентство
Номер претензии
Номер фигурки
Мои документы
- Все
- Архив
-
Узнать больше
См.
 меньше
меньше
- Новый тег
Мой взгляд
- Отмеченный
Моя группа ключевых слов
- Группа ключевых слов
Настройка
Настройки партнера
- Фильтр
- Расширенный
- Сохранить
- Команда
- Подсветка
- Анализ
- Сплит
- Сравнить
- Экспорт
- Скачать
- Оповещения
- Слияние
- Поделиться
- Электронная почта
- Настройки дисплея
- Сохранить поиск
- Правила слияния семей
- Порядок времени Самое раннее приложение Последнее приложение Самая ранняя публикация Последняя публикация
- Приказ учреждения CNUSEP
- Номер заявки Правила слияния
- Предыдущие патенты Применение Патент
Обработка. ..
..
Пожалуйста, не нажимайте назад и не закрывайте это окно, пока мы обрабатываем ваш заказ.
Заголовок
-
- Полный текст
- МПК
Заголовок
-
- Полный текст
- МПК
3. Текущая квота
Текущая квота
3000 записей Истекает через 1 месяц
Максимум 1000 записей на одну загрузку.
$ 9,90
15000 записей Истекает через 1 месяц
Максимум 1000 записей на одну загрузку.
$ 39,90
30000 записей Истекает через 12 месяцев
Максимум 1000 записей на загрузку.
69,90 $
1. Диапазон экспорта
- Выбранные документы (всего 0)
- От к (всего 1 )
2. Формат экспорта
Формат экспорта
3.Скачать структуру папок с файлами
В одной папке (под корнем) Папка отсортирована по годам
4.Текущая квота
1000 записей Истекает через 1 месяц
Максимум 1000 записей на одну загрузку.
$ 9,90
5000 записей Истекает через 1 месяц
Максимум 1000 записей на загрузку.
$ 39,90
10000 записей Истекает через 12 месяцев
Максимум 1000 записей на загрузку.
69,90 $
Если вы удалите , они не смогут видеть будущие изменения в этой общей папке.
Имя предупреждения
Способ уведомления
Частота уведомления
Еженедельно
Ежемесячно
Журнал СТМ — Html View
Рябова Д.А., Орлинская Н.Ю., Цыбусов С.Н., Хомутинникова Н.Е., Лапшин Р.Д., Дурново Е.А.
Ключевые слова : дефекты слизистой оболочки полости рта; рубцовая деформация; регенерация слизистой оболочки полости рта; полимерная фосфолипидная матрица; Реперен.
Целью исследования была оценка возможностей применения полимерной матрицы из материала Реперен для закрытия открытой раневой поверхности на слизистой оболочке полости рта.
Материалы и методы. Экспериментальное исследование проведено на 15 кроликах породы шиншилла. Половина созданного дефекта на слизистой твердого неба зажила под полимерной матрицей «Реперен», а другая половина зажила вторичным натяжением. Результаты гистологического и цитологического исследования оценивали на 3, 5 и 7 сутки.
результатов. Площадь грануляций и соединительной ткани в препаратах слизистой, заживляющих без репереновой матрицы, на 5-е сутки составила 25,0±1,2 и 15,0±1,1%, а на 7-е сутки — 15,0±1,2 и 25,0±1,7% соответственно. При этом в препаратах слизистой оболочки, заживляемой под полимерной матрицей Реперен, их значения существенно изменились: на 3-и сутки они составили 25,0±1,2 и 20,0±1,1%, а на 7-е сутки — 10,0±1,3 и 40,0±1,7%.
Заключение. Полимерная матрица «Реперен» способствует интенсификации местных регенеративных процессов в ране и может быть использована для закрытия больших открытых раневых поверхностей на слизистой оболочке полости рта.
Исходы хирургических вмешательств в полости рта не всегда удовлетворительны и зависят от послеоперационного ведения раны. Даже небольшие по размеру травмы, дефекты и повреждения заставляют хирургов выполнять обширные оперативные вмешательства из-за анатомического строения челюстно-лицевой области в целом и полости рта в частности [1]. Радикальные операции на мягких тканях полости рта часто требуют удаления больших объемов тканей, наложения донорской зоны и формирования послеоперационных дефектов, требующих их одномоментного закрытия и защиты раны.
Заживление открытых раневых поверхностей на слизистой оболочке полости рта протекает обычно вторичным натяжением из-за отсутствия прилежащих местных тканей. При этом происходит постоянное травмирующее воздействие и бактериальное обсеменение раны, вызывающее изменение объема тканей в послеоперационной области и формирование деформирующей рубцовой ткани [2].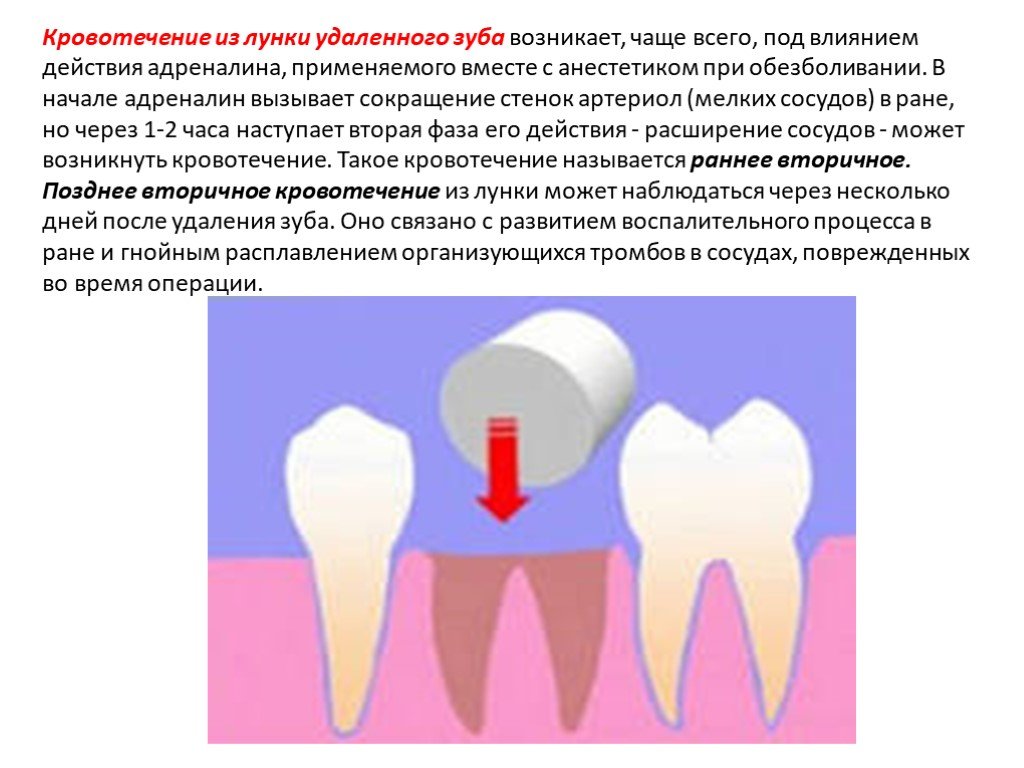 Это часто приводит к изменению архитектоники полости рта, редукции преддверия, а также затрудняет дальнейшее ортопедическое лечение [3–6].
Это часто приводит к изменению архитектоники полости рта, редукции преддверия, а также затрудняет дальнейшее ортопедическое лечение [3–6].
Традиционные методы открытой обработки ран (под йодоформную турунду, Альвогил, ТахоКомб, открытая обработка раневой поверхности, наложение сближающих швов) в большинстве случаев сопровождаются болью, бактериальной инфекцией, кровотечением, а в дальнейшем и формированием рубцовых изменений.
Наложение соединительнотканного лоскута на ножке [7–9] и свободного небного лоскута (свободный десневой лоскут, свободный соединительнотканный лоскут) являются наиболее распространенными методами закрытия открытых ран слизистой оболочки полости рта. Они позволяют хирургам добиваться хороших результатов, но имеют и недостатки, главный из которых – необходимость проведения операции на донорском участке [10, 11]. После удаления аутотрансплантата на небе остается открытая раневая поверхность, которая заживает вторичным натяжением. Послеоперационное течение, сопровождающееся значительным дискомфортом для пациентов, ограничивает применение этих методов в хирургической практике, несмотря на уникальность данного регенеративного материала.
Хотя существует множество консервативных и оперативных методов лечения воспалительно-деструктивных процессов в полости рта, не всегда поврежденные ткани, их первоначальная структура и функции поддаются полному восстановлению. На современном этапе развития хирургической стоматологии ведутся активные поиски новых материалов и методик с более универсальными возможностями и прогнозируемыми результатами, применение которых позволит снизить негативные последствия заживления послеоперационных ран вторичным натяжением.
Следует отметить, что регенерация слизистой оболочки полости рта требует постоянной замены одних популяций клеток другими, специфичными для соединительной ткани, что способствует уменьшению зоны некроза в области раны. Выраженная воспалительная реакция в этом случае активизирует заживление ран вторичным натяжением, но всегда сопровождается миграцией макрофагов и создает благоприятные условия для адгезии микробов [12–16]. В связи с этим большой интерес представляют данные о применении синтетических материалов, позволяющих изолировать послеоперационные дефекты полости рта, защитить раневую поверхность и оптимизировать раневое заживление. Эти материалы не обладают антигенной инородностью и позволяют закрывать дефекты любой конфигурации независимо от строения и формы раневого участка.
Эти материалы не обладают антигенной инородностью и позволяют закрывать дефекты любой конфигурации независимо от строения и формы раневого участка.
Одним из таких материалов является Реперен (Репер Н.Н., Россия) [17]. Этот материал эластичный, т.е. способен принимать любую форму без складок и растяжений, не имеет остаточной деформации. Обладает высокой устойчивостью к биологически активным средам, окислительным процессам и процессам адсорбции белков на поверхности, способствует предотвращению образования грубой соединительнотканной капсулы.
В настоящее время имеется достаточно данных о применении этого материала для закрытия раневых поверхностей в различных областях медицины, таких как общая хирургия, офтальмохирургия, торакопластика, челюстно-лицевая хирургия и нейрохирургия [18–27].
Столь широкое применение полимерного материала «Реперен» и его характеристики сделали привлекательным его применение в хирургической стоматологии для изоляции раневой поверхности после оперативного лечения с целью оптимизации процесса заживления и защиты раневой поверхности.
Целью исследования была оценка возможности использования полимерного материала «Реперен» для закрытия открытых ран на слизистой оболочке полости рта на основании экспериментальных данных.
Материалы и методы
Физико-химические свойства полимерной матрицы Реперен . Полимерный материал Реперен представляет собой сшитый полимер из олигомеров метакриловой группы. Синтезируется по одностадийной технологии (мономер → конечный продукт), что исключает включение посторонних примесей. Полимерный материал изготавливается методом фронтальной фотополимеризации в квазизамкнутых формах заданной геометрии и размеров для изготовления необходимого изделия.
Благодаря своим известным свойствам полимер Реперен был выбран для разработки матрицы, предназначенной для закрытия открытых ран в полости рта и регенерации слизистой оболочки полости рта [28].
Проявленная матрица представляет собой двухслойную неперфорированную пленку. Один слой имеет сетчатую структуру с рельефным рисунком, занимающим 10–90 % площади матрицы, высотой до половины толщины матрицы и с армирующим кольцевым элементом (внутренний диаметр 0,7–2,0 мм, ширина 0,2–1,0 мм). ). Второй слой – сплошной, обеспечивающий прочное прилегание матрицы к поверхности раны.
Один слой имеет сетчатую структуру с рельефным рисунком, занимающим 10–90 % площади матрицы, высотой до половины толщины матрицы и с армирующим кольцевым элементом (внутренний диаметр 0,7–2,0 мм, ширина 0,2–1,0 мм). ). Второй слой – сплошной, обеспечивающий прочное прилегание матрицы к поверхности раны.
Отличительной особенностью данной полимерной мембраны (матрицы) является образующийся на ее поверхности слой из насыщенных углеводов с длиной цепи 8–18 атомов углерода, ориентированный преимущественно к поверхности пластины. Гидрофобные концы обращены к раневой поверхности и поглощают содержащиеся в ней липиды таким образом, что гидрофобные концы липидов обращены к гидрофобным концам матрикса, а гидрофильные концы направлены наружу. Гидрофильные концы липидов, в свою очередь, поглощают белки с раневой поверхности. Таким образом, воспроизводится поверхность, подобная поверхности клеточной мембраны. Такое решение делает возможной высокую адгезию стволовых (мезенхимальных) клеток к матриксу, обеспечивая высокую плотность прикрепления клеток к данному матриксу, а также стимуляцию пролиферации и дифференцировки нативной ткани и роста новой формирующейся соединительной ткани.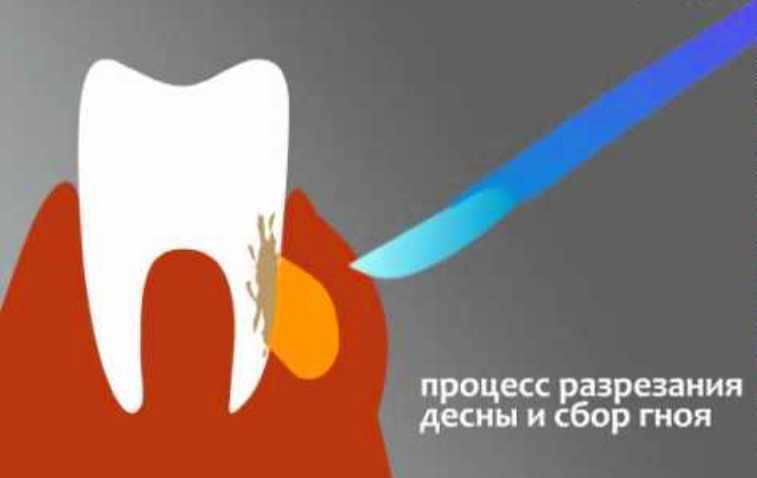 волокна.
волокна.
Эта матрица не вызывает аллергических реакций, устойчива к биологически активным жидкостям, хорошо прилипает к ране и предотвращает собственные движения, в результате чего образуются устойчивые грануляции.
Его применение исключает развитие воспалительных процессов и образование рубцовой ткани, так как эпителизация раневой поверхности протекает без деформации общего объема тканей и без каких-либо структурных изменений. Полимерный матрикс биологически инертен, не вызывает воспалительных реакций и капиллярного роста в прилежащих тканях или отторжения, что позволяет использовать его для ускорения заживления раневой поверхности и, следовательно, повышения эффективности хирургического лечения полости рта.
Экспериментальное исследование. Экспериментальная модель включала создание дефекта слизистой оболочки полости рта на твердом небе животного. Такое состояние было похоже на обычную клиническую ситуацию, возникающую при оперативных вмешательствах, требующих наложения свободного десневого аутотрансплантата, что неизбежно сопровождается образованием раневой поверхности на твердом небе.
Опыт проведен на 15 кроликах породы шиншилла обоего пола массой 3750–4000 г. План исследования включал три этапа наблюдений: на 3, 5, 7 сутки. На каждом этапе исследования участвовало по пять кроликов.
Процедура эксперимента. Работа выполнена в соответствии с этическими принципами, установленными Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и других научных целей (конвенция принята в Страсбурге 18 марта 1986 г., принята в Страсбурге 15 июня 2006 г. ) и одобрен Этическим комитетом Нижегородской государственной медицинской академии. Под общей анестезией барбитуратом натрия (30 мг/кг внутривенно) и вспомогательной инфильтрационной анестезией раствором ультракаина 1:100 000 (содержащим адреналин) забирали соединительнотканный аутотрансплантат определенных размеров и формы (рис. 1, а). Затем после обработки 70%-ным спиртом обрезали края стерильной упаковки с матрицей «Реперен» и удаляли матрицу из упаковки стерильными щипцами. Ножницами вырезали трансплантат необходимого размера и формы, равный 1/2 полученного дефекта. На дефект твердого неба накладывали «Реперен» так, чтобы он покрывал половину раневой поверхности с перекрытием краев раны на 3 мм, и фиксировали узловыми швами шовным материалом «Викрил 5-0», насаженным на атравматическую иглу (рис. 1, б). )). Иглу вводили точно в центр армирующего кольца. Другая половина раневой поверхности зажила вторичным натяжением (традиционный метод) без использования каких-либо дополнительных материалов.
Ножницами вырезали трансплантат необходимого размера и формы, равный 1/2 полученного дефекта. На дефект твердого неба накладывали «Реперен» так, чтобы он покрывал половину раневой поверхности с перекрытием краев раны на 3 мм, и фиксировали узловыми швами шовным материалом «Викрил 5-0», насаженным на атравматическую иглу (рис. 1, б). )). Иглу вводили точно в центр армирующего кольца. Другая половина раневой поверхности зажила вторичным натяжением (традиционный метод) без использования каких-либо дополнительных материалов.
| Рис. 1. Методика эксперимента: а — измерение созданного дефекта твердого неба; б — репереновая мембрана фиксируется швами к половине дефекта; в) прием биоптата после ранее проведенной операции |
Животных выводили из эксперимента на 3, 5 и 7-е сутки после забора аутотрансплантата путем введения барбитурата натрия (30 мг/кг, внутривенно) с последующим введением воздушных эмболов в кровоток через вены. В ходе операции был собран полнослойный соединительнотканный аутотрансплантат твердого неба (в области ранее сформированного дефекта) с забором частично здоровой соединительной ткани из краев раны (рис. 1, в).
В ходе операции был собран полнослойный соединительнотканный аутотрансплантат твердого неба (в области ранее сформированного дефекта) с забором частично здоровой соединительной ткани из краев раны (рис. 1, в).
Затем все биоптаты, полученные на 3, 5, 7 сутки после забора полнослойного аутотрансплантата слизистой оболочки твердого неба с участком экспериментально созданной раневой поверхности на всем протяжении раны, подвергали гистологическому исследованию. Для морфометрической обработки и создания видеоархива полученного материала использовали микроскоп Nikon 1001 (объективы ×90, ×40, ×15 и окуляр ×15). Для компьютерного анализа гистологических препаратов использовали систему анализа изображений, состоящую из светопропускающего микроскопа ECLIPS (Nikon, Германия), компьютера Pentium IV IBM, цветной цифровой камеры DS, блока управления DS-U1 (Nikon) и программного обеспечения FST-2U. . Для оценки патологических процессов в тканях проводили морфометрическое исследование на наличие лимфогистиоцитарной (круглоклеточной) и лейкоцитарной (нейтрофильной) инфильтрации, определяли участки некроза и грануляционной и соединительной ткани.
Данные статистически обработаны методом Фишера (для групп численностью менее 15 человек). Общее количество проанализированных традиционными методами гистологических препаратов составило 30 [29–32].
Интенсивность эпителизации раны оценивали цитологическим методом путем взятия мазков-отпечатков из раны на 3, 5 и 7-е сутки после удаления матрицы Реперен из экспериментально созданного дефекта твердого неба. Мазки наносили на обезжиренные предметные стекла, равномерно распределяли по поверхности шпателем и окрашивали азуром и эозином по Романовскому–Гимзе. Обзор мазка и подсчет клеточных элементов проводили на микроскопе Nikon 1001, ×90, окуляр ×15. Всего было проанализировано 30 мазков из послеоперационной раны [33, 34].
Результаты и обсуждение. На 3-и сутки после операции в биоптатах слизистой оболочки твердого неба при гистологическом исследовании у кролика без матрицы Реперен в зоне ранее созданного дефекта отмечен обширный некроз тканей с выраженной нейтрофильной инфильтрацией, сосудистая гиперемия и отек . Признаков грануляции или развития соединительной ткани не было (рис. 2, а). В гистологической картине слизистой оболочки, на которую накладывали матрицу Реперен, выявлялись небольшие участки некроза, умеренная нейтрофильная и лимфогистиоцитарная инфильтрация, кровоизлияния, гиперемия и начало грануляции в единичных полях зрения (рис. 3, а).
Признаков грануляции или развития соединительной ткани не было (рис. 2, а). В гистологической картине слизистой оболочки, на которую накладывали матрицу Реперен, выявлялись небольшие участки некроза, умеренная нейтрофильная и лимфогистиоцитарная инфильтрация, кровоизлияния, гиперемия и начало грануляции в единичных полях зрения (рис. 3, а).
| Рис. 2. Морфологическая картина гистологического препарата слизистой оболочки твердого неба в зоне заживления без полимерной мембраны «Реперен» (гематоксилин и эозин; ×200): а — на 3-и сутки; б) на 5-й день; в) на 7-й день |
| Рис. 3. Морфологическая картина гистологического препарата слизистой оболочки твердого неба в зоне заживления полимерной мембраной «Реперен» (гематоксилин и эозин; ×200): а — на 3-и сутки; б) на 5-й день; в) на 7-й день |
На 5-е сутки после операции при гистологическом исследовании препаратов слизистой оболочки раны без матрикса Реперен выявлено двукратное уменьшение площади некроза и уменьшение нейтрофильной инфильтрации. В отдельных полях зрения отмечались образования грануляционной ткани и небольшие участки соединительной ткани (рис. 2, б). На 5-е сутки картина заживления слизистой оболочки твердого неба под матриксом показала полное исчезновение нейтрофилов, единичные геморрагии, активное образование грануляций и соединительной ткани (рис. 3, б)) .
В отдельных полях зрения отмечались образования грануляционной ткани и небольшие участки соединительной ткани (рис. 2, б). На 5-е сутки картина заживления слизистой оболочки твердого неба под матриксом показала полное исчезновение нейтрофилов, единичные геморрагии, активное образование грануляций и соединительной ткани (рис. 3, б)) .
На 7-е сутки после операции в зоне, зажившей без матрикса Реперена, отмечено полное отсутствие нейтрофильной инфильтрации, развитие грануляционной ткани и образование соединительной ткани, а также умеренная круглоклеточная инфильтрация (рис. 2, в)) .
Состояние слизистой оболочки на 7-е сутки в зоне заживления под матрицей Реперена соответствовало нормальной оболочке с развитием новообразованных грануляций и тонкой волокнистой соединительной ткани в подслизистом слое (рис. 3, в).
Анализ динамики регенеративного процесса при применении полимерной матрицы Реперен и без нее на основе морфометрического метода исследования клеточного состояния раневой поверхности на различных этапах послеоперационного наблюдения показал, что процесс регенерации слизистой оболочки заживляет под полимерной матрицей протекали значительно быстрее (табл. 1, 2).
1, 2).
| Таблица 1. Морфометрическая характеристика заживления раневой поверхности без полимерной матрицы Реперен (%) |
| Таблица 2. Морфометрическая характеристика заживления раневой поверхности полимерной матрицей Реперен (%) |
При использовании репереновой матрицы интенсивность воспалительной реакции на 3-и сутки снижалась за счет уменьшения количества нейтрофилов, а к 5-м суткам они полностью исчезали. Формирование грануляционной ткани также инициировалось на 3-и сутки. В гистологических препаратах слизистой оболочки, зажившей без полимерной матрицы, некротические явления, проявляющиеся на 3-и сутки и уменьшающиеся вдвое к 5-м суткам, длительный воспалительный процесс и небольшое количество развитая грануляция и соединительная ткань.
Цитологическое исследование и сравнение мазков-отпечатков, взятых с раневой поверхности заживления под матрицей Реперен и без нее, выявили существенные различия в сроках эпителизации. На 3-и сутки в мазках-отпечатках, взятых из ран, заживавших под полимерной мембраной и без нее, выявляли массивные кровоизлияния и большое количество эритроцитов.
На 3-и сутки в мазках-отпечатках, взятых из ран, заживавших под полимерной мембраной и без нее, выявляли массивные кровоизлияния и большое количество эритроцитов.
В мазках из раны на 5-е сутки сохранялось большое количество эритроцитов, в то время как в препаратах из раны под матриксом Реперен отмечалось увеличение клеток дифференцированного эпителия преимущественно за счет промежуточных эпителиоцитов.
На 7-е сутки в мазках из ран, заживающих без матрицы, обнаруживались единичные эпителиоциты, в то время как в препаратах, взятых из ран, заживлявших под матрицей, происходила эпителизация раневой поверхности за счет активного образования эпителиоцитов (рис. 4). , 5).
| Рис. 4. Цитологическое исследование мазков-отпечатков, взятых с незаживающих ран без полимерной мембраны Реперен (окраска азуром и эозином по Романовскому–Гимзе; ×400): а — на 3-и сутки; б) на 5-й день; в) на 7-й день |
Рис. 5. Цитологическое исследование мазков-отпечатков, взятых с заживления раны под полимерной мембраной Реперен (окраска азуром и эозином по Романовскому–Гимзе; ×400): а — на 3-и сутки; б) на 5-й день; в) на 7-й день 5. Цитологическое исследование мазков-отпечатков, взятых с заживления раны под полимерной мембраной Реперен (окраска азуром и эозином по Романовскому–Гимзе; ×400): а — на 3-и сутки; б) на 5-й день; в) на 7-й день
|
Таким образом, анализ данных морфологического и цитологического исследования убедительно доказал преимущества использования полимерной матрицы Реперен для закрытия раневой поверхности в полости рта, проявляющиеся в уменьшении количества дней, необходимых для формирования подслизистого слоя, т. грануляционной и соединительной ткани. Процесс эпителизации раны также протекает значительно успешнее: в 2 раза быстрее по сравнению с открытым лечением ран за счет активного образования промежуточных эпителиоцитов.
Заключение. Полимерная матрица «Реперен» способствует интенсификации местных регенеративных процессов в ране и может быть использована для закрытия обширных открытых раневых поверхностей на слизистой оболочке полости рта.
Финансирование исследования и конфликты интересов. Это исследование не было поддержано какими-либо финансовыми источниками, и у авторов этого исследования нет конкретных тематических конфликтов интересов.
Ссылки
- Бледнов А.В. Перспективные направления разработки новых хирургических повязок. Новости хирургии 2006; 14(1): 9–19.
- Шинкевич Д.С. Особенности заживления послеоперационных ран мягких тканей лица в области преддверия рта, изолированных силиконовыми мембранами. Автореф. дис. … канд. мед. Наук Заживление послеоперационных ран мягких тканей лица в вестибулярной области рта, изолированных силиконовыми мембранами. Кандидатская диссертация]. Москва; 2008.
- Колсанов А.В. Комплексное лечение раневых дефектов кожи и мягких тканей различной этиологии с применением клеточных культур и биопокрытий (экспериментально-клиническое исследование). Автореф. дис. … докт. мед.
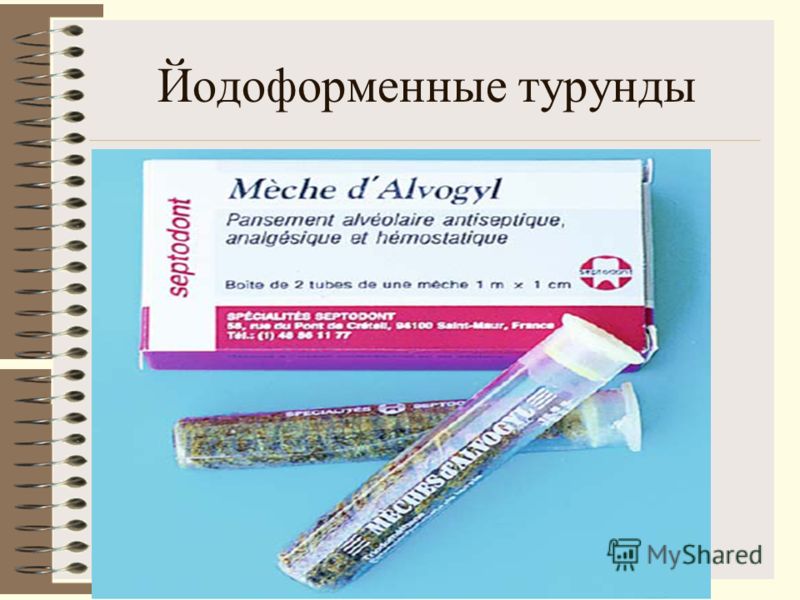 Наук Комплексное лечение раневых дефектов кожи и мягких тканей различной этиологии с использованием клеточных культур и биопокрытий (экспериментально-клиническое исследование). Диссертация доктора наук]. Самара; 2003.
Наук Комплексное лечение раневых дефектов кожи и мягких тканей различной этиологии с использованием клеточных культур и биопокрытий (экспериментально-клиническое исследование). Диссертация доктора наук]. Самара; 2003. - Карнио Дж., Холлмон В.В. Техника увеличения донорского участка небной соединительной ткани: отчет о клиническом случае и гистологическая оценка. Int J Пародонтология Restorative Dent 2005; 25(3): 257–263.
- Hofmänner P., Alessandri R., Laugisch O., Aroca S., Salvi G.E., Stavropoulos A., Sculean A. Предсказуемость хирургических методов, используемых для закрытия множественных смежных рецессий десны — систематический обзор. Квинтэссенция 2012; 43(7): 545–554.
- Мансури С.С., Аюбиан Н., Манучехри М.Е. Сравнительное 6-месячное клиническое исследование аллотрансплантата бесклеточного дермального матрикса и субэпителиального соединительнотканного трансплантата для покрытия корня. Дж. Дент (Тегеран), 2010 г.; 7(3): 156–164.
- Гаспарини Д.
 О. Двойной трансплантат из соединительной ткани на ножке: новый подход для увеличения альвеолярного отростка. В журнале J Periodontics Restorative Dent 2004; 24(3): 280–287.
О. Двойной трансплантат из соединительной ткани на ножке: новый подход для увеличения альвеолярного отростка. В журнале J Periodontics Restorative Dent 2004; 24(3): 280–287. - Calesini G., Micarelli C., Coppè S., Scipioni A. Улучшение беззубых участков: регенеративный подход к лечению беззубых участков. Часть 1. Понтийские области. Int J Пародонтология Restorative Dent 2008; 28(5): 517–524.
- Куру Б., Йылдырым С. Лечение локализованных рецессий десны с помощью трансплантатов десневых единиц: рандомизированное контролируемое клиническое исследование. J Периодонтол 2013; 84(1): 41–50, http://dx.doi.org/10.1902/jop.2012.110685.
- Кобаяси К., Сузуки Т., Номото Ю., Тада Ю., Мияке М., Хазама А., Омори К. Потенциал гетеротопных фибробластов в качестве аутологичных трансплантированных клеток для регенерации эпителия трахеи. Ткани Eng 2007; 13(9): 2175–2184, http://dx.doi.org/10.1089/ten.2007.0008.
- Махаджан А. Лечение множественных рецессий десны с использованием периостального трансплантата на ножке: серия случаев.
 J Периодонтол 2010; 81(10): 1426–1431, http://dx.doi.org/10.1902/jop.2010.100134.
J Периодонтол 2010; 81(10): 1426–1431, http://dx.doi.org/10.1902/jop.2010.100134. - Луканина К.И. Разработка научных и технологических основ создания перевязочных средств из биодеструктируемых и биосовместимых волокнистых материалов на основе полилактида. Автореф. дис. … канд. тех. Наук Разработка научно-технических основ создания перевязочных материалов из биодеструктируемых и биосовместимых волокнистых материалов на основе полилактида. Кандидатская диссертация]. Москва; 2011.
- Рохвагер И.С., Мороз Б.Т. Влияние глубины преддверия полости рта на состояние тканей пародонта. Институт стоматологии 2000; 4(9): 38–39.
- Капур С., Патель С.А., Картан С. Опосредованное толерантностью подавление мезенхимальными стволовыми клетками у пациентов с астмой, вызванной аллергией на пылевых клещей. J Allergy Clin Immunol 2012; 129(4): 1094–1101, http://dx.doi.org/10.1016/j.jaci.2011.10.048.
- Ким Х.С., Ким Н.Х., Ким Дж., Ча И.Х. Индуцирование реэпителизации кожной раны за счет культивирования кератиноцитов слизистой оболочки полости рта.
 J Korean Assoc Oral Maxillofac Surg 2013; 39(2): 63–70, http://dx.doi.org/10.5125/jkaoms.2013.39.2.63.
J Korean Assoc Oral Maxillofac Surg 2013; 39(2): 63–70, http://dx.doi.org/10.5125/jkaoms.2013.39.2.63. - Махдавишахри Н., Могатам Матин М., Ферейдони М., Ярджанлы З., Банихашем Рад С.А., Хаджех Ахмади С. Анализ десневого каркаса человека in vitro при дифференцировке мезенхимальных стволовых клеток костного мозга крысы в кератиноцисты. Иран J Basic Med Sci 2012; 15 (6): 1185–1190.
- Треушников В.М. Основные принципы изготовления биосовместимых имплантатов. Нижегородские ведомости медицины 2007; 6: 46–55.
- Белов А.И., Черекаев В.А., Решетов И.В., Капитанов Д.Н., Винокуров А.Г., Зайцев А.М., Бекяшев А.Х. Пластика дефекта свода черепа после удаления черепно-лицевых опухолей. Вопросы нейрохирургии им. Н.Н. Бурденко 2001; 4: 5–9.
- Дурново Е.А., Хомутинникова Н.Е., Мишина Н.В., Трофимов А.О. Особенности реконструкции стенок глазницы при лечении травматических повреждений лицевого скелета. Медицинский альманах 2013; 5: 159–161.
- Крупко А.В.
 , Богосьян А.Б., Крупко М.С. Применение полимерных сеток «Реперен» в хирургическом лечении воронкообразной деформации грудной клетки. Травматология и ортопедия России 2014; 3(73): 69–75.
, Богосьян А.Б., Крупко М.С. Применение полимерных сеток «Реперен» в хирургическом лечении воронкообразной деформации грудной клетки. Травматология и ортопедия России 2014; 3(73): 69–75. - Тихомиров С.Е. Пластика дефектов свода черепа пластинами «Реперен» (экспериментально-клиническое исследование). Автореф. дис. … канд. мед. Наук Пластика дефекта свода черепа пластинами «Реперен» (экспериментально-клиническое исследование). Кандидатская диссертация]. Нижний Новгород; 2011.
- Тихомиров С.Е. Применение репереновой минипластины для пластики малых дефектов свода черепа при удалении внутримозговых гематом. Современные технологии в медицине 2015; 7(2): 198–201, http://dx.doi.org/10.17691/stm2015.7.2.23.
- Тихомиров С.Е., Цыбусов С.Н., Кравец Л.Я., Фраерман А.П., Балмасов А.А. Пластика дефектов основания черепа и твердой мозговой оболочки новым полимерным материалом Реперен. Современные технологии в медицине 2010; (2): 6–11.
- Ходак В.А., Петров В.В., Дворников А.
 В., Миронов А.А., Бабурин А.Б., Паршиков В.В., Цыбусов С.Н. Возможности и преимущества бесшовной пластики брюшной стенки с использованием различных синтетических сеток в экспериментальном исследовании. Современные технологии в медицине 2012; (2): 31–36.
В., Миронов А.А., Бабурин А.Б., Паршиков В.В., Цыбусов С.Н. Возможности и преимущества бесшовной пластики брюшной стенки с использованием различных синтетических сеток в экспериментальном исследовании. Современные технологии в медицине 2012; (2): 31–36. - Успенский И.В. Полимерные сетки «Реперен». Нижегородские ведомости медицины 2006; 1: 8–9.
- Хомутинникова Н.Е., Орлинская Н.Ю., Цыбусов С.Н., Дурново Е.А., Мишина Н.В. Клинико-морфологическая оценка репаративной регенерации костной ткани орбиты с использованием полимерных имплантатов в эксперименте. Морфологические ведомости 2015; 1: 68–74.
- Шестериков А.А., Лалов Ю.В., Фомин П.А., Успенский И.В. Герметизация дна турецкого седла синтетическим имплантатом «Реперен-СТ» при комбинированном лечении опухолей хиазмального и селлярного отделов. Современные технологии в медицине 2011; (1): 6–10.
- Цыбусов С.Н., Дурново Е.А., Хомутинникова Н.Е., Треушников В.М., Викторова Е.А., Треушников В.В., Сорокина О.
 В. Матрица для регенерации мягких тканей. Патент РФ 2526182. 2014. .
В. Матрица для регенерации мягких тканей. Патент РФ 2526182. 2014. .
- Бозо И.Ю., Деев Р.В., Пинаев Г.П. Является ли «фибробласт» специализированной клеткой или функциональным состоянием производных мезенхимальных клеток. Цитология 2010; 52(2): 99–109.
- Быков Б.Л. Цитология и общая гистология (функциональная морфология клеток и тканей человека). Санкт-Петербург: СОТИС; 2007.
- Орлов А.А., Григорян А.С., Мариничева И.Г., Ипполитов В.П., Кармен Н.В., Маевский Э.И. Перфторан при заживлении мягких и костных тканей у крыс. Российский стоматологический журнал 2004; 3: 6–10.
- Быков В.Л. Тканевые и клеточные защитные механизмы слизистой оболочки полости рта. Морфология 1996; 6: 14–19.
- Бочков Н.П., Никитина В.А. Цитогенетика стволовых клеток человека. Молекулярная медицина 2008; 3: 40–47.
- Мочалова Д.А. Экспериментально-клиническое изучение особенностей регенерации слизистой оболочки полосы рта с использованием полимерной мембраны. Автореф.

