Процедура удаления нерва зуба в современной стоматологии
Время прочтения — 3 минуты
Кому не раз приходилось лечить в недавнем прошлом пораженные кариесом зубы, наверняка сталкивался с такой неприятной процедурой, как удаление нерва с предварительной установкой мышьяка. У многих при этом надолго пропадало желание посещать стоматолога, так как после первого этапа лечения, болевые ощущения длились в течении нескольких дней. В ряде случаев, не помогали даже сильные анальгетики, которые были не в состоянии справиться с сильной болью. Кроме этого, не придавал уверенности используемый во время этой процедуры мышьяк, который считается опаснейшим для человека ядом. Более того, одним посещением врача, удаление нерва еще несколько лет назад, как правило, не заканчивалось. К объективным причинам для беспокойства, также добавлялись рассказы «знающих людей», утверждающих, что превышение максимального срока ношения в канале зуба мышьяка, может привести к полному разрушению ткани. Это утверждение недалеко от истины, так как рассчитать точно количество мышьяка крайне сложно. Поэтому врачи старались продолжать лечение зуба уже через 2-3 дня после установки яда. При этом, пациента часто ждали неприятные минуты, в течении которых стоматолог чистил канал.
Это утверждение недалеко от истины, так как рассчитать точно количество мышьяка крайне сложно. Поэтому врачи старались продолжать лечение зуба уже через 2-3 дня после установки яда. При этом, пациента часто ждали неприятные минуты, в течении которых стоматолог чистил канал.
Запишитесь на прием к стоматологу-хирургу
Стоматолог-хирург сделает все, чтобы сохранить ваши зубы от удаления. Врачи клиники Medall спасут зубы даже в самых сложных случаях. Запишитесь на прием, пока зубы еще можно спасти!
Записаться на прием
Если срочно понадобится томография зубов в СПб — обращайтесь в нашу клинику, где опытные специалисты окажут качественные услуги с помощью новейшего оборудования. Доступные цены и гарантия качества.
Сегодня от использования мышьяка при удалении нерва зуба практически отказались. На смену яду пришли современные методики, позволяющие завершить лечение зуба в течении 30-40 минут и за одно посещение.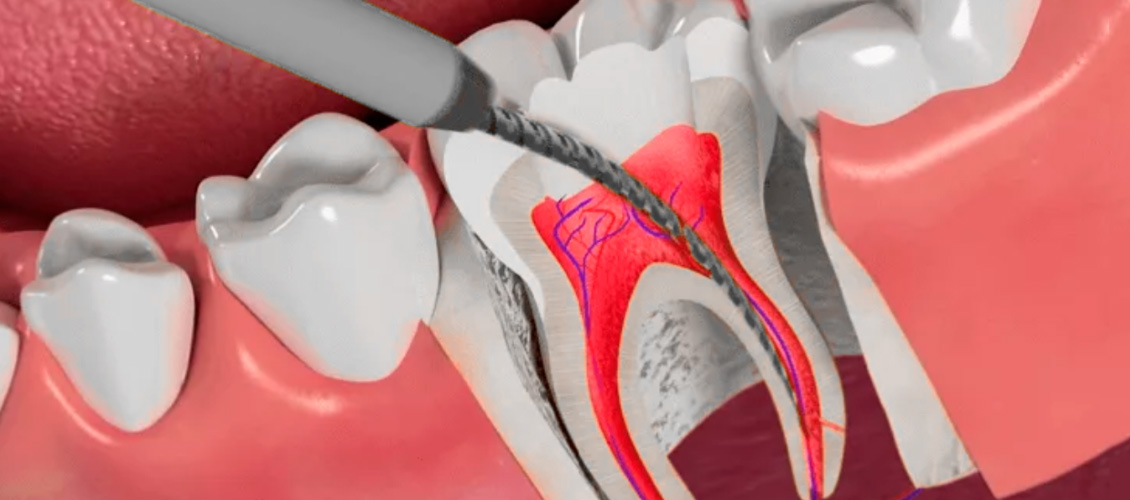 Однако, даже современная методика не исключает болевые ощущения после удаление нерва и закрытия канала. Боль может быть временной, как после любого оперативного вмешательства, а также вызванной неумелыми действиями врача. В первом случае, поводов для беспокойства нет. Во-первых: как правило, боль возникает при сильном сжатии челюстей, а также при приеме слишком горячей или слишком холодной пищи. Пациенту необходимо пересмотреть свое меню и несколько дней использовать перорально анальгетики. При непроходящей в течении нескольких дней боли после удаления нерва, велик риск развития воспалительного процесса или появления аллергии на пломбировочный материал. К слову сказать, непереносимость последнего случается крайне редко. В любом случае, если после лечения зуб продолжает беспокоить, то необходимо как можно быстрее обратиться к стоматологу. В завершении стоит отметить, что удаление нерва — эта крайняя процедура, прибегать к которой врачи стараются очень редко и лишь тогда, когда не помогло другое лечение.
Однако, даже современная методика не исключает болевые ощущения после удаление нерва и закрытия канала. Боль может быть временной, как после любого оперативного вмешательства, а также вызванной неумелыми действиями врача. В первом случае, поводов для беспокойства нет. Во-первых: как правило, боль возникает при сильном сжатии челюстей, а также при приеме слишком горячей или слишком холодной пищи. Пациенту необходимо пересмотреть свое меню и несколько дней использовать перорально анальгетики. При непроходящей в течении нескольких дней боли после удаления нерва, велик риск развития воспалительного процесса или появления аллергии на пломбировочный материал. К слову сказать, непереносимость последнего случается крайне редко. В любом случае, если после лечения зуб продолжает беспокоить, то необходимо как можно быстрее обратиться к стоматологу. В завершении стоит отметить, что удаление нерва — эта крайняя процедура, прибегать к которой врачи стараются очень редко и лишь тогда, когда не помогло другое лечение.
Автор статьи:
Розина Виолетта Олеговна
Врач-стоматолог терапевт
Дата публикации: 25.04.2014 г.
Поделиться
Полезная статья?
Удаление нерва зуба — информация об услуге
Цена услуги
Задать вопрос
Удаление зуба мудрости: показания и осложнения
Обработка полости рта после удаления зуба
Записаться на консультацию к стоматологу-хирургу
Удаление нерва зуба: вчера и сегодня
Наверное, многим из нас знакома процедура удаления нерва зуба. Первые ассоциации – мышьяк и невыносимая боль в течение нескольких дней. Эти воспоминания вызывают ужас, и многие боятся повторения этого кошмара. Но стоит ли бояться? Или же что-то изменилось, и мышьяк ушел в прошлое?
Что такое нерв зуба и когда необходимо его удаление?
Наш зуб – это не только кость.
На начальных стадиях кариеса кариозный процесс находится на уровне дентина и не затрагивает пульпу зуба. Но если вовремя не провести соответствующее лечение кариеса, то поражается уже нерв зуба – это заболевание называется пульпит. В зависимости от того, насколько сильно затронута пульпа, врач принимает решение о возможности провести частичную или полную ампутацию пульпы. В случаях, когда пульпит перешел уже в следующую стадию – периодонтит, – полного депульпирования уже не избежать. Кроме того, удаление нерва зуба необходимо при наличии большой кариозной полости, сильном механическом разрушении зуба, продолжительных болей в зубе.
Удаление нерва зуба мышьяком
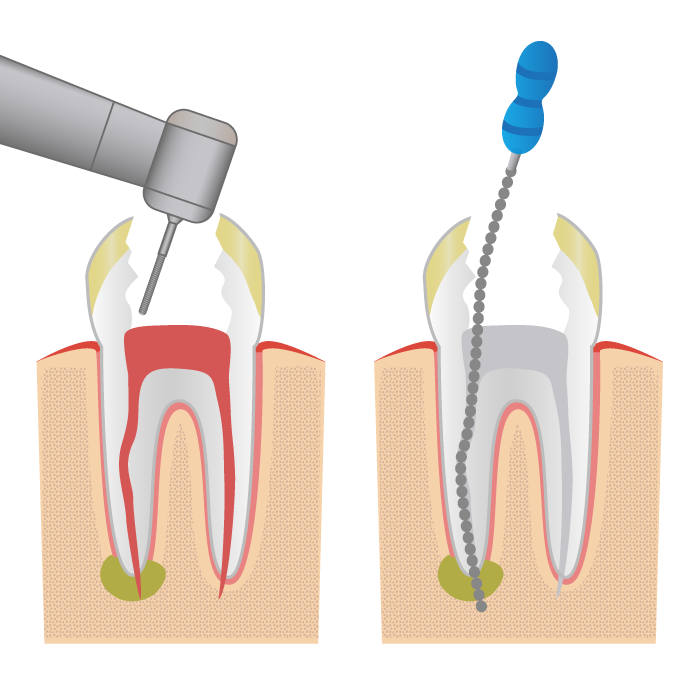
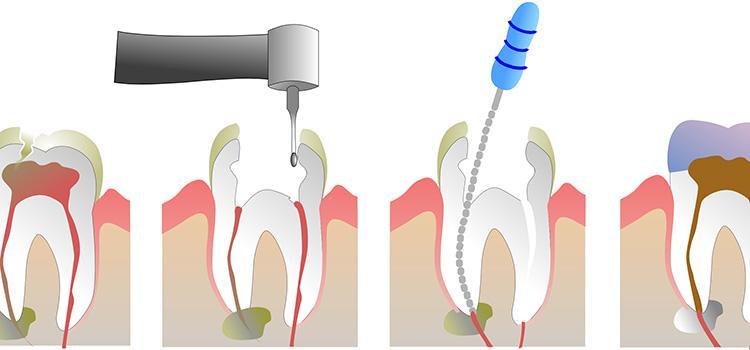
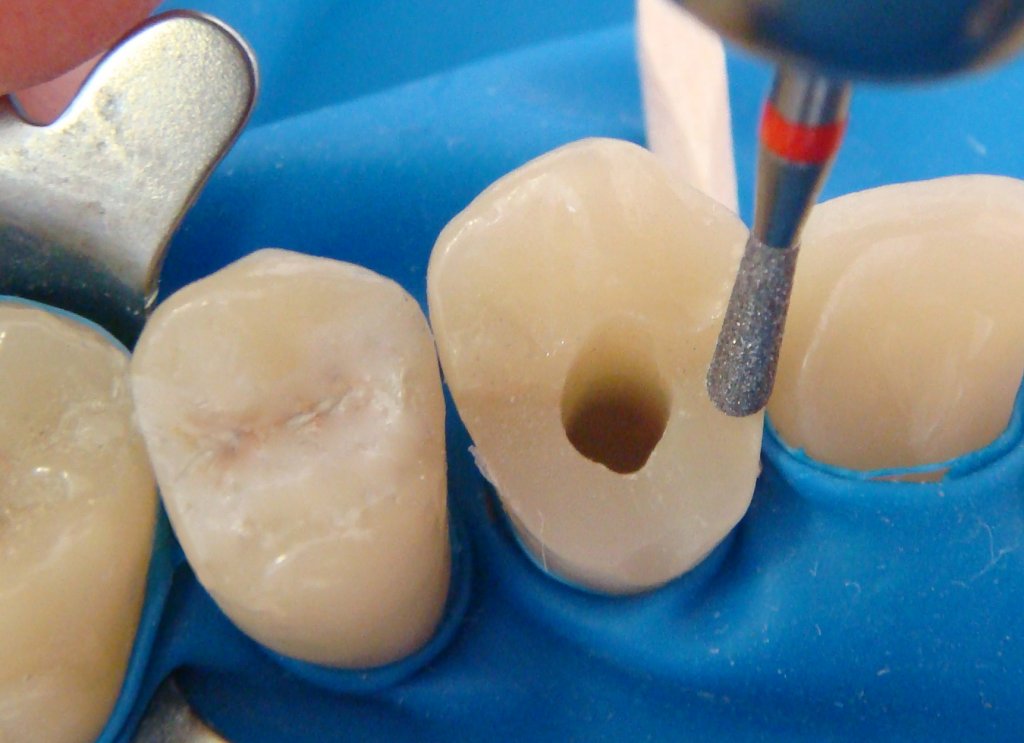
Раньше процедура удаления нерва зуба была долгой, болезненной и требующей нескольких посещений врача. Выглядело это примерно так. Сначала при помощи бормашины расширялся корневой канал, чтобы обнажить пульпу и положить мышьяк. Потом зуб запечатывался временной пломбой на два дня. За это время мышьяк убивал нерв, и процесс этот сопровождался сильной болью, иногда не помогали даже анальгетики. По прошествии двух дней стоматолог снимал временную пломбу, удалял нерв, вычищал корневые каналы. Этот процесс тоже временами оказывался довольно болезненным из-за живучести пульпы и плохой проходимости каналов.
Основной недостаток метода – его небезопасность. Как известно, мышьяк – это сильнейший яд и его использование требует предельной осторожности от врача и ответственности от пациента. Если его оставить внутри зуба более чем на два дня, то может произойти необратимое разрушение зубных тканей. В этом случае можно легко потерять зуб совсем.
Современные методики удаления нерва зуба
Сегодня удалить зубной нерв можно непосредственно в кресле стоматолога за одно посещение. После проведения аппликационной анестезии и обезболивающего укола врач обеспечивает доступ к пульпе, удаляя пораженный дентин. Затем с помощью специальных инструментов из зуба извлекается пульпа. Такая процедура депульпирования длится примерно полчаса. Если весь процесс контролировался специальной аппаратурой (лечение зубов под микроскопом), после удаления нерва зуб и зубные каналы тщательно пломбируются как при лечении периодонтита. Но в любом случае врач может подстраховаться и поставить сначала временную пломбу, дабы убедиться в успешности депульпирования. После того как повторный визит подтвердит качество процедуры, устанавливается уже постоянная пломба.
Помимо полного удаления нерва зуба существует также и частичное. Его проводят только в том случае, когда воспаление затронуло только коронковую часть пульпы. Процедура заключается в следующем – зуб вскрывается, тщательно удаляются некротизированные ткани, коронковая часть пульпы отсекается. Таким образом, сохраняется корневая часть пульпы. Метод рекомендован при лечении кариеса коренных зубов в детском возрасте, когда очень важно сохранить корневую часть пульпы, которая участвует в формировании корней зуба. Кроме того, зуб с частично удаленным нервом остается живым и не так быстро разрушается.
Его проводят только в том случае, когда воспаление затронуло только коронковую часть пульпы. Процедура заключается в следующем – зуб вскрывается, тщательно удаляются некротизированные ткани, коронковая часть пульпы отсекается. Таким образом, сохраняется корневая часть пульпы. Метод рекомендован при лечении кариеса коренных зубов в детском возрасте, когда очень важно сохранить корневую часть пульпы, которая участвует в формировании корней зуба. Кроме того, зуб с частично удаленным нервом остается живым и не так быстро разрушается.
Нередко пациенты обращаются в клиники с жалобами на боль в депульпированном зубе. В этом случае следует различать временную боль после удаления нерва зуба и боль, возникшую в результате некорректного лечения. Временная боль после депульпирования – нормальное явление, так как произошло вмешательство в структуру зуба. Она чаще всего возникает при смыкании челюстей и при приеме горячей или холодной пищи. Для облегчения болезненных ощущений можно использовать анальгетики. Через несколько дней такая боль проходит сама собой.
Через несколько дней такая боль проходит сама собой.
Если лечение было проведено некачественно и нерв удалили не полностью, воспаление и боль в зубе не замедлят вернуться. Плохо обработанные зубные каналы также могут стать причиной сильной болезненности. Очень редко боль вызывает аллергия на пломбировочный материал. В любом случае следует незамедлительно обратиться к врачу. Все это может привести к такому сильному воспалению, что потребуется вмешательство хирурга для резекции верхушки зубного корня, а то и стать причиной для удаления зуба.
Конечно, удаление нерва зуба – не слишком радостное событие, потому что зуб становится мертвым. Но все же лучше сохранить зуб хотя бы в таком виде, чем потерять его совсем. Поэтому если у вас длительное время болит зуб, не откладывайте визит в стоматологическую клинику из-за боязни врача-стоматолога. Грамотный специалист проведет качественное лечение и поможет вам сохранить зуб на долгие-долгие годы!
- Зубная боль.
 Что делать?
Что делать? - Пульпит — враг зубов!
- Все о кариесе зубов: виды, симптомы, причины
- Проблемы, которые могут вызывать зубы мудрости
- Дентофобия: как побороть страх перед стоматологом
- Пломба зуба
- Повышенная чувствительность зубов
- Анестезия в стоматологии: виды и противопоказания
Влияние воздействия мышьяка на неврологическую и когнитивную дисфункцию в исследованиях человека и грызунов: обзор
Недавно опубликованные статьи, представляющие особый интерес, были отмечены как: • Важные •• Особо важные
1. Hughes MF, et др. Воздействие мышьяка и токсикология: историческая перспектива. Токсикол науч. 2011;123(2):305–32. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2. Naujokas MF, et al. Широкий спектр последствий для здоровья от хронического воздействия мышьяка: обновленная информация о всемирной проблеме общественного здравоохранения. Перспектива охраны окружающей среды. 2013;121(3):295–302. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Широкий спектр последствий для здоровья от хронического воздействия мышьяка: обновленная информация о всемирной проблеме общественного здравоохранения. Перспектива охраны окружающей среды. 2013;121(3):295–302. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Wilson D, Hooper C, Shi X. Мышьяк и свинец в соке: яблоко, цитрусовые и яблочная основа. J Здоровье окружающей среды. 2012;75(5):14–20. [PubMed] [Google Scholar]
4. Gosse JA, et al. Монометилированные виды трехвалентного мышьяка нарушают взаимодействие стероидных рецепторов с их ответными элементами ДНК при нецитотоксических клеточных концентрациях. J Appl Toxicol. 2013 [бесплатная статья PMC] [PubMed] [Google Scholar]
5. Kligerman AD, et al. Метилированные трехвалентные соединения мышьяка как кандидаты на окончательную генотоксическую форму мышьяка: индукция хромосомных мутаций, но не генных мутаций. Энвайрон Мол Мутаген. 2003;42(3):192–205. [PubMed] [Google Scholar]
6. Ватанабе Т., Хирано С. Метаболизм мышьяка и его токсикологическое значение. Арх Токсикол. 2013;87(6):969–79. [PubMed] [Google Scholar]
Метаболизм мышьяка и его токсикологическое значение. Арх Токсикол. 2013;87(6):969–79. [PubMed] [Google Scholar]
7. Kruger K, et al. Влияние монометиларсоновой и монометиларсоновой кислот на вызванные синаптические потенциалы в срезах гиппокампа взрослых и молодых крыс. Toxicol Appl Pharmacol. 2009;236(1):115–23. [PubMed] [Google Scholar]
8. Вентура-Лима Дж., Бого М.Р., Монсеррат Дж.М. Токсичность мышьяка у млекопитающих и водных животных: сравнительный биохимический подход. Экотоксикол Environ Saf. 2011;74(3):211–8. [PubMed] [Академия Google]
9. Sanchez-Pena LC, et al. Виды мышьяка, количество AS3MT и экспрессия гена AS3MT в различных областях мозга мыши, подвергшейся воздействию арсенита. Окружающая среда Рез. 2010;110(5):428–34. [PubMed] [Google Scholar]
10. Вахтер М. Влияние мышьяка на здоровье матери и плода. Анну Рев Нутр. 2009; 29: 381–99. [PubMed] [Google Scholar]
11. He W, et al. Воздействие мышьяка на беременных мышей нарушает плацентарный васкулогенез и вызывает самопроизвольный аборт. Токсикол науч. 2007;99(1):244–53. [PubMed] [Академия Google]
Токсикол науч. 2007;99(1):244–53. [PubMed] [Академия Google]
12. Ahmed S, et al. Связанный с мышьяком окислительный стресс, воспаление и нарушение иммунитета в плаценте и пуповинной крови человека. Перспектива охраны окружающей среды. 2011;119(2):258–64. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13.••. Родригес-Барранко М. и соавт. Связь воздействия мышьяка, кадмия и марганца с развитием нервной системы и поведенческими расстройствами у детей: систематический обзор и метаанализ. Научная общая среда. 2013; 454–455: 562–77. [PubMed] [Академия Google]
14. Rosado JL, et al. Воздействие мышьяка и когнитивные способности мексиканских школьников. Перспектива охраны окружающей среды. 2007;115(9):1371–5. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. Roy A, et al. Связь между воздействием мышьяка и поведением первоклассников из Торреона, Мексика. Окружающая среда Рез. 2011;111(5):670–6. [PubMed] [Google Scholar]
16. von Ehrenstein OS, et al. Интеллектуальная функция детей в связи с воздействием мышьяка. Эпидемиология. 2007;18(1):44–51. [PubMed] [Академия Google]
Интеллектуальная функция детей в связи с воздействием мышьяка. Эпидемиология. 2007;18(1):44–51. [PubMed] [Академия Google]
17. Вассерман Г.А. и соавт. Воздействие мышьяка в воде и интеллектуальные функции детей в Араихазаре, Бангладеш. Перспектива охраны окружающей среды. 2004;112(13):1329–33. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Wang SX, et al. Воздействие мышьяка и фтора в питьевой воде: IQ и рост детей в уезде Шаньинь, провинция Шаньси, Китай. Перспектива охраны окружающей среды. 2007;115(4):643–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Llop S, et al. Половые различия в нейротоксичности металлов у детей. Токсикология. 2013;311(1–2):3–12. [PubMed] [Академия Google]
20. Гарднер Р.М. и соавт. Воздействие металлов на окружающую среду и рост детей до 5 лет: проспективное когортное исследование. Am J Эпидемиол. 2013;177(12):1356–67. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Kang J, et al. Влияние мышьяка в питьевой воде на интеллект детей. Вэй Шэн Янь Цзю. 2007;36(3):347–9. [PubMed] [Google Scholar]
Вэй Шэн Янь Цзю. 2007;36(3):347–9. [PubMed] [Google Scholar]
22. Wasserman GA, et al. Воздействие тяжелых металлов и недоедания на развитие. Основной Клин Фармакол Токсикол. 2008;102(2):212–7. [PubMed] [Академия Google]
23. Parajuli RP, et al. Связь уровней свинца, мышьяка и цинка в пуповинной крови с показателями развития нервной системы у новорожденных: когортное исследование в долине Читван, Непал. Окружающая среда Рез. 2013; 121:45–51. [PubMed] [Google Scholar]
24. Hamadani JD, et al. Дородовое и постнатальное воздействие мышьяка и развитие ребенка в возрасте 18 месяцев: когортное исследование в сельских районах Бангладеш. Int J Эпидемиол. 2010;39(5):1206–16. [PubMed] [Google Scholar]
25. Tofail F, et al. Влияние воздействия мышьяка во время беременности на развитие ребенка в возрасте 7 месяцев в сельской местности Матлаб, Бангладеш. Перспектива охраны окружающей среды. 2009 г.;117(2):288–93. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. •. Хамадани Дж. Д. и др. Критические периоды экспозиции для связанных с мышьяком нарушений когнитивных функций у девочек и мальчиков дошкольного возраста: популяционное когортное исследование. Int J Эпидемиол. 2011;40(6):1593–604. [PubMed] [Google Scholar]
•. Хамадани Дж. Д. и др. Критические периоды экспозиции для связанных с мышьяком нарушений когнитивных функций у девочек и мальчиков дошкольного возраста: популяционное когортное исследование. Int J Эпидемиол. 2011;40(6):1593–604. [PubMed] [Google Scholar]
27. Tsai SY, et al. Влияние хронического воздействия мышьяка из питьевой воды на нейроповеденческое развитие в подростковом возрасте. Нейротоксикология. 2003; 24(4–5):747–53. [PubMed] [Академия Google]
28. Райт Р.О. и соавт. Нейропсихологические корреляты уровней мышьяка, марганца и кадмия в волосах у детей школьного возраста, проживающих вблизи свалки опасных отходов. Нейротоксикология. 2006;27(2):210–6. [PubMed] [Google Scholar]
29. Harkins DK, Susten AS. Анализ волос: изучение состояния науки. Перспектива охраны окружающей среды. 2003;111(4):576–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Wasserman GA, et al. Воздействие мышьяка в воде и интеллектуальная функция у 6-летних детей в Араихазаре, Бангладеш. Перспектива охраны окружающей среды. 2007; 115(2):285–9.. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Перспектива охраны окружающей среды. 2007; 115(2):285–9.. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Rai A, et al. Характеристика нейротоксичности смеси As, Cd и Pb для развития: синергетическое действие смеси металлов на глиальные и нейрональные функции. Токсикол науч. 2010;118(2):586–601. [PubMed] [Google Scholar]
32. Aelion CM, et al. Концентрация металлов в верхнем слое почвы в сельской местности в Южной Каролине: потенциальное воздействие на здоровье человека. Научная общая среда. 2008;402(2–3):149–56. [Бесплатная статья PMC] [PubMed] [Google Scholar]
33. McDermott S, et al. Вероятность умственной отсталости связана с концентрацией мышьяка и свинца в почве. Хемосфера. 2011;84(1):31–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Wasserman GA, et al. Воздействие мышьяка и марганца на интеллектуальную функцию детей. Нейротоксикология. 2011;32(4):450–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
35. Drews-Botsch C, et al. Социально-экономические различия и влияние малого веса для гестационного возраста на развитие нервной системы у детей дошкольного возраста. Преподобный Environment Health. 2011;26(3):221–9. [PubMed] [Google Scholar]
Социально-экономические различия и влияние малого веса для гестационного возраста на развитие нервной системы у детей дошкольного возраста. Преподобный Environment Health. 2011;26(3):221–9. [PubMed] [Google Scholar]
36. Dong J, Su SY. Связь между мышьяком и детским интеллектом: метаанализ. Биол Трейс Элем Рез. 2009;129(1–3):88–93. [PubMed] [Google Scholar]
37. Rocha-Amador D, et al. Снижение интеллекта у детей и воздействие фтора и мышьяка в питьевой воде. Кэд Сауд Публика. 2007; 23 (Приложение 4): S579–87. [PubMed] [Google Scholar]
38. Берд Дж. Дефицит железа влияет на развитие и функционирование мозга. Дж Нутр. 2003; 133(5 Приложение 1):1468S–72. [PubMed] [Академия Google]
39. Heck JE, et al. Воздействие мышьяка и анемия в Бангладеш: популяционное исследование. J оккупировать Environ Med. 2008;50(1):80–7. [PubMed] [Google Scholar]
40. Dominguez-Salas P, et al. Потенциал метилирования ДНК: потребление с пищей и концентрация в крови одноуглеродных метаболитов и кофакторов у сельских африканских женщин.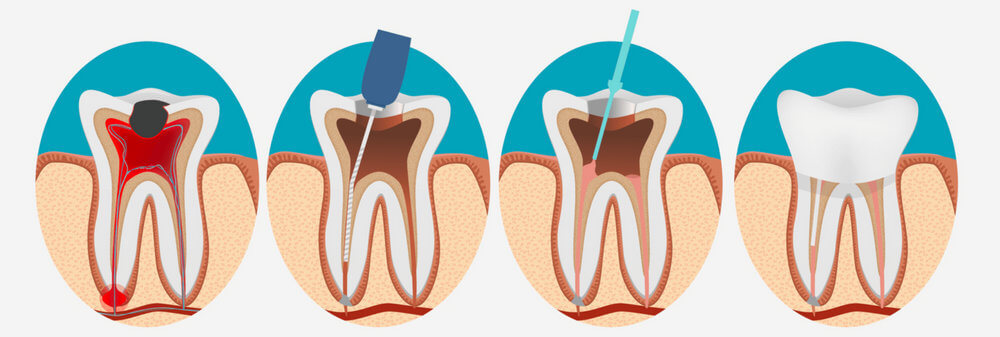 Am J Clin Nutr. 2013;97(6):1217–27. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Am J Clin Nutr. 2013;97(6):1217–27. [Бесплатная статья PMC] [PubMed] [Google Scholar]
41. Heck JE, et al. Потребление с пищей метионина, цистеина, белка и экскреция мышьяка с мочой в Бангладеш. Перспектива охраны окружающей среды. 2009 г.;117(1):99–104. [Бесплатная статья PMC] [PubMed] [Google Scholar]
42. Calderon J, et al. Воздействие мышьяка и свинца и нейропсихологическое развитие мексиканских детей. Окружающая среда Рез. 2001;85(2):69–76. [PubMed] [Google Scholar]
43.••. О’Брайант С.Е. и др. Длительное воздействие мышьяка в малых дозах связано с ухудшением нейропсихологического функционирования: исследование Project FRONTIER. Общественное здравоохранение Int J Environ Res. 2011;8(3):861–74. [Бесплатная статья PMC] [PubMed] [Google Scholar]
44.•. Гонг Г и др. Воздействие мышьяка в подземных водах низкого уровня влияет на когнитивные функции: исследование проекта FRONTIER. J Здоровье окружающей среды. 2011;74(2):16–22. [PubMed] [Google Scholar]
45. Rosselli M, et al. Взаимосвязь образования и пола в пунктах внимания Мини-Экзамена психического состояния у испаноязычных латиноамериканских пожилых людей. Арч Клин Нейропсихология. 2006;21(7):677–86. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Rosselli M, et al. Взаимосвязь образования и пола в пунктах внимания Мини-Экзамена психического состояния у испаноязычных латиноамериканских пожилых людей. Арч Клин Нейропсихология. 2006;21(7):677–86. [Бесплатная статья PMC] [PubMed] [Google Scholar]
46. Franco-Marina F, et al. Еще раз о мини-экзамене психического состояния: эффекты потолка и пола после корректировки баллов по уровню образования у стареющего мексиканского населения. Int Psychogeriatr. 2010;22(1):72–81. [PubMed] [Академия Google]
47. Syed EH, et al. Качество жизни и состояние психического здоровья пациентов, пострадавших от мышьяка, в бангладешской популяции. J Health Popul Nutr. 2012;30(3):262–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
48. Garelick H, et al. Источники загрязнения мышьяком. Rev Environ Contam Toxicol. 2008; 197:17–60. [PubMed] [Google Scholar]
49. Guo JX, et al. Хроническое отравление мышьяком питьевой воды во Внутренней Монголии и связанные с ним последствия для здоровья. J Environ Sci Health A Tox Hazard Subst Environ Eng. 2007; 42 (12): 1853–8. [PubMed] [Академия Google]
J Environ Sci Health A Tox Hazard Subst Environ Eng. 2007; 42 (12): 1853–8. [PubMed] [Академия Google]
50. Данг В.М. и др. Исследование психического здоровья жителей, проживающих в районе полезных ископаемых в провинции Хубэй. Чжунхуа Лао Дун Вэй Шэн Чжи Е Бинг За Чжи. 2008;26(8):457–60. [PubMed] [Google Scholar]
51. Fujino Y, et al. Бремя психического здоровья среди жителей пострадавших от мышьяка районов Внутренней Монголии, Китай. соц. мед. 2004; 59 (9): 1969–73. [PubMed] [Google Scholar]
52. Сен Д., Сарати Бисвас П. Арсеникоз: защитный фактор или предрасполагающий к психическим заболеваниям? Иран J Психиатрия. 2012;7(4):180–3. [Бесплатная статья PMC] [PubMed] [Google Scholar]
53. Zierold KM, Knobeloch L, Anderson H. Распространенность хронических заболеваний у взрослых, подвергшихся воздействию питьевой воды, загрязненной мышьяком. Am J Общественное здравоохранение. 2004; 94 (11): 1936–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
54. •. Мартинес Л. и соавт. Влияние воздействия мышьяка на раннем этапе развития на метилирование промоторных CpG-островков генов, участвующих в пластичности нейронов. Нейрохим Инт. 2011;58(5):574–81. [PubMed] [Google Scholar]
•. Мартинес Л. и соавт. Влияние воздействия мышьяка на раннем этапе развития на метилирование промоторных CpG-островков генов, участвующих в пластичности нейронов. Нейрохим Инт. 2011;58(5):574–81. [PubMed] [Google Scholar]
55. Reichard JF, Schnekenburger M, Puga A. Длительное воздействие низких доз мышьяка вызывает потерю метилирования ДНК. Biochem Biophys Res Commun. 2007; 352(1):188–9.2. [Бесплатная статья PMC] [PubMed] [Google Scholar]
56. Bailey KA, et al. Мышьяк и эпигеном: межиндивидуальные различия в метаболизме мышьяка, связанные с различными моделями метилирования ДНК. J Biochem Mol Toxicol. 2013;27(2):106–15. [Бесплатная статья PMC] [PubMed] [Google Scholar]
57. Kile ML, et al. Пренатальное воздействие мышьяка и метилирование ДНК в лейкоцитах материнской и пуповинной крови. Перспектива охраны окружающей среды. 2012;120(7):1061–6. [Бесплатная статья PMC] [PubMed] [Google Scholar]
58. Koestler DC, et al. Дифференциальное метилирование ДНК в пуповинной крови младенцев, подвергшихся воздействию низких уровней мышьяка в утробе матери. Перспектива охраны окружающей среды. 2013;121(8):971–7. [Статья бесплатно PMC] [PubMed] [Google Scholar]
Перспектива охраны окружающей среды. 2013;121(8):971–7. [Статья бесплатно PMC] [PubMed] [Google Scholar]
59. Reichard JF, Puga A. Влияние воздействия мышьяка на метилирование ДНК и регуляцию эпигенетических генов. Эпигеномика. 2010;2(1):87–104. [бесплатная статья PMC] [PubMed] [Google Scholar]
60. Chervona Y, et al. Связь между воздействием мышьяка и глобальными посттрансляционными модификациями гистонов среди взрослых в Бангладеш. Эпидемиологические биомаркеры рака Prev. 2012;21(12):2252–60. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Zhou X, et al. Влияние никеля, хромата и арсенита на метилирование лизина гистона 3. Toxicol Appl Pharmacol. 2009;236(1):78–84. [Бесплатная статья PMC] [PubMed] [Google Scholar]
62. Zhou X, et al. Арсенит изменяет глобальное метилирование гистона h4. Канцерогенез. 2008; 29 (9): 1831–186. [Бесплатная статья PMC] [PubMed] [Google Scholar]
63. Cronican AA, et al. Полногеномное изменение паттерна ацетилирования гистона h4K9 у потомства мыши, пренатально подвергшегося воздействию мышьяка.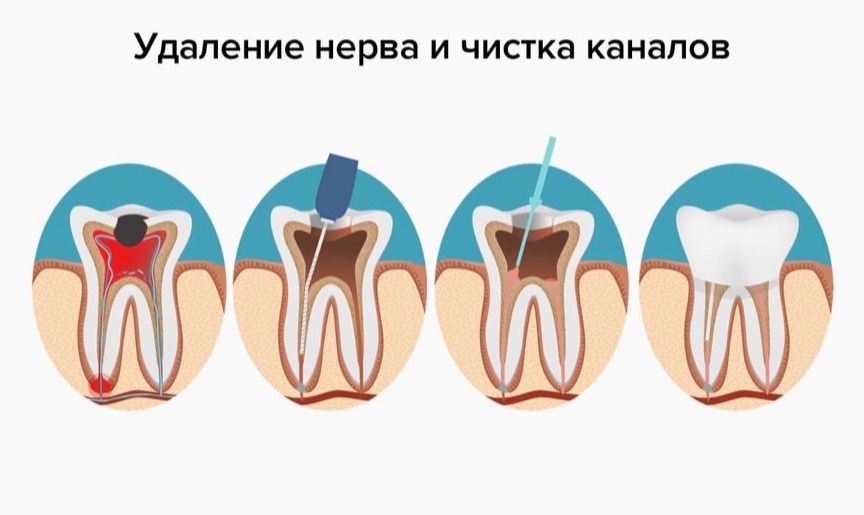 ПЛОС Один. 2013;8(2):e53478. [Бесплатная статья PMC] [PubMed] [Google Scholar]
ПЛОС Один. 2013;8(2):e53478. [Бесплатная статья PMC] [PubMed] [Google Scholar]
64. Zarazua S, et al. Снижение метилирования аргинина и изменений миелина у крыс, подвергшихся воздействию мышьяка. Нейротоксикология. 2010;31(1):94–100. [PubMed] [Google Scholar]
65. Zhou X, et al. Арсенит избирательно взаимодействует с белками цинковых пальцев, содержащими мотивы C3h2 или C4. Дж. Биол. Хим. 2011;286(26):22855–63. [Бесплатная статья PMC] [PubMed] [Google Scholar]
66. Шарма Б., Шарма П.М. Токсичность мышьяка, вызывающая эндотелиальную дисфункцию и деменцию: фармакологический запрет с помощью гистондеацетилазы и индуцибельных ингибиторов синтазы оксида азота. Toxicol Appl Pharmacol. 2013;273(1):180–8. [PubMed] [Академия Google]
67. Мартинес-Финли Э.Дж., Али А.М., Аллан А.М. Дефицит обучения у мышей C57BL/6 J после перинатального воздействия мышьяка: следствие более низких уровней рецепторов кортикостерона? Фармакол Биохим Поведение. 2009;94(2):271–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
68. Jing J, et al. Изменения синаптической структуры нейронов гиппокампа и нарушение пространственной памяти в модели крыс, вызванные хроническим воздействием арсенита. Нейротоксикология. 2012;33(5):1230–8. [PubMed] [Академия Google]
Jing J, et al. Изменения синаптической структуры нейронов гиппокампа и нарушение пространственной памяти в модели крыс, вызванные хроническим воздействием арсенита. Нейротоксикология. 2012;33(5):1230–8. [PubMed] [Академия Google]
69. de Castro MR, et al. Поведенческие и нейротоксические эффекты воздействия мышьяка на рыбок данио (Danio rerio, Teleostei: Cyprinidae) Comp Biochem Physiol C Toxicol Pharmacol. 2009;150(3):337–42. [PubMed] [Google Scholar]
70. Kruger K, et al. Влияние арсенита на долговременную потенциацию в срезах гиппокампа молодых и взрослых крыс. Токсикол Летт. 2006;165(2):167–73. [PubMed] [Google Scholar]
71. Luo JH, et al. Влияние мышьяка, содержащегося в питьевой воде, на пространственную память, ультраструктуры и экспрессию гена NMDAR в гиппокампе крыс. Токсикол Летт. 2009 г.;184(2):121–5. [PubMed] [Google Scholar]
72. Tyler CR, Allan AM. Нейрогенез гиппокампа взрослых и экспрессия мРНК изменяются при перинатальном воздействии мышьяка на мышей и восстанавливаются при кратковременном воздействии обогащения.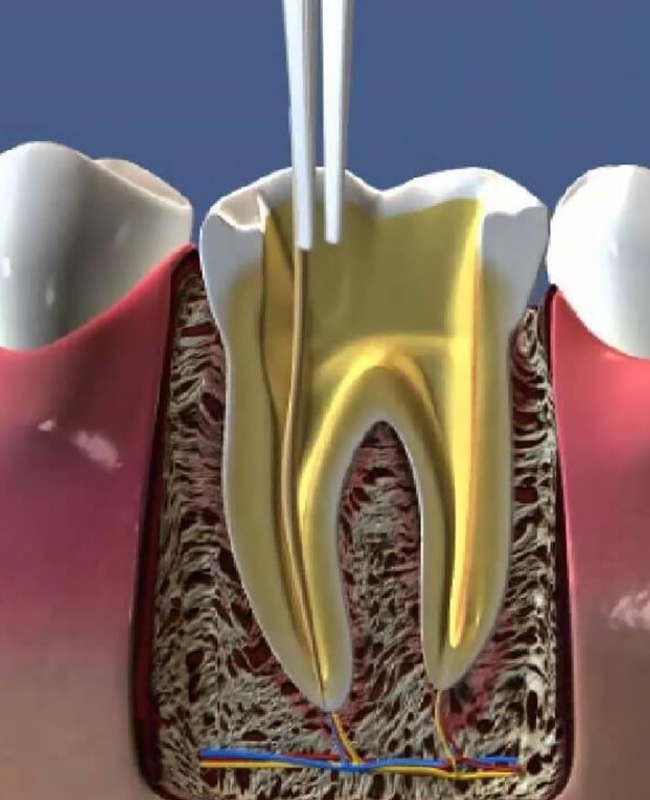 ПЛОС Один. 2013;8(9):e73720. [Бесплатная статья PMC] [PubMed] [Google Scholar]
ПЛОС Один. 2013;8(9):e73720. [Бесплатная статья PMC] [PubMed] [Google Scholar]
73. Luo JH, et al. Воздействие арсенита изменяет экспрессию рецептора NMDA и постсинаптических сигнальных белков в гиппокампе крыс. Токсикол Летт. 2012;211(1):39–44. [PubMed] [Академия Google]
74. Martinez EJ, et al. Умеренное перинатальное воздействие мышьяка изменяет нейроэндокринные маркеры, связанные с депрессией, и усиливает депрессивно-подобное поведение у потомства взрослых мышей. Нейротоксикология. 2008;29(4):647–55. [Бесплатная статья PMC] [PubMed] [Google Scholar]
75. Klein C, et al. Цинк индуцирует ERK-зависимую гибель клеток через специфическую изоформу Ras. Апоптоз. 2006; 11 (11): 1933–44. [PubMed] [Google Scholar]
76. Martinez-Finley EJ, et al. Снижение экспрессии генов MAPK/ERK у потомков, подвергавшихся перинатальному воздействию мышьяка, вызванное дефицитом глюкокортикоидных рецепторов. Нейротоксикол Тератол. 2011;33(5):530–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
77. Бодвелл Дж. Э., Кингсли Л. А., Гамильтон Дж. В. Мышьяк в очень низких концентрациях изменяет активацию генов, опосредованную глюкокортикоидным рецептором (GR), но не репрессию генов, опосредованную GR: сложные эффекты доза-реакция тесно коррелируют с уровнями активированного GR и требуют наличия функционального ДНК-связывающего домена GR. Хим. Рез. Токсикол. 2004;17(8):1064–76. [PubMed] [Google Scholar]
Бодвелл Дж. Э., Кингсли Л. А., Гамильтон Дж. В. Мышьяк в очень низких концентрациях изменяет активацию генов, опосредованную глюкокортикоидным рецептором (GR), но не репрессию генов, опосредованную GR: сложные эффекты доза-реакция тесно коррелируют с уровнями активированного GR и требуют наличия функционального ДНК-связывающего домена GR. Хим. Рез. Токсикол. 2004;17(8):1064–76. [PubMed] [Google Scholar]
78. Bodwell JE, et al. Мышьяк нарушает активацию гена стероидного рецептора: сложные эффекты доза-реакция характерны для нескольких стероидных рецепторов. Хим. Рез. Токсикол. 2006;19(12): 1619–29. [Бесплатная статья PMC] [PubMed] [Google Scholar]
79. Davey JC, et al. Мышьяк как эндокринный разрушитель: влияние мышьяка на экспрессию генов, опосредованную рецептором эстрогена, in vivo и в культуре клеток. Токсикол науч. 2007;98(1):75–86. [PubMed] [Google Scholar]
80. Ahir BK, et al. Системная биология и профилактика врожденных дефектов: блокада глюкокортикоидного рецептора предотвращает врожденные дефекты, вызванные мышьяком. Перспектива охраны окружающей среды. 2013;121(3):332–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Перспектива охраны окружающей среды. 2013;121(3):332–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
81.•. Гоггин С.Л., Лабрек М.Т., Аллан А.М. Перинатальное воздействие арсената натрия в концентрации 50 частей на миллиард вызывает нарушение регуляции гипоталамо-гипофизарно-надпочечниковой оси у самцов мышей C57BL/6. Нейротоксикология. 2012;33(5):1338–45. [Бесплатная статья PMC] [PubMed] [Google Scholar]
82. Rodriguez VM, et al. Влияние воздействия арсенита натрия на развитие и поведение крыс. Нейротоксикол Тератол. 2002;24(6):743–50. [PubMed] [Google Scholar]
83. Bardullas U, et al. Хроническое воздействие мышьяка в малых дозах вызывает у мышей гендерно-специфические изменения двигательной активности, дофаминергических систем и экспрессии тиоредоксина. Toxicol Appl Pharmacol. 2009 г.;239(2):169–77. [PubMed] [Google Scholar]
84. Rodriguez VM, et al. Хроническое воздействие низких концентраций неорганического мышьяка вызывает изменения двигательной активности и экспрессии дофаминергической и антиоксидантной систем у крыс-альбиносов. Нейротоксикол Тератол. 2010;32(6):640–7. [PubMed] [Google Scholar]
Нейротоксикол Тератол. 2010;32(6):640–7. [PubMed] [Google Scholar]
85. Yadav RS, et al. Ослабление нейротоксичности мышьяка куркумином у крыс. Toxicol Appl Pharmacol. 2009;240(3):367–76. [PubMed] [Google Scholar]
86. Luo J, et al. Воздействие арсенита на матерей и в раннем возрасте ухудшает развитие нервной системы и увеличивает экспрессию PSA-NCAM в гиппокампе потомства крыс. Токсикология. 2013;311(3):99–106. [PubMed] [Google Scholar]
87. Ганди Д.Н., Панчал Г.М., Патель К.Г. Исследование токсичности мышьяка для развития и нейроповеденческой токсичности у крыс после гестационного воздействия. Индийский J Exp Biol. 2012;50(2):147–55. [PubMed] [Google Scholar]
88. Baldissarelli LA, et al. Мышьяк изменяет поведенческие параметры и активность эктонуклеотидаз головного мозга у рыбок данио (Danio rerio) Comp Biochem Physiol C Toxicol Pharmacol. 2012;155(4):566–72. [PubMed] [Google Scholar]
89. Yadav RS, et al. Нейропротекторная эффективность куркумина при холинергических дисфункциях, вызванных мышьяком, у крыс. Нейротоксикология. 2011;32(6):760–8. [PubMed] [Академия Google]
Нейротоксикология. 2011;32(6):760–8. [PubMed] [Академия Google]
90. Nagaraja TN, Desiraju T. Влияние на оперантное обучение и активность ацетилхолинэстеразы головного мозга у крыс после хронического приема неорганического мышьяка. Hum Exp Toxicol. 1994;13(5):353–6. [PubMed] [Google Scholar]
91. Patlolla AK, Tchounwou PB. Ацетилхолинэстераза сыворотки как биомаркер индуцированной мышьяком нейротоксичности у крыс линии Спраг-Доули. Общественное здравоохранение Int J Environ Res. 2005;2(1):80–3. [Бесплатная статья PMC] [PubMed] [Google Scholar]
92. Mufson EJ, et al. Холинергическая система при прогрессировании болезни Альцгеймера: терапевтические последствия. Эксперт преподобный Нейротер. 2008;8(11):1703–18. [Бесплатная статья PMC] [PubMed] [Google Scholar]
93. Гонг Г., О’Брайант С.Э. Гипотеза воздействия мышьяка при болезни Альцгеймера. Альцгеймер Dis Assoc Disord. 2010 [PubMed] [Google Scholar]
94. Zarazua S, et al. Мышьяк влияет на экспрессию и процессинг белка-предшественника амилоида (АРР) в первичных нервных клетках, сверхэкспрессирующих шведскую мутацию человеческого АРР. Int J Dev Neurosci. 2011;29(4):389–96. [PubMed] [Google Scholar]
Int J Dev Neurosci. 2011;29(4):389–96. [PubMed] [Google Scholar]
95. Giasson BI, et al. Экологический токсин арсенит вызывает гиперфосфорилирование тау. Биохимия. 2002;41(51):15376–87. [PubMed] [Академия Google]
96. Kim I, et al. Цинк стимулирует фосфорилирование тау-S214 путем активации Raf/митоген-активируемой протеинкиназы-киназы/пути киназы, регулируемой внеклеточным сигналом. Нейроотчет. 2011;22(16):839–44. [PubMed] [Google Scholar]
97. Piacentini S, et al. Полиморфизм GSTO1 * E155del, связанный с повышенным риском позднего начала болезни Альцгеймера: гипотеза ассоциации для необычного генетического варианта. Нейроски Летт. 2012;506(2):203–7. [PubMed] [Академия Google]
98. Уитбред А.К. и соавт. Характеристика омега-класса глутатионтрансфераз. Методы Энзимол. 2005; 401:78–99. [PubMed] [Google Scholar]
99. Ortiz JG, et al. Изучение восприимчивости дрозофилы к мышьяку с генетической точки зрения выявило ключевую роль глутатионсинтетазы. Токсикол науч. 2009;107(2):416–26. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2009;107(2):416–26. [Бесплатная статья PMC] [PubMed] [Google Scholar]
100. Джомова К., Валко М. Достижения в области окислительного стресса, вызванного металлами, и болезней человека. Токсикология. 2011; 283(2–3):65–87. [PubMed] [Академия Google]
101. Govindarajan N, et al. Бутират натрия улучшает функцию памяти в модели мышей с болезнью Альцгеймера при введении на поздней стадии прогрессирования заболевания. Дж. Альцгеймера Дис. 2011;26(1):187–97. [PubMed] [Google Scholar]
102. Liu X, Piao F, Li Y. Защитный эффект таурина на снижение уровня биогенных аминовых нейротрансмиттеров в мозге мышей, подвергшихся воздействию мышьяка. Adv Exp Med Biol. 2013; 776: 277–87. [PubMed] [Google Scholar]
103. Yadav RS, et al. Нейропротекторный эффект куркумина при нейротоксичности, вызванной мышьяком, у крыс. Нейротоксикология. 2010;31(5):533–9. [PubMed] [Google Scholar]
104.•. Лю С. и др. Индуцированное мышьяком ингибирование нейрогенеза гиппокампа и его обратимость. Нейротоксикология. 2012;33(5):1033–9. [PubMed] [Google Scholar]
Нейротоксикология. 2012;33(5):1033–9. [PubMed] [Google Scholar]
105. Hong GM, Bain LJ. Воздействие мышьяка ингибирует миогенез и нейрогенез в стволовых клетках P19 за счет подавления сигнального пути бета-катенина. Токсикол науч. 2012;129(1):146–56. [Бесплатная статья PMC] [PubMed] [Google Scholar]
106. Kaler S, et al. Предварительные морфологические и иммуногистохимические изменения в гиппокампе крыс после постнатального воздействия арсенита натрия. Токсикол Интерн. 2013;20(2):160–9.. [Бесплатная статья PMC] [PubMed] [Google Scholar]
107. Li D, et al. Механизмы развития токсичности арсенита у эмбрионов рыбок данио (Danio rerio). Аква токсикол. 2009;91(3):229–37. [PubMed] [Google Scholar]
108. Anacker C, et al. Связанные с глюкокортикоидами молекулярные сигнальные пути, регулирующие нейрогенез гиппокампа. Нейропсихофармакология. 2013;38(5):872–83. [Бесплатная статья PMC] [PubMed] [Google Scholar]
109. Anacker C, et al. Антидепрессанты усиливают нейрогенез гиппокампа человека, активируя глюкокортикоидный рецептор. Мол Психиатрия. 2011;16(7):738–50. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Мол Психиатрия. 2011;16(7):738–50. [Бесплатная статья PMC] [PubMed] [Google Scholar]
110. Zeng H, Uthus EO, Combs GF., Jr. Механистические аспекты взаимодействия между селеном и мышьяком. Дж. Инорг Биохим. 2005;99(6):1269–74. [PubMed] [Google Scholar]
111. George CM, et al. Поперечное исследование влияния селена в крови на концентрацию мышьяка в крови и моче в Бангладеш. Здоровье окружающей среды. 2013;12:52. [Бесплатная статья PMC] [PubMed] [Google Scholar]
112. Wang X, et al. Влияние субхронического воздействия мышьяка на уровень эссенциальных микроэлементов в мозге мышей и его половые различия. Биометаллы. 2013;26(1):123–31. [PubMed] [Академия Google]
113. Рой С., Чатторадж А., Бхаттачарья С. Вызванные мышьяком изменения гистоархитектоники зрительного нерва и профиля ацетилхолинэстеразы-ацетилхолина у Channa punctatus: улучшение с помощью селена. Comp Biochem Physiol C Toxicol Pharmacol. 2006;144(1):16–24. [PubMed] [Google Scholar]
114. Ahmad M, et al.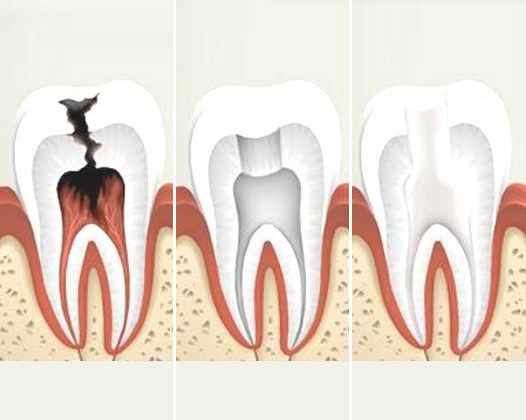 Эффективность цинка в модулировании перинатальных эффектов мышьяка на тератологические эффекты у потомства мышей. Биол рез. 2013;46(2):131–8. [PubMed] [Академия Google]
Эффективность цинка в модулировании перинатальных эффектов мышьяка на тератологические эффекты у потомства мышей. Биол рез. 2013;46(2):131–8. [PubMed] [Академия Google]
115. Milton AG, Zalewski PD, Ratnaike RN. Цинк защищает от индуцированного мышьяком апоптоза в линии нейронов, что измеряется по активности DEVD-каспазы. Биометаллы. 2004;17(6):707–13. [PubMed] [Google Scholar]
116. Флора С.Дж., Пачаури В. Хелатирование при отравлении металлами. Общественное здравоохранение Int J Environ Res. 2010;7(7):2745–88. [Бесплатная статья PMC] [PubMed] [Google Scholar]
117. Ram Kumar M, Flora SJ, Reddy GR. Моноизоамил-2,3-димеркаптоянтарная кислота ослабляет индуцированную мышьяком токсичность: поведенческий и нейрохимический подход. Environ Toxicol Pharmacol. 2013;36(1):231–42. [PubMed] [Академия Google]
118. Mondal S, et al. Предотвращение опосредованной мышьяком репродуктивной токсичности у взрослых самок крыс с помощью диеты с высоким содержанием белка. Фарм Биол. 2013;51(11):1363–71. [PubMed] [Google Scholar]
2013;51(11):1363–71. [PubMed] [Google Scholar]
119. Seow WJ, et al. Снижение содержания мышьяка в питьевой воде и улучшение кожных поражений: последующее исследование в Бангладеш. Перспектива охраны окружающей среды. 2012; 120(12):1733–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Мышьяковая невропатия | МедЛинк Неврология
 J Toxicol Clin Toxicol 2003;41:963-7.
PMID 14705842
J Toxicol Clin Toxicol 2003;41:963-7.
PMID 14705842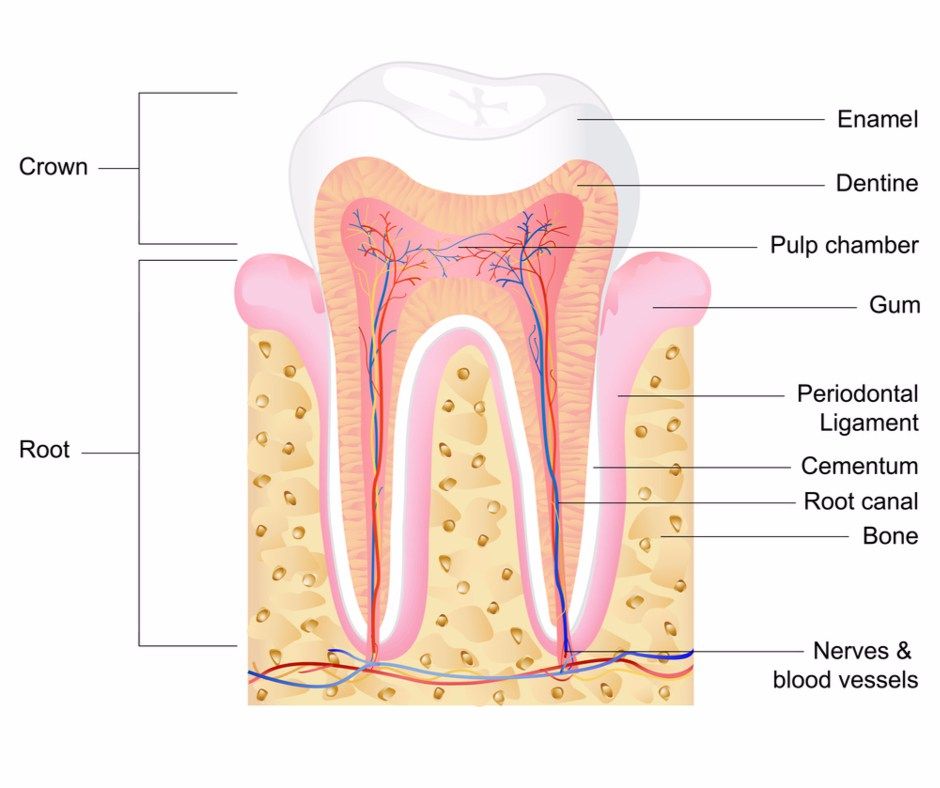
 Хроническая токсичность мышьяка: клинические признаки, эпидемиология и лечение: опыт Западной Бенгалии. J Environ Sci Health Part A Tox Hazard Subst Environ Eng 2003;38(1):141-63.
PMID 12635824
Хроническая токсичность мышьяка: клинические признаки, эпидемиология и лечение: опыт Западной Бенгалии. J Environ Sci Health Part A Tox Hazard Subst Environ Eng 2003;38(1):141-63.
PMID 12635824 J Occup Health 2005;47(1):1-21.
PMID 15703449
J Occup Health 2005;47(1):1-21.
PMID 15703449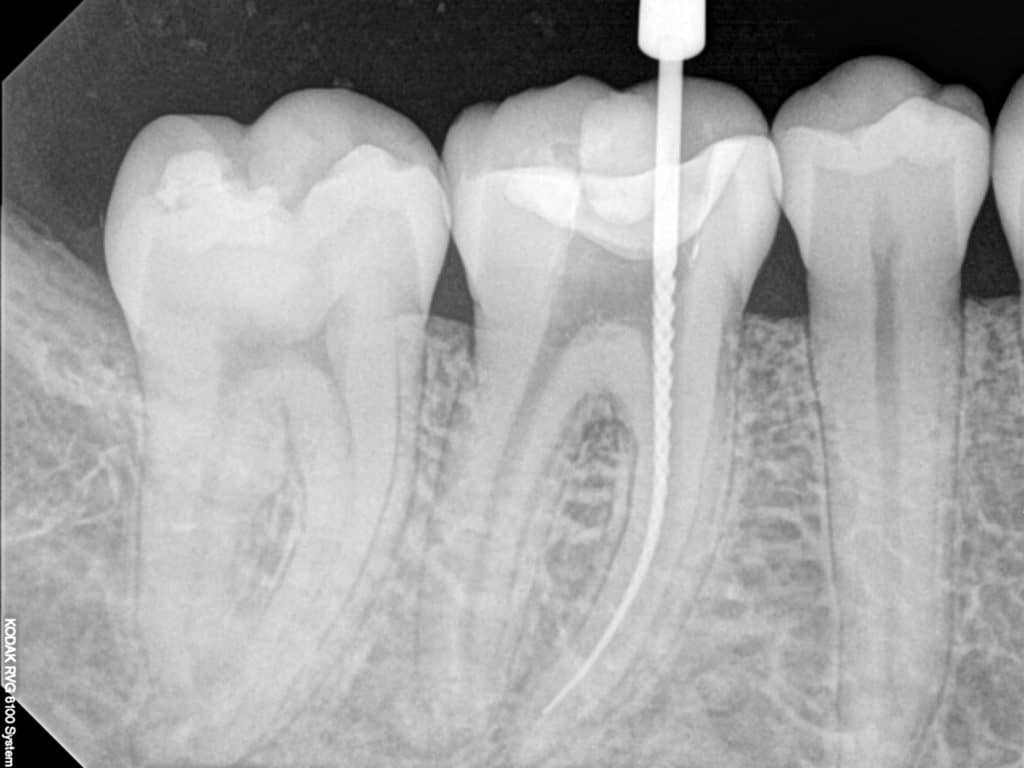 Mediterr J Hematol Infect Dis 2016;8(1):e2016023.
PMID 27158436
Mediterr J Hematol Infect Dis 2016;8(1):e2016023.
PMID 27158436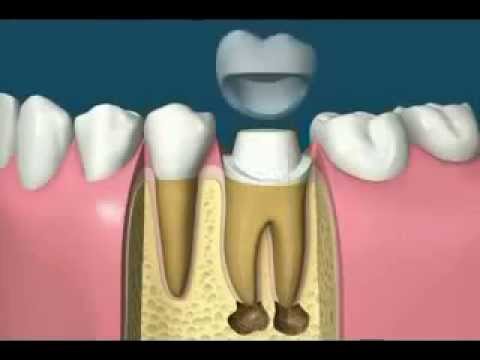 Тест на мышьяк. Mayo Clin Proc 1993;68:1210-1.
PMID 8246626
Тест на мышьяк. Mayo Clin Proc 1993;68:1210-1.
PMID 8246626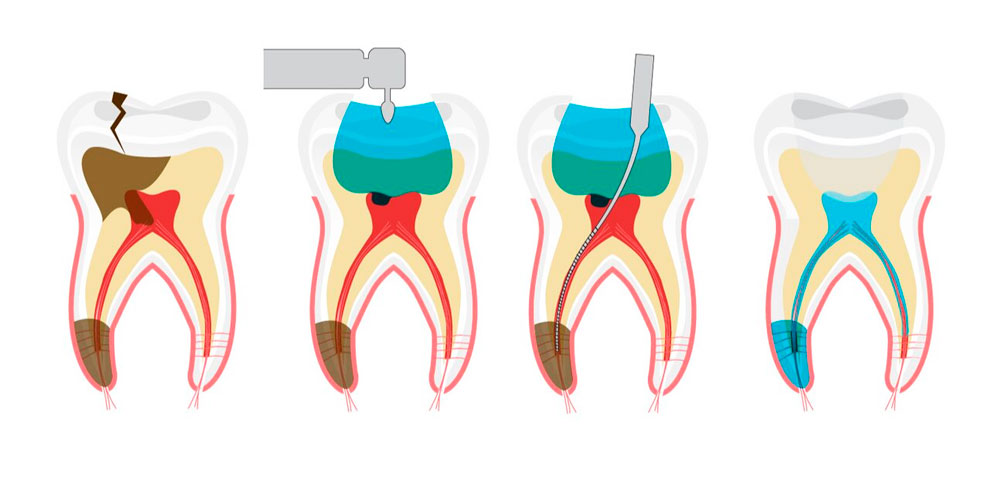 Куреус 2021;13(1):e12780.
PMID 33628652
Куреус 2021;13(1):e12780.
PMID 33628652 PMID 11778666
PMID 11778666 PMID 15819584
PMID 15819584

 Что делать?
Что делать?