Систематика хронических периодонтитов и их место в МКБ-10 Текст научной статьи по специальности «Клиническая медицина»
© САБЛИНА Г.И., КОВТОНЮК П.А., СОБОЛЕВА Н.Н., ЗЕЛЕНИНА Т.Г., ТАТАРИНОВА Е.Н.
УДК 616.314.17-036.12
СИСТЕМАТИКА ХРОНИЧЕСКИХ ПЕРИОДОНТИТОВ И ИХ МЕСТО В МКБ-10
Галина Иннокентьевна Саблина, Петр Алексеевич Ковтонюк, Наталья Николаевна Соболева,
Тамара Григорьевна Зеленина, Елена Николаевна Татаринова (Иркутский государственный институт усовершенствования врачей, ректор д.м.н., проф. В.В. Шпрах, кафедра стоматологии детского возраста и ортодонтии, зав. — к.м.н., доц. Н.Н. Соболева)
Резюме. В сообщении обоснованы уточнения к терминологии клинических форм хронического периодонтита. Клиническая классификация периодонтитов соотнесена с МКБ-10.
Ключевые слова: МКБ-10, периодонтит.
CLASSIFICATION OF CHRONIC PERIODONTITIS AND ITS POSITION IN ICD-10
G.I. Sablina, P.A. Kovtonyuk, Ы.Ы.8оЬо1еуа, T.G. Zelenina, E. N. Tatarinova (Irkutsk State Institute for Postgraduate Medical Education)
Summary. The specification of the terminology of clinical forms of chronic periodontitis has been substantiated. The clinical classification of periodontitis is correlated with ICD-10.
The specification of the terminology of clinical forms of chronic periodontitis has been substantiated. The clinical classification of periodontitis is correlated with ICD-10.
Key words: chronic destructive periodontitis, the International Classification of Diseases (ICD-10).
В связи с появлением приказа Минздрава РФ № 170 от 27.05.1997 г. «О переходе органов и учреждений здравоохранения Российской Федерации на МКБ-10» обозначилась проблема ведения стоматологической документации, связанная с необходимостью использования двух классификаций: статистической и клинической.
Клиническая классификация позволяет регистрировать нозологическую форму патологии, дифференцировать ее от других форм, определять оптимальный метод лечения и прогнозировать его результат.
Международная классификация болезней (МКБ-10) — это система рубрик, в которую отдельные патологические состояния включены в соответствии с определенными установленными критериями [16]. МКБ-10 используется для преобразования словесной формулировки диагнозов болезней и других проблем, связанных со здоровьем, в буквенно-цифровые коды, которые обеспечивают удобство хранения, извлечения и анализа данных.
Научные школы в РФ неоднозначно рассматривают соответствие одних и тех же нозологических форм клинической классификации кодам МКБ-10 [1, 2, 3, 15, 21]. По нашему мнению, наиболее часто возникают разногласия при диагностике различных форм хронического периодонтита и определения их места в МКБ-10. Например, Т.Л. Рединова (2010) хронический гранулирующий периодонтит предлагает относить к коду 04.6 — периапикальному абсцессу со свищем, тогда как Е.В. Боровский (2004) считает, что данная нозологическая форма соответствует коду 04.5 — хроническому апикальному периодонтиту.
Целью сообщения явилось обоснование внесения изменений в клиническую классификацию хронических периодонтитов и адаптации ее к МКБ —10.
С 1936 года по настоящее время в нашей стране основной классификацией поражений тканей периодонта является классификация И.Г. Лукомского [5, 7, 10, 13, 25].
Острые формы:
— острый серозный верхушечный периодонтит,
— острый гнойный верхушечный периодонтит.
Хронические формы:
— хронический верхушечный фиброзный периодонтит,
— хронический верхушечный гранулирующий периодонтит,
— хронический верхушечный гранулематозный периодонтит.
Обострившийся хронический верхушечный периодонтит.
Корневая киста.
Следует отметить, что изначально И.Г. Лукомский выделил всего две формы хронического периодонтита: фиброзный и грануломатозный. Позднее грануломатоз-ный периодонтит был дифференцирован на гранулома-тозный и гранулирующий в зависимости от степени активности процесса хронического воспаления и степени токсичности очагов [5].
Классификация И.Г. Лукомского основана на патологических морфологических изменениях в периодонте. В то же время, клинически часто сложно определить характер воспалительного процесса. Хронические периодонтиты нередко протекают со скудной симптоматикой [23]. Различия в клиническом течении гранулирующей и гранулематозной форм незначительны и недостаточны для дифференциальной диагностики этих форм, а фиброзный периодонтит не имеет собственных клинических признаков [23, 24].
В зависимости от клинической и патологоанатомической картины хронические периодонтиты допускают представлять в двух формах: стабилизированной и активной. К стабилизированной форме относят фиброзный периодонтит, к активной (деструктивной) — гранулирующую и гранулематозную формы. Активная форма хронических периодонтитов сопровождается образованием грануляций, свищевых ходов, гранулем, возникновением нагноений в околочелюстных тканях.
По этому поводу еще в 2003 году, заслуженный деятель науки РФ, профессор Е.В. Боровский утверждал, что нет необходимости деления хронического периодонтита на гранулирующий и гранулематозный [24]. Мы поддерживаем данную точку зрения в том, что эти формы хронического периодонтита целесообразно определять одним клиническим диагнозом «хронический деструктивный периодонтит», основываясь на том, что морфологическая картина характеризуется деструкцией костной ткани при той и другой формах патологии. Под термином «деструкция» понимают разрушение костной ткани и замещение ее другой (патологической) тканью (грануляциями, гноем, опухолевидной) [7].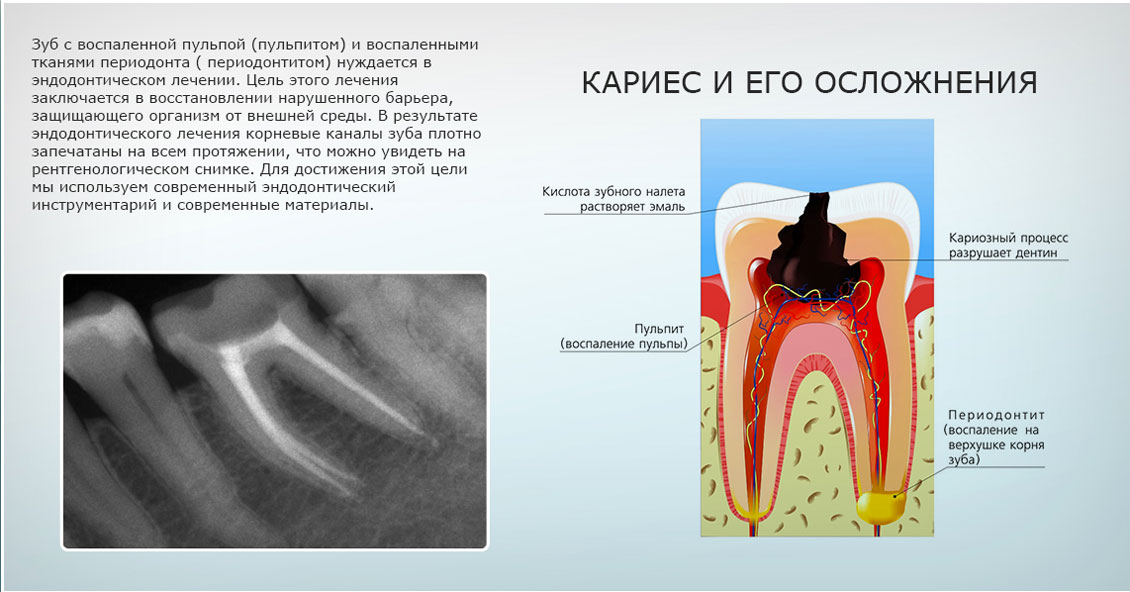 В то же время, далеко не всеми стоматологами в системе вузовского и последипломного образования, а также в практическом здравоохранении принимается данная трактовка диагноза. Специалисты, по-прежнему, придерживаются классификации И.Г. Лукомского, в которой основным дифференциальным признаком хронических периодонтитов все еще признается рентгенологическая характеристика очагов поражения костной ткани челюсти.
В то же время, далеко не всеми стоматологами в системе вузовского и последипломного образования, а также в практическом здравоохранении принимается данная трактовка диагноза. Специалисты, по-прежнему, придерживаются классификации И.Г. Лукомского, в которой основным дифференциальным признаком хронических периодонтитов все еще признается рентгенологическая характеристика очагов поражения костной ткани челюсти.
В руководствах и учебниках по стоматологии приводится традиционное описание рентгенологической характеристики хронического гранулирующего и гранулематозного периодонтитов [7,12, 13,14, 23, 24, 25].
Соответствие классификаций хронических периодонтитов
Нозологические формы периодонтитов по классификации И.Г. Лукомского Нозологическая форма по предлагаемой систематике Код по МКБ-10
Хронический гранулирующий периодонтит, хронический гранулематозный периодонтит Хронический деструктивный периодонтит К 04.5. Хронический апикальный периодонтит (апикальная гранулема)
Хронический фиброзный периодонтит Хронический фиброзный периодонтит К 04.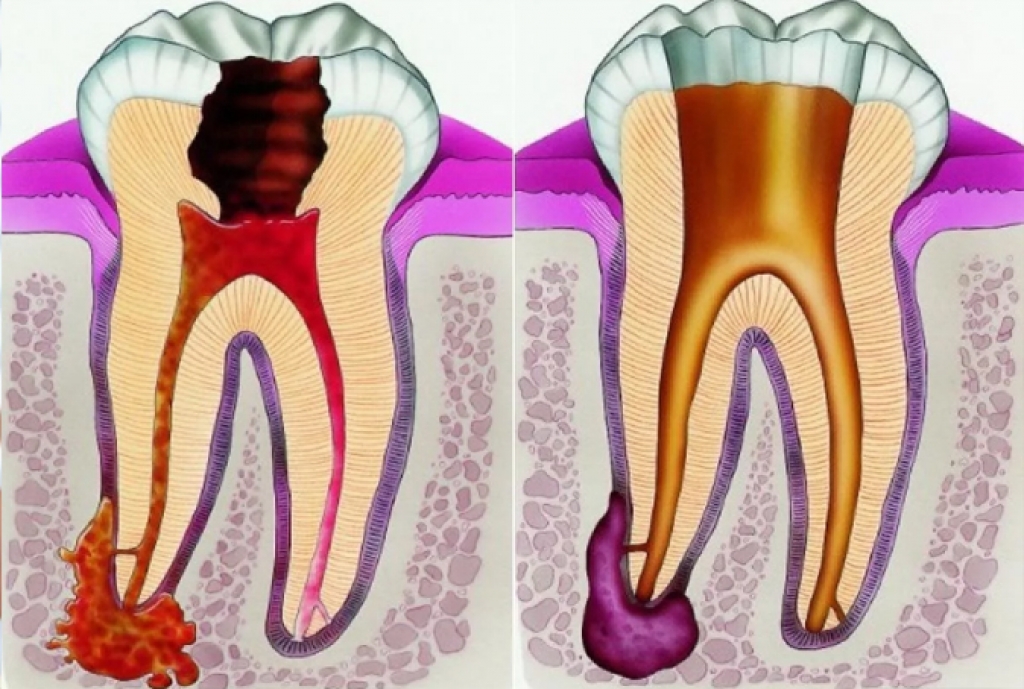 9. Другие неуточненные болезни пульпы и периапикальных тканей
9. Другие неуточненные болезни пульпы и периапикальных тканей
Обострившийся хронический периодонтит Обострившийся хронический периодонтит К 04.7. Периапикальный абсцесс без свища
Основным дифференциальным признаком в различии данных форм патологии периодонта рекомендуется принимать четкость, ровность контуров очага деструкции и его величину. На практике же врачу достаточно трудно, а иногда, и невозможно провести объективную границу контуров очага повреждения с позиций расплывчатости границ. Более того, Н.А. Рабухина., Л.А. Григорьянц., В.А. Бадалян (2001) считают, что форма деструкции на рентгенограмме определяется не активностью процесса (распространяется — гранулирующий, отграничен — гранулема), а расположением его по отношению к кортикальной пластинке. Авторами установлено, что по мере приближения очага воспаления к кортикальной пластинке он приобретает на рентгенограмме округлую форму, а при полном ее вовлечении появляется кортикальный ободок. Кроме того, в клинике иногда при рентгенологической картине, воспринимаемой как гранулирующий периодонтит, при удалении зуба по клиническим показаниям на верхушке корня выявляется фиксированная гранулема.
Как отмечают Н.А. Рабухина, А.П. Аржанцев (1999) «Патоморфологические данные свидетельствуют, что более 90% рентгенологически выявляющихся периа-пикальных разрежений, не имеющих отчетливой клиники, являются гранулемами. Рентгенологическая характеристика гранулирующего и гранулематозного периодонтитов неспецифична, и поэтому не может служить основанием для выделения морфологических типов периодонтитов, как это нередко делают стоматологи на практике. На I Международном конгрессе челюстно-лицевых рентгенологов в 1969 году принято специальное решение об ошибочности использования рентгенологических данных для определения гистопа-тологической сущности зон периапикальной костной резорбции».
Имеющиеся в литературе морфологические данные убедительно доказывают, что нет необходимости деления хронического периодонтита на гранулирующий и гранулематозный, т.к. это различные стадии одного и того же процесса. При снижении реактивности организма грануляционная ткань активно развивается с выходом в костную ткань альвеолы без четких границ, причем ее трансформация в зрелую соединительную ткань задерживается [2, 17]. При гранулематозной форме у верхушки корня пораженного зуба разрастание отграничивается макроорганизмом образованием зрелой волокнистой соединительной ткани в виде капсулы, не имеющей соединения с зубной альвеолой кости. Такое образование называется апикальной гранулемой.
При гранулематозной форме у верхушки корня пораженного зуба разрастание отграничивается макроорганизмом образованием зрелой волокнистой соединительной ткани в виде капсулы, не имеющей соединения с зубной альвеолой кости. Такое образование называется апикальной гранулемой.
Е.В. Боровский (2003) указывает на то, что размер и форма гранулемы может изменяться. В случае преобладания раздражителей корневого канала происходит активация процесса, что рентгенологически проявляется резорбцией костной ткани, отображающейся потерей четкости контуров очага разрежения и его увеличением. Если же побеждают защитные механизмы, то очаг разрежения костной ткани на рентгенограмме стабилизируется и имеет четкие контуры. Автор считает, что эти изменения являются различными стадиями одного и того же процесса.
Таблица 1 Описанные изменения в очаге деструкции согласуются с его морфологической характеристикой, описанной Fisch (1968). Автор выделяет в периапикальном очаге четыре морфологические зоны:
— зону инфекции
— зону разрушения
— зону воспаления
— зону стимуляции.
Изложенные выше морфологические и
рентгенологические обоснования к объединению гранулирующего и гранулематозного периодонтитов в деструктивную нозологическую форму подтверждаются еще и тем, что выбор метода лечения и исход этих периодонтитов не зависит от формы деструкции патологического очага. И при гранулирующем и при гранулематозном периодонтите лечебные мероприятия должны быть направлены на устранение инфекционного очага, снижение инфекционно-токсического, аллергического и аутоиммунного воздействия на организм, предотвращение распространения инфекции [4, 6, 9, 11, 22, 24, 25].
Следует также отметить, что с точки зрения современной стоматологической терминологии в классификации периодонтитов не всегда употребляется слово «верхушечный» для уточнения локализации процесса. Многие специалисты, рассматривая патологию периодонта, понимают локализацию очага деструкции в околоверхушечной или фуркационной зоне зуба. Это объясняется тем, что деструкция, возникающая в маргинальном пародонте, характеризуемая ранее как «маргинальный периодонтит» [5], после принятия классификации заболеваний пародонта в 1986 году диагностируется как локализованный пародонтит [5, 18, 22, 26].
Таким образом, мы считаем целесообразным различать следующие нозологические формы хронических периодонтитов:
— хронический фиброзный периодонтит
— хронический деструктивный периодонтит
— обострившийся хронический периодонтит.
Предложенная систематика была соотнесена нами с
кодами МКБ-10 (табл. 1).
Нами не принят код 04.6 — периапикальный абсцесс со свищем, рекомендуемый некоторыми авторами [21]. Мы считаем необоснованным использовать термин «свищ» для обозначения хронического гранулирующего периодонтита. Свищ наблюдается как при гранулирующем, так и при гранулематозном периодонтитах. Термин же «абсцесс» в Энциклопедическом словаре медицинских терминов (1982 год, том 1) трактуется как «отделяться, нарывать; син.: апостема, гнойник, нарыв», что не всегда соответствует клинической картине гранулирующего периодонтита.
Известно, что хронический фиброзный периодонтит может являться исходом лечения пульпитов, периодонтитов, травм, функциональной перегрузки пародонта и др. Фиброзные изменения периодонта не имеют собственных клинических проявлений и поэтому по МКБ-10 он может быть отнесен к коду 04.9 — другие неуточ-ненные болезни пульпы и периапикальных тканей.
Фиброзные изменения периодонта не имеют собственных клинических проявлений и поэтому по МКБ-10 он может быть отнесен к коду 04.9 — другие неуточ-ненные болезни пульпы и периапикальных тканей.
Гранулирующий и гранулематозный хронические периодонтиты, объединенные термином деструктивный периодонтит, соответствуют коду 04.5 — хронический апикальный периодонтит (апикальная гранулема).
Код 04.7 — периапикальный абсцесс без свища соответствует обострению всех форм хронических периодонтитов.
Таким образом, обоснованная систематика хронических периодонтитов соответствует классификации ВОЗ 10-го пересмотра. Она упрощает клиническую диагностику, ведение документации, внутриведомственный контроль лечения и вневедомственную оценку страховыми компаниями уровня качества лечения (УКЛ).
ЛИTEPATУPA
1. Алимова М.Я., Боровский Е.В., Макеева И.М., Бондаренко И.В. Анализ классификационных систем раздела «Кариес и его осложнения» // Эндодонтия today. — 2008. — №2. — С. 49-54.
2. Бойкова С.П., Зайратьянц О.В. Клиникоморфологическая характеристика и классификация кариеса и его и его осложнений (пульпит, периодонтит, радикуляр-ная киста) в соответствии с требованиями Международной классификации стоматологических болезней // Эндодонтия today. — 2008. — №1. — С. 3-11.
Бойкова С.П., Зайратьянц О.В. Клиникоморфологическая характеристика и классификация кариеса и его и его осложнений (пульпит, периодонтит, радикуляр-ная киста) в соответствии с требованиями Международной классификации стоматологических болезней // Эндодонтия today. — 2008. — №1. — С. 3-11.
3. Боровский Е.В. Терминология и классификация кариеса зубов и его осложнений // Клиническая стоматология. — 2004. — №1. — С. 6-9.
4. Галанова Т.А., Цепов Л.М., Николаев А.И. Алгоритм лечения хронического апикального периодонтита // Эндодонтия today. 2009. — № 3. — С. 74-78
5. Гофунг Е.М. Учебник терапевтической стоматологии. — М.: Медгиз, 1946. —510 с.
6. Гринин В.М., Буляков Р.Т., Матросов В.В. Пероральная антибактериальная терапия в лечении деструктивных форм верхушечного периодонтита на фоне системного остеопороза. // Эндодонтия today. — 2011. — №1. — С. 49-51
7. Детская терапевтическая стоматология: нац. рук./ Под ред. В.К. Леонтьева, Л.П. Кисельникова. — М.: ГЭОТАР-Медиа, 2010.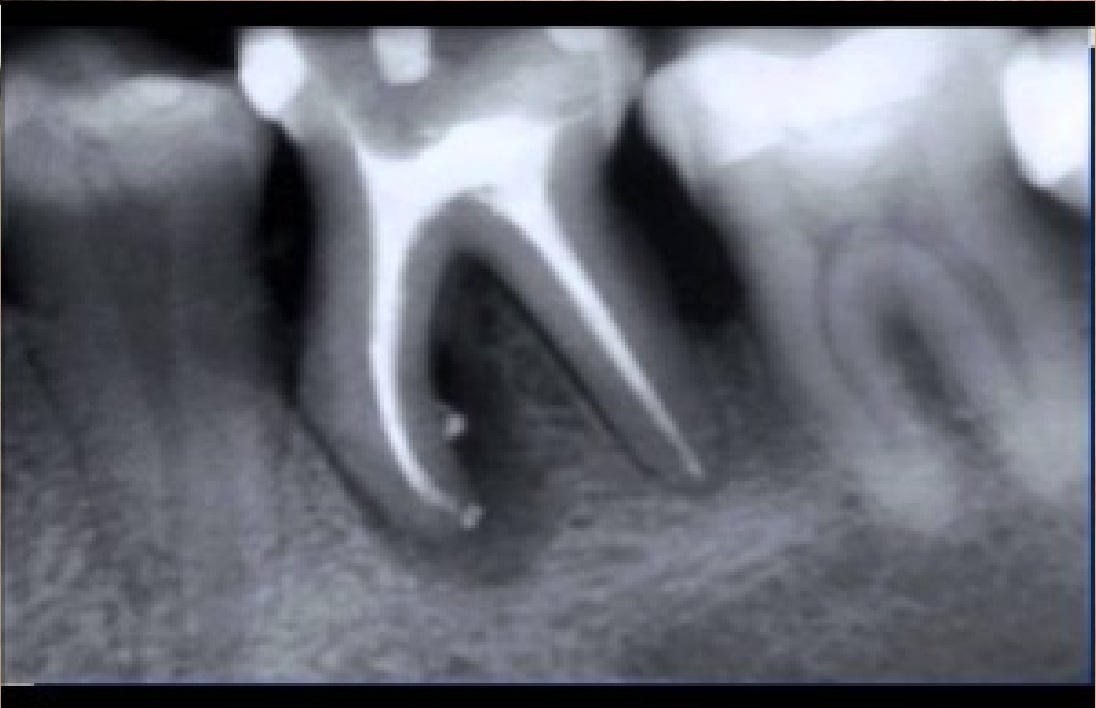 — 896 с.
— 896 с.
8. ЖурочкоЕ.И., Дегтярева Л.А. Комплексный метод оценки состояния околоверхушечных тканей зуба при хроническом верхушечном периодонтите // Эндодонтия today. — 2008. — № 2. — С. 27-31.
9. Звонникова Л.В., Георгиева О.А., Нисанова С.Е., Иванов Д.С. Использование современных антиоксидантов в комплексном лечении апикального периодонтита//Эндодонтия today. — 2008. — №1. — С. 85-87
10. Иванов В.С., Овруцкий Г.Д., Гемонов В.В. Практическая эндодонтия. — М.: Медицина, 1984. — 224 с.
11. Лавров И.К. Выбор метода лечения хронического апикального периодонтита у пациентов пожилого возраста в зависимости от сопутствующей патологии//Эндодонтия today. — 2010. — №2. — С. 68-72.
12. Лукиных Л.М., Лившиц Ю.Н. Верхушечный периодонтит. — Нижний Новгород, 1999. — с.
13. Лукомский И.Г. Терапевтическая стоматология: Учебник. — М., 1955. — 487 с.
14. Лучевая диагностика в стоматологии: национальное
руководство / Под ред. Тома A.Ю. Васильев. — M.: ГЭOTAP-Mедиa, 2Q1Q. злова. — СПб.: СпецЛит., 2QQ3. — C19Q-195.
злова. — СПб.: СпецЛит., 2QQ3. — C19Q-195.
24. Терапевтическая стоматология: Учебник для студентов медицинских вузов / Под ред. Е.В. Боровского. — M.: Mедицинскoе информационное агентство, 2QQ3. — 64Q с.
25. Терапевтическая стоматология: национальное руководство / Под ред. ЛА. Дмитриевой, ЮМ. Maксимoвскoгo. — M.: ГЭOTAP-Mедиa, 2QQ9. — 912 с.
26. Токмакова С.И., Жукова E.Q, Бондаренко O.B., Сысоева O.B. Оптимизация лечения деструктивных форм хронического периодонтита с применением препаратов гидроокиси кальция // Эндодонтия today. — 2Q1Q. — №4. — С. 61-64.
Информация об авторах: 664079, Иркутск, м-н Юбилейный, 100, ИГИУВ, e-mail: [email protected]
Галина Иннокентьевна Саблина — доцент, к.м.н.,
Петр Алексеевич Ковтонюк — доцент, к.м.н.,
Соболева Наталья Николаевна — заведующий кафедрой, к.м.н., доцент;
Тамара Григорьевна Зеленина — доцент, к.м.н.,
Елена Николаевна Татаринова — ассистент. тел. 89025695566, [email protected]
Качество и безопасность
МКБ-С на основе МКБ-10
- Стратегия качества
-
Требования к качеству и безопасности медицинской деятельности
- Документация в стоматологической организации
- Клинические рекомендации
- Порядки оказания медицинской помощи
- Стандарты медицинской помощи
- Санитарно-эпидемиологические требования
- Профессиональные стандарты
- Платные медицинские услуги
-
Организация внутреннего контроля
- Практические рекомендации
- Реестр аудиторов СДС в стоматологии
- Центры компетенций в стоматологии
- Мониторинг эффективности и безопасности лекарственных препаратов
- Мониторинг безопасности медицинских изделий
-
Экспертиза качества
- Экспертиза Росздравднадзора
- Экспертиза качества ОМС
- Досудебное урегулирование споров
-
Медицинская медиация
- О медиации
- Медиация в медицине
- Медиаторы
- Публикации
- Нормативные документы
- Проекты нормативных правовых актов
- МКБ-С на основе МКБ-10
- Медицинская статистика
Скачать полный текст МКБ-С на основе МКБ-10 (3-е издание)
КЛАСС XI Болезни органов пищеварения
Болезни полости рта, слюнных желез и челюстей
| К00 | Нарушения развития и прорезывания зубов |
|---|---|
К00. 0 0
|
Адентия |
|
|
| К00.1 | Сверхкомплектные зубы |
|
|
| К00.2 | Аномалия размеров и формы зубов |
|
|
| К00.3 | Крапчатые зубы |
|
|
| К00.4 | Нарушения формирования зубов |
|
|
| К00.5 | Наследственные нарушения структуры зуба, не классифицированные в других рубриках |
|
|
| К00.6 | Нарушения прорезывания зубов |
|
|
| К00.7 | Синдром прорезывания зубов |
| К00.8 | Другие нарушения развития зубов |
|
|
| К00.9 | Нарушение развития зубов не уточненное |
| К01 | Ретенированные и импактные зубы |
|---|---|
| К01.0 | Ретенированные зубы |
К01. 1 1
|
Импактные зубы |
|
| К02 | Кариес зубов |
|---|---|
| К02.0 | Кариес эмали |
| К02.1 | Кариес дентина |
| К02.2 | Кариес цемента |
| К02.3 | Приостановившийся кариес зубов |
К02. 4 4
|
Одонтоклазия |
| К02.8 | Другой кариес зубов |
| К02.9 | Кариес зубов неуточненный |
| К03 | Другие болезни твердых тканей зубов |
|---|---|
| К03.0 | Повышенное стирание зубов |
|
|
| К03.1 | Сошлифование зубов |
|
|
| К03.2 | Эрозия зубов |
|
|
| К03.3 | Патологическая резорбция зубов |
|
|
| К03.4 | Гиперцементоз |
К03. 5 5
|
Анкилоз зубов |
| К03.6 | Отложения (наросты) на зубах |
|
|
| К03.7 | Изменение цвета твердых тканей зубов после прорезывания |
|
|
| К03.8 | Другие уточненные болезни твердых тканей зубов |
|
|
| К03.9 | Болезнь твердых тканей зубов не уточненная |
| К04 | Болезни пульпы зуба |
|---|---|
| К04.0 | Пульпит |
|
|
| К04.1 | Некроз пульпы |
| К04.2 | Дегенерация пульпы |
| К04.3 | Неправильное формирование твердых тканей в пульпе |
| К04.3Х | Вторичный или иррегулярный дентин |
| К04.4 | Острый апикальный периодонтит пульпарного происхождения |
| К04.5 | Хронический апикальный периодонтит |
| К04.6 | Периапикальный абсцесс со свищом |
|
|
| К04.7 | Периапикальный абсцесс без свища |
| К04.8 | Корневая киста |
|
|
| К04.9 | Другие и не уточненные болезни пульпы и периапикальных тканей |
| К05 | Гингивит и болезни пародонта |
|---|---|
К05. 0 0
|
Острый гингивит |
|
|
| К05.1 | Хронический гингивит |
|
|
| К05.2 | Острый пародонтит |
|
|
| К05.3 | Хронический пародонтит |
|
|
| К05.4 | Пародонтоз |
| К05.5 | Другие болезни пародонта |
| К06 | Другие изменения десны и беззубого альвеолярного края |
|---|---|
| К06.0 | Рецессия десны |
|
|
| К06.8 | Другие уточненные изменения десны и беззубого альвеолярного края |
|
|
| К06.9 | Изменение десны и беззубого альвеолярного края неуточненное |
| К07 | Челюстно-лицевые аномалии [включая аномалии прикуса] |
|---|---|
| К07.0 | Основные аномалии размеров челюстей |
|
|
| К07.1 | Аномалии челюстно-черепных соотношений |
|
|
| К07.2 | Аномалии соотношений зубных дуг |
|
|
| К07.3 | Аномалии положения зубов |
|
|
| К07.4 | Аномалия прикуса не уточненная |
| К07.5 | Челюстно-лицевые аномалии функционального происхождения |
|
|
| К07.6 | Болезни височно-челюстного сустава |
|
| К08 | Другие изменения зубов и их опорного аппарата |
|---|---|
| К08.0 | Эксфолиация зубов вследствие системных нарушений |
| К08.1 | Потеря зубов вследствие несчастного случая, удаления или локальной периодонтальной болезни |
| К08.2 | Атрофия беззубого альвеолярного края |
| К08.3 | Задержка зубного Корня [ретенционный корень] |
| К08.8 | Другие уточненные изменения зубов и их опорного аппарата |
|
|
| К08.9 | Изменение зубов и их опорного аппарата не уточненное |
| К09 | Кисты области рта, не классифицированные в других рубриках |
|---|---|
К09. 0 0
|
Кисты, образовавшиеся в процессе формирования зубов |
|
|
| К09.1 | Ростовые (неодонтогенные) кисты области рта |
|
|
К09.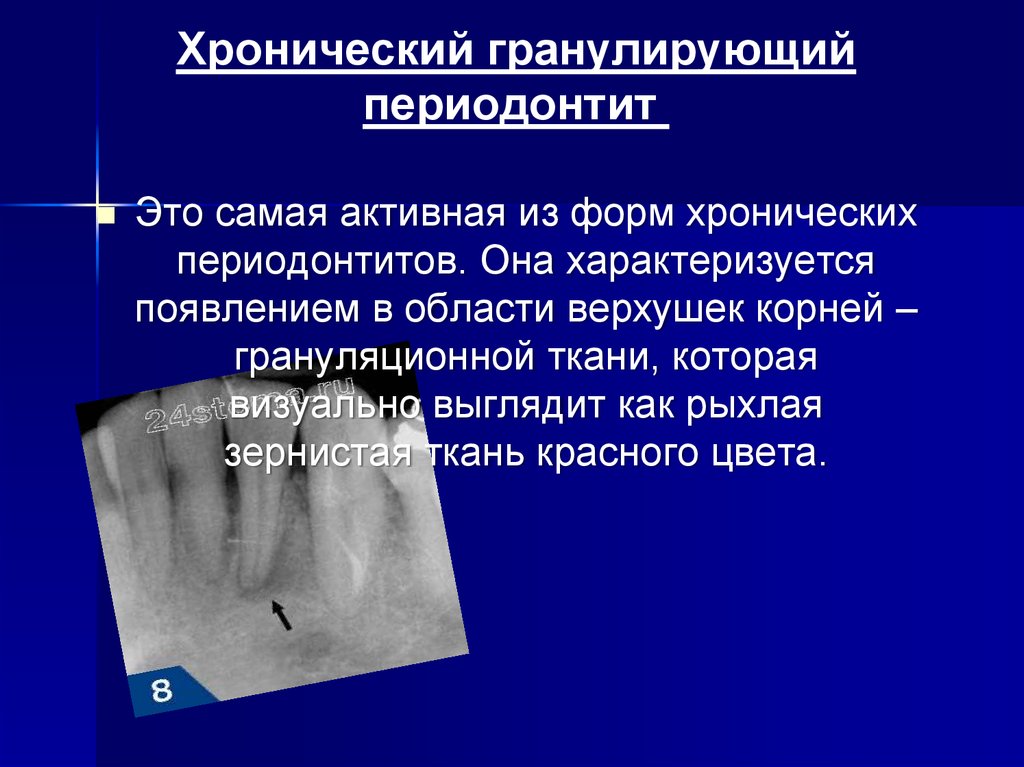 2 2
|
Другие кисты челюстей |
|
|
| К09.8 | Другие уточненные кисты области рта, не классифицированые в других рубриках |
|
|
| К09.9 | Киста области рта не уточненная |
| К10 | Другие болезни челюстей |
|---|---|
K10. 0 0
|
Нарушения развития челюстей |
|
|
| К10.1 | Гигантоклеточная гранулема центральная |
| К10.2 | Воспалительные заболевания челюстей |
|
|
К10. 3 3
|
Альвеолит челюстей |
| К10.8 | Другие уточненные болезни челюстей |
|
|
| К10.9 | Болезнь челюсти не уточненная |
| К11 | Болезнь слюнных желез |
|---|---|
| К11.0 | Атрофия слюнной железы |
| К11.1 | Гипертрофия слюнной железы |
| К11.2 | Сиалоаденит |
| К11.3 | Абсцесс слюнной железы |
| К11.4 | Свищ слюнной железы |
| К11.5 | Сиалолитиаз |
К11. 6 6
|
Мукоцеле слюнной железы |
|
|
| К11.7 | Нарушения секреции слюнных желез |
|
|
| К11.8 | Другие болезни слюнных желез |
|
Подпишитесь на рассылку!
Будьте в курсе наших новостей и обновлений.
| Согласен с | Подписаться |
Классификация периодонтитов
Периодонт́ит
— это воспаление периодонта,
характеризующееся нарушением целостности
связок, удерживающих зуб в альвеоле,
кортикальной пластинки кости, окружающей
зуб и резорбции костной ткани от
незначительных размеров до образования
кист больших размеров.
Классификация
Классификация по клиническому течению
-
Острый периодонтит. В зависимости от характера экссудата различают острый серозный и острый гнойный. Но данное разграничение бывает не всегда возможным, к тому же переход серозной формы в гнойную происходит достаточно быстро и зависит от определённых условий.
-
Хронический периодонтит. Разделяется на основании характера и степени повреждения тканей периодонта и кости. Выделяютхронический фиброзный периодонтит, хронический гранулирующий ихронический гранулематозный периодонтит.
-
Хронический периодонтит в стадии обострения. По клиническому течению схож с острыми формами, но обладает своими особенностями, например, наличием деструктивных изменений в костной ткани.
По происхождению
-
Инфекционный периодонтит. Развивается вследствие проникновения бактерий и их токсинов в ткани периодонта с последующим развитием в них воспаления.

-
Травматический периодонтит. Вызван в результате воздействия на периодонт травматического фактора. Это может быть сильная однократная травма, например, удар или ушиб зуба. А может быть длительно текущая, слабой интенсивности микротравма, например, завышающая пломба, «прямой» прикус, перегрузка зубов или вредные привычки.
-
Медикаментозный периодонтит. Возникает вследствие проникновения сильнодействующих химических веществ, таких как, мышьяковистая паста, формалин, фенол и т.д.
Классификация периодонтита МКБ-10
К04 Болезни периапикальных тканей
К04.4 Острый апикальный периодонтит пульпарного происхождения
К04.5 Хронический апикальный периодонтит
К04.6 Периапикальный абсцесс со свищом
К04.60 Имеющий сообщение [свищ] с верхнечелюстной пазухой
К04.61 Имеющий сообщение [свищ] с носовой полостью
К04.62 Имеющий сообщение [свищ] с полостью рта
К04. 63
Имеющий сообщение [свищ] с кожей
63
Имеющий сообщение [свищ] с кожей
К04.69 Периапикальный абсцесс со свищом неуточнённый
К04.7 Периапикальный абсцесс без свища
-
Дентальный абсцесс
-
Дентоальвеолярный абсцесс
-
Периодонтальный абсцесс пульпарного происхождения
-
Периапикальный абсцесс без свища
К04.8 Корневая киста
К04.80 Апикальная и боковая
К04.81 Остаточная
К04.82 Воспалительная парадентальная
К04.89 Корневая киста неуточнённая
К04.9 Другие и неуточнённые болезни периапикальных тканей
Периодонтит (periodontitis) — воспаление тканей, расположенных в периодонтальной щели (периодонтит), — может быть инфекционным, травматическим и медикаментозным.
Инфекционный
периодонтит возникает
при внедрении аутоинфекции, находящейся
в полости рта. Чаще поражается корневая
оболочка у верхушки зуба, реже — краевой
отдел периодонта.
Травматический периодонтит развивается в результате как однократной (удар, ушиб), так и хронической травмы (нарушение окклюзии при завышении высоты зуба искусственной коронкой, пломбой; при наличии вредных привычек — удерживание в зубах гвоздей, перекусывание ниток, лузганье семечек, разгрызание орехов и др.). Медикаментозный периодонтит может возникать при лечении пульпита, когда при обработке канала применяют сильнодействующие лекарственные вещества, а также вследствие аллергической реакции периодонта на лекарства. В клинической практике наиболее часто встречаются инфекционные верхушечные периодонтиты.
По данным клинической картины и патологоанатомическим изменениям воспалительные поражения периодонта можно выделить следующие группы (по И.Г.Лукомскому): I. Острый периодонтит 1. Серозный (ограниченный и разлитой) 2. Гнойный (ограниченный и разлитой)
II. Хронический периодонтит 1. Гранулирующий 2. Гранулематозный 3. Фиброзный
III. Хронический периодонтит в стадии
обострения.
Хронический периодонтит в стадии
обострения.
Классификаци периодонтитов ВОЗ (МКБ-10)
К04 Болезни периапикальных тканей
К04.4 Острый апикальный периодонтит пульпарного происхождения
К04.5 Хронический апикальный периодонтит
К04.6 Периапикальный абсцесс со свищом
К04.60 Имеющий сообщение [свищ] с верхнечелюстной пазухой
К04.61 Имеющий сообщение [свищ] с носовой полостью
К04.62 Имеющий сообщение [свищ] с полостью рта
К04.63 Имеющий сообщение [свищ] с кожей
К04.69 Периапикальный абсцесс со свищом неуточнённый
К04.7 Периапикальный абсцесс без свища
-
Дентальный абсцесс
-
Дентоальвеолярный абсцесс
-
Периодонтальный абсцесс пульпарного происхождения
-
Периапикальный абсцесс без свища
К04. 8
Корневая киста
8
Корневая киста
К04.80 Апикальная и боковая
К04.81 Остаточная
К04.82 Воспалительная парадентальная
К04.89 Корневая киста неуточнённая
К04.9 Другие и неуточнённые болезни периапикальных тканей
Острый периодонтит — острое воспаление периодонта.
Этиология. Острые
гнойные периодонтиты развиваются под
действием смешанной флоры, где преобладают
стрептококки
(преимущественно негемолитический, а
также зеленящий и гемолитический),
иногда стафилококки
и пневмококки.
Возможны палочковидные формы
(грамположительные и грамотрицательные),
анаэробная инфекция, которая представлена
облигатно-анаэробной инфекцией,
неферментирующими грамотрицательными
бактериями, вейлонеллами, лактобактериями,
дрожжеподобными грибами. При нелеченых
формах верхушечных периодонтитов
микробные ассоциации насчитывают 3—7
видов. Крайне редко выделяют чистые
культуры. При
маргинальном периодонтите, помимо
перечисленных микробов, велико число
спирохет, актиномицетов, в том числе
пигментообразующих.
Патогенез. Острый
воспалительный процесс в периодонте
первично возникает
в результате проникновения инфекции
через отверстие в верхушке зуба, реже
— через патологический зубодесневой
карман. Поражение апикальной части
периодонта возможно при воспалительных
изменениях пульпы, ее омертвении, когда
обильная микрофлора канала зуба
распространяется в периодонт через
верхушечное отверстие корня. Иногда
гнилостное содержимое корневого канала
проталкивается в периодонт во время
жевания, под давлением пищи.
Крайне редко выделяют чистые
культуры. При
маргинальном периодонтите, помимо
перечисленных микробов, велико число
спирохет, актиномицетов, в том числе
пигментообразующих.
Патогенез. Острый
воспалительный процесс в периодонте
первично возникает
в результате проникновения инфекции
через отверстие в верхушке зуба, реже
— через патологический зубодесневой
карман. Поражение апикальной части
периодонта возможно при воспалительных
изменениях пульпы, ее омертвении, когда
обильная микрофлора канала зуба
распространяется в периодонт через
верхушечное отверстие корня. Иногда
гнилостное содержимое корневого канала
проталкивается в периодонт во время
жевания, под давлением пищи.
Маргинальный,
или краевой, периодонтит развивается
вследствие проникновения инфекции
через десневой карман при травме,
попадании на десну лекарственных
веществ, в том числе мышьяковистой
пасты. Проникшие в периодонтальную щель
микробы размножаются, образуют эндотоксины
и вызывают воспаление в тканях периодонта.
Большое значение в развитии первичного острого процесса в периодонте имеют некоторые местные особенности: отсутствие оттока из пульповой камеры и канала (наличие невскрытой камеры пульпы, пломбы), микротравма при активной жевательной нагрузке на зуб с пораженной пульпой.
Играют роль также общие причины: переохлаждение, перенесенные инфекции и др., но чаще всего первичное воздействие микробов и их токсинов компенсируется различными неспецифическими и специфическими реакциями тканей периодонта и организма в целом. Тогда острого инфекционно-воспалительного процесса не возникает. Повторное, иногда длительное воздействие микробов и их токсинов ведет к сенсибилизации, развиваются антителозависимые и клеточные реакции. Антителозависимые реакции развиваются вследствие иммунокомплексных и IgE обусловленных процессов. Клеточные реакции отражают аллергическую реакцию гиперчувствительности замедленного типа.
Механизм
иммунных реакций, с одной стороны,
обусловлен нарушением фагоцитоза,
системы комплемента и увеличением
полиморфно-ядерных лейкоцитов; с другой,
— размножением лимфоцитов и выделением
из них лимфокинов, вызывающих деструкцию
тканей периодонта и резорбцию близлежащей
кости.
В периодонте развиваются различные клеточные реакции: хронический фиброзный, гранулирующий или гранулематозный периодонтит. Нарушение защитных реакций и повторные воздействия микробов могут вызывать развитие острого воспалительного процесса в периодонте, который по своей сути является обострением хронического периодонтита. Клинически они нередко бывают первыми симптомами воспаления. Развитие выраженных сосудистых реакций в достаточно замкнутом пространстве периодонта, адекватная ответная защитная реакция организма, как правило, способствуют воспалению с нормергической воспалительной реакцией.
Компенсаторный
характер ответной реакции тканей
периодонта при первично-остром процессе
и обострении хронического ограничивается
развитием гнойника в периодонте. Он
может опорожняться через корневой
канал, десневой карман при вскрытии
околоверхушечного очага или удалении
зуба. В отдельных случаях при определенных
общих и местных патогенетических
условиях гнойный очаг является причиной
осложнений одонтогенной инфекции, когда
развиваются гнойные заболевания в
надкостнице, кости, околочелюстных
мягких тканях.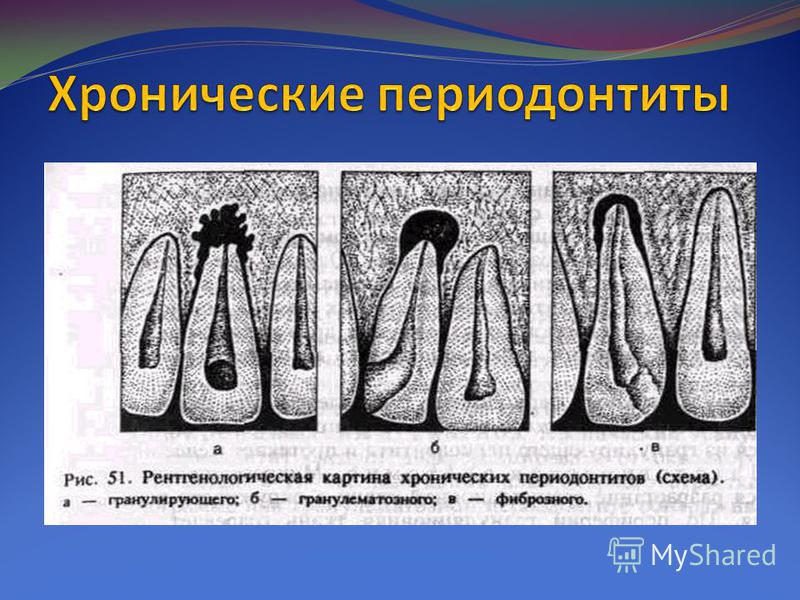
Патологическая анатомия. При остром процессе в периодонте появляются основные феномены воспаления — альтерация, экссудация и пролиферация.
Для острого периодонтита характерно развитие двух фаз — интоксикации и выраженного экссудативного процесса.
В
фазе интоксикации происходит миграция
различных клеток — макрофагов,
мононуклеаров, гранулоцитов и др. — в
зону скопления микробов. В фазе
экссудативного процесса нарастают
воспалительные явления, образуются
микроабсцессы, расплавляются ткани
периодонта и формируется ограниченный
гнойник. При микроскопическом исследовании
в начальной стадии острого периодонтита
можно видеть гиперемию, отек и небольшую
лейкоцитарную инфильтрацию участка
периодонта в окружности верхушки корня.
В этот период обнаруживают периваскулярные
лимфогистиоцитарные инфильтраты с
содержанием единичных полинуклеаров.
По мере дальнейшего нарастания
воспалительных явлений усиливается
лейкоцитарная инфильтрация, захватывая
более значительные участки периодонта. Образуются отдельные гнойные очажки —
микроабсцессы, расплавляются ткани
периодонта. Микроабсцессы соединяются
между собой, образуя гнойник. При удалении
зуба выявляют лишь отдельные сохранившиеся
участки резко гиперемированного
периодонта, а на остальном протяжении
корень бывает обнажен и покрыт гноем.
Образуются отдельные гнойные очажки —
микроабсцессы, расплавляются ткани
периодонта. Микроабсцессы соединяются
между собой, образуя гнойник. При удалении
зуба выявляют лишь отдельные сохранившиеся
участки резко гиперемированного
периодонта, а на остальном протяжении
корень бывает обнажен и покрыт гноем.
Острый
гнойный процесс в периодонте вызывает
изменения тканей, его окружающих (костная
ткань стенок альвеолы, периост
альвеолярного отростка, околочелюстные
мягкие ткани, ткани регионарных
лимфатических узлов). Прежде всего
изменяется костная ткань альвеолы. В
костномозговых пространствах, прилегающих
к периодонту и расположенных на
значительном протяжении, отмечают отек
костного мозга и в различной степени
выраженную, иногда диффузную, инфильтрацию
его нейтрофильными лейкоцитами. В
области кортикальной пластинки альвеолы
появляются лакуны, заполненные
остеокластами, с преобладанием
рассасывания (рис. 7.1, а). В стенках лунки
и преимущественно в области ее дна
наблюдают перестройку костной ткани. Преимущественное рассасывание кости
ведет к расширению отверстий в стенках
лунки и вскрытию костномозговых полостей
в сторону периодонта. Омертвения костных
балок нет (рис. 7.1, б). Таким образом,
нарушается ограничение периодонта от
кости альвеолы. В надкостнице, покрывающей
альвеолярный отросток, а иногда и тело
челюсти, в прилегающих мягких тканях —
десне, околочелюстных тканях — фиксируют
признаки реактивного воспаления в виде
гиперемии, отека, а воспалительные
изменения — также в лимфатическом узле
или 2—3 узлах соответственно пораженному
периодонту зуба. В них наблюдается
воспалительная инфильтрация. При остром
периодонтите фокус воспаления в виде
образования гнойника в основном
локализуется в периодонтальной щели.
Воспалительные изменения в кости
альвеолы и других тканях имеют реактивный,
перифокальный характер. И трактовать
реактивные воспалительные изменения,
особенно в прилежащей к пораженному
периодонту кости, как истинное ее
воспаление нельзя.
Преимущественное рассасывание кости
ведет к расширению отверстий в стенках
лунки и вскрытию костномозговых полостей
в сторону периодонта. Омертвения костных
балок нет (рис. 7.1, б). Таким образом,
нарушается ограничение периодонта от
кости альвеолы. В надкостнице, покрывающей
альвеолярный отросток, а иногда и тело
челюсти, в прилегающих мягких тканях —
десне, околочелюстных тканях — фиксируют
признаки реактивного воспаления в виде
гиперемии, отека, а воспалительные
изменения — также в лимфатическом узле
или 2—3 узлах соответственно пораженному
периодонту зуба. В них наблюдается
воспалительная инфильтрация. При остром
периодонтите фокус воспаления в виде
образования гнойника в основном
локализуется в периодонтальной щели.
Воспалительные изменения в кости
альвеолы и других тканях имеют реактивный,
перифокальный характер. И трактовать
реактивные воспалительные изменения,
особенно в прилежащей к пораженному
периодонту кости, как истинное ее
воспаление нельзя.
Клиническая
картина. При остром периодонтите больной указывает
на боль в причинном зубе, усиливающуюся
при надавливании на него, жевании, а
также при постукивании (перкуссии) по
жевательной или режущей его поверхности.
Характерно ощущение «вырастания»,
удлинения зуба. При длительном давлении
на зуб боль несколько стихает. В дальнейшем
болевые ощущения усиливаются, становятся
непрерывными или с короткими светлыми
промежутками. Нередко они пульсирующие.
При остром периодонтите больной указывает
на боль в причинном зубе, усиливающуюся
при надавливании на него, жевании, а
также при постукивании (перкуссии) по
жевательной или режущей его поверхности.
Характерно ощущение «вырастания»,
удлинения зуба. При длительном давлении
на зуб боль несколько стихает. В дальнейшем
болевые ощущения усиливаются, становятся
непрерывными или с короткими светлыми
промежутками. Нередко они пульсирующие.
Тепловое
воздействие, принятие больным
горизонтального положения, прикосновение
к зубу, а также накусывание усиливают
болевые ощущения. Боль распространяется
по ходу ветвей тройничного нерва. Общее
состояние больного удовлетворительное.
При внешнем осмотре изменений, как
правило, нет. Наблюдают увеличение и
болезненность связанных с пораженным
зубом лимфатического узла или узлов. У
отдельных больных может быть нерезко
выраженный коллатеральный отек соседних
с этим зубом околочелюстных мягких
тканей. Перкуссия его болезненна и в
вертикальном, и в горизонтальном
направлении.
Слизистая оболочка десны, альвеолярного отростка, а иногда и переходной складки в проекции корня зуба гиперемирована и отечна. Пальпация альвеолярного отростка по ходу корня, особенно соответственно отверстию верхушки зуба, болезненна. Иногда при надавливании инструментом на мягкие ткани преддверия рта по ходу корня и переходной складке остается вдавление, свидетельствующее об их отеке.
Диагностика
Температурные раздражители, данные
электроодонтометрии указывают на
отсутствие реакции пульпы вследствие
ее некроза. На рентгенограмме при остром
процессе патологических изменений в
периодонте можно не выявить или обнаружить
расширение периодонтальной щели,
нечеткость кортикальной пластики
альвеолы. При обострении хронического
процесса возникают изменения, характерные
для гранулирующего, гранулематозного,
редко фиброзного периодонтитов. Изменений
крови, как правило, нет, но у некоторых
больных возможны лейкоцитоз (до 9—109/л),
умеренный нейтрофилез за счет
палочкоядерных и сегментоядерных
лейкоцитов; СОЭ чаще в пределах нормы.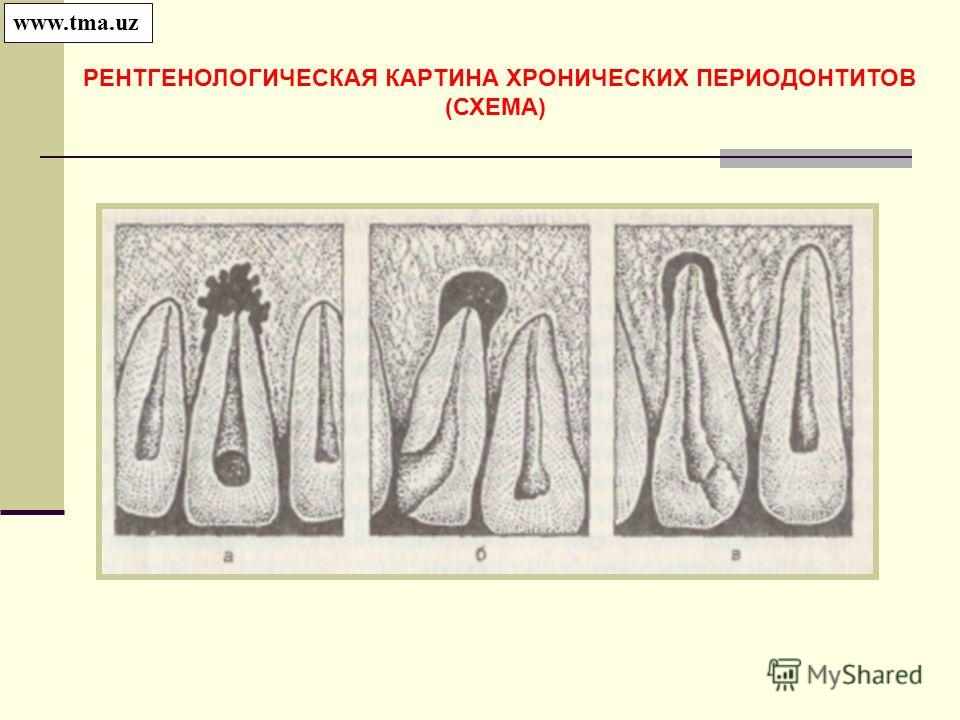
Дифференциальная диагностика. Острый периодонтит дифференцируют от острого пульпита, периостита, остеомиелита челюсти, нагноения корневой кисты, острого одонтогенного гайморита.
В отличие от пульпита при остром периодонтите боль бывает постоянной, при диффузном воспалении пульпы — приступообразной. При остром периодонтите в отличие от острого пульпита наблюдаются воспалительные изменения в прилежащей к зубу десне, перкуссия более болезненна. Кроме того, диагностике помогают данные электроодонтометрии.
Дифференциальная диагностика острого периодонтита и острого гнойного периостита челюсти основывается на более выраженных жалобах, лихорадочной реакции, наличии коллатерального воспалительного отека околочелюстных мягких тканей и разлитой инфильтрации по переходной складке челюсти с образованием поднадкостничного гнойника.
Перкуссия
зуба при периостите челюсти малоболезненна
в отличие от острого периодонтита. По
таким же, более выраженным общим и
местным симптомам проводят дифференциальную
диагностику острого периодонтита и
острого остеомиелита челюсти. Для
острого остеомиелита челюсти характерны
воспалительные изменения прилежащих
мягких тканей по обе стороны альвеолярного
отростка и тела челюсти. При остром
периодонтите перкуссия резко болезненна
в области одного зуба, при остеомиелите
— нескольких зубов. Причем зуб, явившийся
источником заболевания, реагирует на
перкуссию меньше, чем соседние интактные
зубы. Лабораторные данные — лейкоцитоз,
СОЭ и др. — позволяют различать эти
заболевания.
По
таким же, более выраженным общим и
местным симптомам проводят дифференциальную
диагностику острого периодонтита и
острого остеомиелита челюсти. Для
острого остеомиелита челюсти характерны
воспалительные изменения прилежащих
мягких тканей по обе стороны альвеолярного
отростка и тела челюсти. При остром
периодонтите перкуссия резко болезненна
в области одного зуба, при остеомиелите
— нескольких зубов. Причем зуб, явившийся
источником заболевания, реагирует на
перкуссию меньше, чем соседние интактные
зубы. Лабораторные данные — лейкоцитоз,
СОЭ и др. — позволяют различать эти
заболевания.
Гнойный периодонтит следует дифференцировать от нагноения околокорневой кисты. Наличие ограниченного выбухания альвеолярного отростка, иногда отсутствие в центре костной ткани, смещение зубов в отличие от острого периодонтита характеризуют нагноившуюся околокорневую кисту. На рентгенограмме при кисте обнаруживают участок резорбции кости округлой или овальной формы.
Острый
гнойный периодонтит необходимо
дифференцировать от острого одонтогенного
воспаления верхнечелюстной пазухи, при
котором боль может развиться в одном
или нескольких прилежащих к ней зубах. Однако заложенность соответствующей
половины носа, гнойные выделения из
носового хода, головная боль, общее
недомогание характерны для острого
воспаления верхнечелюстной пазухи.
Нарушение прозрачности верхнечелюстной
пазухи, выявляемое на рентгенограмме,
позволяет уточнить диагноз.
Однако заложенность соответствующей
половины носа, гнойные выделения из
носового хода, головная боль, общее
недомогание характерны для острого
воспаления верхнечелюстной пазухи.
Нарушение прозрачности верхнечелюстной
пазухи, выявляемое на рентгенограмме,
позволяет уточнить диагноз.
Лечение. Терапия острого верхушечного периодонтита или обострения хронического периодонтита направлена на прекращение воспалительного процесса в периодонте и предотвращение распространения гнойного экссудата в окружающие ткани — надкостницу, околочелюстные мягкие ткани, кость. Лечение преимущественно консервативное. Консервативное лечение более эффективно при инфильтрационном или проводниковом обезболивании 1—2 % растворами лидокаина, тримекаина, ультракаина.
Более
быстрому стиханию воспалительных
явлений способствует блокада — введение
по типу инфильтрационной анестезии
5—10 мл 0,25— 0,5 % раствора анестетика
(лидокаина, тримекаина, ультракаина) с
линкомицином в область преддверия рта
по ходу альвеолярного отростка
соответственно пораженному и 2—3 соседним
зубам. Противоотечное действие оказывает
введение по переходной складке
гомеопатического средства «Траумель»
в количестве 2 мл или наружных повязок
с мазью этого препарата.
Противоотечное действие оказывает
введение по переходной складке
гомеопатического средства «Траумель»
в количестве 2 мл или наружных повязок
с мазью этого препарата.
Необходимо
иметь в виду, что без оттока экссудата
из периодонта (через канал зуба) блокады
малоэффективны, часто безрезультатны.
Последнее можно сочетать с разрезом по
переходной складке до кости, с перфорацией
при помощи бора передней стенки кости
соответственно околоверхушечному
отделу корня. Это показано также при
безуспешной консервативной терапии и
нарастании воспалительных явлений,
когда не представляется возможным
удалить зуб в силу каких-то обстоятельств.
При
неэффективности лечебных мероприятий
и нарастании воспалительных явлений
зуб следует удалить.
Удаление зуба показано при значительном
его разрушении, непроходимости канала
или каналов, наличии инородных тел в
канале. Как правило, удаление зуба
приводит к быстрому стиханию и последующему
исчезновению воспалительных явлений.
Это можно сочетать с разрезом по
переходной складке до кости в области
корня зуба, пораженного острым
периодонтитом. После удаления
зуба при
первичном остром процессе не рекомендуется
кюретаж лунки, а следует только ее
промыть раствором диоксидина, хлоргекседина
и его производных, грамицидином. После
удаления зуба может усилиться боль,
повыситься температура тела, что часто
обусловлено травматичностью вмешательства.
Однако через 1—2 дня эти явления, особенно
при соответствующей противовоспалительной
лекарственной терапии, исчезают.
После удаления
зуба при
первичном остром процессе не рекомендуется
кюретаж лунки, а следует только ее
промыть раствором диоксидина, хлоргекседина
и его производных, грамицидином. После
удаления зуба может усилиться боль,
повыситься температура тела, что часто
обусловлено травматичностью вмешательства.
Однако через 1—2 дня эти явления, особенно
при соответствующей противовоспалительной
лекарственной терапии, исчезают.
Для
профилактики осложнений после удаления
зуба в зубную альвеолу можно ввести
антистафилококковую плазму, промыть
ее стрептококковым или стафилококковым
бактериофагом, ферментами, хлоргексидином,
грамицидином, оставить в устье йодоформный
тампон, губку с гентамицином. Общее
лечение острого или обострения
хронического периодонтита заключается
в назначении внутрь пиразолоновых
препаратов — анальгина, амидопирина
(по 0,25—0,5 г), фенацетина (по 0,25—0,5 г),
ацетилсалициловой кислоты (по 0,25—0,5
г). Эти препараты обладают обезболивающим,
противовоспалительным и десенсибилизирующим
свойством. Отдельным больным по показаниям
назначают сульфаниламидные препараты
(стрептоцид, сульфадимезин — по 0,5—1 г
каждые 4 ч или сульфадиметоксин,
сульфапиридазин — по 1—2 г в сутки).
Вместе с тем микрофлора, как правило,
бывает устойчива к сульфаниламидным
препаратам. В связи с этим целесообразнее
назначать 2—3 пирозолоновых лекарственных
препарата (ацетилсалициловой кислоты,
анальгина, амидопирина) по /4 таблетки
каждого, 3 раза в день. Такое сочетание
препаратов дает противовоспалительный,
десенсибилизирующий и обезболивающий
эффект. У ослабленных пациентов,
отягощенных другими заболеваниями,
особенно сердечно-сосудистой системы,
соединительной ткани, болезнями почек
проводят лечение антибиотиками —
эритромицином, канамицином, олететрином
(по 250 000 ЕД 4—6 раз в сутки), линкомицином,
индометацином, вольтареном (по 0,25 г) 3—4
раза в сутки. Зарубежные специалисты
после удаления зуба по поводу острого
процесса обязательно рекомендуют
лечение антибиотиками, считая такую
терапию также профилактикой эндокардита,
миокардита.
Отдельным больным по показаниям
назначают сульфаниламидные препараты
(стрептоцид, сульфадимезин — по 0,5—1 г
каждые 4 ч или сульфадиметоксин,
сульфапиридазин — по 1—2 г в сутки).
Вместе с тем микрофлора, как правило,
бывает устойчива к сульфаниламидным
препаратам. В связи с этим целесообразнее
назначать 2—3 пирозолоновых лекарственных
препарата (ацетилсалициловой кислоты,
анальгина, амидопирина) по /4 таблетки
каждого, 3 раза в день. Такое сочетание
препаратов дает противовоспалительный,
десенсибилизирующий и обезболивающий
эффект. У ослабленных пациентов,
отягощенных другими заболеваниями,
особенно сердечно-сосудистой системы,
соединительной ткани, болезнями почек
проводят лечение антибиотиками —
эритромицином, канамицином, олететрином
(по 250 000 ЕД 4—6 раз в сутки), линкомицином,
индометацином, вольтареном (по 0,25 г) 3—4
раза в сутки. Зарубежные специалисты
после удаления зуба по поводу острого
процесса обязательно рекомендуют
лечение антибиотиками, считая такую
терапию также профилактикой эндокардита,
миокардита.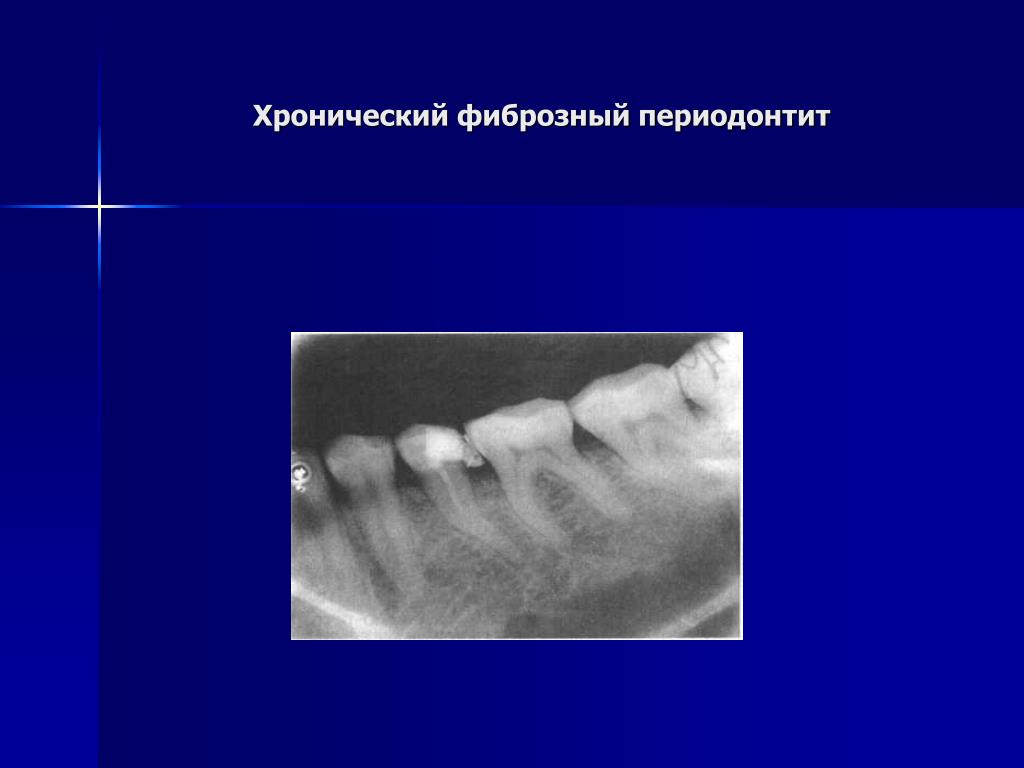 После удаления зуба при
остром периодонтите, чтобы приостановить
развитие воспалительных явлений,
целесообразно применять холод (пузырь
со льдом на область мягких тканей
соответственно зубу в течение 1—2—3 ч).
Далее назначают теплые полоскания,
соллюкс, а при стихании воспалительных
явлений — другие физические методы
лечения: УВЧ, флюктуоризацию, электрофорез
димедрола, кальция хлорида, протеолитических
ферментов, воздействие гелий-неонового
и инфракрасного лазера.
После удаления зуба при
остром периодонтите, чтобы приостановить
развитие воспалительных явлений,
целесообразно применять холод (пузырь
со льдом на область мягких тканей
соответственно зубу в течение 1—2—3 ч).
Далее назначают теплые полоскания,
соллюкс, а при стихании воспалительных
явлений — другие физические методы
лечения: УВЧ, флюктуоризацию, электрофорез
димедрола, кальция хлорида, протеолитических
ферментов, воздействие гелий-неонового
и инфракрасного лазера.
Исход. При
правильном и своевременном консервативном
лечении в большинстве случаев острого
и обострения хронического периодонтита
наступает выздоровление. (Недостаточное
лечение острого периодонтита ведет к
развитию хронического процесса в
периодонте.) Возможно распространение
воспалительного процесса из периодонта
на надкостницу, костную ткань,
околочелюстные мягкие ткани, т.е. могут
развиться острый периостит, остеомиелит
челюсти, абсцесс, флегмона, лимфаденит,
воспаление верхнечелюстной пазухи.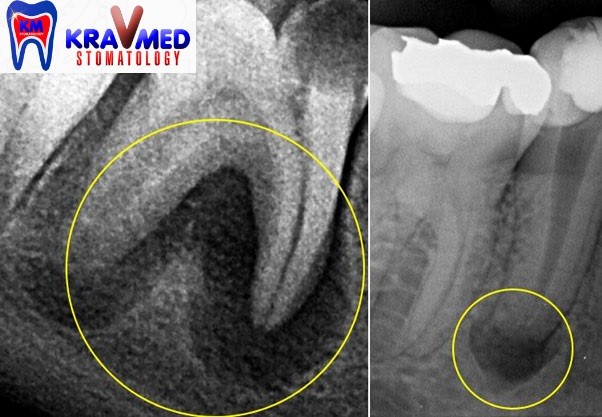
Профилактика основывается на санации полости рта, своевременном и правильном лечении патологических одонтогенных очагов, функциональной разгрузке зубов при помощи ортопедических методов лечения, а также на проведении гигиенических и оздоровительных мероприятий.
Лечение периодонтита
По данным antiplagiat.ru уникальность текста на 16.10.2018 г. – 99%.
Ключевые слова, теги: кариес, пульпит, разрушения костной ткани, киста, одонтогенная киста, флюс, снимок ОПТГ, зубосохраняющие операции, резекция верхушки корня зуба, цистэктомия, ампутация корня, стоматологического микроскоп, презервация, удаление зуба.
Существует множество различных заболеваний зубов, но, пожалуй, самым серьёзным среди них по степени наносимого ущерба является воспаление периодонта — периодонтит. Возникающий в подавляющем большинстве случаев как осложнение кариеса и/или пульпита, он представляет серьёзную угрозу, ведь под его воздействием разрушается не только зуб, но и окружающие его мягкие и твёрдые ткани, кроме того, оказывается негативное воздействие на иммунную систему. Данное заболевание требует незамедлительного медицинского вмешательства, которое, на сегодняшний день, располагает внушительным арсеналом очень действенных методик.
Данное заболевание требует незамедлительного медицинского вмешательства, которое, на сегодняшний день, располагает внушительным арсеналом очень действенных методик.
Историческая справка
Периодонтит, как понятие, ранее не существовало, но, конечно же, это заболевание беспокоило человечество, и его история исчисляется не одним тысячелетием. Так, в научной литературе очень долгое время идёт дискуссия по поводу методик лечения зубов в Древнем Египте. Основанием для дискуссий является ряд артефактов, который указывает на преобладание в зубоврачевании того времени методик консервативного лечения, а следов оперативного хирургического вмешательства при исследовании мумий фараонов не было выявлено1. В тоже самое время исследование мумий показало, что древние египтяне страдали тяжёлыми поражениями зубов и надкостницы, из чего можно сделать вывод, что у первых лиц Древнего Египта, наряду с другими заболеваниями зубов, «процветал» периодонтит. Египтолог М.А. Раффер писал, что на египетских кладбищах нередки находки больных зубов, почти выпавших из воспаленных лунок, или кариозных зубов, явившихся причиной обширных заболеваний челюстей, которых можно было бы избежать и/или вылечить путём проведения простейших операций 1.
В целом, существование этих стоматологических артефактов неумолимо свидетельствует о том, что такая патология зубочелюстной системы, как периодонтит, существует не один век. Но в те времена симптомы, по которым сегодня медицинская наука классифицирует и лечит данное заболевание, были симптомами просто «больного зуба».
Спустя более чем полтора века, в 1889 году, швейцарский механик, а в прошлом – опытный часовщик Август Майллефер, серьёзно увлекавшийся стоматологией, вместе с тремя своими сыновьями основал компанию, занимавшуюся созданием высокоточных механических инструментов и дал ей своё фамильное наименование –Maillefer. Свой богатый опыт работы с часовыми механизмами, отличающимися непревзойдённой «швейцарской» точностью, Майллефер применил для того, чтобы расширить возможности стоматологии.
Пожалуй, первым серьёзным трактатом, в котором были описаны около 130 стоматологических заболеваний, вызванными различными причинами, стал опубликованный в 1728 году труд «Дантист-хирург, или Трактат о зубах» П. Фошара. Он же стал и автором ряда новых пломбировочных материалов и стоматологических инструментов 2. Будто предчувствуя, какую роль в будущем будут играть эндодонтические инструменты, компания Maillefer первая в мире изобрела тримеры, пульпоэкстракторы, файлы – инструменты для работы в зубных каналах. C 1995 года эта компания вошла в концерн DENTSPLY, именуемый в последующем DENTSPLY IMPLANTS, а сегодня это – DENTSPLY SIRONA. И именно разработки компании Августа Майллефера стали «первыми ласточками» современного эндодонтического инструментария, без которого сегодня невозможно эффективное, результативное и надёжное лечение периодонтита.
Фошара. Он же стал и автором ряда новых пломбировочных материалов и стоматологических инструментов 2. Будто предчувствуя, какую роль в будущем будут играть эндодонтические инструменты, компания Maillefer первая в мире изобрела тримеры, пульпоэкстракторы, файлы – инструменты для работы в зубных каналах. C 1995 года эта компания вошла в концерн DENTSPLY, именуемый в последующем DENTSPLY IMPLANTS, а сегодня это – DENTSPLY SIRONA. И именно разработки компании Августа Майллефера стали «первыми ласточками» современного эндодонтического инструментария, без которого сегодня невозможно эффективное, результативное и надёжное лечение периодонтита.
Анатомия периодонта
Периодонт (с лат. perio – около, вокруг; odontos – зуб) – это комплекс тканей, окружающих зуб и удерживающих его в лунке. Он включает в себя десну, цемент зуба, альвеолярную кость, периодонтальную связку, которая находится между зубным корнем и альвеолярной пластинкой и осуществляет связь между альвеолярной костью и цементом корня зуба.
Периодонт состоит из множества кровеносных и лимфатических сосудов, нервных окончаний, периодонтальных волокон. Толщина волокон периодонта зависит от возраста и в среднем составляет 0,2 мм, с годами становясь тоньше. Связочный аппарат периодонта представлен группами (пучками) волокон, которые имеют разное направление, соединяя все участки периодонта в единую систему, протягиваясь между зубами, от цемента одного зуба к цементу другого. Основное вещество периодонта занимает около 60% и представляет из себя аморфную гелеобразную субстанцию, на 70% состоящую из воды. Большое количество основного вещества и воды в нём – факторы, играющие огромную роль в обеспечении амортизации. Характерной особенностью клеточной структуры периодонтальной ткани является способность к быстрому обновлению, но с возрастом этот процесс становится медленнее.Структурную целостность периодонта обеспечивает эмалевое прикрепление, клетки которого полностью обновляются в течение 4–8 дней. Эта способность к обновлению обеспечивает механическую защиту входа в маргинальную часть периодонта и снижает риск влияния на него негативных факторов. Периодонт осуществляет важнейшие функции. Пластическая – обеспечивает рост и развитие зубов благодаря деятельности остеобластов и цементобластов; трофическая – осуществляет питание цементной основы зуба и альвеолярной пластинки; опорно-удерживающая – обеспечивает фиксацию зуба в альвеоле; амортизационная – за счёт связочного аппарата распределяет жевательное давление; защитная – предотвращает попадание болезнетворных микроогранизмов и распространение воспалительных процессов 3.
Периодонт осуществляет важнейшие функции. Пластическая – обеспечивает рост и развитие зубов благодаря деятельности остеобластов и цементобластов; трофическая – осуществляет питание цементной основы зуба и альвеолярной пластинки; опорно-удерживающая – обеспечивает фиксацию зуба в альвеоле; амортизационная – за счёт связочного аппарата распределяет жевательное давление; защитная – предотвращает попадание болезнетворных микроогранизмов и распространение воспалительных процессов 3.
Периодонтит: определение, этиология, симптомы
Периодонтит– это заболевание, характеризующееся воспалением комплекса тканей, окружающих зуб и удерживающих его в лунке.
По этиологии различают несколько видов периодонтита. Инфекционный периодонтит является самым распространённым (90% всех случаев) и возникает вследствие раздражающего воздействия на периодонт инфекционно-токсического содержимого корневых каналов. Как правило, причиной этого является кариес или пульпит, в ряде случаев – некачественное лечение каналов.
Процесс развития заболевания начинается с попадания микробов в канал зуба, где они проходят естественный отбор в жесточайших условиях замкнутого анаэробного пространства. Самые сильные бактерии, выживая, формируют особый класс, который носит обобщающее название «одонтогенная микрофлора». Она отличается от стоматогенной микрофлоры полости рта уникальной живучестью и крайне агрессивным действием продуктов своей жизнедеятельности на окружающие ткани. Постепенно в апикальных и апиколатеральных зонах или, реже, в зоне бифуркации, начинается процесс разрушения костной ткани. Если в вышеуказанных областях есть элементы эпителия, они вовлекаются в одонтогенный воспалительный очаг и начинают расти, формируя гранулёму. Далее, гранулёма развивается и переходит в так называемую переходную стадию – кисто-гранулёму и далее «вырастает» в кисту. В зависимости от целого ряда факторов, таких как активность патогенной микрофлоры, сила иммунитета, особенности жевательной нагрузки, частота стрессовых состояний, условия жизни и другие – одонтогенная киста может быть источником постоянного дискомфорта либо совершенно не беспокоить пациента. «Бессимптомная» киста может вырастать до огромных размеров, вызывая множество патологий зубного ряда и даже деформацию челюсти в силу вовлечения в процесс своего роста большого количества зубов.
«Бессимптомная» киста может вырастать до огромных размеров, вызывая множество патологий зубного ряда и даже деформацию челюсти в силу вовлечения в процесс своего роста большого количества зубов.
Крайне редко встречаются случаи, когда инфекция попадает в периодонт с кровотоком или лимфотоком. В таких случаях заболевания называют ретроградным периодонтитом.
Травматический периодонтит является следствием травмы – бытовой или спортивной, когда пациент получает сильный ушиб, или ятрогенной, то есть вызванной действиями врача (например, случайная эндодонтическая травма, оставленный в канале кусочек от эндодонтического инструмента, пломбирование с выходом пломбировочного материала за верхушку корня, завышенная пломба или коронка, вызывающие постоянное микротравмирование). При острой травме развивается острый периодонтит, характеризующийся видимой травмой мягких тканей, кровоизлиянием, появлением подвижности зуба. При хронической травме изменения в периодонте происходят постепенно.
Медикаментозный, или токсический периодонтит является, чаще всего, осложнением лечения пульпита, когда лекарственные средства с содержанием мышьяка, гидрохлорида натрия, резорцин-формалиновые смеси, асептические растворы, некоторые материалы для пломбирования вызывают раздражение, некротизацию и воспаление периодонта. В некоторых случаях токсический периодонтит может быть вызван не лекарственными средствами, а продуктами распада пульпы, которая подверглась некротическому поражению вследствие некачественного пломбирования при кариесе.
Симптомы периодонтита могут отличаться в зависимости от стадии заболевания и области расположения очага воспаления. Так, возникает пульсирующая, постоянно нарастающая локализованная боль при накусывании, смыкании зубов и даже при их касании. Приём пищи и жидкостей зачастую становится затруднительным и иногда может сопровождаться повышением температуры. Часто пациенты отмечают, что зуб по ощущениям «вырос», возникает чувство распирания. Также к симптомам можно отнести отёк десны, флюс, свищ. В то же самое время периодонтит на различных его стадиях может протекать бессимптомно или сопровождаться некоторым дискомфортом в области больного зуба.
Также к симптомам можно отнести отёк десны, флюс, свищ. В то же самое время периодонтит на различных его стадиях может протекать бессимптомно или сопровождаться некоторым дискомфортом в области больного зуба.
Виды периодонтита по клинической картине заболевания
Периодонтит – сложное, серьёзное заболевание, которое медицинская наука тщательно изучала несколько десятилетий. В процессе поиска эффективных способов его лечения разрабатывались различные видовые классификации, которые позволили распознавать и лечить периодонтит в самых разнообразных его проявлениях. На сегодняшний день наиболее авторитетной является принятая ВОЗ Международная классификация болезней МКБ-10, где периодонтит находится в разделе К04 – болезни пульпы и периапикальных тканей. Но, по мнению стоматологов, более детальное описание всех стадий периодонтита представлено в Международной классификации стоматологических болезней МКБ-С-3 на основе МКБ-10, но имеющей некоторые различия с принятой Классификацией. Так, согласно данным классификациям, выделяют несколько видов периодонтита:
Так, согласно данным классификациям, выделяют несколько видов периодонтита:
К04.4 Острый апикальный периодонтит пульпарного происхождения Острый апикальный периодонтит БДУ*. Это «классический» вид заболевания с чётко обозначенными этиологией и клиническими симптомами: отёк, инфильтрация тканей, воспаление, которое бывает серозным — данная стадия длится 1-2 дня, характерна постоянной болью, особенно при давлении на зуб; серозно-гнойным — продолжительность около 2-х недель, наблюдается отёк мягких тканей, гиперемированная слизистая, подвижность зуба; гнойно-некротическим с формированием абсцесса.
К04.5 Хронический апикальный периодонтит (Апикальная или периапикальная гранулёма. Апикальный периодонтит БДУ*.
Данный этап болезни является исходом острой стадии и означает, что очаг инфекции присутствует уже долгое время – от нескольких недель до нескольких месяцев. На этом этапе пациент почти не чувствует боли. В полости зуба в области верхушки корня наблюдается грануляционное разрастание ткани. При благоприятных условиях эта ткань капсулируется, образуя гранулёму, которая может быть стерильной или инфицированной. Она не соединена с альвеолой, но своими волокнами переходит непосредственно в периодонт, вызывая избыточное образование цемента на верхушке корня или, напротив, способствуя резорбции кости. Склерозирование образования и исчезновение очага воспаления считается благоприятным исходом, который становится возможным вследствие качественного лечения и пломбирования каналов. Неблагоприятный исход в случае отсутствия лечения – осложнение в виде подкожной одонтогенной гранулёмы.
При благоприятных условиях эта ткань капсулируется, образуя гранулёму, которая может быть стерильной или инфицированной. Она не соединена с альвеолой, но своими волокнами переходит непосредственно в периодонт, вызывая избыточное образование цемента на верхушке корня или, напротив, способствуя резорбции кости. Склерозирование образования и исчезновение очага воспаления считается благоприятным исходом, который становится возможным вследствие качественного лечения и пломбирования каналов. Неблагоприятный исход в случае отсутствия лечения – осложнение в виде подкожной одонтогенной гранулёмы.
К04.6 Периапикальный абсцесс с полостью Зубной (дентальный) абсцесс с полостью. Дентоальвеолярный абсцесс с полостью. Ранее данному коду соответствовал Периапикальный абсцесс со свищом, который подразделялся на:
К04.60 Свищ, имеющий сообщение с верхнечелюстной пазухой.
К04.61 Свищ, имеющий сообщение с носовой полостью.
К04. 62 Свищ, имеющий сообщение с полостью рта.
62 Свищ, имеющий сообщение с полостью рта.
К04.63 Свищ, имеющий сообщение с кожей.
К04.69 Периапикальный абсцесс со свищом неуточнённый.
Эта стадия периодонтита характерна отсутствием боли, так как происходит отток инфекционно-токсического содержимого (экссудата) из области периодонта в корневой канал зуба, а затем – в полость рта. Другим вариантом может быть проникновение гнойного содержимого через свищевое отверстие в ротовую полость, гайморову пазуху, носовую полость, кожу. Грануляционная ткань разрастается, заполняет свищевой ход 4.
К04.7 Периапикальный абсцесс без полости Зубной (дентальный) абсцесс БДУ. Дентоальвеолярный абсцесс БДУ. Периапикальный абсцесс БДУ. Этому коду в МКБ-С-3 соответствует Периапикальный абсцесс без свища, который характеризовался тем, что отсутствие свища увеличивало количество экссудативного содержимого в области периодонта, из-за чего появлялась сильная боль, увеличивался отёк и в конце концов образовывался абсцесс 5.
К04.9 Другие и неуточненные болезни пульпы и периапикальных тканей 6.
Методы лечения периодонтита
Современные методики лечения периодонтита можно разделить на две большие группы – консервативные и оперативные (хирургические). Все методы следуют одним и тем же целям: устранение источника инфицирования, то есть ликвидация воспаления в периапикальной области, исключение патогенного влияния на организм одонтогенного воспалительного очага, регенерация структуры тканей периодонта, сохранение и/или восстановление функций зуба. В каждом случае метод выбирается индивидуально и только на основе тщательной диагностики, включающей в себя осмотр полости рта, снимок ОПТГ, КТ и прицельные рентгеновские снимки.
Консервативные методы подразделяются на терапевтические и физиотерапевтические. В целом они результативны в большинстве случаев. Трудности, которые могут возникать в процессе консервативного лечения, связаны с длительностью процессов регенерации очага деструкции в периапикальной области, а также с анатомическими особенностями и без того сложного строения канальной системы зуба.
Терапевтическое лечение периодонтита – это комплекс эндодонтических мероприятий, включающий в себя: препарирование больного зуба, расширение каналов до конической формы для удобства работы в них, чистку каналов от распавшейся корневой пульпы и стенок канала от слоя (слоёв) инфицированного дентина, терапию с применением антисептических и антибиотических препаратов для уничтожения патогенной микрофлоры, пломбирование. Если лечение требует смены лекарственного средства в каналах, сначала устанавливают временную пломбу и только после окончания лечения проводят пломбирование каналов и зуба в целом. Пломбирование должно обеспечить полную герметизацию канала и его ответвлений. После пломбирования врач может назначить медикаментозную терапию, направленную на стимулирование процесса регенерации. Во многих случаях эта терапия сочетается с физиотерапевтическими процедурами.
Физиотерапевтическое лечение в большинстве случаев комбинируется с эндодонтическим или дополняет его. Оно включает в себя процедуры УВЧ, внутриканального электрофареза, лазеро-или магнитотерапии и озонотерапию. Эти дополнительные методы лечения определяются и назначаются лечащим врачом,согласно клинической картине и общему соматическому состоянию пациента.
Оно включает в себя процедуры УВЧ, внутриканального электрофареза, лазеро-или магнитотерапии и озонотерапию. Эти дополнительные методы лечения определяются и назначаются лечащим врачом,согласно клинической картине и общему соматическому состоянию пациента.
Оперативные методы лечения периодонтита используются только в том случае, если консервативное лечение оказалось неэффективным, недостаточно эффективным или по клиническим причинам невозможным. В большинстве случаев применяют зубосохраняющие операции, то есть хирургические вмешательства, позволяющие устранить причину болезни, но сохранить зуб как единицу зубного ряда. К таким операциям относится резекция верхушки корня зуба, показанная при наличии гранулёмы или кисты, во время которой инфицированные и видоизменённые ткани удаляются вместе с частичным отсечением корня зуба. С этой же целью может быть применена цистэктомия или метод PARCH-2 – оперативное вмешательство, предусматривающее полное удаление кисты с иссечением (в большинстве случаев) верхушки корня, содержащего инфицированные апикальные дельты.
Для того, чтобы герметично «запечатать» каналы, после резекции верхушки применяют метод ретроградного пломбирования.
Операция ампутация корня позволяет, удалив один из поражённых заболеванием корень зуба, сохранить зуб на месте с сохранением его коронковой части, а гемисекция предполагает удаление одного из корней вместе с прилегающей коронковой частью, если второй корень целиком не подвергся патологическим изменениям.
Для того, чтобы лечение периодонтита было максимально эффективным, все его этапы, вне зависимости от применяемого метода лечения, проводятся с использованием самых современных стоматологических инструментов, препаратов и обязательно с использованием стоматологического микроскопа. Но, редко, в сильно запущенных случаях периодонтита, когда все другие методики бессильны, проводится операция по удалению зуба максимально щадяще с минимальным травматическим воздействием на мягкие ткани. После удаления зуба обязательно проводится заполнение образовавшейся полости костно-пластическими материалами – презервация.
Лечение периодонтита и перелечивание каналов зуба
Особое внимание стоит уделить лечению периодонтита с уже обтурированными каналами зубов, то есть зубов, каналы которых ранее уже были подвергнуты эндодонтическому лечению. «Перелечивание» таких каналов – процесс крайне трудоёмкий и требующий большого количества времени. Главная сложность заключается в том, что очистить канал от пломбировочного материала в разы сложнее, чем провести первичную очистку одонтогенной микрофлоры и удаление пульпы (зубного нерва) с последующей санацией.
При распломбировании каналов врач-стоматолог вынужден ориентироваться не на анатомию канала, а на материал, которым он был заполнен при пломбировании. Такая «работа вслепую» предполагает высочайшую квалификацию и богатый практический опыт лечащего доктора. Для удаления обтурационных материалов из корневого канала, например, гуттаперчи, в случаях перелечивания используется механический, химический методы и их сочетание. Механический метод предполагает работу в зубных каналах инструментами – файлами и про-файлами, а химический – растворение твердых тканей реагентами.
До настоящего времени не разработан четкий алгоритм повторного эндодонтического лечения при работе файлами и растворителями в зависимости от проведения манипуляций в апикальной, средней и устьевой частях корневого канала 7. Следующим сложным этапом после очистки от пломбировочных материалов при лечении периодонтита с ранее обтурированными каналами зуба является санация каналов.
Этот этап играет главенствующую роль, поскольку для того, чтобы существенно снизить вероятность возникновения рецидива воспалительного процесса, необходимо тщательным образом провести обработку. В этой связи врач-стоматолог зачастую на данном приёме проводит закладывание антисептических лекарственных препаратов в канал на некоторое время. Коронковая часть зуба закрывается на этот период временной пломбой. По истечении установленного врачом временного интервала проводится дальнейшее лечение – герметичное пломбирование каналов зуба и установка постоянной пломбы.
В случаях, когда при сохранённой целостности корня коронковая часть зуба сильно разрушена и требуется последующее протезирование, после санации и перед пломбированием в канал внедряется анкерный или стекловолоконный штифт. Затем, после пломбирования, наращивается искусственная культя из композитных материалов, и только после этого начинается процесс создания и установки стоматологической реставрации. В виду указанных сложностей даже ювелирная точность и высокий квалификационный уровень врача не может гарантировать 100% успех в распломбировании, последующей санации и полной герметичности при новой обтурации таких каналов зуба. Это объясняется тем, что мелкие ответвления канала, особенно боковые дельты, могут быть недоступны или малодоступны для прохождения даже самыми современными и ультратонкими эндодонтическими инструментами.
Затем, после пломбирования, наращивается искусственная культя из композитных материалов, и только после этого начинается процесс создания и установки стоматологической реставрации. В виду указанных сложностей даже ювелирная точность и высокий квалификационный уровень врача не может гарантировать 100% успех в распломбировании, последующей санации и полной герметичности при новой обтурации таких каналов зуба. Это объясняется тем, что мелкие ответвления канала, особенно боковые дельты, могут быть недоступны или малодоступны для прохождения даже самыми современными и ультратонкими эндодонтическими инструментами.
Для достижения наилучших результатов при лечении ранее обтурированных каналов зубов на каждом из этапов делаются контрольные прицельные снимки. Это позволяет врачу-стоматологу избежать интенсивной инструментально-механической обработки и всецело очистить канал от микробных загрязнений и пр. Соблюдение этого баланса — одна из основных задач врача, так как, не достигнув равновесия на данном этапе, всё это может повлечь за собой такие осложнения как перфорация стенки корня зуба, снижение механической стойкости зуба, рецидив периапикальных воспалительных процессов и, рано или поздно, приведёт к потере зуба. Поэтому цель и главная задача стоматолога – обеспечить клинический и рентгенологический успех эндодонтического лечения.
Поэтому цель и главная задача стоматолога – обеспечить клинический и рентгенологический успех эндодонтического лечения.
Эффективное лечение периодонтита зубов является важной и актуальной проблемой современной практической стоматологии. Необходимость решения сложных задач приводит к разработке и внедрению в практику клиницистов новых подходов к механической обработке корневых каналов, новых протоколов ирригации, новых технологий пломбирования каналов, новых принципов постэндодонтического восстановления зубов, требует создания новых инструментов и аппаратов, медикаментов и пломбировочных материалов. Сегодня залогом успеха эндодонтического лечения является трёхмерная очистка и обтурация всей системы корневых каналов с запечатыванием всех ответвлений каналов апикальной дельты, в том числе и просвета дентинных канальцев.
Осложнения
Периодонтит опасен быстро развивающимися грозными осложнениями, поэтому крайне важно при первых же симптомах незамедлительно обратиться к стоматологу. Начальная форма острого периодонтита очень быстро, в течение нескольких дней, переходит в гнойную форму, а затем в абсцесс. На стадии хронического периодонтита образуются свищевые ходы, которые доставляют страдания пациенту и существенно увеличивают период лечения.
Начальная форма острого периодонтита очень быстро, в течение нескольких дней, переходит в гнойную форму, а затем в абсцесс. На стадии хронического периодонтита образуются свищевые ходы, которые доставляют страдания пациенту и существенно увеличивают период лечения.
Кроме того, нельзя забывать, что периодонтит разрушает окружающие зуб костные ткани, а также представляет из себя хронический одонтогенный воспалительный очаг, поэтому существенно снижает иммунный статус пациента, способствует осложнению течения различных соматических заболеваний. Кроме того, шведские учёные из Университета Оребро недавно обнаружили и доказали влияние периодонтита на сердечно-сосудистую систему. Причина этого влияния – в деятельности бактерии Porphyromonasgingivalis, являющейся распространённым возбудителем периодонтита. Данная бактерия нарушает работу гена, отвечающего за контроль воспаления в коронарных артериях, способствуя возникновению атеросклероза и инфарктов 8.
Критерий качества лечения
Качественное, результативное лечение периодонтита подразумевает ювелирную точность при работе в каналах зуба, имеющих сложную форму и индивидуальные анатомические особенности. Обтурация (пломбирование) каналов основывается на принципе «трёх китов»: канал должен быть запломбирован на всю длину, по всем микроответвлениям, без пор и воздушных полостей.Для этого необходимы высокая квалификация и большой опыт лечащего врача, а также использование современного оборудования – эндомоторов, апекслокаторов, файлов, стоматологического микроскопа.
Обтурация (пломбирование) каналов основывается на принципе «трёх китов»: канал должен быть запломбирован на всю длину, по всем микроответвлениям, без пор и воздушных полостей.Для этого необходимы высокая квалификация и большой опыт лечащего врача, а также использование современного оборудования – эндомоторов, апекслокаторов, файлов, стоматологического микроскопа.
Современное эндодонтическое лечение является высокотехнологичной медицинской процедурой и основывается на новых медицинских, технологических и эргономических принципах, что обязывает клиники быть укомплектованными современным оборудованием, а докторов — регулярно повышать свой уровень профессиональной компетентности.
Показания
Показаниями для использования консервативных методов лечения считаются все виды периодонтита при условии хорошей проходимости каналов, но зачастую такие методы для наибольшей эффективности лечения дополняются хирургическими методиками. Чаще всего к ним прибегают в случаях, когда обнаружены кистозные или гранулёматозные образования, непроходимость каналов, каналы имеют предельно сложное строение, на «перелечиваемых» зубах — когда каналы запломбированы старыми цементными пломбами и их невозможно извлечь. Кроме того, хирургические методы применяют, если в каналах обнаружены обломки эндодонтических инструментов, а также в случаях, когда восстановление коронковой части зуба до полной его функциональности предполагает создание многоступенчатой, многозвеньевой конструкции, вызывающей высокие сомнения в эффективности и функциональности.
Кроме того, хирургические методы применяют, если в каналах обнаружены обломки эндодонтических инструментов, а также в случаях, когда восстановление коронковой части зуба до полной его функциональности предполагает создание многоступенчатой, многозвеньевой конструкции, вызывающей высокие сомнения в эффективности и функциональности.
Удаление зуба при периодонтите показано в случаях, если зуб сильно разрушен и его восстановление невозможно, при неэффективности методик и препаратов для снятия болевого симптома, при наличии гнойного воспалительного очага, устранение которого дренированием представляется невозможным.
Окончательное решение по выбору методики и способа лечения периодонтита в каждом конкретном случае осуществляется лечащим врачом, с учётом всех особенностей клинической картины заболевания и на основании его опыта, квалификации, предпочтений, а также возможностей клиники. Ведь, в конечном счёте, ответственность за оказание медицинской услуги несёт именно врач.
Противопоказания
На сегодняшний день не существует абсолютных противопоказаний к лечению периодонтита. При сахарном диабете в стадии декомпенсации, при активной фазе инфекционных заболеваний, при прохождении курса химиотерапии, при обострении сердечно-сосудистых и психических заболеваний лечение осуществляется при применении дополнительных мер предосторожности или откладывается до возникновения улучшения в состоянии пациента, но не отменяется.
При сахарном диабете в стадии декомпенсации, при активной фазе инфекционных заболеваний, при прохождении курса химиотерапии, при обострении сердечно-сосудистых и психических заболеваний лечение осуществляется при применении дополнительных мер предосторожности или откладывается до возникновения улучшения в состоянии пациента, но не отменяется.
Возрастные ограничения
Периодонтит может возникнуть у человека любого возраста, и возрастных ограничений к его лечению не существует. С особой осторожностью проводится лечение беременных женщин, так как, с одной стороны, периодонтит – это опасный источник инфекции, снижающей иммунитет и способной угрожать адекватному течению беременности, а с другой стороны, развитию плода могут угрожать и высокоэффективные лекарства, отличающиеся сильным действием. Поэтому лечение периодонтита в период беременности, а также лактации проводится с помощью максимально щадящих методик и препаратов. Но чтобы не допустить таких ситуаций, необходимо проводить плановое наблюдение, санацию и диспансеризацию в любом возрасте и уж тем более в периоды планирования беременности, а также – дородовый период.
Стоимость
Стоимость лечения периодонтита всегда строго индивидуальна и складывается из совокупности факторов. К ним относится диагностика на начальном и промежуточных этапах лечения, поставленный диагноз и принятый на его основе алгоритм лечебных мероприятий, количество посещений, используемые в лечении препараты, оборудование и технологии, работа узких специалистов в случае необходимости их привлечения, уровень квалификации врача.
Периодонтит – очень серьёзное заболевание зубов и зубочелюстной системы в целом. Несвоевременное обращение к врачу и попытки самолечения могут привести к грозным осложнениям, в том числе таким, которые могут угрожать вашей жизни. При первом же появлении симптомов необходимо срочно посетить стоматологическую клинику! Будьте готовы к длительному лечению, предусматривающему неоднократное посещение врача, так как лечение периодонтита состоит из нескольких этапов, каждый из которых не может быть начат без диагностически доказанной результативности предыдущего. Только такой подход к лечению в сочетании с профессионализмом врача и строгим, бдительным отношением пациента ко всем назначениям и рекомендациям является гарантией качественно проведённого лечения и надёжной защитой от рецидива на несколько лет.
Только такой подход к лечению в сочетании с профессионализмом врача и строгим, бдительным отношением пациента ко всем назначениям и рекомендациям является гарантией качественно проведённого лечения и надёжной защитой от рецидива на несколько лет.
По данным antiplagiat.ru уникальность текста на 16.10.2018 г. – 99%.
Ключевые слова, теги: кариес, пульпит, разрушения костной ткани, киста, одонтогенная киста, флюс, снимок ОПТГ, зубосохраняющие операции, резекция верхушки корня зуба, цистэктомия, ампутация корня, стоматологического микроскоп, презервация, удаление зуба.
1 И. Зимин «Из истории зубоврачевания».
2 «Зубы и зубоврачевание. Очерки истории» / К.А. Пашков. – М. : Ве че, 2014. – 240 с.: ил.
3 Бритова, А. А.Эндодонтия. Болезни пульпы зуба и периапикальных тканей: учеб. пособие, 3-е изд., испр. и доп. / А. А. Бритова; НовГУ им. Ярослава Мудрого. – Великий Новгород, 2016. – 171 с.
– 171 с.
4 http://elestom.ru/recommends МЕЖДУНАРОДНАЯ КЛАССИФИКАЦИЯ СТОМАТОЛОГИЧЕСКИХ БОЛЕЗНЕЙ МКБ-С-3 НА ОСНОВЕ МКБ-10.
5 http://elestom.ru/recommends МЕЖДУНАРОДНАЯ КЛАССИФИКАЦИЯ СТОМАТОЛОГИЧЕСКИХ БОЛЕЗНЕЙ МКБ-С-3 НА ОСНОВЕ МКБ-10.
6 http://mkb-10.com
7 Клещенко А. В. Совершенствование методики распломбирования корневых каналов зубов, обтурированных гуттаперчей: Диссертация кандидата медицинских наук: 14.01.14 / Клещенко Александр Викторович; (Место защиты: ГОУВПО «Московский государственный медико-стоматологический университет»). — Москва, 2011 — 93 с.
8 Доклад Американского общества микробиологов на основе работы. Автор: Тобьорн Бенгтсон, представленной факультетом клинической медицины Школы наук о здравоохранении при Университете Эребру, Швеция.
* БДУ представляют собой аббревиатуру словосочетания «без дополнительных уточнений», означающего «неуточненный» или «неустановленный».
Хронический периодонтит | Стоматология Митино
Виды хронического периодонтита
Хронический периодонтит по локализации процесса делится на 2 вида: апикальный (верхушечный), когда воспалительный процесс располагается на верхушке корня, и маргинальный (краевой), при котором воспаление развивается по краю зуба у десны. По течению хронический периодонтит подразделяется на следующие виды:
По течению хронический периодонтит подразделяется на следующие виды:
-
Хронический гранулирующий периодонтит – возникает вследствие замещения кости молодой соединительной ткани (грануляционная ткань) на верхушечной части корня. В результате этого происходит разрушение кости в области воспалительного очага. При частых обострениях заболевания поражение кости захватывает все новые участки, что может привести к образованию свищевого хода.
-
Хронический гранулематозный периодонтит – обычно развивается из гранулирующего периодонтита. Дальнейшее разрастание грануляционной ткани в околоверхушечной области ведет к формированию гранулемы с плотной капсулой. Гранулема имеет вид округлого “мешочка” с гнойным содержимым диаметром менее 0,5 см. При дальнейшем развитии она вызывает разрушение кости и переходит в кистогранулему диаметром 0,5-1 см. По мере роста она переходит в кисту, размеры которой могут превышать 1 см.

-
Хронический фиброзный периодонтит – может возникать самопроизвольно или в результате лечения гранулирующей или гранулематозной формы. При этом происходит рубцевание воспалительного очага, в результате которого ткани периодонта замещаются грубой соединительной тканью.
Сегодня принято руководствоваться наиболее распространенной классификацией медицинских диагнозов – МКБ-10, предложенной Всемирной организацией здравоохранения. МКБ-10 учитывает форму протекания болезни и наиболее частые осложнения:
К04.5 Хронический апикальный периодонтит.
К04.6 Периапикальный абсцесс с полостью.
К04.5 Периапикальный абсцесс без полости.
К04.5 Корневая киста.
К04.5 Другие и неуточненные болезни пульпы и периапикальных тканей.
Позвоните прямо сейчас
+7 (495) 186-01-41
Записаться
Причины хронического периодонтита
Хронический периодонтит зуба развивается в результате воздействия факторов инфекционной и неинфекционной природы.
К инфекционным причинам относится распространение микроорганизмов в околозубные ткани из хронических воспалительных очагов. К развитию болезни приводит кариес, воспалительный процесс на деснах, в носовых пазухах, небных миндалинах.
Причиной развития инфекционных периодонтитов являются микроорганизмы, обитающие в ротовой полости. Чаще всего встречаются стрептококки, стафилококки и другие микробы.
К неинфекционным факторам относятся:
-
травматические – развиваются вследствие удара зуба, накусывания твердого предмета (косточки) при пережевывании, повреждения стоматологическим инструментом, травмирования неправильно установленными коронками или избыточным количеством пломбы;
-
токсические – являются результатом влияния на околозубные ткани продуктов разложения из инфицированной пульпы;
-
медикаментозные – связаны с попаданием сильнодействующих лекарственных средств из канала корня в периодонт при неверной тактике лечения;
-
аллергические – возникают в ответ на местные анестетики, антибиотики и другие лекарственные средства, применяемые в концентрациях, которые обычно не оказывают вредного влияния на окружающие зуб ткани.

Симптомы хронического периодонтита
Проявления заболевания многообразны:
-
Хронический гранулирующий периодонтит – имеет наиболее активное течение. Чаще больные жалуются на ноющую боль при употреблении твердой и горячей еды, при жевании. Наблюдается покраснение и отек десны. Во время обострения в области больного зуба на слизистой оболочке может образоваться свищ с гнойным отделяемым, иногда с примесью крови. При затухании воспаления заживление свища происходит с формированием рубца.
-
Хронический гранулематозный периодонтит – сначала долгое время протекает бессимптомно. По мере развития процесса возникает болезненность, изменяется цвет эмали, появляется покраснение и отек слизистой, может развиться флюс (периостит – воспаление надкостницы челюсти). Значительное увеличение диаметра кисты иногда приводит к перелому челюстной кости.
-
Хронический фиброзный периодонтит – симптомы выражены слабо.
 Болей может не быть. Течение этой формы более благоприятное. При обострении воспаления появляется болезненность при жевании, отек, зуб становится подвижным, лимфоузлы увеличены и болезненны, могут наблюдаться признаки интоксикации.
Болей может не быть. Течение этой формы более благоприятное. При обострении воспаления появляется болезненность при жевании, отек, зуб становится подвижным, лимфоузлы увеличены и болезненны, могут наблюдаться признаки интоксикации.
Клинические проявления хронического периодонтита обычно отсутствуют и обнаруживаются только во время рентгенологического исследования или возникают при обострении заболевания. При этом появляется резкая болезненность и отек в области зуба, может сформироваться свищ, увеличиваются лимфатические узлы, повышается температура тела.
У детей хронический фиброзный и хронический гранулематозный периодонтит почти не встречается. Наиболее частой формой у них является хронический гранулирующий периодонтит, который протекает бессимптомно. При осмотре врача выявляется подвижность зуба, изменение его цвета, болезненность при надавливании, может наблюдаться глубокий кариес, свищ. Характерным является быстрое развитие воспалительного процесса, который может переходить на корни соседних зубов или зачаток постоянного зуба, что оказывает отрицательное влияние на формирующийся постоянный зуб.
Важно! Отсутствие лечения хронического периодонтита приводит к дальнейшему развитию гнойного воспаления надкостницы и челюстных костей, пазух носа, жировой клетчатки. Особенно опасны очаговое гнойное воспаление головного мозга и его оболочек, сепсис.
Диагностика хронического периодонтита
Для постановки диагноза врач проводит анализ жалоб пациента, выявляет причину возникновения патологии, осматривает полость рта, определяет наличие чувствительности при постукивании больного зуба, ощупывает прилежащие ткани, определяет степень его подвижности, устанавливает наличие кариеса.
Подтверждается диагноз рентгенологическими методами, которые позволяют увидеть измененные участки зуба, наличие кариозного дефекта. Такими методами являются:
-
радиовизиография – современный метод диагностики, выполняемый с использованием компьютерной аппаратуры, обладает высокой точностью и оказывает низкую лучевую нагрузку;
-
фистулография – применяется для исследования свищевых ходов, в которые вводится рентгеноконтрастное вещество.

Так как хронический периодонтит может являться следствием пульпита, в качестве дополнительных методов исследования используется электроодонтометрия, которая позволяет оценить состояние пульпы.
Лечение хронического периодонтита
Если вовремя обратиться к стоматологу, можно сохранить зуб, а также предотвратить переход воспалительного процесса на близлежащие ткани. Основным принципом лечения является устранение причины, повлекшей развитие воспаления:
-
при травматическом периодонтите удаляется пломба, коронка или другое инородное тело, травмирующее ткани;
-
при медикаментозном – удаляется лекарственный препарат, если он вызвал воспаление;
-
при инфекционном – иссекаются все омертвевшие ткани.
Способы лечения хронических форм периодонтита бывают консервативными и хирургическими. Консервативное лечение направлено на поэтапное снятие воспаления и активизацию заживления и восстановления тканей в верхней части корня.
Консервативное лечение направлено на поэтапное снятие воспаления и активизацию заживления и восстановления тканей в верхней части корня.
-
Под местной анестезией полость зуба вскрывается, удаляются все отмершие ткани, обработанная полость промывается антисептиком. Затем в виде лечебной повязки вводятся лекарственные средства, которые оказывают противовоспалительное и антибактериальное действие, а также препараты, стимулирующие формирование костной ткани. После этого полость герметично закрывается временной пломбой. При необходимости врач назначает антибактериальную терапию. При возникновении болей применяются обезболивающие средства.
-
На следующем приеме несколько дней временная пломба удаляется, каналы промывают антисептиками и пломбируют лечебной пастой сроком на 1-3 месяца.
-
На третьем этапе назначается повторное рентгенологическое исследование, выполняется очистка каналов, введение антисептиков и устанавливается постоянная пломба.

Если каналы непроходимы или устранить воспаление консервативными методами не удается, применяют к оперативному вмешательству. Предпочтение отдается методам, которые позволяют сохранить зуб – удаление верхней части корня (резекция), одного корня многокорневого зуба (гемисекция), удаление корня целиком (ампутация), удаление кисты (цистэктомия). В некоторых ситуациях требуется удаление всего зуба. Лечение проводят под местной анестезией.
Справка! В связи с близким расположением зачатков постоянных зубов и большим риском вовлечения их в воспалительный процесс, лечение временных зубов хронического периодонтита у детей консервативными методами нецелесообразно. Поэтому чаще всего применяют хирургическое лечение – удаление зуба.
Во время реабилитации назначают физиотерапевтическое лечение. Целью физиотерапии является снятие воспаления и стимуляция восстановления костной ткани. Для устранения симптомов периостита и лимфаденита применяют электрическое поле УВЧ; для снижения отека – УВЧ, магнитотерапию, лазеротерапию, УФО; при выраженных болях – микроволновую терапию, дарсонвализацию; для введения лекарственных препаратов в полость зуба – электрофорез, ультрафонофорез.
После проведенного лечения необходимо в течение 2 лет наблюдаться у стоматолога. При необходимости назначается контрольное рентгенологическое исследование.
Профилактика хронического периодонтита
Основными профилактическими мероприятиями являются соблюдение гигиены полости рта, своевременное удаление зубного камня, лечение кариеса и заболеваний десен. Регулярное посещение стоматолога дважды в год поможет избежать серьезных проблем и сохранить зубы.
Для предотвращения развития болезни у ребенка особенно важно с раннего возраста приучать его чистить зубы два раза в день, использовать специальную межзубную нить и ополаскиватели. Не стоит злоупотреблять сладостями. Обращаться к стоматологу нужно при появлении первых жалоб и один раз в 3 месяца приходить на профилактический осмотр и профессиональную гигиену полости рта.
Позвоните прямо сейчас
+7 (495) 186-01-41
Записаться
Предыдущая статья
Следующая статья
Лечение периодонтита зубов в Минске, цена на лечение периодонтита в стоматологии
Как получить план лечения дистанционно? Переслать 3D-снимок (КЛКТ)
Адреса клиник в Минске 3D-тур
Международная телефония
+37052060096
+37052060096
+375 29 843-34-01
отзывы
врачи
кейсы
цены
Мало кто задумывается о том, каким образом зуб держится в кости. Даже те пациенты, которые знают о существовании в зубе «нерва» — пульпы, часто не подозревают, что вокруг корней зубов тоже есть чувствительные нервные окончания и связки, фиксирующие зуб в лунке. Вместе с наружным слоем кости и цементом корня зуба эти связки образуют периодонт – совокупность тканей, окружающих зуб.
Даже те пациенты, которые знают о существовании в зубе «нерва» — пульпы, часто не подозревают, что вокруг корней зубов тоже есть чувствительные нервные окончания и связки, фиксирующие зуб в лунке. Вместе с наружным слоем кости и цементом корня зуба эти связки образуют периодонт – совокупность тканей, окружающих зуб.
Здоровый периодонт обеспечивает естественную микроподвижность зубов, поддерживает питание пульпы, амортизирует давление на зубы при жевании и передаёт сигналы о силе давления в головной мозг.
Периодонтит (апикальный, или верхушечный периодонтит) – это воспаление тканей периодонта. Апикальный периодонтит является самым распространённым заболеванием корневых каналов и самой частой причиной лечения зубных каналов. Кроме того, периодонтит — это самое частое осложнение лечения пульпита.
Итак, что приводит к возникновению периодонтита?
Причины периодонтита
Основной фактор развития периодонтита – это попадание патогенных микроорганизмов в периодонт. В полости рта здорового человека находится огромное количество бактерий, которые не доставляют никаких проблем, пока не снижается иммунитет или пока их количество не превышает допустимое. Однако при проникновении бактерий в стерильные околокорневые ткани, сразу возникает воспалительный ответ.
В полости рта здорового человека находится огромное количество бактерий, которые не доставляют никаких проблем, пока не снижается иммунитет или пока их количество не превышает допустимое. Однако при проникновении бактерий в стерильные околокорневые ткани, сразу возникает воспалительный ответ.
Пути попадания инфекции в периодонт:
- При некачественном лечении пульпита, возникшего как осложнение кариеса зуба.
- Во время травмы зуба (ушиб, вывих, перелом корня).
- Редко — с током крови при тяжелых инфекционных заболеваниях.
Неинфекционной причиной периодонтита является нарушение техники протезирования: перегрев тканей зуба при препарировании или хроническая травма периодонта при фиксации слишком высокой коронки.
Как видите, причины могут быть разными. Но как понять, что это периодонтит?
Симптомы периодонтита
В зависимости от фазы заболевания различаются симптомы периодонтита. Клинически значимой является классификация на:
- Острый периодонтит и обострение хронического периодонтита (К04.
 4 по МКБ-10),
4 по МКБ-10), - Хронический периодонтит (К04.5 по МКБ-10).
Острый периодонтит
Острая форма периодонтита встречается редко, в основном — после травмы зуба. Чаще стоматологи сталкиваются с обострением хронического воспалительного процесса. При этом пациент будет жаловаться на сильные ноющие боли, боли при накусывании на зуб. Ощущается, что причинный зуб словно стал выше, чем рядом стоящие зубы, он как будто выдвинулся из зубного ряда. Известны случаи, когда обострение периодонтита вызывает головную боль – после лечения зуба она исчезает.
Десна в области корня периодонтитного зуба краснеет, опухает, часто опухает щека или губа около зуба. Повышается температура тела, ухудшается общее самочувствие пациента. В таком случае не обойтись без антибиотиков и противовоспалительных препаратов.
Если мы имеем дело с периодонтитом верхнего бокового зуба, следует учитывать близкое расположение гайморовой пазухи. Корни верхних жевательных зубов находятся вплотную ко дну пазухи, и воспаление из околокорневых тканей зуба легко распространяется на гайморову пазуху – возникает одонтогенный гайморит. Лечение периодонтита должно проходить вместе с лечением гайморита у ЛОР-врача.
Лечение периодонтита должно проходить вместе с лечением гайморита у ЛОР-врача.
Хронический периодонтит
Вне обострения зуб с хроническим воспалением на корнях может ничем себя не выдавать. Иногда пациент обнаруживает на десне белые точки – свищевые ходы с гнойным отделяемым. Но пока зуб не болит, большинство людей откладывают поход к врачу.
На протяжении долгих лет течение воспалительного процесса может быть бессимптомным – до снижения иммунитета, простуды или сильного стресса. Тогда заболевание выходит в фазу обострения: появляется боль, отёк и ухудшение общего состояния — и пациент будет вынужден спешно обратиться к стоматологу для лечения хронического периодонтита.
Способы лечения периодонтита
К лечению апикального периодонтита есть несколько подходов. В сети стоматологических клиник KANOдоктора строго следуют клиническим протоколам и принимают решение о тактике лечения, исходя из интересов пациента.
На начальных стадиях воспалительного процесса хорошие результаты даёт терапевтическое лечение зуба – лечение зубных каналов. Доктор пломбирует каналы и следит за динамикой по рентген-снимку.
Доктор пломбирует каналы и следит за динамикой по рентген-снимку.
Если же из-за длительного воспаления в периодонте произошло существенное разрушение кости вокруг или между корнями, понадобится хирургическое лечение. Оно включает в себя как зубосохраняющие операции, такие как удаление кисты зуба, так и более радикальные решения – удаление зуба с последующей имплантацией.
Расскажем подробнее про эти методики.
Консервативное лечение периодонтита
Сначала к лечению периодонтита приступает стоматолог-терапевт. Периодонтит возникает как следствие не леченных или некачественно леченных корневых каналов. Поэтому стоматологу нужно провести квалифицированное лечение каналов: убрать старую корневую пломбу, провести антисептическую обработку каналов и запломбировать их до верхушки. После этого прогноз лечения зависит от организма пациента: в благоприятном варианте иммунитет справляется с оставшейся инфекцией, и периодонт восстанавливается. Доказано, что даже очаг разрушения кости – то, что называют кистой — способен к заживлению: это видно на контрольных рентген-снимках через 6 месяцев после лечения.
Хирургическое лечение периодонтита
Если через 6 месяцев после терапевтического лечения каналов на снимке нет положительной динамики, то необходимо задуматься о хирургическом лечении периодонтита. Однако и без проведения консервативного лечения стоматолог может предложить вариант с хирургией после оценки степени разрушения кости и самого зуба. Если зуб многокорневой (один из жевательных зубов), важное значение имеет наличие или отсутствие воспаления в зоне фуркации – то есть между корнями.
В ряде случаев лечение корневых каналов оказывается невозможным — например, если зуб восстановлен штифтом, который тяжело извлечь без повреждения самого зуба. Вариантом выбора будет проведение зубосохраняющих операций, таких как удаление кисты зуба.
Если периодонтит возник как следствие перелома корня, то такой зуб подлежит удалению. В случае с травматическим периодонтитом возможен вариант одномоментной имплантации – можно удалить зуб и сразу установить имплант.
Когда зуб невозможно вылечить консервативно и воспаление зашло слишком далеко, доктор предложит прибегнуть к помощи имплантации. Для лечения зубов с большими воспалительными очагами применяется методика классической двухэтапной имплантации: установка импланта проходит через 3 месяца после удаления зуба — такой срок необходим для заживления кости.
Для лечения зубов с большими воспалительными очагами применяется методика классической двухэтапной имплантации: установка импланта проходит через 3 месяца после удаления зуба — такой срок необходим для заживления кости.
В том случае, если воспалительные очаги и кисты обнаруживаются на всех зубах челюсти, а зубы разрушены до уровня десны, стоматолог порекомендует комплексную имплантацию по методике All-on-4/6.
Лечение периодонтита в Минске
Для того, чтобы выбрать оптимальный вариант лечения периодонтита, доктор должен владеть знаниями и практическим опытом решения различных клинических ситуаций. Этого можно достичь, если иметь возможность применить любой из методов – от консервативных методик лечения каналов до комплексной имплантации. Доктора сети стоматологических клиник KANO проходят обучающие семинары у основателей методик сложнейших видов имплантаций и регулярно посещают практические центры по всему миру для повышения своего профессионального уровня. Поэтому вы можете быть уверены, что в KANO обеспечите себе лечение мирового класса.
Не менее важна кооперация между стоматологами смежных специальностей: терапевт должен понимать, когда его возможности ограничены и пациенту нужна хирургическая помощь. В то же время, хирург должен быть заинтересован в лечении жизнеспособного зуба без удаления. А применение новейшего оборудования и материалов позволяет докторам сети стоматологических клиник KANO проводить лечение по самым высоким стандартам.
Реальные истории пациентов Не каждый готов рассказать свою историю на камеру. Новая улыбка окрыляет и добавляет уверенности в себе! Не верите? Смотрите!
Все отзывы
Из Эстонии в Беларусь лечить зубы! 04 October 2019
Ровные зубы за 6 месяцев? Это реально! 23 August 2019
Имплантация зубов в Беларуси: преимущества 04 July 2019
Отзыв пациента из Грузии о протезировании в KANO 29 January 2020
Нащи специалисты
Все врачи
Ничипоровская Марина Юрьевна
Стоматолог-терапевт. Каналы. Отбеливание Beyond.
Каналы. Отбеливание Beyond.
Каунова Екатерина Евгеньевна Стоматолог-терапевт. Лечение и восстановление зубов «под ключ». Виниры.
Портфолио. ДО и ПОСЛЕ Лучше всего о мастерстве врачей расскажет портфолио. Нажмите «Все примеры работ» ниже, для просмотра полноценных кейсов лечения.
Цены на лечение периодонтита в клинике KANO в Минске Уточняем, что окончательная стоимость лечения может быть определена только после изучения врачами клинической картины пациента при очном осмотре. Все цены указаны в евро.
| Терапевтическое лечение | |
|---|---|
| Кариес маленький | 40 € |
| Кариес средний | 50 € |
| Кариес Большой | 50 € |
| Полная жевательная | 60 € |
| Эндодонтия 1к | 50 € |
| Эндодонтия 2к | 75 € |
| Эндодонтия 3к | 100 € |
| Эндодонтия 4к | 125 € |
| Перелечивание 1к | 70 € |
| Перелечивание 2к | 100 € |
| Перелечивание 3к | 150 € |
| Перелечивание 4к | 180 € |
| Отбеливание дом/офис | 200 € |
Проф. гигиена гигиена
|
60 € |
| Имплант-сервис 1 шт | 10 € |
| Винир композит | 90 € |
Запишитесь на бесплатную консультацию В ближайшее время с Вами свяжется медицинский координатор и проконсультирует Вас по условиям и стоимости лечения, подберёт врача и запишет Вас на приём.
единый телефон для Беларуси
401
401 единый телефон для Беларуси
+375 29 643-34-01
+375 29 843-34-01
+375 17 336-64-01
Блог
Информация о KANO в СМИ. Новости из мира стоматологии. Публикации наших врачей. Обзоры из дентал-блогов.
Новости из мира стоматологии. Публикации наших врачей. Обзоры из дентал-блогов.
Все статьи и публикации
Статьи MagicArt теперь KANO!
Статьи Экспресс-имплантация All-on-4/6: интервью с хирургом
Новости МЦ «Томография» — наш партнер!
Статьи Цифровое протезирование зубов: история пациента
Статьи Ответы на самые частые вопросы о брекетах
Статьи Как правильно выбрать зубные импланты?
Пародонтит: от микробного иммунного подрыва к системному воспалению
1. Pihlstrom BL, Michalowicz BS, Johnson NW. Заболевания пародонта. Ланцет. 2005; 366: 1809–1820. [PubMed] [Google Scholar]
Pihlstrom BL, Michalowicz BS, Johnson NW. Заболевания пародонта. Ланцет. 2005; 366: 1809–1820. [PubMed] [Google Scholar]
2. Adler CJ, et al. Секвенирование древнего обызвествленного зубного налета показывает изменения в микробиоте полости рта с изменением рациона питания в эпоху неолита и промышленной революции. Природа Жене. 2013;45:450–455. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Eke PI, Dye BA, Wei L, Thornton-Evans GO, Genco RJ. Распространенность пародонтита у взрослых в США: 2009 г.и 2010. Дж. Дент. Рез. 2012;91:914–920. [PubMed] [Google Scholar]
4. Genco RJ, Van Dyke TE. Профилактика: снижение риска сердечно-сосудистых заболеваний у пациентов с пародонтитом. Природа Преподобный Кардиол. 2010;7:479–480. [PubMed] [Google Scholar]
5. Лундберг К., Вегнер Н., Юсел-Линдберг Т., Венейблс П.Дж. Пародонтит при РА-цитруллиновом енолазном соединении. Природа Преподобный Ревматол. 2010;6:727–730. [PubMed] [Google Scholar]
6. Kebschull M, Demmer RT, Papapanou PN. «Жевательная резинка, оставьте мое сердце в покое»: эпидемиологические и механистические данные, связывающие периодонтальные инфекции и атеросклероз. Дж. Дент. Рез. 2010;89: 879–902. [Бесплатная статья PMC] [PubMed] [Google Scholar]
«Жевательная резинка, оставьте мое сердце в покое»: эпидемиологические и механистические данные, связывающие периодонтальные инфекции и атеросклероз. Дж. Дент. Рез. 2010;89: 879–902. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Whitmore SE, Lamont RJ. Оральные бактерии и рак. PLoS Патог. 2014;10:e1003933. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Han YW, Wang X. Мобильный микробиом: бактерии полости рта при внеротовых инфекциях и воспалении. Дж. Дент. Рез. 2013;92:485–491. [PMC free article] [PubMed] [Google Scholar]
9. Мадианос П.Н., Бобетсис Ю.А., Оффенбахер С. Неблагоприятные исходы беременности (АПО) и заболевания пародонта: патогенетические механизмы. Дж. Клин. Пародонтол. 2013; 40 (Приложение 14): S170–180. [PubMed] [Академия Google]
10. Сокранский С.С., Хаффаджи А.Д. Микробная экология пародонта. Пародонтол. 2000. 2005; 38: 135–187. [PubMed] [Google Scholar]
11. Abusleme L, et al. Поддесневой микробиом в норме и при пародонтите и его связь с биомассой сообщества и воспалением. ISME J. 2013; 7: 1016–1025. [Статья бесплатно PMC] [PubMed] [Google Scholar]
ISME J. 2013; 7: 1016–1025. [Статья бесплатно PMC] [PubMed] [Google Scholar]
Это метагеномное исследование охарактеризовало экологические события в поддесневых микробных сообществах, лежащих в основе развития пародонтита, и прояснило взаимосвязь между воспалением и микробиомом, связанным с заболеванием.
12. Griffen AL, et al. Различные и сложные бактериальные профили при пародонтите и здоровье человека, выявленные с помощью пиросеквенирования 16S. ISME J. 2012; 6: 1176–1185. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Jorth P, et al. Метатранскриптомика микробиома полости рта человека в норме и при болезни. МБио. 2014;5:e01012–01014. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Dewhirst FE, et al. Микробиом ротовой полости человека. Дж. Бактериол. 2010;192:5002–5017. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Это исследование привело к созданию базы данных микробиома ротовой полости человека, первого тщательно отобранного описания микробиома, специфичного для участка человеческого тела.
15. Hajishengallis G, et al. Виды биопленок с низким содержанием регулируют воспалительное заболевание пародонта через комменсальную микробиоту и комплемент. Клеточный микроб-хозяин. 2011; 10: 497–506. [Бесплатная статья PMC] [PubMed] [Google Scholar]
В этой статье представлено in vivo доказательств того, что один микроб, действующий как краеугольный патоген, может вызывать количественные и качественные изменения комменсальной микробиоты, ведущие к дисбактериозу.
16. Hajishengallis G, Darveau RP, Curtis MA. Гипотеза краеугольного камня-возбудителя. Nature Rev. Microbiol. 2012;10:717–725. [Бесплатная статья PMC] [PubMed] [Google Scholar]
17. Darveau RP. Пародонтит: полимикробное нарушение гомеостаза хозяина. Nature Rev. Microbiol. 2010;8:481–490. [PubMed] [Google Scholar]
18. Розье Б.Т., де Ягер М., Заура Э., Кром Б.П. Исторические и современные гипотезы развития заболеваний полости рта: дошли ли мы до конца? Фронтальная клеточная инфекция. микробиол. 2014;4 [Бесплатная статья PMC] [PubMed] [Google Scholar]
микробиол. 2014;4 [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Хаджишенгаллис Г., Ламонт Р.Дж. От красного комплекса к более сложному: модель полимикробной синергии и дисбиоза (PSD) этиологии заболеваний пародонта. Мол. Оральный микробиол. 2012; 27: 409–419. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Hajishengallis G. Иммуномикробный патогенез периодонтита: краеугольные камни, патобионты и реакция хозяина. Тренды Иммунол. 2014;35:3–11. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Han YW, et al. Мертворождение в срок, вызванное оральным Fusobacterium nucleatum . Обст. Гинекол. 2010; 115:442–445. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Heo SM, Haase EM, Lesse AJ, Gill SR, Scannapieco FA. Генетические взаимосвязи между респираторными патогенами, выделенными из зубного налета и жидкости бронхоальвеолярного лаважа от пациентов в отделении интенсивной терапии, находящихся на искусственной вентиляции легких. клин. Заразить. Дис. 2008; 47: 1562–1570. [Бесплатная статья PMC] [PubMed] [Google Scholar]
клин. Заразить. Дис. 2008; 47: 1562–1570. [Бесплатная статья PMC] [PubMed] [Google Scholar]
23. Scannapieco FA. У людей с хронической обструктивной болезнью легких (ХОБЛ) может быть больше шансов иметь более тяжелое заболевание пародонта, чем у людей без ХОБЛ. Дж. Эвид. На базе Дент. Практика. 2014;14:79–81. [PubMed] [Google Scholar]
24. Tan L, Wang H, Li C, Pan Y. Метагеномный анализ зубного налета и легочных бактерий на основе 16S рДНК у пациентов с тяжелыми острыми обострениями хронической обструктивной болезни легких. Дж. Пародонт. Рез. 2014 [PubMed] [Google Scholar]
25. Козаров Е.В., Дорн Б.Р., Шелбурн С.Е., Данн В.А., младший, Прогульске-Фокс А. Атеросклеротическая бляшка человека содержит жизнеспособные инвазивные Actinobacillus actinomycetemcomitans и Porphyromonas gingivalis . Артериосклероз. тромб. Васк. биол. 2005;25:e17–e18. [PubMed] [Google Scholar]
26. Haraszthy VI, Zambon JJ, Trevisan M, Zeid M, Genco RJ. Выявление пародонтопатогенов в атероматозных бляшках. Дж. Пародонтол. 2000;71:1554–1560. [PubMed] [Google Scholar]
Дж. Пародонтол. 2000;71:1554–1560. [PubMed] [Google Scholar]
27. Carrion J, et al. Состояние микробного носительства дендритных клеток (ДК) периферической крови при хроническом пародонтите влияет на дифференцировку ДК, атерогенный потенциал. Дж. Иммунол. 2012; 189:3178–3187. [Бесплатная статья PMC] [PubMed] [Google Scholar]
В этом исследовании объединены клинические и механические данные, свидетельствующие о том, что миелоидные дендритные клетки крови являются транспортными средствами для системного распространения P. gingivalis из среды его обитания в ротовой полости.
28. Вельско И.М., и соавт. Активная инвазия Porphyromonas gingivalis в ткани полости рта и аорты у мышей причинно связывает периодонтит и атеросклероз. ПЛОС Один. 2014;9:e97811. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. Slocum C, et al. Отдельные фрагменты липида А способствуют патоген-индуцированному локализованному воспалению сосудов. PLoS Патог. 2014;10:e1004215. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
Это исследование показало, что способность P. gingivalis ферментативно модифицировать часть липида А своего липополисахарида позволяет ему избегать опосредованного TLR4 иммунитета и персистировать, вызывая атерогенное воспаление в местах, удаленных от первоначальной инфекции.
30. Maresz KJ, et al. Porphyromonas gingivalis способствует развитию и прогрессированию деструктивного артрита благодаря своей уникальной бактериальной пептидиларгининдезиминазе (PAD) PLoS Pathog. 2013;9:e1003627. [Статья бесплатно PMC] [PubMed] [Google Scholar]
Первое исследование in vivo механистической связи между P. gingivalis пептидил-аргининдеиминазой и ревматоидным артритом, связанным с антителами к цитруллинированному белку.
31. Wegner N, et al. Пептидиларгининдеиминаза из Porphyromonas gingivalis цитруллинирует человеческий фибриноген и альфа-энолазу: значение для аутоиммунитета при ревматоидном артрите. Артрит Ревматолог. 2010;62:2662–2672. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Артрит Ревматолог. 2010;62:2662–2672. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Mikuls TR, et al. Пародонтит и Porphyromonas gingivalis у больных ревматоидным артритом. Артрит Ревматолог. 2014;66:1090–1100. [Бесплатная статья PMC] [PubMed] [Google Scholar]
33. Koziel J, Mydel P, Potempa J. Связь между заболеваниями пародонта и ревматоидным артритом: обновленный обзор. Курс. Ревматол. 2014; 16:408. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Perez-Chaparro PJ, et al. Недавно выявленные патогены, связанные с пародонтитом: систематический обзор. Дж. Дент. Рез. 2014;93: 846–858. [Бесплатная статья PMC] [PubMed] [Google Scholar]
35. Sima C, Glogauer M. Дисфункция нейтрофилов и восприимчивость хозяина к воспалению пародонта: текущее состояние знаний. Курс. Представитель по охране здоровья полости рта, 2014 г.; 1:95–103. [Google Scholar]
36. Nussbaum G, Shapira L. Как исследования нейтрофилов улучшили наше понимание пародонтального патогенеза? Дж. Клин. Пародонтол. 2011; 38:49–59. [PubMed] [Google Scholar]
Клин. Пародонтол. 2011; 38:49–59. [PubMed] [Google Scholar]
37. Йылмаз О. Хроники Porphyromonas gingivalis : микроб, эпителий ротовой полости человека и их взаимодействие. Микробиология. 2008; 154: 2897–2903. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Darveau RP. Манипуляции с нейтрофилами Porphyromonas gingivalis: фактор риска пародонтита? Тенденции микробиол. 2014 [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Bostanci N, Belibasakis GN. Porphyromonas gingivalis : инвазивный и уклончивый условно-патогенный микроорганизм полости рта. FEMS Microbiol Lett. 2012; 333:1–9. [PubMed] [Академия Google]
40. Холт С.К., Эберсоул Дж., Фелтон Дж., Брунсволд М., Корнман К.С. Имплантация Bacteroides gingivalis у нечеловеческих приматов вызывает прогрессирование периодонтита. Наука. 1988; 239: 55–57. [PubMed] [Google Scholar]
41. Darveau RP, Hajishengallis G, Curtis MA. Porphyromonas gingivalis в качестве потенциального общественного активиста по борьбе с болезнью. Дж. Дент. Рез. 2012;91:816–820. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Дж. Дент. Рез. 2012;91:816–820. [Бесплатная статья PMC] [PubMed] [Google Scholar]
42. Maekawa T, et al. Порфиромонас десневой манипулирует комплементом и передачей сигналов TLR, чтобы отделить бактериальный клиренс от воспаления и способствовать дисбактериозу. Клеточный микроб-хозяин. 2014; 15: 768–778. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Это исследование механически проанализировало, как пародонтальные бактерии могут мешать иммунно-опосредованному уничтожению, одновременно способствуя благоприятному с точки зрения питания воспалительному ответу, тем самым закрепляя дисбиоз.
43. Хаджишенгаллис Г., Ламонт Р.Дж. Во все тяжкие: манипулирование ответом хоста с помощью Porphyromonas gingivalis . Евро. Дж. Иммунол. 2014;44:328–338. [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Jiao Y, et al. Индукция потери костной массы с помощью патобионт-опосредованной передачи сигналов nod1 в ротовой полости. Клеточный микроб-хозяин. 2013; 13: 595–601. [PMC free article] [PubMed] [Google Scholar]
2013; 13: 595–601. [PMC free article] [PubMed] [Google Scholar]
Это исследование продемонстрировало концепцию комменсала, ставшего патобионтом, при пародонтите в условиях нарушенного тканевого гомеостаза.
45. Whitmore SE, Lamont RJ. Патогенная персона внебольничных оральных стрептококков. Мол. микробиол. 2011;81:305–314. [Бесплатная статья PMC] [PubMed] [Google Scholar]
46. Haffajee AD, et al. Поддесневая микробиота у здоровых, ухоженных пожилых людей и пациентов с пародонтитом. Дж. Клин. Пародонтол. 1998; 25: 346–353. [PubMed] [Google Scholar]
47. Kesavalu L, et al. Крысиная модель полимикробной инфекции, иммунитета и резорбции альвеолярной кости при заболеваниях пародонта. Заразить. Иммун. 2007; 75: 1704–1712. [Бесплатная статья PMC] [PubMed] [Google Scholar]
48. Daep CA, Novak EA, Lamont RJ, Demuth DR. Структурное рассечение и эффективность in vivo пептидного ингибитора Porphyromonas gingivalis приверженность к Streptococcus gordonii . Заразить. Иммун. 2011;79:67–74. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Заразить. Иммун. 2011;79:67–74. [Бесплатная статья PMC] [PubMed] [Google Scholar]
49. Orth RK, O’Brien-Simpson NM, Dashper SG, Reynolds EC. Синергическая вирулентность Porphyromonas gingivalis и Treponema denticola в модели пародонтита у мышей. Мол. Оральный микробиол. 2011; 26: 229–240. [PubMed] [Google Scholar]
50. Polak D, et al. Мышиная модель экспериментального пародонтита, индуцированного Инфекция Porphyromonas gingivalis/Fusobacterium nucleatum : потеря костной массы и реакция хозяина. Дж. Клин. Пародонтол. 2009; 36: 406–410. [PubMed] [Google Scholar]
51. Tan KH, et al. Porphyromonas gingivalis и Treponema denticola демонстрируют метаболический симбиоз. PLoS Патог. 2014;10:e1003955. [Бесплатная статья PMC] [PubMed] [Google Scholar]
52. Amano A, et al. Генетическая характеристика и патогенетические механизмы пародонтопатогенов. Доп. Вмятина. Рез. 2014;26:15–22. [Бесплатная статья PMC] [PubMed] [Google Scholar]
53. Kuboniwa M, et al. Взгляд на вирулентность оральных биопленок: открытия протеомики. Эксперт Преподобный Протеом. 2012;9:311–323. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Kuboniwa M, et al. Взгляд на вирулентность оральных биопленок: открытия протеомики. Эксперт Преподобный Протеом. 2012;9:311–323. [Бесплатная статья PMC] [PubMed] [Google Scholar]
54. Cyktor JC, Turner J. Интерлейкин-10 и иммунитет против прокариотических и эукариотических внутриклеточных патогенов. Заразить. Иммун. 2011;79:2964–2973. [Бесплатная статья PMC] [PubMed] [Google Scholar]
55. Hajishengallis G. Воспалительный характер микробиоты, ассоциированной с пародонтитом. Мол. Оральный микробиол. 2014 г. DOI: 10.1111/omi.12065. [Бесплатная статья PMC] [PubMed] [Google Scholar]
56. Hajishengallis E, Hajishengallis G. Гомеостаз нейтрофилов и здоровье пародонта у детей и взрослых. Дж. Дент. Рез. 2014;93:231–237. [Бесплатная статья PMC] [PubMed] [Google Scholar]
57. Moutsopoulos NM, et al. Дефектное рекрутирование нейтрофилов при болезни I типа с дефицитом адгезии лейкоцитов вызывает локальную воспалительную потерю костной массы, вызванную IL-17. науч. Перевод Мед. 2014;6:229ra240. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2014;6:229ra240. [Бесплатная статья PMC] [PubMed] [Google Scholar]
58. Ryder MI. Сравнение функций нейтрофилов при агрессивном и хроническом пародонтите. Пародонтол. 2000. 2010; 53: 124–137. [PubMed] [Академия Google]
59. Чаппл И.Л., Мэтьюз Дж.Б. Роль активных форм кислорода и антиоксидантов в деструкции тканей пародонта. Пародонтол. 2000. 2007;43:160–232. [PubMed] [Google Scholar]
60. Eskan MA, et al. Антагонист лейкоцитарного интегрина Del-1 ингибирует опосредованную IL-17 воспалительную потерю костной массы. Натура Иммунол. 2012; 13: 465–473. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Lee W, Aitken S, Sodek J, McCulloch CA. Доказательства прямой связи между активностью нейтрофильной коллагеназы и деструкцией ткани пародонта in vivo: роль активного фермента в пародонтите человека. Дж. Периодон. Рез. 1995;30:23–33. [PubMed] [Google Scholar]
62. Hernandez M, et al. Ассоциации между матриксными металлопротеиназами-8 и -14 и миелопероксидазой в жидкости десневой борозды у субъектов с прогрессирующим хроническим пародонтитом: продольное исследование. Дж. Пародонтол. 2010;81:1644–1652. [PubMed] [Google Scholar]
Дж. Пародонтол. 2010;81:1644–1652. [PubMed] [Google Scholar]
63. Ландзберг М., Деринг Х., Абуди Г.М., Тененбаум Х.К., Глогауэр М. Количественная оценка воспалительной нагрузки в полости рта: количество нейтрофилов в полости рта при здоровье и заболеваниях пародонта. Дж. Пародонт. Рез. 2014 г. DOI: 10.1111/jre.12211. [PubMed] [Академия Google]
64. Риклин Д., Хаджишенгаллис Г., Ян К., Ламбрис Д.Д. Комплемент: ключевая система иммунного надзора и гомеостаза. Натура Иммунол. 2010; 11: 785–797. [Бесплатная статья PMC] [PubMed] [Google Scholar]
65. Popadiak K, Potempa J, Riesbeck K, Blom AM. Двухфазный эффект гингипаинов из Porphyromonas gingivalis на систему комплемента человека. Дж. Иммунол. 2007; 178:7242–7250. [PubMed] [Google Scholar]
66. Jusko M, et al. Металлопротеиназа карилизин присутствует в большинстве Изоляты Tannerella forsythia ингибируют все пути системы комплемента. Дж. Иммунол. 2012;188:2338–2349. [Бесплатная статья PMC] [PubMed] [Google Scholar]
67. Potempa M, et al. Интерпейн А, цистеиновая протеиназа из Prevotella intermedia , ингибирует комплемент путем деградации фактора комплемента С3. PLoS Патог. 2009;5:e1000316. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Potempa M, et al. Интерпейн А, цистеиновая протеиназа из Prevotella intermedia , ингибирует комплемент путем деградации фактора комплемента С3. PLoS Патог. 2009;5:e1000316. [Бесплатная статья PMC] [PubMed] [Google Scholar]
68. Miller DP, et al. Структура фактора Н-связывающего белка В (FhbB) периопатогена, Treponema denticola : понимание прогрессирования заболеваний пародонта. Дж. Биол. хим. 2012; 287:12715–12722. [Бесплатная статья PMC] [PubMed] [Google Scholar]
69. Malm S, et al. Приобретение фактора I ингибитора комплемента сериновой протеазы и его кофакторов C4b-связывающего белка и фактора H с помощью Prevotella intermedia . ПЛОС Один. 2012;7:e34852. [Бесплатная статья PMC] [PubMed] [Google Scholar]
70. Liang S, et al. Рецептор C5a нарушает зависимый от IL-12 клиренс Porphyromonas gingivalis и необходим для индукции потери пародонтальной кости. Дж. Иммунол. 2011; 186: 869–877. [Бесплатная статья PMC] [PubMed] [Google Scholar]
71. Burns E, Bachrach G, Shapira L, Nussbaum G. Cutting Edge: TLR2 необходим для врожденного ответа на Porphyromonas gingivalis : активация приводит к персистенции бактерий и Дефицит TLR2 ослабляет индуцированную резорбцию альвеолярной кости. Дж. Иммунол. 2006; 177:8296–8300. [PubMed] [Google Scholar]
Burns E, Bachrach G, Shapira L, Nussbaum G. Cutting Edge: TLR2 необходим для врожденного ответа на Porphyromonas gingivalis : активация приводит к персистенции бактерий и Дефицит TLR2 ослабляет индуцированную резорбцию альвеолярной кости. Дж. Иммунол. 2006; 177:8296–8300. [PubMed] [Google Scholar]
72. Myneni SR, et al. Передача сигналов TLR2 и ответы Th3 управляют Tannerella forsythia — индуцированная потеря пародонтальной кости. Дж Иммунол. 2011; 187: 501–509. [Бесплатная статья PMC] [PubMed] [Google Scholar]
73. Shin JE, Baek KJ, Choi YS, Choi Y. Пародонтальный патоген Treponema denticola перехватывает реакцию хозяина, управляемую Fusobacterium nucleatum . Иммунол. Клеточная биол. 2013;91:503–510. [PubMed] [Google Scholar]
74. Wang M, et al. Микробный захват перекрестных помех комплемент-толл-подобных рецепторов. науч. Сигнал. 2010;3:ra11. [Бесплатная статья PMC] [PubMed] [Google Scholar]
75. Taxman DJ, et al. Porphyromonas gingivalis опосредует репрессию воспаления в полимикробных культурах посредством нового механизма, включающего снижение эндоцитоза. Дж. Биол. хим. 2012; 287:32791–32799. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Porphyromonas gingivalis опосредует репрессию воспаления в полимикробных культурах посредством нового механизма, включающего снижение эндоцитоза. Дж. Биол. хим. 2012; 287:32791–32799. [Бесплатная статья PMC] [PubMed] [Google Scholar]
76. Ламканфи М., Диксит В.М. Механизмы и функции инфламмасом. Клетка. 2014; 157:1013–1022. [PubMed] [Google Scholar]
77. Moutsopoulos NM, et al. Porphyromonas gingivalis способствует Th27-индуцирующим путям при хроническом пародонтите. Дж. Аутоиммун. 2012;39: 294–303. [Бесплатная статья PMC] [PubMed] [Google Scholar]
78. Jauregui CE, et al. Подавление Т-клеточных хемокинов Porphyromonas gingivalis . Заразить. Иммун. 2013;81:2288–2295. [Статья бесплатно PMC] [PubMed] [Google Scholar]
Это исследование показало, что P. gingivalis -индуцированный «локальный хемокиновый паралич», первоначально показанный как влияющий на врожденный иммунитет, также включает подавление хемокинов Т-хелперов 1.
79. Hayashi C, et al. Защитная роль передачи сигналов TLR4 при прогрессировании атеросклероза, выявленная при инфицировании распространенным оральным патогеном. Дж. Иммунол. 2012;189: 3681–3688. [Бесплатная статья PMC] [PubMed] [Google Scholar]
80. Gemmell E, Yamazaki K, Seymour GJ. Роль Т-клеток в заболеваниях пародонта: гомеостаз и аутоиммунитет. Пародонтол. 2000. 2007; 43:14–40. [PubMed] [Google Scholar]
81. Гаффен С.Л., Хаджишенгаллис Г. Новый воспалительный цитокин в блоке: переосмысление заболеваний пародонта и парадигмы Th2/Th3 в контексте клеток Th27 и IL-17. Дж. Дент. Рез. 2008; 87: 817–828. [Бесплатная статья PMC] [PubMed] [Google Scholar]
82. Бахекар А.А., Сингх С., Саха С., Молнар Дж., Арора Р. Распространенность и заболеваемость ишемической болезнью сердца значительно увеличиваются при пародонтите: метаанализ. Являюсь. Харт Дж. 2007; 154: 830–837. [PubMed] [Google Scholar]
83. Friedewald VE, et al. Консенсус редакторов Американского журнала кардиологии и журнала пародонтологии: периодонтит и атеросклеротические сердечно-сосудистые заболевания. Являюсь. Дж. Кардиол. 2009; 104:59–68. [PubMed] [Google Scholar]
Являюсь. Дж. Кардиол. 2009; 104:59–68. [PubMed] [Google Scholar]
84. Tonetti MS, et al. Лечение пародонтита и эндотелиальной функции. Н. англ. Дж. Мед. 2007;356:911–920. [PubMed] [Google Scholar]
85. Offenbacher S, et al. Результаты исследования пародонтита и сосудистых заболеваний (PAVE): пилотное многоцентровое рандомизированное контролируемое исследование по изучению эффектов периодонтальной терапии в модели вторичной профилактики сердечно-сосудистых заболеваний. Дж. Пародонтол. 2009; 80: 190–201. [Бесплатная статья PMC] [PubMed] [Google Scholar]
86. Desvarieux M, et al. Изменения в клинических и микробиологических профилях пародонта связаны с прогрессированием толщины комплекса интима-медиа сонных артерий: исследование эпидемиологии оральных инфекций и сосудистых заболеваний. Варенье. Сердечный доц. 2013;2:e000254. [Бесплатная статья PMC] [PubMed] [Google Scholar]
87. Brodala N, et al. Бактеремия Porphyromonas gingivalis вызывает атеросклероз коронарных артерий и аорты у свиней с нормохолестеринемией и гиперхолестеринемией. Артериосклеры Тромб Васк Биол. 2005; 25:1446–1451. [PubMed] [Google Scholar]
Артериосклеры Тромб Васк Биол. 2005; 25:1446–1451. [PubMed] [Google Scholar]
88. Tonetti MS. Пародонтит и риск атеросклероза: обновленная информация о интервенционных испытаниях. Дж. Клин. Пародонтол. 2009; 36 (Приложение 10): 15–19. [PubMed] [Google Scholar]
89. Arimatsu K, et al. Оральный патобионт вызывает системное воспаление и метаболические изменения, связанные с изменением микробиоты кишечника. науч. Отчет 2014; 4:4828. [Бесплатная статья PMC] [PubMed] [Google Scholar]
90. Gibson FC, 3rd, et al. Распознавание инвазивных бактерий врожденным иммунитетом ускоряет развитие атеросклероза у мышей с дефицитом аполипопротеина Е. Тираж. 2004; 109: 2801–2806. [PubMed] [Google Scholar]
91. Джайн А., Батиста Э.Л., мл., Серхан С., Шталь Г.Л., Ван Дайк Т.Э. Роль периодонтита в прогрессировании отложения липидов в модели животных. Заразить. Иммун. 2003; 71: 6012–6018. [Статья бесплатно PMC] [PubMed] [Google Scholar]
92. Зелха С.А., Фрейлих Р.В., Амар С. Врожденные иммунные механизмы пародонта, имеющие отношение к атеросклерозу и ожирению. Пародонтол. 2000. 2010; 54: 207–221. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Врожденные иммунные механизмы пародонта, имеющие отношение к атеросклерозу и ожирению. Пародонтол. 2000. 2010; 54: 207–221. [Бесплатная статья PMC] [PubMed] [Google Scholar]
93. Chiu B. Множественные инфекции каротидных атеросклеротических бляшек. Являюсь. Heart J. 1999; 138:S534–536. [PubMed] [Google Scholar]
94. Рейес Л., Эррера Д., Козаров Э., Ролдан С., Прогульске-Фокс А. Бактериальная инвазия и инфекция пародонта: вклад в атеросклеротическую патологию. Дж. Клин. Пародонтол. 2013; 40 (Приложение 14): S30–50. [PubMed] [Google Scholar]
95. Hayashi C, et al. Опосредованный патогенами воспалительный атеросклероз частично опосредуется через воспалительные реакции, индуцированные Toll-подобным рецептором 2. J. Врожденный иммунитет. 2010;2:334–343. [Бесплатная статья PMC] [PubMed] [Google Scholar]
96. Coats SR, et al. Реакции человеческого Toll-подобного рецептора 4 на P. gingivalis регулируются активностью липида А 1- и 4′-фосфатазы. Клеточная микробиология. 2009; 11: 1587–1599. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2009; 11: 1587–1599. [Бесплатная статья PMC] [PubMed] [Google Scholar]
97. Curtis MA, et al. Зависимая от температуры модуляция структуры Porphyromonas gingivalis липида А и взаимодействие с врожденными защитными механизмами хозяина. Заразить. Иммун. 2011;79:1187–1193. [Бесплатная статья PMC] [PubMed] [Google Scholar]
98. Al-Qutub MN, et al. Геминзависимая модуляция структуры липида А липополисахарида Porphyromonas gingivalis . Заразить. Иммун. 2006; 74: 4474–4485. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Refs. 97 и 98 показали на молекулярном уровне, как факторы окружающей среды могут влиять на микробную вирулентность и взаимодействие хозяин-микроб.
99. Zenobia C, et al. Porphyromonas gingivalis Липид Активность фосфатазы А имеет решающее значение для колонизации и увеличения комменсальной нагрузки в модели лигатуры кролика. Заразить. Иммун. 2014; 82: 650–659. [Бесплатная статья PMC] [PubMed] [Google Scholar]
100. Coats SR, Do CT, Karimi-Naser LM, Braham PH, Darveau RP. Антагонистические липополисахариды блокируют функцию липополисахарида E. coli в TLR4 человека посредством взаимодействия с сайтом связывания липополисахарида MD-2 человека. Клеточная микробиология. 2007; 9: 1191–1202. [PubMed] [Google Scholar]
Coats SR, Do CT, Karimi-Naser LM, Braham PH, Darveau RP. Антагонистические липополисахариды блокируют функцию липополисахарида E. coli в TLR4 человека посредством взаимодействия с сайтом связывания липополисахарида MD-2 человека. Клеточная микробиология. 2007; 9: 1191–1202. [PubMed] [Google Scholar]
101. Bostanci N, et al. Porphyromonas gingivalis противодействует Campylobacter rectus индуцирует продукцию цитокинов моноцитами человека. Цитокин. 2007;39: 147–156. [PubMed] [Google Scholar]
102. Wang M, et al. Фимбриальные белки Porphyromonas gingivalis опосредуют вирулентность in vivo и используют TLR2 и рецептор комплемента 3, чтобы сохраняться в макрофагах. Дж. Иммунол. 2007; 179: 2349–2358. [PubMed] [Google Scholar]
103. Wang M, Hajishengallis G. Зависимое от липидов поглощение, передача сигналов и внутриклеточная судьба Porphyromonas gingivalis в макрофагах мыши. Клеточная микробиология. 2008;10:2029–2042. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
104. Манес С., дель Реал Г., Мартинес А.С. Возбудители: угонщики плотов. Нац. Преподобный Иммунол. 2003; 3: 557–568. [PubMed] [Google Scholar]
105. Zeituni AE, McCaig W, Scisci E, Thanassi DG, Cutler CW. Нативная малая фимбрия Porphyromonas gingivalis массой 67 килодальтон представляет собой новый гликопротеин с мотивами, нацеленными на DC-SIGN. Дж. Бактериол. 2010;192:4103–4110. [Бесплатная статья PMC] [PubMed] [Google Scholar]
106. Zeituni AE, Jotwani R, Carrion J, Cutler CW. Нацеливание DC-SIGN на дендритные клетки человека с помощью второстепенных ветвей 9Штамм 0037 Porphyromonas gingivalis вызывает отчетливый ответ эффекторных Т-клеток. Дж. Иммунол. 2009;183:5694–5704. [Бесплатная статья PMC] [PubMed] [Google Scholar]
107. Miles B, et al. Фенотип вторичного лимфоидного самонаведения миелоидных дендритных клеток человека, разрушенный внутриклеточным оральным патогеном. Заразить иммун. 2014;82:101–111. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2014;82:101–111. [Бесплатная статья PMC] [PubMed] [Google Scholar]
108. Liang Z, et al. Замалчивание CXCR4 блокирует метастазирование рака молочной железы. Рак рез. 2005;65:967–971. [Бесплатная статья PMC] [PubMed] [Google Scholar]
109. Sainz J, Sata M. CXCR4, ключевой модулятор сосудистых клеток-предшественников. Артериосклероз. тромб. Васк. биол. 2007; 27: 263–265. [PubMed] [Google Scholar]
110. Belstrom D, et al. Атерогенная бактерия Porphyromonas gingivalis уклоняется от циркулирующих фагоцитов, прикрепляясь к эритроцитам. Заразить. Иммун. 2011;79:1559–1565. [Бесплатная статья PMC] [PubMed] [Google Scholar]
111. Madrigal AG, Barth K, Papadopoulos G, Genco CA. Опосредованный патогенами протеолиз регулятора клеточной гибели RIPK1 и модулятора защиты хозяина RIPK2 в эндотелиальных клетках аорты человека. PLoS Патог. 2012;8:e1002723. [Бесплатная статья PMC] [PubMed] [Google Scholar]
112. Huck O, Elkaim R, Davideau JL, Tenenbaum H. Porphyromonas gingivalis — нарушение врожденного иммунного ответа посредством протеолиза NLRP3 в эндотелиальных клетках. Врожденный иммун. 2014 г.: 10.1177/1753425
Porphyromonas gingivalis — нарушение врожденного иммунного ответа посредством протеолиза NLRP3 в эндотелиальных клетках. Врожденный иммун. 2014 г.: 10.1177/1753425
3459. [PubMed] [Google Scholar]
113. Harokopakis E, Albzreh MH, Martin MH, Hajishengallis G. TLR2 трансмодулирует адгезию и трансмиграцию моноцитов посредством Rac1- и PI3K-опосредованной передачи сигналов наизнанку в ответ на фимбрии Porphyromonas gingivalis . Дж. Иммунол. 2006; 176:7645–7656. [PubMed] [Академия Google]
114. Такахаши Ю., Дэйви М., Юмото Х., Гибсон ФК, 3-й, Genco CA. Фимбрия-зависимая активация провоспалительных молекул в Porphyromonas gingivalis , инфицированных эндотелиальными клетками аорты человека. Клеточная микробиология. 2006; 8: 738–757. [PubMed] [Google Scholar]
115. Джайн С., Коутс С.Р., Чанг А.М., Дарво Р.П. Новый класс молекул, чувствительных к липопротеиновой липазе, опосредует активацию Toll-подобного рецептора 2 с помощью Porphyromonas gingivalis . Заразить. Иммун. 2013;81:1277–1286. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Заразить. Иммун. 2013;81:1277–1286. [Бесплатная статья PMC] [PubMed] [Google Scholar]
116. Clark RB, et al. Сериновые липиды Porphyromonas gingivalis являются лигандами Toll-подобного рецептора 2 человека и мыши. Заразить. Иммун. 2013 [бесплатная статья PMC] [PubMed] [Google Scholar]
117. Delbosc S, et al. Porphyromonas gingivalis участвует в патогенезе аневризмы брюшной аорты человека путем активации нейтрофилов. Доказательство концепции на крысах. ПЛОС Один. 2011;6:e18679. [Бесплатная статья PMC] [PubMed] [Google Scholar]
118. Накаяма К. Porphyromonas gingivalis индуцированная клетками гемагглютинация и агрегация тромбоцитов. Пародонтол. 2000. 2010; 54:45–52. [PubMed] [Google Scholar]
119. Han YW, Houcken W, Loos BG, Schenkein HA, Tezal M. Пародонтоз, атеросклероз, неблагоприятные исходы беременности и рак головы и шеи. Доп. Вмятина. Рез. 2014; 26:47–55. [PubMed] [Google Scholar]
120. Chen YW, et al. Ассоциация между пародонтитом и антикардиолипиновыми антителами при болезни Бюргера. Дж. Клин. Пародонтол. 2009; 36: 830–835. [PubMed] [Академия Google]
Дж. Клин. Пародонтол. 2009; 36: 830–835. [PubMed] [Академия Google]
121. Li XY, et al. Липополисахарид Porphyromonas gingivalis увеличивает накопление липидов, воздействуя на CD36 и АТФ-связывающий кассетный переносчик А1 в макрофагах. Онкол. Отчет 2013; 30: 1329–1336. [PubMed] [Google Scholar]
122. Giacona MB, et al. Porphyromonas gingivalis индуцирует его поглощение макрофагами человека и способствует образованию пенистых клеток in vitro. ФЭМС микробиол. лат. 2004; 241:95–101. [PubMed] [Google Scholar]
123. Санс М., Корнман К. Пародонтит и неблагоприятные исходы беременности: согласованный отчет совместного семинара EFP/AAP по пародонтиту и системным заболеваниям. Дж. Клин. Пародонтол. 2013; 40 (Приложение 14): S164–169.. [PubMed] [Google Scholar]
124. Liu H, Redline RW, Han YW. Fusobacterium nucleatum вызывает гибель плода у мышей посредством стимуляции TLR4-опосредованного плацентарного воспалительного ответа. Дж. Иммунол. 2007; 179: 2501–2508. [PubMed] [Google Scholar]
Иммунол. 2007; 179: 2501–2508. [PubMed] [Google Scholar]
Первое механистическое исследование, связывающее пероральный патоген с осложнениями беременности на животной модели.
125. Han YW, et al. Fusobacterium nucleatum вызывает преждевременные и доношенные мертворождения у беременных мышей: влияние бактерий полости рта на преждевременные роды. Заразить. Иммун. 2004; 72: 2272–2279.. [Бесплатная статья PMC] [PubMed] [Google Scholar]
126. Schenkein HA, et al. Антитела к кардиолипину в сыворотке крови больных пародонтитом. Дж. Дент. Рез. 2003; 82: 919–922. [PubMed] [Google Scholar]
127. Schenkein HA, Bradley JL, Purkall DB. Антикардиолипин в антисыворотке Porphyromonas gingivalis вызывает гибель плода у мышей. Дж. Дент. Рез. 2013;92:814–818. [Бесплатная статья PMC] [PubMed] [Google Scholar]
В этом отчете рассматривается молекулярная мимикрия как механизм, с помощью которого хозяин реагирует на P. gingivalis может индуцировать кардиолипин-специфические аутоантитела, которые вызывают потерю плода у мышей.
128. Шер Ю.Ю., Бретц В.А., Абрамсон С.Б. Заболевания пародонта и поддесневая микробиота как факторы патогенеза ревматоидного артрита: модифицируемые факторы риска? Курс. мнение Ревматол. 2014; 26: 424–429. [Бесплатная статья PMC] [PubMed] [Google Scholar]
129. Джозеф Р., Раджаппан С., Нат С.Г., Пол Б.Дж. Связь между хроническим пародонтитом и ревматоидным артритом: исследование случай-контроль в больнице. Ревматол. Междунар. 2013;33:103–109. [PubMed] [Google Scholar]
130. де Пабло П., Дитрих Т., МакАлиндон Т.Е. Ассоциация заболеваний пародонта и потери зубов с ревматоидным артритом у населения США. Дж. Ревматол. 2008; 35:70–76. [PubMed] [Google Scholar]
131. Suwannalai P, Trouw LA, Toes RE, Huizinga TW. Антитела к цитруллиновым белкам (ACPA) при раннем ревматоидном артрите. Мод. Ревматол. 2012; 22:15–20. [PubMed] [Google Scholar]
132. Gyorgy B, Toth E, Tarcsa E, Falus A, Buzas EI. Цитруллинирование: посттрансляционная модификация в норме и болезни. Междунар. Дж. Биохим. Клеточная биол. 2006; 38: 1662–1677. [PubMed] [Академия Google]
Междунар. Дж. Биохим. Клеточная биол. 2006; 38: 1662–1677. [PubMed] [Академия Google]
133. Pyrc K, et al. Инактивация эпидермального фактора роста Porphyromonas gingivalis как потенциальный механизм повреждения тканей пародонта. Заразить. Иммун. 2013;81:55–64. [Бесплатная статья PMC] [PubMed] [Google Scholar]
134. Pratesi F, et al. Общий эпитоп HLA и ACPA: просто маркер или активный игрок? Аутоиммун. 2013; 12:1182–1187. [PubMed] [Google Scholar]
135. Lundberg K, et al. Антитела к цитруллинированному альфа-енолазному пептиду 1 специфичны для ревматоидного артрита и перекрестно реагируют с бактериальной енолазой. Ревмирующий артрит. 2008;58:3009–3019. [PubMed] [Google Scholar]
В этом исследовании был идентифицирован иммунодоминантный эпитоп в цитруллинированной α-енолазе, который перекрестно реагирует с цитруллинированной энолазой P. gingivalis и участвует в развитии ревматоидного артрита, что, следовательно, согласуется с ролью P. gingivalis. и его цитруллинирующий фермент в стимуляции аутоиммунитета.
gingivalis. и его цитруллинирующий фермент в стимуляции аутоиммунитета.
136. Катрина А.И., Иттерберг А.Дж., Рейнисдоттир Г., Мальмстром В., Клареског Л. Легкие, суставы и иммунитет против цитруллинированных белков при ревматоидном артрите. Природа Преподобный Ревматол. 2014 [PubMed] [Академия Google]
137. Sokolove J, et al. Распространение эпитопа аутоантител на доклинической фазе предсказывает прогрессирование ревматоидного артрита. ПЛОС Один. 2012;7:e35296. [Бесплатная статья PMC] [PubMed] [Google Scholar]
138. Gully N, et al. Porphyromonas gingivalis пептидиларгининдеиминаза, ключевой участник патогенеза экспериментального заболевания пародонта и экспериментального артрита. ПЛОС Один. 2014;9:e100838. [Бесплатная статья PMC] [PubMed] [Google Scholar]
139. Paju S, Scannapieco FA. Оральные биопленки, пародонтит и легочные инфекции. Оральный Дис. 2007; 13: 508–512. [Бесплатная статья PMC] [PubMed] [Google Scholar]
140. Файнголд СМ. Аспирационная пневмония. Преподобный Заражает Дис. 1991; 13 (Приложение 9): S737–742. [PubMed] [Google Scholar]
Аспирационная пневмония. Преподобный Заражает Дис. 1991; 13 (Приложение 9): S737–742. [PubMed] [Google Scholar]
141. Awano S, et al. Здоровье полости рта и риск смертности от пневмонии у пожилых людей. Дж. Дент. Рез. 2008; 87: 334–339. [PubMed] [Google Scholar]
142. Kimizuka R, Kato T, Ishihara K, Okuda K. Смешанные инфекции с Porphyromonas gingivalis и Treponema denticola вызывают чрезмерные воспалительные реакции в мышиной модели пневмонии по сравнению с моноинфекциями. микробы заражают. 2003; 5: 1357–1362. [PubMed] [Академия Google]
143. Muller F. Гигиена полости рта снижает смертность от аспирационной пневмонии у ослабленных пожилых людей. Дж. Дент. Рез. 2014 г.: 10.1177/0022034514552494. [Бесплатная статья PMC] [PubMed] [Google Scholar]
144. Iinuma T, et al. Ношение зубных протезов во время сна удваивает риск пневмонии у очень пожилых людей. Дж. Дент. Рез. 2014 г.: 10.1177/0022034514552493. [Бесплатная статья PMC] [PubMed] [Google Scholar]
145. Peter KP, et al. Ассоциация заболеваний пародонта и хронической обструктивной болезни легких: реальность или догма? Дж. Пародонтол. 2013;84:1717–1723. [PubMed] [Академия Google]
Peter KP, et al. Ассоциация заболеваний пародонта и хронической обструктивной болезни легких: реальность или догма? Дж. Пародонтол. 2013;84:1717–1723. [PubMed] [Академия Google]
146. Сети С., Мерфи Т.Ф. Инфекция в патогенезе и течении хронической обструктивной болезни легких. Н. англ. Дж. Мед. 2008; 359: 2355–2365. [PubMed] [Google Scholar]
147. Pan Y, Teng D, Burke AC, Haase EM, Scannapieco FA. Оральные бактерии модулируют инвазию и индукцию апоптоза в клетках HEp-2 с помощью Pseudomonas aeruginosa . микроб. Патог. 2009; 46:73–79. [PubMed] [Google Scholar]
148. Li Q, et al. Porphyromonas gingivalis модулирует Pseudomonas aeruginosa индуцирует апоптоз клеток респираторного эпителия через сигнальный путь STAT3. микробы заражают. 2014; 16:17–27. [PubMed] [Google Scholar]
149. Yao L, et al. Инфекция Porphyromonas gingivalis секвестрирует проапоптотические клетки Bad через Akt в первичных эпителиальных клетках десны. Мол. Оральный микробиол. 2010; 25:89–101. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Мол. Оральный микробиол. 2010; 25:89–101. [Бесплатная статья PMC] [PubMed] [Google Scholar]
150. Cannon CL, Kowalski MP, Stopak KS, Pier GB. Синегнойная палочка -индуцированный апоптоз дефектен в респираторных эпителиальных клетках, экспрессирующих мутантный регулятор трансмембранной проводимости муковисцидоза. Являюсь. Дж. Дыхание. Ячейка Мол. биол. 2003; 29: 188–197. [PubMed] [Google Scholar]
151. Папапану, ПН. В: Оральная микробиология и иммунология. Ламонт Р.Дж., Хаджишенгаллис Г., Дженкинсон Х., редакторы. АСМ Пресс; Вашингтон, округ Колумбия: 2014. стр. 251–271. [Google Scholar]
152. Кумар П.С. Курение и поддесневая экосистема: сообщество, обогащенное патогенами. Будущая микробиология. 2012;7:917–919. [PubMed] [Google Scholar]
153. Stabholz A, Soskolne WA, Shapira L. Генетические и экологические факторы риска хронического пародонтита и агрессивного пародонтита. Пародонтология 2000. 2010;53:138–153. [PubMed] [Google Scholar]
154. Laine ML, Crielaard W, Loos BG. Генетическая предрасположенность к пародонтиту. Пародонтол. 2000. 2012; 58:37–68. [PubMed] [Google Scholar]
Laine ML, Crielaard W, Loos BG. Генетическая предрасположенность к пародонтиту. Пародонтол. 2000. 2012; 58:37–68. [PubMed] [Google Scholar]
155. Divaris K, et al. Изучение генетической основы хронического пародонтита: полногеномное ассоциативное исследование. Гум. Мол. Жене. 2013;22:2312–2324. [Бесплатная статья PMC] [PubMed] [Google Scholar]
156. Bagaitkar J, et al. Табачный дым усиливает образование биопленки Porphyromonas gingivalis-Streptococcus gordonii . ПЛОС Один. 2011;6:e27386. [PMC free article] [PubMed] [Google Scholar]
157. Атанасова К.Р., Йылмаз О. Глядя в кабинет редкостей Porphyromonas gingivalis : микробий, хозяин и раковая ассоциация. Мол. Оральный микробиол. 2014;29:55–66. [Бесплатная статья PMC] [PubMed] [Google Scholar]
158. Castellarin M, et al. 9Инфекция 0037 Fusobacterium nucleatum распространена при колоректальной карциноме человека. Геном Res. 2012; 22: 299–306. [Бесплатная статья PMC] [PubMed] [Google Scholar]
159. Rubinstein MR, et al. Fusobacterium nucleatum способствует колоректальному канцерогенезу путем модулирования передачи сигналов E-кадгерина/β-катенина через адгезин FadA. Клеточный микроб-хозяин. 2013;14:195–206. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Rubinstein MR, et al. Fusobacterium nucleatum способствует колоректальному канцерогенезу путем модулирования передачи сигналов E-кадгерина/β-катенина через адгезин FadA. Клеточный микроб-хозяин. 2013;14:195–206. [Бесплатная статья PMC] [PubMed] [Google Scholar]
В этом исследовании были получены как механические, так и клинические доказательства причастности ротовой бактерии F. nucleatum при колоректальном раке.
160. Надь К.Н., Сонкоди И., Шоке И., Надь Э., Ньюман Х.Н. Микрофлора, ассоциированная с карциномами ротовой полости человека. Оральный онкол. 1998; 34: 304–308. [PubMed] [Google Scholar]
161. Katz J, Onate MD, Pauley KM, Bhattacharyya I, Cha S. Наличие Porphyromonas gingivalis в плоскоклеточной карциноме десны. Междунар. Дж. Устные науки. 2011;3:209–215. [Бесплатная статья PMC] [PubMed] [Google Scholar]
162. Ан Дж., Сегерс С., Хейс Р.Б. Пародонтоз, Porphyromonas gingivalis Уровни антител в сыворотке крови и смертность от рака желудочно-кишечного тракта. Канцерогенез. 2012;33:1055–1058. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Канцерогенез. 2012;33:1055–1058. [Бесплатная статья PMC] [PubMed] [Google Scholar]
163. Michaud DS, et al. Плазменные антитела к оральным бактериям и риск рака поджелудочной железы в большом европейском проспективном когортном исследовании. Кишка. 2013;62:1764–1770. [Бесплатная статья PMC] [PubMed] [Google Scholar]
164. Inaba H, et al. Porphyromonas gingivalis способствует инвазии плоскоклеточного рака полости рта посредством индукции проММР9и его активации. Клеточная микробиология. 2014;16:131–145. [Бесплатная статья PMC] [PubMed] [Google Scholar]
165. Kuboniwa M, et al. P. gingivalis ускоряет прогрессирование эпителиальных клеток десны в течение клеточного цикла. микробы заражают. 2008; 10: 122–128. [Бесплатная статья PMC] [PubMed] [Google Scholar]
166. Mao S, et al. Внутренние пути апоптоза эпителиальных клеток десны, модулированные Porphyromonas gingivalis . Клеточная микробиология. 2007; 9:1997–2007. [Бесплатная статья PMC] [PubMed] [Google Scholar]
167. Йылмаз О. и др. Удаление АТФ внутриклеточным патогеном Porphyromonas gingivalis ингибирует опосредованный P2X7 апоптоз клеток-хозяев. Клеточная микробиология. 2008; 10: 863–875. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Йылмаз О. и др. Удаление АТФ внутриклеточным патогеном Porphyromonas gingivalis ингибирует опосредованный P2X7 апоптоз клеток-хозяев. Клеточная микробиология. 2008; 10: 863–875. [Бесплатная статья PMC] [PubMed] [Google Scholar]
168. Iwahori K, et al. Сверхэкспрессия SOCS3 проявляет доклиническую противоопухолевую активность против злокачественной мезотелиомы плевры. Междунар. Дж. Рак. 2011; 129:993–1005. [PubMed] [Google Scholar]
169. Moffatt CE, Lamont RJ. Порфиромонас десневой индукция экспрессии микроРНК-203 контролирует супрессор цитокиновой сигнализации 3 в эпителиальных клетках десны. Заразить. Иммун. 2011;79:2632–2637. [Бесплатная статья PMC] [PubMed] [Google Scholar]
170. Groeger S, Domann E, Gonzales JR, Chakraborty T, Meyle J. Рецепторы B7-h2 и B7-DC клеток плоскоклеточной карциномы полости рта активируются Porphyromonas gingivalis. . Иммунобиология. 2011; 216:1302–1310. [PubMed] [Google Scholar]
171. Sznol M, Chen L. Антагонистические антитела к PD-1 и B7-h2 (PD-L1) в лечении распространенного рака человека. Клин Рак Рез. 2013;19: 1021–1034. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Антагонистические антитела к PD-1 и B7-h2 (PD-L1) в лечении распространенного рака человека. Клин Рак Рез. 2013;19: 1021–1034. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Полиморфизмы генов интерлейкина-6 и интерлейкина-10 у пациентов с хроническим пародонтитом и ответ на лечение через 3 года.
Acta Stomatol хорват. 2020 сен; 54(3): 238–249.
doi: 10.15644/asc54/3/2
, 1 , 2, 3 , 3 , 3 and 4
Author information Article notes Copyright and License information Disclaimer
Цель
Целью данного исследования было выяснить, влияет ли генетическая предрасположенность к хроническому пародонтиту, обусловленная наличием генотипа IL-6 -572GG или аллеля IL-10 -592A, на исходы после нехирургического лечения пародонтита. терапии (NSPT) в течение длительного периода времени.
Материалы и методы
Тридцать семь больных хроническим пародонтитом были разделены на две группы по генотипу: восприимчивые (SCP) и нечувствительные (NSCP). Все субъекты были клинически оценены на исходном уровне и через 3 года после NSPT. Образцы крови были собраны на исходном уровне у лиц, которые соответствовали критериям включения. Все участники получали NSPT от одного пародонтолога, который не знал о статусе генотипа каждого пациента. Статистический анализ был проведен путем сравнения переменных между группами с использованием U-критерия Манна-Уитни и между исходным уровнем и 3 годами для каждой группы с использованием теста Уилкоксона.
Все субъекты были клинически оценены на исходном уровне и через 3 года после NSPT. Образцы крови были собраны на исходном уровне у лиц, которые соответствовали критериям включения. Все участники получали NSPT от одного пародонтолога, который не знал о статусе генотипа каждого пациента. Статистический анализ был проведен путем сравнения переменных между группами с использованием U-критерия Манна-Уитни и между исходным уровнем и 3 годами для каждой группы с использованием теста Уилкоксона.
Результаты
Средний возраст населения оценивается в 47,68±8,64 года и включает 51,4% женщин, 48,6% курильщиков и 45,9% потребителей алкоголя. По данным генетического анализа 70,3% пациентов были гомозиготными носителями IL-6-572G (IL-6 SCP), а 46,0% из них были носителями аллеля IL-10-592A (IL-10 SCP). NSPT снижала все изучаемые параметры (глубина зондирования, потеря прикрепления, кровотечение при зондировании, процент участков с глубиной кармана 4-6 мм и ≥7 мм и потеря прикрепления) у всех участников, но результат лечения не был связан с генотипом. У лиц с SCP и NSCP были схожие клинические параметры в начале исследования и через 3 года.
У лиц с SCP и NSCP были схожие клинические параметры в начале исследования и через 3 года.
Выводы
В пределах ограничений этого 3-летнего проспективного когортного исследования у представителей европеоидной расы с диагнозом хронический пародонтит у лиц, предрасположенных к пародонтиту, что определялось наличием генотипа IL-6-572GG или аллеля IL-10-592A, аналогичный результат лечения после NSPT.
Ключевые слова: Хронический пародонтит, интерлейкин-6, интерлейкин-10, терапия, генетический полиморфизм выпадение зубов ( 1 ). Начало и прогрессирование заболеваний пародонта являются результатом взаимодействия между дисбактериозом комменсальной микробиоты полости рта и реакцией хозяина ( 2 ). На Всемирном семинаре 2017 г. по классификации болезней и состояний пародонта и периимплантатных заболеваний было признано, что подгруппы населения могут демонстрировать различные болезненные состояния из-за различий в отношении восприимчивости к заболеваниям и воздействия ( 1 ).
Восприимчивость к заболеваниям пародонта и ответ на лечение различаются у разных людей и зависят от разных факторов. Восприимчивость к заболеванию зависит от факторов риска окружающей среды и хозяина, которые либо поддаются изменению, такие как курение, сахарный диабет, ожирение и гигиена полости рта, либо не поддаются изменению, включая генетическую предрасположенность (9).0037 3 ). В исследовании, основанном на 110 парах взрослых близнецов, 38-82% популяционной дисперсии клинических параметров пародонта могут быть связаны с наследственностью генетических факторов, подчеркивающих роль генетических влияний хозяина ( 4 ). В последние десятилетия многочисленные исследования изучали связь между полиморфизмом генов и риском развития пародонтита ( 5 ).
Полиморфизмы в промоторной области гена интерлейкина (IL)-6 влияют на транскрипцию и экспрессию IL-6 у людей, что приводит к повышению уровня IL-6 в сыворотке ( 6 ) и ткани десен ( 7 ). Точно так же полиморфизмы в промоторной области гена IL-10 могут изменять экспрессию IL-10 в ответ на воспалительное заболевание, тем самым влияя на исход заболевания (8, 9). Мета-анализ, направленный на определение того, придают ли полиморфизмы IL-6 и IL-10 предрасположенность к пародонтиту, показал значительную связь между аллелем IL-6-572 G и аллелем IL-10-592 A и генотипом АА с хроническим пародонтитом (9).0037 10 — 13 ).
Точно так же полиморфизмы в промоторной области гена IL-10 могут изменять экспрессию IL-10 в ответ на воспалительное заболевание, тем самым влияя на исход заболевания (8, 9). Мета-анализ, направленный на определение того, придают ли полиморфизмы IL-6 и IL-10 предрасположенность к пародонтиту, показал значительную связь между аллелем IL-6-572 G и аллелем IL-10-592 A и генотипом АА с хроническим пародонтитом (9).0037 10 — 13 ).
Лечение пародонтита направлено на остановку прогрессирования заболевания за счет снижения бактериальной нагрузки, чтобы снизить риск потери зубов и предотвратить рецидив заболевания ( 14 ). Разумная конечная точка нехирургического пародонтологического лечения должна включать отсутствие клинических признаков воспаления десен, неглубокую глубину кармана и низкий уровень скопления зубного налета. Исследования показали, что пародонтологическое лечение может привести к положительным клиническим результатам, а поддерживающая пародонтальная терапия эффективна для поддержания здоровья пародонта и предотвращения долгосрочной потери зубов (9). 0037 15 — 17 ).
0037 15 — 17 ).
Хотя периодонтальная терапия в высокой степени предсказуема, факторы, связанные с пациентом и зубами, связаны с потерей зубов и дальнейшим прогрессированием заболевания во время поддерживающей пародонтальной терапии, включая возраст, курение, системные заболевания и генетику ( 18 , 19 ). Быстрое прогрессирование гингивита в периодонтит было обнаружено у 10-15% населения, а у 8-12% пациентов в популяции обнаруживаются очаги поражения, которые не реагируют на рутинное пародонтологическое лечение (9).0037 20 , 21 ). Выявление факторов, связанных с хозяином, таких как полиморфизмы генов, связанных с развитием и прогрессированием заболеваний пародонта, может привести к раннему выявлению пациентов, не отвечающих на пародонтологическое лечение ( 22 ). Хотя факторы окружающей среды широко исследовались как возможные предикторы прогрессирования заболевания у лиц, получавших пародонтологическое лечение, информация о генетических факторах недостаточна.
Мета-анализ, в котором изучалось влияние нескольких восприимчивых генотипов к хроническому пародонтиту на исход пародонтологического лечения и потерю зубов, показал, что уменьшение глубины кармана в первые три и шесть месяцев после нехирургической пародонтальной терапии было связано с восприимчивыми генотипами ( 23 ). Однако количество доступных исследований было недостаточным, чтобы сделать четкие выводы, и необходимы дальнейшие исследования ( 21 ). В проспективном исследовании с коротким периодом наблюдения (45 дней после нехирургической пародонтальной терапии) полиморфизмы IL-6-572 G/C и IL-10-592 C/A не влияли на исход лечения хронического пародонтита. 24 ). Необходимы дополнительные методологически обоснованные исследования, чтобы внести свой вклад в прогнозирование ответа пародонта на лечение.
До сих пор отсутствуют долгосрочные данные о результатах лечения и предрасположенности к заболеванию у пациентов с хроническим пародонтитом. Насколько нам известно, в настоящее время нет опубликованных клинических исследований, в которых оценивалось бы влияние полиморфизмов генов на исход нехирургического пародонтологического лечения в течение длительного периода времени. Таким образом, целью данного исследования было выяснить, связана ли генетическая предрасположенность к хроническому пародонтиту, обусловленная наличием генотипа IL-6-572GG или IL-10-59.Аллель 2А влияет на клинические результаты нехирургического длительного пародонтологического лечения.
Таким образом, целью данного исследования было выяснить, связана ли генетическая предрасположенность к хроническому пародонтиту, обусловленная наличием генотипа IL-6-572GG или IL-10-59.Аллель 2А влияет на клинические результаты нехирургического длительного пародонтологического лечения.
В это проспективное когортное исследование были включены последовательные пациенты с хроническим пародонтитом из частной практики, ограниченной пародонтологией и имплантационной стоматологией в Салониках, Греция, в период с сентября 2014 г. по июнь 2015 г. Все подходящие пациенты согласились с протоколами исследования. Из 68 пациентов, получавших лечение, 67 были повторно обследованы через 45 дней после лечения, и результаты анализа были опубликованы отдельно (9).0037 24 ). Субъектам было предложено пройти поддерживающую пародонтальную терапию по протоколу отзыва через 3 или 4 месяца в зависимости от их индивидуальных потребностей. В общей сложности 37 из 67 пациентов, повторно обследованных через 45 дней, поступили на контрольный осмотр через 3 года. Остальные 30 пациентов уехали из этого района, не посещали некоторые или все профилактические осмотры или проходили хирургическое пародонтологическое лечение в рамках своего плана лечения.
Остальные 30 пациентов уехали из этого района, не посещали некоторые или все профилактические осмотры или проходили хирургическое пародонтологическое лечение в рамках своего плана лечения.
Пациенты были включены в исследование на основании следующих критериев включения:
-
Диагностика хронического пародонтита на основе системы классификации заболеваний пародонта 1999 г. ( 25 ). Два или более несмежных участка с интерпроксимальной потерей клинического прикрепления (CAL) ≥ 3 мм, глубиной кармана при зондировании (PPD) ≥ 5 мм и кровотечением при зондировании (BOP).
-
Посещение поддерживающей пародонтальной терапии по протоколу отзыва через 3-4 месяца.
-
Завершение повторной оценки состояния пародонта через 3 года после активного пародонтологического лечения.
-
Системное здоровье.
-
Возраст 30-70 лет.
-
Наличие ≥16 зубов на первичном приеме.
Критерии исключения включали:
-
Любое лечение пародонта в течение последних 12 месяцев с момента начала исследования.

-
Плохая посещаемость контрольных/повторных приемов (непосещение рекомендуемого протокола поддерживающей пародонтальной терапии через 3–4 месяца).
-
Отсутствие данных при контрольном осмотре через 3 года после активного пародонтологического лечения.
-
Необходимость пародонтальной хирургии (резективной или регенеративной) после нехирургического пародонтологического лечения.
-
Наличие системных заболеваний или тяжелых заболеваний.
-
Необходимость антибиотикопрофилактики.
-
Системная противомикробная терапия в течение последних 3 месяцев с момента участия в исследовании.
-
Беременные или кормящие самки.
Клиническое обследование и пародонтотерапия
Детали клинического обследования и последовательности лечения были описаны ранее ( 24 ). Вкратце, состояние пародонта оценивалось, включая PPD, CAL и BOP, независимым пародонтологом, слепым к генетическому анализу и калиброванным (внутриэкспертное соглашение = 0,88) пародонтологом (E. D). Клиническое обследование проводилось с использованием ручного пародонтального зонда (зонд 15 UNC, Hu-Friedy, Чикаго, Иллинойс, США) в шести точках на зуб, кроме третьих моляров. Все пациенты, включенные в исследование, лечились в соответствии с комплексным планом пародонтологического лечения, включая описание случая, инструкции по гигиене полости рта и нехирургическую пародонтальную терапию под местной анестезией. Использовались ручные инструменты (Hu-Friedy, Чикаго, США) и ультразвуковые скейлеры (KaVo SONOsoft LUX, Kavo, Германия).
D). Клиническое обследование проводилось с использованием ручного пародонтального зонда (зонд 15 UNC, Hu-Friedy, Чикаго, Иллинойс, США) в шести точках на зуб, кроме третьих моляров. Все пациенты, включенные в исследование, лечились в соответствии с комплексным планом пародонтологического лечения, включая описание случая, инструкции по гигиене полости рта и нехирургическую пародонтальную терапию под местной анестезией. Использовались ручные инструменты (Hu-Friedy, Чикаго, США) и ультразвуковые скейлеры (KaVo SONOsoft LUX, Kavo, Германия).
Пролеченные пациенты были повторно обследованы через 6 недель после нехирургического пародонтологического лечения, и клиническое обследование было завершено тем же клиническим экспертом, что и при исходном обследовании. Поддерживающая пародонтальная терапия была запланирована на 3-4 месяца, включая оценку PPD, CAL и BOP, повторный инструктаж и повторную мотивацию для эффективного контроля зубного налета, профессиональную чистку зубов ручными инструментами и ультразвуковыми скейлерами, а также поддесневую инструментальную обработку в областях с PPD. ≥5 мм. Последнее клиническое обследование проводилось через 3 года после активного пародонтологического лечения.
≥5 мм. Последнее клиническое обследование проводилось через 3 года после активного пародонтологического лечения.
Исследовательские группы
Набранные лица были сгруппированы на основе полиморфизмов IL-6 -572 G/C и IL-10 -592 C/A: IL-6 SCP: Предрасположенность к хроническому пародонтиту, обусловленному наличием IL- 6 — генотип 572GG; IL-10 SCP: подвержен хроническому пародонтиту, обусловленному наличием аллеля IL-10 -592A; IL-6 NSCP: невосприимчивый к хроническому пародонтиту, несущий нечувствительный генотип IL-6 аллель -572C; IL-10 NSCP: невосприимчивый к хроническому пародонтиту, несущий нечувствительный генотип IL-10-59Генотип 2СС.
Образцы крови и генотипирование
Капли крови, взятые у каждого пациента, использовали для выделения геномной ДНК с использованием имеющегося в продаже набора для выделения геномной ДНК в соответствии с инструкциями производителя (QIAamp, DNA mini blood kit, QIAGEN, Германия). Генотипирование полиморфизмов IL-6-572 G/C (rs1800796) и IL-10-592 C/A (rs1800872) определяли методами полимеразной цепной реакции и полиморфизма длин рестрикционных фрагментов в конечном объеме 25 мкл с использованием стандартного протокола, который было описано ранее ( 24 ). Полиморфизмы IL-6 и IL-10 определяли с использованием праймеров для получения продукта ПЦР, который затем расщепляли и разделяли на полиакриламидных гелях, окрашенных нитратом серебра ( 24 ).
Полиморфизмы IL-6 и IL-10 определяли с использованием праймеров для получения продукта ПЦР, который затем расщепляли и разделяли на полиакриламидных гелях, окрашенных нитратом серебра ( 24 ).
Статистический анализ
Целью данного исследования была оценка результатов лечения после нехирургической пародонтальной терапии между восприимчивыми и не предрасположенными к пародонтиту людьми. PPD считали первичным исходом, и расчет размера выборки выполнялся на основе минимальной разницы в 1 мм в средних значениях PPD для всего рта каждого пациента и стандартного отклонения 0,5 мм. Стремление к достижению 95% мощности исследования было определено, что 6 человек в группе будут необходимы. Распределение клинических параметров проверяли на нормальность с помощью теста Шапиро-Уилка. Тест хи-квадрат использовался для определения того, были ли группы SCP и NSCP составлены из одинаковых пропорций в отношении пола, статуса курения и потребления алкоголя, в то время как U-критерий Манна-Уитни использовался для возраста и количества зубов. Для определения различий между временными точками (исходный уровень и 3 года) для каждой группы использовали критерий Уилкоксона. Критерий Манна-Уитни использовали для сравнения групп SCP и NSCP на исходном уровне и через 3 года. Для выявления возможных ассоциаций между генотипами, клиническими и демографическими параметрами использовали множественный логистический регрессионный анализ. Чтобы избежать смещения результатов из-за множественных сравнений, результаты были скорректированы в соответствии с поправкой Бонферрони для 8 анализируемых переменных. Значение P <0,05 считалось статистически значимым. Статистический анализ выполнен с использованием SPSS v.24.0, IBM, Армонк, Нью-Йорк, США.
Для определения различий между временными точками (исходный уровень и 3 года) для каждой группы использовали критерий Уилкоксона. Критерий Манна-Уитни использовали для сравнения групп SCP и NSCP на исходном уровне и через 3 года. Для выявления возможных ассоциаций между генотипами, клиническими и демографическими параметрами использовали множественный логистический регрессионный анализ. Чтобы избежать смещения результатов из-за множественных сравнений, результаты были скорректированы в соответствии с поправкой Бонферрони для 8 анализируемых переменных. Значение P <0,05 считалось статистически значимым. Статистический анализ выполнен с использованием SPSS v.24.0, IBM, Армонк, Нью-Йорк, США.
Популяция, исследованная в этом исследовании, включала в общей сложности 37 представителей европеоидной расы со средним возрастом 47,68 ± 8,64 года и диагнозом хронический пародонтит. Она была разделена на группы близкого возраста в соответствии с их генотипом. Демографические характеристики исследуемого населения представлены в . Группы IL-6 SCP и NSCP продемонстрировали схожие привычки курения (p = 0,64) и потребления алкоголя (p = 0,50) без существенных различий в отношении среднего количества имеющихся зубов (p = 0,11). Привычки курения оставались неизменными на протяжении всего периода исследования. В обследованной популяции больше мужчин были подвержены заболеваниям пародонта, чем женщины (p = 0,02). Различий между группами ИЛ-10 по возрасту (р=0,30), полу (р=0,86), потреблению алкоголя (р=0,9) не выявлено.0) и количество зубов (p=0,96), в то время как некурящие чаще были подвержены заболеваниям пародонта (p=0,03).
Группы IL-6 SCP и NSCP продемонстрировали схожие привычки курения (p = 0,64) и потребления алкоголя (p = 0,50) без существенных различий в отношении среднего количества имеющихся зубов (p = 0,11). Привычки курения оставались неизменными на протяжении всего периода исследования. В обследованной популяции больше мужчин были подвержены заболеваниям пародонта, чем женщины (p = 0,02). Различий между группами ИЛ-10 по возрасту (р=0,30), полу (р=0,86), потреблению алкоголя (р=0,9) не выявлено.0) и количество зубов (p=0,96), в то время как некурящие чаще были подвержены заболеваниям пародонта (p=0,03).
Table 1
Demographic characteristics of the study population
| Interleukin – 6 | Interleukin – 10 | TOTAL | |||||
|---|---|---|---|---|---|---|---|
| Parameters | SCP ( n=26) | NSCP (n=11) | Значение p* | SCP (n=17) | NSCP (n=20) | Значение p* | (n=37) |
Возраст 907 дюймов 48. 31 ± 9.88 31 ± 9.88 | 46.18 ± 4.56 | 0.50 | 49.29 ± 9.18 | 46.30 ± 8.12 | 0.30 | 47.68 ± 8.64 | |
| Gender Male (%) Female (%) | 16 (61.5) 10 (38,5) | 2 (18,2) 9 (81,8) | 0,02 | 8 (47,1) 9 (52,9) | 10 (50) 10 (50) | 0,86 | 18 (48,6) 19 (51,4) | 77777777777777777777. | 12 (46,2) 14 (53,8) | 6 (54,5) 5 (45,5) | 0,64 | 5 (29,4) 12 (70,6) | 9 13.15) (29,4) 12 (70,6) | 139 13.1078 (29,4) 12 (70,6) | 139 13777.9078 (29,4) 12 (70,6) | 5 (29,4) 12 (70,6) | 779 5 (29,4) 12 (70,6) | 9 | 18 (48,6) 19 (51,4) |
| Употребление алкоголя Да (%) Нет (%) | 11 (42,3) 15 (57,7) | 6 (54,5) 5 (45,5) | 0,50 | 8 (47,1) 9 (52,9) | 9 (45) 11 (55) | 9 (45). 20 (54.1) | |
| Number of teeth (mean ± SD) | 26.23 ± 1.97 | 25.00 ± 2.28 | 0.11 | 25.88 ± 2.21 | 25.85 ± 2.08 | 0.96 | 25.87 ± 2.11 |
Открыть в отдельном окне
* Тесты Манна-Уитни использовались для сравнения возраста и количества зубов в группах SCP и NSCP. Тесты хи-квадрат использовались для сравнения между группами SCP и NSCP в отношении пола, курения, потребления алкоголя.
Сокращения: SCP: чувствительный, NSCP: нечувствительный
Клинические результаты пародонтологического лечения и генотип IL-6
Клинические параметры пациентов с IL-6 SCP и NSCP на исходном уровне и через 3 года после пародонтальной терапии показаны на . Все клинические показатели в группах SCP и NSCP были одинаковыми на исходном уровне, независимо от генотипа (p>0,05), и все они значительно снизились через три года после нехирургического пародонтологического лечения в обеих группах (SCP и NSCP) (p<0,05), за исключением процент участков с CAL≥7 мм в группе NSCP (p=0,097). Кроме того, не выявлено достоверных различий ни по одному из клинических параметров между группами через 3 года лечения (р>0,05).
Все клинические показатели в группах SCP и NSCP были одинаковыми на исходном уровне, независимо от генотипа (p>0,05), и все они значительно снизились через три года после нехирургического пародонтологического лечения в обеих группах (SCP и NSCP) (p<0,05), за исключением процент участков с CAL≥7 мм в группе NSCP (p=0,097). Кроме того, не выявлено достоверных различий ни по одному из клинических параметров между группами через 3 года лечения (р>0,05).
Таблица 2
Клинические параметры пациентов с IL-6 SCP и NSCP исходно и через 3 года после пародонтальной терапии.
| Клинические параметры | SCP (n=26) | NSCP (n=11) | p-значение** | 90 (полный рот)0780 Базовая линия 3 года P-значение* | 3,57 (2,21-4,98) 2,39 (2,00-3,71) <0,001 | 3,37 (2,68-4,19) 2,211 (2,00-3,21) 3,37 (2,68-4,19) 2,211 (2,00-3,21) 3,37 (2,68-4,19) 2,211 (2,00-3,21) 3,37 (2,68-4,19) 2,218 | 3,37 (2,68-4,19) 2,218 | 3,37 (2,68-4,19) 2,218 | 3,37. |
|---|---|---|---|---|---|
| Full-mouth BOP (%) Baseline 3 years p-value* | 100.00 (21.43-100.00) 8.63 (0-100.00) <0.001 | 100.00 (10.87-100) 6.52 ( 0,67-62,50) 0,003 | 1,00 0,56 | ||
| CAL с полным входом (мм) Базовая линия 3 года P-значение* | 3,67 (2,21-5,18) 2,66 (2,00-5,64) 0,003 | 3,55 (2,83-4,31) 2,37 (2,00-5,24) | ,31,31) 2,37 (2,00-5,24) 0,0780 0,0770 0,0770 0,0770 0,0770 0,0770 0,0770 3,55 (2,83-4,31) | 2,37 (2,00-5,24) 9078,55.  | |
| Процент участков с PPD 4-6 мм (%) Базовый уровень 3 года P-значение * | 26,88 (1,92-49,31) 4,92 (0-34,67) 7801011010101010101010101010101010101010101010101010101010101010101010780. 4,92 (0-34,67) 1801010101010101010101070777 (1,92-49,31) 45,65) 2,17 (0-27,38) 0,003 | 0,92 0,84 | |||
| Процент участков с PPD ≥7 мм (%) Исходный уровень 3 года p-значение* | 4,63 (0-23,81) 0 (0-8,64) <0,001 | 9,452 (0-2.00) 0.19 0.52 | |||
| Percentage of sites with CAL 4-6 mm (%) Baseline 3 years p-value* | 29. 15 (1.92-52.50) 15 (1.92-52.50) 8.33 ( 0-87,04) 0,046 | 35,71 (10,0-46,38) 2,50 (0-78,21) 0,033 | 0,79 0,35 | ||
| Процент участков с CAL ≥7 мм (%) Базовый уровень 3 года P-значение* | 4,63 (0-25,00) 0,30 (0-24,07) | 4,63 (0-25,00) 0,30 (0-24,07) | 4,63 (0-25,00) (0-24,07) | , 0–10,67) 0 (0–15,38) 0,097 | 0,37 0,22 |
Открыть в отдельном окне
Сравнение базового уровня и 3-летнего теста Уилкоксона.
**Тест Манна-Уитни: сравнение групп SCP и NSCP.
Сокращения:
PPD: глубина кармана при зондировании
CAL: потеря клинического прикрепления
BOP: кровотечение при зондировании
SCP: чувствительный
NSCP: нечувствительный
пациентов с IL-10 SCP и NSCP в начале исследования и через 3 года после пародонтальной терапии показаны на рис. Значимых различий между группами SCP и NSCP не было обнаружено в начале исследования (p>0,05), в то время как значительное клиническое улучшение наблюдалось через 3 года (p
<0,05), за исключением процента участков с CAL 4-6 мм (p=0,057). ) и процент участков с CAL≥7 мм (p=0,167) в группе NSCP. Индивидуумы, перенесшие хронический периодонтит, демонстрировали статистически значимое снижение PPD, CAL, BOP, процента участков с PPD=4-6 мм, процента участков с PPD≥7 мм, процента участков с CAL=4-6 мм и процента участки с CAL≥7 мм через 3 года после лечения (p<0,03). При сравнении между группами ни у пациентов с SCP, ни у пациентов с NSCP не было выявлено достоверных различий по изучаемым параметрам (p>0,05). 9Таблица 3
9Таблица 3 .
2,50 (2,00-3,23)
<0.001
0.49
Baseline
3 years
p-value*
7.50 (0-100.00)
0.002
11.26 (0-62.50)
<0.001
0.89
Baseline
3 years
p-value*
 55 (2.84-5.18)
55 (2.84-5.18) 2.38 (2,00-4,54)
0,002
2,66 (2,00-5,64)
0.023
0.59
with PPD 4-6 mm (%)
Baseline
3 years
p-value*
4.76 (1.28-34.67)
<0,001
3,21 (0-27,38)
<0,001
0,80

0 (0-3,33)
0,001
0 (0-8,64)
0,003
0,70
с CAL 4-6 Mm (%)
8.33 (0-87.04)
0.028
5.06 (0-78.21)
0.057
0.76
with CAL ≥7 mm (%)
Исходный уровень
3 года
Значение p*
0 (0–7,74)
0,001
0 (0-24,07)
0,167
0,99
Open в отдельном окне
*.
**Тест Манна-Уитни: сравнение групп SCP и NSCP.
Сокращения:
PPD: глубина кармана при зондировании
CAL: потеря клинического прикрепления
BOP: кровотечение при зондировании
SCP: чувствительный
NSCP: нечувствительный
Также был проведен анализ подгрупп для сравнения клинических параметров на исходном уровне и через 3 года после нехирургического пародонтологического лечения между лицами, предрасположенными (n = 13) к хроническому пародонтиту, носителями обоих восприимчивых генотипов для IL-6 (IL-6 GG). ) и IL-10 (IL-10 CA или IL-10 AA) с нечувствительными (n = 24), несущими один или все три нечувствительных генотипа IL-6 GC, IL-6 CC, IL-10 CC. Обе подгруппы показали одинаковое возрастное (p=0,50) и гендерное (p=0,25) распределение. После лечения в восприимчивой группе наблюдалось значительное снижение BOP (p=0,001), PPD (p=0,001), CAL (p=0,013), PPD=4-6 мм (p=0,001), PPD≥ 7 мм (р=0,001) и CAL≥7 мм (р=0,01). Участки с CAL = 4–6 мм не продемонстрировали существенных различий между исходным уровнем и 3 годами в объединенной подгруппе, восприимчивой к IL-6 и IL-10 (p = 0,13). В комбинированной подгруппе нечувствительных к ИЛ-6 и ИЛ-10 все исследованные клинические параметры показали значительное снижение (p<0,04). Подгруппы SCP и NSCP показали сходные клинические переменные в начале исследования и через 3 года (p>0,05).
В комбинированной подгруппе нечувствительных к ИЛ-6 и ИЛ-10 все исследованные клинические параметры показали значительное снижение (p<0,04). Подгруппы SCP и NSCP показали сходные клинические переменные в начале исследования и через 3 года (p>0,05).
Множественный логистический регрессионный анализ
Множественный логистический регрессионный анализ связи между генотипами IL-6 -572 G/C и IL-10 -592 C/A и демографическими и клиническими переменными в исходном состоянии и через 3 года показан на . Исходно генотип IL-6 был достоверно связан с полом (p=0,01) и количеством отсутствующих зубов (p=0,05), в то время как генотип IL-10 и статус курения показали значительную связь (p=0,04). Кроме того, была выявлена достоверная связь между предрасположенностью к хроническому пародонтиту (по наличию генотипа IL-6-572GG) и полом через 3 года (р=0,01). Однако после поправки Бонферрони на множественные сравнения эти данные потеряли статистическую значимость (p>0,05). После 3 лет пародонтологического лечения не было никакой связи между какими-либо из тестируемых переменных (p>0,05).
Таблица 4
Множественный логистический регрессионный анализ связи между генотипами IL-6 -572 G/C и IL-10 -592 C/A и демографическими и клиническими переменными на исходном уровне и через 3 года.
| Parameters | OR | 95%Cl | p-value* | Adjusted p-value (Bonferroni correction) | |
|---|---|---|---|---|---|
| IL-6 | Baseline 9 лет0780 Gender Smoking Alcohol consumption Number of teeth Full-mouth BOP Full-mouth PPD Full-mouth CAL | 1. 12 12 52.09 1.09 0.42 1.79 0.97 0.10 35.69 | 0.97-1.29 2.41 -1125.37 0.09-13.01 0.04-4.78 1.00-3.22 0.93-1.02 0.01-104.32 0.07-18052.25 | 0.12 0.01 0.95 0.49 0.05 0.21 0.52 0.26 | 0.99 0.10 7.56 3.86 0.41 1.66 4.17 2.08 |
| 3 years Age Gender Smoking Alcohol consumption Number of teeth Full-mouth BOP Full-mouth PPD Full -mouth CAL | 1.09 26.86 1.39 0.35 1.32 0.99 0.  28 28 1.94 | 0.96-1.25 2.00-360.16 0.18-10.96 0.05-2.38 0.82-2.11 0.95-1.03 0.01-6.11 0.59-6.38 | 0.19 0.01 0.76 0.29 0.26 0.63 0.42 0.28 | 1.56 0.10 6.04 2.28 2.06 5.04 3.34 2.22 | |
| IL-10 | Исходный уровень Возраст Пол Курение Употребление алкоголя Количество зубов Полный рот BOP Полный рот PPD Полный рот CAL | 1.05 1.09 01780780 1.08 0.98 0.46 3.37 | 0. 95-1.15 95-1.15 0.20-5.78 0.03-0.93 0.36-11.89 0.73-1.59 0.95-1.01 0.01-109.19 0.02-541.77 | 0.33 0.94 0.04 0.42 0.70 0.16 0.78 0.64 | 2.63 7.49 0.33 3.33 5.58 1.30 6.25 5.11 |
| 3 years Age Gender Smoking Alcohol consumption Number of teeth Full-mouth BOP Full-mouth PPD Full-mouth CAL | 1.05 0.61 0.18 2.1 0.80 1.01 1.58 0.63 | 0.95-1.15 0.11-3.50 0.30-1.05 0.42-10.64 0.51-1.26 0.98-1.05 0.  13-19.75 13-19.75 0.25-1.60 | 0.34 0.57 0.06 0.37 0.34 0.48 0.72 0.33 | 2.75 4.59 0.45 2.95 2.68 3.82 5.78 2.62 |
Открыть в отдельном окне
*p-значения, выделенные жирным шрифтом, означают статистическую значимость (p<0,05).
Сокращения:
PPD: глубина кармана при зондировании
CAL: потеря клинического прикрепления
BOP: кровотечение при зондировании сайты внутри отдельных лиц ( 18 , 19 ). Генетический фон каждого человека может объяснить различия в реакции на лечение. Так как Ил-6 -572 и Ил-10 -592 полиморфизма гена в значительной степени связаны с хроническим пародонтитом ( 10 — 13 ), и, поскольку носительство варианта гена может повлиять на ответ на пародонтальную терапию ( 23 ), в этом исследовании мы исследовали влияние генетической предрасположенности к хроническому пародонтиту на результаты лечения пародонта за трехлетний период времени.
В отличие от нашей гипотезы о том, что пациенты предрасположены к хроническому пародонтиту, что определяется наличием генотипа IL-6 -572GG или IL-10 -59Аллель 2A будет иметь значительно худший ответ на нехирургическое лечение пародонта, чем у невосприимчивых людей, аналогичный результат лечения наблюдался для обеих включенных групп. В частности, пациенты с предрасположенностью и невосприимчивостью к хроническому пародонтиту показали статистически значимое улучшение исследуемых клинических параметров через 45 дней (как показано в нашей предыдущей публикации, 24), которое сохранялось до 3 лет после первоначального лечения (как показано в настоящем расследовании). Однако это значительное клиническое пародонтальное улучшение не зависело от генетического фона пациента.
Насколько нам известно, это первое исследование, в котором оценивалась связь между полиморфизмом генов и нехирургическим лечением пародонта в течение длительного периода времени. Предыдущие исследования включали людей, которые наблюдались в течение периода времени от 45 дней до 6 месяцев после нехирургического пародонтологического лечения ( 23 ). Наши результаты могут отличаться от результатов предыдущих исследований из-за более длительного периода наблюдения. Длительный мониторинг и поддерживающее пародонтологическое лечение имеют первостепенное значение для достижения долгосрочного успеха пародонтологического лечения и минимизации риска потери зубов (9).0037 26 ). Кроме того, долгосрочные исследования могут подтвердить или опровергнуть связь, выявленную в относительно краткосрочных исследованиях. Однако не всегда возможно сохранить первоначальный размер выборки и сохранить равное распределение размера выборки между группами при проведении лонгитюдных исследований. Потеря набранных пациентов в течение периода наблюдения может рассматриваться как неотъемлемое ограничение нашего исследования. Хотя наблюдались различия в распределении по полу между группами IL-6 SCP и NSCP, пол не продемонстрировал существенного влияния на исход лечения.
Наши результаты могут отличаться от результатов предыдущих исследований из-за более длительного периода наблюдения. Длительный мониторинг и поддерживающее пародонтологическое лечение имеют первостепенное значение для достижения долгосрочного успеха пародонтологического лечения и минимизации риска потери зубов (9).0037 26 ). Кроме того, долгосрочные исследования могут подтвердить или опровергнуть связь, выявленную в относительно краткосрочных исследованиях. Однако не всегда возможно сохранить первоначальный размер выборки и сохранить равное распределение размера выборки между группами при проведении лонгитюдных исследований. Потеря набранных пациентов в течение периода наблюдения может рассматриваться как неотъемлемое ограничение нашего исследования. Хотя наблюдались различия в распределении по полу между группами IL-6 SCP и NSCP, пол не продемонстрировал существенного влияния на исход лечения.
Кроме того, большинство предыдущих исследований, направленных на изучение влияния предрасположенности к хроническому пародонтиту на исход лечения после нехирургической пародонтальной терапии, показали аналогичные результаты ( 23 ). Проанализированы полиморфизмы генов матриксной металлопротеиназы (ММР)-1, ММР-13, ИЛ-1, ИЛ-4, ИЛ-6, ИЛ-8, маннозо-связывающего лектина (MBL) и моноцитарного хемоаттрактантного белка (МСР)-1. 23 , 27 ). Эти краткосрочные исследования не показали существенных различий между генетическими полиморфизмами генов IL-8, MMP-13, MMP-1, IL-1, IL4, IL-8, MBL и реакцией на нехирургическое лечение пародонта (9).0037 23 ). Напротив, в проспективном лонгитюдном исследовании, проведенном D’Aiuto et al., у восприимчивых пациентов, носителей аллеля C полиморфизма IL-6-174 с генерализованным тяжелым пародонтитом, наблюдались худшие результаты пародонтологического лечения по сравнению с нечувствительными пациентами (). 28 ). Однако включение различных этнических популяций и различия в исследуемых переменных могут объяснить противоречивые результаты. Более конкретно, в один и тот же анализ были включены пациенты из Европы, Африки/Карибского бассейна и Азии, а не из конкретной этнической группы, а влияние генотипа на исход пародонтологического лечения определялось на основе уменьшения количества карманов, а не оценки какого-либо непрерывного пародонтальные параметры.
Проанализированы полиморфизмы генов матриксной металлопротеиназы (ММР)-1, ММР-13, ИЛ-1, ИЛ-4, ИЛ-6, ИЛ-8, маннозо-связывающего лектина (MBL) и моноцитарного хемоаттрактантного белка (МСР)-1. 23 , 27 ). Эти краткосрочные исследования не показали существенных различий между генетическими полиморфизмами генов IL-8, MMP-13, MMP-1, IL-1, IL4, IL-8, MBL и реакцией на нехирургическое лечение пародонта (9).0037 23 ). Напротив, в проспективном лонгитюдном исследовании, проведенном D’Aiuto et al., у восприимчивых пациентов, носителей аллеля C полиморфизма IL-6-174 с генерализованным тяжелым пародонтитом, наблюдались худшие результаты пародонтологического лечения по сравнению с нечувствительными пациентами (). 28 ). Однако включение различных этнических популяций и различия в исследуемых переменных могут объяснить противоречивые результаты. Более конкретно, в один и тот же анализ были включены пациенты из Европы, Африки/Карибского бассейна и Азии, а не из конкретной этнической группы, а влияние генотипа на исход пародонтологического лечения определялось на основе уменьшения количества карманов, а не оценки какого-либо непрерывного пародонтальные параметры. Кроме того, тайваньское исследование показало, что генотип MCP-1-2518 A/G был в значительной степени связан с исходом нехирургического лечения пародонта, что определялось оценкой глубины зондирования, десневого индекса и индекса кровоточивости (9).0037 27 ). Однако данный полиморфизм гена повлиял на исход лечения только у больных с диагнозом агрессивный пародонтит, а не у больных с хроническим пародонтитом.
Кроме того, тайваньское исследование показало, что генотип MCP-1-2518 A/G был в значительной степени связан с исходом нехирургического лечения пародонта, что определялось оценкой глубины зондирования, десневого индекса и индекса кровоточивости (9).0037 27 ). Однако данный полиморфизм гена повлиял на исход лечения только у больных с диагнозом агрессивный пародонтит, а не у больных с хроническим пародонтитом.
Хотя имеются данные, подтверждающие, что факторы, связанные с пациентом, влияют на исход пародонтологического лечения и риск потери зубов ( 18 , 19 ), генетическая предрасположенность к хроническому пародонтиту, обусловленная наличием IL-6-572GG генотип ИЛ-10 или -59Аллель 2A не был связан с худшим исходом лечения в этом исследовании. Другие факторы, такие как курение, возраст и гигиена полости рта, могут быть более сильными факторами неблагоприятного исхода лечения, чем генетические факторы ( 29 ). Кроме того, системные заболевания, такие как сахарный диабет, могут повлиять на заживление пародонта и гомеостаз тканей после пародонтальной терапии ( 20 ). Чтобы свести к минимуму возможные смешанные факторы, набирали только системно здоровых пациентов. Кроме того, отсутствие связи между статусом курения и предрасположенностью к хроническому пародонтиту после поправки на множественные сравнения может быть связано с различными привычками курения (легкое, умеренное, интенсивное курение) включенной популяции.
Чтобы свести к минимуму возможные смешанные факторы, набирали только системно здоровых пациентов. Кроме того, отсутствие связи между статусом курения и предрасположенностью к хроническому пародонтиту после поправки на множественные сравнения может быть связано с различными привычками курения (легкое, умеренное, интенсивное курение) включенной популяции.
IL-6 представляет собой плеотропный цитокин, который способствует развитию хронического воспаления и резорбции костей посредством сложных взаимодействий ( 30 , 31 ). Поскольку полиморфизмы IL-6 связаны с повышенной воспалительной реакцией в первую очередь в присутствии пародонтальных патогенов, ген IL-6 может играть важную роль в патогенезе периодонтита ( 6 , 7 ). ИЛ-10 считается противовоспалительным цитокином, который подавляет иммунные и воспалительные реакции, что может защитить от резорбции кости (9).0037 32 ). Полиморфизмы в области промотора IL-10 -592 связаны со снижением продукции IL-10, что может привести к развитию заболеваний пародонта ( 9 ). Хотя оба полиморфизма связаны с повышенной воспалительной реакцией и, следовательно, играют важную роль в возникновении и прогрессировании заболевания, их влияние может не влиять на процесс заживления после пародонтологического лечения. ИЛ-6 и ИЛ-10, как показано в этом исследовании, могут не влиять на разрешение воспаления пародонта.
Хотя оба полиморфизма связаны с повышенной воспалительной реакцией и, следовательно, играют важную роль в возникновении и прогрессировании заболевания, их влияние может не влиять на процесс заживления после пародонтологического лечения. ИЛ-6 и ИЛ-10, как показано в этом исследовании, могут не влиять на разрешение воспаления пародонта.
Будущие исследования, охватывающие более крупные выборки с различными характеристиками, включая привычки к курению, различные бактериальные штаммы и системные заболевания из разных популяций и этнических групп, необходимы для дальнейшего изучения возможного влияния полиморфизма генов на результаты пародонтологического лечения в течение длительного периода времени. Кроме того, дальнейшие исследования должны включать большее количество пациентов с генерализованной формой хронического пародонтита (> 30% локализаций), чтобы определить, демонстрируют ли пациенты с большей степенью пародонтита существенные различия в отношении результатов лечения. Из-за критериев включения этого исследования (интерпроксимальный CAL ≥ 3 мм, PPD ≥ 5 мм и BOP в двух или более несмежных участках) в анализ были включены лица с локализованным и генерализованным пародонтитом.
Конфликт интересов:
Авторы заявляют об отсутствии потенциального конфликта интересов в отношении этой статьи.
1. Папапану П.Н., Санс М., Будунели Н., Дитрих Т., Ферес М., Файн Д.Х. и соавт. Пародонтит: согласованный отчет рабочей группы 2 Всемирного семинара 2017 г. по классификации пародонтальных и периимплантационных заболеваний и состояний. J Пародонтол. 2018. Июнь;89 Приложение 1: S173–82. 10.1002/JPER.17-0721 [PubMed] [CrossRef] [Google Scholar]
2. Kinane DF, Stathopoulou PG, Papapanou PN. Заболевания пародонта. 22 июня 2017 г.; 3:17038. [ПубМед]
3. Salvi GE, Lawrence HP, Offenbacher S, Beck JD. Влияние факторов риска на патогенез пародонтита. Periodontol 2000. 1997. Июнь; 14:173–201. 10.1111/j.1600-0757.1997.tb00197.x [PubMed] [CrossRef] [Google Scholar]
4. Michalowicz BS, Aeppli D, Virag JG, Klump DG, Hinrichs JE, Segal NL, et al.
Находки пародонта у взрослых близнецов.
J Пародонтол. 1991. Май; 62 (5): 293–9. 10.1902/jop.1991. 62.5.293 [PubMed] [CrossRef] [Google Scholar]
62.5.293 [PubMed] [CrossRef] [Google Scholar]
5. da Silva MK, de Carvalho ACG, Alves EHP, da Silva FRP, Pessoa LDS, Vasconcelos DFP.
Генетические факторы и риск развития пародонтита: результаты систематического обзора, состоящего из 13 исследований метаанализа с участием 71 531 человека.
Инт Дж. Дент. 2017;2017:1
3. 10.1155/2017/1
3 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
6. Fishman D, Faulds G, Jeffery R, Mohamed-Ali V, Yudkin JS, Humphries S, et al. Влияние новых полиморфизмов гена интерлейкина-6 (IL-6) на транскрипцию IL-6 и уровни IL-6 в плазме, а также связь с ювенильным хроническим артритом с системным началом. Джей Клин Инвест. 1998. 1 октября; 102 (7): 1369–76. 10.1172/JCI2629 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
7. Takahashi K, Takashiba S, Nagai A, Takigawa M, Myoukai F, Kurihara H, et al.
Оценка интерлейкина-6 в патогенезе заболеваний пародонта.
J Пародонтол. 1994. Февраль; 65 (2): 147–53. 10.1902/jop. 1994.65.2.147 [PubMed] [CrossRef] [Google Scholar]
1994.65.2.147 [PubMed] [CrossRef] [Google Scholar]
8. Koss K, Satsangi J, Fanning GC, Welsh KI, Jewell DP. Полиморфизмы цитокинов (TNF-альфа, LT-альфа и IL-10) при воспалительных заболеваниях кишечника и в норме: дифференциальные эффекты на продукцию и частоты аллелей. Гены Иммун. 2000. Февраль; 1 (3): 185–90. 10.1038/sj.gene.6363657 [PubMed] [CrossRef] [Google Scholar]
9. Claudino M, Trombone AFP, Cardoso CR. Широкие эффекты функционального промотора IL-10-592 полиморфизм: модуляция экспрессии IL-10, TIMP-3 и OPG и их связь с исходом заболевания пародонта. Дж. Лейкок Биол. 2008;84(6):1565–73. 10.1189/jlb.0308184 [PubMed] [CrossRef] [Google Scholar]
10. Шао М.Ю., Хуан П., Ченг Р., Ху Т. Полиморфизм интерлейкина-6 модифицирует риск пародонтита: систематический обзор и метаанализ. J Zhejiang Univ Sci B. 2009. Декабрь; 10 (12): 920–7. 10.1631/jzus.B0
11. Сонг Г.Г., Чой С.Дж., Джи Д.Д., Ли Ю. Х.
Связь между полиморфизмами промотора фактора некроза опухоли-α -308 A/G, -238 A/G, интерлейкина-6 -174 G/C и -572 G/C и заболеванием пародонта: метаанализ.
Mol Biol Rep. 2013. Август; 40 (8): 5191–203. 10.1007/s11033-013-2621-4 [PubMed] [CrossRef] [Google Scholar]
Х.
Связь между полиморфизмами промотора фактора некроза опухоли-α -308 A/G, -238 A/G, интерлейкина-6 -174 G/C и -572 G/C и заболеванием пародонта: метаанализ.
Mol Biol Rep. 2013. Август; 40 (8): 5191–203. 10.1007/s11033-013-2621-4 [PubMed] [CrossRef] [Google Scholar]
12. Li Y, Feng G, Deng Y, Song J. Вклад полиморфизмов интерлейкина-10-592 (-590, -597) C>A в восприимчивость к пародонтиту: обновленный метаанализ, основанный на 18 исследованиях случай-контроль. Дис маркеры. 2018. 19 сентября;2018:2645963. 10.1155/2018/2645963 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
13. Wong HC, Ooi Y, Pulikkotil SJ, Naing C. Роль трех полиморфизмов гена интерлейкина 10 (- 1082 A > G, - 819 C > T, - 592 A > C) в риске хронического и агрессивного периодонтита: метаанализ и последовательный анализ испытаний. Здоровье полости рта BMC. 2018. 22 октября; 18(1):171. 10.1186/s12903-018-0637-9 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
14. Graziani F, Karapetsa D, Mardas N, Leow N, Donos N. Хирургическое лечение остаточного пародонтального кармана.
Periodontol 2000. 2018. Февраль; 76(1):150–63. 10.1111/prd.12156 [PubMed] [CrossRef] [Google Scholar]
Хирургическое лечение остаточного пародонтального кармана.
Periodontol 2000. 2018. Февраль; 76(1):150–63. 10.1111/prd.12156 [PubMed] [CrossRef] [Google Scholar]
15. Mailoa J, Lin GH, Khoshkam V, MacEachern M, Chan HL, Wang HL. Долгосрочный эффект четырех хирургических методов лечения пародонта и одного нехирургического лечения: систематический обзор и метаанализ. J Пародонтол. 2015. Октябрь; 86 (10): 1150–8. 10.1902/jop.2015.150159 [PubMed] [CrossRef] [Google Scholar]
16. Lindhe J, Nyman S. Долгосрочное ведение пациентов, лечившихся от прогрессирующего пародонтита. Дж. Клин Пародонтол. 1984. Сентябрь; 11 (8): 504–14. 10.1111/j.1600-051X.1984.tb00902.x [PubMed] [CrossRef] [Google Scholar]
17. Hirschfeld L, Wasserman B. Долгосрочное обследование потери зубов у 600 пролеченных пациентов с пародонтитом. J Пародонтол. 1978. Май; 49 (5): 225–37. 10.1902/jop.1978.49.5.225 [PubMed] [CrossRef] [Google Scholar]
18. Chambrone L, Chambrone D, Lima LA, Chambrone LA. Предикторы потери зубов при длительном обслуживании пародонта: систематический обзор обсервационных исследований.
Дж. Клин Пародонтол. 2010. Июль; 37 (7): 675–84. 10.1111/j.1600-051X.2010.01587.x [PubMed] [CrossRef] [Google Scholar]
Предикторы потери зубов при длительном обслуживании пародонта: систематический обзор обсервационных исследований.
Дж. Клин Пародонтол. 2010. Июль; 37 (7): 675–84. 10.1111/j.1600-051X.2010.01587.x [PubMed] [CrossRef] [Google Scholar]
19. Heitz-Mayfield LJ. Прогрессирование заболевания: выявление групп и лиц высокого риска пародонтита. Дж. Клин Пародонтол. 2005;32 Приложение 6: 196–209. 10.1111/j.1600-051X.2005.00803.x [PubMed] [CrossRef] [Google Scholar]
20. Johnson NW, Griffiths GS, Wilton JM, Maiden MF, Curtis MA, Gillett IR, et al. Выявление групп и лиц высокого риска по заболеваниям пародонта. Доказательства существования групп и лиц высокого риска и подходы к их выявлению. Дж. Клин Пародонтол. 1988. Май; 15 (5): 276–82. 10.1111/j.1600-051X.1988.tb01584.x [PubMed] [CrossRef] [Google Scholar]
21. Cobb CM. Нехирургическая карманная терапия: механическая. Энн Пародонтолог. 1996. Ноябрь; 1 (1): 443–90. 10.1902/annals.1996.1.1.443 [PubMed] [CrossRef] [Google Scholar]
22. Yoshie H, Kobayashi T, Tai H, Galicia JC.
Роль генетических полиморфизмов в пародонтите.
Пародонтология 2000. 2007;43:102–32. 10.1111/j.1600-0757.2006.00164.x [PubMed] [CrossRef] [Google Scholar]
Yoshie H, Kobayashi T, Tai H, Galicia JC.
Роль генетических полиморфизмов в пародонтите.
Пародонтология 2000. 2007;43:102–32. 10.1111/j.1600-0757.2006.00164.x [PubMed] [CrossRef] [Google Scholar]
23. Chatzopoulos GS, Doufexi AE, Kalogirou F. Ассоциация восприимчивых генотипов к заболеваниям пародонта с клиническим исходом и выживаемостью зубов после нехирургического пародонтологического лечения: систематический обзор и метаанализ. Med Oral Patol Oral Cir Bucal. 2016. 1 января; 21 (1): e14–29.. 10.4317/medoral.20638 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
24. Chatzopoulos GS, Doufexi AE, Kouvatsi A. Клинический ответ на нехирургическое лечение пародонта у пациентов с полиморфизмами интерлейкина-6 и интерлейкина-10. Med Oral Patol Oral Cir Bucal. 2017. 1 июля; 22 (4): e446–57. 10.4317/medoral.21795 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
25. Armitage GC.
Разработка системы классификации заболеваний и состояний пародонта. Энн Пародонтолог. 1999. Декабрь; 4(1):1–6. 10.1902/annals.1999.4.1.1 [PubMed] [CrossRef] [Google Scholar]
Энн Пародонтолог. 1999. Декабрь; 4(1):1–6. 10.1902/annals.1999.4.1.1 [PubMed] [CrossRef] [Google Scholar]
26. Renvert S, Persson GR. Поддерживающая пародонтальная терапия. Пародонтология 2000. 2004;36:179–95. 10.1111/j.1600-0757.2004.03680.x [PubMed] [CrossRef] [Google Scholar]
27. Chang CW, Lin HH, Wu SY, Wu CY, Lai YL, Hung SL. Ассоциация полиморфизма гена моноцитарного хемоаттрактантного белка-1 -2518 A/G с исходом нехирургического пародонтологического лечения. J Formos Med Assoc. 2018. Март;117(3):191–6. 10.1016/j.jfma.2017.03.013 [PubMed] [CrossRef] [Google Scholar]
28. Д’Айуто Ф., Готовый Д., Паркар М., Тонетти М.С. Относительный вклад изменчивости, связанной с пациентом, зубом и участком, в клинические исходы поддесневой обработки. I. Зондирование глубин. J Пародонтол. 2005. Март; 76 (3): 398–405. 10.1902/jop.2005.76.3.398 [PubMed] [CrossRef] [Google Scholar]
29. Иоанну А.Л., Коцакис Г.А., Хинрихс Дж.Е.
Прогностические факторы пародонтологического лечения и их связь с результатами лечения. Мировые дела J Clin. 2014. 16 декабря; 2(12):822–7. 10.12998/wjcc.v2.i12.822 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Мировые дела J Clin. 2014. 16 декабря; 2(12):822–7. 10.12998/wjcc.v2.i12.822 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
30. Grossi SG, Genco RJ. Заболевания пародонта и сахарный диабет: двусторонняя связь. Энн Пародонтолог. 1998. Июль; 3 (1): 51–61. 10.1902/annals.1998.3.1.51 [PubMed] [CrossRef] [Google Scholar]
31. Fonseca JE, Santos MJ, Canhao H, Choy E. Интерлейкин-6 как ключевой игрок в системном воспалении и разрушении суставов. Autoimmun Rev. 2009. Июнь; 8 (7): 538–42. 10.1016/j.autrev.2009.01.012 [PubMed] [CrossRef] [Google Scholar]
32. де Ваал Малефит Р., Иссел Х., Ронкароло М.Г., Спитс Х., де Врис Дж.Е. Интерлейкин-10. Курр Опин Иммунол. 1992. Июнь; 4 (3): 314–20. 10.1016/0952-7915(92)-P [PubMed] [CrossRef] [Google Scholar]
| A690 | 77867 Некротизирующий язвенный|||
| B002 | Герпесвирусный гингивостоматит и фаринготонзиллит | ||
| B370 | Кандидозный стоматит | ||
| B3783 | Candidal cheilitis | ||
| D100 | Benign neoplasm of lip | ||
| D101 | Benign neoplasm of tongue | ||
| D102 | Benign neoplasm of floor of mouth | ||
| D1030 | Доброкачественное новообразование неуточненной части рта | ||
| D1039 | Доброкачественное новообразование других частей рта | ||
| D165 | Доброкачественное новообразование кости нижней челюсти | ||
| K000 | Anodontia | ||
| K001 | Supernumerary teeth | ||
| K002 | Abnormalities of size and form of teeth | ||
| K003 | Mottled teeth | ||
| K004 | Disturbances in tooth образование | ||
| K005 | Наследственные нарушения строения зубов, не классифицированные в других рубриках | ||
| K006 | Нарушения прорезывания зубов | ||
| K007 | Teething syndrome | ||
| K008 | Other disorders of tooth development | ||
| K009 | Disorder of tooth development, unspecified | ||
| K010 | Embedded teeth | ||
| K011 | Ретинированные зубы | ||
| K023 | Задержанный кариес | ||
| K0251 | Кариес зубов на поверхности ямок и фиссур, ограниченный эмалью | ||
| K0252 | Dental caries on pit and fissure surface penetrating into dentin | ||
| K0253 | Dental caries on pit and fissure surface penetrating into pulp | ||
| K0261 | Dental caries on smooth surface limited to enamel | ||
| K0262 | Кариес на гладкой поверхности с проникновением в дентин | ||
| K0263 | Кариес на гладкой поверхности с проникновением в пульпу | ||
| K027 | Dental root caries | ||
| K029 | Dental caries, unspecified | ||
| K030 | Excessive attrition of teeth | ||
| K031 | Abrasion of teeth | ||
| K032 | Erosion зубов | ||
| K033 | Патологическая резорбция зубов | ||
| K034 | Гиперцементоз | ||
| K035 | Ankylosis of teeth | ||
| K036 | Deposits [accretions] on teeth | ||
| K037 | Posteruptive color changes of dental hard tissues | ||
| K0381 | Cracked tooth | ||
| K0389 | Other specified болезни твердых тканей зубов | ||
| K039 | Болезни твердых тканей зубов неуточненные | ||
| K0401 | Обратимый пульпит | ||
| K0402 | Irreversible pulpitis | ||
| K041 | Necrosis of pulp | ||
| K042 | Pulp degeneration | ||
| K043 | Abnormal hard tissue formation in pulp | ||
| K044 | Acute apical периодонтит пульпового генеза | ||
| K045 | Хронический апикальный периодонтит | ||
| K046 | Периапикальный абсцесс с синусом | ||
| K047 | Periapical abscess without sinus | ||
| K048 | Radicular cyst | ||
| K0490 | Unspecified diseases of pulp and periapical tissues | ||
| K0499 | Other diseases of pulp and periapical tissues | ||
| K0500 | Острый гингивит, вызванный зубным налетом | ||
| K0501 | Острый гингивит, не вызванный зубным налетом | ||
| K0510 | Chronic gingivitis, plaque induced | ||
| K0511 | Chronic gingivitis, non-plaque induced | ||
| K0520 | Aggressive periodontitis, unspecified | ||
| K05211 | Aggressive periodontitis, localized, slight | ||
| K05212 | Агрессивный пародонтит, локализованный, умеренный | ||
| K05213 | Агрессивный пародонтит, локализованный, тяжелый | ||
| K05219 | Aggressive periodontitis, localized, unspecified severity | ||
| K05221 | Aggressive periodontitis, generalized, slight | ||
| K05222 | Aggressive periodontitis, generalized, moderate | ||
| K05223 | Aggressive periodontitis, генерализованный, тяжелый | ||
| K05229 | Агрессивный пародонтит, генерализованный, неуточненной степени тяжести | ||
| K0530 | Chronic periodontitis, unspecified | ||
| K05311 | Chronic periodontitis, localized, slight | ||
| K05312 | Chronic periodontitis, localized, moderate | ||
| K05313 | Chronic periodontitis, localized, severe | ||
| K05319 | Хронический пародонтит, локализованный, неуточненной степени тяжести | ||
| K05321 | Хронический пародонтит, генерализованный, легкий | ||
| K05322 | Chronic periodontitis, generalized, moderate | ||
| K05323 | Chronic periodontitis, generalized, severe | ||
| K05329 | Chronic periodontitis, generalized, unspecified severity | ||
| K054 | Periodontosis | ||
| K055 | Другие заболевания пародонта | ||
| K056 | Болезни пародонта неуточненные | ||
| K06010 | Localized gingival recession, unspecified | ||
| K06011 | Localized gingival recession, minimal | ||
| K06012 | Localized gingival recession, moderate | ||
| K06013 | Localized gingival recession, severe | ||
| K06020 | Генерализованная рецессия десны неуточненная | ||
| K06021 | Генерализованная рецессия десны, минимальная | ||
| K06022 | Generalized gingival recession, moderate | ||
| K06023 | Generalized gingival recession, severe | ||
| K061 | Gingival enlargement | ||
| K062 | Gingival and edentulous alveolar ridge lesions associated with trauma | ||
| K063 | Горизонтальная потеря альвеолярной кости | ||
| K068 | Другие уточненные поражения десны и беззубого альвеолярного гребня | ||
| K069 | Disorder of gingiva and edentulous alveolar ridge, unspecified | ||
| K080 | Exfoliation of teeth due to systemic causes | ||
| K08101 | Complete loss of teeth, unspecified cause, class I | ||
| K08102 | Полная потеря зубов по неустановленной причине, класс II | ||
| K08103 | Полная потеря зубов по неустановленной причине, класс III | ||
| K08104 | Полная потеря зубов, неопределенная причина, класс IV | ||
| K08109 | Полная потеря зубов, неопределенная причина. | ||
| K08112 | Полная потеря зубов в результате травмы II класса | ||
| K08113 | Полная потеря зубов в результате травмы III класса | ||
| K08114 | Полная потеря зубов из -за травмы, класс IV | ||
| K08119 | Полная потеря зубов из -за травмы. | ||
| K08122 | Полная потеря зубов вследствие заболеваний пародонта, II класс | ||
| K08123 | Полная потеря зубов вследствие заболеваний пародонта, III класс | ||
| K08124 | Полная потеря зубов из -за заболеваний пародонта, класс IV | ||
| K08129 | Полная потеря зубов из -за болезней Deperontal. класс I | ||
| K08132 | Полная потеря зубов из-за кариеса, класс II | ||
| K08133 | Полная потеря зубов из-за кариеса, класс III | ||
| K08134 | Полная потеря зубов из -за кариеса, класс IV | ||
| K08139 | Полная потеря зубов. класс I класс I | ||
| K08192 | Полная потеря зубов по другой уточненной причине, класс II | ||
| K08193 | Полная потеря зубов по другой уточненной причине, класс III | ||
| K08194 | Полная потеря зубов из -за другой указанной причины, класс IV | ||
| K08199 | Полная потеря зубов из -за других указанных причин, UNSPEPEPECEDIFIED CLASS 9078 9078 | гребень | | |
| K0821 | Минимальная атрофия нижней челюсти | ||
| K0822 | Умеренная атрофия нижней челюсти | ||
| Severe atrophy of the mandible | |||
| K0824 | Minimal atrophy of maxilla | ||
| K0825 | Moderate atrophy of the maxilla | ||
| K0826 | Severe atrophy of the maxilla | ||
| K083 | Retained корень зуба | ||
| K08401 | Частичная потеря зубов по неустановленной причине, класс I | ||
| K08402 | Частичная потеря зубов по неустановленной причине, класс II | ||
| K08403 | Partial loss of teeth, unspecified cause, class III | ||
| K08404 | Partial loss of teeth, unspecified cause, class IV | ||
| K08409 | Partial loss of teeth, unspecified cause, unspecified класс | ||
| K08411 | Частичная потеря зубов в результате травмы, класс I | ||
| K08412 | Частичная потеря зубов в результате травмы, класс II | ||
| K08413 | Частичная потеря зубов из -за травмы, класс III | ||
| K08414 | Частичная потеря зубов. | ||
| K08421 | Частичная потеря зубов при заболеваниях пародонта, I класс | ||
| K08422 | Частичная потеря зубов при заболеваниях пародонта, II класс | ||
| K08423 | Частичная потеря зубов из -за заболеваний пародонта, класс III | ||
| K08424 | ЧАСТИЧЕСКИЙ ПОЗИТ ЗУБОЛОВ. неуточненный класс | ||
| K08431 | Частичная потеря зубов из-за кариеса, класс I | ||
| K08432 | Частичная потеря зубов из-за кариеса, класс II | ||
| K08433 | Частичная потеря зубов из -за кариеса, класс III | ||
| K08434 | Частичная потеря зубов из -за кари -кари, класс IV 9078 | . класс | |
| K08491 | Частичная потеря зубов по другой уточненной причине, класс I | ||
| K08492 | Частичная потеря зубов по другой уточненной причине, класс II | ||
| K08493 | Частичная потеря зубов из -за другой указанной причины, класс III | ||
| K08494 | Частичная потеря зубов из -за других специфических причина, класс IV 9078 | Частичная потеря зубов, из -за других специфических причина, класс IV 9078 9078 | . по другой уточненной причине, неуточненный класс по другой уточненной причине, неуточненный класс |
| K0850 | Неудовлетворительная реставрация зуба, неуточненная | ||
| K0851 | Открытые края реставрации зуба | ||
| K0852 | Unrepairable overhanging of dental restorative materials | ||
| K08530 | Fractured dental restorative material without loss of material | ||
| K08531 | Fractured dental restorative material with loss of material | ||
| K08539 | Сломанный стоматологический реставрационный материал, неуточненный | ||
| K0854 | Контур существующей реставрации зуба, биологически несовместимой со здоровьем полости рта | ||
| K0855 | Allergy to existing dental restorative material | ||
| K0856 | Poor aesthetic of existing restoration of tooth | ||
| K0859 | Other unsatisfactory restoration of tooth | ||
| K0881 | Primary occlusal trauma | ||
| K0882 | Вторичная жевательная травма | ||
| K0889 | Другие уточненные заболевания зубов и опорных структур | ||
| K089 | Disorder of teeth and supporting structures, unspecified | ||
| K090 | Developmental odontogenic cysts | ||
| K091 | Developmental (nonodontogenic) cysts of oral region | ||
| K098 | Other cysts of ротовая полость, не классифицированная в других рубриках | ||
| K099 | Киста ротовой полости неуточненная | ||
| K120 | Рецидивирующие ротовые афты | ||
| K121 | Other forms of stomatitis | ||
| K122 | Cellulitis and abscess of mouth | ||
| K1230 | Oral mucositis (ulcerative), unspecified | ||
| K1231 | Oral mucositis (ulcerative) due к противоопухолевой терапии | ||
| K1232 | Оральный мукозит (язвенный), вызванный другими препаратами | ||
| K1233 | Оральный мукозит (язвенный), вызванный облучением | ||
| K1239 | Other oral mucositis (ulcerative) | ||
| K130 | Diseases of lips | ||
| K131 | Cheek and lip biting | ||
| K1321 | Leukoplakia of oral mucosa, including tongue | ||
| K1322 | Минимально ороговевшая остаточная слизистая гребня | ||
| K1323 | Избыточно ороговевшая остаточная слизистая гребня | ||
| K1324 | Leukokeratosis nicotina palati | ||
| K1329 | Other disturbances of oral epithelium, including tongue | ||
| K133 | Hairy leukoplakia | ||
| K134 | Granuloma and granuloma-like lesions of oral mucosa | ||
| K135 | Подслизистый фиброз полости рта | ||
| K136 | Раздражающая гиперплазия слизистой оболочки полости рта | ||
| K1370 | Неуточненные поражения слизистой оболочки полости рта | ||
| K1379 | Other lesions of oral mucosa | ||
| K140 | Glossitis | ||
| K141 | Geographic tongue | ||
| K142 | Median rhomboid glossitis | ||
| K143 | Hypertrophy of tongue papillae | ||
| K144 | Атрофия сосочков языка | ||
| K145 | Складчатый язык | ||
| K146 | Glossodynia | ||
| K148 | Other diseases of tongue | ||
| K149 | Disease of tongue, unspecified | ||
| M2600 | Unspecified anomaly of jaw size | ||
| M2601 | Maxillary hyperplasia | ||
| M2602 | Гипоплазия верхней челюсти | ||
| M2603 | Гиперплазия нижней челюсти | ||
| M2604 | Гипоплазия нижней челюсти | ||
| M2605 | Macrogenia | ||
| M2606 | Microgenia | ||
| M2607 | Excessive tuberosity of jaw | ||
| M2609 | Other specified anomalies of jaw size | ||
| M2610 | Unspecified anomaly of соотношение челюсти и основания | ||
| M2611 | Верхнечелюстная асимметрия | ||
| M2612 | Другая асимметрия челюсти | ||
| M2619 | Other specified anomalies of jaw-cranial base relationship | ||
| M2620 | Unspecified anomaly of dental arch relationship | ||
| M26211 | Malocclusion, Angle’s class I | ||
| M26212 | Malocclusion, Класс Энгла II | ||
| M26213 | Аномалия прикуса, класс Энгла III | ||
| M26219 | Аномалия прикуса, класс Энгла, неуточненный | ||
| M26220 | Open anterior occlusal relationship | ||
| M26221 | Open posterior occlusal relationship | ||
| M2623 | Excessive horizontal overlap | ||
| M2624 | Reverse articulation | ||
| M2625 | Anomalies of межзубное расстояние | ||
| M2629 | Другие аномалии соотношения зубных дуг | ||
| M2630 | Unspecified anomaly of tooth position of fully erupted tooth or teeth | ||
| M2631 | Crowding of fully erupted teeth | ||
| M2632 | Excessive spacing of fully erupted teeth | ||
| M2633 | Horizontal displacement of fully erupted зуб или зубы | ||
| M2634 | Вертикальное смещение полностью прорезавшегося зуба или зубов | ||
| M2635 | Вращение полностью прорезавшегося зуба или зубов | ||
| M2636 | Insufficient interocclusal distance of fully erupted teeth (ridge) | ||
| M2637 | Excessive interocclusal distance of fully erupted teeth | ||
| M2639 | Other anomalies of tooth position of fully erupted tooth or teeth | ||
| M264 | Неправильный прикус неуточненный | ||
| M2650 | Челюстно-лицевые функциональные нарушения, неуточненные | ||
| M2651 | Abnormal jaw closure | ||
| M2652 | Limited mandibular range of motion | ||
| M2653 | Deviation in opening and closing of the mandible | ||
| M2654 | Insufficient anterior guidance | ||
| M2655 | Максимальное межбугорковое расхождение центральной окклюзии | ||
| M2656 | Интерференция с нерабочей стороны | ||
| M2657 | Lack of posterior occlusal support | ||
| M2659 | Other dentofacial functional abnormalities | ||
| M26601 | Right temporomandibular joint disorder, unspecified | ||
| M26602 | Left temporomandibular joint disorder, unspecified | ||
| M26603 | Двустороннее поражение височно-нижнечелюстного сустава неуточненное | ||
| M26609 | Неуточненное поражение височно-нижнечелюстного сустава, неуточненная сторона | ||
| M26611 | Adhesions and ankylosis of right temporomandibular joint | ||
| M26612 | Adhesions and ankylosis of left temporomandibular joint | ||
| M26613 | Adhesions and ankylosis of bilateral temporomandibular joint | ||
| M26619 | Adhesions и анкилоз височно-нижнечелюстного сустава неуточненной стороны | ||
| M26621 | Артралгия правого височно-нижнечелюстного сустава | ||
| M26622 | Arthralgia of left temporomandibular joint | ||
| M26623 | Arthralgia of bilateral temporomandibular joint | ||
| M26629 | Arthralgia of temporomandibular joint, unspecified side | ||
| M26631 | Articular disc disorder of right височно-нижнечелюстной сустав | ||
| M26632 | Поражение суставного диска левого височно-нижнечелюстного сустава | ||
| M26633 | Articular disc disorder of bilateral temporomandibular joint | ||
| M26639 | Articular disc disorder of temporomandibular joint, unspecified side | ||
| M2669 | Other specified disorders of temporomandibular joint | ||
| M2670 | Unspecified альвеолярная аномалия | ||
| M2671 | Альвеолярная верхнечелюстная гиперплазия | ||
| M2672 | Alveolar mandibular hyperplasia | ||
| M2673 | Alveolar maxillary hypoplasia | ||
| M2674 | Alveolar mandibular hypoplasia | ||
| M2679 | Other specified alveolar anomalies | ||
| M2681 | Anterior soft tissue impingement | ||
| M2682 | Задний импинджмент мягких тканей | ||
| M2689 | Другие зубочелюстные аномалии | ||
| M269 | Dentofacial anomaly, unspecified | ||
| M270 | Developmental disorders of jaws | ||
| M271 | Giant cell granuloma, central | ||
| M272 | Inflammatory conditions of jaws | ||
| M273 | Альвеолит челюстей | ||
| M2740 | Киста челюсти неуточненная | ||
| M2749 | Другие кисты челюсти | ||
| M2751 | Perforation of root canal space due to endodontic treatment | ||
| M2752 | Endodontic overfill | ||
| M2753 | Endodontic underfill | ||
| M2759 | Other periradicular pathology associated with previous endodontic treatment | ||
| M2761 | Остеоинтеграционная недостаточность зубного имплантата | ||
| M2762 | Биологическая несостоятельность зубного имплантата после остеоинтеграции | ||
| M2763 | Post-osseointegration mechanical failure of dental implant | ||
| M2769 | Other endosseous dental implant failure | ||
| M278 | Other specified diseases of jaws | ||
| M279 | Disease of jaws, не уточнено | ||
| Q184 | Макростомия | ||
| Q185 | Микростомия | ||
| Q186 | 8 Макрохейл0778 | ||
| Q187 | Microcheilia | ||
| Q351 | Cleft hard palate | ||
| Q353 | Cleft soft palate | ||
| Q355 | Cleft hard palate with cleft soft palate | ||
| Q357 | Cleft язычок | ||
| Q359 | Расщелина неба неуточненная | ||
| Q360 | Расщелина губы двусторонняя | ||
| Q3761 | Cleft lip, median | ||
| Q369 | Cleft lip, unilateral | ||
| Q370 | Cleft hard palate with bilateral cleft lip | ||
| Q371 | Cleft hard palate with unilateral cleft lip | ||
| Q372 | Расщелина мягкого неба с двусторонней расщелиной губы | ||
| Q373 | Расщелина мягкого неба с односторонней расщелиной губы0778 | ||
| Q375 | Cleft hard and soft palate with unilateral cleft lip | ||
| Q378 | Unspecified cleft palate with bilateral cleft lip | ||
| Q379 | Unspecified cleft palate with unilateral cleft lip | ||
| Q380 | Врожденные аномалии губ, не классифицированные в других рубриках0778 | ||
| Q383 | Other congenital malformations of tongue | ||
| Q386 | Other congenital malformations of mouth | ||
| R6884 | Jaw pain | ||
| S01501A | Unspecified open wound of lip, initial encounter | ||
| S01502A | Открытая рана полости рта неуточненная, первое попадание | ||
| S01511A | Разрыв губы без инородного тела, первое попадание | ||
| S01512A | Laceration without foreign body of oral cavity, initial encounter | ||
| S01521A | Laceration with foreign body of lip, initial encounter | ||
| S01522A | Laceration with foreign body of oral cavity, initial encounter | ||
| S01531A | Колотая рана без инородного тела губы, первичная встреча | ||
| S01532A | Колотая рана без инородного тела полости рта, первичная встреча | ||
| S01541A | Puncture wound with foreign body of lip, initial encounter | ||
| S01542A | Puncture wound with foreign body of oral cavity, initial encounter | ||
| S01551A | Open bite of lip, initial encounter | ||
| S01552A | Открытый прикус полости рта, первый контакт | ||
| S02400A | Перелом скуловой кости, неуточненная сторона, первый контакт по поводу закрытого перелома | ||
| S02400B | Malar fracture, unspecified side, initial encounter for open fracture | ||
| S02401A | Maxillary fracture, unspecified side, initial encounter for closed fracture | ||
| S02401B | Maxillary fracture, unspecified side, initial контакт по поводу открытого перелома | ||
| S02402A | Перелом скуловой кости неуточненной стороны, первый контакт по поводу закрытого перелома | ||
| S02402B | Zygomatic fracture, unspecified side, initial encounter for open fracture | ||
| S0240AA | Malar fracture, right side, initial encounter for closed fracture | ||
| S0240AB | Malar fracture, right side, initial encounter for открытый перелом | ||
| S0240BA | Перелом скуловой кости, левая сторона, первичное обнаружение закрытого перелома | ||
| S0240BB | Перелом скулы, левая сторона, первичное обнаружение открытого перелома | ||
| S0240CA | Maxillary fracture, right side, initial encounter for closed fracture | ||
| S0240CB | Maxillary fracture, right side, initial encounter for open fracture | ||
| S0240DA | Maxillary fracture, left side, initial | ||
| S0240DB | Перелом верхней челюсти, левая сторона, начальный контакт при открытом переломе | ||
| S0240EA | Перелом скуловой кости, правая сторона, первичное столкновение при закрытом переломе | ||
| S0240EB | Перелом скуловой кости, правая сторона, первичное столкновение с открытым переломом | ||
| S0240FA | 7 закрытый перелом слева | ||
| S0240FB | Перелом скуловой кости, левая сторона, первичное столкновение при открытом переломе | ||
| S02411A | Перелом ЛеФорта I, первичное столкновение с закрытым переломом | ||
| S02411B | LeFort I fracture, initial encounter for open fracture | ||
| S02412A | LeFort II fracture, initial encounter for closed fracture | ||
| S02412B | LeFort II fracture, initial encounter for open fracture | ||
| S02413A | Перелом ЛеФорта III, первое столкновение с закрытым переломом | ||
| S02413B | Перелом ЛеФорта III, первое столкновение с открытым переломом | ||
| S025XXA | Fracture of tooth (traumatic), initial encounter for closed fracture | ||
| S025XXB | Fracture of tooth (traumatic), initial encounter for open fracture | ||
| S02600A | Fracture of unspecified part of тело нижней челюсти, неуточненная сторона, первичное обнаружение закрытого перелома | ||
| S02600B | Перелом неуточненной части тела нижней челюсти, неуточненная сторона, первичное обнаружение открытого перелома | ||
| S02601A | Fracture of unspecified part of body of right mandible, initial encounter for closed fracture | ||
| S02601B | Fracture of unspecified part of body of right mandible, initial encounter for open fracture | ||
| S02602A | Перелом неуточненной части тела левой нижней челюсти, первичный контакт по поводу закрытого перелома | ||
| S02602B | Перелом неуточненной части тела левой нижней челюсти, первичный контакт по поводу открытого перелома | ||
| S02609A | Fracture of mandible, unspecified, initial encounter for closed fracture | ||
| S02609B | Fracture of mandible, unspecified, initial encounter for open fracture | ||
| S02610A | Fracture of condylar process of mandible, неуточненная сторона, первичное обнаружение закрытого перелома | ||
| S02610B | Перелом мыщелкового отростка нижней челюсти, неуточненная сторона, первичное обнаружение открытого перелома | ||
| S02611A | Fracture of condylar process of right mandible, initial encounter for closed fracture | ||
| S02611B | Fracture of condylar process of right mandible, initial encounter for open fracture | ||
| S02612A | Fracture of condylar отростка левой нижней челюсти, первое обнаружение при закрытом переломе | ||
| S02612B | Перелом мыщелкового отростка левой нижней челюсти, первое обнаружение при открытом переломе | ||
| S02620A | Fracture of subcondylar process of mandible, unspecified side, initial encounter for closed fracture | ||
| S02620B | Fracture of subcondylar process of mandible, unspecified side, initial encounter for open fracture | ||
| S02621A | Перелом подмыщелкового отростка правой нижней челюсти, первичный контакт при закрытом переломе | ||
| S02621B | Перелом подмыщелкового отростка правой нижней челюсти, первичный контакт при открытом переломе | ||
| S02622A | Fracture of subcondylar process of left mandible, initial encounter for closed fracture | ||
| S02622B | Fracture of subcondylar process of left mandible, initial encounter for open fracture | ||
| S02630A | Fracture of coronoid отростка нижней челюсти, неуточненная сторона, первичное обнаружение закрытого перелома | ||
| S02630B | Перелом венечного отростка нижней челюсти, неуточненная сторона, первичное обнаружение открытого перелома | ||
| S02631A | Fracture of coronoid process of right mandible, initial encounter for closed fracture | ||
| S02631B | Fracture of coronoid process of right mandible, initial encounter for open fracture | ||
| S02632A | Fracture of coronoid отростка левой нижней челюсти, первое обнаружение при закрытом переломе | ||
| S02632B | Перелом венечного отростка левой нижней челюсти, первое обнаружение при открытом переломе | ||
| S02640A | Fracture of ramus of mandible, unspecified side, initial encounter for closed fracture | ||
| S02640B | Fracture of ramus of mandible, unspecified side, initial encounter for open fracture | ||
| S02641A | Fracture ветви правой нижней челюсти, первое обнаружение по поводу закрытого перелома | ||
| S02641B | Перелом ветви правой нижней челюсти, первое обнаружение по поводу открытого перелома | ||
| S02642A | Fracture of ramus of left mandible, initial encounter for closed fracture | ||
| S02642B | Fracture of ramus of left mandible, initial encounter for open fracture | ||
| S02650A | Fracture of angle of mandible | ||
| S02650B | Перелом угла нижней челюсти, неуточненная сторона, первичное обнаружение открытого перелома | ||
| S02651A | Fracture of angle of right mandible, initial encounter for closed fracture | ||
| S02651B | Fracture of angle of right mandible, initial encounter for open fracture | ||
| S02652A | Fracture of angle of left нижняя челюсть, первый контакт при закрытом переломе | ||
| S02652B | Перелом угла левой нижней челюсти, первый контакт при открытом переломе | ||
| S0266XA | Fracture of symphysis of mandible, initial encounter for closed fracture | ||
| S0266XB | Fracture of symphysis of mandible, initial encounter for open fracture | ||
| S02670A | Fracture of alveolus of mandible, unspecified side, initial контакт по поводу закрытого перелома | ||
| S02670B | Перелом альвеолы нижней челюсти неуточненной стороны, первичный контакт по поводу открытого перелома | ||
| S02671A | Перелом альвеолы правой нижней челюсти, первоначальная встреча с закрытым переломом | ||
| S02671B | ФРКРАКТ АЛАВАЛА СТРАНСКОЙ СТРАН, НАЧИНА НА РИТКАНСКОЙ СТАВОЙ МАНДА, НАЧИНА НА РИТКАНСКОЙ СТАВОЙ МАНДИВНОЙ, Начальный, наступающий на начало 9078 9077. естественных зубов у пациентов с леченным хроническим пародонтитом: новое исследование естественных зубов у пациентов с леченным хроническим пародонтитом: новое исследование AbstractЗубные имплантаты широко используются для замены существующих и отсутствующих зубов. Долгосрочная выживаемость зубных имплантатов хорошо описана в литературе. Длительное сохранение зубов у пациентов с потерей костной массы от умеренной до выраженной, которые лечатся пародонтологической терапией и участвуют в программах поддерживающей терапии пародонта, дает аналогичные или более высокие показатели долгосрочного успеха. Недавнее исследование, сравнивающее уровень ретенции между зубными имплантатами и естественными зубами в течение 10 или более лет у пациентов с хроническим заболеванием пародонта в анамнезе, показало, что зубные имплантаты теряются в 10 раз чаще, чем естественные зубы, потерянные из-за заболеваний пародонта. . В связи с растущей популярностью полного удаления зубов и замены протезами с опорой на имплантаты вместо зубосохраняющей пародонтальной терапии выбор случая должен быть рассмотрен до установки имплантатов. Долгосрочная выживаемость зубных имплантатов хорошо описана в литературе 1 и является методом лечения, широко применяемым в обычных стоматологических кабинетах. Точно так же ретенция пародонтально леченых зубов с потерей костной массы от умеренной до выраженной имеет аналогичные или более высокие показатели долгосрочного успеха. 2 Даже естественные зубы, страдающие выраженной потерей костной массы с прогнозом от осторожного до неблагоприятного, при лечении начальной, хирургической и поддерживающей терапией имеют высокие показатели долгосрочного успеха в литературе. 3,4 В литературе также показано, что пациенты, которые придерживаются строгих гигиенических назначений в сочетании с тщательным уходом на дому, могут предотвратить прогрессирование заболеваний пародонта и сохранить свои зубы в течение длительного периода времени. 5 Анализ ретроспективного исследования В недавнем ретроспективном исследовании с 10-летним наблюдением оценивалась долгосрочная выживаемость естественных зубов по сравнению с дентальными имплантатами у 58 пациентов, которые лечились от хронических заболеваний пародонта и затем были включены в исследование. С другой стороны, потеря зубных имплантатов была в 10 раз выше, 0,4 имплантата потеряны на пациента в год. Девяносто процентов зубов с пародонтальными нарушениями, пролеченных активной пародонтальной терапией (т. е. скейлингом/шлифованием корней, хирургическим вмешательством, уходом за пародонтом), выжили в течение 10-летнего периода исследования. Кроме того, количество зубов с сомнительным прогнозом на исходном уровне уменьшилось в 1,9 раза.%, а зубы с хорошим прогнозом увеличились на 3,6%. Общая выживаемость имплантатов в этой исследуемой популяции составила 90 %, при этом 100 % имплантатов прижились до пяти лет, а затем 10,08 % вышли из строя в диапазоне от шести до 10 лет. Результаты этого исследования согласуются с другими исследованиями, предполагающими, что пациенты с заболеваниями пародонта в анамнезе более подвержены отторжению имплантата в течение длительного периода его функционирования, возможно, из-за бактериального дисбактериоза, смешанного с увеличением продукции цитокинов, таких как интерлейкин-1, интерлейкин-6, фактор некроза опухоли альфа и бета. Другим интересным открытием исследования было то, что за 10-летний период наблюдения имплантаты с глубиной зондирования 6 или более и потерей кости 50 % или более увеличились на 13,5 % и 3,1 % соответственно, в то время как естественные зубы уменьшились. 8% и 10,7% соответственно. Это предполагает, что прогноз для зубов увеличился за период исследования, в то время как прогноз для имплантатов снизился. Кроме того, пациенты с глубиной зондирования 5 и более и/или с полным ротовым кровотечением 25% и более имели значительно повышенный риск периимплантатных заболеваний, что подчеркивает важность контроля заболеваний пародонта у пациентов, являющихся кандидатами на имплантационную терапию. 8 Авторы данного исследования утверждают: Принято считать, что зубы с неблагоприятным прогнозом не следует лечить пародонтологически, так как прогноз комплексной терапии может не соответствовать высокому уровню успешности имплантационного лечения. Исторически считалось, что у пациента с заболеванием пародонта после удаления зубов и начала имплантационной терапии патогены, вызывающие пародонтальную потерю зубов, будут уничтожены и, следовательно, не повлияют на зубной имплантат. 10 Более поздняя литература предполагает, что это неточно, и пациенты с хроническим или агрессивным заболеванием пародонта могут страдать от большего количества биологических осложнений при имплантационной терапии. 11 Только что выпущенный важный документ, в котором оценивается сложность удаления пародонтальных патогенов из полости рта: Повторное заселение обработанных пародонтальных карманов микробными патогенами может также исходить из нескольких ротовых резервуаров, включая эпителий и собственную пластинку стенки кармана. Одно из следствий этой статьи заключается в том, что после удаления зубов с нарушенным пародонтом поверхности зубных имплантатов могут быть колонизированы потенциально болезнетворными пародонтальными патогенами без адекватного контроля биопленки в общей среде полости рта. Это применимо даже в случаях полного удаления полости рта с немедленной или отсроченной имплантационной терапией. Принятие решения о лечении В заключение, при выборе между сохранением естественного зубного ряда и удалением и установкой имплантатов необходимо учитывать множество факторов. В дополнение к показателям долгосрочного успеха практикующий врач и пациент должны оценить долгосрочных экономических последствий пациенту придется терпеть. С повсеместным внедрением полного удаления зубов и последующего лечения полными зубными протезами, поддерживаемыми имплантатами, усилилось стремление к удалению зубов, которые можно спасти с помощью пародонтологического лечения. Примечание редактора: Первоначально эта статья была опубликована в Perio-Implant Advisory , ресурсе для стоматологов и гигиенистов, посвященном проблемам, связанным с пародонтом и имплантатами. Читайте больше статей и подписывайтесь на рассылку. Ссылки
Скотт Фрум, доктор медицинских наук, выпускник Университета штата Нью-Йорк, Школа стоматологической медицины Стони Брук, работает пародонтологом в частной практике в 1110 2nd Avenue, Suite 305, Нью-Йорк, Нью-Йорк. Он является редакционным директором Perio-Implant Advisory и входит в редакционный консультативный совет Dental Economics . Доктор Фрум, дипломат Американского совета по пародонтологии, является клиническим доцентом в Школе стоматологической медицины SUNY Stony Brook на кафедре пародонтологии. Он входит в совет редакционных консультантов Академии остеоинтеграции Новости Академии . Свяжитесь с ним через его веб-сайт по адресу drscottfroom.com или (212) 751-8530. Состав бактериального сообщества при хроническом периодонтите и новые места отбора проб из полости рта для выявления индикаторов заболевания | Микробиом
Микробиом том 2 , номер статьи: 32 (2014) Процитировать эту статью
РефератИстория вопроса Пародонтит — инфекционно-воспалительное заболевание полимикробной этиологии, которое может приводить к разрушению костей и тканей, поддерживающих зубы. Результаты Используя ДНК SubG, SupG и бляшки на языке от 11 здоровых и 13 больных субъектов, мы секвенировали области V3 (приблизительно 200 оснований) гена 16S рРНК, используя секвенирование Illumina. После качественной фильтрации примерно 4,1 миллиона последовательностей были объединены в рабочие таксономические единицы (OTU; порог идентичности последовательностей >97%), которые были классифицированы в общей сложности до 19 типов, охватывающих 114 родов. Выводы Это исследование впервые демонстрирует, что SupG и бляшки на спинке языка могут служить альтернативными источниками для обнаружения и подсчета известных и новых бактериальных биомаркеров ХП. Фон Бактериальные сообщества, колонизирующие организм человека, тесно связаны с физиологией хозяина, его иммунитетом, метаболизмом и питанием [1–3]. Из мест колонизации во рту находится бактериальный консорциум с высоким таксономическим богатством и филогенетическим разнообразием [4–6]. Микробный состав биопленки зубного налета играет решающую роль в здоровье полости рта. Нарушение гомеостаза зубного налета может стимулировать разрушение тканей и воспаление, приводя к таким инфекциям, как кариес, гингивит и пародонтит [4, 7]. Всестороннее и систематическое профилирование биопленки полости рта необходимо не только для понимания микробных ассоциаций с локализованными инфекциями, но и потому, что микробиом полости рта уже давно известен как резервуар инфекций в других участках тела [8, 9]. Пародонтит — хроническое воспалительное заболевание, поражающее опорные структуры зуба, включая альвеолярную кость, соединительнотканное прикрепление и десну [14, 15]. Хотя известно несколько форм заболеваний пародонта, преобладающей категорией является хронический пародонтит (ХП), который остается основной причиной потери зубов у взрослых во всем мире [16]. В дополнение к своему большому социально-экономическому бремени [17], ХП связан со значительной заболеваемостью с точки зрения боли, дискомфорта при жевании, неприятного запаха изо рта и миграции зубов. За последние два десятилетия культуральные, иммуногистохимические и молекулярные методы были сосредоточены в основном на небольшом подмножестве микроорганизмов, ассоциированных с СР, в десневой борозде и, таким образом, упустили из виду влияние потенциально большого числа других видов бактерий полости рта на десневую борозду. инфекционный процесс [22–24]. Хотя эти еще не идентифицированные микроорганизмы не всегда могут быть тесно связаны с пародонтом во все времена, все же вероятно, что некоторые из них в тот или иной момент времени участвуют в патофизиологических процессах, которые приводят к прогрессированию ХП и вызывают его. Недавно подходы высокопроизводительного секвенирования позволили оценить бактериальный состав в глубоких и поверхностных образцах SubG, полученных от пациентов с пародонтитом, по сравнению со здоровыми пациентами [25]. Результаты показали, что пациенты с пародонтитом имели более разнообразные комбинации видов, но также имели все виды, связанные со здоровьем, хотя и с меньшей частотой. В этом исследовании мы использовали анализы гена 16S рРНК для изучения бактериальных сообществ, связанных со здоровьем пародонта и парадонтитом, используя зубной налет, извлеченный из SubG и супрагингивального (SupG), а также участков на спинке языка. Мы предположили, что между ХП и здоровыми пациентами будут существовать устойчивые различия в бактериальных сообществах как зубного налета, так и налета на языке, и что эти различия будут в значительной степени связаны с известными таксонами, связанными с заболеванием, а также с другими, еще не охарактеризованными бактериями. РезультатыДемографические данные, клинические признаки и секвенирование Для этого исследования были набраны пятнадцать женщин и девять мужчин в возрасте от 18 до 71 года. Когорта со здоровым пародонтом состояла из восьми женщин и трех мужчин в возрасте от 18 до 56 лет; группа ХП состояла из семи женщин и шести мужчин в возрасте от 25 до 71 года (таблица 1). Диагноз ХП был поставлен на основании рентгенологического и клинического обследования. Параметры, полученные в результате клинической оценки, включали глубину зондирования и потерю клинического прикрепления (CAL). Потеря костной массы на каждом зубе оценивалась рентгенологически. У пациентов в группе ХП было >30% участков с CAL ≥5 мм и глубиной карманов при зондировании ≥6 мм, тогда как в здоровой группе было >30% участков с потерей прикрепления ≤2 мм и отсутствием карманов >3 мм. В исследование не были включены пациенты с системными заболеваниями, приемом антибиотиков и чисткой зубов в течение 6 месяцев. Полноразмерная таблица Для сравнения состава бактериального сообщества между участниками со здоровым пародонтом и пациентами с ХП ДНК, выделенную из зубного налета, подвергали ПЦР-амплификации с использованием праймеров, покрывающих приблизительно 200-пн сегмента области V3 гена 16S рРНК. Секвенирование ДНК дало примерно 5,8 миллиона последовательностей, из которых минимум 27 187 последовательностей на образец (в среднем 57 441 ± 23 336), а анализ между образцами сократил все данные образцов до 27 187 последовательностей. Прогрессирующие заболевания пародонта не коррелируют с изменениями в α-разнообразии Недавние исследования, направленные на оценку разнообразия бактериальных сообществ в конкретных местах, выявили значительные изменения в таксономическом составе в зависимости от состояния здоровья по сравнению с заболеванием [25, 27, 28]. Следовательно, мы исследовали, может ли состав сообщества биопленки в когорте CP коррелировать с последовательными изменениями в разнообразии OTU. Расчет альфа-разнообразия для здоровых (красный) и больных (синий) образцов. Не наблюдалось существенных различий между здоровыми и больными образцами для различных показателей α-разнообразия. Расчеты и графики были созданы с использованием программного пакета Phyloseq. (A) Все образцы (SubG, SupG и язык) объединены. (B) Образцы SubG. (C) Образцы SupG. (D) Образцы языка. Полноразмерное изображение Язык содержит уникальный консорциум, а деструкция пародонта связана со слабо выраженным сдвигом относительно здоровья Для оценки структурного сходства в сообществах биопленок между SupG, SubG и участками образцов языка у здоровых и больных пациентов была применена процедура перестановки множественных ответов (MRPP) был использован анализ, основанный на матрице расстояний Брея-Кертиса. Диаграмма Брея-Кертиса, основанная на неметрическом многомерном масштабировании (NMDS) для всех образцов. Полноразмерное изображение Рис. 3 График анализа главных координат (PCoA) с несоответствием Брея-Кертиса. Результаты показали, что образцы языка сгруппированы отдельно от образцов зубов (SubG и SupG), что позволяет предположить, что сообщество языка относительно уникально по сравнению с таковым в участках SupG и SubG. Никакой очевидной кластеризации не было видно внутри или между образцами SupG и SubG. (A) Bray-Curtis PCoA ординация объединенных образцов SupG, SubG и языка. (B) Ординация образцов SubG. Образцы здоровых пациентов показаны зеленым цветом, образцы больных пациентов — бледно-красным. Изображение в натуральную величину Дальнейшее исследование было проведено, чтобы определить, есть ли различные бактериальные композиции в SupG, SubG и на языке в зависимости от состояния здоровья периодонта. Для каждого сайта была проведена ординация PCoA и анализ MRPP на основе расстояний Брея-Кертиса. Ординация PCoA не выявила сильной группировки здоровья и болезни по основным осям (рис. 3). Кроме того, на графиках PCoA на основе UniFrac не было четкого разделения образцов здоровья и болезней (см. Дополнительный файл 2). MRPP-анализ матрицы расстояний показал очень слабые различия между образцами здоровья и болезней для комбинированных, SubG и языковых участков (9).4057 P < 0,05; полные результаты MRPP доступны в дополнительном файле 3), но не для сайта SupG. Деструкция пародонта в сообществах зубного налета влияет на относительную численность отдельных таксонов Используя CP и здоровые образцы, сравнивали относительную численность таксонов, чтобы определить, коррелирует ли разрушение пародонта со значительными изменениями численности определенных бактериальных таксонов. Типы, связанные со здоровьем и болезнями, по относительной численности. Показаны пять наиболее распространенных типов со значительными различиями между здоровьем и болезнью. Значимость оценивали с помощью критерия Манна-Уитни ( P < 0,05). Обилие болезней показано бледно-красным цветом, а обилие здоровья - зеленым. (A) Все образцы (SubG, SupG и язык). (B) Образцы SubG. (C) Образцы SupG. (D) Образцы языка. *0,01 < P < 0,05; **0,001 < P < 0,01; *** P < 0,001; **** P < 0,0001. Изображение в натуральную величину Более тщательное изучение профилей численности, ассоциированных с CP, с более высоким таксономическим разрешением показало, что многие широко распространенные роды в SubG значительно увеличили свое здоровье, в том числе Corynebacterium , Capnocytophaga , Campylobacter , Neisseria и Kingella (показаны в дополнительном файле 4, панель A). Деструкция пародонта и здоровье пародонта связаны с индикаторными организмами Чтобы определить, могут ли организмы, присутствующие в местах отбора проб, служить конкретными индикаторами здоровья или заболевания, был проведен индикаторный анализ OTU. Количество таксонов, связанных со здоровьем и болезнью, согласно анализу видов-индикаторов. 9Анализ 4083 видов-индикаторов Дюфрена-Лежандра выявил ассоциации OTU либо со здоровьем, либо с болезнью. Показано количество таксонов-индикаторов на уровне типа, рода и вида (значение индикатора OTU> 0,5 и обилие последовательностей таксонов ≥ 100) здоровья (зеленый), болезни (бледно-красный) или того и другого (светло-синий). Полноразмерное изображение Анализ комбинированных данных по SupG, SubG и участкам языка для видов-индикаторов показал, что несколько OTU-индикаторов являются яркими представителями либо заболевания, либо состояния здоровья (рис. 6A). Synergistes оральный таксон (OT) 363 и Synergistes OT 362 показали самые высокие значения индикатора для CP; Streptococcus sanguinis , T. forsythia , F. alocis , Dialister invisus, Streptococcus sp. и TM7 401h22 также были сильными индикаторами ХП (см. дополнительный файл 6). F. alocis был сильным индикатором заболевания в образцах SubG и SupG, но относительно слабым индикатором заболевания на языке (значение индикатора 0,46; не показано на рисунке 7). Интересно, что T. forsythia , а также неклассифицированные Synergistes OT 363 и 362 были индикаторами заболевания в этом исследовании (рис. Пузырьковая диаграмма индикаторных OTU, связанных со здоровьем и болезнью. Каждый кружок представляет OTU, идентифицированную анализом видов-индикаторов Дюфрена-Лежандра как связанную со здоровьем (зеленый) или болезнью (бледно-красный). (A) Объединенные образцы SupG, SubG и языка; (B) Образцы SubG; (C) Образцы SupG; и (D) образцы языка. Площадь пузырька пропорциональна распространенности последовательности OTU. Показаны только OTU со значениями индикатора >0,5 и таксоны с общим числом последовательностей ≥100. Изображение в полный размер Рисунок 7 Количественное относительное обилие организмов-индикаторов, полученное с помощью ПЦР. Данные для индикаторов представлены как величины, обратные среднему нормализованному порогу цикла (Ct) (то есть, Ct индикаторных видов /Ct общее количество бактерий ). Отдельные точки представляют собой средние нормализованные значения экспрессии для каждого человека, основанные на повторных анализах состояния здоровья (сплошные кружки) и CP (перевернутые открытые треугольники) для (A) Общая бактериальная нагрузка. (B) Filifactor alocis , (C) Porphyromonas gingivalis, и (D) Tannerella forsythia . Значительные различия между здоровыми когортами и пациентами с хроническим пародонтитом в каждом из соответствующих мест в ротовой полости основаны на непараметрическом критерии Манна-Уитни с удалением выбросов с использованием критерия выбросов Граббса. Изображение в натуральную величину Количественная ПЦР подтверждает признаки заболеваний пародонта Не было выявлено значительных изменений числа копий бактериального гена 16S рРНК (на нг ДНК) в здоровых и пораженных бляшках (рис. 7). Используя видоспецифичные праймеры, количественную ПЦР использовали для определения относительной численности трех видов (то есть P. gingivalis , F. alocis и T. forsythia ) в SubG, SupG и участках языка с использованием здоровых и больной налет. Из этих видов P. gingivalis и T. forsythia были подтверждены как наиболее распространенные таксоны в группе СР (рис. 7), что согласуется с данными о последовательности. В частности, уровни P. gingivalis были повышены во всех трех участках, пораженных ХП, что позволяет предположить, что SupG и язык так же эффективны, как и участки отбора проб SubG для количественного определения P. Обсуждение В этом исследовании микробные сообщества, связанные с ХП и здоровьем пародонта, были охарактеризованы путем изучения бактерий зубного налета из SupG, SubG и участков языка, что обеспечило всестороннее поперечное описание микробиоты при наличии ХП и здоровья пародонта. Результаты, представленные здесь, показывают, что большинство OTU являются общими для здоровья пародонта и заболеваний. Тем не менее, относительно небольшая часть OTU отличалась от болезни и включала T. denticola , T. forsythia , P. endodontalis , Synergistes OT 362 и Synergistes OT 363. Высокопроизводительные исследования секвенирования, проведенные на сегодняшний день, изучили зубной налет, полученный из участков SubG и SupG, чтобы отличить консорциумы здоровых пародонтоза от консорциумов [25, 27, 30]. Образцы SubG может быть труднее получить по сравнению с образцами, взятыми из участков SupG или языка. Для сбора зубного налета в местах SubG обычно требуется, чтобы большую часть образцов выполняли исследователи, прошедшие обучение в области стоматологии. Предыдущая работа показала, что определенные бактериальные комплексы связаны друг с другом и потенциальными заболеваниями пародонта [22]. Гибридизация ДНК-ДНК использовалась для мониторинга 40 видов бактерий с использованием 13 261 образца зубного налета от 185 здоровых пациентов или пациентов с заболеваниями пародонта. Изучая бактериальные профили до и после терапии, распространенность видов, ординацию сообщества и связь с глубиной зондирования от 0 до 3 мм, от 4 до 6 мм и > 6 мм, ассоциированные с заболеванием бактерии включали P. gingivalis , T. forsythia и T. denticola, , которые были широко распространены в более глубоких участках, которые кровоточили при зондировании [34]. До этого сообщалось, что вероятность обнаружения оральных трепонем в местах, содержащих P. gingivalis , возрастала по мере увеличения деструкции периодонта [35]. Другие продемонстрировали, что виды, присутствующие при заболевании, также присутствовали в здоровом состоянии, хотя и в меньших пропорциях [25], в то время как другая группа продемонстрировала, что сайты SupG содержали те же виды, что и сайты SubG ниже края десны, опять же в меньших пропорциях [36]. Помимо упомянутых выше классических пародонтит-ассоциированных патогенов, мы и другие исследователи обнаружили F. alocis у пациентов с повышенной деструкцией пародонта (рис. 6) [37–39]. В этом исследовании F. alocis были обнаружены в значительно более высоких количествах при заболевании во всех трех местах (различия между состоянием здоровья и заболеванием визуализируются в дополнительном файле 5, а статистика доступна в дополнительном файле 6). Сравнения внутри участков с использованием анализа КПЦР продемонстрировали увеличение численности бактерий только в образцах языка, полученных от пациентов с ХП (рис. 7). Общая численность бактерий существенно не изменилась при сравнении участков SubG и SupG. Этот результат контрастирует с недавними исследованиями, которые показали заметное увеличение общей бактериальной численности в участках SubG у субъектов, страдающих пародонтитом [36, 42]. Наш анализ qPCR, как и анализы, проведенные другими, не учитывает общую бактериальную биомассу образцов зубного налета. Как и в других исследованиях, общая бактериальная нагрузка между здоровым и болезненным состояниями рассчитывалась путем нормализации результатов количественной ПЦР с общим нанограммом геномной ДНК в каждом образце. Следовательно, невозможно сделать выводы об общей бактериальной нагрузке между здоровыми и больными образцами (то есть на мг сухого веса зубного налета), используя методы, использованные в этом исследовании. Заметных различий в α-разнообразии между консорциумами здоровья и болезни не обнаружено (рис. 1). Эти результаты не согласуются с выводами, полученными в двух недавних высокопроизводительных исследованиях секвенирования, в которых сообщалось о значительном повышении α-разнообразия в сообществе при здоровом состоянии и прогрессирующем заболевании пародонта [25, 27]. Выводы Впервые мы продемонстрировали, что спинка языка и сайты SupG могут использоваться в качестве альтернативных мест отбора проб для обнаружения и подсчета бактериальных биомаркеров, связанных с ХП. Использование зубного налета из этих участков, в отличие от взятия проб из пародонтальных карманов, имеет важное клиническое значение. Язык является легкодоступным участком тела, а взятие проб со спинки языка для сбора налета удобно и менее инвазивно. Это означает, что другие лица, заинтересованные в изучении, например, корреляций между ХП и определенными заболеваниями, не относящимися к полости рта (например, респираторными заболеваниями), вполне могли бы проводить содержательные микробиологические анализы, даже если они не имеют подготовки в области стоматологических клинических наук. Представленные здесь результаты дополняют знания о микробных сообществах полости рта, связанных с пародонтитом. Из классических и новых пародонтальных патогенов, идентифицированных на сегодняшний день, следует отметить роль F. Методы Для этого поперечного исследования 24 пациента были набраны через аспирантуру пародонтологии и университетскую клинику Университета Торонто. Исследование было одобрено Советом по этике исследований Университета Торонто (REB 23872), и от всех пациентов было получено информированное согласие на участие в исследовании. Одиннадцать здоровых и 13 пациентов с распространенным ХП (подтвержденным клиническими и рентгенологическими исследованиями) дали согласие на участие в этом исследовании (таблица 1). Из исследования исключались пациенты с системными заболеваниями и/или те, кто принимал антибиотики или подвергался профессиональной чистке зубов в течение последних шести месяцев. Библиотека генов 16S рРНК примерно из 200 п.н. генов 16S рРНК V3 была создана с использованием модифицированных бактериальных праймеров 341F и 528R [43]. Для каждого образца проводили три ПЦР-амплификации с использованием реакционных объемов 50 мкл, чтобы свести к минимуму потенциальную погрешность амплификации [44]. Каждая реакционная смесь содержала 25 пмоль каждого праймера, 200 мкМ каждого dNTP, 1,5 нМ MgCl 2 и 1 ЕД полимеразы Phusion Taq (New England Biolabs, Ипсвич, Массачусетс, США) и 10 нг матричной ДНК. Амплификацию проводили следующим образом: денатурация при 95°С в течение 5 мин, 20 циклов при 95°С в течение 1 мин, 50°С в течение 1 мин и 72°С в течение 1 мин с последующей стадией удлинения при 72°С в течение 7 мин. Для отделения продуктов от праймеров использовали 2% агарозный гель; правильная полоса была извлечена с использованием набора для извлечения из геля QIAquick в соответствии с рекомендациями производителя (Qiagen, Валенсия, Калифорния, США). Данные последовательности были проанализированы в четырех параллельных анализах AXIOME (v1.6) (т. е. образцы SubG, образцы SupG, образцы языка и все три участка вместе взятые). Все анализы проводились с использованием одних и тех же конфигураций. Чтения с парными концами были собраны с использованием PANDAseq [45], затем собранные последовательности были сгруппированы в операционные таксономические единицы (OTU) с идентичностью 97% с использованием cd-hit-est (v4.5.4) [46]. Множественное выравнивание репрезентативных последовательностей было выполнено с помощью PyNAST (v1. Валидация видов-индикаторов СР с помощью количественной ПЦР в реальном времени (кПЦР) Сорок нанограммов ДНК из каждого образца бляшек амплифицируют с помощью кПЦР с видоспецифичными парами праймеров для Tanerella forsythia ( Tf : 5′- GGATTGACCACCGGCGAAGACA-3′ и 5′-CGGACACGACGGTTACTCAAATGG-3′) , P. gingivalis ( Pg : 5′-CTTGACTTCAGTGGCGGCAG-3′ и 5′-AGGGAAGACGGTTTTTCACCA-3′), и FaGACGGTTTTTCACCA-3′, и Fa Filifactor alocis ( Pg 5′-TCGGTGCCGAAGTTAACACA-3′ и 5′-GGGTCCCCGTCAATTCCTTT-3′), а также универсальные праймеры (5′-TCCTACGGGAGGCAGCAGT-3′ и 5′-GGACTACCAGGGTATCTAATCCTGTT-3′) для количественного определения общего количества бактерий. Каждую реакцию запускали в двух повторностях с использованием амплификатора Stratagene Mx3000P (Agilent Technologies, Санта-Клара, Калифорния, США) и обратных значений средних нормализованных значений Ct (Ct 9Было получено 4529 индикаторных видов /Ct (всего бактерий ). Сокращения
Ссылки
Dewhirst FE, Chen T, Izard J, Paster BJ, Tanner AC, Yu WH, Lakshmanan A, Wade WG: Микробиом ротовой полости человека. J Бактериол. 2010, 192 (19): 5002-5017. 10.1128/JB.00542-10. КАС Статья пабмед ПабМед Центральный Google ученый До Насименто С., Сато С., Мардеган Исса Дж. П., Эдсон Сантос Барбоса Р., Феррейра Де Альбукерке Младший Р.: Метод шахматной доски ДНК для обнаружения бактерий микробиоты в биопленках зубов и языка. Предварительное исследование. Минерва Стоматол. 2008, 57 (11–12): 561–567. КАС пабмед Google ученый Aas JA, Griffen AL, Dardis SR, Lee AM, Olsen I, Dewhirst FE, Leys EJ, Paster BJ: Бактерии кариеса молочных и постоянных зубов у детей и молодых людей. Дж. Клин Микробиол. 2008, 46 (4): 1407-1417. 10.1128/JCM.01410-07. КАС Статья пабмед ПабМед Центральный Google ученый Бартрам А.К., Линч М.Д., Стернс Дж.К., Морено-Хагельсиб Г., Нойфельд Д.Д.: Создание библиотек генов 16S рРНК с многомиллионными последовательностями из сложных микробных сообществ путем сборки парных концевых прочтений illumina. Appl Environ Microbiol. 2011, 77 (11): 3846-3852. 10.1128/АЭМ.02772-10. КАС Статья пабмед ПабМед Центральный Google ученый Wang Q, Garrity GM, Tiedje JM, Cole JR: Наивный байесовский классификатор для быстрого отнесения последовательностей рРНК к новой таксономии бактерий. Appl Environ Microbiol. 2007, 73 (16): 5261-5267. 10.1128/АЭМ.00062-07. КАС Статья пабмед ПабМед Центральный Google ученый Скачать ссылки БлагодарностиМы признаем финансирование от CIHR-IMHA OMH-134133 для DBS, а также Института стоматологических исследований (Университет Торонто) для DBS, DGC и HT. MWH, MDJL и JDN были поддержаны Премией раннего исследователя (правительство Онтарио) и Канадским институтом исследований в области здравоохранения (CIHR). Информация об автореПримечания автора Авторы и организации
Авторы
Автор, ответственный за переписку
Дилани Бразиунас Сенадира. Дополнительная информацияКонкурирующие интересыАвторы заявляют об отсутствии конкурирующих интересов. Вклад авторов В.Г. помогла в сборе образцов, сборе данных об участниках, написании рукописи, анализе и интерпретации данных. MWH помог в написании рукописи, анализе данных и интерпретации. NS помог в анализах qPCR и окончательном утверждении рукописи. MDJL помог в разработке исследования, анализе и интерпретации результатов, пересмотре рукописи и окончательном утверждении рукописи. MG помогла в сборе образцов, сборе данных об участниках, пересмотре рукописи и окончательном утверждении рукописи. HT помогла в сборе образцов, сборе данных об участниках, дизайне исследования, анализе и интерпретации результатов, пересмотре рукописи и окончательном утверждении рукописи. DGC помогла в разработке дизайна исследования, анализе и интерпретации результатов, пересмотре рукописи и окончательном утверждении рукописи. JDN помогала в написании рукописи, анализе данных и результатов, интерпретации и разработке исследования. Вайя Галиманас, Майкл Уильям Холл также внес свой вклад в эту работу. Электронный дополнительный материал40168_2014_58_MOESM1_ESM.xlsДополнительный файл 1: Метаданные образца и пациента. Это включает в себя идентификатор образца, возраст, вес, состояние здоровья и количество курения и алкоголя пациента. (XLS, 40 КБ) 40168_2014_58_MOESM2_ESM.pdfДополнительный файл 2: Согласование анализа основных координат UniFrac (PCoA). PCoA ординация расстояний UniFrac от филогенетического дерева, созданного FastTree. A: Все образцы (SubG, SupG и язык). B: Образцы SubG. C: Образцы SupG. D: Образцы языка. (PDF 35 КБ) 40168_2014_58_MOESM3_ESM.xls Дополнительный файл 3: Процедура перестановки с несколькими ответами (MRPP) результаты Health and Disease. 40168_2014_58_MOESM4_ESM.pdf Дополнительный файл 4: Относительное количество родов между здоровыми и больными образцами для отдельных образцов SubG, SupG и языка. Показана первая десятка наиболее распространенных классификаций уровня рода со значительными различиями между здоровьем и болезнью. Значимость оценивали с помощью критерия Манна-Уитни ( P <0,05). Обилие болезней показано бледно-красным цветом, а обилие здоровья - зеленым. «Дядя». указывает, что группа не была классифицирована до рода, и дается классификация самого низкого уровня. 40168_2014_58_MOESM5_ESM.pdfДополнительный файл 5: Относительная численность видов между здоровыми и больными образцами. Показана десятка самых распространенных классификаций уровня видов со значительными различиями между здоровьем и болезнью. Значимость оценивали с помощью критерия Манна-Уитни ( P < 0,05). Обилие болезней показано бледно-красным цветом, а обилие здоровья - зеленым. «Дядя». указывает, что группа не была классифицирована до видов, и дается классификация самого низкого уровня. A: Все образцы (SubG, SupG и язык). B: Образцы SubG. C: Образцы SupG. D: Образцы языка. (PDF 54 КБ) 40168_2014_58_MOESM6_ESM.xls Дополнительный файл 6: Список видов, значительно увеличенный в состоянии здоровья или болезни. Файл электронной таблицы, содержащий результаты значимости, сравнивающие относительное обилие таксонов в норме и при болезни для сайтов SubG, SupG и Tongue. 40168_2014_58_MOESM7_ESM.xlsДополнительный файл 7: Анализ индикаторных видов Дюфрена-Лежандра. Файл электронной таблицы, содержащий подробные списки индикаторов OTU для комбинированного анализа, анализа SubG, SupG и Tongue. Включены все индикаторные OTU с P < 0,05. (XLS 549 КБ) Права и разрешенияОткрытый доступ Эта статья находится под лицензией Creative Commons Attribution 4.0 International License, которая разрешает использование, совместное использование, адаптацию, распространение и воспроизведение на любом носителе или в любом формате, если вы предоставить соответствующую ссылку на оригинального автора (авторов) и источник, предоставить ссылку на лицензию Creative Commons и указать, были ли внесены изменения. Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons на эту статью, если иное не указано в кредитной строке материала. Чтобы просмотреть копию этой лицензии, посетите https://creativecommons.org/licenses/by/4.0/. Отказ Creative Commons от права на общественное достояние (https://creativecommons.org/publicdomain/zero/1.0/) применяется к данным, представленным в этой статье, если иное не указано в кредитной строке данных. Перепечатки и разрешения Об этой статье2022 Код диагноза МКБ-10-КМ K05.31: Хронический пародонтит локализованный
Хронический периодонтит, локализованный
Следующие коды выше K05.31 содержат обратные ссылки на аннотации Обратная ссылка на аннотацию В этом контексте обратные ссылки на аннотацию относятся к кодам, которые содержат:
, которые могут быть применимы к K05.
Примерные синонимы
История кода
Коды МКБ-10-СМ, смежные с K05.31
K05. K05.213 …… тяжелый K05.219 …… степень тяжести не указана K05.22 Генерализованный агрессивный пародонтит K05.221 …… легкая
K05. K05.223 …… тяжелый K05.229 …… степень тяжести не указана K05.3 Хронический пародонтит0003 K05.30 …… не указано
К05. K05.311 …… легкая K05.312 …… умеренная K05.313 …… тяжелый
K05. K05.32 Хронический генерализованный пародонтит K05.321 …… легкая K05.322 …… умеренный K05.323 …… тяжелая
K05. |

 27 Аномальные бугорки и эмалевые жемчужины [адамантома]
27 Аномальные бугорки и эмалевые жемчужины [адамантома] 49 Нарушения формирования зубов не уточненные
49 Нарушения формирования зубов не уточненные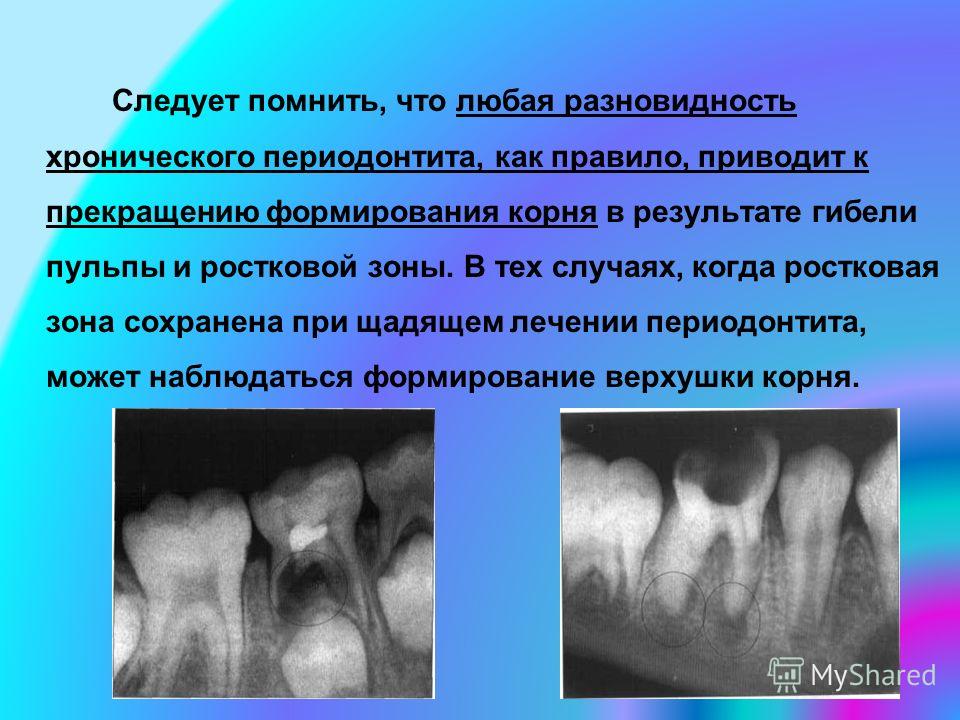 68 Другие уточненные нарушения прорезывания зубов
68 Другие уточненные нарушения прорезывания зубов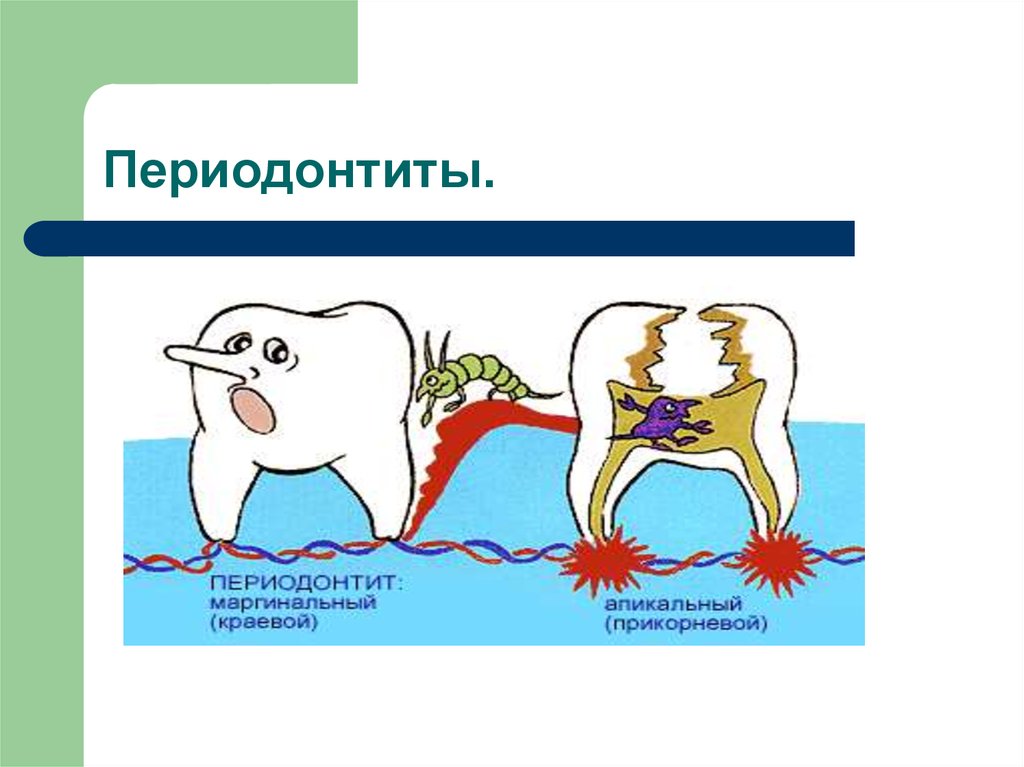 19 Сошлифование зубов не уточненное
19 Сошлифование зубов не уточненное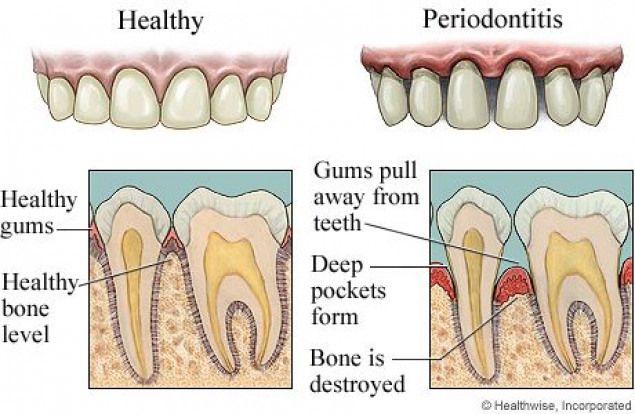 Обусловленное наличием металлов и металлических соединений
Обусловленное наличием металлов и металлических соединений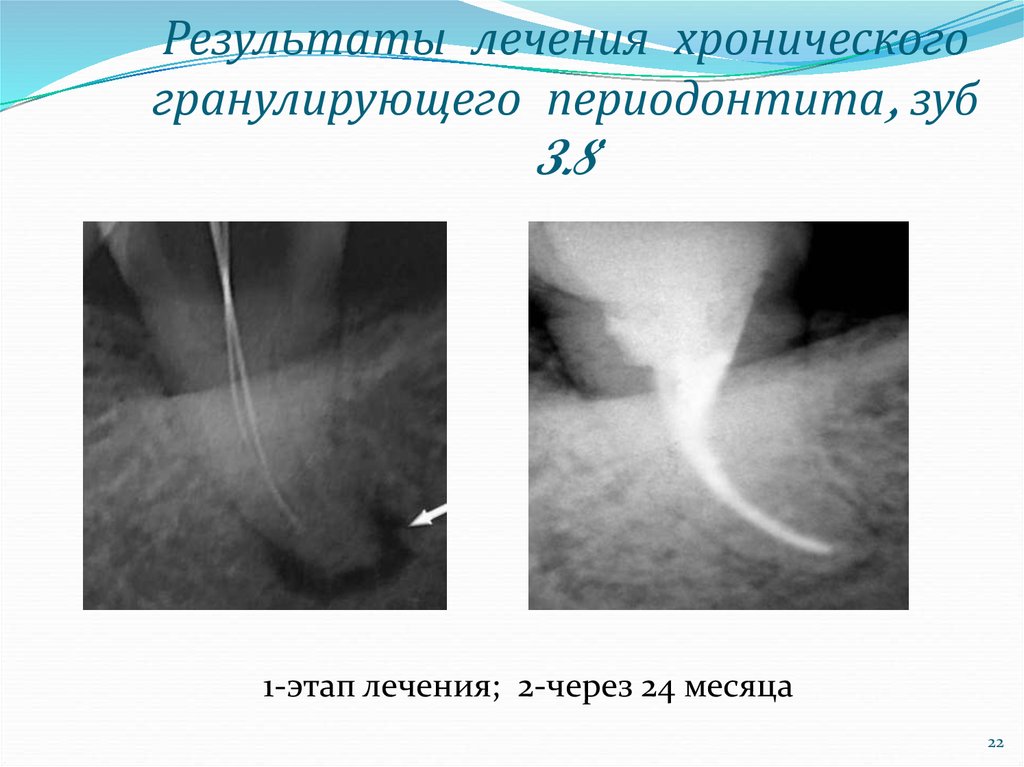 Начальный (гиперемия)
Начальный (гиперемия) Имеющий сообщение с верхнечелюстной пазухой
Имеющий сообщение с верхнечелюстной пазухой 29 Острый пародонтит неуточненный
29 Острый пародонтит неуточненный 2 Поражения десны и беззубого альвеолярного края, обусловленные травмой
2 Поражения десны и беззубого альвеолярного края, обусловленные травмой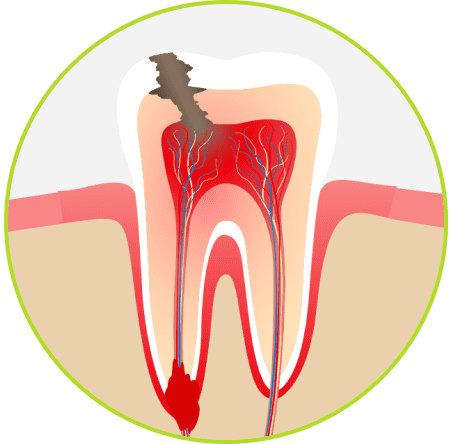 82 Фиброзный эпулис
82 Фиброзный эпулис 09 Аномалия размеров челюстей не уточненная
09 Аномалия размеров челюстей не уточненная 26 Смещение зубных дуг от средней линии
26 Смещение зубных дуг от средней линии 51 Нарушение прикуса вследствие нарушения глотания
51 Нарушение прикуса вследствие нарушения глотания 69 Болезнь височно-челюстного сустава не уточненная
69 Болезнь височно-челюстного сустава не уточненная