Симптомы волчанки и здоровье полости рта
Волчанка — это аутоиммунное заболевание или заболевание, возникающее из-за нарушений в работе иммунной системы. Волчанка может влиять на здоровье полости рта, ее влияние заключается в развитии таких симптомов, как острые (внезапное появляющиеся и имеющие короткую продолжительность) или хронические (сохраняющиеся в течение продолжительного периода времени) поражения мягких тканей. Заболевание не передается от человека к человеку даже при телесном контакте, причина его развития заключается в том, что организм воспринимает некоторые собственные ткани как инородные. Иммунная система защищает органы от воздействия различных клеток, в частности антитела защищают организм от возбудителей инфекций. Симптомы заболевания возникают, когда антитела начинают поражать нормальные клетки организма. Медицинское название данного заболевания – системная красная волчанка, либо красная волчанка других форм. Симптомы заболевания могут сочетаться с симптомами других аутоиммунных заболеваний и проявляться, в том числе, в виде кожной сыпи на поверхности носа и щеках, называемой «бабочкообразной сыпью». Сыпь может появляться и на других участках кожи, которые часто подвергаются воздействию солнечного света. К другим симптомам относятся утомляемость, отек суставов, лихорадка, выпадение волос и воспаление органов, в том числе сердца и почек.
Кто подвержен заболеванию?
По данным Американского фонда изучения волчанки заболевание чаще поражает женщин, нежели мужчин. У женщин данное заболевание обычно развивается в детородном возрасте, т. е. от 20 до 45 лет, при этом наибольшему риску подвержены женщины афро-американского, испанского и азиатского происхождения. Фонд также сообщает, что ежегодно регистрируется 16 000 новых случаев развития волчанки и что во всем мире данным заболеванием страдают 5 миллионов человек.
Постановка диагноза
Для данного заболевания отсутствует отдельный метод диагностики.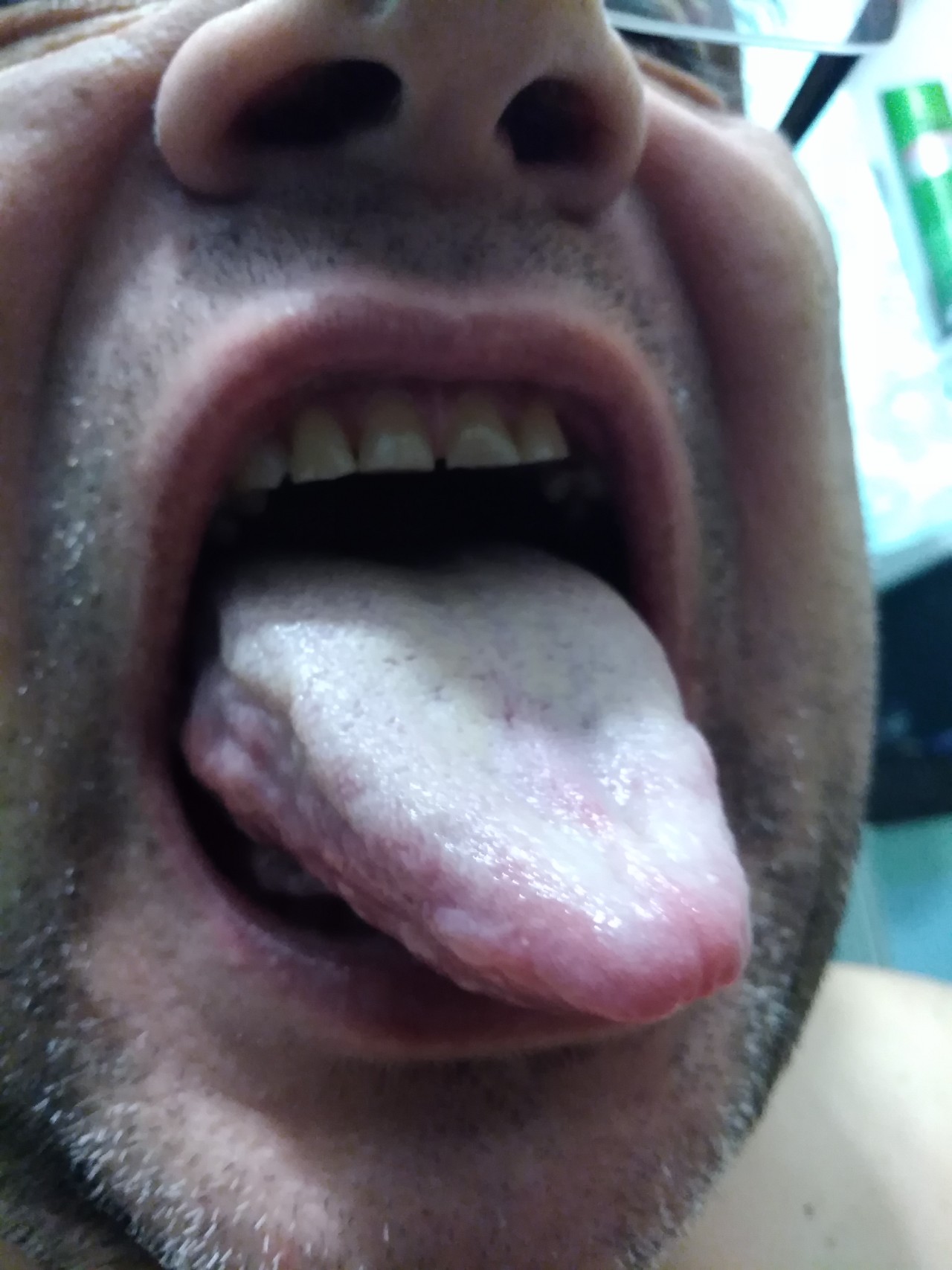
Диагностируемые изменения состояния ротовой полости
Данное заболевание не способствует развитию двух основных заболеваний полости рта: кариеса зубов и заболеваний пародонта. Однако, согласно статье, опубликованной в «Европейском журнале дерматологии», у 9–45 процентов пациентов, страдающих данным заболеванием, могут появляться ротовые язвы или другие поражения слизистой оболочки ротовой полости. Такие язвы и поражения могут иметь острую или хроническую форму и выглядеть аналогично другим видам внутриротовых поражений. В целях первичного диагностирования заболевания и подтверждения того, что причиной внутриротовых поражений является волчанка, может потребоваться проведение биопсии и обследования у ревматолога. В том случае, если заболевание поражает слюнные железы, у пациента может наблюдаться сухость во рту, которая потребует лечения фторидами. Лечение внутриротовых поражений носит смягчающий характер и часто предполагает применение местных стероидных препаратов.
Доступные методы лечения
Выбор метода лечения зависит от пораженного органа и степени тяжести заболевания. Лечение может включать применение стероидных, противомалярийных и обезболивающих средств. Также потребуется изменение образа жизни и контролирование стрессовых ситуаций. Дополнительную информацию о методах лечения можно найти на интернет-сайте клиники «Мэйо» (Mayo Clinic). Также для людей, страдающих данным заболеванием, доступны меры поддержки. Кроме того, существует ряд экспериментальных препаратов, таких как ритуксимаб, которые способствуют перестраиванию иммунной системы, уменьшая таким образом степень проявления заболевания.
Профессиональная гигиена полости рта у детей
Гигиена полости рта у детей — очень важный элемент повседневной заботы. Каждая мама знает, как важно заботиться о здоровых и чистых зубах. Есть много факторов, которые влияют на правильную работу гигиену полости рта детей, таких как правильно подобранная зубная щетка, регулярная чистка зубов или правильная техника чистки.
За зубами стоит ухаживать с ранних лет, чтобы избежать частых посещений стоматолога в будущем. Давно известно, что посещение врача с ребенком — не самое приятное и может вызвать множество стрессовых моментов. Вот почему так важен профилактический уход за зубами.
Но, к сожалению, полностью избавиться от налета в домашних условиях не удается. Даже при ежедневном применении зубной нити или межзубных щеток удаляется только его часть. Основательная чистка зубов происходит во время посещения стоматолога-гигиениста с применением процедуры гигиены полости рта у детей.
Что дает гигиена полости рта у детей
Перед любыми стоматологическими вмешательствами обязательна данная процедура. Лечение плохо очищенных зубов имеет мало шансов на успех.
Несоответствующая гигиена с момента появления у ребенка зубов приводит к накоплению бактериального налета и созданию зубного камня, что заканчивается болезнями:
- кариесом,
- гингивитом,
- стоматитом.
Профессиональная гигиена полости рта необходима для их профилактики и лучшего лечения уже проявившихся заболеваний.
Домашнюю гигиену ротовой полости нужно начинать до появления первого зуба, а профессиональную — после их прорезывания. Гигиенист научит правильной чистке первых зубов малыша, поможет выбрать пасту и щетку.
Как проходит гигиена полости рта у детей
Вначале врач или гигиенист уточняет уровень гигиены с помощью таблеток, обесцвечивающих налет. Таблетки имеют достойный вкус и не доставляют дискомфорта, точно показывают места на эмали с наличием налета. Позже гигиенист приступает к процедуре:
- чистит зубы специальными пастами и щетками, а также зубной нитью
- повторяет при необходимости
- после чистки зубы полируются и покрываются специальным реминерализующим гелем, укрепляющим эмаль.
Если это не помогает, проводится пломбирование молочных зубов.
Как часто требуется гигиена полости рта у детей
Ребенку следует проводить профилактический осмотр и профессиональную гигиену полости рта один раз в квартал. С такими интервалами врач сможет легко увидеть даже самые незначительные изменения эмали и не дать распространиться кариозному повреждению зуба, а также распознать симптомы начинающихся болезней. Ребенок вначале не умеет чистить зубы правильно. Важно, чтобы родители помогали своим детям в возрасте до 8-9 лет чистить зубы в домашних условиях.
В клинике в Москве мы очень ответственно подходим к профилактике заболеваний зубов и десен, включая профессиональную гигиену полости рта у детей и пломбирование молочных зубов. Цена адаптивной гигиены (во время встречи, чтобы ребенок чувствовал себя комфортно и давал врачу проводить простейшие мотивации) доступная.
Обратитесь за услугой к профессионалам в Москве, чтобы получить эффективный результат и предотвратить развитие опасных заболеваний полости рта. Цены на каждое последующее адаптационное посещение в сочетании с чисткой детских зубов, пломбированием молочных зубов, профилактический визит с профессиональной гигиеной и реминерализацию или фторирование эмали вы можете уточнить на сайте или по телефону.
Основные заболевания слизистой оболочки полости рта
Слизистая оболочка полости рта защищает ткани от повреждений, проникновения микроорганизмов и токсических веществ. А наличие множества капилляров, которые просвечивают через эпителии, придают ей привычный нам розовый цвет.
А наличие множества капилляров, которые просвечивают через эпителии, придают ей привычный нам розовый цвет.
Структура слизистой оболочки ротовой полости на разных её участках отличается, — на участках, где механические нагрузки значительны, эпителий является ороговевающим, а на участках, где от тканей требуется большая гибкость, покрыты неороговевающим эпителием. Спинка языка покрыта эпителием, состоящим из ороговевающего и неороговевающего эпителия.
Ороговевающий эпителий содержит четыре слоя: базальный, шиповатый, зернистый и роговой.
Неороговевающий эпителий вместо зернистого слоя содержит промежуточный слой, а вместо рогового — поверхностный слой.
На слизистой оболочке ротовой полости, глотки и надгортанника расположены вкусовые почки — органы вкуса человека. Клетки, образующие вкусовую почку, являются видоизмененными эпителиальными клетками, часть из них, лежащие на вершине почки, представляют собой рецепторы вкуса. Частички пищи, растворенные в слюне, вступают в контакт с рецепторами вкуса, проходя через небольшие отверстия в эпителии слизистой оболочки — вкусовые поры.
Профилактика и лечение заболеваний слизистой никогда не теряют актуальности, из-за высокой распространенности данной патологии.
В зависимости от локализации очага воспаления различаютстоматит, глоссит, гингивит, пародонтит и другие заболевания.
Прежде всего необходимо устранение местных и общих факторов, ведущих к патологическим процессам в полости рта. Причиной поражения слизистой может оказаться системное заболевание, в таких случаях назначается специфическая терапия
Практически не существует патологии, которая не отражалась бы на состоянии слизистой рта.
При этом сходство клинического проявления в полости рта различных по этиологии и патогенезу заболеваний, способствует трудностям при постановке окончательного диагноза. Изучение сочетанных поражений кожи, внутренних органов, слизистой рта, их связь с общей патологией необходимо врачу для правильной постановки диагноза. Существует взаимосвязь большинства патологических процессов, протекающих между слизистой рта и красной каймы губ и различных органов и систем организма, поэтому именно поражения слизистой рта зачастую являются первыми признаками нарушения обмена веществ, а также различных общесоматических заболеваний.
Существует взаимосвязь большинства патологических процессов, протекающих между слизистой рта и красной каймы губ и различных органов и систем организма, поэтому именно поражения слизистой рта зачастую являются первыми признаками нарушения обмена веществ, а также различных общесоматических заболеваний.
Во всех случаях обязательна тщательная гигиена и санация полости рта.
При кандидозе используют противогрибковые средства, при бактериальной инфекции – антибиотики. При обширных болезненных поражениях назначают полоскания полости рта. Иногда требуется врачебное вмешательство: удаление зубного камня, замена пломб, оперативная пластика преддверия полости рта и уздечки.
Наиболее распространенные заболевания полости рта:
Стоматит — воспаление слизистой оболочки полости рта.
Симптомы — воспаление и крайне неприятные ощущения в ротовой полости (жжение, сухость), иногда заболевание сопровождается температурой .
В первую очередь нужно определить причину возникновения стоматита (в этом вам поможет врач-терапевт) и начать её устранять. Лечение стоматита народными средствами, такими, как полоскание с содой, поможет лишь снять симптомы, но не избавит вас от заболевания, и стоматит появится вновь.
Стоматит обязательно нужно лечить, он не проходит сам по себе со временем.
Глоссит — воспаление слизистой оболочки языка.
Чаще всего воспаляется только слизистая оболочка языка, но при глубоких травмах языка в толще мышц может развиться гнойное воспаление с отеком языка, нарушением глотания и высокой температурой тела, иногда образуется абсцесс.
Воспаление слизистой оболочки языка часто провоцирует развитие многих заболеваний. Чаще глоссит протекает в катаральной форме: язык слегка отечный, слизистая оболочка красная, ощущаются саднение и болезненность.
Часто необходимо общее обследование больного для выявления заболевания внутренних органов, вызвавших воспаление слизистой оболочки языка. Поэтому важно вовремя обратиться к стоматологу, выполнять все его назначения. Самостоятельное лечение чревато осложнениями.
Поэтому важно вовремя обратиться к стоматологу, выполнять все его назначения. Самостоятельное лечение чревато осложнениями.
Симптоматическое лечение проводят стоматолог и физиотерапевт, назначаются консультации и лечение у соответствующих специалистов – гастроэнтеролога, эндокринолога, гематолога.
Гингивит — это воспаление десны, сопровождаемое отеком, покраснением и кровоточивостью.
Это довольно распространенное заболевание. Различают острую, хроническую и рецидивирующую форму болезни.
Наиболее частой причиной гингивита является несоблюдение гигиены полости рта, в результате чего образуется зубной камень. Также в возникновении гингивита играют роль такие факторы, как патология прикуса, неправильно наложенные или устаревшие пломбы, ротовое дыхание.
Гингивит чаще встречается у подростков и беременных в связи с гормональными изменениями в организме.
Гингивит может быть и признаком системного заболевания (например, герпеса, аллергии, авитаминоза, лейкопении, истощающего заболевания, сахарного диабета).
Так же длительное применение некоторых препаратов, например, оральных контрацептивов, может усилить воспалительные явления в десне.
Симптомы гингивита — десна воспаляется, возникает отек, изменяется ее контур. Из-за отека углубляется десневая борозда между зубом и образуется так называемый десневой карман. В результате возникает покраснение десневого края, отек и кровоточивость десны, десна становится чувствительной и болезненной, наблюдаются трудности при жевании и глотании.
Лечение гингивитов заключается в воздействии на зубные бляшки, устранении местных и общих предрасполагающих факторов и должно проводиться только врачом-стоматологом. Иногда требуется значительное врачебное вмешательство: тщательное удаление зубного камня, замена и шлифовка нависающих на десну или плохо подогнанных пломб, в некоторых случаях необходимо хирургическое вмешательство.
Гингивит часто свидетельствует о снижении собственных защитных сил организма, поэтому лечение должно быть направлено не только на ликвидацию воспалительного процесса, но и на повышение иммунитета.
Препараты группы иммунокорректоров активизируют защитные силы слизистой оболочки полости рта и способствуют усилению фагоцитарной активности (фагоцитоз — захват и обезвреживание бактерий клетками иммунной системы), увеличению содержания в слюне особого фермента — лизоцима, известного своей бактерицидной активностью, стимуляции и увеличению числа иммунокомпетентных клеток, ответственных за выработку антител.
Для успешной профилактики гингивитов достаточно ежедневно удалять зубные бляшки с помощью зубной пасты и флоса, регулярно проходить обследование и производить профессиональную чистку зубов у стоматолога каждые 6 месяцев.
Хейлит — воспаление красной каймы слизистой оболочки или кожи губ
Обычно развивается при травме и трещинах губ, вследствие ожога, при длительном пребывании на солнце или на морозе в ветреную погоду.
Хейлит грибковый сочетается с грибковым поражением слизистой оболочки рта, но может возникать и изолированно на красной кайме губ, обычно у пожилых. При длительном существовании грибковой заеды на коже губ могут развиваться диффузная краснота, шелушение, небольшая отечность, мелкие трещинки. Картина напоминает обычную экзему.
Хейлит катаральный
Воспаление красной каймы губы, возникающее под действием биологических, механических, химических, физических раздражителей, иногда из-за повреждения во время врачебных манипуляций.
Клиническая картина. Появляются очаги гиперемии с последующими деструктивными нарушениями в виде эрозии, язв. Характерны отек, слущивание эпителия.
Лечение хейлита
Задача лечения хейлита у стоматолога состоит в нормализации стереотипа смыкания губ. Внешним признаком физиологической архитектоники является равенство ширины собственно красной каймы верхней и нижней губы, то есть смыкание — по линии, разграничивающей слизистую оболочку и красную кайму.
Комплекс терапии хейлита включает в себя:
- нормализацию носового дыхания путем устранения привычки дышать через рот или путем лечения заболеваний носоглотки
- исправление аномалий прикуса
- миотерапию для восстановления нормального тонуса круговой мышцы рта
Детская стоматология в Екатеринбурге | Центр немецкой стоматологии
Особый подход и индивидуальная программа лечения – наши принципы в работе с каждым, маленьким пациентом. В отделении детской стоматологии мы не просто лечим зубки на высшем уровне, а также создаём все необходимые условия для психологического комфорта маленького пациента.
В отделении детской стоматологии мы не просто лечим зубки на высшем уровне, а также создаём все необходимые условия для психологического комфорта маленького пациента.
Услуги отделения детской стоматологии
- Лечение кариеса, пульпита, периодонтита
- Коррекция прикуса
- Безболезненное удаление молочных зубов
- Укрепление эмали
- Профилактика заболеваний полости рта у детей
- Сопровождение ребёнка до полного формирования правильного прикуса
Нужны ли ребенку профилактические осмотры и стоит ли лечить молочные зубы?
Однозначно, да. Некоторые родители ошибочно полагают, что лечить молочные зубы необязательно – ведь, в конце концов, их сменят постоянные, коренные. Тем временем, появление кариеса на молочных зубах ребёнка происходит безболезненно и почти моментально перерастает в пульпит. Если и на этом этапе не обратиться к доктору, то разовьется периодонтит, а его осложнениями могут стать уже флегмоны и остеомиелит.
Своевременность диагностики осложняется ещё и тем, что ребёнок не всегда может точно описать, что у него болит, и родители зачастую не могут распознать зубную боль у своего малыша.
Серьезную опасность представляют также патологии прикуса. Неправильное жевание приводит к нарушениям пищеварения. А ведь именно молочные зубы помогают сформировать здоровый прикус.
отзыв пациента
Есинова Юлия Александровна
Хочу выразить благодарность Благовой Юлии Павловне за профессиональный подход к лечению детей, а также взрослых. Спасибо руководству за квалифицированных специалистов. Вам можно доверять! Всегда советую вашу стоматологию друзьям и знакомым. Желаю вам процветания и роста.
Почему родители доверяют докторам нашего центра?
- Психологическая подготовка пациента перед началом лечения. Именно этим и отличается детский доктор. Если малыш впервые в нашем центре, ему проведут экскурсию по кабинету, расскажут, для чего нужен каждый инструмент.
 Только когда доктор почувствует, что ребёнок готов, он приступит к лечению.
Только когда доктор почувствует, что ребёнок готов, он приступит к лечению. - Безболезненность любых процедур. Благодаря использованию европейских анестетиков, дети совершенно не чувствуют боли и каких-либо неприятных манипуляций во рту. А прежде чем ввести основной анестетик, десны ребенка обрабатывают обезболивающим гелем, чтобы и укол не потревожил малыша.
- Комфорт во время лечения. Доктора нашего центра находят подход даже к самым непоседливым пациентам и, как правило, становятся добрыми друзьями малышам на время лечения. А пока врач занят работой, внимание ребёнка привлекает установленный специально для него телевизор с мультфильмами.
- Приятное завершение визита. Любая мама знает, что за поход к врачу и усидчивость ребёнка нужно поощрить.
Помните, лучшее лечение – это профилактика и своевременная диагностика. Запишитесь на приём к детском стоматологу по телефону: 8 (343) 243-58-02. Мы поможем сохранить зубки вашего ребёнка здоровыми и докажем, что доктор может быть другом, а поход в клинику – увлекательной игрой для малыша!
Устные проявления системного заболевания
Компилато Д., Корселло Дж., Кампизи Г. Необычное травматическое изъязвление языка. J Детский педиатр 2012; 48 : 1104–1105.
PubMed Статья Google Scholar
Гилветти С., Портер С. Р., Феделе С. Травматические химические язвы полости рта: отчет о болезни и обзор литературы. Br Dent J 2010; 208 : 297–300.
PubMed Статья Google Scholar
Radoï L, Luce D. Обзор факторов риска рака полости рта: важность стандартизированного определения случая. Community Dent Oral Epidemiol 2013; 41 : 97–109.
PubMed Статья Google Scholar
Рэй Дж. Г., Суэйн Н., Гош Р., Рича, Паттанаяк Моханти С. Врожденный дискератоз со злокачественной трансформацией. BMJ Case Rep 2011; 2011 : DOI: 10.1136 / bcr.03.2010.2848.
Google Scholar
Вонг В. М., Парватанени Ю., Джуэлл П. Д. и др. . Плоскоклеточная карцинома ротового языка у пациента с анемией Фанкони, получавшего лучевую терапию и одновременное лечение цетуксимабом: отчет о клиническом случае и обзор литературы. Голова Шея 2013; 35 : E292-298.
PubMed Google Scholar
Фитцпатрик С.Г., Хирш С.А., Гордон С.С.Злокачественная трансформация красного плоского лишая полости рта и поражение лихеноидом полости рта: систематический обзор. J Am Dent Assoc 2014; 145 : 45–56.
Артикул Google Scholar
Kuo C F, Luo S F, Yu K H et al . Риск рака среди пациентов с системным склерозом: общенациональное популяционное исследование на Тайване. Scand J Rheumatol 2012; 41 : 44–49.
PubMed Статья Google Scholar
Михалек А. М., Махони М. С., Маклафлин С. С., Мерфи Д., Мецгер Б. Б.Исторические и современные корреляты сифилиса и рака. Int J Epidemiol 1994; 23 : 381–385.
PubMed Статья Google Scholar
Триантафиллиду К., Димитракопулос Дж., Иорданидис Ф., Гкагкалис А. Экстранодальные неходжкинские лимфомы полости рта и челюстно-лицевой области: клиническое исследование 58 случаев и обзор литературы. J Oral Maxillofac Surg 2012; 70 : 2776–2785
PubMed Статья Google Scholar
Портер С. Р., Диз Диос П., Кумар Н., Сток С., Барретт А. В., Скалли К.Оральная плазмобластная лимфома при ранее не диагностированном ВИЧ-заболевании. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1999; 87 : 730–734.
Р., Диз Диос П., Кумар Н., Сток С., Барретт А. В., Скалли К.Оральная плазмобластная лимфома при ранее не диагностированном ВИЧ-заболевании. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1999; 87 : 730–734.
PubMed Статья Google Scholar
Кастильо Дж. Дж., Бибас М., Миранда Р. Н. Биология и лечение плазмобластной лимфомы. Кровь 2015; 125 : 2323–2330.
PubMed Статья Google Scholar
Аль-Хаким Д. А., Феделе С., Карлос Р., Портер С.Экстранодальная NK / Т-клеточная лимфома носового типа. Oral Oncol 2007; 43 : 4–14.
PubMed Статья Google Scholar
Паттон Л. Л. Поражения полости рта, связанные с заболеванием, вызванным вирусом иммунодефицита человека. Dent Clin North Am 2013; 57 : 673–698.
PubMed Статья Google Scholar
Рао Р. С., Патил С., Санкет Д., Амрута Н.Метастатические опухоли полости рта. J Contemp Dent Pract 2014; 15 : 263–271.
PubMed Статья Google Scholar
Ильяс С.Е., Чен Ф., Ходжсон Т.А., Спейт П.М., Лейси С.Дж., Портер С.Р. Туберкулез губ: уникальная причина отека губ, осложняющая ВИЧ-инфекцию. HIV Med 2002; 3 : 283–286.
PubMed Статья Google Scholar
Aoun N, El-Hajj G, El Toum S.Язва ротовой полости: необычная локализация при первичном туберкулезе. Aust Dent J 2015; 60 : 119–122.
PubMed Статья Google Scholar
Iatta R, Napoli C, Borghi E, Montagna M. T. Редкие микозы полости рта: эпидемиологический обзор литературы. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2009; 108 : 647–655.
PubMed Статья Google Scholar
Портер С. Р., Скалли К., Станден Г. Р.Аутоиммунная нейтропения, проявляющаяся в виде рецидивирующих язв в полости рта. Oral Surg Oral Med Oral Pathol 1994; 78 : 178–180.
PubMed Статья Google Scholar
Jurge S, Kuffer R, Scully C, Porter S R. Серия заболеваний слизистой оболочки. Номер VI. Рецидивирующий афтозный стоматит. Устные сообщения 2006; 12 : 1–21.
PubMed Статья Google Scholar
Аль-Отайби Л. М., Портер С. Р., Поат Т. У.Болезнь Бехчета: обзор. J Dent Res 2005; 84 : 209–222.
PubMed Статья Google Scholar
Стоянов С., Лапидус С., Читкара П. и др. . Периодическая лихорадка, афтозный стоматит, фарингит и аденит (PFAPA) — это нарушение врожденного иммунитета и активации Th2 в ответ на блокаду IL1. Proc Natl Acad Sci USA 2011; 108 : 7148–7153.
PubMed Статья Google Scholar
Скалли К., Ходжсон Т., Лахманн Х.Аутовоспалительные синдромы и здоровье полости рта. Устные сообщения 2008; 14 : 690–699.
PubMed Статья Google Scholar
Скалли С., Портер С. Орофациальные заболевания: последние данные для стоматологической клинической бригады: 2. Язвы, эрозии и другие причины боли во рту. Часть II. Dent Update 1999; 26 : 31–39.
PubMed Статья Google Scholar
Райан К., Хегарти А. М., Ходжсон Т.Этиология, диагностика и лечение красного плоского лишая полости рта. Br J Hosp Med (Лондон) 2014; 75 : 492–496.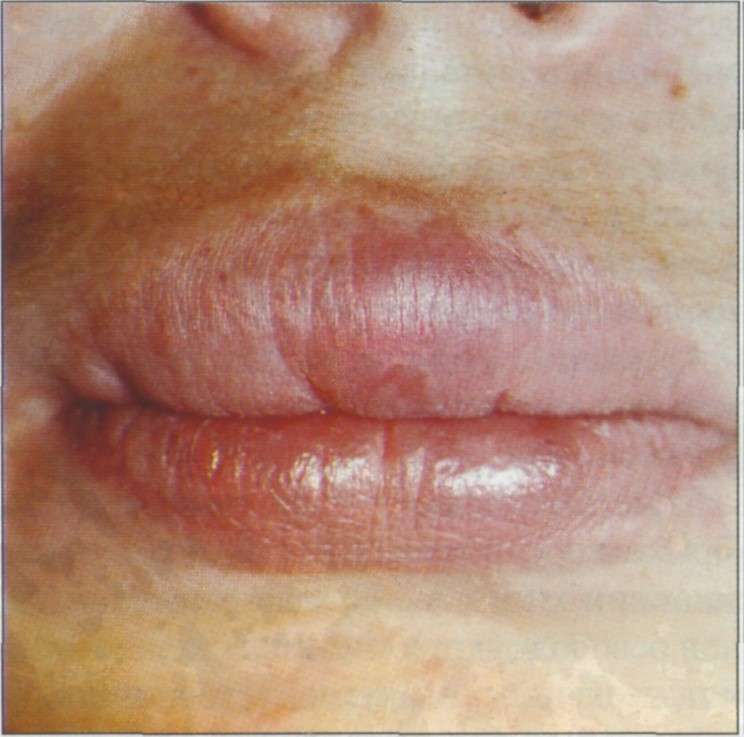
Артикул Google Scholar
Бидарра М., Бьюкенен Дж. А., Скалли С., Родинок Д. Р., Портер С. Р. Красный плоский лишай: состояние с большей стойкостью и экстраоральным поражением, чем предполагалось? J Oral Pathol Med 2008; 37 : 582–586.
PubMed Статья Google Scholar
Лоуренсо С. В., де Карвалью Ф. Р., Богжио П. и др. .Красная волчанка: клинико-гистопатологическое исследование оральных проявлений и иммуногистохимического профиля воспалительного инфильтрата. Дж. Катан Патол 2007; 34 : 558–564.
PubMed Статья Google Scholar
Нико М. М., Вилела М. А, Ривитти Е. А., Лоуренсу С. В. Поражения полости рта при красной волчанке: корреляция с кожными поражениями. евро J Dermatol 2008; 18 : 376–381.
PubMed Google Scholar
Xu H H, Werth V P, Parisi E, Sollecito T. P. Пемфигоид слизистой оболочки. Dent Clin North Am 2013; 57 : 611–630.
PubMed PubMed Central Статья Google Scholar
Леао Дж. К., Ингафу М., Хан А., Скалли С., Портер С. Десквамативный гингивит: ретроспективный анализ ассоциаций болезней большой когорты. Устные сообщения 2008; 14 : 556–560.
PubMed Статья Google Scholar
Chan L S. Пемфигоид глаз и слизистой оболочки полости рта (рубцовый пемфигоид). Clin Dermatol 2012; 30 : 34–37.
PubMed Статья Google Scholar
Касперкевич М., Цилликенс Д., Шмидт Э. Пемфигоидные болезни: патогенез, диагностика и лечение. Аутоиммунитет 2012; 45 : 55–70.
PubMed Статья Google Scholar
Lähteenoja H, Irjala K, Viander M, Vainio E, Toivanen A, Syrjänen S. У пациентов с герпетиформным дерматитом часто поражается слизистая оболочка полости рта. Arch Dermatol 1998; 134 : 756–758.
PubMed Статья Google Scholar
Саид С., Голиц Л.Везикулобуллезные высыпания ротовой полости. Otolaryngol Clin North Am 2011; 44 : 133–160, vi.
PubMed Статья Google Scholar
Дэн Х., Лу Р., Ли В., Чен К., Цзэн Х. Линейное заболевание IgA, ограниченное слизистой оболочкой рта. J Am Acad Dermatol 2011; 65 : 677–679.
PubMed Статья Google Scholar
Eguia del Valle A, Aguirre Urízar JM, Martínez Sahuquillo A.Оральные проявления, вызванные линейной болезнью IgA. Med Oral 2004; 9 : 39–44.
PubMed Статья Google Scholar
Sticherling M, Erfurt-Berge C. Аутоиммунные болезни кожи с образованием пузырей. Autoimmun Ред. 2012; 11 : 226–230.
PubMed Статья Google Scholar
Santoro F A, Stoopler E T, Werth V P.Пузырчатка. Dent Clin North Am 2013; 57 : 597–610.
PubMed Статья Google Scholar
Niimi Y, Ohyama B, Di Zenzo G, Calabresi V, Hashimoto T., Kawana S. Паранеопластическая пузырчатка проявляется в виде легких кожных проявлений листовидной пузырчатки и лихеноидного стоматита с антителами к десмоглеину 1. Dermatol Res Pract 2010; 2010 : DOI: 10.1155 / 2010/931340.
Артикул Google Scholar
Cozzani E, Rosa G M, Drosera M, Intra C, Barsotti A, Parodi A. Ингибиторы АПФ могут индуцировать циркулирующие антитела, направленные к антигенам поверхностных эпидермальных клеток. Arch Dermatol Res 2011; 303 : 327–332.
Ингибиторы АПФ могут индуцировать циркулирующие антитела, направленные к антигенам поверхностных эпидермальных клеток. Arch Dermatol Res 2011; 303 : 327–332.
PubMed Статья PubMed Central Google Scholar
Аль-Йохани К.А., Феделе С., Портер С.Р. Многоформная эритема и связанные с ней расстройства. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2007; 103 : 642–654.
PubMed Статья Google Scholar
Muzyka B C, Epifanio R N.Обновленная информация о грибковых инфекциях полости рта. Dent Clin North Am 2013; 57 : 561–581.
PubMed Статья Google Scholar
Stoopler E. T., Sollecito T. P. Заболевания слизистой оболочки полости рта: оценка и лечение. Med Clin North Am 2014; 98 : 1323–1352.
PubMed Статья Google Scholar
Lanternier F, Cypowyj S, Picard C et al .Первичные иммунодефициты, лежащие в основе грибковых инфекций. Curr Opin Pediatr 2013; 25 : 736–747.
PubMed PubMed Central Статья Google Scholar
Кисанд К., Петерсон П. Аутоиммунная полиэндокринопатия, кандидоз, эктодермальная дистрофия и другие первичные иммунодефицитные заболевания помогают решить природу защитного иммунитета против хронического кожно-слизистого кандидоза. Curr Opin Pediatr 2013; 25 : 715–721.
PubMed Статья Google Scholar
Линд Э, Бреннстрем Дж, Джонс П. и др. . Аутоиммунитет и дефицит цистатина SA1 в основе хронического кожно-слизистого кандидоза при аутоиммунном полиэндокринном синдроме 1 типа. J Autoimmun 2013; 42 : 1–6.
PubMed Статья Google Scholar
Capalbo D, Improda N, Esposito A et al .Аутоиммунная полиэндокринопатия, кандидоз, эктодермальная дистрофия с точки зрения педиатрии. J Endocrinol Invest 2013; 36 : 903–912.
PubMed Google Scholar
Портер С. Р., Скалли К. Синдром кандидозной эндокринопатии. Oral Surg Oral Med Oral Pathol 1986; 61 : 573–578.
PubMed Статья Google Scholar
Келесидис Т., Ян О.Синдром Гуда остается загадкой спустя 55 лет: систематический обзор научных данных. Clin Immunol 2010; 135 : 347–363.
PubMed Статья Google Scholar
Шепард М. К., Шифтер М., Пальме С. Э. Множественные плоскоклеточные карциномы полости рта, связанные с аутоиммунной полиэндокринопатией, кандидозно-эктодермальной дистрофией. Oral Surg Oral Med Oral Pathol Oral Radiol 2012; 114 : e36-e42.
PubMed Статья Google Scholar
Портер С. Р., Меркаданте В., Феделе С. Неопухолевое заболевание слюнных желез. В оториноларингологии Скотта-Брауна: хирургия головы и шеи , 8-е издание. Лондон: Ходдер Арнольд (в печати).
Джефферс Л. К., Мэдден В., Вебстер-Сириак Дж. Б. К. Вирус тропизма к клеткам слюнных желез человека in vitro: последствия для передачи. Virology 2009; 394 : 183–193.
PubMed Статья Google Scholar
Бургер-Кальдерон Р., Мэдден В., Халлетт Р. А., Джинджерих А. Д., Никелейт В., Вебстер-Сириак Дж. Репликация орального вируса BK в клетках слюнных желез человека. J Virology 2014; 88 : 559–573.
PubMed Статья Google Scholar
Махаджан В. С., Матто Х., Дешпанде В., Пиллай С. С., Стоун Дж. Х.Заболевание, связанное с IgG4. Энн Рев Патол 2014; 9 : 315–347.
С., Матто Х., Дешпанде В., Пиллай С. С., Стоун Дж. Х.Заболевание, связанное с IgG4. Энн Рев Патол 2014; 9 : 315–347.
Артикул Google Scholar
Дешпанде В., Зен Й, Чан Дж. К. С и др. . Консенсусное заявление о патологии заболеваний, связанных с IgG4. Mod Pathol 2012; 25 : 1181–1192.
Артикул Google Scholar
Мандель Л., Хелемский Р. Бессимптомный двусторонний отек лица. J Am Dent Assoc 2012; 143 : 1205-1208.
PubMed Статья Google Scholar
Capoccia L, Sbarigia E, Speziale F. Монолатеральный сиаладенит после введения йодированного контрастного вещества для стентирования сонной артерии. Сосудистые 2010; 18 : 34–36.
PubMed Статья Google Scholar
Чау А. М. Т, Суан Д.Йодистый паротит. Клиническая визуализация 2013; 37 : 367–368.
PubMed Статья Google Scholar
Shacham Y, Havakuk O, Roth A. Редкий случай острого контрастного сиаладенита после чрескожного коронарного вмешательства. Israel Med Assoc J 2013; 15 : 652–653.
Google Scholar
Брукс К.Г., Томпсон Д.Ф.Обзор и оценка лекарственного паротита. Ann Pharmacother 2012; 46 : 1688–1699.
PubMed Статья Google Scholar
Дженсен С. Б., Педерсен А. М. Л., Виссинк А. и др. . Систематический обзор гипофункции слюнных желез и ксеростомии, вызванной лечением рака: распространенность, тяжесть и влияние на качество жизни. Support Care Cancer 2010; 18 : 1039–1060.
PubMed Статья Google Scholar
Конингс А. В. Т, Коппс Р. П., Виссинк А. О механизме радиочувствительности слюнных желез. Int J Radiat Oncol Biol Phys 2005; 62 : 1187–1194.
В. Т, Коппс Р. П., Виссинк А. О механизме радиочувствительности слюнных желез. Int J Radiat Oncol Biol Phys 2005; 62 : 1187–1194.
PubMed Статья Google Scholar
Рекстен Т. Р., Йонссон М. Синдром В. Сьегрена: обновленная информация об эпидемиологии и текущие взгляды на патофизиологию. Oral Maxillofac Surg Clin North Am 2014; 26 : 1–12.
PubMed Статья Google Scholar
Вулгарелис М., Зиакас П.Д., Папагеоргиу А., Баимпа Э., Циуфас А.Г., Муцопулос Н.М. Прогноз и исход неходжкинской лимфомы при первичном синдроме Шегрена. Медицина 2012; 91 : 1–9.
PubMed Статья Google Scholar
Routsias J G, Goules J D, Charalampakis G, Tzima S, Papageorgiou A, Voulgarelis M.Злокачественная лимфома при первичном синдроме Шегрена: обновленная информация о патогенезе и лечении. Semin Arthritis Rheum 2013; 43 : 178–186.
PubMed Статья Google Scholar
Микроорганизмы | Бесплатный полнотекстовый | Микробиом полости рта человека в условиях здоровья и болезней: от последовательностей к экосистемам
1. Введение
Подобно различным наземным биомам, составляющим Землю, микробиом человека представляет собой серию отдельных сообществ бактерий, грибов, вирусов, архей и протистов. , и другие микроорганизмы, состав которых зависит от условий окружающей среды [1].Различные участки человеческого тела можно рассматривать как уникальные биомы с резко различающейся средой и доступностью питательных веществ, что, в свою очередь, способствует развитию различных сообществ. Тем не менее, даже в пределах определенного участка тела состав микробиома может сильно варьироваться между людьми с разным состоянием здоровья, с разным образом жизни или из-за ряда других факторов [2]. В центре внимания этого обзора будет микробиом ротовой полости человека, методы подхода к его анализу и описание его типичного состава, который мы знаем в настоящее время, а также его отклонений в нетипичных условиях.Ротовая полость содержит одно из самых разнообразных и уникальных сообществ микробов в организме человека [3,4], однако эта ниша относительно мало изучена по сравнению с кишечником — на момент написания этого обзора поиск в PubMed с «оральным микробиом »привел к 746 статьям по сравнению с 5605 статьями о« кишечном микробиоме ». Миллилитр слюны содержит приблизительно 10 8 микробных клеток [5], а ряд исследований выявил до 700 различных таксонов прокариот [6], при этом типичный здоровый микробиом состоит из диапазона примерно от 100 до 200 различных бактериальных организмов. [7].Появление методов секвенирования следующего поколения (NGS) открыло новые возможности для крупномасштабных метагеномных исследований в различных популяциях, что позволило охарактеризовать структуру микробиома и, в некоторых случаях, функциональные роли и последствия для здоровья. является домом для множества уникальных местообитаний, в каждой из которых есть свое сообщество микроорганизмов. Микробиомы слюны, языка, слизистой оболочки щек, поверхностей зубов, десен, неба, поддесневого и наддесневого налета, а также горла и миндалин были охарактеризованы в многочисленных исследованиях, показывающих общее сходство, но с небольшими различиями. такие как более высокие уровни рода Corynebacterium в обоих типах бляшек [3,8] или более высокие уровни типа Firmicutes как в слюне, так и в слизистой оболочке щек по сравнению с бляшками [8,9].В то время как некоторые метагеномные исследования рассматривают эти отдельные среды обитания по отдельности, также нередко используют полоскание полости рта в качестве метода сбора образцов, чтобы получить репрезентативный образец всего микробиома полости рта [10,11,12]. Независимо от конкретного исследуемого биома или среды обитания, текущая тенденция в исследованиях микробиома в основном заключается в использовании преимуществ технологий NGS, не зависящих от культуры, поскольку они продолжают снижаться как в финансовых, так и в вычислительных затратах, наряду с постоянным расширением баз данных микробных генетических последовательностей.
В центре внимания этого обзора будет микробиом ротовой полости человека, методы подхода к его анализу и описание его типичного состава, который мы знаем в настоящее время, а также его отклонений в нетипичных условиях.Ротовая полость содержит одно из самых разнообразных и уникальных сообществ микробов в организме человека [3,4], однако эта ниша относительно мало изучена по сравнению с кишечником — на момент написания этого обзора поиск в PubMed с «оральным микробиом »привел к 746 статьям по сравнению с 5605 статьями о« кишечном микробиоме ». Миллилитр слюны содержит приблизительно 10 8 микробных клеток [5], а ряд исследований выявил до 700 различных таксонов прокариот [6], при этом типичный здоровый микробиом состоит из диапазона примерно от 100 до 200 различных бактериальных организмов. [7].Появление методов секвенирования следующего поколения (NGS) открыло новые возможности для крупномасштабных метагеномных исследований в различных популяциях, что позволило охарактеризовать структуру микробиома и, в некоторых случаях, функциональные роли и последствия для здоровья. является домом для множества уникальных местообитаний, в каждой из которых есть свое сообщество микроорганизмов. Микробиомы слюны, языка, слизистой оболочки щек, поверхностей зубов, десен, неба, поддесневого и наддесневого налета, а также горла и миндалин были охарактеризованы в многочисленных исследованиях, показывающих общее сходство, но с небольшими различиями. такие как более высокие уровни рода Corynebacterium в обоих типах бляшек [3,8] или более высокие уровни типа Firmicutes как в слюне, так и в слизистой оболочке щек по сравнению с бляшками [8,9].В то время как некоторые метагеномные исследования рассматривают эти отдельные среды обитания по отдельности, также нередко используют полоскание полости рта в качестве метода сбора образцов, чтобы получить репрезентативный образец всего микробиома полости рта [10,11,12]. Независимо от конкретного исследуемого биома или среды обитания, текущая тенденция в исследованиях микробиома в основном заключается в использовании преимуществ технологий NGS, не зависящих от культуры, поскольку они продолжают снижаться как в финансовых, так и в вычислительных затратах, наряду с постоянным расширением баз данных микробных генетических последовательностей. .Согласно расширенной базе данных орального микробиома человека (HOMD) [13], только 57% видов бактерий полости рта были официально названы, 13% культивировались, но остаются неназванными, а 30% не культивируются. Следовательно, методы NGS не только позволяют сделать анализ относительно быстрым и легким, но и значительно расширили нашу осведомленность о некультивируемой и / или редкой микробиоте. Во рту могут быть затронуты несколько патологий, которые широко распространены среди людей, включая пародонтит, гингивит и кариес зубов, все из которых явно связаны с изменениями в микробиоме полости рта (см. ссылки в таблице 1).Однако рот представляет собой точку входа в дыхательную и пищеварительную системы, и он сильно васкуляризован, что приводит к потенциальным последствиям микробиома полости рта при других системных заболеваниях. Действительно, все большее количество исследований показывает связь между другими заболеваниями и изменениями в микробиоме полости рта (Таблица 2). Это говорит о том, что микробиота полости рта может служить потенциальными биомаркерами при диагностике некоторых системных заболеваний. При поиске этих отклонений в популяциях мы также должны учитывать предостережение, что наши знания о микробиоме человека могут быть далеко не полными.Недавние исследования собрали данные о ранее не изученных популяциях и обнаружили не только различия в составе, но даже добавили множество неоткрытых видов в общедоступные базы данных [44,45], подчеркнув сильные различия между различными регионами мира. Большинство исследований было сосредоточено на европейских, североамериканских, китайских или других так называемых «СТРАННЫХ» группах населения. Это относится к западным, образованным, промышленно развитым, богатым и демократическим странам — аббревиатура, которая была первоначально предложена для обозначения предвзятости в психологических исследованиях в пользу этих обществ, которые в то время составляли около 13% населения мира, но составляли от 60 до 60 человек. % и 90% субъектов психологических исследований [46].
.Согласно расширенной базе данных орального микробиома человека (HOMD) [13], только 57% видов бактерий полости рта были официально названы, 13% культивировались, но остаются неназванными, а 30% не культивируются. Следовательно, методы NGS не только позволяют сделать анализ относительно быстрым и легким, но и значительно расширили нашу осведомленность о некультивируемой и / или редкой микробиоте. Во рту могут быть затронуты несколько патологий, которые широко распространены среди людей, включая пародонтит, гингивит и кариес зубов, все из которых явно связаны с изменениями в микробиоме полости рта (см. ссылки в таблице 1).Однако рот представляет собой точку входа в дыхательную и пищеварительную системы, и он сильно васкуляризован, что приводит к потенциальным последствиям микробиома полости рта при других системных заболеваниях. Действительно, все большее количество исследований показывает связь между другими заболеваниями и изменениями в микробиоме полости рта (Таблица 2). Это говорит о том, что микробиота полости рта может служить потенциальными биомаркерами при диагностике некоторых системных заболеваний. При поиске этих отклонений в популяциях мы также должны учитывать предостережение, что наши знания о микробиоме человека могут быть далеко не полными.Недавние исследования собрали данные о ранее не изученных популяциях и обнаружили не только различия в составе, но даже добавили множество неоткрытых видов в общедоступные базы данных [44,45], подчеркнув сильные различия между различными регионами мира. Большинство исследований было сосредоточено на европейских, североамериканских, китайских или других так называемых «СТРАННЫХ» группах населения. Это относится к западным, образованным, промышленно развитым, богатым и демократическим странам — аббревиатура, которая была первоначально предложена для обозначения предвзятости в психологических исследованиях в пользу этих обществ, которые в то время составляли около 13% населения мира, но составляли от 60 до 60 человек. % и 90% субъектов психологических исследований [46]. Это раннее свидетельство подобной предвзятости в исследованиях микробиома предполагает, что остается возможность гораздо более широкого ландшафта «здоровых» микробиомов в разных культурах. Более того, даже в пределах здоровых выборок из одних и тех же популяций можно выявить отдельные подгруппы [10,47,48,49,50,51]. Таким образом, в дополнение к сосредоточению внимания на понимании причин и последствий дисбиоза в микробиоме, Также необходимо постоянно уделять внимание полной характеристике здорового микробиома, чтобы более надежно обнаруживать истинные отклонения от нормального состояния.
Это раннее свидетельство подобной предвзятости в исследованиях микробиома предполагает, что остается возможность гораздо более широкого ландшафта «здоровых» микробиомов в разных культурах. Более того, даже в пределах здоровых выборок из одних и тех же популяций можно выявить отдельные подгруппы [10,47,48,49,50,51]. Таким образом, в дополнение к сосредоточению внимания на понимании причин и последствий дисбиоза в микробиоме, Также необходимо постоянно уделять внимание полной характеристике здорового микробиома, чтобы более надежно обнаруживать истинные отклонения от нормального состояния.Исследования, направленные на определение состава микробиома полости рта в различных популяциях человека, быстро развиваются, равно как и исследования, которые ищут вариации в соответствии с растущим числом параметров, особенно связанных со здоровьем и болезнями. В этом обзоре мы даем общий обзор современных методологий, используемых для изучения микробиома полости рта, и основных результатов, полученных за последнее десятилетие интенсивных исследований. Наконец, мы обсудим текущие проблемы и перспективы этой быстро меняющейся области.На протяжении всего обзора мы сосредоточим внимание на новой роли микробиома полости рта в здоровье и болезнях, а также на новых возможностях терапии и диагностики.
2. Технические подходы к изучению микробиома полости рта
Стоимость секвенирования ДНК резко упала благодаря внедрению технологий NGS, которые теперь позволяют ученым секвенировать несколько геномов человека за один день по цене менее 1000 долларов за геном, что почти невозможно. в миллион раз меньше, чем 20 лет назад [52].Точно так же существует ряд экономичных методов NGS, которые можно использовать сегодня при приближении к исследованиям микробиома, в зависимости от того, что исследователь надеется узнать (рис. 1). Два наиболее широко используемых подхода включают секвенирование целого метагенома (WMS) и секвенирование ампликона рибосомной РНК 16S, оба из которых включают считывание последовательностей ДНК микробов, присутствующих в образце, и сравнение их с базой данных последовательностей для установления относительного количества различные организмы, присутствующие в этом образце.При секвенировании WMS (рис. 1C) ДНК случайным образом фрагментируется несколько раз, что позволяет читать миллионы коротких последовательностей параллельно, а затем они повторно собираются в полные (или частичные) геномные последовательности, соединяя перекрывающиеся концы [53]. Однако секвенирование 16S рРНК (рис. 1A), также известное как штрих-кодирование 16S, чаще используется в метагеномных исследованиях, поскольку оно менее затратно как в экспериментальном, так и в вычислительном отношении, что позволяет проводить более масштабные исследования. Ген 16S рРНК является общим для всех бактерий и архей и имеет высококонсервативные области, что делает его полезным маркером для использования универсальных последовательностей праймеров для его выделения для секвенирования.Среди консервативных областей гена разбросаны девять гипервариабельных областей (от V1 до V9), и именно эти сегменты позволяют таксономическую идентификацию организмов при картировании считываний в базе данных известных последовательностей 16S рРНК [54]. даже с использованием ASV для идентификации, секвенированию 16S все еще недостает значительного таксономического разрешения по сравнению с секвенированием WMS, часто позволяя различать только до уровня рода. Альтернативы секвенированию 16S также были предложены для того, чтобы улучшить разрешение или избежать систематической ошибки из-за различного количества копий гена 16S у разных видов [60] (хотя есть методы для его исправления [61]).Например, ген rpoB имеет преимущество в том, что он обычно является единственной копией и имеет большую вариативность, что позволяет проводить более глубокое таксономическое разрешение. Однако соответствующее отсутствие сохранения делает его менее применимым в качестве универсального маркера [62]. База данных последовательностей генов rpoB доступна на сайте FROGS (Find, Rapidly, Otus with Galaxy Solution) [63]. Некоторые предложили секвенировать один или несколько генов домашнего хозяйства, таких как rpoB, вместе с геном 16S, поскольку они распространены повсеместно и быстро эволюционируют, обеспечивая лучшее таксономическое разрешение, чем только ген 16S [64].Чтобы различать близкородственные организмы, другие предложили подход мультилокусного анализа последовательностей (MLSA), при котором несколько генов домашнего хозяйства из разных хромосомных локусов секвенируются параллельно [65]. Тем не менее, ген 16S рРНК остается текущим стандартом для анализа маркерных генов микробиома. Все упомянутые методы маркерных генов полезны при постановке вопроса «Какие микроорганизмы присутствуют в образце?», Дающем обзор микробного состава во многих образцах.Однако секвенирование WMS может позволить обнаруживать виды или даже штаммы в дополнение к функциональным аннотациям образцов микробиома [66], которые можно предсказать только на основе известных полных последовательностей генома при выполнении секвенирования 16S. Таким образом, WMS дополнительно дает представление о функциональном потенциале микробиома, позволяя исследователям задать вопрос: «Что на самом деле могут делать присутствующие микроорганизмы?». Исследования метагенома могут быть дополнительно подкреплены использованием метатранскриптомики [67], метапротеомики [68]. , и метаболомика [69], хотя только первая из них использует технологии NGS.Метатранскриптомика (рис. 1D) отвечает на вопрос: «Что делают микроорганизмы?» Здесь идея состоит в том, чтобы профилировать общую экспрессию микробных генов в образце, фиксируя содержание общей информационной РНК (мРНК), поэтому это особенно полезно при изучении функциональной активности микробиома в различных условиях, таких как болезнь по сравнению со здоровьем, разные диеты или разное время дня. Метапротеомика (рис. 1E) — это еще один подход к оценке функциональной активности образца микробиома, но вместо секвенирования генетического материала идея состоит в том, чтобы каталогизировать количество микробных белков, присутствующих в образце.Обычно это делается путем экстракции белка и тандемного масс-спектрометрического анализа (МС / МС) [68]. Метаболомика (рис. 1E), с другой стороны, отвечает на вопрос: «Какие микроорганизмы продуцируются в данном образце?» Метаболом — это полный набор небольших молекул, продуцируемых микробиомом (и хозяином) в образце, и может быть сильным индикатором здоровья или дисбактериоза образца [70]. Метаболиты обычно количественно оцениваются с помощью хроматографии и методов обнаружения, таких как масс-спектрометрия (МС) и ядерный магнитный резонанс (ЯМР).Каждый из этих методов также имеет свои недостатки, которые не позволяют использовать его так же широко, как метагеномика. Метатранскриптомике могут препятствовать нестабильность мРНК и избыток рРНК (хотя были разработаны методы противодействия этому [71]), а также ограниченные справочные базы данных транскриптомов [72]. Метапротеомика страдает вычислительными ограничениями при запросе к базам данных белков (которые, тем не менее, остаются неполными), а также избыточностью аннотаций из-за идентичных пептидов в гомологичных белках от разных организмов, которые могут использовать их в разных процессах, тем самым оставляя итоговые таксономические и функциональная количественная оценка неоднозначна [68].Однако последние инструменты утверждают, что борются с обеими этими проблемами [73]. С метаболомикой проблемы заключаются в том, чтобы определить, производятся ли метаболиты хозяином или микробиомом, и связать их с соответствующими генами и путями, что подчеркивает необходимость интеграции этого метода с другими данными омики [72]. инструменты и методы часто направлены на исследование бактериома, который составляет наиболее значительную часть микробиома, но не целиком.Чтобы классифицировать состав микобиома, грибкового компонента микробиома, исследователи часто используют маркерную область, очень похожую на ген 16S рРНК, называемую внутренней транскрибируемой спейсерной областью цистрона ядерной рибосомной РНК, называемой областью ITS (рис. 1A), который обеспечивает такое же таксономическое разрешение, что и при секвенировании 16S для бактерий [74]. Доступ к вирому, вирусному компоненту микробиома, может быть затруднительным, поскольку отсутствуют консервативные маркерные области, подобные гену 16S рРНК у бактерий или ITS-области у грибов.Таким образом, необходимо взять образец полного вирома и сравнить его с известными вирусными последовательностями. Из-за этого возникают две проблемы, поскольку в текущих вирусных базах данных отсутствует характеристика многих вирусов, и, следовательно, любые новые вирусные последовательности, которые не соответствуют таковым в текущих базах данных, будет трудно классифицировать [75]. Другой проблемой для исследований вирома является относительно низкая доля вирусных нуклеиновых кислот наряду с другими микробами. Однако были предложены процедуры обогащения для увеличения содержания вирусных нуклеиновых кислот [76].Совсем недавно был предложен новый подход, названный геномикой одного вируса (SVG) (рис. 1B), в котором отдельные вирусы выделяются с помощью сортировки вирусов, активируемой флуоресценцией (FAVS), а геномный материал амплифицируется и секвенируется [77]. При использовании техники важно, чтобы исследователи пришли к консенсусу относительно точной процедуры сбора и секвенирования для обеспечения воспроизводимости. Хотя некоторые из упомянутых исследований показали, что профиль микробиома образца не сильно зависит от метода сбора [78,79], они сосредоточены на крупномасштабных различиях.Однако по мере того, как технологии секвенирования становятся более эффективными, а базы данных, связанные с микробиомом, становятся более полными, исследователи будут продолжать сравнивать образцы в более мелких масштабах, поэтому незначительные технические вариации, возникающие из-за различных методов взятия мазков или использования другого раствора для сборов полосканий полости рта, потенциально могут результаты воздействия. Были опубликованы некоторые обзоры современных передовых практик [80,81], и их следует продолжать улучшать и развивать. В зависимости от целей исследования исследователя существует множество потенциальных подходов к анализу данных, и их в равной степени много. доступные программные пакеты.Пакеты phyloseq [82] и microbiome [83] для R предлагают средства для организации данных экспериментов по секвенированию вместе с любыми метаданными, а также предоставляют набор инструментов и руководств для расчетов и построения графиков в типичных анализах микробиома. Сюда входят функции для расчета альфа-разнообразия (относительного разнообразия таксонов, присутствующих в образце) и бета-разнообразия (относительного расстояния между любыми двумя образцами на основе общего состава, а также графики для различных методов ординации.Оттуда биоинформатик может пойти в любом количестве направлений, поэтому здесь мы просто упомянем некоторые из наиболее известных анализов. Веганский пакет R [84] предлагает варианты многомерных тестов, таких как функция аносима (анализ сходства) для определения различий в составе микробиома между группами образцов и функция адониса для перманова (пермутационный многомерный дисперсионный анализ), которые могут применять линейный модели для определения источников вариации среди выборок. Модели линейных смешанных эффектов также могут применяться для определения воздействия на различные точки данных, такие как конкретные таксоны, уровни разнообразия или другие переменные метаданных.Стандартные или обобщенные линейные модели могут быть подогнаны с использованием функций lm или glm, соответственно, из основного пакета R, называемого stats [85]. Модели смешанных эффектов также можно использовать с функциями lmer и glmer из пакета lme4 [86]. Также доступны варианты программного обеспечения для прогнозирования функциональных возможностей образца микробиома, секвенированного с использованием маркерного гена-мишени, такого как 16S рРНК. Инструменты PICRUSt (филогенетическое исследование сообществ путем реконструкции ненаблюдаемых состояний) [87] и Tax4Fun [88] используют базы данных эталонных геномов, чтобы попытаться восстановить полные метагеномы из каждого образца.Также были реализованы методы машинного обучения, чтобы попытаться предсказать болезнь на основе состава микробиома [89], и некоторые исследователи сделали свой код общедоступным [90,91]. Микробиом полости рта с некоторым успехом даже использовался в классификаторе колоректального рака [92]. В последнее время в этой области возникают разногласия по поводу композиционной природы данных микробиома и значения для их анализа, что некоторые начали обратиться как с экспериментальной [93], так и со статистической [94] точки зрения.Поскольку считывания, полученные в эксперименте NGS, по сути являются случайными выборками относительных численностей присутствующих организмов, это не может объяснить последствия различий в общей численности организмов, которые могут быть физиологически значимыми. Vandeputte et al. описал экспериментальный метод, называемый количественным профилированием микробиома (QMP) [93], в котором общая микробная нагрузка определяется путем отбора равного количества последовательностей на образец, а затем корректировки смещения числа копий 16S и общего количества клеток в образце. .Они смогли использовать этот подход, чтобы выявить ошибочные результаты стандартного эксперимента, предложив решение некоторых технических предубеждений, присущих исследованиям NGS. Однако, поскольку большинство наборов данных на сегодняшний день не были упорядочены с помощью каких-либо методов, таких как QMP, были предложены другие решения для обработки типичных асимметричных наборов данных в исследованиях микробиома. Редкость подсчетов считываний, при которой из каждой выборки извлекается случайная выборка с одинаковым количеством считываний, была обычным подходом в более ранних исследованиях микробиома, но эта практика не поощрялась, поскольку она пропускала биологически значимую информацию [95].Gloor et al. вместо этого предлагается нормализовать данные с помощью преобразования с центрированным логарифмическим соотношением, на которое минимально влияет глубина считывания выборки [94]. Они также предоставили руководство по рабочему процессу, которое сопровождает их публикацию по этой теме.3. Ротовая полость и ее микробные ниши
Из всех мест обитания в человеческом теле, для которых обычно изучается микробиом, полость рта требует, пожалуй, самого уникального подхода к исследованию, поскольку она содержит ряд четко выраженных ниш, образованных на различных поверхностях во рту.Изменения в доступности кислорода, питательных веществ и pH-опосредованного эффекта слюны [96] могут способствовать росту различных организмов, и, наоборот, эти организмы могут участвовать в строительстве своей собственной небольшой ниши [97] посредством образования биопленок и питательных веществ. метаболизм, который может оказывать влияние как внутри ротовой полости (Таблица 1, Рисунок 2), так и системно (Таблица 2, Рисунок 2). Некоторые исследователи решили изучить все эти ниши параллельно, чтобы сравнить их друг с другом [3,8,9], некоторые выбрали отдельные сайты с особым акцентом на локализованный дисбактериоз при болезненных состояниях [98,99,100,101,102,103,104,105,106], а другие использовали полоскание рта для получения общего вида ротовой полости [10,11,12].Исследования, посвященные конкретным нишам полости рта, обычно направлены на изучение заболевания, имеющего отношение к этому месту. Например, первичный синдром Шегрена (ПСС) в слизистой оболочке щеки считался потенциальным резервуаром для патогенов, неявных в заболевании, при этом было показано, что образцы болезни имеют более высокое соотношение Firmicutes / Proteobacteria по сравнению со здоровым контролем и более высокое содержание бактерий. 19 родов [98]. Различные исследования охарактеризовали изменения поддесневого и наддесневого налета, связанные с пародонтитом [99,100,101,102], а также исследование поддесневого налета и слизистой оболочки щеки, показавшее, что оба участка различались между образцами пародонтита и здоровыми контрольными людьми, причем многие из тех же микроорганизмов были затронуты в обоих стоянки, хотя они также демонстрируют уникальную видовую колонизацию [103].Микробиом языка был исследован у пожилых людей в Японии из-за потенциальной связи между проглоченными микробами и пневмонией, в результате чего было обнаружено, что образцы с более плохим состоянием зубов были обогащены бактериями, связанными с пневмонией [104]. Язык также был выбран как потенциальный сегмент диагностических инструментов, которые, возможно, будут включать микробиомы всего желудочно-кишечного тракта для выявления рака поджелудочной железы [105]. Небные миндалины были исследованы у ВИЧ-инфицированных пациентов, чтобы лучше понять оральные и системные осложнения заболевания, и было показано, что бактериом действительно был значительно изменен у инфицированных людей, а микобиом — нет [106].В широком смысле микробный состав во всех областях ротовой полости довольно постоянен, что делает его легко отличимым от микробиомов других мест обитания человеческого тела [3,107,108,109,110]. Однако, хотя ниши в полости рта в основном состоят из одних и тех же организмов, некоторые из них могут присутствовать в разных пропорциях. Одно исследование, объединяющее образцы из 10 ниш вдоль пищеварительного тракта у более чем 200 человек из США, разделило эти ниши на четыре группы на основе сходства общего состава [8].Одним из участков был кишечник, представленный образцами стула, которые были сгруппированы отдельно, в то время как другие девять находились во рту и горле. Одна из трех других групп состояла из слизистой оболочки щек, ороговевшей десны и твердого неба, другая — из языка, слюны, небных миндалин и горла, а последняя группа содержала поддесневые и наддесневые бляшки. Хотя во всех нестулевых нишах, как правило, доминировали филы Firmicutes и Bacteroidetes, они основывали группы больше на мелкомасштабных различиях.Первая группа была более уникальной, чем две другие группы, не относящиеся к стулу, и, как было показано, имела значительно более высокую численность рода Streptococcus и более низкое общее альфа-разнообразие, которое является мерой относительного разнообразия организмов, присутствующих в данном образце. Группа 3, содержащая два типа десневого налета, обычно имела более высокое альфа-разнообразие. Сравнение между составом этих ниш и их разнообразием было подтверждено в других исследованиях [3,9,111]. Авторы утверждают, что уровень слюноотделения во рту является ключевым фактором, определяющим состав микробиома в каждой нише в оральной среде обитания из-за его способности регулировать pH и доступность питательных веществ, но другие важные факторы могут включать тип поверхности. и доступность кислорода.Эти две бляшки, например, образуются на не отшелушивающих поверхностях зубов, где образуются биопленки, внутри которых ограничен кислород, что приводит к большему количеству облигатных анаэробных организмов в поддесневой бляшке и факультативных анаэробных организмов в наддесневой бляшке [8 ]. Они предполагают, что одну нишу из каждой группы можно использовать для представления всех ниш в этой группе, например, используя микробиом слизистой оболочки щеки в качестве прокси для микробиомов ороговевшей десны и микробиома твердого неба (ниши группы 1).Однако по мере того, как методы секвенирования продолжают совершенствоваться, а затраты продолжают снижаться, мы можем обнаруживать все больше и больше тонких идиосинкразий в каждой нише из-за комбинаций только что упомянутых факторов микросреды, а также любых других. Таким образом, это решение будет зависеть от усмотрения исследователей и актуальности для их исследований. Поскольку эти ниши, как правило, имеют очень похожий общий состав микробиома на всех, кроме самых низких таксономических уровней, многие исследователи предпочитают рассматривать полость рта как отдельную личность. среды обитания и проанализировать глобальный состав и процессы в ней [10,12,112].Несколько исследований показали, что это жизнеспособный и эффективный метод сбора образцов для исследования микробиома полости рта [78,79], и были предложены стандартизированные процедуры [113,114]. По сути, человек должен воздерживаться от еды, питья, чистки зубов или курения (всего, что может временно изменить типичный микробный состав) как минимум за 30 минут до сбора. Затем они полоскали буферным раствором в течение примерно 30-60 с, а затем сплевывали содержимое в пробирку, которую позже центрифугировали и секвенировали.Практические преимущества использования ополаскивателя для полости рта заключаются в простоте сбора, поскольку это быстрый и неинвазивный метод получения ДНК микробов из полости рта у участника исследования, а также в простоте хранения и транспортировки, поскольку эти образцы можно замораживать. и секвенировали позже без ущерба для качества образцов [79,115]. Это выгодно для крупномасштабных проектов по микробиому, поскольку позволяет собирать множество образцов, что может занять недели или месяцы, которые впоследствии можно секвенировать вместе, чтобы минимизировать потенциальную техническую систематическую ошибку, присущую проектам секвенирования, как упоминалось в предыдущем разделе. .4. Здоровый микробиом полости рта и определение стоматотипов
Область исследований микробиома, вероятно, все еще находится в зачаточном состоянии, о чем свидетельствуют продолжающиеся усилия по расширению баз данных по известным микробным геномам и борьбе с предвзятостью в сторону «СТРАННЫХ» популяций. как упоминалось во введении [44,45,116]. Сами по себе эти факторы затрудняют эффективное определение того, что составляет «здоровый» микробиом полости рта. Однако, вдобавок ко всему, накопление исследований за последнее десятилетие или около того показало, что даже в пределах определенных популяций потенциально может существовать несколько различных тенденций в составе микробиома среди людей с относительным общим состоянием здоровья [10,48,49,50 , 51].Таким образом, хотя мы, возможно, стремимся исследовать связь микробиома с болезнью, жизненно важно, чтобы мы также продолжали дальнейшее определение состава микробиома в состоянии здоровья среди различных групп населения и исследовали причины сдвигов внутри этих популяций или между ними. образцы для полоскания идеально подходят для наблюдения за тем, как на микробиом среды обитания полости рта в целом влияют внешние факторы. Конечно, фраза «внешние факторы» может охватывать широкий спектр переменных, но некоторые из них, явно связанные с ртом, — это вода, которую мы пьем, и еда, которую мы едим.В когорте из 1319 образцов здоровых подростков из Испании, проанализированных с помощью секвенирования 16S рРНК, было показано, что различия в ионном составе питьевой воды в общественных местах связаны со сдвигами в общем составе микробиома полости рта [10]. Образцы из регионов с большей щелочностью и более высоким уровнем ионов, таких как сульфат (SO4) и натрий (Na), имели более высокую численность родов, таких как Porphyromonas и Flavobacterium, в то время как регионы с более низкими уровнями показали более высокое содержание других родов, включая Veillonella. , Pseudomonas и Ralstonia.Было также показано, что различные диеты способствуют вариациям в составе микробиома, например, в исследовании на основе WMS, сравнивающем микробиомы полости рта у популяций охотников-собирателей (HG) из Филиппин, традиционных фермеров (TF) из Филиппин и Западные контроли (WC) из проекта Human Microbiome Project (образцы из США) [116]. Они показали, что образцы HG имели более высокое альфа-разнообразие, тогда как образцы WC были ниже, а образцы TF попали в середину. Точно так же наблюдался сильный градиент численности основных оральных родов Neisseria и Haemophilus с высокими уровнями Neisseria и низкими уровнями Haemophilus в образцах HG, обратным в образцах WC и образцами TF снова попадающими между ними.Образцы HG, несмотря на хорошее здоровье полости рта, также показали более высокую численность ряда видов, которые обычно считаются оральными патогенами, связанными с гингивитом и пародонтитом по западным стандартам. Функциональный анализ выявил увеличение количества путей биосинтеза витамина B5 в образцах HG и, в меньшей степени, в образцах TF. Было показано, что американцы потребляют большее количество продуктов с витамином B5, поэтому авторы утверждают, что этот недостаток в рационах охотников-собирателей будет способствовать отбору организмов, которые синтезируют его самостоятельно.Напротив, они показали, что образцы WC и, в меньшей степени, образцы TF были обогащены уреазной активностью, особенно из Haemophilus spp. Эта уреаза противодействует падению pH, которое происходит, когда бактерии разлагают сахар до кислых соединений, поэтому выбор этих организмов в образцах WC с их диетами, богатыми сахаром и крахмалом, имеет смысл. Таким образом, авторы предполагают, что организмы, считающиеся оральными патогенами в западных популяциях, действительно могут быть частью здоровых микробиомов различных популяций, таких как сообщества охотников-собирателей, и что патогенные штаммы этих организмов будут отбираться на основе доступности питательных веществ, привязанной к рациону.Еда и вода являются очевидными влияющими факторами, но на микробиом также могут влиять любые другие факторы. Обычный подход на ранних этапах анализа микробиома любой среды обитания тела — сначала взглянуть на широкое влияние таких факторов путем группирования образцов на основе общего микробного состава. Идея разделения образцов на кластеры обсуждалась в раннем исследовании кишечного микробиома на основе NGS, в котором авторы назвали кластеры «энтеротипами», подразумевая наличие различных предполагаемых категорий микробного состава кишечника [47].Они обнаружили три различных энтеротипа, разделение которых было обусловлено в основном различиями в численности конкретных организмов, а именно родов Bacteroides, Prevotella и Ruminococcus, и подтвердили это, обнаружив очень похожие энтеротипы из двух отдельных наборов образцов. Исходя из этого, они предположили, что может существовать некоторое ограниченное количество равновесий симбиотических состояний между человеком-хозяином и его микробиомом, которые могут возникнуть из-за различных диет и образа жизни. С тех пор многие исследования приняли эту технику, а также в исследованиях полости рта. , аналогично составленные кластеры образцов также появились, названные «стоматотипами» в одном из таких исследований, как дань уважения первоначальному термину энтеротип, но со ссылкой на рот [10].Сводная информация о некоторых родах бактерий, которые, как было установлено, совместно встречаются в разных стоматотипах в ходе исследований, представлена в таблице 3. Таким образом, было показано, по крайней мере, два строго подтвержденных стоматотипа, один из которых включает более высокую численность Proteobacteria родов Neisseria и Haemophilus, а другой с более высокой численностью представителей рода Bacteroidetes Prevotella и рода Firmicutes Veillonella. Некоторые исследования показали больше, чем эти два стоматотипа, хотя консенсус в отношении композиций более разнообразен.Некоторые из родов встречаются по-разному, в зависимости от исследования. Явная природа стоматотипов может быть очень привлекательной в качестве средства дифференциации образцов, но эти несоответствия подчеркивают две основные проблемы. Первый проистекает из фрагментарного характера нашего нынешнего понимания микробиома из-за уже обсужденных культурных предубеждений и технических ограничений. У нас еще нет полной картины того, что может составлять различные потенциальные равновесия численности микробов, которые приводят к определенному стоматотипу, потому что мы не исследовали здоровые микробиомы многих уникальных популяций по всему миру, а многие исследования у нас уже есть не хватает разрешения, чтобы объяснить мелкие различия между образцами.Как упоминалось выше, популяции охотников-собирателей с Филиппин, которые были отобраны, были обогащены Neisseria spp. тогда как западные контрольные образцы были обогащены Haemophilus spp. [116]. Это может означать, что образцы из обеих популяций будут сгруппированы в стоматотип 1 из Таблицы 3, поскольку эти два рода управляют равновесием стоматотипа 1, как правило, вместе, но не во всех исследованиях [49]. Между тем, Bacteroidetes (тип, содержащий Prevotella) и Veillonella, движущие силы стоматотипа 2, больше попадали в середину градиента между равновесиями HG и WC, что является дополнительным потенциальным доказательством того, что HG и WC могут группироваться вместе в стоматотипе 1.Как можно примирить сильные различия, показанные между этими двумя популяциями, и доказательства, представленные до сих пор для составов внутри стоматотипов? Это, вероятно, частично может быть объяснено «СТРАННОЙ» предвзятостью в исследованиях, посвященных стоматотипам — возможно, это равновесие возникает в популяциях с вестернизированными диетами, лечением и образом жизни. Однако этот вопрос также связан со второй важной проблемой, которая заключается в статистической релевантности разделения выборок на дискретные кластеры.Идея анализа градиентов численности микробов была предложена как ответ на концепцию энтеротипа [117]. Это привело к дальнейшим обсуждениям достоинств энтеротипов / стоматотипов, предостерегая от их использования в качестве прогностических или диагностических инструментов [118], а также предлагая улучшения в их расчетах, в то же время акцентируя внимание на градиентах численности [107,119]. На Рисунке 3 показан пример различных градиентов численности организмов в Таблице 3, которые были показаны в качестве драйверов стоматотипа, и того, как они связаны со стоматотипами, обнаруженными в случайной подгруппе из 500 образцов из набора данных о микробиоме полости рта [10] .Эти и другие исследования предполагают, что стоматотипы полезны в качестве первого шага в изучении основных вариаций среди образцов, которые затем могут быть дополнительно исследованы путем более глубокого анализа сдвигов в конкретных организмах. Например, в исследовании подростков в Испании они установили связи с составом водопроводной воды, сначала наблюдая карты распределения образцов в двух найденных ими стоматотипах, которые напоминали карты значений жесткости воды по всей Испании, а затем позже. начали изучать воздействие на определенные организмы в своих образцах [10].5. Небактериальные микробы полости рта
Бактерии доминируют как в исследованиях микробиома ротовой полости человека, так и в биомассе среды обитания ротовой полости, при этом количество грибов оценивается в 120]. Тем не менее, существует значительное разнообразие видов грибов, присутствующих в полости рта, включая виды из родов Candida, Aspergillus, Penicillium, Schizophyllum, Rhodotorula и Gibberella [121]. Тем не менее, два основных осложнения ограничили изучение микобиома: (1) сложность идентификации многих видов грибов и (2) путаница в номенклатуре грибов.Обе эти проблемы начали решаться в значительной степени за счет использования технологий NGS. До недавнего времени считалось, что разнообразие микобиома ротовой полости весьма ограничено, в основном преобладали несколько видов Candida [122]. Во многом это произошло из-за того, что многие грибы трудно культивировать в лаборатории, но достижения в технологиях NGS выявили более широкий спектр грибковых организмов, чем ожидалось ранее. Одно исследование показало, что род Malassezia широко распространен во рту [123], но ранее не был обнаружен на этом участке тела, потому что он имеет особые потребности в липидах и требует специальных питательных сред для выращивания в лаборатории, и ранее считалось, что это возбудитель на коже [124].Однако даже в рамках метагеномных исследований могут возникнуть сложности с категоризацией истинного грибкового разнообразия. Например, исследование, повторно анализировавшее образцы, в которых была обнаружена Malassezia, не смогло найти этот род ни в одном из образцов [125], но это, возможно, связано с тем, что в этом втором исследовании не использовался тот же протокол выделения ДНК, что и в первом. , который включал этап, на котором использовались шарики, которые помогали разрушать клеточные стенки и капсулы. Это подчеркивает несоответствие протоколов метагеномных исследований грибов и необходимость стандартизации.Независимо от технических проблем, связанных со сбором и категоризацией генетического материала в исследованиях грибов, существует некоторая двусмысленность в классификации грибов. Например, Malassezia диморфны, имеют как дрожжевую, так и мицелиальную фазы, и в прошлом относились к нескольким родам [123]. Авторы утверждают, что, хотя таксономия для этого конкретного рода в значительной степени решена, более старые исследования могут упускать эту информацию, и эта проблема может также возникать для других грибковых организмов.В течение последнего десятилетия была предпринята попытка положить конец системе двойной номенклатуры, поскольку этот подход стал рассматриваться как архаичный, и с тех пор стала применяться классификация по одному имени [126]. По мере того, как таксономия грибов продолжает расширяться, исследования на основе NGS вносят большой вклад в идентификацию новых видов, как с использованием ITS-ампликона [74], так и метагеномных методов дробовика [127]. Осложнения в технических подходах и классификации привели к скудным исследованиям оральный виром, но мы можем начать делать некоторые выводы из некоторых недавних работ в этой области.Это важный сегмент исследования микробиома, потому что не только эукариотические вирусы могут напрямую влиять на здоровье хозяина, но и прокариотические вирусы могут это делать, изменяя общий состав бактериома и, следовательно, его функцию [75]. Исследование, проведенное в Испании с использованием геномики одного вируса (SVG) и вирусной метагеномики в 15 образцах слюны, обнаружило 439 оральных вирусов, которые они сгруппировали примерно в 200 кластеров, соответствующих классификации на уровне родов [128]. Они увидели, что большинство вирусов не всегда преобладали, и было трудно определить основную группу вирусов слюны, и вместо этого в оральном вироме были разные межличностные составы.Однако 26 из их 200 вирусных кластеров имеют много общих генов, и большинство из них были фагами Streptococcus, что является разумным открытием, поскольку, как мы видели, Streptococcus обычно является одним из самых распространенных родов бактерий полости рта, если не самым многочисленным. в западных микробиомах полости рта. Другое исследование 72 здоровых взрослых оральных виромов, также проведенное в Испании, дало аналогичные результаты [129]. Они обнаружили очень мало распространенных вирусов, в то время как большинство из них были обнаружены только в отдельных образцах, и снова фаги Streptococcus были обычным явлением.Тем не менее, они действительно предположили небольшое ядро оральных вирусов и указали на присутствие вирусных ядер в других участках тела, наблюдаемых в других исследованиях, включая легкие в здоровых образцах [130], кишечник даже после трансплантации фекалий [28] и кожа [29]. Они также подчеркивают специфичность этого орального вирусного ядра по отношению к западным культурам, поскольку исследования вирома также страдают от «СТРАННОЙ» предвзятости, упомянутой выше. Простейшие и археи также являются компонентами микробиома полости рта, хотя мало что было сказано ни об одной из этих групп.Похоже, что никаких исследований оральных простейших на основе NGS не проводилось, но вместо этого они были идентифицированы методами микроскопии [30, 131, 132, 133]. Однако присутствие гена 16S рРНК у архей привело к использованию методов NGS в некоторых исследованиях. Все виды архей, обнаруженные к настоящему времени в полости рта, являются метаногенами (метанопродуцирующими организмами) типа Euryarchaeota [134]. Было показано, что эти археи чаще встречаются у пациентов, страдающих пародонтитом [14,15].Однако было высказано предположение, что может существовать большее разнообразие архей, которое еще не обнаружено, либо потому, что традиционные методы препятствовали обнаружению других архей, потому что они встречаются с низкой распространенностью и численностью, либо из-за отсутствия разнообразия в популяции, включенные в выборку [135]. Каждая из этих проблем может быть решена путем дальнейшего изучения исследований на основе NGS среди различных групп населения.6. Микробиом полости рта и заболевания полости рта
Эколог растений Роберт Хардинг Уиттакер, определяя наземные биомы в 1970-х годах, обсуждал градиенты условий окружающей среды от благоприятных до экстремальных.Он показал, что как альфа-, так и бета-различия уменьшаются по мере того, как условия биома становятся более экстремальными. [136]. Параллель с этим обобщением наблюдалась в исследованиях микробиома за последнее десятилетие, если учесть, что болезненные состояния приравниваются к «экстремальным» условиям окружающей среды в определенных участках тела. Это часто приводит к низкому альфа-разнообразию (меньшему количеству отдельных организмов), что приводит к низкому бета-разнообразию (уникальности общего состава отдельной выборки), поскольку определенные организмы становятся лучше приспособлены для доминирования в своей среде обитания.Распространенные заболевания полости рта, такие как пародонтит и кариес зубов, являются явными примерами этого явления, когда состав микробиома сильно зависит от болезненного состояния. Однако на данном этапе развития области микробиома не всегда ясно, приводят ли изменения в микробном составе к заболеванию или наоборот. Тем не менее, безусловно, стоит обсудить наблюдаемые ассоциации, чтобы начать постулировать связанные с микробиомом механизмы происхождения или прогрессирования заболевания.Виды «красного комплекса» (Porphyromonas gingivalis, Treponema denticola и Tannerella forsythia) исторически считались основными инфекционными микроорганизмами, вызывающими пародонтит [137], но это было определено культурными исследованиями, которые, таким образом, упустили большую часть из них. бактериальное разнообразие, присутствующее в образцах. С тех пор методы NGS выявили другие организмы, которые также связаны с пародонтитом (Таблица 1, Рисунок 2), такие как классы Clostridia, Negativicutes и Erysipelotrichia [16]; роды Synergistes [17], Prevotella и Fusobacterium [18]; и вид Filifactor alocis [16]; а также виды архей Methanobrevibacter oralis, Methanobacterium curvum / congolense и Methanosarcina mazeii [14,15].И наоборот, некоторые организмы связаны со здоровьем пародонта, включая тип Proteobacteria и класс Firmicutes Bacilli [16], а также роды Streptococcus, Actinomyces и Granulicatella [19]. Очевидно, что существует множество организмов, так или иначе связанных с пародонтитом. , но это поднимает вопрос о том, какие именно возбудители могут быть возбудителями болезни, а на какие просто влияют изменения окружающей среды в болезненном состоянии. Одно исследование, в котором использовались методы метатранскриптомики, сравнивало профили экспрессии 160000 генов и показало сохраняющиеся различия в метаболизме, несмотря на вариации в составе микробиома, предполагая, что в болезненном состоянии организмы, присутствующие в образце, выполняют аналогичные функции, даже если виды различаются между образцами. [20].Это мнение может быть подтверждено другим исследованием, в котором предполагалось, что у метаногенных видов архей развиваются синтрофические отношения, действуя как «поглотители водорода», что способствует увеличению роста патогенных вторичных ферментеров. Представители рода Treponema обладают аналогичной активностью по потреблению водорода, что, возможно, объясняет их участие в «красном комплексе». Действительно, это исследование показало, что численность Treponema и метаногенных архей антикоррелирована, предполагая, что они могут заполнять одну и ту же функциональную нишу [15].Было показано, что при кариесе зубов альфа-разнообразие уменьшается по мере прогрессирования заболевания, и высокие уровни видов Streptococcus mutans были обнаружены на ранних стадиях развития кариеса, но не на более поздних стадиях, в то время как другие виды Streptococcus связаны со здоровьем зубов [22]. . Было высказано предположение, что, хотя S. mutans является ацидогенным и может способствовать начальному образованию кариеса, другие оральные таксоны также являются ацидогенными. Существенным вирулентным фактором в этой ситуации является его способность метаболизировать сахарозу из рациона хозяина во внеклеточные полисахариды (EPS), которые необходимы для образования кариесогенных биопленок.Кроме того, в этих условиях усиливается адгезия между S. mutans и Candida albicans, а C. albicans обеспечивает дополнительный ацидогенез [23]. В последнее время также изучались связи между микробиомом и раком. Ряд видов, обнаруженных в полости рта, были связаны с раком полости рта, в том числе Capnocytophaga gingivalis, Prevotella melaninogenica и Streptococcus mitis [24]. В таблице 1 перечислен ряд видов, которые были описаны как связанные с раком полости рта, хотя есть оговорка, что образцы в одном из этих исследований были взяты из опухолевых и неопухолевых участков у одного и того же пациента, и, таким образом, состав на самом деле оба участка могут быть затронуты заболеванием, и неясно, какое именно лечение рака пациенты прошли, если оно вообще проводилось [25].К сожалению, похоже, что существует не так много исследований, изучающих эту связь с современными методами, и нет большого консенсуса среди таких исследований по составу микробиома при наличии рака полости рта, но существует ряд гипотез о потенциальном действии, способствующем развитию рака. микробиоты. Было высказано предположение, что некоторые нормальные бактерии полости рта, включая Streptococcus salivarius, Streptococcus intermediateus и Streptococcus mitis, могут превращать этанол в канцерогенный ацетальдегид [26,138] или повышать регуляцию цитокинов и других провоспалительных молекул, что приводит к хроническому воспалению, которое может быть вовлечено в канцерогенез [139], и что бактериальные токсины могут также влиять на сигнальные пути клеток или повреждать ДНК [140].Рак пищевода также был исследован с выявлением ассоциаций с пародонтальными патогенами Tannerella forsythia и Porphyromonas gingivalis (членами «красного комплекса») [27]. Исследование показало, что род Neisseria был связан с более низким риском рака пищевода, как и путь биосинтеза каротиноидов, в который потенциально может вносить вклад ряд видов Neisseria.7. Микробиом полости рта и другие заболевания полости рта
Микробиом полости рта ни в коем случае не является изолированным биомом, а, напротив, является частью тесно взаимосвязанной серии микробиомов в человеческом теле, образующей своего рода микробиосферу. .В качестве точки входа почти для всего проглоченного материала и благодаря высокой васкулярности ротовая полость имеет широкие возможности влиять на активность других участков тела. Поэтому неудивительно, что, помимо заболеваний полости рта, микробиом полости рта участвует в ряде системных заболеваний.
Рот — это прямой путь как к легким, так и к пищеварительной системе, поэтому можно ожидать связи между таксонами полости рта и такими заболеваниями, как кистозный фиброз (CF) [33] или колоректальный рак (CRC) [12,141,142,143], учитывая то, что мы уже обсуждали.Патогенность Pseudomonas aeruginosa, основного агента образования биопленок в легких пациентов с МВ, может подавляться пероральными комменсальными видами стрептококков, особенно Streptococcus oralis, за счет выработки перекиси водорода, которая может нарушить производство биопленок, но это только наблюдалось. если эти стрептококки были первичными колонизаторами до интродукции P. aeruginosa. Однако в типичной среде легких при МВ эти виды стрептококков фактически стимулируют выработку P.aeruginosa, включая эластазу и пиоцианин [33]. Дисбактериоз полости рта, приводящий к пародонтиту, был связан, среди прочего, с раком полости рта, пищевода, желудка, легких, поджелудочной железы, предстательной железы, гематологического рака и молочной железы [144, 145]. Гипотезы для этих связей включают: производство канцерогенных молекул, таких как нитрозамины, нитратредуцирующими таксонами [146,147] или ацетальдегида таксонами, метаболизирующими этанол [26,138], увеличение количества связанных с раком вирусов, таких как цитомегаловирус и вирус Эпштейна-Барра [148,149], и , возможно, наиболее заметно, повышение провоспалительных маркеров, происходящих из иммунных реакций на заболевания пародонта, таких как цитокины [139] и рецепторы конечных продуктов гликирования (RAGE) [150].Многочисленные исследования связывают Fusobacterium nucleatum с CRC [141, 142, 143], поскольку это оральный комменсальный вид, который является высокоинвазивным и адгезивным [151] и появляется в образцах аденомы пациентов с CRC. В случаях аденомы это коррелировало с местным воспалением, TNF-α и IL-10 [141]. Однако недавнее исследование, основанное на NGS, не обнаружило связи между Fusobacterium и CRC, а вместо этого обнаружило ассоциации с родами Lactobacillus и Rothia [12]. Авторы предполагают, что результаты некоторых других исследований могут быть искажены курением, которое, как было показано, связано с курением F.nucleatum также во рту [152, 153]. Они также утверждают, что, хотя Lactobacillus, как было показано в предыдущем разделе (см. Таблицу 1, Рисунок 2), был предложен в качестве пробиотика в микробиоме кишечника [154,155], этот род связан с кариесом зубов в микробиоме полости рта. Таким образом, Lactobacillus может не иметь прямого влияния на колоректальный канцерогенез, но, возможно, это может быть дополнительным показателем плохого здоровья полости рта, который, как мы видели, тесно связан с раком. Другое исследование показало более высокое содержание Porphyromonas gingivalis и Aggregatibacter actinomycetemcomitans при раке поджелудочной железы. образцы [31], оба из которых являются ключевыми патогенами пародонтита [18,21] В качестве подтверждающих доказательств они сослались на исследование, которое обнаружило, что риск рака поджелудочной железы значительно повышается в присутствии повышенных сывороточных антител к P.gingivalis [156] и другой, показывающий, что как P. gingivalis, так и A. actinomycetemcomitans обладают потенциалом инициировать пути Toll-подобных рецепторов (TLR), которые, как было показано, являются движущей силой канцерогенеза поджелудочной железы [157]. Однако другое исследование, по-видимому, противоречит первому, обнаружив большее количество Leptotrichia в образцах рака поджелудочной железы по сравнению со здоровым контролем и меньшее количество Porphyromonas, а также меньшее количество Aggregatibacter (хотя последнее не было статистически значимым) [32]. .Они предполагают, что высокое соотношение лептотрихий к порфиромонам (соотношение LP) является биомаркером рака поджелудочной железы. Фактически, они смогли реклассифицировать одного пациента, который изначально был здоровым контролем, но у которого было диагностировано неизвестное заболевание пищеварения. Высокий коэффициент LP у пациента побудил к переоценке, которая привела к диагностике рака поджелудочной железы у этого пациента.Объединение доказательств, представленных в обоих исследованиях, может привести к решению несоответствующих результатов. Оба ссылаются на связь между П.gingivalis и рак поджелудочной железы, поэтому это может быть связано с высокой численностью этого вида до начала заболевания, что приводит к выработке антител и, в конечном итоге, к снижению численности. Высокое исходное количество P. gingivalis потенциально может быть связано с заболеванием пародонта, которое затем может привести к различным видам рака в результате системного воспаления или любого из других механизмов, обсуждаемых здесь. Конкуренция между Leptotrichia и Porphyromonas объясняет их антикорреляцию, так как антитела снижают численность пероральных P.gingivalis, Leptotrichia способна развиваться. Фактически, во втором исследовании некоторые образцы рака поджелудочной железы имели низкие соотношения LP, наравне с долями LP без рака поджелудочной железы, так что тогда это могли быть случаи ранней стадии. Эта ситуация подчеркивает необходимость большего внимания к временной динамике микробиома в подобных исследованиях ассоциаций, чтобы выявить важные факторы, влияющие на начало, прогрессирование и поддержание болезненных состояний.
Некоторые другие системные заболевания также связаны с пародонтитом, например сердечно-сосудистые заболевания / атеросклероз [34,35].Одно исследование с участием более 3000 субъектов в течение 16 лет показало, что пародонтит с потерей коренных зубов был связан с раком груди (среди других типов) и преждевременной смертью из-за рака и сердечно-сосудистых или желудочно-кишечных заболеваний [158]. Как и в случае рака, связанного с периодонтитом, возникающее в результате увеличение системного воспаления является основным объяснением связи с сердечно-сосудистыми заболеваниями [159]. Во многом это связано с инвазивной природой некоторых ассоциированных таксонов, таких как P.gingivalis, который также способствует инвазивности в эпителиальные клетки хозяина у таких видов, как Prevotella intermedia, в остальном комменсальных оральных видов [160]. Белки, секретируемые этими организмами, участвуют в их патогенности, такие как гингипаины из P. gingivalis, которые способствуют образованию его биопленок во время периодонтита [161] и впоследствии активируют продукцию цитокинов [162]. Исследования, связывающие пародонтит и атеросклероз, основывались на данных о бактериях полости рта, колонизирующих атеросклеротические бляшки [34,35], а не на большом количестве таксонов в полости рта (Таблица 2, Рисунок 2).Хотя, по-видимому, меньше исследований с использованием методов NGS образцов полости рта для определения связи между составом микробиома полости рта и сердечно-сосудистыми заболеваниями, потенциальные механизмы действия таксонов полости рта делают эту область еще одной привлекательной для исследований. был связан с пародонтитом [36, 163], что снова связано с P. gingivalis, в данном случае с производством гингипаинов и пептидиларгининдезиминазы, которые активируют цитруллинирование белка, что является важным триггером для RA.Однако недавно было показано, что эта прямая связь может быть ошибочной [164]. Фактически, исследования RA с использованием 16S-секвенирования и целого метагеномного секвенирования, соответственно, показали, что P. gingivalis либо не был связан с RA [37], либо фактически более распространен в здоровой контрольной группе по сравнению с образцами RA [38], в то время как разные организмы были связаны с заболеванием (таблица 2, рисунок 2). Это демонстрирует, как исследования NGS могут позволить исследователям определять достоверность ранее существовавших убеждений и потенциально открывать новые пути для исследований.Неврологические расстройства также связаны с микробиомом полости рта. Возможно, наиболее полным исследованием в этом отношении является связь P. gingivalis с болезнью Альцгеймера [40]. Авторы этого исследования не только идентифицировали эту бактерию в головном мозге пациентов с болезнью Альцгеймера на уровнях, которые коррелировали с агрегатами тау и убиквитина (признак заболевания), но также показали, что инфекция P. gingivalis у мышей приводит к колонизации мозга и увеличению производство компонентов амилоидных бляшек.Далее они показали, что протеазы гингипаинов, продуцируемые P. gingivalis, нейротоксичны и подавляют функцию тау-белка. Это предполагает прямую связь между обнаженной колонизацией P. gingivalis и происхождением или прогрессированием болезни Альцгеймера, а также предполагает, что ингибиторы гингипаина могут использоваться для лечения нейродегенерации при этом заболевании. Также было показано, что типичные оральные виды филума спирохет, включая несколько видов рода Treponema, часто образуют амилоидные бляшки, и что эти организмы способны продуцировать дополнительный амилоид-β и предшественник белка амилоид-β [41].Дисбиоз микробиома полости рта также связан с нарушениями эндокринной системы. В этом случае пародонтит является потенциальным результатом диабета, а не потенциальной причиной, как при большинстве заболеваний, описанных выше. В одном продолжительном исследовании распространенность пародонтита составляла 60% у пациентов с диабетом и 36% у пациентов без диабета [165]. Некоторые из предложенных механизмов влияния диабета на здоровье пародонта включают микроангиопатию или изменения воспалительной реакции, метаболизма коллагена или концентрации глюкозы в десневой трещинной жидкости [166].Тем не менее, было высказано предположение, что пародонтит также может усугублять эффекты диабета за счет усиления выработки воспалительных факторов, таких как TNF-α, которые могут действовать как антагонисты инсулина [167]. Удивительно, но одно исследование NGS показало, что у субъектов с диабетом на самом деле была более низкая численность типичных видов «красного комплекса», наблюдаемых при инфекциях пародонтита, Porphyromonas gingivalis, Tannerella forsythia и Treponema denticola [43]. Авторы отмечают, что потенциальные искажающие факторы в их исследовании включают более высокий средний индекс зубного налета и больший возраст пациентов с диабетом.Однако также возможно, что любой из предложенных механизмов влияния диабета на здоровье пародонта может привести к изменению типичного дисбиотического состава при пародонтите, или что образцы были собраны на той стадии прогрессирования заболевания, на которой распространены общие патогены встречаются в меньших количествах. В любом случае это представляет собой еще одну интересную возможность для более масштабных продольных исследований, чтобы обнаружить потенциальные альтернативные пути развития пародонтоза и, таким образом, лучше понять его механизмы и потенциальные методы лечения или превентивные меры.8. Клинический потенциал микробиома полости рта / Манипуляции и нарушения микробиома полости рта
Мы продемонстрировали здесь несколько ключевых примеров широкого действия микробиома полости рта на организм человека. Это открывает широкие возможности для диагностики и вмешательства, лишь некоторые из которых начали изучаться или даже осмысляться. Чтобы в полной мере использовать этот потенциал, нам нужно будет продолжать исследовать состав и действие микробиомов полости рта как на мелкомасштабных взаимодействиях внутри людей с разным состоянием здоровья, так и в широком масштабе среди различных групп населения.Микробиом полости рта уже показал потенциал в качестве диагностического инструмента. Одно исследование на основе машинного обучения, в котором было собрано 2424 общедоступных метагенома из восьми исследований, показало, что эффективность прогнозов заболеваний улучшилась при использовании функций на уровне штаммов (что невозможно при секвенировании 16S), и предположило, что фенотипы заболеваний связаны с «не -core »микробные гены / факторы, которые могут быть обнаружены в вариабельных областях генома, специфичных для штаммов / подвидов [90]. Однако они предостерегают от использования некоторых потенциальных биомаркеров для диагностики заболевания, таких как вид Streptococcus anginosus, который на самом деле ассоциируется с общим дисбактериозом, а не с конкретным заболеванием.Авторы по-прежнему считают эту работу ранним этапом моделирования здорового микробиома, так что ее можно использовать для сопоставления состояний дисбактериоза, связанных с заболеванием. Другая попытка использования микробов в полости рта в качестве биомаркеров показала некоторый предварительный успех в раннем обнаружении поражений колоректального рака (CRC) [92]. Иммунный тест кала (FIT) и анализ кала на скрытую кровь (FOBT) являются типичными неинвазивными процедурами скрининга, используемыми для обнаружения CRC, но они страдают низкой чувствительностью при обнаружении ранних поражений.Авторы показали, что классификационная модель, основанная на образцах микробиома полости рта, имеет высокую специфичность и большую чувствительность, чем стандартные тесты при различении образцов CRC и полипов от здоровых контролей, с дальнейшим увеличением чувствительности при объединении с образцами фекального микробиома. Таким образом, при дальнейших проверочных исследованиях микробиом может быть внедрен для повышения скорости раннего выявления CRC. Помимо биомаркера, микробиом полости рта может быть как инструментом, так и мишенью для лечения заболеваний.Было показано, что коммерчески доступные пробиотики, которые содержат живые штаммы из бактериальных родов, таких как Bifidobacterium, Lactobacillus и Streptococcus, способствуют большему альфа-разнообразию в микробиоме полости рта, хотя и без крупномасштабных или постоянных изменений его состава [154]. Как упоминалось в предыдущем разделе, Lactobacillus, в частности, является распространенным и эффективным пробиотиком в контексте микробиома кишечника, но он был связан с кариесом зубов и косвенно с CRC.Однако также возможно, что этот эффект зависит от окружающей среды, как обсуждалось выше в случае Streptococcus oralis во время муковисцидоза или Leptotrichia во время рака поджелудочной железы. Таким образом, Lactobacillus без условий окружающей среды, подходящих для кариеса зубов, вместо этого может способствовать большему альфа-разнообразию и лучшему здоровью полости рта. Это еще один случай предварительных результатов с интересным потенциалом, которые требуют более глубокого лонгитюдного исследования. Были предложены механизмы положительного воздействия других потенциальных пробиотиков, чтобы противодействовать прогрессированию заболеваний пародонта и кариеса, включая штаммы Streptococcus salivarius, которые были показано, что они подавляют воспалительные реакции и стимулируют полезные пути, такие как ответы на интерферон I и II типа [168].Другими потенциальными пробиотиками для этого применения являются Streptococcus dentisani [169] и Streptococcus A12 [170], которые могут буферизовать кислый pH, образующийся в кариесогенных биопленках в результате метаболизма аргинина. Протеобактерии вида Bdellovibrio bacteriovorus были предложены в качестве инструмента для потенциальной борьбы с патогенами пародонта [171]. Он питается грамотрицательными бактериями, вторгаясь в них, что в конечном итоге приводит к лизису своей жертвы. Эксперименты ex vivo на слюне и поддесневом налете показали, что B. bacteriovorus был способен атаковать два важных оральных патогена, Fusobacterium nucleatum и Aggregatibacter actinomycetemcomitans, хотя и не на некоторые другие желаемые цели, и не был специфичным только для этих целей.Пути и продукты микробиоты полости рта также могут быть объектами лечения. Было показано, что провоспалительный цитокин IL-17 имеет наиболее сильную активацию у пациентов с диабетом и связан с периодонтитом, в то время как лечение антителами против IL-17 могло смягчить этот эффект [172]. При болезни Альцгеймера ингибиторы гингипаиновых протеаз, секретируемых Porphyromonas gingivalis, были способны уменьшить инфицирование этим видом в головном мозге, а также продукцию амилоида-β и нейровоспаление [40].Еще многое предстоит узнать о функциях микробиома полости рта и его потенциальной реакции на лечение. Один случай проистекает из «СТРАННОЙ» предвзятости, из-за которой многие люди в мире не попадают в эту область исследования. В исследовании «бесконтактных» индейцев в венесуэльской Амазонии, изолированном сообществе, неизвестном о воздействии антибиотиков, были обнаружены бактерии, несущие гены функциональной устойчивости к антибиотикам (AR) [45]. Авторы предполагают, что «гены AR, вероятно, готовы к мобилизации и обогащению при воздействии фармакологических уровней антибиотиков».Авторы подчеркивают необходимость характеристики удаленных популяций «до того, как глобализация современных практик затронет потенциально полезные бактерии, обитающие в организме человека». Таким образом, контекст исследований микробиома необходимо продолжать расширять, прежде чем мы сможем найти оптимальные подходы к лечению.9. Выводы и перспективы на будущее
Улучшения в методах секвенирования и стоимости продолжают продвигать область исследований микробиома вперед, обеспечивая более масштабные подходы и более широкое понимание его структуры и функций.Однако за последнее десятилетие или около того большая часть исследований носила исследовательский характер, и многие исследователи использовали свои собственные подходы к проведению экспериментов и анализов, поскольку возможности и ограничения этих новых методов были исследованы. В результате на результаты в этой области, несомненно, повлияло некоторое количество технических предубеждений. По мере того как мы начинаем понимать, что показывают нам эксперименты NGS, и по мере разработки новых подходов, мы должны стремиться к стандартизированным методам, которые позволят проводить надежное сравнение данных с минимальной систематической ошибкой.То же самое верно для дизайна исследований и методов сбора выборки, как было предложено [113]. Микробиом полости рта особенно выиграет от конкретных методологий для обеспечения надлежащего контекста для данного исследования, потому что, в зависимости от цели исследования, результаты могут зависеть от конкретных ниш в этой среде обитания. Текущие данные позволяют сделать по крайней мере некоторые предварительные обобщения о структура микробиома полости рта. Несмотря на аргументы в пользу ориентации на градиенты численности в выборках популяции и против использования стоматотипов (или других соответствующих кластеров образцов микробиома), стоматотипы позволяют исследователям получить широкую перспективу и могут помочь в проведении дальнейшего анализа.Обсуждаемые выше стоматотипы Neisseria / Haemophilus и Prevotella / Veillonella могут представлять собой относительно здоровые композиции, в то время как другие обнаруженные стоматотипы, которые, как правило, менее согласованы с точки зрения состава, могут представлять дисбактериоз. Роды-драйверы первых двух стоматотипов часто связаны со здоровьем, в то время как роды-драйверы в других описанных стоматотипах часто связаны с болезнями, такими как Porphyromonas, Rothia и некоторые виды Streptococcus.Конечно, есть исключения, такие как ассоциации, о которых сообщалось между пародонтитом и Prevotella [18] или между кариесом зубов и Neisseria [22], хотя для уточнения этого утверждения, как упоминалось выше, могут быть изменения в изобилии многие таксоны являются результатом болезни, а не ее причиной. Таким образом, как и в случае Prevotella при пародонтите или Neisseria при кариесе зубов, эти таксоны могут просто стать оппортунистическими в окружающей среде, созданной болезнью (Neisseria может просто использовать преимущества «стока водорода», создаваемого архейными метаногенами и / или Treponema видов, поскольку его виды, как правило, являются ацидогенными [173]), и поэтому все еще могут считаться связанными с общим здоровьем полости рта.Пародонтит и кариес зубов — это хорошо изученные заболевания, но при поиске ассоциаций между микробиомом и любым заболеванием важно тщательно изучить механизмы прогрессирования заболевания, прежде чем обозначать какой-либо конкретный организм в качестве возбудителя. Таблицу 1 и таблицу 2, представленные в этом обзоре, в которых перечислены ассоциированные таксоны, следует воспринимать как просто список потенциальных ассоциаций, требующих дальнейшего изучения. Как подчеркивалось в этом обзоре, наши текущие представления о микробиоме полости рта в значительной степени необъективны. к образу жизни в «СТРАННЫХ» странах (западных, образованных, индустриальных, богатых и демократических) [46], поскольку большинство исследователей и изученных выборок происходят из этих популяций.Несколько упомянутых здесь исследований, которые включали незападные образцы, подчеркивают пробелы в наших текущих знаниях о потенциальных составах и структурах микробиома полости рта [44] и его функциональных возможностях в определенных контекстах [45]. По мере того, как исследователи интегрируют в поле более разнообразные группы населения (а также расширяют кругозор, чтобы включить другие области жизни, присутствующие в микробиоме), они смогут постоянно создавать более обширные базы данных таксономии и функциональности, связанной с ротовой полостью человека, что позволит расширить комплексные исследования.Его позиция в качестве ворот к некоторым из наиболее жизненно важных функций человека плотно соединяет полость рта с остальными частями тела и оказывает мощное влияние на многие процессы в организме. Дисбиоз в микробиоме полости рта явно связан с рядом местных и системных заболеваний, хотя некоторые из конкретных ассоциаций и механизмов действия остаются предположительными в ожидании дальнейшего изучения. Некоторые из обсуждаемых здесь примеров лечения кажутся простыми, даже несмотря на необходимость более глубокой проверки эффективности.Однако микробиом человека представляет собой многомерную взаимосвязанную микробиосферу, и возмущения могут иметь пока еще непредвиденные последствия, независимо от того, будут ли они незамеченными в краткосрочной перспективе или неопределенными в долгосрочной перспективе без соответствующих планов исследования. Мы уже упоминали примеры, когда неродственные организмы могут заполнять одни и те же функциональные ниши (см. Выше обсуждение трепонем и метаногенных видов архей, действующих как поглотители водорода при периодонтите), и их конкуренция может быть связана с заболеванием.Исследования микробиома далеко не завершены, и без глубокого понимания его природы мы должны проявлять осторожность и терпение, прежде чем широко использовать его медицинский потенциал. Это потребует проведения еще многих крупномасштабных и продольных исследований, большего внимания к функциональному компоненту микробиома и более точной характеристики различных структур каждого микробиома организма в разных контекстах, часть которых будет заключаться в борьбе со СТРАННЫМИ предубеждениями. , что до сих пор ограничивало объем исследований и недостаток внимания к менее заметным областям микробиома, таким как грибы, археи и вирусы.
Что такое нижнечелюстной тори? — Westermeier Martin Dental Care
Знаете ли вы, что есть заболевание полости рта, которым страдает от 5 до 7 процентов взрослого населения США? Это состояние называется нижнечелюстным тором, которое вызывает боль и дискомфорт, а некоторые его симптомы практически незаметны. Это костный нарост, который развивается на нижней челюсти, под языком и сбоку от него. По данным Национального института здоровья, от тори страдают около 27 из 1000 взрослых, хотя это заболевание не так широко известно, как другие заболевания полости рта.Хотя это не указывает на какое-либо опасное заболевание или состояние здоровья, некоторые люди считают их некрасивыми или неудобными при употреблении определенных продуктов. Вот что вам нужно знать об этом необычном состоянии.
Что такое торы нижней челюсти?
Это состояние возникает на внутренней стороне нижней челюсти. Тор или тори (множественное число) — это доброкачественное разрастание кости во рту, и в 90 процентах случаев есть тор как с левой, так и с правой стороны ротовой полости, что делает это в подавляющем большинстве случаев двусторонним заболеванием.Эта аномалия полости рта обычно не вызывает серьезных повреждений. Это вызовет дискомфорт, и если рост будет продолжаться, то нижнечелюстные торы могут вызвать боль или нарушение функций рта. Размер тора может меняться на протяжении всей жизни, а в некоторых случаях может быть достаточно большим, чтобы соприкасаться друг с другом по средней линии рта. Это состояние может усложнить изготовление зубных протезов. Если необходимо удалить торы, можно сделать операцию, чтобы уменьшить количество кости, но торы могут восстановиться в тех случаях, когда близлежащие зубы все еще испытывают локальную нагрузку.
Что вызывает торс нижней челюсти?
Может быть несколько факторов, связанных с торсом нижней челюсти. Начиная с генетики, это заболевание чаще встречается у мужчин, чем у женщин, и может передаваться от отца к сыну. Другими факторами являются напряжение в кости челюсти и бруксизм. Это состояние чаще встречается в раннем взрослом возрасте, и, следовательно, считается, что торы нижней челюсти являются результатом местных стрессов, а не только генетических влияний. Генетическое влияние лучше всего можно увидеть в исследованиях близнецов.Согласно одному исследованию, у 93,6% однояйцевых близнецов либо у обоих были торы, либо у обоих их не было. Среди разнояйцевых близнецов такая конкордантность наблюдалась в 79,4% пар.
Каковы симптомы?
Это состояние проявляется в виде нароста кости под языком и сбоку. У вас может быть один или несколько наростов, и они могут развиваться на одной или обеих сторонах рта. Обычно это заболевание протекает бессимптомно, но иногда может вызывать проблемы.Если вы носите зубные протезы, их рост может помешать посадке нижнего протеза. Ваш зубной протез может быть неудобным и не оставаться на месте. Мягкие ткани, покрывающие нарост, в некоторых случаях также могут изъязвляться. Хотя симптомы нижнечелюстного тора безвредны, наиболее распространенными являются следующие:
- Воспаление десен
- Раздраженные миндалины
- Шатающиеся зубы
- Невнятная речь
- Боль в горле
- Болезнь челюсти
Как лечится?
Даже если ваш рост протекает бессимптомно, стоматолог должен его осмотреть.Если ваш стоматолог подтвердит, что ваш рост — это torus mandibularis, он может порекомендовать не лечить его. Это потому, что эти доброкачественные новообразования обычно не должны нарушаться. Однако, если ваш рост болезненный или мешает протезам, может быть выполнено хирургическое удаление. Операция — вариант, когда торы начинают мешать речи. Или в случае использования зубного протеза ваш стоматолог может рассмотреть возможность операции, потому что чрезмерно разрастающаяся кость будет мешать установке зубного протеза. Посещение стоматолога необходимо для полной диагностики.Для операции, в зависимости от роста кости и места ее расположения, стоматолог может удалить нарост с помощью традиционных хирургических инструментов или более новых методов, таких как лазеры.
Есть ли у вас какие-либо вопросы по поводу торов нижней челюсти? Позвоните в Westermeier Martin Dental Care, чтобы записаться на прием к стоматологу 716-508-4547.
Рак полости рта и глотки: Диагноз
НА ЭТОЙ СТРАНИЦЕ: Вы найдете список общих тестов, процедур и сканирований, которые врачи используют для поиска причины медицинской проблемы.Используйте меню для просмотра других страниц.
Врачи используют множество тестов для обнаружения или диагностики рака. Они также проводят тесты, чтобы узнать, распространился ли рак на другую часть тела, откуда он начался. Если это происходит, это называется метастазированием. Например, визуализационные тесты могут показать, распространился ли рак. Визуализирующие тесты показывают изображения внутренней части тела. Врачи также могут провести тесты, чтобы узнать, какое лечение лучше всего.
При большинстве видов рака биопсия — единственный надежный способ для врача узнать, есть ли рак в той или иной области тела.При биопсии врач берет небольшой образец ткани для исследования в лаборатории. Если биопсия невозможна, врач может предложить другие тесты, которые помогут поставить диагноз.
В этом разделе описаны варианты диагностики этого типа рака. Не все тесты, перечисленные ниже, будут использоваться для каждого человека. Ваш врач может учитывать следующие факторы при выборе диагностического теста:
Медицинский осмотр. Стоматологи и врачи часто обнаруживают рак губ и полости рта во время плановых осмотров.Если у человека проявляются признаки рака полости рта или ротоглотки, врач соберет полную историю болезни, расспросив пациента о симптомах и факторах риска. Врач ощупывает любые шишки на шее, губах, деснах и щеках. Поскольку люди с раком полости рта или ротоглотки имеют более высокий риск других видов рака в области головы и шеи, врач осмотрит область за носом, гортань (голосовой ящик) и лимфатические узлы шеи.
Эндоскопия. Эндоскопия позволяет врачу осмотреть ротовую полость и глотку. Обычно тонкая гибкая трубка с прикрепленной линзой для света и обзора, называемая эндоскопом, вводится через нос для исследования областей головы и шеи. Иногда жесткий эндоскоп, представляющий собой полую трубку с линзой для освещения и обзора, помещается в заднюю часть рта, чтобы увидеть заднюю часть глотки более подробно. Обследование имеет разные названия в зависимости от исследуемой области тела, например, ларингоскопия для осмотра гортани, фарингоскопия для осмотра глотки или назофарингоскопия для осмотра носоглотки.Чтобы пациенту было удобнее, эти обследования проводятся с использованием анестезирующего спрея, чтобы обезболить пораженную область. Если область выглядит подозрительной, врач возьмет биопсию (см. Ниже). Анализы часто проводятся в кабинете врача. Однако иногда эндоскопию необходимо проводить в операционной в больнице с использованием общей анестезии, которая блокирует осознание боли.
Биопсия. Биопсия — это удаление небольшого количества ткани для исследования под микроскопом.Другие тесты могут указывать на наличие рака, но точный диагноз может поставить только биопсия. Тип выполняемой биопсии будет зависеть от локализации рака. Во время тонкоигольной аспирационной биопсии клетки удаляются с помощью тонкой иглы, вводимой непосредственно в подозрительную область. Затем патолог анализирует клетки. Патолог — это врач, который специализируется на интерпретации лабораторных тестов и оценке клеток, тканей и органов для диагностики заболеваний.
Щеточная биопсия полости рта .Во время обычных стоматологических осмотров некоторые стоматологи используют более новую и простую технику для обнаружения рака полости рта, при которой стоматолог использует небольшую щеточку для сбора образцов клеток из подозрительной области. Затем образец отправляется в лабораторию для анализа. Эту процедуру можно проводить в кресле стоматолога с очень небольшой болью или без нее. Если рак обнаружен с помощью этого метода, рекомендуется традиционная биопсия для подтверждения результатов.
Тестирование на ВПЧ. Тест на ВПЧ может быть проведен на образце опухоли, удаленной во время биопсии.Как описано в разделе «Факторы риска и профилактика», ВПЧ связан с более высоким риском развития рака ротоглотки. Информация о том, есть ли у человека ВПЧ, может помочь определить стадию рака и варианты лечения, которые могут оказаться наиболее эффективными. ASCO рекомендует проводить тестирование на ВПЧ всем пациентам, у которых впервые диагностирована плоскоклеточная карцинома ротоглотки. Это тип рака ротоглотки, который начинается с плоских чешуевидных клеток, называемых плоскоклеточными клетками. Тестирование обычно не рекомендуется при раке ротоглотки, который начинается в других типах клеток, или при других типах рака головы и шеи.Узнайте больше о рекомендациях по тестированию на ВПЧ на отдельном веб-сайте ASCO.
Рентген. Рентген — это способ получить изображение структур внутри тела с использованием небольшого количества излучения. Ваш стоматолог или врач может порекомендовать рентгеновское излучение для выявления аномалий во рту или шее.
Ласточка с барием / Ласточка с модифицированным барием . Есть 2 теста на глотание с барием, которые обычно используются для осмотра ротоглотки и проверки глотания пациента.Первый — это традиционная бариевая ласточка. Во время рентгенологического исследования пациента просят проглотить жидкий барий. Это позволяет врачу искать любые изменения в структуре ротовой полости и горла и видеть, легко ли жидкость попадает в желудок. Для оценки трудностей с глотанием можно использовать модифицированный бариевый глоток или видеофлюороскопию.
Компьютерная томография ( КТ или КТ). Компьютерная томография позволяет делать снимки внутренней части тела с использованием рентгеновских лучей, сделанных под разными углами.Компьютер объединяет эти изображения в подробное трехмерное изображение, на котором видны любые аномалии или опухоли. Компьютерная томография может использоваться для измерения размера опухоли, помочь врачу решить, можно ли удалить опухоль хирургическим путем, и показать, распространился ли рак на лимфатические узлы шеи или нижнюю челюсть. Иногда перед сканированием наносят специальный краситель, называемый контрастным веществом, чтобы улучшить детализацию изображения. Этот краситель можно вводить пациенту в вену или давать в виде таблетки или жидкости для проглатывания.
Магнитно-резонансная томография (МРТ). МРТ использует магнитные поля, а не рентгеновские лучи, для получения подробных изображений тела, особенно изображений мягких тканей, таких как миндалины и основание языка. МРТ можно использовать для измерения размера опухоли. Перед сканированием наносится специальный краситель, называемый контрастным веществом, для создания более четкого изображения. Этот краситель можно вводить пациенту в вену или давать в виде таблетки или жидкости для проглатывания.
УЗИ. Ультразвук использует звуковые волны для создания изображения внутренних органов. Этот тест может обнаружить распространение рака на лимфатические узлы шеи, называемые шейными лимфатическими узлами.
Позитронно-эмиссионная томография (ПЭТ) или ПЭТ-КТ. ПЭТ-сканирование обычно сочетается с компьютерной томографией (см. Выше), называемой ПЭТ-КТ-сканированием. Однако вы можете услышать, что ваш врач называет эту процедуру просто ПЭТ-сканированием. ПЭТ-сканирование — это способ создания изображений органов и тканей внутри тела.В организм пациента вводится небольшое количество радиоактивного сахарного вещества. Это сахарное вещество поглощается клетками, которые потребляют больше всего энергии. Поскольку рак имеет тенденцию активно использовать энергию, он поглощает больше радиоактивного вещества. Затем сканер обнаруживает это вещество и создает изображения внутренней части тела.
После того, как диагностические тесты будут выполнены, ваш врач изучит вместе с вами все результаты. Если диагноз — рак, эти результаты также помогают врачу описать рак.Это называется постановкой.
Следующий раздел в этом руководстве — Этапы и классы . Он объясняет систему, которую используют врачи для описания степени заболевания. Используйте меню, чтобы выбрать другой раздел для чтения в этом руководстве.
Вылечите заболевание десен у пожилых людей с доктором Валеном
Известный способ называть пожилых людей «давно на зубах» предполагает, что предопределено, что по мере того, как мы стареем, наши зубы «длиннее» или «больше не становятся». .»Это неправда.
Заболевания пародонта, зубной налет и потеря зубов не являются неизбежным аспектом старения. Потеря прикрепления или опоры кости вокруг зуба — это результат бактериальной инфекции. Верно то, что по мере того, как мы становимся старше, мы все больше подвержены воздействию этих инфекционных организмов и увеличиваем вероятность заражения и развития пародонтоза. Половина людей старше 55 лет страдает пародонтозом.
Факторы риска, которые делают пожилых людей более восприимчивыми к заболеваниям пародонта, включают:
Системные заболевания : Некоторые системные заболевания, такие как диабет, могут снизить способность организма бороться с инфекциями и могут привести к более тяжелым заболеваниям пародонта.Остеопороз также может увеличить количество и скорость потери костной ткани вокруг зубов. Системные заболевания повлияют на пародонтоз, если это уже существующее заболевание. Чтобы уменьшить влияние системных заболеваний на полость рта, тщательно контролируйте образование зубного налета и регулярно посещайте стоматолога для осмотра и профессиональной чистки.
Лекарства : Сердечные препараты могут оказывать прямое воздействие на десны, вызывая повышенную реакцию на зубной налет и приводя к их разрастанию.Антидепрессанты могут вызвать сухость во рту и снизить способность слюны нейтрализовать зубной налет.
Иммунодепрессанты и другие препараты для борьбы с болезнями могут снизить способность организма бороться с инфекциями, увеличивая риск заболеваний пародонта. Стоматолог должен знать обо всех лекарствах, которые вы принимаете, и вам необходимо тщательно контролировать зубной налет и регулярно посещать стоматолога для осмотра и профессиональной чистки.
Сухость во рту : Недостаток слюны может быть результатом приема некоторых лекарств или болезни.Если недостаточно слюны для нейтрализации зубного налета, это может привести к увеличению кариеса и заболеванию пародонта.
Кроме того, сухость во рту или ксеростомия могут затруднить ношение зубных протезов, а также могут затруднить прием пищи, речь или глотание пищи. Полоскание рта или искусственная слюна могут быть очень полезны при этих проблемах.
Могут быть полезны частые глотки воды или леденцы, если они не содержат сахара. Ополаскиватели и гели с фтором помогают уменьшить или предотвратить появление кариеса, которая может быть вызвана сухостью во рту.
Проблемы с подвижностью : физические недостатки могут снизить подвижность и способность ежедневно удалять зубной налет. Плохая гигиена полости рта может увеличить риск кариеса и заболеваний пародонта.
Электрические зубные щетки и держатели зубной нити помогают улучшить контроль зубного налета. Частые профессиональные чистки в сочетании с полосканием ротовой полости противомикробными препаратами или фторидом также могут быть полезны в снижении частоты кариеса и заболеваний пародонта.
Дефицит эстрогена : Пожилые женщины могут иметь некоторые особые опасения по поводу заболеваний пародонта.Научные исследования показали, что дефицит эстрогена, возникающий после менопаузы, может увеличить риск серьезных заболеваний пародонта и потери зубов. Заместительная терапия эстрогенами может обратить эти эффекты вспять.
С возрастом важно сохранять зубы, потому что каждый зуб играет важную роль в жевании и разговоре. Они влияют на нашу внешность и самооценку.
Зубные протезы, шатающиеся или отсутствующие зубы могут ограничивать нашу диету, что приводит к плохому питанию и системным осложнениям.Благодаря достижениям современной стоматологии и современным методам профилактики и лечения мы должны рассчитывать на то, что сохраним наши зубы на всю жизнь — независимо от того, насколько «долго» это может быть!
Стоматологические проблемы у людей с синдромом Дауна
Важно знать тип анатомических мягких тканей и зубных аномалий, которые являются частью типичной модели развития людей с синдромом Дауна, которые влияют на стоматологические проблемы.
Введение
Развитие ротовой полости и скелета, связанное с синдромом Дауна, способствует возникновению стоматологических проблем.Важно знать тип анатомических мягких тканей и зубных аномалий, которые являются частью типичного паттерна развития людей с синдромом Дауна, которые влияют на стоматологические проблемы.
Анатомическое развитие изменяет основание черепа, среднюю треть лица и соотношение между верхней и нижней челюстями. Это изменение скелета приводит к тому, что люди с синдромом Дауна имеют узнаваемый внешний вид лица. Наиболее пораженным элементом мягких тканей является язык с трещинами и выступами.Язык кажется большим, потому что он должен находиться в узкой зубной дуге. Также увеличены миндалины и аденоиды.
Стоматологические аномалии связаны с морфологией зуба:
- Уменьшение соотношения корня к коронке
- Уменьшение размера зуба
- Гиподонтия или частичная анодония
- Отсроченное прорезывание
Стоматологические проблемы
Нормальное развитие структура и функции полости рта изменяются, что приводит к нарушению развития сосания, глотания, жевания и речи; и пускать слюни, если нет эффективного вмешательства.Степень сложности варьируется от человека к человеку:
Профилактические меры и терапия необходимы для облегчения проблем, возникающих при глотании и жевании. Здесь может быть применен комплексный подход с логопедом и языковым терапевтом.
Стоматологические заболевания
Люди с синдромом Дауна подвержены такой же степени стоматологических заболеваний, как и все население.Заболевания пародонта: у людей с синдромом Дауна развиваются более тяжелые формы пародонтоза, чем у населения в целом. Это может быть связано с факторами иммунологического дефицита. Это заболевание наиболее распространено среди молодых людей в возрасте от 16 до 20 лет. Прогрессирование болезни вызывает периоды острой инфекции и боли, что может привести к изменению поведения, отказу от еды или глотанию пищи целиком.
| Изображение 1: Гингивит передних зубов | Изображение 2: a раствор с зубным налетом (слева) невидимы на тех же зубах без раствора (справа) | Изображение 3: Кариес и воспаление десен |
Кариес: различные исследования показали снижение заболеваемости кариесом у детей и молодых людей с Синдром Дауна.Это может быть связано с тем, что многие из этих детей следят за своим питанием, чтобы предотвратить их склонность к ожирению. Здесь стоматолог и диетолог могут работать вместе, чтобы убедиться, что потребляемая пища способствует улучшению состояния полости рта и общего состояния здоровья.
Риск, связанный с инфекцией, повышается у людей с синдромом Дауна, поскольку частота врожденных сердечных заболеваний увеличивается в этой группе (от 3% до 40%), что приводит к серьезному риску эндокардита.
Рвотный рефлекс может возникнуть даже в переднем отделе ротовой полости. Сзади, чем премоляры, рвотный рефлекс может сопровождаться гастроэзофегальным рефлюксом. Детям это очень неудобно.
Бруксизм возникает у людей с синдромом Дауна и может быть вызван состоянием хронической тревоги, неправильным прикусом зубов, дисфункцией височно-нижнечелюстного сустава из-за слабости поддерживающих связок и / или недостаточного нервного контроля.
Травмы зубов часто возникают из-за недостаточной двигательной активности.Переломы или вывих передних зубов являются частыми и часто связаны с потерей жизнеспособности зубов.
Лечение и профилактика
- Программы надлежащей гигиены полости рта и контролируемой чистки зубов
- Образование, например с помощью видеозаписей
- Диета, общение и использование мышц ротовой полости. Это требует комплексного подхода к уходу, поскольку в нем участвует команда профессионалов и лиц, осуществляющих уход.
- Для лечения любого неправильного прикуса требуется многопрофильная команда для постановки диагноза и планирования лечения (например,грамм. Ортодонт, восстановительный хирург и челюстно-лицевой хирург)
Щелкните здесь, чтобы получить некоторые рекомендации по улучшению ухода за полостью рта для людей с ограниченными интеллектуальными возможностями.
Впервые статья была опубликована на сайте в 2002 году.
Устные науки | Оральные поражения
Что такое поражения полости рта?
Поражение ротовой полости (которое включает афтозные язвы) — это язва, которая возникает на слизистой оболочке ротовой полости.Они очень распространены, возникают в связи со многими заболеваниями и по разным механизмам. Их можно распознать по разрывам кожи или слизистой оболочки с потерей поверхностной ткани и распадом и некрозом эпителиальной ткани.
Наиболее частыми причинами поражений полости рта являются локализованные травмы (т. Е. Трение острым краем о сломанную пломбу), инфекции, системные состояния, сопутствующие дерматологические заболевания и рецидивирующие афтозные язвы (язвы).
