Эмаль. Что это и зачем нужно Стоматология Dental Way в Москве и Московской области
Какая самая твёрдая ткань в организме? Прежде всего на ум приходят кости скелета. Однако, это заблуждение. Несмотря на высокую плотность костная ткань уступает первенство зубной эмали.
Что такое зубная эмаль? Для чего она нужна? Как сохранить её целостность?
Попробуем разобраться.
Зубная эмаль – это ткань, которая располагается поверх дентина, покрывая коронку зуба и его шейку. Толщина эмали постоянных зубов в среднем составляет два-три миллиметра: на жевательных буграх эмалевый слой самый толстый, а на боковых поверхностях – тоньше. Толщина эмали молочных зубов не превышает 1 мм.
Зубная эмаль прозрачная. Цвет зуба зависит от того, насколько она прозрачна и какой толщины: через тонкий слой может просвечивать дентин, который и придаёт желтоватый оттенок зубам.
Из чего состоит эмаль
Основу зубной эмали (примерно 96%) образуют неорганические соединения – кристаллы гидроксиапатита – обуславливающие высокую прочность этой ткани. Гидроксиапатит представляет собой минерал состоящий из кальция, фтора, магния, углерода. Эти соединения уязвимы к воздействию кислой среды. Жидкостная составляющая эмали минимальна (около 2-3%).
Гидроксиапатит представляет собой минерал состоящий из кальция, фтора, магния, углерода. Эти соединения уязвимы к воздействию кислой среды. Жидкостная составляющая эмали минимальна (около 2-3%).
Органические вещества представлены эмалевыми белками, и на их долю приходится всего 1-2%. Вокруг эмалевых протеинов образуются гидроксиапатиты из минеральных веществ, поступающих в эмаль извне. По мере созревания эмали органическая матрица почти полностью утрачивается.
По твёрдости эмаль соразмерна с природным минералом – кварцем. Благодаря специфике своей структуры эмаль отлично выдерживает механическую нагрузку, но вместе с тем отличается хрупкостью. Целостность эмали обеспечивается слоем дентина, который обладает небольшой эластичностью и является своеобразным амортизатором давления, приходящегося на зуб во время жевания.
В эмаль легко проникают ионы кальция и фтора из слюны и гигиенических средств (зубных паст, ополаскивателей, лечебных составов). В этом свойстве есть и минус, так как пигменты и красители, содержащиеся в продуктах питания и напитках, проникая в поры эмали, изменяют оттенок зуба.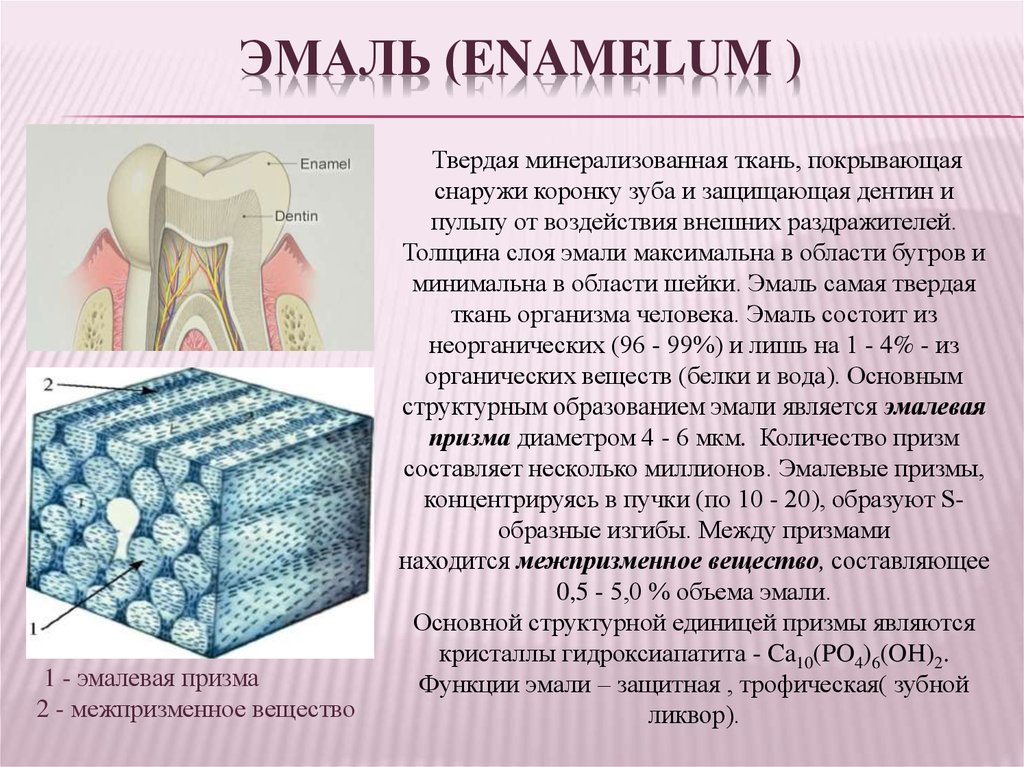
Зубная эмаль одна из немногих тканей организма, не способных к восстановлению, так как в ее составе отсутствуют клетки. Эмаль состоит из эмалевых призм, межпризменного пространства, кутикулы. Если эмалевые призмы и межпризменное вещество ненасыщены минералами, зуб легко разрушается под воздействием продуктов жизнедеятельности микроорганизмов.
При микроскопическом исследовании в области шейки зуба можно увидеть эмалевые пластинки, а в глубине дентинэмалевого соединения – эмалевые пучки. Некоторые учёные считают, что через эти образования в толщу эмали проникают патогенные бактерии, способствующие развитию кариеса.
Толщина эмали молочного зуба примерно вдвое меньше, чем постоянного, а эмалевые призмы в них расположены горизонтально. На поверхности эмали временных зубов хорошо различимы призмы, множество пор и микротрещин из-за большого количества пучков и пластинок. Именно поэтому детские зубы более подвержены кариесу.
Зачем нужна эмаль
Основная функция эмали – защита дентина и пульпы от внешних механических, химических, температурных раздражителей.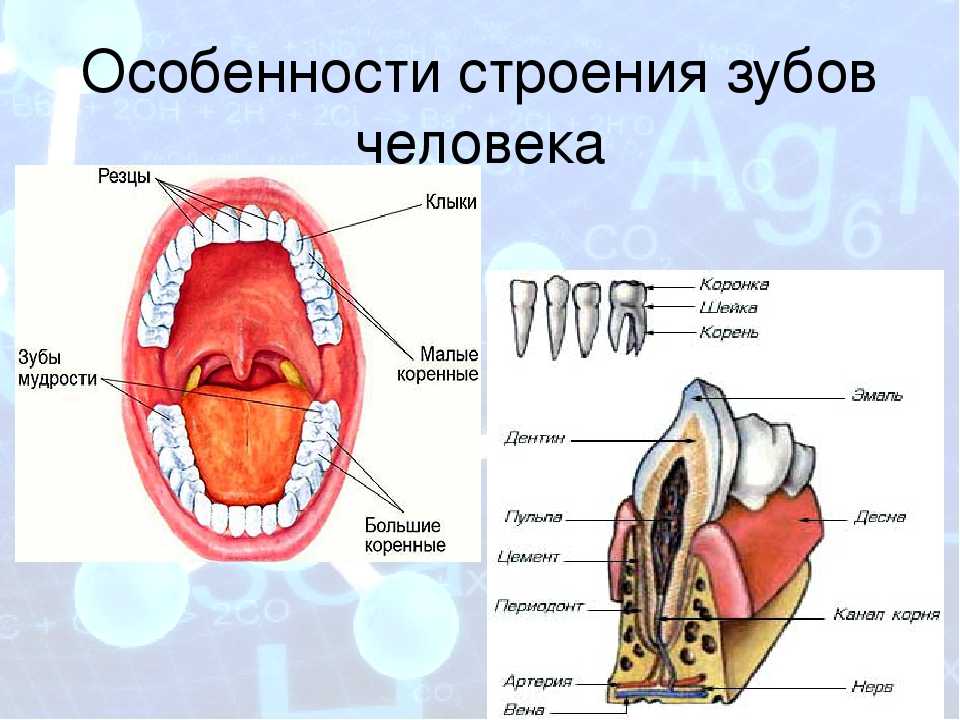 Неповреждённая эмаль препятствует проникновению в ткани зуба патогенных бактерий. Благодаря этому зуб функционирует: участвует в откусывании или пережёвывании пищи. Кроме того, гладкая белая эмаль придаёт зубам эстетичный вид.
Неповреждённая эмаль препятствует проникновению в ткани зуба патогенных бактерий. Благодаря этому зуб функционирует: участвует в откусывании или пережёвывании пищи. Кроме того, гладкая белая эмаль придаёт зубам эстетичный вид.
Процессы деминерализации и реминерализации в эмали сменяют друг друга на протяжении всей жизни человека. Реминерализация (иначе, насыщение эмали ионами) зависит от особенностей строения дентина и пульпы, а также от состава слюны. С возрастом процессы деминерализации преобладают, поэтому следует обращаться к специалисту для своевременного проведения реминерализующей терапии.
Как предупредить повреждение эмали
Самый простой и вместе с тем действенный способ защиты эмали и продления срока её службы – следование правилам гигиены полости рта. Важно не подвергать зубы механическому воздействию (грызть орехи, семечки, ногти, откупоривать бутылки и т.п.), так как, поверхность эмали хрупкая и подвержена возникновению трещин.
Большое влияние на состояние эмали оказывает также рацион человека и наличие вредных привычек.
Специалисты клиники DW рекомендуют регулярно проходить профилактические осмотры у стоматолога для выявления поражений эмали на самых ранних стадиях.
Российские ученые создали эмаль для зубов, превосходящую по твердости естественную — Газета.Ru
Российские ученые создали эмаль для зубов, превосходящую по твердости естественную — Газета.Ru | Новости
close
100%
Материал для минерализации костей и зубов гидроксиапатит усовершенствовали ученые из УрФУ при поддержке коллег из Воронежского государственного и Воронежского государственного медицинского университетов и Университета Аль-Азхар и Национального исследовательского центра в Египте. Новый метод восстановления зубной ткани может использоваться для снижения чувствительности зубов в случае истирания эмали или для ее восстановления после эрозии или неправильной диеты. Об этом «Газете. Ru» сообщили в пресс-службе университета.
Ru» сообщили в пресс-службе университета.
Исследователи добавили в состав гидроксиапатита комплекс аминокислот, в который вошли, в частности, лизин, аргинин и гистидин, имеющие важное значение для формирования и восстановления костных и мышечных структур. Это позволило сформировать из материала слой для покрытия зубов, воспроизводящий состав и микроструктуру природной эмали. Улучшенный состав материала повторяет особенности поверхности зуба на молекулярном и структурном уровнях, а по прочности превосходит природную ткань.
«Зубная эмаль несет защитную функцию, но, к сожалению, ее целостность может быть нарушена, например, истиранием, эрозией или микросколами. Если вовремя не восстановить поверхность тканей, поражение эмали далее затронет дентин, а затем и пульпу зуба. Поэтому необходимо восстановить поверхность эмали до здорового уровня или нарастить дополнительные слои на поверхности, если она стала очень тонкой. Мы создали биомиметический (т. е. имитирующий природный) минерализованный слой, нанокристаллы которого повторяют упорядоченность нанокристаллов апатита эмали зубов.
Ученые протестировали разработку на здоровых зубах, чтобы исключить влияние сторонних факторов на результат. С помощью микроскопических методов и химической визуализации они подтвердили формирование минерализованного слоя со свойствами, напоминающими свойства естественной твердой ткани
Далее исследователи займутся решением задачи по восстановлению крупных дефектов, которые могут иметь разную природу — от начальных стадий кариеса до трещин и объемных сколов.
Все новости на тему:
Цивилизация
Подписывайтесь на «Газету.Ru» в Новостях, Дзен и Telegram.
Новости
Дзен
Telegram
Георгий Малинецкий
За клубную работу всерьез!
О функциях РАН
«Дай Откусить»
Еще чашечку
О культуре потребления кофе в России и мире
Анастасия Миронова
Похудели на 100 кг? Лучше расскажите, как вы их наели!
О загадочных людях, которые не могут остановиться
Иван Глушков
Цимлянское несут уже
О том, как сделать российское вино самобытным и уникальным
Юлия Меламед
Два пьяных таракана
О релокантах в Ереване и иммигрантах в Константинополе
Найдена ошибка?
Закрыть
Спасибо за ваше сообщение, мы скоро все поправим.
Продолжить чтение
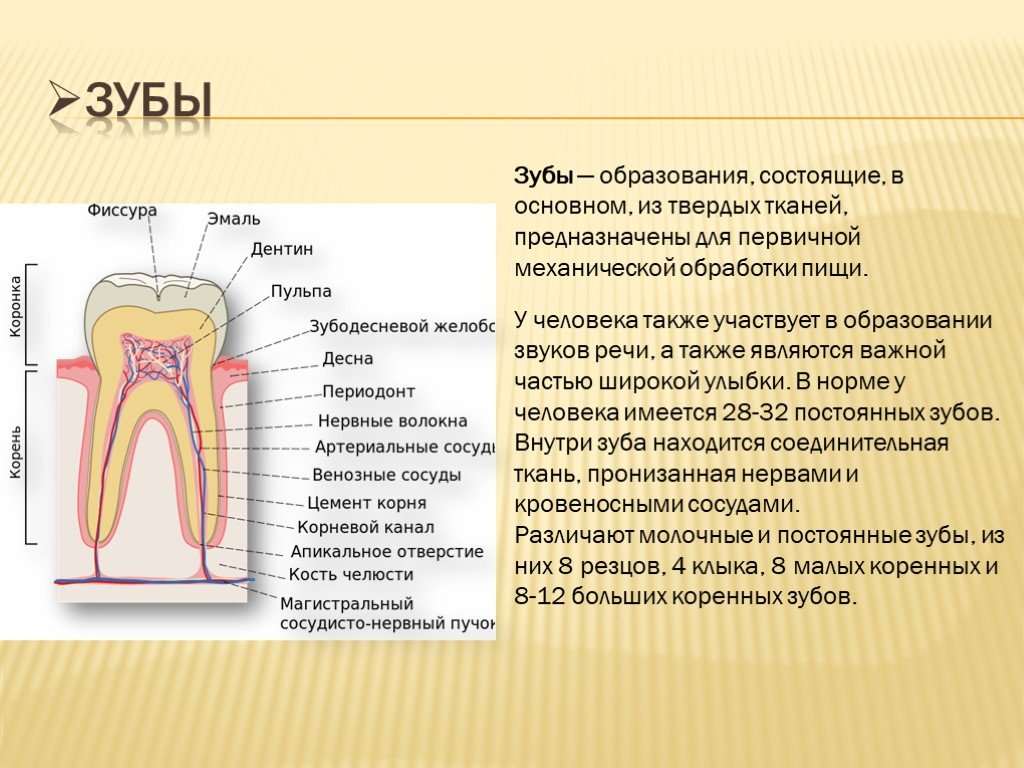
Состав рта и зубов
Рот
Джули
25 декабря 2017 г.
Рот и зубы состоят из ряда различных компонентов, каждый из которых имеет свое назначение и функцию, помогая нам есть, пить и общение.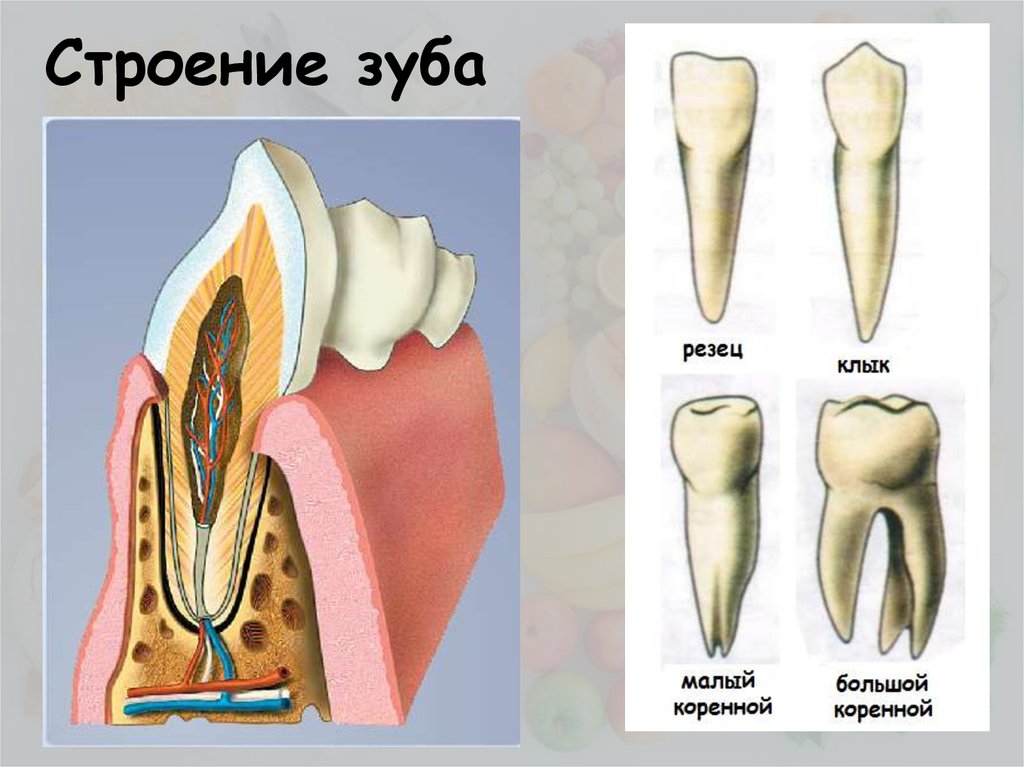 Один из лучших способов понять, как сохранить здоровье полости рта и обнаружить любые необычные признаки, — это узнать, что представляют собой эти различные компоненты и их важность для общей функции полости рта.
Один из лучших способов понять, как сохранить здоровье полости рта и обнаружить любые необычные признаки, — это узнать, что представляют собой эти различные компоненты и их важность для общей функции полости рта.
Состав полости рта
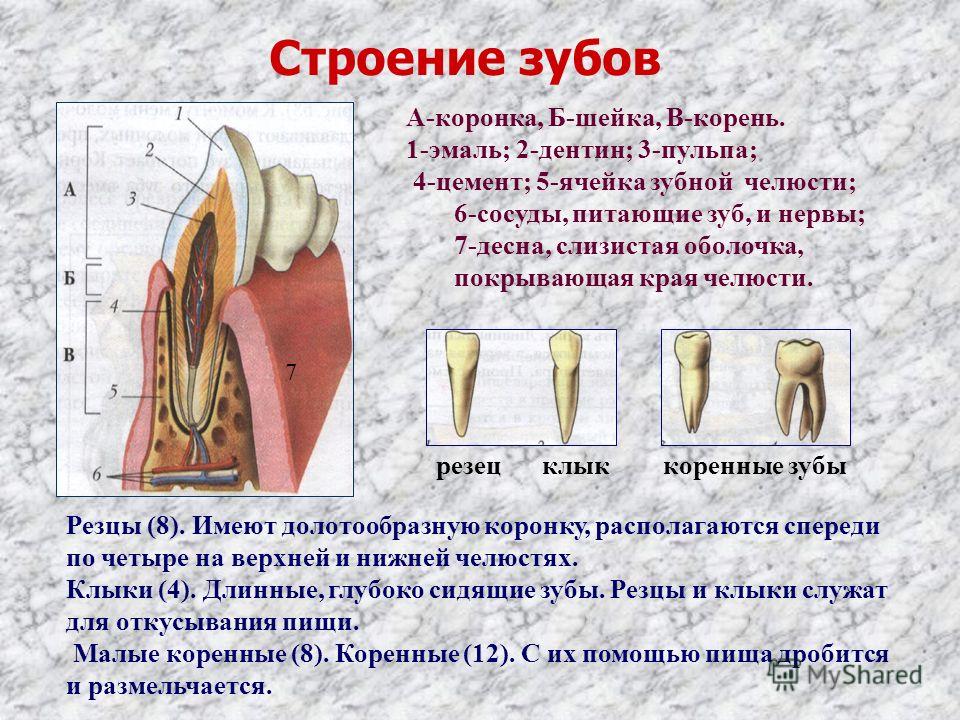
В школе нас учат о различных типах зубов и о том, как они помогают нам пережевывать пищу. В качестве напоминания (для тех из нас, кто давно закончил школу) вот разбивка зубов, которые составляют нашу улыбку:
Зубы
- Резцы (x8): расположены в передней части рта, с четырьмя вверху и четыре внизу, эти острые зубы используются для разрезания и измельчения пищи на более мелкие и удобные кусочки.
- Клыки (x4): обычно их называют клыками, один клык расположен по обе стороны от резцов, а заостренная форма зуба используется для захвата пищи и помощи нам в ее разрыве.
- Премоляры (x8): в отличие от резцов и клыков, наши премоляры имеют плоскую жевательную поверхность, которая помогает нам измельчать пищу в процессе жевания.
 С двумя премолярами, расположенными за нашими клыками, премоляры помогают подготовить пищу к последней стадии жевания на коренных зубах.
С двумя премолярами, расположенными за нашими клыками, премоляры помогают подготовить пищу к последней стадии жевания на коренных зубах. - Коренные зубы (x8): расположены в задней части рта, коренные зубы являются самыми большими из зубов, и их плоская поверхность используется для дробления и измельчения пищи на мелкие кусочки, чтобы облегчить глотание и облегчить пищеварение.
- Зубы мудрости (x4): зубы мудрости — это третьи моляры, которые обычно прорезываются в возрасте 17–25 лет. Они могут появиться не все, а в некоторых случаях и вовсе, но если и когда они появятся, то прорежутся в самой задней части каждого квадранта, за последним коренным зубом. Зубы мудрости часто ретинируются и требуют удаления.
Нёбо
Помимо полного набора зубов, наш рот также имеет другие жизненно важные компоненты, которые позволяют нам принимать пищу. Твердое небо, образующее нёбо, действует как барьер между ротовой полостью (ртом) и носовой полостью (носом). Мягкое небо также помогает защитить носовую полость от содержимого рта при глотании с помощью язычка.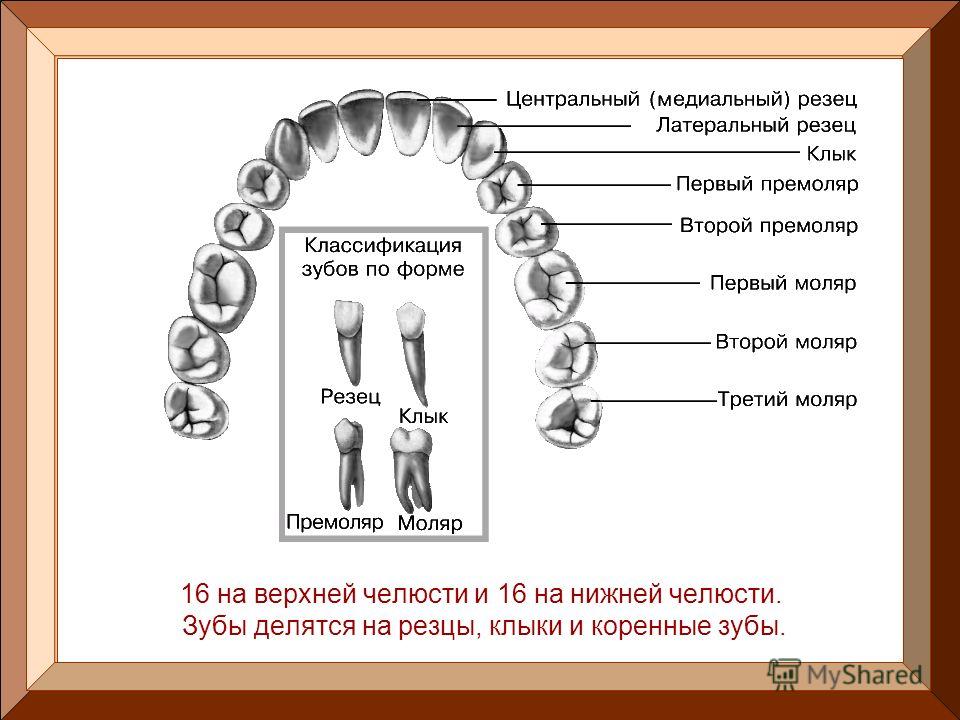
Небный язычок и миндалины
Небный язычок — это часть рта, которая свисает в центре мягкого неба. Он помогает при глотании, смазке горла и даже произношении определенных звуков. По обеим сторонам язычка находятся миндалины, скопление лимфатической ткани, которая играет важную роль в нашей иммунной системе. Собирая клетки чужеродных патогенов, которые попадают в наш рот, миндалины могут запускать иммунную систему нашего организма и увеличиваться в размерах и кровообращении, чтобы помочь бороться с болезнью.
Язык
Не в последнюю очередь это язык; эта сильная мышца помогает нам перемещать пищу, глотать, пробовать на вкус и говорить. Наш язык также помогает нам естественным образом поддерживать чистоту зубов и покрыт слюной, которая обладает антибактериальными свойствами, необходимыми для гигиены полости рта.
Состав зубов
Помимо понимания различных типов зубов, из которых состоит наш рот, и роли, которую они играют в пережевывании пищи, также важно знать состав зубов, чтобы понять гигиену полости рта и то, как ваши зубы остаются сильными и здоровыми.
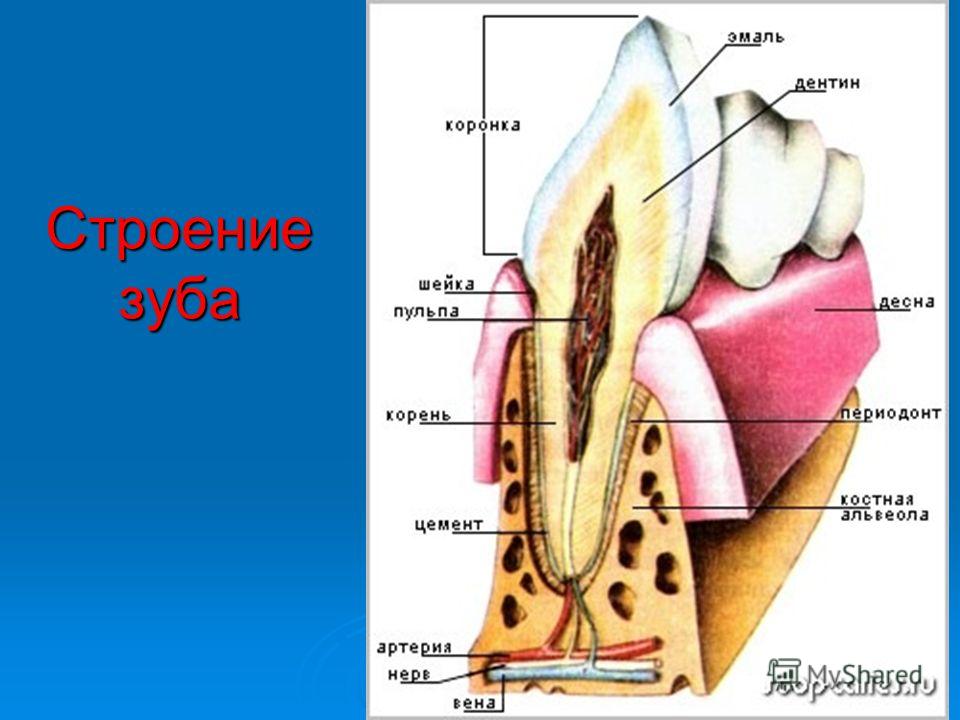
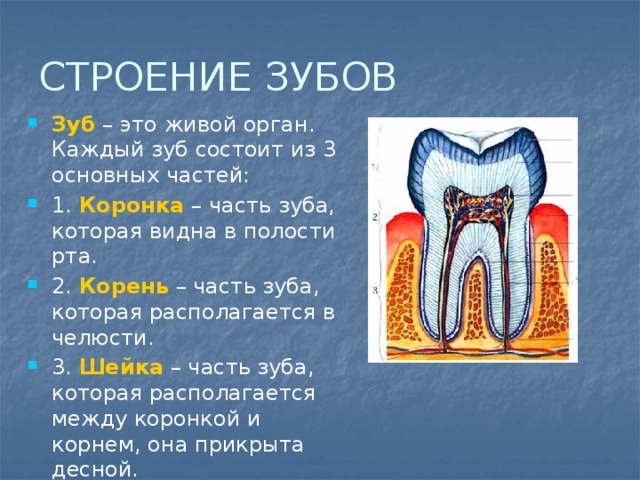
Эмаль
Коронка зуба покрыта тонким слоем эмали, особенно прочного вещества, которое содержит самый высокий уровень минерального вещества во всем теле. Это одна из четырех основных тканей, из которых состоит зуб, и ее основная цель — выступать в качестве барьера между более чувствительными компонентами зуба и вредными бактериями или веществами, которые попадают в наш рот. Из-за его относительной тонкости очень важно попытаться сохранить эмаль и сохранить ее здоровой, насколько это возможно. Если зубная эмаль утрачена из-за разрушения или износа, зуб становится гораздо более подверженным заболеваниям.
Дентин
Под эмалью находится дентин, менее хрупкое вещество, которое действует как опора для эмали, а также защищает расположенную ниже пульповую камеру, самую внутреннюю часть зуба, в которой находятся кровеносные сосуды и нервы, снабжающие зуб. Дентин имеет желтоватый цвет и благодаря полупрозрачности эмали именно отсюда берется естественный цвет наших зубов.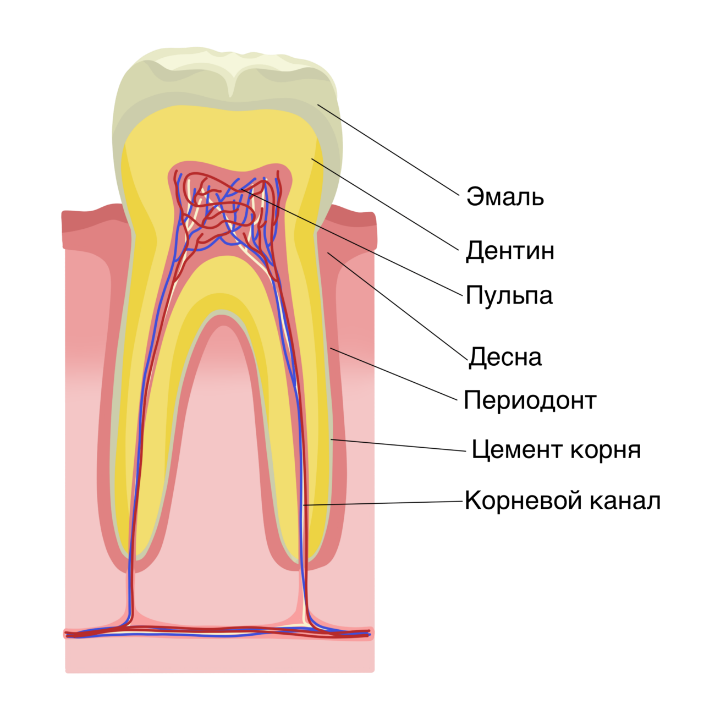
Пульпа
Пульпа зуба представляет собой соединительную ткань, расположенную в пульповой камере в центре зуба. Он проходит в зуб через каждый корневой канал и встречается посередине под эмалью и дентином в коронке зуба. Помимо нервов и кровеносных сосудов, питающих зуб, пульпа также содержит клетки, называемые одонтобластами, которые производят дентин.
Цемент
В отличие от коронки зуба корень не покрыт эмалью. Вместо этого он покрыт веществом, называемым цементом, который помогает ему закрепляться на деснах (деснах) и альвеолярной кости (зубной лунке). Поскольку цемент мягче, чем эмаль и дентин, если корень зуба обнажается из-за рецессии десен или периодонтита, цемент подвергается риску повреждения и чувствительности.
Можно с уверенностью сказать, что полость рта состоит из очень сложного и увлекательного набора компонентов, которые при правильном уходе помогут нам есть, пить, глотать, говорить и даже бороться с инфекцией на протяжении всей нашей жизни. Наши рты проходят через многое и ежедневно обрабатывают большое количество бактерий. Хотя они отлично защищают наш организм от вредных заболеваний, хорошая гигиена полости рта необходима для поддержания правильной функции рта и зубов.
Наши рты проходят через многое и ежедневно обрабатывают большое количество бактерий. Хотя они отлично защищают наш организм от вредных заболеваний, хорошая гигиена полости рта необходима для поддержания правильной функции рта и зубов.
Если вы хотите поговорить с опытным гигиенистом, чтобы лучше понять, как ухаживать за зубами, свяжитесь с нашей командой Vitality сегодня, чтобы договориться о консультации. Для получения дополнительной информации посетите нашу специальную страницу о гигиене.
Вы также можете связаться с нами, если у вас есть какие-либо текущие опасения по поводу проблем со здоровьем полости рта, вы заметили какие-либо изменения во рту или испытываете боль во рту, зубах или челюсти. Позвоните нам сегодня, чтобы обсудить ваши требования и договориться о встрече с нашей высококвалифицированной командой.
Эта статья была одобрена
Dr. Arvin Mirzadeh BDS MJDF RCS (ENG)
Стоматологический хирург и принцип практики
GDC 83757
- ← Общие проблемы с орелью в пожилом
- .
 Зубы: факты →
Зубы: факты →
Дентин: структура, состав и минерализация
1. Орвиг Т. Филогения тканей зубов: эволюция некоторых кальцифицированных тканей у ранних позвоночных. В: Майлз AEW, редактор. Структурно-химическая организация зубов. Академическая пресса; Нью-Йорк и Лондон: 1967. С. 45–110. [Google Scholar]
2. Кавасаки К., Бьюкенен А.В., Вайс К.М. Дупликация генов и эволюция минерализации скелета позвоночных. Клетки Ткани Органы. 2007; 186:7–24. [PubMed] [Google Scholar]
3. Такума С., Янагисава Т., Лин В.Л. Ультраструктурные и микроаналитические аспекты развития остеодентина в резцах крыс. Кальциф ткани Res. 1977; 29: 215–222. [PubMed] [Google Scholar]
4. Керебель Б., Ле Кабелек М.-Т., Дакулси Г., Керебель Л.-М. Остеодентин и сосудистый остеодентин Anarhichas lupus (L.) Cell Tiss Research. 1978;187:135–146. [PubMed] [Google Scholar]
5. Schilke R, Lisson JA, Bauss O, Geurtsen W. Сравнение количества и диаметра дентинных канальцев в дентине человека и быка с помощью сканирующего электронного микроскопа.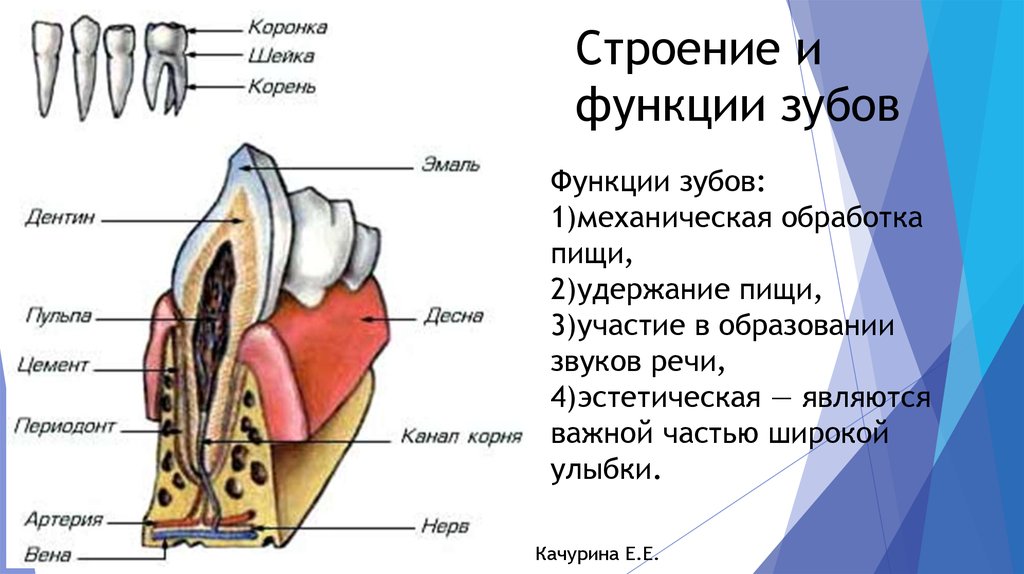 Arch Oral Biol. 2000;45:355–361. [PubMed] [Google Scholar]
Arch Oral Biol. 2000;45:355–361. [PubMed] [Google Scholar]
6. Kagayama M, Sasano Y, Tssuchia M, Watanabe M, Mizoguchi I, Kamakura S, Motegi K. Конфокальная микроскопия зернистого слоя Tomes в премолярах собак. Анат Эмбриол. 2000; 201:131–137. [PubMed] [Академия Google]
7. Ван Р.З., Вайнер С. Взаимоотношения деформации и структуры в зубах человека с использованием муаровых полос. Дж. Биомех. 1998; 31: 135–141. [PubMed] [Google Scholar]
8. Takagi Y, Sasaki S. Гистологическое распределение фосфофорина в нормальном и патологическом дентине человека. Дж Орал Патол. 1986; 15: 463–467. [PubMed] [Google Scholar]
9. Rahima M, Tsay TG, Andujar M, Veis A. Локализация фосфофорина в дентине резца крысы с использованием иммуноцитохимических методов. J Гистохим Цитохим. 1988; 36: 153–157. [PubMed] [Академия Google]
10. MacDougall M., Slavkin HC, Zeichner-David M. Характеристики фосфорилированного и нефосфорилированного дентинного фосфопротеина. Биохим Дж. 1992; 287:851–856.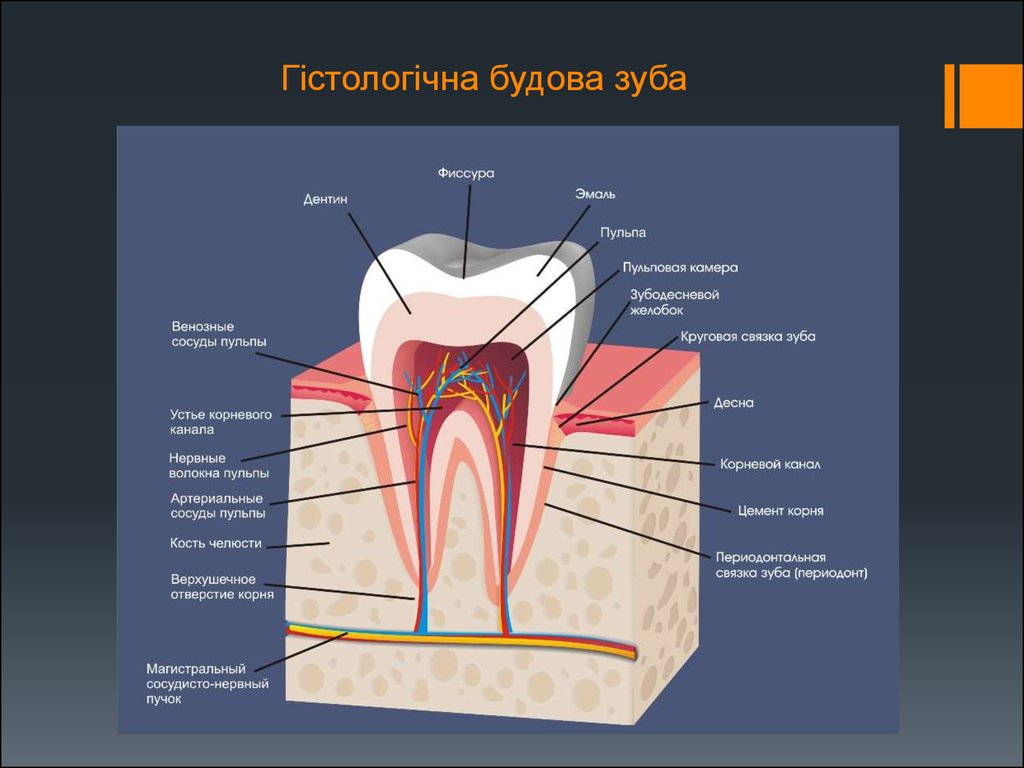 [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
11. Goldberg M, Septier D, Bourd K, Hall R, Jeanny J-Cl, Johnet L, Colin S, Tager F, Chaussain-Miller C, Garabedian M, Джордж А., Голдберг Х., Менаши С. Еще раз о соединении дентино-эмаль. Подключить тканевый рез. 2002; 43: 482–489. [PubMed] [Google Scholar]
12. Boukpessi T, Septier D, Bagga S, Garabedian M, Goldberg M, Chaussain-Miller C. Изменение дентина молочных зубов при гипофосфатемическом рахите человека. Кальциф ткани Int. 2006;79: 294–300. [PubMed] [Google Scholar]
13. Ван Р., Вайнер С. Дентин корня человека: структурная анизотропия и изотропия микротвердости по Виккерсу. Подключить тканевый рез. 1998; 39: 269–279. [PubMed] [Google Scholar]
14. Славкин Х.К., Круассан Р.Д., Брингас П., Матросян П., Уилсон П., Мино В., Гюнтер В. Неоднородность матричных пузырьков: возможные морфогенетические функции матричных пузырьков. ФРС проц. 1976; 35: 127–134. [PubMed] [Google Scholar]
15. Goldberg M, Molon Noblot M, Septier D.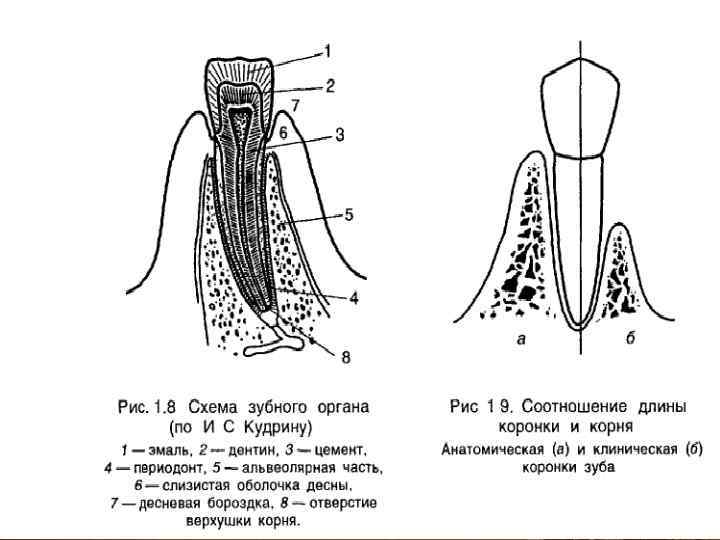 Влияние двух методов деминерализации на сохранение гликопротеинов и протеогликанов в межтрубчатом и перитубулярном дентине у лошади. J Биол Буккаль. 1980;8:315–330. [PubMed] [Google Scholar]
Влияние двух методов деминерализации на сохранение гликопротеинов и протеогликанов в межтрубчатом и перитубулярном дентине у лошади. J Биол Буккаль. 1980;8:315–330. [PubMed] [Google Scholar]
16. Weiner S, Veis A, Beniash E, Arad T, Dillon JW, Sabsay B, Siddiqui F. Формирование перитубулярного дентина: организация кристаллов и макромолекулярные компоненты в зубах человека. J Struct Biol. 1999; 126:27–41. [PubMed] [Google Scholar]
17. Готлив Б.А., Робач Дж.С., Вейс А. Состав и структура перитубулярного дентина крупного рогатого скота: картирование методом времяпролетной масс-спектроскопии вторичных ионов. J Struct Biol. 2006; 156:320–333. [PubMed] [Академия Google]
18. Готлив Б.А., Вейс А. Перитубулярный дентин, апатитная минерализованная ткань позвоночных без коллагена: роль фосфолипидно-протеолипидного комплекса. Кальциф ткани Int. 2007; 81: 191–205. [PubMed] [Google Scholar]
19. Голдберг М., Боски А.Л. Прогресс в гистохимии цитохимии. 2. Том. 31. Г.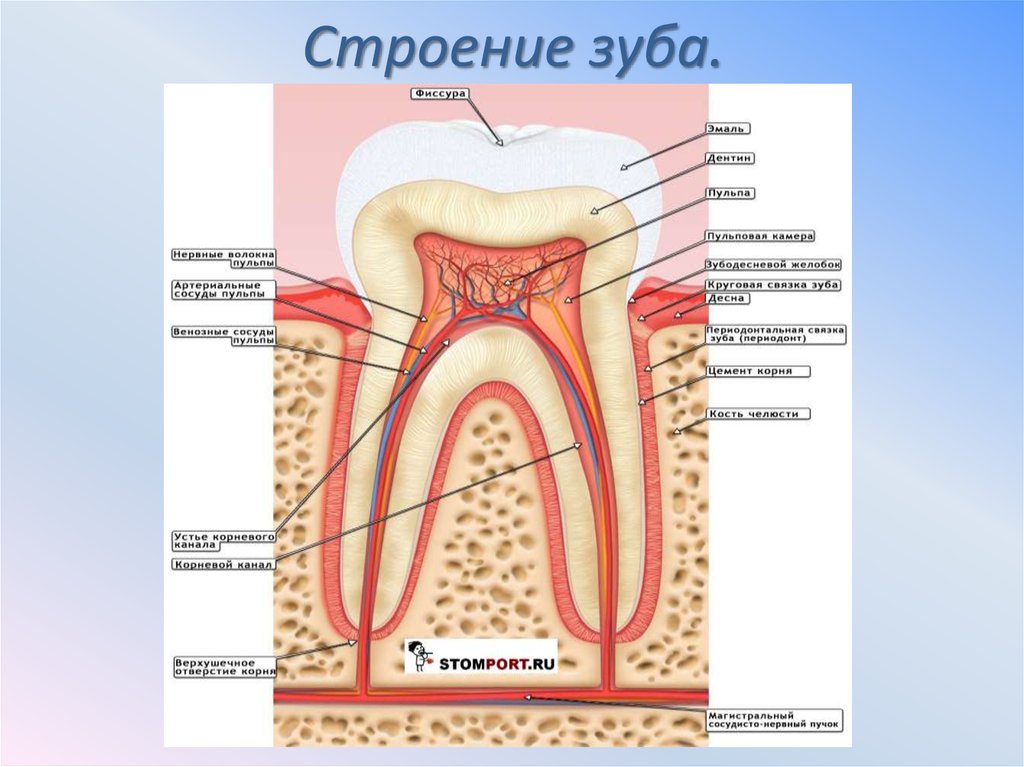 Фишер; Штутгарт: 1996. Липиды и биоминерализация; стр. 1–189. [PubMed] [Google Scholar]
Фишер; Штутгарт: 1996. Липиды и биоминерализация; стр. 1–189. [PubMed] [Google Scholar]
20. Лестер К.С., Бойд А. Морфология поверхности некоторых кристаллических компонентов дентина. В: Symons NBB, редактор. Дентин и пульпа: их строение и реакции. Томсон и Ко, ООО; Данди: 1968. стр. 197–219. [Google Scholar]
21. Шредер Л., Франк Р.М. Просвечивающая электронная микроскопия высокого разрешения перитубулярного дентина взрослого человека. Сотовые Ткани Res. 1985; 242: 449–451. [PubMed] [Google Scholar]
22. Goldberg M, Septier D. Сравнительное исследование перехода между предентином и дентином с использованием различных подготовительных процедур у крыс. Европа J Оральные науки. 1996; 104: 269–277. [PubMed] [Google Scholar]
23. Goldberg M, Septier D, Rapoport O, Iozzo RV, Young MF, Ameye LG. Целенаправленное разрушение двух небольших богатых лейцином протеогликанов, бигликана и декорина, оказывает разное влияние на формирование эмали и дентина. Кальциф ткани Int.
24. Goldberg M, Septier D, Oldberg A, Young MF, Ameye LG. У мышей с дефицитом фибромодулина наблюдается нарушение фибриллогенеза коллагена в предентине, а также измененная минерализация дентина и формирование эмали. J Гистохим Цитохим. 2006; 54: 525–537. [PubMed] [Google Scholar]
25. Goldberg M, Septier D, Escaig-Haye F. Progress in Histochemistry Cytochemistry. 17/2. Штутгарт: G.Fischer Verlag; 1987. Гликоконъюгаты в дентиногенезе и дентине; стр. 1–113. [PubMed] [Академия Google]
26. Сильвер Ф.Х., Лэнгли К.Х., Трелстад Р.Л. Фибриллогенез коллагена I типа: инициация посредством обратимых линейных и латеральных этапов роста. Биополимеры. 2004; 18: 2523–2535. [PubMed] [Google Scholar]
27. Höehl E. Beitrag zur гистология пульпы и дентина. Архив анатомии и физиологии. 1896; 32:31–54. [Google Scholar]
28. Джонс С.Дж., Бойд А. Ультраструктура дентина и дентиногенез. В: Линде А, редактор. Дентин и дентиногенез.
29. Азеведо Н., Голдберг М. Постнатальное развитие зубных структур у Didelphis albiventris. J Биол Буккаль. 1987; 15: 23–35. [PubMed] [Google Scholar]
30. Ruch JV, Lesot H, Begue-Kirn C. Дифференцировка одонтобластов. Int J Dev Biol. 1995; 39: 51–68. [PubMed] [Google Scholar]
31. Голдберг М., Септье Д., Леколь С., Шарден Х., Кинтана М.А., Асеведо А.С., Гафни Г., Диллуйя Д., Вермелин Л., Тонеманн Б., Шмальц Г., Биссила-Мапаху П., Карро Дж.П. Зубная минерализация. Int J Dev Biol. 1995;39:93–110. [PubMed] [Google Scholar]
32. Weinstock M, Leblond CP. Синтез, миграция и высвобождение предшественника коллагена одонтобластами, визуализируемые с помощью радиоаутографии после введения 3H-пролина. Джей Селл Биол. 1974; 60: 92–127. [Бесплатная статья PMC] [PubMed] [Google Scholar]
33. Фрэнк Р.М. Авторадиография дентиногенеза и электронная микроскопия с добавлением тритиона пролина у крыс. Arch Oral Biol. 1970; 15: 583–596. [PubMed] [Google Scholar]
Arch Oral Biol. 1970; 15: 583–596. [PubMed] [Google Scholar]
34. Salomon JP, Lecolle S, Roche M, Septier D, Goldberg M. Радиоавтографическое сравнение включения 3H-пролина и 3H-серина in vivo в пульповый дентин моляров крыс: вариации в соответствии с разные зоны. J Биол Буккаль. 1990;18:307–312. [PubMed] [Google Scholar]
35. Батлер В.Т. Коллаген дентина: химическая структура и роль в минерализацииx0201C; В: Линде А, редактор. Дентин и дентиногенез. II. КПР Пресс; Бока-Ратон: 1984. стр. 37–53. Глава 8. [Google Scholar]
36. Weinstock M, Leblond CP. Радиоавтографическая визуализация отложения фосфопротеина на фронте минерализации в дентине резца крысы. Джей Селл Биол. 1973; 56: 838–845. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Goldberg M, Genotelle-Septier D, Weill R. Glycoproteines et protéoglycanes dans la matrice prédentinaire et dentinaire chez le rat: une etude ultrastructurale. J Биол Буккаль. 1978; 6: 75–90. [PubMed] [Google Scholar]
38. Torres-Quintana MA, Lécolle S, Goldberg M. Влияние гексасульфата инозитола, ингибитора казеинкиназы, на фосфорилированные белки дентина в культуре органов мышиных зубных зачатков. Arch устные биол. 1998; 43: 597–610. [PubMed] [Академия Google]
Torres-Quintana MA, Lécolle S, Goldberg M. Влияние гексасульфата инозитола, ингибитора казеинкиназы, на фосфорилированные белки дентина в культуре органов мышиных зубных зачатков. Arch устные биол. 1998; 43: 597–610. [PubMed] [Академия Google]
39. Гольдберг М., Такаги М. Протеогликаны дентина: состав, ультраструктура и функции. Histochemical J. 1993; 25:781–806. [PubMed] [Google Scholar]
40. Embery G, Hall R, Waddington R, Septier D, Goldberg M. Протеогликаны в дентиногенезе. Критический обзор биологии и медицины полости рта. 2001; 12:331–349. [PubMed] [Google Scholar]
41. Septier D, Hall R, Lloyd D, Embery G, Goldberg M. Количественные иммуногистохимические доказательства функционального градиента хондроитин-4-сульфата / дерматансульфата, регулируемого развитием в предентине резца крысы. . Гистохимический J. 1998;30:275–284. [PubMed] [Google Scholar]
42. Hall R, Septier D, Embery G, Goldberg M. Стромелизин-1 (MMP-3) в формировании эмали и предентина в резце крысы – скоординированное распределение с протеогликанами предполагает функциональную роль.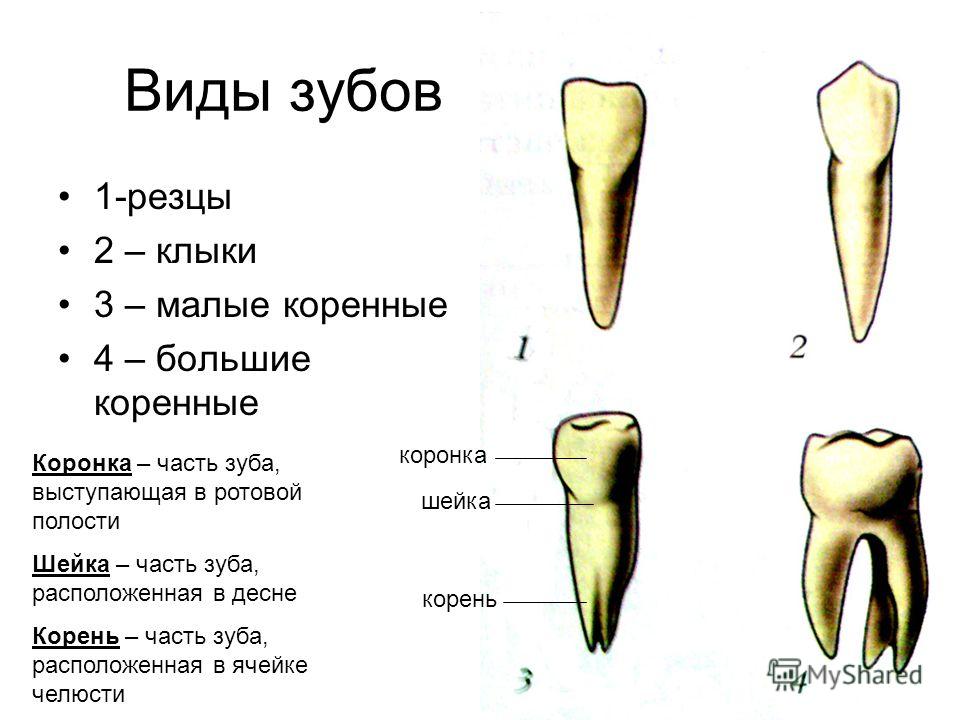 Histochemical J. 1999;31:761–770. [PubMed] [Google Scholar]
Histochemical J. 1999;31:761–770. [PubMed] [Google Scholar]
43. Goldberg M, Escaig F. Появление фазы протеогликанов в TEM предентина зависит от фиксации. J Микроскопия. 1984; 134: 161–167. [PubMed] [Google Scholar]
44. Lormée P, Lécolle S, Beaudin, Septier D, Goldberg M. Двойное включение ( 35 S) сульфат в протеогликаны дентина, действующие как стимуляторы минерализации в молярах крыс, и протеогликаны предентина. Calcified Tissue International. 1996; 58: 368–375. [PubMed] [Google Scholar]
45. Septier D, Hall RC, Embery G, Goldberg M. Иммуноэлектронно-микроскопическая визуализация про- и секретируемых форм декорина и бигликана в предентине и во время образования дентина в резце крысы. Кальциф Тиссью Интернэшнл. 2001; 69: 38–45. [PubMed] [Google Scholar]
46. Goldberg M, Rapoport O, Septier D, Palmier K, Hall R, Embery G, Young M, Ameye L. Протеогликаны в предентине: последние 15 микрометров перед минерализацией. Подключить тканевый рез. 2003; 44 (Приложение 1): 184–188.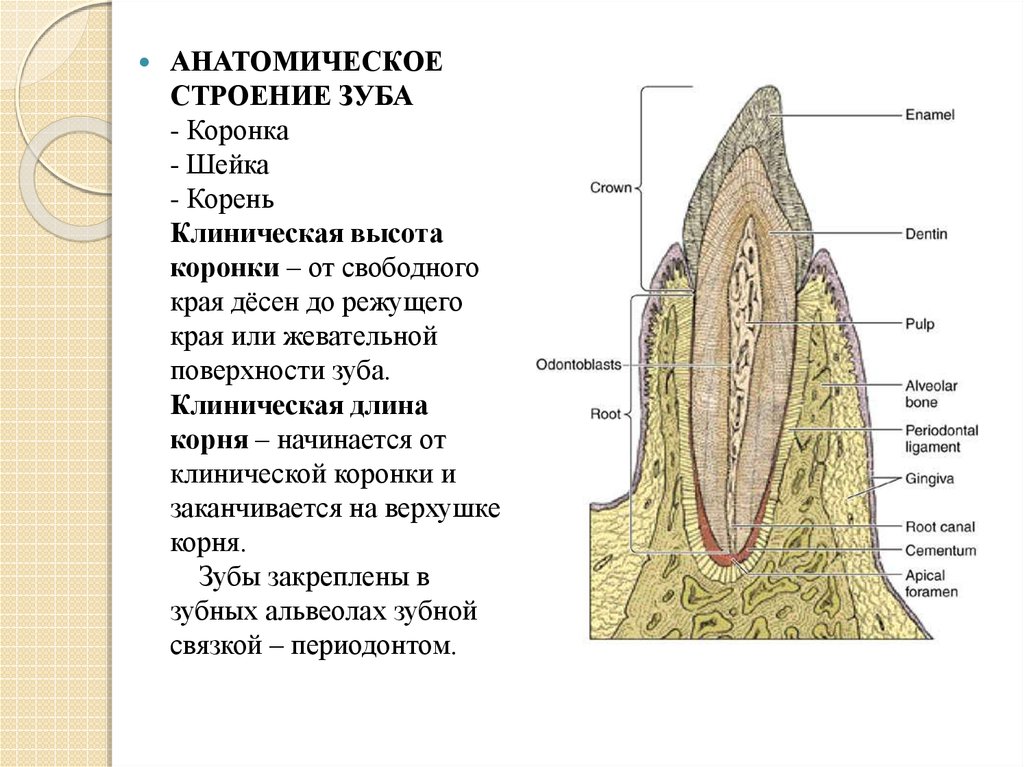 [PubMed] [Академия Google]
[PubMed] [Академия Google]
47. Inage T, Toda Y. Синтез и секреция фосфопротеинов одонтобластами в резце крысы по данным электронно-микроскопической радиоаутографии. Ам Дж Анат. 1988; 182: 369–380. [PubMed] [Google Scholar]
48. Вайншток А., Вайншток М., Леблон С.П. Авторадиографическое обнаружение включения 3 Н-фукозы в гликопротеин одонтобластами и ее отложения на участке фронта кальцификации в дентине. Кальциф ткани Res. 1972; 8: 181–189. [PubMed] [Академия Google]
49. Warshawsky H, Josephsen K. Поведение веществ, меченных 3H-пролином и 3H-фукозой, в клеточных отростках одонтобластов и амелобластов. Анат Рек. 1981; 200:1–10. [PubMed] [Google Scholar]
50. Goldberg M, Lécolle S, Vermelin L, Benghezal A, Septier D, Godeau G. Поглощение [3H]холина и превращение в фосфолипиды мембраны и внеклеточного матрикса, визуализированные с помощью радиоаутографии в дентине резца крысы и эмаль. Кальциф ткани Int. 1999; 65: 66–72. [PubMed] [Академия Google]
51. Ушияма Дж. Щелевые контакты между одонтобластами, выявленные трансъюнкционными потоками флуоресцентных индикаторов. Сотовые Ткани Res. 1989; 258: 611–616. [PubMed] [Google Scholar]
Ушияма Дж. Щелевые контакты между одонтобластами, выявленные трансъюнкционными потоками флуоресцентных индикаторов. Сотовые Ткани Res. 1989; 258: 611–616. [PubMed] [Google Scholar]
52. Киношита Ю. Включение сывороточного альбумина в развивающийся дентин и эмалевой матрикс в развивающийся дентин и эмалевой матрикс резца кролика. Кальциф ткани Int. 1979; 29: 41–46. [PubMed] [Google Scholar]
53. Veerlamp JH, Maatman RGHJ. Цитоплазматические белки, связывающие жирные кислоты: их структура и гены. Прогр липидов рез. 1995;34:17–52. [PubMed] [Google Scholar]
54. Munhoz COG, Leblond CP. Отложение фосфата кальция в дентине и эмали, как показано на рентгенограмме срезов резцов после инъекции 45 Ca крысам. Кальциф ткани Res. 1974; 15: 221–235. [PubMed] [Google Scholar]
55. Нагаи Н., Фрэнк Р.М. Электронно-микроскопическая авторадиография Ca45 во время дентиногенеза. Сотовый Тисс Res. 1974; 135: 513–523. [PubMed] [Google Scholar]
56. Фишер Л. В., Федарко Н.С. Шесть генов, экспрессируемых в костях и зубах, кодируют текущие члены семейства белков SIBLING. Подключить тканевый рез. 2003; 44 (Приложение 1): 33–40. [PubMed] [Академия Google]
В., Федарко Н.С. Шесть генов, экспрессируемых в костях и зубах, кодируют текущие члены семейства белков SIBLING. Подключить тканевый рез. 2003; 44 (Приложение 1): 33–40. [PubMed] [Академия Google]
57. Алфорд А.И., Ханкенсон К.Д. Матрицеллюлярные белки: внеклеточные модуляторы развития, ремоделирования и регенерации костей. Кость. 2006; 38: 749–757. [PubMed] [Google Scholar]
58. Jadlowiec JA, Zhang X, Li J, Campbell PG, Sfeir C. Опосредованная внеклеточным матриксом передача сигналов дентинным фосфофорином включает активацию пути Smad независимо от костного морфогенетического белка. Дж. Биол. Хим. 2006; 281:5341–5347. [PubMed] [Google Scholar]
59. Bonucci E. Тонкая структура ранней кальцификации хряща. J Ultrastruct Res. 1967;20:33. [PubMed] [Google Scholar]
60. Андерсон Х.К. Везикулы, связанные с кальцинозом в матрице эпифизарного хряща. Джей Селл Биол. 1969; 41: 59–72. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Kardos TB, Hubbard MJ.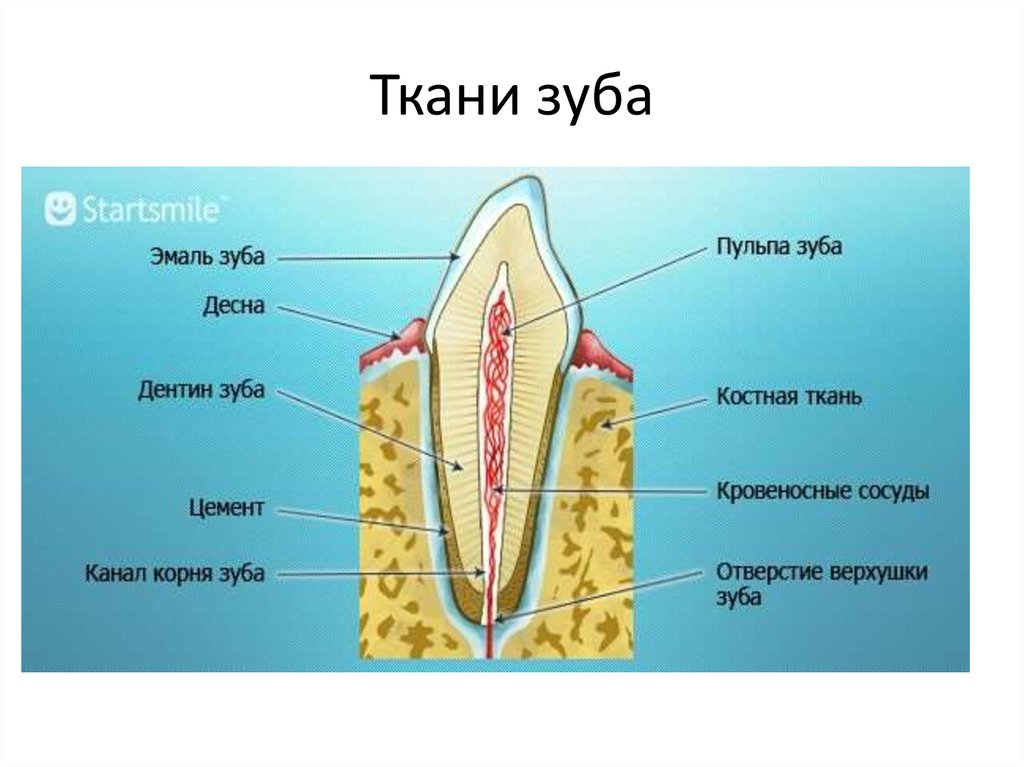 Являются ли матриксные везикулы апоптозными телами? Прог Клин Биол Рез. 1982; 101: 45–60. [PubMed] [Google Scholar]
Являются ли матриксные везикулы апоптозными телами? Прог Клин Биол Рез. 1982; 101: 45–60. [PubMed] [Google Scholar]
62. Глимчер М.Дж. Фосфопептиды матрикса эмали. Джей Дент Рез. 1979; 58 (Б): 790–806. [PubMed] [Google Scholar]
63. Мацуки Ю., Накашима М., Амизука Н., Варшавски Х., Гольцман Д., Ямада К.М., Ямада Ю. Компиляция частичных последовательностей случайно выбранных клонов кДНК из резца крысы. Джей Дент Рез. 1995;74:307–312. [PubMed] [Google Scholar]
64. Buchaille R, Couble ML, Magloire H, Bleicher F. Библиотека кДНК на основе субстрактивной ПЦР из клеток одонтобласта человека: идентификация новых генов, экспрессируемых в зубообразующих клетках. Матрица биол. 2000; 19: 421–430. [PubMed] [Google Scholar]
65. Davis GE, Bayless KJ, Davis MJ, Meininger GA. Регуляция реакций на повреждение тканей путем воздействия на матрикриптические сайты внутри молекул внеклеточного матрикса. Ам Джей Патол. 2000; 156:1489–149.8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
66. Van der Rest M, Garrone R. Семейство белков коллагена. FASEB J. 1991; 5: 2814–2823. [PubMed] [Google Scholar]
Van der Rest M, Garrone R. Семейство белков коллагена. FASEB J. 1991; 5: 2814–2823. [PubMed] [Google Scholar]
67. Дэвид Л., Кристиансен, Хуанг Эрик К., Фредерик Х. Сильвер Сборка коллагена I типа: слияние субъединиц фибрилл и влияние диаметра фибрилл на механические свойства. Матричная биология. 2000;19:409–420. [PubMed] [Google Scholar]
68. Milan AM, Sugars RV, Embery G, Waddington RJ. Модуляция фибриллогенеза коллагена дентинными протеогликанами. Кальциф ткани Int. 2005; 76: 127–135. [PubMed] [Академия Google]
69. Эрлих Х.П., Росс Р., Борнштейн П. Влияние антимикротубулярных агентов на секрецию коллагена. Биохимическое и морфологическое исследование. Джей Селл Биол. 1974; 62: 390–405. [Бесплатная статья PMC] [PubMed] [Google Scholar]
70. Goldberg M, Escaig F. Odontoblastes/collagène dans la prédentine et la dentine de l’incisive de rat. Этюд по криофрактуре. Биология клетки. 1981; 40: 203–216. [Google Scholar]
71. Нагаи Н. Ультраструктурная локализация кислой фосфатазы в одонтобластах резцов молодых крыс. Булл Токио Дент Кол. 1970;11:85–120. [PubMed] [Google Scholar]
Булл Токио Дент Кол. 1970;11:85–120. [PubMed] [Google Scholar]
72. Prockop DJ, Sieron AL, Li SW. Проколлаген-N-протеиназа и проколлаген-С-протеиназа. Две необычные металлопротеиназы, которые необходимы для процессинга проколлагена, вероятно, играют важную роль в развитии и передаче клеточных сигналов. Матрица биол. 1998; 16: 399–408. [PubMed] [Google Scholar]
73. Salomon J-P, Septier D, Goldberg M. Ультраструктура межодонтобластных волокон в моляре крысы. Arch Oral Biol. 1991; 36: 171–176. [PubMed] [Академия Google]
74. Huq NL, Loganathan A, Cross KJ, Chen YY, Johnson NI, Willetts M, Veith PD, Reynolds EC. Ассоциация фосфофорина бычьего дентина с фрагментами коллагена. Arch Oral Biol. 2005; 50:807–19. [PubMed] [Google Scholar]
75. Huang B, Sun Y, Maciejewska I, Qin D, Peng T, McIntyre B, Wygant J, Butler WT, Qin C. Распределение белков SIBLING в органической и неорганической фазах крысы дентин и кость. Eur J Oral Sci. 2008; 116: 104–112. [Бесплатная статья PMC] [PubMed] [Google Scholar]
76. Огбуреке К.У., Фишер Л.В. Экспрессия SIBLINGs и их партнерских MMP в слюнных железах. Джей Дент Рез. 2004; 83: 664–670. [PubMed] [Google Scholar]
Огбуреке К.У., Фишер Л.В. Экспрессия SIBLINGs и их партнерских MMP в слюнных железах. Джей Дент Рез. 2004; 83: 664–670. [PubMed] [Google Scholar]
77. Огбуреке К.У., Фишер Л.В. Почечная экспрессия белка SIBLING и их партнерских матриксных металлопротеиназ (ММП) Kidney Int. 2005; 68: 155–166. [PubMed] [Google Scholar]
78. McKnight DA, Simmer JP, Hart PS, Hart TC, Fisher LW. Перекрывающиеся мутации DSPP вызывают дисплазию дентина и несовершенный дентиногенез. Джей Дент Рез. 2008; 87: 1108–1111. [Бесплатная статья PMC] [PubMed] [Google Scholar]
79. Yamakoshi Y, Hu JC-C, Fukae M, Zhang H, Simmer JP. Гликопротеин дентина Белок в середине сиалофосфопротеиновой химеры дентина. Дж. Биол. Хим. 2005; 280:17472–17479. [PubMed] [Google Scholar]
80. фон Маршалл З., Фишер Л.В. Сиалофосфопротеин дентина (DSPP) расщепляется на два продукта естественного дентинного матрикса тремя изоформами костного морфогенетического белка-1 (BMP1) Matrix Biol. doi: 10.1016/j.matbio. 2010.01.002. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2010.01.002. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
80А. Тиагараджан Т., Шринат Т., Чо А., Райт Дж. Т., Кулкарни А. Б. Снижение экспрессии сиалофосфопротеина дентина связано с диспластическим дентином у мышей со сверхэкспрессией трансформирующего фактора роста-бета 1 в зубах. Дж. Биол. Хим. 2001;276(14):11016–11020. [PubMed] [Google Scholar]
80B. Тиагараджан Т., Тотей С., Дантон М.Дж., Кулкарни А.Б. Генетически измененные модели мышей: хорошие, плохие и уродливые. Crit Rev Oral Biol Med. 2003;14(3):154–174. [PubMed] [Академия Google]
81. Chen S, Gluhak-Heinrich J, Martinez M, Li T, Wu Y, Chuang H-H, Chen L, Dong J, Gay I, MacDougall M. Костный морфогенетический белок 2 опосредует экспрессию сиалофосфопротеина в дентине и дифференцировку одонтобластов через NF-Y Сигнализация. Дж. Биол. Хим. 2008; 283: 19359–19370. [Бесплатная статья PMC] [PubMed] [Google Scholar]
82. Sreenath T, Thyagarajan T, Hall B, Longenecker G, D’Souza R, Hong S, Wright JT, MacDougall M, Sauk J, Kulkarni AB.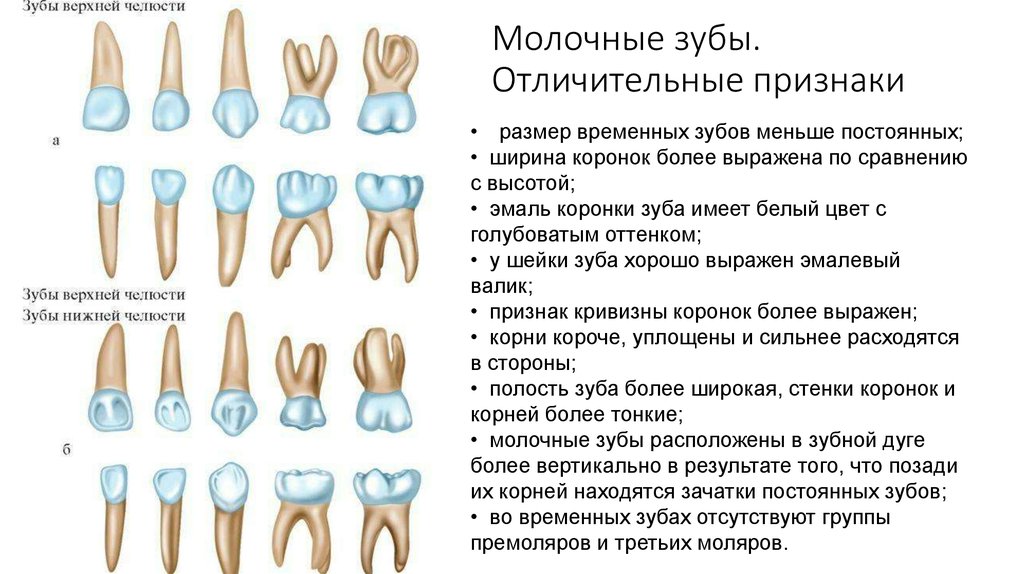 Зубы мышей с нокаутом дентина по сиалофосфопротеину демонстрируют расширенную зону предентина и развивают дефектную минерализацию дентина, аналогичную несовершенному дентиногенезу человека типа III. Дж. Биол. Хим. 2003; 278:24874–24880. [PubMed] [Академия Google]
Зубы мышей с нокаутом дентина по сиалофосфопротеину демонстрируют расширенную зону предентина и развивают дефектную минерализацию дентина, аналогичную несовершенному дентиногенезу человека типа III. Дж. Биол. Хим. 2003; 278:24874–24880. [PubMed] [Академия Google]
83. Yamakoshi Y, Hu JC-C, Fukae M, Iwata T, Kim JW, Zhang H, Simmer JP. Сиалопротеин свиного дентина представляет собой протеогликан с цепями гликозаминогликанов, содержащий хондроитин-6-сульфат. Дж. Биол. Хим. 2005; 280:1552–1560. [PubMed] [Google Scholar]
84. Боски А., Спевак Л., Тан М., Доти С.Б., Батлер В.Т. Сиалопротеин дентина (DSP) оказывает ограниченное влияние на образование и рост апатита in vitro. Кальциф ткани Int. 2000; 67: 472–478. [PubMed] [Google Scholar]
85. Suzuki S, Sreenath T, Haruyama N, Honeycutt C, Terse A, Cho A, Kohler T, Müller R, Goldberg M, Kulkarni AB. Сиалопротеин дентина и фосфопротеин дентина играют различную роль в минерализации дентина. Матрица биол. 2009 г.;28:221–229. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
86. Хе Г., Рамачандран А., Даль Т., Джордж С., Шульц Д., Куксон Д., Вейс А., Джордж А. Фосфорилирование фосфорина имеет решающее значение для его функции в качестве Медиатор биоминерализации. Дж. Биол. Хим. 2005; 280:33109–33114. [PubMed] [Google Scholar]
87. Yamakoshi Y, Lu Y, Hu JC, Kim JW, Iwata T, Kobayashi K, Nagano T, Yamakoshi F, Hu Y, Fukae M, Simmer JP. Сиалофосфопротеин свиного дентина: полиморфизм длины, гликозилирование, фосфорилирование и стабильность. Дж. Биол. Хим. 2008; 283:14835–14844. [Бесплатная статья PMC] [PubMed] [Google Scholar]
89. Лусси А., Креншоу М.А., Линде А. Индукция и ингибирование образования гидроксиапатита фосфопротеином дентина крысы in vitro. Arch Oral Biol. 1988; 33: 685–691. [PubMed] [Google Scholar]
90. Сайто Т., Ямаути М., Абико Ю., Мацуда К., Креншоу М.А. Индукция апатита in vitro фосфофорином, иммобилизованным на модифицированных коллагеновых фибриллах. Джей Боун Шахтер Рез.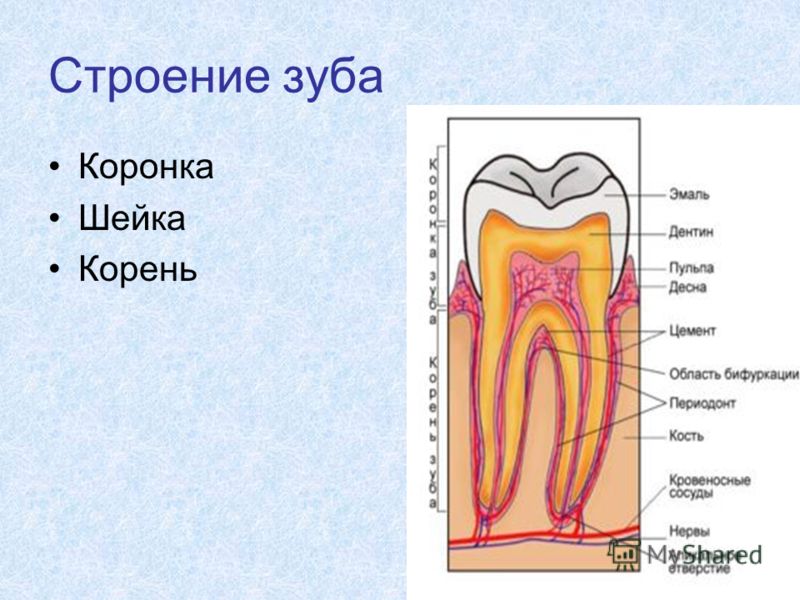 2000;15:1615–1619. [PubMed] [Google Scholar]
2000;15:1615–1619. [PubMed] [Google Scholar]
91. Fujisawa R, Kuboki Y. Преимущественная адсорбция дентина и костных кислых белков на поверхности (100) кристаллов гидроксиапатита. Биохим Биофиз Акта. 1991;1075:56–60. [PubMed] [Google Scholar]
92. Kim JW, Yamakoshi Y, Iwata T, Hu YY, Zhang H, Hu JC, Simmer JP. Матричный белок 1 дентина свиньи: структура гена, последовательность кДНК и экспрессия в зубах. Eur J Oral Sci. 2006; 114:33–41. [Бесплатная статья PMC] [PubMed] [Google Scholar]
93. Steiglitz BM, Ayala M, Narayanan K, George A, Greenspan DS. Костный морфогенетический белок-1/толлоидоподобные протеиназы обрабатывают белок дентинной матрицы-1. Дж. Биол. Хим. 2004; 279: 980–986. [PubMed] [Академия Google]
94. Нараянан К., Гаджераман С., Рамачандран А., Хао Дж., Джордж А. DMP-1 регулирует транскрипцию гена сиалофосфопротеина дентина во время ранней дифференцировки одонтобластов. Дж. Биол. Хим. 2006; 281:19064–19071. [PubMed] [Google Scholar]
95. Tartaix PH, Doulaverakis M, George A, Fisher LW, Butler WT, Qin C, Salih E, Tan M, Fujimoto Y, Spevak L, Boskey AL. Исследование In Vitro Влияние белка дентинной матрицы-1 на образование гидроксиапатита позволяет получить представление о функциях in Vivo . Дж. Биол. Хим. 2004;279: 18115–18120. [PubMed] [Google Scholar]
Tartaix PH, Doulaverakis M, George A, Fisher LW, Butler WT, Qin C, Salih E, Tan M, Fujimoto Y, Spevak L, Boskey AL. Исследование In Vitro Влияние белка дентинной матрицы-1 на образование гидроксиапатита позволяет получить представление о функциях in Vivo . Дж. Биол. Хим. 2004;279: 18115–18120. [PubMed] [Google Scholar]
96. Линг Ю., Риос Х.Ф., Майерс Э.Р., Лу Ю., Фэн Дж.К., Боски А.Л. Истощение DMP1 снижает минерализацию костей in vivo: анализ изображений FTIR. Джей Боун Шахтер Рез. 2005;20:2169–2177. [Бесплатная статья PMC] [PubMed] [Google Scholar]
97. Qin C, DSouza R, Feng JQ. Dentin Matrix Protein 1 (DMP1): новые и важные роли в биоминерализации и фосфатном гомеостазе. Джей Дент Рез. 2007; 86: 1134–1141. [PubMed] [Google Scholar]
98. Ye L, MacDougall M, Zhang S, Xie Y, Zhang J, Li Z, Lu Y, Mishina Y, Feng JQ. Делеция Dentin Matrix Protein-1 приводит к частичному нарушению созревания предентина в дентин, гипоминерализации и расширению полостей пульпы и корневых каналов во время постнатального развития зубов.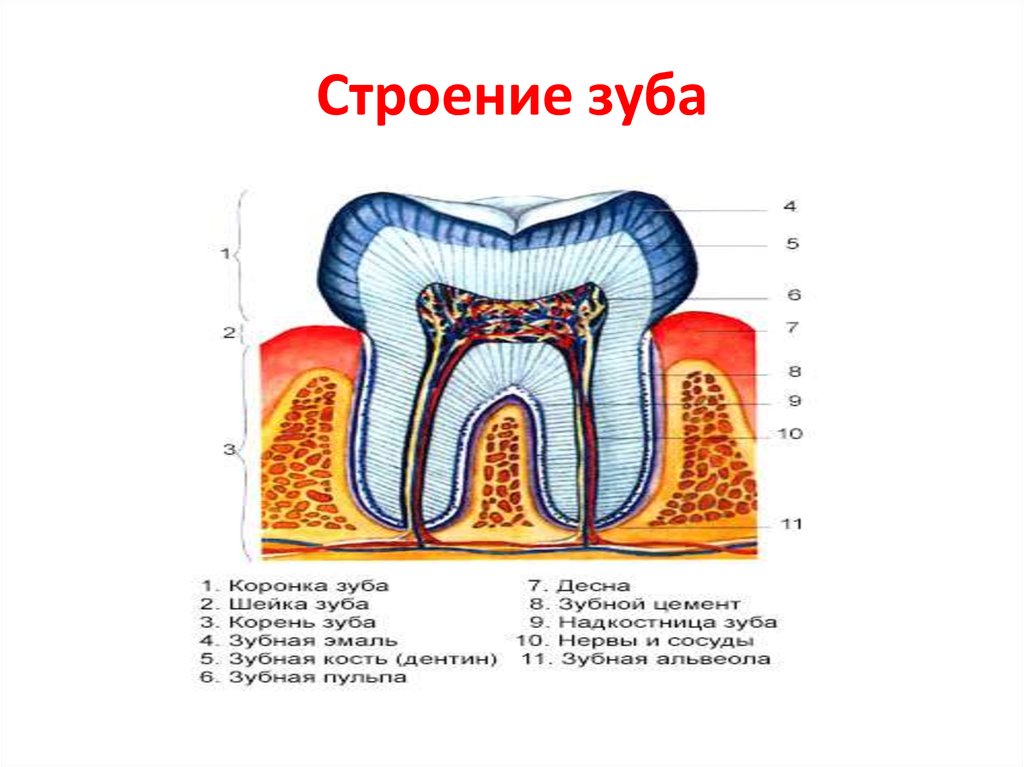 Дж. Биол. Хим. 2004;279: 19141–19148. [PubMed] [Google Scholar]
Дж. Биол. Хим. 2004;279: 19141–19148. [PubMed] [Google Scholar]
99. Ganss B, Kim RH, Sodek J. Bone Sialoprotein. Crit Rev Oral Biol Med. 1999; 10:79–98. [PubMed] [Google Scholar]
100. Chen J, Shapiro HS, Sodek J. Разработка экспрессии мРНК костного сиалопротеина в минерализованных соединительных тканях крыс. Джей Боун Шахтер Рез. 1992; 7: 987–997. [PubMed] [Google Scholar]
101. Zhang J, Tu Q, Chen J. Применение трансгенов в исследованиях костного сиалопротеина. J Cellular Physiol. 2009; 220:30–34. [Бесплатная статья PMC] [PubMed] [Google Scholar]
102. Содек Дж., Гансс Б., Макки М.Д. Остеопонтин. Crit Rev Oral Biol Med. 2000; 11: 279–303. [PubMed] [Google Scholar]
103. Gericke A, Qin C, Spevak L, Fujimoto Y, Butler WT, Sørensen ES, Boskey AL. Важность фосфорилирования для остеопонтиновой регуляции биоминерализации. Кальциф ткани Int. 2005; 77: 45–54. [Бесплатная статья PMC] [PubMed] [Google Scholar]
104. Boskey AL, Chiang P, Fermanis A, Brown J, Taleb H, David V, Rowe PSN.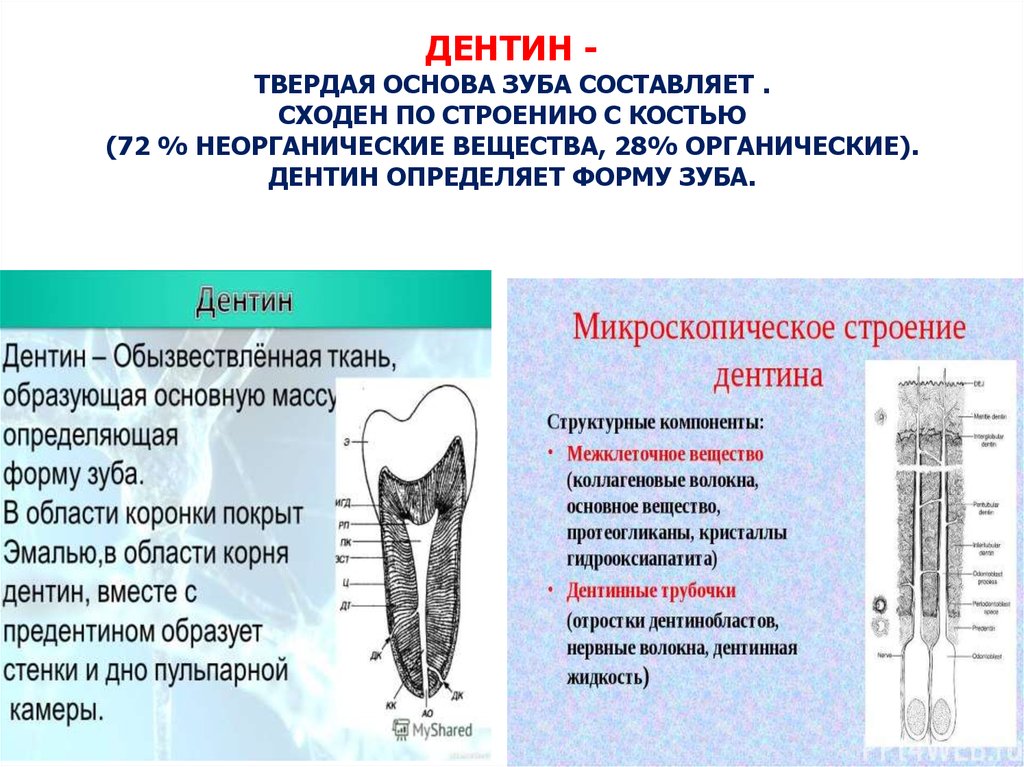 Разнообразное влияние MEPE на минерализацию. Кальциф ткани Int. 2010;86:42–46. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Разнообразное влияние MEPE на минерализацию. Кальциф ткани Int. 2010;86:42–46. [Бесплатная статья PMC] [PubMed] [Google Scholar]
105. Boukpessi T, Septier D, Bagga S, Garabedian M, Goldberg M, Chaussain-Miller C. Изменение дентина молочных зубов при гипофосфатемическом рахите человека. Кальциф ткани Int. 2006; 79: 294–300. [PubMed] [Google Scholar]
106. Gorter de Vries I, Quartier E, Boute P, Wisse E, Coomans D. Иммуноцитохимическая локализация остеокальцина в развивающихся зубах крысы. Джей Дент Рез. 1987; 66: 784–790. [PubMed] [Google Scholar]
107. Бронкерс А.Л., Прайс П.А., Шрайверс А., Бервоетс Т.Дж., Карсенти Г. Изучение функции остеокальцина при формировании дентина в зубах грызунов. Eur J Oral Sci. 1998;106:795–807. [PubMed] [Google Scholar]
108. Onishi T, Ogawa T, Hayashibara T, Hoshino T, Okawa R, Ooshima T. Гиперэкспрессия мРНК остеокальцина в одонтобластах мышей Hyp. Джей Дент Рез. 2005; 84: 84–88. [PubMed] [Google Scholar]
109. Chun YH, Yamakoshi Y, Kim JW, Iwata T, Hu JC, Simmer JP.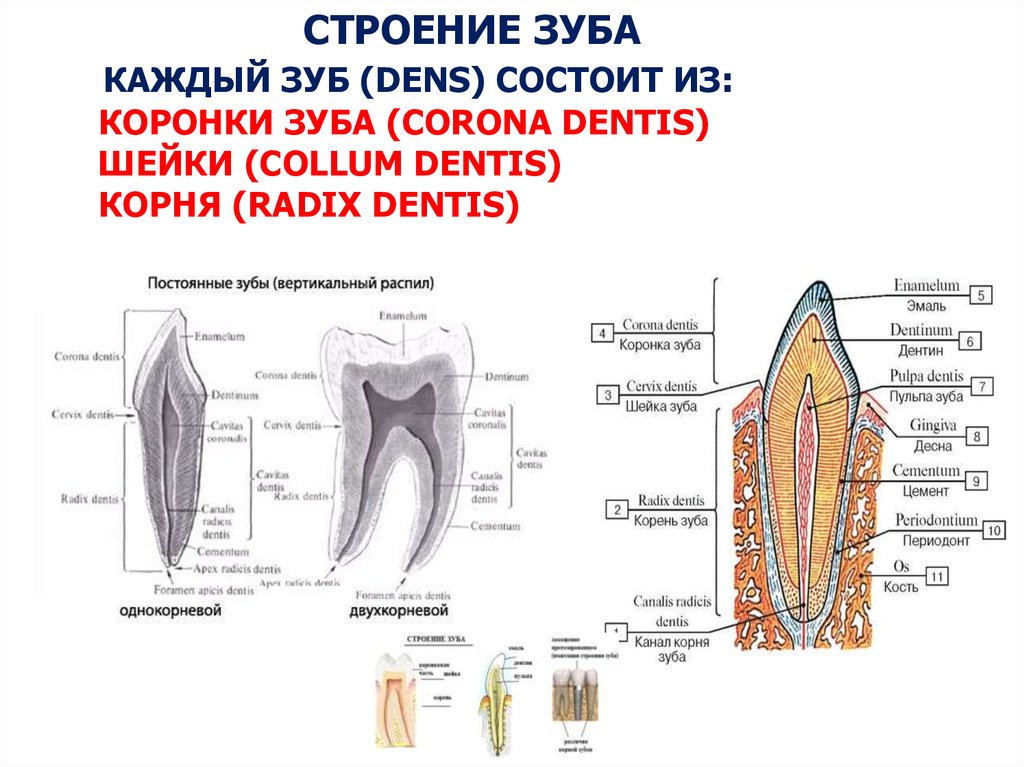 Свиной SPARC: выделение из дентина, последовательность кДНК и компьютерная модель. Eur J Oral Sci. 2006; 114 (Приложение 1): 78–85. [PubMed] [Google Scholar]
Свиной SPARC: выделение из дентина, последовательность кДНК и компьютерная модель. Eur J Oral Sci. 2006; 114 (Приложение 1): 78–85. [PubMed] [Google Scholar]
110. Holland PWH, Harper SJ, McVey JH, Hogan BLM. Экспрессия мРНК Са++-связывающего белка SPARC (остеонектин) in vivo, выявленная с помощью гибридизации in situ. Джей Селл Биол. 1987;105:473–482. [Бесплатная статья PMC] [PubMed] [Google Scholar]
111. Goldberg M, Feinberg J, Lecolle S, Kaetzel MA, Rainteau D, Lessard JL, Dedman JR, Weinman S. Совместное распределение аннексина VI и актина в секреторной системе. амелобласты и одонтобласты резца крысы. Сотовые Ткани Res. 1991; 263:81–89. [PubMed] [Google Scholar]
112. Somogyi E, Petersson U, Sugars RV, Hultenby K, Wendel M. Nucleobindin—Ca-связывающий белок, присутствующий в клетках и минерализованных тканях зуба. Кальциф ткани Int. 2004; 74: 366–376. [PubMed] [Академия Google]
113. Оримо Х. Механизм минерализации и роль щелочной фосфатазы в норме и болезни.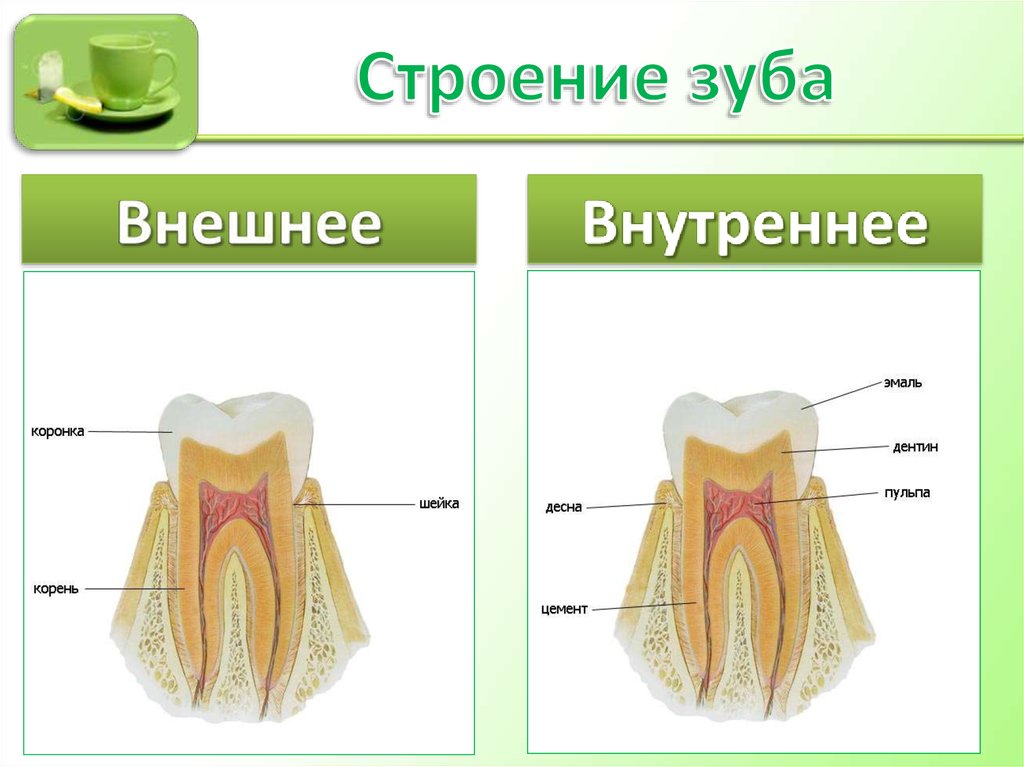 J Nippon Med Sch. 2010;77:4–12. [PubMed] [Google Scholar]
J Nippon Med Sch. 2010;77:4–12. [PubMed] [Google Scholar]
114. Fanchon S, Bourd K, Septier D, Everts V, Beertsen W, Menashi S, Goldberg M. Участие матриксных металлопротеиназ в начале минерализации дентина. Eur J Oral Sci. 2004; 112: 171–176. [PubMed] [Google Scholar]
115. Бурд-Бойттин К., Фридман Р., Фанчон С., Септье Д., Голдберг М., Менаши С. Ингибирование матриксной металлопротеиназы ухудшает процессинг, образование и минерализацию зубных тканей во время развития моляров у мышей. Экспериментальные исследования клеток. 2005;304:493–505. [PubMed] [Google Scholar]
116. Lormée Ph, Lécolle S, Septier D, Le Denmat D, Goldberg M. Автометаллография для гистохимической визуализации полианионов резцов крысы с купролиновым синим. JHistochemCytochem. 1989; 37: 203–208. [PubMed] [Google Scholar]
117. Gafni G, Septier D, Goldberg M. Влияние хондроитинсульфата и бигликана на кристаллизацию гидроксиапатита в физиологических условиях. J Рост кристаллов. 1999; 205: 618–623. [Google Scholar]
[Google Scholar]
118. Харуяма Н., Шринат Т.Л., Судзуки С., Яо Х., Ван З., Ван И., Ханикатт С., Йоццо Р.В., Янг М.Ф., Кулкарни А.Б. Генетические доказательства ключевой роли декорина и бигликана в минерализации дентина. Матрица биол. 2009 г.;28:129–36. [Бесплатная статья PMC] [PubMed] [Google Scholar]
119. Goldberg M, Ono M, Septier D, Bonnefoix M, Kilts TM, Bib Y, Embree M, Ameye L, Young MF. Мыши с дефицитом фибромодулина выявили двойную функцию фибромодулина в регуляции формирования зубной ткани и альвеолярной кости. Клетки Ткани Органы. 2009; 189:198–202. [Бесплатная статья PMC] [PubMed] [Google Scholar]
120. Baker SM, Sugars RV, Wendel M, Smith AJ, Waddington RJ, Cooper PR, Sloan AJ. TGF- b / Взаимодействия с внеклеточным матриксом в дентине Ma Роль trix: в регулировании секвестрации и защите биоактивности. Кальциф ткани Int. 2009 г.;85 :66–74. [PubMed] [Google Scholar]
121. Waddington RJ, Hall RC, Embery G, Lloyd DM. Изменение профилей протеогликанов при переходе предентина в дентин. Матрица биол. 2003; 22: 153–161. [PubMed] [Google Scholar]
Матрица биол. 2003; 22: 153–161. [PubMed] [Google Scholar]
122. Ирвинг Дж.Т. Суданофильные включения в амелобластах, одонтобластах и клетках ротового эпителия. Природа. 1958; 181: 569–570. [PubMed] [Google Scholar]
123. Ирвинг Дж.Т. Гистохимическое окрашивание недавно кальцифицированных тканей. Природа. 1958; 181: 704–705. [PubMed] [Академия Google]
124. Финчем А.Г., Беркланд Г.А., Шапиро И.М. Липофилия матрикса эмали — химическое исследование нейтральных липидов и липофильных белков эмали. Кальциф ткани Res. 1972; 9: 247–259. [PubMed] [Google Scholar]
125. Голдберг М., Септье Д. Фосфолипиды в амелогенезе и дентиногенезе. Crit Rev Oral Biol Med. 2002; 13: 276–290. [PubMed] [Google Scholar]
126. Vermelin L, Septier D, Goldberg M. Йодоплатинатная визуализация фосфолипидов в предентине резца крысы и дентине по сравнению с малахитовым зеленым альдегидом. Гистохимия. 1994;101:63–72. [PubMed] [Google Scholar]
127. Dunglas C, Septier D, Carreau J-P, Goldberg M.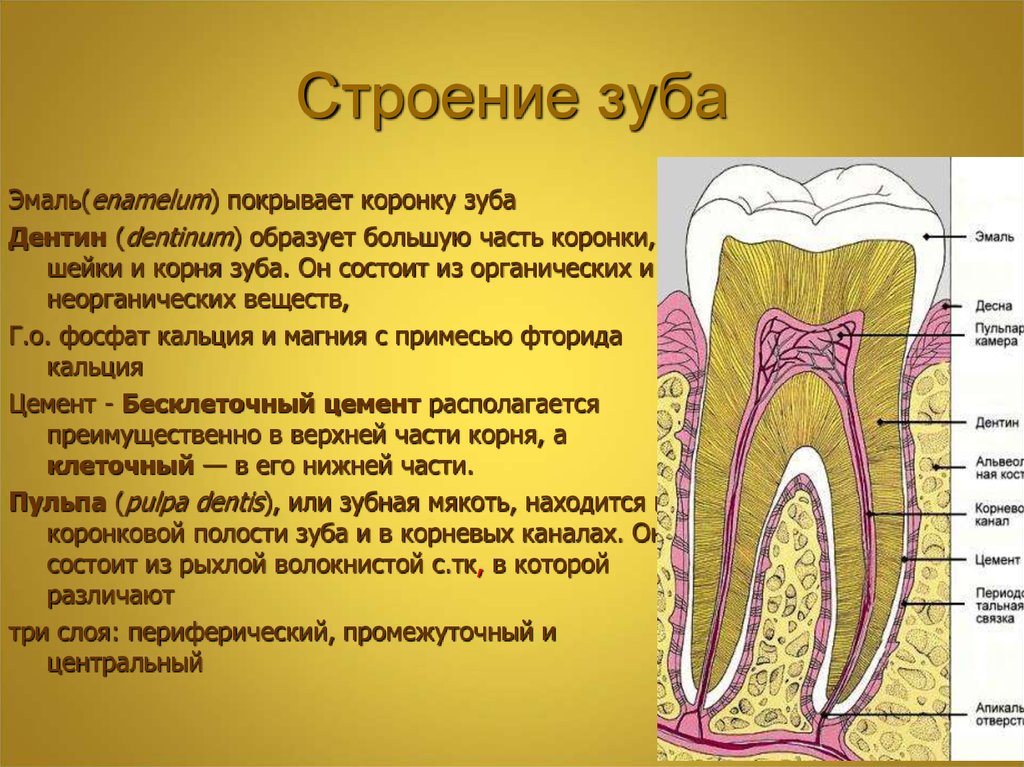 Изменения в составе фосфолипидов в коренном зубе мыши, регулируемые развитием. Histochem J. 1999; 31: 535–540. [PubMed] [Google Scholar]
Изменения в составе фосфолипидов в коренном зубе мыши, регулируемые развитием. Histochem J. 1999; 31: 535–540. [PubMed] [Google Scholar]
128. Aubin I, Adams CP, Opsahl S, Septier D, Bishop CE, Auge N, Salvayre R, Negre-Salvayre A, Goldberg M, Guenet JL, Poirier C. Делеция в ген, кодирующий сфингомиелинфосфодиэстеразу 3 ( Smpd 3 ), приводит к несовершенному остеогенезу и дентиногенезу у мышей. Генетика природы. 2005; 37: 803–805. [PubMed] [Академия Google]
129. Голдберг М., Опсал С., Обен И., Септье Д., Шоссэн-Миллер С., Боски А., Гене Ж.-Л. Открытие: Деградация сфингомиелина является ключевым фактором минерализации дентина и кости: уроки, полученные на мышах туда/сюда . Джей Дент Рез. 2008; 87: 9–13. [Бесплатная статья PMC] [PubMed] [Google Scholar]
130. Choglay AA, Purdom IF, Hulmes DJ. Связывание проколлагена со сфингомиелином. Дж. Биол. Хим. 1993; 268:6107–6114. [PubMed] [Google Scholar]
131. Wu LNY, Genge BR, Kang MW, Arsenault AL, Wuthier RE.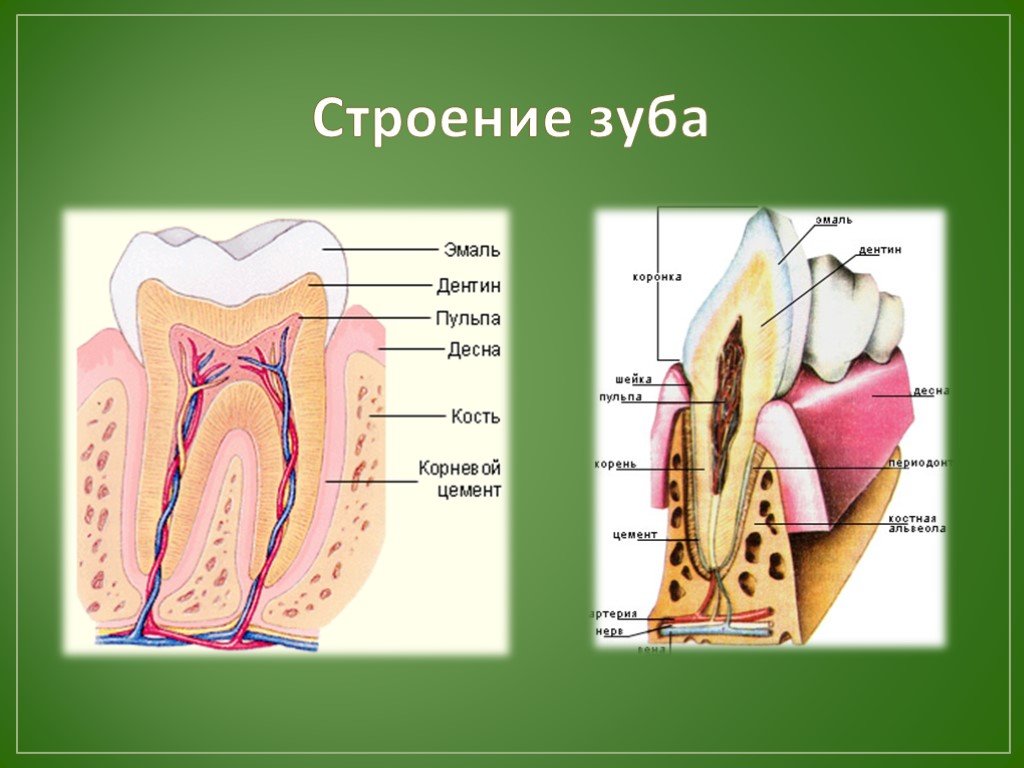

 С двумя премолярами, расположенными за нашими клыками, премоляры помогают подготовить пищу к последней стадии жевания на коренных зубах.
С двумя премолярами, расположенными за нашими клыками, премоляры помогают подготовить пищу к последней стадии жевания на коренных зубах. Зубы: факты →
Зубы: факты →