Периодонтит – лечение, диагностика, причины возникновения
Периодонтит — стоматологическое заболевание, которое представляет собой воспаление периодонта, пространства между костной тканью лунки и непосредственно зубом. Подобная патология способна достаточно быстро привести к утрате элемента зубного ряда и распространения гнойного процесса на окружающие ткани.
Чем опасен периодонтит
Воспаление периодонта — следующий за пульпитом этап распространения инфекции из кариозного зуба.
Очаг его находится на верхушке корня и представляет собой небольшую полость, заполненную гноем.
При отсутствии терапии инфекционно-воспалительный процесс распространяется на периодонт — промежуточные ткани, которые разделяют корни и шейку зуба и костные ткани десны.
Важно! Периодонт окружает всю поддесневую часть зуба и играет роль цемента, фиксирующего зуб в челюсти. При его повреждении вследствие периодонтита вероятность расшатывания и потери зуба возрастает многократно.
Чаще всего периодонтит локализуется у верхушечной части пораженного пульпитом корня. При отсутствии лечения воспаление распространяется дальше, охватывая всю поддесневую часть зуба. В процессе развития заболевания вокруг корней образуется гнойная полость, которая рано или поздно вскрывается на слизистые оболочки полости рта или на кожу лица. При переходе в хроническую форму периодонтит сопровождается постоянным нагноением с оттоком содержимого через свищ — длительно существующие протоки, стенки которых не срастаются.
Причины периодонтита
Этиология периодонтита в большинстве случаев связана с запущенными формами кариеса. При поражении пульпы воспаление переходит на корень зуба и далее по каналу распространяется на периодонт. Помимо этого причинами заболевания могут быть:
- травмы зуба — перелом или трещина корня, ушиб, скол коронки с последующим проникновением инфекции в пульпу;
- нарушение техники обработки корневого канала с травмированием тканей острыми инструментами;
- нарушение техники пломбирования канала корня с выходом пломбировочного материала за верхушку корня;
Стоматологу важно выяснить причину воспаления периодонта, чтобы подобрать оптимальные схемы лечения зуба и предупреждения рецидива.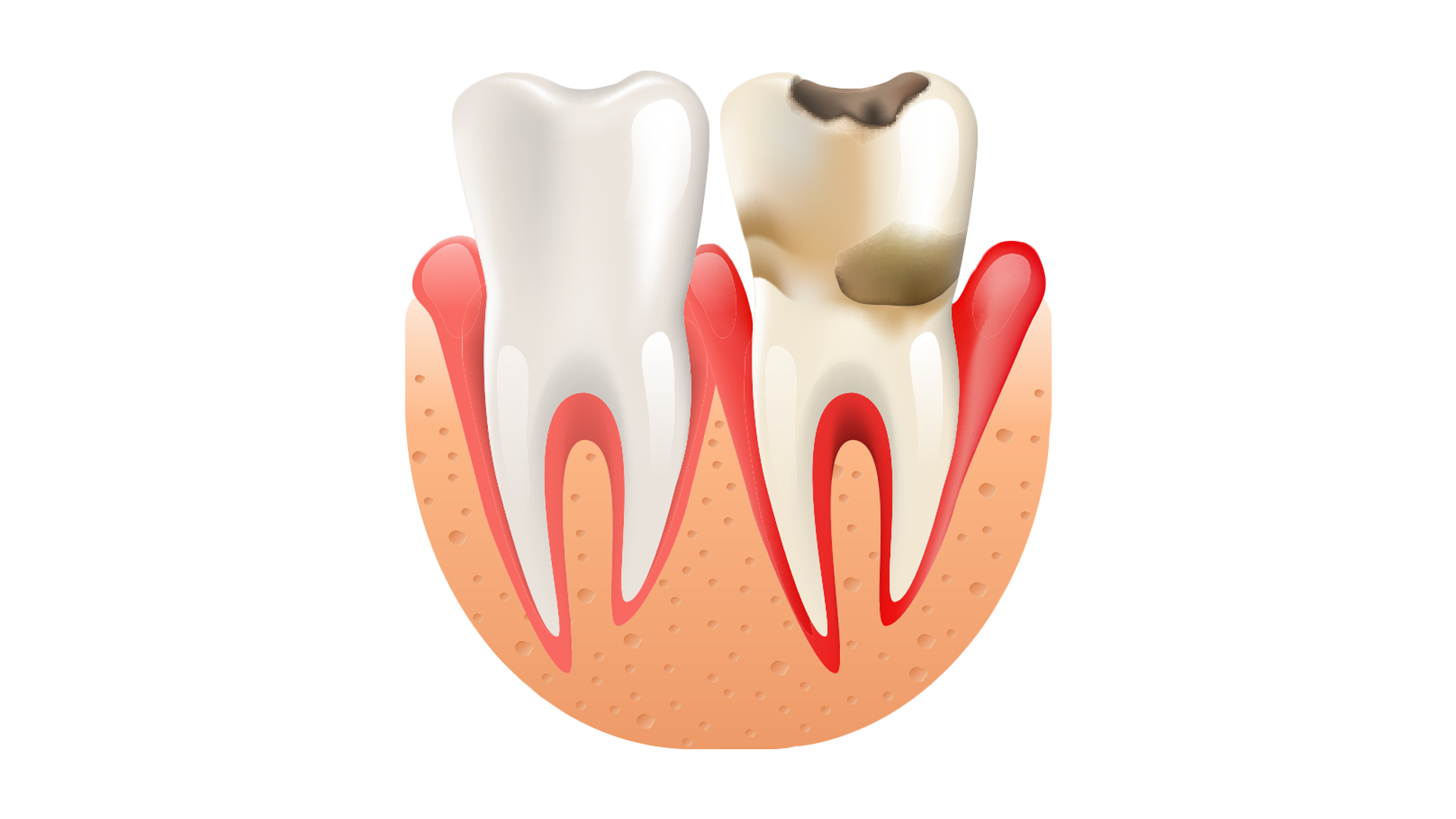
Признаки
Клинические проявления воспаления периодонта зависят от формы заболевания.
При остром течении симптоматика ярко выражена, нередко сопровождается формированием болезненного абсцесса на десне, флюса (глубоко расположенного абсцесса с интенсивным отеком мягких тканей десны и лица), повышением температуры тела и т. д. Острое воспаление может протекать в двух формах:
- Серозный периодонтит протекает без образования гнойной полости. Сопровождается постоянными ноющими болями, которые не усиливаются при прикосновении к зубу или надкусывании пищи.
- Гнойный периодонтит сопровождается образованием абсцесса. Сопровождается острыми, распирающими или пульсирующими болевыми ощущениями, интенсивность которых может меняться. На десне возле больного зуба заметен флюс, опухают мягкие ткани лица на пораженной стороне. Подвижность зуба увеличена, боль усиливается при надкусывании и прикосновении к зубу.
При хронической форме периодонтит протекает не так ярко, как острый. Существует три формы заболевания:
Существует три формы заболевания:
- Фиброзный, симптомами которого становятся вялотекущее воспаление без формирования абсцесса и свищей. Боли при такой форме возникают редко. Внешний признак — изменение цвета эмали на серый, изменение ее прозрачности. Признаки воспаления видны только на рентгене.
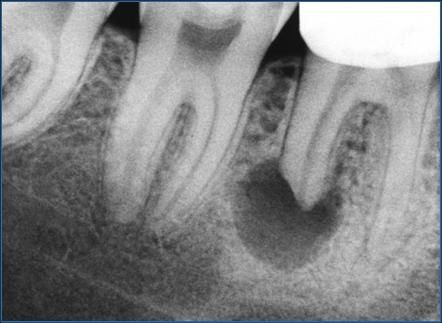
- Гранулематозный , симптомами которого становится периодическое формирование абсцесса. По мере его «созревания» на десне открывается проток, из которого изливается гнойное содержимое. Такие протоки могут образовывать постоянные незаживающие свищи. На рентгеновских снимках такая форма периодонтита выглядит как очаг диаметром до 5 мм на верхушке корня.
- Гранулирующий, симптомами которого являются хроническая зубная боль, усиливающаяся при надкусывании твердой, горячей или холодной пищи больным зубом. Десны возле зуба постоянно отечные, гиперемированы. Отверстие свища может открываться как на слизистую полости рта, так и на коже лица.

Симптомы любой формы периодонтита склонны ослабевать при очищении гнойной полости от содержимого.
Важно знать! Основным отличием периодонтита от пульпита является характер боли. При пульпите она острая, мучительная, напоминающая разряды тока, усиливающаяся при контакте больного зуба с твердыми частицами пищи, горячим или холодным воздухом.
Диагностика
Для постановки диагноза периодонтит опытному стоматологу достаточно провести осмотр ротовой полости пациента. Наличие свищевых отверстий, воспаления десны вокруг зуба и наличие типичной для периодонтита симптоматики поможет распознать болезнь. Для дифференцирования патологии с пульпитом и пародонтозом используют:
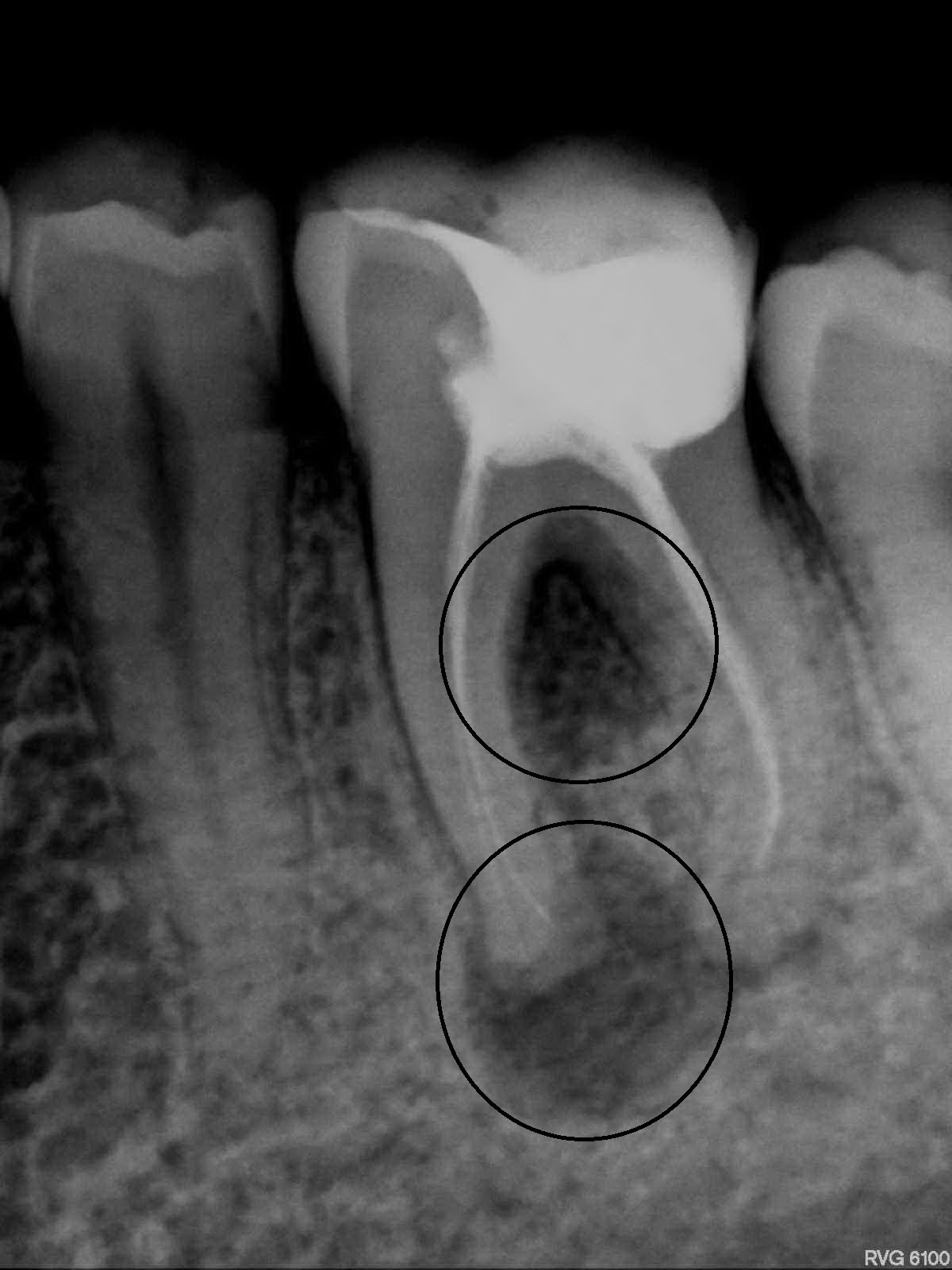
- рентгенографию зуба — на снимках будет видно разрежение пародонта, наличие гнойного очага, гранулемы или кистозного новообразования у верхушки корня;
- КТ — более информативный метод лучевой диагностики, позволяющий получить трехмерное детализированное изображение зуба и окружающих его тканей, на котором будут видны границы воспаления периодонта, а также определятся его источники.
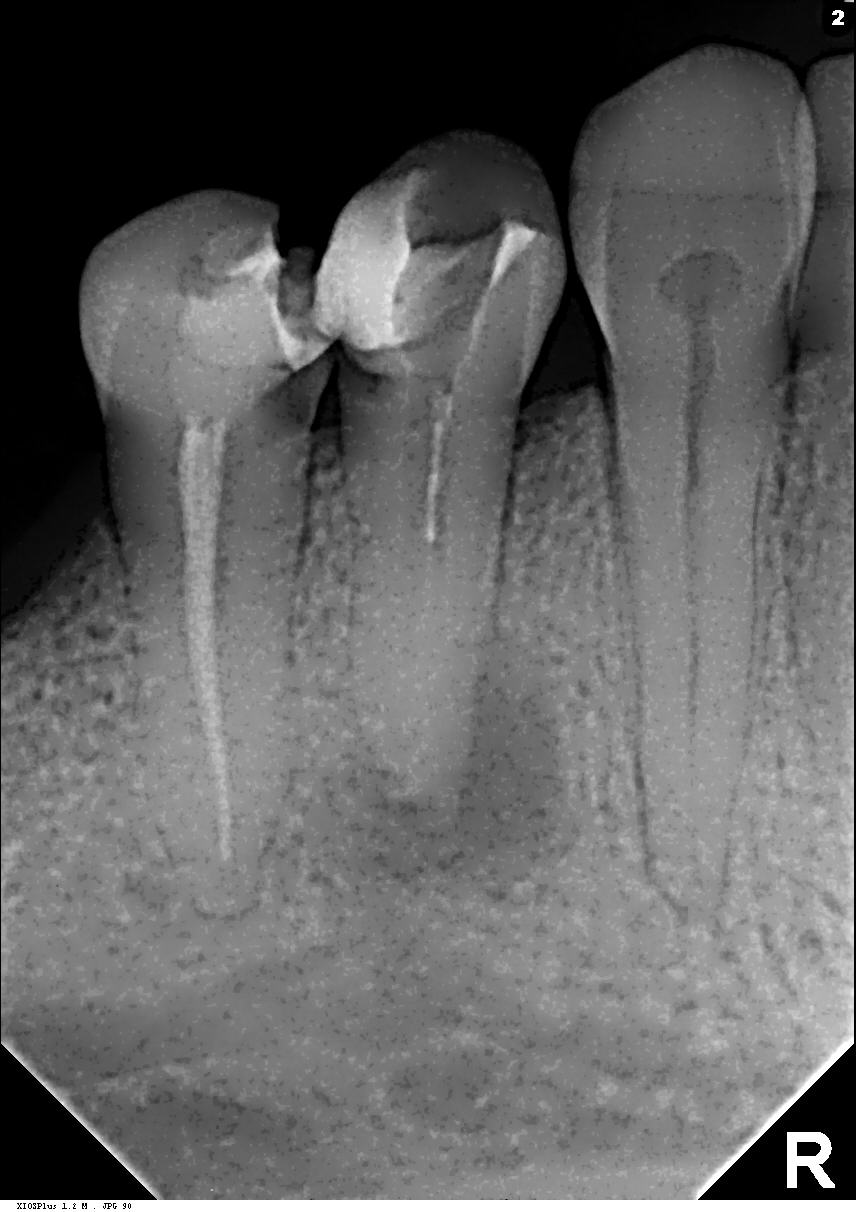
Способы и этапы лечения
Лечение периодонтита разделено на несколько этапов. Первым и самым важным является депульпирование зуба — удаление некротических тканей из корневого канала, его механическая обработка и расширение, обработка антисептическими и противовоспалительными препаратами.
Важно! Если зуб, пораженный периодонтитом, был ранее запломбирован, врачу предстоит удалить из канала пломбировочные материалы и вновь провести его обработку и подготовку.
В дальнейшем проводится консервативное или хирургическое лечение периодонтита.
Консервативная терапия
Для консервативного устранения периодонтита используются местные средства, которые врач помещает в подготовленный корневой канал. Чаще всего это пасты длительного действия с антисептическим и противовоспалительным эффектом «Калосепт» или «Метапекс». Их оставляют в канале на 2-3 недели, а при обширном поражении зуба периодически обновляют в течение 2-3 месяцев.
Важно! В процессе лечения выполняют снимки, на которых будет видна динамика. Если воспаление купировано, можно завершить лечение пломбированием.
Хирургическое лечение
К хирургическим методам лечения периодонтита прибегают при отсутствии положительной динамики, крупном очаге воспаления у верхушки корня зуба (больше 10 мм в диаметре), при невозможности провести депульпирование и очистку корневых каналов (ранее установленные в них гуттаперчи, культевые вкладки и т. д.).
Применяется несколько методов хирургического лечения периодонтита:
- резекция верхушки корня зуба — отсечение трети корня с гранулемой через разрез на десне;
- гемисекция —удаление всего корня с окружающими корень тканями;
- ампутация корня — удаление корня с сохранением коронки;
- сепарация — удаление корня вместе с частью коронки;
- реплантация — удаление зуба и его последующее лечение вне ротовой полости, и последующее приживление его на прежнее место.
Перечисленные методики позволяют сохранить зуб на определенный промежуток времени. Если они невозможны из-за разрушения большей части коронки, перфорации корней, стремительного распространения инфекции и некроза костной ткани, проводят радикальное удаление зуба с последующей обработкой лунки антисептиками, выскабливанием гранулемы и заполнением полости средствами, стимулирующими образование костной ткани.
Другие материалы по теме:
Лечение зубной боли
Автор: Наталия Айбасова
Врач стоматолог терапевт – хирург
В 2010 г. окончила Ставропольскую Государственную Медицинскую Академию.
В 2013 г. окончила ординатуру на кафедре ортопедической стоматологии СГМА.
Лечение каналов зубов (пульпита и периодонтита) в Петроградском районе / Клиника ЭКСПЕРТ
Сложность лечения каналов зуба зависит от степени воспаления (пульпит или периодонтит) и от количества каналов.
Если зуб болит — не откладывайте визит к стоматологу, чтобы избежать осложенения заболевания.
Пульпит
В каждом зубе есть пульпа — сплетение сосудов и нервных волокон. Среди пациентов пульпа зуба больше известна как «нерв». Она располагается в полой камере внутри самого зуба, а также в каналах его корней. Пульпа зуба надежно защищена от механических и температурных раздражителей толстым (до 3-х мм) слоем твердых тканей зуба — дентина и эмали. Но чем глубже кариес пробирается внутрь зуба, тем меньше становится защитный слой, и зуб начинает все чаще реагировать сначала на сладкое (когда кариозная полость прошла первый защитный барьер — эмаль), затем на холодное — когда поврежден дентин и кариес оказывается в опасной близости от нервов и сосудов. Иногда болевые ощущения возникают не сразу. Особенно, если кариозная полость развивается под старой пломбой или на труднодоступной боковой поверхности — между зубами. Порой боли может не быть даже тогда, когда кариозный процесс уничтожил все преграды и проник в пульпарную камеру. Но бактерии, которые этот процесс вызвали, немедленно попадают внутрь и вызывают хроническое или острое воспаление «нерва» — пульпит.
Но бактерии, которые этот процесс вызвали, немедленно попадают внутрь и вызывают хроническое или острое воспаление «нерва» — пульпит.
Симптомы пульпита
При хроническом процессе болей может практически не быть (в тех же случаях, что и при бессимптомном течении кариеса). Либо может быть сильная продолжительная реакция на холод или попадание пищи в кариозную полость, проходящая в течение нескольких минут.
При остром течение процесса боль появляется сразу. Она чаще нарастает ночью, становясь практически невыносимой, и ослабевает к утру. Ее интенсивность объясняется малыми объемами замкнутого пространства пульповой камеры, в котором происходит скопление большого количества жидкости, выделяющейся при воспалении.
Примерно в течение пяти дней интенсивные боли в пораженном зубе свидетельствуют о борьбе, происходящей между тканями пульпы и проникшими в них бактериями, но, к сожалению, бактерии всегда побеждают. Ткани пульпы отмирают, и бактерии быстро распространяются по всему объему внутренней камеры зуба и каналов. Однако, это еще не конец.
Однако, это еще не конец.
Что происходит дальше?
Периодонтит
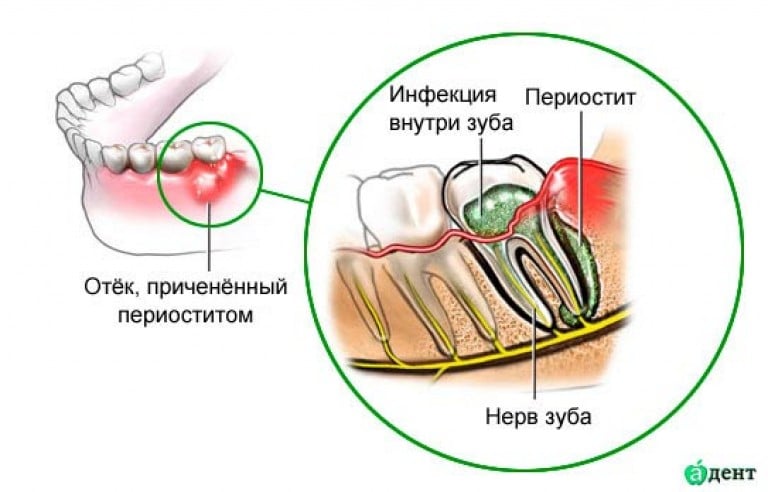
На кончике каждого корня есть отверстие, через которое выходят сосуды и нервы пульпы. Через него же выходят и бактерии, после того как нерв погибает, и в результате в костной ткани челюсти вокруг кончика корня начинается воспаление — периодонтит. Как и в истории с пульпитом, оно может быть острым и хроническим.
Симптомы периодонтита
В случае хронического развития очаг воспаления может не причинять почти никакого беспокойства, немного ныть при простуде или переохлаждении, давать ощущение непонятного дискомфорта. При этом размеры очага постепенно увеличиваются и со временем (от полугода) он превращается в кисту — полость внутри кости с плотными стенками и гнойным содержимым, или образует так называемый «свищ» — ход внутри кости от места воспаления наружу, до десны или даже кожи, где формируется отверстие («прыщик») с гнойным отделяемым. Кроме того, в любой момент хроническая форма может перейти в острую.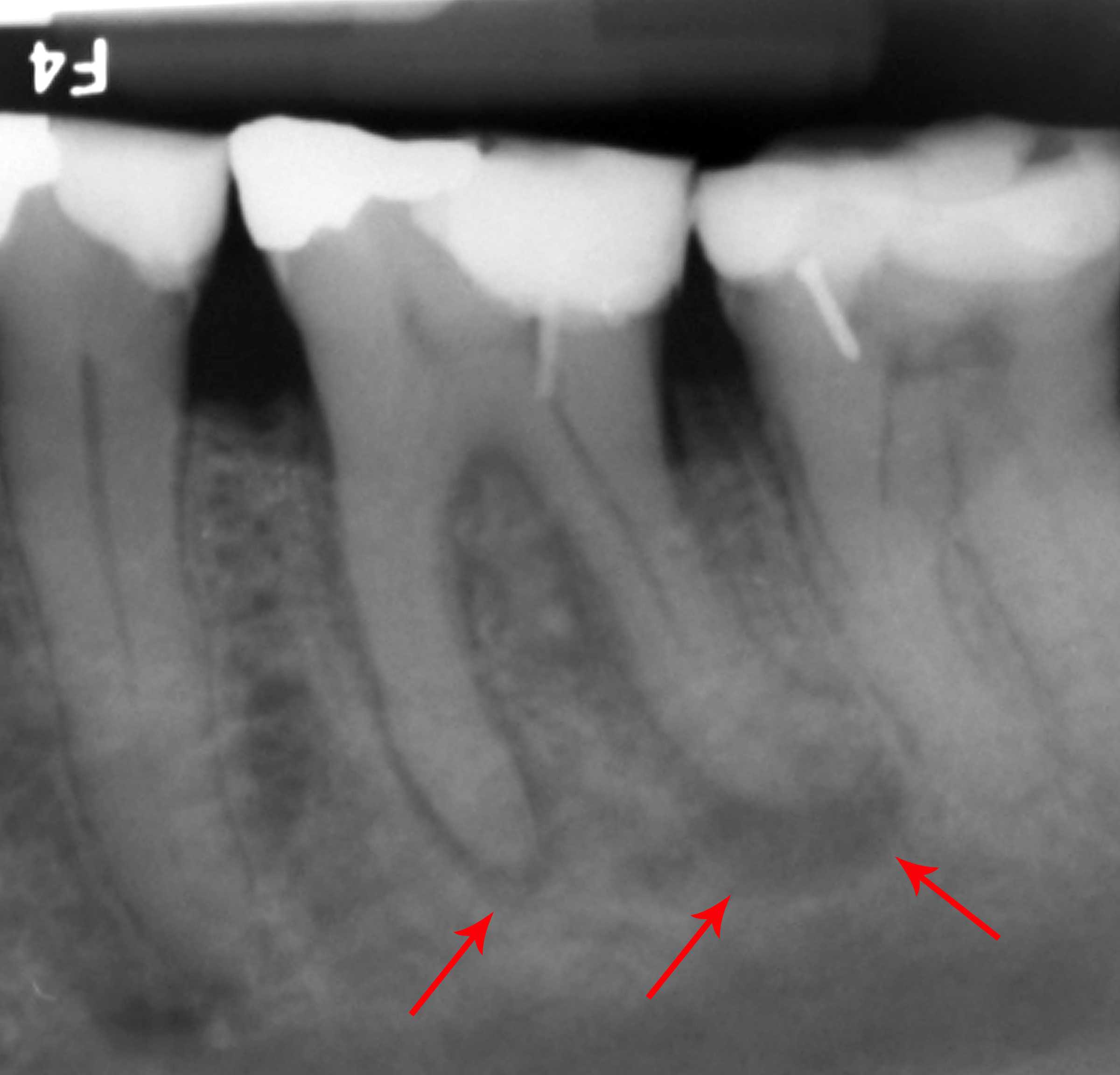
Лечение пульпита и периодонтита
При остром течении процесса опять возникает боль. При периодонтите очень болезненным становится надавливание, а иногда даже простое дотрагивание до зуба. Кажется, что зуб вырос и не дает сомкнуть зубы. Жевать на стороне пораженного зуба невозможно. Через 2-3 дня, а иногда и быстрее, развивается отек мягких тканей вокруг больного зуба, опухает губа или щека. Тогда боли становятся меньше, так как инфекционный процесс вышел из плотной кости в окружающую мягкую клетчатку. Но это опасное затишье, так как следующий шаг развития заболевания — флегмона (гнойник) мягких тканей — приводит пациента на больничную койку в отделение челюстно-лицевой хирургии. И больной зуб уже будет не спасти.
Единственное, что Вы можете сделать сами, это приложить все усилия для предотвращения развития описанных выше печальных событий. Для этого нужно следовать простым правилам: тщательно соблюдать личную гигиену полости рта и раз в полгода проверять свои зубки у стоматолога. Только так, останавливая развитие кариеса в зародыше, или вовсе не давая ему появиться благодаря личной и профессиональной гигиене полости рта, можно не допустить пульпита и периодонтита.
Только так, останавливая развитие кариеса в зародыше, или вовсе не давая ему появиться благодаря личной и профессиональной гигиене полости рта, можно не допустить пульпита и периодонтита.
Но, если все же одно из таких заболеваний у Вас обнаружилось, мы, врачи-терапевты-стоматологи Клиники ЭКСПЕРТ, гарантируем использование самых лучших, совершенных, современных и, в то же время, проверенных технологий, инструментов и материалов для лечения Ваших зубов. Лечение пульпита и лечение периодонтита откладывать нельзя, иначе это приведет к потере зуба.
Итоговая стоимость лечения пульпита и периодонтита точно определяется на консультации врача стоматолога, так как объем работ зависит от каждого конкретного случая.
Периодонтит: откуда берется и как вылечить
Коварный периодонтит: знают об этой болезни в основном лишь те, кому довелось «лицом к лицу» столкнуться с недугом. Раньше, чтобы избавиться от боли, нужно было удалять зуб. Современные методы позволяют в большинстве случаев вылечить периодонтит и сохранить зуб. Хотите узнать, что такое периодонтит, какие формы он принимает и как лечат заболевание в наши дни – прочитайте эту статью.
Хотите узнать, что такое периодонтит, какие формы он принимает и как лечат заболевание в наши дни – прочитайте эту статью.
Воспаление периодонта – что это за болезнь
Периодонтитом стоматологи называют воспалительный процесс, который разрушает костную ткань возле корня зуба (периодонта). В результате на верхушке корня образуется абсцесс или киста. Признаки периодонтита могут быть различными, зависят от вида и стадии болезни.
Проявления острой формы:
- тянущая боль в конкретном зубе;
- пульсирующие болевые ощущения, когда болезнь переходит в гнойное воспаление;
- на проблемный зуб невозможно жевать;
- подвижность пораженного зуба;
- общее ухудшение самочувствия, нарушение сна;
- повышение температуры.
Хронический периодонтит – симптомы:
- болезненность при накусывании и постукивании причинного зуба;
- терпимые, слабые болевые ощущения;
- на внешней поверхности челюсти образуется свищ с незначительными гнойными выделениями.

Коварство хронической разновидности периодонтита в том, что болезнь часто протекает бессимптомно, и пациент обращается в клинику слишком поздно, когда спасти поврежденный зуб уже нельзя. Выявить появление абсцесса можно с помощью рентгеновского снимка.
Что приводит к возникновению периодонтита
Причины периодонтита можно разделить на две основных категории:
- Инфекционные. Патогенные микроорганизмы проникают в ткани периодонта через корневой канал. Например, запущенный пульпит, некачественное пломбирование канала, инфицирование зуба под коронкой.
- Травматические. Заболевание развивается в результате падения или удара в челюсть. Причиной может стать хроническая травма (выступающая пломба или перекусывание проволоки зубами). Сопровождается острыми симптомами.
- Медикаментозные. Самая распространенная причина – некачественное лечение зубного нерва, когда сильнодействующие лекарства (мышьяк, фенол) проникают в периодонт. Другая причина – аллергия на медицинские препараты, проявляется в иммунологической реакции.

Классификация периодонтитов и методы лечения
В стоматологии периодонтиты подразделяют на несколько видов:
1. Острая форма. Процесс длится от 2 дней до 2-3 недель. Симптомы – ярко-выраженные, о них мы уже писали выше. Острая фаза болезни бывает двух типов:
- серозное воспаление – увеличивается отек периодонта, капилляры расширяются, скапливаются клетки крови. Это провоцирует усиление боли;
- гнойное воспаление – несколько мелких очагов воспаления сливаются в один. От расширения тканей появляется подвижность зуба, а боль становится невыносимой. Как только гной прорывается наружу, наступает быстрое облегчение.
2. Хронический периодонтит протекает замедленно и не так заметно. Основные формы:
- фиброзная. Ткани периодонта уплотняются и рубцуются. Обострения случаются редко. Самое благоприятное течение болезни, которое можно определить только с помощью рентгенограммы;
- гранулирующая форма.
 Разрушение костной ткани происходит стремительно и беспорядочно. Сопровождается разрастанием периодонта;
Разрушение костной ткани происходит стремительно и беспорядочно. Сопровождается разрастанием периодонта; - гранулематозная форма. Организм пытается защититься от инфекции, образуя вокруг очага поражения плотную капсулу – гранулему. Внутри полости ткани постепенно разрушаются;
3. Обострение хронического периодонтита. В этой стадии наблюдаются симптомы острой формы, которые исчезают с появлением свища. Болезнь возвращается в хроническую форму.
Осложнения периодонтита проявляются в появлении абсцессов, флегмон, гайморита, челюстного остеомиелита и прочих серьезных заболеваний.
Лечение периодонтита проходит по принципу: «чем раньше – тем лучше». Воспаление, обнаруженное на ранних стадиях, позволяет избавиться от болезни без хирургического вмешательства.
Как лечат периодонтит профессиональными методами:
- Стоматолог открывает доступ к корневым каналам.
- Тщательно вычищает все гнойные образования и стенки каналов, обеспечивает экссудату возможность оттока;
- Проводит лечение каналов, дентинных канальцев и периодонта.

- Пломбирует каналы и коронковую часть зуба.
Когда гранулема разрастается до больших размеров, приходится прибегать к хирургическому способу лечения зубов – резекции верхушки корня.
Квалифицированная стоматологическая помощь – единственный шанс вылечить периодонтит и сохранить зуб. Появились тревожные симптомы, не ждите, пока «само пройдет» – срочно к врачу!
Лечение острых одонтогенных инфекций в ЛОР-стоматологии
Инфекции, развивающиеся от зубов, носят название «одонтогенные». Хронические инфекции, годами медленно протекающие в каналах зубов, скрыто провоцируют воспаление на кости, окружающей корни с инфекцией.
Иногда, пациент, от страха неизвестности, не соглашается на удаление скомпрометированного зуба, вызвавшего образование кисты на корне. Веря в чудеса, ищет врача, готового взяться за безнадежную ситуацию, находит, уговаривает, подписывает договора об отказе от гарантии, тратит деньги на безнадежное лечение, терпит боль.
Через какое-то время, могут появиться симптомы гайморита, пациент обращается в отоларингологию, где узнает, что киста на корне, которую лечили ранее, теперь проросла в нос.
Этот вечный процесс лечения кист с отказом от гарантий, стоматологические манипуляции с инфицированными зубами, находящимися в непосредственной близости с синусами, к сожалению, создают стабильный поток пациентов с осложнениями.
Все воспалительные процессы, с которыми работает наше отделение ЛОР стоматологии, классифицируются по локализации, степени и глубине инфицирования кости:
- Гайморит — воспаление слизистых оболочек синусов с активным гнойным процессом и выходом гнойного содержимого во все свободные пространства и полости. Встречаются страйки с полипами и мукоцеле (это происходит в носу).
- Периостит — воспаление надкостницы вокруг корней зубов, окружающей верхнечелюстные кости снаружи. Может быть, как самостоятельно возникший процесс, например, от воспаления на корне или вторично, как следствие длительно текущего скрытого гнойного гайморита (это происходит во рту).
- Остеомиелит — разрушение костных тканей, начинается с воспаления альвеолярного отростка, затем вовлекаются перегородки гайморовой пазухи и кости всей верхней челюсти. Следствие периостита, которое в скрытом формате постепенно растворяет кость до состояния ваты (а это уже происходит и во рту и в носу).
- Здоровые гайморовы пазухи
- Гайморит левой верхнечелюстной пазухи
Почему стоит доверить лечение отделению ЛОР-стоматологии
ЛОР-стоматология объединяет два направления медицинских услуг и вариантов лечения — отоларингологию и стоматологию. Это современный формат работы клиники по комплексной реабилитации при лечении травматических и воспалительных процессов на верхней челюсти, проникающих в гайморову пазуху или проходящих по ее границам.
Центр Приватной Стоматологии «Доктор Левин» много лет специализируется на оказании помощи пациентам с комбинированной ЛОР и стоматологической патологией. Лечебные и хирургические программы лечения проводят кандидаты медицинских наук, челюстно-лицевые хирурги с ЛОР-подготовкой.
Лечебные и хирургические программы лечения проводят кандидаты медицинских наук, челюстно-лицевые хирурги с ЛОР-подготовкой.
Особенности работы ЛОР-отделения «Доктор Левин»
ЛОР-установка Chammed XU-7 visual
Современное оборудование рабочего места ЛОР-хирурга
Ультразвуковая хирургия без крови
Аппарат PiezoSurgery воздействует только на твердые ткани, не повреждает десну, нервы, сосуды и мембраны. Долото, фрезы и буры в работе Отделения не используем!
3D-томограф Sirona Galileos
Точная диагностика одонтогенных заболеваний и новообразований верхнечелюстных пазух
Лечение во сне под седацией
Операции проводим только в медикаментозном сне, под седацией, без болевых и нервных перегрузок
Дентальный микроскоп
SEILER Evolution XR6
Каждая ЛОР-операция проводится с полноценным оптическим контролем операционного поля челюстно-лицевым хирургом
Реабилитация без стационара
всего за 1-2 дня
Результативные методы снятия отечности, гематомы и болезненных ощущений после операции
Как мы лечим
Лечение проводится только комплексное и стремится к проведению в одно посещение, одномоментно:
- Гигиеническая чистка и стоматологическое лечение.
 Готовим полость рта к стерильной хирургической работе. Перелечиваем скомпрометированные корни. Операции проводятся только в санированной полости рта во избежание повторного инфицирования.
Готовим полость рта к стерильной хирургической работе. Перелечиваем скомпрометированные корни. Операции проводятся только в санированной полости рта во избежание повторного инфицирования. - Операция. Проводится в хирургическом отделении при соблюдении всех условий стерильных оперблоков. Ультразвуком убираются воспалительные процессы, удаляются корни, спровоцировавшие, либо поддерживающие воспаление, устраняются все воспалительные элементы, удаляются кисты, полипы, мукоцеле, инородные тела.
- Ортопедия. Фиксируются временные коронки или любые другие ортопедические элементы, маскирующие проведенные работы. Делаем все, чтобы не отправить пациента домой без зубов!
Мы не приветствуем радикальную и карательную хирургию! Будьте уверены в том, что после операции мы никогда не задержим Вас в стационаре без крайней необходимости.
Ультразвуковой протокол
PiezoSurgery не воздействует на мягкие ткани
Реабилитация всего за 1-2 дня
С помощью микротоковой и PRP плазмотерапии
Дентальная микроскопия
Оптический контроль операционной зоны
Седация вместо общего наркоза
Легкий и быстрый выход из искусственного сна
Госпитализация
Дневной стационар в нашем Центре — это послеоперационный поддерживающий сервис пациентов. Необходим при наличии у пациента сопутствующих кардиологических вопросов, например гипертоническая болезнь, аритмия, АОШ и т.д.
Необходим при наличии у пациента сопутствующих кардиологических вопросов, например гипертоническая болезнь, аритмия, АОШ и т.д.
Щадящие ультразвуковые хирургические протоколы проведения низкотраматичных операций PiezoSurgery в сочетании с микроскопной хирургией, проводимой операционными бригадами из пар опытнейших врачей-хирургов нашего Центра, позволяют проводить лечение так деликатно, что Вам не потребуется обязательная в госпитализация, которую так любят навязывать в больницах Москвы.
Все операции проводятся только в медикаментозном сне, без болевых и нервных перегрузок.
Лечение будет проведено с уважением к Вашему личному времени, в сжатые сроки и в комфортное время, операционные бригады и анестезиологическое отделение работают без выходных и праздников.
Варианты проведения ЛОР-операций
| Интраназальный протокол |
Микрохирургический протокол | Микрогайморотомия | Радикальная гайморотомия |
|---|---|---|---|
|
Доступ Через носовой проход с расширением естественного соустья, используется эндоскоп |
Доступ Альвеолярный («ЧЛХ-доступ»), т. |
Доступ «ЛОР-доступ», через отверстие 3-4 мм в передней стенке гайморовой пазухи в полости рта |
Доступ Латеральный, в передней стенке под верхней губой в области 6 зуба создается окно диаметром 10-15 мм |
|
Показания Простые случаи: нет новообразований, позволяет локализация инородного тела, нет противопоказаний |
Показания Случаи средней сложности: если зуб не спасти, есть новообразования, сложная локализация |
Показания Сложные случаи: удаление множественных или крупных новообразований, сложная локализация инородных тел |
Показания Запущенные случаи: множественные новообразования, сложная локализация инородных тел |
|
Травматичность незначительная |
Травматичность низкая |
Травматичность низкая |
Травматичность высокая |
|
Длительность операции 60 минут |
Длительность операции до 1,5 часов |
Длительность операции от 1 до 3 часов |
Длительность операции от 2 до 4 часов |
|
Стоимость низкая |
Стоимость средняя |
Стоимость средняя |
Стоимость высокая |
Этапы лечения
-
Диагностика
Рентгенологическое 3D-обследование на компьютерном томографе в специальном ЛОР-режиме для определения масштабов воспаления, локализации инородных тел, характера новообразований.
-
Планирование
ЧЛХ-хирург совместно с ЛОР-врачом оценивают ситуацию, ставят диагноз. Определяют масштаб, выбирают тактику лечения и способ проведения операции
-
Анализы
Назначаются индивидуально в зависимости от клинической ситуации — для определения стадии воспалительного процесса, характера новообразования. Для возрастных пациентов и пациентов с хроническими заболеваниями необходимо обследование перед проведением седации (в остальных случаях не требуется)
-
Операция
Проводится под седацией в медикаментозном сне без применения общего наркоза по выбранному протоколу доступа к пазухе
-
Послеоперационный контроль
После хирургического вмешательства обязательно рентгенологическое обследование для оценки качества операции
-
Реабилитация
Длится 1-2 дня. Для ускоренного рассасывания отеков, гематом применяется микротоковая и плазмотерапия.
 Назначается прием лекарств, в т.ч. антибиотиков. Во избежание приобретения пациентом «на стороне» контрафактной продукции, весь пакет препаратов пациент получает в клинике бесплатно
Назначается прием лекарств, в т.ч. антибиотиков. Во избежание приобретения пациентом «на стороне» контрафактной продукции, весь пакет препаратов пациент получает в клинике бесплатно -
Завершение ЛОР-лечения
Через 10-14 дней снимаются швы, проводится контрольный КТ-снимок, назначается дата профосмотра
Врачи
Цены
Консультация челюстно-лицевого хирурга
Визуальный осмотр, анализ рентген-снимков, постановка диагноза, составление плана лечения
Компьютерная томография в ЛОР-режиме
Определяет локализацию инородных тел, объемы новообразований, степень повреждения костных структур в области повреждения верхнечелюстного синуса
Закрытие перфорации с латеральным доступом
Операция реконструкции нижней границы верхнечелюстного синуса с ревизией гайморовой пазухи при закрытии перфорации с ультразвуковым ЛОР-доступом
Закрытие перфорации с альвеолярным доступом
Операция реконструкции нижней границы верхнечелюстного синуса с ревизией гайморовой пазухи при закрытии перфорации с альвеолярным ЧЛХ-доступом
Эндоскопическая гайморотомия
Операция удаления инородного тела с ревизией гайморовой пазухи с интраназальным доступом с применением эндоскопа
Микрогайморотомия с ЛОР-доступом 1-ой категории сложности
Операция удаления инородного тела с ревизией гайморовой пазухи с ультразвуковым ЛОР-доступом PiezoSurgery 1-ой категории сложности
Микрогайморотомия с ЛОР-доступом 2-ой категории сложности
Операция удаления инородного тела с ревизией гайморовой пазухи с ультразвуковым ЛОР-доступом 2-ой категории сложности
Микрохирургическая гайморотомия 1-ой категории сложности
Операция удаления инородного тела с ревизией гайморовой пазухи с альвеолярным ЧЛХ-доступом 1-ой категории сложности
Микрохирургическая гайморотомия 2-ой категории сложности
Операция удаления инородного тела с ревизией гайморовой пазухи с альвеолярным ЧЛХ-доступом 2-ой категории сложности
Удаление новообразований 1-ой категории сложности, ЛОР-доступ
Операция удаления новообразований с ревизией гайморовой пазухи с ультразвуковым ЛОР-доступом 1-ой категории сложности
Удаление новообразований 2-ой категории сложности, ЛОР-доступ
Операция удаления новообразований с ревизией гайморовой пазухи с ультразвуковым ЛОР-доступом 2-ой категории сложности
Удаление новообразований 1-ой категории сложности, ЧЛХ-доступ
Операция удаления новообразований с ревизией гайморовой пазухи с альвеолярным ЧЛХ-доступом 1-ой категории сложности
Удаление новообразований 2-ой категории сложности, ЧЛХ-доступ
Операция удаления новообразований с ревизией гайморовой пазухи с альвеолярным ЧЛХ-доступом 2-ой категории сложности
Микротоковая терапия
Лечение с использованием низкочастотных импульсных токов сверхмалой силы с целью восстановления клеточного метаболизма
PRP-терапия (плазмотерапия)
Реабилитационная процедура с использованием собственной очищенной и обогащенной плазмы крови
Биостимуляция кожи лица
Повышение регенеративного потенциала кожи лица после хирургического вмешательства с применением биомодуляторов D-NUCLEO
Лечение периодонтита — Стоматология в Истре «Доктор НеболитЪ»
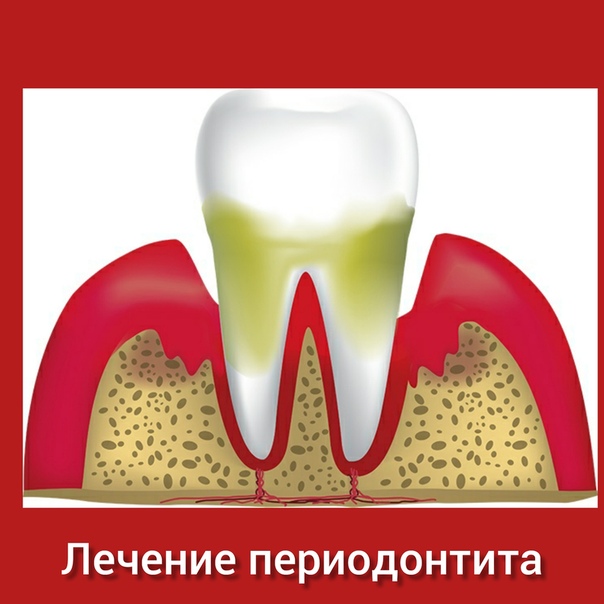
Периодонтит – это воспаление тканей, прилегающих к зубу — периодонта.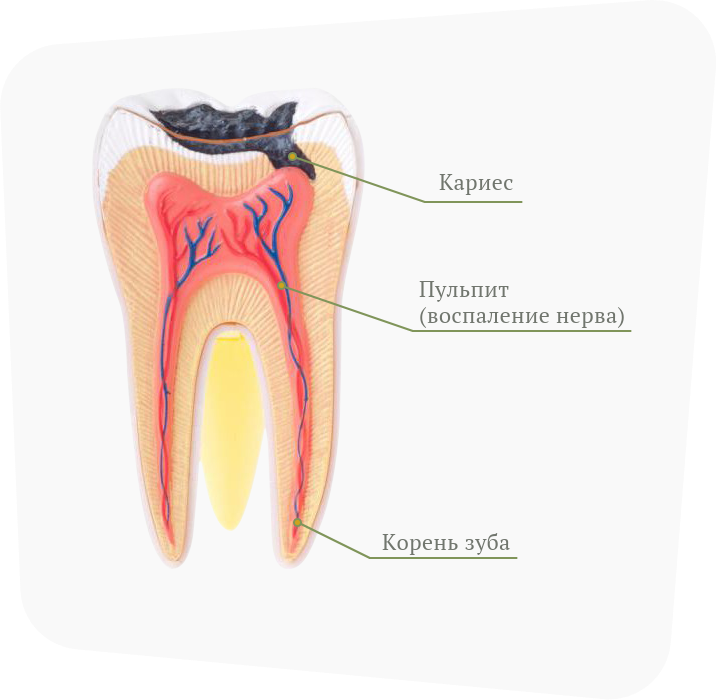 Зубы располагаются в луночках в деснах и держатся в них специальными связками (переплетение коллагеновых волокон). Когда микробы проникают к связкам, они воспаляются.
Зубы располагаются в луночках в деснах и держатся в них специальными связками (переплетение коллагеновых волокон). Когда микробы проникают к связкам, они воспаляются.
Периодонтит принимает разнообразное течение:
В хронической форме эту болезнь трудно диагностировать, не прибегая к рентгеновским снимкам. Сам больной довольно долго может не подозревать о болезни и узнать о ее существовании случайно, при лечении соседних зубов. Внешне зуб может измениться в цвете..стать более темным или серым. Временами могут возникать тупые ноющие бессистемные быстро проходящие боли, появится ощущения тяжести и ощущение «выросшего зуба».
Хронический фиброзный периодонтит почти не беспокоит больного. Разве что временами появляются слабые ноющие боли, но они быстро проходят. Мысль о заболевании даже не возникает. Данную форму можно распознать только с помощью рентгеновского снимка.
Хронический гранулирующий периодонтит характеризуется формированием грануляций. Процесс сопровождается ноющими тупыми болями, опять же непостоянными. Если постучать по больному зубу он болезненно среагирует. Такой периодонтит опять же выявляется рентгеном. Он становится явно заметным при возникновении свищей и подкожных гранулем.
Если постучать по больному зубу он болезненно среагирует. Такой периодонтит опять же выявляется рентгеном. Он становится явно заметным при возникновении свищей и подкожных гранулем.
О хроническом гранулематозном периодонтите можно говорить, когда возникают гранулемы – капсулы из соединительной ткани, заполненные грануляциями. Течение болезни проходит довольно вяло, симптомов почти нет. Опять же заметить гранулематозный периодонтит можно на рентгеновском снимке. Однако это не значит, что он безобиден. Постепенно гранулема перерастает в кистогранулему, а потом в полноценную кисту, растущую от верха зуба в сторону кости. И тут без помощи стоматолога хирурга уже не обойтись. Хронический гранулематозный периодонтит грозит крайне неприятными осложнениями.
Хронический периодонтит переходит в острую гнойную форму стремительно, всего за несколько дней. Симптомы нарастают как снежный ком. При накусывании и даже просто при прикосновении к больному зубу ощущается сильная резкая боль. Боль может распространяться на пол челюсти. Возникает впечатление, что зуб вырос. Опухает, краснеет и тоже начинает болеть десна и зуб шатается. Если в этот период не обратиться в стоматологию, то через несколько дней боль станет менее острой, может даже совсем пройти. А в десне или даже на щеке появится ранка, из которой будет сочиться гной. Это свищ, необходимый для оттока гноя из организма. Выход наружу гной прокладывает самостоятельно, расплавляя ткани. Но что вызывает периодонтит? Каким образом микробы добираются до казалось бы закрытых от внешней среды тканей?
Боль может распространяться на пол челюсти. Возникает впечатление, что зуб вырос. Опухает, краснеет и тоже начинает болеть десна и зуб шатается. Если в этот период не обратиться в стоматологию, то через несколько дней боль станет менее острой, может даже совсем пройти. А в десне или даже на щеке появится ранка, из которой будет сочиться гной. Это свищ, необходимый для оттока гноя из организма. Выход наружу гной прокладывает самостоятельно, расплавляя ткани. Но что вызывает периодонтит? Каким образом микробы добираются до казалось бы закрытых от внешней среды тканей?
Бывает в возникновении периодонтита виноват больной, а бывает что и стоматолог. Если больной довёл зуб до хронического пульпита или глубокого кариеса и вовремя не обратился к стоматологу, то микробы успевают от верхушки корня зуба перебраться пониже. Иногда периодонтит возникает вследствие перегрузки, это если во рту недостаёт большого количества зубов. Ресурс тех, что остались, исчерпывается в разы быстрее, чем при наличии полного зубного ряда.
К сожалению, встречаются случаи, когда периодонтит возникает вследствие некачественного лечения кариеса или пульпита. Инфекция после кариеса или пульпита может остаться в зубе, в результате недостаточной медикаментозной и механической обработке канала зуба или некачественной пломбировке.
Раньше болезнь зачастую провоцировал мышьяк, который использовали стоматологи, чтобы убить нерв. Сегодня они обходятся безмышьяковыми пастами. Поэтому отравление мышьяком можно исключить из списка причин.
Лечение хронических и острых форм различное, но в любом случае длительное.
Лечение хронического периодонтита врач начинает с того, что обрабатывает канал больного зуба: удаляет поражённые болезнью ткани (пульпу, микроорганизмы, поражённый дентин, продукты распада), при необходимости распломбировывает зуб, затем тщательно дезинфицирует. После этого закладывает в канал противомикробные и противовоспалительные средства и прикрывает их временной пломбой. Лекарства нужно периодически закладывать заново, так как они постепенно рассасываются.
Если лечение не помогает или если больной зуб прикрыт коронкой, то хирурги используют последние доступное им средство – верхушечную резекцию корня. Операция заключается в том, что в десне делается маленький разрез и через него удаляют верхушку корня вместе с очагом воспаления. Если не помогла верхушечная резекция, то не остаётся ничего кроме как удалить зуб.
При лечении острого периодонтита зуб сначала оставляют открытым, чтобы весь гной вышел наружу. В течение некоторого времени больной принимает назначенные стоматологом антибиотики. Ну а дальше всё в точности, как при лечении хронического периодонтита.
В большинстве случаев зуб можно спасти, но бывают условия, при которых единственным способом лечения может быть только удаление больного зуба. К таким условиям относится вертикальный перелом зуба, поражение периодонта, невозможность обработки канала и восстановления зуба.
Периодонтит может спровоцировать как общие, так и локализованные осложнения. К общим можно отнести интоксикацию организма (головные боли, повышение температуры до 38С и выше, общую слабость), аутоиммунные болезни почек, суставов, сердца. Местные осложнения проявляются в виде кист, гнойных мешочков, свищей, разлитого гнойного воспаления шеи, воспалении костной ткани челюсти, гайморита.
Лечение периодонтита зубов в стоматологической клинике FaceLine-Clinic
Периодонтитом называют воспалительный процесс, который сосредоточен в соединительной ткани (периодонте), окружающей зуб. Воспаление может сопровождаться острой болью. Не затягивайте с обращением к врачу — в хронической форме заболевание приводит к разрушению челюстной кости. В стоматологии Faceline вам предложат адекватное лечение периодонтита и решат проблему.
Причины
Чаще всего периодонтит становится следствием запущенного кариеса или пульпита. Заболевание вызывает инфекция, попадающая в периодонт из твердых зубных тканей или из пульпы. Воспаление затрагивает также верхнюю часть корня зуба, бактерии проникают в корневые каналы.
Симптомы периодонтита
Острая форма
- Развитие заболевания происходит за 2-3 дня.
- Зуб становится чувствительным к холодному/горячему.
- Отдает болью, если на него надавить.
- На вторые сутки начинается острая боль.
- Десневые ткани набухают.
- Зуб может стать подвижным.
- Появляется гной.
- В десне могут возникать гнойные свищи.
Хроническая форма
- Нередко развивается под пломбой, коронкой.
- Заболевание может длиться неделями и даже месяцами.
- Зуб умеренно болезненный.
- Иногда возникают обострения с острой болью.
- На десне постоянно наблюдается небольшой отек.
- Выделяется небольшое количество гноя.
- Кость в районе корня может постепенно атрофироваться.
- Зуб со временем расшатывается.
- Среди осложнений — киста, гранулема.
Как проходит лечение периодонтита в клинике Faceline
Многие пациенты считают, что воспаление «само пройдет». На самом деле, дома вылечить периодонтит невозможно, и острая форма неминуемо перейдет в хроническую. Дело закончится потерей зуба. Поэтому при первых симптомах заболевания обязательно обратитесь в стоматологию. Чем раньше вы сделаете это, тем проще будет снять воспаление.
Эндодонтическое лечение периодонтита
Так как инфекция затронула корень, требуется очистить от нее зубные каналы. Врач аккуратно вскрывает их, удаляет инфицированные ткани и проводит обработку антисептическими составами. Все работы при лечении периодонтита мы проводим с применением микроскопа, чтобы не пропустить малейшего источника бактерий и тщательно вычистить каждый канал. Если в области корня скопился гной, понадобится маленький разрез в десне, чтобы он выходил.
После того как врач убедится, что каналы полностью очищены, он герметизирует их гуттаперчевыми штифтами. Далее можно пломбировать зуб и переходить к физиотерапевтическим процедурам и медикаментозному лечению заболевания. Это позволит снять воспаление — после периодонтита ткани заживут и восстановятся.
Хирургическое лечение периодонтита
В сложных случаях заболевания, когда в области корня зуба скапливается большое количество гноя, образовалась киста или гранулема, требуется вмешательство хирурга. Мы практикуем зубосохраняющие методы и приложим все усилия, чтобы восстановить внешний вид и функциональность зуба после периодонтита.
Врач деликатно вскрывает десну, устраняет патологические ткани, вычищает грануляции. В ряде случаев периодонтита может потребоваться удаление части корня — оно поможет сохранить остальную часть зуба.
Записаться на прием
Наши врачи учились у признанных гуру стоматологии и внедрили в свою практику лучший мировой опыт.
Мы подходим индивидуально и тщательно к планированию вашего лечения.
Стоимость лечения по согласованному вами плану будет зафиксирована.
Впишем все необходимые визиты в клинику в ваш привычный жизненный график.
Онлайн диагностика
У вас есть снимок зуба?Вы хотите получить мнение наших врачей по вашему случаю без визита в клинику?
Пришлите нам снимок через форму на сайте, опишите ваш запрос и мы дадим заочную консультацию по предоставленным данным.
Заполнить форму
Онлайн консультация
Если какие-то причины не позволяют вам посетить стоматолога, мы приглашаем вас на онлайн-консультацию! Вы сможете познакомиться с врачом и получить экспертные ответы на все вопросы, не выходя из дома. Вы выберете удобный способ видеосвязи — видеозвонок или скайп. Вам будет составлен план лечения, который вы сможете реализовать, когда будете готовы. Мы зафиксируем стоимость плана лечения и забронируем под вас необходимые материалы. Важно знать, что ситуация в полости рта постепенно меняется, поэтому составленный план будет действителен 6 месяцев. Внести аванс можно онлайн, договор и чек будет вам предоставлен. При этом, если вы все же передумаете лечиться, аванс будет возвращен полностью. Мы стремимся предоставить нашим пациентам все возможности для сохранения безопасности, и онлайн-консультация — это лучшее решение для тех, кто пока не готов к посещению клиники.
Запишитесь на прием
Выберите способ связи
В назначенное время врач выйдет на связь
Врач пришлет назначение на рентген
Врач составит план лечения
Вы вносите аванс, и мы фиксируем стоимость
Заполнить форму
Отзывы пациентов
11.01.2021
Ирина Владимировна К.
Ещё один визит в клинику, и лишний раз убедилась в отличном обслуживании всей команды. Серьёзные, ответственные, доброжелательные, дай Бог чтобы все клиники Москвы так работали. Растите и процветайте, дай Бог Вам здоровья. Уходила счастливой, Огромное спасибо!!!
16.06.2020
Понадобилась простая стоматологическая процедура – установка пломбы. Единственной проблемой было то, что я никак не могла записаться в стоматологии, которые у меня были на примете, на оптимальный для меня день (в субботу просто забито было). Но в этой клинике мне нашли окошко. Стоматолог оказался внимательным и приятным в общении, он очень аккуратно и быстро все сделал. Цена (как для Москвы) невысокая. Я думала, что потрачусь намного сильнее.
15.10.2020
Марисенкова Людмила Юрьевна
Большая благодарность доктору Пигаревой Наталье Петровне. Аккуратный внимательный грамотный доктор. Обязательно приду на прием повторно.
04.12.2020
Хочу выразить огромную благодарность доктору Кучиной К.А. и ее ассистенту Кубе. Всю свою жизнь я боялась лечить зубы. И только сегодня я поняла, что есть профессионалы такого уровня, которые избавляют от страха легко и делают свою работу быстро и качественно. Прекрасная команда профессионалов. Всем рекомендую Кристину Андреевну и клинику Фейслайн.
Наши врачи
Малыхина Евгения Петровна
Главный врач, врач-стоматолог терапевт, детский врач-стоматолог, врач-стоматолог ортопед
Кочканян Артем Суренович
Врач стоматолог-хирург, врач стоматолог-ортопед
Кучина Кристина Андреевна
Врач стоматолог-терапевт
Гордеева Елена Николаевна
Врач-стоматолог ортопед
Оганесян Елена Валерьевна
Врач-ортодонт
Пигарева Наталья Петровна
Врач-стоматолог
Лебедева Евгения Владимировна
Врач-стоматолог терапевт
Ермолаева Анна Юрьевна
Врач стоматолог-хирург, врач стоматолог-ортопед
Лукиных Вероника Андреевна
Врач-стоматолог хирург, детский врач-стоматолог
Шиханцов Алексей Владимирович
Врач-стоматолог
Михеев Владислав Олегович
Врач-стоматолог терапевт
Лапин Олег Владимирович
Врач анестезиолог-реаниматолог
Наши лицензии
Лечение периодонтита | Медицинский центр «Новая жизнь»
Периодонтит — это воспаление тканей периодонта (тканей, окружающих корни зубов), характеризующееся нарушением целостности связок, удерживающих зуб в альвеоле, кортикальной пластинке кости, а также резорбцией костной ткани от незначительных размеров до образования кист больших размеров. По причине возникновения периодонтит делится на:
- Инфекционный периодонтит в основном является осложнением кариеса, то есть сначала был кариес, потом вследствии возник пульпит, а после инфекция вышла за верхушку корня зуба и развился периодонтит.
- Травматический периодонтит возникает в результате однократного воздействия в область причинного зуба, например, при ударе или же при длительной нагрузке на зуб, например, завышенная пломба или неправильно изготовленные ортопедические конструкции.
- Медикаментозный периодонтит развивается чаще всего при неправильном лечении пульпита, когда сильнодействующие препараты попадают в периодонт (например паста, содержащая мышьяк, формалин, фенол) или раздражающие материалы (фосфат-цемент, штифты).
В практике чаще всего встречается, конечно, инфекционный периодонтит, так как пациенты, в основном, затягивают с приемом к врачу, что и ведет к такому осложнению, как периодонтит. Клинические проявления периодонтита зависят от течения процесса. То есть при остром периодонтите или обострении хронического периодонтита пациента мучают не только постоянная острая боль, усиливающаяся при накусывании на зуб, но и припухлость в области больного зуба. При хроническом процессе может возникать незначительная боль при надавливании, накусывании на зуб, а может и вовсе не возникать никаких субъективных ощущений. В случае отсутствия симптомов можно периодически наблюдать свищевой ход (гнойник) на слизистой десен.
Лечение периодонтита.
Лечение проводится минимум в два посещения, а в случае наличия острого или обостренного периодонтита — в три посещения. Ниже приведем примерную схему лечения:
Первое посещение.
- Анестезия (по необходимости)
- Удаление кариозных тканей или старой реставрации (пломбы).
- Расширение и антисептическая обработка корневых каналов.
- Пломбирование корневых каналов противовоспалительным препаратом (для того, чтобы снять острый процесс)
- Временная пломба.
Второе посещение.
- Удаление временной пломбы.
- Промывание корневых каналов антисептическими растворами.
- Пломбирование корневых каналов кальцийсодержащим препаратом ( так как кальций способствует регенеративным процессам в апикальных тканях)
- Временная пломба
Кальцийсодержащие препараты должны находится в канале не менее двух недель, так как за меньшее количество времени кальций просто не успеет оказать нужное регенеративное воздействие на переапикальные ткани.
Третье посещение.
- Удаление временной пломбы.
- Промывание корневых каналов антисептическими растворами.
- Постоянное пломбирование корневых каналов.
- Постоянная реставрация (пломба) или пломба под ортопедическую конструкцию, если это необходимо.
В зависимости от клинической ситуации количество посещений может быть изменено. Нужно отметить, что как и при лечении пульпита, лечение периодонтита обязательно должно быть с применением коффердама (раббердама) по причине необходимости изолировать зуб от слюны, а слизистую десны, щек и языка от высококонцентрированных антисептических растворов.
Исследователи выявляют иммунных виновников, связанных с воспалением и потерей костной массы при заболевании десен
Новое исследование, проведенное клиническим исследователем NIDCR доктором Ники Мутсопулос, предполагает, что заболевание пародонта вызывается иммунными клетками Th27, которые запускаются нездоровым бактериальным сообществом. Фото: Национальный институт стоматологических и черепно-лицевых исследований, NIH.Согласно новому исследованию на мышах и людях, нездоровая популяция микробов во рту запускает специализированные иммунные клетки, которые воспаляют и разрушают ткани, что приводит к потере костной массы, связанной с тяжелой формой заболевания десен.Исследование, проведенное учеными из Национального института стоматологических и черепно-лицевых исследований (NIDCR) при Национальном институте здравоохранения и Школы стоматологической медицины Пенсильванского университета в Филадельфии, может иметь значение для новых подходов к лечению этого состояния. Результаты появятся в Интернете 17 октября 2018 г. в журнале Science Translational Medicine .
Заболевания пародонта — распространенное заболевание, которым страдает почти половина взрослых американцев старше 30 лет и 70 процентов взрослых в возрасте 65 лет и старше.У пострадавших бактерии вызывают воспаление тканей, окружающих зубы, что может привести к потере костей и зубов на поздней стадии заболевания, называемого пародонтитом.
«В течение многих лет мы знали, что микробы стимулируют воспаление. Удаление бактерий с помощью чистки зубов и ухода за зубами контролирует воспаление, но не навсегда, что предполагает наличие других факторов», — сказал старший автор исследования Ники Мутсопулос, доктор медицинских наук, доктор философии. ., клинический исследователь NIDCR. «Наши результаты показывают, что иммунные клетки, известные как Т-хелперы 17, являются движущими силами этого процесса, обеспечивая связь между бактериями полости рта и воспалением.«
Мутсопулос и его коллеги наблюдали, что Т-хелперные (Th) 17-клетки были гораздо более распространены в ткани десен людей с пародонтитом, чем в деснах их здоровых коллег, и что количество клеток Th27 коррелировало с тяжестью заболевания.
КлеткиTh27 обычно живут в так называемых барьерных участках, таких как рот, кожа и пищеварительный тракт, где микробы впервые контактируют с телом. Известно, что клетки Th27 защищают от молочницы, грибковой инфекции полости рта, но они также связаны с воспалительными заболеваниями, такими как псориаз и колит, что позволяет предположить, что они играют двойную роль в здоровье и болезни.
Чтобы лучше понять эту динамику, ученые NIDCR объединились с исследовательской группой, финансируемой NIDCR, во главе с старшим автором исследования Джорджем Хаджишенгаллисом, доктором медицинских наук, из Школы стоматологической медицины Пенсильванского университета и коллегами из Национального института медицины США. Аллергия и инфекционные заболевания (NIAID) и Национальный институт рака (NCI).
Ученые обнаружили, что, как и у людей, в деснах мышей с периодонтитом накопилось больше Th27-клеток, чем у здоровых мышей, которые служили контрольной группой.
Чтобы увидеть, может ли микробиом полости рта быть триггером накопления клеток Th27, исследователи поместили мышей в коктейль с антибиотиками широкого спектра действия. Они обнаружили, что устранение микробов полости рта предотвращает распространение клеток Th27 в деснах мышей с периодонтитом, в то же время не затрагивая другие иммунные клетки, что позволяет предположить, что нездоровая бактериальная популяция запускает накопление клеток Th27.
Затем группа хотела узнать, может ли блокирование клеток Th27 уменьшить заболевание пародонта.Когда ученые с помощью генной инженерии создали у мышей отсутствие клеток Th27 или дали животным низкомолекулярный препарат, предотвращающий развитие клеток Th27, они увидели аналогичные результаты: снижение потери костной массы от пародонтита. Анализ РНК показал, что препарат, блокирующий Th27, приводит к снижению экспрессии генов, участвующих в воспалении, разрушении тканей и потере костной массы, что позволяет предположить, что клетки Th27 могут опосредовать эти процессы при пародонтите.
Наконец, исследователи изучили группу из 35 пациентов в Клиническом центре NIH с дефектом гена, из-за которого у них отсутствовали клетки Th27.Ученые пришли к выводу, что если клетки Th27 так же важны для пародонтита, как предполагали исследования на животных, отсутствие клеток Th27 должно защитить от заболеваний десен. Это действительно то, что группа обнаружила — пациенты были менее восприимчивы к этому заболеванию и имели меньше воспалений и потери костной массы по сравнению с добровольцами того же возраста и пола.
«Наши клинические наблюдения указывают на актуальность наших исследований на животных для людей и предоставляют дополнительные доказательства того, что клетки Th27 являются движущей силой пародонтита», — сказал исследователь NIDCR Николас Дутзан, доктор философии.Д., первый автор статьи.
«Эти результаты дают ключевое представление о механизмах, лежащих в основе развития пародонтоза», — сказала директор NIDCR Марта Дж. Сомерман, доктор медицинских наук, доктор философии. «Важно отметить, что они также предлагают убедительные доказательства терапевтического воздействия на определенные клетки, что в конечном итоге может помочь нам обеспечить лучшее лечение и большее облегчение для пациентов с этим распространенным заболеванием».
Исследования показывают удивительную пользу для здоровья от пережевывания пищи.
Дополнительная информация: Н.Дутзан и др., «Дисбиотический микробиом запускает клетки Th27, чтобы опосредовать иммунопатологию слизистой оболочки полости рта у мышей и людей», Science Translational Medicine (2018). stm.sciencemag.org/lookup/doi/… scitranslmed.aat0797
Предоставлено NIH / Национальный институт стоматологических и черепно-лицевых исследований
Ссылка : Исследователи выявляют иммунных виновников, связанных с воспалением и потерей костной массы при заболевании десен (2018, 17 октября) получено 16 мая 2021 г. из https: // medicalxpress.ru / news / 2018-10-иммунные-виновники-связанные-воспаления-кости.html
Этот документ защищен авторским правом. За исключением честных сделок с целью частного изучения или исследования, никакие часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в информационных целях.
Активированные микробиомом клетки Th27 переключаются с защитных на деструктивные; могут быть потенциальными мишенями для лечения — ScienceDaily
Согласно новому исследованию, нездоровая популяция микробов во рту запускает специализированные иммунные клетки, которые воспаляются и разрушают ткани, что приводит к потере костной массы, связанной с тяжелой формой заболевания десен. мыши и люди.Исследование, проведенное учеными из Национального института стоматологических и черепно-лицевых исследований (NIDCR) при Национальном институте здравоохранения и Школы стоматологической медицины Пенсильванского университета в Филадельфии, может иметь значение для новых подходов к лечению этого состояния. Результаты появятся в Интернете 17 октября 2018 года в журнале Science Translational Medicine .
Заболевание пародонта — распространенное заболевание, которым страдает почти половина взрослых американцев старше 30 лет и 70 процентов взрослых в возрасте 65 лет и старше.У пострадавших бактерии вызывают воспаление тканей, окружающих зубы, что может привести к потере костей и зубов на поздней стадии заболевания, называемого пародонтитом.
«В течение многих лет мы знали, что микробы стимулируют воспаление. Удаление бактерий с помощью чистки зубов и ухода за зубами контролирует воспаление, но не навсегда, что предполагает наличие других факторов», — сказал старший автор исследования Ники Мутсопулос, доктор медицинских наук, доктор философии. ., клинический исследователь NIDCR. «Наши результаты показывают, что иммунные клетки, известные как Т-хелперы 17, являются движущими силами этого процесса, обеспечивая связь между бактериями полости рта и воспалением.«
Мутсопулос и его коллеги наблюдали, что Т-хелперные (Th) 17-клетки были гораздо более распространены в ткани десен людей с пародонтитом, чем в деснах их здоровых коллег, и что количество клеток Th27 коррелировало с тяжестью заболевания.
Клетки Th27 обычно живут в так называемых барьерных участках, таких как рот, кожа и пищеварительный тракт, где микробы впервые контактируют с телом. Известно, что клетки Th27 защищают от молочницы, грибковой инфекции полости рта, но они также связаны с воспалительными заболеваниями, такими как псориаз и колит, что позволяет предположить, что они играют двойную роль в здоровье и болезни.
Чтобы лучше понять эту динамику, ученые NIDCR объединились с исследовательской группой, финансируемой NIDCR, во главе с старшим автором исследования Джорджем Хаджишенгаллисом, доктором медицинских наук, из Школы стоматологической медицины Пенсильванского университета и коллегами из Национального института медицины США. Аллергия и инфекционные заболевания (NIAID) и Национальный институт рака (NCI).
Ученые обнаружили, что, как и у людей, в деснах мышей с периодонтитом накопилось больше Th27-клеток, чем у здоровых мышей, которые служили контрольной группой.
Чтобы увидеть, может ли микробиом полости рта быть триггером накопления клеток Th27, исследователи поместили мышей в коктейль с антибиотиками широкого спектра действия. Они обнаружили, что устранение микробов полости рта предотвращает распространение клеток Th27 в деснах мышей с периодонтитом, в то же время не затрагивая другие иммунные клетки, что позволяет предположить, что нездоровая бактериальная популяция запускает накопление клеток Th27.
Затем группа хотела узнать, может ли блокирование клеток Th27 уменьшить заболевание пародонта.Когда ученые с помощью генной инженерии создали у мышей отсутствие клеток Th27 или дали животным низкомолекулярный препарат, предотвращающий развитие клеток Th27, они увидели аналогичные результаты: снижение потери костной массы от пародонтита. Анализ РНК показал, что препарат, блокирующий Th27, приводит к снижению экспрессии генов, участвующих в воспалении, разрушении тканей и потере костной массы, что позволяет предположить, что клетки Th27 могут опосредовать эти процессы при пародонтите.
Наконец, исследователи изучили группу из 35 пациентов в Клиническом центре NIH с дефектом гена, из-за которого у них отсутствовали клетки Th27.Ученые пришли к выводу, что если клетки Th27 так же важны для пародонтита, как предполагали исследования на животных, отсутствие клеток Th27 должно защитить от заболеваний десен. Это действительно то, что обнаружила группа — пациенты были менее восприимчивы к этому заболеванию и имели меньше воспалений и потери костной массы по сравнению с добровольцами того же возраста и пола.
«Наши клинические наблюдения указывают на актуальность наших исследований на животных для людей и предоставляют дополнительные доказательства того, что клетки Th27 являются движущей силой пародонтита», — сказал исследователь NIDCR Николас Дутзан, доктор философии.Д., первый автор статьи.
«Эти результаты дают ключевое представление о механизмах, лежащих в основе развития пародонтоза», — сказала директор NIDCR Марта Дж. Сомерман, доктор медицинских наук, доктор философии. «Важно отметить, что они также предлагают убедительные доказательства терапевтического воздействия на определенные клетки, что в конечном итоге может помочь нам обеспечить лучшее лечение и большее облегчение для пациентов с этим распространенным заболеванием».
Связь первичного воспаления с потерей костной массы
Заболевание пародонта (БП) или пародонтит определяется как бактериально индуцированное заболевание поддерживающих зуб (пародонта) тканей.Характеризуется воспалением и потерей костной массы; поэтому понимание того, как они связаны, поможет найти наиболее эффективный терапевтический подход. Бактериальная инфекция является первичной этиологией, но ее недостаточно, чтобы вызвать начало или прогрессирование заболевания. Действительно, бактериальные факторы стимулируют местную воспалительную реакцию и активацию врожденной иммунной системы. Врожденный ответ включает распознавание микробных компонентов клетками-хозяевами, и это событие опосредуется толл-подобными рецепторами (TLR), экспрессируемыми резидентными клетками и лейкоцитами.Активация этих клеток приводит к высвобождению провоспалительных цитокинов и привлечению фагоцитов и лимфоцитов. Активация Т- и В-клеток инициирует адаптивный иммунитет с ответом Th2 Th3 Th27 Treg и выработкой антител соответственно. В этом воспалительном сценарии цитокины, участвующие в регуляции и поддержании костной ткани, имеют большое значение, поскольку считается, что разрушение ткани является следствием воспалительной реакции хозяина на бактериальную нагрузку. В настоящем обзоре мы суммируем факторы хозяина, включая популяции клеток, цитокины и механизмы, участвующие в разрушении поддерживающих тканей зуба, и обсуждаем перспективы лечения, основанные на этих знаниях.
1. Введение
БП — хроническое инфекционное воспалительное заболевание, которое поражает пародонт и постепенно разрушает поддерживающую зуб альвеолярную кость. Пародонт — это поддерживающая структура, которая окружает и поддерживает зубы. Он состоит из различных тканей, включая десны, цемент, периодонтальную связку и поддерживающую альвеолярную кость.
Заболевания пародонта вызываются бактериальными факторами и антигенами, которые стимулируют местную воспалительную реакцию и активацию врожденной иммунной системы [1, 2].Среди видов бактерий, колонизирующих полость рта, некоторые из них связаны с пародонтитом и определяются как пародонтопатогены. Врожденный ответ хозяина инициируется toll-подобными рецепторами (TLR), подобными белку, кодируемому геном Toll Drosophila [3]. Toll-подобные рецепторы в основном экспрессируются на клетках врожденной иммунной системы [4], но также были идентифицированы в тканях пародонта [5]. Патогены могут проникать в эпителиальные клетки десен, связывая -1 интегрин и реплицироваться, избегая наблюдения хозяина [6].Toll-подобные рецепторы, присутствующие на эпителиальных клетках десен, могут обнаруживать микробные структуры, высоко консервативные среди патогенов, включая липополисахарид (LPS), пептидогликан, бактериальную ДНК, двухцепочечную РНК и липопротеин, называемые патоген-ассоциированными молекулярными структурами (PAMP) [7]. Как только TLR, присутствующие на поверхности резидентных клеток, распознают PAMP, они инициируют активацию нескольких факторов транскрипции, включая ядерный фактор-B (NFB) и протеин-активатор 1 (AP-1), через каскад митоген-активируемой протеинкиназы (MAK) [8 , 9].Они, в свою очередь, активируют различные пути врожденного иммунитета, включая выработку цитокинов и хемокинов, которые привлекают нерезидентные лейкоциты в пародонтальное пространство. В свою очередь, активированные лейкоциты, клетки адаптивного иммунитета, секретируют провоспалительные цитокины и хемокины в тканях [10]. В настоящее время принято считать, что усиление этого первоначального местного ответа хозяина (продолжающееся приблизительно 21 день) приводит к распространению воспаления и разрушению мягких и минерализованных тканей пародонта [11].Традиционное лечение пародонтита направлено на механическое удаление бактериальных агентов, что снижает инфекционную опасность и ведет к разрешению воспаления и контролю БП. Однако стандартное лечение может быть недостаточным или окончательным, чтобы привести к клиническим улучшениям, требуя более сложного биологического подхода. Модуляция ответа хозяина считается новой многообещающей терапией и заключается в модуляции защитных механизмов хозяина в ответ на воспаление.На сегодняшний день единственным лекарственным средством-модулятором хозяина, одобренным Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США, является SDD (доксициклин с субантимикробной дозой). SSD ингибирует производные от хозяина матриксные металлопротеиназы (MMP), ответственные за деградацию мягких и минерализованных тканей, что приводит к снижению прогрессирования периодонтита [12]. Однако расширяющиеся знания показывают, что в деструкцию тканей пародонта вовлечены несколько сигналов, и, таким образом, для достижения долгосрочных результатов, таких как предотвращение потери зубов, может потребоваться блокировка многих путей.С другой стороны, фармакологическая модуляция иммунной системы хозяина может привести к нежелательным побочным эффектам, что требует тщательного мониторинга этого подхода. Следовательно, более подробное понимание клеточных популяций, путей и цитокинов, участвующих в патогенезе пародонта, поможет найти наиболее эффективные стратегии лечения пародонтита.
2. Резидентные клетки и врожденный иммунитет
Резидентные клетки, участвующие во врожденном ответе хозяина, многочисленны, включая эпителиальные клетки, фибробласты десен и пародонтальной связки (PDL), остеобласты и дендритные клетки [9].Эпителиальные клетки продуцируют интерлейкин-8 (IL-8), хемоаттрактант нейтрофилов, который задействует миграцию нейтрофилов [13] и увеличивает адгезию моноцитов в кровеносных сосудах. Нейтрофилы, попадающие в среду пародонта, примированы и демонстрируют повышенную продукцию провоспалительных цитокинов, таких как интерлейкин-1 (IL-1), интерлейкин-6 (IL-6) и фактор некроза опухоли (TNF-) [14]. Эти цитокины опосредуют разрушение тканей пародонта, стимулируя резорбцию кости. С другой стороны, моноциты могут дифференцироваться в остеокласты (ОК) при различных триггерах, а также продуцировать воспалительные цитокины; Недавно сообщалось об экспрессии Wnt5a в ответ на липополисахарид (LPS) [15].
Дендритные клетки (ДК) встречаются, когда эпителиальный барьер вторгается в микроорганизмы. Эти клетки активируют иммунный ответ, либо действуя как антигенпрезентирующие клетки, либо продуцируя IL-12 и IL-18, которые, следовательно, способствуют секреции интерферона (IFN-) NK-клетками, а затем и T-клетками [16]. Фибробласты периодонтальной связки (PDLF) и фибробласты десен (GF) являются основными клетками мягкой соединительной ткани пародонта и доступны, когда микроорганизмы нарушают эпителиальный барьер.Они реагируют высвобождением цитокинов и молекул деградации. GF продуцируют TNF-, (IL) -6, (IL) -8, макрофагальный воспалительный белок (MIP) -1 альфа и фактор стромального происхождения (SDF) -1, которые являются важными регуляторами воспалительного процесса и метаболизма костей [17 –19]. Экспрессия матриксных металлопротеиназ (ММР), ламинина и ламинина усиливается [20, 21] в PDLF; однако эти клетки также вносят свой вклад в воспаление пародонта и потерю костной массы через IL-1, IL-6, TNF- и рецепторный активатор лиганда ядерного фактора-B (RANKL), продуцирующий и высвобождающий [19, 22, 23].Микроорганизмы могут проникать глубже в ткани пародонта и достигать поверхности альвеолярной кости. Porphyromonas gingivalis , как было продемонстрировано, вторгается в остеобласты, взаимодействуя с интегрином 51, вызывая конденсацию актина, активацию пути JNK и апоптоз остеобластов [24, 25]. Тем не менее, микробные PAMPs способствуют экспрессии проостеокластогенного цитокина RANKL в остеобластах (OB), тем самым способствуя остеокластогенезу [26, 27]. Все эти события, которые представляют собой начальную реакцию на инфекцию, создают собственно локальное воспаление врожденного иммунитета.Воспалительные цитокины, продуцируемые резидентными клетками (эпителиальными клетками, GF, PDLF, OB и DC) и фагоцитами (нейтрофилами и макрофагами), участвуют в остеокластогенезе и ответственны за потерю альвеолярной кости.
3. Лейкоциты и адаптивный иммунитет
После этого начального ответа инфекция активирует процесс адаптивного иммунитета: дендритные клетки, не участвующие во врожденном воспалительном ответе, обладают способностью захватывать и представлять антигены В- и Т-клеткам приобретенного иммунитета. система [28].Активированные CD4 Т-хелперные клетки продуцируют субнаборы цитокинов, которые будут определять фенотипически различимые иммунные ответы: клетки Th-1 и Th-2, соответственно, связаны с клеточным и гуморальным иммунитетом [29] и недавно описанными регуляторными Th-17 и T (Treg ) клетки, которые играют антагонистическую роль как эффекторные и супрессивные клетки соответственно [10, 30, 31]. В-клетки также активируются и трансформируются в плазматические клетки, вырабатывающие антитела против бактериальных антигенов. В результате ткани, пораженные пародонтитом, становятся колонизированными обоими подтипами лимфоцитов, но с большей долей В-клеток, чем Т-лимфоциты [32].Действительно, многочисленные исследования продемонстрировали, что развитие пародонтита включает переход от гингивитного поражения, в основном опосредованного Т-клетками, к поражению с участием большого количества В-клеток и плазматических клеток [33]. Контроль этого сдвига также обеспечивается балансом между подмножествами Th2 и Th3 Т-клеток, при этом хронический периодонтит опосредуется клетками Th3 [33]. Этот воспалительный сценарий приводит к разрушению соединительной ткани и альвеолярной кости. Резорбирующие кости клетки, остеокласты, дифференцируются под контролем системы RANK / RANKL / OPG, однако недавно было продемонстрировано, что ряд цитокинов, главным образом продуцируемых в патологических условиях, участвует в модуляции остеокластогенеза.
4. Цитокины, участвующие в потере костной ткани
4.1. RANKL / OPG
RANKL экспрессируется остеобластами и рядом других типов клеток, включая фибробласты и Т- и В-лимфоциты. При патологических состояниях, например, при пародонтите, происходит нарушение регуляции выработки этого цитокина. Остеобласты экспрессируют TLR1, 2, 4 и 6 и отвечают на лиганды TLR2 / 6 и TLR2 / 1 увеличением активации NFB и уровней экспрессии RANKL [34]. Другие исследования показали, что P.endodontalis LPS обладает способностью стимулировать экспрессию RANKL в остеобластах мышей, и эта индукция происходила в основном через сигнальный путь TLR2 / 4-JNK [27]. Экспрессия RANK-L фибробластами в физиологических условиях низкая; однако его экспрессия усиливается в ответ на цитотоксин от Aggregatibacter actinomycetemcomitans и Porphyromonas gingivalis LPS [35, 36]. Однако наиболее распространенным источником RANKL при пародонтите являются клетки иммунной системы.Исследования гибридизации in situ показывают, что высокие уровни RANKL-специфичных транскриптов мРНК локализуются в воспалительных клетках, в основном в лимфоцитах [37]. RANKL-положительные лимфоциты обнаруживаются в воспалительной соединительной ткани пораженной ткани десны [38], но также циркулирующие Т-клетки экспрессируют высокие уровни RANK-L и спонтанно способствуют остеокластогенезу у пациентов [39]. Точнее, основным источником RANKL при пародонтозе являются клетки Th2 или Th27, а также B-клетки, тогда как показано, что клетки Treg ослабляют экспрессию RANKL другими активированными Т-клетками [40].Недавние исследования демонстрируют, что B-клетки продуцируют RANKL в ответ на стимуляцию пародонтальных патогенов [41], и что большинство B-клеток в поражениях пародонта являются RANKL + [42]. В моделях на животных у мышей с удаленными В-клетками отсутствует потеря костной массы при инфицировании P. gingivalis , хотя В-клетки не требуются. Действительно, в отсутствие В-клеток Т-клетки по-прежнему опосредуют LSP-индуцированную потерю костной массы [43].
Действие RANKL может быть заблокировано его растворимым рецептором-ловушкой остеопротегерином (OPG), который подавляется при пародонтите, что приводит к увеличению отношения RANKL / OPG.В здоровых условиях OPG продуцируется резидентными фибробластами пародонта и эндотелиальными клетками. Иммуногистохимические исследования демонстрируют значительно более низкое окрашивание OPG в ткани, пораженной пародонтитом, по сравнению со здоровой тканью десны, а исследования экспрессии генов сообщают о более низких уровнях экспрессии OPG при пародонтите по сравнению с контрольной группой [44]. В исследовании изучаются относительные концентрации RANKL и OPG во время прогрессирования экспериментального периодонтита, индуцированного у мышей. В начале исследования наблюдается быстрая потеря костной массы, что коррелирует с повышенной экспрессией RANKL по сравнению с OPG (дни с 0 по 15).В последней части исследования (дни с 30 по 60), когда скорость потери костной массы замедлялась, концентрация RANKL снижалась, тогда как концентрация OPG была высокой [2]. Все доступные исследования в совокупности показывают, что RANKL увеличивается, тогда как OPG уменьшается при пародонтите; однако не сообщается о различиях в соотношении пациентов с пародонтитом легкой, средней или тяжелой степени [11].
4.2. TNF-
Другие цитокины, такие как TNF-, могут действовать синергично с RANK-L, способствуя остеокластогенезу. Дальнейшие исследования показывают, что TNF-активирует передачу сигналов c-Jun, NF-B и кальция, что приводит к активации NFATc1 и, таким образом, к дифференцировке остеокластов независимо от RANKL в макрофагах человека [45].TNF- играет центральную роль в воспалительной реакции, резорбции альвеолярной кости и потере прикрепления соединительной ткани [1, 46]. Известно, что он связан с местным и системным воспалением, связанным с потерей костной массы [46]. Он присутствует в больших количествах в пораженных тканях пародонта, где положительно коррелирует с экспрессией RANKL [1, 46–48]. Экспериментальная модель пародонтита у приматов демонстрирует, что местные инъекции антагонистов TNF- уменьшают появление воспалительных клеток в альвеолярной кости и образование остеокластов, резорбирующих костную ткань.Другие исследования показывают спонтанное образование остеокластов и повышенную резорбцию кости из циркулирующих PBMC пациентов с пародонтитом, что коррелирует с высокими уровнями TNF- и RANK-L [39, 49]. В результате реакции врожденного иммунитета TNF- локально продуцируется нейтрофилами, которые демонстрируют повышенную хемотаксисную продукцию провоспалительных цитокинов [14]. Макрофаги представляют собой важный источник TNF-, который при нарушении регуляции способствует разрушению тканей хозяина. После антигенной стимуляции наивные CD4 + Т-клетки активируются, пролиферируют и дифференцируются в отдельные субпопуляции эффекторных клеток, характеризующиеся их специфическим цитокином.Подмножество лимфоцитов Th2 характеризуется секрецией TNF- [50]. Таким образом, TNF- способствует повреждению пародонта за счет своего прямого воздействия на остеокластогенез и усиления воспалительных иммунных реакций. Кроме того, данные in vitro демонстрируют эффект TNF- не только на остеокласты, но также и на остеобласты, ингибируя дифференцировку и образование костных узелков [51].
4.3. IL-17
Интерлейкин-17 (IL-7) представляет собой иммунный регуляторный белок, продуцируемый Т-клетками в очагах воспаления.Нарушение регуляции IL-17 способствует остеокластогенезу и связано с потерей костной массы . Высокие уровни IL-17 обнаружены в трещинной жидкости пародонтальных карманов у пациентов с пародонтитом [52]. Клетки Th27, характеризуемые как субнабор Т-клеток, продуцирующих IL-17, были недавно идентифицированы при хронических поражениях БП [53]. Интересно, что мыши с дефицитом рецептора IL-17 (IL-17 r) обнаруживают значительную задержку рекрутирования нейтрофилов в инфицированные участки [54]. Когда эти мыши подвергаются воздействию организмов как P.gingivalis . У них усиливается деструкция костей пародонта [55], что приводит к восприимчивости к инфекции. Эти данные показывают, что IL-17 имеет решающее значение для защиты от внеклеточных патогенов и может играть двойную роль: улучшая контроль патогенов и способствуя альвеолярной резорбции при высвобождении в чрезмерных количествах. IL-17 проявляет свою остеокластогенную активность за счет усиления экспрессии RANKL на остеобластах и CD4 + Т-клетках [56]. Кроме того, IL-17 способствует местному воспалению, рекрутируя и активируя иммунные клетки, что приводит к обилию воспалительных цитокинов, таких как IL-1 и TNF- и RANKL [57].
4.4. TRAIL
Связанный с TNF лиганд, индуцирующий апоптоз (TRAIL), изначально был известен своей апоптотической ролью в раковых и нормальных клетках [58, 59]; однако недавние исследования согласны с его апоптотической ролью в остеобластах и дифференцированных остеокластах [60–62]. С другой стороны, в литературе появляются противоречивые результаты относительно роли TRAIL в остеокластогенезе [63–65]. Высокие уровни TRAIL обнаружены в сыворотке пациентов с БП, несущих потерю альвеолярной кости [66], а спонтанный остеокластогенез наблюдается в культурах PBMC от тех же пациентов [39].Интересно, что инфекция микроорганизмов индуцирует экспрессию TRAIL остеобластами [67]. Добавление нейтрализующих антител TRAIL к культурам PD PBMC частично устраняет спонтанный остеокластогенез дозозависимым образом. Авторы объясняют этот эффект взаимодействием TRAIL / OPG. В подтверждение этого добавление RANKL полностью снимает ингибирование образования остеокластов, вызванное нейтрализующими антителами TRAIL [68]. Подтверждающие данные демонстрируют, что избыток TRAIL над OPG усиливает связывание RANKL с его рецептором RANK за счет титрования ингибирующей молекулы [69].Потеря альвеолярной кости при БП также может быть определена снижением костеобразования остеобластами. Остеобласты, полученные из фрагментов альвеолярной кости пациентов с БП, обладают более слабым характерным фенотипом по сравнению с контрольными клетками и более чувствительны к апоптотическому эффекту, индуцированному TRAIL [66, 70, 71]. Чувствительность к TRAIL-индуцированному апоптозу определяется соотношением рецепторов смерти и ловушек. Высокие уровни рецепторов-ловушек TRAIL и TRAIL обнаруживаются в пораженных тканях десен и пародонта, что способствует ингибированию апоптоза при БП и объясняет более длительное выживание воспалительных клеток [72].
5. Выводы
Развитие пародонтита зависит от множества факторов. Заболевание имеет полимикробный патогенез, поскольку инициаторами воспалительного процесса являются разные виды бактерий. Врожденный иммунитет — это первая линия защиты хозяина и устойчивости к инфекции. Врожденный иммунитет хозяина действует через TLR, которые распознают консервативные молекулярные структуры патогенных бактерий. Сеть секретируемых цитокинов приводит к активации лимфоцитов, но прогрессирование поражений пародонта вызвано нарушением регуляции молекул, высвобождаемых конкретными популяциями клеток.Многие из этих секретируемых факторов участвуют в регуляции и поддержании костной ткани, и их дисбаланс приводит к изменению ремоделирования пародонта. Таким образом, происходит усиление активности остеокластов без увеличения костеобразования, что приводит к потере альвеолярной кости. Механическое удаление инфекционных агентов в тканях десен вместе с введением SDD в качестве модулятора ответа хозяина является единственным современным методом лечения пародонтита. Эти подходы пытаются управлять воспалением и контролировать повреждение тканей.Однако сложность путей, вовлеченных в реакцию хозяина, определяет различия в клинических проявлениях и прогрессировании заболевания, что, возможно, требует различных терапевтических подходов. Важной задачей является понимание различных ролей медиаторов воспаления, их клеточного источника, их участков действия и, возможно, способов их контроля. На рисунке 1 мы суммируем сеть цитокинов, выделяемых резидентными и мигрирующими клетками, участвующими в резорбции пародонта. Блокирование активности провоспалительных цитокинов может быть многообещающим терапевтическим методом при пародонтите.В некоторых исследованиях изучали влияние антагонистов TNF- и IL-1 на периодонтит, сообщая о значительном уменьшении воспаления и резорбции костей, хотя исследования ингибиторов TNF дали противоречивые результаты [72]. Ось RANK / RANKL / OPG является центральным путем в регуляции метаболизма костной ткани и является привлекательной фармакологической мишенью для лечения патологической потери костной массы. Использование ингибиторов RANKL при пародонтите, хотя и ограничено экспериментальными моделями на животных, демонстрирует защитный эффект на резорбцию альвеолярной кости [73].Эти результаты побуждают сосредоточиться на появляющейся сети цитокинов, секретируемых при БП, некоторые из которых суммированы в этом обзоре, и рассматривать их в качестве дополнительных терапевтических мишеней. Тем не менее, следует помнить, что пути, участвующие в возникновении и прогрессировании пародонтита, являются общими для воспалительных заболеваний с костными осложнениями, таких как ревматоидный артрит, множественная миелома и рак. Таким образом, дальнейшее понимание механизмов, связывающих воспаление с потерей костной массы при пародонтите, также будет способствовать раскрытию влияния иммунных клеток на развитие и поддержание костей в физиологических и патологических состояниях.
Заболевание десен | Центр имплантологии и лазерной пародонтальной хирургии
Основные причины заболевания десен
Заболевание пародонта (десен), также известное как пародонтоз и пародонтит, является прогрессирующим заболеванием, которое, если его не лечить, может привести к потере зубов. Заболевание десен начинается с воспаления и раздражения тканей десны, которые окружают и поддерживают зубы. Причиной этого воспаления являются токсины, обнаруженные в зубном налете, которые вызывают продолжающуюся бактериальную инфекцию.
Бактериальная инфекция колонизируется в ткани десен, и между зубами и деснами образуются глубокие карманы. При своевременном лечении пародонтологом последствия легкого воспаления (известного как гингивит) полностью обратимы. Однако, если бактериальная инфекция прогрессирует, пародонтоз начинает разрушать десны и нижележащую челюстную кость; способствует потере зубов. В некоторых случаях бактерии от этой инфекции могут перемещаться в другие части тела через кровоток.
Признаки и симптомы
- Десны кровоточат при чистке зубов. Даже небольшое кровотечение — это ненормально. Если у вас «розовая» зубная щетка, обратитесь к пародонтологу.
- Красные, опухшие или болезненные десны.
- Отслоение десны от зубов.
- Гной, выделяющийся из линии десен при надавливании на десны.
- Зубы расшатались или изменили положение.
- Любое изменение в соединении зубов при прикусе.
- Любое изменение посадки частичных протезов.
- Хронический неприятный запах изо рта или неприятный вкус.
Важные факторы риска
Есть генетические факторы и факторы окружающей среды, влияющие на начало заболевания десен, и во многих случаях риск развития пародонтита можно значительно снизить, приняв профилактические меры.
Вот некоторые из наиболее частых причин заболеваний десен:
- Плохая гигиена полости рта — Профилактика стоматологических заболеваний начинается дома с хорошей гигиены полости рта и сбалансированного питания.Профилактика также включает регулярные посещения стоматолога, которые включают осмотры, чистки и рентген. Сочетание превосходного домашнего ухода и профессионального ухода за зубами гарантирует и сохранит естественные зубные ряды и поддерживающие костные структуры. Когда бактерии и зубной камень (зубной камень) не удаляются, десны и кости вокруг зубов поражаются токсинами бактерий и могут вызвать гингивит или периодонтит, что может привести к потере зубов.
- Употребление табака — Исследования показали, что курение и употребление табака являются одними из наиболее важных факторов в развитии и прогрессировании заболеваний десен.Помимо того, что у курильщиков более медленное выздоровление и скорость заживления, курильщики гораздо чаще страдают от налета (зубного камня) на зубах, глубоких карманов в десневой ткани и значительной потери костной массы.
- Генетическая предрасположенность — Несмотря на строгие правила гигиены полости рта, до 30% населения могут иметь сильную генетическую предрасположенность к заболеваниям десен. У этих людей вероятность развития пародонтоза в шесть раз выше, чем у лиц без генетической предрасположенности.Генетические тесты могут использоваться для определения восприимчивости, и может быть выполнено раннее вмешательство для сохранения здоровья полости рта.
- Беременность и менопауза — Во время беременности регулярная чистка зубов щеткой и зубной нитью имеет решающее значение. Гормональные изменения, испытываемые организмом, могут сделать ткань десен более чувствительной, что делает их более восприимчивыми к заболеваниям десен.
- Хронический стресс и неправильное питание — Стресс снижает способность иммунной системы бороться с болезнями, что означает, что бактериальные инфекции могут побеждать защитную систему организма.Плохое питание или недоедание также могут снизить способность бороться с инфекциями пародонта, а также негативно сказаться на здоровье десен.
- Диабет и основные медицинские проблемы — Многие заболевания могут усиливать или ускорять начало и прогрессирование заболеваний десен, включая респираторные заболевания, болезни сердца, артрит и остеопороз. Диабет снижает способность организма усваивать инсулин, что затрудняет контроль и лечение бактериальной инфекции десен.
- Шлифовка зубов — Сжатие или скрежетание зубов может значительно повредить поддерживающую ткань, окружающую зубы. Скрежетание зубами обычно связано с «плохим прикусом» или смещением зубов. Когда человек страдает заболеванием десен, дополнительное разрушение десневой ткани из-за шлифовки может ускорить прогрессирование заболевания.
- Лекарство — Многие лекарства, включая оральные противозачаточные таблетки, сердечные лекарства, антидепрессанты и стероиды, влияют на общее состояние зубов и десен; делает их более восприимчивыми к заболеваниям десен.Использование стероидов способствует чрезмерному разрастанию десен, что делает отек более частым явлением и позволяет бактериям легче колонизировать ткань десен.
Диагностика
Заболевание пародонта, также известное как заболевание десен, диагностируется вашим стоматологом, пародонтологом или стоматологом-гигиенистом во время осмотра пародонта. Этот тип осмотра всегда должен быть частью вашего регулярного стоматологического осмотра. Если вы взрослый и не проходили ежегодный осмотр пародонта, обратитесь в Центр имплантологии и лазерной пародонтальной хирургии в Эль-Пасо и Лас-Крусес.
Пародонтальный зонд (небольшой стоматологический инструмент) осторожно используется для измерения борозды (кармана или пространства) между зубом и деснами. Глубина здоровой борозды составляет три миллиметра или меньше, и она не кровоточит. Пародонтальный зонд помогает определить глубину карманов более трех миллиметров. По мере прогрессирования заболеваний пародонта карманы обычно становятся глубже.
На самом деле существует несколько типов заболеваний пародонта. Все они вызваны бактериальной инфекцией, которая разрушает десны, кости и связки, поддерживающие зубы.Заболевание пародонта прогрессирует незаметно, часто без боли или явных симптомов, которые могли бы предупредить вас о его наличии. Он может развиваться медленно или довольно быстро.
Ваш пародонтолог или гигиенист будет использовать глубину кармана, количество кровотечений, воспаление, подвижность зубов и т. Д., Чтобы поставить диагноз, который попадет в категорию ниже:
Нормальная, здоровая десна
Здоровые десны и кости надежно фиксируют зубы
Гингивит
Гингивит — первая стадия пародонтоза.Зубной налет и побочные продукты его токсинов раздражают десны, делая их нежными, воспаленными и склонными к кровотечению.
Пародонтит
Зубной налет затвердевает до образования зубного камня (зубного камня). По мере того как зубной камень и зубной налет продолжают накапливаться, десны начинают отступать от зубов. Между деснами и зубами образуются более глубокие карманы, которые заполняются бактериями и гноем. Десны сильно раздражаются, воспаляются и легко кровоточат. Может присутствовать незначительная или умеренная потеря костной массы.
Пародонтит поздней стадии
Зубы теряют большую опору, так как десна, кости и периодонтальная связка продолжают разрушаться.Если не лечить, пораженные зубы станут очень шаткими и могут быть потеряны. Может присутствовать генерализованная потеря костной массы от умеренной до тяжелой.
Несмотря на беспрецедентные достижения в стоматологии и научные исследования, заболевания пародонта остаются серьезной проблемой для здоровья зубов. Девять из десяти человек страдают этим заболеванием в течение своей жизни. Пародонтоз, вызывающий значительную потерю зубов у взрослых, в настоящее время поражает примерно трех из четырех взрослых людей старше 40 лет.
Лечение заболеваний десен
Пародонтологи специализируются на лечении заболеваний десен и установке зубных имплантатов.Во многих случаях стоматологу-гигиенисту, возможно, придется выполнить эффективные процедуры очистки глубоких карманов, такие как удаление зубного камня и планирование корней, чтобы помочь остановить прогрессирование заболевания и подготовить ткани к операции. При лазерной терапии этот шаг может не потребоваться. Часто эту процедуру можно выполнять с помощью лазера, без резки и сшивания. Лазер генерирует крошечный луч концентрированной световой энергии. Эта энергия стерилизовала область, удаляла больные ткани и мусор, обнаруженные под десной внутри кармана.Лазерная технология уменьшает кровотечение, отек и общее время заживления.
Хирургическое лечение тяжелых зубных отложений и карманов
Хирургия пародонта — это процедура, используемая для лечения заболеваний или восстановления дефектов в тканях зубов или прилегающих областях. В случаях умеренного и запущенного пародонтита пародонтолог может выполнить множество различных процедур в зависимости от тяжести заболевания пародонта во рту. Некоторым зубам может потребоваться терапия по уменьшению карманов, в то время как другие могут получить пользу от костных трансплантатов с биологическими усилителями для ускорения естественной регенерации тканей.В более тяжелых случаях может потребоваться удаление некоторых или всех зубов для улучшения общего состояния здоровья пациента.
Лечение костного дефекта с управляемой регенерацией тканей
Раньше после удаления зубов выбор был ограничен. Однако зубные имплантаты произвели революцию в способах замены зубов. Сегодня пародонтологи могут устанавливать зубные имплантаты для поддержки одиночных зубов, мостов и протезов. Это всего лишь несколько вариантов. Найдите время, чтобы ознакомиться со всеми нашими услугами.Вы можете легко запросить консультацию онлайн или по телефону.
Профилактика заболеваний пародонта имеет решающее значение для сохранения естественных зубных рядов и улучшения вашего самочувствия. Устранение причин заболевания десен и их обсуждение со стоматологом поможет предотвратить возникновение, прогрессирование и рецидив заболевания пародонта.
Если у вас есть какие-либо вопросы или опасения по поводу причин или методов лечения заболеваний десен, пожалуйста, свяжитесь с Центром имплантологии и лазерной пародонтальной хирургии, чтобы назначить консультацию в Лас-Крусес.
Термин «пародонт» означает «вокруг зуба». Заболевание пародонта (также известное как пародонтит и заболевание десен) — это распространенное воспалительное заболевание, которое поражает поддерживающие и окружающие мягкие ткани зуба, в конечном итоге поражая саму кость челюсти на самых поздних стадиях заболевания.
Заболеваниям пародонта чаще всего предшествует гингивит, который представляет собой бактериальную инфекцию тканей десен. Бактериальная инфекция поражает десны, когда содержащиеся в зубном налете токсины начинают раздражать и воспалять ткани десен.Как только эта бактериальная инфекция колонизируется в десневых карманах между зубами, ее становится гораздо труднее удалить и лечить. Заболевания пародонта — это прогрессирующее заболевание, которое в конечном итоге приводит к разрушению соединительной ткани и челюстной кости. Если не лечить, это может привести к смещению зубов, расшатыванию зубов и, в конечном итоге, к их потере.
Заболевания пародонта являются основной причиной потери зубов среди взрослых в развитых странах, и их всегда следует лечить незамедлительно.
Типы заболеваний пародонта
При отсутствии лечения гингивит (легкое воспаление десен) может распространяться ниже линии десен.Когда десны раздражаются токсинами, содержащимися в зубном налете, хроническая воспалительная реакция заставляет организм разрушаться и разрушать собственные кости и мягкие ткани. Симптомы могут быть незначительными или отсутствовать, поскольку при пародонтозе зубы отделяются от инфицированной ткани десен. Углубляющиеся карманы между деснами и зубами обычно указывают на то, что мягкие ткани и кость разрушаются пародонтозом.
Вот некоторые из наиболее распространенных типов заболеваний пародонта:
-
Хронический пародонтит — Воспаление поддерживающих тканей вызывает глубокие карманы и рецессию десен.Может показаться, что зубы удлиняются, но на самом деле десны отступают. Это наиболее распространенная форма заболевания пародонта, характеризующаяся прогрессирующей потерей прикрепления, перемежающейся периодами быстрого прогрессирования.
-
Агрессивный пародонтит — Эта форма заболевания десен возникает у клинически здорового человека. Он характеризуется быстрой потерей прикрепления десен, хроническим разрушением костей и семейной агрегацией.
-
Некротический пародонтит — Эта форма пародонтоза чаще всего возникает у людей, страдающих такими системными заболеваниями, как ВИЧ, иммуносупрессия и недоедание. Некроз (отмирание тканей) возникает в периодонтальной связке, альвеолярной кости и тканях десен.
-
Пародонтит, вызванный системным заболеванием — Эта форма заболевания десен часто начинается в раннем возрасте.Заболевания, такие как респираторные заболевания, диабет и сердечные заболевания, являются распространенными кофакторами.
Лечение пародонтоза
Существует множество хирургических и нехирургических методов лечения, которые пародонтолог может выбрать, в зависимости от точного состояния зубов, десен и челюстной кости. Перед проведением или рекомендацией какого-либо лечения будет проведено полное пародонтальное обследование полости рта.
Вот некоторые из наиболее распространенных методов лечения заболеваний пародонта:
-
Снятие зубного камня и строгание корня — Чтобы сохранить здоровье тканей десен, необходимо удалить бактерии и зубной камень (зубной камень), которые изначально вызвали инфекцию.Карманы десен будут очищены и обработаны антибиотиками по мере необходимости, чтобы облегчить инфекцию. Ополаскиватель для рта по рецепту может быть включен в ежедневную процедуру очистки.
-
Регенерация тканей — Когда костная ткань и ткань десен разрушены, возобновление роста можно активно стимулировать с помощью процедур трансплантации. Мембрана может быть вставлена в пораженные участки, чтобы способствовать процессу регенерации.
-
Операция по удалению карманов — Операция по удалению карманов (также известная как хирургия лоскута) — это хирургическое лечение, которое может выполняться для уменьшения размера кармана между зубами и деснами.Операция на челюстной кости — еще один вариант, который служит для устранения вмятин в кости, которые способствуют колонизации бактерий.
-
Зубные имплантаты — Если зубы были потеряны из-за заболевания пародонта, эстетику и функциональность полости рта можно восстановить, имплантировав протезы зубов в кость челюсти. Перед установкой зубного имплантата могут потребоваться процедуры регенерации тканей, чтобы укрепить кость.
Пожалуйста, свяжитесь с нашим офисом, если у вас есть вопросы или опасения по поводу заболеваний пародонта, лечения пародонта или зубных имплантатов.
Местные и системные механизмы, связывающие заболевания пародонта и сопутствующие воспалительные заболевания.
Genco, R. J. & Sanz, M. Клинические и общественные последствия заболеваний пародонта и системных заболеваний: обзор. Periodontol. 2000 83 , 7–13 (2020).
PubMed Статья PubMed Central Google Scholar
Potempa, J., Mydel, P. & Koziel, J. Случай пародонтита в патогенезе ревматоидного артрита. Нац. Rev. Rheumatol. 13 , 606–620 (2017).
CAS PubMed Статья PubMed Central Google Scholar
Хаджишенгаллис, Г. Пародонтит: от микробной иммунной субверсии к системному воспалению. Нац. Rev. Immunol. 15 , 30–44 (2015).
CAS PubMed PubMed Central Статья Google Scholar
Ачарья, К., Сахингур, С. Э. и Баджадж, Дж. С. Микробиота, цирроз и возникающая ось орально-кишечник-печень. JCI Insight 2 , e94416 (2017).
PubMed Central Статья Google Scholar
Schenkein, H.A., Papapanou, P.N., Genco, R. & Sanz, M. Механизмы, лежащие в основе связи между пародонтитом и атеросклеротическим заболеванием. Periodontol. 2000 г. 83 , 90–106 (2020).
PubMed Статья PubMed Central Google Scholar
Kitamoto, S. et al. Межслизистое соединение рта и кишечника при комменсальном колите, вызванном патобионтами. Ячейка 182 , 447–462 (2020). Это исследование элегантно показывает, что специфические для оральных бактерий T H 17 клетки, которые разрастаются во время экспериментального пародонтита, получают указание мигрировать в кишечник, где они активируются перемещенными (через желудочно-кишечный тракт) бактериями полости рта и способствуют развитию колита .
CAS PubMed Статья PubMed Central Google Scholar
Abed, J.и другие. Fap2 опосредует обогащение Fusobacterium nucleatum колоректальной аденокарциномы путем связывания с экспрессируемым опухолью Gal-GalNAc. Cell Host Microbe 20 , 215–225 (2016). В этой статье объясняется тропизм F. nucleatum к CRC. Бактерия экспрессирует Gal-GalNAc-связывающий лектин (Fap2), который может связываться с полисахаридом хозяина Gal-GalNAc, который высоко экспрессируется в CRC человека.
CAS PubMed PubMed Central Статья Google Scholar
Atarashi, K. et al. Внематочная колонизация ротовыми бактериями в кишечнике стимулирует индукцию клеток Th2 и воспаление. Наука 358 , 359–365 (2017). Это первая статья, показывающая, что эктопическая колонизация кишечника бактериями орального происхождения приводит к размножению колитогенных Т-клеток и развитию колита у восприимчивого хозяина .
CAS PubMed PubMed Central Статья Google Scholar
Blasco-Baque, V. et al. Пародонтит, вызванный Porphyromonas gingivalis , вызывает дисбактериоз пародонтальной микробиоты и инсулинорезистентность через нарушение адаптивного иммунного ответа. Кишечник 66 , 872–885 (2017).
CAS PubMed Статья PubMed Central Google Scholar
Gur, C. et al. Связывание белка Fap2 Fusobacterium nucleatum с человеческим ингибиторным рецептором TIGIT защищает опухоли от атаки иммунных клеток. Иммунитет 42 , 344–355 (2015). Это исследование идентифицирует важный механизм уклонения от иммунитета с помощью F. nucleatum , который использует свой адгезин Fap2 для активации ингибирующего иммунорецептора TIGIT, который отключает активность Т-клеток и естественных клеток-киллеров по уничтожению опухолей.
CAS PubMed PubMed Central Статья Google Scholar
Dominy, S.S. et al. Porphyromonas gingivalis в мозге при болезни Альцгеймера: данные о причинах заболевания и лечении низкомолекулярными ингибиторами. Sci. Adv. 5 , eaau3333 (2019). Это исследование предоставляет убедительные клинические и экспериментальные доказательства того, что оральный патоген P. gingivalis может инфицировать мозг и способствовать воспалительной патологии при болезни Альцгеймера .
PubMed PubMed Central Статья CAS Google Scholar
Konig, M. F. et al. Aggregatibacter actinomycetemcomitans -индуцированное гиперцитруллинирование связывает пародонтальную инфекцию с аутоиммунитетом при ревматоидном артрите. Sci. Пер. Med. 8 , 369ра176 (2016). В этом исследовании показано, что пародонтальный патоген A. actinomycetemcomitans индуцирует образование цитруллинированных аутоантигенов, участвующих в ревматоидном артрите, за счет действия порообразующего лейкотоксина A (LtxA) на нейтрофилы.Антитела против LtxA тесно связаны с положительностью ACPA у пациентов с ревматоидным артритом .
PubMed PubMed Central Статья CAS Google Scholar
Meghil, M. M. et al. Нарушение иммунного гомеостаза в дендритных клетках человека посредством регуляции аутофагии и апоптоза Porphyromonas gingivalis . Фронт. Иммунол. 10 , 2286 (2019).
CAS PubMed PubMed Central Статья Google Scholar
Sato, K. et al. Обострение коллаген-индуцированного артрита при пероральном введении Porphyromonas gingivalis посредством модуляции микробиоты кишечника и иммунной системы кишечника. Sci. Отчет 7 , 6955 (2017).
PubMed PubMed Central Статья CAS Google Scholar
Farrugia, C. et al. Механизмы поражения сосудов системным распространением орального возбудителя Porphyromonas gingivalis . FEBS J. https://doi.org/10.1111/febs.15486 (2020).
Артикул PubMed PubMed Central Google Scholar
Zhao, Y. et al. Характеристика и регуляция предшественников остеокластов после хронической инфекции Porphyromonas gingivalis . J. Leukoc. Биол. 108 , 1037–1050 (2020). Это исследование определяет механизм, посредством которого костный мозг может связывать периодонтит с другими нарушениями потери костной массы.В частности, индуцированный пародонтальными бактериями сывороточный IL-6 действует в костном мозге, способствуя расширению и смещению остеокластогенных клонов популяции предшественников, которые могут перемещаться в места резорбции кости и дифференцироваться в зрелые остеокласты .
CAS PubMed Статья PubMed Central Google Scholar
Netea, M. G. et al. Определение тренированного иммунитета и его роли в здоровье и болезнях. Нац.Rev. Immunol. 20 , 375–388 (2020).
CAS PubMed Статья PubMed Central Google Scholar
Chavakis, T., Mitroulis, I. & Hajishengallis, G. Гематопоэтические клетки-предшественники как интегративные центры для адаптации и тонкой настройки воспаления. Нац. Иммунол. 20 , 802–811 (2019).
CAS PubMed PubMed Central Статья Google Scholar
D’Aiuto, F. et al. Системные эффекты лечения пародонтита у пациентов с диабетом 2 типа: 12-месячное одноцентровое рандомизированное исследование с маскировкой исследователя. Ланцет Диабет Эндокринол. 6 , 954–965 (2018). Хорошо спланированное и проведенное рандомизированное контролируемое исследование, показывающее благоприятное влияние местного пародонтального лечения на системные воспалительные маркеры, гликемический контроль, функции сосудов и почек у пациентов с сахарным диабетом 2 типа .
PubMed Статья PubMed Central Google Scholar
Ishai, A. et al. Заболевания пародонта связаны с артериальным воспалением через усиление кроветворно-артериальной оси. JACC Cardiovasc. Imaging 12 , 2271–2273 (2019). Важное клиническое исследование с визуализацией, которое коррелирует метаболическую активность / воспаление пародонта с активностью кроветворной ткани и артериальным воспалением, таким образом подтверждая гипотезу, полученную в результате экспериментальных исследований, что воспалительная адаптация кроветворных клеток-предшественников в костном мозге может связывать различные хронические воспалительные заболевания .
PubMed PubMed Central Статья Google Scholar
Teles, R. & Wang, C.-Y. Механизмы, участвующие в ассоциации между заболеваниями перидонта и сердечно-сосудистыми заболеваниями. Oral Dis. 17 , 450–461 (2011).
CAS PubMed PubMed Central Статья Google Scholar
Bajaj, J. S. et al. Пародонтальная терапия благоприятно модулирует ось орально-кишечно-печеночная при циррозе. Am. J. Physiol. Гастроинтест. Liver Physiol. 315 , G824 – G837 (2018).
PubMed PubMed Central Статья CAS Google Scholar
Xiao, E. et al. Диабет увеличивает экспрессию IL-17 и изменяет микробиом полости рта, повышая его патогенность. Cell Host Microbe 22 , 120–128 e124 (2017).
CAS PubMed PubMed Central Статья Google Scholar
Телес Ф., Ван Й., Хаджишенгаллис Г., Хастурк Х. и Марчезан Дж. Влияние системных факторов на формирование микробиома пародонта. Periodontol. 2000 г. 85 , 126–160 (2021 г.).
PubMed Статья PubMed Central Google Scholar
Monsarrat, P. et al. Клиническая исследовательская деятельность в пародонтологической медицине: систематическое отображение журналов клинических испытаний. J. Clin. Пародонтол. 43 , 390–400 (2016).
PubMed Статья PubMed Central Google Scholar
Rydén, L. et al. Пародонтит увеличивает риск первого инфаркта миокарда. Тираж 133 , 576–583 (2016).
Google Scholar
Rodríguez-Lozano, B. et al. Связь между тяжестью пародонтита и клинической активностью у пациентов с ревматоидным артритом: исследование случай – контроль. Arthritis Res. Ther. 21 , 27 (2019).
PubMed PubMed Central Статья Google Scholar
Дженко Р. Дж. И Ван Дайк Т. Е. Профилактика: снижение риска сердечно-сосудистых заболеваний у пациентов с пародонтитом. Нац. Rev. Cardiol. 7 , 479–480 (2010).
PubMed Статья PubMed Central Google Scholar
D’Aiuto, F., Orlandi, M. & Gunsolley, J. C. Доказательства того, что лечение пародонта улучшает биомаркеры и исходы сердечно-сосудистых заболеваний. J. Clin. Пародонтол. 40 , S85 – S105 (2013).
PubMed Статья PubMed Central Google Scholar
Х. Бохари, С.А. и др. Безоперационная пародонтальная терапия снижает маркеры риска ишемической болезни сердца: рандомизированное контролируемое исследование. J. Clin. Пародонтол. 39 , 1065–1074 (2012).
Артикул Google Scholar
де Оливейра, К., Ватт, Р. и Хамер, М. Чистка зубов, воспаление и риск сердечно-сосудистых заболеваний: результаты обследования состояния здоровья в Шотландии. руб. Med. J. 340 , c2451 (2010).
Артикул Google Scholar
Тонетти, М. С. Пародонтит и риск атеросклероза: обновленная информация о интервенционных испытаниях. J. Clin. Пародонтол. 36 , 15–19 (2009).
PubMed Статья PubMed Central Google Scholar
Türer Ç, C., Durmuş, D., Balli, U. & Güven, B. Влияние нехирургического лечения пародонта на десневую трещиноватую жидкость и эндокан сыворотки, фактор роста эндотелия сосудов А и опухоль уровни фактора некроза альфа. J. Periodontol. 88 , 493–501 (2017).
PubMed Статья CAS PubMed Central Google Scholar
Маммен, М. Дж., Сканнапеко, Ф. А. и Сетхи, С. Взаимодействие микробиома полости рта и легких при заболеваниях легких. Periodontol. 2000 г. 83 , 234–241 (2020).
PubMed Статья PubMed Central Google Scholar
Qin, N. et al. Изменения микробиома кишечника человека при циррозе печени. Природа 513 , 59–64 (2014).
CAS PubMed Статья PubMed Central Google Scholar
Arimatsu, K. et al. Оральный патобионт вызывает системное воспаление и метаболические изменения, связанные с изменением микробиоты кишечника. Sci. Отчет 4 , 4828 (2014).
CAS PubMed PubMed Central Статья Google Scholar
Хотамислигил Г.С. Воспаление и метаболические нарушения. Nature 444 , 860–867 (2006).
CAS PubMed Статья PubMed Central Google Scholar
Norata, G.D. et al. Клеточные и молекулярные основы трансляционного иммунометаболизма. Иммунитет 43 , 421–434 (2015).
CAS PubMed Статья PubMed Central Google Scholar
Орланди М., Грациани Ф. и Д’Айуто Ф. Пародонтологическая терапия и риск сердечно-сосудистых заболеваний. Periodontol. 2000 г. 83 , 107–124 (2020).
PubMed Статья PubMed Central Google Scholar
Genco, R.J., Graziani, F. & Hasturk, H. Влияние заболеваний пародонта на гликемический контроль, осложнения и заболеваемость сахарным диабетом. Periodontol. 2000 г. 83 , 59–65 (2020).
PubMed Статья PubMed Central Google Scholar
Джепсен, С., Суван, Дж. И Дешнер, Дж. Связь заболеваний пародонта с метаболическим синдромом и ожирением. Periodontol. 2000 г. 83 , 125–153 (2020).
PubMed Статья PubMed Central Google Scholar
Tonetti, M. S. et al. Лечение пародонтита и функции эндотелия. N. Engl. J. Med. 356 , 911–920 (2007).
CAS PubMed Статья PubMed Central Google Scholar
Desvarieux, M. et al. Изменения в клинических и микробиологических профилях пародонта связаны с увеличением толщины интима-медиа сонной артерии: эпидемиологическое исследование инфекций полости рта и сосудистых заболеваний. J. Am. Сердце доц. 2 , e000254 (2013).
PubMed PubMed Central Статья Google Scholar
Yoneda, M. et al. Участие пародонтального патогена Porphyromonas gingivalis в патогенезе неалкогольной жировой болезни печени. БМЦ Гастроэнтерол. 12 , 16 (2012).
PubMed PubMed Central Статья Google Scholar
Helenius-Hietala, J. et al. Пародонтит связан с хроническим заболеванием печени — популяционное когортное исследование. Liver Int. 39 , 583–591 (2019).
CAS PubMed Статья PubMed Central Google Scholar
Brito, L. C. W. et al. Экспериментальный пародонтит способствует преходящему воспалению сосудов и дисфункции эндотелия. Arch. Устный. Биол. 58 , 1187–1198 (2013).
CAS PubMed Статья PubMed Central Google Scholar
Matsuda, Y. et al. Пародонтит, индуцированный лигатурой, у мышей вызывает повышенный уровень циркулирующего интерлейкина-6, но оказывает лишь слабое воздействие на жировую ткань и ткани печени. J. Periodont. Res. 51 , 639–646 (2016).
CAS Статья Google Scholar
О’Бойл, К.и другие. Пародонтит, вызванный лигатурой, вызывает системное воспаление, но не влияет на острый исход после инсульта у мышей. Внутр. Дж. Инсульт 15 , 175–187 (2019).
PubMed PubMed Central Статья Google Scholar
Anbinder, A. L. et al. Заболевания пародонта усугубляют вызванную системной овариэктомией потерю костной массы у мышей. Кость 83 , 241–247 (2016).
PubMed Статья PubMed Central Google Scholar
Миядзима, С.-и. и другие. Моноциты / макрофаги, активированные пародонтитом, вызывают воспаление аорты. Sci. Отчет 4 , 5171 (2014).
CAS PubMed PubMed Central Статья Google Scholar
Hasturk, H. et al. Резолвин E1 (RvE1) ослабляет образование атеросклеротических бляшек при диете и вызванном воспалением атерогенезе. Arterioscl. Тромб. Васк. Биол. 35 , 1123–1133 (2015).
CAS PubMed Статья PubMed Central Google Scholar
Tian, J. et al. Porphyromonas gingivalis вызывает инсулинорезистентность за счет повышения уровня BCAA у мышей. J. Dent. Res. 99 , 839–846 (2020).
CAS PubMed Статья PubMed Central Google Scholar
Уайт, П. Дж. И Ньюгард, К.Б. Аминокислоты с разветвленной цепью при болезни. Наука 363 , 582–583 (2019).
CAS PubMed Статья PubMed Central Google Scholar
Chavakis, T. et al. Рецептор распознавания образов (RAGE) является контррецептором для интегринов лейкоцитов: новый путь рекрутирования воспалительных клеток. J. Exp. Med. 198 , 1507–1515 (2003).
CAS PubMed PubMed Central Статья Google Scholar
Руис, Х. Х., Рамасами, Р. и Шмидт, А. М. Передовые конечные продукты гликирования: опираясь на концепцию «общей почвы» при метаболических заболеваниях. Эндокринология 161 , 1–10 (2020).
Артикул Google Scholar
Lalla, E. et al. Блокада RAGE подавляет связанную с пародонтитом потерю костной массы у мышей с диабетом. J. Clin. Вкладывать деньги. 105 , 1117–1124 (2000).
CAS PubMed PubMed Central Статья Google Scholar
Nakahara, T. et al. Участие Porphyromonas gingivalis в прогрессировании неалкогольной жировой болезни печени. J. Gastroenterol. 53 , 269–280 (2018).
CAS PubMed Статья PubMed Central Google Scholar
Nagasaki, A. et al. Одонтогенная инфекция, вызываемая Porphyromonas gingivalis , обостряет фиброз при НАСГ за счет активации звездчатых клеток печени. Sci. Отчетность 10 , 4134 (2020).
CAS PubMed PubMed Central Статья Google Scholar
Vasconcelos, D. F. P. et al. Уменьшение перицитов связано с заболеванием печени, вызванным лигатурным периодонтитом у крыс. J. Periodontol. 88 , e49 – e57 (2017).
PubMed Статья PubMed Central Google Scholar
Tsukasaki, M. et al. Защита хозяина от микробиоты полости рта с помощью Т-клеток, повреждающих кости. Нац. Commun. 9 , 701 (2018).
PubMed PubMed Central Статья CAS Google Scholar
Komazaki, R. et al. Патогенные бактерии пародонта, Aggregatibacter actinomycetemcomitans , влияют на неалкогольную жировую болезнь печени, изменяя микробиоту кишечника и метаболизм глюкозы. Sci.Отчет 7 , 13950 (2017).
PubMed PubMed Central Статья CAS Google Scholar
Кинг, К. Ю. и Гуделл, М. А. Воспалительная модуляция HSC: рассмотрение HSC как основы иммунного ответа. Нац. Rev. Immunol. 11 , 685 (2011).
CAS PubMed PubMed Central Статья Google Scholar
Yamamoto, R. et al. Клональный анализ открывает самообновляющиеся предшественники с ограниченным клонированием, полученные непосредственно из гемопоэтических стволовых клеток. Cell 154 , 1112–1126 (2013).
CAS PubMed Статья PubMed Central Google Scholar
Цукасаки, М. и Такаянаги, Х. Остеоиммунология: развивающиеся концепции взаимодействия костей и иммунитета при здоровье и болезнях. Нац. Rev. Immunol. 19 , 626–642 (2019).
CAS PubMed Статья PubMed Central Google Scholar
Herrera, B. S. et al. Мононуклеарные фагоциты периферической крови пациентов с хроническим пародонтитом предназначены для образования остеокластов. J. Periodontol. 85 , e72 – e81 (2014).
PubMed Статья PubMed Central Google Scholar
Манц, М.G. & Boettcher, S. Неотложный гранулопоэз. Нац. Rev. Immunol. 14 , 302–314 (2014).
CAS PubMed Статья PubMed Central Google Scholar
Arts, R. J. W. et al. Вакцинация БЦЖ защищает людей от экспериментальной вирусной инфекции за счет индукции цитокинов, связанных с тренированным иммунитетом. Cell Host Microbe 23 , 89–100 (2018).
CAS PubMed PubMed Central Статья Google Scholar
Mitroulis, I. et al. Модуляция предшественников миелопоэза — неотъемлемый компонент тренированного иммунитета. Cell 172 , 147–161 (2018). Это исследование показывает, что тренированный иммунитет может быть инициирован в костном мозге посредством длительных метаболических и транскрипционных адаптаций в HSPCs, которые приводят к усилению миелопоэза .
CAS PubMed PubMed Central Статья Google Scholar
Pietras, E. M. et al. Хроническое воздействие интерлейкина-1 приводит гематопоэтические стволовые клетки к преждевременной миелоидной дифференцировке за счет самообновления. Нац. Cell Biol. 18 , 607–618 (2016).
CAS PubMed PubMed Central Статья Google Scholar
Fifer, K. M. et al. Измерение поглощения 18F-фтордезоксиглюкозы пародонтом с помощью позитронно-эмиссионной томографии связано с гистологически определяемым воспалением каротидных бляшек. J. Am. Coll. Кардиол. 57 , 971–976 (2011).
PubMed Статья PubMed Central Google Scholar
Линг М. Р., Чаппл И. Л. и Мэтьюз Дж. Б. Гиперреактивность нейтрофильных цитокинов периферической крови при хроническом периодонтите. Врожденный иммунитет. 21 , 714–725 (2015).
CAS PubMed Статья PubMed Central Google Scholar
Радвар, М., Таваккол-Афшари, Дж., Баджестан, М. Н., Насех, М. Р. и Араб, Х. Р. Влияние пародонтального лечения на выработку ИЛ-6 моноцитами периферической крови у пациентов с агрессивным пародонтитом и хроническим пародонтитом. Иран. J. Immunol. 5 , 100–106 (2008).
CAS PubMed PubMed Central Google Scholar
Kleinnijenhuis, J. et al. Бацилла Кальметта-Герена индуцирует NOD2-зависимую неспецифическую защиту от повторного заражения посредством эпигенетического репрограммирования моноцитов. Proc. Natl Acad. Sci. США 109 , 17537–17542 (2012).
CAS PubMed Статья PubMed Central Google Scholar
Cirovic, B. et al. Вакцинация БЦЖ у людей вызывает выработанный иммунитет через компартмент гематопоэтических предшественников. Cell Host Microbe 28 , 322–334 (2020). Это исследование показывает, что вакцинация БЦЖ у людей вызывает стойкое транскриптомное миелоидное смещение в HSPC, связанное с долгосрочным повышенным ответом циркулирующих миелоидных клеток на воспалительные стимулы, тем самым делая выводы Mitroulis et al.(2018).
CAS PubMed PubMed Central Статья Google Scholar
Bernelot Moens, S.J. et al. Неожиданная стенка артерии и клеточное воспаление у пациентов с ревматоидным артритом в стадии ремиссии с использованием биологической терапии: поперечное исследование. Arthritis Res. Ther. 18 , 115 (2016).
PubMed PubMed Central Статья CAS Google Scholar
Шлосс, М. Дж., Свирски, Ф. К. и Нахрендорф, М. Модифицируемый сердечно-сосудистый риск, кроветворение и врожденный иммунитет. Circ. Res. 126 , 1242–1259 (2020).
CAS PubMed Статья PubMed Central Google Scholar
Christ, A. et al. Западная диета запускает NLRP3-зависимое репрограммирование врожденного иммунитета. Cell 172 , 162–175 (2018).
CAS PubMed PubMed Central Статья Google Scholar
Bekkering, S. et al. Тренированный иммунитет: связь ожирения и сердечно-сосудистых заболеваний на протяжении всей жизни? Trends Endocrinol. Метаб. 31 , 378–389 (2020).
CAS PubMed Статья PubMed Central Google Scholar
Pink, C. et al. Продольные эффекты маркеров системного воспаления на периодонтит. J. Clin. Пародонтол. 42 , 988–997 (2015).
CAS PubMed Статья PubMed Central Google Scholar
Райт, Х. Дж., Мэтьюз, Дж. Б., Чаппл, И. Л., Линг-Маунтфорд, Н. и Купер, П. Р. Пародонтит связан с сигнатурой IFN 1 типа в нейтрофилах периферической крови. J. Immunol. 181 , 5775–5784 (2008).
CAS PubMed Статья PubMed Central Google Scholar
Kalafati, L. et al. Врожденная иммунная тренировка гранулопоэза способствует противоопухолевой активности. Ячейка 183 , 771–785 (2020).
CAS PubMed PubMed Central Статья Google Scholar
Rafferty, B. et al. Влияние моноцитарных клеток на восстановление некультивируемых бактерий из атеросклеротических поражений. J. Intern. Med. 270 , 273–280 (2011).
CAS PubMed PubMed Central Статья Google Scholar
Козаров Е.В., Дорн Б.R., Shelburne, C.E., Dunn, W.A. Jr, Progulske-Fox, A. Человеческая атеросклеротическая бляшка содержит жизнеспособные инвазивные Actinobacillus actinomycetemcomitans и Porphyromonas gingivalis . Артериосклер. Тромб. Васк. Биол. 25 , e17 – e18 (2005).
CAS PubMed Статья PubMed Central Google Scholar
Carrion, J. et al. Состояние микробного носительства дендритных клеток (ДК) периферической крови при хроническом периодонтите влияет на дифференцировку ДК, атерогенный потенциал. J. Immunol. 189 , 3178–3187 (2012).
CAS PubMed PubMed Central Статья Google Scholar
Gevers, D. et al. Микробиом, ранее не получавший лечения, при впервые возникшей болезни Крона. Cell Host Microbe 15 , 382–392 (2014).
CAS PubMed PubMed Central Статья Google Scholar
Schirmer, M. et al. Изменения состава и времени в микробиоме кишечника пациентов с язвенным колитом у детей связаны с течением заболевания. Cell Host Microbe 24 , 600–610.e604 (2018). Gevers et al. и Schirmer et al. демонстрируют, что доминирующие виды с повышенной численностью у педиатрических пациентов с ВЗК на самом деле происходят из полости рта, а не являются типичными кишечными бактериями .
CAS PubMed PubMed Central Статья Google Scholar
Ламонт, Р. Дж., Ку, Х. и Хаджишенгаллис, Г. Микробиота полости рта: динамические сообщества и взаимодействия с хозяином. Нац. Rev. Microbiol. 16 , 745–759 (2018).
CAS PubMed PubMed Central Статья Google Scholar
Gimbrone, M. A. Jr & García-Cardeña, G. Дисфункция эндотелиальных клеток и патобиология атеросклероза. Circ. Res. 118 , 620–636 (2016).
CAS PubMed PubMed Central Статья Google Scholar
Mougeot, J. C. et al. Porphyromonas gingivalis — самый распространенный вид, обнаруживаемый в коронарных и бедренных артериях. J. Oral Microbiol. 9 , 1281562 (2017).
PubMed PubMed Central Статья CAS Google Scholar
Диогарди, М.и другие. Роль пародонтита и пародонтальных бактерий в возникновении и прогрессировании болезни Альцгеймера: систематический обзор. J. Clin. Med. 9 , 495 (2020).
CAS PubMed Central Статья Google Scholar
Beydoun, M. A. et al. Клинические и бактериальные маркеры пародонтита и их связь с общей деменцией и деменцией, вызванной болезнью Альцгеймера, в большом национальном исследовании. J. Alzheimers Dis. 75 , 157–172 (2020).
CAS PubMed Статья PubMed Central Google Scholar
Kovacech, B. & Novak, M. Усечение тау является продуктивной посттрансляционной модификацией нейрофибриллярной дегенерации при болезни Альцгеймера. Curr. Alzheimer Res. 7 , 708–716 (2010).
CAS PubMed Статья PubMed Central Google Scholar
Лонг, Дж. М. и Хольцман, Д. М. Болезнь Альцгеймера: обновленная информация о патобиологии и стратегиях лечения. Ячейка 179 , 312–339 (2019).
CAS PubMed PubMed Central Статья Google Scholar
Муньос, С. С., Гарнер, Б. и Оои, Л. Понимание роли фрагментов ApoE в болезни Альцгеймера. Neurochem. Res. 44 , 1297–1305 (2019).
PubMed Статья CAS PubMed Central Google Scholar
Lönn, J. et al. Модификации липопротеинов гингипаинами Porphyromonas gingivalis . J. Periodont. Res. 53 , 403–413 (2018).
PubMed Central Статья CAS Google Scholar
Poole, S. et al. Активная инвазия Porphyromonas gingivalis и вызванная инфекцией активация комплемента в головном мозге мышей ApoE — / — . J. Alzheimers Dis. 43 , 67–80 (2015).
CAS PubMed Статья PubMed Central Google Scholar
Hajishengallis, G., Reis, E. S., Mastellos, D. C., Ricklin, D. & Lambris, J. D. Новые механизмы и функции комплемента. Нац. Иммунол. 18 , 1288–1298 (2017).
CAS PubMed PubMed Central Статья Google Scholar
Инь, К.и другие. АпоЕ ослабляет неразрешимое воспаление за счет образования комплекса с активированным C1q. Нац. Med. 25 , 496–506 (2019).
CAS PubMed PubMed Central Статья Google Scholar
Kantarci, A. et al. Комбинированное введение резолвина E1 и липоксина A4 устраняет воспаление на мышиной модели болезни Альцгеймера. Exp. Neurol. 300 , 111–120 (2018).
CAS PubMed Статья PubMed Central Google Scholar
Kantarci, A. et al. Микроглиальный ответ на экспериментальный пародонтит на мышиной модели болезни Альцгеймера. Sci. Реп. 10 , 18561 (2020).
CAS PubMed PubMed Central Статья Google Scholar
Papageorgiou, S. N. et al. Воспалительное заболевание кишечника и здоровье полости рта: систематический обзор и метаанализ. J. Clin. Пародонтол. 44 , 382–393 (2017).
PubMed Статья PubMed Central Google Scholar
Pietropaoli, D. et al. Возникновение спонтанного заболевания пародонта на мышиной модели болезни Крона SAMP1 / YitFc. J. Periodontol. 85 , 1799–1805 (2014).
PubMed PubMed Central Статья Google Scholar
Moran, C.J. et al. Полиморфизм IL-10R связан с очень ранним язвенным колитом. Inflamm. Кишечник. 19 , 115–123 (2013).
PubMed PubMed Central Статья Google Scholar
Schmidt, T. S. et al. Обширная передача микробов по желудочно-кишечному тракту. eLife 8 , e42693 (2019).
PubMed PubMed Central Статья Google Scholar
Ячида, С.и другие. Метагеномный и метаболомный анализы выявляют различные стадийно-специфические фенотипы кишечной микробиоты при колоректальном раке. Нац. Med. 25 , 968–976 (2019).
CAS Статья Google Scholar
Thomas, A. M. et al. Метагеномный анализ наборов данных о колоректальном раке определяет микробные диагностические сигнатуры кросс-когорт и связь с деградацией холина. Нац. Med. 25 , 667–678 (2019).
CAS PubMed Статья PubMed Central Google Scholar
Kostic, A. D. et al. Fusobacterium nucleatum усиливает онкогенез кишечника и модулирует иммунное к опухоли микроокружение. Клеточный микроб-хозяин 14 , 207–215 (2013).
CAS PubMed PubMed Central Статья Google Scholar
Wirbel, J. et al. Мета-анализ фекальных метагеномов выявляет глобальные микробные сигнатуры, специфичные для колоректального рака. Нац. Med. 25 , 679–689 (2019).
CAS PubMed Статья PubMed Central Google Scholar
Castellarin, M. et al. Инфекция Fusobacterium nucleatum широко распространена при колоректальной карциноме человека. Genome Res. 22 , 299–306 (2012).
CAS PubMed PubMed Central Статья Google Scholar
Kostic, A. D. et al. Геномный анализ идентифицирует ассоциацию Fusobacterium с колоректальной карциномой. Genome Res. 22 , 292–298 (2012).
CAS PubMed PubMed Central Статья Google Scholar
Фигеро, Э., Хан, Ю.W. & Furuichi, Y. Заболевания пародонта и неблагоприятные исходы беременности: механизмы. Periodontol. 2000 г. 83 , 175–188 (2020).
PubMed Статья PubMed Central Google Scholar
Rubinstein, M. R. et al. Fusobacterium nucleatum способствует колоректальному канцерогенезу, модулируя передачу сигналов E-кадгерин / β-катенин через свой адгезин FadA. Клеточный микроб-хозяин 14 , 195–206 (2013).
CAS PubMed PubMed Central Статья Google Scholar
Casasanta, M. A. et al. Fusobacterium nucleatum Связывание и инвазия клетки-хозяина индуцирует секрецию IL-8 и CXCL1, которая стимулирует миграцию клеток колоректального рака. Sci. Сигнал. 13 , eaba9157 (2020). Это исследование идентифицирует новый механизм, связывающий F. nucleatum с CRC, показывая, что эта оральная бактерия способствует секреции хемокинов, которые стимулируют миграцию и инвазию опухолевых клеток .
CAS PubMed PubMed Central Статья Google Scholar
Yu, T. et al. Fusobacterium nucleatum способствует химической устойчивости к колоректальному раку, модулируя аутофагию. Cell 170 , 548–563 (2017). Эта статья показывает, что F. nucleatum отрицательно влияет на химиотерапевтический ответ CRC, модулируя аутофагию .
CAS PubMed PubMed Central Статья Google Scholar
Комия Ю. и др. Пациенты с колоректальным раком имеют идентичные штаммы Fusobacterium nucleatum при колоректальном раке и в полости рта. Кишечник 68 , 1335–1337 (2019).
PubMed Статья PubMed Central Google Scholar
Abed, J. et al. Связанный с раком толстой кишки Fusobacterium nucleatum может происходить из полости рта и достигать опухолей толстой кишки через систему кровообращения. Фронт. Cell Infect. Microbiol. 10 , 400 (2020).
CAS PubMed PubMed Central Статья Google Scholar
Нинг, Ю. и Ленц, Х. Дж. Нацеливание на IL-8 при колоректальном раке. Эксперт. Opin. Ther. Задачи 16 , 491–497 (2012).
CAS PubMed Статья PubMed Central Google Scholar
Рубинштейн, М. Р. и др. Fusobacterium nucleatum способствует развитию колоректального рака путем индукции модулятора Wnt / β-катенина аннексина A1. Представитель EMBO 20 , e47638 (2019).
PubMed PubMed Central Статья CAS Google Scholar
Sun, J. et al. Роль микробиоты полости рта в развитии и прогрессировании рака. Cancer Med. 9 , 6306–6321 (2020).
PubMed PubMed Central Статья Google Scholar
Hashimoto, M. et al. Пародонтит и Porphyromonas gingivalis в доклинической стадии у больных артритом. PLoS ONE 10 , e0122121 (2015).
PubMed PubMed Central Статья CAS Google Scholar
Mikuls, T. R. et al. Пародонтит и Porphyromonas gingivalis у пациентов с ревматоидным артритом. Arthritis Rheumatol. 66 , 1090–1100 (2014).
PubMed PubMed Central Статья Google Scholar
Аль-Катма, М. К., Бисада, Н. Ф., Бордо, Дж. М., Сью, Дж. И Аскари, А. Д. Контроль за инфекцией пародонта снижает тяжесть активного ревматоидного артрита. J. Clin. Ревматол. 13 , 134–137 (2007).
PubMed Статья PubMed Central Google Scholar
Khare, N. et al. Нехирургическая пародонтальная терапия снижает тяжесть ревматоидного артрита: исследование случай-контроль. J. Contemp. Вмятина. Практик. 17 , 484–488 (2016).
PubMed Статья PubMed Central Google Scholar
Ortiz, P. et al. Пародонтальная терапия снижает тяжесть активного ревматоидного артрита у пациентов, получавших или не принимавших ингибиторы фактора некроза опухоли. Дж.Пародонтол. 80 , 535–540 (2009).
CAS PubMed PubMed Central Статья Google Scholar
Maresz, K. J. et al. Porphyromonas gingivalis способствует развитию и прогрессированию деструктивного артрита благодаря своей уникальной бактериальной пептидиларгининдеиминазе (PAD). PLoS Pathog. 9 , e1003627 (2013).
CAS PubMed PubMed Central Статья Google Scholar
Gully, N. et al. Porphyromonas gingivalis пептидиларгининдезиминаза, ключевой фактор в патогенезе экспериментальных заболеваний пародонта и экспериментального артрита. PLoS ONE 9 , e100838 (2014). Maresz et al. — первое исследование, которое механически связывает пародонтальный патоген ( P. gingivalis ) с образованием цитруллинированных аутоантигенов, которые участвуют в патогенезе ревматоидного артрита.Gully et al. обеспечивают независимое подтверждение того, что пептидиларгининдезиминаза P. gingivalis способствует индукции ACPA и экспериментального артрита .
PubMed PubMed Central Статья CAS Google Scholar
Wegner, N. et al. Пептидиларгининдезиминаза из Porphyromonas gingivalis citrullinates человеческий фибриноген и альфа-енолаза: последствия для аутоиммунитета при ревматоидном артрите. Arthritis Rheumatol. 62 , 2662–2672 (2010).
CAS Статья Google Scholar
Lübcke, P. M. et al. Пародонтологическое лечение предотвращает артрит у мышей, а метотрексат улучшает потерю пародонтальной костной массы. Sci. Отчетность 9 , 8128 (2019).
PubMed PubMed Central Статья CAS Google Scholar
Flak, M. B. et al. Воспалительный артрит нарушает механизмы рассасывания кишечника, способствуя разрушению барьера Porphyromonas gingivalis . JCI Insight 4 , e125191 (2019).
PubMed Central Статья Google Scholar
Бояка, П. Н. и Фуджихаши, К. в Клиническая иммунология (пятое издание) (ред. Рич, Р. Р. и др.) 285–298 (Elsevier, 2019).
Гилл, Н., Влодарска, М. и Финлей, Б. Б. Будущее иммунологии слизистых оболочек: изучение интегрированного общесистемного органа. Нац. Иммунол. 11 , 558–560 (2010).
CAS PubMed Статья PubMed Central Google Scholar
Скрибано, М. Л. Ведолизумаб при воспалительном заболевании кишечника: от рандомизированных контролируемых испытаний до реальных доказательств. World J. Gastroenterol. 24 , 2457–2467 (2018).
CAS PubMed PubMed Central Статья Google Scholar
Calderón-Gómez, E. et al. Комменсал-специфические клетки CD4 + от пациентов с болезнью Крона имеют воспалительный профиль Т-хелперов 17. Гастроэнтерология 151 , 489–500 (2016).
PubMed Статья CAS PubMed Central Google Scholar
Wang, J. et al. Инфекция, вызванная вирусом респираторного гриппа, вызывает повреждение иммунной системы кишечника из-за опосредованного микробиотой воспаления, зависимого от клеток Th27. J. Exp. Med. 211 , 2397–2410 (2014).
CAS PubMed PubMed Central Статья Google Scholar
Д’Амико, Ф., Баумгарт, Д. К., Данезе, С. и Пейрин-Бируле, Л. Диарея во время инфекции COVID-19: патогенез, эпидемиология, профилактика и лечение. Clin. Гастроэнтерол. Гепатол. 18 , 1663–1672 (2020).
PubMed PubMed Central Статья CAS Google Scholar
Miles, B. et al. Фенотип вторичного лимфоидного самонаведения миелоидных дендритных клеток человека, нарушенный внутриклеточным оральным патогеном. Заражение. Иммун. 82 , 101–111 (2014).
PubMed PubMed Central Статья CAS Google Scholar
Sainz, J. & Sata, M. CXCR4, ключевой модулятор сосудистых клеток-предшественников. Артериосклер. Тромб. Васк. Биол. 27 , 263–265 (2007).
CAS PubMed Статья PubMed Central Google Scholar
Rajendran, M. et al. Системная антибактериальная терапия снижает циркулирующие воспалительные дендритные клетки и пластичность Treg-Th27 при пародонтите. J. Immunol. 202 , 2690–2699 (2019).
CAS PubMed PubMed Central Статья Google Scholar
Chen, M. et al. Апоптоз дендритных клеток в поддержании иммунной толерантности. Наука 311 , 1160–1164 (2006).
CAS PubMed Статья PubMed Central Google Scholar
Хаджишенгаллис, Г., Чавакис, Т. и Ламбрис, Дж. Д. Современное понимание патогенеза заболеваний пародонта и целей для терапии с модуляцией хозяина. Periodontol. 2000 84 , 14–34 (2020).
PubMed Статья PubMed Central Google Scholar
Ридкер П. М. и др. Противовоспалительная терапия канакинумабом при атеросклеротическом заболевании. N. Engl. J. Med. 377 , 1119–1131 (2017).
CAS PubMed Статья PubMed Central Google Scholar
Джайсвал, С. и Либби, П. Клональный гемопоэз: связь старения и воспаления при сердечно-сосудистых заболеваниях. Нац. Rev. Cardiol. 17 , 137–144 (2020).
PubMed Статья PubMed Central Google Scholar
Fuster, J. J. et al. Клональный гемопоэз, связанный с дефицитом ТЕТ2, ускоряет развитие атеросклероза у мышей. Наука 355 , 842–847 (2017). Это исследование предоставляет причинно-следственные доказательства связи CHIP с атеросклерозом. Авторы показывают, что атеросклероз прогрессирует быстрее у мышей, которым трансплантированы TET2-дефицитные клетки костного мозга, что в значительной степени объясняется повышенной воспалительной активностью TET2-дефицитного потомства макрофагов .
CAS PubMed PubMed Central Статья Google Scholar
Eskan, M. A. et al. Антагонист интегрина лейкоцитов Del-1 ингибирует опосредованную IL-17 воспалительную потерю костной массы. Нац. Иммунол. 13 , 465–473 (2012).
CAS PubMed PubMed Central Статья Google Scholar
Shin, J. et al. DEL-1 сдерживает остеокластогенез и подавляет воспалительную потерю костной массы у нечеловеческих приматов. Sci. Пер. Med. 7 , 307ра155 (2015).
PubMed PubMed Central Статья CAS Google Scholar
Kourtzelis, I. et al. DEL-1 способствует эффероцитозу макрофагов и устранению воспаления. Нац. Иммунол. 20 , 40–49 (2019).
CAS PubMed Статья PubMed Central Google Scholar
Li, X. et al. Ось интегрина DEL-1 / β3 способствует ответам регуляторных Т-клеток во время разрешения воспаления. J. Clin. Вкладывать деньги. 130 , 6261–6277 (2020).
CAS PubMed Статья PubMed Central Google Scholar
Mitroulis, I. et al. Секретируемый белок Del-1 регулирует миелопоэз в нише гемопоэтических стволовых клеток. J. Clin. Вкладывать деньги. 127 , 3624–3639 (2017).
PubMed PubMed Central Статья Google Scholar
Adler, C.J. et al. Секвенирование древних кальцинированных зубных отложений показывает изменения в микробиоте полости рта с изменениями в питании эпохи неолита и промышленной революции. Нац. Genet. 45 , 450–455 (2013).
CAS PubMed PubMed Central Статья Google Scholar
Peres, M. A. et al. Заболевания полости рта: глобальная проблема общественного здравоохранения. Ланцет 394 , 249–260 (2019).
PubMed PubMed Central Статья Google Scholar
Dutzan, N. et al. Дисбиотический микробиом запускает клетки Th27, чтобы опосредовать иммунопатологию слизистой оболочки полости рта у мышей и людей. Sci. Пер. Med. 10 , eaat0797 (2018).
PubMed PubMed Central Статья CAS Google Scholar
Абэ Т. и Хаджишенгаллис Г. Оптимизация модели пародонтита, индуцированного лигатурой, у мышей. J. Immunol. Методы 394 , 49–54 (2013).
CAS PubMed PubMed Central Статья Google Scholar
Hajishengallis, G. et al. Малочисленные виды биопленок организуют воспалительные заболевания пародонта через комменсальную микробиоту и комплемент. Cell Host Microbe 10 , 497–506 (2011).
CAS PubMed PubMed Central Статья Google Scholar
Payne, M. A. et al. Горизонтальный и вертикальный перенос микробного дисбактериоза полости рта и заболеваний пародонта. J. Dent. Res. 98 , 1503–1510 (2019).
CAS PubMed Статья PubMed Central Google Scholar
Пенков С., Митроулис И., Хаджишенгаллис Г. и Чавакис Т. Иммунометаболические перекрестные помехи: унаследованный принцип тренированного иммунитета? Trends Immunol. 40 , 1–11 (2019).
CAS PubMed Статья PubMed Central Google Scholar
Kaufmann, E. et al. БЦЖ обучает кроветворные стволовые клетки создавать защитный врожденный иммунитет против туберкулеза. Ячейка 172 , 176–190 (2018).
CAS PubMed Статья PubMed Central Google Scholar
Нахрендорф, М. Вклад миелоидных клеток в здоровье и болезни сердечно-сосудистой системы. Нац. Med. 24 , 711–720 (2018).
CAS PubMed PubMed Central Статья Google Scholar
Мерфи А. Дж. И Толл А. Р. Нарушение кроветворения и атеротромбоз. евро. Heart J. 37 , 1113–1121 (2016).
PubMed PubMed Central Статья Google Scholar
Барретт Т. Дж., Мерфи А. Дж., Голдберг И. Дж. И Фишер Е. А. Диабет-опосредованный миелопоэз и связь с риском сердечно-сосудистых заболеваний. Ann. Акад. Sci. 1402 , 31–42 (2017).
PubMed PubMed Central Статья Google Scholar
Толл А. Р. и Иван-Шарве Л. Холестерин, воспаление и врожденный иммунитет. Нац. Rev. Immunol. 15 , 104–116 (2015).
CAS PubMed PubMed Central Статья Google Scholar
Антагонисты интерлейкина-1 уменьшают воспаление и потерю тканей, вызванные патогенами пародонта | Журнал инфекционных болезней
Аннотация
Заболевания пародонта — серьезная причина потери зубов у взрослых.Он инициируется патогенными бактериями, которые вызывают воспалительную реакцию, которая эффективно предотвращает значительную микробную колонизацию тканей десны. У некоторых людей реакция на бактерии может привести к чрезмерной реакции хозяина, что приведет к разрушению тканей пародонта. Недавние разработки предполагают, что генетический полиморфизм интерлейкина (IL) -1 может идентифицировать определенных людей, которые имеют предрасположенность к нарушению пародонта, и что повышенные уровни IL-1 обнаруживаются у людей с заболеваниями пародонта.Однако нет прямых доказательств того, что IL-1 сам по себе ответственен за критические события, возникающие при пародонтите. Мы исследовали роль ИЛ-1 в заболеваниях пародонта на модели приматов Macaca fascicularis , используя человеческий растворимый рецептор ИЛ-1 типа I в качестве специфического ингибитора. Результаты показывают, что ингибирование одного только ИЛ-1 значительно снижает воспаление, потерю прикрепления соединительной ткани и резорбцию кости, которые вызваны патогенами пародонта
Пародонтит — это инфекционное заболевание, которое приводит к разрушению структур, поддерживающих зубы, а именно, прикрепления к зубам альвеолярной кости и соединительной ткани.По оценкам, 15–35% взрослого населения США страдает этим многофакторным заболеванием, которое является важной причиной потери зубов в этой популяции [1, 2]. Заболевание пародонта инициируется бактериальной колонизацией поверхности зуба, которая вызывает иммуновоспалительную реакцию в прилегающих тканях хозяина. Хотя бактериальные патогены необходимы для инициирования процесса заболевания, стало очевидно, что одного их присутствия недостаточно, чтобы вызвать степень разрушения тканей, которая возникает при пародонтите [2, 3]
Интерлейкин (ИЛ) -1 является провоспалительным цитокином. который выполняет широкий спектр биологических функций и напрямую регулирует несколько генов, экспрессируемых во время воспаления.Существуют 2 основные формы IL-1, которые обладают агонистической активностью (IL-1α и IL-1β), и третий лиганд (антагонист рецептора IL-1), который действует как конкурентный ингибитор [4]. IL-1α и IL-1β обладают сходной биологической активностью, которая обусловлена их способностью связываться с высокоаффинными рецепторами на поверхности клеток-мишеней, обозначенными как «рецептор IL-1 типа I» (IL-1RI) и «IL- 1 рецептор типа II »(IL-1RII) [4–7]. IL-1RI и его корецептор, известный как «дополнительный белок рецептора IL-1», ответственны за передачу сигнала в IL-1-чувствительных клетках [5, 6].Сообщалось, что IL-1RII, который имеет минорный внутриклеточный домен, действует в основном как рецептор-ловушка [7], хотя есть сообщения, что он может опосредовать клеточную активность [8]. IL-1RII может отщепляться от поверхности клетки в местах воспаления, чтобы действовать как эндогенный ингибитор IL-1 [7]
Биологические эффекты IL-1 участвуют в патогенезе нескольких патологических состояний, включая астму [ 9], застойной сердечной недостаточности [10], артрита [11], септического шока [12] и преждевременных родов [13].Существует несколько доказательств, указывающих на участие IL-1 в патогенезе заболеваний пародонта. IL-1 продуцируется в нескольких типах клеток-хозяев, обнаруженных в пародонтальной среде, в ответ на пародонтальные патогены или их продукты, такие как липополисахарид [14, 15]. Более того, уровни ИЛ-1 высоки в тех местах, где присутствует пародонтоз [16, 17]. Недавно сообщалось, что генетический полиморфизм в локусе гена IL-1 может идентифицировать людей, предрасположенных к пародонтиту, хотя существуют разногласия относительно того, какой вариант гена IL-1 придает восприимчивость [18–20]
Чтобы определить, является ли Экспрессия ИЛ-1 сама по себе является значимым фактором при пародонтите, индуцированном бактериями, были проведены эксперименты, в которых активность ИЛ-1 ингибировалась лечением растворимым ИЛ-1RI (sIL-1RI) на модели экспериментального пародонтита приматов, отличных от человека. .Результаты показывают, что ингибирование IL-1 значительно снижает прогрессирование воспаления в сторону альвеолярной кости и деструктивные эффекты патогенов пародонта
Материалы и методы
Схема эксперимента Человеческий sIL-1RI, использованный в этих экспериментах, был щедро предоставлен Immunex и описан в [21]. Эксперименты на животных были одобрены Комитетом по уходу и использованию животных в Медицинском центре Бостонского университета.Использовалась модель пародонтоза Macaca fascicularis , в которой шелковые лигатуры обвязывали вокруг задних зубов, чтобы вызвать накопление зубного налета и возникновение пародонтита. Считается, что эта модель превосходит другие модели на животных, потому что она демонстрирует клинические и гистологические особенности, сходные с болезненным состоянием у людей, и потому, что разрушение пародонта явно вызывается бактериальной инфекцией [22]. Обследованы девять животных (возрастной диапазон 3–6 лет). Три животных были убиты в нулевой момент времени для проведения исходных измерений.Экспериментальный периодонтит был вызван у оставшихся 6 животных путем завязывания шелковых лигатур, инокулированных Porphyromonas gingivalis (штамм A7436), вокруг задних зубов нижней челюсти, как описано в другом месте [23]. Трем животным (экспериментальная группа) вводили sIL-1RI (6 мкг на инъекцию) в десну задних зубов, а 3 животных (контрольная группа) получали инъекции стерильного PBS. Каждую инъекцию вводили локально в межзубные сосочки 3 раза в неделю в течение 6 недель
Подготовка образца Блок-секции задних секстантов нижней челюсти иссекали и фиксировали в 4% параформальдегиде в течение 2 дней при 4 ° C.Интерпроксимальные области между первым и вторым премолярами и вторым премоляром и первым моляром правой и левой сторон нижней челюсти декальцинировали путем погружения в холодный Immunocal (Decal) на 2 недели и готовили для криостата. Срезы вырезали параллельно длинной оси зубов по средней линии межзубной области и окрашивали гематоксилин-эозином
Гистоморфометрический анализ Мононуклеарные воспалительные клетки были идентифицированы как круглые, окрашенные гематоксилином клетки темно-синего цвета с конденсированными ядрами и небольшой цитоплазмой. и были легко отличимы от удлиненных фибробластических клеток, гистиоцитов и эндотелиальных клеток.Фронт воспаления определялся как поля ближайшей альвеолярной кости, которые имели минимум 10 воспалительных клеток на поле при большом увеличении (× 500), как мы описали в другом месте [24]. Как расстояние между полем, ближайшим к альвеолярной кости, и костью, так и среднее расстояние между полями воспалительного фронта и альвеолярной кости измеряли с помощью компьютерной системы анализа изображений. Количество воспалительных клеток в непосредственной близости от кости измеряли, как описано в [25].Утрата прикрепления соединительной ткани определялась как расстояние от цементно-эмалевого соединения до самого коронарного протяжения прикрепления соединительной ткани. Потеря костной массы рассчитывалась путем вычитания расстояния между линией, соединяющей 2 противоположных цементно-эмалевых соединения, и наибольшей корональной протяженностью костного гребня в нулевой момент времени из среднего расстояния между этими точками за 6-недельный период. Гистологические ориентиры показаны на рисунке 1. Гистоморфометрический анализ выполняли с использованием программного обеспечения Image ProPlus (Media Cybernetics).Измерения проводились одним слепым исследователем, и значения рассчитывались на основе этих результатов. Примерно 25% образцов были случайным образом отобраны для повторного исследования, и результаты, как правило, были в пределах 15% от исходного значения
.Рисунок 1
Гистология пародонта при здоровье и болезнях. A Нормальный пародонт с гистологическими признаками, обозначенными стрелками. B Влияние заболеваний пародонта на гистологические признаки пародонта.Обратите внимание на уменьшение длины прикрепления соединительной ткани и уменьшение высоты кости, которые вызваны заболеванием пародонта.
Рисунок 1
Гистология пародонта в состоянии здоровья и болезни. A Нормальный пародонт с гистологическими признаками, обозначенными стрелками. B Влияние заболеваний пародонта на гистологические признаки пародонта. Обратите внимание на уменьшение длины прикрепления соединительной ткани и уменьшение высоты кости, вызванные пародонтозом.
Статистический анализ Гистоморфометрические данные были рассчитаны для каждого блока (6 блоков на группу).Статистическая значимость определялась дисперсионным анализом с использованием множественного сравнения Шеффе в качестве апостериорного теста. P <0,05 считалось значимым
Результаты
Заболевание пародонта вызывается бактериями, которые колонизируют поверхность зуба и вызывают воспалительную реакцию, которая, как считается, ответственна за последующее повреждение тканей. Важным признаком является прогрессирование воспалительного инфильтрата из области, расположенной ниже эпителия, в сторону альвеолярной кости.Чтобы установить взаимосвязь между возникновением пародонтита и появлением воспалительного инфильтрата, для каждого образца измеряли расстояние между фронтом воспаления и поверхностью альвеолярной кости (рис. 2). В группе животных с пародонтитом, не получавших лечения, это расстояние было значительно меньше, чем в группе нулевой временной точки. Однако, когда животных лечили sIL-1RI, «миграция» воспалительного инфильтрата в сторону альвеолярной кости была значительно меньше.Это уменьшение составило 55% для премоляров нижней челюсти и 70% для образцов премоляров / первых моляров. При оценке ближайшего участка воспалительного фронта к альвеолярной кости наблюдались сокращения на 60% и 80% (рис. 2C и 2D). Все различия были значительными
Рисунок 2
Растворимый рецептор интерлейкина-1 типа I (sIL-1RI) подавляет прогрессирование воспалительного фронта в сторону альвеолярной кости при экспериментальном пародонтите. Заболевание пародонта было инициировано у приматов Macaca fascicularis и человек.Контрольная группа (без лечения) получала инъекции только носителя (PBS), а экспериментальная группа получала инъекции антагонистов IL-1. Заболевание пародонта не было инициировано в группе с нулевой временной точкой, которая предоставила базовые измерения. Среднее расстояние между полями воспалительного фронта и альвеолярной кости и расстояние между аспектом воспалительного фронта, ближайшим к поверхности альвеолярной кости и кости, измеряли, как описано в разделе «Материалы и методы». A Расстояние между передней частью воспаления и костью для премоляров нижней челюсти; B расстояние между костью и ближайшим к кости участком воспалительного фронта для премоляра и первого моляра; C расстояние между передней частью воспаления и костью для премоляров нижней челюсти; D расстояние между костью и частью воспалительного фронта, ближайшей к кости для премоляра и первого моляра
Рисунок 2
Растворимый рецептор интерлейкина-1 типа I (sIL-1RI) ингибирует прогрессирование воспалительного фронта в сторону альвеол кость при экспериментальном пародонтите.Заболевание пародонта было инициировано у приматов Macaca fascicularis и человек. Контрольная группа (без лечения) получала инъекции только носителя (PBS), а экспериментальная группа получала инъекции антагонистов IL-1. Заболевание пародонта не было инициировано в группе с нулевой временной точкой, которая предоставила базовые измерения. Среднее расстояние между полями воспалительного фронта и альвеолярной кости и расстояние между аспектом воспалительного фронта, ближайшим к поверхности альвеолярной кости и кости, измеряли, как описано в разделе «Материалы и методы». A Расстояние между передней частью воспаления и костью для премоляров нижней челюсти; B расстояние между костью и ближайшим к кости участком воспалительного фронта для премоляра и первого моляра; C расстояние между передней частью воспаления и костью для премоляров нижней челюсти; D Расстояние между костью и ближайшим к кости участком воспалительного фронта для премоляра и первого моляра
Степень воспаления в глубокой соединительной ткани также оценивалась путем измерения наличия воспалительных клеток, прилегающих к альвеолярной кости ( рисунок 3).В образцах премоляров нижней челюсти количество воспалительных клеток было значительно снижено (на 70%) у животных, получавших sIL-1RI. Для образцов премоляров / первых моляров обработка sIL-1RI уменьшала количество воспалительных клеток на 50%, что также было статистически значимым
Рисунок 3
Растворимый рецептор интерлейкина-1 типа I (sIL-1RI) подавляет рекрутирование воспалительных клеток вблизи альвеолярной кости во время разрушения пародонта. Заболевание пародонта было инициировано у приматов Macaca fascicularis, приматов в контрольной группе (без лечения) и экспериментальной группе (получавшей sIL-1RI).Нет. Количество воспалительных клеток в соединительной ткани, прилегающей к альвеолярной кости, измеряли, как описано в разделе «Материалы и методы». Измерения проводились между премолярами нижней челюсти и между премоляром и первым моляром.
Рисунок 3
Растворимый рецептор интерлейкина-1 типа I (sIL-1RI) подавляет рекрутирование воспалительных клеток вблизи альвеолярной кости во время разрушения пародонта. Заболевание пародонта было инициировано у приматов Macaca fascicularis, приматов в контрольной группе (без лечения) и экспериментальной группе (получавшей sIL-1RI).Нет. Количество воспалительных клеток в соединительной ткани, прилегающей к альвеолярной кости, измеряли, как описано в разделе «Материалы и методы». Измерения проводились между премолярами нижней челюсти и между премоляром и первым моляром.
Гистологический анализ был проведен для определения влияния sIL-1RI на разрушение поддерживающего пародонта. Потеря прикрепления соединительной ткани представляет собой уменьшение длины плотной соединительной ткани, прочно прикрепленной к зубам. В нулевой момент времени произошла только минимальная потеря прикрепления, тогда как значительная потеря была очевидна, когда возникло заболевание пародонта (рисунок 4).Лечение sIL-1RI было эффективным в уменьшении потери соединительной ткани; снижение на 30% было отмечено в срезах премоляров, и на 70% — в области премоляров / первого моляра. Оба различия были статистически значимыми
Рисунок 4
Растворимый рецептор интерлейкина-1 типа I (sIL-1RI) ингибирует потерю прикрепления соединительной ткани при экспериментально индуцированном периодонтите. Заболевание пародонта было инициировано у Macaca fascicularis приматов (B и C) , и ткань пародонта сравнивали с тканью приматов в контрольной группе (A) .(Первоначальное увеличение, × 10). Животные, у которых был периодонтит, получали лечение только носителем (PBS) (B) или sIL-1RI (C) в течение 6 недель. Верхние стрелки на панелях A – C указывают исходную корональную протяженность прикрепления соединительной ткани, обозначенную наличием цемента, а нижние стрелки указывают корональную протяженность прикрепления соединительной ткани в то время, когда животное было убито. Длину прикрепления соединительной ткани оценивали на гистологических срезах с помощью анализа изображений.Измерения проводились между первым и вторым премолярами нижней челюсти (D) и между вторым премоляром и первым моляром (E)
Рисунок 4
Растворимый рецептор интерлейкина-1 типа I (sIL-1RI) ингибирует потерю прикрепление соединительной ткани при экспериментально индуцированном пародонтите. Заболевание пародонта было инициировано у Macaca fascicularis приматов (B и C) , и ткань пародонта сравнивали с тканью приматов в контрольной группе (A) .(Первоначальное увеличение, × 10). Животные, у которых был периодонтит, получали лечение только носителем (PBS) (B) или sIL-1RI (C) в течение 6 недель. Верхние стрелки на панелях A – C указывают исходную корональную протяженность прикрепления соединительной ткани, обозначенную наличием цемента, а нижние стрелки указывают корональную протяженность прикрепления соединительной ткани в то время, когда животное было убито. Длину прикрепления соединительной ткани оценивали на гистологических срезах с помощью анализа изображений.Измерения проводились между первым и вторым премолярами нижней челюсти (D) и между вторым премоляром и первым моляром (E)
Лечение sIL-1RI также уменьшило потерю высоты альвеолярной кости (рис. 5). Как в контрольной, так и в экспериментальной группах наблюдалась потеря высоты кости; однако потеря высоты альвеолярной кости была меньше у животных, получавших инъекции sIL-1RI, чем у контрольных животных. Это снижение было статистически значимым и колебалось от 65% для премоляров нижней челюсти до 60% для премоляров / моляров
.Рисунок 5
Применение растворимого рецептора интерлейкина-1 типа I (sIL-1RI) подавляет потерю высоты альвеолярной кости.Заболевание пародонта было инициировано у приматов Macaca fascicularis и человек. Экспериментальная группа получала инъекции sIL-1RI, а контрольная группа (без лечения) получала инъекции только носителя (PBS). Уменьшение высоты альвеолярной кости определяли гистологически, как описано в разделе «Материалы и методы». Измерения проводились между премолярами нижней челюсти и между премоляром и первым моляром.
Рис. 5
Применение растворимого рецептора интерлейкина-1 типа I (sIL-1RI) ингибирует потерю высоты альвеолярной кости.Заболевание пародонта было инициировано у приматов Macaca fascicularis и человек. Экспериментальная группа получала инъекции sIL-1RI, а контрольная группа (без лечения) получала инъекции только носителя (PBS). Уменьшение высоты альвеолярной кости определяли гистологически, как описано в разделе «Материалы и методы». Измерения проводились между премолярами нижней челюсти и между премоляром и первым моляром
Обсуждение
Заболевание пародонта вызывается отдельными видами бактерий, которые колонизируют поверхность зуба и проникают в прилегающие ткани, вызывая воспаление и, в конечном итоге, разрушение соединительной ткани и резорбцию кости.То, что антибиотики эффективно подавляют экспериментальный пародонтит на нескольких моделях животных, в том числе на модели приматов, использованной здесь, свидетельствует о центральной роли бактерий в запуске деструктивных эффектов [2, 22]. Однако данные о том, что потеря ткани, вызванная заболеванием пародонта, снижается ингибиторами простагландинов и ингибиторами матриксных металлопротеиназ, указывает на то, что большая часть повреждения тканей вызвана повышающей регуляцией ответа хозяина [26, 27]
IL-1 играет роль играет важную роль в стимуляции врожденного ответа хозяина и в этой способности подготавливает хозяина к защите от бактерий [28].Важность IL-1 в защите хозяина от оральных патогенов была продемонстрирована на мышиной модели, в которой пульпа зуба была инфицирована бактериями на мышах, лишенных IL-1RI [29]. Удивительно, но остеолиз был сильнее у мышей, лишенных функционального IL-1RI, чем у мышей дикого типа, что противоречит результатам настоящего исследования. Вероятно, это результат разницы в модели. В эндодонтической модели ответ хозяина должен активироваться из наивного состояния, тогда как в пародонтальной модели ответ хозяина уже регулируется наличием гингивита, даже до начала заболевания пародонта [25].Таким образом, у наивного хозяина активность IL-1 необходима для оптимального индуцирования защитного ответа на бактериальную инфекцию и, таким образом, минимизации потери мягких и твердых тканей, тогда как дальнейшая повышающая регуляция в условиях, в которых воспалительный ответ уже имеет место, приводит к к усиленному разрушению соединительной ткани и остеолизу. Это согласуется с предыдущими сообщениями о том, что положительный эффект IL-1 сводится на нет, если его экспрессия чрезмерна; например, перепроизводство IL-1 вызывает разрушение тканей у людей с аутоиммунными заболеваниями, такими как ревматоидный артрит, а также способствует гипотонии, гематологической дискразии и септическому шоку [12].В клинических испытаниях на людях антагонисты IL-1 терапевтически полезны при лечении артрита [11]. Интересно, что блокирование ИЛ-1, по-видимому, более эффективно, чем блокирование фактора некроза опухоли (ФНО), в снижении потери костной массы, связанной с артритом. На животных моделях было показано, что ингибирование IL-1 эффективно для лечения ряда воспалительных состояний, включая септический шок, экспериментальный гломерулонефрит и церебральную ишемию [12, 30, 31]
Мы сообщали, что одновременное ингибирование IL-1 и TNF значительно снижает разрушение тканей и воспаление при экспериментальном пародонтите [24, 25, 32].Поскольку в этих исследованиях использовалась комбинация ингибиторов IL-1 и TNF, точная роль IL-1 не была определена. Кроме того, недавнее сосредоточение внимания на IL-1 как маркере восприимчивости к заболеваниям пародонта и эффективности антагониста IL-1 в остановке потери костной массы, вызванной ревматоидным артритом, заставило нас сосредоточиться конкретно на роли IL-1 в прогрессировании заболеваний пародонта. Результаты показывают, что лечение одним sIL-1RI значительно снижает 3 критических параметра разрушения тканей пародонта: воспаление, потерю плотного прикрепления соединительной ткани к зубам и резорбцию кости.
Представленные здесь результаты подтверждают мнение о том, что потеря ткани пародонта является причиной из-за преувеличенной реакции хозяина на бактерии полости рта, о чем впервые свидетельствуют сообщения о том, что ингибиторы синтеза простагландинов уменьшают потерю костной массы, связанную с экспериментально индуцированным пародонтитом [26].Наши результаты также подтверждают концепцию, что критическим событием при пародонтите является прогрессирование воспалительного фронта от области, расположенной ниже эпителия, к более глубоким структурам пародонта. Причины этого остаются неясными. Одним из механизмов может быть приобретение бактериями способности проникать глубже в соединительную ткань. Если это происходит, бактерии или их продукты, такие как липополисахарид, могут индуцировать экспрессию IL-1, который затем играет важную роль в усилении реакции хозяина, что приводит к разрушению ткани.Инициирование воспалительного процесса посредством индукции IL-1 будет стимулировать выработку вторичных медиаторов, таких как хемокины или продукты циклооксигеназы, которые, в свою очередь, увеличивают степень воспаления [33, 34]. Как только это произойдет, индуцированные матриксные металлопротеиназы будут участвовать в разрушении соединительной ткани [27], в то время как цитокины могут снизить способность хозяина восстанавливать поврежденную ткань посредством апоптоза резидентных клеток, таких как фибробласты [35].Наконец, индукция воспалительного каскада стимулирует остеокластогенез, что приводит к разрушению кости [36]. Настоящие данные непосредственно устанавливают решающую роль IL-1 в экспериментальном периодонтите и подчеркивают потенциальное использование IL-1R в лечении заболеваний пародонта
Благодарность
Авторы благодарят Алисию Руфф за административную поддержку при подготовке рукописи
Список литературы
1,,.Заболевания пародонта в США в 1981 году: распространенность, серьезность, степень и роль в смертности зубов
,J Periodontol
,1989
, vol.60
(стр.363
—70
) 2.Заболевания пародонта
,N Engl J Med
,1990
, vol.322
(стр.373
—82
) 3.Роль матриксных металлопротеиназ в заболеваниях пародонта человека
,J Periodontol
,1993
, vol.64
(стр.474
—84
) 4.Биологическая основа интерлейкина-1 при болезни
,Кровь
,1996
, т.87
(стр.2095
—147
) 5« и др.Новый рецептор IL-1, клонированный из В-клеток путем экспрессии млекопитающих, экспрессируется во многих типах клеток
,EMBO J
,1991
, vol.10
(стр.2821
—32
) 6« и др.Вспомогательный белок рецептора IL-1 является важным компонентом рецептора IL-1
,J Immunol
,1998
, vol.161
(стр.5614
—20
) 7,,,.Рецептор-ловушка типа II: новый регуляторный путь для интерлейкина-1
,Immunol Today
,1994
, vol.15
(стр.562
—6
) 8« и др.Индукция внутриклеточных сигналов интерлейкина-1 бета через рецептор интерлейкина-1 типа II в фибробластах десен человека
,J Dent Res
,2000
, vol.79
(стр.1683
—8
) 9« и др.Возможная роль индуцированных интерлейкином-1 аллергеном поздних астматических реакций у морских свинок: подавляющий эффект антагониста рецепторов интерлейкина-1 на позднюю астматическую реакцию
,J Allergy Clin Immunol
,1995
, vol.95
(стр.1236
—45
) 10,.Патофизиологическая роль цитокинов при застойной сердечной недостаточности
,Annu Rev Med
,2001
, vol.52
(стр.15
—27
) 11,,,.Анти-интерлейкин-1 терапия при ревматических заболеваниях
,Curr Opin Rheumatol
,2001
, vol.13
(стр.170
—6
) 12,,, et al.Кожный аллергический ответ на поздней стадии у человека ингибируется растворимым рецептором IL-1
,J Immunol
,1994
, vol.152
(стр.2033
—41
) 13.Преждевременные роды: синдром внутриматочной воспалительной реакции
,J Reprod Immunol
,1997
, vol.36
(стр.93
—109
) 14,,,,.Функциональная роль интерлейкина 1 в заболеваниях пародонта: индукция продукции интерлейкина 1 липополисахаридом Bacteroides gingivalis в перитонеальных макрофагах мышей C3H / HeN и S3H / Hej
,Infect Immun
,1985
, vol.50
(стр.262
—70
) 15,,,,.Цитокиновые ответы эпителиальных клеток ротовой полости на инфекцию Porphyromonas gingivalis
,J Dent Res
,2000
, vol.79
(стр.1808
—14
) 16« и др.Локализация интерлейкина-1 бета в ткани пародонта человека
,J Periodontol
,1991
, vol.62
(стр.36
—43
) 17,.Цитокиновые профили клеток, выделенных у людей с заболеваниями пародонта
,J Dent Res
,1998
, vol.77
(стр.16
—26
) 18,,, et al.Генотип интерлейкина-1 как фактор серьезности заболеваний пародонта у взрослых
,J Clin Periodontol
,1997
, vol.24
(стр.72
—7
) 19,,, et al.Полиморфизмы семейства генов интерлейкина-1, микробные возбудители полости рта и курение при пародонтите у взрослых
,J Dent Res
,2001
, vol.80
(стр.1695
—9
) 20« и др.Генотип IL-1 и пародонтит взрослых у молодых жителей Новой Зеландии
,J Dent Res
,2001
, vol.80
(стр.1700
—3
) 21« и др.Кожный аллергический ответ на поздней стадии у человека ингибируется растворимым рецептором IL-1
,J Immunol
,1994
, vol.152
(стр.2033
—41
) 22,,.Приматы, не относящиеся к человеку, используемые в исследованиях патогенеза заболеваний пародонта: обзор литературы
,J Periodontol
,1993
, vol.64
(стр.497
—508
) 23,,,,.Имплантация Bacteroides gingivalis нечеловеческим приматам инициирует прогрессирование пародонтита
,Science
,1988
, vol.239
(стр.55
—7
) 24,,,,.Интерлейкин-1 и антагонисты фактора некроза опухоли подавляют прогрессирование инфильтрации воспалительных клеток в сторону альвеолярной кости при экспериментальном пародонтите
,J Periodontol
,1998
, vol.69
(стр.1419
—25
) 25,,,,.Антагонисты IL-1 и TNF подавляют воспалительную реакцию и потерю костной массы при экспериментальном пародонтите
,J Immun
,1998
, vol.160
(стр.403
—9
) 26,,,,.Флурбипрофен: мощный ингибитор резорбции альвеолярной кости у гончих
,Science
,1985
, vol.227
(стр.640
—2
) 27« и др.Химически модифицированный неантимикробный тетрациклин (CMT-8) ингибирует металлопротеиназы десневого матрикса, разрушение пародонта и экстраоральную потерю костной массы у овариэктомированных крыс
,Ann NY Acad Sci
,1999
, vol.878
(стр.290
—310
) 28.Активация нейтрофилов интерлейкинами-1 и -2 и факторами некроза опухоли
,Immunol Ser
,1992
, vol.57
(стр.417
—36
) 29,,,.Передача сигналов рецептора интерлейкина-1, а не фактора некроза опухоли, имеет решающее значение для защиты хозяина от тяжелых последствий анаэробной инфекции полимикроба
,Infect Immun
,2000
, vol.68
(стр.4746
—51
) 30« и др.IL-1 активирует экспрессию остеопонтина при экспериментальном серповидном гломерулонефрите у крыс
,Am J Pathol
,1999
, vol.154
(стр.833
—41
) 31,,,.Возможные механизмы участия интерлейкина-1 в ишемии головного мозга
,J Neuroimmunol
,1999
, vol.100
(стр.203
—15
) 32« и др.Растворимые антагонисты интерлейкина-1 (IL-1) и фактора некроза опухоли (TNF) ингибируют потерю прикрепления тканей при экспериментальном пародонтите
,J Clin Periodontol
,2001
, vol.28
(стр.233
—40
) 33,,.Изменения метаболитов циклооксигеназы при экспериментальном пародонтите у Macaca mulatta
,J Periodontal Res
,1989
, vol.24
(стр.63
—74
) 34,.Патогены пародонта стимулируют продукцию CC-хемокинов мононуклеарными клетками и клетками костного происхождения
,J Periodontol
,1999
, vol.70
(стр.1472
—8
) 35,,,,.Фактор некроза опухоли модулирует апоптоз фибробластов, рекрутирование PMN и образование остеокластов в ответ на инфекцию P. gingivalis
,J Dent Res
,2001
, vol.

 е. через лунку удаленного зуба, не позднее 9 дней со дня удаления
е. через лунку удаленного зуба, не позднее 9 дней со дня удаления